Die Kohlenwasserstoffe und ihre Nomenklatur
|
|
|
- Jesko Holtzer
- vor 6 Jahren
- Abrufe
Transkript
1 Die Kohlenwasserstoffe und ihre Nomenklatur Ein Leitprogramm für die hemie Autor Beratung Dr. Georg Graf Prof. Dr. Antonio Togni, ETZ
2 Leitprogramm Nomenklatur Adressaten Gymnasiasten ab 2. Schuljahr im Grundlagenfach hemie Bearbeitungsdauer Fundamentum 6 Lektionen Additum 2 Lektionen Fachliche Vorkenntnisse Die Schüler und Schülerinnen wissen Bescheid über das Prinzip der kovalenten Bindung. Sie haben bereits eine ganze Reihe von einfach gebauten Molekülen kennen gelernt. Sie sind gut vertraut mit den typischen Bindungswinkeln und den daraus resultierenden Molekülgeometrien. Version Oktober 2003
3 Inhaltsverzeichnis Einführung Warum gerade dieses Thema? Wie arbeitet man mit diesem Leitprogramm? Fundamentum 1 Das Wesen der Kohlenwasserstoffe Die graphische Darstellung Die Benennung der Kohlenwasserstoffe Additum 4 Erweiterte Nomenklaturregeln Nomenklatur für Tierliebhaber Anhang für die Lehrkraft A Lösungen der Kontrollaufgaben B Kapiteltests mit Lösungen Medien für die Schüler D Material für die Experimente E Literatur Inhaltsverzeichnis 1
4 Einführung Warum gerade dieses Thema? Tridec-1-en-3,5,7,9,11-pentain oder Tridec-3,5,7,8-tetraen-10,12-diinsäure. Was in Ihren Augen als fürchterliches Kauderwelsch erscheinen mag, das sind die wissenschaftlichen Namen für zwei bedeutende medizinische Wirkstoffe. Der erste kommt in der Wurzel der Baldrian-Pflanze vor und wird oft für Schlafmittel verwendet. Der zweite ist ein typisches Antibiotikum, das wegen seinen tuberkulostatischen Eigenschaften geschätzt wird. Diese beiden Beispiele lassen erahnen, dass die Benennung von chemischen Substanzen eine ziemlich abenteuerliche Angelegenheit sein muss. Das ist auch nicht weiter verwunderlich, wenn man bedenkt, dass bis heute weit über 25 Millionen verschiedene Substanzen untersucht und beschrieben worden sind. Jede von ihnen benötigt einen unverwechselbaren Namen. Er muss so beschaffen sein, dass präzise Rückschlüsse auf die chemische Struktur der beteiligten Moleküle möglich sind. Um dieses Problem zu lösen, haben die hemiker ein sehr ausgeklügeltes Regelwerk ersonnen, das man als die Nomenklatur- Regeln der hemie bezeichnet. Selbstverständlich kann es hier nicht darum gehen, diese Regeln in allen Details kennen zu lernen. Aber für Sie als angehende Studierende macht es sicher Sinn, einen gewissen Einblick in dieses komplexe wissenschaftliche Nomenklatur-System zu gewinnen und seine Funktionsweise näher kennen zu lernen. So gesehen genügt es durchaus, wenn wir uns auf die sogenannten Kohlenwasserstoffe beschränken. Aber eines scheint mir sicher: Sie werden den Beipackzettel zum nächsten Medikament, das Sie einnehmen müssen, mit ganz anderen Augen lesen! Warum ein Leitprogramm? Die richtige Benennung von Kohlenwasserstoffen erfordert die Kenntnis von Regeln und deren richtige Anwendung. Um dieses Ziel zu erreichen ist es optimal, wenn die Lernschritte in einem individuell angepassten Tempo erfolgen können und der Zeitraum für die zweifellos nötigen Übungen nicht künstlich eingeschränkt ist. Ein Leitprogramm schafft diese Rahmenbedingungen wohl am besten. Es fördert zudem das vernetzte Denken. Beim selbständigen Lernen mit gut ausgearbeiteten Unterlagen lässt sich das Lerntempo selber bestimmen. Übungsaufgaben mit Lösungen geben Ihnen die Sicherheit, den Lernstoff gut verstanden zu haben. Das Lernen ist abwechslungsreich, indem viele unterschiedliche Lerntechniken zum Zug kommen. 2 Einführung
5 Wie arbeitet man mit diesem Leitprogramm? Vermutlich sind Sie sich bislang vor allem den sogenannten Frontalunterricht gewohnt: Ihr Lehrer führt in die Theorie ein, schreibt einiges an die Wandtafel und stellt ab und zu Fragen. Zwischendurch lösen Sie vielleicht mal eine Aufgabe. Aber die ganze Verantwortung über den Stundenverlauf liegt bei der Lehrperson. Das soll jetzt anders werden - zumindest für einige Lektionen! Mit diesen Unterlagen arbeiten Sie ganz allein, und zwar in dem Tempo, das Sie selber bestimmen. Die Theorie wird hier Schritt für Schritt aufgerollt. Obligatorisch ist für Sie nur das sogenannte Fundamentum, das heisst die ersten drei Kapitel. Die letzten zwei Kapitel sind nur für jene gedacht, die besonders schnell vorwärts gekommen oder in besonderem Mass an der Sache interessiert sind. Es soll ja immer wieder Studierende geben, die höhere Ansprüche stellen als der Durchschnitt... Im Einzelnen sieht der Ablauf der nächsten Lektionen wie folgt aus: 1 An and dieser Einführung machen Sie sich zuerst einmal damit vertraut, wie der Unterricht in den folgenden Lektionen organisiert ist. Das ist sehr wesentlich, damit Sie nachher wirklich das Maximum herausholen. Mehr als zehn Minuten sollten Sie dazu aber nicht benötigen. 2 Sie beginnen mit der ersten Lektion und studieren den Text bis zur ersten Kontrollaufgabe. Studieren heißt, den Text mindestens zweimal zu lesen. Zuerst verschaffen Sie sich einen groben Überblick, worum es eigentlich geht. Beim zweiten Durchgang legen Sie dann jedes Wort und jede Formulierung auf die Goldwaage. Geben Sie nicht vorschnell auf! Manchmal muß man sich etwas durchbeissen, bis man es wirklich genau verstanden hat. Dafür kann man sich dann nachher um so mehr über seine Leistung freuen. 3 Gelegentlich sind Kontrollaufgaben eingeschoben. ier ist jeweils ein alt geboten. Bearbeiten Sie nötigenfalls den vorangehenden Text noch einmal, bis Sie glauben, alles bisher Behandelte wirklich gut verstanden zu haben. Ist das der Fall, so lösen Sie die Kontrollaufgabe, und zwar schriftlich. Das ist sehr wichtig, weil Sie sonst der Gefahr der Selbsttäuschung unterliegen. 4 Sie müssen Ihre Lösungsvorschläge niemandem zeigen. Sie korrigieren sich nämlich selbst: Im Schulzimmer liegt ein Ordner mit den Lösungen aller Kontrollaufgaben auf. Da schauen Sie nach, ob Sie richtig liegen. Wenn ja: Bravo! Sie können den Text weiter studieren, bis zur nächsten Kontrollaufgabe. Wenn nein: alb so schlimm. Aber: Sie müssen den vorangegangenen Text nochmals durcharbeiten. Nur so können Sie die vorhandenen Lücken stopfen! Einführung 3
6 5 Verstehen Sie dann immer noch nichts, so können Sie einen Kollegen oder eine Kollegin fragen. Aber tun Sie das bitte nur im Notfall. Geben Sie nicht vorschnell auf! Wenn auch Ihr Kollege nicht weiterhelfen kann, können Sie die Lehrperson konsultieren. Das sollte aber im Verlauf ihrer Arbeit nur selten vorkommen. 6 Ab und zu ist mehr als nur Lesen angesagt: Vielleicht müssen Sie zwischendurch ein Experiment durchführen, eine Textstelle aus einem Buch interpretieren, eine Recherche im Internet tätigen oder ein omputerprogramm studieren. Entsprechende Symbole und Anleitungen im Text machen Sie darauf aufmerksam. Fahren Sie anschließend mit der Lektüre dort weiter, wo Sie unterbrochen haben. 7 Wenn Sie ein Kapitel vollständig abgeschlossen, seinen Inhalt ganz verstanden und alle Kontrollaufgaben richtig gelöst haben, sind Sie reif für den Kapiteltest. Diesen absolvieren Sie bei der Lehrerperson oder einer von ihr bezeichneten ilfsperson. Sie müssen sich dabei kurz über die von Ihnen erworbenen Kenntnisse ausweisen. Falls Sie den Kapiteltest bestehen, dürfen Sie mit dem nächsten Kapitel weiterfahren. Falls nicht, werden Sie zu einer Wiederholung Ihres Studiums verknurrt, und können in frühestens zehn Minuten zu einem zweiten Kapiteltest antreten. Natürlich fahren Sie zeitlich besser, wenn Sie schon den ersten Test bestehen... 8 So geht es weiter, bis die drei Kapitel des Fundamentums erledigt sind. Damit ist Ihr Soll erfüllt. Wenn Sie dieses Ziel vorzeitig erreicht haben, so ist vorgesehen, dass Sie die verbleibende Zeit zum Studium des Additums einsetzen. Das hat mehrere Vorteile: Erstens können Sie mit einem zusätzlichen Kapiteltest weitere Punkte sammeln, zweitens sind Sie besser für die Abschluss-Prüfung gerüstet und drittens können Sie Ihrer Lehrperson endlich einmal den Meister zeigen... 9 Nach dem Durcharbeiten aller fünf Kapitel haben Sie einen recht guten Durchblick in Sachen Nomenklatur. Aber auch mit nur drei verarbeiteten Kapiteln können Sie zufrieden sein. Der Stoff des Fundamentums wird an der Abschluss-Prüfung vorausgesetzt. 10 Falls Ihnen die vorgesehenen Lektionen für die vollständige Bearbeitung des Fundamentums nicht ausreichen, so müssen Sie das Reststudium zu ause erledigen und sich den noch fehlenden Kapiteltests in der unterrichtsfreien Zeit unterziehen. Das sollte aber eigentlich nicht vorkommen, wenn Sie während der Lektionen voll bei der Sache sind. Ich wünsche Ihnen viel Spaß! Georg Graf 4 Einführung
7 Zum Schluß eine Zusammenstellung der im Text benutzten Piktogramme: Kontrollaufgabe ier müssen Sie eine Aufgabe lösen, welche sicherstellt, daß Sie den unmittelbar vorangehenden Text auch wirklich verstanden haben. Lösen Sie solche Aufgaben auf jeden Fall schriftlich, und kontrollieren Sie Ihre Lösung anschließend im Lösungsordner. Experiment Im Schulzimmer oder im Labor ist ein Versuch vorbereitet. Führen Sie ihn nach Anleitung durch. Lesen Sie die zugehörige Vorschrift genau durch und beachten Sie die Sicherheitsvorkehrungen. Buch Im Schulzimmer liegt ein Buch bereit. Lösen Sie mit dessen ilfe die gestellte Aufgabe! Machen Sie sich stichwortartige Notizen! omputer Im Schulzimmer oder in einem Nebenraum steht ein omputer mit Internet-Anschluss bereit. Lösen Sie mit seiner ilfe die gestellte Aufgabe! Einführung 5
8 Fundamentum 1 Das Wesen der Kohlenwasserstoffe Was erfahren Sie in diesem Kapitel? Zunächst wird die Klasse der Kohlenwasserstoffe präzise definiert. Sie werden über das Vorkommen der Kohlenwasserstoffe orientiert, lernen einige typische Vertreter dieser Stoffklasse kennen und bekommen Informationen zur praktischen Bedeutung der Kohlenwasserstoffe. Es folgt ein inweis auf die einzigartigen Eigenschaften des Kohlenstoffatoms. Abgeschlossen wird das Kapitel durch eine kurze Besprechung der wichtigsten chemischen und physikalischen Stoffeigenschaften. Wie gehen Sie vor, um dieses Kapitel zu bearbeiten? Lesen Sie die vorgegebenen Texte aufmerksam durch. Nach jedem Abschnitt sind Kontrollfragen eingestreut. Versuchen Sie die Aufgaben selbständig zu lösen. Zur Bestätigung können Sie die Antworten im Lösungsordner nachschauen. Wenn Sie alle Kontrollaufgaben gut gelöst haben, melden Sie sich bei der Lehrperson. Sie wird Ihnen einige Testfragen zum Kapitel stellen. Um den Test bestehen zu können, müssen Sie folgende Lernziele erreichen: Sie können den Begriff "Kohlenwasserstoff" definieren. Sie wissen, wo Kohlenwasserstoffe vorkommen. Sie wissen Bescheid über die Verwendung von Kohlenwasserstoffen. Sie kennen den Grund für die Vielfältigkeit der Kohlenwasserstoffe. Sie kennen die wichtigsten Eigenschaften der Kohlenwasserstoffe. Sie können die Verbrennung eines Kohlenwasserstoffs formulieren. 6 1 Das Wesen der Kohlenwasserstoffe
9 Was versteht man unter einem Kohlenwasserstoff? Unter einem Kohlenwasserstoff versteht man eine chemische Verbindung, bei welcher die Moleküle ausschliesslich aus Kohlenstoffatomen und Wasserstoffatomen aufgebaut sind. Kohlenwasserstoffe können demnach durch Summenformeln vom Typ x y beschrieben werden. Wo kommen Kohlenwasserstoffe vor? Die weitaus wichtigste Quelle von Kohlenwasserstoffen ist das natürliche Erdöl. hemisch gesehen handelt es dabei um ein Gemisch aus einer grossen Zahl verschiedener Kohlenwasserstoffe. In Raffinerien wird das rohe Erdöl in verschiedene technisch verwendbare Fraktionen zerlegt. Die bekanntesten davon sind Benzin, Kerosin, Dieselöl und eizöl. Diese Produkte sind also ebenfalls Gemische von Kohlenwasserstoffen. Aus gewissen Rückständen der Erdöldestillation können zudem Paraffine gewonnen werden. Dabei handelt es sich um feste oder flüssige Gemische von Kohlenwasserstoffen, die farblos, geruchslos und geschmackslos sind. In kleineren Mengen findet man Kohlenwasserstoffe auch in den Wachsschichten, welche die Oberflächen vieler bekannter Früchte schützen. Beispiele von Kohlenwasserstoffen 1.1 Gegeben sind fünf Kohlenwasserstoffe: Pentan, Octan, yclohexan, Toluol und exadecan. Unterziehen Sie diese Stoffe einer Prüfung durch ihre Sinne und tragen Sie die Ergebnisse in die die folgende Tabelle ein! Schlagen Sie zudem die Siedepunkte im aufliegenden "hemikerkalender" nach! Überprüfen Sie die Brennbarkeit der fünf Stoffe, indem Sie je eine kleine Probe in je einer Porzellanschale zu entzünden versuchen! Pentan Octan yclohexan Toluol exadecan AZ Farbe Geruch Sdp B AZ : Aggregatzustand bei Normalbedingungen Sdp : Siedepunkt B : Brennbarkeit 1 Das Wesen der Kohlenwasserstoffe 7
10 Wozu werden Kohlenwasserstoffe verwendet? In Form von Erdöl und den daraus resultierenden andelsprodukten Benzin, Kerosin, Dieselöl und eizöl dienen die Kohlenwasserstoffe als die wohl wichtigste Energiequelle der modernen Zivilisation. In der chemischen Industrie dienen Kohlenwasserstoffe als Lösemittel für chemische Reaktionen, zum Extrahieren von fettähnlichen Stoffen und als leicht erhältliche und kostengünstige Ausgangsstoffe für Synthesen. Auch bei den für die Funktion von Maschinen und Motoren wichtigen Schmiermitteln handelt es sich in der Regel um mehr oder weniger komplexe Gemische von Kohlenwasserstoffen. Das bereits weiter oben erwähnte Paraffin findet vielseitige Verwendung zur erstellung von Salben, remen, Kerzen, Fußbodenpflegemitteln, Möbelpolituren, Autopflegemitteln, gewachstem Papier, Baumwachs, Modelliermassen und Malstiften. Die speziellen Eigenschaften des Kohlenstoffatoms Kohlenstoffatome neigen dazu, lange Ketten mit ihresgleichen zu bilden. Dadurch nehmen sie unter allen andern Atomen eine Sonderstellung ein: Normalerweise sind kovalente Bindungen zwischen zwei Atomen der selben Sorte wenig stabil. Als Vertreter der vierten auptgruppe haben Kohlenstoffatome zudem die Fähigkeit, je vier kovalente Einfachbindungen einzugehen. Das bedeutet, dass auch beliebig verzweigte Ketten von Kohlenstoff-Atomen möglich sind. Als Konsequenz daraus existiert eine riesige Anzahl verschiedener Kohlenwasserstoffe. Physikalische und chemische Stoffeigenschaften Grundsätzlich unterscheidet man bei einem Stoff zwischen den physikalischen und den chemischen Stoffeigenschaften. Eine Stoffeigenschaft wird als physikalisch bezeichnet, wenn sie gemessen werden kann, ohne dass dabei neue Stoffe gebildet werden. Eine Stoffeigenschaft wird als chemisch bezeichnet, wenn im Zusammenhang mit ihrer Messung neue Stoffe gebildet werden. 1.1 Welche der folgenden Stoffeigenschaften sind physikalischer, welche chemischer Art? Brechzahl, Brennbarkeit, Dichte, Giftigkeit, ärte, Lichtechtheit, Säurebeständigkeit, Schmelzpunkt, Siedepunkt. 8 1 Das Wesen der Kohlenwasserstoffe
11 hemische Eigenschaften der Kohlenwasserstoffe Die wichtigste chemische Eigenschaft der Kohlenwasserstoffe ist ihre Brennbarkeit. Die damit verbundene Abgabe von Energie ist der Grund, weshalb das Erdöl zu einem der begehrtesten Rohstoffe gehört. Die Verbrennung ist chemisch gesehen eine Reaktion mit Sauerstoff aus der Luft. Die Produkte sind Kohlenstoffdioxid und Wasser. Als Beispiel seien die Reaktionsgleichungen für die Verbrennung von drei besonders einfachen Kohlenwasserstoffen angegeben: Ethan : O 2 4 O O 1189 kj / mol Ethen : O 2 4 O O 1072 kj / mol Ethin : O 2 4 O O 996 kj / mol Bei den kursiv gedruckten Zahlen hinter den Gleichungen handelt es sich um die sogenannten Reaktionsenergien. Darunter versteht man die Energiemengen, die bei der Verbrennung von jeweils einem Mol des betreffenden Stoffs freigesetzt werden. Neben der Verbrennung zeigen die Kohlenwasserstoffe noch eine ganze Reihe weiterer chemischer Reaktionen. Im Vergleich zu anderen Stoffklassen der organischen hemie sind sie aber ausgesprochen reaktionsträge. Das liegt zum einen daran, dass sie keine stark polaren Bindungen enthalten und zum andern, dass ihre -Ketten durch die vielen -Atome gut gegen äussere Angriffe abgeschirmt werden. 1.2 Stellen Sie die chemischen Gleichungen auf für die Verbrennung der folgenden Kohlenwasserstoffe: a) 4 b) 5 10 c) 5 12 d) Verbrennt man Ethan, Ethen und Ethin unter den genau gleichen Bedingungen, so liefert Ethin die heisseste Flamme. Dies ist ziemlich überraschend angesichts der Tatsache, dass Ethin von allen drei Stoffen die kleinste Reaktionsenergie aufweist. aben Sie eine Erklärung für den Widerspruch? Physikalische Eigenschaften der Kohlenwasserstoffe Eine detaillierte Besprechung der physikalischen Eigenschaften der Kohlenwasserstoffe ist erst nach Einführung der Nomenklaturregeln möglich. Was aber allgemein gesagt werden kann: Kohlenwasserstoffe sind bei Raumtemperatur meist flüssig oder fest. Sie sind typischerweise farblos und riechen oft benzinartig. Die Schmelz- und Siedepunkte liegen tiefer als jene von andern Stoffen mit ähnlich grossen Molekülen. Ihre Dichten sind ebenfalls relativ klein. 1 Das Wesen der Kohlenwasserstoffe 9
12 2 Die graphische Darstellung Was erfahren Sie in diesem Kapitel? Kohlenwasserstoffe sind molekulare Stoffe. Ihre chemisch relevanten Teilchen sind also Moleküle. Damit diese Moleküle richtig benannt werden können muss zuerst ihre chemische Struktur und ihr räumlicher Bau in eine verbindlich interpretierbare graphische Darstellung umgesetzt werden. Im folgenden Kapitel lernen Sie die verschiedenen Möglichkeiten zur graphischen Darstellung eines Kohlenwasserstoff-Moleküls kennen. Dabei benötigen Sie ihre früher erworbenen Kenntnisse von der räumlichen Geometrie der chemischen Bindungen. Wie gehen Sie vor, um dieses Kapitel zu bearbeiten? Lesen Sie die vorgegebenen Texte aufmerksam durch. Nach jedem Abschnitt sind Kontrollfragen eingestreut. Versuchen Sie die Aufgaben selbständig zu lösen. Zur Bestätigung können Sie die Antworten im Lösungsordner nachschauen. Wenn Sie alle Kontrollaufgaben gut gelöst haben, melden Sie sich bei der Lehrperson. Sie wird Ihnen wiederum einige Testfragen stellen. Um den Test bestehen zu können, müssen Sie folgende Lernziele erreichen: Sie kennen vier Varianten zur graphischen Darstellung eines Kohlenwasserstoff-Moleküls. Sie können die einzelnen Varianten ineinander umwandeln Die graphische Darstellung
13 Kohlenwasserstoff-Moleküle lassen sich auf verschiedene Arten grafisch darstellen. Die wichtigsten davon werden im Folgenden vorgestellt: Die Lewisformel: Sie zeigt an, auf welche Art die Atome des Moleküls verknüpft sind. Die räumliche Anordnung der Atome wird nicht korrekt wiedergegeben. Man kann sich also nicht darauf verlassen, dass die aufgezeichneten Bindungslängen und Bindungswinkel der Realität entsprechen. Die Keilformel: Sie bringt so gut als möglich die räumliche Anordnung der Atome zum Ausdruck. Bindungen, die nicht in der Zeichenebene liegen, werden als Keile dargestellt: Ein Bindungsende liegt vor der Zeichenebene Ein Bindungsende liegt hinter der Zeichenebene Die Skelettformel: Sie ist eine vereinfachte Keilschreibweise. Es werden nur noch die --Bindungen dargestellt, da ja das restliche Molekül jederzeit rekonstruiert werden kann. Die Summenformel: Sie gibt lediglich an, wie viele -Atome und wie viele -Atome im Molekül vorhanden sind. Dabei müssen die -Atome immer vor den -Atomen genannt werden Die graphische Darstellung 11
14 2.1 Von der Lehrperson wird Ihnen ein omputer und ein Datenträger mit der Powerpoint-Datei nomenklatur1.pps zur Verfügung gestellt. Wenn Sie die Datei öffnen, können Sie am Beispiel einer bekannten Droge noch einmal mitverfolgen, wie man von der Keilformel zur Skelettformel gelangt. 2.1 Gemäss der Theorie der kovalenten Bindungen herrscht um jede --Einfachbindung freie Drehbarkeit. Kohlenwasserstoff-Moleküle sind von daher sehr beweglich. Logischerweise kann man ein bestimmtes Kohlenwasserstoff-Molekül auf sehr viele Arten aufzeichnen. Die folgenden Skelettformeln stellen bis auf eine Ausnahme alle das selbe Molekül dar. Welches Molekül ist ist hier fehl am Platz? 12 2 Die graphische Darstellung
15 2.2 Setzen Sie die gegebene Formel in die fehlenden Formeltypen um! Bauen Sie das Molekül mit einem Molekülbaukasten zusammen! Summenformel Lewisformel Keilformel Skelettformel 2.3 Setzen Sie die gegebene Formel in die fehlenden Formeltypen um! Bauen Sie das Molekül mit einem Molekülbaukasten zusammen! Summenformel Lewisformel Keilformel Skelettformel 2 Die graphische Darstellung 13
16 2.4 Setzen Sie die gegebene Formel in die fehlenden Formeltypen um! Bauen Sie das Molekül mit einem Molekülbaukasten zusammen! Summenformel Lewisformel Keilformel Skelettformel 2.5 Setzen Sie die gegebene Formel in die fehlenden Formeltypen um! Bauen Sie das Molekül mit einem Molekülbaukasten zusammen! Summenformel Lewisformel Keilformel Skelettformel 14 2 Die graphische Darstellung
17 3 Die Benennung der Kohlenwasserstoffe Was erfahren Sie in diesem Kapitel? Zuerst lernen Sie, was man unter Alkanen, Alkenen, Alkinen und Aromaten zu verstehen hat. Damit sind die Vorbereitungen abgeschlossen: Sie können endlich daran gehen, erste Beispiele von Kohlenwasserstoff-Moleküle zu benennen. Dabei erfahren Sie schrittweise die Grundprinzipien der chemischen Nomenklatur. Wie gehen Sie vor, um dieses Kapitel zu bearbeiten? Lesen Sie die vorgegebenen Texte aufmerksam durch. Nach jedem Abschnitt sind Kontrollfragen eingestreut. Versuchen Sie die Aufgaben selbständig zu lösen. Zur Bestätigung können Sie die Antworten im Lösungsordner nachschauen. Wenn Sie alle Kontrollaufgaben gut gelöst haben, melden Sie sich bei der Lehrperson. Sie wird Ihnen wiederum einige Testfragen stellen. Um den Test bestehen zu können, müssen Sie folgende Lernziele erreichen: Sie können erklären, was Alkane, Alkene, Alkine und Aromaten sind. Sie kennen die Namen der ersten 16 unverzweigten Alkane auswendig. Sie können verzweigte Alkane benennen und aufzeichnen. Sie können unverzweigte Alkene benennen und aufzeichnen. Sie können unverzweigte Alkine benennen und aufzeichnen. Sie wissen, in welchen Aggregatzuständen die unverzweigten Alkane bei Raumtemperatur vorliegen. 3 Die Benennung der Kohlenwasserstoffe 15
18 Vorbemerkung Das heute gültige Regelwerk zur Benennung der Kohlenwasserstoff-Moleküle ist in einer Sprache formuliert, die für den Anfänger nicht verständlich ist. Ähnlich wie die Sprache der Juristen kann sie nur vor dem intergrund einer fundierten Ausbildung verstanden werden. Deshalb wählen wir hier einen anderen Zugang, nämlich den des "learning by doing". Das heisst, wird beginnen damit, ganz einfache Beispiele von Molekülen zu benennen. Dabei ergeben sich wie von selbst gewisse Einsichten und ein erstes Gefühl für die dahinter verborgenen Regeln. Dabei nehmen wir bewusst in Kauf, dass unsere Erkenntnisse nur in einem beschränkten Rahmen anwendbar sind. Mit der Zeit werden Fragen auftauchen, auf die wir keine Antworten geben können. Aber wir werden sicher so weit kommen, dass wir einfachere Beispiele von Kohlenwasserstoff-Molekülen absolut korrekt benennen können. Für jene Studierenden, die sich damit nicht zufrieden geben, sind dann im Additum die ausführlichen Regeln in der Fachsprache der hemie formuliert. Es wird dann spannend sein, die zuvor selbst entdeckten Gesetzmässigkeiten im Rahmen der wissenschaftlich korrekten Formulierung wieder zu finden Die Benennung der Kohlenwasserstoffe
19 Die Einteilung der Kohlenwasserstoffe Die Benennung der Kohlenwasserstoffe beruht auf einer Einteilung in vier Unterklassen: Alkane Alkene Alkine : Ihre Moleküle weisen ausschliesslich --Einfachbindungen auf : Ihre Moleküle weisen mindestens eine --Doppelbindung auf : Ihre Moleküle weisen mindestens eine --Dreifachbindung auf Aromaten : Ihre Moleküle weisen delokalisierte Elektronen auf. Darunter versteht man Elektronen, die über grössere Teilbereiche eines Moleküls frei beweglich sind. Die Benennung der Aromaten erfolgt nach eigenen Regeln und wird in diesem Programm nicht besprochen. Alkane Alkene Alkine Aromaten Die dargestellten Alkine entsprechen den darüber abgebildeten Alkanen und Alkenen. Im Gegensatz zu diesen weisen sie im Bereich der Dreifachbindungen eine lineare Struktur auf. Das liegt daran, dass bei einer Dreifachbindung die vier beteiligten Atomzentren immer auf einer Geraden liegen. Der einfachste aller Kohlenwasserstoffe heisst Methan und hat die Summenformel 4. Obwohl in einem Methan-Molekül gar keine --Bindung vorkommt, wird Methan zu den Alkanen gezählt. 3 Die Benennung der Kohlenwasserstoffe 17
20 3.1 Eine verdünnte wässrige Lösung von Brom wird im Fachjargon als "Bromwasser" bezeichnet. Alkene und Alkine können Bromwasser entfärben, während Alkane diese Eigenschaft nicht aufweisen. Gegeben sind ein typisches Alkan, ein typisches Alken und ein typischer Aromat: yclohexan yclohexen Benzol Es soll untersucht werden, ob sich diese drei Kohlenwasserstoffe gegenüber Bromwasser wie erwartet verhalten. Achtung: Benzol und Brom sind stark giftig. Ihre Dämpfe sollten möglichst nicht eingeatmet werden! Im eingeschalteten Abzug werden drei Reagenzgläser (RG) mit den folgenden Inhalten vorbereitet: RG 1 RG 2 RG 3 : 1 ml yclohexan : 1 ml yclohexen : 1 ml Benzol Zu jedem RG wird aus einer Pipette je 1 ml Bromwasser zugegeben. Die RG werden mit Gummistopfen versehen und kräftig geschüttelt. Bei welchen Stoffen tritt Entfärbung ein, bei welchen nicht? alten Sie das Ergebnis schriftlich fest! Worauf beruht die allfällige Entfärbung? Stellen Sie eine ypothese auf! 18 3 Die Benennung der Kohlenwasserstoffe
21 Die Benennung der Alkane a) Die Benennung der unverzweigten Alkane In der folgenden Tabelle sind die Namen, die Summenformeln und die Skelettformeln für die ersten sechszehn unverzweigten Alkane angegeben: Methan 4 Ethan 2 6 Propan 3 8 Butan 4 10 Pentan 5 12 exan 6 14 eptan 7 16 Octan 8 18 Nonan 9 20 Decan Undecan Dodecan Tridecan Tetradecan Pentadecan exadecan Die Namen der ersten vier unverzweigten Alkane sind historisch bedingt. Deshalb müssen sie auswendig gelernt werden. Die Namen der längerkettigen Vertreter basieren auf den Zahlwörtern un, do, tri, tetra, penta, hexa, hepta, octa, nona, deca. Man kann sie also leicht im Gedächtnis behalten. Man beachte, das sich ein unverzweigtes Alkan durch die allgemeine Formel n 2n+2 darstellen lässt. 3 Die Benennung der Kohlenwasserstoffe 19
22 b) Die Benennung der verzweigten Alkane Einleitung Die Namen der unverzweigten Kohlenwasserstoffe sind nun bekannt. Wie aber werden die verzweigte Kohlenwasserstoffe benannt? Dazu einige Beispiele: Beispiel 1 Man benenne Der Name eines verzweigten Alkans basiert immer auf der sogenannten Stammkette, das heisst der längsten Kette von -Atomen im betreffenden Molekül. Sie bekommt den gleichen Namen wie das entsprechende unverzweigte Alkan. Die -Atome der Stammkette werden durchnummeriert. Der Beginn der Nummerierung ist so zu wählen, dass man möglichst schnell zu einer Abzweigung gelangt richtig falsch Eine Seitenkette wird ebenfalls gemäss ihrer Länge bezeichnet, aber die Endsilbe an wird durch die Endsilbe yl ersetzt. Seitenkette mit 1 -Atom : Methyl Seitenkette mit 2 -Atomen : Ethyl Seitenkette mit 3 -Atomen : Propyl usw. Der Name eines verzweigten Alkans wird gebildet, indem zuerst die Seitenkette und anschliessend die Stammkette genannt wird. Um klarzustellen, wo die Seitenkette abzweigt, stellt man vor ihren Namen die Nummer der Verzweigungsstelle. Es wird jeweils nur der erste Buchstabe gross geschrieben. Das Molekül heisst also 2-Methylpentan Die Benennung der Kohlenwasserstoffe
23 Beispiel 2 Man benenne Sind mehrere Seitenketten vorhanden, so werden ihre Namen in einer alphabetischen Reihenfolge vor dem Namen der Stammkette aufgeführt. Zum Beispiel: Ethyl-exyl-Methyl-Propyl-. Tritt die selbe Seitenkette mehrmals auf, so wird ihrem Namen eine darauf hinweisende Silbe vorangestellt: di : Kette kommt 2 mal vor tri : Kette kommt 3 mal vor tetra : Kette kommt 4 mal vor penta : Kette kommt 5 mal vor hexa : Kette kommt 6 mal vor usw. Diese Vorsilbe hat aber keinen Einfluss auf die alphabetische Reihenfolge, in der die Seitenketten genannt werden müssen. Das Molekül heisst also 3-Ethyl-2,4-dimethylpentan. Beispiel 3 Man benenne und Ist die auptkette in sich geschlossen, so wird ihrem Namen die Silbe cyclo vorangestellt. Die Namen sind also yclohexan und 1,3-Dimethylcyclohexan. 3 Die Benennung der Kohlenwasserstoffe 21
24 3.1 Die folgende Abbildung zeigt sämtliche Kohlenwasserstoff-Moleküle, die zur Summenformel 6 14 gezeichnet werden können. Wie lauten ihre Namen? 3.2 Benennen Sie auch die folgenden Moleküle: 3.3 Zeichnen Sie die Strukturen der folgenden Moleküle auf: a) 2,2,4-Trimethylpentan b) 3-Ethyl-2-methyl-4-propyloctan c) 2,2-Dimethylpropan 3.4 Die folgenden Moleküle sind falsch benannt. Warum? 2-Ethylbutan 3-Etyl-6-methylheptan 2-Methyl-4-ethyl-5-methyloctan 3.5 Benennen Sie die folgenden Moleküle: 3.6 Zeichnen Sie die Strukturen der folgenden Moleküle auf: a) Methylcyclohexan b) 1-Ethyl-2-methylcyclopropan 22 3 Die Benennung der Kohlenwasserstoffe
25 Die Benennung unverzweigter Alkene Einleitung Die Benennung entspricht weitgehend derjenigen der entsprechenden Alkane. Es ist aber wichtig, dass die Position einer vorhandenen Doppelbindung klar zum Ausdruck gebracht wird. Beispiel 4 Man benenne und Eine Doppelbindung in einem Kohlenwasserstoff-Molekül wird dadurch angezeigt, dass im Namen der Stammkette die Endung an durch die Endung en ersetzt wird. Die genaue Lage einer Mehrfachbindung wird ähnlich wie bei Seitenketten durch die Nummer des entsprechenden -Atoms angegeben. Sie wird unmittelbar vor die Silbe en gesetzt. Die Moleküle heissen also: Pent-2-en ex-3-en 3.7 Benennen Sie die folgenden Moleküle: 3.8 Zeichnen Sie die folgenden Moleküle auf: a) yclohexen b) ept-3-en 3 Die Benennung der Kohlenwasserstoffe 23
26 Die Benennung unverzweigter Alkine Einleitung Die Benennung entspricht weitgehend derjenigen der entsprechenden Alkane. Es ist aber wichtig, dass die Position einer vorhandenen Dreifachbindung klar zum Ausdruck gebracht wird. Beispiel 5 Man benenne und Eine Dreifachbindung in einem Kohlenwasserstoff-Molekül wird dadurch angezeigt, dass im Namen der Stammkette die Endung an durch die Endung in ersetzt wird. Die genaue Lage einer Mehrfachbindung wird ähnlich wie bei Seitenketten durch die Nummer des entsprechenden -Atoms angegeben. Sie wird unmittelbar vor die Silbe in gesetzt. Die Moleküle heissen also: ex-2-in ept-3-in 3.9 Benennen Sie die folgenden Moleküle: 3.10 Zeichnen Sie die folgenden Moleküle auf: a) ycloheptin b) ept-3-in 24 3 Die Benennung der Kohlenwasserstoffe
27 3.11 Nachdem Sie nun über die Namen der unverzweigten Alkane Bescheid wissen, können deren Aggregatzustände bei Raumtemperatur erörtert werden: Die folgende Tabelle zeigt die Schmelz- und Siedepunkte der unverzweigten Alkane von 4 bis : Formel Name Smp Sdp AZ bei RT 4 Methan Ethan Propan Butan Pentan exan eptan Octan Nonan Decan Undecan Dodecan Tridecan Tetradecan Pentadecan exadecan eptadecan Octadecan Nonadecan Tragen Sie in letzte Spalte der Tabelle für jedes Alkan den bei Raumtemperatur herrschenden Aggregatzustand ein und fassen Sie dann den Inhalt der Tabelle in wenigen Worten zusammen! 3.12 Die Organisation, welche die Nomenklaturregeln herausgibt, wird IUPA genannt. Sie lässt für gewisse einfach gebaute Kohlenwasserstoff-Moleküle nach wie vor Trivialnamen zu. Beispiele dafür sind Isobutan, Isopentan, Neopentan und Isohexan. Laden Sie im Internet die folgende omepage: Suchen Sie innerhalb dieser omepage nach den Strukturen für Isobutan, Isopentan, Neopentan und Isohexan! 3 Die Benennung der Kohlenwasserstoffe 25
28 3.13 Die Nomenklatur-Regeln sind so clever konzipiert, dass sie auf beliebig kompliziert gebaute Kohlenwasserstoff-Moleküle anwendbar sind. Allerdings resultieren dabei oft sehr lange, nur mühsam zu schreibende Namen. Deshalb werden in solchen Fällen sogenannte Trivialnamen verwendet, die als Abkürzungen für eine komplexe Molekülstruktur verstanden werden können. Im Arbeitszimmer liegt das folgende Buch bereit: ellwinkel Dieter, "Die systematische Nomenklatur der Organischen hemie", Springer Verlag, Berlin, Suchen Sie in diesem Buch nach den Trivialnamen für die folgenden Moleküle: 3.14 Von der Lehrperson wird Ihnen ein omputer und ein Datenträger mit der Powerpoint-Datei nomenklatur2.pps zur Verfügung gestellt. Diese Datei erklärt Ihnen auf spielerische Art und Weise das Grundprinzip der chemischen Nomenklatur! 26 3 Die Benennung der Kohlenwasserstoffe
Die Kohlenwasserstoffe und ihre Nomenklatur
 Die Kohlenwasserstoffe und ihre Nomenklatur Ein Leitprogramm für die hemie Autor Beratung Dr. Georg Graf Prof. Dr. Antonio Togni, ETZ Leitprogramm Nomenklatur Adressaten Gymnasiasten ab 2. Schuljahr im
Die Kohlenwasserstoffe und ihre Nomenklatur Ein Leitprogramm für die hemie Autor Beratung Dr. Georg Graf Prof. Dr. Antonio Togni, ETZ Leitprogramm Nomenklatur Adressaten Gymnasiasten ab 2. Schuljahr im
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Die Alkane. Anna Heynkes. 22.6.2005, Aachen. 1 Was sind Alkane 1. 2 Verwendung der Alkane 1. 3 Einige Eigenschaften der Alkane 2
 Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Systematische Nomenklatur
 Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
OSZ Körperpflege Chemie Fachhochschulreife FOS 2009/10
 Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2
 A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
Isomere. 3. Bsp. C5H12
 Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Was ist ein Kaleidozyklus?
 Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Alkane - eine vielseitige Stoffgruppe. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Clara Schumann -Gymnasium Grundlagen der organischen Chemie
 1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Zusammenfassung Prüfung Chemie vom
 Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
ORGANISCHE CHEMIE. Prof. Dipl.-Ing. Manfred SUSSITZ. Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt
 ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln.
 Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Fachdidaktik Chemie ETH Reaktionen S. 1
 Fachdidaktik Chemie ETH Reaktionen S. 1 Mischung oder Reaktion Im Labor mischen die Schülerinnen zwei Flüssigkeiten. Wenn die Stoffe miteinander reagieren, sind überraschende Farben, Fällungen oder Gasblasen
Fachdidaktik Chemie ETH Reaktionen S. 1 Mischung oder Reaktion Im Labor mischen die Schülerinnen zwei Flüssigkeiten. Wenn die Stoffe miteinander reagieren, sind überraschende Farben, Fällungen oder Gasblasen
1. Wer sich über Erdgas informieren will, findet im Internet viele Informationen dazu, zum Beispiel diese:
 Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe
 Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
Fachdidaktik Chemie ETH Reaktionen S. 1
 Fachdidaktik Chemie ETH Reaktionen S. 1 Mischung oder Reaktion Im Labor mischen die Schülerinnen zwei Flüssigkeiten. Wenn die Stoffe miteinander reagieren, sind überraschende Farben, Fällungen oder Gasblasen
Fachdidaktik Chemie ETH Reaktionen S. 1 Mischung oder Reaktion Im Labor mischen die Schülerinnen zwei Flüssigkeiten. Wenn die Stoffe miteinander reagieren, sind überraschende Farben, Fällungen oder Gasblasen
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
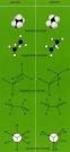 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
IUPAC Nomenklatur. Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten. Feld 2: Stammname der Verbindung
 Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
wir-sind-klasse.jimdo.com
 Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
1. STATION: Probe Verhalten beim Erhitzen organisch anorganisch A
 HTBL-PINKAFELD Arbeitsblatt A5 LAUFZETTEL: Einf. Organische Chemie Namen:... PROTOKOLL: 1. STATION: Probe Verhalten beim Erhitzen organisch anorganisch A B C D E F 2. STATION: Entflammbarkeit: reiner Alkohol
HTBL-PINKAFELD Arbeitsblatt A5 LAUFZETTEL: Einf. Organische Chemie Namen:... PROTOKOLL: 1. STATION: Probe Verhalten beim Erhitzen organisch anorganisch A B C D E F 2. STATION: Entflammbarkeit: reiner Alkohol
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Konzentrationsbestimmung mit Lösungen
 Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur
 Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
Stoffplan GLF Chemie 4Mb
 Organische Chemie Stoffplan GLF Chemie 4Mb Theorie: Organische Chemie: -Kohlenwasserstoffe -Aromatische Kohlenwasserstoffe: z.b. Benzol -Organische Sauerstoffverbindungen: z.b. Ethanol -Von der Organik
Organische Chemie Stoffplan GLF Chemie 4Mb Theorie: Organische Chemie: -Kohlenwasserstoffe -Aromatische Kohlenwasserstoffe: z.b. Benzol -Organische Sauerstoffverbindungen: z.b. Ethanol -Von der Organik
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
5 Internetrecherche LI
 Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
CURRICULUM AUS NATURWISSENSCHAFTEN Physik und Chemie 1. Biennium FOWI
 Allgemeine Ziele und Kompetenzen Der Unterricht der soll den SchülerInnen eine aktive Auseinandersetzung mit physikalischen und chemischen Phänomenen ermöglichen. In aktuellen und gesellschaftsrelevanten
Allgemeine Ziele und Kompetenzen Der Unterricht der soll den SchülerInnen eine aktive Auseinandersetzung mit physikalischen und chemischen Phänomenen ermöglichen. In aktuellen und gesellschaftsrelevanten
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Stationenlernen Chemie im Paket. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Organische Verbindungen 4. Nomenklatur organischer Stoffe (Kl. 9/10) Die Nomenklatur organischer Verbindungen ein Übungszirkel
 Organische Verbindungen 4. Nomenklatur organischer Stoffe (Kl. 9/10) 1 von 28 Die Nomenklatur organischer Verbindungen ein Übungszirkel Ein Beitrag von Günther Lohmer, Leverkusen Mit Illustrationen von
Organische Verbindungen 4. Nomenklatur organischer Stoffe (Kl. 9/10) 1 von 28 Die Nomenklatur organischer Verbindungen ein Übungszirkel Ein Beitrag von Günther Lohmer, Leverkusen Mit Illustrationen von
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Alkane einfache Kohlenwasserstoffe
 Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Drill&Practice: Alkene und Alkine
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Schweizerische Maturitätsprüfung Gruppe / Kandidat/in Nr:... Winter 2010, Zürich Name/Vorname:...
 Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Kapitel 02: Erdgas und Erdöl
 Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Chemiegrundwissen. 1. Atombau Bohrsches Atommodell Elemente, PSE, Hauptgruppen Elektronegativität
 hemiegrundwissen 1. Atombau Bohrsches Atommodell Elemente, PSE, auptgruppen Elektronegativität 2. Element, Verbindung Gemisch Unterschied Reinstoff, Gemisch Salze Ionen aus Metall-Nichtmetall Salze in
hemiegrundwissen 1. Atombau Bohrsches Atommodell Elemente, PSE, auptgruppen Elektronegativität 2. Element, Verbindung Gemisch Unterschied Reinstoff, Gemisch Salze Ionen aus Metall-Nichtmetall Salze in
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Übungen zur VL Chemie für Biologen und Humanbiologen Diese Aufgaben werden in der Übung besprochen.
 Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Schweizerische Maturitätsprüfung Gruppe / Kandidat/in Nr:... Sommer 2010, Bern Name/Vorname:...
 Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSAFTEN hemie Verfasser: Richtzeit: ilfsmittel: inweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total 4 Stunden)
Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSAFTEN hemie Verfasser: Richtzeit: ilfsmittel: inweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total 4 Stunden)
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
ORGANISCHE CHEMIE 1 KOHLENWASSERSTOFFE GF
 KSO ORGANISCE CEMIE 1 KOLENWASSERSTOFFE GF Skript Organische Chemie 1 Kohlenwasserstoffe GF V1.0 8/12 Bor Skript KW & org. Sauerstoffverbindungen 24 M.Mosimann (edited by Bor 01/11) 1 INALTSVERZEICNIS
KSO ORGANISCE CEMIE 1 KOLENWASSERSTOFFE GF Skript Organische Chemie 1 Kohlenwasserstoffe GF V1.0 8/12 Bor Skript KW & org. Sauerstoffverbindungen 24 M.Mosimann (edited by Bor 01/11) 1 INALTSVERZEICNIS
Benennung (Nomenklatur) von Alkanen. zusammengestellt von W. Habelitz-Tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S.
 Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
Unterrichtsvorhaben II Vom Alkohol zum Aromastoff
 Unterrichtsvorhaben II Vom Alkohol zum Aromastoff Umfang: Jgst.: 38 EF Schwerpunkte / Inhalt Konkrete Kompetenzerwartungen Vgl. Kapitel im Schulbuch Anmerkungen Rund um das Parfum: Aromastoffe (Vorkommen,
Unterrichtsvorhaben II Vom Alkohol zum Aromastoff Umfang: Jgst.: 38 EF Schwerpunkte / Inhalt Konkrete Kompetenzerwartungen Vgl. Kapitel im Schulbuch Anmerkungen Rund um das Parfum: Aromastoffe (Vorkommen,
Chemie. GRUNDLAGENFACH CHEMIE Stundentafel
 Fachlehrplan Chemie Seite 1 5 Chemie GRUNDLAGENFACH CHEMIE Stundentafel 4. Schuljahr 5. Schuljahr 3 Wochenstunden 2 Wochenstunden BILDUNGSZIELE Beitrag der Chemie zu den Zielen gemäss MAR Der Chemieunterricht
Fachlehrplan Chemie Seite 1 5 Chemie GRUNDLAGENFACH CHEMIE Stundentafel 4. Schuljahr 5. Schuljahr 3 Wochenstunden 2 Wochenstunden BILDUNGSZIELE Beitrag der Chemie zu den Zielen gemäss MAR Der Chemieunterricht
Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
