Organometallic Reactions for Natural Product Synthesis. Oliver Reiser Universität Regensburg
|
|
|
- Swen Lange
- vor 5 Jahren
- Abrufe
Transkript
1 rganometallic eactions for atural Product Synthesis liver eiser Universität egensburg
2 1) General Preparation of Functionalized rganomagnesium eagents 12 Mg Grignard : 1900 Mg X Mg X δ- C δ+ MgX alogen-magnesium Exchange 1 X 2 Mg X - 2 X 1 Mg X General review : P. KnochelAngew. Chem. nt. Ed. 2000, 39, 4414
3 alogen-magnesium exchange C 3 TF + C MgCl 2 MgCl ºC >90% J. Villieras, Bull.Soc.Chim.Fr.1967, 1520 F F + 2EtMg TF F Mg F + 2 Et F F >90% F Mg F C. Tamborski J. rganomet. Chem. 1971, 26, EtMg 25 C, 0.5 h Mg. Furukawa Tetrahedron Lett. 1987, 28, 5848
4 Ester Functionalized Arylmagnesium eagents C i-prmg C C C 90 % TF, -10 C 30 min Mg stable at 0 C c-ex-c c-ex C 72 % G. Varchi, Munich 2001
5 Synthesis of Functionalized ndolylmagnesium Compounds i-prmgcl, TF MgCl C C 2 Et -20 C, 0.5 h C 2 Et C 2 Et PMB PMB PMB 84 %. Sapountzis, Munich 2002
6 Chloromethyl-Substituted Arylmagnesium eagents C Cl 1) i-prmg -30 C,1h C Cl MgX Pr C 1) -10 C, 1 h 2) reflux, 12 h C 60 % C Pr -10 Ctort C 75 % T. DELACX, L. BELL, J. TBET, P. KCEL, J. rg. Chem. 2000, 65, 8108
7 ing Closure of Functionalized Arylmagnesium eagents (1) Ac i-prmg -10 C, 3.5 h Mg Ac AT 95 % Ts Ts Ac i-prmg Co(acac) 2 (10 mol%) X Co Ac Ts -10 C, 17 h "SY" 95 % Ts Ts F. Kneisel, Y. Monguchi, K. Knapp, K. M. Zipse, P. Knochel, Tetrahedron Lett. 2002, 43, 4875
8 ing Closure of Functionalized Arylmagnesium eagents (2) Et 2 C i-prmgcl Et 2 C MgCl Et 2 C 63 %ee Ts -20 C, 1 h Ts CuC 2 LiCl ( 10 mol%) -30 C to 50 C 4 h 83 %; 63 %ee S 2 i-prmgcl -20 C MgCl S 2 CuC 2 LiCl (1 mol%) -30 C to rt, 8 h S 2 87 % F. Kneisel, Y. Monguchi, K. Knapp, K. M. Zipse, P. Knochel, Tetrahedron Lett. 2002, 43, 4875
9 Chemoselective /Mg-Exchange i-prmg 20 C, 4 h Mg 62 % 68 % Et i-prmg -10 C,1h Mg Et CC 2 Et rt, 3 h Et 48 % CEt M. ABAB, F. DEMEL, P. K. J. rg. Chem. 2000, 65, 4618
10 ndole Synthesis via a Chemoselective /Mg-Exchange 2 CEt 1) i-prmg 2 TF, -20 C 2) CuC 2LiCl 30 min 20 mol% 2) CuC 2LiCl 3) 3) CEt 73 % CEt 88 % 1) i-prmg TF, -20 C 30 min 1) i-prmg TF, -20 C, 30 min 2) CuC 2LiCl (C 2 ) 3 C 2 Et 3) Cl, Et, 80 C, 16 h 2 1) Cl/TF/ 2, rt, 5 min 2) ZnCl 2, Et, reflux, 16 h EtC EtC 95 % EtC 54 % D. Lindsay, W. Dohle, A. E. Jensen, P. Knochel, rg. Lett. 2002, 4, 1819
11 Unprotected Amino-Substituted Arylmagnesium eagents 2 1) MgCl, TF -30 C, 5 min 2) i-prmgcl, TF -25 C, 10 min ClMg MgCl C -20 C, 0.5 h 2 84 % C 2 Et C 2 Et C 2 Et 2 1) MgCl, TF -30 C, 5 min ClMg MgCl C 2 2) i-prmgcl, TF -25 C, 10 min -20 C, 0.5 h 76 % C C C 2 1) MgCl, TF -30 C, 5 min ClMg MgCl C 2 C 2) i-prmgcl, TF -25 C, 10 min C -20 C, 0.5 h C 75 % C. Kofink, G. Varchi, D.W. Lindsay, P. Knochel. Munich 2002
12 itro-substituted Arylmagnesium eagents 2 MgCl (1.1 equiv) MgCl 2 C 2-80 C, 5 min -80 C, 0.5 h 94 % CEt CEt CEt 2 MgCl (1.1 equiv) 2 MgCl C 2-40 C, 5 min -40 C, 0.5 h 90 % C C C 2 2 MgCl (1.1 equiv) 2 MgCl C (1. 2 equiv) -40 C, 5 min -40 C, 0.5 h %. Sapountzis, P Knochel, Angew. Chem. nt. Ed. 2002, 41, 1610
13 itro-substituted Arylmagnesium eagents 2 MgCl (1.1 equiv) 2 MgCl CuC 2 LiCl 2 Cu 2 (1.0 equiv) -40 C, 5 min -40 C, 10 min -40 C, 0.5 h 75 % 2 MgCl (1.1 equiv) MgCl 2 CuC 2 LiCl Cu C, 5 min -40 C, 10 min -40 C, 0.5 h CEt CEt CEt CEt 70 %. Sapountzis, P Knochel, Angew. Chem. nt. Ed. 2002, 41, 1610
14 Functionalized Ester-Substituted Alkenylmagnesium eagents C 2 Et Et i-prmg -20 C, 0.5 h C 2 Et Mg CuC 2LiCl C 2 Et C C 2 Et C C 70 %; E : Z > 99 : 1.Sapountzis, P. Knochel Chem. Commun. 2001, 2068.
15 Functionalized Alkenyl-Magnesium Carbenoids C 2 Et i-prmgcl, ether -50 C, 15 min MgCl C 2 Et 2 C 2 79 % C 2 Et 89 % 2 C Zn 2 C 71 % VET A VU, Munich, 2002, unpublished results Pd(dba) 2 ( 5 mol%) tfp (10 mol%) 76 %
16 Ester-Substituted Alkylmagnesium eagents i-prmgcl E Et -40 C, 15 min Et Mg (Cu() or Pd(0) ) Et 2 C E Et 2 C C 2 Et Et 2 C Et 2 C 81 % 90 % 73 % 92 % C 2 V.-A. Vu,. Marek, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, 351
17 Ester-Substituted Magnesium Carbenoids i-prmgcl 2 Et -50 C, 10 min ether Et Mg Cl Et 2 C 85 %; dr > 99:1 i-prmgcl BCl 2 C-CCl 2 Et -50 C, 10 min ether Et Mg Cl Et 2 C 80 %; dr > 99:1 V.-A. Vu,. Marek, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, 351
18 ew preparation of functionalized cyclopropyl-magnesium compounds Et 2 C 1) i-prmgcl, ether -60 C, 5 min Et 2 C 1) i-prmgcl, TF -40 C, 20 min 2) CuC 2 LiCl CCl Et 2 C C 2) %; only trans 70 % V.-A. Vu,. Marek, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, 351
19 Copper ()- mediated Cross-Couplings C C 2 1) i-prmg TF, -20 C 30 min C 2 C rt, 2 h C 81 % 2) CuC 2LiCl -20 C to rt P() 3 (1.9 equiv) Cu rt, 3 h stable at 20 C Piv Piv C 89 % W. Dohle, D. Lindsay, P. Knochel, rg. Lett. 2001, 3, 2871
20 Fe()-catalyzed Cross-Coupling between Csp2-centers C i-prmg C Fe(acac) 3 (5 mol%) F 3 C 2 S Bn TF, -10 C 30 min Mg S 2CF 3 Bn 2 C 69 % TF, -20 C, min CEt CEt f Fe(acac) 3 (5 mol%) f Mg TF, -20 C, min Bu Bu 73 % W. Dohle, F. Kopp, G. Cahiez, P. Knochel, Synlett, 2001, 1901
21 Keto-Substituted Arylmagnesium eagents Mg Mg SS S 2. 5 equiv -50 C, 3.5 d TF -50 C to rt C 2 72 % Mg Mg 1) Zn equiv -30 C, 1 h TF : MP 4 : 1 F. F. Kneisel, P. Knochel, Synlett, 2002, in press 2) Pd(dba) mol% tfp 5 mol% C 2 64 %
22 The omine- Copper Exchange for the Synthesis of Functionalized rganocoppers CEt CuLi LiC 2 Li Cu CEt CEt CEt -40 C, 15 min (- neopentyl bromide) CEt CEt 76 % C. Piazza, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, in press
23 The alogen- Copper Exchange for the Synthesis of Functionalized rganocoppers Li CuLi LiC Cu 2-40 to 0 C, 30 min (- neopentyl iodide) 80 % 80 % C. Piazza, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, in press
24 Convenient preparation of functionalized cuprates via Dineophyl Lithium Cuprate Cl 1 mol : 830 Euros Cl 1 mol : 11 Euros eopentyl chloride eophyl chloride Cl Li, hexane reflux, 12 h 67 % Li 1/2 CuC 2 CuLi LiC (eophyl)culi C 2 Et C 2 Et C 2 Et 1) (eophyl)culi 1) (eophyl)culi 2) CCl 2) allyl bromide 95 % C 90 % C. Piazza, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, in press
25 Functionalized Arylcopper eagents Bearing a Keto group C 77 % C C 68 % CCl TMSCl 2 CuLi LiC Cu(eophyl)Li C -30 C to 25 C, 1 h 25 C, 1 h C C 70 % C 2 Et C 2 Et C 78 %; >98 % E C. Piazza, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, in press
26 Functionalized Arylcopper eagents Bearing an Aldehyde group C C 70 % C 3 CCl C 2 CuLi LiC Cu(eopent)Li C C -40 C to -20 C, 4 h 25 C, 1 h 80 % C. Piazza, P. Knochel, Angew. Chem. nt. Ed. 2002, 41, in press
27 Chemoselective preparation of functionalized cuprates CuLi LiC 2 Cu(neo-Pent)Li -40 to 0 C, 1 h 74 % C 2 Et CuLi LiC 2 C 2 Et CCl C 2 Et MPA ( 9 equiv) -78 C, 15 min Cu(eophyl)Li C 69 % C. Piazza, P. Knochel Munich 2002, unpublished results
28 Chemoselective preparation of functionalized cuprates CuLi LiC 2 ( 2 equiv ) Cu(p)Li 2 TF, 0 C, 1 h Cu (p) 2 Li % S C CuLi LiC 2 TF, 0 C, 4 h S C Cu(p)Li S C 61 % C CuLi LiC 2 TF, -78 C, 1 h C Cu(eophyl)Li C 67 % C. Piazza, P. Knochel Munich 2002, unpublished results
29 Stereoselective Anti-S2' allylic substitution (1) CEt CuLi LiC 2 CEt Ac (93 %ee) CEt TF, -30 to 0 C, 1 h Cu(p)Li -30 to 0 C, 1 h 64 %; 92 %ee C. Piazza, Munich 2002
30 Stereoselective Anti-S2' allylic substitution (2) P()(Et) 2 Zn (3 equiv) 94 %ee CuC 2 LiCl (3 equiv) TF:MP 3:1 0 C to 20 C, 12 h 84 %; 91%ee P()(Et) 2 EtC Zn (3 equiv) CEt BuLi (1.5 equiv) TMSCl ( 1.2 equiv) 94 %ee CuC 2 LiCl (3 equiv) TF:MP 3:1 0 C to 20 C, 12 h 68 %; 94 %ee TF, -70 C, 2 h 75 %; 93 %ee. Calaza, Munich 2002
31 Synthesis of Propargylamines Cu (5 mol%) 4 toluene 2 rt or 60 C 3-24 h 5 ex (All)Bn (All)Bn (All)Bn 69 % 75 % 98 % C Bn 2 Bn 2 77 % 82 % C. Koradin, P. Knochel Angew. Chem. nt. Ed. 2002, 41, 2535
32 Enantioselective Synthesis of Propargylamines Bn 2 + p- Cu (5.0 mol%) -(+)-Quinap (5.5 mol%) toluene, rt 44 h Bn 2 83 %, 90 % ee p- Bn 2 + Cu (5.0 mol%) -(+)-Quinap (5.5 mol%) toluene, rt 76 h Bn 2 73 %, 70 % ee P 2 -(+)-Quinap C. Koradin, P. Knochel Angew. Chem. nt. Ed. 2002, 41, 2535
33 Proposed chanism Bn 2 + D Cu (5.0 mol%) toluene, rt 14 h D Bn 2 91 %, > 90 % d C. Koradin, P. Knochel Angew. Chem. nt. Ed. 2002, 41, 2535
34 Proposed chanism 2 P Cu P Cu 2 P Cu P Cu 2 2
35 Silanole Si + 1 Pd(P 3 ) 4 (5 mol%) Ag 2 (100 mol%) TF, 60 C, 36h 30-80% 1 = 2-, 4-, 4-CF 3 1 = 2-, 4-, 4-CF 3, 4-2, 4-, 4-Tf omide und Triflate sind keine guten Kupplungspartner Si 2 + Pd(P 3 ) 4 (5 mol%) Ag 2 (100 mol%) TF, 60 C, 36h 80% Si 2 + Pd(P 3 ) 4 (5 mol%) Ag 2 (100 mol%) TF, 60 C, 14h A. Mori, rg. Lett. 1999, 1, % S-30a
36 Stille eaction 1 SnBu X Pd(0) X SnBu 3 Stille, J. K.; Milstein, D. J. Am. Chem. Soc. 1978, 100, K. C. icolaou, Chem. Eur. J. 1995, 1, 318. Bu 3 Sn SnBu 3 20 mol% Pd(C) 2 Cl 2 i-pr 2 Et 25 C DMF/TF 48 hours rapamycin, 27% eviews: Farina, V.; Krishnamurthy, V.; Scott, W. J. in rganic eactions, Volume 50; L. Paquette et al., Eds. Wiley: ew York, 1997; p 1. Mitchell, T.. Synthesis 1992, 803.
37 eactions chanism (2) xidative Addition / eductive Elimination M n + A B xidative Addition A M n+2 B n = xidation number xidation of the metal Two ligands are added to the coordination sphere Starting complex must have at least 2 d-electrons and 2 free coordination sites A M n+2 B eductive Elimination M n + A B eduction of the metal Two ligands are removed from the coordination eductive Elimination is the reversal of xidation Addition
38 (2) xidative Addition / eductive Elimination eaction chanism M n + A B xidative Addition A M n+2 B Substrates (a) unpolar Compounds, 3 Si, (b) polar Compounds X, X, X X =,, Cl, Tf, P()() 2 (c) Multiple Bonds M 0 M 2 Ligands that increase the electron density on the metal accelerate the oxidative addition
39 (2) xidative Addition / eductive Elimination eaktion chanism M n + A B xidative Addition A M n+2 B Protonation X M 0 X M 2 X M 2 "When a Proton is not a Proton", B. M. Trost, Chem. Eur. J. 1998, 4, Ligands that increase the electron density on the metal slow down the reductive elimination Ligands that decrease the electron on the metal density accelerate the reductive elimination e.g. C or
40 eaktion chanism (3) nsertion / Deinsertion Alkene nsertion X M Deinsertion X M C C "insertion" X C X M "deinsertion" M nsertion in M X Bond: no change of the oxidations state of M number of electrons in M ächanges from n to n 2 Deinsertion not possible in 18 electronen complexes X and ligand: cis and coplanar X wmigrates with retention rate of insertion > > >
41 (3) nsertion / Deinsertion: β-ydride elimination eaktion chanism β M α β-ydride elimination M equirements: 16 Electrons or less cis-position of M and coplanar position of M and Stable organometall compounds M M M C 2 Si 3 M C 2 C 3 M M
42 eaktion chanism (4) Transmetalation Liganden exhange between metals L* M* + L M L M* + *L M tathesis mechanism L L L *M + M *M M *M + M L* L* L* transfer of a ligand from a main group to a transition metal Pd X + Bu 3 Sn 1 Bu 3 SnX Pd 1 main group metals: Li, Mg, B, Si, Sn, Zn, g often rate determining in catalysis
43 Alkinkupplungen
44 Palladium-katalysierte Alkinkupplungen eview:. ossi rg. Prep. Proc. ntl. 1995, 27, 127. A. Castro-Stevens Kupplung 1 Cu B. The Sonogashira-agihara Kupplung 1 + X X =,, Cl PdCl 2 (P 3 ) 2 (2 mol%) Cu oder CuAc(1 mol%) Amin = Et 2, Et 3 oder 25 C Lösungsmittel (wichtig!): Amin, TF(!) chanismus: ähnlich wie Suzuki und Stille, aber mit rganokupferverbindung Cu Cu Diese Species wird transmetalliert A-1
45 Palladium-katalysierte Akinkupplungen Alkynylzinkverbindungen M = Li, Mg M ZnCl 2 1 X + ClZn Pd(P 3 ) C, TF 1 1 = Aryl, Vinyl X =, E. egishi, J. Chem. Soc. Chem. Commun. 1977, E. egishi, J. rg. Chem. 1978, 43, Si 3 Si 3 Pd(P 3 ) 4 ClZn TF 20 bis 0 C Si 3 + Si 3. osshi, Tetrahedron Lett. 1988, 29, 2239 A-9
46 Palladium-katalysierte Akinkupplungen Alkynylzinkverbindungen C 2 + ClZn (3 equiv) PdCl 2 (C) 2 DMF, Et 2, T C 2 (E) oder (Z), eaktion ist stereospezifisch A. Duchene, Synthesis 1996, n-buli 2. ZnCl 2 3. C=CCl Pd(P 3 ) 4 Cl (1) a 2 / 3 (2) + E. egishi, J. rg. Chem. 1984, 49, 2629 A-10
47 Palladium-katalysierte Akinkupplungen Alkynylzinnverbindungen M = Li, Mg M Bu 3 SnCl 1 X + Bu 3 Sn Pd(0) T, TF, DMF oder MPA 1 1 = Aryl, Vinyl X = > > Tf >> Cl bei Zusatz von LiCl: > Tf > >> Cl Kein Amin und kein Cu() nötig! Ligandenfreie Katalyatoren wie PdCl 2 (C 3 C) 2 oftmals reaktiver als Pd(P 3 ) 4. Beletskaya, Doke. Akad. auk. SSS 1983, 272, 1384 J. K. Stille, Tetrahedron Lett. 1988, 29, 1509 A-11
48 Palladium-katalysierte Akinkupplungen Alkynylzinnverbindungen Tf + Bu 3 Sn Si 3 Pd(P 3 ) 4 / LiCl TF, T, 41h, 90% Si 3 J. K. Stille, J. Am. Chem. Soc. 1984, 106, X + Bu 3 Sn X + 2 Tf Bn(P 3 ) 2 PdCl (5%) Cu (8%) DMF, T P. Stang, J. rg. Chem. 1996, 61, 6162 A-12
49 Palladium-katalysierte Akinkupplungen Alkynylzinnverbindungen Latent basenempfindliche Substrate - Sonogashira Kupplung nicht möglich! 2 C C 2 + Bu 3 Sn PdCl 2 (P 3 ) 2, TF 25 C, 72h, 92% 2 C C 2 F. Diederich, Angew. Chem. 1992, 104, Bu 3 Sn PdCl 2 (P 3 ) 2 / Cu TF, T, 2h, 70-74%. J. K. Taylor, Tetrahedron Lett. 1996, 37, K. gasahara, J. Chem. Soc. Chem. Commun. 1996, A-13
50 Alkynylmagnesiumverbindungen Palladium-katalysierte Akinkupplungen 1 X + Mg cat. Pd(0) oder cat. i(0) 1 G. Linstrumelle, Tetrahedron Lett. 1978, 191. ossi, Tetrahedron 1984, 40, 2773 Cl Cl + Mg Si 3 i(dppp)cl 2 3 Si Si 3 (E) oder (Z), eaktion ist stereospezifisch F. Wudl, J. rg. Chem. 1984, 49, 4733 A-14
51 Alkynylmagnesiumverbindungen Palladium-katalysierte Akinkupplungen Tf Tf 3 Si Mg PdCl 2 [L*] / Li 3 Si Tf bis zu >99%ee Pd P Cl Cl T. ayashi, Tetrahedron Lett. 1996, 37, 3161 A-15
52 2-Alkynylverbindungen (Propargyl) Palladium-katalysierte Akinkupplungen 2 1 X 4 3 X = Cl, Ac, C 2 Cu Pd(0) 1 2 Cu 3 PdX Et Cl Bu + C 5 11 Pd(P 3 ) 4, Cu (i-pr) 2 Et Bu 91% C 5 11 J. Tsuji, Tetrahedron Lett. 1990, 31, 7179 J. Tsuji, J. rganomet. Chem. 1991, 417, 305 A-16
53 2-Alkynylverbindungen (Propargyl) Palladium-katalysierte Akinkupplungen Zink TMS ZnCl + Pd(P 3 ) 4 TF, 85% TMS. Kleijn, ecl. Trav. Chim. Pays-Bas 1982, 101, 97 Ac Bu + C 5 11 Pd(P 3 ) 4, (Cu) TF, ZnCl 2, 65 C, 74% Bu C 5 11 G. Linstrumelle, Tetrahedron Lett. 1993, 34, 3853 A-17
54 Alken / Alkin Trimerisierungen
55 Alkin/Alken-Trimerisierungen Prinzipien (1) Alkin-Trimerisierungen Katalysator bzw. diator (2) Alkin/Alken-Trimerisierungen Katalysator bzw. diator Katalysatoren: h, Pd diatoren: Co, Zr T-1
56 Alkin/Alken-Trimerisierungen chanismen (1) Alkin-Trimerisierungen ML n ML n ML n L n M (2) Alkin/Alken-Trimerisierungen ML n ML n ML n ML n T-2
57 Alkin/Alken-Trimerisierungen (1) Alkin-Trimerisierungen hodium h(p 3 ) 3 Cl (cat) Et, 1h, 40 C =, 79% = 59% h(p 3 ) 3 Cl (cat) 2h, 25 o C 75%. Grigg, Tetrahedron Lett. 1982, 23, 2691 T-5
58 Alkin/Alken-Trimerisierungen hodium (1) Alkin-Trimerisierungen 0.2 eq Clh(P 3 ) 3 Et, 78 C = TBDPS, 35% = Ac, 58% Bn Bn Bn Bn Acetylen in Et 0.1 eq Clh(P 3 ) 3, 0 C 89% Bn Bn Bn Bn Zhu,.; olmquist, C.; McDonald,F. E. J. Am. Chem. Soc. 1995, 117, 6605 T-6
59 Alkin/Alken-Trimerisierungen uthenium (1) Alkin-Trimerisierungen tathese [u] [u] [u] [u] ul n = C 2 =u(pcy 3 ) 2 Cl 2 S. Blechert Chem. Commun. 1997, T-7
60 Alkin/Alken-Trimerisierungen Zirkon (1) Alkin-Alken-Schwefel-Trimerisierung 1 BuLi Li 1 Cp 2 Zr()Cl Cp 2 Zr 1 C Cp 2 Zr 1 TMS 4 TMS Cp 2 Zr 1 SCl 2, TF TMS S % 4 2 Fang, Q.; Buchwald,S. L. J. rg. Chem. 1989, 54, 2793 T-10
Palladiumkatalysierte Kreuzkupplungen in der Totalsynthese. Brigitte Czepukojc, Anton Bayer
 Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
Katalyse - Metallorganik I. Oliver Reiser Universität Regensburg
 Katalyse - tallorganik I liver eiser Universität egensburg Prinzipien in der Katalyse 1. Die 18 Elektronenregel Übergangsmetalle können max. 18 Elektronen in ihrer äußeren Schale haben z. B. 3. Periode:
Katalyse - tallorganik I liver eiser Universität egensburg Prinzipien in der Katalyse 1. Die 18 Elektronenregel Übergangsmetalle können max. 18 Elektronen in ihrer äußeren Schale haben z. B. 3. Periode:
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen:
 Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Suzuki-Reaktion. - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert
 Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Katalyse - Metallorganik I
 Prinzipien in der Katalyse 1. Die 18 Elektronenregel Katalyse - tallorganik Übergangsmetalle können max. 18 Elektronen in ihrer äußeren chale haben z.. 3. Periode: 4s 2, 4p 6 ==> igandenbeitrag; 3d 10
Prinzipien in der Katalyse 1. Die 18 Elektronenregel Katalyse - tallorganik Übergangsmetalle können max. 18 Elektronen in ihrer äußeren chale haben z.. 3. Periode: 4s 2, 4p 6 ==> igandenbeitrag; 3d 10
3. Gruppe: Aromatische Substitution
 1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
Moderne Methoden in der Organischen Chemie
 oderne ethoden in der rganischen Chemie 0 Allgemeines: Wichtig für alle chemischen eaktionen: elektivität Chemoselektivität: egioselektivität: + tereoselektivät: - nantioselektivität: -Diastereosektivität:
oderne ethoden in der rganischen Chemie 0 Allgemeines: Wichtig für alle chemischen eaktionen: elektivität Chemoselektivität: egioselektivität: + tereoselektivät: - nantioselektivität: -Diastereosektivität:
Spezielle Methoden der pharmazeutischen Chemie 1
 Spezielle thoden der pharmazeutischen Chemie 1 andhabung von tallorganika (für Diplomanden und Dissertanten im Fach armazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Geräte und Arbeitstechniken 2.
Spezielle thoden der pharmazeutischen Chemie 1 andhabung von tallorganika (für Diplomanden und Dissertanten im Fach armazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Geräte und Arbeitstechniken 2.
1. Übung zur Vorlesung OC III
 . Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
. Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
3. C-C-Knüpfungen (Carbonylreaktionen) 26
 3. C-C-Knüpfungen (Carbonylreaktionen) 26 3.1 eaktionen an der Carbonylgruppe 26 3.1.1 Selektivität bei Carbonyladditionen 26 a) Chemoselektivität 26 b) Stereoselektivität 27 3.1.2 Additionen metallorganischer
3. C-C-Knüpfungen (Carbonylreaktionen) 26 3.1 eaktionen an der Carbonylgruppe 26 3.1.1 Selektivität bei Carbonyladditionen 26 a) Chemoselektivität 26 b) Stereoselektivität 27 3.1.2 Additionen metallorganischer
Organokatalytische Transferhydrierung. Von Mathias Ronellenfitsch und Christoph Krämer
 rganokatalytische Transferhydrierung Von Mathias Ronellenfitsch und Christoph Krämer 03.12.2009 Gliederung 1. Metallkatalysierte ydrierung von Doppelbindungen 2. Enantioselektive ydrierung in der atur
rganokatalytische Transferhydrierung Von Mathias Ronellenfitsch und Christoph Krämer 03.12.2009 Gliederung 1. Metallkatalysierte ydrierung von Doppelbindungen 2. Enantioselektive ydrierung in der atur
Metallorganik Teil 2. OFP-Seminar. Marburg, 31.01.06
 Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Neuere organisch-chemische Synthesemethoden
 euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
Moderne Methoden in der Organischen Chemie
 Moderne Methoden in der rganischen Chemie 0. Allgemeines: Wichtig für alle chemischen eaktionen: Selektivität Chemoselektivität: egioselektivität: Stereoselektivät: - nantioselektivität: -Diastereosektivität:
Moderne Methoden in der rganischen Chemie 0. Allgemeines: Wichtig für alle chemischen eaktionen: Selektivität Chemoselektivität: egioselektivität: Stereoselektivät: - nantioselektivität: -Diastereosektivität:
Technische Universität Dresden Fachrichtung Chemie Organisch-chemisches Praktikum zum Modul OCII
 rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
Schutzgruppen in der organischen Synthesechemie
 Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung
 Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Organische Chemie III
 1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
Name: Matrikelnummer: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom
 Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Functionalization of Organic Molecules by Transition-Metal-Catalyzed C(sp 3 )-H Activation
 Functionalization of Organic Molecules by Transition-Metal-Catalyzed C(sp 3 )- Activation Rodolphe Jazzar, Julien itce, Alice Renaudat, Julien Sofack-Kreutzer, and Olivier Baudoin Chem. Eur. J. 2010, 16,
Functionalization of Organic Molecules by Transition-Metal-Catalyzed C(sp 3 )- Activation Rodolphe Jazzar, Julien itce, Alice Renaudat, Julien Sofack-Kreutzer, and Olivier Baudoin Chem. Eur. J. 2010, 16,
Julia-Colonna- Epoxidierung Nadzeya Sigle Johanna Lauer
 Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Hoch effiziente asymmetrische Katalyse durch doppelte Aktivierung von Nucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem.
 och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
LÖSUNG. Klausur. Hinweis:
 rganisch-chemisches Institut 4.03.00 der Universität Münster LÖSUNG Klausur zum rganisch-chemischen Fortgeschrittenen- Praktikum im Wintersemester 009/00 Name: Mustermann Vorname: Max Matrikelnummer: Abgabezeit:
rganisch-chemisches Institut 4.03.00 der Universität Münster LÖSUNG Klausur zum rganisch-chemischen Fortgeschrittenen- Praktikum im Wintersemester 009/00 Name: Mustermann Vorname: Max Matrikelnummer: Abgabezeit:
Retrosynthese Ketten. Verwendung von Alkinen
 etrosynthese Ketten Konstruktion von Ketten relativ einfache Strukturen: gesättigte oder ungesättigte Ketten Biologie: Ketten (aus Fettsäure- oder Terpenbiosynthese) sind oft Vorläufer für cyclische Moleküle
etrosynthese Ketten Konstruktion von Ketten relativ einfache Strukturen: gesättigte oder ungesättigte Ketten Biologie: Ketten (aus Fettsäure- oder Terpenbiosynthese) sind oft Vorläufer für cyclische Moleküle
4. Gruppe: Alkene und Alkine
 1 1) Alkene 1.1. Struktur und Isomerie der Alkene 117 : 350 kj/mol : 350 265 = 615 kj/mol Doppelbindungs-Anteil 1.34Å Isomerie # = 260 kj/mol # = 180 kj/mol Saytzeff-egel: Substituierte Doppelbindungen
1 1) Alkene 1.1. Struktur und Isomerie der Alkene 117 : 350 kj/mol : 350 265 = 615 kj/mol Doppelbindungs-Anteil 1.34Å Isomerie # = 260 kj/mol # = 180 kj/mol Saytzeff-egel: Substituierte Doppelbindungen
3mol%Pd(OAc) 2 6 mol% R-BINAP
 eck-eaktion: Asymmetrische Induktion Tf 3mol%(Ac) 2 6 mol% -BIAP Protonenschwamm AB = 71% ee= 93% P 2 P 2 -BIA P Protonenschwamm Die chirale Information wird über die Liganden am Palladium eingebracht;
eck-eaktion: Asymmetrische Induktion Tf 3mol%(Ac) 2 6 mol% -BIAP Protonenschwamm AB = 71% ee= 93% P 2 P 2 -BIA P Protonenschwamm Die chirale Information wird über die Liganden am Palladium eingebracht;
7. Syntheseübung WS 2008/09
 7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
ORGANISCHE CHEMIE 1. Stoff der 21. Vorlesung: Reaktionen... I. Reaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard Organolithium Wittig
 Stoff der 21. Vorlesung: eaktionen... GANISCE CEMIE 1 21. Vorlesung, Freitag, 05. Juli 2013 I. eaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard rganolithium Wittig arald Schwalbe Institut für
Stoff der 21. Vorlesung: eaktionen... GANISCE CEMIE 1 21. Vorlesung, Freitag, 05. Juli 2013 I. eaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard rganolithium Wittig arald Schwalbe Institut für
Master-Studiengang Chemie
 Master-Studiengang Chemie Modul BC 02: Metallorganische Synthese bioaktiver Moleküle Bestehend aus: Vorlesung: Metallorganische Synthesen, 2 SWS (Knölker) Praktikum, 10 SWS (Assistenten) Seminar, 2 SWS
Master-Studiengang Chemie Modul BC 02: Metallorganische Synthese bioaktiver Moleküle Bestehend aus: Vorlesung: Metallorganische Synthesen, 2 SWS (Knölker) Praktikum, 10 SWS (Assistenten) Seminar, 2 SWS
2. Gruppe: Carbonsäuren und Derivate
 1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
D D. D endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% p = 6.8 kbar: 72.0 : 27.0 : <1.0 cis-stereoselectivity: >99%
 4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
1. Gruppe: Nucleophile Substitution
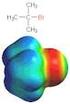 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
Ruthenium-katalysierte Reaktionen eine Schatzkiste der Atomökonomie. B.M. Trost, M.U. Frederiksen, M.T. Rudd, Angew. Chem. 2005, 117,
 uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
1. Übung zur Vorlesung OC IV
 1. Übung zur Vorlesung C IV 19.05.03 ufgabe 1 a) Zeichnen Sie in das unten abgebildete Schema für die Reaktionsgleichung I das Produkt (wählen Sie ein beliebiges Enantiomer) bzw. für die Reaktionsgleichung
1. Übung zur Vorlesung C IV 19.05.03 ufgabe 1 a) Zeichnen Sie in das unten abgebildete Schema für die Reaktionsgleichung I das Produkt (wählen Sie ein beliebiges Enantiomer) bzw. für die Reaktionsgleichung
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
Anna Stoyanova (ХП 0432) Nobelpreis für Chemie 2010: Für Palladium-katalysierte Kreuzkupplungen in organischer Synthese.
 Anna Stoyanova (ХП 0432) Nobelpreis für Chemie 2010: Für Palladium-katalysierte Kreuzkupplungen in organischer Synthese. = R e f e r a t = Vorgelegt am Lehrstuhl fur Organische Chemie UCTM Sofia, 2014
Anna Stoyanova (ХП 0432) Nobelpreis für Chemie 2010: Für Palladium-katalysierte Kreuzkupplungen in organischer Synthese. = R e f e r a t = Vorgelegt am Lehrstuhl fur Organische Chemie UCTM Sofia, 2014
METALLORGANISCHE CHEMIE (SPOC III; WS 2009/10)
 VLESUG SPC III PF. GLIUS METALLGAISCHE CHEMIE (SPC III; WS 2009/10) Termine Mo/Di: 8ct-9 Uhr; Do/Fr: 11ct-12 Uhr, jeweils in C2. Freitag, 29. Januar (11ct-12 Uhr): Besprechung der Übungsaufgaben. Aufbau
VLESUG SPC III PF. GLIUS METALLGAISCHE CHEMIE (SPC III; WS 2009/10) Termine Mo/Di: 8ct-9 Uhr; Do/Fr: 11ct-12 Uhr, jeweils in C2. Freitag, 29. Januar (11ct-12 Uhr): Besprechung der Übungsaufgaben. Aufbau
Klausur (Modulabschlussprüfung)
 rganisch-chemisches Institut 02.08.20 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 20 Lösung ame: Vorname: Matrikelnummer:
rganisch-chemisches Institut 02.08.20 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 20 Lösung ame: Vorname: Matrikelnummer:
Totalsynthese ohne Schutzgruppen
 Totalsynthese ohne Schutzgruppen Saarbrücken, den Lisa Wirtz und Verena Dittlinger Inhalt Totalsynthese Ideale Synthese Strategien der schutzgruppenfreie Synthese Skelettaufbau und Modifikation Biomimetische
Totalsynthese ohne Schutzgruppen Saarbrücken, den Lisa Wirtz und Verena Dittlinger Inhalt Totalsynthese Ideale Synthese Strategien der schutzgruppenfreie Synthese Skelettaufbau und Modifikation Biomimetische
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
11. Syntheseübung WS 2006/2007
 11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
Nobelpreis Chemie 2010. Wer? Warum? Wer nicht?
 obelpreis Chemie 2010 Wer? Warum? Wer nicht? Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer eaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur obelpreisvergabe und Diskussion
obelpreis Chemie 2010 Wer? Warum? Wer nicht? Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer eaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur obelpreisvergabe und Diskussion
Die Corey-Bakshi-Shibata-Reduktion. Eine Möglichkeit zur enantioselektiven Reduktion von Ketonen
 Die Corey-akshi-Shibata-Reduktion Eine Möglichkeit zur enantioselektiven Reduktion von Ketonen Gliederung Einführung - Wer sind Corey, akshi, Shibata? - Komplexe Metallhydride und das Problem der enantioselektiven
Die Corey-akshi-Shibata-Reduktion Eine Möglichkeit zur enantioselektiven Reduktion von Ketonen Gliederung Einführung - Wer sind Corey, akshi, Shibata? - Komplexe Metallhydride und das Problem der enantioselektiven
Schwache Bindungen Molekulare Erkennung und Supramolekulare Chemie
 Schwache Bindungen Molekulare Erkennung und Supramolekulare Chemie Burkhard König Universität egensburg Intermolekulare Wechselwirkungen bestimmen unser Leben Grundlegende physikalische Eigenschaften z.
Schwache Bindungen Molekulare Erkennung und Supramolekulare Chemie Burkhard König Universität egensburg Intermolekulare Wechselwirkungen bestimmen unser Leben Grundlegende physikalische Eigenschaften z.
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Abschlußbericht zum Forschungsprojekt Domino-Eisen-katalysierte Reaktionen (2766) gefördert durch das Max-Buchner-Programm der DECHEMA
 Abschlußbericht zum Forschungsprojekt Domino-Eisen-katalysierte Reaktionen (2766) gefördert durch das Max-Buchner-Programm der DECHEMA Waldemar M. Czaplik, Axel Jacobi von Wangelin Department Chemie, Universität
Abschlußbericht zum Forschungsprojekt Domino-Eisen-katalysierte Reaktionen (2766) gefördert durch das Max-Buchner-Programm der DECHEMA Waldemar M. Czaplik, Axel Jacobi von Wangelin Department Chemie, Universität
Von Fendt Franziska und Mädl Eric. Phosphinidene
 Von Fendt Franziska und Mädl Eric Phosphinidene Synthese elektrophiler Phosphiniden-Komplexe (I) Elektrophile Phosphinidene 1.Ringspaltungsmethode: a. aus 7-Phosphanorbornadien Marinetti A, Methey F, Fischer
Von Fendt Franziska und Mädl Eric Phosphinidene Synthese elektrophiler Phosphiniden-Komplexe (I) Elektrophile Phosphinidene 1.Ringspaltungsmethode: a. aus 7-Phosphanorbornadien Marinetti A, Methey F, Fischer
C-H Functionalization in the Synthesis of Amino Acids and Peptides
 Mittwochseminar: Literatur Vortrag Marcel Reimann 29.04.15 C-H Functionalization in the Synthesis of Amino Acids and Peptides A. F. M. Noisier, M. A. Brimble, Chemical Reviews 2014, 114, 8775-8806. Überblick
Mittwochseminar: Literatur Vortrag Marcel Reimann 29.04.15 C-H Functionalization in the Synthesis of Amino Acids and Peptides A. F. M. Noisier, M. A. Brimble, Chemical Reviews 2014, 114, 8775-8806. Überblick
O Br. o-xylol Wie könnte man folgende Verbindungen aus mono-substituierten Benzolen herstellen? Br
 Grundlagen der rganischen Chemie, SS 2002, Kroutil Übungszettel 10 10.1. Benennen sie nomenklaturgerecht N 10.2. Zeichnen sie die Struktur von 2-Chlor-6-methyl naphthalin N 2 10.3. Was entsteht bei folgender
Grundlagen der rganischen Chemie, SS 2002, Kroutil Übungszettel 10 10.1. Benennen sie nomenklaturgerecht N 10.2. Zeichnen sie die Struktur von 2-Chlor-6-methyl naphthalin N 2 10.3. Was entsteht bei folgender
Technische Universität Dresden Institut für Organische Chemie Organisch-chemisches Grundpraktikum. Aufgabe Max. Punkte Punkte
 Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Crom(VI)-Reagenzien. bzw. Reagenzien: a) K 2. SO 4 ( wasserhaltig ) b) CrO 3. CrO 7. , verd. H 2. , Aceton (Jones-Reagenz)
 xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
Moderne Methoden in der Organischen Chemie
 oderne ethoden in der rganischen Chemie Seite 0. Allgemeines 1 Chemoselektivität 1 egioselektivität 1 Stereoselektivität 1 1. xidationsreaktionen 2 1.1 xidationen von C--Bindungen 2 1.1.1 icht aktivierte
oderne ethoden in der rganischen Chemie Seite 0. Allgemeines 1 Chemoselektivität 1 egioselektivität 1 Stereoselektivität 1 1. xidationsreaktionen 2 1.1 xidationen von C--Bindungen 2 1.1.1 icht aktivierte
Graphisches Inhaltsverzeichnis
 Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
C-H-Funktionalisierungsreaktionen in der Organischen Synthese
 C-H-Funktionalisierungsreaktionen in der rganischen Synthese Probevorlesung Manuskript der Vorlesung unter: http://www.catalysis.de/cycloadditionen.42.0.html 1 Einführung A tunable, selective hydrocarbon
C-H-Funktionalisierungsreaktionen in der rganischen Synthese Probevorlesung Manuskript der Vorlesung unter: http://www.catalysis.de/cycloadditionen.42.0.html 1 Einführung A tunable, selective hydrocarbon
Übungsblatt I Drei- und Vierringe
 C VI: eterocyclen W 2002/2003 eite von 0 Übungsblatt I Drei- und Vierringe. Ergänzen ie die in den Kästchen fehlenden Produkte bzw. Reagentien und Reaktionsbedingungen. a) Et LiAl 4 (TF) b) CMe CMe 2 [Pd()
C VI: eterocyclen W 2002/2003 eite von 0 Übungsblatt I Drei- und Vierringe. Ergänzen ie die in den Kästchen fehlenden Produkte bzw. Reagentien und Reaktionsbedingungen. a) Et LiAl 4 (TF) b) CMe CMe 2 [Pd()
3.5 Über die Selektivität von Reaktionen mit lithiumorganischen Verbindungen:
 3.5 Über die elektivität von Reaktionen mit lithiumorganischen Verbindungen: Vorhersagen über die elektivität bei der Reaktion von Nukleophilen (Lewis-Basen) mit Elektrophilen (Lewis-äuren) können durch
3.5 Über die elektivität von Reaktionen mit lithiumorganischen Verbindungen: Vorhersagen über die elektivität bei der Reaktion von Nukleophilen (Lewis-Basen) mit Elektrophilen (Lewis-äuren) können durch
Entschlüsseln Sie die Bedeutung der folgenden Abkürzungen: PMB tbu TBS Ph Ts Bz TPS MOM Bn Ms TES
 rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
5 Radikalreaktionen 79
 5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
Unsymmetrical ansa-metallocenes of zirconium and hafnium W. A. Herrmann, M. J. A. Morawietz, Th. Priermeier J. Organomet. Chem. 506 (1996) 351-355.
 Tin-bridged ansa-metallocenes of zirconium: synthesis and catalytic performance in olefin polymerization, M. J. A. Morawietz, H.-F. Herrmann, F. Küber J. Organomet. Chem. 509 (1996) 115-117. Unsymmetrical
Tin-bridged ansa-metallocenes of zirconium: synthesis and catalytic performance in olefin polymerization, M. J. A. Morawietz, H.-F. Herrmann, F. Küber J. Organomet. Chem. 509 (1996) 115-117. Unsymmetrical
Organische Synthese. Sommersemester 2012 Technische Universität München. Nachholklausur am
 rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 9 Addition von eteroatom-cleophilen an Carbonylverbindungen & Folgereaktionen... Dr. ermann A. Wegner hermann.wegner@unibas.ch Gleichgewicht
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 9 Addition von eteroatom-cleophilen an Carbonylverbindungen & Folgereaktionen... Dr. ermann A. Wegner hermann.wegner@unibas.ch Gleichgewicht
Organische Chemie III
 rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Organische Chemie III
 1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 28.05.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift) inweise
1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 28.05.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift) inweise
Moderne Synthesechemie Org. Chemie (OC III; SS 2012)
 VLESUG C III PF. GLIUS Moderne Synthesechemie rg. Chemie (C III; SS 2012) Aufbau des ersten Teils der Vorlesung (rganometallchemie-teil) 1) Grundlagen und Einleitung 2) Katalytische Grundoperationen 3)
VLESUG C III PF. GLIUS Moderne Synthesechemie rg. Chemie (C III; SS 2012) Aufbau des ersten Teils der Vorlesung (rganometallchemie-teil) 1) Grundlagen und Einleitung 2) Katalytische Grundoperationen 3)
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
6. Gruppe: Carbonylverbindungen
 1 1) Darstellung von Aldehyden und Ketonen 1.1. eaktivität der Carbonylgruppe: u C C : 146 kcal/mol E C : 175 kcal/mol : Base Enolat Enol 1.2. tallorganische ynthese Cl 2 CuL i CuX Cl 2 ZnX Pd(0)kat. Cl
1 1) Darstellung von Aldehyden und Ketonen 1.1. eaktivität der Carbonylgruppe: u C C : 146 kcal/mol E C : 175 kcal/mol : Base Enolat Enol 1.2. tallorganische ynthese Cl 2 CuL i CuX Cl 2 ZnX Pd(0)kat. Cl
(+) - Boronolid. O OAc. OAc. 4. Syntheseübung SS Bestandteil der Rinde und Blätter verschiedener Pflanzen
 4. Syntheseüung SS 2007 Ac Ac Ac () - oronolid - estandteil der inde und lätter verschiedener Pflanzen - Planzenzuereitungen finden Verwendung als Naturheilmittel gegen Malaria und als Emetikum (rechmittel)
4. Syntheseüung SS 2007 Ac Ac Ac () - oronolid - estandteil der inde und lätter verschiedener Pflanzen - Planzenzuereitungen finden Verwendung als Naturheilmittel gegen Malaria und als Emetikum (rechmittel)
Organische Chemie III
 Seite A-1 rganische Chemie III Sommersemester 2001 Technische Universität München Klausur am 12.10.2001 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift)
Seite A-1 rganische Chemie III Sommersemester 2001 Technische Universität München Klausur am 12.10.2001 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift)
Organische Chemie III
 rganische Chemie III Sommersemester 2005 Technische Universität München Klausur am 31.05.2005 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2005 Technische Universität München Klausur am 31.05.2005 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
1. Übung zur Vorlesung OC III
 1. Übung zur Vorlesung C III 26.04.03 Aufgabe 1 Für eine retrosynthetische Zerlegung eines Zielmoleküls bietet es sich an dieses zuerst in sinnvolle Synthone zu zerlegen und anschließend die dafür denkbaren
1. Übung zur Vorlesung C III 26.04.03 Aufgabe 1 Für eine retrosynthetische Zerlegung eines Zielmoleküls bietet es sich an dieses zuerst in sinnvolle Synthone zu zerlegen und anschließend die dafür denkbaren
Organische Chemie III Sommersemester 2009 Technische Universität München
 rganische Chemie III Sommersemester 2009 Technische Universität München achholklausur am 09.10.2009 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
rganische Chemie III Sommersemester 2009 Technische Universität München achholklausur am 09.10.2009 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
1. Übung zur Vorlesung OC III
 1. Übung zur Vorlesung C III 02.05.06 Aufgabe 1 Zerlegen Sie folgendes Molekül retrosynthetisch in sinnvolle Synthone und die entsprechenden Syntheseäquivalente. Et 2 2 Aufgabe 2 a) Im folgendem Beispiel
1. Übung zur Vorlesung C III 02.05.06 Aufgabe 1 Zerlegen Sie folgendes Molekül retrosynthetisch in sinnvolle Synthone und die entsprechenden Syntheseäquivalente. Et 2 2 Aufgabe 2 a) Im folgendem Beispiel
Klausur (Modulabschlussprüfung)
 rganisch-chemisches Institut 02.08.202 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 202 Lösung Name: Vorname: Matrikelnummer:
rganisch-chemisches Institut 02.08.202 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 202 Lösung Name: Vorname: Matrikelnummer:
CH-Aktivierung. MCII - Seminar Christoph Sonnenschein und David Schrempp
 C-Aktivierung MCII - Seminar 17.12.09 Christoph Sonnenschein und David Schrempp 1 Inhalt 1. Einleitung 2. Aktivierung über σ-komplexe 3. Intramolekularer Verlauf 4. Murai-Reaktion 5. Intermolekularer Verlauf
C-Aktivierung MCII - Seminar 17.12.09 Christoph Sonnenschein und David Schrempp 1 Inhalt 1. Einleitung 2. Aktivierung über σ-komplexe 3. Intramolekularer Verlauf 4. Murai-Reaktion 5. Intermolekularer Verlauf
Vorlesung Organische Chemie II, Teil 2, SS Quickie Nr. 1: Radikalreaktionen und aromatische Substitution
 Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Wolfgang Dohle. Funktionalisierte Heterocyclen durch eine Halogen-Magnesium-Austauschreaktion
 Wolfgang Dohle Funktionalisierte eterocyclen durch eine alogen-magnesium-austauschreaktion München 2002 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität
Wolfgang Dohle Funktionalisierte eterocyclen durch eine alogen-magnesium-austauschreaktion München 2002 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität
Chemie der Inamide und Inamine
 Chemie der Inamide und Inamine Ruprecht-Karls-Universität Heidelberg MCII-Seminar Referenten: Friedrich Baumgärtel und Max Joost Betreuender Assistent: R. Döpp WS 2008/2009 Übersicht 1. Einleitung 1.1.
Chemie der Inamide und Inamine Ruprecht-Karls-Universität Heidelberg MCII-Seminar Referenten: Friedrich Baumgärtel und Max Joost Betreuender Assistent: R. Döpp WS 2008/2009 Übersicht 1. Einleitung 1.1.
Synthesen von Carbonsäuren: industrielle Verfahren
 Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Klausur WS 03/04. 1 Schutzgruppen 10
 Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Organische Chemie III
 rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Organische Chemie III
 rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
Komplexe mit einfachen Hydroxo-, Alkoxo- und Amidliganden
 Seminar Anorganische Chemie Komplexe mit einfachen ydroxo-, Alkoxo- und Amidliganden Boris Kosog 07. Dezember 2006 R. G. Bergman, Acc. Chem. Res. 2002, 35, 44-56 Komplexe mit einfachen ydroxo-, Alkoxo-
Seminar Anorganische Chemie Komplexe mit einfachen ydroxo-, Alkoxo- und Amidliganden Boris Kosog 07. Dezember 2006 R. G. Bergman, Acc. Chem. Res. 2002, 35, 44-56 Komplexe mit einfachen ydroxo-, Alkoxo-
6 Reduktionen und Oxidationen
 6 eduktionen und xidationen 6.1 Allgemeines Zur Bestimmung der xidationszahlen in anorganischen Verbindungen werden die Elektronen einer kovalenten Bindung AB, die verschiedene Atomsorten A und B miteinander
6 eduktionen und xidationen 6.1 Allgemeines Zur Bestimmung der xidationszahlen in anorganischen Verbindungen werden die Elektronen einer kovalenten Bindung AB, die verschiedene Atomsorten A und B miteinander
Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil7
 Prof. r. P. ademacher rganische Chemie IV CIV-SS2005-Teil7 Arine C. Grundmann, Arine, Methoden der rganischen Chemie (ouben-weyl), Bd. 5/2b, Georg Thieme Verlag, Stuttgart, 1981, S. 613-648... Wenk, M.
Prof. r. P. ademacher rganische Chemie IV CIV-SS2005-Teil7 Arine C. Grundmann, Arine, Methoden der rganischen Chemie (ouben-weyl), Bd. 5/2b, Georg Thieme Verlag, Stuttgart, 1981, S. 613-648... Wenk, M.
Rolle des Katalysators
 olle des Katalysators Aktivierungsenergie der unkatalysierten eaktion Aktivierungsenergie der katalysierten eaktion Energie E a E a ' Edukte nicht katalysierte eaktion eaktion mit Katalysator zu stark
olle des Katalysators Aktivierungsenergie der unkatalysierten eaktion Aktivierungsenergie der katalysierten eaktion Energie E a E a ' Edukte nicht katalysierte eaktion eaktion mit Katalysator zu stark
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Organische Chemie III
 rganische Chemie III Wintersemester 2007/08 Technische Universität München Nachholklausur am 12.10.2007 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
rganische Chemie III Wintersemester 2007/08 Technische Universität München Nachholklausur am 12.10.2007 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
Organokatalyse durch asymmetrische
 rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
Shvo s Katalysator. Von Michaela Märken und Matthias Hussong
 Shvo s Katalysator Von Michaela Märken und Inhalt Allgemeines und Struktur Entdeckung Synthese Anwendung Mechanismen analoge Systeme Y.Shvo et al. J. Am. Chem. Soc. 1986, 108,7400 Allgemeine Daten kristalliner
Shvo s Katalysator Von Michaela Märken und Inhalt Allgemeines und Struktur Entdeckung Synthese Anwendung Mechanismen analoge Systeme Y.Shvo et al. J. Am. Chem. Soc. 1986, 108,7400 Allgemeine Daten kristalliner
Totalsynthese von Citrafungin A
 Totalsynthese von Citrafungin A HC HC R S HC R HC H H R R Fanny Epperlein, Michael Hans, Anja Hartmann, René Jatzke, Marco Kunaschk, Christian Pätzold, Anne-Kathrin Weniger Quelle: TU Dresden, 17.12.2009
Totalsynthese von Citrafungin A HC HC R S HC R HC H H R R Fanny Epperlein, Michael Hans, Anja Hartmann, René Jatzke, Marco Kunaschk, Christian Pätzold, Anne-Kathrin Weniger Quelle: TU Dresden, 17.12.2009
Lithium. Seminarvortrag am von Josefine Martin und Bettina Nägele
 Lithium Seminarvortrag am 22.1.2009 von Josefine Martin und Bettina ägele 2 Gliederung 1. Einführung 2. organische Synthese 3. Verwendung von Lithiumorganylen in der organischen Synthese 4. Literatur 3
Lithium Seminarvortrag am 22.1.2009 von Josefine Martin und Bettina ägele 2 Gliederung 1. Einführung 2. organische Synthese 3. Verwendung von Lithiumorganylen in der organischen Synthese 4. Literatur 3
Totalsynthese von Cruentaren B
 Fakultätsname XYZ Fachrichtung XYZ Institutsname XYZ, Professur XYZ Totalsynthese von Cruentaren B Nach Tushar Kanti Chakraborty und Amit Kumar Chattopadhyay J. rg. Chem. 2008, 73 (9), 3578-3581. Dresden,
Fakultätsname XYZ Fachrichtung XYZ Institutsname XYZ, Professur XYZ Totalsynthese von Cruentaren B Nach Tushar Kanti Chakraborty und Amit Kumar Chattopadhyay J. rg. Chem. 2008, 73 (9), 3578-3581. Dresden,
Neue Methoden zur Herstellung hochfunktionalisierter Organozink- und -magnesiumreagenzien und deren Verwendung in der Synthese
 Neue Methoden zur Herstellung hochfunktionalisierter rganozink- und -magnesiumreagenzien und deren Verwendung in der Synthese F l o r i a n F e l i x K n e i s e l München 2003 Dissertation zur Erlangung
Neue Methoden zur Herstellung hochfunktionalisierter rganozink- und -magnesiumreagenzien und deren Verwendung in der Synthese F l o r i a n F e l i x K n e i s e l München 2003 Dissertation zur Erlangung
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
