Soliris jetzt als einzige Komplement-basierte Therapie und neue Behandlungsstrategie zugelassen
|
|
|
- Arwed Dittmar
- vor 6 Jahren
- Abrufe
Transkript
1 DGN Satelliten-Symposium Alexion Pharma Germany Generalisierte therapierefraktäre Myasthenia gravis: Soliris jetzt als einzige Komplement-basierte Therapie und neue Behandlungsstrategie zugelassen Leipzig (22. September 2017) Die Myasthenia gravis ist eine chronische, neuromuskuläre Autoimmunerkrankung, die durch unterschiedlich ausgeprägte, belastungsabhängige Schwäche der quergestreiften Muskulatur mit variablem Verlauf und variabler Prognose gekennzeichnet ist. Eine Untergruppe von rund 10 % bis 15 % der Patienten mit generalisierter Myasthenia gravis sind therapierefraktär und sprechen auch auf erweiterte Therapieansätze nicht an. Dies geht mit einer hohen Morbidität und Mortalität einher.1-3 Therapeutische Standards für diese Patienten gibt es nicht, die meisten Zweitlinienmedikamente sind nicht für die Behandlung der generalisierten therapierefraktären Myasthenia gravis zugelassen. Mit dem gegen den Komplementfaktor C5 gerichteten monoklonalen Antikörper Soliris (Eculizumab) steht erwachsenen Patienten mit Acetylcholinrezeptor(AChR)-Antikörper-positiver, generalisierter therapierefraktärer Myasthenia gravis nun eine neue, evidenzbasierte Therapieoption zur Verfügung.4 Im Rahmen des DGN-Kongresses berichteten Experten unter dem Vorsitz von Prof. Dr. Andreas Meisel, Berlin, in einem von Alexion unterstützen Satelliten-Symposium über neue Erkenntnisse bei Patienten mit generalisierter therapierefraktärer Myasthenia gravis. 1 / 8
2 Eculizumab greift als terminaler Komplementinhibitor direkt am Effektormechanismus an Myasthenia gravis ist eine Autoimmunerkrankung, die klinisch mit belastungsabhängiger Muskelschwäche einhergeht und zu einer deutlichen Beeinträchtigung im Alltag und in der Lebensqualität führt.5 Initial manifestieren sich die Symptome häufig nur okulär mit einer Schwäche der Augen- und Lidmuskulatur. In 80 % bis 90 % der Fälle kommt es innerhalb der ersten zwei Jahre zu einer Generalisierung der Erkrankung mit Beteiligung der Kopf-, Hals-, Rumpf-, Extremitäten- und Atemwegsmuskulatur.6 Dies kann bis hin zu lebensbedrohlichen myasthenen Krisen mit Ateminsuffizienz und Notwendigkeit einer intensivmedizinischen Betreuung führen. Pathophysiologischer Hintergrund sei die Bildung von Autoantikörper gegen unter-schiedliche Proteine der neuromuskulären Endplatte, insbesondere Autoantikörper gegen AChR (85 %), aber auch Autoantikörper gegen muskelspezifische Rezeptor-Kinase (MuSK), Low density lipoprotein receptor-related protein 4 (LRP4), und andere, erklärte PD Dr. Christiane Schneider-Gold, Bochum.6 Die AChR-Antikörper beeinträchtigen durch ihre Bindung an die postsynaptischen, nikotinergen AChR die neuromuskuläre Erregungsübertragung nur zu einem geringen Teil. Die wesentlichen Pathomechanismen seien die Quervernetzung der AChR, die zu ihrer Internalisierung und damit zur Reduktion der Rezeptorendichte führen würden, sowie die chronische Komplementaktivierung mit Bildung eines Membranangriffkomplexes, der eine Lyse der postsynaptischen Membran verursache, betonte Schneider-Gold.7, 8 Hier greift Eculizumab direkt am Effektor an: Durch seine hoch affine Bindung an den Komplementfaktor C5 verhindert der monoklonale Antikörper Eculizumab dessen Spaltung in die Fragmente C5a und C5b. Durch diesen Mechanismus wird die terminale Komplementkaskade mit der Bildung des Membranangriffkomplexes 2 / 8
3 blockiert und die lytische Zerstörung an der postsynaptischen Membran verhindert. Mit seinem neuen Wirkansatz direkt am Effektor könne Eculizumab als erste und einzige Komplement-basierte Therapie vielversprechende Erfolge bringen, so Schneider-Gold. Refraktäre Pat ienten haben ein erhöhtes Risiko für Exazerbat ionen, Krisen und Klinikaufenthalte Rund 10 % bis 15 % der Patienten mit generalisierter Myasthenia gravis sind therapierefraktär:1-3 Sie sprechen auf die Standardtherapie bestehend aus symptomatischer, chirurgischer und immuninterventioneller Behandlung nur unzureichend an oder weisen Kontraindikationen gegen die Therapie auf. Therapierefraktäre Patienten hätten ein höheres Risiko für Exazerbationen und myasthene Krisen mit Notwendigkeit einer Eskalationstherapie sowie für Aufenthalte im Krankenhaus und intensivmedizinische Behandlungen, sagte Meisel. Eine Schärfung der Definition der generalisierten therapierefraktären Myasthenia gravis, die national wie international nicht vorliege, sei essenziell, betonte Meisel, insbesondere da ein hoher ungedeckter Bedarf in der Behandlung dieser seltenen Erkrankung besteht: aktuell existiert kein einheitlicher Behandlungs-algorithmus und nur wenige der derzeit eingesetzten, steroidsparenden Immunsuppressiva sind zur Behandlung der generalisierten therapierefraktären Myasthenia gravis zugelassen. Mit Eculizumab als evidenzbasierte Therapie stünde nun eine gute und zugelassene Behandlungsoption für die AChR-Antikörper-positive, generalisierte therapierefraktäre Myastenia gravis zur Verfügung, so Meisel.9 Soliris : gutes Sicherheitsprofil bei klinisch signifikanter Verbesserung innerhalb der ersten sechs Wochen Bereits seit Jahren wird der Komplementinhibitor Eculizumab erfolgreich eingesetzt zur Behandlung des atypischen hämolytisch-urämischen Syndroms (ahus) und der paroxysmalen, 3 / 8
4 nächtlichen Hämoglobinurie (PNH), bei denen die unkontrollierte Komplementaktivierung eine zentrale Rolle in der Pathogenese spielt. Nun wurde Soliris im August 2017 auch für erwachsene Patienten mit AChR-Antikörper-positiver, generalisierter therapierefraktärer Myasthenia gravis zugelassen. Gute Sicherheitsdaten lägen durch Erfahrungen in der Behandlung mit ahus und PNH bereits vor, betonte Prof. Dr. Benedikt Schoser, München. Wie bei jeder immunsuppressiven Therapie sei ein besonderes Augenmerk auf den Impfstatus zu richten. So ist auch vor dem Behandlungsstart mit Eculizumab die Impfung gemäß den nationalen Impfempfehlungen insbesondere gegen Meningokokken (Serogruppen A, C, Y, W135 und B) eine Voraussetzung, da aufgrund seines Wirkmechanismus Eculizumab ein Infektionsrisiko insbesondere mit bekapselten Bakterien birgt. Wenn aus klinischen Gründen ein sofortiger Therapiebeginn erforderlich ist, kann die Zeit bis zum Impfschutz mit einer adäquaten Antibiotikaprophylaxe überbrückt werden. In einer randomisierten, doppelblinden, Placebo-kontrollierten Phase-III-Studie (REGAIN) wurden die Wirksamkeit und die Sicherheit von Soliris (Eculizumab) bei erwachsenen Patienten mit AChR-Antikörper-positiver, generalisierter therapierefraktärer Myasthenia gravis untersucht. Die Studie wird voraussichtlich im Oktober 2017 veröffentlicht. Die vorläufigen Ergebnisse10 seien ermutigend, so Schoser: Dreimal mehr Patienten, die mit Soliris behandelt wurden, hätten eine klinisch signifikante Verbesserung der Muskelkraft und des Aktivitätsniveaus erreicht. Des Weiteren hätten die Patienten in der Soliris -Gruppe eine zehnmal höhere Chance, in den Myasthenia gravis-spezifischen Scores besser abzuschneiden als die Patienten der Placebo- Gruppe. Von besonderem Interesse sei, dass man die Verbesserungen bereits innerhalb der ersten zwei Wochen feststellen könne und diese für die Dauer der Erhaltungstherapie anhielten, betonte Schoser. Dies ist vor dem Hintergrund zu sehen, dass ein Problem der derzeit bei der generalisierten therapierefraktären Myasthenia gravis eingesetzten, steroidsparenden Immun-suppressiva 4 / 8
5 ihr später Wirkeintritt erst nach 6 bis 18 Monaten ist.9 Eculizumab zeige ein günstiges Sicherheitsprofil, berichtete Schoser weiter: Im Allgemeinen wurde die Therapie gut vertragen. Die aufgetretenen Nebenwirkungen waren insbesondere Kopf-schmerzen, respiratorische Infekte, Nasopharyngitis und Nausea. Diese traten in der Placebo- Gruppe mit einer vergleichbaren Häufigkeit auf. Eine Meningokokkeninfektion wurde nicht beobachtet. Von Eculizumab als neu zugelassener Behandlungsstrategie können erwachsene Patienten mit AChR-Antikörper-positiver, generalisierter therapierefraktärer Myasthenia gravis sehr profitieren, so das Fazit von Meisel. Referenzen 1. Silvestri N et al. Treatment-refractory myasthenia gravis. J Clin Neuromuscul Dis. 2014; 15: Howard J et al. Targeting the complement system in refractory myasthenia gravis. Suplement to Neurology Reviews. Februar Sanders DB et al. International consensus guidance for management of myasthenia gravis: Executive summary. Neurology 2016; 87: Howard J et al. A randomized, double-blind, placebo-controlled phase II study of eculizumab in patients with refractory generalized myasthenia gravis. Muscle Nerve. 2013; 48: Silvestri N et al. Myasthenia gravis. Semin Neurol 2012; 32: Melzer N et al. Clinical features, pathogenesis, and treatment 5 / 8
6 of myasthenia gravis: a supplement to the guidelines of the German Neurological Society. J Neurol 2016; 263: Sathasivam S et al. Diagnosis and management of myasthenia gravis. Progress in Neurology and Psychiatry Kusner L et al. Targeting therapy to the neuromuscular junction: proof of concept. Muscle Nerve 2014; 49: Meisel A et al. Neue Erkenntnisse bei Patienten mit therpaierefraktärer Myasthenia gravis. DGN Kongress 2017, Leipzig, Satelliten-Symposium. 10. Howard J et al. Efficacy of eculizumab is maintained beyond 26 weeks in patients with AChR+ refractory generalized myasthenia gravis. Posterpresentation at the 64th Annual Meeting of the American Association of Neuromuscular & Electrodiagnostic Medicine, Phoenix, USA.Poster # Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung. Wirkstoff: Eculizumab. Zusammensetzung: Eine Durchstechflasche mit 30 ml enthält 300 mg Eculizumab (10 mg/ml). Sonstige Bestandteile: Natriumphosphat monobasisch, Natriumphosphat dibasisch, Natriumchlorid, Polysorbat 80, Wasser für Injektionszwecke. Anwendungsgebiet: Behandlung von Erwachsenen, Kindern und Jugendlichen mit Paroxysmaler Nächtlicher Hämoglobinurie (PNH), atypischem Hämolytisch-Urämischen Syndrom (ahus). Behandlung von Erwachsenen mit refraktärer generalisierter Myasthenia gravis (gmg) bei Acetylcholinrezeptor (AChR)-Antikörper positiven Patienten. 6 / 8
7 Gegenanzeigen: Überempfindlichkeit gegen Eculizumab, murine Proteine oder sonstige Bestandteile. Nicht ausgeheilte Infektion mit Neisseria meningitidis. Fehlender aktueller Impfschutz gegen Neisseria meningitidis (es sei denn, die Patienten erhalten eine geeignete Antibiotikaprophylaxe bis zwei Wochen nach der Impfung). Nebenwirkungen: Sehr häufig ( 1/10): Kopfschmerzen. Häufig ( 1/100,<1/10): Pneu-monie, Infektion der oberen Atemwege, Nasopharyngitis, Harnwegsinfektion, Lippen-herpes, Leukopenie, Anämie, Insomie, Schwindelgefühl, Dysgeusie, Tremor, Hypertonie, Husten, oropharyngale Schmerzen, Diarrhoe, Erbrechen, Übelkeit, Bauchschmerzen, Hautausschlag, Pruritus, Alopezie, Arthralgie, Myalgie, Schmerzen in Extremitäten, Fieber, Schüttelfrost, Fatigue, grippeähnliche Erkrankung. Gelegentlich ( 1/1.000, <1/100): Meningokokken-Infektion, Sepsis, septischer Schock, Peritonitis, Infektion der unteren Atemwege, Pilzinfektion, Virusinfektion, Bronchitis, Abszess, Zellulitis, Influenza, gastrointestinale Infektion, Zystitis, Infektion, Sinusitis, Zahninfektion, Thrombozytopenie, Lymphopenie, anaphylaktische Reaktion, Hypersensitivität, Appetitverlust, Depression, Angst, Stimmungsschwankungen, Parästhesie, verschwommenes Sehen, Tinnitus, Ver-tigo, Palpitation, akzelerierte Hypertonie, Hypotonie, Hitzewallungen, Venenerkrankung, Dyspnoe, Nasenbluten, Rachenreizung, verstopfte Nase, Rhinorrhoe, Obstipation, Dys-pepsie, abdominales Spannungsgefühl, Urtikaria, Erythem, Petechien, Hyperhidrose, trockene Haut, Muskelspasmen, Knochenschmerzen, Rückenschmerzen, Nacken-schmerzen, Gelenkschwellung, Nierenfunktionsstörung, Dysurie, Spontanerektion, Men-struationsstörungen, Ödeme, Thorax-Beschwerden, Asthenie, Schmerzen im Brustraum, Schmerzen an der Infusionsstelle, Alanin-Aminotransferase erhöht, Aspartat-Amino-transferase erhöht, γ-glutamyltransferase erhöht, Hämatokrit erniedrigt, Hämoglobin erniedrigt, Infusionsbedingte Reaktion. Selten ( 1/10.000, <1/1.000): Aspergillus- Infektion, bakterielle Arthritis, Gonokokken-Infektion des Urogenitaltrakts, Haemophilus-influenza-Infektion, Impetigo, 7 / 8
8 Zahnfleischentzündung, Malignes Melanom, Myelo-dysplastisches Syndrom, Hämolyse, abnormer Gerinnungsfaktor, Erythrozyten- Agglutination, Koagulopathie, Morbus Basedow, abnorme Träume, Schlafstörungen, Syn-kope, Bindehautreizung, Hämatom, Gastroösophageale Refluxkrankheit, schmerzendes Zahnfleisch, Ikterus, Dermatitis, Depigmentierung der Haut, Trismus, Hämaturie, Extra-vasat, Parästhesie an der Infusionsstelle, Wärmegefühl, Coombs-Test positiv. Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit: siehe veröffentlichte Fachinformation. Verschreibungspflichtig/ Rezept- und apothekenpflichtig. Pharmazeutischer Unternehmer: Alexion Europe SAS, 1-15, avenue Edouard Belin, Rueil-Malmaison, Frankreich. Stand der Information: August 2017 Quelle: Alexion Pharma Germany, (tb). 8 / 8
Erste und einzige zugelassene komplementbasierte Therapie für Patienten mit refraktärer gmg
 Swissmedic erteilt Soliris (Eculizumab) Zulassung für Indikationserweiterung zur Behandlung von Patienten mit refraktärer generalisierter Myasthenia gravis (gmg) Erste und einzige zugelassene komplementbasierte
Swissmedic erteilt Soliris (Eculizumab) Zulassung für Indikationserweiterung zur Behandlung von Patienten mit refraktärer generalisierter Myasthenia gravis (gmg) Erste und einzige zugelassene komplementbasierte
Wichtige sicherheitsrelevante Informationen für. Patienten. zur Behandlung mit Soliris bei refraktärer gmg. Patienten.
 Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur
Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur
Wichtige sicherheitsrelevante Informationen für. Patienten. zur Behandlung mit Soliris bei refraktärer gmg. ( E culizumab) Patienten.
 Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre
Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre
Wichtige sicherheitsrelevante Informationen für. Fachkreise. zur Behandlung mit Soliris bei PNH. ( E culizumab) Fachkreise PNH
 Fachkreise PNH Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre zur Anwendung
Fachkreise PNH Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre zur Anwendung
Informationsbroschüre für Eltern von Kleinkindern mit ahus
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Wichtige sicherheitsrelevante Informationen für. Fachkreise. zur Behandlung mit Soliris bei PNH. Fachkreise PNH
 Fachkreise PNH Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung von Soliris
Fachkreise PNH Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung von Soliris
Harnblasenkarzinom. Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung
 Einladung zum Symposium Wichtige Aspekte der ersten Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung Im Herbst 2016 wird die erste zum veröffentlicht. Dies bedeutet einen
Einladung zum Symposium Wichtige Aspekte der ersten Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung Im Herbst 2016 wird die erste zum veröffentlicht. Dies bedeutet einen
Gebrauchsinformation: Information für Anwender. Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab
 Gebrauchsinformation: Information für Anwender Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Wichtige sicherheitsrelevante Informationen für. Fachkreise. zur Behandlung mit Soliris bei ahus. ( E culizumab) Fachkreise. ahus
 Fachkreise ahus Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei ahus behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre zur Anwendung
Fachkreise ahus Wichtige sicherheitsrelevante Informationen für Fachkreise zur Behandlung mit Soliris bei ahus behördlich genehmigtes Schulungsmaterial ( E culizumab) Diese Informationsbroschüre zur Anwendung
Wichtige sicherheitsrelevante Informationen für. Patienten/Eltern. zur Behandlung mit Soliris bei ahus. Patienten/Eltern. ahus
 Patienten/Eltern ahus Wichtige sicherheitsrelevante Informationen für Patienten/Eltern zur Behandlung mit Soliris bei ahus behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung
Patienten/Eltern ahus Wichtige sicherheitsrelevante Informationen für Patienten/Eltern zur Behandlung mit Soliris bei ahus behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung
Wichtige sicherheitsrelevante Informationen für. Patienten/Eltern. zur Behandlung mit Soliris bei PNH. Patienten/Eltern PNH
 Patienten/Eltern PNH Wichtige sicherheitsrelevante Informationen für Patienten/Eltern zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung
Patienten/Eltern PNH Wichtige sicherheitsrelevante Informationen für Patienten/Eltern zur Behandlung mit Soliris bei PNH behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur Anwendung
Wichtige sicherheitsrelevante Informationen für Eltern von Säuglingen und Kindern zur Behandlung mit Soliris bei ahus
 Elterninformation ahus behördlich genehmigtes Schulungsmaterial Wichtige sicherheitsrelevante Informationen für Eltern von Säuglingen und Kindern zur Behandlung mit Soliris bei ahus Diese Informationsbroschüre
Elterninformation ahus behördlich genehmigtes Schulungsmaterial Wichtige sicherheitsrelevante Informationen für Eltern von Säuglingen und Kindern zur Behandlung mit Soliris bei ahus Diese Informationsbroschüre
Neues subkutanes Immunglobulin. Hochkonzentriert. High-Speed. Hizentra. Immune Globulin Subcutaneous (Human) 20%Liquid
 Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Bendamustin. eine (Substanz) Klasse für sich. Neueste Daten zum Wirkmechanismus einer bewährten Substanz. Bendamustin
 eine (Substanz) Klasse für sich Neueste Daten zum Wirkmechanismus einer bewährten Substanz NCI-Screening: einzigartiges Aktivitätsprofil zeigt im NCI-Screening ein anderes Aktivitätsprofil als die klassischen
eine (Substanz) Klasse für sich Neueste Daten zum Wirkmechanismus einer bewährten Substanz NCI-Screening: einzigartiges Aktivitätsprofil zeigt im NCI-Screening ein anderes Aktivitätsprofil als die klassischen
Störungen der neuromuskulären Übertragung L.Kappos
 Störungen der neuromuskulären Übertragung L.Kappos Myasthenia gravis: Epidemiologie Prävalenz: 5-10 /100000 Manifestationszeitpunkt: am häufigsten im jüngeren Erwachsenenalter; prinzipiell aber in jeder
Störungen der neuromuskulären Übertragung L.Kappos Myasthenia gravis: Epidemiologie Prävalenz: 5-10 /100000 Manifestationszeitpunkt: am häufigsten im jüngeren Erwachsenenalter; prinzipiell aber in jeder
Von Fall zu Fall Die Komplement-basierte Therapie der refraktären Myasthenia gravis Kasuistik-Session. Myasthenia gravis Up 2 date
 Von Fall zu Fall Die Komplement-basierte Therapie der refraktären Myasthenia gravis Kasuistik-Session Myasthenia gravis Up 2 date Hintergrund Myasthenia gravis chronisch progrediente neuromuskuläre Autoimmunerkrankung
Von Fall zu Fall Die Komplement-basierte Therapie der refraktären Myasthenia gravis Kasuistik-Session Myasthenia gravis Up 2 date Hintergrund Myasthenia gravis chronisch progrediente neuromuskuläre Autoimmunerkrankung
Molekulare und biochemische Ursachen neuraler Krankheiten. Myasthenia gravis
 Molekulare und biochemische Ursachen neuraler Krankheiten Myasthenia gravis Inhalt Allgemeines Symptome AChR und MuSK in der Reizweiterleitung Erscheinungsformen von MG Einfluss der Thymusdrüse Diagnose
Molekulare und biochemische Ursachen neuraler Krankheiten Myasthenia gravis Inhalt Allgemeines Symptome AChR und MuSK in der Reizweiterleitung Erscheinungsformen von MG Einfluss der Thymusdrüse Diagnose
Cytomegalie-Immunglobulin vom Menschen
 Immunglobuline Prophylaxe klinischer Manifestationen einer Cytomegalie-Virus-Infektion bei Patienten unter immunsuppressiver Therapie, insbesondere Transplantat-Empfängern. CMV-Infektion (Prophylaxe) Kdr.,
Immunglobuline Prophylaxe klinischer Manifestationen einer Cytomegalie-Virus-Infektion bei Patienten unter immunsuppressiver Therapie, insbesondere Transplantat-Empfängern. CMV-Infektion (Prophylaxe) Kdr.,
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn
 EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Körpergewicht Induktionsphase Erhaltungsphase
 1. BEZEICHNUNG DES ARZNEIMITTELS Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eculizumab ist ein humanisierter monoklonaler (IgG 2/4κ ) Antikörper, der
1. BEZEICHNUNG DES ARZNEIMITTELS Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eculizumab ist ein humanisierter monoklonaler (IgG 2/4κ ) Antikörper, der
Bewilligungsantrag Nucala (Mepolizumab) - Erstdokumentation
 Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
PROGRAMM VIII. INTERNATIONALER DIALOG GEBURTSHILFE, HEBAMMEN, ANÄSTHESIE UND NEONATOLOGIE IM GESPRÄCH
 PROGRAMM VIII. INTERNATIONALER DIALOG GEBURTSHILFE, HEBAMMEN, ANÄSTHESIE UND NEONATOLOGIE IM GESPRÄCH 22. 24. SEPTEMBER 2016 MEDIZINISCHE UNIVERSITÄT WIEN www.perinatal-dialog.at Sehr geehrte Damen und
PROGRAMM VIII. INTERNATIONALER DIALOG GEBURTSHILFE, HEBAMMEN, ANÄSTHESIE UND NEONATOLOGIE IM GESPRÄCH 22. 24. SEPTEMBER 2016 MEDIZINISCHE UNIVERSITÄT WIEN www.perinatal-dialog.at Sehr geehrte Damen und
 FACHINFORMATION Bezeichnung des Arzneimittels KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Qualitative und Quantitative Zusammensetzung Eine Durchstechflasche mit Pulver
FACHINFORMATION Bezeichnung des Arzneimittels KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Qualitative und Quantitative Zusammensetzung Eine Durchstechflasche mit Pulver
Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
Informationsbroschüre für Eltern von Kleinkindern mit ahus
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief CETIRIZIN HEXAL TR B ALLER CETIRIZIN HEXAL Tropfen bei Allergien Hexal AG PZN: 02579607 Menge: 10 ml Art: Tropfen Link: https://www.medipreis.de/02579607 Anwendungsgebiete Das
MediPreis Produktsteckbrief CETIRIZIN HEXAL TR B ALLER CETIRIZIN HEXAL Tropfen bei Allergien Hexal AG PZN: 02579607 Menge: 10 ml Art: Tropfen Link: https://www.medipreis.de/02579607 Anwendungsgebiete Das
Myastenia Gravis. Anna van Roye, Christina Gassner Biochemische und Molekulare Ursachen Neuraler Krankheiten
 16.06.2016 Biochemische und Molekulare Ursachen Neuraler Krankheiten Inhaltsverzeichnis Was ist Myastenia Gravis? Hintergrundinformationen: - Immunantwort - Motorische Endplatte Molekulare Ursachen Symptome
16.06.2016 Biochemische und Molekulare Ursachen Neuraler Krankheiten Inhaltsverzeichnis Was ist Myastenia Gravis? Hintergrundinformationen: - Immunantwort - Motorische Endplatte Molekulare Ursachen Symptome
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
Schweres Eosinophiles Asthma (SEA)
 Schweres Eosinophiles Asthma (SEA) Ihre Therapie mit Nucala (Mepolizumab) Diese Unterlage für die Therapieaufklärung Ihrer Nucala-Patienten verbleibt bei Ihnen! Asthma Ihr Aufklärungsgespräch zum SEA
Schweres Eosinophiles Asthma (SEA) Ihre Therapie mit Nucala (Mepolizumab) Diese Unterlage für die Therapieaufklärung Ihrer Nucala-Patienten verbleibt bei Ihnen! Asthma Ihr Aufklärungsgespräch zum SEA
Gebrauchsinformation: Information für den Anwender. Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab
 Gebrauchsinformation: Information für den Anwender Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für den Anwender Soliris 300 mg, Konzentrat zur Herstellung einer Infusionslösung Eculizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Soliris 300 mg Konzentrat zur Herstellung einer Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
remittierender Multipler Sklerose
 PLEGRIDY : Erstes pegyliertes Interferon alle 2 Wochen s.c. für erwachsene Patienten mit schubförmig r PLEGRIDY Erstes pegyliertes Interferon alle 2 Wochen s.c. für erwachsene Patienten mit schubförmig
PLEGRIDY : Erstes pegyliertes Interferon alle 2 Wochen s.c. für erwachsene Patienten mit schubförmig r PLEGRIDY Erstes pegyliertes Interferon alle 2 Wochen s.c. für erwachsene Patienten mit schubförmig
Patient mit Husten: Klinische Unterscheidung von akuter Bronchitis und Pneumonie
 Alkoholmissbrauch Patient mit Husten: Klinische Unterscheidung von akuter Bronchitis und Pneumonie TGAM-Weiterbildung Bronchitis, 19. 11. 2014 Vortrag Herbert Bachler 1 Akute Bronchitis In den ersten Tagen
Alkoholmissbrauch Patient mit Husten: Klinische Unterscheidung von akuter Bronchitis und Pneumonie TGAM-Weiterbildung Bronchitis, 19. 11. 2014 Vortrag Herbert Bachler 1 Akute Bronchitis In den ersten Tagen
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
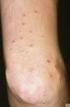 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
PHV-issue: Anti-Human-Thymozyten-Immunglobulin vom Kaninchen
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Gebrauchsinformation: Information für Anwender. Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa
 Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Patienten. Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab
 Gebrauchsinformation: Information für Patienten Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Patienten Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen
 Gebrauchsinformation: Bitte aufmerksam lesen! Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen Was in
Gebrauchsinformation: Bitte aufmerksam lesen! Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen Was in
Kardiologie Netzwerk Burgenland. Update April 2019, Kulturzentrum Eisenstadt
 Burgenland Update 2019 Burgenland: Update 2019 Programm Vorsitz: Prim. Prof. Dr. Rudolf Berger; OA Dr. Maximilian Juhasz 09.00 10.30 Session 1 09.00 09.30 Therapiemöglichkeiten der arteriellen Hypertonie
Burgenland Update 2019 Burgenland: Update 2019 Programm Vorsitz: Prim. Prof. Dr. Rudolf Berger; OA Dr. Maximilian Juhasz 09.00 10.30 Session 1 09.00 09.30 Therapiemöglichkeiten der arteriellen Hypertonie
Gebrauchsinformation: Information Für Anwender. PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff
 Gebrauchsinformation: Information Für Anwender PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft
Gebrauchsinformation: Information Für Anwender PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft
ANHANG NEBENWIRKUNGEN
 ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
ahus: Entstehung, Symptome und Diagnostik
 ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz. Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl.
 Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl. 1, Abstract 394 Ziele der Studie Untersuchung der Pharmakokinetik und des renalen
Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl. 1, Abstract 394 Ziele der Studie Untersuchung der Pharmakokinetik und des renalen
Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem Antigenhalt)
 Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
SIGNALE NEUROLOGIE. Neue Erkenntnisse bei Patienten mit therapierefraktärer Myasthenia gravis
 SIGNALE NEUROLOGIE Neue Erkenntnisse bei Patienten mit therapierefraktärer Myasthenia gravis Freitag, 27. Oktober 2017, Hamburg Adina Hotel am Michel, Hamburg CME-Zertifizierung beantragt Fortbildungsreihe
SIGNALE NEUROLOGIE Neue Erkenntnisse bei Patienten mit therapierefraktärer Myasthenia gravis Freitag, 27. Oktober 2017, Hamburg Adina Hotel am Michel, Hamburg CME-Zertifizierung beantragt Fortbildungsreihe
Dossierbewertung A15-13 Version 1.0 Ruxolitinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Vi-Polysaccharid von Salmonella typhi (Ty2 Stamm)
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
ANHANG III ÄNDERUNGEN RELEVANTER ABSCHNITTE DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE
 ANHANG III ÄNDERUNGEN RELEVANTER ABSCHNITTE DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 41 A. ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 4.1 Anwendungsgebiete [derzeitig
ANHANG III ÄNDERUNGEN RELEVANTER ABSCHNITTE DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 41 A. ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 4.1 Anwendungsgebiete [derzeitig
Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson
 Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Informationsbroschüre für PNH-Patienten und Eltern oder Betreuungspersonen von
 BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
Generalisierte Angststörung im Alter: Diagnose sichern, mit Pregabalin therapieren
 Generalisierte Angststörung im Alter Diagnose sichern, mit Pregabalin therapieren Berlin (10. Januar 2014) - Das Lebenszeitrisiko an GAD zu erkranken, wird mit etwa zehn Prozent beziffert, wobei der Altersgang
Generalisierte Angststörung im Alter Diagnose sichern, mit Pregabalin therapieren Berlin (10. Januar 2014) - Das Lebenszeitrisiko an GAD zu erkranken, wird mit etwa zehn Prozent beziffert, wobei der Altersgang
Klinikum Vest GmbH Der besondere Fall Gintarė Kaklauskaitė Assistenzärztin für Neurologie
 Klinikum Vest GmbH Der besondere Fall Gintarė Kaklauskaitė Assistenzärztin für Neurologie 1 Paroxysmale nächtliche Hämoglobinurie (PNH) erworbene klonale Erkrankung der hämatopoetischen Stammzellen Mutation
Klinikum Vest GmbH Der besondere Fall Gintarė Kaklauskaitė Assistenzärztin für Neurologie 1 Paroxysmale nächtliche Hämoglobinurie (PNH) erworbene klonale Erkrankung der hämatopoetischen Stammzellen Mutation
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension
 GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
GEBRAUCHSINFORMATION. FELOCELL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Katzen
 GEBRAUCHSINFORMATION FELOCELL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS
GEBRAUCHSINFORMATION FELOCELL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS
Informationsbroschüre für ahus-patienten und Eltern oder Betreuungspersonen von ahus-patienten
 BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
Beschluss vom: 4. August 2016 gültig bis: In Kraft getreten am: 4. August 2016 BAnz AT B2
 Afamelanotid Beschluss vom: 4. August 2016 gültig bis: 01.01.2021 In Kraft getreten am: 4. August 2016 BAnz AT 22.09.2016 B2 Zugelassenes Anwendungsgebiet (laut Zulassung vom 22. Dezember 2014): Scenesse
Afamelanotid Beschluss vom: 4. August 2016 gültig bis: 01.01.2021 In Kraft getreten am: 4. August 2016 BAnz AT 22.09.2016 B2 Zugelassenes Anwendungsgebiet (laut Zulassung vom 22. Dezember 2014): Scenesse
DGRh Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung
 DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Lektinol-Ampullen. Wirkstoff: Mistelkraut-Flüssigextrakt
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Lektinol-Ampullen Wirkstoff: Mistelkraut-Flüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Lektinol-Ampullen Wirkstoff: Mistelkraut-Flüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Daten und Fakten: Therapie der Multiplen Sklerose mit Tysabri
 Hintergrundtext Fachmedien Daten und Fakten: Therapie der Multiplen Sklerose mit Tysabri Natalizumab Zulassung und Indikation Natalizumab (Tysabri ) ist der erste alpha-4-integrin-antagonist zur Behandlung
Hintergrundtext Fachmedien Daten und Fakten: Therapie der Multiplen Sklerose mit Tysabri Natalizumab Zulassung und Indikation Natalizumab (Tysabri ) ist der erste alpha-4-integrin-antagonist zur Behandlung
PACKUNGSBEILAGE (CCDS ) (Ref )
 PACKUNGSBEILAGE (CCDS 0110-05) (Ref. 26.09.2013) 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Surbronc 60 mg Filmtabletten Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
PACKUNGSBEILAGE (CCDS 0110-05) (Ref. 26.09.2013) 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Surbronc 60 mg Filmtabletten Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Hedera Effervescent Tablets MODULE Product Information SPC, Labelling and Package Leaflet 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
Bluthochdruck stark und verträglich senken
 Azilsartan bei essenzieller Hypertonie Bluthochdruck stark und verträglich senken München (16. Mai 2012) Die Behandlung der Hypertonie, des weltweit stärksten Risikofaktors für Mortalität, hat mit dem
Azilsartan bei essenzieller Hypertonie Bluthochdruck stark und verträglich senken München (16. Mai 2012) Die Behandlung der Hypertonie, des weltweit stärksten Risikofaktors für Mortalität, hat mit dem
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE
 DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid
 Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Deutscher Schmerz- und Palliativtag 2014: Tapentadol ab April auch in schnellfreisetzenden Zubereitunge
 Deutscher Schmerz- und Palliativtag 2014 Tapentadol ab April auch in schnellfreisetzenden Zubereitungen Frankfurt am Main (20. März 2014) - Die Therapie chronischer Schmerzen ist eine Herausforderung -
Deutscher Schmerz- und Palliativtag 2014 Tapentadol ab April auch in schnellfreisetzenden Zubereitungen Frankfurt am Main (20. März 2014) - Die Therapie chronischer Schmerzen ist eine Herausforderung -
Unübertroffene Compliance durch 3x1 Dosierung
 Unübertroffene Compliance durch 3x1 Dosierung HNO- und Atemwegsinfekte erfordern eine wirksame Therapie mit hoher Sicherheit und bestmöglicher Compliance 3 x 1 ZITHROMAX empfiehlt sich als Mittel der Wahl,
Unübertroffene Compliance durch 3x1 Dosierung HNO- und Atemwegsinfekte erfordern eine wirksame Therapie mit hoher Sicherheit und bestmöglicher Compliance 3 x 1 ZITHROMAX empfiehlt sich als Mittel der Wahl,
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
Biogen Idec erhält europäische Zulassung für FAMPYRA
 Verbesserung der Gehfähigkeit für MS-Patienten Biogen Idec erhält europäische Zulassung für FAMPYRA Ismaning (26. Juli 2011) Die europäische Arzneimittelbehörde (EMA) hat Fampridin Retardtabletten (FAMPYRA
Verbesserung der Gehfähigkeit für MS-Patienten Biogen Idec erhält europäische Zulassung für FAMPYRA Ismaning (26. Juli 2011) Die europäische Arzneimittelbehörde (EMA) hat Fampridin Retardtabletten (FAMPYRA
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Journal Club vom Stefan Erb. N Engl J Med 2017;376:
 Journal Club vom 24.7.2017 Stefan Erb N Engl J Med 2017;376:2545-55. Hintergrund Ubi pus, ibi evacua Unkomplizierte Hautinfektionen/Abszesse häufig, meist S. aureus Behandlung durch Inzision allein ( Expert
Journal Club vom 24.7.2017 Stefan Erb N Engl J Med 2017;376:2545-55. Hintergrund Ubi pus, ibi evacua Unkomplizierte Hautinfektionen/Abszesse häufig, meist S. aureus Behandlung durch Inzision allein ( Expert
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Japomin Öl - Tropfen Wirkstoff: Minzöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Japomin Öl - Tropfen Wirkstoff: Minzöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Japomin Öl - Tropfen Wirkstoff: Minzöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Xolair - praktische Hinweise zum Einsatz von Omalizumab bei chronischer spontaner Urtikaria
 Xolair - praktische Hinweise zum Einsatz von Omalizumab bei chronischer spontaner Urtikaria Diese Informationen dienen zur Beantwortung Ihrer spontanen medizinischen Anfrage. Bitte beachten Sie, dass die
Xolair - praktische Hinweise zum Einsatz von Omalizumab bei chronischer spontaner Urtikaria Diese Informationen dienen zur Beantwortung Ihrer spontanen medizinischen Anfrage. Bitte beachten Sie, dass die
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
Warum war die Studie notwendig?
 Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit milder Alzheimer-Krankheit und Problemen bei der geistigen Funktionsfähigkeit verbessert Nachfolgender Text
Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit milder Alzheimer-Krankheit und Problemen bei der geistigen Funktionsfähigkeit verbessert Nachfolgender Text
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
Beschluss vom: 5. April 2018 gültig bis: unbefristet In Kraft getreten am: 5. April 2018 BAnz AT B4
 Beschluss vom: 5. April 2018 gültig bis: unbefristet In Kraft getreten am: 5. April 2018 BAnz AT 16.05.2018 B4 Zugelassenes Anwendungsgebiet (laut Zulassung vom 18. September 2017): Xermelo ist indiziert
Beschluss vom: 5. April 2018 gültig bis: unbefristet In Kraft getreten am: 5. April 2018 BAnz AT 16.05.2018 B4 Zugelassenes Anwendungsgebiet (laut Zulassung vom 18. September 2017): Xermelo ist indiziert
Inhaltsverzeichnis. Fall 1 Seite 2 67-jährige Patientin mit ausgeprägter Luftnot. Fall 2 Seite 3 72-jährige Patientin mit makrozytärer Anämie
 Inhaltsverzeichnis Fall 1 Seite 2 67-jährige Patientin mit ausgeprägter Luftnot Fall 2 Seite 3 72-jährige Patientin mit makrozytärer Anämie Fall 3 Seite 4 26-jährige Patientin mit rezidivierendem Fieber
Inhaltsverzeichnis Fall 1 Seite 2 67-jährige Patientin mit ausgeprägter Luftnot Fall 2 Seite 3 72-jährige Patientin mit makrozytärer Anämie Fall 3 Seite 4 26-jährige Patientin mit rezidivierendem Fieber
Gebrauchsinformation: Information für Patienten. Ortoton forte 1500 mg Filmtabletten Zur Anwendung bei Erwachsenen. Methocarbamol
 Gebrauchsinformation: Information für Patienten Ortoton forte 1500 mg Filmtabletten Zur Anwendung bei Erwachsenen Methocarbamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Patienten Ortoton forte 1500 mg Filmtabletten Zur Anwendung bei Erwachsenen Methocarbamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten
 1/5 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG In 1 Tablette sind enthalten: Capsicum
1/5 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG In 1 Tablette sind enthalten: Capsicum
1.3.3 PACKAGE LEAFLET
 1.3.3 PACKAGE LEAFLET 1.3.3 Package Leaflet TDE-1.3.3 v08 14may08 - page 1 Gebrauchsinformation: Information für den Anwender Viveo 150 mg Filmtabletten Wirkstoff: Tolperisonhydrochlorid Lesen Sie die
1.3.3 PACKAGE LEAFLET 1.3.3 Package Leaflet TDE-1.3.3 v08 14may08 - page 1 Gebrauchsinformation: Information für den Anwender Viveo 150 mg Filmtabletten Wirkstoff: Tolperisonhydrochlorid Lesen Sie die
Fachinformation. Sehr geehrte Damen und Herren,
 Datum: 09.05.2014 Kontakt: Veronika Iro Abteilung: REGA Tel. / Fax: +43 (0) 505 55 36247 E-Mail: pv-implementation@ages.at Unser Zeichen: 16c-140509-00024-A-PHV Ihr Zeichen: PHV-issue: Clindamycin hältige
Datum: 09.05.2014 Kontakt: Veronika Iro Abteilung: REGA Tel. / Fax: +43 (0) 505 55 36247 E-Mail: pv-implementation@ages.at Unser Zeichen: 16c-140509-00024-A-PHV Ihr Zeichen: PHV-issue: Clindamycin hältige
Gebrauchsinformation: Information für Patienten. trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen. Weinblätter, in Pulverform
 PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Ambroxol Genericon 60 mg lösliche Tabletten. Wirkstoff: Ambroxolhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Ambroxol Genericon 60 mg lösliche Tabletten Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Ambroxol Genericon 60 mg lösliche Tabletten Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose
 Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose Wiesbaden (29. September 2011) - Fampridin (Fampyra ) ist seit Juli dieses Jahres zur Behandlung von erwachsenen Patienten mit
Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose Wiesbaden (29. September 2011) - Fampridin (Fampyra ) ist seit Juli dieses Jahres zur Behandlung von erwachsenen Patienten mit
Tiorfan Hidrasec Tiorfix Tiorfast 100 mg PACKUNGSBEILAGE
 Tiorfix Tiorfast 100 mg PACKUNGSBEILAGE 1 Tiorfix Tiorfast 100 mg Gebrauchsinformation: Information für den Anwender 100 mg Hartkapseln Racecadotril Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Tiorfix Tiorfast 100 mg PACKUNGSBEILAGE 1 Tiorfix Tiorfast 100 mg Gebrauchsinformation: Information für den Anwender 100 mg Hartkapseln Racecadotril Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
