Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
|
|
|
- Helmuth Baumann
- vor 6 Jahren
- Abrufe
Transkript
1 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 21/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: Gruppe 12: Farb-, Spreng- und Wirkstoffe Versuch (Farbstoffdarstellung): Darstellung von 1-Naphthol-2,6-disulfonsäure-azo-(1)-benzol-4-sulfonsäure-Natriumsalz Zeitbedarf Vorbereitung: 15 Minuten Durchführung: 6 Minuten Nachbereitung: 15 Minuten Reaktionsgleichung Abb. 1: Azokupplung der nitrierten Sulfanilsäure mit der 1-Naphthol-2,6-disulfonsäure. Chemikalien [2] Tab. 1: Verwendete Chemikalien. Eingesetzte Summen- Menge R-Sätze S-Sätze Gefahrensymbole Schuleinsatz Stoffe formel Sulfanilsäure C 6 H 7 NO 3 S (s) 5 g 36/38-43 (2) Xn S1 Natriumhydroxidlösung NaOH (aq) 4 ml C S1 (c = 2 mol/l) 36/37/39-45 Natriumnitrit NaNO 2(s) 2 g (1/2)-45- O, T, N S1 61 Salzsäure HCl (aq) 25 ml 36/37/38 26 Xi S1 (c = 3 mol/l) 1-Naphthol-2,6- disulfonsäure C 1 H 8 O 7 S 2(s) 8,8 g S1 1
2 o C Geräte 3 Erlenmeyerkolben (1 x 5 ml, Rundfilter 1 x 1 ml, 1 x 5 ml) Vakuumpumpe Kristallisierschale (Eisbad) Stativmaterial Thermometer Glasstab Saugflasche Petrischale Büchner Trichter 3 Reagenzgläser + Ständer Aufbau 1) 2) 1 1 ml 75 5 Abb. 2: Versuchsaufbau. Durchführung In einem 1 ml Erlenmeyerkolben werden 5 g Sulfanilsäure abgewogen und 15 ml Natronlauge (c = 2 mol/l) zugeführt. Des Weiteren werden 2 g Natriumnitrit in einem 5 ml Erlenmeyerkolben abgewogen und mit 25 ml Wasser versetzt. Diese Lösung wird zur Sulfanilsäurelösung gegeben und in ein Eisbad gestellt (siehe Abb. 2-1). Nun werden tropfenweise 25 ml Salzsäure (c = 3 mol/l) unter Rühren zugegeben. Die Temperatur der Lösung sollte dabei nicht über 5 C steigen! Zu 8,8 g 1-Naphthol-2,6-disulfonsäure werden nun in einem 5 ml Erlenmeyerkolben 25 ml Natronlauge (c = 2 mol/l) gegeben. Die mit Salzsäure umgesetzte Sulfanilsäure- Natriumnitrit-Lösung wird nun zügig, unter Rühren mit dem Glasstab zur 1-Naphthol-2,6- disulfonsäurelösung gegeben. Anschließend wird die Lösung für ca. 1 Stunde in den Kühlschrank gestellt und dann filtriert (mit Saugflasche und Vakuumpumpe, siehe Abb. 2-2). Der Filterkuchen wird auf eine Petrischale gelegt und für ca. 2 Stunden im Trockenschrank bei 3 C getrocknet. Das Produkt wird in eine saure, eine neutrale und eine alkalische Lösung gegeben. 2
3 Beobachtung Die Sulfanilsäure löst sich schlecht in der zugeführten Natronlauge, ein weißer Bodensatz bleibt zurück. Sobald die farblose Natriumnitritlösung zugeführt wird, färbt sich die gesamte Lösung gelb, ein weißer Bodensatz bleibt. Abb. 3: Die Sulfanilsäurelösung vor (links) und nach der Zugabe von Natriumnitritlösung (rechts). Nachdem im Eisbad tropfenweise Salzsäure zugeführt wurde, liegt eine orangefarbene Lösung vor. Zudem liegt ein voluminöser orangener Bodensatz vor. Wird die Lösung zur milchig, trüben 1-Naphthol-2,6-disulfonsäurelösung (eher Suspension) gegeben, tritt sofort eine intensive, dunkelrote Färbung ein. Ein orangeroter Bodensatz ist zu erkennen Abb. 4: Die mit Salzsäure umgesetzte orangefarbene Sulfanilsäure-Natriumnitrit-Lösung mit orangenem Bodensatz 1, die trübe 1-Naphthol-2,6-disulfonsäuresuspension 2, intensive, dunkelrote Färbung, roter Bodensatz nach dem Mischen von 1 und 2. Wird die Lösung filtriert, bleibt ein orangeroter, körniger Filterkuchen zurück. 1 2 Abb. 5: Orangeroter Farbstoff als Filterkuchen 1, verteilt auf einer Petrischale 2. 3
4 Wird das rote Produkt in eine saure, eine neutrale und eine basische Lösung gegeben, so sind verschiedene Färbungen zu beobachten Abb. 6: In basischer Lösung (1: ph = 13) tritt eine rote, in neutraler Lösung (2: ph = 7) eine orangene und in saurer Lösung (3: ph = 2) eine gelbe Färbung ein. Entsorgung Der Azofarbstoff wird im Sammelbehälter für Feststoffabfälle entsorgt. Fachliche Auswertung der Versuchsergebnisse [3-9] Wie entsteht ein Farbeindruck? Farbe selbst ist keine Eigenschaft eines Materials, denn die Außenwelt ist eigentlich farblos. Allerdings besitzt jede Oberfläche ein gewisses Absorptionsvermögen von elektromagnetischen Wellen. Aus diesem Grund werden eine oder mehrere bestimmte Frequenzen des Lichts, welches auf die Oberfläche eines Körpers trifft, absorbiert und ein anderer Teil reflektiert. Treffen die reflektierten Lichtfrequenzen auf die Netzhaut des Auges, werden in den Sehzellen Impulse ausgelöst, die an das Gehirn weitergeleitet werden. Das Gehirn verarbeitet die Informationen und erst durch diesen Prozess kommt es zu einer Farbwahrnehmung. Im sichtbaren Spektralbereich sind vor allem die delokalisierten π-elektronen für Lichtadsorption verantwortlich. Man spricht dann von Delokalisierung, wenn die Ladung einer Atomgruppe nicht genau lokalisierbar ist, sondern über die einzelnen Atome, das gesamte System verteilt ist. Dies ist beispielsweise beim Benzol, als typischer Vertreter der Aromaten, der Fall. Abb. 7: [5] Delokalisierung der -Elektronen im Benzolmolekül 4
5 Trifft Licht nun beispielsweise auf die -Elektronen eines Benzolrings, werden diese energetisch angeregt. Dabei wird ein Elektron durch eine bestimmte Wellenlänge des Lichts vom höchsten besetzten Molekülorbital (HOMO = Highest Occupied Molecular Orbital) in das niedrigste unbesetzte Molekülorbital (LUMO = Lowest Unoccupied Molecular Orbital) überführt. Energie LUMO HOMO Abb. 8: Molekülorbitale eines delokalisierten -Elektronensystems (von Hexatrien als Beispiel): Anregung eines -Elektrons durch eine bestimmte Lichtfrequenz vom HOMO ins LUMO In Abb. 8 ist zu erkennen, dass die energetischen Abstände der Molekülorbitale bei zunehmendem energetischem Niveau abnehmen. Daraus folgt: Je mehr -Elektronen in einem System vorhanden sind, desto kleiner werden die Abstände zwischen HOMO und LUMO. Kleinere Energieabstände bedeuten wiederrum, dass weniger Energie benötigt wird um ein Elektron vom HOMO ins LUMO anzuregen, d.h. langwelligeres, energieärmeres Licht reicht bereits dazu aus. Liegt diese Lichtfrequenz nun im sichtbaren Spektralbereich, so entsteht für den Menschen ein gewisser Farbeindruck. Die wahrgenommene Farbe ist dabei stets die Komplementärfarbe des absorbierten Lichts. Abb. 9: [7] Die Komplementärfarben (jeweils gegenüber). 5
6 Synthese des Azofarbstoffs (Versuchserklärung) Bei der im Versuch stattfindenden Reaktion handelt es sich um eine sog. Diazotierung. Sie bezeichnet die Nitrosierung primärerer aromatischer Amine durch Salpetrige Säure. Letztere wird im Versuch in situ durch die Zugabe von Salzsäure zum in Lösung befindlichen Natriumnitrit erzeugt. NaNO 2(aq) + HCl (aq) HNO 2(aq) + NaCl (aq) Durch Protonierung der Hydroxy-Gruppe der Salpetrigen Säure und anschließender Abstraktion eines Wassermoleküls wird das sog. Nitrosylkation erhalten. Abb. 1: Reaktion der Salpetrigen Säure zum Nitrosylkation. Das Nitroxylkation ist in saurer Lösung relativ stabil. Im neutralen oder basischen Milieu liegt es eher als Nitrosylhalogenid (z.b. Cl-N=O) vor. Nun ist ein elektrophiler Angriff des Kations an der Sulfanilsäure möglich. Abb. 11: Elektrophiler Angriff des Nitrosylkations. Es folgt eine Abspaltung und Übertragung der am positiv geladenen Stickstoffatom gebundenen Wasserstoffatome (siehe Abb. 11) als Protonen. Unter Abspaltung von Wasser wird schließlich das Diazonium-Ion gebildet. Diazonium-Ion Abb. 12: Bildung des Diazonium-Ions. 6
7 Das Diazonium-Ion verfügt bezüglich der Diazoniumgruppe über zwei mesomere Grenzstrukturen. Abb. 13: Mesomere Grenzstrukturen der Diazoniumgruppe. Im Folgenden kommt es zur sog. Azokupplung, bei der ein elektrophiler Angriff des Diazonium-Ions am delokalisierten -Elektronensystem der 1-Naphthol-2,6-disulfonsäure erfolgt. Abb. 14: Azokupplung. Da die Azokupplung im basischen Milieu durchgeführt wird (siehe Durchführung), liegen die Sulfonsäuregruppen und die Hydroxylgruppe nun als Anionen vor. In Abb. 14 wird ersichtlich, dass der elektrophile Angriff in para-stellung zur Hydroxylgruppe der 1-Naphthol-2,6-disulfonsäure erfolgt. Dies ist darauf zurückzuführen, dass ein freies Elektronenpaar der Hydroxylgruppe nur bei einer Addition in ortho- oder para-stellung im Übergangszustand (Abb Produkt) mit in die mesomeren Grenstrukuren des Naphthylrings einbezogen werden kann. Dabei gilt: Je ausgedehnter das System zur Ladungsverteilung ist, desto besser kann eine positive Ladung stabilisiert werden. 7
8 Da die ortho-position bereits von einer Sulfonsäure-Gruppe besetzt wird, erfolgt der Angriff deshalb ausschließlich in para-position. [...] Abb. 15: Mesomere Grenzstrukturen des Übergangszustands ( -Komplex). Die positive Ladung ist über den gesamten Naphthalin-Ring verteilt ([ ] = weitere Grenzstrukturen). Durch Übertagung eines Protons entsteht letztlich das 1-Naphthol-2,6-disulfonsäure-azo-(1)- benzol-4-sulfonsäure-natriumsalz. Abb. 16: Bildung des 1-Naphthol-2,6-disulfonsäure-azo-(1)-benzol-4-sulfonsäure-Natriumsalzes durch Protonenübertragung. Die orange-rote Farbe des entstandenen Azofarbstoffs kommt aufgrund eines relativ großen delokalisierten -Elektronensystems zustande. [...] Abb. 17: Exemplarische mesomere Grenzstrukturen. (Konjugation geht über das gesamte Moleküle!) 8
9 Azofarbstoff als ph-indikator Wird der im Versuch hergestellt Azofarbstoff zu Lösungen mit verschiedenen ph-werten gegeben, so treten unterschiedliche Färbungen auf. ph = 13 ph = 7 ph = 2 Verkleinerung des delokalisierten -Elektronensystems Abb. 18: Verkleinerung des delokalisierten -Elektronensystems bei abnehmendem ph-wert. In Abb. 18 werden die Strukturen des Azofarbstoffs bei unterschiedlichen ph-werten dargestellt. Für ph = 13 liegt die Hydroxygruppe deprotoniert vor, sodass die Außenelektronen des Sauerstoffs in das delokalisierte -Elektronensystem des Naphthalinrings stärker integriert werden können und jenes auf diese Weise vergrößert wird. Bei ph = 2 findet eine Protonierung eines Stickstoffatoms der Azogruppe statt, wodurch das delokalisierte -Elektronensystems insgesamt unterbrochen und so verkleinert wird. Nach Abb. 8 werden die Abstände zwischen HOMO und LUMO für kleinere -Elektronensysteme größer. Dies hat zur Folge, dass energiereicheres, kurzwelligeres Licht zur Anregung der Elektronen benötigt wird. Dies wird im Versuch durch die unterschiedlichen Farbeindrücke bestätigt: Für ph = 13 wird relativ energiearmes, grünes Licht ( Komplementärfarbe = Farbeindruck: rot) zur Anregung der Elektronen benötigt. Für ph = 7 wird energiereicheres, blau-grünes Licht ( oranger Farbeindruck) und für ph = 2 energiereiches, blaues Licht ( gelber Farbeindruck) zur Anregung benötigt. Die Verwendung von Azofarbstoffen als Farbindikator beruht folglich auf der ph-bedingten, unterschiedlich weiten Ausdehnung des konjugierten -Elektronensysteme. Zu den als Indikator bedeutsamsten Azofarbstoffen gehören Methylrot und Methylorange. 9
10 Verwendung von Azofarbstoffen Azofarbstoffe werden industriell u.a. zur Färbung von Textilien, Holz oder Papier eingesetzt. Da viele jedoch krebserregende aromatische Amine freisetzen, sind nur wenige Azofarbstoffe als Färbemittel für Alltagsgegenstände, wie z.b. Kleidung oder Kosmetika, zugelassen. Methodisch-Didaktische Analyse 1 Einordnung [1] Laut hessischem Lehrplan werden Farbstoffe im Leistungskurs in der Qualifikationsphase 2 oder als Wahlthema der angewandten Chemie im Grund- oder Leistungskurs der Qualifikationsphase 4 behandelt. Auch die Synthese von Farbstoffen wird im Lehrplan explizit erwähnt. Aufgrund seiner relativ komplexen Struktur ist der im Versuch synthetisch hergestellte Farbstoff nicht zum Einstieg in das Thema Azofarbstoffe geeignet. Hierfür sollte ein den Schülern bereits bekannter Farbstoff, wie z.b. Methylorange, besprochen werden. Die Synthese und Eigenschaften von 1-Naphthol-2,6-disulfonsäure-azo-(1)-benzol-4- sulfonsäure-natriumsalz (Trivialname nicht existent) wäre lediglich als Vertiefung und Wiederholung (Azokupplung und para-dirigierende Eigenschaft der Hydroxylgruppe) geeignet. Aufgrund des Einsatzes als Färbemittel oder Indikator besitzt das Thema Azofarbstoffe einen guten Alltagsbezug. 2 Aufwand Für den hergestellten Farbstoff sind keine Gefahrensätze in Stoffdatenbanken zu finden. Da Azofarbstoffe im Allgemeinen jedoch oft als krebserregend eingestuft werden, ist davon auszugehen, dass der synthetisierte Farbstoff ebenfalls gesundheitsschädlich ist. Aus diesem Grund sollten bei der Versuchsdurchführung Handschuhe getragen werden. Die Synthese ist insbesondere wegen der ständigen Temperaturkontrolle und -regulierung, die stets mit einer gewissen Wartezeit verbunden sind, relativ zeitaufwändig. Der Versuch zu den ph-abhängigen Eigenschaften des Farbstoffs lässt sich hingegen relativ rasch durchführen. 3 Durchführung Aufgrund der gesundheitsschädlichen Eigenschaften, die im Allgemeinen von Azofarbstoffen ausgehen (wenige Ausnahmen), ist der Versuch nicht als Schülerversuch geeignet. Die Synthese ist aufgrund des Zeitaufwands auch nicht als Demonstrationsversuch des Lehrers sinnvoll. Aufgrund der schönen Farbeindrücke würden sich jedoch die unterschiedliche Färbungen des Farbstoffs bei verschiedenen ph-werten zur Demonstration anbieten. Im Plenum könnte anschließend die Theorie zur unterschiedlichen Farbgebung besprochen werden. 1
11 4 Fazit Lediglich die Indikator-Eigenschaften des synthetisch hergestellten Azofarbstoffs eignen sich als Demonstrationsversuch des Lehrers. Die eigentliche Synthese ist zu zeitaufwändig und aufgrund der gesundheitsschädlichen Wirkung des Farbstoffs nicht als Schülerversuch geeignet. Quellenverzeichnis [1] Versuchsquelle: Buthenut-Skript: Darstellung von 2-Hydroxy-3,6disuoflnsäurenaphthyl-azo-(1)-benzol-4-sulfonsäure-Natriumsalz, Seite 23, Versuch [2] HessGISS - GUV-Regel Umgang mit Gefahrenstoffen im Unterricht Ausgabe Januar 1998 (Aktualisierte Fassung Juni 24) [3] Vollhardt, K. Peter C. und Neil E. Schore: Organische Chemie. Vierte Auflage. Wiley-VCH Verlag. Weinheim 25. S. 726 f., 1194 f. [4] Reinhard Brückner: Reaktionsmechanismen, 3. Auflage, Springer-Verlag, Heidelberg, 27, S. 225 f. [5] Titel: Organische Verbindungen Urheber: Hans-Peter Willig Zugriff am 9. Februar 211 [6] (Stichwort: Naphtholsulfonsäuren) Titel: Naphtholsulfonsäuren Urheber: Thieme RÖMPP Online Zugriff am: 9. Februar 211 [7] Titel: Farbwahrnehmung Urheber: FHT Esslingen Zugriff am: 19. Februar 211 [8] reaktionen/reaktionen_aromaten.vlu/page/vsc/de/ch/12/oc/aromaten/reaktionen/ar_se/diazotie rung/diazotierung.vscml.html Titel: Diazotierung Urheber: Fachinformationszentrum Chemie GmbH Zugriff am: 19. Februar 211) [9] Titel: Azofarbstoffe Urheber: enius Zugriff am: 19. Februar 211 [1] Titel: Spektralanalyse von -Naphtholorange Urheber: C.-J. Bautsch Zugriff am: 19. Februar 211 [1] Hessischer Lehrplan: Chemie (Zugriff am 19. Februar 211) 11
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23112010 Gruppe 4: Aromaten Assi-Versuch: Reaktion
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23112010 Gruppe 4: Aromaten Assi-Versuch: Reaktion
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 24.11.2010 Gruppe 4: Aromaten Versuch (selbst):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 24.11.2010 Gruppe 4: Aromaten Versuch (selbst):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch: Reaktivität
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch: Reaktivität
Versuch: Darstellung eines Azofarbstoffes (Methylorange)
 PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß. Schulversuch-Protokoll Jan gr.
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von β-aphtholorange
rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von β-aphtholorange
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Alkoholtest):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Alkoholtest):
Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, Natriumsalz) - Azofarbstoff -
 Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 200/ Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 5.2.200 Gruppe 9: Kohlenhydrate Versuch (selbst):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 200/ Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 5.2.200 Gruppe 9: Kohlenhydrate Versuch (selbst):
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Versuchsprotokoll. Gruppe 12, Typ: Pflichtversuch - H + Einsatz in der Schule Sulfanilsäure NH 2 C 6 H 4 SO 3 H Xi 36/38, 43 24, 37 S I
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Synthese von β-aphtolorange
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Synthese von β-aphtolorange
Versuch: Isolierung von Citronensäure aus Zitronen
 Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen u.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen u.
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe. Kurzprotokoll
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
Spektroskopie-Seminar SS UV-Vis-Spektroskopie. UV-Vis-Spektroskopie
 UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
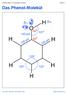 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Farbstoffe Einleitung
 Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für Höhlenmalereien. Diese Farben bestehen aus anorganischen
Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für Höhlenmalereien. Diese Farben bestehen aus anorganischen
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Gruppe 3: Alkene, Alkine Versuch: omierung von
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Gruppe 3: Alkene, Alkine Versuch: omierung von
Gruppe 4 eigener Versuch. Reduktion von Anthrachinon
 Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 eigener Versuch Reduktion von Anthrachinon
Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 eigener Versuch Reduktion von Anthrachinon
Gruppe 13 vorgegebener Versuch. Polyelektrolyte im Haargel
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts Praktikumsleitung: Dr. Reiß WS 2010/11 Assistent(in): Julia Konen Name: Johannes Hergt Datum: 24.11.2010 Zeitbedarf Gruppe 3: Alkene, Alkine
Praktikum zur Organischen Chemie für Studierende des Lehramts Praktikumsleitung: Dr. Reiß WS 2010/11 Assistent(in): Julia Konen Name: Johannes Hergt Datum: 24.11.2010 Zeitbedarf Gruppe 3: Alkene, Alkine
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 2: Alkane Versuch: alogenierung von Alkanen
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 2: Alkane Versuch: alogenierung von Alkanen
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 7.12.2010 Zeitbedarf Gruppe 7: Aldehyde und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 7.12.2010 Zeitbedarf Gruppe 7: Aldehyde und
Versuchsprotokoll. ph-abhängigkeit der Getränkefarben
 AnnaLena Eicke PhilippsUniversität Marburg OrganischChemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll phabhängigkeit der Getränkefarben
AnnaLena Eicke PhilippsUniversität Marburg OrganischChemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll phabhängigkeit der Getränkefarben
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in):Beate Abé Name: Johannes Hergt Datum: 16.11.2010 Gruppe 1: Einführung in die organische
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in):Beate Abé Name: Johannes Hergt Datum: 16.11.2010 Gruppe 1: Einführung in die organische
Versuch: Molischprobe mit Gelatine H 2 SO 4. O - 2 H e H 2. Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
 Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 10, Amine, Aminosäuren, Peptide Versuch: Molischprobe
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 10, Amine, Aminosäuren, Peptide Versuch: Molischprobe
Versuchsprotokoll. Kernbromierung und Seitenkettenbromierung von Xylol. Gruppe 4, Typ: Assiversuch KKK SSS
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Kernbromierung und Seitenkettenbromierung
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Kernbromierung und Seitenkettenbromierung
Schulversuch (Gruppe 6/Assistentenversuch): Vergleich aliphatischer Alkohole und Phenole
 Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
Gruppe 06: pulsierende Amöben
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 06: pulsierende Amöben Reaktion: Chemikalien: Eingesetzte Stoffe Gefahrensymbole
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 06: pulsierende Amöben Reaktion: Chemikalien: Eingesetzte Stoffe Gefahrensymbole
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Schulversuch-Protokoll Jan gr. Austing
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: xidation von Milchsäure ) Reaktionsgleichung:
rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: xidation von Milchsäure ) Reaktionsgleichung:
Versuchsprotokoll. Nitrierung von Phenol. Gruppe 4, Typ: Pflichtversuch O O - N
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Zeitbedarf Gruppe 6: Alkohole Versuch: Mischungsexperimente
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Zeitbedarf Gruppe 6: Alkohole Versuch: Mischungsexperimente
+ 30,5 O 2 (g) 20 CO 2 (g) + 21 H 2 O
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Versuch: Hydrolyse von Stärke mit Speichel
 Philipps-Universität Marburg 27.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Hydrolyse von Stärke mit
Philipps-Universität Marburg 27.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Hydrolyse von Stärke mit
Gruppe 05: Alkylchloride gegenüber AgNO 3
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 7.12.2010 Gruppe 7: Aldehyde und Carbonsäuren
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 7.12.2010 Gruppe 7: Aldehyde und Carbonsäuren
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 8.11.2010 Gruppe 7: Aldehyde und Carbonsäuren
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Katrin Hohmann Name: Johannes Hergt Datum: 8.11.2010 Gruppe 7: Aldehyde und Carbonsäuren
Sublimation & Resublimation
 Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent: Jan Schäfer Name: Johannes Hergt Datum: 28. Januar 2011 Gruppe 10: Amine, Aminosäuren und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent: Jan Schäfer Name: Johannes Hergt Datum: 28. Januar 2011 Gruppe 10: Amine, Aminosäuren und
Versuchsprotokoll: Ampel-Bottle - Experiment
 Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Philipps-Universität Marburg Organisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß Assistentin: Beate Abé
 Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes ergt Datum: 12.11.2010 Gruppe 1: Einführung in die organische
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes ergt Datum: 12.11.2010 Gruppe 1: Einführung in die organische
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent: Jan Schäfer Name: Johannes Hergt Datum: 3.2.2011 Gruppe 10: Amine, Aminosäuren und Peptide
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent: Jan Schäfer Name: Johannes Hergt Datum: 3.2.2011 Gruppe 10: Amine, Aminosäuren und Peptide
Versuchsprotokoll. Reaktivität von Alkylbromiden. Gruppe 5, Typ: Pflichtversuch. AgBr + HNO 3 + H 3 C C C C. AgBr + HNO 3 +
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Gruppe 2 eigener Versuch. Veränderung einer Kerzenflamme in Feuerzeuggas
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Versuchsprotokoll. Gummibärchen-Indikator
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
+ HBr. Gruppe 2 Pflichtversuch. Fotochemische Halogenierung des Toluols. Reaktion: h ν. Zeitbedarf: Versuchsdurchführung: Nachbereitung
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 9.12.2010 Gruppe 8: Ester, Fette, Seifen und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 9.12.2010 Gruppe 8: Ester, Fette, Seifen und
Gruppe 9 Pflichtversuch. Unterscheidung von Glucose und Fructose
 Philipps- Universität Marburg FB 1 hemie rganisch-hemisches Grundpraktikum für das Lehramt hristian Lego Leitung: err Dr. Reiß Datum:.06.09 SS 09 Gruppe 9 Pflichtversuch Unterscheidung von Glucose und
Philipps- Universität Marburg FB 1 hemie rganisch-hemisches Grundpraktikum für das Lehramt hristian Lego Leitung: err Dr. Reiß Datum:.06.09 SS 09 Gruppe 9 Pflichtversuch Unterscheidung von Glucose und
Gruppe 4 Pflichtversuch. Bromierung des Kerns von Toluol 40 % Menge R-Sätze S-Sätze Gefahrensymbole. 2 ml /
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 Pflichtversuch omierung des Kerns von Toluol
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 Pflichtversuch omierung des Kerns von Toluol
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Versuch 5: Diazotierung und Azokupplung Chemieteil, Frühlingssemester 2009
 Versuch 5: Diazotierung und Azokupplung Chemieteil, Frühlingssemester 2009 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 06.03.2009 Assistent: Esther Amstad E-Mail: zclaudio@student.ethz.ch
Versuch 5: Diazotierung und Azokupplung Chemieteil, Frühlingssemester 2009 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 06.03.2009 Assistent: Esther Amstad E-Mail: zclaudio@student.ethz.ch
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts Praktikumsleitung: Dr. Reiß WS 2010/11 Assistent(in): Julia Konen Name: Johannes Hergt Datum: 23.11.2010 Gruppe 3: Alkene, Alkine Versuch (Halogenierung):
Praktikum zur Organischen Chemie für Studierende des Lehramts Praktikumsleitung: Dr. Reiß WS 2010/11 Assistent(in): Julia Konen Name: Johannes Hergt Datum: 23.11.2010 Gruppe 3: Alkene, Alkine Versuch (Halogenierung):
Farbigkeit bei Molekülen Fluoreszenz Phosphoreszenz
 Farbigkeit bei Molekülen Im Unterschied zu einzelnen Atomen zeigen die Absorptionsspektren von Molekülen keine scharfen Linen, sondern breitere Absorptionsbanden. Die Moleküle absorbieren also nicht nur
Farbigkeit bei Molekülen Im Unterschied zu einzelnen Atomen zeigen die Absorptionsspektren von Molekülen keine scharfen Linen, sondern breitere Absorptionsbanden. Die Moleküle absorbieren also nicht nur
Versuchsprotokoll. Mischbarkeit von Alkoholen
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Mischbarkeit von Alkoholen Gruppe
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Mischbarkeit von Alkoholen Gruppe
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Synthese von Acetophenon
 Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose
![+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose + 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose](/thumbs/54/33374656.jpg) Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung)
 Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuch: Nachweis von Salicylsäure
 Philipps-Universität Marburg 11.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 12, Farb- und Wirkstoffe Versuch: Nachweis von Salicylsäure
Philipps-Universität Marburg 11.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 12, Farb- und Wirkstoffe Versuch: Nachweis von Salicylsäure
Br 1. Auch bei der folgenden Kombination, sind die Strukturen nicht identisch, sie lassen sich durch Drehung nicht ineinander überführen.
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME Drill&Practice: Arene. Sind folgende Strukturpaare zueinander identisch? Die Frage ist möglicherweise nicht so simpel, wie sie sich anhört. Gemeint
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME Drill&Practice: Arene. Sind folgende Strukturpaare zueinander identisch? Die Frage ist möglicherweise nicht so simpel, wie sie sich anhört. Gemeint
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 3: Alkene, Alkine Versuch: erstellung und
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 3: Alkene, Alkine Versuch: erstellung und
Rosa Geheimschrift. Durchführung
 Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
+ Na. Gruppe 4 vorgegebener Versuch. Reaktion aromatischer Ketone mit elementarem Natrium. Reaktion: Zeitbedarf: Versuchsdurchführung:
 Philipps- Universität Marburg FB 15 hemie rganisch-hemisches Grundpraktikum für das Lehramt hristian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 vorgegebener Versuch Reaktion aromatischer
Philipps- Universität Marburg FB 15 hemie rganisch-hemisches Grundpraktikum für das Lehramt hristian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 4 vorgegebener Versuch Reaktion aromatischer
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Darstellung von Malachitgrün Präparat 5
 Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe.
 2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
Versuchsprotokoll. Züchtung von Kandiszucker-Kristallen
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Versuch: Fäden spinnen Polymer aus Citronensäure und Glycerin
 Philipps-Universität Marburg 16.02.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 13, Polymere Versuch: Fäden spinnen Polymer aus Citronensäure
Philipps-Universität Marburg 16.02.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 13, Polymere Versuch: Fäden spinnen Polymer aus Citronensäure
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P )
 Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Versuch: Elektrophile Addition von Brom an Ethen
 Philipps-Universität Marburg 03.12.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 3, Alkene / Alkine Versuch: Elektrophile Addition von
Philipps-Universität Marburg 03.12.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 3, Alkene / Alkine Versuch: Elektrophile Addition von
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate
 Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
