Patienteninformation
|
|
|
- Georg Busch
- vor 7 Jahren
- Abrufe
Transkript
1 Patienteninformation Prüfzentrum (Name, Anschrift): Prüfarzt (Name/Telefon): Studienzentrale (Anschrift/Telefon): Studienleiter: Prof. Dr. med. M. Gregor, Universitätsklinikum Tübingen Dokumentationsassistentin: Fr. Dipl. Biol. U. Koppenhöfer Bitte lesen Sie den folgenden Text sorgfältig, bevor Sie eine Entscheidung treffen. Wenn Sie etwas nicht verstehen, fragen Sie bitte den für Sie zuständigen Prüfarzt. Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen besteht, wie Sie wissen, eine bösartige Erkrankung der Gallenblase bzw. Gallenwege. Es wird Ihnen deshalb vorgeschlagen, an der klinischen Prüfung Prospektive, multizentrische Phase-III-Studie zur ambulanten Therapie mit Capecitabin versus Cisplatin plus Capecitabin beim fortgeschrittenen Adenokarzinom der Gallenblase und Gallenwege teilzunehmen. Um bessere Behandlungsergebnisse bei Tumorerkrankungen zu erzielen, werden neue Medikamente, z.t. auch in Kombination mit lange bekannten Medikamenten gegen Krebserkrankungen, in klinischen Prüfungen untersucht. Wir möchten Sie mit Hilfe dieser Patienteninformation bitten, an einer solchen klinischen Prüfung teilzunehmen. Das Ziel und der Ablauf der klinischen Prüfung, der Nutzen sowie mögliche Risiken und Nebenwirkungen, die während dieser klinischen Prüfung auftreten können, werden im folgenden beschrieben. Welche Medikamente werden verwendet? In dieser klinischen Prüfung werden Sie nach dem Zufallsprinzip einem von zwei möglichen Therapiemöglichkeiten (Behandlungsarmen) zugelost.
2 Im Arm A wird ein Medikament eingesetzt: Capecitabin (Xeloda ) Im Arm B wird eine Medikamentenkombination verabreicht: Capecitabin (Xeloda ) kombiniert mit Cisplatin (Cis-GRY ). Capecitabin (Xeloda ) gehört zu den 5-Fluorouracil-(5-FU) Abkömmlingen. Capecitabin wird als Tablette eingenommen. Die darin enthaltenen Wirkstoffe wandeln sich vorrangig in den Krebszellen so um, daß sie in Wirkung und Nebenwirkungen der seit Jahren angewandten 5-FU-Infusion entsprechen. Capecitabin (Xeloda ) ist in Deutschland, den USA und in der Schweiz für die Therapie beim fortgeschrittenen Brustkrebs zugelassen. Die Zulassung für die Therapie fortgeschrittener Darmkrebserkrankungen wurde in Deutschland und Europa am durch die europäische Zulassungsbehörde erteilt. Cisplatin (Cis-GRY ) hemmt ebenfalls die Zellteilung und soll das unkontrollierte Wachstum von Krebszellen verhindern. Es wirkt über einen anderen Mechanismus als Capecitabin. Cisplatin ist als Einzeltherapie oder in Kombination mit anderen Medikamenten zur Therapie zahlreicher Krebserkrankungen zugelassen (z. B. Krebserkrankungen im Kopf-Hals-Bereich; Lungenkrebs, Harnblasenkrebs, Knochenkrebs, Eierstockkrebs, Hodenkrebs etc.). Sowohl Capecitabin (Xeloda ) als auch Cisplatin (Cisplatin Gry ) sind außerhalb von Studien bislang für die Therapie von Gallenblasen- und Gallenwegskarzinomen nicht zugelassen. Was ist das Ziel dieser klinischen Prüfung? Das Hauptziel dieser klinischen Prüfung ist es zu untersuchen, ob die Medikamentenkombination bestehend aus Cisplatin und Capecitabin der alleinigen Therapie mit Capecitabin in der Behandlung von Krebserkrankungen der Gallenblase und Gallenwege überlegen ist. Zur Risiko-/Nutzen-Bewertung der unterschiedlichen Therapiearme ist anzumerken, daß sowohl Capecitabin als Einzeltherapie als auch in Kombination mit Cisplatin innerhalb von klinischen Prüfungen bei Patienten mit Gallenblasen-/ Gallenwegskrebserkrankungen erfolgreich eingesetzt wurde. Trotzdem sind beide Substanzen wie oben erwähnt außerhalb von klinischen Studien bislang nicht für die Therapie von Gallenblasen- und Gallenwegskrebserkrankungen zugelassen. Es handelt es sich deshalb formal in beiden Therapiearmen um eine nicht erprobte (experimentelle) Therapie. Es ist möglich, daß die Therapie mit Cisplatin wirksamer als ohne Cisplatin ist. Andererseits ist das Auftreten von unerwünschten Nebenwirkungen unter der Kombinationstherapie mit Cisplatin generell wahrscheinlicher. Wie werden die Arzneimittel verabreicht? Die von Ihrem Prüfarzt berechnete tägliche Tablettenmenge für Capecitabin (2.500 mg/m 2 in der Therapie als Einzelsubstanz (Arm A) bzw mg/m 2 in der Kombinationstherapie mit Cisplatin nehmen Sie für 14 Tage aufgeteilt auf zwei Tagesdosen (jeweils mg/m 2 (Arm A) bzw. jeweils mg/m 2 (Arm B)), - 2 -
3 jeweils morgens und abends nach dem Essen mit etwas Flüssigkeit ein. Danach folgt eine 7- tägige Einnahmepause. Alle 3 Wochen wird dieser Rhythmus wiederholt. Cisplatin wird in Ihrer Klinik dreiwöchentlich über eine Körpervene als sogenannte intravenöse Infusion in einer Dosierung von 60 mg/m 2 über 1 Stunde verabreicht. Vor der Gabe von Cisplatin und danach erhalten Sie Elektrolyte und Flüssigkeit in Form von Kochsalzlösung sowie einer Zuckerlösung (jeweils 1 Liter vor und nach Cisplatin) über eine Körpervene verabreicht. Da Cisplatin eine Nierenschädigung hervorrufen kann, sollten Sie an den zwei Folgetagen nach der Gabe von Cisplatin jeweils mindestens 3 Liter Flüssigkeit über den Tag verteilt trinken. Wie lange werden die Arzneimittel verabreicht? Cisplatin und/oder Capecitabin erhalten Sie so lange, wie der Tumor kein Wachstum zeigt. Sollte sich bei Ihnen der Tumor komplett zurückbilden, wird die Therapie für vier weitere Zyklen fortgeführt. Ihr Prüfarzt wird mit Ihnen das Vorgehen genau besprechen. Welche Nebenwirkungen sind zu erwarten? Die im folgenden geschilderten Nebenwirkungen einer Behandlung mit Cisplatin und/oder Capecitabin können auftreten, wobei die Erfahrung gezeigt hat, dass diese Nebenwirkungen nach Absetzen der Medikamente in der Regel voll rückbildungsfähig sind (Aber: unter der Therapie mit Cisplatin (Arm B) können Hörschädigung, Nierenschädigung und Nervenschädigung in Einzelfällen bleibend sein). Unter der Kombinationstherapie ist es gegenüber der Einzeltherapie generell wahrscheinlicher, dass unerwünschte Nebenwirkungen eintreten. Eine Verringerung der Dosis oder eine Verlängerung der therapiefreien Zeit kann notwendig werden. Mögliche Nebenwirkungen: Insbesondere Übelkeit, Erbrechen, Durchfall, Schleimhautentzündungen im Mund sowie Reizungen der Bindehaut des Auges, Hautrötung und -schuppung, teilweise auch Empfindungsstörungen an Händen und Füßen mit Funktionseinschränkungen können auftreten, ebenso wie Müdigkeit, Störungen des Geschmacks und Haarausfall. In sehr seltenen Fällen können eine Mundschleimhautentzündung, die so schwer ist, dass die Nahrungsaufnahme nicht möglich ist oder schwerer Durchfall eine stationäre Behandlung zur Flüssigkeitsgabe und Ernährung erfordern. Es kann zu einer Verminderung von Blutzellen mit dem Risiko einer Blutarmut (Anämie), einer Blutungsneigung oder Infektion kommen. Es ist daher möglich, daß die Gabe von Blutbestandteilen (Bluttransfusionen) notwendig ist oder auch eine stationäre Aufnahme und ggf. eine intensivmedizinische Betreuung. Regelmäßige (wöchentliche) Blutuntersuchungen sind daher wichtig, um diese Veränderungen frühzeitig zu erkennen. Weiterhin können wie bei der Gabe jeglicher Medikamente auch allergische Reaktionen mit Hautausschlag, Atembeschwerden und, in sehr seltenen Fällen, auch mit allergischem Schock mit potentieller Todesfolge auftreten
4 Überdies können nach der intravenösen Infusion von Cisplatin auch lokale Reizerscheinungen und Venenentzündungen auftreten. Dosisabhängig, aber in Einzelfällen auch bereits nach einmaliger Gabe der Therapie mit Cisplatin, können Nierenfunktionsstörungen (mit nachfolgenden Elektrolytentgleisungen), Hörschäden (in Einzelfällen bis zum Hörverlust), und Nervenschädigungen auftreten. Cisplatin kann zu Unfruchtbarkeit bei Männern und bei Frauen führen und fruchtschädigend wirken. Sowohl unter Cispatin als auch unter Capecitabin sind in seltenen Fällen, vorrangig bei Patienten mit einer Vorerkrankung des Herzens, herzschädigende Nebenwirkungen aufgetreten, die sich durch Herzmuskelkrämpfe, Engegefühl hinter dem Brustbein, Herzrhytmusstörungen bis zum plötzlichen Herztod äußern können. Welche Untersuchungen werden vorgenommen? Die häufigen körperlichen Untersuchungen während der Therapie dienen dem rechtzeitigen Erkennen von Befindlichkeitsstörungen im Sinne von Nebenwirkungen. Es ist deshalb wichtig, daß Sie die von Ihnen selbst beobachteten Veränderungen vollständig und sofort Ihrem Prüfarzt mitteilen, damit er, falls erforderlich, Gegenmaßnahmen ergreifen kann. Überdies werden im Rahmen dieser klinischen Prüfung regelmäßige Blutuntersuchungen (1x/Woche), Elektrokardiogramme (EKG) zur Überprüfung der Herzfunktion, Röntgenuntersuchungen der Lunge (jeweils alle 3 Wochen) sowie Ultraschall- und computertomographische Untersuchungen des Oberbauches und Hörprüfungen durchgeführt (zu Beginn der klinischen Prüfung und nach 6 Wochen, dann alle 9 Wochen). Sinn dieser Untersuchungen ist es, neben der Feststellung Ihres allgemeinen körperlichen Gesundheitszustandes die genaue Ausbreitung und den Verlauf Ihrer Erkrankung zu erfassen. Um Informationen über den Einfluß einer Therapie mit Capecitabin und Cisplatin gegen Ihre Krebserkrankung auf Ihr tägliches Leben zu gewinnen, werden Sie anfangs nach 6 Wochen und später alle 12 Wochen gebeten, einen Fragebogen zur Lebensqualität auszufüllen. Unter bestimmten Voraussetzungen muß auch ein Schwangerschaftstest durchgeführt werden, um das Vorliegen einer Schwangerschaft auszuschließen. Über die notwendige Empfängnisverhütung wird eine Aufklärung durch den Prüfarzt erfolgen. Falls Sie im Verlauf der klinischen Prüfung trotzdem schwanger werden, müssen Sie sofort Ihren behandelnden Prüfarzt benachrichtigen. Worin besteht der mögliche Nutzen der klinischen Prüfung? Wir versprechen uns sowohl mit der Gabe von Capecitabin als auch mit der Kombinationstherapie bestehend aus Capecitabin und Cisplatin auch bei Ihnen einen Rückgang oder Stillstand der Erkrankung. Ob Capecitabin als Einzeltherapie genauso wirksam ist wie in der Kombination mit Cisplatin ist ungeklärt. Trotzdem sollte die Therapie in beiden Armen, bei generell guter Verträglichkeit, anderen bei Ihrer Erkrankungsform eingesetzten Therapien mindestens gleichwertig, wenn nicht - 4 -
5 überlegen sein. Die mit der Therapie in beiden Armen verbundenen geplanten Klinikkontakte sind gegenüber nahezu allen derzeit bei Ihrer Erkrankung eingesetzten Therapieformen vermindert. Andere Behandlungsmöglichkeiten Für Ihre Erkrankung stehen andere Behandlungsmöglichkeiten zur Verfügung. Diese könnten sein: andere Formen der Chemotherapie mit einer Einzelsubstanz oder eine Mehrfachtherapie und/oder eine Schmerztherapie und/oder eine Ernährungstherapie. Ihr Prüfarzt wird diese Möglichkeiten ausführlich mit Ihnen besprechen. Ist die Teilnahme an dieser klinischen Prüfung Pflicht? Die Teilnahme an dieser klinischen Prüfung ist freiwillig und selbstverständlich können Sie jederzeit Ihre Zusage zur Teilnahme zurückziehen. Es werden Ihnen hierdurch keinerlei Nachteile entstehen. Sie haben darüber hinaus jederzeit die Möglichkeit, sich mit Ihrem behandelnden Prüfarzt über den Fortgang der Therapie zu unterhalten. Die klinische Prüfung kann jedoch auch von den beteiligten Ärzten aus Gründen, die einen vorzeitigen Abbruch der klinischen Prüfung rechtfertigen, beendet werden. Auf Wunsch wird Ihnen Ihr Prüfarzt den Grund für die vorzeitige Beendigung der klinischen Prüfung erläutern. Selbstverständlich werden Sie auch in diesem Fall von Ihrem Prüfarzt nach bestem Wissen und Gewissen weiterbehandelt werden. Was ist zusätzlich zu beachten? Sollten Sie sich entschließen an der klinischen Prüfung teilzunehmen, werden Sie gebeten, folgende Punkte zu berücksichtigen: Bitte erscheinen Sie zu allen Kontrolluntersuchungen. Halten Sie bitte alle Anweisungen Ihres behandelnden Prüfarztes ein. Bitte informieren Sie Ihren Prüfarzt über alle Medikamente, die Sie zeitgleich zur klinischen Prüfung einnehmen. Bitte nennen Sie alle Begleiterkrankungen. Im Falle eines vorzeitigen Studienabbruchs kommen Sie bitte zur Abschlußuntersuchung. Versicherungsschutz Entsprechend dem deutschen Arzneimittelgesetz (AMG) wurde für Sie eine Versicherung bei dem Gerling-Konzern, Düsseldorf, abgeschlossen (Police-Nr: ). Voraussetzung für den Versicherungsschutz ist die Einhaltung folgender Hinweise: Sie dürfen sich einer anderen medizinischen Behandlung nur nach Rücksprache mit dem Sie im Rahmen dieser klinischen Prüfung betreuenden Prüfarzt unterziehen, außer im Notfall
6 Falls Sie an sich eine Gesundheitsschädigung beobachten oder vermuten, die als Folge der klinischen Prüfung eingetreten sein könnte, ist dies dem Versicherer unverzüglich anzuzeigen; die Anzeigepflicht erfaßt alle körperlichen Schäden, die in ursächlichem Zusammenhang mit der Anwendung der zu untersuchenden Medikamente oder mit einer Maßnahme, die im Zusammenhang mit der klinischen Prüfung durchgeführt wurde, stehen können. Sie können den Versicherer entweder selbst benachrichtigen oder sich zur Vereinfachung an Ihren Prüfarzt wenden, der dann in Ihrem Auftrag die Versicherung informiert. Sie dürfen erwarten, daß Sie eine Kopie dieser Anzeige erhalten. Sponsor Die Firma Hoffmann La Roche AG, Grenzach-Wyhlen, übernimmt als Co-Sponsor einen Teil der Finanzierung dieses Projekts. Meldung an die Behörden Die klinische Prüfung wurde entsprechend dem Arzneimittelgesetz von der Ethikkommission des Universitätsklinikums Tübingen begutachtet. Ein positives Ethikvotum wurde jeweils am (Version 2.0) und am (Amendment, Version 3.0) erteilt. Außerdem wurde die klinische Prüfung dem Bundesinstitut für Arzneimittel und Medizinprodukte sowie dem zuständigen Regierungspräsidium angezeigt. Fragen Falls Sie irgendwelche Fragen zu dieser klinischen Prüfung oder zu Ihren Rechten haben, wenden Sie sich bitte an Ihren Prüfarzt. Wichtige neue Informationen, die sich während der klinischen Prüfung ergeben und die Ihre Teilnahme an der klinischen Prüfung haben könnten, werden Ihnen sofort mitgeteilt. Vertraulichkeit / Datenschutz Während der Behandlung mit Arzneimitteln werden medizinische Befunde und persönliche Informationen von Ihnen erhoben und niedergeschrieben. Die Aufzeichnung der im Rahmen dieser klinischen Prüfung erhobenen Daten erfolgt zunächst in Originalunterlagen / Ihrer Krankenakte, in die Ihr Arzt auch bisher alle Befunde eingetragen hat. Die für die klinische Prüfung wichtigen Daten werden zusätzlich in anonymisierter Form in einen gesonderten Dokumentationsbogen eingetragen. Nach dem Deutschen Arzneimittelgesetz ist die Durchführung einer klinischen Prüfung nur zulässig, wenn Sie mit der Aufzeichnung Ihrer Krankheitsdaten und deren Weitergabe in anonymisierter Form an die zuständigen Gesundheitsbehörden (örtliche Überwachungsbehörden und Bundesgesundheitsbehörde) und, soweit dies zutrifft, an eine zentrale Auswertungsstelle im Auftrag einer Fachgesellschaft oder an - 6 -
7 den Arzneimittelhersteller einverstanden sind. Die anonymisierten Daten können auch an ausländische Gesundheitsbehörden weitergegeben werden. Um sicherzustellen, daß alle Daten korrekt aus den Originalunterlagen / Ihrer Krankenakte in die Dokumentationsbögen übertragen wurden, können die Eintragungen in die anonymisierten Dokumentationsbögen jedoch durch Angehörige staatlicher Gesundheitsbehörden und, wenn eine Fachgesellschaft / ein Arzneimittelhersteller beteiligt ist, durch besonders geschulte und zur Verschwiegenheit verpflichtete Mitarbeiter des Auftraggebers, sogenannte Monitore, mit den Originaldaten verglichen werden. Mit Ihrem Eiverständnis zur Teilnahme an dieser klinischen Prüfung entbinden Sie den Prüfarzt gegenüber den staatlichen Gesundheitsbehörden und gegenüber dem Monitor von seiner Schweigepflicht, insofern, als Gesundheitsbehörden und Monitor, soweit zur Überprüfung der korrekten Datenübertragung notwendig, Einsicht in die im Rahmen dieser klinischen Prüfung erfolgten Originalaufzeichnungen nehmen können. Bei Widerruf der Zustimmung zur klinischen Prüfung ist aus gesetzlichen Gründen für eine bestimmte Zeit keine Löschung der schon gewonnen Daten möglich. Unterschriften: um in die klinische Prüfung aufgenommen werden zu können, müssen Sie die Unterschriftsseite unterschreiben und mit Datum versehen. Wir danken Ihnen für Ihr Interesse an dieser klinischen Prüfung
Prospektive Phase-I/II-Studie zur Therapie mit Capecitabin, Mitomycin C und Oxaliplatin beim fortgeschrittenen Ösophaguskarzinom (CAMOXA-Studie)
 Prospektive Phase-I/II-Studie zur Therapie mit Capecitabin, Mitomycin C und Oxaliplatin beim fortgeschrittenen Ösophaguskarzinom (CAMOXA-Studie) Patienteninformation Prüfzentrum (Name, Anschrift): Prüfarzt
Prospektive Phase-I/II-Studie zur Therapie mit Capecitabin, Mitomycin C und Oxaliplatin beim fortgeschrittenen Ösophaguskarzinom (CAMOXA-Studie) Patienteninformation Prüfzentrum (Name, Anschrift): Prüfarzt
Patienteninformation
 Patienteninformation Bitte lesen Sie den folgenden Text sorgfältig, bevor Sie eine Entscheidung treffen. Wenn Sie etwas nicht verstehen, fragen Sie bitte den für Sie zuständigen Prüfarzt. Sehr geehrte
Patienteninformation Bitte lesen Sie den folgenden Text sorgfältig, bevor Sie eine Entscheidung treffen. Wenn Sie etwas nicht verstehen, fragen Sie bitte den für Sie zuständigen Prüfarzt. Sehr geehrte
Patienteninformation. zur Teilnahme an
 Prüfstelle: Patienteninformation zur Teilnahme an Randomisierte endokrine Therapieintervention bei postmenopausalen, hormonrezeptorpositiven Patientinnen mit dem Nachweis zirkulierender Tumorzellen im
Prüfstelle: Patienteninformation zur Teilnahme an Randomisierte endokrine Therapieintervention bei postmenopausalen, hormonrezeptorpositiven Patientinnen mit dem Nachweis zirkulierender Tumorzellen im
Patienteninformation
 Patienteninformation Prüfzentrum (Name, Anschrift): Prüfarzt (Name/Telefon): Studienzentrale (Anschrift/Telefon): Leiter der klinischen Prüfung: Prof. Dr. med. M. Gregor, Universitätsklinikum Tübingen
Patienteninformation Prüfzentrum (Name, Anschrift): Prüfarzt (Name/Telefon): Studienzentrale (Anschrift/Telefon): Leiter der klinischen Prüfung: Prof. Dr. med. M. Gregor, Universitätsklinikum Tübingen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
Einverständniserklärung:
 Zum Verbleib beim Patienten Einverständniserklärung: Name, Vorname...geb. am... wohnhaft in... Ich wurde ausreichend in mündlicher und schriftlicher Form über die klinische Studie Phase II Studie zur Therapie
Zum Verbleib beim Patienten Einverständniserklärung: Name, Vorname...geb. am... wohnhaft in... Ich wurde ausreichend in mündlicher und schriftlicher Form über die klinische Studie Phase II Studie zur Therapie
Informationsbroschüre für Patienten
 Haben Sie Gedächtnisprobleme? Schwierigkeiten, klar zu denken? Wenn das auf Sie oder auf jemanden in Ihrem Bekanntenkreis zutrifft, dann ziehen Sie bitte eine Teilnahme an der EMERGE- Studie in Betracht
Haben Sie Gedächtnisprobleme? Schwierigkeiten, klar zu denken? Wenn das auf Sie oder auf jemanden in Ihrem Bekanntenkreis zutrifft, dann ziehen Sie bitte eine Teilnahme an der EMERGE- Studie in Betracht
Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen
 Prüfstelle: Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen Simultaneous Study of Docetaxel Based Anthracycline Free Adjuvant Treatment Evaluation,
Prüfstelle: Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen Simultaneous Study of Docetaxel Based Anthracycline Free Adjuvant Treatment Evaluation,
Patienteninformation:
 Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Fragen und Antworten Für Patientinnen, die eine Teilnahme an der Studie LUX-Breast 1 in Betracht ziehen. Breast 1
 Fragen und Antworten Für Patientinnen, die eine Teilnahme an der Studie LUX-Breast 1 in Betracht ziehen LUX Breast 1 Einleitung Zurzeit führen wir eine klinische Studie durch, mit deren Hilfe wir weitere
Fragen und Antworten Für Patientinnen, die eine Teilnahme an der Studie LUX-Breast 1 in Betracht ziehen LUX Breast 1 Einleitung Zurzeit führen wir eine klinische Studie durch, mit deren Hilfe wir weitere
Patienteninformation zur EORTC Studie zur Behandlung von Analkarzinomen (Version Tübingen 2.1 vom )
 Universitätsklinikum Tübingen Eberhard-Karls-Universität Universitätsklinikum Tübingen Klinik für Radioonkologie Abteilung für Radioonkologie mit Poliklinik Hoppe-Seyler-Str. 3 D-72076 Tübingen Patienteninformation
Universitätsklinikum Tübingen Eberhard-Karls-Universität Universitätsklinikum Tübingen Klinik für Radioonkologie Abteilung für Radioonkologie mit Poliklinik Hoppe-Seyler-Str. 3 D-72076 Tübingen Patienteninformation
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie
 Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
PATIENTENINFORMATION. Caregiver Burden bei betreuenden Angehörigen schwer betroffener Parkinsonpatienten
 Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg. ZVR-Zahl Zahl p.a. Schloßhoferstrasse 4/4/12, 1210 Wien
 Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg ZVR-Zahl Zahl 295050213 p.a. Schloßhoferstrasse 4/4/12, 1210 Wien Patientenaufklärung und Patientendatenschutzrechtliche Zustimmungserklärung
Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg ZVR-Zahl Zahl 295050213 p.a. Schloßhoferstrasse 4/4/12, 1210 Wien Patientenaufklärung und Patientendatenschutzrechtliche Zustimmungserklärung
Patientenaufklärungs- und Informationshinweise
 Patientenaufklärungs- und Informationshinweise ZIELSETZUNG DER STUDIE Ihnen wird hiermit die Teilnahme an einer klinischen Studie angeboten. Ziel dieser Studie ist der klinische Ausgang und der Wirksamkeitsnachweis
Patientenaufklärungs- und Informationshinweise ZIELSETZUNG DER STUDIE Ihnen wird hiermit die Teilnahme an einer klinischen Studie angeboten. Ziel dieser Studie ist der klinische Ausgang und der Wirksamkeitsnachweis
PATIENTENINFORMATION UND EINVERSTÄNDNISERKLÄRUNG für die klinische Prüfung
 PATIENTENINFORMATION UND EINVERSTÄNDNISERKLÄRUNG für die klinische Prüfung Eine historisch-kontrollierte, einarmige, multizentrische, prospektive Studie zur Untersuchung der Sicherheit und Wirksamkeit
PATIENTENINFORMATION UND EINVERSTÄNDNISERKLÄRUNG für die klinische Prüfung Eine historisch-kontrollierte, einarmige, multizentrische, prospektive Studie zur Untersuchung der Sicherheit und Wirksamkeit
für die Patienten-Information und -Einwilligung zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten
 PROSTATITIS, ENTZÜNDUNG UND FRUCHTBARKEIT für die zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten Prüfstelle: Klinik für Urologie, Kinderurologie und Andrologie,
PROSTATITIS, ENTZÜNDUNG UND FRUCHTBARKEIT für die zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten Prüfstelle: Klinik für Urologie, Kinderurologie und Andrologie,
Mustertext. (Studienteilnehmer und schwangere Partnerin des Studienteilnehmers)
 Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
PATIENTEN- INFORMATIONSKARTE
 PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
Patienteninformation zur Studie
 Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
Behandlung mit. was Sie darüber wissen müssen
 Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie
 PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie Effekt einer Reduktion von tierischem Eiweiß auf den Verlauf einer bestehenden Krebserkrankung Sehr geehrte Teilnehmerin,
PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie Effekt einer Reduktion von tierischem Eiweiß auf den Verlauf einer bestehenden Krebserkrankung Sehr geehrte Teilnehmerin,
Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1
 Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1 Prüfstelle: Prüfarzt: Petrus-Krankenhaus Wuppertal Prof. Dr. med.
Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1 Prüfstelle: Prüfarzt: Petrus-Krankenhaus Wuppertal Prof. Dr. med.
Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen
 Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen Sehr geehrte Patientin, sehr geehrter Patient Wir laden Sie ein, an der
Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen Sehr geehrte Patientin, sehr geehrter Patient Wir laden Sie ein, an der
Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen
 Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen Studienstelle: Klinik für Nephrologie Universitätsklinikum Düsseldorf Moorenstr.
Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen Studienstelle: Klinik für Nephrologie Universitätsklinikum Düsseldorf Moorenstr.
Patienteninformation und Einverständniserklärung zur Teilnahme an der klinischen Prüfung
 Patienteninformation und Einverständniserklärung zur Teilnahme an der klinischen Prüfung Effekte von Nifedipin auf die Eisenhomeostase bei Patienten mit Hämochromatose (ENIO) Sehr geehrter Patient! Wir
Patienteninformation und Einverständniserklärung zur Teilnahme an der klinischen Prüfung Effekte von Nifedipin auf die Eisenhomeostase bei Patienten mit Hämochromatose (ENIO) Sehr geehrter Patient! Wir
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie Der Einfluss von kontrollierter Bewegung und balneologischer Therapie bei PatientInnen mit chronischen unspezifischen
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie Der Einfluss von kontrollierter Bewegung und balneologischer Therapie bei PatientInnen mit chronischen unspezifischen
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patienteninformation und Einwilligungserklärung. zur Teilnahme am Nephronophthise-Register
 Patienteninformation und Einwilligungserklärung zur Teilnahme am Nephronophthise-Register Auftraggeber der Studie: Prof. Dr. med. Heymut Omran Direktor der Klinik und Poliklinik für Kinder- und Jugendmedizin
Patienteninformation und Einwilligungserklärung zur Teilnahme am Nephronophthise-Register Auftraggeber der Studie: Prof. Dr. med. Heymut Omran Direktor der Klinik und Poliklinik für Kinder- und Jugendmedizin
Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC)
 Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC) Prüfstelle: Prüfarzt: Patienteninformation zur Teilnahme an Randomisierte
Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC) Prüfstelle: Prüfarzt: Patienteninformation zur Teilnahme an Randomisierte
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
Studie zur Sicherheit von Flugreisen bei Patienten mit Pulmonaler Hypertonie (jeglicher Genese)
 Prüfstelle: Abteilung Pneumologie und Intensivmedizin der Medizinischen Klinik II Uniklinik Gießen und Marburg Standort Gießen Klinikstr. 33, 35392 Gießen Telefon: 0641 985 42352 Prüfärzte: Prof. Dr. A.
Prüfstelle: Abteilung Pneumologie und Intensivmedizin der Medizinischen Klinik II Uniklinik Gießen und Marburg Standort Gießen Klinikstr. 33, 35392 Gießen Telefon: 0641 985 42352 Prüfärzte: Prof. Dr. A.
Offene (konventionelle) versus laparoskopische Magenresektion beim Magenkarzinom
 Patienteninformation Offene (konventionelle) versus laparoskopische Magenresektion beim Magenkarzinom Sehr geehrte, liebe Patientin, sehr geehrter, lieber Patient, ihr behandelnder Chirurg hat Sie bereits
Patienteninformation Offene (konventionelle) versus laparoskopische Magenresektion beim Magenkarzinom Sehr geehrte, liebe Patientin, sehr geehrter, lieber Patient, ihr behandelnder Chirurg hat Sie bereits
wir möchten Sie fragen, ob Sie bereit sind, an der von uns vorgesehenen klinischen Studie teilzunehmen.
 Universitätsklinikum Essen. Neurologische Klinik und Poliklinik. Hufelandstr. 55. 45122 Essen Sehr geehrte Dame, sehr geehrter Herr, wir möchten Sie fragen, ob Sie bereit sind, an der von uns vorgesehenen
Universitätsklinikum Essen. Neurologische Klinik und Poliklinik. Hufelandstr. 55. 45122 Essen Sehr geehrte Dame, sehr geehrter Herr, wir möchten Sie fragen, ob Sie bereit sind, an der von uns vorgesehenen
Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie
 Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie Gesucht: Patienten mit progressiver supranukleärer Blickparese (PSP) für PASSPORT-Studie PSP betrifft 5 6 von 100.000 Personen. Einige
Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie Gesucht: Patienten mit progressiver supranukleärer Blickparese (PSP) für PASSPORT-Studie PSP betrifft 5 6 von 100.000 Personen. Einige
PATIENTENINFORMATION Medikamente im Krankenhaus
 PATIENTENINFORMATION Medikamente im Krankenhaus Liebe Patientin, lieber Patient, sehr geehrte Angehörige, Ihre Gesundheit liegt uns sehr am Herzen. Deshalb kümmert sich während Ihres Krankenhausaufenthalts
PATIENTENINFORMATION Medikamente im Krankenhaus Liebe Patientin, lieber Patient, sehr geehrte Angehörige, Ihre Gesundheit liegt uns sehr am Herzen. Deshalb kümmert sich während Ihres Krankenhausaufenthalts
PATIENTENINFORMATION. Nationales Klinisches Amyloidose-Register
 UniversitätsKlinikum Heidelberg Medizinische Klinik Universitätsklinikum Heidelberg Im Neuenheimer Feld 410 69120 Heidelberg Medizinische Klinik (Krehl-Klinik) Abteilung Innere Medizin V Hämatologie, Onkologie
UniversitätsKlinikum Heidelberg Medizinische Klinik Universitätsklinikum Heidelberg Im Neuenheimer Feld 410 69120 Heidelberg Medizinische Klinik (Krehl-Klinik) Abteilung Innere Medizin V Hämatologie, Onkologie
Diskussionsleitfaden für Studienteilnehmer von klinischen Studien
 Diskussionsleitfaden für Studienteilnehmer von klinischen Studien Sehr geehrte Frau [last name], / Sehr geehrter Herr [last name], vielen Dank, dass Sie sich Zeit nehmen, um über eine Teilnahme an einer
Diskussionsleitfaden für Studienteilnehmer von klinischen Studien Sehr geehrte Frau [last name], / Sehr geehrter Herr [last name], vielen Dank, dass Sie sich Zeit nehmen, um über eine Teilnahme an einer
Informationsschrift. Momentum Projekt Heidelberg Aktiver Umgang mit einer Krebserkrankung
 Informationsschrift Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer, Zweck der Studie Der Umgang mit einer Krebserkrankung kann sehr unterschiedlich ausfallen: Jede/r Betroffene findet andere Wege,
Informationsschrift Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer, Zweck der Studie Der Umgang mit einer Krebserkrankung kann sehr unterschiedlich ausfallen: Jede/r Betroffene findet andere Wege,
WICHTIGE INFORMATIONEN FÜR PATIENTEN
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
Informationsbroschüre für Patienten Was Sie wissen müssen
 Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung... (Vollständiger Titel der klinischen Prüfung in Deutscher Sprache) Sehr geehrte Patientin, sehr geehrter Patient!
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung... (Vollständiger Titel der klinischen Prüfung in Deutscher Sprache) Sehr geehrte Patientin, sehr geehrter Patient!
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Patienteninformation und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung
 Patienteninformation und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung EINE RANDOMISIERTE, MULTIZENTRISCHE, PROSPEKTIVE, BEOBACHTER UND PATIENTEN VERBLINDETE STUDIE ZUR BEURTEILUNG VON
Patienteninformation und Einwilligungserklärung zur Teilnahme an der klinischen Prüfung EINE RANDOMISIERTE, MULTIZENTRISCHE, PROSPEKTIVE, BEOBACHTER UND PATIENTEN VERBLINDETE STUDIE ZUR BEURTEILUNG VON
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
PACKUNGSBEILAGE. Seite 1 von 5
 PACKUNGSBEILAGE Seite 1 von 5 Gebrauchsinformation: Information für Anwender Hepa-Merz 3 g Granulat Wirkstoff: Ornithinaspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PACKUNGSBEILAGE Seite 1 von 5 Gebrauchsinformation: Information für Anwender Hepa-Merz 3 g Granulat Wirkstoff: Ornithinaspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
- 1 - MCL younger (version 2.2 d, 7.6.2004)
 Patienten-Information zur Europäischen Mantelzell-Lymphom-Studie Wirksamkeit von 3 Doppelzyklen R-CHOP/R-DHAP mit anschließendem Ara-C-haltigem myeloablativem Regime und autologer Stammzell-Transplantation
Patienten-Information zur Europäischen Mantelzell-Lymphom-Studie Wirksamkeit von 3 Doppelzyklen R-CHOP/R-DHAP mit anschließendem Ara-C-haltigem myeloablativem Regime und autologer Stammzell-Transplantation
auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
 Seite 4 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Folsäure Heumann 5 mg Tabletten Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Seite 4 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Folsäure Heumann 5 mg Tabletten Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Sie stehen nun vor der Entscheidung, an einer weiteren Studie teilzunehmen, die begleitend zu den o.g. Studien durchgeführt wird.
 Patienteninformation 1 PATIENTENINFORMATION Multizentrische randomisierte Phase-III-Studie zur Bestimmung von Effektivität und Sicherheit von Rasburicase (Fasturtec ) im Vergleich zu Allopurinol zur Behandlung
Patienteninformation 1 PATIENTENINFORMATION Multizentrische randomisierte Phase-III-Studie zur Bestimmung von Effektivität und Sicherheit von Rasburicase (Fasturtec ) im Vergleich zu Allopurinol zur Behandlung
Patienteninformation
 Radiofrequenzablation und Chemotherapie mit Oxaliplatin/5- FU/Folinsäure bei Patienten mit inoperablen Lebermetastasen bei kolorektalen Karzinomen Patienteninformation Sehr geehrte Patientin, sehr geehrter
Radiofrequenzablation und Chemotherapie mit Oxaliplatin/5- FU/Folinsäure bei Patienten mit inoperablen Lebermetastasen bei kolorektalen Karzinomen Patienteninformation Sehr geehrte Patientin, sehr geehrter
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
MUSTERTEXT. empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen gemäß Beschluss vom *
 MUSTERTEXT für die Information und Einwilligung von Kindern im Alter von etwa 7-11 Jahren, die an einer klinischen Prüfung eines Arzneimittels teilnehmen empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen
MUSTERTEXT für die Information und Einwilligung von Kindern im Alter von etwa 7-11 Jahren, die an einer klinischen Prüfung eines Arzneimittels teilnehmen empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen
Patientinnen-Information: Teil 2 (TRAFO-Projekt)
 Patientinnen-Information: Teil 2 (TRAFO-Projekt) Name und Anschrift der Einrichtung, in der die die klinische Prüfung durchgeführt wird (Prüfzentrum/Studienleiter) sowie Name und Telefon-Nummer des/r aufklärenden
Patientinnen-Information: Teil 2 (TRAFO-Projekt) Name und Anschrift der Einrichtung, in der die die klinische Prüfung durchgeführt wird (Prüfzentrum/Studienleiter) sowie Name und Telefon-Nummer des/r aufklärenden
Patienteninformation Teil 2 Untersuchung der Erbsubstanz (genetische und epigenetische Untersuchung) der Blutproben für das
 Technische Universität München Leiter des Forschungsvorhaben Univ.-Prof. Dr. Wolfgang Dott Direktor des Instituts für Hygiene und Umweltmedizin Pauwelsstr. 30 D 52074 Aachen Telefon (+49) 0241 80 88 385
Technische Universität München Leiter des Forschungsvorhaben Univ.-Prof. Dr. Wolfgang Dott Direktor des Instituts für Hygiene und Umweltmedizin Pauwelsstr. 30 D 52074 Aachen Telefon (+49) 0241 80 88 385
Aflibercept (Zaltrap) bei metastasiertem Darmkrebs
 verstehen abwägen entscheiden Aflibercept (Zaltrap) bei metastasiertem Darmkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
verstehen abwägen entscheiden Aflibercept (Zaltrap) bei metastasiertem Darmkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
KLINISCHE STUDIEN KOMPAKT
 KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
Rivoltan Teufelskralle 480 mg wird angewendet zur unterstützenden Behandlung bei Verschleißerscheinungen des Bewegungsapparates.
 Gebrauchsinformation: Information für Patienten Rivoltan Teufelskralle 480 mg, Filmtabletten Für Erwachsene Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Rivoltan Teufelskralle 480 mg, Filmtabletten Für Erwachsene Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Aspecton Hustensaft Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustensaft Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 1 Jahr Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustensaft Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 1 Jahr Lesen Sie die gesamte Packungsbeilage sorgfältig
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
 'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender GRANU FINK BLASE Wirkstoffe: 1 Hartkapsel enthält: Kürbissamen, zerkleinert 400 mg Kürbissamenöl
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender GRANU FINK BLASE Wirkstoffe: 1 Hartkapsel enthält: Kürbissamen, zerkleinert 400 mg Kürbissamenöl
W. Spitzner Arzneimittelfabrik GmbH
 Seite: 1 von 5 3. Packungsbeilage Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage/Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
Seite: 1 von 5 3. Packungsbeilage Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage/Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
Erläuterungen zur Einwilligungserklärung
 Erläuterungen zur Einwilligungserklärung Leisten Sie einen Beitrag zur medizinischen Forschung Liebe Patientin, Lieber Patient Dank der medizinischen Forschung leisten die Ärzte und Wissenschaftler der
Erläuterungen zur Einwilligungserklärung Leisten Sie einen Beitrag zur medizinischen Forschung Liebe Patientin, Lieber Patient Dank der medizinischen Forschung leisten die Ärzte und Wissenschaftler der
Patienteninformation zur Molekularen Diagnostik und Therapie
 KLINIKUM DER UNIVERSITÄT MÜNCHEN CAMPUS GROSSHADERN CAMPUS INNENSTADT KREBSZENTRUM MÜNCHEN COMPREHENSIVE CANCER CENTER CCC LMU Patienteninformation zur Molekularen Diagnostik und Therapie 3 Sehr geehrte
KLINIKUM DER UNIVERSITÄT MÜNCHEN CAMPUS GROSSHADERN CAMPUS INNENSTADT KREBSZENTRUM MÜNCHEN COMPREHENSIVE CANCER CENTER CCC LMU Patienteninformation zur Molekularen Diagnostik und Therapie 3 Sehr geehrte
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP)
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
ChroPacStudie. zum Vergleich von zwei chirurgischen Techniken bei chronischer Bauchspeicheldrüsenentzündung
 ChroPac- eine randomisierte, kontrollierte multizentrische Studie zum Vergleich von zwei chirurgischen Techniken bei chronischer Bauchspeicheldrüsenentzündung ChroPac-Duodenum preserving head resection
ChroPac- eine randomisierte, kontrollierte multizentrische Studie zum Vergleich von zwei chirurgischen Techniken bei chronischer Bauchspeicheldrüsenentzündung ChroPac-Duodenum preserving head resection
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Einwilligungserklärung zur klinischen Prüfung: Teil 2 (vor Studienaufnahme)......
 Einwilligungserklärung zur klinischen Prüfung: Teil 2 (vor Studienaufnahme) Name und Anschrift der Einrichtung, in der die klinische Prüfung durchgeführt wird (Prüfzentrum) Name und Telefon-Nummer des/r
Einwilligungserklärung zur klinischen Prüfung: Teil 2 (vor Studienaufnahme) Name und Anschrift der Einrichtung, in der die klinische Prüfung durchgeführt wird (Prüfzentrum) Name und Telefon-Nummer des/r
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE
 LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Pelargonium Zentiva Erkältungslösung Flüssigkeit zum Einnehmen Zur Anwendung bei Erwachsenen und Kindern ab 6 Jahren Wirkstoff: Pelargoniumwurzel-Tinktur
Gebrauchsinformation: Information für Anwender Pelargonium Zentiva Erkältungslösung Flüssigkeit zum Einnehmen Zur Anwendung bei Erwachsenen und Kindern ab 6 Jahren Wirkstoff: Pelargoniumwurzel-Tinktur
LEITFADEN FÜR PATIENTINNEN
 LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
Patienteninformation zur Behandlung der Psoriasis mit Methotrexat
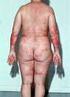 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
6,69 g Thymiankraut-Dickextrakt in 100 ml Flüssigkeit zum Einnehmen
 Gebrauchsinformation: Information für Anwender Aspecton Hustensaft 6,69 g Thymiankraut-Dickextrakt in 100 ml Flüssigkeit zum Einnehmen für Erwachsene und Kinder ab 1 Jahr Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Aspecton Hustensaft 6,69 g Thymiankraut-Dickextrakt in 100 ml Flüssigkeit zum Einnehmen für Erwachsene und Kinder ab 1 Jahr Lesen Sie die gesamte Packungsbeilage
- Patienteninformation / Merkblatt. Sehr geehrte Patientin, sehr geehrter Patient,
 Universitätsklinikum Chirurgische Klinik SDGC Im Neuenheimer Feld 110 69120 Heidelberg PORTAS-3: Multizentrische, randomisierte, kontrollierte Studie (RCT) zum Vergleich der Komplikationsraten der offenen
Universitätsklinikum Chirurgische Klinik SDGC Im Neuenheimer Feld 110 69120 Heidelberg PORTAS-3: Multizentrische, randomisierte, kontrollierte Studie (RCT) zum Vergleich der Komplikationsraten der offenen
Bei Ihnen soll eine Leberbiopsie durchgeführt werden. Zu dieser Untersuchung erhalten Sie beiliegend:
 EINVERSTÄNDNIS LEBERBIOPSIE (Information für Patienten, Einverständniserklärung) Sehr geehrte Patientin Sehr geehrter Patient Bitte lesen Sie die vorliegenden Unterlagen sofort nach Erhalt durch. Füllen
EINVERSTÄNDNIS LEBERBIOPSIE (Information für Patienten, Einverständniserklärung) Sehr geehrte Patientin Sehr geehrter Patient Bitte lesen Sie die vorliegenden Unterlagen sofort nach Erhalt durch. Füllen
Patienteninformation zur klinischen Studie:
 UniversitätsKlinikum Heidelberg Universitätsklinikum Heidelberg INF 400 69120 Heidelberg Radiologische Klinik Abteilung RadioOnkologie und Strahlentherapie -Czernyklinik- Patienteninformation zur klinischen
UniversitätsKlinikum Heidelberg Universitätsklinikum Heidelberg INF 400 69120 Heidelberg Radiologische Klinik Abteilung RadioOnkologie und Strahlentherapie -Czernyklinik- Patienteninformation zur klinischen
Aktuelle Aspekte zur Chemotherapie. Dr. med. Alexandra Coumbos GYN ZENTRUM BERLIN Gynäkologisch-onkologische Schwerpunktpraxis
 Aktuelle Aspekte zur Chemotherapie Dr. med. Alexandra Coumbos GYN ZENTRUM BERLIN Gynäkologisch-onkologische Schwerpunktpraxis Historie Möglichst tumorfreie Operation, kein Tumorrest Platinhaltige Chemotherapie
Aktuelle Aspekte zur Chemotherapie Dr. med. Alexandra Coumbos GYN ZENTRUM BERLIN Gynäkologisch-onkologische Schwerpunktpraxis Historie Möglichst tumorfreie Operation, kein Tumorrest Platinhaltige Chemotherapie
GLIOBLASTOM-THERAPIE MIT OPTUNE
 GLIOBLASTOM-THERAPIE MIT OPTUNE 2 «Am Anfang war ich etwas skeptisch, ob sich denn diese Therapie auch so in den Alltag integrieren lässt, wie einem das versprochen wird. Ich brauchte etwas Zeit, bis ich
GLIOBLASTOM-THERAPIE MIT OPTUNE 2 «Am Anfang war ich etwas skeptisch, ob sich denn diese Therapie auch so in den Alltag integrieren lässt, wie einem das versprochen wird. Ich brauchte etwas Zeit, bis ich
UniversitätsKlinikum Heidelberg
 Chirurgische Universitätsklinik Im Neuenheimer Feld 110 D-69120 Heidelberg Studienleitung Prof. Dr.med. Jürgen Weitz, Leiter der Sektion Chirurgische Onkologie der Chirurgischen Universitätsklinik Studienkoordination
Chirurgische Universitätsklinik Im Neuenheimer Feld 110 D-69120 Heidelberg Studienleitung Prof. Dr.med. Jürgen Weitz, Leiter der Sektion Chirurgische Onkologie der Chirurgischen Universitätsklinik Studienkoordination
*400058* Fragebogen zu Herz- und Kreislauferkrankungen. Postfach Oberursel. Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum:
 ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu Herz- und Kreislauferkrankungen 1. Welche Erkrankungen oder Beeinträchtigungen
ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu Herz- und Kreislauferkrankungen 1. Welche Erkrankungen oder Beeinträchtigungen
Erivedge Schwangerschaftsverhütungs-Programm:
 Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Meno Albin Tabletten
 1 Gebrauchsinformation: Information für Anwender Meno Albin Tabletten Wirkstoff: Trockenextrakt aus dem Wurzelstock der Traubensilberkerze (Cimicifugae rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Gebrauchsinformation: Information für Anwender Meno Albin Tabletten Wirkstoff: Trockenextrakt aus dem Wurzelstock der Traubensilberkerze (Cimicifugae rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten. rz_jin_patientenbroschuere_a4_2017.indd :58
 JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
Versicherteninformation. Versicherteninformation. Besondere Versorgung (DAK-Spezialisten-Netzwerk) BC72IV028 / DA003
 Besondere Versorgung (DAK-Spezialisten-Netzwerk) Anlage 8 zum Diabetes-Vertrag mit der Kassenärztlichen Vereinigung Berlin Vertrags-Nr.: BC72IV028 / 171722DA003 Versicherteninformation Versicherteninformation
Besondere Versorgung (DAK-Spezialisten-Netzwerk) Anlage 8 zum Diabetes-Vertrag mit der Kassenärztlichen Vereinigung Berlin Vertrags-Nr.: BC72IV028 / 171722DA003 Versicherteninformation Versicherteninformation
