Gase. Eigenschaften, Gasgesetze, techn. Anwendungen & wichtige Gase. Mag. Gerald Trutschl
|
|
|
- Horst Busch
- vor 7 Jahren
- Abrufe
Transkript
1 Gase Eigenschaften, Gasgesetze, techn. Anwendungen & wichtige Gase Mag. Gerald Trutschl 1
2 Inhalt 1. Aggregatzustande 2. Eigenschaften der Gasteilchen 3. Atmosphäre 4. Gasgesetze 5. Joule Thomson Effekt und Lindeverfahren 6. Löslichkeit von Gasen 7. Wichtige Gase 2
3 1. Aggregatzustände Gas Gas ist ein Aggregatzustand eines Stoffes. Durch Änderung der Parameter wie Druck oder Temperatur lässt sich dieser verändern. gasförmig fest schmelzen erstarren flüssig 3
4 1. Aggregatzustände Eigenschaften Aggregatzustand Volumenbeständigkeit Formbeständigkeit Ordnungsmerkmal Gase nein nein keines Flüssigkeiten ja nein (teilweise) H-Brückenbindungen Festkörper ja ja ja (Molekül-,Metall-, Ionengitter) 4
5 2. Eigenschaften der Gasteilchen ideale Gase Eigenschaften idealer Gase: Die Gasteilchen bewegen sich geradlinig bis zu einer Kollision mit einem Objekt oder anderen Gasteilchen. Zwischen den Gasteilchen herrscht keine (bis sehr schwache) Wechselwirkung zw. den Gasteilchen ist relativ viel Platz 1mol Gas (= 6,022*10 23 Teilchen) füllt unter Normalbedingungen (25 C & 1013,25hPa) ein Volumen von 22,41Liter. Bei gleicher Temperatur besitzen alle Gasteilchen die selbe kinetische Energie. E=(m*v²)/2 Gasteilchen sind in einem Raum homogen (gleichmäßig) verteilt. 5
6 3. Atmosphäre Luft Luft besteht aus: 6
7 2. Atmosphäre Luft Restgase / Spurengase: Wasserstoff Helium, Argon, Neon, Xenon, Radon Kohlenstoffdioxid CO 2 Methangas CH 4 Stickoxide Ozon O 3 7
8 3. Atmosphäre Kohlenstoffdioxid Kohlenstoffdioxidanteil steigt stetig durch die Verbrennung von fossilen Brennstoffen. 2015: 394ppm (0,0394%) Mauna Loa Carbon Dioxide-de von Mauna_Loa_Carbon_Dioxide-en.svg: Sémhurderivative work: Spitzl (talk) - Mauna_Loa_Carbon_Dioxide-en.svg. Lizenziert unter CC BY-SA 3.0 über Wikimedia Commons - #/media/file:mauna_loa_carbon_dioxide-de.svghttps://commons.wikimedia.org/wiki/file:mauna_loa_carbon_dioxidede.svg 8
9 3. Atmosphäre Kohlenstoffdioxid Kohlenstoffdioxid ist verantwortlich neben Methangas am Treibhauseffekt sowie an der globalen Erderwärmung da es IR- Strahlung reflektiert. Innerhalb eines Jahres schwankt der CO 2 Gehalt, da die Landmasse auf der Nordhalbkugel größer ist und hier im Frühjahr und Sommer (Blätter auf Bäumen) mehr CO 2 gebunden werden kann. Neben dem Wald sind auch die Ozeane große CO 2 -Senken (Senke = Aufnahme eines Stoffes). Damit werden aber die Ozeane saurer. (Kohlensäure entsteht) 9
10 3. Atmosphäre Aufbau der Atmosphäre Schichten der Erdatmosphäre: Exosphäre Ionosphäre 500km Mesopause Thermosphäre 80km Stratopause Tropopause Mesosphäre Stratosphäre Troposphäre 50km 12-15km 10
11 3. Atmosphäre Aufbau der Atmosphäre Die internationale Standardatmosphäre ISA: Druck p auf MSL (Mean Sea Level): 1013,25hPa Temperatur T auf MSL: 15 C Dichte: 1,225kg/m³ Feuchte: 0% rel. Temperaturabnahme: -0,65 C/100m (2 C/1000ft) Druckabnahme: m => 1hPa/8m m => 1hPa/16m 11
12 3. Gasgesetze keine Volumenbeständigkeit Das Volumen der Gase ist nicht beständig, sofern sich Temperatur und Druck ändern! Zusätzlich ändert sich das Volumen mit der Gasteilchenanzahl. 12
13 4. Gasgesetze Gesetz von Boyle und Mariotte Gesetz von R. Boyle und E. Mariotte Je höher der Druck einer bestimmten Gasteilchenmenge, desto kleiner das Volumen! p p 1 *V 1 = p 2 *V 2 T = konstant V 13
14 4. Gasgesetze Gesetz vongay Lussac Gesetz von Gay Lussac Je höher die Temperatur einer bestimmten Gasteilchenmenge, desto größer das Volumen! V p = konstant V 1 /T 1 = V 2 /T 2 T 14
15 4. Gasgesetze Allgemeines Gasgesetz Dadurch sich das Volumen von Gas durch Druck, Temperatur und Teilchenanzahl ändert, formulierte man die allgemeine Gasgleichung die alle Parameter berücksichtigt. V=f(p,n,T) p*v=n*r*t 15
16 4. Gasgesetze Druckeinheiten Die einzige zulässige Druckeinheit in der Chemie und Physik (SI-Einheiten) ist Pascal! 1Pa= 1N/m² Andere Druckeinheiten in der Verwendung: 1bar = Pa = 100kPa =1000hPa 1atm = Pa 1torr = 133,32Pa 1psi = 6 894,8Pa 16
17 5. Joule Thomson Effekt Kühleffekt Joule Thomson Effekt: Generell herrscht zwischen den Gasen herrscht eine Wechselwirkung (gegenseitige Anziehungskraft) p 1 >p 2 ; T 1 >T 2 Wird ein komprimiertes Gas dekomprimiert so nimmt die Temperatur ab, da die Teilchen aus physikalischer Sicht Arbeit verrichten. Sie müssen gegen die Anziehungskraft einen Weg zurücklegen W=F*s weil sie sich voneinander entfernen. 17
18 5. Lindeverfahren flüssige Luft Produktion flüssiger Luft: schematisches Prinzip Ventil Wärmetauscher Ventil Düse: Joule Thomson Effekt Ventil frische Luft Kompressor (200bar) Isoliertes Sammelgefäß für flüssige Luft 18
19 5. Lindeverfahren flüssige Luft Produktion flüssiger Luft: schematisches Prinzip Der Kompressor saugt frische Luft an, komprimiert die Luft wobei sie sich dabei erwärmt. Im Wärmetauscher erfolgt die Kühlung. Erst in der Düse erfolgt der Joule Thomson Effekt und die Verflüssigung der Luft Siedepunkt O 2 : -196 C Siedepunkt N 2 : -183 C 19
20 6. Joule Thomson Effekt Kühlschrank Löslichkeit von Gasen in Wasser Je kälter das Wasser und je höher der Druck desto besser ist Gas in Wasser löslich! Prinzip des kleinsten Zwanges: Le-Chartelier Taucherkrankheit: Wenn ein Taucher tief taucht (hoher Druck), dann löst sich viel Stickstoff im Blut. Taucht er zu schnell auf, kann sich das Gas im Blut nicht mehr lösen und das Blut schäumt auf. => tödlich! 20
21 7. Wichtige Gase Stickstoff N 2 Stickstoff ist ein Inertgas. Es reagiert nur schwer mit anderen Stoffen. Verwendung: Inertgas beim Schweißen Kühlflüssiggas im Labor Reifengas in Flugzeugen Treibgas bei Schlagsahne aus der Dose zur Ammoniaksynthese (=> Düngestoffproduktion) 21
22 7. Wichtige Gase Sauerstoff reaktives Gas fördert Oxidationen häufigstes Element der Erde Verwendung: Mensch und Tier als Atemgas Medizin/Notfallmedizin Stahl Produktion Frischen Schweißbrenngasmischung mit Acetylen Raketentreibstoff (Oxidationsmittel) 22
23 7. Wichtige Gase Ozon Starkes Oxidationsmittel Absorbiert UV-Strahlung Ozonschicht: 35km Höhe bläuliches Gas Verwendung/Nutzen: Wasserdesinfektion Geruchseliminierung Ozon wird am Boden künstlich hergestellt aus reinem Sauerstoff unter Hochspannungsentladungen (Ionisation) 23
24 7. Wichtige Gase Methan Erdgas klimaschädlich entsteht bei Faulprozessen Entsteht im Verdauungstrakt von Wiederkäuern Verwendung: Brenngas, Heizen 24
Fernerkundung der Erdatmosphäre
 Fernerkundung der Erdatmosphäre Dr. Dietrich Feist Max-Planck-Institut für Biogeochemie Jena Max Planck Institut für Biogeochemie Foto: Michael Hielscher Max Planck Institut für
Fernerkundung der Erdatmosphäre Dr. Dietrich Feist Max-Planck-Institut für Biogeochemie Jena Max Planck Institut für Biogeochemie Foto: Michael Hielscher Max Planck Institut für
Die Atmosphären der Erde, der Planeten unseres Sonnensystems und der Exoplaneten
 Research Collection Report Die Atmosphären der Erde, der Planeten unseres Sonnensystems und der Exoplaneten Author(s): Brüesch, Peter Publication Date: 2016 Permanent Link: https://doi.org/10.3929/ethz-a-010580523
Research Collection Report Die Atmosphären der Erde, der Planeten unseres Sonnensystems und der Exoplaneten Author(s): Brüesch, Peter Publication Date: 2016 Permanent Link: https://doi.org/10.3929/ethz-a-010580523
Version 1.1 Einführung in die Physik der Atmosphäre
 Version 1.1 MT Einführung in die Physik der Atmosphäre Inhalt: 1. Die Zusammensetzung der Atmosphäre 2. Unterteilung der Atmosphäre 3. Der vertikale Aufbau der Atmosphäre 1. Die Zusammensetzung der Atmosphäre
Version 1.1 MT Einführung in die Physik der Atmosphäre Inhalt: 1. Die Zusammensetzung der Atmosphäre 2. Unterteilung der Atmosphäre 3. Der vertikale Aufbau der Atmosphäre 1. Die Zusammensetzung der Atmosphäre
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Abweichungen vom idealen Gasverhalten: van der Waals. Abweichungen vom idealen Gasverhalten: van der
 Abweichungen vom idealen Gasverhalten: van der Abweichungen vom idealen Gasverhalten: van der Waals Der holländische Wissenschaftler J. van der Waals hat in diesem Zusammenhang eine sehr wertvolle Gleichung
Abweichungen vom idealen Gasverhalten: van der Abweichungen vom idealen Gasverhalten: van der Waals Der holländische Wissenschaftler J. van der Waals hat in diesem Zusammenhang eine sehr wertvolle Gleichung
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Parameter für die Habitabilität von Planeten - Atmosphäre
 Parameter für die Habitabilität von Planeten - Atmosphäre Gliederung Definition von Habitabilität Erdatmosphäre Zusammensetzung Aufbau Einfluss der Atmosphäre auf die Temperatur Reflexion Absorption Treibhauseffekt
Parameter für die Habitabilität von Planeten - Atmosphäre Gliederung Definition von Habitabilität Erdatmosphäre Zusammensetzung Aufbau Einfluss der Atmosphäre auf die Temperatur Reflexion Absorption Treibhauseffekt
1. Wärmelehre 1.1. Temperatur Wiederholung
 1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
4.6.5 Dritter Hauptsatz der Thermodynamik
 4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Montag 22.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3B Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Montag 22.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE VORÜBERLEGUNGEN
 1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE Chemie beschäftigt sich mit Materie. Die Aggregatzustände (s, l und g) sind Formen der Materie. Materie besteht aus
1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE Chemie beschäftigt sich mit Materie. Die Aggregatzustände (s, l und g) sind Formen der Materie. Materie besteht aus
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
Experimentalphysik. Vorlesungsergänzung (VE), Wintersemester 2017 Modulnummer PTI 301
 Experimentalphysik Vorlesungsergänzung (VE), Wintersemester 2017 Modulnummer PTI 301 Experimentalphysik, Inhalt VE 2.1: Temperatur und Wärmeausdehnung VE 2.2: Zustandsgleichung idealer Gase VE 2.3: Erster
Experimentalphysik Vorlesungsergänzung (VE), Wintersemester 2017 Modulnummer PTI 301 Experimentalphysik, Inhalt VE 2.1: Temperatur und Wärmeausdehnung VE 2.2: Zustandsgleichung idealer Gase VE 2.3: Erster
Wie ist der Druck p allgemein definiert. Wie groß ist der Luftdruck unter Normalbedingungen ungefähr? Welche Einheit hat er?
 Wie ist der Druck p allgemein definiert? Welche Einheit hat er? Wie groß ist der Luftdruck unter Normalbedingungen ungefähr? Was kann man sich anschaulich unter dem Stempeldruck in einer Flüssigkeit vorstellen?
Wie ist der Druck p allgemein definiert? Welche Einheit hat er? Wie groß ist der Luftdruck unter Normalbedingungen ungefähr? Was kann man sich anschaulich unter dem Stempeldruck in einer Flüssigkeit vorstellen?
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 24 (von 12.02 bis 16.02) Hausaufgaben 1 Bis Montag 19.02: Lerne die Notizen von Woche 24! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3B Woche 24 (von 12.02 bis 16.02) Hausaufgaben 1 Bis Montag 19.02: Lerne die Notizen von Woche 24! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Gesetz von Boyle. Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V.
 Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Kapitel 10 - Gase. Kapitel 10 - Gase. Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller Bewegung
 Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Aufgaben zur Wärmelehre
 Aufgaben zur Wärmelehre 1. Ein falsch kalibriertes Quecksilberthermometer zeigt -5 C eingetaucht im schmelzenden Eis und 103 C im kochenden Wasser. Welche ist die richtige Temperatur, wenn das Thermometer
Aufgaben zur Wärmelehre 1. Ein falsch kalibriertes Quecksilberthermometer zeigt -5 C eingetaucht im schmelzenden Eis und 103 C im kochenden Wasser. Welche ist die richtige Temperatur, wenn das Thermometer
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Wettersysteme HS 2012
 Wettersysteme HS 2012 Kapitel 1 Grundlegendes zur Erdatmosphäre 19. September 2012 1. Vertikaler Aufbau - Einteilung nach dem Temperaturverlauf - Einteilung in 4 Schichten: - Troposphäre - Stratosphäre
Wettersysteme HS 2012 Kapitel 1 Grundlegendes zur Erdatmosphäre 19. September 2012 1. Vertikaler Aufbau - Einteilung nach dem Temperaturverlauf - Einteilung in 4 Schichten: - Troposphäre - Stratosphäre
Die Reise durch die Atmosphäre
 Die Reise durch die Atmosphäre Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung C2.2 Eigenschaften wichtiger Substanzen und Stoffklassen W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt
Die Reise durch die Atmosphäre Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung C2.2 Eigenschaften wichtiger Substanzen und Stoffklassen W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt
Aufbau der Atmosphäre
 Lektion 4 Atmosphäre II 1 (5) Aufbau der Atmosphäre Kurzbeschreibung In der heutigen Lektion wird die Atmosphäre als Ganzes unter die Lupe genommen. Verschiedene Atmosphärenbereiche werden definiert und
Lektion 4 Atmosphäre II 1 (5) Aufbau der Atmosphäre Kurzbeschreibung In der heutigen Lektion wird die Atmosphäre als Ganzes unter die Lupe genommen. Verschiedene Atmosphärenbereiche werden definiert und
Planungsblatt Physik für die 3F
 Planungsblatt Physik für die 3F Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Freitag 26.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Gerät, kinetische Energie,
Planungsblatt Physik für die 3F Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Freitag 26.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Gerät, kinetische Energie,
2 Luft. 2.1 Die Lufthülle der Erde. Aufbau
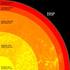 2 Luft 2.1 Die Lufthülle der Erde Aufbau Atmosphäre - Gashülle eines Himmelskörpers (griech. atmos, Dunst, Dampf; lat. sphaira, Kugel, Erdkugel) Sphäre - Schicht der Erdatmosphäre, Untergliederung in verschiedene
2 Luft 2.1 Die Lufthülle der Erde Aufbau Atmosphäre - Gashülle eines Himmelskörpers (griech. atmos, Dunst, Dampf; lat. sphaira, Kugel, Erdkugel) Sphäre - Schicht der Erdatmosphäre, Untergliederung in verschiedene
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Vorfahrt fürs Klima Schulprojekt für Jugendliche der 7./8. Klasse
 Vorfahrt fürs Klima Schulprojekt für Jugendliche der 7./8. Klasse EINSTIEG Experiment Treibhauseffekt Zeit 10-15 Minuten Aufbau und Erklärung, Laufzeit etwa 1 Schultag Material Tisch Stellwand Treibhauseffekt-Experiment
Vorfahrt fürs Klima Schulprojekt für Jugendliche der 7./8. Klasse EINSTIEG Experiment Treibhauseffekt Zeit 10-15 Minuten Aufbau und Erklärung, Laufzeit etwa 1 Schultag Material Tisch Stellwand Treibhauseffekt-Experiment
Ideale Gase. Abb.1: Versuchsanordnung von Torricelli
 Ideale Gase 1 Empirische Gasgesetze, Einblick in die Geschichte der Naturwissenschaften. Wie hängt das Volumen eines Gases von Druck, Temperatur und Stoffmenge ab? Definition Volumen V: Das Volumen V ist
Ideale Gase 1 Empirische Gasgesetze, Einblick in die Geschichte der Naturwissenschaften. Wie hängt das Volumen eines Gases von Druck, Temperatur und Stoffmenge ab? Definition Volumen V: Das Volumen V ist
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas. Thermodynamik
 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
wir-sind-klasse.jimdo.com Exosphäre (ab ca. 600km) Thermosphäre (85 600km) Temperaturanstieg elektrisch leitende Schicht (reflektiert Rundfunkwellen)
 untere Atmosphäre Homosphäre mittlere Atmosphäre obere Atmosphäre (Weltraum) Heterosphäre wir-sind-klasse.jimdo.com Atmosphäre Exosphäre (ab ca. 600km) keine Grenze nach oben Ungeladene Gasteilchen können
untere Atmosphäre Homosphäre mittlere Atmosphäre obere Atmosphäre (Weltraum) Heterosphäre wir-sind-klasse.jimdo.com Atmosphäre Exosphäre (ab ca. 600km) keine Grenze nach oben Ungeladene Gasteilchen können
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
ELEMENTE DER WÄRMELEHRE
 ELEMENTE DER WÄRMELEHRE 3. Elemente der Wärmelehre 3.1 Grundlagen 3.2 Die kinetische Gastheorie 3.3 Energieumwandlungen 3.4 Hauptsätze der Thermodynamik 2 t =? 85 ºC t =? 61.7 ºC Warum wird der Kaffe eigentlich
ELEMENTE DER WÄRMELEHRE 3. Elemente der Wärmelehre 3.1 Grundlagen 3.2 Die kinetische Gastheorie 3.3 Energieumwandlungen 3.4 Hauptsätze der Thermodynamik 2 t =? 85 ºC t =? 61.7 ºC Warum wird der Kaffe eigentlich
PC IV - Reaktionsdynamik
 PC IV - Reaktionsdynamik Kapitel 4 Modellierung chemischer Reaktionen Beispiele aus der Atmosphärenchemie 1 Erdatmosphäre p h = p ho e -h/h o mit h o = 8,0 km Klassifizierungen der Erdatmosphäre über :
PC IV - Reaktionsdynamik Kapitel 4 Modellierung chemischer Reaktionen Beispiele aus der Atmosphärenchemie 1 Erdatmosphäre p h = p ho e -h/h o mit h o = 8,0 km Klassifizierungen der Erdatmosphäre über :
Übung 2. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Die drei Aggregatzustände - Erklärung
 2.1.3 - Die drei Aggregatzustände - Erklärung VERSUCH 1 - DIE WASSERPISTOLE Versuchsdurchführung: Die Wasserpistole (Bild 4) wird zum einerseits mit Wasser und andererseits mit Luft gefüllt. Anschließend
2.1.3 - Die drei Aggregatzustände - Erklärung VERSUCH 1 - DIE WASSERPISTOLE Versuchsdurchführung: Die Wasserpistole (Bild 4) wird zum einerseits mit Wasser und andererseits mit Luft gefüllt. Anschließend
Grundlage für das Verständnis der Gegebenheiten unter Wasser Erkennen der sich daraus ableitenden Vorgänge in diesem für den Taucher
 Tauchphysik Grundlage für das Verständnis der Gegebenheiten unter Wasser Erkennen der sich daraus ableitenden Vorgänge in diesem für den Taucher lebensfeindlichen Milieu Einhaltung wichtiger Verhaltens-regeln,
Tauchphysik Grundlage für das Verständnis der Gegebenheiten unter Wasser Erkennen der sich daraus ableitenden Vorgänge in diesem für den Taucher lebensfeindlichen Milieu Einhaltung wichtiger Verhaltens-regeln,
Lösungsvorschlag Übung 1
 Lösungsvorschlag Übung Aufgabe : Physikalische Einheiten a) Es existieren insgesamt sieben Basisgrössen im SI-System. Diese sind mit der zugehörigen physikalischen Einheit und dem Einheitenzeichen in der
Lösungsvorschlag Übung Aufgabe : Physikalische Einheiten a) Es existieren insgesamt sieben Basisgrössen im SI-System. Diese sind mit der zugehörigen physikalischen Einheit und dem Einheitenzeichen in der
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Materie ist die Gesamtheit aller Stoffe: Energie bei chemischen Reaktionen:
 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
Physik für Nicht-Physikerinnen und Nicht-Physiker
 RUHR-UNIVERSITÄT BOCHUM FAKULTÄT FÜR PHYSIK UND ASTRONOMIE Physik für Nicht-Physikerinnen und Nicht-Physiker Prof. W. Meyer 5. Juni 2014 Wärmelehre Lernziele Alle Körper haben eine Temperatur Die Temperatur
RUHR-UNIVERSITÄT BOCHUM FAKULTÄT FÜR PHYSIK UND ASTRONOMIE Physik für Nicht-Physikerinnen und Nicht-Physiker Prof. W. Meyer 5. Juni 2014 Wärmelehre Lernziele Alle Körper haben eine Temperatur Die Temperatur
Planungsblatt Physik für die 3F
 Planungsblatt Physik für die 3F Woche 22 (von 29.01 bis 02.02) Hausaufgaben 1 Bis Freitag 02.02: Lerne die Notizen von Woche 22! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3F Woche 22 (von 29.01 bis 02.02) Hausaufgaben 1 Bis Freitag 02.02: Lerne die Notizen von Woche 22! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON. Kohlenmonoxid-Sensor
 Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON Kohlenmonoxid-Sensor Sensortechnik Kohlenmonoxid-Sensor Inhaltsverzeichnis Einleitung Kohlenstoffmonoxid Chemie
Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON Kohlenmonoxid-Sensor Sensortechnik Kohlenmonoxid-Sensor Inhaltsverzeichnis Einleitung Kohlenstoffmonoxid Chemie
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Chemie für Bauingenieure
 / V3 Prof., Institut für Baustoffe, HIF E 15, ETHZ Vorlesung Montag 13-15 h, Uebung Montag 15-16 h Email: elsener@ethz.ch Tel. 044 633 2791 http://www.ifb.ethz.ch/education/chemie Assistentin Lea Pessina
/ V3 Prof., Institut für Baustoffe, HIF E 15, ETHZ Vorlesung Montag 13-15 h, Uebung Montag 15-16 h Email: elsener@ethz.ch Tel. 044 633 2791 http://www.ifb.ethz.ch/education/chemie Assistentin Lea Pessina
1. Wie berechnet man die globale Temperatur der Erde? 2. Wie kann man die historischen Klimadaten (vor 1880) ermitteln? 3. Wie funktioniert der
 1. Wie berechnet man die globale Temperatur der Erde? 2. Wie kann man die historischen Klimadaten (vor 1880) ermitteln? 3. Wie funktioniert der Treibhauseffekt? 4. Wie beeinflusst die Sonne das Klima auf
1. Wie berechnet man die globale Temperatur der Erde? 2. Wie kann man die historischen Klimadaten (vor 1880) ermitteln? 3. Wie funktioniert der Treibhauseffekt? 4. Wie beeinflusst die Sonne das Klima auf
Antrieb und Wärmebilanz bei Phasenübergängen. Speyer, März 2007
 Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Buch Seite 3-5. WIW - HTL St. Pölten
 Aufbau der Materie Aggregatzustände Buch Seite 3-5 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt
Aufbau der Materie Aggregatzustände Buch Seite 3-5 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt
Planungsblatt Physik für die 3A
 Planungsblatt Physik für die 3A Woche 14 (von 04.12 bis 08.12) Hausaufgaben 1 Bis Mittwoch 13.12: Lerne die Notizen von Woche 14! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3A Woche 14 (von 04.12 bis 08.12) Hausaufgaben 1 Bis Mittwoch 13.12: Lerne die Notizen von Woche 14! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Physikübungsaufgaben Institut für math.-nat. Grundlagen (IfG)
 Datei Alugefaess.docx Kapitel Thermodynamik ; thermische Ausdehnung Titel Aluminiumgefäß randvoll gefüllt Hinweise: Orear: Kap. 12.4, 12.5, Hering: Kap. 3.3.1 Dobrinski: Kap. 2.3 Alonso Finn: Kap. 13.7-9
Datei Alugefaess.docx Kapitel Thermodynamik ; thermische Ausdehnung Titel Aluminiumgefäß randvoll gefüllt Hinweise: Orear: Kap. 12.4, 12.5, Hering: Kap. 3.3.1 Dobrinski: Kap. 2.3 Alonso Finn: Kap. 13.7-9
Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON. Kohlenmonoxid-Sensor
 Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON Kohlenmonoxid-Sensor 2 Sensortechnik Inhaltsverzeichnis Einleitung Kohlenstoffmonoxid Chemie Kohlenstoffmonoxid
Modul: Labor und Statistik SENSORTECHNIK M.SC.KRUBAJINI KRISHNAPILLAI; PROF.DR.ROBBY ANDERSSON Kohlenmonoxid-Sensor 2 Sensortechnik Inhaltsverzeichnis Einleitung Kohlenstoffmonoxid Chemie Kohlenstoffmonoxid
Klasse : Name : Datum :
 Gasgesetze (Boyle-Mariotte, Gay-Lussac, Amontons) Klasse : Name : Datum : Hinweis: Sämtliche Versuche werden vom Lehrer durchgeführt (Lehrerversuche). Die Protokollierung und Auswertung erfolgt durch den
Gasgesetze (Boyle-Mariotte, Gay-Lussac, Amontons) Klasse : Name : Datum : Hinweis: Sämtliche Versuche werden vom Lehrer durchgeführt (Lehrerversuche). Die Protokollierung und Auswertung erfolgt durch den
8. Vorlesung EP. EPI WS 2007/08 Dünnweber/Faessler
 8. Vorlesung EP I. Mechanik 5. Mechanische Eigenschaften von Stoffen a) Deformation von Festkörpern b) Hydrostatik, Aerostatik (Fortsetzung: Auftrieb) c) Oberflächenspannung und Kapillarität Versuche:
8. Vorlesung EP I. Mechanik 5. Mechanische Eigenschaften von Stoffen a) Deformation von Festkörpern b) Hydrostatik, Aerostatik (Fortsetzung: Auftrieb) c) Oberflächenspannung und Kapillarität Versuche:
Die Atmosphäre der Erde (2)
 Die Atmosphäre der Erde (2) Wiederholung: Vertikaler Aufbau der Erdatmosphäre Für das Wetter- und Klimageschehen auf der Erde ist im Wesentlichen nur die Troposphäre verantwortlich Domäne der Meteorologie
Die Atmosphäre der Erde (2) Wiederholung: Vertikaler Aufbau der Erdatmosphäre Für das Wetter- und Klimageschehen auf der Erde ist im Wesentlichen nur die Troposphäre verantwortlich Domäne der Meteorologie
Trennverfahren (c) by Gerald Trutschl
 Trennverfahren (c) by Gerald Trutschl Inhalt Einteilung der Materie Homogene vs. Heterogene Gemische Trennverfahren Materie Materie by GT Gemische Reinstoffe heterogene Elemente homogene Verbindungen Gemische
Trennverfahren (c) by Gerald Trutschl Inhalt Einteilung der Materie Homogene vs. Heterogene Gemische Trennverfahren Materie Materie by GT Gemische Reinstoffe heterogene Elemente homogene Verbindungen Gemische
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Die atmosphärische Entwicklung von Venus und Mars
 Die atmosphärische Entwicklung von Venus und Mars Graz in Space 2008 KF-Uni Graz, 4.9.2008 Ute Amerstorfer (IWF) 1 Überblick Warum Venus und Mars? Kurze Vorstellung unserer Nachbarn Entwicklung von terrestrischen
Die atmosphärische Entwicklung von Venus und Mars Graz in Space 2008 KF-Uni Graz, 4.9.2008 Ute Amerstorfer (IWF) 1 Überblick Warum Venus und Mars? Kurze Vorstellung unserer Nachbarn Entwicklung von terrestrischen
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 1. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Methan, Treibhausgase & Klima
 Methan, Treibhausgase & Klima - Forschung am MPI für Chemie - - Der Treibhauseffekt - - Messung von Methangehalten in Mainzer Luft, Atemluft und in Reinluft - Dr. Diana Rose, Dr. Marloes Penning de Vries,
Methan, Treibhausgase & Klima - Forschung am MPI für Chemie - - Der Treibhauseffekt - - Messung von Methangehalten in Mainzer Luft, Atemluft und in Reinluft - Dr. Diana Rose, Dr. Marloes Penning de Vries,
Im Mittel ist die Teilchenenergie im Dampf um die Verdampfungsenergie E V höher als in der Flüssigkeit. Auch hier gilt das BOLTZMANN-Theorem:!
 3. Aggregatzustände 3.1. Flüssigkeit und Dampf Wir betrachten Flüssigkeit + angrenzendes Volumen : Die Flüssigkeitsteilchen besitzen eine gewisse Verteilung der kinetischen Energie Es kommt vor, dass ein
3. Aggregatzustände 3.1. Flüssigkeit und Dampf Wir betrachten Flüssigkeit + angrenzendes Volumen : Die Flüssigkeitsteilchen besitzen eine gewisse Verteilung der kinetischen Energie Es kommt vor, dass ein
2,00 1,75. Kompressionsfaktor z 1,50 1,25 1,00 0,75 0,50 0,25. Druck in MPa. Druckabhängigkeit des Kompressionsfaktors. Chemische Verfahrenstechnik
 Kompressionsfaktor z,00 1,75 1,50 1,5 1,00 0,75 0,50 0,5 H CH 4 CO 0 0 0 40 60 80 Druck in MPa ideales Gas Nach dem idealen Gasgesetz gilt: pv nrt = pv m RT = 1 (z) Nennenswerte Abweichungen vom idealen
Kompressionsfaktor z,00 1,75 1,50 1,5 1,00 0,75 0,50 0,5 H CH 4 CO 0 0 0 40 60 80 Druck in MPa ideales Gas Nach dem idealen Gasgesetz gilt: pv nrt = pv m RT = 1 (z) Nennenswerte Abweichungen vom idealen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Klassenarbeit: Klimawandel, Klimaschutz, ökologisches Wirtschaften (erhöhtes Niveau) Das komplette Material finden Sie hier: School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Klassenarbeit: Klimawandel, Klimaschutz, ökologisches Wirtschaften (erhöhtes Niveau) Das komplette Material finden Sie hier: School-Scout.de
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan)
 Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
Vakuum - Mehr als Nichts? Was ist Vakuum? Luftdruck Vakuumpumpen Druckmessung Anwendungen
 Zum 400. Geburtstag von Otto von Guericke Vakuum - Mehr als Nichts? Was ist Vakuum? Luftdruck Vakuumpumpen Druckmessung Anwendungen Was ist Vakuum? Vakuum: Luftdruck geringer als Normaldruck Druck p
Zum 400. Geburtstag von Otto von Guericke Vakuum - Mehr als Nichts? Was ist Vakuum? Luftdruck Vakuumpumpen Druckmessung Anwendungen Was ist Vakuum? Vakuum: Luftdruck geringer als Normaldruck Druck p
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 16 (von 18.12 bis 22.12) Hausaufgaben 1 Bis Montag 08.01: Lerne die Notizen von Woche 16! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3B Woche 16 (von 18.12 bis 22.12) Hausaufgaben 1 Bis Montag 08.01: Lerne die Notizen von Woche 16! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Physik für Biologen und Zahnmediziner
 Physik für Biologen und Zahnmediziner Kapitel 7: Hydrostatik Dr. Daniel Bick 29. November 2017 Daniel Bick Physik für Biologen und Zahnmediziner 29. November 2017 1 / 27 Übersicht 1 Mechanik deformierbarer
Physik für Biologen und Zahnmediziner Kapitel 7: Hydrostatik Dr. Daniel Bick 29. November 2017 Daniel Bick Physik für Biologen und Zahnmediziner 29. November 2017 1 / 27 Übersicht 1 Mechanik deformierbarer
Druck-/ Höhenbegrie. 1 Grundlagen. Pascal Frèrebeau Dichte. 1.2 Druck
 1 Druck-/ Höhenbegrie Pascal Frèrebeau 29.04.2014 1 Grundlagen 1.1 Dichte Die Dichte eines Körpers (ρ) ist seine Masse (M) geteilt durch sein Volumen (V ): ρ = M V In einem Medium (zum Beispiel die Atmosphäre
1 Druck-/ Höhenbegrie Pascal Frèrebeau 29.04.2014 1 Grundlagen 1.1 Dichte Die Dichte eines Körpers (ρ) ist seine Masse (M) geteilt durch sein Volumen (V ): ρ = M V In einem Medium (zum Beispiel die Atmosphäre
Geografie, D. Langhamer. Klimarisiken. Beschreibung des Klimas eines bestimmten Ortes. Räumliche Voraussetzungen erklären Klimaverlauf.
 Klimarisiken Klimaelemente Klimafaktoren Beschreibung des Klimas eines bestimmten Ortes Räumliche Voraussetzungen erklären Klimaverlauf Definitionen Wetter Witterung Klima 1 Abb. 1 Temperaturprofil der
Klimarisiken Klimaelemente Klimafaktoren Beschreibung des Klimas eines bestimmten Ortes Räumliche Voraussetzungen erklären Klimaverlauf Definitionen Wetter Witterung Klima 1 Abb. 1 Temperaturprofil der
Physik-Vorlesung SS Fluide.
 Physik Fluide 3 Physik-Vorlesung SS 2016. Fluide. SS 16 2. Sem. B.Sc. Oec. und B.Sc. CH Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe unter gleichen
Physik Fluide 3 Physik-Vorlesung SS 2016. Fluide. SS 16 2. Sem. B.Sc. Oec. und B.Sc. CH Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe unter gleichen
Grund- und Angleichungsvorlesung Fluidkinematik.
 1 Grund- und Angleichungsvorlesung Physik. Fluidkinematik. SS 18 2. Sem. B.Sc. LM-Wissenschaften Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe
1 Grund- und Angleichungsvorlesung Physik. Fluidkinematik. SS 18 2. Sem. B.Sc. LM-Wissenschaften Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe
Gase Struktur und Eigenschaften
 55 11275 Didaktische FWU-DVD Gase Struktur und Eigenschaften Chemie Klasse 7 10 Trailer ansehen Schlagwörter Aggregatzustand; Atmosphäre; Atom; Avogadro, Amedeo; Avogadro-Konstante; Boyle, Robert; Charles,
55 11275 Didaktische FWU-DVD Gase Struktur und Eigenschaften Chemie Klasse 7 10 Trailer ansehen Schlagwörter Aggregatzustand; Atmosphäre; Atom; Avogadro, Amedeo; Avogadro-Konstante; Boyle, Robert; Charles,
Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag
 2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
Kurze Einführung in die Thermodynamik mit Begriffsklärungen
 Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
Berechnung von Oberflächendrücken
 Berechnung von Oberflächendrücken Methode 1: Faustformel 1 (fixe, konstante Druckänderung) Es wird von einem fixen, konstanten Druckabfall von 0.1bar / 1000m Höhe (ü.m.) ausgegangen. p amb-surf (H) = p
Berechnung von Oberflächendrücken Methode 1: Faustformel 1 (fixe, konstante Druckänderung) Es wird von einem fixen, konstanten Druckabfall von 0.1bar / 1000m Höhe (ü.m.) ausgegangen. p amb-surf (H) = p
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Physikalische Aspekte der Respiration
 Physikalische Aspekte der Respiration Christoph Hitzenberger Zentrum für Biomedizinische Technik und Physik Themenübersicht Physik der Gase o Ideale Gasgleichung o Atmosphärische Luft o Partialdruck Strömungsmechanik
Physikalische Aspekte der Respiration Christoph Hitzenberger Zentrum für Biomedizinische Technik und Physik Themenübersicht Physik der Gase o Ideale Gasgleichung o Atmosphärische Luft o Partialdruck Strömungsmechanik
Kompetenzcheck Atmosphärische Prozesse KT 05/L
 1. Orientierungskompetenz a) Ich kann typische Luftströmungen über Mitteleuropa auf einer Karte bestimmen. (S. 128, Atlas) Ergänze die Legende zur Karte Typische Luftströmungen über Mitteleuropa im Sommer.
1. Orientierungskompetenz a) Ich kann typische Luftströmungen über Mitteleuropa auf einer Karte bestimmen. (S. 128, Atlas) Ergänze die Legende zur Karte Typische Luftströmungen über Mitteleuropa im Sommer.
 www.zaubervorlesung.de Institut für Anorganische Chemie Institut für Anorganische Chemie Universität Erlangen-Nürnberg Donnerstag 19. Okt. 2006 Einlass: 18:00 Uhr Beginn: 20:00 Uhr Getränke dürfen nur
www.zaubervorlesung.de Institut für Anorganische Chemie Institut für Anorganische Chemie Universität Erlangen-Nürnberg Donnerstag 19. Okt. 2006 Einlass: 18:00 Uhr Beginn: 20:00 Uhr Getränke dürfen nur
Allgemeine Gasgleichung und technische Anwendungen
 Allgemeine Gasgleichung und technische Anwendungen Ziele i.allgemeine Gasgleichung: Darstellung in Diagrammen: Begriffsdefinitionen : Iso bar chor them Adiabatische Zustandsänderung Kreisprozess prinzipiell:
Allgemeine Gasgleichung und technische Anwendungen Ziele i.allgemeine Gasgleichung: Darstellung in Diagrammen: Begriffsdefinitionen : Iso bar chor them Adiabatische Zustandsänderung Kreisprozess prinzipiell:
Im ersten Teil geht es um die Einwirkung der physikalischen Größen Temperatur und
 O:/Wiley/Reihe_Dummies/71187_Heun/3d/c01.3d from 25.08.2017 11:20:50 IN DIESEM KAPITEL Den Begriff»Physikalische Chemie«definieren Den Einfluss von Druck und Temperatur auf Gase beschreiben Ideales und
O:/Wiley/Reihe_Dummies/71187_Heun/3d/c01.3d from 25.08.2017 11:20:50 IN DIESEM KAPITEL Den Begriff»Physikalische Chemie«definieren Den Einfluss von Druck und Temperatur auf Gase beschreiben Ideales und
Planungsblatt Physik für die 3A
 Planungsblatt Physik für die 3A Woche 27 (von 05.03 bis 09.03) Hausaufgaben 1 Bis Mittwoch 21.03: Lerne die Notizen von Woche 27! Kernbegriffe dieser Woche: Wärme, Konvektion, Wärmestrahlung, Verdampfungswärme,
Planungsblatt Physik für die 3A Woche 27 (von 05.03 bis 09.03) Hausaufgaben 1 Bis Mittwoch 21.03: Lerne die Notizen von Woche 27! Kernbegriffe dieser Woche: Wärme, Konvektion, Wärmestrahlung, Verdampfungswärme,
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 14 (von 04.12 bis 08.12) Bis Montag 11.12: Lerne gut für den Test! Hausaufgaben 1 Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion, Wärmestrahlung,
Planungsblatt Physik für die 3B Woche 14 (von 04.12 bis 08.12) Bis Montag 11.12: Lerne gut für den Test! Hausaufgaben 1 Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion, Wärmestrahlung,
WS 17/18 1. Sem. B.Sc. Catering und Hospitality Services
 2 Physik 1. Fluide. WS 17/18 1. Sem. B.Sc. Catering und Hospitality Services Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nicht-kommerziell Weitergabe unter gleichen Bedingungen
2 Physik 1. Fluide. WS 17/18 1. Sem. B.Sc. Catering und Hospitality Services Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nicht-kommerziell Weitergabe unter gleichen Bedingungen
Die kinetische Gastheorie beruht auf den folgenden drei Annahmen:
 Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
ZUSAMMENFASSUNG WETTER & KLIMA. Zusammenfassung für die Geografie-Prüfung über das Wetter & Klima
 ZUSAMMENFASSUNG WETTER & KLIMA Zusammenfassung für die Geografie-Prüfung über das Wetter & Klima Exposee Zusammenfassung für die Geografie-Prüfung über das Wetter & Klima am 27.10.2017 RaviAnand Mohabir
ZUSAMMENFASSUNG WETTER & KLIMA Zusammenfassung für die Geografie-Prüfung über das Wetter & Klima Exposee Zusammenfassung für die Geografie-Prüfung über das Wetter & Klima am 27.10.2017 RaviAnand Mohabir
Allgemeine Chemie WS 04/05
 Allgemeine Chemie WS 04/05 Vorlesung: Dienstag 8:30-10:00, Beginn 19. 10. 2004 Grüner Hörsaal D5104 Übungen: Mittwoch 8:30-9:00, Beginn 20. 10. 2004 Grüner Hörsaal D5104 Gez. Prof. A. J. Meixner für die
Allgemeine Chemie WS 04/05 Vorlesung: Dienstag 8:30-10:00, Beginn 19. 10. 2004 Grüner Hörsaal D5104 Übungen: Mittwoch 8:30-9:00, Beginn 20. 10. 2004 Grüner Hörsaal D5104 Gez. Prof. A. J. Meixner für die
8. Reines Ethanol besitzt eine Dichte von ρ = 0,79 g/cm³. Welches Volumen V Ethanol ist erforderlich, um eine Masse von m = 158g Ethanol zu erhalten?
 Staatliche Schule für technische Assistenten in der Medizin Klinikum der Johann Wolfgang Goethe-Universität Frankfurt am Main Testklausur Physik 1. 10 2 10 3 =... 2. 4 10 3 2 10 3=... 3. 10 4 m= cm 4.
Staatliche Schule für technische Assistenten in der Medizin Klinikum der Johann Wolfgang Goethe-Universität Frankfurt am Main Testklausur Physik 1. 10 2 10 3 =... 2. 4 10 3 2 10 3=... 3. 10 4 m= cm 4.
Zusatzstation: Klimalexikon Anleitung
 Anleitung Die Lexikonkarten liegen verdeckt vor euch. Mischt die Karten. Jeder Spieler zieht zwei Karten. Lest die Begriffe auf den Karten. Erklärt die Begriffe euren Mitspielern mit Hilfe des Bildes.
Anleitung Die Lexikonkarten liegen verdeckt vor euch. Mischt die Karten. Jeder Spieler zieht zwei Karten. Lest die Begriffe auf den Karten. Erklärt die Begriffe euren Mitspielern mit Hilfe des Bildes.
KSO STÖCHIOMETRIE II GF. Skript Stöchiometrie II GF V1.0 12/12 MMo, edited by Bor
 KSO STÖCHIOMETRIE II GF Skript Stöchiometrie II GF V1.0 12/12 MMo, edited by Bor 1 INHALTSVERZEICHNIS "STÖCHIOMETRIE II" 1. Einleitung...02 2. Repetition... 02 3. Gasförmige Stoffe... 03 3.1 Das Gesetz
KSO STÖCHIOMETRIE II GF Skript Stöchiometrie II GF V1.0 12/12 MMo, edited by Bor 1 INHALTSVERZEICHNIS "STÖCHIOMETRIE II" 1. Einleitung...02 2. Repetition... 02 3. Gasförmige Stoffe... 03 3.1 Das Gesetz
V. Vom Experiment zur Reaktionsgleichung. Themen dieses Kapitels:
 Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
