Acylierung aromatischer Verbindungen an zeolithischen Katalysatoren im Rieselbettreaktor
|
|
|
- Christian Sachs
- vor 7 Jahren
- Abrufe
Transkript
1 Studiengang Diplom Chemie DIPLMARBEIT Acylierung aromatischer Verbindungen an zeolithischen Katalysatoren im Rieselbettreaktor vorgelegt von: Frank Heinrich Betreuender Gutachter: Prof. Dr. Frank Rößner Zweiter Gutachter: Priv.-Doz. Dr. Axel Brehm ldenburg, 23. Februar
2 Danksagung Die vorliegende Arbeit wurde in der Zeit von August 1997 bis Februar 1998 in der Technischen Chemie II des Fachbereiches Chemie der Carl von ssietzky Universität ldenburg angefertigt. Für die Überlassung des Themas sowie für die Betreuung und Unterstützung dieser Arbeit möchte ich Herrn Professor Dr. Rößner recht herzlich danken. Ferner gilt mein Dank Herrn Privatdozent Dr. Brehm für die Bereitschaft die Arbeit zu begutachten. Mein Dank gilt auch allen Mitarbeitern des Fachbereichs Chemie, die zum Gelingen dieser Arbeit beigetragen haben. 2
3 "! 8 D...5! #%$ &" '$ (*)# $ +, -"...7./ ;:<= AB A2C4D%E D F GHD%ID;JKE KL M N Der Zeolith Struktur der Zeolithe Eigenschaften der Zeolithe Aktivierung des Acylierungsagenzes Acylierung von Arenen Acylierung von Anisol Acylierung von Heterocyclen Acylierung von Phenolen Fries-Umlagerung von Phenylacetat...17 PQRST U V WXT Y*Z T [ [ T%\...23 ]^ _2`ba c d ed f g ha i j%k l g mon p*f c d a qrs Chemikalien und Katalysatoren Ionenaustausch am Y-Zeolith Aktivierung der Zeolithe Versuchsaufbau Reaktionsbedingungen und Durchführung...26 tu v2wbx y z { ~} 4 z x ƒ Chemikalien und Katalysatoren Aktivierung der Zeolithe Bestimmung von Wassergehalt und Glühverlust Versuchsaufbau Reaktionsbedingungen und Durchführung oˆ Š Œ ;Žˆ 2 bžœ Žˆ Probennahme Der Gaschromatograph Bestimmung der Responsefaktoren Referenzsubstanzen Auswertung
4 š *œ 6ž *Ÿ 4œ ž* œ 2 b ª ««±%² ³ óµ * ª «¹ Vergleich der Reaktionen mit und ohne Lösungsmittel Variation des Katalysators Untersuchungen zur Kinetik...39 º» ¼2½b¾ À Á Â~à Ä4Å ÆÇÀ ¾ ÈÉÇ Vergleich Rührkessel-/Rieselbettreaktor Variation des Katalysators Variation des Katalysator-Reaktand-Verhältnisses Einfluß des Lösungsmittels Untersuchungen zum Mechanismus...48 ÊËÌÎÍ*Ï ÐÑÒÑXÓ ÔÕ ÐÏ Ï Í*ÔÖ2ÍÔ* Ø4ÍÏ ÙÚ Û Ü Ý...53 Þßàá â ã ä åâ æ*ä
5 ç è é2ê ë ì íê îïë ð Aromatische Ketone sind häufig benötigte End- und Zwischenprodukte in der chemischen Industrie. Sie werden für die Herstellung von Pharmaka (z. B. Analgetika wie Ibuprofen oder Paracetamol), Kosmetika, Parfümen (Moschus- Riechstoffe) und Acetophenon Harzen verwendet [1]. Die Herstellung erfolgt dabei durch Friedel-Crafts-Acylierung oder Fries- Umlagerung in einer homogenen Reaktion. Aus dem im nächsten Kapitel beschriebenen Reaktionsmechanismus geht hervor, daß die katalysierende Lewissäure (z. B. AlCl 3 ) mindestens in stöchiometrischen Mengen verwendet werden muß. Daher fallen hohe Deponiekosten durch die hohe Salzfracht an. Ferner wird bei der Reaktion Chlorwasserstoff frei, der zu Korrosionsproblemen führt und daher einen hohen Aufwand im Anlagenbau erfordert. Aus diesen Gründen wird daran gearbeitet eine Methode zu entwickeln, die die oben angeführten Probleme vermeidet. Salzarme Synthesen werden z. B. realisiert durch die Verwendung von Acetanhydrid mit Phophorsäure oder Fluorwasserstoff [2]. Ein weiterer Ansatz besteht in der heterogenen Katalyse unter Verwendung von Festkörpersäuren als Katalysatoren. Dazu gehören feste Supersäuren wie sulfatierte Zirkoniumoxide. Ebenso wurden Ionentauscherharze, z. B. Nafion-H oder Amberlyst [3] eingesetzt. Die heterogene Katalyse bietet den Vorteil einer guten Abtrennbarkeit und die Möglichkeit der Regeneration. Neben den obengenannten Festkörpersäuren finden auch Zeolithe in der Katalyse Verwendung. Sie sind in bestimmten Formen starke Festkörpersäuren und bieten aufgrund ihrer Porenstruktur eine hervorrangende Formselektivität [4]. Im Rahmen dieser Arbeit wurde das Verhalten von Zeolithen bei Acylierungsreaktionen untersucht. Dabei galt es unter Variation von Zeolith- Typen, Lösungsmitteln und Katalysatormengen die Umsätze bei hoher Selektivität zu steigern. Ferner galt es durch die ptimierung des Reaktors die Desaktivierung des Katalysators zu minimieren. Dabei kam ein Reaktor zum Einsatz, der dem eines Rieselbettreaktors ähnelt. Außerdem wurden Untersuchungen zur Kinetik und dem Reaktionsmechanismus gemacht. 5
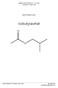
6 Für diese Arbeit kamen zwei Reaktionen zur Anwendung. Zum einen die Friedel- Crafts-Acylierung. Dazu wurde Anisol mit Acetanhydrid am Zeolithen zu Methoxyacetophenonen umgesetzt. Das Anisol bot sich durch die als Elektronendonator wirkende Methoxy-Gruppe als aktivierter Aromat für diese Reaktion an. H 3 C + C H 3 C H 3 C C (Zeolith) - CH 3 CH C H 3 C CH 3 Anisol Acetanhydrid Methoxyacetophenon (MAP) Abbildung 1.1: Friedel-Crafts-Acylierung Desweiteren wurde die Fries-Umlagerung von Phenylacetat zu Hydroxyacetophenonen untersucht. Auch hier wurden Zeolithe als Katalysatoren verwendet. Bei dieser Reaktion wurde unter anderem auch der Rieselbettreaktor eingesetzt. C CH 3 H (Zeolith) C CH 3 Phenylacetat Hydroxyacetophenon (HAP) Abbildung 1.2: Fries-Umlagerung Besonderes Interesse bestand am ñ -Hydroxyacetophenon, da es für die Synthese von z. B. ò -Hydroxystyrol verwendet werden kann. 6
7 ó4ô õ2ö ø ù ú* ûîùü ýøîù þ ö ÿ Î Die Acylierung von Aromaten erfolgt durch elektrophile Substitution. Bei der dabei üblichen Synthese nach Friedel-Crafts setzt man ein Acylierungsmittel, z. B. ein Säurechlorid in Gegenwart eines Metallhalogenids wie AlCl 3 mit dem Aromaten in einer homogenen Katalyse um. Bei dieser Art der Katalyse liegen der Katalysator und die Substrate in einer Phase vor. Aus dem Säurechlorid und der Lewissäure (AlCl 3 ) resultiert ein Gleichgewicht zwischen einem Komplex und dem Acylium-Ion. Diese Spezies lagern sich nach einem elektrophilen Angriff am Aromatenkern unter Bildung eines Carbenium-Ions an. Unter Protonenabgabe bildet sich der!" # $ % & ')( *( + (, % * -.#0/1*, # 32 4)+ ück. Da das AlCl 3 bis zur Hydrolyse des Komplexes am Keton gebunden ist, benötigt man mehr als äquimolare Mengen des Katalysators. Ferner werden bei der Hydrolyse Chlorwasserstoff und Salze in großen Mengen frei. Durch die den Aromaten desaktivierende C-Gruppe ist eine Zweitsubstitution nicht zu erwarten [5; 6]. RC AlCl 4 H C R C R RCCl / AlCl 3 + HCl AlCl 3 H C AlCl 3 R Cl AlCl 4 Abbildung 2.1: Reaktionsschema der Friedel-Crafts-Acylierung; [7] Unter Verwendung eines polaren Lösungsmittels wie z. Β. 1,2-Dichlorethan erhält man durch Umsetzung von Anisol mit Acetylchlorid und AlCl Methoxyacetophenon in einer Ausbeute von 60 % [8]. Eine weitere Methode für die Herstellung von aromatischen Ketonen stellt die Fries-Umlagerung dar. Auch sie wird mit Hilfe von mindestens äquimolen Mengen an Metallhalogeniden in einer homogenen Katalyse an Phenylestern 7
8 durchgeführt. Dabei entsteht ein Gemisch aus 6 - und 798 Acylphenolen. Man geht davon aus, daß die Verschiebung in die :); < =): -Stellung intramolekular, die in >9?)@? -Stellung intermolekular verläuft. Durch niedrige (< 373 K) Temperaturen und die Wahl eines polaren Lösungsmittels wird die Bildung des A -Acylphenols begünstigt [5; 9]. Untersuchungen zum Mechanismus der Fries-Reaktion bei Phenylacetat wurden von gata et al. [10] in Anwesenheit von AlCl 3 und C 14 -markiertem Acetanhydrid gemacht. Aus der Zusammensetzung der radioaktiven Produkte konnte geschlossen werden, inwieweit ein Austausch der markierten Acylium- Gruppe an die Aromaten stattfindet. Im Gegensatz zu Henecka [9] wurde eine simultane inter- und intramolekulare Wanderung als weniger wahrscheinlich angesehen. Denn sollte die Bildung des B9C)D C -Isomers intermolekular verlaufen, müßte die Radioaktivität hier höher sein als beim E)F G H)E -Isomer, was aber nicht beobachtet wurde. Ferner beschreiben gata et al. [10] die Fries-Umlagerung als eine bimolekulare Reaktion, die über das Acetoxyacetophenon zum Hydroxyacetophenon führt. Kobayashi et al. [11] haben gezeigt, daß bei der Verwendung von Hafnium- Trifluoromethansulfonat keine überstöchiometrischen Mengen an Katalysator bei der Fries-Umlagerung nötig sind, da das Hf(Tf) 4 nicht durch die Carbonylverbindungen komplex gebunden wird. Beim Einsatz von 10 mol % des Hf(Tf) 4 ergab sich eine Ausbeute von 5 % für I -Hydroxyacetophenon und 52 % für J -Hydroxyacetophenon. Noch höhere Ausbeuten von bis zu 97 % wurden bei der direkten Acylierung von Phenolen und Naphtholen erzielt. K L K MN) N)P Q R NS9NTU U V WX N Bei dieser Form der Katalyse liegen Substrate und Katalysator in verschiedenen Phasen vor. Zur Durchführung von heterogen katalysierten Acylierungen in flüssiger Phase wurden für diese Arbeit Zeolithe verwendet. 8
9 Y Z Y Z []\^ _ `^ a b c d e Unter Zeolithen versteht man Alkali- bzw. Erdalkali-Alumosilikate, die sowohl in der Natur vorkommen, als auch synthetisch hergestellt werden. Sie finden vielfältig Verwendung als Ionentauscher, Adsorptions- und Trocknungsmittel sowie in der Katalyse. f g f g fih j k lmj lkn)o k po q r s j t o Die elementaren Struktureinheiten sind T 4 -Tetraeder, wobei T entweder ein Si 4+ - oder Al 3+ -Kation sein kann. Um den Ladungsausgleich am Al - 4 -Tetraeder herbeizuführen, befinden sich an der berfläche und in den Hohlräumen Kationen. Dies können Ammonium-, Alkali- bzw. Erdalkali-Kationen oder auch Protonen sein. Durch Verknüpfung der Tetraeder über die Sauerstoffatome erhält man die sekundären Baueinheiten (SBU). Aus diesen SBU lassen sich nun Polyeder aufbauen. Daraus folgen Strukturen, die über Hohlräume und Kanäle verfügen. Je nach den bevorzugten SBU und dem weiteren Strukturprinzip lassen sich die Zeolithe in strukturelle Klassen wie z. B. Zeolith A oder Faujasit (Y) einteilen [12; 13]. Zur Herstellung setzt man wäßrig-alkalische Lösungen von reaktionsfähigen Silicium- und Aluminiumverbindungen ein. Die Reaktionsbedingungen, wie z. B. Temperatur, Rührgeschwindigkeit und vor allem die molare Zusammensetzung der Edukte, bestimmen den dabei entstehenden Zeolith-Typ. Bei der sogenannten Gelsynthese entsteht zuerst ein Alumosilicat-Gel. Im noch amorphen Zustand des Gels finden Umlagerungen statt. Das Reaktionsgemisch ist jetzt sehr empfindlich gegenüber Bewegungen. Nach diesem Reifeprozeß findet dann die eigentliche Kristallisation aus den Keimen bei ca. 333 K bis 573 K statt. Eine Variante stellt die Gelsynthese in Gegenwart von organischen Kationen dar. Das sogenannte Templat sorgt hier für eine zielgerichtete Kristallisation. Um den Zeolith nutzen zu können, muß das Templat, das in erster Linie aus Alkylammonium-Kationen besteht, abgebrannt werden [14]. In dieser Arbeit kam in erster Linie der Beta-Zeolith zum Einsatz. Er hat die Formel Na n [Al n Si 64-n 128 ] mit n < 7. Die Struktur des Beta-Zeolith verfügt über ein tetragonales Kristallgitter mit zwei verschiedenen 12-Ring-Poren, deren Radien 5,5 x 5,5 Å und 7,6 x 6,4 Å betragen. Er gehört damit zu den weitporigen 9
10 Zeolithen. Seine dreidimensionale Netzstruktur besteht aus sich durchdringenden Kanälen, die sowohl gewunden als auch gerade sind. Siehe dazu die Abbildungen 2.2 und 2.3. Die Charakterisierung erfolgt unter anderem durch Adsorptionsmessungen, Röntgendiffraktometrie, hochauflösende Elektronenmikroskopie, FT-IR-Spektroskopie oder mittels Festkörper-MAS- NMR [13; 15]. Abbildung 2.2: Kristallgitter des Beta-Zeolith in [100]; [13] A B Abbildung 2.3: Beta-Zeolith, 12-Ring-Poren; A: Pore zu geraden Kanälen in [001], B: Pore zu gewundenen Kanälen in [100], Angaben in Å; [13] u v u v wix]y z { } ~ ƒ { }0 ){ { ˆ y ƒ { Csicsery [4] berichtet von den Besonderheiten, die die Zeolithe für die heterogene Katalyse interessant machen. Sie haben austauschbare Kationen und verfügen über kleine, gleichartige Poren mit bestimmten Durchmessern von weniger als 10 Å, die zu einer hohen Formselektivität führen. Diese Eigenschaft begründet sich darin, daß die meisten aktiven Zentren sich innerhalb des Zeolithen befinden. Csicsery unterscheidet dabei zwischen der Reaktant- und der Produkt-Selektivität. Im ersten Fall können nur die Edukte an die reaktiven Zentren gelangen, die über einen ausreichend kleinen Durchmesser verfügen um die Poren zu passieren. Im 10
11 zweiten Fall sind es die im Zeolith entstandenen Produkte, die nicht nur in die Hohlräume passen müssen, sondern sie auch nur bei einer bestimmten Größe wieder verlassen können. Daher eignet sich z. B. ein weitporiger Beta-Zeolith mit 12-Ring-Poren besser für die Synthese großer aromatischer Moleküle als ein mittelporiger (10-Ring) ZSM-5 oder engporiger (8-Ring) Zeolith A. Durch die Variation des Kations kann der Porendurchmesser des Zeolith A verändert werden. Das zweiwertige Ca 2+ besetzt nur jede zweite Kationenposition, so daß im Vergleich zu Na + nun größere Moleküle die Pore passieren können. Ferner kommt es zu Transportlimitierungen durch Film- und Porendiffusion, die einen großen Einfluß auf die Reaktivität und Selektivität haben. Die hohe katalytische Aktivität ist auf das elektrostatische Feld im Innern des Zeolithen zurückzuführen, das durch Lewis- und Brönsted-Säurezentren gebildet wird. Die Acidität ist steuerbar durch den Aluminiumgehalt und durch Ionenaustausch. Verwendet man Protonen zum Kationenaustausch, so erhält man eine sehr starke Festkörpersäure mit einer großen Anzahl von Brönstedsäure- Zentren. Durch eine Dealuminierung mit Wasserdampf bei verschiedenen Partialdrücken und Temperaturen wird das Si/Al-Verhältnis erhöht. Dadurch verringert sich die Anzahl der Brönstedsäure-Zentren und die der Lewissäure- Zentren nimmt zu. Die Acidität ist aber in erster Linie von der Dichte, Natur und der Stärke der Säurezentren abhängig. Im Folgenden [16; 17; 18] zeigt sich, daß die Aktivität in Bezug auf die Acylierung aber von Reaktion zu Reaktion verschieden ist, so daß keine eindeutige Zuordnung möglich ist. Jansen et al. [19] führen aus, daß die Säureeigenschaften des Beta-Zeolithen zum Teil auf Defektstrukturen zurückzuführen sind. Um 90 gedrehte tertiäre Baueinheiten (TBU) sind nicht mehr richtig mit benachbarten Schichten verbunden. Durch die nicht mehr korrekte Koordination der T-Atome zum Kristallgitter bilden sich starke Lewissäure-Zentren. Die Brönsted- und Lewissäure-Zentren befinden sich sowohl in den Kanälen als auch an der berfläche des Zeolithen. 11
12 Š Š Œi Ž ) Œ š œ Für eine Acylierungsreaktion ist die Aktivierung des Agenzes nötig. Dadurch bildet sich ein Elektrophil, das am Aromatenkern angreifen kann. Die Aktivierung kann an multivalenten Ionen (Lewissäure) oder an Protonenzentren (Brönstedsäure) erfolgen. An Protonenzentren sind z. B. für Essigsäure zwei symmetrische Übergangszustände möglich, die durch ein- oder zweizähnige Wechselwirkungen entstehen. In Abbildung 2.4 sind zwei Beispiele für solche Adsorptionen beschrieben [20; 21]: H Si Al Zeolith H Si + R C H Acylierungsagens H H H R C Si Al Si Al einzähniger R C H H H Si Si zweizähniger aktivierter Zustand Abbildung 2.4: Aktivierung von Carbonsäuren an Brönstedsäure-Zentren; [20] ž ž Ÿ ª«0 ) ± ²i ± ³ µi Acylierungsreaktionen von Arenen mit Säurechloriden und Carbonsäuren an weitporigen Zeolithen sind vielfach beschrieben. Zeolithe, bei denen die Kationen gegen Seltene Erden ausgetauscht wurden, zeigten in Verbindung mit Carbonsäuren hohe Reaktivität bei hoher 9¹)º ¹ -Selektivität. 12
13 Die Umsetzung von Arenen mit geradkettigen Carbonsäuren haben Chiche et al. [22] ausführlich beschrieben. Zum einen setzten sie» -Xylol und Toluol an CeNa- Y-Zeolithen in flüssiger Phase bei 423 K um. Dabei zeigte sich eine mit der Kettenlänge von C 2 bis C 20 fast linear ansteigende Ausbeute bei einer Selektivität von 94 % für das ¼9½)¾ ½ -Isomer. Ab einer Kettenlänge von mehr als C 20 sank die Ausbeute wieder. Die Autoren schlossen daraus, daß die Fettsäuren offensichtlich zu groß seien, um die Porenöffnungen zu passieren. Doch muß hier angemerkt werden, daß der Durchmesser der Carbonsäuren ab C 3 in etwa den gleichen Durchmesser haben. Nur die Kettenlänge differiert. Daher ist eher anzunehmen, daß Effekte der Diffusion und Adsorption die Reaktionen limitieren. Desweiteren setzte die Gruppe um Chiche [23] Benzol, Xylol und Toluol an kationengetauschtem Montmorillonit und Carbonsäuren (C 3 bis C 16 ) um. Auch hier hing der Umsatz vom Kation in den Schichten ab. Dieses Schichtsilikat zeigte mit Al 3+ und H + die größte Aktivität. Mit Ni 2+, Ce 3+, Cu 2+ oder La 3+ ausgetauschtem Montmorillinit zeigten sich deutlich geringere bis gar keine Ausbeuten. Der Montmorillonit ergab eine von der Kettenlänge unabhängige, schlechtere Selektivität als seine Pendants des Y-Zeolithen. Acylierungen von Toluol mit Säurechloriden an ausgetauschten Zeolithen sind von Akporiaye et al. [24] gemacht worden. Bei 374 K in der flüssigen Phase stieg die Aktivität der Acylierungsagenzien in folgender Weise: Benzoyl- < Acetyl- < Propionyl-Chlorid unabhängig von der Katalysatormodifikation. Der verwendete Y-Zeolith wurde mit Lanthan ausgetauscht. Die Aktivität stieg mit dem Austauschgrad. Auch erhielt man hohe Umsätze von über 60 % bei hoher 9À)Á À - Selektivität. Einen anderen Weg beschritten Singh et al. [16] mit der Acylierung von Benzol mit Essigsäure in der Gasphase. Zum Einsatz kamen hier H-ZSM-5, H-Mordenit, H-Y und Selten Erden ausgetauschter Y-Zeolith. Der Y-Zeolith katalysierte in keiner hier verwendeten Modifikation die Reaktion. Im Gegensatz hierzu erreichte der H-ZSM-5 einen Umsatz von 42,6 % bezogen auf Essigsäure. Die Selektivität betrug dabei 91,1 % für das Acetophenon. Der H-Mordenit lieferte mit einem Umsatz von 7,2 % und einer Selektivität von 31,4 % schon deutlich schlechtere Werte. Untersuchungen mit einer temperaturprogrammierten Desorption (NH 3 - TPD) von Ammoniak zeigten, daß für diese Reaktion starke Brönstedsäure- 13
14 Zentren nötig sind. Sie sind wichtig für die Polarisation der Essigsäure zu einem Elektrophil (CH 3 C + ), das am Benzolring angreift. Die Variation des Si 2 /Al Verhälnisses führte zu keiner Veränderung der Produktverteilung. Dafür verringerte sich mit steigendem Modul von 41 zu 160 der Umsatz von 42,6 % auf 14,1 %, was auf eine Abnahme der Brönstedsäure-Zentren zurückgeführt wurde. Â Ã Â Ã Ä9Å Æ ÇÈ É Ê Ë ÌÍÎÏ Ð ÍiÅiÍ É Ñ Ð È Die Methoxygruppe wirkt am aromatischen Ring als Elektronendonator. Durch diese Aktivierung läuft die Acylierung besonders gut ab. Corma et al. [17] untersuchten die Acylierung von Anisol mit Phenylacetyl- bzw. Phenylpropanoylchlorid und deren Säure-Analogen in flüssiger Phase bei 323 K bis 388 K. Es wurden H-Beta-, H-Y- und H-ZSM-5 Zeolithe verwendet. In jedem Fall ergab sich für die beiden 12-Ring-Zeolithe eine hohe Ò9Ó)Ô Ó -Selektivität. Der H-ZSM-5 hingegen zeigte keine Aktivität. Es wurden nur geringe Mengen an nicht identifizierten Produkten gebildet. Selbst die entsprechenden Õ)Ö Ø)Õ -Isomere finden sich nur in Spuren. Für den Y-Zeolith wurde durch Dealuminierung das Si/Al-Verhältnis von 9 bis 24 variiert. Die Aktivität nahm zu, was auf die zunehmende Hydrophobie des Zeolithen zurückgeführt wurde. hne Lösungsmittel setzten Harvey et al. [18] Anisol mit Acetanhydrid bzw. Phenylacetylchlorid in flüssiger Phase bei 363 K bzw. 393 K um. Die Reaktionen verliefen mit einer Selektivität von bis zu 99 % für das Ù9Ú)Û Ú -Isomer unabhängig vom verwendeten Zeolith. Unterschiede gab es aber bei den Umsätzen. So erreichte der Beta-Zeolith mit Werten von 83 % bis 97 % bessere Werte als der USY-Zeolith mit 59 % bzw. 64 %. Der ZSM-5 zeigte bei der Verwendung von Phenylacetylchlorid keine Reaktion und bei der Umsetzung mit Acetanhydrid nur einen Umsatz von 35 %. Dies ist wahrscheinlich darauf zurückzuführen, daß er im Vergleich zu den beiden anderen Zeolithen nur über kleinere 10-Ring-Poren verfügt. Eine Variation des Si/Al-Verhältnisses beim Beta-Zeolith zeigte keine wesentlichen Auswirkungen auf die Aktivität. Somit eignet sich dieser Parameter nicht um die Zusammenhänge der Reaktion zu erklären. Andere Bedingungen wie z. B. die Verteilung des Aluminiums im Gitter und die Stärke der Säurezentren müssen ebenfalls bedacht werden. 14
15 Auch Wang et al. [25] führten wie Chiche et al. [22; 23] Acylierungsreaktionen mit Carbonsäuren unterschiedlicher Länge (C 2 bis C 18 ) durch. In der flüssigen Phase bei 423 K wurden sie mit Anisol am H-ZSM-5-Zeolith umgesetzt. Als Reaktionsprodukte wurden Acylanisole und Phenylester erhalten. Die Selektivität für die Ü9Ý)Þ Ý -Acylanisole lag zwischen 60 % und 84 %. Die Umsätze fielen mit steigender Kettenlänge von 92 % für die Propansäure auf 0 % für die Benzoesäure bzw. Stearinsäure. Die Autoren sehen darin den Einfluß der geringen Porenweite des Zeolithen auf die Aktivität. Die Bildung von großen Molekülen wird dadurch behindert. Doch wie bereits bei Chiche et al. [22; 23] angeführt, werden auch die erschwerte Diffusion und Adsorption der in der Kettenlänge wachsenden Reaktanden einen bedeutenden Einfluß haben. Von Spagnol et al. [26] wurden in flüssiger Phase bei 393 K Anisol mit Acetanhydrid, Benzoesäureanhydrid und verschiedene Acylchloride an bis zu sechs verschiedenen Katalysatoren umgesetzt. Bei allen Reaktionen lag die Selektivität bei 98 % für das ß9à)á à -Isomer. Deutliche Unterschiede gab es aber bei den Umsätzen. Bei der Acylierung mit Acetanhydrid erreichten H-Beta und H-Y mit 70 % die gleichen Werte. Der H-Mordenit kam auf 29 % und der H-ZSM-5 auf 12 % Umsatz. Bei der Benzoylierung ergaben die vier genannten Zeolithe mit 13 % bis 16 % fast identische Umsätze. Keinen Umsatz erhielt man bei der Verwendung von H-Beta und Acetylchlorid. Beim Mordenit und H-Y wurden auch nur 6 % bzw. 7 % Umsatz erreicht. Durch Untersuchungen mit dem NMR konnten Spagnol et al. zeigen, daß das Acetanhydrid durch Brönstedsäure-Zentren aktiviert wird. Während die Acylchloride eine höhere Neigung zu Lewissäure- Zentren haben. Spagnol et al. beschrieben die Reaktion mit Übergangszuständen vom Wheland-Typ und bestimmten deren Größe. Im Vergleich der Zeolithe stellte sich heraus, daß das Volumen der Hohlräume des H-ZSM-5 nicht ausreichend groß ist und somit die Reaktion an der berfläche des Katalysators ablaufen muß. Die durchschnittlichen Volumina der Kanäle und Hohlräume vom Beta- und Y- Zeolithen sind groß genug. â ã â ã ä å æ çè é ê ë ìíîï ð íñ0ê ò ê ë ð)æ ç æ è ê í Auch Heterocyclen lassen sich mit Hilfe von Acetanhydrid und Y-Zeolithen acylieren. Richard et al. [27] setzten Benzofuran und 2-Methylbenzofuran im Festbettreaktor mit Acetanhydrid bei 333 K um. Beide Reaktionen gelangen, 15
16 wobei das 2-Methylbenzofuran an der óô õ ö -Stellung besonders aktiv war. Das Hauptprodukt resultierte daraus mit einer Ausbeute von 95 %. Das Benzofuran war weniger aktiv. Bei beiden Reaktionen kam es zu einer merklichen Desaktivierung des Katalysators. Beim Benzofuran geschah dies schneller und drastischer. Im Verlauf von ca. 2 Stunden ging der Umsatz fast auf 0 % zurück. Nach der Reaktion wurde der Zeolith in Flußsäure aufgelöst und die Verkokungsprodukte untersucht. Neben den Edukten fand sich das Acylierungsprodukt. Im Falle des Benzofurans waren auch größere Moleküle unter dem nicht desorbierbaren Material, das für die besonders schnelle Desaktivierung verantwortlich war. ø ø ù9ú û üý þ ÿ ÿ ý ÿ Neves et al. [28] haben Phenol mit Essigsäure am H-ZSM-5 bei 533 K zu den Hauptprodukten Phenylacetat und Hydroxyacetophenonen umgesetzt. Sie konnten zeigen, daß die Passivierung der äußeren Säurezentren durch Dealuminierung das -Verhältnis für die Hydroxyacetophenone erhöht, ohne die Aktivität des Zeolithen zu beeinflussen. Es wurde daraus der Schluß gezogen, daß das -Isomer und das -Isomer auf verschiedene Weise gebildet werden. Man postulierte, daß das! "# Isomer hauptsächlich in den Poren gebildet wird. Das $%& % -Isomer dagegen entsteht über verschiedene Zwischenschritte, wobei einer dieser Schritte einen sperrigen Übergangszustand darstellt, der an den äußeren Säurezentren abläuft. Dieses unerwartete Ergebnis steht im Gegensatz zu den bisherigen Erkenntnissen, wonach erst durch die Formselektvität der Kanäle und Hohlräume eine ausgeprägte '() ( -Selektivität möglich ist. In weiteren Untersuchungen beschäftigten sich Neves et al. [29; 30] mit der Kinetik und dem Reaktionsschema der Acylierung von Phenol mit Essigsäure am H-ZSM-5 in der Gasphase. Unter allen Bedingungen lagen Phenylacetat, * - Hydroxyacetophenon und Aceton als Hauptprodukte vor. + -Hydroxyacetophenon wurde nur zu 1 % und, -Acetoxyacetophenon nur in Spuren gebildet. Durch die um bis zu 20 mal schnellere -Acylierung (Veresterung) von Phenol durch Essigsäure erhält man Phenylacetat, während die langsamere C-Acylierung von Phenol durch Phenylacetat zum - -Hydroxyacetophenon führt. Die C-Acylierung des Phenols mit der Essigsäure verläuft noch langsamer. Die hohe Selektivität für 16
17 das./ Isomer folgt aus der besonderen Stabilität des Übergangszustandes und der Formselektivität des Zeolithen. 2 -Acetoxyacetophenon entsteht durch Autoacylierung des Phenylacetats und hydrolysiert zum 3 -Hydroxyacetophenon. Das für die Hydrolyse benötigte Wasser entsteht durch die Veresterung des Phenols mit Essigsäure und durch die Decarboxylierung der Essigsäure zu Aceton. Die Reaktionsordung für Phenol lag nahe bei null und war negativ bezogen auf Essigsäure. Die Bildung von 4 -Hydroxyacetophenon durchlief bei 550 K ein Maximum, während die vom Isomer mit der Reaktionstemperatur anstieg. Hoefnagel et al. [3] setzten Resorcinol mit Benzoesäuren zu Benzophenonen in der flüssigen Phase unter Rückfluß um. Als Katalysatoren verwendeten sie u. a. protonierte Ionentauscher-Harze (Amberlyst-15, Nafion-117) und den H-Beta- Zeolithen, die alle eine gute Aktivität zeigten. Die Acylierungsreaktion steht mit einer folgenden Fries-Umlagerung im Gleichgewicht. Hierzu wurden mit Chlor oder Alkylgruppen substituierte Benzoesäuren und Phenole untersucht. Elektronendonatoren (+I-Effekt) am Kern der Benzoesäuren beschleunigen die Fries-Reaktion. Elektronenakzeptoren (-I-Effekt) an den Phenolen behindern sowohl die Veresterung als auch die Fries-Umlagerung. Im Vergleich zu den Harzen zeigte der H-Beta-Zeolith eine ausgeprägte Formselektivität A B CDE F GH@ = IJ GLK M JN>P@ J QRE T FT Bei dieser Reaktion kommt man zu vergleichbaren Produkten wie bei der zuvor beschriebenen Acylierung von Phenolen. Die erwünschten Hydroxyacetophenone entstanden im allgemeinen nur in geringen Mengen. b die Umlagerung interoder intramolekular ist noch nicht einheitlich geklärt. Das Hauptprodukt war Phenol. Auch das Problem der Desaktivierung durch Verkokung wurde wiederholt beschrieben. Schon sehr früh haben Pouilloux et al. [31] die Fries-Umlagerung von Phenylacetat an Zeolithen bei 673 K in der Gasphase durchgeführt. Verwendet wurden H-ZSM-5, fluoriertes Aluminiumoxid und H-Y, deren Aktivität in der gleichen Reihenfolge anstieg. In allen Fällen bildete sich hauptsächlich Phenol. Daneben entstand bei dem fluorierten Aluminiumoxid und dem H-Y U - und V - Hydroxyacetophenon, die analogen Acetoxyacetophenone sowie Diphenylether. 17
18 Die letzten beiden Verbindungen traten bei der Verwendung von H-ZSM-5 nicht auf. Dafür einige nicht identifizierte Substanzen. Der H-ZSM-5 zeigte ein zehnfach höheres WXY X Z [Y \ ][ -Verhältnis als die beiden anderen Katalysatoren. Cundy et al. [32] haben die Fries-Umlagerung von Phenylacetat in flüssiger Phase ohne Lösungsmittel bei 443 K bzw. 483 K durchgeführt. Als Katalysatoren wurden 1,5 g siliciumreiche Zeolithe, wie z. B. H-Nu, H-ZSM-5 oder NaY, auf 55 mmol Phenylacetat verwendet. Der H-Nu-2 zeigte eine vergleichsweise hohe ^_` _ -Selektivität für Hydroxyacetophenon und Acetoxyacetophenon bei einem Umsatz von 70 % nach 24 Stunden Reaktionszeit. Dabei entstand 20 % Phenol, was auf vorhandenes Wasser zurückgeführt wurde. Bei getrocknetem Zeolithen ging der Umsatz sowie der Anteil des Phenols zurück. Die hohe abc b -Selektivität fand sich auch beim weniger aktivem H-ZSM-5, der nur einen Umsatz von 22 % erzielte. Der H-Nu-10 erreichte aufgrund seiner zu kleinen Porenöffnungen einen deutlich geringeren Umsatz und Selektivität, da nur die berfläche des Katalysators zur Verfügung stand. Bei der Verwendung der Natrium-Form des Y- Zeolithen kam es zu keiner Umlagerung, sondern in geringen Maßen zur Hydrolyse. Auch van Bekkum et al. [2] führten die Fries-Umlagerung von Phenylacetat in der flüssigen Phase bei 453 K durch. Es wurden sechs verschiedene Zeolithe untersucht, von denen jeweils 1, 5 g auf 55 mmol Phenylacetat eingesetzt wurden. Die Reaktionszeit betrug 24 Stunden. Der ZSM-5 erreichte mit 68 % den höchsten Umsatz gefolgt vom Beta-Zeolith mit 58 %. Der Nu-10-Zeolith erreichte mit 7,6 % den geringsten Umsatz. Das niedrige def e g hf i jh -Verhältnis weist darauf hin, daß die Reaktion hauptsächlich an der äußeren berfläche des Zeolithen abläuft. Van Bekkum et al. stellten fest, daß mit steigendem Porendurchmesser das klm l n om p qo -Verhältnis fällt. Die an der äußeren berfläche ablaufenden Reaktionen führten zu polymeren Spezien, die den Zugang zu den Poren behinderten. Die äußere berfläche wurde daher mit Triphenylchlorsilan passiviert. Durch N 2 -Adsorption wurde die berfläche nach BET bestimmt, um so die Strukturveränderung zu kontrollieren. Beim ZSM-5 und ZSM-12 führte dies zu einer deutlichen Erhöhung des rst s u vt w xv -Verhältnisses. Der Beta-Zeolith konnte davon nicht profitieren, da offensichtlich auch Porenöffnungen verstopft wurden, wodurch sich das zur Verfügung stehende Volumen verringerte. Van 18
19 Bekkum et al. führen aus, daß die Anzahl der Säurezentren einen starken Einfluß auf die Aktivität des Zeolithen habe, die Selektivität einer Reaktion sei aber davon unabhängig. Die Variation des Si/Al-Verhältnisses von 20 bis 414 bei MFI- Strukturen zeigte aber keinen Einfluß auf die Bildung von y - und z - Hydroxyacetophenone und das { -Acetoxyacetophenon. Die Verwendung von polaren Lösungsmitteln führte zu einer Erhöhung von Umsatz, }~ } -Selektivität und der Bildung von Phenol. Dies deutet auf ein ionisches Reaktionsschema hin. In kontinuierlicher Flüssigphase erhielt man bei höheren Temperaturen deutlich bessere Umsätze. Die Reaktion lief dabei in erster Linie an der äußeren berfläche ab, da der Austausch der flüssigen Phase in den Kanälen zu langsam erfolgte. Ergänzend zu der Acylierung von Anisol haben Harvey et al. [18] auch die Fries- Umlagerung von Phenylacetat an Beta-, USY- und ZSM-5-Zeolithen in flüssiger Phase bei 453 K untersucht. Es wurden ebenfalls 1,5 g Katalysator auf 55 mmol Phenylacetat eingesetzt. Die Reaktionszeit betrug auch hier 24 Stunden. Dabei zeichneten sich der Beta- und der USY-Zeolith durch ein vergleichbares Reaktionsverhalten aus. Nach einem schnellen Start nahm die Reaktion stark ab. Im Falle des USY-Zeolithen bereits nach einer Stunde. Die geringe Selektivität kam durch die erhöhte Bildung von Phenol und Nebenprodukten zustande. Der ZSM-5 zeichnete sich im Gegensatz zu den 12-Ring-Zeolithen durch eine hohe Selektivität von 92,9 % und ein ƒ ƒ Verhältnis von 1,5 aus. Der Umsatz stieg zwar langsamer dafür aber kontinuierlicher, da die Diffusion in die kleineren 10-Ring-Poren erschwert ist. Erst bei größeren Molekülen, wie z. B. dem Phenylbenzoat, stieg die Selektivität und das ˆ ˆ Š Œ -Verhältnis beim Beta- Zeolith. Der ZSM-5 zeigte hier keine Reaktion. In einer kontinuierlichen Flüssigphasenreaktion hatte der Beta-Zeolith die stabilste Aktivität. Das Si/Al- Verhältnis hatte keinen wesentlichen Einfluß auf die Aktivität des Beta-Zeolithen. Beim ZSM-5-Zeolith zeigte sich hingegen eine steigende Aktivität mit steigendem Aluminiumgehalt. Vogt et al. [33] haben die Fries-Umlagerung von Phenylacetat und verwandten Estern unter Verwendung von Zeolithen in der H-Form durchgeführt. Die Gasphasenreaktion erfolgte bei 693 K. Die Ergebnisse entsprachen denen von Pouilloux et al. [31; 34], die ebenfalls eine schnelle Desaktivierung des 19
20 Katalysators und Phenol als Hauptprodukt feststellten. Die schnelle Desaktivierung wurde auf die zu scharfen Reaktionsbedingungen zurückgeführt. Es bildete sich Koks, der sich auf den stark sauren Zeolithen ablagerte. In der flüssigen Phase wurde die Fries-Umlagerung bei 453 K gemacht. Der Umsatz und die Selektivität hing hier sehr stark von dem verwendeten Zeolithen ab. Das Ž -Verhältnis war hier jedenfalls höher als in der Gasphase, und fiel mit wachsender Porenöffnung. Die besten Ergebnisse lieferte der ZSM-5. Bei einem Umsatz von 69 % nach 24 Stunden bildete sich am wenigsten Phenol und Nebenprodukte, was auf seine Formselektivität zurückgeht. Die schlechtesten Werte ergaben sich beim Nu-10 mit einem Umsatz von 8 % bei einer Selektivität von 84 % für Phenol. Der Beta-Zeolith begann mit einer hohen Aktivität, die aufgrund von Verkokung schnell wieder nachließ. Untersuchungen zur Desaktivierung ergaben, daß der Koks sich an der äußeren, sauren berfläche anlagert und so den Zugang in die Hohlräume verhindert. Hierzu haben Vogt et al. ebenso wie van Bekkum et al. [2] die berfläche passiviert. Die Ergebnisse entsprachen einander. Mit der Variation der Si/Al-Verhältnisse beim Beta- Zeolithen konnten die Ergebnisse von Harvey et al. [18] bestätigt werden. Einen Einfluß der Deluminierung auf den ZSM-5-Zeolith bei der Fries-Umlagerung konnte im Gegensatz zu Harvey et al. von Vogt et al. und von van Bekkum et al. nicht festgestellt werden. Weitere Untersuchungen ergaben dann, daß die Reaktion am Beta-Zeolith einer starken Diffusionslimitierung unterlag. Neves et al. [35] konnten durch die Zugabe von Wasser die Umsetzung von Phenylacetat verbessern. Die Reaktion wurde bei 673 K in der Gasphase an H-Yund H-ZSM-5-Zeolithen durchgeführt. Bei der alleinigen Umsetzung von Phenylacetat kam es schnell zur Desaktivierung des Katalysators. Durch die Zugabe von Wasser wurde die Aktivität erhöht, da wahrscheinlich die Bildung von Keten und seiner Kondensationsprodukte behindert wurde. Die Bildung von Phenol nahm deutlich zu. Die Ausbeute der eigentlich erwünschten Hydroxyacetophenone oder des -Acetoxyacetophenons nahm noch weiter ab. Dieses Verhalten zeigten beide Zeolithe. Pouillioux et al. [34] haben weitere Versuche zur Untersuchung des Mechanismus der Fries-Umlagerung von Phenylacetat durchgeführt. Dabei setzten sie wieder H- Y und H-ZSM-5 in der Gasphase bei 673 K ein. Sie erhielten wiederum Phenol 20
21 und Keten als Hauptprodukt. Am H-Y entstand außerdem Hydroxyacetophenon, während am H-ZSM-5 - und -Hydroxyacetophenon im Verhältnis eins zu eins entstanden. Beide Zeolithe bildeten š -Acetoxyacetophenon. Die Zugabe von Wasser hatte beim H-Y keinen Einfluß. Beim H-ZSM-5 führte die Wasserzugabe zu einer höheren Katalysatorstabilität, so daß der Umsatz länger erhalten blieb. Denn auch Pouilloux et al. berichteten über eine schnelle Verkokung, die bereits während der ersten zwei Stunden auftrat. Durch Extraktion mit Dichlormethan nach dem Auflösen des Zeolithen, waren 20 % des Koks zu entfernen. Der Koks hatte polyaromatischen Charakter. Aus den Produktverteilungen schlossen Pouilloux auf folgenden Mechanismus. Da Phenol immer als Hauptprodukt auftrat, kommt eine alleinige Autoacylierung von Phenylacetat nicht in Frage. Daher ist es wahrscheinlich, daß Phenylacetat auch in Phenol und Keten zerlegt wird. Das -Hydroxyacetophenon wird durch intramolekulare Wanderung des Acylium-Ions gebildet. Durch intermolekulare Transacylierung von Phenylacetat auf Phenol erhält man œ -Hydroxyacetophenon. Eine weitere Reaktion stellt die Disproportionierung von Phenylacetat zu -Acetoxyacetophenon und Phenol dar. Subba Rao et al. [36] setzten mit Übergangsmetallen modifizierte ZSM-5-Zeolithe in der Gasphase mit Phenylacetat ein. Der Ga-ZSM-5 erreichte bei einem Umsatz von 71 % eine hohe Selektivität von 46 % für das ž -Hydroxyacetophenon, das in diesem Fall das Hauptprodukt war. Phenol bildete sich nur mit einer Selektivität von 20 %. Die ungewöhnlich hohe Ausbeute an Ÿ -Hydroxyacetophenon wurde auf den relativ stabilen Übergangszustand zurückgeführt. Durch die Zugabe von Acetanhydrid gelang es die Bildung von Phenol zu mindern. Das Steigern des Si/Al-Verhältnisses von 30 auf 280 ließ den Umsatz und die Ausbeute an - Hydroxyacetophenon sinken. Den Grund sahen die Autoren in der geringeren Zahl der Brönstedsäure-Zentren des H-ZSM-5-Zeolithen, was wiederum zu geringeren Umsätzen führte. Unter Verwendung des neuen, siliciumreichen und weitporigen NCL-1-Zeolithen führten Sasidharan et al. [37] die Fries-Umlagerung von Phenylacetat durch. In der Gasphase stieg der Umsatz mit der Temperatur und sank bei höheren Durchflußraten. Die Steigerung des Si/Al-Verhältnisses von 83 auf 255 ließ den Umsatz von 21 % auf 9 % fallen und die Selektivität der Hydroxyacetophenone auf bis zu 81 % steigen. Auch dieser neue Zeolith unterlag bei 673 K in der 21
22 Gasphase einer raschen Desaktivierung. In der flüssigen Phase ohne Lösungsmittel ergaben sich bei 413 K und 453 K mit 5 % bzw. 8 % geringere Umsätze als in der Gasphase. 22
23 ª «R ª ²± Die Untersuchung des Verhaltens von zeolithischen Katalysatoren bei der Friedel- Crafts-Acylierung und der Fries-Umlagerung wurde unter folgenden Bedingungen durchgeführt. ³² µ ¹ º¹» ¼ ½ ¾ HÀ Á ¼  à ÄÅ» ¹ ÆÇÈ Die Reaktion von Anisol mit Acetanhydrid zu Methoxyacetophenon (MAP) erfolgte durch heterogene Katalyse am Zeolithen im diskontinuierlichen Rührkesselreaktor. É Ê Ë Ê ËÌÎÍÏ Ð Ñ Ò Ó Ô Ñ Ï Õ ÖÕØÚÙ<ÓÛ Ó Ô ÜRÝ ÓÛ Þ ß Ï Õ Tabelle 3.1: Substanzen und deren Herkunft Anisol, p. A. Riedel-de-Haën AG, Seelze Acetanhydrid, p. A. Riedel-de-Haën AG, Seelze Toluol, 99,5 % Scharlan, La Jota Dichlormethan, p. A. Merck, Darmstadt Ammoniumchlorid Merck, Darmstadt Tabelle 3.2: Zeolithe und deren Herkunft H-Beta, Si/Al = 12, Pulver Süd Chemie AG, München H-Beta, dealuminiert, Si/Al = 90 Süd Chemie AG, München H-Pentasil (ZSM-5), Pulver Süd Chemie AG, München NH 4 -Y, Pulver Süd Chemie AG, München MCM-41, Si/Al = 15, Pulver Anke Hagen à á â á ã<ä å æç æè é ê ë è éê ì ílè îðï ñ òåç å ó ô ë í Bis auf den Y-Zeolith wurden alle Katalysatoren unverändert eingesetzt. Beim Y- Zeolith wurde ein Ionenaustausch durchgeführt, um eventuell vorhandenes Natrium durch Ammonium zu tauschen. Der Y-Zeolith enthält etwa 2 mmol aktiver Zentren pro Gramm. Für den Ionenaustausch wurden zwanzigmal soviel in Wasser gelöste Ammonium-Ionen angeboten wie Natrium-Ionen an den aktiven Zentren zu erwarten waren. Dabei 23
24 sollte ein Feststoff-Flüssigkeits-Verhältnis von über 1 zu 100 erreicht werden. Somit wurden in einem 2-l-Kolben 0,4 mol Ammoniumchlorid in 1,25 l destilliertem Wasser gelöst. Dazu kamen 10 g Y-Zeolith. Mit Hilfe eines Heizrührers wurde die Suspension fünf Stunden bei ca. 353 K gerührt. Nach dem Abkühlen wurde der Zeolith über einer Nutsche abfiltriert und mit destilliertem Wasser gewaschen. Mit einer Silberchlorid-Lösung wurde getestet, ob das Waschwasser chloridfrei war. Der Ionenaustausch wurde ein weiteres Mal wiederholt. Danach folgte das Calcinieren bei 723 K drei Stunden im Muffelofen. Durch das Glühen erhält man aus der Ammonium-Form die saure H-Form des Zeolithen, der dadurch auch über Brönstedsäure-Zentren verfügt. õ ö ö õåøªù ú û ü û ý þ ÿ ý þ Åý û ú ý Auf eine Aktivierung des Zeolithen zur Entfernung von physisorbiertem Wasser wurde verzichtet. Durch die Anwesenheit von Acetanhydrid wurde das Wasser chemisch durch Bildung von Essigsäure entfernt [vgl. Abb. 3.1]. Der Vergleich mit Reaktionen, die zuvor in der Arbeitsgruppe mit aktivierten Zeolithen gemacht wurden, bestätigte diese Annahme [38]. C H 3 H 3 C C C + H 2 2 CH 3 CH Acetanhydrid Wasser Essigsäure Abbildung 3.1: Reaktion von Wasser mit Acetanhydrid!" Alle Reaktionen der Friedel-Crafts-Acylierung fanden in der flüssigen Phase statt. Die Edukte sowie der Katalysator wurden in einem 250-ml-Dreihalskolben vorgelegt, der mit einem Kühler, Magnetrührer und einem Thermometer bestückt war (vgl. Abb. 3.2 B). Auf dem Rückflußkühler befand sich ein Trockenrohr. Der Dreihalskolben wurde mittels eines Siliconöl-Bades beheizt. Für die Versuche zur Kinetik der Friedel-Crafts-Acylierung kam statt des Dreihalskolbens ein doppelwandiges Gefäß mit zwei Rückflußkühlern, Magnetrührer und Thermometer zum Einsatz (vgl. Abb. 3.2 A). In dem äußeren 24
25 Mantel befand sich ein Lösungsmittel oder Lösungsmittelgemisch (Azeotrop), das durch einen Heizrührer zum Sieden gebracht wurde. In dem inneren Gefäß, das durch das siedene Lösungsmittel im äußeren Mantel auf eine konstante und definierte Reaktionstemperatur gebracht wurde, fand die Reaktion statt. Tabelle 3.3: Heizmedien und deren Siedepunkte Toluol 384 K i-butanol 379 K Wasser 373 K i-propanol (88 Mol-%)/Wasser (12 Mol-%) 353 K Aceton 329 K n-hexan(37,7 Mol-%)/Methanol (29,5 Mol-%)/Aceton (32,8 Mol-%) 320 K Kühler Kühler Thermometer äußerer Mantel mit Lösungsmittel Thermometer inneres Gefäß mit Friedel-Crafts-Reaktion Friedel-Crafts-Reaktion Magnetrührer Magnetrührer A B Abbildung 3.2: Reaktionsapparaturen für Friedel-Crafts-Acylierungen; A: Untersuchungen zur Kinetik; B: Standardaufbau # $ % $ &('*) +, -. / 0 1 2") 3" "4 ) : ; < : Unter Standardbedingungen wurden 0,1 mol Anisol, 0,1 mol Acetanhydrid und 1,5 g zeolithischer Katalysator in das Reaktionsgefäß gefüllt. Mit einem Siliconölbad bzw. einem Heizrührer wurde dann das Reaktionsgemisch unter Rückfluß erhitzt. Ein Zirkulus sorgte für eine intensive Durchmischung. Bei der Verwendung von 30 ml Toluol als Lösungsmittel lag die Reaktionstemperatur bei 388 K. hne Toluol erfolgte die Reaktion bei 393 K. Bei den Reaktionen zur 25
26 Untersuchung der Kinetik war die Temperatur durch die Wahl des Lösungsmittels bestimmt, das in die äußere Ummantelung des Reaktionsgefäßes gefüllt wurde. Die Reaktionstemperaturen lagen dann jeweils zwischen 320 K und 384 K (vgl. Tab. 3.3). Nach dem Kontakt des Zeolithen mit dem kalten Reaktionsgemisch verfärbten sich Katalysator und Reaktionsgemisch von weiß bzw. klar zu beige. Beim Aufheizen und im Laufe der Reaktion verdunkelte sich das Gemisch zu dunkelbraun. In regelmäßigen Abständen von zunächst 15 min und später 30 min wurden Proben mit einer Pasteurpipette aus dem Reaktionsgefäß entnommen. Die gesamte Reaktionszeit betrug jeweils 240 min. = >?A@CB D E F GHJILK MNE B QPJN Im diskontinuierlichen Rührkesselreaktor und im Rieselbettreaktor wurde Phenylacetat (PhAc) durch heterogene Katalyse am Zeolithen zu Hydroxyacetophenon (HAP) umgesetzt. R S T S UCVXWY Z [ \ ] ^ [ Y _`"_a(b*]"c ] ^ de ]"c f g Y _ Tabelle 3.4: Substanzen und deren Herkunft Phenylacetat, 99 % Acetanhydrid, p. A. Phenol, 99 % Essigsäure, 99,8 % Anisol, p. A. Sulfolan, 99 % Chlorbenzol Decan, > 95 % Aldrich, Milwaukee, USA Riedel-de-Haën AG, Seelze Sigma-Aldrich, Steinheim Riedel-de-Haën AG, Seelze Riedel-de-Haën AG, Seelze Sigma-Aldrich, Steinheim Merck, Darmstadt Fluka, CH-Buchs Tabelle 3.5: Zeolithe und deren Herkunft H-Beta, Si/Al = 12, Pulver H-Beta, Si/Al = 12, Extrudat (20 % Bindemittel) H-Beta, dealuminiert, Si/Al = 90, Agglomerate H-Pentasil (ZSM-5), Pulver NH 4 -Y, Pulver Valfor CBV (ZSM-5), Si/Al = 87, Pulver Süd Chemie AG, München Süd Chemie AG, München Süd Chemie AG, München Süd Chemie AG, München Süd Chemie AG, München The PQ Corporation, USA 26
27 Zum Einsatz im Rieselbettreaktor wurden die Zeolithe, die als Pulver vorlagen, mit einer hydraulischen Presse mit ca. 100 MPa verpreßt. Nach dem Zerkleinern im Mörser wurde der Zeolith mit einem Prüfsieb von 315 µm Maschenweite gesiebt. Dieses Verfahren war notwendig, um ein Verstopfen der Fritte im Glastiegel zu vermeiden. h i j i j7kml n o p o q r s t u v"q r w7q x y o n zq Zur Entfernung von physisorbiertem Wasser wurden die Zeolithe abgewogen und in einem Porzellantiegel bei 623 K für zwei Stunden im Muffelofen ohne Schutzgas aktiviert. Für die Reaktion wurde der heiße Zeolith verwendet. { } {m~( ƒcƒ " ˆ Š Œ Ž " J ˆ Ž Es war nicht bekannt, ob der Valfor CBV noch Templat enthielt. Daher wurde der Gehalt an physisorbiertem Wasser und der Glühverlust durch Verwendung zweier verschiedener Temperaturen festgestellt. Bei der niedrigeren Temperatur wird nur das leicht gebundene, physisorbierte Wasser entfernt. Bei der höheren Temperatur desorbiert fester gebundenes Wasser und eventuell vorhandene organische Bestandteile pyrolysieren. Aus dem jeweiligen Gewichtsverlust läßt sich dann der Ursprung der desorbierten Stoffe ableiten. Für eine ausreichende Genauigkeit ist es wichtig zügig zu arbeiten und einen Exsikkator zu verwenden, da die getrockneten Zeolithe außerordentlich hydroskopisch sind und schnell Luftfeuchtigkeit adsorbieren. Zur Bestimmung des Wassergehaltes wurden genau abgewogene Mengen des Valfor CBV in Wägeschälchen für vier Stunden bei 423 K in den Trockenschrank gelegt. Danach kühlten die Proben im Exsikkator ab und wurden dann erneut gewogen. Aus der Differenz der Wägungen vor und nach dem Trocknen ergab sich ein Gewichtsverlust, der durch desorbiertes Wasser entstand. Aus Messungen verschiedener Proben wurde im arithmetischen Mittel ein Wasseranteil von 1,6 Gew.-% ermittelt. Der Glühverlust wurde bestimmt, in dem der Valfor CBV in verschiedene Tiegel eingewogen und im Muffelofen bei 773 K für drei Stunden geglüht wurde. Anschließend kamen die Proben zum Abkühlen in den Exsikkator. Auch hier 27
28 bestimmte die Differenz der Wägungen vor und nach dem Glühen den Gewichtsverlust. Er betrug im Mittel 2,0 Gew.-%. Daraus ließ sich nun folgern, daß der Valfor CBV ohne Templat vorlag und bei der höheren Temperatur zusätzlich fester gebundenes Wasser desorbiert. Das Templat, das in der Regel aus Alkylammonium-Kationen besteht, hätte einen höheren Gewichtsverlust beim Glühen verursachen müssen. š œ ž Ÿ œ "Ÿ œ Bei der Fries-Umlagerung wurden zwei verschiedene Konzepte zur Reaktion in der flüssigen Phase umgesetzt. Der Aufbau des herkömmlichen Rührkesselreaktors entspricht dem bei der Friedel-Crafts-Acylierung (vgl. Abb. 3.2 B). Die Edukte und der Katalysator wurden unter Schutzgasatmosphäre in einem mit Rückflußkühler, Magnetrührer und Thermometer bestückten 250-ml-Dreihalskolben vorgelegt. Daneben kam eine Apparatur zum Einsatz, die aus der Überlegung entstand eine kontinuierliche Extraktion mit der Reaktion zu kombinieren, um die Aktivität des Zeolithen über einen längeren Zeitraum zu erhalten. Das Reaktionsgemisch und der Katalysator sind dabei räumlich getrennt. Der Rieselbettreaktor (vgl. Abb. 3.3) besteht aus einem Glasrohr, das am unteren Ende über Einkerbungen im Glas verfügt, auf denen ein herausnehmbarer Glastiegel mit eingeschmolzener Glasfritte PR 1 steht. Zwischen Reaktorwand und Glastiegel bleibt rundherum ein Spalt von ca. 1 cm. Der Reaktor ist mit einem Heizdraht umwickelt, der mit einen Trafo geregelt wurde. Mit einen Normalschliff wurde der Reaktor auf einen 250-ml-Dreihalskolben gesetzt, der über einen Magnetrührer und ein Thermometer verfügte. Auf dem Reaktor wurde ein Rückflußkühler angebracht. Die gesamte Anlage stand unter Stickstoffatmosphäre. Da für diese Reaktion höhere Temperaturen nötig waren, kam für beide Apparaturen ein Heizpilz statt des Siliconöl-Bades zum Einsatz. Der Rieselbettreaktor kam bei der Friedel-Crafts-Acylierung nicht zum Einsatz, weil zwei Substrate an der Reaktion beteiligt sind. Die Dampfphase hat aufgrund 28
29 der unterschiedlichen Siedepunkte eine andere Zusammensetzung der Edukte als das benötigte stöchiometrische Verhältnis von eins zu eins [38]. Stickstoff Kühler Übergangsstück Rieselbettreaktor Heizdraht Glastiegel mit Katalysator Thermometer Magnetrührer Reaktionsgemisch Abbildung 3.3: Der Rieselbettreaktor ( * ª «" "«±² "± ² 7³ ² µ ² ± In den Rührkesselreaktor wurden 2 g Katalysator und 0,35 mol Phenylacetat unter Stickstoffatmosphäre ohne Lösungsmittel in den Dreihalskolben gegeben. Mit einem Heizpilz wurde das Reaktionsgemisch bei 469 K unter Rückfluß erhitzt. Ein Zirkulus sorgte während der 300 min Reaktionszeit für Durchmischung. Bei der Verwendung des Rieselbettreaktors wurde 0,35 mol Phenylacetat und je nach Versuchsvariation weitere Edukte in den Dreihalskolben unter Stickstoffatmosphäre gegeben. Der aktivierte, heiße Zeolith wurde in den 29
30 Glastiegel gefüllt mit Quarzwolle bedeckt und mit Hilfe einer Angel in den Reaktor gelassen. Der Heizpilz brachte das Phenylacetat bei 469 K zum Sieden. Der aufsteigende Dampf der Edukte strömte an dem elektrisch beheizten Rieselbettreaktor vorbei um im Rückflußkühler zu kondensieren. Das Kondensat tropfte nun in den Glastiegel auf die Quarzwolle, die gewährleisten sollte, daß die Katalysatorschüttung gleichmäßig durchlaufen wird. Das Reaktionsgemisch trat durch die Glasfritte PR 1 wieder aus und tropfte zurück in den Dreihalskolben. Dieser stationärer Zustand stellte sich nach ungefähr 15 min. ein. Die Reaktionszeit betrug 300 min. Im Laufe der Reaktion kam es bei beiden Aufbauten zu einer beigen bis braunen Verfärbung von Reaktionsgemisch und Katalysator. Mit einer Pasteurpipette wurde innerhalb der ersten Stunde alle 15 min, danach alle 30 min eine Probe zur gaschromatographischen Analyse entnommen. ¹ º ¹*»L¼Q½¾ 7À Á ÂQ¼JÃ*»LÂQÀ ÄCÁ"Å Æ ÂJ¼QÇ Die Probennahme und die anschließende gaschromatographische Analyse sowie die Auswertung erfolgte für beide Modellreaktionen auf dem gleichen Wege. È É È É Ê(ËQÌ Í"Î"Ï ÐÐÑ ÒÓ Ï Die Probennahme von nur wenigen Tropfen erfolgte direkt aus dem Reaktionsgefäß mit Hilfe einer Pasteurpipette. Zur gaschromatographischen Analyse mußte sichergestellt werden, daß sich in der Probe keine Feststoffteilchen mehr befanden, die die Säule des Gaschromatographen verstopfen könnten. Dazu wurde die Probe zur Filterung auf eine speziell präparierte Pasteurpipette gegeben. Diese Pipette war mit Quarzwolle und einer sich darauf befindlichen Schüttung von ca. 1,5 cm Kieselgel gefüllt. Mit ca. 1 ml Dichlormethan wurde dann die Probe durch die Schüttung gespült und in einem verschließbaren Probengläschen aufgefangen. Ô Õ Ô Õ Ö* CØ Ù(Ú7Û Ü Ý ÞÙ ß à Û"á ß âù Û ãxþ Mit Hilfe einer Mikroliterspritze wurde ungefähr 1 µl der zu analysierenden Probe in die Flüssigdosierung des Gaschromatographen eingespritzt. Von dort aus gelangte die Probe auf die Säule, wo sie temperaturprogrammiert (vgl. Tab. 3.7) aufgetrennt wurde. Am Ende der Säule wurden die Substanzen mit einem 30
Siedende Steine Siedesteine
 . Siedende Steine Siedesteine Siedende Steine Siedesteine Siedesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 Si 2 8 ] Siedende Steine Siedesteine Siedesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 Si 2 8 ]
. Siedende Steine Siedesteine Siedende Steine Siedesteine Siedesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 Si 2 8 ] Siedende Steine Siedesteine Siedesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 Si 2 8 ]
Synthese und Charakterisierung von Zeolithen: Zeolith A (Norbert Stock) 1. Synthese und Charakterisierung von Zeolithen. Zeolith A
 Synthese und Charakterisierung von Zeolithen: Zeolith A (Norbert Stock) 1 Versuch P1 Synthese und Charakterisierung von Zeolithen Zeolith A Motivation Dieser Versuch soll Sie in das Gebiet der Zeolithe
Synthese und Charakterisierung von Zeolithen: Zeolith A (Norbert Stock) 1 Versuch P1 Synthese und Charakterisierung von Zeolithen Zeolith A Motivation Dieser Versuch soll Sie in das Gebiet der Zeolithe
Zeolithe. Was sind sie? Wozu werden sie verwendet?
 Folie 1 Zeolithe Was sind sie? Wozu werden sie verwendet? Folie 2... im Feuer vor dem Lötröhrchen wallet und schäumet fast wie Borax". Zeolithe wurden vor zweihundert Jahren entdeckt als ein Mineral, das
Folie 1 Zeolithe Was sind sie? Wozu werden sie verwendet? Folie 2... im Feuer vor dem Lötröhrchen wallet und schäumet fast wie Borax". Zeolithe wurden vor zweihundert Jahren entdeckt als ein Mineral, das
5007 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin
 57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Praktikumsversuch: Zeolithe
 Praktikumsversuch: Zeolithe Darstellung von Zeolith A {[Na + ] 96 [216 H 2 O]}{[AlO 2 ] 96 [SiO 2 ] 96 } Zeolithe Siedende Steine (griech.: Zeo = ich siede, lithos = Stein) Definition: Zeolithe sind kristalline,
Praktikumsversuch: Zeolithe Darstellung von Zeolith A {[Na + ] 96 [216 H 2 O]}{[AlO 2 ] 96 [SiO 2 ] 96 } Zeolithe Siedende Steine (griech.: Zeo = ich siede, lithos = Stein) Definition: Zeolithe sind kristalline,
Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase
 Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase Von der Fakultät für Mathematik und Naturwissenschaften der zur Erlangung des Grades eines Doktors der Naturwissenschaften
Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase Von der Fakultät für Mathematik und Naturwissenschaften der zur Erlangung des Grades eines Doktors der Naturwissenschaften
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
Zeolithe Siedende Steine
 Zeolithe Siedende Steine AGP-Versuch 4.53 (ZSM-5) AGP-Begleitvorlesung, 11.2012, C. Röhr Einleitung Strukturen Synthese Verwendung Zusammenfassung Literatur Einleitung Einleitung Strukturen Synthese Verwendung
Zeolithe Siedende Steine AGP-Versuch 4.53 (ZSM-5) AGP-Begleitvorlesung, 11.2012, C. Röhr Einleitung Strukturen Synthese Verwendung Zusammenfassung Literatur Einleitung Einleitung Strukturen Synthese Verwendung
Siedende Steine Siedesteine
 . edende Steine edesteine edende Steine edesteine edesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 2 8 ] edende Steine edesteine edesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 2 8 ] edende Steine: Zeo Lithos
. edende Steine edesteine edende Steine edesteine edesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 2 8 ] edende Steine edesteine edesteine: z.b. Ca-Feldspat (Anorthit) Ca[Al 2 2 8 ] edende Steine: Zeo Lithos
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on
 Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester
 NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol
 Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Dietikon, 3. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Dietikon, 3. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol
 4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid
 NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Test für das Grundlagentraining 1
 Test für das Grundlagentraining 1 Liebe Schachspielerin, lieber Schachspieler! Die folgenden Seiten sollen überprüfen, inwieweit du die Inhalte des Grundlagentrainings 1 beherrscht. Das kann Dir helfen,
Test für das Grundlagentraining 1 Liebe Schachspielerin, lieber Schachspieler! Die folgenden Seiten sollen überprüfen, inwieweit du die Inhalte des Grundlagentrainings 1 beherrscht. Das kann Dir helfen,
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Synthese von Essigsäureisopropylester (1) Präparat 1
 Synthese von Essigsäureisopropylester (1) Präparat 1 1. Reaktionstyp: Azeotrope Veresterung 2. Reaktionsgleichung: 3 3 3 3 2 3 3 Essigsäure Isopropanol Essigsäureisopropylester Wasser 60,05 g/mol 60,1
Synthese von Essigsäureisopropylester (1) Präparat 1 1. Reaktionstyp: Azeotrope Veresterung 2. Reaktionsgleichung: 3 3 3 3 2 3 3 Essigsäure Isopropanol Essigsäureisopropylester Wasser 60,05 g/mol 60,1
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid
 1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol OH
 4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol
 4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Synthese von Essigsäureisobutylester
 Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von Essigsäureisobutylester Dietikon, 3. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Der Essigsäurebutylester
Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von Essigsäureisobutylester Dietikon, 3. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Der Essigsäurebutylester
5 HPLC-Methodenentwicklung zur Isomerentrennung
 HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
Organisch-Chemisches Grundpraktikum Praxisseminar III
 Organisch-Chemisches Grundpraktikum Praxisseminar III Inhalt: Arbeiten mit Gasen Azeotropdestillation Naturstoffextraktion Laboretikette 3. April 21 Dr. Stefan Breitenlechner Lehrstuhl für Organische Chemie
Organisch-Chemisches Grundpraktikum Praxisseminar III Inhalt: Arbeiten mit Gasen Azeotropdestillation Naturstoffextraktion Laboretikette 3. April 21 Dr. Stefan Breitenlechner Lehrstuhl für Organische Chemie
3012 Synthese von Adamantylidenadamantan aus Adamantanon
 Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Chloro(salen*)mangan(III)
 Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
Organisches Praktikum I - SS 2006 Assistentin: Gabi Marti. Synthese von. Isobutylacetat. Zürich, Balzers & Eschen, Mai 2005
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
Feststellungsprüfung Chemie Lösungen. Wegen seiner hohen Reaktivität kommt Chlor in der Natur nicht elementar vor. = 26, ,957=35,45
 Thema I 1a 1b 1c 1d 1e 2a 2b Feststellungsprüfung Chemie Lösungen Wegen seiner hohen Reaktivität kommt Chlor in der Natur nicht elementar vor.,,,, = 26,496 8,957=35,45 Die relative Isotopenmasse ist die
Thema I 1a 1b 1c 1d 1e 2a 2b Feststellungsprüfung Chemie Lösungen Wegen seiner hohen Reaktivität kommt Chlor in der Natur nicht elementar vor.,,,, = 26,496 8,957=35,45 Die relative Isotopenmasse ist die
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester
 NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken
 Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
5009 Synthese von Kupferphthalocyanin
 P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
1. Teilprüfung (30 P) - Gruppe A
 Chemisches Grundpraktikum IIB (270062) und Spezielle Synthesechemie (270222) W2016 24.10.2016 1. Teilprüfung (30 P) - Gruppe A NAME: Vorname: Matrikel Nr.: Bitte alle Fragen möglichst an dem dafür vorgesehenen
Chemisches Grundpraktikum IIB (270062) und Spezielle Synthesechemie (270222) W2016 24.10.2016 1. Teilprüfung (30 P) - Gruppe A NAME: Vorname: Matrikel Nr.: Bitte alle Fragen möglichst an dem dafür vorgesehenen
Darstellung von Malachitgrün Präparat 5
 Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231
 Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie. Allgemeine Chemie. Rückblick auf vorherige Übung
 Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Organostickstoff- Verbindungen
 rganostickstoff- Verbindungen [1] Chiralität von Aminen [2] -Enantiomere Isomerisieren sehr schnell -E A 20-30 KJ/mol [2] Alkylierung von Ammoniak [2] [2] [2] -geringe Selektivität aufgrund von Mehrfachalkylierung
rganostickstoff- Verbindungen [1] Chiralität von Aminen [2] -Enantiomere Isomerisieren sehr schnell -E A 20-30 KJ/mol [2] Alkylierung von Ammoniak [2] [2] [2] -geringe Selektivität aufgrund von Mehrfachalkylierung
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
3021 Oxidation von Anthracen zu Anthrachinon
 xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
Technische Universität Dresden Fachrichtung Chemie Modul OC II
 Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren Brombutanen
 1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren ombutanen Na R R + Adogen 464 + Na 4 9 (137.) 6 5 Na (116.1) 2a-c 1 14 (15.2) a: 2 1-ombutan b:
1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren ombutanen Na R R + Adogen 464 + Na 4 9 (137.) 6 5 Na (116.1) 2a-c 1 14 (15.2) a: 2 1-ombutan b:
Chemie für Biologen, Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema ) iii) Carbonsäure iv) Dicarbonsäure
 Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Synthese von tert-butylchlorid (2-Chloro-2-methylpropan)
 Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
8 Stevia qualitativ aus der Pflanze extrahieren
 8 Stevia qualitativ aus der Pflanze extrahieren 8.1 Vorwort Stevia ist der mit Abstand am teuersten Zuckerersatzstoff den wir untersucht haben, deshalb beschäftigte uns die Frage, wie der hohe Preis zu
8 Stevia qualitativ aus der Pflanze extrahieren 8.1 Vorwort Stevia ist der mit Abstand am teuersten Zuckerersatzstoff den wir untersucht haben, deshalb beschäftigte uns die Frage, wie der hohe Preis zu
Siedende Steine Zeolithe
 edende Steine Zeolithe (altgriechisch: ζǫon = zeon = siedend + λιθoσ = lithos = Stein) Caroline Röhr, Institut für Anorganische und Analytische Chemie, Universität Freiburg Schülertage April 2013 Einleitung
edende Steine Zeolithe (altgriechisch: ζǫon = zeon = siedend + λιθoσ = lithos = Stein) Caroline Röhr, Institut für Anorganische und Analytische Chemie, Universität Freiburg Schülertage April 2013 Einleitung
EINE 2 H-NMR-UNTERSUCHUNG ZUR INTRAKRISTALLINEN DIFFUSION VON BENZOL, TOLUOL UND XYLOL IN DEN ZEOLITHEN NAX UND NAY. Diplomarbeit. von.
 EINE 2 H-NMR-UNTERSUCHUNG ZUR INTRAKRISTALLINEN DIFFUSION VON BENZOL, TOLUOL UND XYLOL IN DEN ZEOLITHEN NAX UND NAY Diplomarbeit von Harald Schwarz Oktober 1988 Lehrstuhl für Physikalische Chemie II Fachbereich
EINE 2 H-NMR-UNTERSUCHUNG ZUR INTRAKRISTALLINEN DIFFUSION VON BENZOL, TOLUOL UND XYLOL IN DEN ZEOLITHEN NAX UND NAY Diplomarbeit von Harald Schwarz Oktober 1988 Lehrstuhl für Physikalische Chemie II Fachbereich
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Organisch-chemisches Praktikum Wintersemester 2005/06. 1-Phenyl-propan-1-ol. Stephan Steinmann
 Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid
 2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
... City Trip. City Trip. City Trip! DUBLIN. CityTrip EXTRATIPPS. City-Faltplan. Mit Faltplan. Preisbewusste Nachteulen
 T x ü: ß 147 T T 11 T - 142 10 144 T! T 3 I T 8 I 130 ä I T T T - T XTTI x I T T T T T T x -- x T T è 8 I 19 1 4, ü Ü 90 T T 74 143 2014/1 14 13 T ä : á I 978-3-8317-2424- 18 ç 9 I -ü, 144 9,9 [] I 49
T x ü: ß 147 T T 11 T - 142 10 144 T! T 3 I T 8 I 130 ä I T T T - T XTTI x I T T T T T T x -- x T T è 8 I 19 1 4, ü Ü 90 T T 74 143 2014/1 14 13 T ä : á I 978-3-8317-2424- 18 ç 9 I -ü, 144 9,9 [] I 49
β-binaphthol (1,1 -Binaphthyl-2,2 -diol)
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von β-binaphthol (1,1 -Binaphthyl-2,2 -diol) Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1, 2
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von β-binaphthol (1,1 -Binaphthyl-2,2 -diol) Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1, 2
5026 Oxidation von Anthracen zu Anthrachinon
 NP 506 xidation von Anthracen zu Anthrachinon KMn /Al C H 0 KMn C H 8 (78.) (58.0) (08.) Literatur Nüchter, M., ndruschka, B., Trotzki, R., J. Prakt. Chem. 000,, No. 7 Klassifizierung Reaktionstypen und
NP 506 xidation von Anthracen zu Anthrachinon KMn /Al C H 0 KMn C H 8 (78.) (58.0) (08.) Literatur Nüchter, M., ndruschka, B., Trotzki, R., J. Prakt. Chem. 000,, No. 7 Klassifizierung Reaktionstypen und
3. Übung Grundlagen der Hauptgruppenchemie
 Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Klausur 3 Klasse 11c Physik Lösungsblatt
 16.05.00 Klausur 3 Klasse 11c Physik Lösungsblatt Bei den Aufgaben dürfen Sie ausschließlich die Programme Cassy-Lab, erive 5 und Excel benutzen. Alle schriftlichen Überlegungen und Ergebnisse müssen auf
16.05.00 Klausur 3 Klasse 11c Physik Lösungsblatt Bei den Aufgaben dürfen Sie ausschließlich die Programme Cassy-Lab, erive 5 und Excel benutzen. Alle schriftlichen Überlegungen und Ergebnisse müssen auf
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Organische Chemie III
 Organische Chemie III Sommersemester 2012 Technische Universität München Klausur am 15.06.2012 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Bachelor... (Eigenhändige
Organische Chemie III Sommersemester 2012 Technische Universität München Klausur am 15.06.2012 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Bachelor... (Eigenhändige
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
Berichte OCP1. Manuela Bieri 17. Januar 2007
 Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Synthese von Dibenzalaceton (DBA) (1,5-Bisphenylpenta-1E,4E-dien-3-on)
 Praktikum rganische Chemie I Zürich, 08.01.2006 529-0229-00L (für Biol./arm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Dibenzalaceton (DBA)
Praktikum rganische Chemie I Zürich, 08.01.2006 529-0229-00L (für Biol./arm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Dibenzalaceton (DBA)
5001 Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol
 00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
3 Reaktionsmechanismus. 3.1 Auswahl der Modellsubstanzen
 Reaktionsmechanismus 15 3 Reaktionsmechanismus 3.1 Auswahl der Modellsubstanzen Für die Untersuchungen wurde auf Modellsubstanzen mit aromatischer Grundstruktur zurückgegriffen. Zunächst erfolgten die
Reaktionsmechanismus 15 3 Reaktionsmechanismus 3.1 Auswahl der Modellsubstanzen Für die Untersuchungen wurde auf Modellsubstanzen mit aromatischer Grundstruktur zurückgegriffen. Zunächst erfolgten die
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie
![Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie](/thumbs/74/70509027.jpg) Protokoll Versuch 2 Versuchsprotokoll Fachbereich 2: Chemie Autor: Marcus Knappert Studienbereich: Fachbereich 2: Chemie Matrikelnummer: 24 24 74 3 E-Mail: marcus.knappert@gmx.de Semester: Wintersemester
Protokoll Versuch 2 Versuchsprotokoll Fachbereich 2: Chemie Autor: Marcus Knappert Studienbereich: Fachbereich 2: Chemie Matrikelnummer: 24 24 74 3 E-Mail: marcus.knappert@gmx.de Semester: Wintersemester
Gruppenpräparat: Versuch Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon
 P II Praktikum im WS 2008/2009 Gruppenpräparat: Versuch 7.4.1.1 Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon 1.Gruppe: Christoph Mann Marco Schott 2.Gruppe: Tim Walter Holger Hartleb Stefan
P II Praktikum im WS 2008/2009 Gruppenpräparat: Versuch 7.4.1.1 Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon 1.Gruppe: Christoph Mann Marco Schott 2.Gruppe: Tim Walter Holger Hartleb Stefan
Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 R 2
 rganische Chemie Ri 12 2.5. Ketone Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 C R 2 R 1 C R 2 R 1 C R 2 Strukturformel Elektronenstrichformel
rganische Chemie Ri 12 2.5. Ketone Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 C R 2 R 1 C R 2 R 1 C R 2 Strukturformel Elektronenstrichformel
Synthese von DOC (2,5-Dimethoxy-4-chloramphetamin)
 T + K (2000) 68 (2): 62 Synthese von D (2,5-Dimethoxy-4-chloramphetamin) Dorothea Ehlers und Johanna Schäning Technische Fachhochschule Berlin, FB V, Kurfürstenstrasse 141, D-1210 Berlin, e-mail: ehlers@tfh-berlin.de
T + K (2000) 68 (2): 62 Synthese von D (2,5-Dimethoxy-4-chloramphetamin) Dorothea Ehlers und Johanna Schäning Technische Fachhochschule Berlin, FB V, Kurfürstenstrasse 141, D-1210 Berlin, e-mail: ehlers@tfh-berlin.de
Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin
 Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin Matthias Kellermeier Einordnung der nucleophilen Katalyse und Beispiele nucleophiler Katalysatoren Nucleophile Katalyse bislang wenig erforscht;
Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin Matthias Kellermeier Einordnung der nucleophilen Katalyse und Beispiele nucleophiler Katalysatoren Nucleophile Katalyse bislang wenig erforscht;
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Betreuer: Tobias Olbrich Literatur: Nach Organic Syntheses Coll. Vol. 10 (2004), 96.
 rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
Aldehyde und Ketone Carbonylverbindungen
 Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Acylierung aromatischer Verbindungen an Zeolithen vom Typ Beta
 Studiengang Diplom Chemie Diplomarbeit Acylierung aromatischer Verbindungen an Zeolithen vom Typ Beta vorgelegt von: Elke Schlotthauer Betreuender Gutachter: Prof. Dr. Frank Rößner Zweiter Gutachter: Priv.-Doz.
Studiengang Diplom Chemie Diplomarbeit Acylierung aromatischer Verbindungen an Zeolithen vom Typ Beta vorgelegt von: Elke Schlotthauer Betreuender Gutachter: Prof. Dr. Frank Rößner Zweiter Gutachter: Priv.-Doz.
6 Zusammenfassung und Ausblick
 6. Zusammenfassung und Ausblick 117 6 Zusammenfassung und Ausblick Der Schwerpunkt dieser Arbeit lag in stationären und instationären Untersuchungen zur Methanolsynthese. Ein Ziel war, den Einfluss der
6. Zusammenfassung und Ausblick 117 6 Zusammenfassung und Ausblick Der Schwerpunkt dieser Arbeit lag in stationären und instationären Untersuchungen zur Methanolsynthese. Ein Ziel war, den Einfluss der
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Synthese von cis- und trans-stilben
 28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
1017 Azokupplung von Benzoldiazoniumchlorid mit 2-Naphthol zu 1-Phenylazo-2-naphthol
 OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Carbonsäuren und Derivate. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Carbonsäuren und Derivate Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Carbonsäuren und Derivate Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse
 III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse III.1. Einleitung Bei der Art Apis mellifera lassen sich nach Angaben von Carlson et al. (1989) europäische und afrikanische Rassen
III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse III.1. Einleitung Bei der Art Apis mellifera lassen sich nach Angaben von Carlson et al. (1989) europäische und afrikanische Rassen
Herstellung von Natriumethanolat
 Illumina-Chemie.de - Artikel Synthesen Herstellung von Natriumethanolat Die folgende Anleitung kann zur Orientierung zur Herstellung anderer Natriumalkoholate verwendet werden. Allerdings muss bei der
Illumina-Chemie.de - Artikel Synthesen Herstellung von Natriumethanolat Die folgende Anleitung kann zur Orientierung zur Herstellung anderer Natriumalkoholate verwendet werden. Allerdings muss bei der
