Dossier zur Nutzenbewertung gemäß 35a SGB V
|
|
|
- Harald Hermann
- vor 5 Jahren
- Abrufe
Transkript
1 Dokumentvorlage, Version vom Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
2 Inhaltsverzeichnis Seite Tabellenverzeichnis... 2 Eigene Tabellen... 3 Abbildungsverzeichnis... 4 Abkürzungsverzeichnis Modul 2 allgemeine Informationen Allgemeine Angaben zum Arzneimittel Administrative Angaben zum Arzneimittel Angaben zum Wirkmechanismus des Arzneimittels Zugelassene Anwendungsgebiete Anwendungsgebiete, auf die sich das Dossier bezieht Beschreibung der Informationsbeschaffung für Modul Referenzliste für Modul Lenvatinib (Lenvima ) Seite 1 von 17
3 Tabellenverzeichnis Seite Tabelle 2-1: Allgemeine Angaben zum zu bewertenden Arzneimittel... 6 Tabelle 2-2: Pharmazentralnummern und Zulassungsnummern für das zu bewertende Arzneimittel... 7 Tabelle 2-3: Zugelassene Anwendungsgebiete, auf die sich das Dossier bezieht Tabelle 2-4: Weitere in Deutschland zugelassene Anwendungsgebiete des zu bewertenden Arzneimittels Lenvatinib (Lenvima ) Seite 2 von 17
4 Eigene Tabellen Tabelle 2-A: In Deutschland zugelassene Arzneimittel im Anwendungsgebiet Tabelle 2-B: Multiple TKI und ihre Ziel-Rezeptor-Tyrosinkinasen Lenvatinib (Lenvima ) Seite 3 von 17
5 Abbildungsverzeichnis Es konnten keine Einträge für ein Abbildungsverzeichnis gefunden werden. Seite Lenvatinib (Lenvima ) Seite 4 von 17
6 Abkürzungsverzeichnis Abkürzung ATC-Code ATP BRAF c-kit c-raf DFG DTC FGF FGFR FLT3R HCC MAPK PDGF PDGF-A PDGF-B PDGF-C PDGF-D PDGFR PDGFRα PDGFRβ PI3K PZN RAI RET TKI VEGF VEGFR V600E Bedeutung Anatomisch-Therapeutisch-Chemischer Code Adenosintriphosphat Rapidly Accelerated Fibrosarcoma; Isoform B Tyrosinkinase KIT Rapidly Accelerated Fibrosarcoma; Isoform C Asparaginsäure, Phenylalanin, Glycin Schilddrüsenkarzinom Fibroblast Growth Factor Fibroblast Growth Factor Receptor Fms-Like Tyrosine kinase 3 Receptor Hepatocellular carcinoma Mitogen-Aktivated Protein Kinase Platelet-Derived Growth Factor Platelet-Derived Growth Factor Subunit A Platelet-Derived Growth Factor Subunit B Platelet-Derived Growth Factor Subunit C Platelet-Derived Growth Factor Subunit D Platelet-Derived Growth Factor Receptor Platelet-Derived Growth Factor Receptor alpha Platelet-Derived Growth Factor Receptor beta Phosphatidyl Inositol-3-Kinase Pharmazentralnummer Radiojodtherapie Rearranged during transfection tyrosine kinase Tyrosinkinase-Inhibitor Vascular Endothelial Growth Factor Vascular Endothelial Growth Factor Receptor Mutationsstatus V600E der BRAF Kinase (Austausch Valin gegen Glutaminsäure) Lenvatinib (Lenvima ) Seite 5 von 17
7 2 Modul 2 allgemeine Informationen Modul 2 enthält folgende Informationen: Allgemeine Angaben über das zu bewertende Arzneimittel (Abschnitt 2.1) Beschreibung der Anwendungsgebiete, für die das zu bewertende Arzneimittel zugelassen wurde (Abschnitt 2.2); dabei wird zwischen den Anwendungsgebieten, auf die sich das Dossier bezieht, und weiteren in Deutschland zugelassenen Anwendungsgebieten unterschieden. Alle in den Abschnitten 2.1 und 2.2 getroffenen Aussagen sind zu begründen. Die Quellen (z. B. Publikationen), die für die Aussagen herangezogen werden, sind in Abschnitt 2.4 (Referenzliste) eindeutig zu benennen. Das Vorgehen zur Identifikation der Quellen ist im Abschnitt 2.3 (Beschreibung der Informationsbeschaffung) darzustellen. Im Dokument verwendete Abkürzungen sind in das Abkürzungsverzeichnis aufzunehmen. Sofern Sie für Ihre Ausführungen Tabellen oder Abbildungen verwenden, sind diese im Tabellen- bzw. Abbildungsverzeichnis aufzuführen. 2.1 Allgemeine Angaben zum Arzneimittel Administrative Angaben zum Arzneimittel Geben Sie in Tabelle 2-1 den Namen des Wirkstoffs, den Handelsnamen und den ATC-Code für das zu bewertende Arzneimittel an. Tabelle 2-1: Allgemeine Angaben zum zu bewertenden Arzneimittel Wirkstoff: Lenvatinib Handelsname: Lenvima ATC-Code: L01XE29 Geben Sie in der nachfolgenden Tabelle 2-2 an, welche Pharmazentralnummern (PZN) und welche Zulassungsnummern dem zu bewertenden Arzneimittel zuzuordnen sind, und benennen Sie dabei die zugehörige Wirkstärke und Packungsgröße. Fügen Sie für jede Pharmazentralnummer eine neue Zeile ein. Lenvatinib (Lenvima ) Seite 6 von 17
8 Tabelle 2-2: Pharmazentralnummern und Zulassungsnummern für das zu bewertende Arzneimittel Pharmazentralnummer (PZN) Zulassungsnummer Wirkstärke Packungsgröße EU/1/15/1002/001 4 mg Hartkapseln: Jede Hartkapsel enthält Lenvatinibmesilat, das 4 mg Lenvatinib entspricht EU/1/15/1002/ mg Hartkapseln: Jede Hartkapsel enthält Lenvatinibmesilat, das 10 mg Lenvatinib entspricht 4 mg Hartkapseln: Packung mit 30 Tabletten à 4 mg 10 mg Hartkapseln: Packung mit 30 Tabletten à 10 mg Angaben zum Wirkmechanismus des Arzneimittels Beschreiben Sie den Wirkmechanismus des zu bewertenden Arzneimittels. Begründen Sie Ihre Angaben unter Nennung der verwendeten Quellen. Tyrosinkinasen sind Enzyme, die durch Phosphorylierung der Aminosäure Tyrosin Proteine in ihrer Aktivität verändern. Die phosphorylierten Tyrosinreste können Bestandteil eigener Proteinstrukturen (Autophosphorylierung) oder andere Proteine sein. Durch die Steuerung der Aktivität von Proteinen kommt den Tyrosinkinasen eine wichtige Bedeutung in der Signalweiterleitung zellulärer Prozesse zu. Tyrosinkinasen lassen sich in verschiedene Gruppen einteilen: Sie können Teil eines an der Zellmembran gebundenen Rezeptors sein (Rezeptor- Tyrosinkinasen), wobei die Tyrosinkinase dann ein Teil der intrazellulären Domäne ist. Alternativ sind die Tyrosinkinasen nicht direkt Teil des membrangebundenen Rezeptors, sondern binden an diesen Rezeptor und stellen damit die Gruppe der nicht membrangebundenen Tyrosinkinasen dar (Nicht-Rezeptor-Tyrosinkinasen) (Paul und Mukhopadhyay 2004). Mindestens 90 Tyrosinkinasen sind bisher bekannt, davon 58 Rezeptor-Tyrosinkinasen und 32 Nicht-Rezeptor-Tyrosinkinasen. Die Rezeptor-Tyrosinkinasen lassen sich in weitere Subgruppen unterteilen, wie beispielsweise die Familie der vaskulären endothelialen Wachstumsfaktor-Rezeptoren (engl. Vascular Endothelial Growth Factor Receptor, VEGFR), die Familie der Plättchen-Wachstumsfaktor-Rezeptoren (engl. Platelet-derived Growth Factor Receptor, PDGFR), die Familie der Fibroblasten-Wachstumsfaktor-Rezeptoren (engl. Fibroblast Growth Factor Receptor, FGFR) und die Familie der Rearranged during transfection tyrosine kinase (RET)-Rezeptoren (Madhusudan und Ganesan 2004). Bei Bindung eines Liganden an die etrazelluläre Liganden-Bindungsstelle der Rezeptor- Tyrosinkinase kommt es zu einer Konformationsänderung, wodurch die intrazelluläre Tyrosinkinasendomäne aktiviert und daraufhin eigene (reversibel) sowie die Tyrosinreste anderer Proteine phosphoryliert werden. Diese Konformationsänderung geht entweder auf die Lenvatinib (Lenvima ) Seite 7 von 17
9 Homodimerisierung zweier gleicher oder auf die Heterodimerisierung zweier unterschiedlicher Rezeptorsubtypen zurück (Madhusudan und Ganesan 2004; Müller-Tidow et al. 2007). Durch die Aktivierung der Tyrosinkinasen und die anschließende Phosphorylierung von Tyrosinresten wird eine Kaskade über signalweiterleitende Proteine in Gang gesetzt, wodurch das etrazelluläre Signal (d.h. der Ligand) in intrazelluläre Signale transformiert wird (Faivre et al. 2006; Madhusudan und Ganesan 2004). Diese intrazellulären Signale induzieren via Genepression zahlreiche biologische Prozesse wie Zellproliferation, Zell-Zyklus-Progression, Apoptose, Angiogenese und Zellmigration (Faivre et al. 2006; Hunter 1998; Madhusudan und Ganesan 2004; Müller-Tidow et al. 2007). Fehlregulierte Tyrosinkinasen sind maßgeblich an der Bildung maligner Tumoren und der Tumorprogression beteiligt (Madhusudan und Ganesan 2004; Müller-Tidow et al. 2007). Durch Mutationen oder auch Überepressionen von Rezeptor-Tyrosinkinasen kann es zu einer unkontrollierten und Liganden-unabhängigen Dauer-Signalübertragung kommen und in deren Folge zur Proliferation, Metastasierung und Tumor-Angiogenese (Müller-Tidow et al. 2007; Yakes et al. 2011). Die Hemmung der Rezeptor-Tyrosinkinasen durch Tyrosinkinase-Inhibitoren (TKI), zu denen auch Lenvatinib zählt, stellt eine wichtige therapeutische Möglichkeit zur Behandlung von Tumorerkrankungen dar (Faivre et al. 2006; Müller-Tidow et al. 2007; Yamamoto et al. 2014). Die Mehrzahl der TKI hemmen die Tyrosinkinase-Aktivität durch Bindung an die intrazelluläre Adenosintriphosphat (ATP)-Bindungsstelle der Rezeptor-Tyrosinkinase, wodurch die Phosphorylierung verhindert und so die intrazelluläre Signalübertragung unterbrochen wird (Faivre et al. 2006; Müller-Tidow et al. 2007). Die anti-tumorale Wirkung von TKI zeigt sich insbesondere durch zwei Funktionen: die anti-angiogene und die anti-proliferative Funktion (Sunnie und Ghassan 2014). Diese beiden anti-tumoralen Funktionen werden im Folgenden für den TKI Lenvatinib beschrieben. Anti-angiogene Funktion von Lenvatinib Aufgrund des hohen Vaskularisierungs-Grades von Leberzellkarzinomen (engl. hepatocellular carcinoma, HCC) spielt die Hemmung der Angiogenese bei der Behandlung dieser Tumore eine besonders große Rolle (Sunnie und Ghassan 2014). Hierbei kommen der Hypoie (Sauerstoff- Mangelversorgung) und der dadurch ausgelösten kompensatorischen Hyperaktivierung der Angiogenese eine Schlüsselrolle in der Entwicklung des HCC zu (Wu X. et al. 2007). Lenvatinib hemmt verschiedene Rezeptor-Tyrosinkinasen, die eine Rolle in der Tumor- Angiogenese spielen. Die anti-angiogenen Eigenschaften von Lenvatinib ergeben sich vor allem durch die Hemmung der Rezeptor-Tyrosinkinasen VEGFR und FGFR, aber auch durch die Hemmung der Rezeptor-Tyrosinkinasen PDGFR und KIT (c-kit) (Banumathy und Cairns 2010; Sunnie und Ghassan 2014). Die Funktionen der Rezeptor-Tyrosinkinasen VEGFR, FGFR, PDGFR und c-kit sowie deren Beteiligung an angiogenen Prozessen werden nachfolgend erläutert. Die Tumor-Angiogenese verläuft in einem mehrstufigen Prozess, der von verschiedenen proangiogenen Faktoren und Inhibitoren gesteuert wird (Raica und Cimpean 2010). Viele Lenvatinib (Lenvima ) Seite 8 von 17
10 Wachstumsfaktoren, wie VEGF, FGF-2 oder PDGF, sind maßgeblich an der Induktion und Progression der Angiogenese beteiligt (Raica und Cimpean 2010). VEGF sind zentrale Wachstumsfaktoren, die vor allem über Aktivierung des Mitogenaktivierten Proteinkinase (engl. Mitogen-Activated Protein Kinase, MAPK)- und des Phosphatidyl-Inositol-3-Kinase (PI3K)-Akt-Signalweges die Bildung neuer Blutgefäße mit normaler (d.h. nicht krankhafter) Struktur und Funktion stimulieren (Ferrara 2005). In Tumoren treibt VEGF die Tumor-Angiogenese an und ist daher ein wichtiger prognostischer Marker in soliden Tumoren (Madhusudan und Ganesan 2004; Raica und Cimpean 2010). Eine gesteigerte Epression von VEGF ist sowohl beim HCC als auch in anderen Tumoren mit einer schlechten Prognose verbunden (Ferrara 2005). VEGF führt zu vaskulärer Permeabilität, Endothelzell- Proliferation und -Migration sowie Tubenbildung und ist damit ein Schlüsselregulator des Tumorwachstums und der Metastasierung (Fo et al. 2001; Schöffski et al. 2006; Yamamoto et al. 2014). Blutgefäße in Tumoren, die unter dem Einfluss von VEGF gebildet wurden, sind in der Regel desorganisiert, entartet sowie undicht und weisen einen hohen interstitiellen Druck auf. Die Zufuhr von Sauerstoff sowie von Medikamenten durch die Blutgefäße ist daher wesentlich schlechter als in normalem Gewebe. Dies trägt zu einer positiven Selektion von Krebszellen und der Entwicklung von Resistenzen gegenüber Medikamenten und Bestrahlung bei (Ferrara 2005; Fo et al. 2001). Die Hemmung von VEGF bzw. der VEGF / VEGFR- Interaktion unterbricht die Signalübertragung und führt demzufolge zu einer Normalisierung der vaskulären Permeabilität und zu reduziertem interstitiellen Druck (Ferrara 2005). Folglich kommt es zu verringertem Tumorwachstum, einer Hemmung der Progression für einen längeren Zeitraum und verringerter Invasivität (Stjepanovic und Capdevila 2014). VEGF-Rezeptoren (VEGFR) lassen sich in drei Subtypen unterteilen: VEGFR-1, VEGFR-2 und VEGFR-3. An der Angiogenese sind insbesondere VEGFR-1 und VEGFR-2 beteiligt. Die genaue Funktion von VEGFR-1 ist noch nicht abschließend geklärt. Verschiedene Evidenz zeigt aber, dass VEGFR-1 sowohl positive als auch negative Einflüsse auf die Angiogenese hat (Ferrara 2005; Rahimi 2006). Während der frühen embryonalen Angiogenese ist VEGFR-1 ein wichtiger Gegenspieler und Kontrollmechanismus von VEGFR-2, im Gegensatz dazu jedoch auch unerlässlich für Tumorwachstum und Metastasierung entarteter Zellen (Shibuya 2013). VEGFR-2 ist dagegen der wichtigste Mediator der Tumor-Angiogenese, der das Zellwachstum, die Differenzierung, die Migration und die Tubulogenese fördert (Ferrara 2005; Glen et al. 2011). VEGFR-3 wird überwiegend in lymphatischen endothelialen Zellen eprimiert und ist daher vor allem in die Neubildung lymphatischer Gefäße, die Lymphangiogenese, involviert (Ferrara 2005; Stjepanovic und Capdevila 2014). Viele HCC-Patienten, die mit gegen VEGF bzw. VEGFR gerichteten Therapien behandelt werden, entwickeln im Laufe der Zeit eine Resistenz gegen die Behandlung (Sunnie und Ghassan 2014). Dieser als erworbene Resistenz bezeichnete Mechanismus wurde neben der primären Resistenz unter der Therapie mit dem TKI Sorafenib in verschiedenen Studien beschrieben (Zhu et al. 2017). Der FGF / FGFR- Signalweg stellt häufig eine Alternative für Tumorzellen dar, wenn der Signalweg über VEGF / VEGFR blockiert ist. Infolge die Hemmung des FGF / FGFR-Signalweges durch Lenvatinib wird auch der für die Tumorangiogenese bekannte Kompensationsmechanismus blockiert (Stjepanovic und Capdevila 2014). Lenvatinib (Lenvima ) Seite 9 von 17
11 FGF sind Heparin-bindende Wachstumsfaktoren. Derzeit sind 23 FGF-Wachstumsfaktoren, FGF-1 bis FGF-23, und vier Rezeptor Subtypen, FGFR1 bis FGFR4, bekannt (St Bernard et al. 2005). Lenvatinib bindet an die Rezeptoren der Subtypen FGFR1 bis 4 (Eisai 2018). Die Komponenten des FGF / FGFR-Signalweges werden in vielen Geweben eprimiert und sind in eine Vielzahl biologischer Prozesse, beispielsweise der Organogenese, involviert (Turner und Grose 2010). In Tumoren spielt der FGF / FGFR Signalweg eine entscheidende Rolle für die Zellproliferation, die Resistenz gegenüber Chemotherapie durch anti-apoptotische Effekte und die Zellmigration (Turner und Grose 2010). FGF-Wachstumsfaktoren stimulieren außerdem alle Phasen der Angiogenese und schaffen somit eine für das Tumorwachstum geeignete Umgebung (Zheng et al. 2016). PDGF umfasst eine Gruppe von Wachstumsfaktoren (PDGF-A, PDGF-B, PDGF-C, PDGF- D), die bei der Embryogenese, Zellproliferation, Zellmigration, Wundheilung und Angiogenese eine Rolle spielen (Raica und Cimpean 2010). PDGFR sind Rezeptor-Tyrosinkinasen, die sich als Bindungsstelle für PDGF an der Zelloberfläche befinden. In Tumoren führt die PDGF / PDGFR-Wechselwirkung durch autokrine und zell-autonome Prozesse zur Stimulation der Angiogenese und zur Kontrolle des interstitiellen Tumordrucks und dadurch zu Tumorentwicklung und Tumorprogression (Raica und Cimpean 2010). Von besonderer klinischer Bedeutung ist PDGF-A, ein wichtiger chemotaktischer Faktor für die Bildung stromaler Fibroblasten, der physiologisch insbesondere von Herz- und Skelettmuskelzellen sowie im Pankreas eprimiert wird. Pathologisch wird PDGF-A auch von Tumorzellen produziert. Durch Unterbrechung des parakrinen Signalweges durch PDGFR dem Rezeptor für PDGF-A, können das Tumorwachstum und die Angiogenese reduziert werden (Raica und Cimpean 2010). PDGF-B und der dazugehörige Rezeptor PDGFRβ sind essentiell an der Entwicklung des kardiovaskulären Systems beteiligt, sowohl bei normalen als auch bei pathologischen Prozessen. PDGF-B führt gemeinsam mit anderen pro-angiogenen Faktoren zu Wachstum und Formation sowie zur Stabilisation neuer Blutgefäße. Die tumorbezogene Angiogenese wird von PDGF-B durch autokrine und / oder parakrine Mechanismen sowie durch Migration während der Tumorinvasion gefördert (Raica und Cimpean 2010). In vitro zeigt Lenvatinib eine Inhibition sowohl von PDGFR als auch PDGFRβ (Matsui et al. 2008). Klinisch zeigt sich für PDGFR eine im Vergleich zu anderen Rezeptor-Tyrosinkinasen schwächere Inhibition, so dass sich das klinische Inhibitionsprofil von Lenvatinib betreffend PDGFR auf PDGFR bezieht (Schlumberger et al. 2015). C-KIT ist eine Rezeptor-Tyrosinkinase, die eine wichtige Rolle bei der Hämatopoese, Melanogenese und Spermatogenese spielt (Tanaka et al. 1995). Eine Überepression von c- KIT führt zu onkogenen Prozessen, wie Proliferation, verringerter Apoptose und Metastasierung, letztere durch Zellmigration, Zell-Adhäsion und Zell-Invasion (Faivre et al. 2006). Eine Aktivierung von c-kit führt zur Induktion verschiedener Signalwege, wie z.b. dem MAPK-Signalweg und dem PI3K-Akt-Signalweg. Die erhöhte Aktivierung dieser Signalwege führt wiederum zu einer Aktivierung von Mastzellen, welche pro-angiogene Faktoren, wie VEGF, PDGFβ und FGF, sezernieren und somit eine Verstärkung der Angiogenese bewirken (Marech et al. 2014). Lenvatinib (Lenvima ) Seite 10 von 17
12 Zusammenfassend ist festzuhalten, dass Lenvatinib durch die gleichzeitige, effektive Hemmung der dargestellten angiogenen Signalwege die Tumorangiogenese und somit die Tumorprogression des HCC wirksam und für einen längeren Zeitraum inhibiert (Cheng et al. 2017; Ikeda et al. 2017). Anti-proliferative Funktion von Lenvatinib Die anti-proliferative Funktion von Lenvatinib entsteht durch zwei Mechanismen. Zum einen kontrolliert Lenvatinib über die Hemmung der Rezeptor-Tyrosinkinasen RET, c-kit und PDGFR die aberrante Tumorzell-Proliferation. Zum anderen beeinflusst Lenvatinib durch die Hemmung von FGFR1 bis 4 und PDGFR / β die Mikroumgebung des Tumors (Matsui et al. 2008; Stjepanovic und Capdevila 2014). Die Funktionen der Rezeptor-Tyrosinkinasen RET, c- KIT, PDGFR und FGFR und deren Beteiligung an proliferativen Prozessen werden nachfolgend erläutert. Die Rezeptor-Tyrosinkinase RET ist an der Aktivierung verschiedener Signalkaskaden, wie z.b. dem MAPK-Signalweg und dem PI3K-Akt-Signalweg, beteiligt (Stjepanovic und Capdevila 2014). Der MAPK-Signalweg und der PI3-Akt-Signalweg steuern die zellulären Prozesse der Differenzierung, Proliferation und Hemmung der Apoptose (Benvenga und Koch 2014). Eine aberrante Aktivierung dieser Signalwege kann so zur Initiierung und Progression von Krebs führen (Benvenga und Koch 2014). Die Überepression der Rezeptor-Tyrosinkinase c-kit führt zu onkogenen Prozessen, wie Proliferation, verringerte Apoptose und Metastasierung, letztere durch Zellmigration, Zell- Adhäsion und Zell-Invasion (Faivre et al. 2006). Die Beteiligung des PDGF / PDGFR-Signalweges und des FGF / FGFR-Signalweges an der Tumorzell-Proliferation und somit dem Tumorwachstum konnte in verschiedenen Tumorarten gezeigt werden (Raica und Cimpean 2010; St Bernard et al. 2005). Wie zuvor erläutert sind die Rezeptor-Tyrosinkinasen RET, c-kit, PDGFR und FGFR an zahlreichen proliferativen Prozessen beteiligt, die zur Tumorentwicklung und Tumorprogression führen. Die multiple Hemmung aberrant aktivierter Rezeptor- Tyrosinkinasen durch Lenvatinib ermöglicht es, die Tumorprogression bei Patienten mit Leberzellkarzinomen für einen längeren Zeitraum zu hemmen oder bei einzelnen Patienten eine Komplettremission herbeizuführen (Cheng et al. 2017; Ikeda et al. 2017). Beschreiben Sie, ob und inwieweit sich der Wirkmechanismus des zu bewertenden Arzneimittels vom Wirkmechanismus anderer bereits in Deutschland zugelassener Arzneimittel unterscheidet. Differenzieren Sie dabei zwischen verschiedenen Anwendungsgebieten, für die das zu bewertende Arzneimittel zugelassen ist. Begründen Sie Ihre Angaben unter Nennung der verwendeten Quellen. Lenvima ist indiziert als Monotherapie für die Behandlung von erwachsenen Patienten mit fortgeschrittenem oder inoperablem HCC, die zuvor noch keine systemische Therapie erhalten Lenvatinib (Lenvima ) Seite 11 von 17
13 haben. In dieser Indikation sind in Deutschland folgende weitere Wirkstoffe zugelassen (Tabelle 2-A): Tabelle 2-A: In Deutschland zugelassene Arzneimittel im Anwendungsgebiet Wirkstoffklasse Wirkstoff / Handelsname Anwendungsgebiet Tyrosin-Kinase-Inhibitor (zielgerichtete Therapie) Zielgerichtete Therapie Sorafenib / Neavar (Bayer Pharma AG 2018) Behandlung des Leberzellkarzinoms Multiple TKI Multiple TKI, wie Lenvatinib und Sorafenib, können verschiedene Signalwege gleichzeitig hemmen, indem sie auf mehrere Rezeptoren wirken (Tabelle 2-B) (Stjepanovic und Capdevila 2014). Die multiple Hemmung wichtiger Rezeptor-Tyrosinkinasen bietet zusätzlich die Option, mögliche Kompensationsstrategien der Tumorzellen ebenfalls zu blockieren (Sonpavde et al. 2014). Tabelle 2-B: Multiple TKI und ihre Ziel-Rezeptor-Tyrosinkinasen Lenvatinib (Eisai 2018; Matsui et al. 2008) Sorafenib (Bayer Pharma AG 2018) VEGFR1 VEGFR2 VEGFR3 FGFR1 FGFR2 FGFR3 FGFR4 PDGFRα PDGFRβ c-kit RET FLT3R c-raf BRAF V600E BRAF: Rapidly Accelerated Fibrosarcoma; Isoform B; c-kit: Tyrosinkinase KIT; c-raf: Rapidly Accelerated Fibrosarcoma; Isoform C; FGFR: Fibroblast Growth Factor Receptor; FLT3R: Fms-Like Tyrosine kinase 3 Receptor; PDGFR: Platelet-Derived Growth Factor Receptor; RET: Rearranged during transfection tyrosine kinase; V600E: Mutationsstatus V600E der BRAF Kinase (Austausch Valin gegen Glutaminsäure)VEGFR: Vascular Endothelial Growth Factor Receptor Lenvatinib (Lenvima ) Seite 12 von 17
14 Lenvatinib ist ein multipler TKI mit einem im Vergleich zu Sorafenib anderen Inhibitionsprofil, da Lenvatinib zusätzlich zu den VEGFR-Subtypen auch FGFR 1 bis 4 hemmt (Tabelle 2-B) (Sonpavde et al. 2014; St Bernard et al. 2005; Stjepanovic und Capdevila 2014). Durch die FGFR-Inhibition kann bei Lenvatinib die häufig beobachtete Entwicklung einer Resistenz gegen VEGF / VEGFR-Inhibitoren umgangen werden. Lenvatinib gehört zudem zu einer Klasse von TKI mit einem neuen Bindungsmechanismus. Alle vor Lenvatinib zugelassenen VEGFR2 TKI binden an die ATP-Bindungsstelle von VEGFR-2 (Okamoto et al. 2015). Hierbei können die Inhibitoren entweder die aktive Form von VEGFR-2, die sogenannte DFG-in Konformation (benannt nach der Orientierung der konservierten Aminosäure-Triade Asparaginsäure (D), Phenylalanin (F) und Glycin (G) am N- Terminus der Aktivierungsschleife), oder die inaktive Form von VEGFR-2, die sogenannte DFG-out Konformation binden. Typ-II Inhibitoren, wie z.b. Sorafenib, binden die inaktive Form von VEGFR-2, die sogenannte DFG-out Konformation, und zusätzlich die benachbarte nichtkonservierte allosterische Region. Diese Art der Bindung bedingt eine langsame Assoziations- und Dissoziationskinetik, d.h. eine lange Bindungsdauer bei meist hoher Selektivität. Lenvatinib hingegen zeigt als Typ-I-Inhibitor einen neuartigen Bindungsmechanismus, indem es die DFG-in Konformation und zusätzlich die benachbarte nichtkonservierte allosterische Region bindet (Okamoto et al. 2015). Dies resultiert in einer schnellen Assoziationskinetik und einer verlängerten Bindungsdauer und damit in einer mehr als zehnfach besseren Wirksamkeit gegen VEGFR-2 im Vergleich zu Sorafenib. Zudem bedingt die zusätzliche Bindung an die benachbarte Region eine mit Sorafenib vergleichbare Selektivität. Zusammenfassend hebt sich Lenvatinib von dem im Anwendungsgebiet zugelassenen zielgerichteten Therapeutikum Sorafenib durch die Blockade möglicher Kompensationsstrategien der Tumorzellen, und damit der Resistenzentwicklung gegen die alleinige VEGF / VEGFR Inhibition, sowie durch seine effektive Hemmung der Rezeptor- Tyrosinkinasen über ein neuartiges Bindungsprinzip entscheidend ab. 2.2 Zugelassene Anwendungsgebiete Anwendungsgebiete, auf die sich das Dossier bezieht Benennen Sie in der nachfolgenden Tabelle 2-3 die Anwendungsgebiete, auf die sich das vorliegende Dossier bezieht. Geben Sie hierzu den Wortlaut der Fachinformation an. Sofern im Abschnitt Anwendungsgebiete der Fachinformation Verweise enthalten sind, führen Sie auch den Wortlaut an, auf den verwiesen wird. Fügen Sie für jedes Anwendungsgebiet eine neue Zeile ein, und vergeben Sie eine Kodierung (fortlaufende Bezeichnung von A bis Z ) [Anmerkung: Diese Kodierung ist für die übrigen Module des Dossiers entsprechend zu verwenden]. Lenvatinib (Lenvima ) Seite 13 von 17
15 Tabelle 2-3: Zugelassene Anwendungsgebiete, auf die sich das Dossier bezieht Anwendungsgebiet (Wortlaut der Fachinformation inkl. Wortlaut bei Verweisen) Orphan (ja / nein) Datum der Zulassungserteilung Kodierung im Dossier a Lenvima ist indiziert als Monotherapie für die Behandlung von erwachsenen Patienten mit fortgeschrittenem oder inoperablem hepatozellulären Karzinom (HCC), die zuvor noch keine systemische Therapie erhalten haben (siehe Abschnitt 5.1) nein B a: Fortlaufende Angabe A bis Z. Benennen Sie die den Angaben in Tabelle 2-3 zugrunde gelegten Quellen. Die Beschreibung des zugelassenen Anwendungsgebiets, auf das sich das Dossier bezieht, ist der deutschen Fachinformation von Lenvima mit Stand August 2018 entnommen (Eisai 2018) Weitere in Deutschland zugelassene Anwendungsgebiete Falls es sich um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, benennen Sie in der nachfolgenden Tabelle 2-4 die weiteren in Deutschland zugelassenen Anwendungsgebiete des zu bewertenden Arzneimittels. Geben Sie hierzu den Wortlaut der Fachinformation an; sofern im Abschnitt Anwendungsgebiete der Fachinformation Verweise enthalten sind, führen Sie auch den Wortlaut an, auf den verwiesen wird. Fügen Sie dabei für jedes Anwendungsgebiet eine neue Zeile ein. Falls es kein weiteres zugelassenes Anwendungsgebiet gibt oder es sich nicht um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, fügen Sie in der ersten Zeile unter Anwendungsgebiet kein weiteres Anwendungsgebiet ein. Tabelle 2-4: Weitere in Deutschland zugelassene Anwendungsgebiete des zu bewertenden Arzneimittels Anwendungsgebiet (Wortlaut der Fachinformation inkl. Wortlaut bei Verweisen) LENVIMA ist indiziert für die Behandlung von erwachsenen Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem differenziertem (papillärem / follikulärem/ Hürthle-Zell-) Schilddrüsenkarzinom (DTC), das nicht auf eine Radiojodtherapie (RAI) angesprochen hat (Eisai 2018). Datum der Zulassungserteilung Datum der Erteilung der Zulassung: 28. Mai 2015 Benennen Sie die den Angaben in Tabelle 2-4 zugrunde gelegten Quellen. Falls es kein weiteres zugelassenes Anwendungsgebiet gibt oder es sich nicht um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, geben Sie nicht zutreffend an. Die Informationen sind der Fachinformation mit Stand August 2018 entnommen (Eisai 2018). Lenvatinib (Lenvima ) Seite 14 von 17
16 2.3 Beschreibung der Informationsbeschaffung für Modul 2 Erläutern Sie an dieser Stelle das Vorgehen zur Identifikation der im Abschnitt 2.1 und im Abschnitt 2.2 genannten Quellen (Informationsbeschaffung). Sofern erforderlich, können Sie zur Beschreibung der Informationsbeschaffung weitere Quellen benennen. Zur Informationsbeschaffung von Abschnitt Angaben zum Wirkmechanismus des Arzneimittels erfolgte eine orientierende Literaturrecherche unter der Verwendung von relevanten Schlagwörtern in den Datenbanken MEDLINE, Cochrane Library und PubMed sowie in online Suchmaschinen. Die Informationsbeschaffung zu Abschnitt 2.2 Zugelassene Anwendungsgebiete wurden der aktuellen deutschen Fachinformation von Lenvima mit Stand August 2018 entnommen (Eisai 2018). 2.4 Referenzliste für Modul 2 Listen Sie nachfolgend alle Quellen (z. B. Publikationen), die Sie in den vorhergehenden Abschnitten angegeben haben (als fortlaufend nummerierte Liste). Verwenden Sie hierzu einen allgemein gebräuchlichen Zitierstil (z. B. Vancouver oder Harvard). Geben Sie bei Fachinformationen immer den Stand des Dokuments an. 1. Banumathy G. und Cairns P Signaling pathways in renal cell carcinoma. Cancer biology & therapy 10 (7), S Bayer Pharma AG Fachinformation Neavar 200 mg Filmtabletten; Wirkstoff: Sorafenib. Stand Juni Benvenga S. und Koch C. A Molecular pathways associated with aggressiveness of papillary thyroid cancer. Current genomics 15 (3), S Cheng A. L. et al Phase III trial of lenvatinib (LEN) vs sorafenib (SOR) in first-line treatment of patients (pts) with unresectable hepatocellular carcinoma (uhcc). Journal of Clinical Oncology 35 (15), S Eisai Europe Ltd. (Eisai) Fachinformation Lenvima 4 mg/10 mg Hartkapseln; Wirkstoff: Lenvatinib. Stand August Faivre S. et al New paradigms in anticancer therapy: targeting multiple signaling pathways with kinase inhibitors. Seminars in oncology 33 (4), S Ferrara N VEGF as a therapeutic target in cancer. Oncology 69 Suppl 3, S Fo S. B. et al Angiogenesis: pathological, prognostic, and growth-factor pathways and their link to trial design and anticancer drugs. The Lancet. Oncology 2 (5), S Glen H. et al E7080, a multi-targeted tyrosine kinase inhibitor suppresses tumor cell migration and invasion. BMC cancer 11, S Lenvatinib (Lenvima ) Seite 15 von 17
17 10. Hunter T The Croonian Lecture The phosphorylation of proteins on tyrosine: its role in cell growth and disease. Philosophical Transactions of the Royal Society B: Biological Sciences 353 (1368), S Ikeda K. et al Phase 2 study of lenvatinib in patients with advanced hepatocellular carcinoma. Journal of Gastroenterology 52 (4), S Madhusudan S. und Ganesan T. S Tyrosine kinase inhibitors in cancer therapy. Clinical biochemistry 37 (7), S Marech I. et al Possible prognostic and therapeutic significance of c-kit epression, mast cell count and microvessel density in renal cell carcinoma. International journal of molecular sciences 15 (7), S Matsui J. et al Multi-kinase inhibitor E7080 suppresses lymph node and lung metastases of human mammary breast tumor MDA-MB-231 via inhibition of vascular endothelial growth factor-receptor (VEGF-R) 2 and VEGF-R3 kinase. Clinical cancer research: an official journal of the American Association for Cancer Research 14 (17), S Müller-Tidow C. et al Tyrosinkinasen als Ziele neuer onkologischer Therapien. Deutsches Ärzteblatt 19 (104), S. A Okamoto K. et al Distinct binding mode of multikinase inhibitor lenvatinib revealed by biochemical characterization. ACS medicinal chemistry letters 6 (1), S Paul M.P. und Mukhopadhyay A. K Tyrosine kinase Role and significance in Cancer. International Journal of Medical Science 1 (2), S Rahimi N VEGFR-1 and VEGFR-2: two non-identical twins with a unique physiognomy. Frontiers in bioscience: a journal and virtual library 11, S Raica M. und Cimpean A. M Platelet-Derived Growth Factor (PDGF)/PDGF Receptors (PDGFR) Ais as Target for Antitumor and Antiangiogenic Therapy. Pharmaceuticals (Basel, Switzerland) 3 (3), S Schlumberger M. et al Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. The New England journal of medicine 372 (7), S Schöffski P. et al Emerging role of tyrosine kinase inhibitors in the treatment of advanced renal cell cancer: a review. Annals of oncology: official journal of the European Society for Medical Oncology 17 (8), S Shibuya M Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases. Journal of biochemistry 153 (1), S Sonpavde G. et al Fibroblast growth factor receptors as therapeutic targets in clear-cell renal cell carcinoma. Epert opinion on investigational drugs 23 (3), S Lenvatinib (Lenvima ) Seite 16 von 17
18 24. St Bernard R. et al Fibroblast growth factor receptors as molecular targets in thyroid carcinoma. Endocrinology 146 (3), S Stjepanovic N. und Capdevila J Multikinase inhibitors in the treatment of thyroid cancer: specific role of lenvatinib. Biologics: targets & therapy 8, S Sunnie K. und Ghassan K. A The Role of Tyrosine Kinase Inhibitors in Hepatocellular Carcinoma. Clinical Advances in Hematology & Oncology 12 (1), S Tanaka T. et al c-kit proto-oncogene is more likely to lose epression in differentiated thyroid carcinoma than three thyroid-specific genes: thyroid peroidase, thyroglobulin, and thyroid stimulating hormone receptor. Endocrine journal 42 (5), S Turner N. und Grose R Fibroblast growth factor signalling: from development to cancer. Nature Reviews Cancer 10 (2), S Wu X. et al Hypoia and hepatocellular carcinoma: The therapeutic target for hepatocellular carcinoma. Journal of Gastroenterology and Hepatology 22 (8), S Yakes F. M. et al Cabozantinib (XL184), a novel MET and VEGFR2 inhibitor, simultaneously suppresses metastasis, angiogenesis, and tumor growth. Molecular cancer therapeutics 10 (12), S Yamamoto Y. et al Lenvatinib, an angiogenesis inhibitor targeting VEGFR/FGFR, shows broad antitumor activity in human tumor enograft models associated with microvessel density and pericyte coverage. Vascular cell 6, S Zheng N. et al Emerging roles of FGF signaling in hepatocellular carcinoma. Translational Cancer Research 5 (1), S Zhu Y. J. et al New knowledge of the mechanisms of sorafenib resistance in liver cancer. Acta pharmacologica Sinica 38 (5), S Lenvatinib (Lenvima ) Seite 17 von 17
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 2 Erwachsene Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 2 Erwachsene Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Pasireotid (Signifor ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Pasireotid (Signifor ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
NUB Antrag 2018/2019 Lenvatinib
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V
 Dokumentvorlage, Version vom 14.11.2013 Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V () Modul K1 Zusammenfassung der Aussagen im Dossier
Dokumentvorlage, Version vom 14.11.2013 Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V () Modul K1 Zusammenfassung der Aussagen im Dossier
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Kisplyx ) Eisai GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 29.09.2016 Inhaltsverzeichnis
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Kisplyx ) Eisai GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 29.09.2016 Inhaltsverzeichnis
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Albiglutid (Eperzan ) GlaxoSmithKline GmbH & Co. KG Zusatzdokument zur Nachforderung fehlender Unterlagen/Angaben (gemäß
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Albiglutid (Eperzan ) GlaxoSmithKline GmbH & Co. KG Zusatzdokument zur Nachforderung fehlender Unterlagen/Angaben (gemäß
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
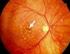 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
HINTERGRUND 1. WAS IST NINTEDANIB*? 2. WIRKMECHANISMUS
 HINTERGRUND 1. Was ist Nintedanib*? 2. Wirkmechanismus 3. Stand der Entwicklung 4. Studiendaten 5. Klinisches Potential 1. WAS IST NINTEDANIB*? Nintedanib* (Vargatef ) ist ein oraler 3-fach zielgerichteter
HINTERGRUND 1. Was ist Nintedanib*? 2. Wirkmechanismus 3. Stand der Entwicklung 4. Studiendaten 5. Klinisches Potential 1. WAS IST NINTEDANIB*? Nintedanib* (Vargatef ) ist ein oraler 3-fach zielgerichteter
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabazitaxel (Jevtana ) Sanofi-Aventis Modul 2 mhr Prostatakarzinom Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabazitaxel (Jevtana ) Sanofi-Aventis Modul 2 mhr Prostatakarzinom Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Phase-III-Studie mit Regorafenib bei Patienten mit metastasiertem GIST erreicht primären Endpunkt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Progressionsfreies Überleben verdoppelt und Gesamtüberleben deutlich verlängert
 Gezielte Therapie mit dem Multi Kinase Inhibitor - Sorafenib zur Therapie des fortgeschrittenen Nierenze Gezielte Therapie mit dem Multi-Kinase-Inhibitor Sorafenib zur Therapie des fortgeschrittenen Nierenzellkarzinoms
Gezielte Therapie mit dem Multi Kinase Inhibitor - Sorafenib zur Therapie des fortgeschrittenen Nierenze Gezielte Therapie mit dem Multi-Kinase-Inhibitor Sorafenib zur Therapie des fortgeschrittenen Nierenzellkarzinoms
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nusinersen (Spinraza ) Biogen GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nusinersen (Spinraza ) Biogen GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Pathologie und Konsequenzen für die Klinik. Molekularpathologie. Steffen Hauptmann Institut für Pathologie der MLU Halle-
 Pathologie und Konsequenzen für die Klinik Molekularpathologie Steffen Hauptmann Institut für Pathologie der MLU Halle- Wittenberg Karsten Münstedt Abteilung für Gynäkologie und Geburtshilfe, Klinikum
Pathologie und Konsequenzen für die Klinik Molekularpathologie Steffen Hauptmann Institut für Pathologie der MLU Halle- Wittenberg Karsten Münstedt Abteilung für Gynäkologie und Geburtshilfe, Klinikum
Vorbehaltlich der Genehmigung durch das BMG und Veröffentlichung im Bundesanzeiger gem. 91 Abs. 4 SGB V
 Anlage V - Antrag auf Freistellung von der Nutzenbewertung nach 35a Abs. 1a SGB V i.v.m. 15 VerfO wegen Geringfügigkeit für Fertigarzneimittel 1) Pharmazeutischer Unternehmer a) Name des pharmazeutischen
Anlage V - Antrag auf Freistellung von der Nutzenbewertung nach 35a Abs. 1a SGB V i.v.m. 15 VerfO wegen Geringfügigkeit für Fertigarzneimittel 1) Pharmazeutischer Unternehmer a) Name des pharmazeutischen
Nintedanib (Vargatef )
 Nintedanib (Vargatef ) Zur Behandlung des nicht-kleinzelligen Lungenkarzinoms (NSCLC) stehen bereits mehrere zielgerichtet wirksame Tyrosinkinase-Inhibitoren zur Verfügung (s. Tabelle 1): Erlotinib (Tarceva,
Nintedanib (Vargatef ) Zur Behandlung des nicht-kleinzelligen Lungenkarzinoms (NSCLC) stehen bereits mehrere zielgerichtet wirksame Tyrosinkinase-Inhibitoren zur Verfügung (s. Tabelle 1): Erlotinib (Tarceva,
Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis
 Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis IMD Berlin MVZ Vascular endothelial growth factor (VEGF) Signalmolekül in der Vaskulogenese und Angiogenese
Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis IMD Berlin MVZ Vascular endothelial growth factor (VEGF) Signalmolekül in der Vaskulogenese und Angiogenese
Investor News. Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs Stivarga
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs Stivarga
Zielgerichtete Therapie bei Darmkrebs: Hemmung des Blutgefäßwachstums. Eine neue Chance für die Patienten
 Zielgerichtete Therapie bei Darmkrebs: Hemmung des wachstums Eine neue Chance für die Patienten Tumor-Angiogenese Was ist Angiogenese? Der Begriff Angiogenese leitet sich ab aus den altgriechischen Bezeichnungen
Zielgerichtete Therapie bei Darmkrebs: Hemmung des wachstums Eine neue Chance für die Patienten Tumor-Angiogenese Was ist Angiogenese? Der Begriff Angiogenese leitet sich ab aus den altgriechischen Bezeichnungen
NUB Antrag 2018/2019 Cabozantinib
 Haben Sie externe Hilfestellungen zum Ausfüllen der Formblätter in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche
Haben Sie externe Hilfestellungen zum Ausfüllen der Formblätter in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche
Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU
 Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Olaratumab (Lartruvo )
 Olaratumab (Lartruvo ) Der monoklonale Antikörper Olaratumab (Lartruvo ) ist in einem beschleunigten Verfahren von der EMA zur Therapie von Weichteilsarkomen zugelassen worden. Ausschlaggebend für die
Olaratumab (Lartruvo ) Der monoklonale Antikörper Olaratumab (Lartruvo ) ist in einem beschleunigten Verfahren von der EMA zur Therapie von Weichteilsarkomen zugelassen worden. Ausschlaggebend für die
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Projekte: Gutartige, boesartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
 Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib-L-malat (CABOMETYX ) Ipsen Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib-L-malat (CABOMETYX ) Ipsen Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Investor News. Bayer erhält US-Zulassung für Stivarga (Regorafenib) zur Zweitlinien-Behandlung von Leberkrebs
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält US-Zulassung für Stivarga (Regorafenib) zur Zweitlinien-Behandlung von Leberkrebs Stivarga ist
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält US-Zulassung für Stivarga (Regorafenib) zur Zweitlinien-Behandlung von Leberkrebs Stivarga ist
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Rauben Sie dem Tumor seine Energie zum Wachsen
 Rauben Sie dem Tumor seine Energie zum Wachsen Woher nimmt ein Tumor die Kraft zum Wachsen? Tumorzellen benötigen wie andere Zellen gesunden Gewebes auch Nährstoffe und Sauerstoff, um wachsen zu können.
Rauben Sie dem Tumor seine Energie zum Wachsen Woher nimmt ein Tumor die Kraft zum Wachsen? Tumorzellen benötigen wie andere Zellen gesunden Gewebes auch Nährstoffe und Sauerstoff, um wachsen zu können.
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Migalastat (Galafold ) Amicus Therapeutics Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Migalastat (Galafold ) Amicus Therapeutics Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Immuntherapien in der Onkologie: Was lange währt, wird endlich gut?
 Immuntherapien in der Onkologie: Was lange währt, wird endlich gut? Dr.med. Isabel Marieluise Gruber, PhD 3. März 2016 Trendtage Gesundheit Luzern Krebs verursacht eine grosse Krankheitslast Vier von zehn
Immuntherapien in der Onkologie: Was lange währt, wird endlich gut? Dr.med. Isabel Marieluise Gruber, PhD 3. März 2016 Trendtage Gesundheit Luzern Krebs verursacht eine grosse Krankheitslast Vier von zehn
Tumor Angiogenese und. Anti-Angiogenese als. Tumor-Therapie
 Tumor Angiogenese und Anti-Angiogenese als Tumor-Therapie Norbert Fusenig, DKFZ - Heidelberg Die Tumorzelle im Zentrum der Aufmerksamkeit - Akkumulation genetischer Veränderungen in den Tumorzellen: Aktivierung
Tumor Angiogenese und Anti-Angiogenese als Tumor-Therapie Norbert Fusenig, DKFZ - Heidelberg Die Tumorzelle im Zentrum der Aufmerksamkeit - Akkumulation genetischer Veränderungen in den Tumorzellen: Aktivierung
Herausforderungen in der individualisierten Therapie beim mcrc
 Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib (Cometriq ) Swedish Orphan Biovitrum GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib (Cometriq ) Swedish Orphan Biovitrum GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
EU-Kommission erteilt Zulassung für IRESSA
 Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
Dual targeting of FGFR1 and VEGFR1 displays antitumor efficacy in breast cancer
 Dual targeting of FGFR1 and VEGFR1 displays antitumor efficacy in breast cancer I n a u g u r a l - D i s s e r t a t i o n zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät
Dual targeting of FGFR1 and VEGFR1 displays antitumor efficacy in breast cancer I n a u g u r a l - D i s s e r t a t i o n zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Cabozantinib (Nierenzellkarzinom)
 IQWiG-Berichte Nr. 606 Cabozantinib (Nierenzellkarzinom) Addendum 2 zum Auftrag A17-56 Addendum Auftrag: A18-18 Version: 1.0 Stand: 15.03.2018 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 606 Cabozantinib (Nierenzellkarzinom) Addendum 2 zum Auftrag A17-56 Addendum Auftrag: A18-18 Version: 1.0 Stand: 15.03.2018 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Neue Immuntherapeutika bei Nierenzellkarzinom
 Neue Immuntherapeutika bei Nierenzellkarzinom 08.06.2015 EAU-Kongress 2015 in Madrid Im Rahmen des EAU-Kongresses 2015 in Madrid referierte Prof. Jens Bedke aus Tübingen über aktuelle Entwicklungen der
Neue Immuntherapeutika bei Nierenzellkarzinom 08.06.2015 EAU-Kongress 2015 in Madrid Im Rahmen des EAU-Kongresses 2015 in Madrid referierte Prof. Jens Bedke aus Tübingen über aktuelle Entwicklungen der
Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms
 Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms S. Stintzing 26.06.09 EGF-Rezeptor - Auf 60-80% der kolorektalen Karzinome exprimiert (IHC) - Intrazelluläre
Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms S. Stintzing 26.06.09 EGF-Rezeptor - Auf 60-80% der kolorektalen Karzinome exprimiert (IHC) - Intrazelluläre
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nintedanib (Vargatef ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nintedanib (Vargatef ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Elosulfase alfa (Vimizim ) BioMarin Deutschland GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 28 Mai 2014
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Elosulfase alfa (Vimizim ) BioMarin Deutschland GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 28 Mai 2014
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie
 EU-Zulassung für Vectibix zur Behandlung des metastasierten kolorektalen Karzinoms Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie München (10. Dezember 2007) Die europäische Arzneimittelagentur
EU-Zulassung für Vectibix zur Behandlung des metastasierten kolorektalen Karzinoms Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie München (10. Dezember 2007) Die europäische Arzneimittelagentur
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Axitinib (Inlyta ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Axitinib (Inlyta ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Systemische Therapie des Colorektalen-karzinoms. Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT)
 Systemische Therapie des Colorektalen-karzinoms Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT) Systemische Therapie des Rektumkarzinoms 1957 5-Fluorouracil
Systemische Therapie des Colorektalen-karzinoms Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT) Systemische Therapie des Rektumkarzinoms 1957 5-Fluorouracil
Neue Substanzen in der Therapie des KRK Prof. V. Heinemann
 Neue Substanzen in der Therapie des KRK Prof. V. Heinemann Medizinische Klinik und Poliklinik III, Klinikum Großhadern Ludwig-Maximilians Universität München Extrazellulär Neue Targets in der Krebstherapie
Neue Substanzen in der Therapie des KRK Prof. V. Heinemann Medizinische Klinik und Poliklinik III, Klinikum Großhadern Ludwig-Maximilians Universität München Extrazellulär Neue Targets in der Krebstherapie
Zusammenfassung. Bei Patienten mit PAH zeigte sich in Lungengewebe eine erhöhte Expression von PAR-1 und PAR-2. Aktuelle Arbeiten weisen darauf
 Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
Zirkulierende Tumorzellen (CTC) beim metastasierten Mammakarzinom
 Zirkulierende Tumorzellen (CTC) beim metastasierten Mammakarzinom Bahriye Aktas Universitätsfrauenklinik Essen Direktor: Prof. Dr. med. Rainer Kimmig Das Mammakarzinom- eine systemische Erkrankung! METASTASENBILDUNG
Zirkulierende Tumorzellen (CTC) beim metastasierten Mammakarzinom Bahriye Aktas Universitätsfrauenklinik Essen Direktor: Prof. Dr. med. Rainer Kimmig Das Mammakarzinom- eine systemische Erkrankung! METASTASENBILDUNG
AMB 2014, 48, 43. Neues onkologisches Arzneimittel: Regorafenib (Stivarga )
 AMB 2014, 48, 43 Neues onkologisches Arzneimittel: Regorafenib (Stivarga ) Patienten mit metastasiertem kolorektalem Karzinom haben unbehandelt eine mediane Lebenserwartung von etwa sechs Monaten (1).
AMB 2014, 48, 43 Neues onkologisches Arzneimittel: Regorafenib (Stivarga ) Patienten mit metastasiertem kolorektalem Karzinom haben unbehandelt eine mediane Lebenserwartung von etwa sechs Monaten (1).
44. Jahrestagung der American Society of Clinical Oncology (ASCO): Neue Phase-II-Daten zu Nexavar zeigen Anwendungspotenzial bei weiteren Krebsarten
 44. Jahrestagung der American Society of Clinical Oncology (ASCO): Neue Phase-II-Daten zu Nexavar zeigen Anwendungspotenzial bei weiteren Krebsarten Berlin/Chicago (2. Juni 2008) - Neue Daten aus dem Phase-II-Entwicklungsprogramm
44. Jahrestagung der American Society of Clinical Oncology (ASCO): Neue Phase-II-Daten zu Nexavar zeigen Anwendungspotenzial bei weiteren Krebsarten Berlin/Chicago (2. Juni 2008) - Neue Daten aus dem Phase-II-Entwicklungsprogramm
Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet Leverkusen, 28. Mai
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet Leverkusen, 28. Mai
Tyrosinkinase- Rezeptoren
 Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Übung 8. Vorlesung Bio-Engineering Sommersemester Kapitel Zellkommunikation
 1. Zellkommunikation 1.1. G-Proteine Unsere Geruchsempfindung wird ausgelöst wenn ein Geruchsstoff an einen G-Protein-verknüpften Rezeptor bindet und dieses Signal dann weitergeleitet wird. a) Was passiert
1. Zellkommunikation 1.1. G-Proteine Unsere Geruchsempfindung wird ausgelöst wenn ein Geruchsstoff an einen G-Protein-verknüpften Rezeptor bindet und dieses Signal dann weitergeleitet wird. a) Was passiert
Biomarker für den Kampf gegen Lungenkrebs
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/biomarker-fuer-den-kampfgegen-lungenkrebs/ Biomarker für den Kampf gegen Lungenkrebs Ein von Biomarkern geleiteter,
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/biomarker-fuer-den-kampfgegen-lungenkrebs/ Biomarker für den Kampf gegen Lungenkrebs Ein von Biomarkern geleiteter,
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib-L-malat (CABOMETYX ) Ipsen Pharma GmbH Modul 2 Behandlung des fortgeschrittenen Nierenzellkarzinoms bei
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabozantinib-L-malat (CABOMETYX ) Ipsen Pharma GmbH Modul 2 Behandlung des fortgeschrittenen Nierenzellkarzinoms bei
Ceritinib (Zykadia) bei fortgeschrittenem Lungenkrebs
 verstehen abwägen entscheiden Ceritinib (Zykadia) bei fortgeschrittenem Lungenkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
verstehen abwägen entscheiden Ceritinib (Zykadia) bei fortgeschrittenem Lungenkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Invasionsmechanismen und Metastasierung des Urothelkarzinoms. Dr. med. Karl-Ernst Ambs, Facharzt für Urologie, Parkstr.
 Invasionsmechanismen und Metastasierung des Urothelkarzinoms Dr. med. Karl-Ernst Ambs, Facharzt für Urologie, Parkstr. 6 65812 Bad Soden Allgemeines Hauptursachen der krebsspezifischen Mortalität sind
Invasionsmechanismen und Metastasierung des Urothelkarzinoms Dr. med. Karl-Ernst Ambs, Facharzt für Urologie, Parkstr. 6 65812 Bad Soden Allgemeines Hauptursachen der krebsspezifischen Mortalität sind
Tumortherapie. Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr Berlin
 Tumortherapie Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr. 5 10961 Berlin Grundsätzliches Ideale Krebsbehandlung: Nur bösartige Zellen werden abgetötet, gesunde Zellen
Tumortherapie Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr. 5 10961 Berlin Grundsätzliches Ideale Krebsbehandlung: Nur bösartige Zellen werden abgetötet, gesunde Zellen
HER2-positiver Rezeptorstatus als signifikanter Überlebensvorteil
 10 Jahre Herceptin HER2-positiver Rezeptorstatus als signifikanter Überlebensvorteil Frankfurt am Main (27. September 2010) - Die Entwicklung von Trastuzumab (Herceptin) hat die Brustkrebstherapie revolutioniert.
10 Jahre Herceptin HER2-positiver Rezeptorstatus als signifikanter Überlebensvorteil Frankfurt am Main (27. September 2010) - Die Entwicklung von Trastuzumab (Herceptin) hat die Brustkrebstherapie revolutioniert.
Lenvatinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung
 IQWiG-Berichte Nr. 321 Lenvatinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-06 Version: 1.0 Stand: 27.08.2015 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 321 Lenvatinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-06 Version: 1.0 Stand: 27.08.2015 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Dabrafenib in der EU zugelassen
 Vielversprechende Therapieoption für Patienten mit fortgeschrittenem Melanom Dabrafenib in der EU zugelassen München (27. September 2013) - Die Europäische Arzneimittelzulassungsbehörde EMA hat den von
Vielversprechende Therapieoption für Patienten mit fortgeschrittenem Melanom Dabrafenib in der EU zugelassen München (27. September 2013) - Die Europäische Arzneimittelzulassungsbehörde EMA hat den von
Grundlagenforschung. Medikamente: von der Erforschung bis zur Anwendung. Basiskurs Krebswissen Sommer Thema
 Grundlagenforschung Basiskurs Krebswissen Sommer 2015 Medikamente: von der Erforschung bis zur Anwendung 1 Walter Berger, Institut für Krebsforschung, Autor, Einrichtung, Medizinische Abteilung Universität...
Grundlagenforschung Basiskurs Krebswissen Sommer 2015 Medikamente: von der Erforschung bis zur Anwendung 1 Walter Berger, Institut für Krebsforschung, Autor, Einrichtung, Medizinische Abteilung Universität...
Aus dem Leben einer Krebszelle
 Basiskurs Krebswissen 2015 Aus dem Leben einer Krebszelle 1 Berger, Walter Univ. Berger, Klinik Institut Innere für Medizin Krebsforschung, I, Institut Medizinische für Krebsforschung Universität Wien
Basiskurs Krebswissen 2015 Aus dem Leben einer Krebszelle 1 Berger, Walter Univ. Berger, Klinik Institut Innere für Medizin Krebsforschung, I, Institut Medizinische für Krebsforschung Universität Wien
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Trifluridin/Tipiracil (Lonsurf ) Servier Deutschland GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Trifluridin/Tipiracil (Lonsurf ) Servier Deutschland GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Neues aus der Onkologie Jörg Thomalla
 Neues aus der Onkologie 2015 Was haben neue Wirkstoffe gebracht? Jörg Thomalla Wirkstoffe mit gleicher Indikationstellung und gleichem Wirkmechanismus Beispiel malignes Melanom Kombination BRAF-Inhibitor
Neues aus der Onkologie 2015 Was haben neue Wirkstoffe gebracht? Jörg Thomalla Wirkstoffe mit gleicher Indikationstellung und gleichem Wirkmechanismus Beispiel malignes Melanom Kombination BRAF-Inhibitor
The Journal Club. Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs
 The Journal Club Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs Derzeitige Therapieansätze bei CRPC Doxetacel Cabazitacel (Dreifach-)Hormon-Blockade
The Journal Club Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs Derzeitige Therapieansätze bei CRPC Doxetacel Cabazitacel (Dreifach-)Hormon-Blockade
Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse -
 Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse - Franz Edler von Koch Klinikum Dritter Orden Klinik für Gynäkologie und Geburtshilfe Brustzentrum Gynäkologisches
Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse - Franz Edler von Koch Klinikum Dritter Orden Klinik für Gynäkologie und Geburtshilfe Brustzentrum Gynäkologisches
Cobimetinib und Vemurafenib: Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom
 Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
6.3 Phospholipide und Signaltransduktion. Allgemeines
 6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur utzenbewertung gemäß 35a SGB V Vandetanib (Caprelsa ) Genzyme GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Dokumentvorlage, Version vom 18.04.2013 Dossier zur utzenbewertung gemäß 35a SGB V Vandetanib (Caprelsa ) Genzyme GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Letermovir (PREVYMIS ) MSD SHARP & DOHME GMBH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Letermovir (PREVYMIS ) MSD SHARP & DOHME GMBH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Bristol-Myers Dokumentvorlage, Squibb Version GmbH vom & Co 20.01.2011 KGaA und AstraZeneca GmbH Dossier zur Nutzenbewertung gemäß 35a SGB V Metforminhydrochlorid+Saxagliptin (Komboglyze 2,5 mg/850 mg
Bristol-Myers Dokumentvorlage, Squibb Version GmbH vom & Co 20.01.2011 KGaA und AstraZeneca GmbH Dossier zur Nutzenbewertung gemäß 35a SGB V Metforminhydrochlorid+Saxagliptin (Komboglyze 2,5 mg/850 mg
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Osimertinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Aflibercept (Zaltrap ) Sanofi-Aventis Deutschland GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Aflibercept (Zaltrap ) Sanofi-Aventis Deutschland GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
Rezeptortyrosinkinasen. Prof. Dr. Albert Duschl
 Rezeptortyrosinkinasen Prof. Dr. Albert Duschl Wespentaillen-Proteine Viele Rezeptoren sind single-pass Transmembranproteine. Es ist ein Problem im Inneren der Zelle wahrzunehmen, daß auf der Zellaussenseite
Rezeptortyrosinkinasen Prof. Dr. Albert Duschl Wespentaillen-Proteine Viele Rezeptoren sind single-pass Transmembranproteine. Es ist ein Problem im Inneren der Zelle wahrzunehmen, daß auf der Zellaussenseite
Hirntumore neue Therapien
 Hirntumore neue Therapien Peter Vajkoczy CHARITÉ - Universitätsmedizin Berlin (peter.vajkoczy@charite.de) U N I V E R S I T Ä T S M E D I Z I N B E R L I N THERAPIE MALIGNER GLIOME Langzeitüberleben beim
Hirntumore neue Therapien Peter Vajkoczy CHARITÉ - Universitätsmedizin Berlin (peter.vajkoczy@charite.de) U N I V E R S I T Ä T S M E D I Z I N B E R L I N THERAPIE MALIGNER GLIOME Langzeitüberleben beim
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dossier zur Nutzenbewertung gemäß 35a SGB V Fingolimod (Gilenya ) Novartis Pharma GmbH Modul 4 Schubförmig-remittierende Multiple Sklerose Ergänzung zu den am 18.06.2014 eingereichten Dossierunterlagen
Dossier zur Nutzenbewertung gemäß 35a SGB V Fingolimod (Gilenya ) Novartis Pharma GmbH Modul 4 Schubförmig-remittierende Multiple Sklerose Ergänzung zu den am 18.06.2014 eingereichten Dossierunterlagen
Neue Substanzen in der Therapie des Mammakarzinoms
 Neue Substanzen in der Therapie des Mammakarzinoms Prof. V. Heinemann Department of Medical Oncology, Klinikum Grosshadern, University of Munich Germany Docetaxel + Bevacizumab beim HER2-negativen MBC
Neue Substanzen in der Therapie des Mammakarzinoms Prof. V. Heinemann Department of Medical Oncology, Klinikum Grosshadern, University of Munich Germany Docetaxel + Bevacizumab beim HER2-negativen MBC
In dieser Doktorarbeit wird eine rezeptorvermittelte Signalkaskade für Thrombin
 Diskussion -33-4. Diskussion In dieser Doktorarbeit wird eine rezeptorvermittelte Signalkaskade für Thrombin beschrieben, die zur Differenzierung von neonatalen glatten Gefäßmuskelzellen führt. Thrombin
Diskussion -33-4. Diskussion In dieser Doktorarbeit wird eine rezeptorvermittelte Signalkaskade für Thrombin beschrieben, die zur Differenzierung von neonatalen glatten Gefäßmuskelzellen führt. Thrombin
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V () 1 Anhang Checkliste zur Prüfung der formalen Vollständigkeit
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V () 1 Anhang Checkliste zur Prüfung der formalen Vollständigkeit
Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg
 Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg Her2 Resistenz - Die klinischen Fakten - ca. 30% der Her2 pos. MBC sprechen auf
Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg Her2 Resistenz - Die klinischen Fakten - ca. 30% der Her2 pos. MBC sprechen auf
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 3A Erwachsene Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 3A Erwachsene Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem
Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung-
 Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung- Torsten Keßler aus der Medizinischen Klinik und Poliklinik A -Direktor - Univ.-Prof. Dr. W.E. Berdel torstenkessler@uni-muenster.de Neu zugelassene
Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung- Torsten Keßler aus der Medizinischen Klinik und Poliklinik A -Direktor - Univ.-Prof. Dr. W.E. Berdel torstenkessler@uni-muenster.de Neu zugelassene
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Vandetanib (Caprelsa ) AstraZeneca GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Vandetanib (Caprelsa ) AstraZeneca GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
Das Schilddrüsenkarzinom Molekulare Grundlagen und systemische Therapie mit Tyrosinkinase-Inhibitoren
 Das Schilddrüsenkarzinom Molekulare Grundlagen und systemische Therapie mit Tyrosinkinase-Inhibitoren Das Schilddrüsenkarzinom, grundsätzlich eine kurativ behandelbare Erkrankung, wird je nach histologischer
Das Schilddrüsenkarzinom Molekulare Grundlagen und systemische Therapie mit Tyrosinkinase-Inhibitoren Das Schilddrüsenkarzinom, grundsätzlich eine kurativ behandelbare Erkrankung, wird je nach histologischer
Neues zum fortgeschrittenen Mammakarzinom
 Neues zum fortgeschrittenen Mammakarzinom Ulrike Nitz Brustzentrum Niederrhein MBC OS Aktuelle Bestandsaufnahme OMEDCO nterims Analyse 2013; ABC Gruppe; n=1409/2250 Patients alive 100% 90% 80% 70% 60%
Neues zum fortgeschrittenen Mammakarzinom Ulrike Nitz Brustzentrum Niederrhein MBC OS Aktuelle Bestandsaufnahme OMEDCO nterims Analyse 2013; ABC Gruppe; n=1409/2250 Patients alive 100% 90% 80% 70% 60%
Adoptive cell transfer
 Christian Lang Adoptive cell transfer -Im Überblick- Christian Lang Transfer von zytotoxischen T-Zellen spezifisch Tumorassoziiertes Antigen (TAA) NK-Zellen unspezifisch T-Zellen Christian Lang Christian
Christian Lang Adoptive cell transfer -Im Überblick- Christian Lang Transfer von zytotoxischen T-Zellen spezifisch Tumorassoziiertes Antigen (TAA) NK-Zellen unspezifisch T-Zellen Christian Lang Christian
Neue Substanzen, neue klinische Daten noch ein update. - Antiangiogenese - Thomas Hawighorst. Klinik für Gynäkologie und Geburtshilfe
 Neue Substanzen, neue klinische Daten noch ein update - Antiangiogenese - Thomas Hawighorst Klinik für Gynäkologie und Geburtshilfe COMBATing Breast Cancer 26./27.11.2010 Karzinogenese - Angiogenese Versorgung
Neue Substanzen, neue klinische Daten noch ein update - Antiangiogenese - Thomas Hawighorst Klinik für Gynäkologie und Geburtshilfe COMBATing Breast Cancer 26./27.11.2010 Karzinogenese - Angiogenese Versorgung
Rekombinante Wirkstoffe. Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.
 Rekombinante Wirkstoffe Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Empfohlene Literatur Rekombinante Wirkstoffe Der legale
Rekombinante Wirkstoffe Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Empfohlene Literatur Rekombinante Wirkstoffe Der legale
Der ras/raf Pathway. Prof. Dr. Albert Duschl
 Der ras/raf Pathway Prof. Dr. Albert Duschl Biologische Regelsysteme Behalten Sie bitte im Gedächtnis, daß biologische Systeme immer wieder vor vergleichbaren Aufgaben stehen, bei denen es darum geht,
Der ras/raf Pathway Prof. Dr. Albert Duschl Biologische Regelsysteme Behalten Sie bitte im Gedächtnis, daß biologische Systeme immer wieder vor vergleichbaren Aufgaben stehen, bei denen es darum geht,
Bayer erhält US-Zulassung für Copanlisib zur Behandlung von wiederkehrendem follikulärem Lymphom bei vorbehandelten Patienten
 Presse-Information Bayer AG Communications and Public Affairs 51368 Leverkusen Deutschland Tel. +49 214 30-0 www.news.bayer.de Bayer erhält US-Zulassung für Copanlisib zur Behandlung von wiederkehrendem
Presse-Information Bayer AG Communications and Public Affairs 51368 Leverkusen Deutschland Tel. +49 214 30-0 www.news.bayer.de Bayer erhält US-Zulassung für Copanlisib zur Behandlung von wiederkehrendem
105. Jahrestagung der American Association for Cancer Research. Bayer präsentiert neue Daten aus seinem wachsenden Onkologie- Portfolio
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de 105. Jahrestagung der American Association for Cancer Research Bayer präsentiert
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de 105. Jahrestagung der American Association for Cancer Research Bayer präsentiert
