Dossier zur Nutzenbewertung gemäß 35a SGB V
|
|
|
- Hermann Wetzel
- vor 5 Jahren
- Abrufe
Transkript
1 Dokumentvorlage, Version vom Dossier zur Nutzenbewertung gemäß 35a SGB V Nintedanib (Vargatef ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand:
2 Inhaltsverzeichnis Seite Tabellenverzeichnis... 2 Tabellenverzeichnis des pharmazeutischen Unternehmers... 3 Abbildungsverzeichnis... 4 Abkürzungsverzeichnis Allgemeine Angaben zum Arzneimittel Administrative Angaben zum Arzneimittel Angaben zum Wirkmechanismus des Arzneimittels Zugelassene Anwendungsgebiete Anwendungsgebiete, auf die sich das Dossier bezieht Weitere in Deutschland zugelassene Anwendungsgebiete Beschreibung der Informationsbeschaffung für Modul Referenzliste für Modul Nintedanib (Vargatef ) Seite 1 von 23
3 Tabellenverzeichnis Seite Tabelle 2-1: Allgemeine Angaben zum zu bewertenden Arzneimittel... 7 Tabelle 2-2: Pharmazentralnummern und Zulassungsnummern für das zu bewertende Arzneimittel... 8 Tabelle 2-3: Zugelassene Anwendungsgebiete, auf die sich das Dossier bezieht Tabelle 2-4: Weitere in Deutschland zugelassene Anwendungsgebiete des zu bewertenden Arzneimittels Nintedanib (Vargatef ) Seite 2 von 23
4 Tabellenverzeichnis des pharmazeutischen Unternehmers Seite Tabelle 2-A: Inhibitorische Aktivität von Nintedanib in vitro Tabelle 2-B: Laut S3-Leitlinie empfohlene Medikamente sowie zugelassene Proteinkinase-Inhibitoren im Anwendungsgebiet von Nintedanib Tabelle 2-C: Wirkmechanismen der zur Behandlung des fortgeschrittenen NSCLC im vorliegenden Anwendungsgebiet verwendeten Zytostatika (von der S3-Leitlinie empfohlene Zytostatika) Nintedanib (Vargatef ) Seite 3 von 23
5 Abbildungsverzeichnis Seite Abbildung 2-1: Chemische Strukturformel von Nintedanib: (Z)-methyl 3-((4-(N-methyl- 2-(4-methylpiperazin-1-yl) acetamido)phenylamino)(phenyl) methylene)-2-oxoindoline- 6-carboxylate Abbildung 2-2: Expression von Rezeptoren, die an der Angiogenese beteiligt sind Abbildung 2-3: Tumorinduzierte Angiogenese Nintedanib (Vargatef ) Seite 4 von 23
6 Abkürzungsverzeichnis Abkürzung AKT ALK ATC-Code ATP Bedeutung V-Akt Murine Thymoma Viral Oncogene Homolog Anaplastic Lymphoma Kinase Anatomisch-Therapeutisch-Chemischer Code Adenosin-Triphosphat Del 19 Deletion im Exon 19 DGHO EGFR Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.v. Epidermal Growth Factor Receptor (epidermaler Wachstumsfaktor-Rezeptor) EML4 Echinoderm Microtubule-Associated Protein Like 4 ErbB ESMO FGF FGFR GARFT HIF L858R MAPK MET NCCN NSCLC PDGF PDGFR PI3K PZN RTK TKI TS V-Erb-B2 Erythroblastic Leukemia Viral Oncogene Homolog European Society of Medical Oncology Fibroblast Growth Factor Fibroblast Growth Factor Receptor Glycinamide-Ribonucleotide-Formyltransferase Hypoxie-induzierter Faktor Substitution von Leucin (L) gegen Arginin (R) an Aminsäureposition 858 des EGFR-Proteins (Tyrosinkinase- Domäne) aufgrund einer Punktmutation im Exon 21 Mitogen-Activated Protein Kinase MNNG HOS Transforming Gene National Comprehensive Cancer Network Non-Small Cell Lung Cancer (nicht-kleinzelliges Lungenkarzinom) Platelet Derived Growth Factor Platelet Derived Growth Factor Receptor Phosphatidylinositol-4,5-Bisphosphate 3-Kinase Pharmazentralnummer Rezeptor-Tyrosinkinase Tyrosinkinase-Inhibitor Thymidylatsynthase Nintedanib (Vargatef ) Seite 5 von 23
7 VEGF VEGFR Vascular Endothelial Growth Factor Vascular Endothelial Growth Factor Receptor Nintedanib (Vargatef ) Seite 6 von 23
8 2 Modul 2 allgemeine Informationen Modul 2 enthält folgende Informationen: Allgemeine Angaben über das zu bewertende Arzneimittel (Abschnitt 2.1) Beschreibung der Anwendungsgebiete, für die das zu bewertende Arzneimittel zugelassen wurde (Abschnitt 2.2); dabei wird zwischen den Anwendungsgebieten, auf die sich das Dossier bezieht, und weiteren in Deutschland zugelassenen Anwendungsgebieten unterschieden. Alle in den Abschnitten 2.1 und 2.2 getroffenen Aussagen sind zu begründen. Die Quellen (z. B. Publikationen), die für die Aussagen herangezogen werden, sind in Abschnitt 2.4 (Referenzliste) eindeutig zu benennen. Das Vorgehen zur Identifikation der Quellen ist im Abschnitt 2.3 (Beschreibung der Informationsbeschaffung) darzustellen. Im Dokument verwendete Abkürzungen sind in das Abkürzungsverzeichnis aufzunehmen. Sofern Sie für Ihre Ausführungen Tabellen oder Abbildungen verwenden, sind diese im Tabellen- bzw. Abbildungsverzeichnis aufzuführen. 2.1 Allgemeine Angaben zum Arzneimittel Administrative Angaben zum Arzneimittel Geben Sie in Tabelle 2-1 den Namen des Wirkstoffs, den Handelsnamen und den ATC-Code für das zu bewertende Arzneimittel an. Tabelle 2-1: Allgemeine Angaben zum zu bewertenden Arzneimittel Wirkstoff: Nintedanib Handelsname: Vargatef ATC-Code: L01XE31 Geben Sie in der nachfolgenden Tabelle 2-2 an, welche Pharmazentralnummern (PZN) und welche Zulassungsnummern dem zu bewertenden Arzneimittel zuzuordnen sind, und benennen Sie dabei die zugehörige Wirkstärke und Packungsgröße. Fügen Sie für jede Pharmazentralnummer eine neue Zeile ein. Nintedanib (Vargatef ) Seite 7 von 23
9 Tabelle 2-2: Pharmazentralnummern und Zulassungsnummern für das zu bewertende Arzneimittel Pharmazentralnummer (PZN) Zulassungsnummer Wirkstärke Packungsgröße EU/1/14/954/ mg 60 Weichkapseln EU/1/14/954/ mg 120 Weichkapseln EU/1/14/954/ mg 60 Weichkapseln Angaben zum Wirkmechanismus des Arzneimittels Beschreiben Sie den Wirkmechanismus des zu bewertenden Arzneimittels. Begründen Sie Ihre Angaben unter Nennung der verwendeten Quellen. Zusammenfassung des Abschnitts Nintedanib (Vargatef ) ist ein Tyrosinkinase-Inhibitor, der durch eine spezifische Blockade der Rezeptor-Tyrosinkinasen VEGFR (Vascular Endothelial Growth Factor Receptor) 1-3, PDGFR (Platelet Derived Growth Factor Receptor) α und β und FGFR (Fibroblast Growth Factor Receptor) 1 3 eine dreifach zielgerichtete Angiogenese-Blockade ermöglicht. Die Angiogenese (Neubildung von Blutgefäßen aus einem bestehenden Gefäßsystem) ist von zentraler Bedeutung für das Wachstum und die Ausbreitung solider Tumore. Tumore ab einer bestimmten Größe sind in der Lage, durch Sekretion von Wachstumsfaktoren eine eigene Gefäßversorgung zu bilden. Jedes Blutgefäß besteht mindestens aus einer einlagigen Schicht von Endothelzellen, dem Endothel. Das Endothel wird von der Basalmembran umgeben und unter anderem von Perizyten und glatten Muskelzellen umhüllt, die für die Stabilität der Blutgefäße sorgen. Der Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor) nimmt bei der komplex regulierten Angiogenese eine Schlüsselfunktion ein und aktiviert Endothelzellen über Bindung an den VEGFR. FGF (Fibroblast Growth Factor) kann über die Bindung an den FGFR ebenfalls die Proliferation von Endothelzellen aber auch glatten Muskelzellen anregen. Aktivierte Endothelzellen produzieren wiederum PDGF (Platelet Derived Growth Factor), dessen Rezeptor PDGFR hauptsächlich von Perizyten und glatten Muskelzellen exprimiert wird. Als anti-angiogener Wirkstoff unterscheidet sich Nintedanib von allen anderen im Anwendungsgebiet zugelassenen Wirkstoffen, indem er die Neubildung von Blutgefäßen im Tumor hemmt. Die dreifach zielgerichtete Blockade von VEGFR, PDGFR und FGFR ermöglicht eine Hemmung der Tumor-Angiogenese über verschiedene, alternative Signalwege. Nintedanib (Vargatef ) Seite 8 von 23
10 Nintedanib (Vargatef ) ist zugelassen in Kombination mit Docetaxel zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie (Boehringer Ingelheim Pharma GmbH & Co. KG, 2014). Nintedanib ist ein Tyrosinkinase-Inhibitor (TKI), der eine dreifach zielgerichtete Blockade entscheidender Rezeptor-Tyrosinkinasen (RTK) der Angiogenese ermöglicht (Triple- Angiokinase-Inhibitor). Die Angiogenese (Neubildung von Blutgefäßen aus einem bestehenden Gefäßsystem) ist entscheidend für das Tumorwachstum und die Bildung von Metastasen (Folkman, 1995). Nintedanib ist ein anti-angiogener Wirkstoff. Präklinische Daten belegen, dass Nintedanib die Tyrosinkinase-Aktivität von VEGFR (Vascular Endothelial Growth Factor Receptor) 1-3, PDGFR (Platelet Derived Growth Factor Receptor) α und β sowie FGFR (Fibroblast Growth Factor Receptor) 1-3 effektiv inhibiert (Hilberg et al., 2008). Diese drei RTK spielen eine zentrale Rolle bei der Koordination der Angiogenese: - Die VEGFR-Familie mit den Mitgliedern VEGFR 1-3 liefert, hauptsächlich über VEGFR 2, eines der initialen Signale zur Gefäßneubildung (Cook und Figg, 2010; Carmeliet und Jain, 2011). - Die PDGFR-Familie mit den Mitgliedern PDGFR α und β beeinflusst im Wesentlichen die Gefäßstabilität und -integrität (Cook und Figg, 2010; Carmeliet und Jain, 2011). - Die FGFR-Familie mit den Mitgliedern FGFR 1-3 hat vielseitige Funktionen, die sowohl im Zusammenhang mit der Angiogenese stehen (durch Stimulierung der Endothelzellproliferation) als auch allgemeinerer Natur sind (Regulation von Proliferation, Überleben, Migration und Invasion) (Turner und Grose, 2010). Rezeptor-Tyrosinkinasen Die Aktivierung von RTK erfolgt durch Bindung des entsprechenden Wachstumsfaktors an die extrazelluläre Domäne des Rezeptors. Durch die Bindung des Wachstumsfaktors kommt es zur Dimerisierung des Rezeptors. Dies führt wiederum zur Aktivierung der intrinsischen Tyrosinkinase (Madhusudan und Ganesan, 2004) und zur Autophosphorylierung der Tyrosinreste auf der cytoplasmatischen Seite mittels ATP (Adenosin-Triphosphat) (Hubbard und Till, 2000). Durch die Phosphorylierung der Tyrosinreste ist der Rezeptorkomplex in der Lage, mit diversen Signalmolekülen zu interagieren und so verschiedene Signalwege zu induzieren (Madhusudan und Ganesan, 2004). Einige der bekannten Signalkaskaden der Angiogenese werden über Mitogen-Activated Protein Kinasen (MAPK) und Phosphatidylinositol-4,5-Bisphosphate 3-Kinase (PI3K)/ V-Akt Murine Thymoma Viral Oncogene Homolog (AKT) reguliert (Cook und Figg, 2010). Nintedanib gehört zur ATC (anatomisch-therapeutisch-chemischen)-klasse der Proteinkinase- Inhibitoren. Chemisch gesehen handelt es sich bei Nintedanib um ein Indolinon-Derivat (siehe Abbildung 2-1). Durch reversible Bindung innerhalb der ATP-Bindungstasche der Nintedanib (Vargatef ) Seite 9 von 23
11 entsprechenden Kinasedomänen von VEGFR, PDGFR und FGFR inhibiert Nintedanib die Angiogenese-vermittelnden Signalkaskaden (Hilberg et al., 2008). Abbildung 2-1: Chemische Strukturformel von Nintedanib: (Z)-methyl 3-((4-(N-methyl-2-(4- methylpiperazin-1-yl) acetamido)phenylamino)(phenyl) methylene)-2-oxoindoline-6- carboxylate Quelle: (Hilberg et al., 2008) Angiogenese Die Angiogenese (Neubildung von Blutgefäßen aus einem bestehenden Gefäßsystem) spielt physiologisch unter anderem eine wichtige Rolle bei der Embryogenese (Carmeliet, 2003) und der Wundheilung (Werner und Grose, 2003). Sie ist aber auch von zentraler Bedeutung bei pathologischen Prozessen, wie z. B. dem Wachstum und der Ausbreitung solider Tumore (Folkman, 1995). Jedes Blutgefäß besteht mindestens aus einer einlagigen Schicht von Endothelzellen, dem Endothel, die die Blutgefäße auskleiden (Plank und Sleeman, 2003). Das Endothel wird von der Basalmembran umgeben und unter anderem von Perizyten und glatten Muskelzellen umhüllt (Plank und Sleeman, 2003), die für die Stabilität der Blutgefäße sorgen und die Durchblutung kontrollieren (Carmeliet und Jain, 2011). Neue Blutgefäße entstehen durch einen komplexen, streng regulierten Angiogenese-Prozess, an dem Endothelzellen, Perizyten und glatte Muskelzellen beteiligt sind (Armulik et al., 2005). Die Neubildung von Blutgefäßen wird durch Wachstumsfaktoren ausgelöst, die die Endothelzellen aktivieren und zur Vasodilatation und zur erhöhten Permeabilität des Endothels führen. Es kommt in der Folge zur Ablösung von Perizyten und zur Degradation der das Gefäß umgebenden Basalmembran. Die aktivierten Endothelzellen proliferieren, lösen sich von ihren Nachbarzellen und migrieren auf das angiogene Signal zu. Es kommt zur Ausbildung einer extrazellulären Matrix, an der sich die migrierenden Endothelzellen organisieren. Zur Ausbildung eines reifen, funktionalen Gefäßes tragen schließlich stabilisierende Zelltypen wie Perizyten und glatte Muskelzellen bei (Carmeliet und Jain, 2011). Nintedanib (Vargatef ) Seite 10 von 23
12 Der Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor) nimmt bei der Induktion der Angiogenese eine Schlüsselfunktion ein und aktiviert die Endothelzellen über Bindung an den VEGFR, der fast ausschließlich auf diesem Zelltyp exprimiert wird (Plank und Sleeman, 2003). Ein weiterer Rezeptor, der von Endothelzellen exprimiert wird, ist FGFR (Presta et al., 2005). Der Wachstumsfaktor FGF (Fibroblast Growth Factor) kann ebenfalls die Proliferation von Endothelzellen aber auch glatten Muskelzellen anregen (Turner und Grose, 2010). Aktivierte Endothelzellen produzieren wiederum den Wachstumsfaktor PDGF (Platelet Derived Growth Factor), dessen Rezeptor (PDGFR) hauptsächlich von Perizyten und glatten Muskelzellen exprimiert wird. Auf diese Weise werden die das Endothel stabilisierenden Zellen rekrutiert und zur Teilung angeregt (Plank und Sleeman, 2003) (siehe Abbildung 2-2). Abbildung 2-2: Expression von Rezeptoren, die an der Angiogenese beteiligt sind Quelle: modifiziert nach (Rolfo et al., 2013) Tumorangiogenese Tumore sind in der Lage, durch Sekretion von Wachstumsfaktoren Angiogenese zu induzieren (siehe Abbildung 2-3). Bei ihrer Versorgung sind Tumore abhängig vom passiven Transport von Sauerstoff und Nährstoffen aus den umliegenden Blutgefäßen (Sutherland, 1986). Während des Wachstums eines Tumors wird sein Umfeld immer sauerstoffärmer (Cook und Figg, 2010), da die vorhandenen Blutgefäße ab einer bestimmten Größe nicht mehr zur Versorgung ausreichen. Es entsteht Hypoxie (Sauerstoffmangel). Die Hypoxie führt zur Aktivierung des Transkriptionsfaktors HIF (Hypoxie-induzierter Faktor), der die Expression von Wachstumsfaktoren wie z. B. VEGF induziert (Pugh und Ratcliffe, 2003). Nintedanib (Vargatef ) Seite 11 von 23
13 Abbildung 2-3: Tumorinduzierte Angiogenese Quelle: modifiziert nach (Rolfo et al., 2013) Die tumorinduzierten Blutgefäße unterscheiden sich strukturell und funktionell von normalen Blutgefäßen. Da die angiogenen Prozesse - anders als im physiologischen Zustand - nicht aufeinander abgestimmt sind, kommt es zur Ausbildung chaotischer, durchlässiger Gefäßstrukturen (Jain, 2005). In der Folge können vermehrt Tumorzellen über die unreifen Gefäße auswandern und Metastasen bilden. Durch die Neubildung von Blutgefäßen wird daher nicht nur das Wachstum des Tumors gefördert, sondern auch das Metastasierungspotenzial erhöht (Schirrmacher, 1985; Moserle und Casanovas, 2013). Es wird angenommen, dass die strukturellen Unterschiede letztendlich zu dem anormalen Mikromilieu des Tumors führen, das durch einen hohen interstitiellen Druck, Hypoxie und Übersäuerung charakterisiert ist (Jain, 2005). Jain et al. vertreten die Hypothese, dass Medikamente, die eine Normalisierung der Gefäße induzieren, die Wirksamkeit konventioneller Therapien steigern können (Jain, 2005). So konnten durch die Kombination einer Chemotherapie mit dem monoklonalen Antikörper Bevacizumab (Avastin ), der gegen den Wachstumsfaktor VEGF gerichtet ist, verlängerte Überlebenszeiten erreicht werden (Hurwitz et al., 2004). Zwar wird der Prozess der Angiogenese vorwiegend durch den Wachstumsfaktor VEGF reguliert (Carmeliet und Jain, 2011), aber komplementäre und redundante Signalwege erschweren eine effiziente Inhibition der Tumorangiogenese. So wurde beobachtet, dass bei der ausschließlichen Hemmung VEGFR-vermittelter Signale nach anfänglichem Ansprechen eine Überwindung der Blockade eintritt (Bottsford-Miller et al., 2012). Einen möglichen Escape-Mechanismus stellt die Induktion FGF-induzierter Signalwege dar (Casanovas et al., 2005). Nintedanib (Vargatef ) Seite 12 von 23
14 Nintedanib wurde mit dem Ziel entwickelt, eine dreifach zielgerichtete Blockade wichtiger RTK der Angiogenese zu ermöglichen und dadurch mehrere Signalwege der Tumorangiogenese zu inhibieren. Präklinische Daten Die inhibitorische Aktivität von Nintedanib wurde in vitro und in vivo bestätigt (Hilberg et al., 2008). In vitro-untersuchungen belegen, dass Nintedanib die Tyrosinkinase-Aktivität von VEGFR 1-3, PDGFR α und β sowie FGFR 1-3 effektiv inhibiert (siehe Tabelle 2-A). Tabelle 2-A: Inhibitorische Aktivität von Nintedanib in vitro RTK-Klasse RTK * Nintedanib: mittlere inhibitorische Konzentration (IC 50 ) (nmol/l) VEGFR VEGFR 1 34 ±15 VEGFR 2 21 ±13 VEGFR 3 13 ±10 PDGFR PDGFR α 59 ±71 PDGFR β 65 ±7 FGFR FGFR 1 69 ±70 FGFR 2 37 ±2 FGFR ±41 * humane, rekombinante Proteinkinasedomäne Quelle: modifiziert nach (Hilberg et al., 2008) Weitere in vitro-experimente auf zellulärer Ebene zeigten, dass Nintedanib die Proliferation von Endothelzellen, Perizyten und glatten Muskelzellen hemmt und die Aktivierung der durch die Wachstumsfaktoren induzierten Signalwege (MAPK und AKT) inhibiert. Zudem konnte die Induktion von programmiertem Zelltod (Apoptose) nachgewiesen werden (Hilberg et al., 2008). Des Weiteren wurde eine anhaltende Blockade der Autophosphorylierung des VEGFR 2 beobachtet (mindestens 32 h) (Hilberg et al., 2008), die auf ein langanhaltendes Inhibitionspotential von Nintedanib hindeutet. In vivo-experimente mit Nintedanib als Monosubstanz sowie in Kombination mit einem Chemotherapeutikum wurden in Modellen mit verschiedenen Tumorzelllinien durchgeführt (Hilberg et al., 2008; Kutluk Cenik et al., 2013). In verschiedenen Xenograft-Modellen konnte gezeigt werden, dass Nintedanib die Wachstumsrate (Hilberg et al., 2008; Kutluk Cenik et al., 2013), die Gefäßdichte (Hilberg et al., 2008; Kutluk Cenik et al., 2013) sowie die Metastasierung (Kutluk Cenik et al., 2013) des Tumors reduziert. Nintedanib (Vargatef ) Seite 13 von 23
15 Klinische Wirksamkeit und Sicherheit Die klinische Wirksamkeit und Sicherheit von Nintedanib in Kombination mit Docetaxel basiert auf den Daten der Phase-III-Studie LUME-Lung 1, auf der auch die Zulassung beruht. Diese Phase-III-Studie war randomisiert, doppelblind, kontrolliert sowie multizentrisch. Patienten im Stadium IIIB/IV oder mit lokal rezidiviertem NSCLC nach einer Erstlinien- Chemotherapie wurden in die Studie eingeschlossen. Die Patienten wurden randomisiert im Verhältnis 1:1 den Behandlungsarmen zugeteilt und erhielten entweder Nintedanib 200 mg oral zweimal täglich in Kombination mit Docetaxel (75 mg/m 2 ) oder Placebo+Docetaxel (75 mg/m 2 ) (21 Tage-Behandlungszyklen). Der primäre Endpunkt war das progressionsfreie Überleben (PFS). Das Gesamtüberleben (OS) war der wichtigste sekundäre Endpunkt (Boehringer Ingelheim Pharma GmbH & Co. KG, 2013a; Reck et al., 2014b). Beschreiben Sie, ob und inwieweit sich der Wirkmechanismus des zu bewertenden Arzneimittels vom Wirkmechanismus anderer bereits in Deutschland zugelassener Arzneimittel unterscheidet. Differenzieren Sie dabei zwischen verschiedenen Anwendungsgebieten, für die das zu bewertende Arzneimittel zugelassen ist. Begründen Sie Ihre Angaben unter Nennung der verwendeten Quellen. Der bisher einzige auf dem deutschen Markt befindliche Angiogenese-Inhibitor mit Zulassung im Anwendungsgebiet NSCLC ist Bevacizumab. Bevacizumab ist ein monoklonaler Antikörper, der gegen den VEGF-Liganden gerichtet ist und somit die VEGFR-vermittelten Signale inhibiert (Roche Registration Limited, 2014). Die Zulassung ist beschränkt auf die Behandlung von Erstlinien-Patienten mit inoperablem fortgeschrittenen, metastasiertem oder rezidivierendem NSCLC (Roche Registration Limited, 2014). Daher steht NSCLC-Patienten in Deutschland bisher noch kein Angiogenese-Inhibitor zur Zweitlinien (Second-Line)- Therapie zur Verfügung. Im Folgenden werden die derzeit in Deutschland bestehenden Therapieoptionen im Anwendungsgebiet von Nintedanib zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem NSCLC mit Adenokarzinom- Histologie nach Erstlinien-Chemotherapie dargestellt. Dies erfolgt hauptsächlich anhand der S3-Leitlinie zur Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms (Goeckenjan et al., 2010). Therapieoptionen Bei Patienten in gutem Allgemeinzustand mit einer Erkrankungsprogression nach palliativer Erstlinien-Chemotherapie empfiehlt die S3-Leitlinie die Durchführung einer Zweitlinien- Therapie bis zum Progress oder bis zum Auftreten von Toxizitäten (Empfehlungsgrad A). Es werden darin folgende unabhängig vom Mutationsstatus zugelassene Therapien empfohlen: Docetaxel, Pemetrexed (Alimta ; Nicht-Plattenepithelkarzinome) und Erlotinib Nintedanib (Vargatef ) Seite 14 von 23
16 (Tarceva ) (Goeckenjan et al., 2010). Die S3-Leitlinie führt als weitere Therapieoption den gegen EGFR (Epidermal Growth Factor Receptor) gerichteten TKI Gefitinib (Iressa ) bei aktivierenden Mutationen des EGFR für Patienten in der Zweitlinien-Therapie an, insbesondere bei der Deletion im Exon 19 (Del 19) und der Punktmutation im Exon 21 L858R (Substitution von Leucin [L] gegen Arginin [R] an Aminosäureposition 858 des EGFR-Proteins [Tyrosinkinase-Domäne]) (Empfehlungsgrad B) (Goeckenjan et al., 2010). Afatinib (Giotrif ), ein irreversibler Blocker der ErbB (V-Erb-B2 Erythroblastic Leukemia Viral Oncogene Homolog)-Familie gehört ebenfalls zu der ATC-Klasse der Proteinkinase- Inhibitoren und ist auch für die Behandlung von TKI-naiven Patienten mit aktivierenden EGFR-Mutationen in der Zweitlinien-Therapie indiziert (Boehringer Ingelheim Pharma GmbH & Co. KG, 2013b). Afatinib ist seit September 2013 in Europa zugelassen und ist bereits in die Therapieempfehlungen aktualisierter Leitlinien des National Comprehensive Cancer Network (NCCN) (Ettinger et al., 2015) sowie der European Society of Medical Oncology (ESMO) (Reck et al., 2014c) eingegangen. Die aktuellen Leitlinien der DGHO (Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.v.), des NCCN sowie der ESMO empfehlen bei vorliegendem Nachweis von ALK (Anaplastic Lymphoma Kinase)-Mutationen den gegen ALK und MET (MNNG HOS Transforming Gene) gerichteten TKI Crizotinib (Xalkori ) (Griesinger et al., 2012; Reck et al., 2014c; Ettinger et al., 2015). Zugelassene Wirkstoffe In Tabelle 2-B sind die im Anwendungsgebiet von Nintedanib zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem NSCLC mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie eingesetzten Wirkstoffe gemäß Fachinformation aufgeführt. Tabelle 2-B: Laut S3-Leitlinie empfohlene Medikamente sowie zugelassene Proteinkinase- Inhibitoren im Anwendungsgebiet von Nintedanib Pharmakotherapeutische Gruppe Wirkstoff ATC-Code Anwendungsgebiet Antimetaboliten Folsäureanaloga Pemetrexed L01BA04 Alimta in Monotherapie ist angezeigt zur Behandlung in Zweitlinien-Therapie von Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC außer bei überwiegender plattenepithelialer Histologie (Eli Lilly Nederland B.V., 2012). Pflanzliche Alkaloide und andere natürliche Mittel Taxane Docetaxel L01CD02 Taxotere ist zur Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC nach Versagen einer vorausgegangenen Chemotherapie angezeigt (Aventis Pharma S.A., 2014). Nintedanib (Vargatef ) Seite 15 von 23
17 Pharmakotherapeutische Gruppe Wirkstoff ATC-Code Anwendungsgebiet Andere Antineoplastische Mittel Proteinkinase- Inhibitoren Afatinib L01XE13 Crizotinib L01XE16 Erlotinib L01XE03 Gefitinib L01XE02 Giotrif als Monotherapie wird angewendet zur Behandlung von EGFR-TKI-naiven erwachsenen Patienten mit lokal fortgeschrittenem und/oder metastasiertem NSCLC mit aktivierenden EGFR- Mutationen (Boehringer Ingelheim Pharma GmbH & Co. KG, 2013b). Xalkori wird angewendet bei Erwachsenen zur Behandlung des vorbehandelten ALK-positiven, fortgeschrittenen NSCLC (Pfizer Limited, 2014). Tarceva ist auch zur Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC angezeigt, bei denen mindestens eine vorausgegangene Chemotherapie versagt hat (Roche Registration Limited, 2013) 1. Iressa ist angezeigt zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem, NSCLC mit aktivierenden Mutationen der EGFR-Tyrosinkinase (AstraZeneca AB, 2014). Wirkmechanismen Nachfolgend werden die Wirkmechanismen der Substanzen, die zur Behandlung von Patienten innerhalb des Anwendungsgebiets von Nintedanib zur Verfügung stehen, dargestellt und die Unterschiede zur Wirkungsweise von Nintedanib erklärt. Zytostatika Die Wirkmechanismen der zur Behandlung des fortgeschrittenen NSCLC im vorliegenden Anwendungsgebiet verwendeten Zytostatika sind in Tabelle 2-C dargestellt. Zytostatika hemmen das Zellwachstum lediglich unspezifisch. Nintedanib unterscheidet sich im Wirkmechanismus von diesen Substanzen durch seine spezifische Hemmung der drei an der Angiogenese beteiligten RTK VEGFR, PDGFR sowie FGFR und stellt damit im Unterschied zu den Zytostatika einen zielgerichteten Therapieansatz dar. 1 Erlotinib hat in der Zweitlinie keine Indikationseinschränkung für Patienten mit aktivierender EGFR-Mutation (Roche Registration Limited, 2013) und kann gemäß Zulassung daher auch bei Patienten mit EGFR-Wildtyp eingesetzt werden. Nintedanib (Vargatef ) Seite 16 von 23
18 Tabelle 2-C: Wirkmechanismen der zur Behandlung des fortgeschrittenen NSCLC im vorliegenden Anwendungsgebiet verwendeten Zytostatika (von der S3-Leitlinie empfohlene Zytostatika) Wirkstoff Docetaxel Pemetrexed Wirkmechanismus Docetaxel ist eine antineoplastisch wirksame Substanz, deren Wirkung auf einer gesteigerten Polymerisation von Tubulin zu stabilen Mikrotubuli beruht. Gleichzeitig wird die Depolymerisation gehemmt, was zu einer deutlichen Abnahme an freiem Tubulin führt. Die Anlagerung von Docetaxel an die Mikrotubuli ändert nichts an der Zahl ihrer Protofilamente. In vitro-untersuchungen zeigen, dass Docetaxel das mikrotubuläre Netzwerk der Zellen zerstört, welches für lebenswichtige Zellfunktionen der Mitose- und Interphasen essenziell ist (Aventis Pharma S.A., 2014). Pemetrexed ist ein antineoplastisches Antifolat, das seine Wirkung ausübt, indem es wichtige folsäureabhängige metabolische Prozesse unterbricht, die für die Zellreplikation notwendig sind. In vitro-studien zeigten, dass Pemetrexed als Antifolat mit mehreren Angriffspunkten wirkt, indem es die Thymidylatsynthase (TS), Dihydrofolatreduktase und Glycinamide-Ribonucleotide- Formyltransferase (GARFT) blockiert, die folatabhängige Schlüsselenzyme der de-novo- Biosynthese von Thymidin- und Purinnucleotiden sind. Pemetrexed wird sowohl von dem reduzierten Folat-Carrier als auch membranständigen folatbindenden Proteintransportsystemen in die Zellen transportiert. Sobald es sich in der Zelle befindet, wird Pemetrexed schnell und wirksam durch das Enzym Folylpolyglutamatsynthase in Polyglutamatformen überführt. Die Polyglutamatformen werden in den Zellen zurückgehalten und sind noch stärkere Inhibitoren der TS und GARFT. Die Polyglutamatreaktion ist ein zeit- und konzentrationsabhängiger Prozess, der in Tumorzellen stattfindet und, in geringerem Maße, in normalen Zellen. Metaboliten der Polyglutamatreaktion haben eine verlängerte intrazelluläre Halbwertzeit, was zu einer verlängerten Wirkdauer in malignen Zellen führt (Eli Lilly Nederland B.V., 2012). Zielgerichtete Therapieansätze EGFR-TKI Fehlregulationen der Mitglieder der ErbB-Rezeptorfamilie spielen in der Onkogenese des NSCLC eine wichtige Rolle (Heukamp et al., 2011). Ein mutierter EGFR z. B. führt zu einer ligandenunabhängigen Aktivierung der weiterführenden Signalwege (Heukamp et al., 2011) und gibt daher ein permanentes Wachstumssignal in die Zelle ab (Shih et al., 2011). Bei etwa 10% der Lungenkarzinome in der westlichen Welt und 30%-50% der Tumoren im asiatischen Raum sind aktivierende Mutationen (v. a. Exon 19-Deletionen und L858R-Punktmutationen) des EGFR nachweisbar (Paez et al., 2004; Köhler und Schuler, 2011). Inzwischen hat sich die medikamentöse Inhibition des EGFR als erfolgversprechendes Therapiekonzept etabliert. Gefitinib und Erlotinib sind selektive, niedermolekulare Inhibitoren des EGFR. Gefitinib ist, unabhängig von der Therapielinie, für die Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC mit aktivierenden EGFR-Mutationen zugelassen (AstraZeneca AB, 2014). Erlotinib hat in der Zweitlinie keine Indikationseinschränkung für Patienten mit aktivierender EGFR-Mutation (Roche Registration Limited, 2013) und kann gemäß Zulassung daher auch bei Patienten mit EGFR-Wildtyp eingesetzt werden. Gefitinib und Erlotinib binden reversibel an die ATP- Bindestelle innerhalb der Tyrosinkinase-Domäne des EGFR. Dabei konkurrieren sie mit ATP und inhibieren so die Autophosphorylierung des EGFR und nachgeschaltete intrazelluläre Nintedanib (Vargatef ) Seite 17 von 23
19 Signalwege (Heukamp et al., 2011). Gegenüber den ErbB-Familienmitgliedern ErbB2 und ErbB4 zeigten die beiden TKI kaum inhibitorische Wirkung (Li et al., 2008; Solca et al., 2012). ErbB-Familienblocker Afatinib ist ein starker und selektiver irreversibler Blocker der ErbB-Familie und wurde im September 2013 in Europa für die Behandlung von EGFR-TKI-naiven Patienten mit aktivierenden EGFR-Mutationen zugelassen (Boehringer Ingelheim Pharma GmbH & Co. KG, 2013b). Im Gegensatz zu Erlotinib und Gefitinib bindet Afatinib kovalent an alle von den Mitgliedern der ErbB-Familie (EGFR [ErbB1], ErbB2, ErbB3 und ErbB4) gebildeten Homound Heterodimere und blockiert somit irreversibel die Signalgebung über diese Rezeptoren (Boehringer Ingelheim Pharma GmbH & Co. KG, 2013b). ALK und MET-TKI Crizotinib wurde im Oktober 2012 in Europa für die Therapie von vorbehandelten ALK-positiven NSCLC-Patienten zugelassen und ist ein niedermolekularer Inhibitor der Tyrosinkinasen ALK und MET sowie ihrer onkogenen Varianten (Pfizer Limited, 2014). Das Fusionsonkogen EML4 (Echinoderm Microtubule-Associated Protein Like 4)-ALK ist eine beim NSCLC auftretende Genfusion. Sie betrifft etwa 3%-7% der Patienten. Das gleichzeitige Vorkommen von EML4-ALK-Translokationen und EGFR-Mutationen ist weitgehend ausgeschlossen (Pao und Girard, 2011). Die intrazellulären Signalwege, mit deren Hilfe das EML4-ALK-Fusionsprotein das Wachstum von Tumoren induziert, sind noch nicht vollständig aufgeklärt (Bang, 2011). Bekannt ist, dass Crizotinib an die ATP-Bindungsstelle der ALK bindet. Die Anheftung von ATP wird somit inhibiert und die Autophosphorylierung, die zur Aktivierung der Kinase notwendig ist, blockiert (Bang, 2011). Anti-Angiogenese Nintedanib gehört wie die zuvor beschriebenen zielgerichteten Therapieansätze zur ATC-Klasse der Proteinkinase-Inhibitoren. Nintedanib ist ein anti-angiogener Wirkstoff und unterscheidet sich dadurch im Wirkmechanismus von den zuvor beschriebenen Therapieoptionen, indem er die Neubildung von Blutgefäßen im Tumor hemmt. Dies wird durch eine spezifische Blockade der für die Tumorangiogenese entscheidenden RTK-Klassen VEGFR, PDGFR und FGFR erreicht (Hilberg et al., 2008; Reck et al., 2014a). Diese dreifach zielgerichtete Blockade von VEGFR, PDGFR und FGFR ermöglicht eine Hemmung der Tumor-Angiogenese über verschiedene, alternative Signalwege. Bis zur Zulassung von Nintedanib war in Deutschland noch kein Angiogenese-Inhibitor für die Zweitlinien-Therapie von Patienten mit fortgeschrittenem NSCLC zugelassen. Nintedanib (Vargatef ) Seite 18 von 23
20 2.2 Zugelassene Anwendungsgebiete Anwendungsgebiete, auf die sich das Dossier bezieht Benennen Sie in der nachfolgenden Tabelle 2-3 die Anwendungsgebiete, auf die sich das vorliegende Dossier bezieht. Geben Sie hierzu den Wortlaut der Fachinformation an. Sofern im Abschnitt Anwendungsgebiete der Fachinformation Verweise enthalten sind, führen Sie auch den Wortlaut an, auf den verwiesen wird. Fügen Sie für jedes Anwendungsgebiet eine neue Zeile ein, und vergeben Sie eine Kodierung (fortlaufende Bezeichnung von A bis Z ) [Anmerkung: Diese Kodierung ist für die übrigen Module des Dossiers entsprechend zu verwenden]. Tabelle 2-3: Zugelassene Anwendungsgebiete, auf die sich das Dossier bezieht Anwendungsgebiet (Wortlaut der Fachinformation inkl. Wortlaut bei Verweisen) orphan (ja / nein) Datum der Zulassungserteilung Kodierung im Dossier a Nintedanib (Vargatef ) wird angewendet in Kombination mit Docetaxel zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie nein A a: Fortlaufende Angabe A bis Z. Benennen Sie die den Angaben in Tabelle 2-3 zugrunde gelegten Quellen. Die Angaben wurden der Fachinformation von Nintedanib entnommen (Boehringer Ingelheim Pharma GmbH & Co. KG, 2014) Weitere in Deutschland zugelassene Anwendungsgebiete Falls es sich um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, benennen Sie in der nachfolgenden Tabelle 2-4 die weiteren in Deutschland zugelassenen Anwendungsgebiete des zu bewertenden Arzneimittels. Geben Sie hierzu den Wortlaut der Fachinformation an; sofern im Abschnitt Anwendungsgebiete der Fachinformation Verweise enthalten sind, führen Sie auch den Wortlaut an, auf den verwiesen wird. Fügen Sie dabei für jedes Anwendungsgebiet eine neue Zeile ein. Falls es kein weiteres zugelassenes Anwendungsgebiet gibt oder es sich nicht um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, fügen Sie in der ersten Zeile unter Anwendungsgebiet kein weiteres Anwendungsgebiet ein. Nintedanib (Vargatef ) Seite 19 von 23
21 Tabelle 2-4: Weitere in Deutschland zugelassene Anwendungsgebiete des zu bewertenden Arzneimittels Anwendungsgebiet (Wortlaut der Fachinformation inkl. Wortlaut bei Verweisen) Kein weiteres Anwendungsgebiet Datum der Zulassungserteilung Benennen Sie die den Angaben in Tabelle 2-4 zugrunde gelegten Quellen. Falls es kein weiteres zugelassenes Anwendungsgebiet gibt oder es sich nicht um ein Dossier zu einem neuen Anwendungsgebiet eines bereits zugelassenen Arzneimittels handelt, geben Sie nicht zutreffend an. Nicht zutreffend 2.3 Beschreibung der Informationsbeschaffung für Modul 2 Erläutern Sie an dieser Stelle das Vorgehen zur Identifikation der im Abschnitt 2.1 und im Abschnitt 2.2 genannten Quellen (Informationsbeschaffung). Sofern erforderlich, können Sie zur Beschreibung der Informationsbeschaffung weitere Quellen benennen. Für die Beschreibung der Therapieoptionen wurde hauptsächlich die aktuelle S3-Leitlinie zur Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms herangezogen. Zusätzlich wurden für die Beschreibung von Crizotinib die aktuellen Leitlinien des NCCN, der DGHO sowie der ESMO verwendet. Die Angaben zum Wirkmechanismus der einzelnen Medikamente wurden den jeweiligen aktuellen Fachinformationen sowie Sekundärliteratur entnommen. 2.4 Referenzliste für Modul 2 Listen Sie nachfolgend alle Quellen (z. B. Publikationen), die Sie in den vorhergehenden Abschnitten angegeben haben (als fortlaufend nummerierte Liste). Verwenden Sie hierzu einen allgemein gebräuchlichen Zitierstil (z. B. Vancouver oder Harvard). Geben Sie bei Fachinformationen immer den Stand des Dokuments an. [1] Armulik, A., Abramsson, A. & Betsholtz, C Endothelial/pericyte interactions. Circ Res, 97(6), [2] AstraZeneca AB Fachinformation Iressa 250 mg Filmtabletten (Gefitinib). Stand: September Verfügbar: [Aufgerufen am ]. [3] Aventis Pharma S.A Fachinformation Taxotere 20 mg/1 ml, 80 mg/4 ml, 160 mg/8 ml Konzentrat zur Herstellung einer Infusionslösung (Docetaxel). Stand: April Verfügbar: [Aufgerufen am ]. Nintedanib (Vargatef ) Seite 20 von 23
22 [4] Bang, Y. J The potential for crizotinib in non-small cell lung cancer: a perspective review. Ther Adv Med Oncol, 3(6), [5] Boehringer Ingelheim Pharma GmbH & Co. KG. 2013a. Clinical Trial Report (Final OS Analysis): Multicentre, randomised, double-blind, Phase III trial to investigate the efficacy and safety of oral BIBF 1120 plus standard docetaxel therapy compared to placebo plus standard docetaxel therapy in patients with stage IIIB/IV or recurrent non small cell lung cancer after failure of first line chemotherapy (LUME-Lung 1). Document Number: U (Data on file) [6] Boehringer Ingelheim Pharma GmbH & Co. KG. 2013b. Fachinformation Giotrif 40 mg Filmtabletten (Afatinib). September Verfügbar: [Aufgerufen am ]. [7] Boehringer Ingelheim Pharma GmbH & Co. KG Fachinformation Vargatef 100 mg/150 mg Weichkapseln (Nintedanib). Stand: November [8] Bottsford-Miller, J. N., Coleman, R. L. & Sood, A. K Resistance and escape from antiangiogenesis therapy: clinical implications and future strategies. J Clin Oncol, 30(32), [9] Carmeliet, P Angiogenesis in health and disease. Nat Med, 9(6), [10] Carmeliet, P. & Jain, R. K Molecular mechanisms and clinical applications of angiogenesis. Nature, 473(7347), [11] Casanovas, O., Hicklin, D. J., Bergers, G., et al Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell, 8(4), [12] Cook, K. M. & Figg, W. D Angiogenesis inhibitors: current strategies and future prospects. CA Cancer J Clin, 60(4), [13] Eli Lilly Nederland B.V Fachinformation Alimta 100/500 mg Pulver zur Herstellung eines Konzentrates zur Herstellung einer Infusionslösung (Pemetrexed). Stand: November Verfügbar: [Aufgerufen am ]. [14] Ettinger, D. S., Wood, D. E., Akerley, W., et al NCCN Clinical Practice Guidelines in Oncology; Non-Small Cell Lung Cancer. Version Verfügbar: [Aufgerufen am ]. [15] Folkman, J Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med, 333(26), [16] Goeckenjan, G., Sitter, H., Thomas, M., et al Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. Pneumologie, 64 Suppl 2, e [17] Griesinger, F., Eberhard, W., Früh, M., et al Lungenkarzinom, nicht-kleinzellig (NSCLC). Leitlinie. Stand: Oktober Verfügbar: [Aufgerufen am ]. [18] Heukamp, L. C., Wolf, J. & Büttner, R Pathophysiologie und Molekulardiagnostik beim nichtkleinzelligen Lungenkarzinom. Onkologe, 17, [19] Hilberg, F., Roth, G. J., Krssak, M., et al BIBF 1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res, 68(12), [20] Hubbard, S. R. & Till, J. H Protein tyrosine kinase structure and function. Annu Rev Biochem, 69, Nintedanib (Vargatef ) Seite 21 von 23
23 [21] Hurwitz, H., Fehrenbacher, L., Novotny, W., et al Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med, 350(23), [22] Jain, R. K Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Science, 307(5706), [23] Köhler, J. & Schuler, M Personalisierte medikamentöse Therapie des fortgeschrittenen nichtkleinzelligen Lungenkarzinoms. Onkologe, 17(8), [24] Kutluk Cenik, B., Ostapoff, K. T., Gerber, D. E., et al BIBF 1120 (nintedanib), a triple angiokinase inhibitor, induces hypoxia but not EMT and blocks progression of preclinical models of lung and pancreatic cancer. Mol Cancer Ther, 12(6), [25] Li, D., Ambrogio, L., Shimamura, T., et al BIBW2992, an irreversible EGFR/HER2 inhibitor highly effective in preclinical lung cancer models. Oncogene, 27(34), [26] Madhusudan, S. & Ganesan, T. S Tyrosine kinase inhibitors in cancer therapy. Clin Biochem, 37(7), [27] Moserle, L. & Casanovas, O Anti-angiogenesis and metastasis: a tumour and stromal cell alliance. J Intern Med, 273(2), [28] Paez, J. G., Janne, P. A., Lee, J. C., et al EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science, 304(5676), [29] Pao, W. & Girard, N New driver mutations in non-small-cell lung cancer. Lancet Oncol, 12, [30] Pfizer Limited Fachinformation Xalkori 200/250 mg Hartkapseln (Crizotinib). Stand: August Verfügbar: [Aufgerufen am ]. [31] Plank, M. J. & Sleeman, B. D Tumour-induced angiogenesis: a review. J Theor Med, 5(3-4), [32] Presta, M., Dell'Era, P., Mitola, S., et al Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis. Cytokine Growth Factor Rev, 16(2), [33] Pugh, C. W. & Ratcliffe, P. J Regulation of angiogenesis by hypoxia: role of the HIF system. Nat Med, 9(6), [34] Reck, M., Heigener, D. & Reinmuth, N. 2014a. Nintedanib for the treatment of patients with advanced non-small-cell lung cancer. Expert Rev Clin Pharmacol, 7(5), [35] Reck, M., Kaiser, R., Mellemgaard, A., et al. 2014b. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial. Lancet Oncol, 15(2), [36] Reck, M., Popat, S., Reinmuth, N., et al. 2014c. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 25 Suppl 3, iii27-iii39. [37] Roche Registration Limited Fachinformation Tarceva 25/100/150 mg Filmtabletten (Erlotinib). Stand: Dezember Verfügbar: [Aufgerufen am ]. [38] Roche Registration Limited Fachinformation Avastin 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung (Bevacizumab). Stand: September Verfügbar: [Aufgerufen am ]. Nintedanib (Vargatef ) Seite 22 von 23
24 [39] Rolfo, C., Raez, L. E., Bronte, G., et al BIBF 1120/ nintedanib : a new triple angiokinase inhibitor-directed therapy in patients with non-small cell lung cancer. Expert Opin Investig Drugs, 22(8), [40] Schirrmacher, V Cancer metastasis: experimental approaches, theoretical concepts, and impacts for treatment strategies. Adv Cancer Res, 43, [41] Shih, A. J., Telesco, S. E. & Radhakrishnan, R Analysis of Somatic Mutations in Cancer: Molecular Mechanisms of Activation in the ErbB Family of Receptor Tyrosine Kinases. Cancers (Basel), 3(1), [42] Solca, F., Dahl, G., Zoephel, A., et al Target binding properties and cellular activity of afatinib (BIBW 2992), an irreversible ErbB family blocker. J Pharmacol Exp Ther, 343(2), [43] Sutherland, R. M Importance of critical metabolites and cellular interactions in the biology of microregions of tumors. Cancer, 58(8), [44] Turner, N. & Grose, R Fibroblast growth factor signalling: from development to cancer. Nat Rev Cancer, 10(2), [45] Werner, S. & Grose, R Regulation of wound healing by growth factors and cytokines. Physiol Rev, 83(3), Nintedanib (Vargatef ) Seite 23 von 23
Nintedanib (Vargatef )
 Nintedanib (Vargatef ) Zur Behandlung des nicht-kleinzelligen Lungenkarzinoms (NSCLC) stehen bereits mehrere zielgerichtet wirksame Tyrosinkinase-Inhibitoren zur Verfügung (s. Tabelle 1): Erlotinib (Tarceva,
Nintedanib (Vargatef ) Zur Behandlung des nicht-kleinzelligen Lungenkarzinoms (NSCLC) stehen bereits mehrere zielgerichtet wirksame Tyrosinkinase-Inhibitoren zur Verfügung (s. Tabelle 1): Erlotinib (Tarceva,
HINTERGRUND 1. WAS IST NINTEDANIB*? 2. WIRKMECHANISMUS
 HINTERGRUND 1. Was ist Nintedanib*? 2. Wirkmechanismus 3. Stand der Entwicklung 4. Studiendaten 5. Klinisches Potential 1. WAS IST NINTEDANIB*? Nintedanib* (Vargatef ) ist ein oraler 3-fach zielgerichteter
HINTERGRUND 1. Was ist Nintedanib*? 2. Wirkmechanismus 3. Stand der Entwicklung 4. Studiendaten 5. Klinisches Potential 1. WAS IST NINTEDANIB*? Nintedanib* (Vargatef ) ist ein oraler 3-fach zielgerichteter
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Afatinib (Giotrif ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Afatinib (Giotrif ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene
EU-Kommission erteilt Zulassung für IRESSA
 Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Pasireotid (Signifor ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Pasireotid (Signifor ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie
 EU-Zulassung für Vectibix zur Behandlung des metastasierten kolorektalen Karzinoms Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie München (10. Dezember 2007) Die europäische Arzneimittelagentur
EU-Zulassung für Vectibix zur Behandlung des metastasierten kolorektalen Karzinoms Klinisch relevanter Biomarker KRAS ermöglicht individualisierte Therapie München (10. Dezember 2007) Die europäische Arzneimittelagentur
Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V
 Dokumentvorlage, Version vom 14.11.2013 Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V () Modul K1 Zusammenfassung der Aussagen im Dossier
Dokumentvorlage, Version vom 14.11.2013 Dossier zur Kosten-Nutzen-Bewertung gemäß 35b SGB V () Modul K1 Zusammenfassung der Aussagen im Dossier
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Osimertinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Nintedanib. veröffentlicht am 1. April 2015 Vorgangsnummer D-147 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC
 SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Herausforderungen in der individualisierten Therapie beim mcrc
 Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Dossierbewertung A16-11 Version 1.0 Ramucirumab (Lungenkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabazitaxel (Jevtana ) Sanofi-Aventis Modul 2 mhr Prostatakarzinom Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Cabazitaxel (Jevtana ) Sanofi-Aventis Modul 2 mhr Prostatakarzinom Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
internationalen SAiL Studie, in der die Sicherheit und Wirksamkeit des VEGF Antikörpers in der täglichen Routine analysiert werden.
 DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
Molekularpathologische Diagnostik bei bösartiger Neubildung der Lunge
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Neues aus Diagnostik und Therapie beim Lungenkrebs. Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln
 Neues aus Diagnostik und Therapie beim Lungenkrebs Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln Über was ich Ihnen heute berichten will: Lungenkrebs ist nicht gleich Lungenkrebs
Neues aus Diagnostik und Therapie beim Lungenkrebs Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln Über was ich Ihnen heute berichten will: Lungenkrebs ist nicht gleich Lungenkrebs
Dossierbewertung A16-25 Version 1.0 Nivolumab (nicht plattenepitheliales NSCLC)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
NichtPlattenepithelkarzinom
 Die Therapie des NSCLC: Pemetrexed: Wirksamkeitsunterschiede nach der histologischen Differenzierun Die Therapie des NSCLC Pemetrexed: Wirksamkeitsunterschiede nach der histologischen Differenzierung in
Die Therapie des NSCLC: Pemetrexed: Wirksamkeitsunterschiede nach der histologischen Differenzierun Die Therapie des NSCLC Pemetrexed: Wirksamkeitsunterschiede nach der histologischen Differenzierung in
Individualisierte Therapieentscheidung zum Nutzen des NSCLC Patienten. Wolfgang Schütte Krankenhaus Martha-Maria Halle-Dölau
 Individualisierte Therapieentscheidung zum Nutzen des NSCLC Patienten Wolfgang Schütte Krankenhaus Martha-Maria Halle-Dölau Chemotherapie des fortgeschrittenen NSCLC Zweifachkombination mit Platin + neuer
Individualisierte Therapieentscheidung zum Nutzen des NSCLC Patienten Wolfgang Schütte Krankenhaus Martha-Maria Halle-Dölau Chemotherapie des fortgeschrittenen NSCLC Zweifachkombination mit Platin + neuer
NUB Antrag 2017/2018 Alectinib
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Osimertinib (Tagrisso )
 Osimertinib (Tagrisso ) Die bedeutende Rolle des epidermalen Wachstumsfaktor-Rezeptors (epidermal growth factor receptor = EGFR) beim nichtkleinzelligen Lungenkarzinom (non-smallcell lung cancer = NSCLC)
Osimertinib (Tagrisso ) Die bedeutende Rolle des epidermalen Wachstumsfaktor-Rezeptors (epidermal growth factor receptor = EGFR) beim nichtkleinzelligen Lungenkarzinom (non-smallcell lung cancer = NSCLC)
Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, Dr. M. Engels, Institut für Pathologie
 Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, 03.11.2012 Dr. M. Engels, Institut für Pathologie Adenokarzinom Plattenepithelkarzinom molekulare Subtypen
Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, 03.11.2012 Dr. M. Engels, Institut für Pathologie Adenokarzinom Plattenepithelkarzinom molekulare Subtypen
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Albiglutid (Eperzan ) GlaxoSmithKline GmbH & Co. KG Zusatzdokument zur Nachforderung fehlender Unterlagen/Angaben (gemäß
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Albiglutid (Eperzan ) GlaxoSmithKline GmbH & Co. KG Zusatzdokument zur Nachforderung fehlender Unterlagen/Angaben (gemäß
NUB Antrag 2018/2019 Lenvatinib
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Bevacizumab kann demnach bei selektionierten Patienten im
 Fortgeschrittenes NSCLC Neue S3-Leitlinie empfiehlt Bevacizumab Grenzach-Wyhlen (7. April 2010) - Die kürzlich veröffentlichte S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms
Fortgeschrittenes NSCLC Neue S3-Leitlinie empfiehlt Bevacizumab Grenzach-Wyhlen (7. April 2010) - Die kürzlich veröffentlichte S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms
Dossierbewertung A15-01 Version 1.0 Nintedanib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nintedanib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nintedanib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Perspektiven mit Tarceva und Avastin
 Fortgeschrittenes NSCLC: Perspektiven mit Tarceva und Avastin Mannheim (20. März 2009) - Die Behandlung des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms (Non Small Cell Lung Cancer, NSCLC) mit
Fortgeschrittenes NSCLC: Perspektiven mit Tarceva und Avastin Mannheim (20. März 2009) - Die Behandlung des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms (Non Small Cell Lung Cancer, NSCLC) mit
Palliative Chemotherapie First line 04.Februar 2006
 Klinikum der Johann Wolfgang Goethe Universität Zentrum für Innere Medizin Medizinische Klinik I Pneumologie/Allergologie Palliative Chemotherapie First line 04.Februar 2006 W. Gleiber Klinikum der Johann
Klinikum der Johann Wolfgang Goethe Universität Zentrum für Innere Medizin Medizinische Klinik I Pneumologie/Allergologie Palliative Chemotherapie First line 04.Februar 2006 W. Gleiber Klinikum der Johann
Avastin wirkt unabhängig vom K-RAS-Mutationsstatus in der First-Line-Therapie des metastasierten kolorektalen Karzinoms
 Avastin wirkt unabhängig vom K-RAS-Mutationsstatus in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin / Grenzach-Wyhlen (3. Oktober 2008) - Avastin (Bevacizumab) ist das einzige
Avastin wirkt unabhängig vom K-RAS-Mutationsstatus in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin / Grenzach-Wyhlen (3. Oktober 2008) - Avastin (Bevacizumab) ist das einzige
Erfolge der Immuntherapie beim Lungenkrebs. Martin Früh Klinik für Onkologie und Hämatologie Kantonsspital St. Gallen
 Erfolge der Immuntherapie beim Lungenkrebs Martin Früh Klinik für Onkologie und Hämatologie Kantonsspital St. Gallen Weltweite Krebsstatistik 2012 (Industrieländer) Neuerkrankungen/Jahr Mortalität/Jahr
Erfolge der Immuntherapie beim Lungenkrebs Martin Früh Klinik für Onkologie und Hämatologie Kantonsspital St. Gallen Weltweite Krebsstatistik 2012 (Industrieländer) Neuerkrankungen/Jahr Mortalität/Jahr
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
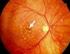 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Ergebnisse von zwei großen Phase-III-Studien beim fortgeschrittenen nicht-kleinzelligen Lungenkarzinom
 Ergebnisse von zwei großen Phase-III-Studien beim fortgeschrittenen nicht-kleinzelligen Lungenkarzinom (NSCLC) Post-ASCO vorgestellt - Erstlinientherapie: Afatinib* bestätigt in weiterer Phase-III-Studie
Ergebnisse von zwei großen Phase-III-Studien beim fortgeschrittenen nicht-kleinzelligen Lungenkarzinom (NSCLC) Post-ASCO vorgestellt - Erstlinientherapie: Afatinib* bestätigt in weiterer Phase-III-Studie
Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis
 Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis IMD Berlin MVZ Vascular endothelial growth factor (VEGF) Signalmolekül in der Vaskulogenese und Angiogenese
Vascular endothelial growth factor (VEGF) Diagnostische Bedeutung Dr. rer. nat. Cornelia Doebis IMD Berlin MVZ Vascular endothelial growth factor (VEGF) Signalmolekül in der Vaskulogenese und Angiogenese
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Afatinib. veröffentlicht am 17. August 2015 Vorgangsnummer D-163 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom)
 Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 22. August 2016 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom) veröffentlicht
Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 22. August 2016 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom) veröffentlicht
AMB 2014, 48, 43. Neues onkologisches Arzneimittel: Regorafenib (Stivarga )
 AMB 2014, 48, 43 Neues onkologisches Arzneimittel: Regorafenib (Stivarga ) Patienten mit metastasiertem kolorektalem Karzinom haben unbehandelt eine mediane Lebenserwartung von etwa sechs Monaten (1).
AMB 2014, 48, 43 Neues onkologisches Arzneimittel: Regorafenib (Stivarga ) Patienten mit metastasiertem kolorektalem Karzinom haben unbehandelt eine mediane Lebenserwartung von etwa sechs Monaten (1).
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Crizotinib (XALKORI ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Crizotinib (XALKORI ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs
 Medienmitteilung Basel, 8 Juni 2016 Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs Dies ist die erste Zulassung
Medienmitteilung Basel, 8 Juni 2016 Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs Dies ist die erste Zulassung
Dossierbewertung A13-41 Version 1.0 Afatinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Zielgerichtete Therapie bei Darmkrebs: Hemmung des Blutgefäßwachstums. Eine neue Chance für die Patienten
 Zielgerichtete Therapie bei Darmkrebs: Hemmung des wachstums Eine neue Chance für die Patienten Tumor-Angiogenese Was ist Angiogenese? Der Begriff Angiogenese leitet sich ab aus den altgriechischen Bezeichnungen
Zielgerichtete Therapie bei Darmkrebs: Hemmung des wachstums Eine neue Chance für die Patienten Tumor-Angiogenese Was ist Angiogenese? Der Begriff Angiogenese leitet sich ab aus den altgriechischen Bezeichnungen
Behandlungspfade Interdisziplinäres Onkologisches Zentrum Klinikum Ernst von Bergmann Potsdam. Lungenkarzinom NSCLC.
 Lungenkarzinom NSCLC Stand Januar 2017 Klinischer Zustand Notwendige Diagnostik Entscheidungsgrundlage Handlung Stadium I A T1 a/b- N0 Klinische Untersuchung LuFu, EKG Bronchoskopie + Biospie Thorax-CT
Lungenkarzinom NSCLC Stand Januar 2017 Klinischer Zustand Notwendige Diagnostik Entscheidungsgrundlage Handlung Stadium I A T1 a/b- N0 Klinische Untersuchung LuFu, EKG Bronchoskopie + Biospie Thorax-CT
Projekte: Gutartige, boesartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
 Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Pembrolizumab (KEYTRUDA ) MSD SHARP & DOHME GMBH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Pembrolizumab (KEYTRUDA ) MSD SHARP & DOHME GMBH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Behandlungspfade Interdisziplinäres Onkologisches Zentrum Klinikum Ernst von Bergmann Potsdam. Lungenkarzinom NSCLC.
 Lungenkarzinom NSCLC Stand Januar 2017 Klinischer Zustand Notwendige Diagnostik Entscheidungsgrundlage Handlung Stadium I A T1 a/b- N0 Klinische Untersuchung LuFu, EKG Bronchoskopie + Biospie Thorax-CT
Lungenkarzinom NSCLC Stand Januar 2017 Klinischer Zustand Notwendige Diagnostik Entscheidungsgrundlage Handlung Stadium I A T1 a/b- N0 Klinische Untersuchung LuFu, EKG Bronchoskopie + Biospie Thorax-CT
Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms
 Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms S. Stintzing 26.06.09 EGF-Rezeptor - Auf 60-80% der kolorektalen Karzinome exprimiert (IHC) - Intrazelluläre
Klinische Bedeutung von KRAS und BRAF Mutationen in der Therapie des kolorektalen Karzinoms S. Stintzing 26.06.09 EGF-Rezeptor - Auf 60-80% der kolorektalen Karzinome exprimiert (IHC) - Intrazelluläre
Dabrafenib in der EU zugelassen
 Vielversprechende Therapieoption für Patienten mit fortgeschrittenem Melanom Dabrafenib in der EU zugelassen München (27. September 2013) - Die Europäische Arzneimittelzulassungsbehörde EMA hat den von
Vielversprechende Therapieoption für Patienten mit fortgeschrittenem Melanom Dabrafenib in der EU zugelassen München (27. September 2013) - Die Europäische Arzneimittelzulassungsbehörde EMA hat den von
Neues aus der Onkologie Jörg Thomalla
 Neues aus der Onkologie 2015 Was haben neue Wirkstoffe gebracht? Jörg Thomalla Wirkstoffe mit gleicher Indikationstellung und gleichem Wirkmechanismus Beispiel malignes Melanom Kombination BRAF-Inhibitor
Neues aus der Onkologie 2015 Was haben neue Wirkstoffe gebracht? Jörg Thomalla Wirkstoffe mit gleicher Indikationstellung und gleichem Wirkmechanismus Beispiel malignes Melanom Kombination BRAF-Inhibitor
Zielgerichtete Therapie Ob Ihr wollt oder nicht
 Zielgerichtete Therapie Ob Ihr wollt oder nicht Ziad Atassi Universitätsfrauenklinik Ulm Direktor: Prof.Dr.R.Kreienberg inedome Ulm 08.07.2009 ADECATUMUMAB N = 22 NERATINIB N = 37 PERTUZUMAB N = 29 TRASTUZUMAB
Zielgerichtete Therapie Ob Ihr wollt oder nicht Ziad Atassi Universitätsfrauenklinik Ulm Direktor: Prof.Dr.R.Kreienberg inedome Ulm 08.07.2009 ADECATUMUMAB N = 22 NERATINIB N = 37 PERTUZUMAB N = 29 TRASTUZUMAB
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Progressionsfreies Überleben verdoppelt und Gesamtüberleben deutlich verlängert
 Gezielte Therapie mit dem Multi Kinase Inhibitor - Sorafenib zur Therapie des fortgeschrittenen Nierenze Gezielte Therapie mit dem Multi-Kinase-Inhibitor Sorafenib zur Therapie des fortgeschrittenen Nierenzellkarzinoms
Gezielte Therapie mit dem Multi Kinase Inhibitor - Sorafenib zur Therapie des fortgeschrittenen Nierenze Gezielte Therapie mit dem Multi-Kinase-Inhibitor Sorafenib zur Therapie des fortgeschrittenen Nierenzellkarzinoms
Anlage III. Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V
 Anlage III Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V Datum 22. Juni 2016 Stellungnahme zu Stellungnahme von Ramucirumab, Nr. 398, A16-11, Version: 1.0, Stand:
Anlage III Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V Datum 22. Juni 2016 Stellungnahme zu Stellungnahme von Ramucirumab, Nr. 398, A16-11, Version: 1.0, Stand:
Neue Substanzen in der Therapie des Mammakarzinoms
 Neue Substanzen in der Therapie des Mammakarzinoms Prof. V. Heinemann Department of Medical Oncology, Klinikum Grosshadern, University of Munich Germany Docetaxel + Bevacizumab beim HER2-negativen MBC
Neue Substanzen in der Therapie des Mammakarzinoms Prof. V. Heinemann Department of Medical Oncology, Klinikum Grosshadern, University of Munich Germany Docetaxel + Bevacizumab beim HER2-negativen MBC
Neue Substanzen in der Therapie des KRK Prof. V. Heinemann
 Neue Substanzen in der Therapie des KRK Prof. V. Heinemann Medizinische Klinik und Poliklinik III, Klinikum Großhadern Ludwig-Maximilians Universität München Extrazellulär Neue Targets in der Krebstherapie
Neue Substanzen in der Therapie des KRK Prof. V. Heinemann Medizinische Klinik und Poliklinik III, Klinikum Großhadern Ludwig-Maximilians Universität München Extrazellulär Neue Targets in der Krebstherapie
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Crizotinib (XALKORI ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Crizotinib (XALKORI ) Pfizer Pharma GmbH als örtlicher Vertreter des Zulassungsinhabers Pfizer Limited Modul 2 Allgemeine
Erbitux (Cetuximab) beim metastasierten kolorektalen Karzinom: Erstlinientherapie und Biomarker im Fokus
 Erbitux (Cetuximab) beim metastasierten kolorektalen Karzinom: Erstlinientherapie und Biomarker im Fokus Berlin (20. Februar 2008) Auch auf dem diesjährigen 28. Deutschen Krebskongress in Berlin überzeugte
Erbitux (Cetuximab) beim metastasierten kolorektalen Karzinom: Erstlinientherapie und Biomarker im Fokus Berlin (20. Februar 2008) Auch auf dem diesjährigen 28. Deutschen Krebskongress in Berlin überzeugte
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Lungenkarzinom. Christian Scholz Vivantes Klinikum Am Urban Innere Medizin Hämatologie und Onkologie Berlin, Germany
 Lungenkarzinom Christian Scholz Vivantes Klinikum Am Urban Innere Medizin Hämatologie und Onkologie Berlin, Germany Inzidenz 2010 erkrankten ca. 17.000 Frauen u. 35.000 Männer an bösartigen Lungentumoren,
Lungenkarzinom Christian Scholz Vivantes Klinikum Am Urban Innere Medizin Hämatologie und Onkologie Berlin, Germany Inzidenz 2010 erkrankten ca. 17.000 Frauen u. 35.000 Männer an bösartigen Lungentumoren,
Lungen. Bronchialkarzinome. PD Dr. med. Florian Fuchs. Leiter Schwerpunkt Pneumologie Medizinische Klinik 1 (Direktor: Prof. Dr. med. M.F.
 Lungen Bronchialkarzinome PD Dr. med. Florian Fuchs Leiter Schwerpunkt Pneumologie Medizinische Klinik 1 (Direktor: Prof. Dr. med. M.F. Neurath) Offenlegung von Zuwendungen und potentielle Interessenskonflikten
Lungen Bronchialkarzinome PD Dr. med. Florian Fuchs Leiter Schwerpunkt Pneumologie Medizinische Klinik 1 (Direktor: Prof. Dr. med. M.F. Neurath) Offenlegung von Zuwendungen und potentielle Interessenskonflikten
Phase-III-Studie mit Regorafenib bei Patienten mit metastasiertem GIST erreicht primären Endpunkt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Cobimetinib und Vemurafenib: Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom
 Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
Biomarker für den Kampf gegen Lungenkrebs
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/biomarker-fuer-den-kampfgegen-lungenkrebs/ Biomarker für den Kampf gegen Lungenkrebs Ein von Biomarkern geleiteter,
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/biomarker-fuer-den-kampfgegen-lungenkrebs/ Biomarker für den Kampf gegen Lungenkrebs Ein von Biomarkern geleiteter,
Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung-
 Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung- Torsten Keßler aus der Medizinischen Klinik und Poliklinik A -Direktor - Univ.-Prof. Dr. W.E. Berdel torstenkessler@uni-muenster.de Neu zugelassene
Neue Substanzen in der Onkologie -Wirkung und Nebenwirkung- Torsten Keßler aus der Medizinischen Klinik und Poliklinik A -Direktor - Univ.-Prof. Dr. W.E. Berdel torstenkessler@uni-muenster.de Neu zugelassene
Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab
 Neues und Wissenswertes aus der Onkologie Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab München (26. Juli 2012) - Deutliche Fortschritte in der Tumortherapie haben in den letzten
Neues und Wissenswertes aus der Onkologie Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab München (26. Juli 2012) - Deutliche Fortschritte in der Tumortherapie haben in den letzten
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Afatinib (Giotrif ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 3 A EGFR-TKI-naive erwachsene Patienten mit lokal
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Afatinib (Giotrif ) Boehringer Ingelheim Pharma GmbH & Co. KG Modul 3 A EGFR-TKI-naive erwachsene Patienten mit lokal
Olaratumab (Lartruvo )
 Olaratumab (Lartruvo ) Der monoklonale Antikörper Olaratumab (Lartruvo ) ist in einem beschleunigten Verfahren von der EMA zur Therapie von Weichteilsarkomen zugelassen worden. Ausschlaggebend für die
Olaratumab (Lartruvo ) Der monoklonale Antikörper Olaratumab (Lartruvo ) ist in einem beschleunigten Verfahren von der EMA zur Therapie von Weichteilsarkomen zugelassen worden. Ausschlaggebend für die
NUB Antrag 2018/2019 Cabozantinib
 Haben Sie externe Hilfestellungen zum Ausfüllen der Formblätter in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche
Haben Sie externe Hilfestellungen zum Ausfüllen der Formblätter in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Personalisierte Medizin und Lungenkrebs
 Personalisierte Medizin und Lungenkrebs Neue Diagnose- und molekulare Testverfahren machen es heute möglich, das genetische Profil von Tumoren genauer zu analysieren. So lässt sich mittlerweile nicht nur
Personalisierte Medizin und Lungenkrebs Neue Diagnose- und molekulare Testverfahren machen es heute möglich, das genetische Profil von Tumoren genauer zu analysieren. So lässt sich mittlerweile nicht nur
Individualisierte Therapieentscheidung Aktueller Stand aus klinischer Sicht
 Onkologischer Workshop: Individualisierte Therapieentscheidung Aktueller Stand aus klinischer Sicht Bernd Schmidt Schwerpunkt Pneumologie, Universitätsklinikum Halle (Saale) Samstag 6. März 2010 Histologie
Onkologischer Workshop: Individualisierte Therapieentscheidung Aktueller Stand aus klinischer Sicht Bernd Schmidt Schwerpunkt Pneumologie, Universitätsklinikum Halle (Saale) Samstag 6. März 2010 Histologie
Nierenzellkarzinom: First-Line-Therapie mit Bevacizumab plus Interferon alfa-2a erhält Lebensqualität und. Therapieoptionen
 Nierenzellkarzinom First-Line-Therapie mit Bevacizumab plus Interferon alfa-2a erhält Lebensqualität und Therapieoptionen Düsseldorf (1.Oktober 2010) - Anlässlich der 62. Jahrestagung der Deutschen Gesellschaft
Nierenzellkarzinom First-Line-Therapie mit Bevacizumab plus Interferon alfa-2a erhält Lebensqualität und Therapieoptionen Düsseldorf (1.Oktober 2010) - Anlässlich der 62. Jahrestagung der Deutschen Gesellschaft
Tumor Angiogenese und. Anti-Angiogenese als. Tumor-Therapie
 Tumor Angiogenese und Anti-Angiogenese als Tumor-Therapie Norbert Fusenig, DKFZ - Heidelberg Die Tumorzelle im Zentrum der Aufmerksamkeit - Akkumulation genetischer Veränderungen in den Tumorzellen: Aktivierung
Tumor Angiogenese und Anti-Angiogenese als Tumor-Therapie Norbert Fusenig, DKFZ - Heidelberg Die Tumorzelle im Zentrum der Aufmerksamkeit - Akkumulation genetischer Veränderungen in den Tumorzellen: Aktivierung
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Ceritinib (Zykadia ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Ceritinib (Zykadia ) Novartis Pharma GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete
Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016: Positive Daten zu
 Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016 Positive Daten zur PD-L1-Inhibition mit Atezolizumab Leipzig (15. Oktober 2016) - Der Anti-PD-L1-Antikörper Atezolizumab
Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016 Positive Daten zur PD-L1-Inhibition mit Atezolizumab Leipzig (15. Oktober 2016) - Der Anti-PD-L1-Antikörper Atezolizumab
Diskussion Fall 1. Neue Optionen beim metastasierten NSCLC ohne Treibermutation: Welche Patienten profitieren wirklich? PD Dr. med.
 Neue Optionen beim metastasierten NSCLC ohne Treibermutation: Welche Patienten profitieren wirklich? Diskussion Fall 1 PD Dr. med. Florian Fuchs Leiter Schwerpunkt Pneumologie Medizinische Klinik 1 (Direktor:
Neue Optionen beim metastasierten NSCLC ohne Treibermutation: Welche Patienten profitieren wirklich? Diskussion Fall 1 PD Dr. med. Florian Fuchs Leiter Schwerpunkt Pneumologie Medizinische Klinik 1 (Direktor:
Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU
 Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Tumortherapie. Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr Berlin
 Tumortherapie Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr. 5 10961 Berlin Grundsätzliches Ideale Krebsbehandlung: Nur bösartige Zellen werden abgetötet, gesunde Zellen
Tumortherapie Dr. Martin Ruhnke Schwerpunktpraxis für Gynäkologische Onkologie Bergmannstr. 5 10961 Berlin Grundsätzliches Ideale Krebsbehandlung: Nur bösartige Zellen werden abgetötet, gesunde Zellen
Systemische Therapie des Colorektalen-karzinoms. Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT)
 Systemische Therapie des Colorektalen-karzinoms Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT) Systemische Therapie des Rektumkarzinoms 1957 5-Fluorouracil
Systemische Therapie des Colorektalen-karzinoms Carsten Grüllich Abteilung Medizinische Onkologie Nationales Centrum für Tumorerkrankungen (NCT) Systemische Therapie des Rektumkarzinoms 1957 5-Fluorouracil
Bevacizumab in der Erstlinien-Therapie metastasierter kolorektaler Karzinome
 AMB 2005, 39, 1 Bevacizumab in der Erstlinien-Therapie metastasierter kolorektaler Karzinome Dickdarmkrebs ist in den westlichen Industrienationen die häufigste Tumorerkrankung, bei der etwa die Hälfte
AMB 2005, 39, 1 Bevacizumab in der Erstlinien-Therapie metastasierter kolorektaler Karzinome Dickdarmkrebs ist in den westlichen Industrienationen die häufigste Tumorerkrankung, bei der etwa die Hälfte
Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg
 Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg Her2 Resistenz - Die klinischen Fakten - ca. 30% der Her2 pos. MBC sprechen auf
Her2 Resistenz Schicksal oder Herausforderung? Elmar Stickeler Universitätsfrauenklinik Freiburg Co-Director CCCF Freiburg Her2 Resistenz - Die klinischen Fakten - ca. 30% der Her2 pos. MBC sprechen auf
Vorbehaltlich der Genehmigung durch das BMG und Veröffentlichung im Bundesanzeiger gem. 91 Abs. 4 SGB V
 Anlage V - Antrag auf Freistellung von der Nutzenbewertung nach 35a Abs. 1a SGB V i.v.m. 15 VerfO wegen Geringfügigkeit für Fertigarzneimittel 1) Pharmazeutischer Unternehmer a) Name des pharmazeutischen
Anlage V - Antrag auf Freistellung von der Nutzenbewertung nach 35a Abs. 1a SGB V i.v.m. 15 VerfO wegen Geringfügigkeit für Fertigarzneimittel 1) Pharmazeutischer Unternehmer a) Name des pharmazeutischen
Immun-Checkpoint- Inhibitoren Wirkungsweise und Anwendungsspektrum. P Markus Deckert
 Immun-Checkpoint- Inhibitoren Wirkungsweise und Anwendungsspektrum P Markus Deckert Gibt es überhaupt eine Tumor- Immunologie? Paul Ehrlich in seinem Arbeitszimmer im Frankfurter Georg-Speyer-Haus, 1910
Immun-Checkpoint- Inhibitoren Wirkungsweise und Anwendungsspektrum P Markus Deckert Gibt es überhaupt eine Tumor- Immunologie? Paul Ehrlich in seinem Arbeitszimmer im Frankfurter Georg-Speyer-Haus, 1910
Nintedanib eine neue Behandlungsoption beim nsclc mit Adenokarzinom-Histologie
 Drug Review 2016 Journal of Medical Drug Reviews. All rights reserved. J Med Drug Rev 2016;6:1 9 eine neue Behandlungsoption beim nsclc mit Adenokarzinom-Histologie M. Filipits und R. Pirker Zusammenfassung
Drug Review 2016 Journal of Medical Drug Reviews. All rights reserved. J Med Drug Rev 2016;6:1 9 eine neue Behandlungsoption beim nsclc mit Adenokarzinom-Histologie M. Filipits und R. Pirker Zusammenfassung
Aktuelles zur medikamento sen Therapie in der metastasierten Situation
 Johannes Ettl Interdisziplinäres i Brustzentrum t und Frauenklinik ik rechts der Isar, Technische Universität München Aktuelles zur medikamento sen Therapie in der metastasierten Situation Überlebenszeit
Johannes Ettl Interdisziplinäres i Brustzentrum t und Frauenklinik ik rechts der Isar, Technische Universität München Aktuelles zur medikamento sen Therapie in der metastasierten Situation Überlebenszeit
Erbitux (Cetuximab) erhält Empfehlung des CHMP für den Erstlinieneinsatz in der Behandlung von Kopf-Hals-Tumoren
 Erbitux (Cetuximab) erhält Empfehlung des CHMP für den Erstlinieneinsatz in der Behandlung von Kopf Erbitux (Cetuximab) erhält Empfehlung des CHMP für den Erstlinieneinsatz in der Behandlung von Kopf-Hals-Tumoren
Erbitux (Cetuximab) erhält Empfehlung des CHMP für den Erstlinieneinsatz in der Behandlung von Kopf Erbitux (Cetuximab) erhält Empfehlung des CHMP für den Erstlinieneinsatz in der Behandlung von Kopf-Hals-Tumoren
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V. Ceritinib
 22. November 2017 Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V Ceritinib veröffentlicht am 1. November 2017 Vorgangsnummer 2017-08-01-D-296 IQWiG Bericht Nr. 552 1. Zusammenfassung
22. November 2017 Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V Ceritinib veröffentlicht am 1. November 2017 Vorgangsnummer 2017-08-01-D-296 IQWiG Bericht Nr. 552 1. Zusammenfassung
Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu. IA-Empfehlung bewertet
 Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in
Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in
Medienmitteilung. Basel, den 3. Juni 2011
 Medienmitteilung Basel, den 3. Juni 2011 Tarceva verdoppelt nahezu für Patienten mit einem bestimmten genetischen Typ von Lungenkrebs die Zeit, in der sich ihre Erkrankung nicht verschlechtert Roche (SIX:
Medienmitteilung Basel, den 3. Juni 2011 Tarceva verdoppelt nahezu für Patienten mit einem bestimmten genetischen Typ von Lungenkrebs die Zeit, in der sich ihre Erkrankung nicht verschlechtert Roche (SIX:
Dossierbewertung A16-14 Version 1.0 Osimertinib (Lungenkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Osimertinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Osimertinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Formular für Vorschläge zur ICD-10 und zum OPS
 Formular für Vorschläge zur ICD-10 und zum OPS Bitte füllen Sie diesen Fragebogen in einem Textbearbeitungsprogramm aus und schicken Sie ihn als e-mail-anhang ans DIMDI an folgende e-mail-adresse Vorschlagsverfahren@dimdi.de
Formular für Vorschläge zur ICD-10 und zum OPS Bitte füllen Sie diesen Fragebogen in einem Textbearbeitungsprogramm aus und schicken Sie ihn als e-mail-anhang ans DIMDI an folgende e-mail-adresse Vorschlagsverfahren@dimdi.de
Nivolumab (neues Anwendungsgebiet)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nivolumab (Opdivo ) Bristol-Myers Squibb GmbH & Co. KGaA Modul 1 C Zusammenfassung der Aussagen im Dossier Stand: 28.04.2016
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Nivolumab (Opdivo ) Bristol-Myers Squibb GmbH & Co. KGaA Modul 1 C Zusammenfassung der Aussagen im Dossier Stand: 28.04.2016
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 18.09.2018
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Lenvatinib (Lenvima ) Eisai GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 18.09.2018
