Laura Sigg Werner Stumm Aquatische Chemie
|
|
|
- Nadine Weiner
- vor 7 Jahren
- Abrufe
Transkript
1 Laura Sigg Werner Stumm Aquatische Chemie Einführung in die Chemie natürlicher Gewässer v/dll vdf Hochschulverlag AG an der ETH Zürich
2 Inhalt 1 Einführung in die chemische Zusammensetzung natürlicher Gewässer Gewässer als Ökosysteme Globaler Wasserkreislauf : Chemische Prozesse in den Gewässern Verwitterungsprozesse Austausch zwischen Atmosphäre und Wasser Wechselwirkungen zwischen Organismen und Wasser Anthropogene Einträge in Gewässer Typische Zusammensetzung verschiedener Gewässer Wasser und seine einzigartigen Eigenschaften 31 Aquoionen Wichtige Reaktionstypen in Gewässern 34 Literatur 35 Lehrbücher 35 Weiterführende Literatur 35 Übungen 37 Anhang Kapitel 1: Einheiten und Konstanten 38 Tab. A.1: Konzentrationseinheiten 38 Tab. A.2: Internationale Einheiten für physikalische Quantitäten 39 Sl-Präfixe für Einheiten 40 Tab. A.3: Nützliche Umrechnungsfaktoren 40 Tab. A.4: Wichtige Konstanten 41 2 Säuren und Basen Einleitung Säure-Base-Theorie 44
3 6 Aquatische Chemie 2.3 Die Stärke einer Säure oder Base Aciditätskonstante Selbstionisation des Wassers Zusammengesetzte" Aciditätskonstante Konzentrationen der einzelnen Spezies als Funktion des ph Gleichgewichtsberechnungen Vorgehen beim Lösen von Gleichgewichtsproblemen 52 Protonen-Balance anstelle der Ladungsbalance Tableaux 55 Beispiel 2.1: ph einer starken Säure ph als Mastervariable: grafische Lösung von Gleichgewichtsproblemen Einprotonige Säure Zweiprotonige Säure Weitere Rechnungsbeispiele 65 Beispiel 2.2: Essigsäure bei verschiedenen Konzentrationen 65 Beispiel 2.3: Ampholyt als Puffersystem: Hydrogenphtalat 67 Beispiel 2.4: Mischung von Säure und konjugierter Base 69 Beispiel 2.5: Ammoniak-Konzentration in Gewässern Säure-Base-Titrationskurven Titration einer einprotonigen Säure Titration von multiprotonigen Säuren und Basen Pufferintensität Säure- und Basen-Neutralisierungskapazität ph- und Aktivitätskonventionen Referenz- und Standardzustände ph-skalen Aktivitätskoeffizienten Aciditätskonstanten, Gleichgewichtskonstanten Saure atmosphärische Niederschläge Zusammensetzung des Regenwassers 81 Beispiel 2.6: ph im Regenwasser Nebel Saure atmosphärische Depositionen und Auswirkungen der Luftschadstoffe auf terrestrische und aquatische Ökosysteme 86 Weitergehende Literatur 87 Übungen 87
4 Inhalt 3 Carbonatgleichgewichte Carbonatgleichgewichte als Puffersystem der Gewässer Offenes und geschlossenes Carbonatsystem; Modellsysteme Das offene System - Wasser im Gleichgewicht mit dem C0 2 der Gasphase 94 Modell für Regenwasser 94 Konstruktion der Abbildung Tableau Die Auflösung von CaCO 3 (s)(calcit) im offenen System: 98 Modell für See- und Flusswasser Grundwasser: erhöhter CO 2 -Partialdruck Vergleich mit der Zusammensetzung natürlicher Gewässer Das geschlossene Carbonatsystem 103 Konstruktion eines doppelt-logarithmischen Gleichgewichts- Diagramms für ein 10" 3 M-Carbonatsystem 104 Tableau für NaHCO 3 -Lösung Alkalinität und Acidität Definitionen der Alkalinität und Acidität Alternative Definition der Alkalinität Einfluss von Fotosynthese und Respiration auf ph und Alkalinität 109 Beispiel Alkalinität im Ozean und p C o2-zunahme Pufferintensität des Carbonatsystems Analytische Bestimmung der Alkalinität und der Acidität Bestimmung der Alkalinität Bestimmung der Acidität Potenziometrische und spektrophotometrische Methoden der Bestimmung von ph 118 Weiterführende Literatur 779 Übungen Wechselwirkung Wasser-Atmosphäre Einleitung Einfache Gas/Wasser-Gleichgewichte; Bedeutung in der Chemie des Wolkenwassers, des Regens und des Nebelwassers Offenes und geschlossenes System mit Gasphase und Wasser 126
5 8 Aquatische Chemie Beispiel 4.1: Geschlossenes System - Auflösung von Wasserstoffperoxid und von Ozon 128 Beispiel 4.2: Geschlossenes System - Auflösung von HCI Verteilung von SO 2 zwischen Gasphase und Wasser 130 Beispiel 4.3: Löslichkeit von SO 2 in Gegenwart von Formaldehyd Verteilung von NH 3 zwischen Gasphase und Wasser Auswaschung von Schadstoffen aus der Atmosphäre Die Genese eines Nebeltröpfchens 742 SO 2 -und NH 3 -Absorption Aerosole 747 Die Bildung von Sulfat- und Nitrataerosolen 147 Beispiel 4.4: Auflösung von Aerosolen im Nebelwasser Ansäuerung und Erholung von Gewässern Effekte der sauren Niederschläge auf Gewässer Ökologische Auswirkungen Erholung saurer Gewässer durch Verminderung der sauren Einträge 152 Weiterführende Literatur 753 Übungen Anwendung thermodynamischer Daten und kinetischer Grundlagen Thermodynamische Daten Freie Reaktionsenthalpie, chemisches Potenzial und chemisches Gleichgewicht 757 Beispiel 5.1: Berechnung der freien Reaktionsenthalpie AG 0 und der Gleichgewichtskonstante 162 Beispiel 5.2: Vergleich des Reaktionsquotienten mit der Gleichgewichtskonstante (Q/K) Umrechnung von Gleichgewichtskonstanten auf andere Temperaturen und Drucke Temperaturabhängigkeit 164 Beispiel 5.3: K s0 von Calcit in Funktion der Temperatur Druckabhängigkeit Kinetische Grundlagen Die Reaktionsgeschwindigkeit Einfache Zeitgesetze für homogene Reaktionen 167
6 Inhalt Prozesse in der Umwelt 169 Anwendungsbeispiele Elementarreaktionen Zeitgesetze für einfache Elementarreaktionen Konsekutive reversible Reaktionen Konsekutive irreversible Reaktionen Steady-State-Annahme Enzym-Katalyse 174 Beispiel 5.4: Bestimmung von K m und v max für Enzyme in Algen Temperaturabhängigkeit 176 Beispiel 5.5: Bestimmung der Aktivierungsenergie für die Reaktion von HSO 3 " mit H 2 O Beispiel 5.6: Radioaktive Elemente als kinetische Hilfsmittel bei der Altersbestimmung Theorie des Übergangszustandes; der aktivierte Komplex Fallbeispiel: Die Hydratisierung des CO Fallbeispiel: Kinetik der Absorption von CO 2 ; Gas-Transfer Atmosphäre-Wasser 784 Beispiel 5.7: Gasaustausch mit Oberflächenwasser 185 Beispiel 5.8: CO 2 -Transfer bei der ph-erhöhung durch Fotosynthese Chemische Beschleunigung des CO 2 -Transfers 187 Weiterführende Literatur 788 Allgemeine Lehrbücher 188 Anwendungen auf aquatische Systeme 188 Datensammlungen 188 Übungen Metallionen in wässriger Lösung Einleitung 797 Speziierung Koordinationschemie und ihre Bedeutung für die Speziierung der Metallionen in natürlichen Gewässern Einteilung der Metallionen Hydrolyse und die Bildung schwer löslicher Oxide und Hydroxide 193 Beispiel 6.1: Hydrolyse von Al 3+ ohne Bildung eines festen Hydroxids 195
7 10 Aquatische Chemie Beispiel 6.2: Hydrolyse und Löslichkeit von Al 3+ in Gegenwart von festem Aluminiumhydroxid AI(OH) 3 (s) Komplexbildung mit anorganischen und organischen Liganden in Lösung Gleichgewichtsberechnungen der Speziierung von Metallionen Vorgehen zur Berechnung von Komplexbildungsgleichgewichten Beispiele für Berechnungen 200 Beispiel 6.3: Anorganische Speziierung von Cu(ll) 200 Beispiel 6.4: Speziierung von Cu(ll) in Anwesenheit eines organischen Komplexbildners 203 Beispiel 6.5: Bindung von Ca 2+ und Cu 2+ durch NTA Berechnungen mit Computerprogrammen Einfache Modelle der Speziierung von Metallen in natürlichen Gewässern 206 Einfaches anorganisches Modell Komplexbildung mit Humin- und Fulvinsäuren Komplexbildung mit Kolloiden und Partikeln Löslichkeit von Metallen Kinetik der Komplexbildung 274 Beispiel 6.6: Kinetik der Komplexbildung von Co(ll) mit F" 216 Beispiel 6.7: Kinetik der Dissoziation stabiler Komplexe Speziierung und analytische Bestimmung Wechselwirkungen von Metallen mit Algen Essenzielle und toxische Spurenmetalle Modelle für die Metallaufnahme in Algen Metallpuffer als Kulturmedien Metallaufnahme in Periphyton 225 Weiterführende Literatur 226 Übungen Fällung und Auflösung fester Phasen Fällung und Auflösung fester Phasen als Mechanismus zur Regulierung der Zusammensetzung natürlicher Gewässer 23 7 Beispiel 7.1: Chemische Verwitterungsrate und Gewässerzusammensetzung 232 Löslichkeitsgieichgewicht 233
8 Inhalt Löslichkeitsgieichgewichte von Hydroxiden 234 Löslichkeit von Fe(OH) 3 (s) (Ferrihydrit) in Funktion des ph Löslichkeitsgieichgewichte von Carbonaten Löslichkeit von CaCO 3 (s) im geschlossenen System ohne Gasphase Löslichkeit von CaCO 3 (s) und anderen Carbonaten im Gleichgewicht mit pco Löslichkeit von Carbonaten im geschlossenen System mit C T = konstant Löslichkeit von Sulfiden Löslichkeit von SiO 2 und Silikaten Löslichkeit von SiO 2 (s) Löslichkeit von Kaolinit Löslichkeit und Stabilität im System K-Feldspat / Muskovit / Kaolinit Löslichkeit von Albit als Funktion des p co Abhängigkeit der Löslichkeit von Temperatur, lonenstärke, Druck, Grosse der Partikel 249 Beispiel 7.2: Löslichkeit von CaCO 3 (s) und von SiO 2 (s) in Funktion der Temperatur Welche feste Phase kontrolliert die Löslichkeit? Löslichkeit und Stabilität verschiedener fester Phasen 250 Beispiel 7.3: Stabilität von FeS(s) oder FeCO 3 (s) in Gegenwart von Sulfid 252 Beispiel 7.4: Löslichkeit von Cu in Gegenwart von Carbonat Komponenten, Phasen und Freiheitsgrade 258 Beispiel 7.5: Koexistenz verschiedener Phasen Sind feste Phasen im Löslichkeitsgieichgewicht? 260 Gleichgewichtskohlensäure, Sättigungs-pH und Sättigungs-Indizes Beispiel 7.6: Überprüfung der Sättigung mit Calciumcarbonat in einem Grundwasser Kinetik der Nukleierung und Auflösung fester Phase Theorie des Kristallwachstums Nukleierung Wachstumskinetik Auflösungskinetik 267 Weiterführende Literatur 267 Übungen 267
9 12 Aquatische Chemie 8 Redoxprozesse Einleitung Definitionen - Oxidation und Reduktion Oxidation und Reduktion 270 Beispiel 8.1: Redox-Stöchiometrie Die Oxidationszahl Der globale Elektronenkreislauf (Fotosynthese, Respiration) Redox-Gleichgewichte und Redoxintensität Redoxintensität und Redoxpotenzial 275 Beispiel 8.2: Fe 3+ / Fe Einfluss der Speziierung Einfache Berechnungen von Redoxgleichgewichten Doppeltlogarithmisches Diagramm 279 Beispiel 8.3: Fe 3+ / Fe Beispiel 8.4: SO 2 4 " / HS" 281 Beispiel 8.5: Einfache ps-(e - )-Rechnungen 282 Beispiel 8.6: Cl-Spezies ps-ph-diagramme Redox-Puffer 287 Beispiel 8.7: ps/ph-diagramm für Fe, CO 2, H 2 O Durch Mikroorganismen katalysierte Redoxprozesse Sequenz der Redoxreaktionen unter dem Einfluss der Mikroorganismen 292 i) Denitrifikation 294 ii) Reduktion von Mangan- und Eisenoxiden 295 iii) Sulfatreduktion 295 iv) Methanbildung 296 v) Fermentationsreaktionen Oxidationsreaktionen durch Mikroorganismen Einfluss von Redoxreaktionen auf Säure-Base-Verhältnisse Kinetik von Redoxprozessen Oxidation von Fe(ll) zu Fe(lll) durch O Oxidation von Mn(ll) Oxidation von Schwefelwasserstoff mit Sauerstoff 304 Beispiel 8.8: k (S. M ) und Halbwertszeit von H 2 S mit O 2 bei ph Oxidation durch Sauerstoff Thermodynamische Parameter der Sauerstoffreaktionen 306
10 Inhalt Wasserstoffperoxid H 2 O Die Ein-Elektronenschritte bei der Reduktion von O Das Fenton-Reagens Singulettsauerstoff Kann die Redox-Reaktivität mit Hilfe der Thermodynamik abgeschätzt werden? Fotochemische Redoxprozesse Fotochemische Reaktionen in Gewässern Lichtabsorption Indirekte fotochemische Umwandlungen: Produktion von reaktiven Sauerstoffspezies Direkte fotochemische Umwandlungen Eisenredoxkreislauf unter dem Einfluss von fotochemischen Reaktionen Die Messung des Redox-Potenzials in natürlichen Gewässern 379 Beispiel 8.9: Abschätzung von E H oder pe aus analytischer Information Glaselektrode; ionenselektive Elektroden 323 Weiterführende Literatur 324 Übungen Grenzflächenchemie Einleitung Partikel in natürlichen Gewässern Wechselwirkungen an der Grenzfläche zwischen fester Phase und Wasser Die koordinative Bindung: Oberflächenkomplexe Elektrostatische und andere Wechselwirkungen Wechselwirkungen nichtpolarer Verbindungen an Oberflächen Adsorption aus der Lösung Adsorptionsisothermen Langmuir-Adsorptionsisotherme und Freundlich-Isotherme Die Oberflächenspannung Oxidoberflächen: Säure-Base-Reaktionen,Wechselwirkung mit Kationen und Anionen Oberflächenkomplexe an Oxidoberflächen 339
11 14 Aquatische Chemie Säure-Base- und Komplexbildungsreaktionen an Oxidoberflächen Elektrische Ladung auf Oberflächen Modelle der Oberflächenladung und der elektrischen Doppelschicht ph pzc (ph bei Oberflächenladung null) Modelle für die Oberflächenkomplexbildung 349 Beispiel 9.1: Adsorption von Pb(ll) auf einer Haematit-Oberfläche Tonmineralien Strukturen und funktionelle Gruppen an Oberflächen von Tonmineralien 351 Die Siloxan di-trigonale Kavität Oberflächenladung und lonenbindungsvermögen 353 Beispiel 9.2: Oberflächenladung von Kaolinit lonenaustauschgleichgewichte 354 lonenaustauschharze Spektroskopische Methoden zur Untersuchung der Strukturen an Oberflächen 355 Beispiel 9.3: Adsorption von Arsenat und Arsenit an Eisenoxidoberflächen Oberflächenchemie und Reaktivität; Kinetik der Auflösung Oberflächenreaktionen und Auflösung Geschwindigkeitsgesetze Auflösung von Aluminiumsilikaten Katalyse von Redoxprozessen an Oxidoberflächen Die Halbleiteroberfläche; ihr Einfluss auf lichtinduzierte Redoxprozesse Kolloidstabilität Physikalisches Modell der Kolloidstabilität Die chemische Beeinflussung der Oberflächenladung Sorption hydrophober Verbindungen Synthetische Nanopartikel 377 Weiterführende Literatur 378 Übungen Wassertechnologie; Anwendung oberflächenchemischer Prozesse Einleitung 387
12 Inhalt Flockung, Koagulation Definition der Koagulation Al(lll) und Fe(lll) als Koagulationsmittel Entfernung von Huminstoffen und huminähnlichen Verbindungen Organische Polyelektrolyte Phosphat-Elimination Anwendungen der Koagulation in der Abwassertechnologie Kinetik der Koagulation 388 Beispiel 10.1: Koagulationskinetik Filtration Raumfiltration in porösem Medium Membranfiltration Flotation Aktivkohleadsorption Sorptionsisothermen Die Durchbruchskurve Korrosion der Metalle als elektrochemischer Prozess Thermodynamische Aspekte Kathodischer Schutz und anodische Aktivierung Passivierung einer Metalloberfläche 401 Die Kalkrostschutzschicht 401 Weiterführende Literatur 402 Übungen Biogeochemische Kreisläufe einiger Elemente Verteilung von Stoffen in der Umwelt 405 Die verschiedenen Reservoire der Umwelt Kohlenstoffkreislauf in den Gewässern Globaler Kohlenstoffkreislauf Kohlenstoffkreislauf in Gewässern Zusammensetzung des natürlichen organischen Materials (NOM) Stickstoffkreislauf in Gewässern und Atmosphäre Globaler Stickstoffkreislauf Die wichtigsten Redoxprozesse im Kreislauf N 2 (g) NH + 4» NO 3 " N 2 (g) 420 i) N 2 -Fixierung 420 ii) Nitrifikation 421
13 16 Aquatische Chemie iii) Denitrifikation 421 iv) Stickoxide in der Atmosphäre Biogeochemischer Kreislauf des Phosphors Kreisläufe von Metallen in Gewässern Einträge von Metallen in Gewässer Bindung der Metalle an Liganden, an Partikeloberflächen und an Organismen Regulierung von Metallen in Seen und Flüssen Spurenmetalle in den Ozeanen 429 Weiterführende Literatur 437 Übungen Anwendungen auf aquatische Systeme See Fotosynthetische Produktion und Eutrophierung Redoxverhältnisse in eutrophen Seen 436 Rücklösung von Phosphat aus Sedimenten Ausfällung von Calciumcarbonat in Seen Sedimentation Fliessgewässer Belastungsquellen und Wasserqualität Chemische und biologische Prozesse in Fliessgewässern 444 Fotosynthese und Respiration 444 Nitrifikation 445 Gasaustausch 447 Wechselwirkungen gelöst / partikulär Abfluss und Stoffkonzentrationen in Fliessgewässern 450 Langfristige Konzentrationsänderungen in Fliessgewässern Grundwasser Grundwasser als Trinkwasserreservoir - Belastungsquellen Biogeochemische Prozesse bei der Infiltration Transport von Schadstoffen im Grundwasser 458 Weiterführende Literatur 463 See 463 Fliessgewässer 464 Grundwasser 464 Übungen 465
14 Inhalt 17 Referenzen 469 Übungslösungen 483 Kapitell 483 Kapitel Kapitel Kapitel Kapitel Kapitel Kapitel Kapitel Kapitel Kapitel Kapiteln 490 Kapitel Anhang 1: Periodensystem der Elemente 492 Anhang 2: Anwendung von Computerprogrammen zur Lösung von chemischen Gleichgewichtsproblemen 493 Anhang 2.1: Computerprogramme 493 Anhang 2.2: Allgemeines Vorgehen 493 Anhang 2.3: Beispiele 495 Beispiel 1: Komplexbildung von Cu 2+ mit OH" und CO 2 3 " (Tableau 6.2) 495 Beispiel 2: Löslichkeit einer festen Phase 496 Beispiel 3: Adsorption an einer festen Phase 497 Anhang 3: Thermodynamische Daten 500 Index 512
Die chemische Zusammensetzung natiirlicher Gewasser
 Inhaltsverzeichnis Vorwort XI KAPITEL 1 KAPITEL 2 Die chemische Zusammensetzung natiirlicher Gewasser 1.1 Einleitung 1.2 Verwitterungsprozesse 1.3 Wechselwirkungen zwischen Organismen und Wasser 1.4 Das
Inhaltsverzeichnis Vorwort XI KAPITEL 1 KAPITEL 2 Die chemische Zusammensetzung natiirlicher Gewasser 1.1 Einleitung 1.2 Verwitterungsprozesse 1.3 Wechselwirkungen zwischen Organismen und Wasser 1.4 Das
Laura Sigg Werner Stumm. Aquatische Chemie. Einführung in die Chemie natürlicher Gewässer
 Laura Sigg Werner Stumm Aquatische Chemie Einführung in die Chemie natürlicher Gewässer Laura Sigg Werner Stumm Aquatische Chemie Einführung in die Chemie natürlicher Gewässer vdf Hochschulverlag AG an
Laura Sigg Werner Stumm Aquatische Chemie Einführung in die Chemie natürlicher Gewässer Laura Sigg Werner Stumm Aquatische Chemie Einführung in die Chemie natürlicher Gewässer vdf Hochschulverlag AG an
Eine Arbeitsgemeinschaft der Verlage
 UTB 8463 Eine Arbeitsgemeinschaft der Verlage Böhlau Verlag Wien Köln Weimar Verlag Barbara Budrich Opladen Farmington Hills facultas.wuv Wien Wilhelm Fink München A. Francke Verlag Tübingen und Basel
UTB 8463 Eine Arbeitsgemeinschaft der Verlage Böhlau Verlag Wien Köln Weimar Verlag Barbara Budrich Opladen Farmington Hills facultas.wuv Wien Wilhelm Fink München A. Francke Verlag Tübingen und Basel
Chemie aquatischer Systeme. Herbstsemester 2013
 Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss
 1 Uebungen zur Prüfungsvorbereitung 4.12.14 1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss Die folgenden Tiefenprofile von gelöstem Mangan, Eisen und Sulfid (S 2- ) sowie die
1 Uebungen zur Prüfungsvorbereitung 4.12.14 1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss Die folgenden Tiefenprofile von gelöstem Mangan, Eisen und Sulfid (S 2- ) sowie die
Inhaltsverzeichnis 1 Theorie...1
 Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
VL Limnochemie
 VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
Grundwasser: chemische Vorgänge bei der Infiltration. Redoxprozesse im Grundwasser Transport reaktiver Spezies
 Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Inhaltsverzeichnis Hinweise zur Benutzung Einführung in die Arbeits- und Denkweise Basis der Thermodynamik
 Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
Chemie für Mediziner. 2., aktualisierte Auflage. Carsten Schmuck Bernd Engels Tanja Schirmeister Reinhold Fink
 Chemie für Mediziner 2., aktualisierte Auflage Carsten Schmuck Bernd Engels Tanja Schirmeister Reinhold Fink Chemie für Mediziner - PDF Inhaltsverzeichnis Chemie für Mediziner Impressum Inhaltsübersicht
Chemie für Mediziner 2., aktualisierte Auflage Carsten Schmuck Bernd Engels Tanja Schirmeister Reinhold Fink Chemie für Mediziner - PDF Inhaltsverzeichnis Chemie für Mediziner Impressum Inhaltsübersicht
Anionenaustausch. Definition Anionen-Austausch-Kapazität (AAK): AAK = Σ austauschbar gebundenene Anionen
 Anionenaustausch Definition Anionen-Austausch-Kapazität (AAK): AAK = Σ austauschbar gebundenene Anionen Ursache der Anionensorption positive Ladungen (Protonierung von Al/Fe-OH-Gruppen; unspezifische Sorption)
Anionenaustausch Definition Anionen-Austausch-Kapazität (AAK): AAK = Σ austauschbar gebundenene Anionen Ursache der Anionensorption positive Ladungen (Protonierung von Al/Fe-OH-Gruppen; unspezifische Sorption)
Natürliche ökologische Energie- und Stoffkreisläufe
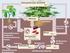 Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-Fragen 1. ALLGEMEINE CHEMIE 1 1.1 Atombau 1 1.2 Periodensystem der Elemente 23 1.3 Ionenbindung 32 1.4 Atombindung 37 1.5 Koordinative Bindung 47 1.6 Metallische Bindung 53 1.7
VII INHALTSVERZEICHNIS MC-Fragen 1. ALLGEMEINE CHEMIE 1 1.1 Atombau 1 1.2 Periodensystem der Elemente 23 1.3 Ionenbindung 32 1.4 Atombindung 37 1.5 Koordinative Bindung 47 1.6 Metallische Bindung 53 1.7
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-Fragen 1. ALLGEMEINE CHEMIE 1 1.1 Atombau 1 1.2 Periodensystem der Elemente 22 1.3 Ionenbindung 30 1.4 Atombindung 34 1.5 Koordinative Bindung 43 1.6 Metallische Bindung 48 1.7
VII INHALTSVERZEICHNIS MC-Fragen 1. ALLGEMEINE CHEMIE 1 1.1 Atombau 1 1.2 Periodensystem der Elemente 22 1.3 Ionenbindung 30 1.4 Atombindung 34 1.5 Koordinative Bindung 43 1.6 Metallische Bindung 48 1.7
Inhaltsverzeichnis. 1. Chemische Grundbegriffe...9
 sverzeichnis 3 1. Chemische Grundbegriffe...9 1.1. Sinn und Zweck dieser Lehreinheit... 9 1.2. Das Wesen der Naturwissenschaften... 10 1.3. Stoffe und Körper...12 1.4. Physikalische und chemische Vorgänge...
sverzeichnis 3 1. Chemische Grundbegriffe...9 1.1. Sinn und Zweck dieser Lehreinheit... 9 1.2. Das Wesen der Naturwissenschaften... 10 1.3. Stoffe und Körper...12 1.4. Physikalische und chemische Vorgänge...
Studienbücherei. Grundpraktikum. von R Mitzner. Von einem Kollektiv unter Leitung. 3., überarbeitete Auflage. Mit 45 Abbildungen und 11 Tabellen
 Studienbücherei Physikalischchemisches Grundpraktikum Von einem Kollektiv unter Leitung von R Mitzner 3., überarbeitete Auflage Mit 45 Abbildungen und 11 Tabellen m VEB Deutscher Verlag der Wissenschaften
Studienbücherei Physikalischchemisches Grundpraktikum Von einem Kollektiv unter Leitung von R Mitzner 3., überarbeitete Auflage Mit 45 Abbildungen und 11 Tabellen m VEB Deutscher Verlag der Wissenschaften
Thematische Aufgliederung der Prüfungsfragen
 Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Inhaltsverzeichnis. Vorwort. xvii. Kapitel 1 Aufbau der Materie 1. Kapitel 2 Die chemische Bindung 39
 Vorwort xvii Kapitel 1 Aufbau der Materie 1 1.1 MateriebestehtausAtomen... 3 1.2 Elementarteilchen... 3 1.3 AufbaueinesAtoms... 4 1.4 AtommassenundStoffmengen... 5 1.5 Isotope... 7 1.6 Radioaktivität und
Vorwort xvii Kapitel 1 Aufbau der Materie 1 1.1 MateriebestehtausAtomen... 3 1.2 Elementarteilchen... 3 1.3 AufbaueinesAtoms... 4 1.4 AtommassenundStoffmengen... 5 1.5 Isotope... 7 1.6 Radioaktivität und
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Reaktionen mit Protonenübergang - Säuren
 Reaktionen mit Protonenübergang - Säuren Protonen kleinstes Kation, hohe Ladungsdichte, geringe Größe hohe Reaktivität, nicht frei existent Säuren nach Arrhenius H 2 O + H + H 3 O + geben Protonen ab,
Reaktionen mit Protonenübergang - Säuren Protonen kleinstes Kation, hohe Ladungsdichte, geringe Größe hohe Reaktivität, nicht frei existent Säuren nach Arrhenius H 2 O + H + H 3 O + geben Protonen ab,
Bodenfruchtbarkeit potentielle Säure und Melioration
 Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Bodenfruchtbarkeit potentielle Säure und Melioration Univ.
Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Bodenfruchtbarkeit potentielle Säure und Melioration Univ.
Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl -
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
Verteilung und Chemie des atmosphärischen Aerosols Atmosphärisches Aerosol p. 1 Einleitung p. 1 Begriffe und Definitionen p. 2 Größenverteilung p.
 Verteilung und Chemie des atmosphärischen Aerosols Atmosphärisches Aerosol p. 1 Einleitung p. 1 Begriffe und Definitionen p. 2 Größenverteilung p. 3 Das Mischkernkonzept p. 6 Feuchtewachstum p. 9 Chemische
Verteilung und Chemie des atmosphärischen Aerosols Atmosphärisches Aerosol p. 1 Einleitung p. 1 Begriffe und Definitionen p. 2 Größenverteilung p. 3 Das Mischkernkonzept p. 6 Feuchtewachstum p. 9 Chemische
Chemie für Mediziner. Norbert Sträter
 Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Erich Tag Elektrochemie
 STUDIENBÜCHER CHEMIE Erich Tag Elektrochemie Eine Einführung in die Theorie elektrochemischer Gleichgewichte und elektrochemischer Prozesse Herausgegeben von W. Botsch, E. Höfling und J. Mauch VERLAG MORITZ
STUDIENBÜCHER CHEMIE Erich Tag Elektrochemie Eine Einführung in die Theorie elektrochemischer Gleichgewichte und elektrochemischer Prozesse Herausgegeben von W. Botsch, E. Höfling und J. Mauch VERLAG MORITZ
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Von Bindungsformen, Mobilisierbarkeit, Bioverfügbarkeit und Toxizität zu den Elementspezies
 Von Bindungsformen, Mobilisierbarkeit, Bioverfügbarkeit und Toxizität zu den Elementspezies 2 Bindungsformen Im Wasser sind neben hydratisierten Ionen (in unterschiedlichen Oxidationsstufen, je nach dem
Von Bindungsformen, Mobilisierbarkeit, Bioverfügbarkeit und Toxizität zu den Elementspezies 2 Bindungsformen Im Wasser sind neben hydratisierten Ionen (in unterschiedlichen Oxidationsstufen, je nach dem
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II
 Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Katalyse. Martin Babilon 14/07/2011. Katalyse. Martin Babilon Universität Paderborn. 14 Juli Montag, 18. Juli 2011
 Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner Samstag, Uhr Allgemeine Chemie
 Seite 1 von 6 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner 25.02. 04.03.2017 Samstag, 25.02.17 15.00 17.00 Uhr Allgemeine Chemie Mittwoch,
Seite 1 von 6 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner 25.02. 04.03.2017 Samstag, 25.02.17 15.00 17.00 Uhr Allgemeine Chemie Mittwoch,
IONENAUSTAUSCH UND RETENTION
 1 IONENAUSTAUSCH UND RETENTION Die Wechselwirkung zwischen den im Bodenwasser gelösten Ionen und den reaktiven Oberflächen der festen Phase eines Bodens wird als Ionenaustausch (wenn praktisch reversibel)
1 IONENAUSTAUSCH UND RETENTION Die Wechselwirkung zwischen den im Bodenwasser gelösten Ionen und den reaktiven Oberflächen der festen Phase eines Bodens wird als Ionenaustausch (wenn praktisch reversibel)
1 Partikel / Mineral / Phase
 1 Partikel / Mineral / Phase Agglomerat eine mehr oder weniger verfestigte Anhäufung von vorher losen Bestandteilen Nanosan-relevant: kein Begriff der Kolloidchemie, d.h. Aggregat besser geeignet Aggregat
1 Partikel / Mineral / Phase Agglomerat eine mehr oder weniger verfestigte Anhäufung von vorher losen Bestandteilen Nanosan-relevant: kein Begriff der Kolloidchemie, d.h. Aggregat besser geeignet Aggregat
1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. Natrium, Kalium Ionenaustausch
 Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Stöchiometrie: Das Rechnen mit chemischen Formeln und Gleichungen 77. Kapitel 8 Grundlegende Konzepte der chemischen Bindung 289
 haltsübersicht Vorwort xv Kapitel 1 Einführung: Stoffe und Maßeinheiten 1 Kapitel 2 Atome, Moleküle und Ionen 37 Kapitel 3 Kapitel 4 Stöchiometrie: Das Rechnen mit chemischen Formeln und Gleichungen 77
haltsübersicht Vorwort xv Kapitel 1 Einführung: Stoffe und Maßeinheiten 1 Kapitel 2 Atome, Moleküle und Ionen 37 Kapitel 3 Kapitel 4 Stöchiometrie: Das Rechnen mit chemischen Formeln und Gleichungen 77
Inhalt. Vorwort.
 Inhalt Vorwort Atombau und Periodensystem - ein untrennbarer Zusammenhang 1 1 Vorstellung uber den Bau der Atome 1 1.1 Erste Atommodelle - Entwicklung aus Crundgesetzen und Versuchen 1 1.2 Atomkern-KernteilchenalsKenngroKenderElemente...
Inhalt Vorwort Atombau und Periodensystem - ein untrennbarer Zusammenhang 1 1 Vorstellung uber den Bau der Atome 1 1.1 Erste Atommodelle - Entwicklung aus Crundgesetzen und Versuchen 1 1.2 Atomkern-KernteilchenalsKenngroKenderElemente...
Inhalt. 1 Atombau Die chemische Bindung Energetik chemischer Reaktionen 50. Vorwort 9
 Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Qualitative anorganische Analyse
 Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
1.-::1JV. Georg Job I Regina Rüffler. Physikalische Chemie. Eine Einführung nach neuem Konzept mit zahlreichen Experimenten STUDIUM VIEWEG+ TEUBNER
 Georg Job I Regina Rüffler V//C' - 1.-::1JV ci/(hj Physikalische Chemie Eine Einführung nach neuem Konzept mit zahlreichen Experimenten STUDIUM 11 VIEWEG+ TEUBNER 1 Einführung und erste Grundbegriffe 1
Georg Job I Regina Rüffler V//C' - 1.-::1JV ci/(hj Physikalische Chemie Eine Einführung nach neuem Konzept mit zahlreichen Experimenten STUDIUM 11 VIEWEG+ TEUBNER 1 Einführung und erste Grundbegriffe 1
Aufgabe Punkte (je 10) Name: Vorname: Matrikel-Nr.
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
2
 1 2 3 4 5 6 Atmosphärischer Eintrag zwischen 0,07 und 1,7 kgha 1 a 1. Der Großteil des Eintrages entfällt auf die trockenen Partikel. Lt. Newman (1995) etwa 89%. Quellen für den Atmosphärischen P sind
1 2 3 4 5 6 Atmosphärischer Eintrag zwischen 0,07 und 1,7 kgha 1 a 1. Der Großteil des Eintrages entfällt auf die trockenen Partikel. Lt. Newman (1995) etwa 89%. Quellen für den Atmosphärischen P sind
Korrosion und Korrosionsschutz
 Korrosion und Korrosionsschutz Von Tobias Reichelt und Birte Schwan Teil A I. Einleitung II. Thermodynamik III. Kinetik Teil B I. Korrosionsarten (atmosphärischer Korrosion) II. Vermeidungsstrategien III.
Korrosion und Korrosionsschutz Von Tobias Reichelt und Birte Schwan Teil A I. Einleitung II. Thermodynamik III. Kinetik Teil B I. Korrosionsarten (atmosphärischer Korrosion) II. Vermeidungsstrategien III.
1.2 Ziel des Praktikums Experimente / Versuche korrekt durchführen
 Vorwort XI Kapitel 1 Einleitung 1 1.1 Herzlich willkommen im chemischen Praktikum... 1.1 2 1.2 Ziel des Praktikums... 1.2 3 1.3 Experimente... 1.3 4 1.4 Experimente / Versuche korrekt durchführen... 1.4
Vorwort XI Kapitel 1 Einleitung 1 1.1 Herzlich willkommen im chemischen Praktikum... 1.1 2 1.2 Ziel des Praktikums... 1.2 3 1.3 Experimente... 1.3 4 1.4 Experimente / Versuche korrekt durchführen... 1.4
Biogeochemische Kreisläufe
 Biogeochemische Kreisläufe Dr. Maria A. Siegesmund siegesmu@rhrk.unikl.de Gebäude 14, Büro 243 http://www.nesl.ucar.edu/lar/2007/catalog/tiimes/images/hollandnccycle.jpg Leitfaden Was sind biogeochemische
Biogeochemische Kreisläufe Dr. Maria A. Siegesmund siegesmu@rhrk.unikl.de Gebäude 14, Büro 243 http://www.nesl.ucar.edu/lar/2007/catalog/tiimes/images/hollandnccycle.jpg Leitfaden Was sind biogeochemische
Grundlegende Definitionen
 Grundlegende Definitionen 2 In diesem Kapitel werden die wichtigsten und grundlegenden Definitionen, welche für das Verständnis der Kohlensäuregleichgewichte notwendig sind, definiert und erläutert (Appelo
Grundlegende Definitionen 2 In diesem Kapitel werden die wichtigsten und grundlegenden Definitionen, welche für das Verständnis der Kohlensäuregleichgewichte notwendig sind, definiert und erläutert (Appelo
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Chemie-Tutorien zur Vorbereitung auf das Praktikum
 Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. Juli 2017, Uhr. Prof. Dr. T. Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
 Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Inhaltsverzeichnis. 1 Einführung und erste Grundbegriffe 1
 1 Einführung und erste Grundbegriffe 1 1.1 Stoffdynamik 1 1.2 Stoffe und Grundstoffe 3 1.3 Messung und Metrisierung 7 1.4 Stoffmenge 13 1.5 Gemisch, Gemenge und Zusammensetzungsgrößen 15 1.6 Zustand 17
1 Einführung und erste Grundbegriffe 1 1.1 Stoffdynamik 1 1.2 Stoffe und Grundstoffe 3 1.3 Messung und Metrisierung 7 1.4 Stoffmenge 13 1.5 Gemisch, Gemenge und Zusammensetzungsgrößen 15 1.6 Zustand 17
GRUNDIAGEN DER ALLGEMEINEN UND ANORGANISCHEN CHEMIE
 Dr. sc. nat. Hans Rudolf Christen 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. GRUNDIAGEN DER ALLGEMEINEN UND
Dr. sc. nat. Hans Rudolf Christen 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. GRUNDIAGEN DER ALLGEMEINEN UND
Thermodynamik für Werkstoffingenieure und Metallurgen
 Thermodynamik für Werkstoffingenieure und Metallurgen Eine Einführung 2., stark überarbeitete Auflage Von Prof. Dr.-Ing. Martin G. Frohberg Technische Universität Berlin Mit 99 Abbildungen und 14 Tabellen
Thermodynamik für Werkstoffingenieure und Metallurgen Eine Einführung 2., stark überarbeitete Auflage Von Prof. Dr.-Ing. Martin G. Frohberg Technische Universität Berlin Mit 99 Abbildungen und 14 Tabellen
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Elektrochemie Chemie der Metalle
 Elektrochemie Chemie der Metalle Thomas A. BIER Institut für Keramik, Glas- und Baustofftechnik, Leipziger Straße 28, 09596 Freiberg, Bauchemische Grundlagen Elektrochemie Redoxreaktionen Oxidation Reduktion
Elektrochemie Chemie der Metalle Thomas A. BIER Institut für Keramik, Glas- und Baustofftechnik, Leipziger Straße 28, 09596 Freiberg, Bauchemische Grundlagen Elektrochemie Redoxreaktionen Oxidation Reduktion
Einstieg in die Physikalische Chemie für Nebenfächler
 Wolfgang Bechmann Joachim Schmidt 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Einstieg in die Physikalische Chemie
Wolfgang Bechmann Joachim Schmidt 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Einstieg in die Physikalische Chemie
Chemie I Prüfungsfragen
 Chemie I Prüfungsfragen Kommentierte Originalfragen bis Herbst 2010 Allgemeine und Anorganische Chemie für Pharmazeuten Eberhard Ehlers, Hofheim/Taunus Mit Beiheft: Lösungen der MC-Fragen Deutscher Apotheker
Chemie I Prüfungsfragen Kommentierte Originalfragen bis Herbst 2010 Allgemeine und Anorganische Chemie für Pharmazeuten Eberhard Ehlers, Hofheim/Taunus Mit Beiheft: Lösungen der MC-Fragen Deutscher Apotheker
0 Einleitung 0.1 Vorbemerkungen
 0 Einleitung 0.1 Vorbemerkungen Professur Radiochemie Sommersemester 2010 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung
0 Einleitung 0.1 Vorbemerkungen Professur Radiochemie Sommersemester 2010 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Bauchemische Grundlagen Reaktionen Säure Base
 Bauchemische Grundlagen Reaktionen Säure Base Thomas A. BIER Institut für Keramik, Glas- und Baustofftechnik, Leipziger Straße 28, 09596 Freiberg, Bauchemische Grundlagen WS 2011/12 Allgemeine Grundlagen
Bauchemische Grundlagen Reaktionen Säure Base Thomas A. BIER Institut für Keramik, Glas- und Baustofftechnik, Leipziger Straße 28, 09596 Freiberg, Bauchemische Grundlagen WS 2011/12 Allgemeine Grundlagen
Schnellbericht Elbe. Sächsischer Elbe - Längsschnitt. Dresden
 Abteilung Wasser, Boden, Wertstoffe Zur Wetterwarte 11, 01109 Dresden Internet: http://www.smul.sachsen.de/lfulg Schnellbericht Elbe Sächsischer Elbe - Längsschnitt Zehren/ Dresden Ausgewählte Untersuchungsergebnisse
Abteilung Wasser, Boden, Wertstoffe Zur Wetterwarte 11, 01109 Dresden Internet: http://www.smul.sachsen.de/lfulg Schnellbericht Elbe Sächsischer Elbe - Längsschnitt Zehren/ Dresden Ausgewählte Untersuchungsergebnisse
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Chemische Thermodynamik. Arbeitsbuch 4. 4., überarbeitete Auflage. Autoren. Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
 Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
Inhaltsverzeichnis. 1 Allgemeine Chemie VII. Vorwort Grundbegriffe, Grundgesetze... 3 Chemische Reaktionen... 3
 VII Vorwort... V 1 Allgemeine Chemie 1.0 Grundbegriffe, Grundgesetze... 3 Chemische Reaktionen... 3 1.1 Atombau... 4 1.1.1 Aufbau der Atome... 4 1.1.2 Isotope... 10 1.1.3 Radioaktiver Zerfall... 14 1.1.4
VII Vorwort... V 1 Allgemeine Chemie 1.0 Grundbegriffe, Grundgesetze... 3 Chemische Reaktionen... 3 1.1 Atombau... 4 1.1.1 Aufbau der Atome... 4 1.1.2 Isotope... 10 1.1.3 Radioaktiver Zerfall... 14 1.1.4
Abschlußklausur (Nachklausur)
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Praktikum Anorganische und Analytische Chemie Abschlußklausur (Nachklausur) 13.1.2012 Name: Vorname: Matrikel-Nr. Hinweis: Verwenden Sie für die Antworten den
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Praktikum Anorganische und Analytische Chemie Abschlußklausur (Nachklausur) 13.1.2012 Name: Vorname: Matrikel-Nr. Hinweis: Verwenden Sie für die Antworten den
7 Korrosion und Korrosionsschutz
 7 Korrosion und Korrosionsschutz 7.1 Metallkorrosion lat. corrodere = zernagen, zerfressen Veränderung eines metallischen Werkstoffs durch Reaktion mit seiner Umgebung Beeinträchtigungen der Funktion Substanzverlust,
7 Korrosion und Korrosionsschutz 7.1 Metallkorrosion lat. corrodere = zernagen, zerfressen Veränderung eines metallischen Werkstoffs durch Reaktion mit seiner Umgebung Beeinträchtigungen der Funktion Substanzverlust,
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Roland Reich. Thermodynamik. Grundlagen und Anwendungen in der allgemeinen Chemie. Zweite, verbesserte Auflage VCH. Weinheim New York Basel Cambridge
 Roland Reich Thermodynamik Grundlagen und Anwendungen in der allgemeinen Chemie Zweite, verbesserte Auflage VCH Weinheim New York Basel Cambridge Inhaltsverzeichnis Formelzeichen Maßeinheiten XV XX 1.
Roland Reich Thermodynamik Grundlagen und Anwendungen in der allgemeinen Chemie Zweite, verbesserte Auflage VCH Weinheim New York Basel Cambridge Inhaltsverzeichnis Formelzeichen Maßeinheiten XV XX 1.
Die Freie Aktivierungsenthalpie
 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
1.3 Chemische Reaktionen des Wassers - Bildung von Säuren und Basen
 1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
Aufgabe Punkte (je 10) Anorganisches Grund-Praktikum (Poly-BSc/Lehramt) Abschlußklausur (Nachklausur) Name: Vorname: Matrikel-Nr.
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
K4 Argumentation B3 Werte und Normen
 Thema/Kontext: Auf die Geschwindigkeit kommt es an Inhaltsfeld: Reaktionsgeschwindigkeit und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Schwerpunkte übergeordneter Kompetenzerwartungen: Reaktionsgeschwindigkeit
Thema/Kontext: Auf die Geschwindigkeit kommt es an Inhaltsfeld: Reaktionsgeschwindigkeit und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Schwerpunkte übergeordneter Kompetenzerwartungen: Reaktionsgeschwindigkeit
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
Thermodynamik für Metallurgen und Werkstofftechniker
 Von Prof. Dr.-lng. Martin G. Frohberg Mit 78 Bildern und 13 Tabellen Thermodynamik für Metallurgen und Werkstofftechniker EINE EINFÜHRUNG VEB DEUTSCHER VERLAG FÜR GRUNDSTOFFINDUSTRIE LEIPZIG 1 nhaltsverzeichnis
Von Prof. Dr.-lng. Martin G. Frohberg Mit 78 Bildern und 13 Tabellen Thermodynamik für Metallurgen und Werkstofftechniker EINE EINFÜHRUNG VEB DEUTSCHER VERLAG FÜR GRUNDSTOFFINDUSTRIE LEIPZIG 1 nhaltsverzeichnis
STRUKTUR UND REAKTION INDER CHEMIE
 STRUKTUR UND REAKTION INDER CHEMIE Ein Leitfaden für das Studium der Chemie 2., bearbeitete Auflage Mit 129 Bildern und 32 Tabellen INHALTSVERZEICHNIS Abkürzungen, Größen, Konstanten und Umrechnungsfaktoren
STRUKTUR UND REAKTION INDER CHEMIE Ein Leitfaden für das Studium der Chemie 2., bearbeitete Auflage Mit 129 Bildern und 32 Tabellen INHALTSVERZEICHNIS Abkürzungen, Größen, Konstanten und Umrechnungsfaktoren
Chemie der Atmosphäre
 T. E. Graedel und Paul J. Crutzen Chemie der Atmosphäre Bedeutung für Klima und Umwelt Aus dem Englischen übersetzt von Florian Kläger und PaulJ. Crutzen unter Mithilfe von Christoph Brühl, Uta Biermann,
T. E. Graedel und Paul J. Crutzen Chemie der Atmosphäre Bedeutung für Klima und Umwelt Aus dem Englischen übersetzt von Florian Kläger und PaulJ. Crutzen unter Mithilfe von Christoph Brühl, Uta Biermann,
Inhaltsverzeichnis. Vorwort Zur Gestaltung des Buches
 Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
SS Thomas Schrader. der Universität Duisburg-Essen. (Teil 8: Redoxprozesse, Elektrochemie)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
KORROSION UND KORROSIONSSCHUTZ VON METALLEN
 11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
Katalyse. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben
 Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Diplom
 Grundlagen der Chemie für Studierende des Maschinenbaus, Prof. Deutschmann Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Diplom Freitag, 20. März 2009, 14:00-17:00
Grundlagen der Chemie für Studierende des Maschinenbaus, Prof. Deutschmann Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Diplom Freitag, 20. März 2009, 14:00-17:00
Chemiefüringenieure. von Dr. rer. nat. Angelika Vinke, Prof. Dr.Gerolf Marbach, Prof. Dr. rer. nat. Johannes Vinke 2., überarbeitete Auflage
 Chemiefüringenieure von Dr. rer. nat. Angelika Vinke, Prof. Dr.Gerolf Marbach, Prof. Dr. rer. nat. Johannes Vinke 2., überarbeitete Auflage Oldenbourg Verlag München Inhaltsverzeichnis 1 Einführung 1 2
Chemiefüringenieure von Dr. rer. nat. Angelika Vinke, Prof. Dr.Gerolf Marbach, Prof. Dr. rer. nat. Johannes Vinke 2., überarbeitete Auflage Oldenbourg Verlag München Inhaltsverzeichnis 1 Einführung 1 2
Kompendium der allgemeinen und anorganischen Chemie
 Kompendium der allgemeinen und anorganischen Chemie Von Dr. rer. nat. habil. Peter Hermann Wissenschaftlicher Oberassistent am Physiologisch-Chemischen Institut der Martin-Luther-Universität Halle-Wittenberg
Kompendium der allgemeinen und anorganischen Chemie Von Dr. rer. nat. habil. Peter Hermann Wissenschaftlicher Oberassistent am Physiologisch-Chemischen Institut der Martin-Luther-Universität Halle-Wittenberg
Analytische Chemie. B. Sc. Chemieingenieurwesen. 12. September Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 12. September 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 12. September 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
4 LÖSLICHKEITSPRODUKT
 Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
Physikalische Chemie. für Chemisch-technische Assistenten Friedrich Bergler. 176 Abbildungen, 22 Tabellen 2. durchgesehene Auflage
 Physikalische Chemie für Chemisch-technische Assistenten Friedrich Bergler 176 Abbildungen, 22 Tabellen 2. durchgesehene Auflage 1991 Georg Thieme Verlag Stuttgart New York Kapitel 1 Gase 1 1. Ideale Gase
Physikalische Chemie für Chemisch-technische Assistenten Friedrich Bergler 176 Abbildungen, 22 Tabellen 2. durchgesehene Auflage 1991 Georg Thieme Verlag Stuttgart New York Kapitel 1 Gase 1 1. Ideale Gase
