Nutzenbewertung. von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V. Wirkstoff: Ivermectin. nach 2 Abs. 2 VerfO des G-BA
|
|
|
- Linda Schneider
- vor 6 Jahren
- Abrufe
Transkript
1 Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Ivermectin nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 1. September 2015 Stand
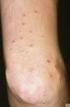
2 Ivermectin Zugelassenes Anwendungsgebiet (Stand Mai 2015) 1 Soolantra wird angewendet bei erwachsenen Patienten zur topischen Behandlung von entzündlichen Läsionen der (papulopustulösen) Rosazea. 1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie Der Zusatznutzen im Verhältnis zur zweckmäßigen Vergleichstherapie gilt als nicht belegt. Der pharmazeutische Unternehmer hat die erforderlichen Nachweise für die Nutzenbewertung nach 35a SGB V dem G-BA trotz Aufforderung nicht vorgelegt. Die in 35a Abs.1 Satz 5 SGB V angeordnete Rechtsfolge ist, dass ein Zusatznutzen als nicht belegt gilt. Zweckmäßige Vergleichstherapie: Die zweckmäßige Vergleichstherapie zur topischen Behandlung der (papulopustulösen) Rosazea ist: Azelainsäure oder Doxycyclin (oral) oder Metronidazol (topisch). 2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung in Frage komme n- den Patientengruppen Beschreibung der Erkrankung und Charakterisierung der Zielpopulation Beschreibung der Erkrankung Die Rosazea ist eine überwiegend im Erwachsenenalter auftretende chronisch-progrediente Gesichtsdermatose unter Beteiligung vaskulärer und entzündlicher Faktoren. Die genauen Ursachen sind nicht geklärt, Störungen im angeborenen Immunsystem, neuroinflammatorische Mechanismen, ultraviolette Strahlung, lokale Entzündungsreaktionen auf kutane Mikroorganismen und auch Veränderungen der Gefäß- und potentiell Lymphgefäßregulation scheinen eine Rolle zu spielen a,b. Die Rosazea ist in verschiedene Schweregrade eingeteilt c : Das Vorstadium (Rosazeadiathese) sowie der Schweregrad I sind gekennzeichnet durch die vaskuläre Komponente, bei der in der Regel zentrofazial lokalisierte Erytheme (Flushs) auftreten. Im Vorstadium treten diese anfallsartig auf (endogene und exogene Reize können als Trigger wirken), während das Erythem beim Schweregrad I (Rosacea erythematosateleangiectatica) persistiert. Typischerweise kommt es hier auch zur Erweiterung oberflächlicher Blutgefäße, welche als Teleangiektasien sichtbar werden. Beim Schweregrad II 1 Fachinformation Soolantra, Stand Mai
3 (Rosazea papulopustulosa) kommt neben teilweise auftretenden Lymphödemen die entzündliche Komponente mit Papeln und Pusteln hinzu. Selten sind auch extrafaziale Bereiche wie Hals, Brustbereich, Kopfhaut und Rücken betroffen. Die papulopustulöse Rosazea zeigt in ihren Symptomen Ähnlichkeit zur Acne vulgaris, allerdings treten keine Komedonen auf. Bei besonders schweren Formen (Schweregrad III, glandulärhyperplastische Rosazea) entstehen Talgdrüsen- und Bindegewebshyperplasien, die sich in Form von Knollen (sog. Phymen) manifestieren. Bei 30-50% der Patienten kommt es zu einer Manifestation am Auge (Ophthalmorosazea), eine Korrelation zwischen der Ausprägung der Augen- und der Hautsymptome besteht allerdings nicht d. Weitere Sonderformen sind bekannt (lupoide Rosazea, Steroidrosazea, Rosacea conglobata, Rosacea fulminans, gramnegative Rosazea und solides persistierendes Gesichtsödem bei Rosazea (Morbus Morbihan). In der vorliegenden Nutzenbewertung und vom Anwendungsgebiet von Ivermectin sind diese Ausprägungen jedoch nicht umfasst. Umfang der Zielpopulation Zur Ermittlung des Umfangs der Zielpopulation wurde eine systematische Literaturrecherche in Medline sowie eine Handrecherche in öffentlich verfügbaren Datenbanken, Internetseiten von KBV und GKV, Fachportalen oder Institutionen (wie z. B. Gesundheitsberichterstattung des Bundes, Robert Koch-Institut) durchgeführt. Die Recherche ergab insgesamt 288 Treffer, die auf Themenrelevanz überprüft wurden. Es wurden 18 Referenzen mit in den Bericht aufgenommen. Ergebnisse zur Epidemiologie der Rosazea sind aufgrund von Unterschieden in Studienm e- thodik und Patientenpopulationen sowie unterschiedlicher kultureller und sozialer Wahrnehmung heterogen und erschweren einen direkten Vergleich. Prävalenzen der Rosazea werden in einem Bereich zwischen unter 1 % bis über 20 % e,f angegeben. Bei einer griechischen Kohortenstudie mit Personen lag die Prävalenz in einem Zeitraum von 1995 bis 2002 bei 1,22 % g. In Schweden betrug sie im Jahre 1989 nach der Untersuchung von 809 Arbeitern 10 % h, eine estnische Studie bestimmte von 2005 bis 2007 eine Prävalenz von sogar 22 % in einer Population von 348 Angestellten f. Betrachtet wurden hierbei Personen ab einem Alter von 30 Jahren. Dies erhöht die Prävalenz automatisch, da die Erkrankung sich in der Regel erst ab diesem Alter manifestiert f,i. Andererseits wurden auch in einer in den USA durchgeführten groß angelegten Kohortenstudie mit Personen ausschließlich Personen über 30 Jahren erfasst, und hier lag die Prävalenz bei 1,34 % j. Weiterhin wurden zwei deutsche Studien, die die Häufigkeit des Auftretens der Rosazea untersucht haben, identifiziert. Diese zeigten im Vergleich untereinander ähnliche Prävalenzen, ohne jedoch eine Differenzierung zwischen den einzelnen Schweregraden der Erkrankung vorzunehmen: in einer in den Jahren 2001 bis 2005 durchgeführten Querschnittsstudie mit Angestellten wurde eine Prävalenz von 2,2 % k ermittelt, in einer von 2002 bis 2008 durchgeführten Kohortenstudie mit Personen lag sie bei 2,3 % l. Nach Angaben verschiedener Fachportale zur Rosazea sind in Deutschland rund 4 Millionen Menschen betroffen m,n,o. Dies entspricht der auf die deutsche Bevölkerung extrapolierten US- Prävalenzrate von 4,78 % aus dem Jahre 2004 p. In einer vom IQWiG herausgegebenen Gesundheitsinformation zum Thema Rosazea liegt die Prävalenz in Deutschland zwischen 2 und 5 % q. 3
4 Rosazea tritt bei beiden Geschlechtern ähnlich häufig auf f,g,k,l. In der Studie von Augustin et al. lag die Prävalenz von Rosazea bei Männern bei 2,4 %, bei Frauen bei 2,1 % l. In einigen Studien wurde jedoch eine erhöhte Krankheitsrate bei weiblichen Betroffenen beobachtet h,i. Mehr als 80 % aller Rosazea-Diagnosen werden nach der dritten Lebensdekade gestellt i. Am häufigsten sind Personen im Alter von Jahren betroffen f -h,r. Überwiegend sind Patienten mit heller Haut (Fitzpatrick-Hauttyp I und II) betroffen r,s. In einer amerikanischen Studie wurde zwischen 1993 und 2010 durch Auswertung von Daten des National Ambulatory Medical Care Survey die Erkrankung Rosazea bei 8,3 % der weißen und bei 2,2 % der dunkelhäutigen Patienten diagnostiziert t. Da überwiegend helle Hauttypen von der Erkrankung betroffen sind, wurden zur Ermittlung der GKV-Patientenpopulation für die Nutzenbewertung vorwiegend Studien berücksichtigt, bei der der Hauttyp der untersuchten Patientenpopulationen überwiegend der deutschen Bevölkerung entspricht. Allgemein sind nur wenige Daten zur Prävalenz der papulopustulösen Rosazea verfügbar: bei einer irischen Studie aus dem Jahre 2010 zur Untersuchung des Zusammenhangs zwischen UV-Strahlung und papulopustulöser Rosazea bei 1000 Personen lag die Prävalenz bei 2,7% u. Ein Zusammenhang zwischen der Entwicklung oder Verschlechterung der papulopustulösen Rosazea und erhöhter UV-Strahlenexposition konnte nicht nachgewiesen werden. In der bereits o.g. schwedischen Studie aus dem Jahre 1989 lag die Prävalenz der papulopustulösen Rosazea bei 1,9 % h, bei der in Estland durchgeführten Studie aus dem Jahre 2010 bei 4,84 % f. Zur Inzidenz der Rosazea wurde nur eine britische retrospektive Fall-Kontroll-Studie von Spoendlin et al. aus dem Jahre 2012 i identifiziert: die Auswertung von Daten aus den Jahren 1995 bis 2008 ergaben eine Gesamtinzidenzrate von 1,65 pro 1000 Personenjahren. Am häufigsten waren Personen zwischen 40 und 49 Jahren betroffen Eine Differenzierung zwischen den verschiedenen Schweregraden erfolgte nicht. GKV-Zielpopulation Für die Anzahl der Patienten der Zielpopulation können anhand der vorliegenden epidemiologischen Daten lediglich Näherungswerte angegeben werden. Gemäß den Angaben der Gesundheitsberichterstattung des Bundes sind 86,7% v w Bevölkerung gesetzlich krankenversichert. der Nach den Ergebnissen der zwei großen deutschen Studien ergibt sich eine Prävalenz aller Rosazea-Schweregrade von 2,2 bis 2,3 % k,l. Unter Berücksichtigung der Aussagen zur Rosazea-Prävalenz von bis zu 5 % in verschiedenden Fachportalen m-o ergibt sich eine geschätzte Spanne der GKV-Zielpopulation von 1,5 bis 3,5 Mio. Patienten. Diese Spanne umfasst alle Schweregrade der Rosazea, sodass eine Überschätzung der eigentlichen Zielpopulation (Patienten mit papulopustulöser Rosazea) wahrscheinlich ist. Prävalenzdaten aus Deutschland zur papulopustolösen Rosazea liegen nicht vor. Zu einer Annäherung an die Prävalenz des Schweregrades II in Deutschland wurden solche Studien 4
5 herangezogen, bei denen der Hauttyp der untersuchten Patientenpopulationen überwiegend der deutschen Bevölkerung entsprach. Der Anteil der papulopustulösen Rosazea der betrachteten schwedischen Population an der Prävalenz aller Schweregrade lag bei 19 % h, in der Studie aus Estland betrug der Anteil 22 % f. Zur Berechnung der Anzahl an Patienten mit papulopustulöser Rosazea wurde ein Anteil von 20 % an der Gesamtheit aller Schweregrade herangezogen. Demnach ergibt sich eine Spanne für die GKV-Zielpopulation von bis Patienten. 3. Anforderungen an eine qualitätsgesicherte Anwendung Die Vorgaben der Fachinformation sind zu berücksichtigen. Der Behandlungszyklus kann wiederholt werden. Falls es nach 3 Monaten zu keiner Besserung kommt, sollte die Behandlung abgebrochen werden. 4. Therapiekosten Die Therapiekosten basieren auf den Angaben der Fachinformationen sowie den Angaben der Lauer-Taxe (Stand: 15. August 2015). Zur Darstellung des Verbrauchs Hinsichtlich des Verbrauchs wurde der Jahresdurchschnittsverbrauch unter Angabe an Gramm Creme bzw. Gel und Anzahl an Hartkapseln bzw. Tabletten ermittelt. Es wurden die in den Fachinformationen empfohlenen Tagesdosen als Berechnungsgrundlage herangez o- gen. Zu bewertendes Arzneimittel: Ivermectin (Soolantra ) Soolantra (10 mg Ivermectin pro g Creme) wird einmal täglich für eine Dauer von bis zu 4 Monaten angewendet. Der Behandlungszyklus kann wiederholt werden. Falls es nach 3 Monaten zu keiner Besserung kommt, sollte die Behandlung abgebrochen werden. Verbrauch Es wird jeweils eine erbsengroße Menge des Arzneimittels auf die Haut der fünf Bereiche des Gesichts aufgetragen: Stirn, Kinn, Nase und beide Wangen. Das Arzneimittel soll als 5
6 dünne Schicht über das ganze Gesicht unter Vermeidung von Augen, Lippen und Schleimhaut verteilt werden. Aufgrund fehlender Angaben zum Tagesverbrauch von Soolantra in der Fachinformation wird ein Verbrauch von 0,5 bis 1 g Creme pro Tag angenommen 2. Informationen hinsichtlich des Verbrauches in der klinischen Praxis liegen nicht vor. zweckmäßige Vergleichstherapie: - Azelainsäure (Skinoren ) Skinoren (150 mg/g Gel) wird zweimal täglich auf die befallenen Hautstellen aufgetragen. Zur Erreichung optimaler Ergebnisse kann Skinoren -Gel über mehrere Monate angewendet werden. Wenn nach 2 Monaten keine Verbesserung oder eine Verschlechterung der Rosazea eintritt, sollte Skinoren -Gel abgesetzt werden. Nach der in der Fachinformation angegebenen Therapiedauer von 12 Wochen in klinischen Studien wird im klinischen Alltag ebenfalls von einer 12-wöchigen Therapiedauer ausgegangen. Verbrauch Skinoren -Gel wird morgens und abends auf die befallenen Hautstellen aufgetragen und vorsichtig in die Haut eingerieben. Etwa 0,5 g (= 2,5 cm) Gel reichen für die gesamte Gesichtsfläche aus. - Doxycyclin Anmerkung: Zur systemischen Therapie der (papulopustulösen) Rosazea mit dem Wirkstoff Doxycyclin sind zwei unterschiedliche Therapieschemata möglich, die sich in der Tagesdosis (40 mg versus 100 mg/50 mg) unterscheiden. Orayzea ist ein speziell zur Therapie der Rosazea zugelassenes Arzneimittel, das niedrig dosiertes Doxycyclin (40 mg) mit veränderter Wirkstofffreisetzung enthält. Aus diesem Grund wurden für beide Dosierungen der Verbrauch sowie die Kosten der Therapie dargestellt. Doxycyclin 40 mg (Oraycea ) Die liegt zunächst bei 6 Wochen. Bei ausbleibender Wirkung ist eine Beendigung der Behandlung in Betracht zu ziehen. 4 Wochen nach Beendigung der Behandlung ist nach erneuter Beurteilung eine Fortführung der Therapie zu erwägen. In klinischen Studien wurden Patienten über 16 Wochen behandelt. Demnach ist für einzelne 2 Auskunft des pharmazeutischen Unternehmers auf Anfrage 6
7 Patienten auch eine Therapie über 16 Wochen möglich. Da die Standardtherapie jedoch 6 Wochen beträgt, wird die Therapiedauer über 16 Wochen nicht berücksichtigt. Verbrauch Die Tagesdosis beträgt 40 mg (1 Kapsel). Doxycyclin 100 mg Die liegt zwischen 7 und 21 Tagen. Eine Erhaltungstherapie für weitere zwei bis drei Wochen ist möglich. Für die Kostendarstellung wird folglich von einer Gesamtbehandlungsdauer von 6 Wochen ausgegangen. Verbrauch Die Tagesdosis beträgt 100 mg. Bei Durchführung einer Erhaltungstherapie werden einmal täglich 50 mg Doxycyclin verabreicht. Zur Berechnung des Verbrauchs und der Therapiekosten finden teilbare Darreichungsformen Anwendung. - Metronidazol (MetroGalen ) Das Gel wird zweimal täglich als dünner Film auf die betroffene Gesichtshaut aufgetragen. Die Dauer der Anwendung beträgt 4 Wochen. Falls notwendig, kann die Behandlung für weitere 4 Wochen fortgesetzt werden. Die empfohlene Anwendungsdauer sollte nicht überschritten werden. Falls erforderlich könnte die Therapie wiederholt werden, jedoch sollte ein Abstand von 6 Wochen eingehalten werden. Eine unnötige und eine längere Anwendung von MetroGalen Gel als vorgesehen ist zu vermeiden. Bei keiner klaren klinischen Besserung sollte die Therapie beendet werden. Verbrauch Metronidazol (MetroGalen ) sollte zweimal täglich (morgens und abends) als dünner Film auf die betroffene Gesichtshaut aufgetragen werden. Nach der in der DIMDI-Datenbank angegebenen DDD 3 von 15 mg Metronidazol ergibt sich ein Verbrauch von 1 g Metronidazol- Gel pro Anwendung. 3 Defined daily dose 7
8 Zur Darstellung der Kosten Für die Berechnung der Arzneimittelkosten wurde zunächst anhand des Verbrauchs die benötigte Anzahl an Packungen ermittelt. Mit der ermittelten Anzahl der benötigten Packungen wurden dann die Arzneimittelkosten auf Basis der Kosten pro Packung, nach Abzug der gesetzlich vorgeschriebenen Rabatte, berechnet. Die Arzneimittelkosten wurden zur besseren Vergleichbarkeit näherungsweise sowohl auf der Basis der Apothekenverkaufspreisebene als auch abzüglich der gesetzlich vorgeschriebenen Rabatte nach 130a SGB V (Abs. 1, 1a, 3a) und nach 130 Abs. 1 SGB V, erhoben. Bezeichnung Therapie der Anzahl Behandlungen pro Patient Behandlungsmodus je Behandlung (Tage) Behandlungstage pro Patient Zu bewertendes Arzneimittel: Ivermectin Ivermectin kontinuierlich 1x täglich Zweckmäßige Vergleichstherapie Azelainsäure Doxycyclin 40 mg Doxycyclin 6 kontinuierlich 2x täglich kontinuierlich 1x täglich kontinuierlich mg 7 1x täglich mg 8 1x täglich Es wurde eine von 4 Monaten zugrunde gelegt. Bei Bedarf kann der Behandlungszyklus wiederholt werden. 5 Die kann sich nach Angaben der Fachinformation zu Orayzea nach visueller Beurteilung 4 Wochen nach Beendigung der Therapie gegebenenfalls verlängern. 6 Zugrunde gelegt wird eine Initialtherapie über 21 Tage mit 100 mg Doxycyclin täglich und eine anschließende Erhaltungstherapie mit einer Tagesdosis von 50 mg Doxycyclin über 21 Tage. 7 Initialtherapie 8 Erhaltungstherapie 8
9 Bezeichnung Therapie der Anzahl Behandlungen pro Patient Behandlungsmodus je Behandlung (Tage) Behandlungstage pro Patient Metronidazol. kontinuierlich 2x täglich Die kann sich nach Angaben der Fachinformation zu MetroGalen gegebenenfalls verlängern. 9
10 Verbrauch: Bezeichnung der Therapie Wirkstärke Menge pro Packung Jahresdurchschnittsverbrauch Zu bewertendes Arzneimittel: Ivermectin Ivermectin 10 mg/g 30 g Creme g 10 Zweckmäßige Vergleichstherapie: Azelainsäure 150 mg/g 2x50 g Gel 84 g Doxycyclin 40 mg Doxycyclin 40 mg 56 Hartkapseln mit veränderter Wirkstofffreisetzung 42 Stück mg 100 mg 20 Tabletten 21 Stück mg 100 mg 20 Tabletten 11 Stück 12 Metronidazol 7,5 mg/g 50 g Gel g Gel g 10 Die Ermittlung des Jahresdurchschnittsverbrauchs erfolgte unter der angenommenen täglichen mittleren Verbrauchsspanne von 0,5-1 g. Die Angaben beziehen sich auf eine Therapiedauer für Ivermectin von 4 Monaten. Bei Bedarf kann die Behandlung wiederholt werden. Entsprechend erhöht sich der Jahresdurchschnittsverbrauch. 11 Der Verbrauch an Oraycea (Wirkstoff Doxycyclin) kann sich nach Angaben der Fachinformation erhöhen, wenn vier Wochen nach Beendigung der Therapie erneut Symptome auftreten. 12 Die Therapie mit Doxycyclin beginnt über 7-21 Tage mit 100 mg täglich. Eine Erhaltungstherapie mit 50 mg täglich über bis zu 21 Tagen ist möglich. Zur Berechnung des Verbrauchs wurde eine Initialtherapie über 21 Tage sowie eine Erhaltungstherapie über 21 Tage unter Berücksichtigung teilbarer Doxycyclin-Formulierungen zugrunde gelegt. 13 Wirtschaftlichste Stückelung 10
11 Kosten: Kosten der Arzneimittel: Bezeichnung der Therapie Kosten pro Packung (Apothekenabgabepreis) oder Behandlung Kosten nach Abzug gesetzlich vorgeschriebener Rabatte Zu bewertendes Arzneimittel: Ivermectin Ivermectin 37,53 34,29 [1,77 14 ; 1,47 15 ] Zweckmäßige Vergleichstherapie: Azelainsäure 51,92 47,88 [1,77 14, 2,27 15 ] Doxycyclin 40 mg 50,99 46,37 [1,77 14, 2,85 15 ] Doxycyclin 100 mg 16 12,50 10,61 [1,77 14, 0,12 15 ] Metronidazol 23, , ,23 [1,77, 1,60 15 ] 13,09 [1,77 14, 0,56 15 ] Stand Lauer-Taxe: 15. August 2015 Kosten für zusätzlich notwendige GKV-Leistungen: keine 14 Rabatt nach 130 SGB V 15 Rabatt nach 130a SGB V 16 Festbetrag 17 Wirtschaftlichste Stückelung 11
12 Jahrestherapiekosten: Bezeichnung der Therapie Jahrestherapiekosten pro Patient Zu bewertendes Arzneimittel: Ivermectin Ivermectin 68,58-137,16 Zweckmäßige Vergleichstherapie Azelainsäure 47,88 Doxycyclin 40 mg 46,37 Doxycyclin 100 mg 21,22 Metronidazol 33,32-53,55 12
13 Referenzliste a Cribier B. Pathophysiology of rosacea: redness, telangiectasia, and rosacea. Ann Dermatol Venereol. 2011; 138 Suppl 3: S b Schwab VD, Sulk M, Seeliger S, et al. Neurovascular and neuroimmune aspects in the pathophysiology of rosacea. J Investig Dermatol Symp Proc. 2011; 15: c Wilkin J, Dahl M, Detmar M, et al. Standard classification of rosacea: Report of the National Rosacea Society Expert Committee on the Classification and Staging of Rosacea. J Am Acad Dermatol. 2002; 46: d Zugriff am e Lomholt G. Prevalence of skin diseases in a population; a census study from the Faroe Islands. Dan Med Bull Feb; 11: 1-7. f Abram K, Silm H, Oona M. Prevalence of rosacea in an Estonian working population using a standard classification. Acta Derm Venereol May;90(3): g Kyriakis KP, Palamaras I, Terzoudi S et al. Epidemiologic aspects of rosacea. J Am Acad Dermatol Nov; 53(5): h Berg M, Lidén S. An epidemiological study of rosacea. Acta Derm Venereol. 1989; 69(5): i Spoendlin J, Voegel JJ, Jick SS et al. A study on the epidemiology of rosacea in the U.K. Br J Dermatol Sep;167(3): j Romanowicz M, Stephenson JJ, Del Rosso JQ et al. Healthcare utilization and costs of patients with rosacea in an insured population. J Drugs Dermatol Jan;7(1):41-9. k Schaefer I, Rustenbach SJ, Zimmer L et al. Prevalence of skin diseases in a cohort of 48,665 employees in Germany. Dermatology.2008;217(2): l Augustin M, Herberger K, Hintzen S et al. Prevalence of skin lesions and need for treatment in a cohort of workers. Br J Dermatol.2011 Oct;165(4): m Zugriff am n GD Gesellschaft für Dermopharmazie e.v. Zugriff am o Berufsverband der Deutschen Dermatologen e.v. Zugriff am p Right diagnosis from healthgrades Zugriff am q Gesundheitsinformation.de Zugriff am r Moustafa F, Hopkinson D, Huang KE et al. Prevalence of rosacea in community settings. J Cutan Med Surg Mar;19(2): s Doe PT, Asiedu A, Acheampong JW et al. Skin diseases in Ghana and the UK. Int J Dermatol May;40(5): t Al-Dabagh A, Davis SA, McMichael AJ et al. Rosacea in skin of color: not a rare diagnosis. Dermatol Online J Oct;20(10). u McAleer MA, Fitzpatrick P, Powell FC. Papulopustular rosacea: prevalence and relationships to photodamage. J Am Acad Dermatol Jul;63(1):33-9. v GKV-Mitglieder und Mitversicherte Familienangehörige ; Zugriff am w Statistisches Bundesamt Bevölkerungsstand erung/bevoelkerungsstand/ Tabe llen/zensus_geschlecht_staatsangehoerigkeit.html;jsessionid= 5538E7B0E07729F6F248EEE6DC74 4E58.cae1; Zugriff am
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Nutzenbewertung. von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V. Wirkstoff: Nepafenac. nach 2 Abs. 2 VerfO des G-BA
 Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Nepafenac nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 1. Oktober 2013 1 Nepafenac Zugelassenes Anwendungsgebiet
Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Nepafenac nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 1. Oktober 2013 1 Nepafenac Zugelassenes Anwendungsgebiet
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bundesministerium für Gesundheit. Bekanntmachung
 Seite 1 von 5 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung
Seite 1 von 5 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vortioxetin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 06.08.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 11.11.2014 B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 20.11.2014 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Sachverständigenausschuss für Verschreibungspflicht (SVA) 73. Sitzung Metronidazol zur Anwendung auf der Haut bei papulopustulöser Rosazea
 Sachverständigenausschuss für Verschreibungspflicht (SVA) 73. Sitzung Metronidazol zur Anwendung auf der Haut bei papulopustulöser Rosazea Antrag auf Entlassung aus der Verschreibungspflicht Metronidazol
Sachverständigenausschuss für Verschreibungspflicht (SVA) 73. Sitzung Metronidazol zur Anwendung auf der Haut bei papulopustulöser Rosazea Antrag auf Entlassung aus der Verschreibungspflicht Metronidazol
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Apixaban wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
BAnz AT 04.04.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 23.04.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Nutzenbewertung. von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V (nach 5. Kapitel 1 Abs. 2 Nr. 2 i.v.m. 2 Abs.
 Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V (nach 5. Kapitel 1 Abs. 2 Nr. 2 i.v.m. 2 Abs. 2 VerfO des G-BA) Wirkstoff: Insulin degludec Datum der Veröffentlichung: 15. September
Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V (nach 5. Kapitel 1 Abs. 2 Nr. 2 i.v.m. 2 Abs. 2 VerfO des G-BA) Wirkstoff: Insulin degludec Datum der Veröffentlichung: 15. September
Gebrauchsinformation: Information für Anwender. Skinoren 15 % Gel. Azelainsäure
 Gebrauchsinformation: Information für Anwender Skinoren 15 % Gel Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für Anwender Skinoren 15 % Gel Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
Akne und Rosazea. Priv.-Doz. Dr. med. habil. Thomas Jansen. Dermatologische Praxis, Köln und Düsseldorf Lehrauftrag Universität Duisburg-Essen
 Akne und Rosazea Priv.-Doz. Dr. med. habil. Thomas Jansen Dermatologische Praxis, Köln und Düsseldorf Lehrauftrag Universität Duisburg-Essen Haarfollikelarten Vellushaarfollikel Flaumhaar Terminalhaarfollikel
Akne und Rosazea Priv.-Doz. Dr. med. habil. Thomas Jansen Dermatologische Praxis, Köln und Düsseldorf Lehrauftrag Universität Duisburg-Essen Haarfollikelarten Vellushaarfollikel Flaumhaar Terminalhaarfollikel
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Secukinumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Carfilzomib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung
 IQWiG-Berichte Nr. 367 Carfilzomib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-16 Version: 1.0 Stand: 25.02.2016 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 367 Carfilzomib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-16 Version: 1.0 Stand: 25.02.2016 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daclatasvir wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Anhaltspunkt für erheblichen Zusatznutzen
 Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Ivacaftor (neues Anwendungsgebiet)
 IQWiG-Berichte Nr. 371 Ivacaftor (neues Anwendungsgebiet) Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-13 Version: 1.0 Stand: 01.03.2016 Impressum Herausgeber: Institut für Qualität
IQWiG-Berichte Nr. 371 Ivacaftor (neues Anwendungsgebiet) Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G15-13 Version: 1.0 Stand: 01.03.2016 Impressum Herausgeber: Institut für Qualität
Nutzenbewertung. von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V. Wirkstoff: Lomitapid. nach 2 Abs. 2 VerfO des G-BA
 Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Lomitapid nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 17. März 2014 Stand 12.03.2014 1 Lomitapid Zugelassenes
Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Lomitapid nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 17. März 2014 Stand 12.03.2014 1 Lomitapid Zugelassenes
Dossierbewertung A15-31 Version 1.0 Tiotropium/Olodaterol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Interdisziplinäres Management der Rosazea
 Stellungnahme der GD Gesellschaft für Dermopharmazie e. V. Interdisziplinäres Management der Rosazea GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589
Stellungnahme der GD Gesellschaft für Dermopharmazie e. V. Interdisziplinäres Management der Rosazea GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589
S3-Leitlinie Exokrines Pankreaskarzinom : Empfehlung für die Kombinationstherapie mit Tarceva
 S3-Leitlinie Exokrines Pankreaskarzinom : Empfehlung für die Kombinationstherapie mit Tarceva München (20. Mai 2008) - Die Zulassung von Erlotinib (Tarceva ) in der Indikation Pankreaskarzinom gilt als
S3-Leitlinie Exokrines Pankreaskarzinom : Empfehlung für die Kombinationstherapie mit Tarceva München (20. Mai 2008) - Die Zulassung von Erlotinib (Tarceva ) in der Indikation Pankreaskarzinom gilt als
BAnz AT 07.07.2016 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Antrag auf Änderung der Verkaufsabgrenzung von Metronidazol bei papulopustulöser Rosazea
 Antrag auf Änderung der Verkaufsabgrenzung von Metronidazol bei papulopustulöser Rosazea Rationale des Antrags Metronidazol stellt einen der Goldstandards in der dermalen Therapie der papulopustulösen
Antrag auf Änderung der Verkaufsabgrenzung von Metronidazol bei papulopustulöser Rosazea Rationale des Antrags Metronidazol stellt einen der Goldstandards in der dermalen Therapie der papulopustulösen
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs
 AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
Rosazea Erscheinungsformen und Therapieansätze
 PHARMAZEUTISCHE WISSENSCHAFT Beatrice Reichenstein, Heilpraktikerin & Apothekerin Rosazea Erscheinungsformen und Therapieansätze Rosazea ist eine häufige entzündliche, vornehmlich das Gesicht betreffende
PHARMAZEUTISCHE WISSENSCHAFT Beatrice Reichenstein, Heilpraktikerin & Apothekerin Rosazea Erscheinungsformen und Therapieansätze Rosazea ist eine häufige entzündliche, vornehmlich das Gesicht betreffende
Ivacaftor (neues Anwendungsgebiet)
 IQWiG-Berichte Nr. 258 Ivacaftor (neues Anwendungsgebiet) Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G14-09 Version: 1.0 Stand: 26.11.2014 Impressum Herausgeber: Institut für Qualität
IQWiG-Berichte Nr. 258 Ivacaftor (neues Anwendungsgebiet) Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G14-09 Version: 1.0 Stand: 26.11.2014 Impressum Herausgeber: Institut für Qualität
Fragebogen zur Beschreibung einer Erkrankung und derer Behandlung für Patienten und Patientinnen bzw. Patientenorganisationen
 Beteiligung an der frühen Nutzenbewertung des IQWiG Fragebogen zur Beschreibung einer Erkrankung und derer Behandlung für Patienten und Patientinnen bzw. Patientenorganisationen (Stand: 01/2013) Fragebogen
Beteiligung an der frühen Nutzenbewertung des IQWiG Fragebogen zur Beschreibung einer Erkrankung und derer Behandlung für Patienten und Patientinnen bzw. Patientenorganisationen (Stand: 01/2013) Fragebogen
für die wissenschaftliche Beratung und das überlassene klinische Bildmaterial.
 Diasammlung Akne Hermal dankt Univ.-Prof. Dr. H. Gollnick Universitätsklinik für Dermatologie und Venerologie Otto-von-Guericke-Universität Magdeburg Priv.-Doz. Dr. med. Dr. rer. nat. J. Kreusch, Lübeck
Diasammlung Akne Hermal dankt Univ.-Prof. Dr. H. Gollnick Universitätsklinik für Dermatologie und Venerologie Otto-von-Guericke-Universität Magdeburg Priv.-Doz. Dr. med. Dr. rer. nat. J. Kreusch, Lübeck
Beschluss. Vom 17. Juli 2014
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Zu Akne neigende Haut PAPULEX
 Zu Akne neigende Haut 1 Was ist zu Akne neigende Haut und Akne? Fettige Haut und Akne entstehen in Folge übermäßiger Talgdrüsenproduktion. Die Übergänge zwischen fettiger Haut und Akne sind fließend. Die
Zu Akne neigende Haut 1 Was ist zu Akne neigende Haut und Akne? Fettige Haut und Akne entstehen in Folge übermäßiger Talgdrüsenproduktion. Die Übergänge zwischen fettiger Haut und Akne sind fließend. Die
3 Beratung bei der Abgabe von OTC-Arzneimitteln... 40
 Inhaltsverzeichnis Vorwort V Teil A Anatomie und Physiologie der Haut 1 Anatomie und Physiologie der Haut 2 1.1 Aufbau der Haut 2 1.1.1 Die Subkutis (Unterhaut) 4 1.1.2 Die Dermis (Lederhaut) 5 1.1.3 Die
Inhaltsverzeichnis Vorwort V Teil A Anatomie und Physiologie der Haut 1 Anatomie und Physiologie der Haut 2 1.1 Aufbau der Haut 2 1.1.1 Die Subkutis (Unterhaut) 4 1.1.2 Die Dermis (Lederhaut) 5 1.1.3 Die
Neue Wirksamkeitsdimension bei Rosacea papulopustulosa
 SOOLANTRA Neue Wirksamkeitsdimension bei Rosacea papulopustulosa Düsseldorf (17. Juni 2015) - Die Behandlung der sensiblen und aufgrund der gestörten Hautbarrierefunktion trockenen Rosacea-Haut bedarf
SOOLANTRA Neue Wirksamkeitsdimension bei Rosacea papulopustulosa Düsseldorf (17. Juni 2015) - Die Behandlung der sensiblen und aufgrund der gestörten Hautbarrierefunktion trockenen Rosacea-Haut bedarf
Für Sie untersucht: Stabilitätsuntersuchungen
 Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Sofosbuvir/Velpatasvir (chronische Hepatitis C)
 IQWiG-Berichte Nr. 468 Sofosbuvir/Velpatasvir (chronische Hepatitis C) Addendum zum Auftrag A16-48 Addendum Auftrag: A16-73 Version: 1.0 Stand: 08.12.2016 Impressum Herausgeber: Institut für Qualität und
IQWiG-Berichte Nr. 468 Sofosbuvir/Velpatasvir (chronische Hepatitis C) Addendum zum Auftrag A16-48 Addendum Auftrag: A16-73 Version: 1.0 Stand: 08.12.2016 Impressum Herausgeber: Institut für Qualität und
BAnz AT 06.04.2016 B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
PATENT DE B4
 P A T E N T M E R K M A L E PATENT DE10 2007 048 094 B4 VERFAHREN UND PATENTGRUNDLAGE M.O.M HELENAA Das patentierte Verfahren M.O.M Helenaa beschreibt eine Technologie z.b. über Apps, als integrierte Lösung
P A T E N T M E R K M A L E PATENT DE10 2007 048 094 B4 VERFAHREN UND PATENTGRUNDLAGE M.O.M HELENAA Das patentierte Verfahren M.O.M Helenaa beschreibt eine Technologie z.b. über Apps, als integrierte Lösung
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Tragende Gründe. Vom 2. August Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf... 6
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Epidemiologie und gesellschaftliche Kosten der Osteoporose. Mosekilde, Bone Miner 1990; 10: 13-35
 Epidemiologie und gesellschaftliche Kosten der Osteoporose Mosekilde, Bone Miner 199; 1: 13-35 Dr. E. Edelmann Rheumatologische Schwerpunktpraxis Bad Aibling 1/23 Definition u. Häufigkeit der Osteoporose
Epidemiologie und gesellschaftliche Kosten der Osteoporose Mosekilde, Bone Miner 199; 1: 13-35 Dr. E. Edelmann Rheumatologische Schwerpunktpraxis Bad Aibling 1/23 Definition u. Häufigkeit der Osteoporose
Innovative Arzneimittelversorgung im Spannungsfeld zwischen Nutzenbewertung und Sicherstellung des medizinischen Fortschritts
 Innovative Arzneimittelversorgung im Spannungsfeld zwischen Nutzenbewertung und Sicherstellung des medizinischen Fortschritts Roger Jaeckel, Leiter Gesundheitspolitik, GlaxoSmithKline Gemeinsame Fachtagung
Innovative Arzneimittelversorgung im Spannungsfeld zwischen Nutzenbewertung und Sicherstellung des medizinischen Fortschritts Roger Jaeckel, Leiter Gesundheitspolitik, GlaxoSmithKline Gemeinsame Fachtagung
Tragende Gründe. Vom 21. Juni 2012
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII- Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII- Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Auf der 84. Jahrestagung der Deutschen Gesellschaft für Neurologie (DGN), die noch bis zum 1. Oktober in
 Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Psorcutan - Salbe Wirkstoff: Calcipotriol
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Psorcutan - Salbe Wirkstoff: Calcipotriol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Psorcutan - Salbe Wirkstoff: Calcipotriol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Ledipasvir/Sofosbuvir wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Skinoren 20% Creme. Wirkstoff: Azelainsäure
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Skinoren 20% Creme Wirkstoff: Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Skinoren 20% Creme Wirkstoff: Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
kontrolliert wurden. Es erfolgte zudem kein Ausschluss einer sekundären Genese der Eisenüberladung. Erhöhte Ferritinkonzentrationen wurden in dieser S
 5.8 Zusammenfassung Auf der Grundlage der dargestellten Ergebnisse dieser Studie erscheint die laborchemische Bestimmung der Transferrinsättigung zur Abklärung einer unklaren Lebererkrankung und Verdacht
5.8 Zusammenfassung Auf der Grundlage der dargestellten Ergebnisse dieser Studie erscheint die laborchemische Bestimmung der Transferrinsättigung zur Abklärung einer unklaren Lebererkrankung und Verdacht
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Akne Rosacea Rosacea-artige periorale Dermatitis. Prof. Dr. M. Jünger
 Akne Rosacea Rosacea-artige periorale Dermatitis Prof. Dr. M. Jünger Akne comedonica Akne pustulosa Akne conglobata Knoten, Narben, Fistelkomedonen, Starke Seborrhoe Akne und akneähnliche Erkrankungen
Akne Rosacea Rosacea-artige periorale Dermatitis Prof. Dr. M. Jünger Akne comedonica Akne pustulosa Akne conglobata Knoten, Narben, Fistelkomedonen, Starke Seborrhoe Akne und akneähnliche Erkrankungen
Celgene GmbH Joseph-Wild-Straße München. Telefon: (089) PRESSEMITTEILUNG
 Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
Dossierbewertung A15-60 Version 1.0 Sacubitril/Valsartan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Moderne Therapie der Herzinsuffizienz und Asthma/COPD zwei unvereinbare Entitäten. Stefan Hammerschmidt Klinikum Chemnitz ggmbh
 Moderne Therapie der Herzinsuffizienz und Asthma/COPD zwei unvereinbare Entitäten Stefan Hammerschmidt Klinikum Chemnitz ggmbh Obstruktive Atemwegserkrankungen Differentialdiangose wahrscheinlicher Asthma
Moderne Therapie der Herzinsuffizienz und Asthma/COPD zwei unvereinbare Entitäten Stefan Hammerschmidt Klinikum Chemnitz ggmbh Obstruktive Atemwegserkrankungen Differentialdiangose wahrscheinlicher Asthma
Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland
 Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Dossierbewertung A13-41 Version 1.0 Afatinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Brentuximabvedotin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
AWMF-Register Nr. 013/065 Klasse: S1
 publiziert bei: AWMF-Register Nr. 013/065 Klasse: S1 Leitlinie der Deutschen Dermatologischen Gesellschaft Rosazea Markus Reinholz 1, Julia K. Tietze 1, Katharina Kilian 1, Martin Schaller 2, Helmut Schöfer
publiziert bei: AWMF-Register Nr. 013/065 Klasse: S1 Leitlinie der Deutschen Dermatologischen Gesellschaft Rosazea Markus Reinholz 1, Julia K. Tietze 1, Katharina Kilian 1, Martin Schaller 2, Helmut Schöfer
Tragende Gründe. Vom 4. August 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
AscoTop Nasal erhält Zulassung für die Behandlung von Cluster-Kopfschmerz
 AscoTop Nasal erhält Zulassung für die Behandlung von Cluster-Kopfschmerz Patienten profitieren von schnellem Wirkeintritt und guter Verträglichkeit Wedel (2. September 2008) - Zolmitriptan Nasenspray
AscoTop Nasal erhält Zulassung für die Behandlung von Cluster-Kopfschmerz Patienten profitieren von schnellem Wirkeintritt und guter Verträglichkeit Wedel (2. September 2008) - Zolmitriptan Nasenspray
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Orphan Drugs. Arzneimitteltherapie seltener Krankheiten
 Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Verbesserung des Tuberkulose-Screenings bei Patienten mit rheumatischen Erkrankungen vor Beginn einer Therapie mit TNFα-Blockern
 Rheumatologie / Klinische Immunologie Prof. Dr. H.P. Tony (Leiter des Schwerpunktes) Prof. Dr. med. Ch. Kneitz Medizinische Poliklinik Klinikstr. 6-8 97070 Würzburg Abstract: 1 / 10 Verbesserung des Tuberkulose-Screenings
Rheumatologie / Klinische Immunologie Prof. Dr. H.P. Tony (Leiter des Schwerpunktes) Prof. Dr. med. Ch. Kneitz Medizinische Poliklinik Klinikstr. 6-8 97070 Würzburg Abstract: 1 / 10 Verbesserung des Tuberkulose-Screenings
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
Anhang 4. Bias durch Überdiagnose von papillären Mikrokarzinomen
 Anhang 4 Bias durch Überdiagnose von papillären Mikrokarzinomen Bias durch Überdiagnose von papillären Mikrokarzinomen H. Bertelsmann AG Epidemiologie und Medizinische Statistik Universität Bielefeld Dezember
Anhang 4 Bias durch Überdiagnose von papillären Mikrokarzinomen Bias durch Überdiagnose von papillären Mikrokarzinomen H. Bertelsmann AG Epidemiologie und Medizinische Statistik Universität Bielefeld Dezember
Topische Therapie. Lokaltherapie. Lokaltherapie The preferred route of drug administration in dermatology is?
 The preferred route of drug administration in dermatology is? Topische Therapie 1. Oral 2. Intravenous 3. Topical DDr. Ahmad Jalili 28.01.2013, Vienna 4. Subcutaneous Ihre Empfehlung zur lokalen Therapie?
The preferred route of drug administration in dermatology is? Topische Therapie 1. Oral 2. Intravenous 3. Topical DDr. Ahmad Jalili 28.01.2013, Vienna 4. Subcutaneous Ihre Empfehlung zur lokalen Therapie?
