Schmelz- und Siedetemperaturen
|
|
|
- Andreas Steinmann
- vor 6 Jahren
- Abrufe
Transkript
1 Schmelz- und Siedetemperaturen 1) Schmelztemperatur einiger fester Stoffe und Siedetemperatur von Wasser: Chemikalien: Geräte: Stearinsäure (=Octadecansäure), Fixiersalz (=Natriumthiosulfat-pentahydrat), Naphthalin [X n,, N; nur Lehrerversuch!], (dest.) Wasser Reagenzgläser, Thermometer (Bereich C), Stativmaterial (Stativ mit Klemme und Muffe), 250ml-Becherglas mit 150ml Wasser und 2 Siedesteinchen, Dreifuß mit Keramikdrahtnetz, Gasbrenner, Streichhölzer, Stoppuhr, saugfähiges Papier, Gummistopfen Versuchsdurchführung: Das Reagenzglas wird etwa 2fingerbreit mit einer der drei Substanzen gefüllt, schräg gehalten und unter Drehen das Thermometer bis zum Reagenzglasboden eingeführt. Das Becherglas mit 150ml Wasser wird auf den Dreifuß mit Keramikdrahtnetz gestellt, das Reagenzglas an seinem oberen Ende am Stativ befestigt und bis etwa 1fingerbreit oberhalb des Becherglasbodens eingetaucht, so dass das Wasser höher steht als der Feststoff. Ein weiteres Thermometer wird unbefestigt in das Becherglas gestellt. Der Gasbrenner wird entzündet, die Arbeitsflamme eingestellt und mit Hilfe der Gasregulierungsschraube so geregelt, dass sie eben ans Keramikdrahtnetz reicht. Beim Drunterstellen des Gasbrenners wird die Stoppuhr gestartet und sofort die Reagenzglas sowie im Becherglas abgelesen und in einer Tabelle notiert. Dann wird alle 10sec die Reagenzglas und alle 30sec die Becherglas abgelesen und das jeweilige Aussehen des Stoffes im Reagenzglas und des Wassers im Becherglas beschrieben. Wenn das Wasser 4min lang deutlich kocht, wird der Brenner ausgestellt, das Reagenzglas etwa 1handbreit oberhalb des Becherglases befestigt, das auf dem Dreifuß stehen bleibt. Wie zuvor wird alle 10sec die Reagenzglas und alle 30sec die Becherglas abgelesen und das jeweilige Aussehen des Stoffes im Reagenzglas und des Wassers im Becherglas beschrieben. Das Ablesen wird beendet, nachdem der Stoff im Reagenzglas vollständig erstarrt ist (bzw. bei Fixiersalz: wenn die Reagenzglas 35 C erreicht hat). Wenn das Reagenzglas mit Fixiersalz auf Zimmertemperatur abgekühlt ist, wird ein Körnchen Fixiersalz aus dem Vorratsgefäß hinzugegeben und Reagenzglas sowie Thermometer beobachtet. Um die Thermometer aus den Reagenzgläsern mit den wieder fest gewordenen Stoffen nehmen zu können, werden diese Reagenzgläser gesammelt in ein Becherglas mit kochendem Wasser gestellt, bis der Inhalt erneut geschmolzen ist. Die Thermometer werden dann mit saugfähigem Papier gründlich gereinigt. Die (beschrifteten) Reagenzgläser werden mit einem Gummistopfen verschlossen aufbewahrt. Zeichnungen:
2 Reagenzglas Reagenzglas Becherglas Becherglas (1min) (2min) (3min) (4min) (5min) (6min) (7min)
3 Reagenzglas Reagenzglas Becherglas Becherglas (8min) (9min) (10min) (11min) (12min) (13min) (14min) (15min)
4 Reagenzglas Reagenzglas Becherglas Becherglas
5 Die Tabellen-Daten werden graphisch dargestellt, indem sie (für Feststoff und Wasser verschieden farbig) auf mm-papier bzw. mm-folie in ein rechtwinkliges Diagramm übertragen werden: waagerechte x-achse (): 1mm = 10sec senkrechte y-achse (Temperatur): Nullpunkt: 10 C 10mm = 5 C Die jeweiligen Messpunkte bzw. kreuze werden untereinander zu einer Kurve verbunden. : a) Stearinsäure: Während der Aufheizphase steigt die Kurve anfänglich nur langsam, dann stetig an. Bei einer Temperatur von 71 C verläuft sie kurze parallel zur x-achse, um dann wieder stetig anzusteigen. In der Abkühlphase sinkt die Temperatur zunächst stetig. Bei einer Temperatur von 71 C verläuft sie wieder kurze parallel zur x-achse, um dann wieder stetig weiter zu fallen. b) Fixiersalz: Während der Aufheizphase steigt die Kurve anfänglich nur langsam, dann stetig an. Bei einer Temperatur von 45 C verläuft sie kurze parallel zur x-achse, um dann wieder stetig anzusteigen. In der Abkühlphase sinkt die Kurve langsam, ohne dass sie bei einer Temperatur von 45 C wieder kurze parallel zur x-achse verläuft. Auch bei Abkühlen bis auf Zimmertemperatur wird der Stoff nicht wieder fest, sondern bleibt flüssig. Bei Zugabe eines Kristall-Körnchens jedoch erstarrt das Fixiersalz sehr schnell, wobei gleichzeitig die Temperatur bis auf C steigt. c) Naphthalin: Während der Aufheizphase steigt die Kurve anfänglich nur langsam, dann stetig an. Bei einer Temperatur von 81 C verläuft sie kurze parallel zur x-achse, um dann wieder stetig anzusteigen. In der Abkühlphase sinkt die Kurve zunächst stetig. Bei einer Temperatur von 81 C verläuft sie wieder kurze parallel zur x-achse, um dann wieder stetig weiter zu fallen. Auswertung (= Mögliche Erklärung der ): Als Schmelztemperatur (SmT) wird die Temperatur festgelegt, bei der die Kurve im Temperatur--Diagramm während der Aufheizphase des Feststoffs parallel zur -Achse verläuft: SmT (Stearinsäure): 71 C SmT (Fixiersalz): 45 C SmT (Naphthalin): 81 C Trotz weiteren Erwärmens steigt die Temperatur nicht weiter an, weil die zugeführte (Wärme-) Energie zum vollständigen Schmelzen des Feststoffes benötigt wird. Als Erstarrungstemperatur wird die Temperatur festgelegt, bei der die Kurve im Temperatur- -Diagramm während der Abkühlphase der Flüssigkeit wieder parallel zur -Achse verläuft. Die Erstarrungstemperatur ist genauso groß wie die Schmelztemperatur, so dass vereinfachend nur letztere angegeben wird (auch für Stoffe, die bei Zimmertemperatur flüssig oder gasig sind). Fixiersalz zeigt die Besonderheit, dass es nach dem Schmelzen beim Abkühlen nicht ohne weiteres wieder erstarrt (sog. unterkühlte Flüssigkeit). Erst bei Zufügen eines "Kristallisationskeims" wird das flüssige Fixiersalz wieder fest, wobei die in der Flüssigkeit gespeicherte Energie wieder als Wärme abgegeben wird (vgl. praktische Anwendung in sog. "Handwärmern").
6 : d) Wasser: Während der Aufheizphase steigt die Kurve langsam, aber stetig an. Bei einer Temperatur von 100 C verläuft sie parallel zur x-achse, solange das Wasser "kocht". Auswertung (= Mögliche Erklärung der ): Als Siedetemperatur (SdT) wird die Temperatur festgelegt, bei der die Kurve im Temperatur- -Diagramm während der Aufheizphase der Flüssigkeit parallel zur -Achse verläuft. Trotz weiteren Erwärmens steigt die Temperatur nicht weiter an, weil die zugeführte (Wärme-) Energie zum vollständigen Verdampfen der Flüssigkeit benötigt wird: SdT (Wasser): 100 C Zusammenfassendes Ergebnis: Die Temperatur, bei der ein Feststoff durch Erwärmen zu einer Flüssigkeit wird, ist eine Stoffeigenschaft, die Schmelztemperatur (SmT). Trotz weiteren Erwärmens steigt die Temperatur während des Schmelzens nicht weiter an, weil die zugeführte (Wärme-)Energie zum vollständigen Schmelzen des Feststoffes benötigt wird. Die Temperatur, bei der eine Flüssigkeit durch Abkühlen zu einem Feststoff wird, nennt man Erstarrungstemperatur. Da Schmelztemperatur = Erstarrungstemperatur ist, gibt man auch für Stoffe, die bei Zimmertemperatur flüssig (oder gasig) sind, nur eine Schmelztemperatur an. Die Temperatur, bei der eine Flüssigkeit durch Erwärmen zu einem Gas wird, ist eine Stoffeigenschaft, die Siedetemperatur (SdT). Trotz weiteren Erwärmens steigt die Temperatur während des Siedens nicht weiter an, weil die zugeführte (Wärme-)Energie zum vollständigen Verdampfen der Flüssigkeit benötigt wird. Die Temperatur, bei der ein Gas durch Abkühlen zu einer Flüssigkeit wird, nennt man Kondensationstemperatur. Da Siedetemperatur = Kondensationstemperatur ist, gibt man auch für Stoffe, die bei Zimmertemperatur gasig (oder fest) sind, nur eine Siedetemperatur an. Anmerkungen zum Begriff "gasig": Der Begriff "gasig" mag ungewohnt erscheinen, ist meiner Meinung nach aber (nicht nur für Schüler) wesentlich besser als der weithin bekannte, aber irreführende Begriff "gasförmig", denn Gase besitzen nun mal keine Form. Auch in anderen Sprachen wird dieser irreführende Begriff nicht verwendet (z.b. englisch: gaseous / französisch: gazeux / spanisch: gaseoso).
7 2) Siedetemperatur von feuergefährlichen Flüssigkeiten: Chemikalien: Geräte: Ethanol (Hauptbestandteil von Spiritus) Aceton (Hauptbestandteil mancher Nagellackentferner) Ethylacetat (Lösemittel für Klebstoffe, z.b. Uhu, Pattex ) Glycerin (Gleitmittel für Glas in Gummi) 50ml-Weithals-Erlenmeyerkolben, doppelt durchbohrter Gummistopfen, ca. 40cm langes Glasrohr mit etwas Eisenwolle im oberen Ende, Thermometer (Bereich C), Stativmaterial (Stativ mit Klemme und Muffe), Siedesteinchen, Dreifuß mit Keramikdrahtnetz, 250ml-Becherglas mit etwa 150ml Wasser und 2 Siedesteinchen, Gasbrenner, Streichhölzer, Stoppuhr Versuchsdurchführung: In den Erlenmeyerkolben werden etwa 20ml Flüssigkeit sowie 2 Siedesteinchen gegeben. In den Gummistopfen werden mit Hilfe von 1-2Tropfen Glycerin von oben her vorsichtig das Glasrohr und das Thermometer eingeführt. Dabei soll das Glasrohr nur eben aus dem Stopfen herauskommen, das Thermometer hingegen etwa 1cm oberhalb des Erlenmeyerkolben-Bodens enden. Die Apparatur wird am Stativ befestigt und in das auf dem Dreifuß stehende Becherglas mit Wasser getaucht, so dass der Wasserstand im Becherglas etwa 1fingerbreit höher ist als der Flüssigkeitsstand im Erlenmeyerkolben. Der Gasbrenner wird entzündet, die Arbeitsflamme eingestellt und mit Hilfe der Gasregulierungsschraube so geregelt, dass sie eben ans Keramikdrahtnetz reicht. Beim Drunterstellen des Gasbrenners wird die Stoppuhr gestartet und sofort die Erlenmeyerkolben abgelesen und in einer Tabelle notiert. Dann wird weiterhin alle 15sec die Erlenmeyerkolben abgelesen und das jeweilige Aussehen des Stoffes beschrieben. Wenn die Flüssigkeit zu sieden beginnt, wird zusätzlich das Steigrohr beobachtet und alle 15sec ein brennendes Streichholz an das obere Ende gehalten. Wenn sich kaum noch Flüssigkeit im Erlenmeyerkolben befindet bzw. die Flamme endgültig erlischt, lässt man das Wasser noch 4min lang deutlich kochen und liest weiterhin alle 15sec die Temperatur ab. Dann wird der Brenner ausgestellt und die Apparatur zur Abkühlung etwa 1handbreit oberhalb des Becherglases befestigt, das auf dem Dreifuß stehen bleibt. Alternativ kann wie in Versuch a alle 30sec auch die Temperatur des Wassers im Becherglas mit einem Thermometer gemessen und notiert werden. Die Tabellen-Daten werden graphisch dargestellt, indem sie (ggf. für Wasser verschieden farbig) auf mm- Papier bzw. mm-folie in ein rechtwinkliges Diagramm übertragen werden: waagerechte x-achse (): 1mm = 15sec senkrechte y-achse (Temp.): 10mm = 5 C Nullpunkt: 10 C Die jeweiligen Messpunkte bzw. kreuze werden untereinander zu einer Kurve verbunden. Zeichnungen:
8 Erlenmeyerkolben Erlenmeyerkolben Evtl.: Temperatur im Becherglas (1min) (2min) (3min) (4min) (5min) (6min) (7min) (8min) (9min) (10min)
9 Erlenmeyerkolben Erlenmeyerkolben Evtl.: Becherglas (11min) (12min) (13min) (14min) (15min) (16min) (17min) (18min) (19min) (20min)
10 Erlenmeyerkolben Erlenmeyerkolben Evtl.: Temperatur im Becherglas
11 : Während der Aufheizphase steigt die Kurve anfänglich langsam, dann stetig an, bis die Flüssigkeiten deutlich sieden. Dann verläuft die Kurve parallel zur x- Achse. Wenn alle Flüssigkeit verdampft ist, steigt sie wieder weiter an. Im Glasrohr sieht man eine langsam nach oben steigende ("wallende") kleine Zone Flüssigkeit. Kurz bevor diese Zone das obere Ende das Glasrohrs erreicht, bildet sich beim Entzünden eine Flamme. Auswertung (= Mögliche Erklärung der ): Als Siedetemperatur (SdT) wird die Temperatur festgelegt, bei der die Kurve im Temperatur- -Diagramm während der Aufheizphase der Flüssigkeit parallel zur -Achse verläuft: SdT (Ethanol): 78 C SdT (Aceton): 56 C SdT (Ethylacetat): 77 C Auch wenn das Thermometer nicht mehr in die siedende Flüssigkeit ragt, steigt trotz weiteren Erwärmens die Temperatur nicht weiter an, weil die zugeführte (Wärme-)Energie zum vollständigen Verdampfen der Flüssigkeit benötigt wird. Erst wenn die Flüssigkeit vollständig verdampft ist, kann die Temperatur des Dampfes weiter steigen. Der Dampf (= das Gas) der siedenden Flüssigkeit kondensiert teilweise wieder an den etwas kälteren Wänden des Glasrohrs in Form eines sog. "Siede-Krönchens" (Kondensationstemperatur = Siedetemperatur). Diese Zone verschiebt sich weiter nach oben, da von unten heiße Dämpfe nachströmen. Erreichen brennbare Dämpfe das obere Ende des Glasrohres, so lassen sie sich entzünden und brennen mit einer (je nach Dampfnachschub mehr oder weniger großen) Flamme. Der kleine Büschel Eisenwolle soll sicherheitshalber als sog Rückschlagsicherung ein Zurückschlagen der Flamme in den Erlenmeyerkolben-Bereich verhindern, was möglich wäre, falls sich dort noch Luft (und damit auch Sauerstoff) befinden sollte. Zusammenfassendes Ergebnis: Die Temperatur, bei der eine Flüssigkeit durch Erwärmen zu einem Gas wird, ist eine Stoffeigenschaft, die Siedetemperatur (SdT). Die Temperatur, bei der ein Gas durch Abkühlen zu einer Flüssigkeit wird, nennt man Kondensationstemperatur. Da Siedetemperatur = Kondensationstemperatur ist, gibt man auch für Stoffe, die bei Zimmertemperatur gasig (oder fest) sind, nur eine Siedetemperatur an. Trotz weiteren Erwärmens steigt die Temperatur nicht weiter an, weil die zugeführte (Wärme-) Energie zum vollständigen Verdampfen der Flüssigkeit benötigt wird.
12 3) Eis Wasser Wasserdampf??!!: - Schmelz- und Siedetemperatur von Wasser: Chemikalien: Geräte: Eiswürfel (bzw. "crushed-ice"-beutel), (dest.) Wasser Tiefkühlschrank, Hammer, Abtrockentuch, 400ml-Becherglas, Dreifuß mit Keramikdrahtnetz, Thermometer (Bereich 20 bis +110 C), Gasbrenner, Streichhölzer, Stoppuhr, Leder-Arbeitshandschuh, Bierdeckel Versuchsdurchführung: Das 400ml-Becherglas wird gut zur Hälfte mit Eis gefüllt, das in ein Abtrockentuch gewickelt mit einem Hammer gut zerkleinert worden ist (bzw. direkt als "crushed ice" einem Eisbeutel entnommen wird) und auf den Dreifuß mit Keramikdrahtnetz gestellt. Man liest sofort die Temperatur ab, danach alle 15sec, wobei durchgängig mit dem Thermometer vorsichtig gerührt wird. Nach 2min wird der Gasbrenner mit eingestellter Arbeitsflamme unter den Dreifuß gestellt. Ohne Unterbrechung wird gerührt und weiterhin alle 15sec die Temperatur gemessen (Hand ggf. mit Lederhandschuh vor Wärme schützen). Wenn das Wasser 4min lang kräftig siedet, wird die Temperaturmessung beendet. Man beobachtet den Bereich direkt über der Flüssigkeit und am oberen Rand des Becherglases. Dann wird der Brenner ausgestellt und das Becherglas zum Abkühlen vorsichtig auf einem Bierdeckel abgestellt. Die Tabellen-Daten werden graphisch dargestellt, indem sie auf mm-papier bzw. mm-folie in ein rechtwinkliges Diagramm übertragen werden: waagerechte x-achse (): 1mm = 15sec senkrechte y-achse (Temp.): 10mm = 5 C Nullpunkt: -10 C Die jeweiligen Messpunkte bzw. kreuze werden untereinander zu einer Kurve verbunden. Evtl. Zusatzversuch: Etwa 20ml Wasser und 2 Siedesteinchen in einem 100ml-Erlenmeyerkolben mit einfach durchbohrtem Gummistopfen und etwa 10cm langem Glasrohr auf Dreifuß mit Keramikdrahtnetz stehend am Stativ befestigen und mit der rauschenden Brennerflamme erhitzen. Wenn das Wasser kräftig siedet, den Bereich am oberen Ende des Glasrohres genau beobachten. Dann Gasbrenner ausstellen und Apparatur abkühlen lassen. Zeichnungen:
13 (1min) (2min) (3min) (4min) (5min) (6min) (7min) (8min) (9min) (10min) Temperatur im Becherglas Aussehen im Becherglas
14 (11min) (12min) (13min) (14min) (15min) (16min) (17min) (18min) (19min) (20min) Temperatur im Becherglas Aussehen im Becherglas
15 Temperatur im Becherglas Aussehen im Becherglas
16 : Wird die Temperatur des Eises unmittelbar nach Entnahme aus dem Tiefkühlschrank gemessen, stellt man ca. 15 bis 10 C fest. Danach steigt die Temperatur auf ca. 0 C und bleibt (auch beim Erwärmen mit dem Gasbrenner) solange unverändert, wie neben flüssigem Wasser noch Eis vorhanden ist. Erst wenn alles Eis geschmolzen ist, steigt die Temperatur weiter an. Wenn das Wasser kräftig siedet, liegt die Temperatur bei ca. 100 C und steigt trotz weiteren Erwärmens nicht mehr an. Direkt über der Flüssigkeit ist nichts zu sehen. Am oberen Rand des Becherglases sieht man nebelartige Schwaden. Auch beim Zusatzversuch ist direkt an der oberen Öffnung des Glasrohres nichts zusehen, wohl aber nebelartige Schwaden etwa 1fingerbreit oberhalb der Öffnung. Auswertung (= Mögliche Erklärung der ): Als Schmelztemperatur (SmT) wird die Temperatur festgelegt, bei der die Kurve im Temperatur--Diagramm während der Aufheizphase des Feststoffes parallel zur -Achse verläuft: SmT (Wasser): 0 C Trotz Erwärmens steigt die Temperatur zunächst nicht weiter an, weil die zugeführte (Wärme-)Energie zum vollständigen Schmelzen des Feststoffes benötigt wird. Erst wenn der Feststoff vollständig geschmolzen ist, führt die weiterhin aufgenommene (Wärme-)Energie zu einer Temperaturerhöhung der Flüssigkeit. Als Siedetemperatur (SdT) wird die Temperatur festgelegt, bei der die Kurve im Temperatur- -Diagramm während der Aufheizphase der Flüssigkeit parallel zur -Achse verläuft: SdT (Wasser): 100 C Trotz Erwärmens steigt die Temperatur nicht weiter an, weil die zugeführte (Wärme-)Energie zum vollständigen Verdampfen der Flüssigkeit benötigt wird. Das gasig gewordene Wasser (= Wasserdampf) ist farblos und (wie alle Gase) durchsichtig. Erst wenn der Dampf in den etwas kälteren Bereichen oberhalb der Öffnung zu kleinen Wassertröpfchen kondensiert, sind diese Tröpfchen feinverteilt in der Luft als sog. Nebel zu erkennen. Zusammenfassendes Ergebnis: Das tiefgefrorene Wasser (= der Feststoff Eis) schmilzt (trotz weiteren Erwärmens) bei einer konstant bleibenden Temperatur von 0 C: SmT (Wasser) = 0 C Erst wenn der gesamte Feststoff geschmolzen ist, steigt beim Erwärmen die Temperatur der Flüssigkeit weiter an, bis das Wasser schließlich (trotz weiteren Erwärmens) bei einer konstant bleibenden Temperatur von 100 C siedet, also gasig wird: SdT (Wasser) = 100 C Als Dampf bezeichnet man gasig gewordene Stoffe, die bei Zimmertemperatur (20 C) fest oder flüssig sind. Gasiges Wasser (= Wasserdampf) ist farblos und durchsichtig und damit (wie Luft) nicht sichtbar (vgl. Luftfeuchtigkeit = Wasserdampf in der Luft oder Atemfeuchtigkeit = Wasserdampf in der ausgeatmeten Luft). Erst wenn das gasige Wasser wieder kondensiert, sind die in der Luft fein verteilten Tröpfchen von flüssigem Wasser, der sog. Nebel, wieder sichtbar (vgl. Atemhauch in kalter Luft bzw. an kalter Glasscheibe oder Wolken über Kühltürmen).
Fachhochschule Flensburg. Institut für Physik
 Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser
 HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
Anregungen zum experimentellen Arbeiten. Fehling-Lab. Zusammengestellt von Peter Dünschede, Stuttgart peter.duenschede@t-online.de
 1 Anregungen zum experimentellen Arbeiten Zusammengestellt von Peter Dünschede, Stuttgart peter.duenschede@t-online.de 2 Wärme verändert Das Thema ist sehr auf den Alltag der bezogen und kann deswegen
1 Anregungen zum experimentellen Arbeiten Zusammengestellt von Peter Dünschede, Stuttgart peter.duenschede@t-online.de 2 Wärme verändert Das Thema ist sehr auf den Alltag der bezogen und kann deswegen
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Europäischer Chemielehrerkongress Leoben Österreich im April 2007
 Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Chemie (in) der Extra_Klasse: Erneuerbare Energien Mein ipod läuft mit Kuhmist!
 Unterrichts- und Lernmaterialien geprüft vom PARSEL-Konsortium im Rahmen des EC FP6 geförderten Projekts: SAS6-CT-2006-042922-PARSEL Kooperierende Institutionen und Universitäten des PARSEL-Projekts: Anregungen
Unterrichts- und Lernmaterialien geprüft vom PARSEL-Konsortium im Rahmen des EC FP6 geförderten Projekts: SAS6-CT-2006-042922-PARSEL Kooperierende Institutionen und Universitäten des PARSEL-Projekts: Anregungen
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente
 350³ - 1-350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente An fünf Stationen führen die Schüler einfache Experimente aus uns
350³ - 1-350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente An fünf Stationen führen die Schüler einfache Experimente aus uns
Verbrennung von Eisenwolle und Holz
 Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Siede- und Schmelztemperatur
 Schulversuchspraktikum Name: Anna Elisabeth Gulyas Semester: Sommersemester 2013 Klassenstufen 5 & 6 Siede- und Schmelztemperatur Auf einen Blick: In dieser Unterrichtseinheit lernen die SuS Siede- und
Schulversuchspraktikum Name: Anna Elisabeth Gulyas Semester: Sommersemester 2013 Klassenstufen 5 & 6 Siede- und Schmelztemperatur Auf einen Blick: In dieser Unterrichtseinheit lernen die SuS Siede- und
3.3 Entparaffinierung durch Extraktion. Aufbau. Gefahren. Aufbau. Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl
 Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Lernzirkel WAS Station 1 Herstellung von Seife aus Kokosfett
 Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Die vorliegenden Arbeitsblätter enthalten vor allem experimentelle Zugänge zum Projektthema.
 Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
Versuch Nr. 7. = q + p dv
 Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Aufgabe: Erkläre folgende Tatsache mit Hilfe des Teilchenmodells! An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen.
 An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
Stoffe / Gemische / Wasser
 CorEx ier-gerätesatz (SEG) Chemie I e / Gemische / Wasser ier-gerätesatz (SEG) Chemie I Bestellnummer 94100 en: 1 e und ihre Eigenschaften... 1 Versuch 1.1: Aussehen... 1 Versuch 1.2: Löslichkeit in Wasser...
CorEx ier-gerätesatz (SEG) Chemie I e / Gemische / Wasser ier-gerätesatz (SEG) Chemie I Bestellnummer 94100 en: 1 e und ihre Eigenschaften... 1 Versuch 1.1: Aussehen... 1 Versuch 1.2: Löslichkeit in Wasser...
Luft / Verbrennung / Redoxreaktionen
 CorEx ier-gerätesatz (SEG) Chemie II Luft / Verbrennung / Redoxreaktionen ier-gerätesatz (SEG) Chemie II Bestellnummer 94200 en: 1 Luft...1 Versuch 1.1: Luft braucht Raum (1)...1 Versuch 1.2: Luft braucht
CorEx ier-gerätesatz (SEG) Chemie II Luft / Verbrennung / Redoxreaktionen ier-gerätesatz (SEG) Chemie II Bestellnummer 94200 en: 1 Luft...1 Versuch 1.1: Luft braucht Raum (1)...1 Versuch 1.2: Luft braucht
EINE KERZE INTERPRETATIONEN BEOBACHTUNGEN FLAMME REAKTIONEN WACHS DOCHT GASE. Reaktionsgleichungen Prozesse. Theorien
 Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Besitzen andere Kohlenwasserstoffe ähnliche Eigenschaften wie Methan?
 Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Welcher Unterschied besteht zwischen schwefliger Säure und Schwefelsäure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemische Grundlagen und Handgriffe
 Chemische Grundlagen und Handgriffe Beim chemischen Arbeiten gibt es viele spezielle Werkzeuge und Handgriffe. Drei davon wollen wir zu Beginn besonders gut erlernen. Es sind: das Heizen mit dem Gasbrenner
Chemische Grundlagen und Handgriffe Beim chemischen Arbeiten gibt es viele spezielle Werkzeuge und Handgriffe. Drei davon wollen wir zu Beginn besonders gut erlernen. Es sind: das Heizen mit dem Gasbrenner
1. Sicheres Experimentieren
 1. Sicheres Experimentieren Versuchsanleitung vor der Stunde sorgfältig lesen, allfällige Fragen und Unklarheiten notieren. Genau nach Anweisung arbeiten und nur die vorgeschriebenen Arbeiten durchführen.
1. Sicheres Experimentieren Versuchsanleitung vor der Stunde sorgfältig lesen, allfällige Fragen und Unklarheiten notieren. Genau nach Anweisung arbeiten und nur die vorgeschriebenen Arbeiten durchführen.
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen
 Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
1. Skizzieren Sie, wie man in der Hauptschule die Aggregatzustände mit Hilfe eines Teilchenmodells deutet.
 Universität: Julius-Maximilians-Universität Würzburg Seminar: Klausurübung Fachdidaktik Physik Dozent: Dr. Thomas Wilhelm Referentin: Dorothée Berthold Datum: 2.12.2009 (WS 2009/10) FÄCHERGRUPPE DER HAUPTSCHULE
Universität: Julius-Maximilians-Universität Würzburg Seminar: Klausurübung Fachdidaktik Physik Dozent: Dr. Thomas Wilhelm Referentin: Dorothée Berthold Datum: 2.12.2009 (WS 2009/10) FÄCHERGRUPPE DER HAUPTSCHULE
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Schulversuchspraktikum. 5. Protokoll. Wärmelehre. (2. und 3. Klasse Unterstufe) Dana Eva Ernst 9955579
 Schulversuchspraktikum 5. Protokoll Wärmelehre (2. und 3. Klasse Unterstufe) Dana Eva Ernst 9955579 Linz, am 8.1.2003 Inhaltsverzeichnis Kapitel I - Thema und Ziele 3 Kapitel II - Grundlagen 2.1. Das Thermometer
Schulversuchspraktikum 5. Protokoll Wärmelehre (2. und 3. Klasse Unterstufe) Dana Eva Ernst 9955579 Linz, am 8.1.2003 Inhaltsverzeichnis Kapitel I - Thema und Ziele 3 Kapitel II - Grundlagen 2.1. Das Thermometer
Stoffkreisläufe: O 2 /CO 2 -Kreislauf - Versuche zu Atmung und CO 2 -
 Experimente zum Thema Stoffkreisläufe: O 2 /CO 2 -Kreislauf - Versuche zu Atmung und CO 2 - Projekttitel: Nachhaltige Chemie im Agnes-Pockels-SchülerInnen- Labor Neue pädagogische Angebote zu Stoffkreisläufen
Experimente zum Thema Stoffkreisläufe: O 2 /CO 2 -Kreislauf - Versuche zu Atmung und CO 2 - Projekttitel: Nachhaltige Chemie im Agnes-Pockels-SchülerInnen- Labor Neue pädagogische Angebote zu Stoffkreisläufen
Physikalisches Grundpraktikum Taupunktmessung. Taupunktmessung
 Aufgabenstellung: 1. Bestimmen Sie den Taupunkt. Berechnen Sie daraus die absolute und relative Luftfeuchtigkeit. 2. Schätzen Sie die Messunsicherheit ab! Stichworte zur Vorbereitung: Temperaturmessung,
Aufgabenstellung: 1. Bestimmen Sie den Taupunkt. Berechnen Sie daraus die absolute und relative Luftfeuchtigkeit. 2. Schätzen Sie die Messunsicherheit ab! Stichworte zur Vorbereitung: Temperaturmessung,
Sekundarschule Kilchberg / Curdin Riedi
 Sekundarschule Kilchberg / Curdin Riedi Inhaltsverzeichnis 1. Einführung... 3 2. Laborarbeit... 4 2.1 Laborregeln/Verhalten beim Experimentieren... 4 2.2 Gefahrensymbole... 6 3. Vertrag «Verhaltensregeln»...
Sekundarschule Kilchberg / Curdin Riedi Inhaltsverzeichnis 1. Einführung... 3 2. Laborarbeit... 4 2.1 Laborregeln/Verhalten beim Experimentieren... 4 2.2 Gefahrensymbole... 6 3. Vertrag «Verhaltensregeln»...
zum Experimentalvortrag
 ersuchsanleitungen en Ve rs uc h sanl e itu ng zum Experimentalvortrag Das chemische Potenzial als Einstieg in die Thermodynamik Regina Rüffler, Georg Job 22. Tagung der Fachgruppe Chemieunterricht, Jena,
ersuchsanleitungen en Ve rs uc h sanl e itu ng zum Experimentalvortrag Das chemische Potenzial als Einstieg in die Thermodynamik Regina Rüffler, Georg Job 22. Tagung der Fachgruppe Chemieunterricht, Jena,
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und heoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2. Das Gasgesetz von Gay-Lussac hema In diesem ersuch soll das erhalten von Gasen bei Erwärmung unter
Institut für Physikalische und heoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2. Das Gasgesetz von Gay-Lussac hema In diesem ersuch soll das erhalten von Gasen bei Erwärmung unter
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Versuche zur Kontrolle des Erlernten
 Versuche zur Kontrolle des Erlernten Kontrollexperiment 1: Flüssigkeitsheber Trinkröhrchen 2 Wassergläser Wasser Tinte zum Färben Kontrollexperiment 2: Das zweite Loch im Tetrapack bzw. Milchdöschen kleiner
Versuche zur Kontrolle des Erlernten Kontrollexperiment 1: Flüssigkeitsheber Trinkröhrchen 2 Wassergläser Wasser Tinte zum Färben Kontrollexperiment 2: Das zweite Loch im Tetrapack bzw. Milchdöschen kleiner
Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein!
 Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein! Station 1: Gase im Vergleich E1 Auffangen von Luft durch Wasserverdrängung E2 Ein Gas aus Brausetabletten und Backpulver E3 Spanprobe
Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein! Station 1: Gase im Vergleich E1 Auffangen von Luft durch Wasserverdrängung E2 Ein Gas aus Brausetabletten und Backpulver E3 Spanprobe
Versuch 22. Luftfeuchtigkeit
 Versuch 22 Luftfeuchtigkeit 1 1 Grundlagen Infolge der Verdunstung an der freien Wasseroberfläche der Erde hat die Atmosphäre immer einen gewissen Feuchtigkeitsgehalt. Diese Feuchtigkeit wird gemessen
Versuch 22 Luftfeuchtigkeit 1 1 Grundlagen Infolge der Verdunstung an der freien Wasseroberfläche der Erde hat die Atmosphäre immer einen gewissen Feuchtigkeitsgehalt. Diese Feuchtigkeit wird gemessen
Alltäglichen Phänomenen auf der Spur VS Tobadill
 Feuer und Luft Alltäglichen Phänomenen auf der Spur VS Tobadill 2 INHALTSVERZEICHNIS 1. EINLEITUNG 4 2. METHODEN UND VORGEHENSWEISE 4 3. BEISPIELE VON EXPERIMENTEN AUS UNSERER FORSCHUNG 5 ZWEI GUMMIBÄRCHEN
Feuer und Luft Alltäglichen Phänomenen auf der Spur VS Tobadill 2 INHALTSVERZEICHNIS 1. EINLEITUNG 4 2. METHODEN UND VORGEHENSWEISE 4 3. BEISPIELE VON EXPERIMENTEN AUS UNSERER FORSCHUNG 5 ZWEI GUMMIBÄRCHEN
Lösungen zu den Zusatzübungen zur Physik für Ingenieure (Maschinenbau) (WS 13/14)
 Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Warum ist Feuer nützlich und warum sind Flammen heiß?
 Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Die Heizungsanlage eines Hauses wird auf Ölfeuerung umgestellt. Gleichzeitig wird mit dieser Anlage Warmwasser aufbereitet.
 Übungsaufgaben zur Wärmelehre mit Lösungen 1) Die Heizungsanlage eines Hauses wird auf Ölfeuerung umgestellt. Gleichzeitig wird mit dieser Anlage Warmwasser aufbereitet. Berechnen Sie die Wärme, die erforderlich
Übungsaufgaben zur Wärmelehre mit Lösungen 1) Die Heizungsanlage eines Hauses wird auf Ölfeuerung umgestellt. Gleichzeitig wird mit dieser Anlage Warmwasser aufbereitet. Berechnen Sie die Wärme, die erforderlich
2 Erste Arbeitstechniken
 2 Erste Arbeitstechniken 1. Halbtag 2.1 Das Arbeiten mit dem Gasbrenner Zur Wärmeerzeugung werden im Chemielabor neben elektrischen Heizgeräten Brenner für Erdgas (Methan) verwendet. Methan verbrennt bei
2 Erste Arbeitstechniken 1. Halbtag 2.1 Das Arbeiten mit dem Gasbrenner Zur Wärmeerzeugung werden im Chemielabor neben elektrischen Heizgeräten Brenner für Erdgas (Methan) verwendet. Methan verbrennt bei
1.9 Darstellung und Eigenschaften von schwefliger Säure. Aufgabe. Welche Eigenschaften besitzt schweflige Säure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
4.2 Reaktion von Kupfer und Schwefel. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (2)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Dichteanomalie von Wasser
 Prinzip Die Veränderung der Dichte von Wasser bei Änderung der Temperatur lässt sich mit einfachen Mitteln messen. Dazu wird die Volumenänderung in Abhängigkeit von der Temperatur gemessen. Die Daten werden
Prinzip Die Veränderung der Dichte von Wasser bei Änderung der Temperatur lässt sich mit einfachen Mitteln messen. Dazu wird die Volumenänderung in Abhängigkeit von der Temperatur gemessen. Die Daten werden
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Klexse- Experimente erprobt von Manfred Martin und Bernd Setzer
 Klexse- Experimente Im Kapitel Wasser und andere Flüssigkeiten werden einige Experimente beschrieben, durch die man manches über flüssige Körper die Oberflächenspannung die Zähigkeit von Flüssigkeiten
Klexse- Experimente Im Kapitel Wasser und andere Flüssigkeiten werden einige Experimente beschrieben, durch die man manches über flüssige Körper die Oberflächenspannung die Zähigkeit von Flüssigkeiten
Welche Eigenschaften hat die in Haushaltsreinigern verwendete Lauge?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758750) 2.3 Ammoniak - Vergleich von Gas und wässrige Lösung Experiment von: Phywe Gedruckt: 5.0.203 :56:44 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758750) 2.3 Ammoniak - Vergleich von Gas und wässrige Lösung Experiment von: Phywe Gedruckt: 5.0.203 :56:44 intertess (Version 3.06 B200,
WASSER. Station 1. com. N Arbeitsblatt
 Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
Nachhaltige Chemie im Agnes-Pockels-SchülerInnen- Labor Neue pädagogische Angebote zu Stoffkreisläufen und Ressourcenschonung
 Experimente zum Thema Stoffkreisläufe: O 2 /CO 2 -Kreislauf - Fotosynthese - Projekttitel: Nachhaltige Chemie im Agnes-Pockels-SchülerInnen- Labor Neue pädagogische Angebote zu Stoffkreisläufen und Ressourcenschonung
Experimente zum Thema Stoffkreisläufe: O 2 /CO 2 -Kreislauf - Fotosynthese - Projekttitel: Nachhaltige Chemie im Agnes-Pockels-SchülerInnen- Labor Neue pädagogische Angebote zu Stoffkreisläufen und Ressourcenschonung
Welcher Unterschied besteht zwischen schwefliger Säure und Schwefelsäure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :47:54 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :47:54 intertess (Version 3.06 B200, Export 2000) Aufgabe
Die Schlange des Pharao
 Name: Datum: Materialien: 1 Brausetablette (mit Zucker), Vogelsand, Tropffläschchen mit Ethanol, lange Streichhölzer, feuerfeste Unterlage (z.b. Untertasse oder Porzellanschale), Gefäß mit Wasser Sicherheitshinweis:
Name: Datum: Materialien: 1 Brausetablette (mit Zucker), Vogelsand, Tropffläschchen mit Ethanol, lange Streichhölzer, feuerfeste Unterlage (z.b. Untertasse oder Porzellanschale), Gefäß mit Wasser Sicherheitshinweis:
Wie funktioniert ein Heißluftballon? Einen Mini-Heißluftballon aufsteigen lassen
 Wie funktioniert ein Heißluftballon? Einen Mini-Heißluftballon aufsteigen lassen In aller Kürze Hast du schon mal einen Heißluftballon am Himmel beobachtet? Wie kommt es eigentlich, dass er fliegen kann?
Wie funktioniert ein Heißluftballon? Einen Mini-Heißluftballon aufsteigen lassen In aller Kürze Hast du schon mal einen Heißluftballon am Himmel beobachtet? Wie kommt es eigentlich, dass er fliegen kann?
VERDAMPFUNGSGLEICHGEWICHTE: SIEDEDIAGRAMM EINER BINÄREN MISCHUNG
 VERDAMPFUNGSGLEICHGEWICHTE: RAMM EINER BINÄREN MISCHUNG 1. Lernziel Ziel des Versuchs ist es, ein zu bestimmen, um ein besseres Verständnis für Verdampfungsgleichgewichte und Mischeigenschaften flüssiger
VERDAMPFUNGSGLEICHGEWICHTE: RAMM EINER BINÄREN MISCHUNG 1. Lernziel Ziel des Versuchs ist es, ein zu bestimmen, um ein besseres Verständnis für Verdampfungsgleichgewichte und Mischeigenschaften flüssiger
Wie lässt sich Stickstoff gewinnen, welche Eigenschaften hat er?
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P753800) 2.6 Stickstoff - Darstellung und Eigenschaften Experiment von: P753900D Gedruckt: 24.03.204 0:54:2 intertess (Version
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P753800) 2.6 Stickstoff - Darstellung und Eigenschaften Experiment von: P753900D Gedruckt: 24.03.204 0:54:2 intertess (Version
Veranstaltung 5: Chemie macht hungrig!
 Veranstaltung 5: Chemie macht hungrig! Station 1: Kohlenhydrate E1 Gummibärchen gehen baden! E2 Ist Zucker gleich Zucker? E3 Was macht eine Kartoffel stark? Station 2: Fette E4 Können Fette verschwinden?
Veranstaltung 5: Chemie macht hungrig! Station 1: Kohlenhydrate E1 Gummibärchen gehen baden! E2 Ist Zucker gleich Zucker? E3 Was macht eine Kartoffel stark? Station 2: Fette E4 Können Fette verschwinden?
Bestimmung der Dichte und der Molmasse von Flüssiggas
 Experimente zum Thema Kohlenwasserstoffe Bestimmung der Dichte und der Molmasse von Flüssiggas Messzylinder (500 ml), Wasserwanne, Analysenwaage (0,01 g, besser 0,001 g), Gummischlauch, gewinkeltes Glasrohr,
Experimente zum Thema Kohlenwasserstoffe Bestimmung der Dichte und der Molmasse von Flüssiggas Messzylinder (500 ml), Wasserwanne, Analysenwaage (0,01 g, besser 0,001 g), Gummischlauch, gewinkeltes Glasrohr,
Station 1: Säuren in Lebensmitteln (1)
 Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Fest flüssig - gasförmig
 Auflistung der einzelnen Versuche Luft drücken Luftströme Der schwebende Ball Feuerlöscher Gesalzenes Eis Einzelne Versuche, die zu diesem Themenkomplex passen finden sich auch unter Versuche mit Wasser
Auflistung der einzelnen Versuche Luft drücken Luftströme Der schwebende Ball Feuerlöscher Gesalzenes Eis Einzelne Versuche, die zu diesem Themenkomplex passen finden sich auch unter Versuche mit Wasser
Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse
 Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
8.3 Seifenwirkung. Aufgabe. Wie lassen sich Eigenschaften der Seifen erklären? Naturwissenschaften - Chemie - Organische Chemie - 8 Seifen
 Naturwissenschaften - Chemie - Organische Chemie - 8 Seifen (P773500) 8.3 Seifenwirkung Experiment von: Anouch Gedruckt: 25.02.204 4:26:06 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lassen
Naturwissenschaften - Chemie - Organische Chemie - 8 Seifen (P773500) 8.3 Seifenwirkung Experiment von: Anouch Gedruckt: 25.02.204 4:26:06 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lassen
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #12 10/11/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Konvektion Verbunden mit Materietransport Ursache: Temperaturabhängigkeit der Dichte In Festkörpern
Physik für Mediziner im 1. Fachsemester #12 10/11/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Konvektion Verbunden mit Materietransport Ursache: Temperaturabhängigkeit der Dichte In Festkörpern
Marco Kröpfl, Doris Wagner 1
 Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Arbeitsblatt Wasserkreislauf der Erde
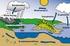 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Flüssigkeiten. einige wichtige Eigenschaften
 Flüssigkeiten einige wichtige Eigenschaften Die Oberflächenspannung einer Flüssigkeit ist die zur Vergröß ößerung der Oberfläche um den Einheitsbetrag erforderliche Energie (H 2 O bei 20 C: 7.29 10-2 J/m
Flüssigkeiten einige wichtige Eigenschaften Die Oberflächenspannung einer Flüssigkeit ist die zur Vergröß ößerung der Oberfläche um den Einheitsbetrag erforderliche Energie (H 2 O bei 20 C: 7.29 10-2 J/m
ENT 8.1. Erwärmen von Wasser mit einer Parabolrinne
 Erwärmen von Wasser mit einer Parabolrinne ENT Schlüsselworte Sonnenenrgie, Parabolspiegel, Brennpunkt Parabolrinnen-Kraftwerk, Absorption, Reflexion Kaltes Wasser Prinzip Parabolspiegel bündeln das Licht
Erwärmen von Wasser mit einer Parabolrinne ENT Schlüsselworte Sonnenenrgie, Parabolspiegel, Brennpunkt Parabolrinnen-Kraftwerk, Absorption, Reflexion Kaltes Wasser Prinzip Parabolspiegel bündeln das Licht
Auf welche Eigenschaften lassen sich Kunststoffe untersuchen? (5)
 Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780800) 3.5 Kunststoffeigenschaften (5) - Bestimmung des Schmelzbereiches Experiment von: Seb Gedruckt: 02.04.204
Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780800) 3.5 Kunststoffeigenschaften (5) - Bestimmung des Schmelzbereiches Experiment von: Seb Gedruckt: 02.04.204
Versuch: Siedediagramm eines binären Gemisches
 Versuch: Siedediagramm eines binären Gemisches Aufgaben - Kalibriermessungen Bestimmen Sie experimentell den Brechungsindex einer gegebenen Mischung bei unterschiedlicher Zusammensetzung. - Theoretische
Versuch: Siedediagramm eines binären Gemisches Aufgaben - Kalibriermessungen Bestimmen Sie experimentell den Brechungsindex einer gegebenen Mischung bei unterschiedlicher Zusammensetzung. - Theoretische
Versuch V1 - Viskosität, Flammpunkt, Dichte
 Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden!
 Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden! Verhaltensregeln für alle Experimente: - Lange Haare müssen zusammengebunden werden - Tragen von Tüchern
Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden! Verhaltensregeln für alle Experimente: - Lange Haare müssen zusammengebunden werden - Tragen von Tüchern
Abiotische Faktoren des Wassers: Anomalie und Oberflächenspannung
 Staatliches Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Fach: Biologie - Feuer, Erde, Luft und Wasser - Abiotische Faktoren des Wassers: Anomalie und Oberflächenspannung Erarbeitet von: Jennifer
Staatliches Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Fach: Biologie - Feuer, Erde, Luft und Wasser - Abiotische Faktoren des Wassers: Anomalie und Oberflächenspannung Erarbeitet von: Jennifer
Herstellung von Acetylsalicylsäure (Aspirin) Von Anne Stahl, Catarina Schmidt, Eugenia Friesen, Jennifer Aschenbrenner, Julia Holzapfel
 Herstellung von Acetylsalicylsäure (Aspirin) Von Anne Stahl, Catarina Schmidt, Eugenia Friesen, Jennifer Aschenbrenner, Julia Holzapfel Inhaltsverzeichnis 1.Versuchsbeschreibung 2. Die Geschichte der ASS
Herstellung von Acetylsalicylsäure (Aspirin) Von Anne Stahl, Catarina Schmidt, Eugenia Friesen, Jennifer Aschenbrenner, Julia Holzapfel Inhaltsverzeichnis 1.Versuchsbeschreibung 2. Die Geschichte der ASS
Aufgaben verändern Beispiele zur Chemie
 A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
Extraktion. Arbeitstechnik der Extraktion
 1 Extraktion Die heute vielfach angewandte Trennung durch Extraktion basiert auf der unterschiedlichen Löslichkeit bestimmter Verbindungen in zwei nicht (od. begrenzt) mischbaren Lösungsmittel. (Das Lösungsmittesystem
1 Extraktion Die heute vielfach angewandte Trennung durch Extraktion basiert auf der unterschiedlichen Löslichkeit bestimmter Verbindungen in zwei nicht (od. begrenzt) mischbaren Lösungsmittel. (Das Lösungsmittesystem
Wärmepumpe DT400-1P. NTL-Schriftenreihe Versuchsanleitung - Wärmepumpe
 Wärmepumpe DT400-1P NTL-Schriftenreihe Versuchsanleitung - Wärmepumpe Wärmepumpe Allgemein Eine Wärmepumpe ist eine Wärmekraftmaschine. Sie hebt Wärme von einem Körper tieferer Temperatur T 1 auf einen
Wärmepumpe DT400-1P NTL-Schriftenreihe Versuchsanleitung - Wärmepumpe Wärmepumpe Allgemein Eine Wärmepumpe ist eine Wärmekraftmaschine. Sie hebt Wärme von einem Körper tieferer Temperatur T 1 auf einen
Zustandsbeschreibungen
 Siedediagramme Beispiel: System Stickstoff Sauerstoff - Das Siedeverhalten des Systems Stickstoff Sauerstoff Der Übergang vom flüssigen in den gasförmigen Aggregatzustand. - Stickstoff und Sauerstoff bilden
Siedediagramme Beispiel: System Stickstoff Sauerstoff - Das Siedeverhalten des Systems Stickstoff Sauerstoff Der Übergang vom flüssigen in den gasförmigen Aggregatzustand. - Stickstoff und Sauerstoff bilden
Löschen. 1. einen : Das Material muss sein. kein Feuer entstehen oder unterhalten werden. Zündtemperatur erreicht, kann ebenfalls kein Feuer
 Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Physik für Bauingenieure
 Fachbereich Physik Prof. Dr. Rudolf Feile Dipl. Phys. Markus Domschke Sommersemster 2010 17. 21. Mai 2010 Physik für Bauingenieure Übungsblatt 5 Gruppenübungen 1. Wärmepumpe Eine Wärmepumpe hat eine Leistungszahl
Fachbereich Physik Prof. Dr. Rudolf Feile Dipl. Phys. Markus Domschke Sommersemster 2010 17. 21. Mai 2010 Physik für Bauingenieure Übungsblatt 5 Gruppenübungen 1. Wärmepumpe Eine Wärmepumpe hat eine Leistungszahl
Wie bringt man eine Kerze zum Fliegen?
 Wie bringt man eine Kerze zum Fliegen? Experimentalvortrag im Rahmen der Kinderuniversität am 19. Dezember 2007 Bevor wir diese Frage beantworten können, müssen wir zunächst einmal etwas über Kerzen an
Wie bringt man eine Kerze zum Fliegen? Experimentalvortrag im Rahmen der Kinderuniversität am 19. Dezember 2007 Bevor wir diese Frage beantworten können, müssen wir zunächst einmal etwas über Kerzen an
Wasser. Versuche. Seite 26
 Wasser Versuche Seite 26 Wolken selber erzeugen Materialien 1. Erhitze Wasser im Wasserkocher. 2. Gieße das heiße Wasser in das Glasgefäß. Du wirst sehen, dass Dampf aufsteigt. 3. Halte nun die Schale
Wasser Versuche Seite 26 Wolken selber erzeugen Materialien 1. Erhitze Wasser im Wasserkocher. 2. Gieße das heiße Wasser in das Glasgefäß. Du wirst sehen, dass Dampf aufsteigt. 3. Halte nun die Schale
Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus.
 Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus. Materialien Ein dickwandiges Glas Wasser Aufbau und Durchführung
Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus. Materialien Ein dickwandiges Glas Wasser Aufbau und Durchführung
Thermoplast oder Duroplast?
 Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Untersuche die Wirkung von Seife auf Trinkwasser und destilliertes Wasser.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
cc Christina Peter von: PH Vorarlberg Seite 1 Peter Christina
 von: PH Vorarlberg Seite 1 Peter Christina Was ist Luft? 1. Forscherauftrag Material: 1 Flasche 1 Schüssel So funktioniert es: 1. Fülle die Schüssel mit Wasser. 2. Tauche eine leere Flasche mit dem Flaschenhals
von: PH Vorarlberg Seite 1 Peter Christina Was ist Luft? 1. Forscherauftrag Material: 1 Flasche 1 Schüssel So funktioniert es: 1. Fülle die Schüssel mit Wasser. 2. Tauche eine leere Flasche mit dem Flaschenhals
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Destillation von Rotwein
 Destillation von Rotwein Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Zerlegung der Verbindung Wasser Titration Herstellung von Natronlauge Öltröpfchen versuch
Destillation von Rotwein Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Zerlegung der Verbindung Wasser Titration Herstellung von Natronlauge Öltröpfchen versuch
7.3 Kohlendioxid. Aufgabe. Wie kann Kohlendioxid nachgewiesen werden? Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser
 Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser (P78800) 7.3 Kohlendioxid Experiment von: Anouch Gedruckt: 28.02.204 :4:54 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie kann
Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser (P78800) 7.3 Kohlendioxid Experiment von: Anouch Gedruckt: 28.02.204 :4:54 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie kann
3 150 ml-bechergläser als Wasserbäder Thermometer 2 ml-plastikpipetten Parafilm
 Nachweis der Enzymaktivität und Enzymhemmung Chemikalien: Harnstofflösung (10% w/v) Phenolphtalein-Lösung Urease rohe Kartoffel Wasserstoffperoxid-Lösung (30 % w/v) Bäckerhefe verdünnte Lösung von Methylenblau
Nachweis der Enzymaktivität und Enzymhemmung Chemikalien: Harnstofflösung (10% w/v) Phenolphtalein-Lösung Urease rohe Kartoffel Wasserstoffperoxid-Lösung (30 % w/v) Bäckerhefe verdünnte Lösung von Methylenblau
Stoffänderungen beim Erhitzen und Abkühlen. A Der Gasbrenner / Bunsenbrenner / Teclu-Brenner. Praktikumstag 1: Erste Arbeiten - Aggregatzustände
 Am ersten Praktikumstag erhalten Sie zunächst eine Laboreinführung und Teil 2 der Sicherheitsbelehrung, deren Teilnahme Sie am Schluss mit Ihrer Unterschrift bestätigen. Sie dient dazu, das Labor und seine
Am ersten Praktikumstag erhalten Sie zunächst eine Laboreinführung und Teil 2 der Sicherheitsbelehrung, deren Teilnahme Sie am Schluss mit Ihrer Unterschrift bestätigen. Sie dient dazu, das Labor und seine
Feuer und Luft. So macht Chemie Spaß einfache Experimente
 Feuer und Luft So macht Chemie Spaß einfache Experimente Impressum 2009 Chemie-Verbände Baden-Württemberg Zeichnungen: Michaela Bautz, Heidelberg Grafik und Konzept: Pressebüro Baden-Baden GmbH 2 Inhaltsverzeichnis
Feuer und Luft So macht Chemie Spaß einfache Experimente Impressum 2009 Chemie-Verbände Baden-Württemberg Zeichnungen: Michaela Bautz, Heidelberg Grafik und Konzept: Pressebüro Baden-Baden GmbH 2 Inhaltsverzeichnis
Der Gebrauch von "Arbeitsmaterialien" in der Chemie Best.- Nr. 2021009 Dauer: ca. 20 min. - Klassenstufe: 8.-13. Klasse
 Der Gebrauch von "Arbeitsmaterialien" in der Chemie Best.- Nr. 2021009 Dauer: ca. 20 min. - Klassenstufe: 8.-13. Klasse Das Ziel dieses Videoprogramms ist es, ein "Werkzeug" für Lehrer und Schüler gleichermaßen
Der Gebrauch von "Arbeitsmaterialien" in der Chemie Best.- Nr. 2021009 Dauer: ca. 20 min. - Klassenstufe: 8.-13. Klasse Das Ziel dieses Videoprogramms ist es, ein "Werkzeug" für Lehrer und Schüler gleichermaßen
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 5 & 6. Verfahren zur Stofftrennung
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 5 & 6 Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sind
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 5 & 6 Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sind
