Inaugural - Dissertation. zur. Erlangung des akademischen. Grades. Doktor der Medizin (Dr. med.) der. Universitätsmedizin. der
|
|
|
- Klara Beltz
- vor 7 Jahren
- Abrufe
Transkript
1 Aus der Klinik und Poliklinik für Augenheilkunde (Direktor Univ.- Prof. Dr. med. S. Clemens) der Universitätsmedizin der Ernst-Moritz-Arndt-Universität Greifswald Thema: Überlegungen zur Optimierung der panretinalen Photokoagulation bei diabetischer Makulopathie unter Berücksichtigung der diskutierten Wirkmechanismen der Lasertherapie Inaugural - Dissertation zur Erlangung des akademischen Grades Doktor der Medizin (Dr. med.) der Universitätsmedizin der Ernst-Moritz-Arndt-Universität Greifswald 2012 vorgelegt von: Katharina Müller geb. am: in: Leipzig
2 Dekan: Prof. Dr. med. dent. Reiner Biffar 1. Gutachter: Univ.-Prof. Dr. med. Stefan Clemens 2. Gutachter: Prof. Dr. med. Gisbert Richard Ort, Raum: Greifswald, Seminarraum der Augenklinik (E 0.45) Tag der Disputation:
3 Für meine geliebte Schwester
4 Inhaltsverzeichnis 1 Einleitung Diabetische Retinopathie Epidemiologie Pathogenese Risikofaktoren Stadieneinteilung Diagnostik Therapie Systemische Kontrolle Medikamentöse Therapieansätze Kryokoagulation pars-plana Vitrektomie Lasertherapie Entstehungsgeschichte Therapieschemata und deren Indikation bei einer Makulopathie Die panretinale Photokoagulation Komplikationen der Lasertherapie Wirkweise der Laserkoagulation thermisch-induzierte histologische Gewebeveränderungen Änderungen der hämodynamischen Eigenschaften Einfluss auf die Blut-Retina-Schranke und Wachstumsfaktoren Zielstellung der Arbeit Behandlung der Makulopathie mittels panretinaler Photokoagulation Einführung Makulopathie Vorstellung wichtiger Studien Zusammenfassung Parameter und Ergebnisse der untersuchten Studien Zusammenfassung Literaturauswertung Retrospektive Patientendatenauswertung Patienten und Methoden Patientengut Methoden...72
5 8.1.3 Patientenaufteilung statistische Auswertung Ergebnisse Wirkung panretinale Laserkoagulation Allgemeine Patientendatenverteilung Patientenmerkmale Diskussion Patientendaten Ergebnisse der panretinalen Lasertherapie Einfluss der Patientenmerkmale auf die Lasertherapieergebnisse Zusammenfassung...95 Literaturverzeichnis...97 Abbildungsverzeichnis Tabellenverzeichnis...109
6 1 Einleitung Jahr für Jahr steigt die Zahl der Patienten mit der Dauer-Diagnose Diabetes mellitus stark an. Dadurch kommt der diabetischen Retinopathie in der heutigen Gesellschaft eine immer größer werdende Bedeutung zu. Im Zusammenhang mit dieser Stoffwechselerkrankung treten sowohl makro- als auch mikroangiopathische Veränderungen auf. Zirkulationsstörungen in den kleinen Gefäßen betreffen ins Besondere die Nieren und die Augen. Durch zahlreiche Veränderungen des Blutes und des Gefäßsystems, die vor allem in einer anhaltenden Hyperglykämie begründet sind, kommt es zu Behinderungen des Blutflusses in den kleinsten Gefäßen, wie in der Netzhaut des Auges. Im Zusammenhang mit diesen mikrozirkulatorischen Veränderungen kommt es zu Beeinträchtigungen der Sehschärfe und des Gesichtsfeldes, die bis zur Erblindung eines oder beider Augen führen können. Um diesen Früh- und Spätschäden für den Patienten entgegenzuwirken, ist nicht nur eine gute internistische Betreuung nötig, sondern ebenso eine optimale ophthalmologische Versorgung, die eine frühzeitige Erkennung und stadiengerechte Therapie der Retinopathia diabetica zum Ziel hat. 1
7 2 Diabetische Retinopathie 2.1 Epidemiologie Das Krankheitsbild des Diabetes mellitus lässt sich in zwei große Untergruppen einteilen. Erstens in den Diabetes mellitus Typ I, die juvenile Form, bei der es aufgrund einer gestörten Antikörperproduktion zu einer Zerstörung der Langerhans-Inseln im Pankreas mit einem dadurch verursachtem absoluten Insulinmangel kommt. Diese Form betrifft vor allem Männer. Dem gegenüber steht der Diabetes mellitus Typ II. 90% der Diabetiker, darunter vorwiegend Frauen, können dieser Form, die unter anderem durch eine Insulinresistenz oder eine Sekretionsstörung der B-Zellen des Pankreas charakterisiert ist, zugeordnet werden [41,75,92]. Dem Diabetes mellitus kommt als Erblindungsursache der berufstätigen Bevölkerung im Alter zwischen 30 bis 60 Jahren die größte Bedeutung zu [44,86]. Laut einer Studie von Zimmet et al. [92] aus dem Jahr 2001 leben im gesamten europäischen Raum 26,5 Millionen Diabetiker. Wir müssen davon ausgehen, dass es zum heutigen Zeitpunkt schon etwa 24% Patienten mehr sind. Laut der von Rathmann et al. veröffentlichen KORA Studie aus dem Jahr 2000 leiden 16,6% der Einwohner Deutschlands im Alter zwischen 55 und 74 Jahren unter der Stoffwechselerkrankung Diabetes mellitus. Im Vergleich zu anderen europäischen Ländern gibt es in der BRD die meisten unentdeckten Fälle von Diabetes. Ihre Zahl wird auf 1% der Gesamtbevölkerung geschätzt. Man nimmt an, dass die Mehrzahl der noch nicht erkannten Diabetesfälle Männer betrifft [60,82] publizierte Thefeld die Schätzungen des Gesundheitssurveys von 1998 zur Prävalenz des Diabetes in der deutschen Bevölkerung auf deren Daten sich die folgende Tabelle bezieht. 2
8 Altersgruppe / Geschlecht Männer Frauen Jahre 0,6% 1,3% Jahre 1,2% 2,6% Jahre 8% 2,8% Jahre 12,9% 11,4% Jahre 13% 19,4% Tabelle 1: Prävalenz des Diabetes mellitus in Deutschland [82] Betrachtet man aufgrund dieser Verteilung die durchschnittliche Anzahl der erkrankten Frauen und Männer im Alter zwischen 18 und 79 Jahren, so sind mehr Frauen erkrankt. (4,7% der Männer, 5,6% der Frauen). Des Weiteren ist ersichtlich, dass der Großteil der Patienten auf eine orale antidiabetische Therapie eingestellt ist [82]. Therapieform / Geschlecht Männer Frauen orale Antidiabetika 46% 43,4% Insulin 24,5% 24,6% Diät 12,9% 17,3% keine Behandlung 16,6% 14,7% Tabelle 2: Verteilung der Behandlungsstrategien [82] In Deutschland erblindeten in den Jahren ,6 bzw. 38,8 pro an Diabetes mellitus erkrankte Frauen bzw. Männer. Dank verbesserter Strategien zur individuellen Diabetesbehandlung ist es gelungen, die Rate der Erblindungen um 3% pro Jahr zu senken. Das Risiko zu erblinden ist für Diabetiker mit 81% etwa mal höher als für Nicht- Diabetiker [84]. Die Haupterblindungsursache stellt dabei die diabetische Retinopathie dar. Jeder 10. Diabetiker zwischen 20 und 74 Jahren ist davon betroffen. Etwa 50% aller Diabetiker zeigen mikrovaskuläre Störungen im Augenbereich, die mit der Diabetesdauer und dem Alter der Patienten korrelieren. Je länger die Erkrankungsdauer und je älter der Patient ist, desto häufiger tritt eine Retinopathia diabetica auf. Drei bis fünf 3
9 Jahre nach Erblindung sterben 50% aller Diabetiker an anderen Folgen dieser schwerwiegenden Stoffwechselerkrankung. Nur 20% der Patienten leben mehr als 10 Jahre mit ihrer Blindheit [30,38,39,69,86]. Die Ursachen für die hohe Prävalenz der Erblindungen in den Industrienationen liegen unter anderem in der erhöhten Lebenserwartung, mangelnder Bewegung, veränderten Essgewohnheiten und zu einem gewissen Teil spielen genetische Komponenten eine Rolle [44,86]. Von einer Retinopathia diabetica sind 20% der nicht-insulinabhängigen und 40 % der insulinabhängigen Diabetiker betroffen. Die proliferative Form, die in Deutschland etwa Menschen betrifft, findet man vermehrt bei Patienten vom Diabetes mellitus Typ I (5,6% bei Typ I, 0,9% bei Typ II) [30,35,42,86]. Weibliche Patienten entwickeln häufiger diese Netzhautveränderungen, wohingegen Männer meist eine schwerere Form aufweisen. (Level 7/8 der Wisconsin Studie: 11% der Männer und 6% der Frauen) [39]. Durch eine Optimierung der diabetischen Stoffwechsellage kann die Entstehung bzw. Progression der diabetischen Retinopathie mit zum Teil schwerem Visusverlust verzögert werden [42,75]. Entsprechend der Studienergebnisse zur proliferativen Form der diabetischen Retinopathie gibt es auch Daten über die diabetische Makulopathie, eine Sonderform, die durch Schäden im makulären Bereich gekennzeichnet ist. Von dieser Form der diabetischen Augenerkrankung sind vorwiegend Typ II Diabetiker betroffen ( Typ I 7,9% bzw. 15%, Typ II 12,8% bzw. 23%) [42,91]. Vor allem Altersveränderungen in der Makula und bisher noch unbekannte Mechanismen der Entstehung des Makulaödems sind die Gründe für eine solche Verteilung [38,43,86]. Die größte Studie zu epidemiologischen Daten der diabetischen Retinopathie ist die Wisconsin Studie, welche die Untersuchung von über Diabetikern umfasst. Hierbei wurden Risikofaktoren, die mit der Entwicklung einer Retinopathie im Zusammenhang stehen, untersucht. Es stellte sich heraus, dass die Dauer der Diabeteserkrankung und das Alter der Patienten die auffälligsten Faktoren waren. 4
10 Das Patientengut wurde in zwei Gruppen unterteilt. Patienten, die zum Zeitpunkt der Diagnosestellung jünger als 30 Jahre waren und jene, die älter gewesen sind. Für die Gruppe der insulinabhängigen Diabetiker, die bei der Diagnosestellung Diabetes mellitus jünger als 30 Jahre waren, ergab sich, dass sie innerhalb der ersten 5 Jahre keine Makulopathie oder proliferative diabetische Retinopathie entwickelten. Dies konnte auch in anderen Studien bestätigt werden. Nach 15 Jahren litten dagegen schon 97,5% an diabetischen Augenveränderungen. Des Weiteren wurde ein Zusammenhang mit dem Hormonhaushalt festgestellt. Die Wahrscheinlichkeit, eine diabetische Retinopathie vor dem 13. Lebensjahr, also präpubertär, zu entwickeln, ist sehr gering. In höheren Altersklassen jedoch um das 5½fache erhöht [38,39,69]. Bei Patienten mit einem Alter über 30 Jahre bei Diagnosestellung liegt die Wahrscheinlichkeit, eine Retinopathie zu entwickeln, höher. Bedingt ist dies zum einen durch die im Alter erhöhte Netzhautsensitivität, zum anderen dadurch, dass der Diabetes mellitus oft zu einem späten Zeitpunkt entdeckt wurde, wenn sich Veränderungen des Augenhintergrundes bereits eingestellt hatten. Nach 15 Krankheitsjahren leiden in dieser Gruppe 85% der Typ I Patienten und 58% der Typ II Patienten an einer diabetischen Retinopathie. Bei älteren Patienten besteht längere Zeit ein nicht-proliferatives Stadium. Jüngere Patienten weisen dagegen nach vergleichbarer Krankheitsdauer eine schnellere Progression auf. Daten dazu stammen unter anderem ebenfalls aus der amerikanischen Wisconsin Studie, bei der 25% der jüngeren Diabetiker nach einer Diabetesdauer von über 15 Jahren proliferative Veränderungen aufweisen, ältere Diabetiker vom Typ II dagegen nur in 4% der Fälle nach gleicher Erkankungsdauer [38,39,41,43]. In weiteren Studien, wie zum Beispiel von Ulbig et al. [86], wurden ähnliche Ergebnisse ermittelt. Man fand heraus, dass bei 90% aller Diabetiker nach 30 Jahren mindestens eine milde nicht-proliferative Retinopathie besteht. 5
11 2.2 Pathogenese Die genauen Entstehungsmechanismen der diabetischen Retinopathie, einer Mikroangiopathie, die vornehmlich präkapilläre Arteriolen, Kapillaren und Venolen betrifft [26], sind bisher noch nicht vollständig geklärt. Im Verlauf der Jahre wurden zahlreiche Thesen anhand von Tierversuchen oder Patientenstudien bestätigt. Aus den daraufhin veröffentlichten Ergebnissen lässt sich ein Gesamtbild der ursächlichen Faktoren aufzeigen [44,90]. Bei Diabetikern kommt es infolge verschiedenster Mechanismen zu einem erhöhten Blutzuckerspiegel. Diese chronische Hyperglykämie ist Ursache für die meisten Veränderungen, welche die Entstehung einer Retinopathie begünstigen. Die verschiedenen Faktoren lassen sich in biochemische, hämodynamische und endokrine Komponenten unterteilen. Erst in ihrer Komplexität ergeben diese drei Kategorien ein verständliches Bild. Es wurde entdeckt, dass in diabetischen Endothelzellen der Glukosetransporter GLUT-1 stärker exprimiert wird und dadurch mehr Glukose aus dem Blut in die Zellen aufgenommen wird [32]. Diese Glukose wird mittels Glykolyse- und Citratzyklus abgebaut, wodurch Sauerstoffradikale entstehen, welche die Zelle unter oxidativen Stress setzen. Diese Radikale erzeugen Strangbrüche in der DNA, was zu einer Störung der Glykolyse mit nachfolgender Anhäufung der Zwischenprodukte in den Zellen führt. Damit sind die normalen Stoffwechselwege erschöpft und alternative Wege treten in Kraft. Die akkumulierte Glukose wird durch die Aldosereduktase zu Sorbitol verstoffwechselt. Bei normalen Blutzuckerwerten hat das Enzym eine eher geringe Affinität zur Glukose. Erst bei erhöhten Werten dieser, wie es hier der Fall ist, wird es aktiv. Das gebildete Sorbitol erzeugt einen osmotischen Gradienten. Da das Sorbitol die Zelle nicht verlassen kann, kommt es zu einer Schwellung des Gewebes, insbesondere der Perizyten und der Basalmembran. Weiterhin werden durch die hohen Glukosemengen nicht-enzymatische Glykosylierungen 6
12 an verschiedenen Proteinen vorgenommen. Dazu zählt das Hämoglobin, bei dessen Glykosylierung das Glukosemolekül mit der Aminosäure Lysin verknüpft wird. Das dabei entstehende HbA1c wird zur Überwachung der chronischen Hyperglykämie bei Diabetes mellitus Patienten genutzt. Es werden auch andere Moleküle, wie zum Beispiel Fibrinogen, Kollagen oder die Erythrozytenmembran selbst glykosyliert, so dass die Erythrozyten nicht mehr so flexibel sind und die Viskosität des Blutes erhöht ist. An die veränderten roten Blutzellen wird der Sauerstoff stärker gebunden, weshalb dieser nur vermindert an das Gewebe abgegeben werden kann. Diese Art der Glukoseverwertung findet auch innerhalb der Zellen statt. Durch Bindung der Glukosemoleküle an Amine, wie zum Beispiel Proteine, entstehen Amadori-Produkte. Diese werden über weitere Schritte in AGE`s (advanced glycation endproducts) umgewandelt. Sie besitzen neben ihrer eigenen Toxizität die Fähigkeit zur Begünstigung der Bildung von Zytokinen wie VEGF. Die akkumulierten Stoffwechselprodukte führen zum Untergang der Perizyten, was besonders in der Netzhaut schwerwiegende Folgen hat, weil die normale Verteilung jeweils einen Perizyten pro Endothelzelle vorsieht. Dies entspricht der größten Perizytendichte im gesamten menschlichen Körper [29]. Dadurch entfällt so zum einen die Sphinkterfunktion der Perizyten am Übergang zu den Kapillaren, wodurch diese weniger anpassungsfähig hinsichtlich Blutdruckschwankungen sind und der Blutdurchfluss im Kapillarbett erhöht wird. Zum anderen wird die Blut-Retina-Schranke, die aus dem retinalen Pigmentepithel, den Blutgefäßen und den dazwischen befindlichen Tight junctions gebildet wird, zerstört [ 32]. Diese mikrovaskulären Lecks erzeugen eine Hyperpermeabilität, wodurch Proteine und Lipide in die Netzhaut eintreten, was wiederum zur Entstehung von Mikroaneurysmen, harten Exsudaten und Ödemen führt. Die Blutviskosität wird einerseits, wie bereits beschrieben, durch die verminderte Flexibilität der Erythrozyten erhöht, ebenso aber auch durch die stärkere Adhäsion der Thrombozyten. Letzteres hängt ursächlich mit den zuvor gebildeten Wachstumsfaktoren zusammen. Im Blut entstehen dadurch Mikrothromben, die eine autoregulatorische 7
13 Vasodilatation hervorrufen. Dadurch erhöht sich der Blutfluss eines Diabetikers auf das 2- fache im Vergleich zu einem Nicht-Diabetiker. An Stellen, an denen dieser Regulationsmechanismus nicht mehr ausreicht, kommt es zu einer Minderperfusion des umgebenden Gewebes. Da jeder Patient unterschiedliche Kapazitäten zur Glykosylierung besitzt, ist der Zeitpunkt der Ausbildung einer Retinopathie individuell verschieden. Autoregulatorisch entstandene dilatierte Venen und Mikroaneurysmen sind die ersten klinischen Manifestationen einer nicht-proliferativen Retinopathie [45]. Mikroaneurysmen sind von inflammatorischen Zellen und Fibroblasten umgeben und entstehen um verschlossene Kapillaren als initialer Versuch einer Neovaskularisation. Ein weiteres Kennzeichen einer Retinopathia diabetica ist das Auftreten harter Exsudate. Diese sind fibröse Matrices aus Serumproteinen und Lipiden und sind deshalb mit erhöhten Triacylglycerid-Werten im Blut korreliert. Umgeben sind die harten Exsudate von lipidabbauenden Makrophagen, fibroblastenähnlichen Stromazellen und einer erhöhten Konzentration an VEGF. Letzteres erhöht die Permeabilität der Gefäße, was zur Ausbildung eines Makulaödems beiträgt [10,77]. Die bisher beschriebenen biochemischen, endokrinen und hämodynamischen Prozesse führen zu Gefäßverschlüssen und Nervenfaserinfarkten (cotton-whool-exudate) aus denen ischämische Areale entstehen. Die nachfolgenden kompensatorischen Revaskularisationsversuche der unterversorgten Retina charakterisieren den Beginn der Ausbildung einer proliferativen Form der diabetischen Retinopathie. Funduskopisch ist der Übergang von der nicht-proliferativen in die proliferative Form der diabetischen Retinopathie durch intraretinale Blutungen, weiche Exsudate, arteriovenöse Shunts und perlschnurartig erweiterte Venen geprägt. Zuerst entstehen die Neovaskularisationen in der mittleren Netzhautperipherie, obwohl die Schäden im Bereich der Makula und der Peripherie identisch sind [43,45]. Der Grund dafür ist, dass die Makula näher an den großen Gefäßbögen liegt, wo der Perfusionsdruck höher ist als in der Peripherie. Dadurch sind in der zentralen Netzhaut bessere Ver- und 8
14 Entsorgungsmöglichkeiten gegeben, die eine effizientere Kompensation der biochemischen Zerstörungsprozesse ermöglichen. Zwischen den großen Gefäßen bilden sich arteriovenöse Shunts (IRMA-intraretinale mikrovaskuläre Anomalien), die stark dilatiert sind und so einen schnelleren Blutfluss von peripher nach zentral erzeugen. Das schnell fließende Blut und der dadurch verringerte Perfusionsdruck verhindern eine ausreichende Versorgung des umliegenden Gewebes. Es kommt zur Hypoxie und Neurodegeneration. Die in hypoxämischen Bereichen entstehenden, von fibrösem Material umgebenen Neovaskularisationen, breiten sich bis zur Papille aus. Zur Bildung der Gefäße kommt es, weil durch Wegfall der Perizyten die negativen Wachstumsfaktoren entfallen und Endothelzellen nun durch Unterstützung positiver Wachstumsfaktoren ungebremst proliferieren können. Da die veränderten Gefäße sehr instabil sind, kommt es zu Blutungen in die Netzhaut oder den Glaskörper. Dabei werden Fibroblasten mitgetragen, die sich vermehren und den Glaskörper infiltrieren. Die fibrösen Veränderungen erzeugen durch Schrumpfung des Glaskörpers Traktionen, wodurch es zu Glaskörperabhebungen, gegebenenfalls sogar zur Netzhautablösung kommen kann. In weit fortgeschrittenen Phasen der diabetischen Retinopathie wachsen Gefäße, getriggert durch Wachstumsfaktoren, auch in das Gewebe der Iris ein. Diese, als Rubeosis iridis bezeichnete Komplikation ist genau wie das Neovaskularisationsglaukom, bei dem Gefäße den Kammerwinkel verschließen und durch Abflussstörung eine Druckerhöhung erzeugen, eine Spätfolge der diabetischen Augenveränderungen. Ohne eine frühzeitige Therapie führen diese späten Veränderungen beim Patienten zur irreversiblen Sehkraftminderung bis hin zur Erblindung. Die Existenz der im vorangegangenen Text häufig angesprochenen Wachstumsfaktoren wird schon lange vermutet. Dank neuer Techniken ist es jetzt möglich, sie zu klassifizieren. Deshalb widmen sich neuere Untersuchungen immer häufiger der Bedeutung dieser 9
15 Wachstumsfaktoren bei der Entstehung einer diabetischen Retinopathie und deren proliferativen Form [12,32,44,48,51,74,75]. So wird der VEGF (vascular endothelial growth factor) vom retinalen Pigmentepithel, den Perizyten und dem Endothel produziert. Er hat angiogenetische und inflammatorische Eigenschaften, trägt zum Zusammenbruch der Blut-Retina-Schranke bei und fördert die Adhäsion der Leukozyten, welche die Kapillarverschlüsse verursachen. Auslöser für die Bildung von VEGF sind neben Hypoxie auch die Aktivierung der Proteinkinase C, die durch Diacylglyceride aktiviert wird. Letztere entstehen bei der Verstoffwechslung von Glukose. IL-6 (Interleukin-6), das ebenfalls von hypoxischen Endothelzellen gebildet wird, wirkt auf die Tight junctions und das Aktin der Endothelzelle. Dadurch kontrahiert diese und die parazelluläre Permeabilität für Albumin wird erhöht. Vom Gehalt an VEGF und IL-6 im Glaskörper wird die Schwere eines spontanen Makulaödems bestimmt [71]. Einfluss auf die Progression der diabetischen Retinopathie haben weiterhin der, von den Pigmentepithelzellen gebildete stromal cell-derived factor (SDF)1α, der chemotaktisch auf Entzündungszellen wirkt und das zusätzlich vom Endothel gebildete Chemokin RANTES (Regulated upon Activation, Normal T-cell Expressed and Secreted). Letzteres ist besonders bei schwereren Graden der Retinopathia diabetica erhöht. Bei Diabetikern wird im Allgemeinen neben RANTES auch MCP-1 (monocyte chemoattractant protein-1) in höheren Konzentrationen in der Retina nachgewiesen. Dieses wird von Makrophagen und Endothelzellen gebildet und hat positive Effekte auf Inflammation und Neovaskularisation. Durch den Perizytenverlust wird angiogen wirkendes und Fibroblasten stimulierendes FGF (Fibroblast-Growth-Factor) frei, das in der Basalmembran verankert war. Desgleichen TGFβ (Transforming growth factor), der durch den Kontaktverlust seine wachstumshemmende Wirkung verliert. 10
16 Weitere in der Netzhaut von an Diabetes mellitus erkrankten Patienten gebildete Wachstumsfaktoren sind zum Ersten IGF-1 (insulin-like growth factor-1), der dem Schutz vor Apoptose dient, die durch akkumulierte Glukosestoffwechselprodukte in der Zelle induziert wird. Zum Zweiten PDGF (Platelet-Derived Growth Factor), der, genau wie FGF, das Wachstum von Fibroblasten anregt und damit eine Netzhautablösung begünstigt. Zusammenfassend lässt sich sagen, dass die bei Diabetikern auftretende chronische Hyperglykämie zu Schäden an den Netzhautgefäßen führt und einzelne Blutparameter verändert. Dadurch kommt es zu Okklusionen der Kapillaren mit nachfolgender Unterversorgung des umgebenden retinalen Gewebes. Um diese ischämische Situation rückgängig zu machen, wird die Retina mit Hilfe von wachstumsfördernden Substanzen neovaskularisiert. Ohne frühzeitige Therapie kommt es sehr bald zu den für die Retinopathia diabetica typischen Komplikationen, die bis zur Erblindung des Patientenauges führen können [3,26,29,32,35,43,45,46,53,74,76,86]. 2.3 Risikofaktoren Wie bereits im Kapitel 2.1 erwähnt, sind die wichtigsten Risikofaktoren, die im Zusammenhang mit der Entwicklung und Progression einer diabetischen Retinopathie stehen, das Alter des Patienten und die Dauer des Diabetes mellitus. Die meisten Angaben über Risikofaktoren stammen aus umfangreichen Studien, die in den 1980er Jahren in Amerika durchgeführt wurden. Dazu gehört einerseits das Material, das in Verbindung mit der ETDRS (Early Treatment Diabetic Retinopathy Study) ausgewertet wurde und andererseits Ergebnisse der großen epidemiologischen Untersuchungen in Wisconsin [10,27,38,39,40,41]. Je länger ein Patient an Diabetes mellitus erkrankt ist, desto größer ist die Wahrscheinlichkeit, eine diabetische Retinopathie und insbesondere deren proliferative 11
17 Form zu entwickeln. Das Gleiche gilt für die Ausbildung einer diabetischen Makulopathie [91]. Ebenso verhält es sich in Bezug auf das Alter des Patienten, weshalb die Zusammenhänge mit der Diabetesdauer auch als Alterseffekt interpretiert werden könnten, da ein Patient, je älter er ist, auch länger an einem Diabetes mellitus leiden könnte. Bei der Makulopathie ist allerdings zusätzlich entscheidend, ob der Patient bei der Diagnosestellung jünger als 30 Jahre ist. Patienten unter 30 Jahren mit einer Diabetesdauer unter 5 Jahren erkranken nicht an einem Makulaödem [91]. Die Ursachen für die schlechtere Prognose im Alter liegen sehr wahrscheinlich in einer erhöhten Netzhautsensitivität, bei altersbedingten Veränderungen in der Bruchschen Membran, an der Beschaffenheit des Glaskörpers und dem von jüngeren Diabetikern abweichenden endokrinen Status. Außerdem ist es möglich, dass bei vielen Patienten aufgrund fehlender Symptomatik erst im fortgeschrittenen Alter die Erkrankung diagnostiziert wird und somit die Entstehungsmechanismen der diabetischen Retinopathie lange Zeit wirken konnten [6,86]. Den Zusammenhang zwischen Alter und prozentualem Auftreten diabetischer Augenhintergrundveränderungen gibt folgende Tabelle wieder. Altersklasse Anteil diabetische Retinopathie Jahre 10% Jahre 41% Jahre 58% 45 Jahre 70% Tabelle 3: Anteil der an diabetischer Retinopathie Erkrankten bezogen auf Diabetiker ihrer Altersklasse [39] Diabetiker, die jünger als Jahre sind, zeigen, unabhängig von der Erkrankungsdauer, in den seltensten Fällen diabetische Augenveränderungen [44]. Nach Erreichen der Pubertät haben die Patienten ein fünfeinhalb mal höheres Risiko eine Retinopathia diabetica zu entwickeln. Ursachen dafür sind metabolische und hormonelle Umstellungen, die während dieser Phase durchlebt werden. 12
18 In einer Studie von Haffner et al. [27] wurde der Einfluss von Sexualhormonen untersucht. Es fand sich ein Zusammenhang zwischen niedrigen SHBG (sexual hormone-binding globulin) -Werten und einer höheren Progressionsrate einer diabetischen Retinopathie. Eine Änderung der SHBG-Werte um 10,1 mmol/l hatte dabei größere Auswirkungen auf das Fortschreiten der Netzhautveränderung als eine Erhöhung des HbA1c um 2%. Bezüglich des glykosylierten Hämoglobin fanden Meleth et al. [51] und Zander et al. [91], dass schon geringe Abweichungen auf einen schlechteren Verlauf der Retinopathia diabetica sowie der makulären Veränderungen hinweisen. Es fand sich ein größeres Makulaödem und eine schwerer verlaufende diabetische Retinopathie bei einem HbA1c von 8,1% gegenüber einem von 7,4%. Begründbar ist dies mit der Pathologie. Eine bessere Blutzuckereinstellung führt zu vermindertem oxidativem Stress. Dadurch werden vermindert wachstumsfördernde Zytokine ausgeschüttet und die angiogene Proliferation wird verlangsamt [1]. Weiterhin fanden Qiao et al. [59] heraus, dass Patienten mit einer normozytären diabetogen bedingten Anämie bei einem Hämoglobingehalt von weniger als 7,45 mmol/l (12 g/dl) ebenfalls ein höheres Risiko haben, an diabetischer Retinopathie zu erkranken. Die glykosylierten Erythrozyten sind weniger flexibel und haben deshalb eine verkürzte Lebensdauer. Das Volumen und das Gewicht des Erythrozyten betreffend wurde allerdings kein Zusammenhang nachgewiesen. Im Gegensatz dazu ist ein Thrombozytengehalt von weniger als Zellen/mm³ ein grenzwertiger Faktor für ein vermindertes Proliferationsrisiko. Diabetiker mit erhöhten Triacylglycerid- (TAG), Cholesterin- und verringerten HDL-Werten zeigen häufiger schwerere Verläufe der Retinopathia diabetica (TAG 235 mg/dl vs. 117 mg/dl, Cholesterin 203 mg/dl vs. 179 mg/dl, HDL 50 mg/dl vs. 57 mg/dl; alle Werte im Vergleich zu leichteren Formen der diabetischen Retinopathie). Bei Patienten, bei denen vermehrt harte Exsudaten und ein größeres Makulaödem nachweisbar sind, findet man ebenfalls höhere TAG-Werte (Vergleich hohe Anzahl Exsudate vs. weniger in Bezug auf mittlere TAG-Konzentration; 191 mg/dl vs. 117 mg/dl). Ebenso wie Hyperlipoproteinämien werden schlecht eingestellte Hypertonien beim 13
19 Diabetes mellitus Typ II häufiger von diabetischen Augenveränderungen begleitet. (Vergleich schwere vs. leichte Netzhautveränderungen in Bezug auf den mittleren Blutdruck;146/74 mmhg vs. 126/66 mmhg) [51]. Dabei ist die Bedeutung des systolischen Blutdrucks bei älteren Patienten für die Schwere der diabetischen Retinopathie größer als die des diastolischen Druckes. Letzterer dagegen hat Einfluss auf die Entstehung einer Retinopathia diabetica bei einer Diabetesdauer von unter 10 Jahren [51,91]. Es wird vermutet, dass eine bestehende Hypertonie Ursache des diabetischen Nierenschadens ist, die Niere bei der Regulation des Blutdrucks eine wichtige Rolle spielt. Patienten mit Diabetes mellitus vom Typ II mit schwerwiegenderen Formen der Retinopathie und Makulopathie weisen oft Nephropathien im Zusammenhang mit Proteinurie und einem erhöhten Kreatinin im Serum (über 115 μmol/l) auf [59,91]. Wie schon beschrieben hängt die Ausbildung diabetischer Augenveränderungen auch von der Art des Diabetes und dessen Behandlungsqualität ab. Diabetiker vom Typ II weisen im Vergleich zum Typ I häufiger eine Makulopathie auf (23% Typ II vs. 15% Typ I) [91]. Wie aus der folgenden Tabelle zu ersehen ist, zeigen mit Insulin behandelte Patienten, insbesondere Männer, häufiger schwerere proliferative Stadien auf (WESDR Retinopathie- Level 7/8 : Männer: 11%, Frauen: 6%) [41,59]. Aus diesem Grund sollten bei Retinopathien Diabetiker vor einer Umstellung auf die intensivierte Allgemeintherapie gelasert werden. Frauen dagegen neigen eher zur Entstehung einer Retinopathie mit geringerer Tendenz zur Progression. Dies wird in der Literatur mit deren besserer Compliance begründet. Dauer / Insulin IDDM NIDDM Retinopathieform DR PDR DR PDR 2 Jahre 30% 4% 23% 3% 15 Jahre 85% 20% 58% 4% Tabelle 4: Prozentualer Anteil der an Retinopathia diabetica Erkrankten in Abhängigkeit von der Insulintherapie und Erkrankungsdauer (IDDM= Insulin-Dependent Diabetes mellitus, NIDDM= Non-Insulin-Dependent Diabetes Mellitus, DR= Diabetische Retinopathie, PDR= Proliferative 14
20 Diabetische Retinopathie) [38,41] Über Progressionsraten hinsichtlich der Retinopathia diabetica während der Schwangerschaft gibt es verschiedene Meinungen. Laut einer Studie von Gerke und Meyer-Schwickerath aus dem Jahr 1982 [25] entspricht das Risiko für eine Progression von 15% dem gleichen Risiko einer nicht-schwangeren Frau für einen Zeitraum von 9 Monaten. Einer Veröffentlichung von Seidlein et al. [ 67] zufolge findet bei 63% der Frauen während des 1. und 2. Trimenon eine Progression der Retinopathie statt. Als Ursachen für eine Verschlechterung des Augenhintergrundbefundes werden die gleichen auch für nicht-schwangere Diabetikerinnen gültigen Risikofaktoren, wie Hypertonie, Dauer des Diabetes und Alter der Patientin genannt. Wird die diabetische Schwangere vor Beginn der Befruchtung ausreichend laserkoaguliert, besteht kaum ein Risiko für einen progressiven Verlauf während der Gravidität [25]. Zur frühzeitigen Erfassung von Veränderungen sollte eine Schwangere in jedem Trimester, bei Komplikationen auch häufiger, vom Augenarzt kontrolliert werden. Letztlich findet man in der Literatur Hinweise darauf, dass weitere Risikofaktoren für eine diabetische Retinopathie Diabetes-assoziierte neuropathische Veränderungen sind. Diese werden besonders im Zusammenhang mit der Makulopathie genannt [91]. Schließlich findet man laut einer Veröffentlichung des WESDR den Hinweis auf den Einfluss der ethnischen Herkunft. So erleiden mehr hellhäutige Menschen eine proliferative diabetische Retinopathie [10]. Keine Verbindung zur Retinopathieentwicklung und -progression wurde für Nikotinabusus, Pulsqualität, Typ und Dosis des verabreichten Insulin, den intraokularen Druck und genetische Faktoren gefunden. Als protektive Faktoren gelten eine hohe Myopie mit chorioatrophischen Narben und Amblyopie, sowie eine glaukomatöse Optikusatrophie. Bei Vorliegen dieser Krankheiten werden weniger schwere Verläufe einer Retinopathia diabetica verzeichnet. Laut Literatur [7] kann eine vorhandene Glaskörperabhebung am hinteren Augenpol gegebenenfalls von Vorteil sein, wenn durch in den Glaskörper einwachsende Proliferationen eine Traktionsablatio drohen würde. 15
21 2.4 Stadieneinteilung Die diabetische Retinopathie wird in eine nicht-proliferative und proliferative Form, sowie die Makulopathie eingeteilt. Damit Patientenbefunde für verschiedene Behandelnde vergleichbar sind, wurde eine genauere Einteilung der diabetischen Retinopathie nach ophthalmoskopischen und für die Makulopathie nach floureszenzangiografischen Gesichtspunkten vorgenommen, die im Folgenden aufgeführt sind [7,69,91]. Stadium Bezeichnung morphologische Veränderungen R 0 subklinische DR keine Netzhautveränderungen R I milde NPDR MA R II mit/ohne MP mäßige NPDR IRB, HE, CW schwere NPDR R III mit/ohne MP PDR ohne Vitreopathie R IV proliferative Uveovitreo-optikopathie R V Blindheit Visus < 0,15 DR NPDR PDR MA IRB HE CW MP IRMA = diabetische Retinopathie = nicht-proliferative diabetische Retinopathie = proliferative diabetische Retinopathie = Mikroaneurysma = intraretinale Blutungen = harte Exsudate = cotton-whool Herd = Makulopathie = intraretinale mikrovaskuläre Anomalie Regel in 4 Quadranten > 20 MA s + IRB ODER in 2 Quadranten perlschnurartige Venen ODER in 1 Quadranten IRMA Neovaskularisationen und fibröse Proliferationen ohne Glaskörperbeteiligung Neovaskularisationen der Papille, Glaskörperproliferationen und Rubeosis iridis Tabelle 5: Stadieneinteilung der diabetischen Retinopathie nach ophthalmoskopischen Gesichtspunkten Stadium R II und III kann weiterhin nach einer Fluoreszenzangiographie entsprechend dem Vorhandensein einer Makulopathie in Untergruppen unterteilt werden. 16
22 ohne Makulopathie Prädisposition zur Makulopathie präproliferative Retinopathie ohne spezielle Prädisposition --- mit Makulopathie fokale Makulopathie hyperpermeable Areale temporal der Makula avaskuläre Areale in der mittleren Netzhautperipherie fokale Leckstellen verursacht durch Mikroaneurysmen am hinteren Augenpol diffuse Makulopathie durch einen generalisierten Zusammenbruch der Blut-Retina-Schranke, diffuse Leckstellen am hinteren Pol ischämische Makulopathie Okklusion des am hinteren Pol gelegenen perifovealen Gefäßnetzes Tabelle 6: fluoreszenzangiographische Differenzierung der diabetischen Retinopathie und Makulopathie Die wichtigsten morphologischen Veränderungen der Netzhaut, die zur Entstehung einer Makulopathie führen, sind die Mikroaneurysmen. Nunes et al. [54] haben herausgefunden, dass Patienten vom Diabetes Typ II mit einer nicht-proliferativen diabetischen Retinopathie ein erhöhtes Risiko haben, ein klinisch signifikantes Makulaödem zu entwickeln, wenn sich an der Netzhaut pro Jahr mehr als 2 neue Mikroaneurysmen bilden. Laut ETDRS [18] bezeichnet man ein Makulaödem als klinisch signifikant, wenn sich eine Verdickung der Netzhaut oder harte Exsudate innerhalb von 500µm um das makuläre Zentrum herum zeigen oder eine Netzhautdickenzunahme größer als ein Papillendurchmesser zu verzeichnen ist. Dabei muss die Zunahme der Netzhautdicke nicht ausschließlich im Bereich der Makula liegen. 17
23 2.5 Diagnostik Da die diabetische Retinopathie in den Anfangsstadien symptomlos verläuft, wird Diabetikern vom Typ II empfohlen, direkt nach Diagnosestellung einen Augenarzt aufzusuchen, da schon über einen längeren Zeitraum diabetogene Veränderungen in der Netzhaut stattgefunden haben können. Diabetiker vom Typ I weisen innerhalb der ersten 5 Jahre nach Diagnosestellung selten schwerwiegende Veränderungen des Augenhintergrundes auf. Somit kann der erste Augenarztkontakt bis zu 5 Jahre nach Diagnosestellung liegen. Die erste den Patienten einschränkende Symptomatik ist eine Visusminderung. Deshalb muss bei jeder Untersuchung eine Überprüfung der Sehschärfe durchgeführt werden. Mittels Spaltlampe werden die vorderen Augenabschnitte untersucht, um eine Rubeosis iridis nicht zu übersehen. Mit Hilfe eines Kontaktglases kann die Netzhaut begutachtet werden. Dies sollte in Mydriasis und binokular erfolgen, um möglichst viel Fläche der Retina einsehen zu können und ein Makulaödem besser zu diagnostizieren. Sollte die Sicht durch eine Katarakt oder Glaskörpertrübung eingeschränkt sein, ist eine Ultraschalldiagnostik indiziert. Kleinste Leckstellen und Okklusionszonen im Bereich der Netzhaut sind mittels fluoreszierender Stoffe bei einer Angiografie identifizierbar. Ist eine Laserkoagulation geplant, empfiehlt es sich, mittels eines OCT (Optical Coherence Tomograph) die foveale Netzhautdicke zu ermitteln. Dies ist angebracht, da sich eine Foveadicke von über 300µm bei Patienten ohne Makulopathie mit gutem Visus als ungünstiger Faktor für die Stabilisierung der Sehkraft nach einer panretinalen Laserung erwiesen hat [73]. Die Befunderhebung muss dokumentiert, mit dem Patienten besprochen und einmal jährlich an den behandelnden Hausarzt oder Diabetologen übermittelt werden. Liegen keine Netzhautveränderungen vor, sollte der Patient einmal pro Jahr beim Augenarzt vorstellig werden. Sind nicht-proliferative Veränderungen vorhanden, ist eine 18
24 halbjährliche Kontrolluntersuchung und bei proliferativen Veränderungen oder einem klinisch signifikanten Makulaödem eine vierteljährliche Kontrolle angezeigt. Eine häufigere Begutachtung durch den Augenarzt ist außerdem für Risikopatienten empfehlenswert. Das gilt für Hypertoniker, bei Fettstoffwechselstörungen, Stoffwechselentgleisungen und Schwangeren. Frauen mit Kinderwunsch sollten vor der Konzeption oder spätestens zu Beginn der Schwangerschaft einen Ophthalmologen aufsuchen und bis zur Entbindung in einem Dreimonatsrhythmus vorstellig werden [33,69]. 19
25 2.6 Therapie Das wichtigste therapeutische Mittel zur Behandlung, bzw. Eindämmung der pathologischen mikrovaskulären Vorgänge in der Retina ist der Einsatz von Laserstrahlen. Es gibt auch andere therapeutische Ansätze, die bereits in Prozesse eingreifen sollen, die zur Bildung einer Retinopathie führen Systemische Kontrolle Einer der Ansätze, die therapeutisch wirken sollen, bevor es zur Retinopathia diabetica gekommen ist, besteht in der internistischen Betreuung und Einstellung der Diabetiker. Das Ziel ist dabei, Risikofaktoren, welche zur Ausbildung einer diabetischen Retinopathie beitragen, auszuschalten. So sollte der Blutdruck unter 140/80 mmhg eingestellt werden, da höhere Werte die kleinen Gefäße schädigen. Eine bestehende Fettstoffwechselstörung sollte normalisiert werden, da erhöhte Blutfettwerte die Grundlage zur Ausbildung harter Exsudate darstellen. Auch die Ausbildung und schnellere Verschlechterung eines Makulaödems wird dadurch begünstigt. Die Hyperglykämie als pathogenetischer Hauptfaktor sollte vermieden werden. Zur Beobachtung der langfristigen Blutzuckerwerte dient das HbA1c, das unter 7% liegen sollte. Möglich ist dies zum Beispiel bei insulinunabhängigen Diabetikern mittels Diät, aber auch insulinabhängige Diabetiker können mittels einer intensivierten Insulintherapie besser vor der Entwicklung einer Retinopathie bewahrt werden. Die intensivierte Therapie beinhaltet entweder die 3-4 malige Injektion von Insulin pro Tag oder das Anbringen einer Insulinpumpe. Das Ziel der intensivierten Therapie ist ein HbA1c-Wert von unter 6%. Mittels dieser Therapieform wird die Progressionsrate der diabetischen Retinopathie um 54%, deren Entstehungsrate sogar um 76% gesenkt. Patienten unter dieser Therapie weisen auch weniger Fälle von Albuminurien und Neuropathien auf. 20
26 Doch eine solche Behandlung hat auch negative Folgen. So leiden intensiv behandelte Diabetiker drei mal häufiger unter hypoglykämischen Episoden, neigen zur Gewichtszunahme und in der Umstellungsphase findet eine kurzfristige Verschlechterung einer schon vorhandenen Retinopathie statt. Neben guter medizinischer Betreuung ist eine hohe Compliance der Patienten wichtig, damit die vorgeschlagene Therapie ordnungsgemäß durchgeführt werden kann. Auch nicht-gesicherte Risikofaktoren müssen ausgeschaltet werden. Dazu zählt zum Beispiel der Nikotinabusus, für den keine statistisch relevanten Beziehungen zur diabetischen Retinopathie nachgewiesen werden konnten, aber dessen Bedeutung als vaskulärer Risikofaktor für den Diabetiker bekannt ist [11,33] Medikamentöse Therapieansätze Wie oben bereits erwähnt, ist eine Normalisierung der Blutfettwerte wichtig. Möglich ist dies zum Beispiel mit Fibraten. In der FIELD-Studie [37] wurde ihr Einfluss auf die diabetische Retinopathie bei Diabetikern vom Typ II untersucht. Neben der Senkung des Cholesterins und der Triacylglyceride waren unter dieser Behandlung über 30% weniger Laserbehandlungen wegen eines Makulaödems oder einer proliferativen Retinopathie notwendig. Die verminderte Progression der diabetischen Veränderungen wird damit begründet, dass die Fibrate anti-inflammatorisch wirken, die Zellmigration und außerdem die Apoptose in den hyperglykämisch geschädigten Endothelzellen der Retina hemmen. Ähnliche Ergebnisse fanden sich auch in einer Studien mit Lisinopril, einem ACE-Hemmer, der bei normotensiven Typ I Diabetikern getestet wurde. Dabei senkte Lisinopril im Vergleich zu einem Placebo bei gut eingestellten Patienten mit einem HbA1c unter 7% die Progression der diabetischen Retinopathie um 50% (Progressionsrate mit Placebo: 23,4%; mit Lisinopril 13,2%) [8]. Sowohl für Fenofibrate, als auch für Lisinopril gibt es keine feste Empfehlung von 21
27 Augenärzten, da die systemische Einstellung internistisch betreut werden sollte. Bereits eingesetzt werden Glucocorticoide zur Behandlung eines Makulaödems. Zum Teil in Kombination mit einer panretinalen Lasertherapie wird das kristalloide Triamcinolonacetonid intravitreal verabreicht. Dort reduziert es durch seine antiinflammatorischen und anti-angiogenen Eigenschaften die Makuladicke und Anzahl an Leckagen. In Verbindung mit einer Kryokoagulation kann es beim Neovaskularisationsglaukom eingesetzt werden. Bei vorhandener Rubeosis iridis ist eine Kataraktoperation schwierig, da durch das Instrumentieren die Iris gereizt wird, was wiederum zu Entzündungen führen kann. Deshalb kommen oben genannte Glucocorticoide zusätzlich zum Einsatz, wodurch diese Reizerscheinung vermindert wird. Neben der begrenzten Wirkdauer von 3-6 Monaten gibt es auch Nebenwirkungen. Das Einbringen in den Glaskörper kann so zum Beispiel zu einer infektiösen Endophthalmitis führen, der Wirkstoff selbst kann eine Erhöhung des Augeninnendrucks oder eine Katarakt erzeugen [34]. Der wichtigste vasoaktive Wachstumsfaktor, der zur Proliferation beiträgt und durch seine permeabilitätssteigernde Wirkung für den Zusammenbruch der Blut-Retina-Schranke mitverantwortlich ist, ist das VEGF. Zur Behandlung sind bereits VEGF-Antikörper zugelassen, die durch ihre VEGF hemmende und damit proliferations- und leckagenvermindernde Wirkung für die Behandlung der diabetischen Retinopathie von Nutzen sind. Eine weitere Methode, welche die VEGF induzierte Permeabilität um über 95% senkt, ist der Einsatz von PKCβ-Inhibitoren. Sie verhindern die Aktivierung von IL-6 und VEGF und können damit die Endothelpermeabilität reduzieren und auch die gesteigerte Endothelzellproliferation verhindern. Leider konnte kein positiver Effekt auf die Progression einer Retinopathie nachgewiesen werden. Sie haben sich nur bei der Verringerung der Netzhautdicke bei einem Makulaödem bewährt und können die Resistenz des Netzhautendothels gegen hyperglykämische Zustände erhöhen. Indiziert sind sie bei Patienten mit einer nicht- 22
28 proliferativen Retinopathie mit dem Ziel der Verhinderung eines ausgeprägten Visusverlustes [12,46]. Momentan wird ein Bradykinin-B1-Rezeptor-Antagonist untersucht, der durch Applikation in Tropfenform zur Therapie eines diabetischen Makulaödems eingesetzt werden soll. Im Rahmen dieser Forschungen fand man eine erhöhte Dichte an Kinin-B1-Rezeptoren in Augen von Ratten, bei denen ein Diabetes induziert wurde. Bradykinin, ein Bestandteil des Kallikrein-Renin-Systems, wirkt pro-inflammatorisch. Bisher konnten die Studien zeigen, dass es durch den topischen Einsatz dieses Medikamentes unter anderem zu einer Verringerung der Gefäßpermeabilität kommt. Eine Phase 2 Studie wird derzeit durchgeführt [58]. Neben Wirkstoffen, die einen positiven Effekt bei der Behandlung einer Retinopathie aufweisen, gibt es auch Stoffe, für die kein Nutzen festgestellt werden konnte. Dazu gehört das Calciumdobesilat, das in der groß angelegten CALDIRET-Studie bei Diabetikern vom Typ II mit einer nicht-proliferativen diabetischen Retinopathie getestet wurde. Obwohl es die Kapillarpermeabilität senkt, die Blutviskosität und die Thrombozytenaggregation verringert, konnte kein Einfluss auf mikrovaskuläre Veränderungen in der Netzhaut festgestellt werden. Neben der fehlenden Wirkung, auch bei einem klinisch signifikanten Makulaödem, erzeugte der Wirkstoff keine Komplikationen oder Nebenwirkungen bei den Anwendern [31]. Im Zusammenhang mit der ETDRS wurde Aspirin im Vergleich zu einem Placebo an Diabetikern getestet. Der Cyclooxygenasehemmer hatte trotz seiner negativen Wirkung auf die Thrombozytenaggregation keinen Effekt auf die diabetische Retinopathie [19] Kryokoagulation Die Kryokoagulation ist eine Methode zur Behandlung proliferativer Netzhautveränderungen, wenn eine normale Laserkoagulation wegen fehlender Einsicht durch nicht-resorbierbare Glaskörperblutungen unmöglich ist. Bei vorangehenden 23
29 Untersuchungen muss sichergestellt werden, dass keine Traktionen an der Papille oder den großen Gefäßbögen vorliegen. 15 bis 20 Kälteherde werden in einem 360 Grad Winkel auf Höhe des Äquators transkonjunktival gesetzt. Eine solche Kältetherapie führt zur fast vollständigen Resorption einer Glaskörperblutung. Auch eine vorhandene Rubeosis iridis bildet sich in 57,2% der Fälle zurück. Zur Regression der Gefäßproliferationen kommt es, da durch die Koagulation die minderperfundierten Areale durch Narbengewebe ersetzt und somit die kompensatorischen Neovaskularisationsprozesse unnötig werden. Bereits 6 Monate nach der Koagulation bessert sich der Visus bei 69% der Patienten. Eine hochgradige Sehschärfenverschlechterung findet man in Augen, die zu stark fibrosiert sind. In solchen Fällen sollte keine Kryokoagulation durchgeführt werden, da diese die Fibrosierung anregen kann. Andere Ursachen für eine schlechte Visusentwicklung sind rezidivierende, nicht-resorbierbare Glaskörperblutungen oder eine zentrale Traktionsablatio [56] pars-plana Vitrektomie Ist eine Laserkoagulation nicht möglich, wird heute nur noch selten eine Kryokoagulation durchgeführt, das Mittel der Wahl ist die Vitrektomie. Bei diesem chirurgischen Eingriff wird der Glaskörper ausgeschnitten und abgesaugt und durch eine Tamponade ausgetauscht, die nach einiger Zeit durch eine vom Auge selbst gebildete Flüssigkeit ersetzt wird. Indikationen für eine Glaskörperentfernung sind nicht-resorbierbare Glaskörperblutungen, welche eine Laserung verhindern, schwere progressive fibrovaskuläre Proliferationen, prämakuläre subhyaloidale Blutungen oder eine Traktionsablatio bzw. ein traktives Makulaödem. Durch die Entfernung des Glaskörpers bessert sich neben dem Visus der Patienten auch ein vorhandenes Makulaödem. Dieses Ergebnis kann durch eine Mitentfernung der Membrana limitans interna noch verbessert werden. Bleiben bei dem Eingriff Glaskörperreste zurück oder fehlt die Anheftung des Glaskörperersatzes, bilden diese sofort wieder eine Grundlage für weitere Neovaskularisationen. Deshalb muss eine vollständige Entfernung und eine gute Anlage der Netzhaut durch die Tamponade 24
30 gesichert sein. In Kombination mit dem chirurgischen Eingriff sollten bereits vorhandene Neovaskularisationen mittels einer panretinalen Laserung behandelt werden, um erneute Einblutungen zu verhindern. Patienten mit einem Diabetes mellitus vom Typ I weisen mehr Proliferationen auf, weshalb sich bei dieser Form eine frühe Vitrektomie positiv auf den weiteren Verlauf der Retinopathie auswirkt. Im Vergleich zu später vitrektomierten Patienten weisen diese seltener eine traktionsbedingte Netzhautablösung auf (Ablatio bei früher ppv 13% und bei später ppv 20%) [22,80]. 25
31 3 Lasertherapie 3.1 Entstehungsgeschichte Der Nutzungsbeginn von Lichtstrahlen in der Augenheilkunde liegt in den 1950er Jahren. In dieser Zeit führte Meyer-Schwickerath die Behandlung von Netzhauterkrankungen mittels Lichtkoagulation in die ophthalmologische Praxis ein. Am Anfang wurde die Sonne als Lichtquelle genutzt, bald darauf entwickelte man den Xenonlichtkoagulator. Zu Beginn wurden direkt die Blutgefäße koaguliert, von denen eine Blutung in den Glaskörper ausging. Aber auch Mikroaneurysmen laserte man damals schon. Anfang der 1960er Jahre wurde der erste Laser eingeführt, der Rubinlaser (694nm). Um die Lage der Herde besser steuern zu können, wurde einige Jahre später der Argonlaser mit Wellenlängen im blau-grünen Bereich zur Therapie eingesetzt. Da das blaue Licht besonders im Bereich der Makula gut absorbiert wird, entstanden dabei allerdings Schäden. So hat sich der Argon-grün Laser mit einer Wellenlänge von 514nm gegenüber der Lichtkoagulation für den therapeutischen Einsatz als besser geeignet erwiesen. Seine kleinen Herde sind leichter zu platzieren und seine geringere Energie ermöglicht eine bessere Steuerung hinsichtlich des Ausmaßes der Koagulationsnarben. Kann der Argonlaser wegen einer starken Katarakt oder Glaskörpertrübungen nicht eingesetzt werden, nutzt man viel seltener den Krypton-rot Laser (647nm) wurde eine Studie von Elsner et al. [16] veröffentlicht, in der eine schonendere Laserbehandlung zur Therapie einer diabetischen Makulopathie vorgestellt wurde. Für diese Selektive Retina-Therapie (SRT) verwendeten die Untersucher einen Nd:YLF Laser (Neodym: Yttrium Lithium Fluorid), der eine Wellenlänge von 527nm hat. Es wird für die Applikation der Laserherde nur eine sehr geringe Expositionszeit von 1,7μs gewählt (Vergleich Argonlaser: 0,1s=100ms= μs). Vorteilhaft an dieser Technik ist die fehlende Zerstörung der neurosensorischen Retina, da nur das Pigmentepithel geschädigt wird. So kommt es zu weniger Gesichtsfeldeinschränkungen für den Patienten, besonders 26
32 im zentralen Netzhautbereich. Während der Untersuchung kann keine klinische Beurteilung bzw. Kontrolle der platzierten Laserherde erfolgen, da sie aufgrund der geringen Energie nicht sichtbar sind. Mit Hilfe einer Angiographie mit Indocyaningrün können die Herde sichtbar gemacht werden. Allerdings ist diese schonende Lasertechnik nicht für eine Makulopathie vom rein diffusen Typ geeignet. In einer Studie von Rüfer et.al aus dem Jahr 2008 [62] werden erste klinische Erfahrungen mit dem Pattern Scanning Laser beschrieben. Dieser Laser ist ein Nd:YAG-Laser mit einer Wellenlänge von 532nm, mit dem es möglich ist bis zu 56 Herde auf einmal zu setzen. Im Vergleich zu herkömmlichen Lasern ist die Schmerzempfindung bei den Patienten geringer. Eine Behandlung im Bereich der Makula ist aber schlecht möglich, da die Abtastzeit zu hoch ist und es den Patienten infolge der großen Blendungsempfindung schwerfiel, complient zu bleiben. Bei der Nutzung der Muster kommt es leichter zu unerwünschten Verletzungen von kleinen Gefäßen, wodurch Blutungen provoziert werden. Es empfiehlt sich deshalb bei schlechten organischen Gegebenheiten mit Einzelherden zu arbeiten. Der angestrebte Vorteil dieses Lasersystems war die Zeitersparnis, welche beim Setzen von Einzelherden nicht ausgenutzt werden kann. 3.2 Therapieschemata und deren Indikation bei einer Makulopathie Bei der Therapie diabetischer Netzhautveränderungen haben sich drei verschiedene Koagulationsmethoden bewährt, die fokale und die Grid-Technik im Bereich der Makula und die panretinale Koagulation im Bereich der peripheren Netzhaut. Bei einer ischämischen Makulopathie ist das Areal um die Makula herum durch Okklusionen der makulären Gefäße unterversorgt. Handelt es sich um diese Form der Makulopathie ist keine Behandlung mehr möglich, da eine Lasertherapie zu keiner Besserung der minderperfundierten Situation und damit des Visus des Patienten führen würde. Bei der ödematösen Form eignet sich am besten die Grid- oder auch Gitter-Technik. Infolge des generalisierten Zusammenbruchs der Blut-Retina-Schranke entsteht eine 27
33 ödematöse Aufschwemmung der Netzhaut in einem abgegrenzten Bereich um die Makula herum. In diesem Fall werden großflächig Herde platziert, die C-förmig um die Makula liegen. Ausgespart wird dabei das papillo-makuläre Nervenbündel und ein zentraler Bereich um die Fovea von mindestens 500μm. Die Herdgröße wird dabei zwischen 50μm bis maximal 200μm gewählt. Zu beachten ist, dass die ödematöse Form der Makulopathie auch im Zusammenhang mit einer Schwangerschaft oder der Einnahme von Kontrazeptiva auftreten kann. Vor einer Laserung sollte ein Rückgang des Ödems nach der Entbindung bzw. nach Absetzen des Medikaments abgewartet werden. Ist dies nicht der Fall, wird die Grid-Lasertechnik angewandt. Am besten auf eine Lasertherapie reagieren Makulaödeme der fokalen Form, bei der es zu lokalen Leckstellen um Mikroaneurysmen herum kommt. Mittels Fluoreszenzangiographie werden die Leckagen identifiziert und direkt gelasert. Die Herde haben dabei eine Größe von 50μm und liegen außerhalb einer Zone von 500μm um die Fovea. Häufig befinden sich innerhalb eines Ringes aus harten Exsudaten (auch Circinata-Figur genannt) viele Mikroaneurysmen. In diesem Fall können die Herde auch 200 bis 500μm groß gewählt werden. Der Laser sollte so lange auf eine Stelle gerichtet werden, bis die Netzhaut eine weißlichgelbe Färbung annimmt. Wird zu zaghaft vorgegangen, wird nicht genügend Gewebe zerstört um einen ausreichenden Verschluss der Leckagen zu gewährleisten. Wird andererseits der Herd zu intensiv gelasert, werden Nervenfaserbündel unwiderruflich zerstört oder eine Erneuerung der Blut-Retina-Schranke in diesem Bereich verhindert. Nach einiger Zeit kommt es zur Vernarbung des gelaserten Netzhautbereiches und damit ändert sich auch die Farbgebung. Ältere Laserherde lassen sich an der gräulichen Pfeffer- Salz-artigen Verfärbung erkennen, begründet im Durchscheinen der Sklera, kombiniert mit den histologischen Veränderungen in der Netzhaut, auf die später im Kapitel 4.1 eingegangen wird [88]. Im Anschluss an eine Koagulationstherapie erfolgen in regelmäßigen Abständen Funduskontrollen. Ist nach 4 Monaten kein eindeutiger Rückgang des Ödems zu erkennen 28
34 sollte eine erneute Photokoagulation durchgeführt werden um die verbliebenen Leckagen zu verschließen. Ist der zentrale Bereich der Makula betroffen und ist der Patient in seiner Sehkraft eingeschränkt, so kann mit Hilfe einer adäquaten Laserbehandlung das 3-Jahres Risiko einer fortschreitenden Visusverschlechterung um bis zu 60% gesenkt werden. [17,19,28,85] Die folgende Tabelle zeigt eine Zusammenfassung der beiden Methoden der Makulalaserung. Parameter / Laserart Fokal Grid Herdgröße Expositionszeit Platzierung Mikroaneurysmen direkt μm um Fovea μm 0,05-0,1s Anzahl der Sitzungen 1 Wiederholungsbehandlung C-förmig im Bereich von 500μm um Fovea herum Ödempersistenz nach 3-4 Monaten Tabelle 7: Zusammenfassung der Lasertechniken bei Makulopathie 3.3 Die panretinale Photokoagulation Weist der Patient zusätzlich oder unabhängig von einer Makulopathie proliferative diabetische Veränderungen der peripheren Netzhaut auf, ist eine panretinale Photokoagulation das Mittel der Wahl. Patienten mit einer nicht-proliferativen diabetischen Retinopathie sollten mit einer systemischen Therapie, im Sinne von Blutzuckereinstellung und Hypertoniekontrolle behandelt werden. Eine Lasertherapie sollte so lange abgewartet werden, bis erste Neovaskularisationen auftreten. 29
35 Laut Cheng et al. [9] und DRS [79] sind die wichtigsten Indikationen für eine panretinale Photokoagulation bei diabetischer Retinopathie: Neovaskularisationen auf der Papille Neovaskularisationen an anderer Stelle auf der Netzhaut mit Glaskörperblutungen oder in der Nähe von Papille oder Makula, unabhängig von Blutungen keine Koagulation, wenn die Gefahr besteht, das papillo-makuläre Bündel zu verletzen schwere nicht-proliferative diabetische Retinopathie Neovaskularisationen der vorderen Augenkammer Wird die Koagulation in frühen proliferativen Stadien durchgeführt, so ist es möglich, das Risiko für eine Progression der Retinopathia diabetica und einen schweren Visusverlust um bis zu 50% zu senken [19]. Eine panretinale Photokoagulation kann sowohl als mild scatter als auch als full scatter durchgeführt werden [19,81]. Bei beiden Formen wird ein Bereich vom hinteren Augenpol bis mindestens zum Äquator gelasert. Ausgelassen wird bei der initialen Laserbehandlung ein ovaler Netzhautbereich am hinteren Augenpol, der sich zwei Papillendurchmesser temporal, unter- und oberhalb und 500μm nasal von einer Verbindungslinie zwischen Foveazentrum und nasalem Papillenrand befindet. Als Expositionszeit sollte 0,1s gewählt werden. Beim mild scatter werden 450 bis 600 Herde gesetzt, zwischen denen ein Abstand von einem Herddurchmesser eingehalten werden sollte. In der full scatter Variante setzt man in zwei oder mehr verschiedenen Behandlungen mit einem Abstand von mindestens zwei Wochen 1200 bis 1600 Herde mit einem halben Herddurchmesser Abstand. Je schwerwiegender die proliferativen Veränderungen an der Netzhaut sind, umso aggressiver sollte die Laserung durchgeführt werden. Liegen bereits Glaskörperproliferationen vor, sollte vorher abgewogen werden, ob eine Lasertherapie genügend Vorteile für den Patienten mit sich bringt, da diese Proliferationen durch eine intensive Laserung zum weiteren Wachstum angeregt werden [19]. 30
36 Damit nach einer panretinalen Photokoagulation möglichst keine Nebenwirkungen auftreten, sollten bestimmte Lasereinstellungen berücksichtigt werden. Die Expositionszeit wird häufig bei 0,1s gewählt. Wade et al. [87] zeigten aber, dass eine Expositionszeit von 0,5s zur Behandlung einer proliferativen diabetischen Retinopathie vorteilhafter ist. Einen Visusverlust über zwei Linien hatten 20% der Patienten mit 0,1s Expositionszeit, bei 0,5s dagegen nur 8%. Neue Blutungen traten bei 30% der Gruppe mit 0,1s Laserzeit auf und in der Gruppe mit 0,5s nur bei 16%. Lediglich für Patienten mit Traktionen sind kürzere Expositionszeiten besser geeignet, denn bei 16% aus der 0,5s Patientengruppe traten nach einem Monat Netzhautablösungen auf, bei der Vergleichsgruppe dagegen keine. Der Abstand zwischen zwei Laserterminen sollte zwei Wochen betragen. In einer Studie von Shimura et al. [72] wiesen 92% der Patienten wieder einen normalen Visus auf, wenn zwei Wochen Abstand zwischen den Terminen eingehalten wurden. (bei einer Woche Abstand hatten 89% der Patienten einen normalen Visus). Auch sind weniger zusätzliche fokale Laserungen von Neovaskularisationen nötig (zusätzliche Laserung 42% bei einer Woche Abstand, 36% bei zwei Wochen Abstand). Ebenfalls von Vorteil für die Entwicklung des Visus ist es, peripherer liegende Netzhautanteile mit zu lasern. In einer Veröffentlichung von Blankenship [4] wiesen nur 8% der Patienten nach einer peripheren Koagulation einen Visusverlust von mehr als zwei Linien auf, im Vergleich dazu waren es bei der zentral gelaserten Gruppe 24%. Dabei wurden die Herde bei der zentralen Laserung näher an die Papille gesetzt, bei der peripheren Methode hingegen so weit peripher wie möglich in Richtung Ora serrata. Die mittlere Peripherie wurde bei beiden Varianten in gleicher Art und Weise koaguliert, da dieser Bereich die meisten vaskulären Störungen aufweist [70]. Die Herdgröße auf der Retina variiert je nach verwendetem Kontaktglas. Barr [2] berechnete in seiner Studie für das Drei-Spiegel Kontaktglas nach Goldmann und für das Panfunduskop der Firma Rodenstock die Größe der Herde, die mittels Argonlaser auf der Netzhaut gesetzt werden. Die Messungen wurden einen bzw. zwei Tage nach der Laserbehandlung an autopsierten Augen durchgeführt. Am Laser wurde eine Herdgröße von 500μm und eine Expositionszeit von 0,1s ausgewählt. Im Mittel betrug die Herdgröße beim Goldmann-Kontaktglas 490 ± 15μm (0,190 ± 0,041mm²) und für das Rodenstock 31
37 Panfunduskop 810 ± 20μm (0,509 ± 0,032mm²). Er berechnete die Gesamtfläche der Netzhaut mit etwa 1100mm². Unter Abzug des auszusparenden Bereiches um die Makula und die Papille von circa 50mm² bleiben für die Koagulation eines emmetropen Auges 1050mm² Netzhautfläche. So können ohne Überlappung der Laserherde mit dem Kontaktglas nach Goldmann maximal 5500 Herde und mit dem Rodenstock Panfunduskop maximal 2050 Herde auf der gesamten Netzhaut verteilt werden. Diese maximale Herdanzahl und die Tatsache, dass durch das Panfunduskop fast doppelt so Große Narben entstehen wie vorgesehen, muss bei zusätzlichen Laserbehandlungen beachtet werden. In der folgenden Tabelle sind die beiden Formen der panretinalen Photokoagulation noch einmal zusammenfassend gegenübergestellt. Parameter / Laserart mild scatter full scatter Herdgröße 500μm Expositionszeit 0,1s Anzahl der Herde Platzierung unter Aussparung einer Fläche von zwei Papillendurchmesser temporal, ober- und unterhalb und 500μm nasal von Makula und Papille Herdabstand 1 Herddurchmesser ½ Herddurchmesser Sitzungen 2 mit zwei Wochen Abstand Tabelle 8: Zusammenfassung panretinale Photokoagulationstechniken Weist der Patient ein Makulaödem kombiniert mit leichten proliferativen Veränderungen auf, sollte je nach Art der Makulopathie erst eine Behandlung mittels fokaler oder Grid- Technik erfolgen und zu einem späteren Zeitpunkt eine panretinale Photokoagulation. Ist die Makulopathie mit schweren proliferativen Netzhautveränderungen vergesellschaftet, wird eine gleichzeitige fokale und mild scatter Photokoagulation empfohlen [19]. 32
38 3.4 Komplikationen der Lasertherapie Eine Zusammenfassung aller Komplikationen, die im Zusammenhang mit einer Photokoagulation auftreten können, hat die Gruppe um Townsend erstellt [83]. Die möglichen unvermeidlichen Nebenwirkungen lassen sich dabei in drei verschiedene Untergruppen aufteilen. sofort auftretende unvermeidliche Nebenwirkungen (Rückbildung innerhalb einer Stunde nach Laserbehandlung): Visusminderung (durch Blendung) Patient sieht alles rot oder pink (Wellenlänge des Argonlasers im grünen 7Bereich) etwas später auftretende unvermeidliche Nebenwirkungen (treten innerhalb von einer bis vier Wochen auf): milde Uveitis Visusminderung anhaltende unvermeidliche Nebenwirkungen (können sich in einem Zeitraum von 6 bis 18 Monaten noch zurückbilden): Störung der Dunkeladaptation (vorrangig in der Peripherie vorkommende Stäbchen werden zerstört) Skotome (fehlende Photorezeptoren im Bereich der Lasernarben) Wahrnehmungsstörungen im blau-grünen Farbbereich Pupillendefekte (Verletzung durch Laser) Des Weiteren werden die Komplikationen, die im Zusammenhang mit der Photokoagulation auftreten, in zufällige und chirurgische unterteilt. zufällige Komplikationen: Kammerwinkelverschluss (Laser-assoziierte Myopie, Rückbildung nach ca. einer Woche) Netzhautablatio 33
39 Makulaödem und Verschlechterung vorhandener Ödeme Gefäßverschluss großer Netzhautgefäße Blutungen Fibrosierungen chirurgische Komplikationen: Verbrennungen an Kornea, Linse (Kataraktbildung) oder Makula Makulaödem und Progression vorhandener Ödeme 34
40 4 Wirkweise der Laserkoagulation Da die Lasertherapie eine wichtige Rolle bei der Behandlung der Retinopathia diabetica spielt, soll in diesem Kapitel speziell auf die spezifische Wirkung der Laserstrahlung auf die Netzhaut und die daraus resultierenden Veränderungen an den Gefäßen, Zellen und dem Glaskörper eingegangen werden. Bedingt durch die Laser-induzierten Veränderungen der Gewebeeigenschaften verbessert sich unter anderem die Sauerstoffversorgung in der Retina. Vorhandene Neovaskularisationen bilden sich zurück und der Stimulus für die Neubildung von Gefäßen entfällt. Veränderungen der Endothelpermeabilität führen zur Resorption vorhandener Exsudate und durch die Strahlung können Mikroaneurysmen und Blutungen direkt lokal behandelt werden. Die durch die thermische Wirkung erzeugten Narben dienen der Ablationsprophylaxe. 4.1 thermisch-induzierte histologische Gewebeveränderungen Um die von den Laserstrahlen erzeugten histologischen Veränderungen darstellen zu können, ist es nötig, den normalen Aufbau der Netzhaut zu beschreiben. Angrenzend an die Bruchmembran liegt die äußerste Schicht der Netzhaut, das retinale Pigmentepithel, das der Lichtabsorption und Ernährung der Photorezeptoren dient. Es folgt die Photorezeptorenschicht, sie wird aus den Außen- und Innensegmenten der Stäbchen und Zapfen gebildet. Die Rezeptoren werden durch eine Gliaschicht, die äußere Grenzmembran, geteilt. Zellkerne der Photorezeptoren bilden die äußere Körnerschicht. In der äußeren plexiformen Schicht liegen die Axone der Stäbchen und Zapfen und verbinden diese unter anderem mit den Bipolarzellen. Die Zellkerne der Bipolar-, Horizontal- und amakrinen Zellen befinden sich in der inneren Körnerschicht. Die Axonverbindungen der Bipolarzellen mit den Ganglienzellen bilden die innere plexiforme 35
41 Schicht, auf diese folgt die Ganglienzellschicht. Ganglienzellaxone ziehen horizontal bis zur Papille und bilden die Nervenfaserschicht. Als innere Grenzmembran bezeichnet man die Endfortsätze der Müller-Stützzellen, welche durch die gesamte Netzhaut ziehen und hier die Grenze zum Glaskörper bilden. Im Bereich der Makula sind die Bipolar- und Ganglienzellen zur Seite verlagert. Durch diese Ausdünnung gelangen Strahlen direkt an die äußersten Schichten, weshalb es sehr wichtig ist diesen Bereich bei einer Laserbehandlung auszulassen. Die oben beschriebene Schichtung der Netzhaut stellt die folgende Zeichnung schematisch dar [47]. Abbildung 1: schematische Netzhautdarstellung [47] 36
42 Treffen Laserstrahlen auf die Netzhaut, wird ihre Energie vom Melanin im retinalen Pigmentepithel absorbiert. Dadurch erhitzen sich die folgenden Netzhautschichten auf 70 bis 100 Grad Celsius und die enthaltenen Eiweiße werden koaguliert. Die Läsionen dehnen sich kegelförmig in Richtung der inneren Netzhautschichten aus [21,68]. Als Nebenwirkung bekannte Gesichtsfeldausfälle entstehen als Folge dieser Schädigung der Netzhaut und der darin enthaltenen nuklearen und plexiformen Schichten. Je mehr Herde auf der Netzhaut gesetzt werden, umso größer sind die Auswirkungen auf die Lichtunterscheidungsempfindlichkeit [55]. Außerdem kommt es durch die Laserwirkung zu einer Schwellung der Netzhaut. Die damit verbundene Zunahme des Nervenfaserdurchmessers muss nicht zwingend als krankhaft angesehen werden, da Diabetiker eine kleinere Nervenfaserdicke aufweisen als Vergleichspersonen ohne Diabetes mellitus. Veränderungen an der Papille eines kürzlich gelaserten Patienten mit Diabetes und Glaukom als glaukomatöse Veränderungen zu werten, könnte somit zu einer Fehldiagnose führen [61]. In einer Studie von Wallow et al. [88] wurden menschliche Netzhäute auf die Struktur der laserinduzierten Narben hin untersucht. Folgendes konnte dabei gezeigt werden: Es wurden drei Laserarten berücksichtigt. Das waren Xenon- und Argonlicht, wobei man die Laserung mit Argon noch in kurze (0,1s) und lange (0,5s) Expositionszeiten unterteilte. Die Membrana limitans interna als innere Grenze zum Glaskörper blieb bei allen drei Laservarianten unverletzt, genau wie die Bruchmembran als Grenze zur außen liegenden Choroidea. Die darunter liegende Choriocapillaris weist durch die Erhitzung in unregelmäßigen Abständen Verschlüsse des Lumens auf. Es befinden sich keine kleinen Blutgefäße mit offenem Lumen in diesem Bereich. Große Blutgefäße haben dagegen ein weites Lumen und eine verdickte Gefäßwand. Je nach eingesetztem Laser variieren die Narbendurchmesser. Xenonlicht erzeugt die größten Narben mit einer Fläche von 1280μm. Bei der Verwendung von Argon mit einer langen Expositionszeit entstehen μm große Narben. Bei kurzen Argonexpositionszeiten entstehen etwa 350μm messende Narben. 37
43 Unterschiedliche Pigmentierungen innerhalb der Narben korrelieren mit dem Regenerationsgrad des Gewebes. In allen Narben sind pigmentbeladene Makrophagen enthalten, die dem Abbau des nekrotischen, melaninhaltigen Pigmentepithelgewebes dienen. Sie lagern sich bei den Xenon- und den Argonnarben mit langer Expositionszeit ringförmig um eine zentral liegende weiße atrophische Zone. Innerhalb dieser hypopigmentierten Areale befinden sich proliferierende Pigmentepithelzellen als einzige Quelle einer Regeneration. Die Pigmentepithelzellen sind Duplikationen von Nachbarzellen, die entlang der Bruchmembran in das Narbengewebe einwachsen und somit nicht neu gebildet sind. Am Übergang zur hyperpigmentierten Makrophagenzone liegen proliferierende Gliazellen, welche die zerstörten äußeren und inneren Netzhautschichten ersetzen sollen. Bei Argonlaserläsionen mit kurzer Expositionszeit und Narben, die durch lange Expositionszeiten entstanden sind aber weniger schwere Veränderungen nach sich gezogen haben, ist die Struktur umgekehrt. Zentral befindet sich hier die hyperpigmentierte Zone aus Makrophagen und um diese herum das neugebildete Pigmentepithel. Da die inneren Netzhautschichten weniger stark verletzt wurden, ist in diesem Bereich ein Ersatz durch Gliagewebe möglich. Pigmentierte Makrophagen liegen innerhalb dieses Gliagewebes, wodurch die darunterliegenden hypopigmentierten Pigmentepithelzellen überdeckt werden und das Zentrum marmoriert erscheint. Bei schwereren Verletzungen durch Xenonlicht sind die inneren Netzhautschichten nicht ersetzbar, weshalb nur die Pigmentepithelzellen als helles Zentrum, aufgrund des Pigmentverlustes, erkennbar sind. Durch die Umformung der in Folge der diabetischen Veränderungen entstandenen, hypoxischen Areale in avaskuläres Narbengewebe wird der Stimulus für die Bildung von Neovaskularisationen genommen. Ausschlaggebend dabei ist die Zerstörung der Photorezeptoren, die wegen ihres hohen Gehalts an Mitochondrien einen großen Sauerstoffbedarf haben. Fehlen diese, ist eine bessere Sauerstoffversorgung der inneren Netzhautschichten möglich [49]. Eine nach der Lasertherapie kurzzeitig auftretende Hyperämie der Aderhaut durch die erweiterten choroidalen Blutgefäße ermöglicht die Diffusion von großen Sauerstoffmengen direkt in die Netzhaut. Für die schnelle Regeneration des Pigmentepithels und damit der Blut-Retina-Schranke stehen somit genügend Nährstoffe zur Verfügung [68]. 38
44 Die oben beschriebene Narbenbildung findet in einem Zeitraum von etwa 10 Tagen statt. Das gebildete Narbengewebe verankert die Netzhaut fester am Untergrund und dient so auch der Prophylaxe einer Traktionsamotio. Früher machte man sich die Lichtabsorption durch das Hämoglobin im Blut zu Nutze und hat Neovaskularisationen zur Blutungsprophylaxe direkt gelasert [21,68,93]. Da aber ein vollständiger und langanhaltender Verschluss der Gefäße nicht immer gewährleistet ist und es bei ungenauen Herdplatzierungen zu Schädigungen des umgebenden Gewebes kommen kann, ist man zur panretinalen Laserung übergegangen. Genutzt wird dabei unter anderem der oben beschriebene Effekt, der zu einer verbesserten Sauerstoffbilanz des Netzhautgewebes führt, wodurch es zur Obliteration der neugebildeten Gefäße kommt. Außerdem führt die panretinale Laserkoagulation zu einer verminderten Freisetzung vasogener Faktoren, womit ein indirekter Effekt gegen die Neovaskularisationen gesetzt wird. Zur Behandlung einer Makulopathie werden Mikroaneurysmen als Orte einer potentiellen Leckage direkt gelasert um diese zu verschließen. Besonders in diesem zentralen Netzhautbereich ist es wichtig, kontrollierte Laserherde zu setzen und die umgebenden Strukturen nicht zu schädigen. Aus diesem Grund wird heute meist ein Argon-grün Laser verwendet. Früher wurden Wellenlängen im blau-grünen Bereich genutzt. Blaues Licht wird heute aber herausgefiltert, da es in besonderem Maße vom im Makulagelb befindlichen Xantophyll absorbiert wird. Ein Mindestabstand der Laserherde zur Fovea ist trotzdem zu beachten. Die funktionell wichtige Zone um Foveola und papillomakuläres Bündel muss von der Laserung ausgespart werden, weil der Schädigungseffekt auf die innere plexiforme Schicht und die Ganglienzellschicht nie ausgeschlossen werden kann. 4.2 Änderungen der hämodynamischen Eigenschaften Bei gegebener Indikation kann eine Behandlung mittels Lasertechnik bei einem Patienten durchgeführt werden. Die Laserstrahlen erzeugen Gewebeveränderungen, die sich auf die Mikrozirkulation des 39
45 Auges auswirken. Eine Beeinflussung der Makrozirkulation findet dabei nicht statt [65]. Die Veränderungen der Fließeigenschaften können mittels verschiedener Messtechniken nachgewiesen werden. Wird mittels Laserenergie das Gewebe der Netzhaut koaguliert, findet eine teilweise Obliteration der Choriocapillarisgefäße statt. Deshalb kann eine Pan-retinale- Photokoagulation auch als eine Pan-choroidale-Photokoagulation bezeichnet werden. Die Choriocapillaris ist eine Schicht der Choroidea, die an die Netzhaut grenzt und der Versorgung dieser mit Nährstoffen dient. In einer Studie von Schmitt et al. [65] wurde eine post-laser auftretende Reduktion der okulären Pulsamplitude und des pulsatilen okulären Blutflusses gemessen. Der Grund für diese Erscheinungen sind die reversiblen Gefäßobliterationen im Bereich der Choriocapillaris, die für eine verminderte pulsatile Durchblutung der Aderhaut verantwortlich sind. Da für eine gute Regeneration der Netzhaut eine ausreichende Nährstoffversorgung von Seiten der Aderhaut nötig ist, beeinflusst die vorherige Durchblutungssituation der Choroidea und die Intensität der Laserung den Erfolg einer Laserbehandlung. Ähnliche Ergebnisse zeigt eine Veröffentlichung von Takahashi et al. [78], bei welcher der choroidale Blutfluss im Bereich der Makula untersucht wurde. Das Blutvolumen war nach einer Laserbehandlung verringert, der Blutfluss um 46% erhöht. Die Untersuchungen zeigten, dass eine panretinale Laserung die Fließeigenschaften des Blutes normalisiert, da bei Patienten mit Diabetes mellitus vom Typ II das Blutvolumen erhöht und der Blutfluss vermindert ist. An dem Ort, an dem die Laserherde platziert werden, kommt es vor der Narbenbildung zu einer Entzündungsreaktion. Grund für diese Inflammation ist das durch Nekrose zugrunde gehende Netzhautgewebe. Durch diese Entzündung wird die NO-Synthase stimuliert, welche daraufhin Stickstoffmonoxid (NO) produziert. Auf dieses NO reagieren die nichtobliterierten Blutgefäße im Bereich der Makula mit einer Dilatation. Diese autoregulatorischen Mechanismen erklären die gemessenen Werte. 40
46 Zu einem verminderten Blutfluss im Bereich der mit Laser behandelten mittleren Netzhautperipherie kann es nicht nur infolge direkter Gefäßverschlüsse kommen. Durch die Zerstörung der Photorezeptoren in der Netzhaut ist das Sauerstoffangebot in diesen Bereichen höher als der Bedarf. Auf Grund des erhöhten Sauerstoffdrucks kommt es in den arteriellen retinalen Gefäßen zu einer autoregulatorischen Vasokonstriktion. Diese Vasokonstriktion ist allerdings als eine Normalisierung in Richtung gesunder Gefäßdurchmesser zu sehen, da die bei einer diabetischen Retinopathie vorherrschende hypoxische Lage im Vorfeld zu einer Vasodilatation geführt hat. Eine vollständige Rückführung auf normale Verhältnisse ist aber kaum möglich, da die diabetischen Veränderungen an den Blutgefäßen dies nicht zulassen. Nachgewiesen wurde dies von Bertram et al. [3] anhand von Messungen der arterio-venösen Passagezeit, die nach einer panretinalen Lasertherapie verringert war. Diese Verringerung ist Zeichen einer Vasokonstriktion, die wiederum Folge einer Laser-induzierten besseren Oxygenierung der Netzhaut ist. In der temporalen Netzhaut konnten diese Werte nicht bestätigt werden. Begründet werden kann dieses Ergebnis durch die Aussparung der Makula beim Lasern. Da ein kleinerer Netzhautanteil gelasert wird, ist der Effekt auf die Sauerstoffbilanz in diesem Bereich nicht so groß und mithilfe der arterio-venösen Passagezeit nicht nachweisbar. Die Besserung der Sauerstoffbilanz durch Änderungen der hämodynamischen Eigenschaften hat auch positive Effekte auf eine bestehende Makulopathie. Wie bereits erwähnt, führt ein erhöhter Sauerstoffgehalt zur Vasokonstriktion. Verbunden mit dieser Lumenverringerung in den Arterien ist auch eine Abnahme des hydrostatischen Druckes innerhalb der venösen und kapillären Gefäße. Dadurch wird die passive Permeabilität durch die Gefäßwände verändert, sodass weniger Flüssigkeit aus den Gefäßen in die Retina dringt und vorhandene Ödeme sich zurückbilden können. Wichtig dabei ist, dass keine Steigerung des aktiven Transportes durch die Photokoagulation erfolgt, sondern eine Minderung der passiven Permeabilität. Dieser Effekt wird bei der Behandlung einer Makulopathie mittels der Grid oder fokalen Lasertechniken ausgenutzt [63]. 41
47 4.3 Einfluss auf die Blut-Retina-Schranke und Wachstumsfaktoren Das Auge verfügt über zwei Blut-Retina-Barrieren. Diese sind eine äußere, die von den Tight-junctions der Pigmentepithelzellen gebildet wird und eine innere, die von den Tight junctions der retinalen Endothelzellen gebildet wird. Durch einen Laserherd wird die äußere Blut-Retina-Schranke durch Hitze zerstört. Diese Schädigung ist allerdings nach einigen Wochen durch Regeneration der Pigmentepithelzellen zum Großteil reversibel. Die innere Barriere bleibt im Normalfall intakt. In einem Experiment von Peyman et al. [57] wurde dies bei Netzhäuten von Affen nachgewiesen. Verabreichte man Peroxidase nach einer Laserbehandlung intravitreal, diffundierte diese durch das Narbengewebe hindurch bis in die Choriocapillaris. Intravenös verabreicht konnte die Peroxidase bis in die äußeren Netzhautschichten durchdringen. Die Diffusion der Stoffe ist dabei in Richtung retinal-choroidal größer als in choroidal-retinaler Richtung. Möglich erscheint dies nur durch unterschiedliche Druckverhältnisse zwischen Glaskörper, Retina und Choroidea. Auf diesem Weg ist es möglich, dass Flüssigkeiten aus retinalen Ödemen nach einer Lasertherapie abgebaut werden können, was bei der Behandlung einer Makulopathie von Nutzen sein kann. Nach einigen Tagen kommt es zur Pigmentepithelregeneration und der Neubildung einer Blut-Retina-Schranke, womit diese Permeabilität wieder abnimmt. Diese abnehmende Permeabilität wurde von McNaught et al. mit verschieden großen Dextranmolekülen nachgewiesen [50]. Eine weitere Theorie geht davon aus, dass durch den nekrotischen Gewebeuntergang nach einer Koagulation eine Entzündungsreaktion zu einem Zusammenbruch der Blut- Retina-Schranke führt [15]. Die dadurch verursachte erhöhte Permeabilität erzeugt, nach Meinung dieser und anderer Autoren, einen Flüssigkeitsstrom in Richtung des Augeninneren. Dieser Strom kann nach Blondeau et al. [5] auch zu einer akuten Zunahme des intraokularen Druckes führen. Bereits nach wenigen Stunden oder spätestens nach Abklingen der Entzündungsreaktion ist dieses Phänomen reversibel. Wie oben beschrieben dominiert zu einem späteren Zeitpunkt der Strom aus dem Augeninneren heraus. Die durch eine Entzündung erhöhte Endothelpermeabilität kann mittels Messungen von 42
48 Zytokinkonzentrationen nachgewiesen werden. Dafür wird der Glaskörper von vitrektomierten Patienten, die vorher auch eine Photokoagulation erhalten haben, auf das Vorhandensein von Zytokinen hin untersucht. Zu den die Endotheldurchlässigkeit steigernden Faktoren zählen zum Beispiel die inflammatorisch wirkenden Zytokine RANTES, IL-6, SDF-1 und VEGF. Nach der panretinalen Koagulation der Netzhaut kommt es zur Nekrose des zerstörten Gewebes. Bei der folgenden Entzündungsreaktion werden die pro-inflammatorischen Zytokine ausgeschüttet. In einer Studie von Shimura et al. [71] wurden Glaskörperflüssigkeiten auf den Gehalt von VEGF, SDF-1, RANTES und IL-6 hin untersucht. Dabei wurde festgestellt, dass der VEGFund SDF-1-Gehalt nicht durch eine panretinale Koagulation beeinflusst wird. Die Konzentration an IL-6 und RANTES war nach einer Laserbehandlung jedoch höher. Die durchschnittlichen Konzentrationen von IL-6 und RANTES bei der gelaserten Patientengruppe und der nicht-gelaserten Kontrollgruppe sind aus der folgenden Tabelle zu ersehen. Faktor / Laser PRP keine PRP IL-6 520,3 ±258,2 pg/ml 390,7 ±150,5 pg/ml RANTES 2104,1 ±310,4 pg/ml 1942 ±198,8 pg/ml Tabelle 9: Glaskörperkonzentrationen für IL-6 und RANTES [71] Bei der Veröffentlichung von Augustin et al. [1] wurden die Konzentrationen von VEGF und Lipidperoxiden in den Glaskörpern von 208 vitrektomierten Patienten gemessen. Unterteilt wurden die Patienten dabei in drei Gruppen, abhängig von der Zeitspanne, die zwischen Koagulation und Vitrektomie lag. Die VEGF-Konzentration wird hierbei untersucht um die Wirkung der Laserstrahlen auf Faktoren hin zu untersuchen, welche die Neovaskularisation stimulieren. Lipidperoxid wird zur Beobachtung der Lasereffekte auf Produkte von oxidativen Metaboliten gemessen. Diese Glykosylierungsprodukte entstehen in den Zellen der Netzhaut beim Abbau akkumulierter Glukose über Alternativwege und sind ein wichtiger Faktor bei der 43
49 Entstehung der diabetischen Retinopathie. Die Lipidperoxidkonzentrationen konnten durch die Photokoagulation sofort deutlich reduziert werden. Mit zunehmendem Zeitintervall zwischen Koagulation und Operation sinken die Werte weiter ab. Ähnliche Ergebnisse wurden auch für VEGF gefunden. Bei Diabetikern vom Typ I sind die Konzentrationen im Glaskörper höher als für Patienten vom Diabetes mellitus Typ II. Die Koagulation führte auch hier sofort zu einer Senkung der Konzentrationen und bei Typ I Diabetikern nochmals zu einer starken Reduktion nach 3 Monaten. Bei Diabetes mellitus Typ II Patienten war ein Intervall von über 3 Monaten notwendig um eine sichtbare Konzentrationserniedrigung zu verzeichnen. Mit Hilfe dieser Studie konnte ein positiver therapeutischer Effekt der Lasertherapie auf Faktoren, die die diabetische Retinopathie erzeugen und deren Progression fördern, nachgewiesen werden. Mit der Verringerung der oxidativen Metabolite wird die Entstehung neuer Gefäßschäden durch erhöhte Blutzuckerwerte kurzzeitig reduziert. Die Abnahme der VEGF-Konzentration entnimmt dem Auge einen wichtigen Wachstumsreiz, der zur Bildung von Neovaskularisationen beiträgt. Jedoch sind diese Effekte nicht von Dauer, wodurch nochmals die Notwendigkeit einer ganzheitlichen Behandlung des Diabetes mellitus unterstrichen wird. Das beinhaltet eine panretinale Koagulation sowie die genaue Stoffwechseleinstellung durch einen Diabetologen. 44
50 5 Zielstellung der Arbeit Im vorangehenden Teil der Arbeit sind die verschiedenen Faktoren, welche zur Entstehung und Progression einer diabetischen Retinopathie beitragen, genannt. Die gängigen Strategien für eine Laserbehandlung bei diabetischen Augenveränderungen wurden vorgestellt und unter Berücksichtigung der pathogenetischen Mechanismen konnten verschiedene Theorien zum Wirkmechanismus der Laserstrahlung dargestellt werden. Im folgenden Teil wird die Möglichkeit untersucht, eine im Zusammenhang mit einer diabetischen Retinopathie aufgetretene Makulopathie mit einer panretinalen Photokoagulation zu therapieren. Eine solche Behandlung der diffusen Makulopathie mittels panretinaler Koagulation würde eine sanfte Alternative darstellen, da auf diesem Wege die Netzhaut im wichtigen zentralen Bereich weniger oder gar nicht geschädigt werden müsste. Bisher werden ödematöse Veränderungen im Bereich der Makula mittels Gitter- oder fokaler Technik gelasert. Eine Makulopathie wird im Zusammenhang mit einer panretinalen Laserung von den meisten Autoren nur als häufigste Nebenwirkung beschrieben. Unterstützt wird die hier geäußerte Hypothese zur Variation der Photokoagulationstherapie durch eine Veröffentlichung aus dem Jahr Wessel et al. [89] konnten in einer retrospektiven Auswertung von Ultra-Weitfeld Floureszenzangiografiebildern einen Zusammenhang zwischen peripherer Ischämie und einem diabetischen Makulaödem zeigen. Die Datenanalyse ergab, dass Diabetiker mit peripher minderperfundierter Netzhaut fast vier mal häufiger ein Makulaödem entwickeln als Patienten ohne periphere Ischämien. Die Studie lässt somit vermuten, dass eine Lasertherapie zur Verringerung der minder durchbluteten Areale in der Netzhautperipherie geeignet sein könnte, eine diabetische Makulopathie zu heilen. Nachfolgend werden verschiedene Studien zur panretinalen Lasertherapie hinsichtlich des Auftretens eines Makulaödems verglichen, um so die aufgestellte Hypothese zu bekräftigen. 45
51 6 Behandlung der Makulopathie mittels panretinaler Photokoagulation 6.1 Einführung Makulopathie Als Makulopathie werden diabetische Netzhautveränderungen im Bereich der Makula am hinteren Augenpol bezeichnet. In Deutschland weisen 23% aller Typ-II Diabetiker und 15% der Diabetiker vom Typ I solche Veränderungen am Augenhintergrund auf. Als wichtige Risikofaktoren, welche die Ödembildung im Bereich der Makula begünstigen, gelten unter anderem die Diabetesdauer, das Alter des Patienten, der Diabetestyp (Typ I oder II), die Blutkonzentration an glykosyliertem Hämoglobin (HbA1c) und ein arterieller Hypertonus [91]. Bei der augenärztlichen Untersuchung kann man mit Hilfe der binokularen Spaltlampenmikroskopie derartige Augenhintergrundveränderungen der Netzhaut erkennen. Zur genaueren Klassifizierung erweisen sich die OCT (Optical Coherence Tomography) zur genauen Bestimmung der Netzhautdickenzunahme und die Fluoreszenzangiographie zur Ortung der Leckagen als nützlich. Es können drei Formen unterschieden werden. Durch okkludierte Gefäße in diesem Bereich ist die ischämische Makulopathie gekennzeichnet. Eine Sanierung dieser hypoxischen Stoffwechsellage mittels Lasertherapie ist nicht mehr möglich. Ein generalisierter Zusammenbruch der Blut-Retina-Schranke führt zur ödematösen Verdickung der Netzhaut. Ist dabei ein abgegrenzter Bereich um die Makula herum betroffen, bezeichnet man diese Form der Makulopathie als diffus. Mittels großflächiger, gitterförmiger Laserung der Netzhaut in diesem Bereich kann ein Rückgang des Ödems erreicht werden. Das fokale Ödem ist durch einzelne, fleckförmige Leckagen gekennzeichnet, die mit Hilfe einer Fluoreszenzangiographie identifiziert und mit fokalen Laserherden verschlossen werden können. Bei diesen Formen der Lasertherapie werden die Herde direkt im Bereich der Makula platziert und zerstören an der schärfsten Stelle des Sehens wichtige Photorezeptoren. 46
52 Wäre es möglich, ein Makulaödem mit einer panretinalen Photokoagulation zu behandeln, könnte man Nebenwirkungen wie Gesichtsfelddefekte und Visusverlust vermeiden. Jedoch gilt bisher das Auftreten oder die Verschlechterung eines bereits vorhandenen Makulaödems als eine der häufigsten Nebenwirkungen der panretinalen Koagulation. Dabei kann das Ödem vorübergehend für einige Stunden oder Wochen oder gar persistierend sein. Es wurden auch Studien veröffentlicht, die eine Regression eines vor der Koagulation bestehenden Ödems nachweisen konnten. 6.2 Vorstellung wichtiger Studien Nachfolgend werden einige wichtige Studien vorgestellt, die sich mit der panretinalen Lasertherapie bei diabetischer Retinopathie befassen, unter dem Aspekt der Auswirkung dieser auf eine Makulopathie. Hierbei werden die Neubildung, Rückbildung und Verschlechterung eines Ödems im Bereich der Makula verglichen und auf einen eventuellen Zusammenhang mit den genutzten Laserparametern hin untersucht. Ziel ist es, die bestmöglichen Eigenschaften einer panretinalen Photokoagulation zu ermitteln, die geeignet wäre, eine Makulopathie zu kurieren. S.M. Meyers Macular edema after scatter laser photocoagulation for proliferative diabetic retinopathy Meyers [52] behandelte bei drei Patienten fünf Augen mit proliferativer diabetischer Retinopathie mittels panretinaler Photokoagulation. Die Patienten wiesen vor der Behandlung keine Makulopathie auf, entwickelten aber nach der Laserbehandlung ausnahmslos ein transientes Makulaödem. Als Laserparameter wurde ein Herddurchmesser von 200 bis 500μm und eine Expositionszeit von 0,1 oder 0,2s gewählt. Etwa 1500 Laserherde wurden dabei in der ersten Sitzung im unteren und in einer zweiten Sitzung im oberen Abschnitt der gesamten Netzhaut verteilt. Mindestens zwei Wochen lagen zwischen den einzelnen Laserterminen. Die Verteilungsgrenzen der einzelnen Laserherde in den Sitzungen ist in folgender 47
53 Abbildung mit einer Schraffierung schematisch skizziert. Abbildung 2: Panretinal gelaserter Augenhintergrund. Aufbereitet in Anlehnung an die Beschreibungen aus der Studie von Meyers 1980 [52] und Shimura et al [71]. (die Reihenfolge entspricht den Ziffern) Die durch diabetische Veränderungen bereits instabilen Gefäße im perifovealen Bereich reagieren auf die panretinale Photokoagulation mit Exsudation. Ursache ist die durch die Koagulation induzierte Inflammation. Eine andere Erklärung ist der veränderte Blutfluss aufgrund der erhöhten Oxygenierung im Bereich der gelaserten Netzhaut. Die Schwere des auftretenden Makulaödems kann mit einer Modifizierung der Lasertechnik vermindert werden. Die Expositionszeit und Intensität der Laserherde sollte dabei verringert werden, ebenso deren Anzahl. In den meisten Fällen führt die Photokoagulation dann nur zu einer vorübergehenden Einschränkung der Sehkraft. H.R. McDonald, H. Schatz Macular edema following panretinal photocoagulation McDonald und Schatz [49] behandelten 175 Patientenaugen mit proliferativen Veränderungen, von denen 90% vor der panretinalen Photokoagulation bereits eine Makulopathie aufwiesen. Es wurde bei der Koagulation mit einem Argonlaser gearbeitet, die Expositionszeit wurde mit 0,05s gewählt. Es wurden 500μm große Laserherde in 48
54 mehreren Sitzungen mit einem Abstand von drei bis 21 Tagen gesetzt. Im Durchschnitt wurden 2300 Herde auf der gesamten Netzhaut verteilt. Dabei wurde ein Abstand von zwei Papillendurchmessern temporal der Fovea eingehalten. In der ersten Sitzung wurde der Bereich um den Sehnerv und die großen Gefäßarkaden koaguliert. Bei den folgenden Terminen hat man die periphere Netzhaut gelasert, wie es in Abbildung 3 ersichtlich ist. 60% der Patienten wurden an jeweils drei verschiedenen Tagen photokoaguliert, die restlichen 40% verteilten sich gleichmäßig auf zwei oder vier Laserbehandlungen. Abbildung 3: Panretinal gelaserter Augenhintergrund. Die Skizze ist den Beschreibungen aus der Studie von McDonald und Schatz nachempfunden [49].( die Ziffern in den Kreisen geben die Laserreihenfolge wieder) In einem Zeitraum von sechs bis zehn Wochen nach der panretinalen Photokoagulation entwickelte bzw. verschlechterte sich in 43% der Augen ein Makulaödem. Das entspricht 75 Patientenaugen. 64% dieser Augen wurden während der Behandlung mit mehr als 2200 Herden versehen. Bei 28 Patienten (37%) bildete sich das Makulaödem zurück, bei den restlichen 63% (47 Patientenaugen) war es persistent. Das entspricht einem Anteil von 27% von allen gelaserten Patientenaugen. Von diesen 63% zeigten 33% (16 Augen) eine Verschlechterung der Sehkraft von mehr als zwei Linien. Bei zwei dieser Augen war 49
55 nicht das Makulaödem die Ursache für die Sehkraftminderung. Trotz Makulaödem sind die Aussichten für die Entwicklung der Sehkraft gut, da nur bei 8% eine deutliche Verschlechterung des Visus auftrat. Da in dieser Studie keine Kontrollgruppe involviert war, kann nicht beurteilt werden, ob das Makulaödem eine direkte Folge der Laserbehandlung ist oder dem Spontanverlauf der diabetischen Retinopathie entspricht. Als mögliche Ursachen für die Entwicklung eines Makulaödems im Zusammenhang mit der panretinalen Laserkoagulation werden zwei Theorien genannt. Zum einen führt die Koagulation zur Nekrose des Netzhautgewebes, wodurch es zur Inflammation kommt, die wiederum zu Leckagen in den Kapillaren führt. Andererseits steigt durch die Zerstörung des retinalen Pigmentepithels der Sauerstoffpartialdruck in der Netzhaut. Es kommt daraufhin zur Vasokonstriktion im Bereich der arteriellen Blutgefäße. Der Blutfluss in der mittleren, mit Laserherden durchsetzten Peripherie wird vermindert und im Bereich der Makula kommt es zu einer Steigerung des Blutflusses. Da durch diabetische Veränderungen der Gefäße in diesem Bereich die autoregulatorischen Kapazitäten bereits voll ausgeschöpft sind, dringt über Leckagen Flüssigkeit in die Netzhaut ein. S. Scheiber, P. Bischoff, P. Speiser progredienter Verlauf der diabetischen Retinopathie trotz panretinaler Laserkoagulation 1982 veröffentlichten Scheiber, Bischoff und Speiser [64] eine Studie mit 57 Patienten, die proliferative Netzhautveränderungen aufwiesen. Wie viel Prozent der Patienten auch von einer Makulopathie betroffen sind, ist aus den Unterlagen nicht ersichtlich. Auch diese Patientenaugen wurden mittels panretinaler Laserkoagulation mit einem Argonlaser behandelt. In fünf bis sieben Sitzungen haben die behandelnden Ärzte 3000 bis 4000 Herde in einer Größe von 500μm und einer Expositionszeit zwischen 0,05 und 0,1s auf der Netzhaut verteilt. Sechs Monate bis zwei Jahre nach der Behandlung zeigte sich bei 20 der 57 Patienten eine Verschlechterung der Sehkraft. Bei sechs dieser 20 Augen war die Ursache ein transientes Makulaödem, das sich nach wenigen Tagen zurückgebildet hat. 50
56 G.W. Blankenship A clinical comparison of central and peripheral argon laser panretinal photocoagulation for proliferative diabetic retinopathy Im Jahr 1987 führte Blankenship [4] eine prospektive Patientenstudie mit 50 Probanden durch. Alle Probanden wiesen proliferative Veränderungen der Netzhaut aufgrund einer diabetischen Retinopathie auf. Mit einem blau-grünen Argonlaser wurden in einer einzelnen Sitzung 500μm große Laserherde mit einer Expositionszeit von 0,1s panretinal platziert. Ziel der Studie war es, eine zentrale mit einer peripheren Laserkoagulation zu vergleichen. Bei beiden Varianten hat man die mittlere Peripherie durch ein Panfunduskop mit 400 bis 500 Laserherden versetzt. Mit einem Kontaktglas nach Goldmann wurde das restliche Netzhautareal photokoaguliert. Dabei wurden bei der ersten Methode die restlichen 400 bis 470 Laserherde weiter zentral verteilt. Ein Bereich um die Makula, Papille und das makulo-papilläre Bündel wurde dabei ausgelassen. Bei der zweiten Behandlungsmethode wurden zusätzlich 400 bis 500 Herde auf der weiter peripher liegenden Netzhaut verstreut. Die an der Studie teilnehmenden Patienten wurden den beiden Lasermethoden gleichmäßig zugeteilt. Auf der Abbildung 4 und 5 kann man die verschieden durchgeführten Laservarianten direkt miteinander vergleichen. Abbildung 4: zentrale panretinale Laserkoagulation [4] Abbildung 5: periphere panretinale Laserkoagulation [4] Beim Vergleich der beiden Laservarianten gelangten die Untersucher in Bezug auf die 51
57 Neubildung oder Progression eines Makulaödems zu folgenden Ergebnissen: Vor der Photokoagulationsbehandlung hatten 17 Patienten der zentralen Gruppe ein Makulaödem, dies entspricht einem Anteil von 68%. In der peripher gelaserten Patientengruppe wiesen vorher 16 Patientenaugen, also 64% eine diabetische Makulopathie auf. Eine Verschlechterung dieses diabetischen Makulaödems trat nach der Laserbehandlung bei drei Patienten in der zentralen Gruppe auf. In der peripheren Gruppe dagegen verbesserte sich bei drei Patienten das Ödem im Bereich der Makula. Nach sechs Monaten hatte sich in beiden Kollektiven bei jeweils zwei Patienten ein neues Makulaödem entwickelt. Aus diesen Daten ergibt sich, dass eine weiter peripher erfolgende Laserkoagulation für bereits vorhandene diabetische Makulaödeme von Vorteil ist und zu deren Resorption führen kann. E.C. Wade, G.W. Blankenship The effect of short versus long exposure times of argon laser panretinal photocoagulation on proliferative diabetic retinopathy Wade und Blankenship [87] verglichen die Wirkungen von kurzen und langen Expositionszeiten. Auch hier wurden 50 Patientenaugen gleichmäßig auf zwei Gruppen verteilt. Alle Patienten wiesen eine schwere proliferative diabetische Retinopathie auf, die mit einer panretinalen Photokoagulation gemildert werden sollte. Die 500μm großen Laserherde wurden mit einem blau-grünen Argonlaser gesetzt. Dabei wurde ein Abstand von eineinhalb Laserherden eingehalten. Gearbeitet haben die behandelnden Ärzte mit einem Panfunduskop der Firma Rodenstock. Zur vollständigen Nachkontrolle standen in der ersten Gruppe 19 Augen zur Verfügung. Für diese Patienten betrug die Expositionszeit des Argonlasers 0,1s. Auf der Netzhaut wurden 650 bis 1000 Herde verteilt, in welchen Bereichen das erfolgte, kann der Abbildung 6 entnommen werden. Die zweite Patientengruppe umfasste 24 Augen, die mit einer Expositionszeit von 0,5s gelasert wurden. 500 bis 900 Laserherde konnten auf der Retina platziert werden. Ausgelassen wurden dabei die großen Gefäßarkaden und der Abstand temporal zur Makula betrug zwei Papillendurchmesser. 52
58 Abbildung 6: Art der panretinalen Laserkoagulation nach Wade, Doft und Blankenship. [15,87] Vor der Laserbehandlung hatten 21% (4 Augen) in der 0,1s Expositionszeitgruppe und 33% (8 Augen) in der 0,5s Gruppe eine diabetische Makulopathie. Eine Woche nach der Photokoagulation trat bei 47% (9 Augen) der Patienten, die mit einer Expositionszeit von 0,1s behandelt wurden, ein Makulaödem auf. 21% (4 Augen) davon waren Verschlechterungen bereits vorhandener Makulaödeme. In der Gruppe mit einer Expositionszeit von 0,5s wiesen nach einer Woche 38%, das entspricht ebenfalls 9 Augen, ein Makulaödem auf. Auch in diesem Fall handelte es sich bei vier dieser Patienten um eine Progression eines bereits vorher bestehenden Makulaödems. Diese neun Ödeme im Bereich der Makula, welche eine Woche nach der Photokoagulation gemessen wurden, bildeten sich fast vollständig innerhalb eines Monats zurück. Am Ende des Nachuntersuchungszeitraumes von sechs Monaten waren in der Gruppe mit 0,1s Expositionszeit nur zwei Patienten mit einer Makulopathie. Das entsprach 10% aller Augen, die dieser Behandlungsgruppe angehörten. In der zweiten Gruppe hatten 4% der Patienten nach sechs Monaten noch ein Makulaödem, das entspricht einem Patientenauge. Damit zeigt sich, dass eine höhere Expositionszeit bessere Effekte auf den Rückgang 53
59 einer diabetischen Makulopathie hat. Allerdings mit der Komplikation, dass mehr transiente Makulaödeme als Folge der Photokoagulation entstehen. Die Untersucher betonen aber, dass die geringe Anzahl bleibender Makulaödeme auch mit der fehlenden fluoreszenzangiografischen Untersuchung zusammenhängen kann, besonders da diese Untersuchungsmethode präziser ist, wenn es darum geht, milde Makulopathien zu identifizieren. Trotz allem ist eine Rückbildungstendenz vorhandener Ödeme im Bereich der Makula deutlich zu erkennen, auch wenn eine Woche nach der panretinalen Photokoagulation mehr Makulaödeme auftraten. Ursache dieser durch eine panretinale Photokoagulation induzierten Ödemreduktion ist die verbesserte Netzhautoxygenierung. Zum einen wird das durch eine erhöhte Versorgung der Netzhaut mit Blut aus der Choroidea ermöglicht. Durch die Zerstörung der retinalen Pigmentepithelschicht und der äußeren Netzhautschichten kann der Sauerstoff besser in die inneren Schichten der Retina diffundieren. Andererseits sinkt der Sauerstoffverbrauch der Netzhaut durch Zerstörung der mitochondrienreichen Pigmentepithelzellen. B.H. Doft, G.W. Blankenship Single versus Multiple Treatment Sessions of Argon Laser Panretinal Photocoagulation for Proliferative Diabetic Retinopathy Bereits einige Jahre zuvor untersuchte Doft [15] in Zusammenarbeit mit Blankenship die Wirkung von einer einzelnen Laserbehandlung im Vergleich zu multiplen Sitzungsterminen auf die Retinopathia diabetica. Bei dieser Studie hatte man ebenfalls 50 Patientenaugen auf zwei Gruppen verteilt. Alle Probanden zeigten proliferative diabetische Netzhautveränderungen und wurden mit einem Argonlaser panretinal koaguliert. Die Herdgröße betrug in beiden Gruppen 500μm und die Expositionszeit 0,1s. In der ersten Gruppe setzte man bei den Patienten in einer Sitzung zwischen 1200 und 1290 Laserherde auf die Netzhaut (siehe Abbildung 6). In der zweiten Patientengruppe wurde die gleiche Herdmenge auf drei Sitzungen, mit einem Abstand von einer Woche, verteilt, wie man in Abbildung 7 gut erkennen kann. Pro Sitzung wurden 400 bis 430 Herde gesetzt. Gelasert wurde dabei bis nah an die Makula und den Sehnerv heran. Bei dem ersten Sitzungstermin wurden die nasalen und temporalen Netzhautbereiche koaguliert, in der zweiten Sitzung der obere Netzhautanteil und beim dritten Lasertermin der untere Bereich der Retina, unterhalb der Makula. 54
60 Abbildung 7: Skizze Augenhintergrund mit Laserarealen bei multiplen Sitzungen, nach Doft und Blankenship [15]. (die Ziffern geben die Laserreihenfolge wieder) Nach Auswertung der Ergebnisse haben Doft und Blankenship festgestellt, dass für die Bildung eines Makulaödems die Anzahl der Sitzungen nicht relevant ist. Vor der Laserbehandlung hatten 40% der ersten Gruppe ein Makulaödem, das entsprach 10 von 25 Patientenaugen. In der Gruppe der multiplen Lasersitzungen besaßen 44%, also 11 von 25 Augen, eine Makulopathie. Sechs Monate nach der panretinalen Photokoagulation hatten in der ersten Gruppe 36%, also noch 9 von 25 Augen ein Makulaödem. Im Verlauf der Nachuntersuchung bildete sich bei vier Patienten das Makulaödem zurück, es bildete sich aber auch bei drei Patienten ein neues. Bei der Patientengruppe mit mehreren Sitzungsterminen haben sich innerhalb der sechs Monate drei Makulaödeme resorbiert und zwei neugebildet. Am Ende des Untersuchungszeitraumes wiesen noch 40%, also 10 von 25 Patientenaugen ein Makulaödem auf. T.W. Gardner et al. Improvement of Macular Edema after Panretinal Photocoagulation for Proliferative Diabetic Retinopathy und Reduction of severe macular edema in eyes with poor vision after panretinal photocoagulation for proliferative diabetic retinopathy Von Gardner, Eller und Friberg wurden zwei retrospektiv ausgewertete Studien 55
61 veröffentlicht, bei denen ein Rückgang vorhandener Makulaödeme mittels panretinaler Photokoagulation verzeichnet werden konnte. Die Patienten wurden mit einem Argon-grün Laser behandelt. Die Herdgröße variierte zwischen 200 und 500μm. Die Expositionszeit wurde mit 0,1s gewählt. Pro Sitzung wurden 600 bis 900 Laserherde über die Netzhaut verteilt, bis alle proliferativen Veränderungen rückgängig waren. Zwischen zwei Sitzungsterminen lagen drei bis vier Wochen. Während der ersten Lasersitzung wurde die mittlere Peripherie koaguliert und in den folgenden Behandlungen der Rest. Laserherde wurden nicht innerhalb der großen Gefäßbogen gesetzt. Zur Fovea wurde temporal ein Abstand von drei bis vier Papillendurchmessern eingehalten. Alle Patienten, welche in die Untersuchung eingeschlossen wurden, hatten eine Makulopathie. Falls die proliferativen Veränderungen auf der Netzhaut bei den Probanden sehr schwerwiegend waren, wurden sie trotz ihrer Makulopathie primär panretinal photokoaguliert. Ein Vergleich der Art der Laserkoagulation in den beiden Veröffentlichungen kann man den Abbildungen 8 und 9 entnehmen. Abbildung 8: Skizze panretinale Laserherdverteilung nach Gardner 1988 [23]. (die Ziffern entsprechen der Reihenfolge, in der gelasert wurde) Abbildung 9: Skizze panretinale Laserherdverteilung nach Gardner 1991 [24]. (die Ziffern entsprechen der Reihenfolge, in der gelasert wurde) In der ersten Veröffentlichung aus dem Jahr 1988 [23] verbesserte sich nach der panretinalen Photokoagulation bei vier von den zehn Patienten der Visus um mehr als 2 56
62 Linien. Bei weiteren vier Patienten verbesserte sich der Visus auch, aber nicht so stark und bei zwei der Augen verminderte sich die Sehkraft. Bei einem Auge kam dabei für die Visusminderung am ehesten eine subkapsuläre Katarakt in Frage folgte eine zweite Veröffentlichung, in der 18 Patientenfälle retrospektiv ausgewertet wurden [24]. Alle Patienten hatten einen Ausgangsvisus von weniger als 20/200, aufgrund eines schweren Makulaödems. Keines der 18 Patientenaugen zeigte nach der panretinalen Photokoagulation eine Progression der Makulopathie. Bei 13 dieser Patienten verbesserte sich die Situation und es kam zu einem Rückgang des diabetischen Makulaödems. Bei vier der restlichen fünf Patienten kam es zu einer Visusminderung, die nicht dem Ödem zu Grunde lag. Ursachen waren eine traktive Makulaabhebung, eine Makulaischämie oder die Vergrößerung bereits vorhandener Zysten im Bereich der Makula. Betrachtet man die 13 Patienten mit einer Regression der Makulopathie, so zeigten acht von ihnen einen Visusanstieg. Vier dieser acht Patienten erreichten einen Visus von mehr als 20/80. Dafür, dass sich bei fünf Patienten trotz Rückbildung des Makulaödems der Visus nicht verbesserte, kommen verschiedene Ursachen in Frage. Zum einen kann die lang andauernde und schwere Makulopathie bereits zur Atrophie des retinalen Pigmentepithels geführt haben. Andererseits kann es sich um eine ischämische Form gehandelt haben. Von einer fehlenden Verbesserung der Sehkraft waren besonders schlecht eingestellte Hypertoniker und Patienten mit unkontrollierten Blutzuckerschwankungen betroffen. Als Grund für den Rückgang der Makulaödeme sehen die Autoren zum einen die angewandte Lasertechnik. Die Abstände zwischen den einzelnen Lasersitzungen wurden mit drei bis vier Wochen sehr großzügig gewählt. Im Bereich der großen Gefäße wurden keine Laserherde platziert und es wurde mit drei bis vier Papillendurchmessern ein größerer Abstand zur Makula eingehalten. Diese milde Lasertherapie führt zu einem veränderten Blutfluss, der eine Vasokonstriktion der retinalen Gefäße erzeugt. Der Blutfluss im Bereich der Makula und damit auch der 57
63 transmurale Druck in den makulären Kapillaren nimmt ab. Die Tendenz zur Bildung eines Makulaödems verringert sich. Würde man am hinteren Pol eine intensivere Lasertherapie durchführen, so würde das Blut schneller zu den bereits hyperperfundierten Gefäßen der Makula fließen. Die autoregulatorischen Mechanismen der diabetischen Netzhautgefäße sind dort aber bereits vollkommen ausgeschöpft und es kommt eher zur Neubildung oder Verschlechterung einer Makulopathie. Des Weiteren verbessert eine panretinale Photokoagulation die Oxygenierung der Netzhaut. Deshalb empfehlen die Autoren bei starken Okklusionen der Kapillaren im Bereich der mittleren Netzhautperipherie erst mit einer panretinalen Laserkoagulation zu beginnen. Sollte das Makulaödem sich nicht zurückbilden, ist eine fokale oder Grid Koagulation zwingend erforderlich um den Visus des Patienten nicht zu gefährden. Aktuelle Studien, die sich direkt mit diesem Thema befassen, sind im Moment sehr rar. Indirekte Zusammenhänge gibt es aber zu den Veröffentlichungen von Shimura et al. [71,73]. Den Untersuchern aus den vorher genannten Arbeiten stand damals ein wichtiges Gerät für die Diagnostik noch nicht zur Verfügung. Ein relativ neuer wichtiger diagnostischer Parameter ist die OCT (Optical Coherence Tomography), mit deren Hilfe die Dicke der Netzhaut ermittelt werden kann. M. Shimura et al. Visual Dysfunction After Panretinal Photocoagulation in Patients With Severe Diabetic Retinopathy and Good Vision. Shimura et al. behandelten 64 Patienten mit schwerer nicht-proliferativer und proliferativer diabetischer Retinopathie. Der Visus betrug bei allen Probanden mindestens 20/20 und kein Makulaödem war vorhanden. Für die panretinale Photokoagulation wurde im Gegensatz zu den vorherigen Studien kein Argonlaser, sondern ein Krypton-rot Laser eingesetzt, der eine Wellenlänge von 647nm besitzt. Die Herdgröße variiert von 200 bis 500μm Herddurchmesser und die Expositionszeit wurde zwischen 0,15 und 0,2s gewählt Laserherde wurden gleichmäßig auf vier Sitzungstermine mit einem Abstand von zwei Wochen verteilt. In der ersten Sitzung hat man den nasalen Bereich, danach den unteren, dann den oberen und beim letzten Lasertermin den temporalen Netzhautbereich koaguliert, wie man der Abbildung 10 entnehmen kann. Es wurde darauf geachtet, dass die Laserherde einen Mindestabstand zur Fovea von zwei Papillendurchmessern hatten. 58
64 Nachfolgend bestimmte man die Netzhautdicke im fovealen und parafovealen Bereich und wertete die Daten aus. Abbildung 10: Panretinal gelaserter Augenhintergrund. Die Skizze ist nach den Beschreibungen aus der Studie von Shimura et al [73] gefertigt. (die Zahlen entsprechen der Reihenfolge der Laserbehandlung) Die Messwerte der parafovealen Netzhautdicke ließen sich in drei Gruppen unterteilen: Patienten die eine parafoveale Netzhautdicke von 240μm haben, weisen nach der panretinalen Photokoagulation ihren Ausgangsvisus auf. Bei einer retinalen Dicke in diesem Bereich von circa 275μm kommt es zu einer transienten Sehkraftminderung. Liegt die Netzhautdicke über 300μm, folgt auf eine panretinale Photokoagulation ein permanenter Visusverlust. Ähnliche Ergebnisse wurden für die foveale Netzhautdicke gefunden. Je stärker der Netzhautdickenanstieg nach der ersten Laserbehandlung ist, umso größer ist der Visusverlust. Wird bei der OCT nach der ersten Lasersitzung ein Anstieg der fovealen Netzhautdicke auf über 300μm gemessen, sollten die Laserparameter modifiziert werden. Die Herdabstände können größer gewählt werden und es können zum Beispiel mit geringerer Energie in der Summe weniger Herde auf der Netzhaut verteilt werden. 59
Arabella Klinik München. Makula Netzhaut Zentrum MAC 14. Diabetische Makulopathie. FLA versus OCT. J. Nasemann Makula-Netzhaut-Zentrum-München
 MAC 14 Diabetische Makulopathie FLA versus OCT J. Nasemann Makula--- Epidemiologie in Deutschland Blum et al: Ophthalmologe, 2007 5596 Patienten mit Diabetes aus 181 Augenarztpraxen Im Mittel: 64 Jahre
MAC 14 Diabetische Makulopathie FLA versus OCT J. Nasemann Makula--- Epidemiologie in Deutschland Blum et al: Ophthalmologe, 2007 5596 Patienten mit Diabetes aus 181 Augenarztpraxen Im Mittel: 64 Jahre
Diabetische Retinopathie
 Diabetische Retinopathie Ute Wolf-Schnurrbsuch Universitätsklinik für Augenheilkunde Diabetische Folgeerkrankungen Häufigste Erblindungsursache der Bevölkerung im erwerbstätigen Alter Diabetische Retinopathie
Diabetische Retinopathie Ute Wolf-Schnurrbsuch Universitätsklinik für Augenheilkunde Diabetische Folgeerkrankungen Häufigste Erblindungsursache der Bevölkerung im erwerbstätigen Alter Diabetische Retinopathie
FORUM 01/ RETINOPATHIA DIABETICA GRUNDLAGEN
 FORUM 01/1994 - RETINOPATHIA DIABETICA GRUNDLAGEN Zu den typischen Folgeerkrankungen des Diabetes mellitus gehören die Mikroangiopathien, pathologische Veränderungen der Kapillaren. 25% aller Diabetiker
FORUM 01/1994 - RETINOPATHIA DIABETICA GRUNDLAGEN Zu den typischen Folgeerkrankungen des Diabetes mellitus gehören die Mikroangiopathien, pathologische Veränderungen der Kapillaren. 25% aller Diabetiker
Diabetische Retinopathie. P.Walter
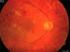 Diabetische Retinopathie P.Walter Diabetes mellitus -Häufigste Erblindungsursache in den industrialisierten Ländern -Häufigster Grund für neue Erblindungen zwischen 20 64 Lebensjahr Diabetische Komplikationen
Diabetische Retinopathie P.Walter Diabetes mellitus -Häufigste Erblindungsursache in den industrialisierten Ländern -Häufigster Grund für neue Erblindungen zwischen 20 64 Lebensjahr Diabetische Komplikationen
Netzhaut I. PD Dr. R. Guthoff. Universitäts-Augenklinik Düsseldorf Direktor: Prof. Dr. G. Geerling
 Netzhaut I PD Dr. R. Guthoff Universitäts-Augenklinik Düsseldorf Direktor: Prof. Dr. G. Geerling Makula (5mm) Fovea (1,5mm) Foveola (0,35mm) Sehschärfe Fovea (1,5mm) 0.4 1.0 0.4 Foveola (0,35mm) Fluoreszein-Angiographie
Netzhaut I PD Dr. R. Guthoff Universitäts-Augenklinik Düsseldorf Direktor: Prof. Dr. G. Geerling Makula (5mm) Fovea (1,5mm) Foveola (0,35mm) Sehschärfe Fovea (1,5mm) 0.4 1.0 0.4 Foveola (0,35mm) Fluoreszein-Angiographie
Diabetes mellitus und Auge Susan Schmitz. Schmitz-G., Astrid Stein
 Diabetes mellitus und Auge Susan Schmitz Schmitz-G., Astrid Stein Mobilität t der Diabetiker Lebensqualität t bestimmt durch Trias: 1. Skelettsystem 2. Fussbeschaffenheit 3. Sehvermögen (Insulininjektion,
Diabetes mellitus und Auge Susan Schmitz Schmitz-G., Astrid Stein Mobilität t der Diabetiker Lebensqualität t bestimmt durch Trias: 1. Skelettsystem 2. Fussbeschaffenheit 3. Sehvermögen (Insulininjektion,
Diabetologie und Stoffwechsel
 Diabetologie und Stoffwechsel Dezember 2014 Seite S95 S228 9. Jahrgang www.thieme-connect.de/ejournals S2 2014 Supplement Praxisempfehlungen der Deutschen Diabetes Gesellschaft Hrsg.: M. Kellerer, E. Siegel,
Diabetologie und Stoffwechsel Dezember 2014 Seite S95 S228 9. Jahrgang www.thieme-connect.de/ejournals S2 2014 Supplement Praxisempfehlungen der Deutschen Diabetes Gesellschaft Hrsg.: M. Kellerer, E. Siegel,
Update Diabetessprechstunde und neue Studienergebnisse
 Update Diabetessprechstunde und neue Studienergebnisse J. Nasemann Makula-Netzhaut-Zentrum-München Probleme bei der Betreuung von Patienten mit diabetischer Retinopathie Hohe morphologische Variabilität
Update Diabetessprechstunde und neue Studienergebnisse J. Nasemann Makula-Netzhaut-Zentrum-München Probleme bei der Betreuung von Patienten mit diabetischer Retinopathie Hohe morphologische Variabilität
Patienteninformation zur diabetischen Retinopathie
 Patienteninformation zur diabetischen Retinopathie Diabetes und Auge Zuckerkrankheit (Diabetes mellitus) beruht auf einer Funktionsstörung der Bauchspeicheldrüse. Man unterscheidet zwei Haupttypen dieser
Patienteninformation zur diabetischen Retinopathie Diabetes und Auge Zuckerkrankheit (Diabetes mellitus) beruht auf einer Funktionsstörung der Bauchspeicheldrüse. Man unterscheidet zwei Haupttypen dieser
Intravitreale Injektion von Triamcinolonacetat zur Behandlung diffuser Makulaödeme
 Aus der Augenklinik und Poliklinik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Intravitreale Injektion von Triamcinolonacetat zur Behandlung diffuser Makulaödeme Inauguraldissertation
Aus der Augenklinik und Poliklinik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Intravitreale Injektion von Triamcinolonacetat zur Behandlung diffuser Makulaödeme Inauguraldissertation
Ozurdex R -Therapie bei besonderen Indikationen
 Ozurdex R -Therapie bei besonderen Indikationen J. Nasemann Makulaödem Definition: Extravaskuläre Schwellung, ausgelöst durch eine abnormale Permeabilität retinaler Kapillaren. Ursache: Durch unterschiedliche
Ozurdex R -Therapie bei besonderen Indikationen J. Nasemann Makulaödem Definition: Extravaskuläre Schwellung, ausgelöst durch eine abnormale Permeabilität retinaler Kapillaren. Ursache: Durch unterschiedliche
Diabetes mellitus Spätschäden früh erkennen und richtig behandeln
 Diabetes mellitus Spätschäden früh erkennen und richtig behandeln Dr. Roman Iakoubov - Diabetesambulanz - II. Medizinische Klinik Klinikum rechts der Isar Diabetes und Spätfolgen Diabetes mellitus Überblick
Diabetes mellitus Spätschäden früh erkennen und richtig behandeln Dr. Roman Iakoubov - Diabetesambulanz - II. Medizinische Klinik Klinikum rechts der Isar Diabetes und Spätfolgen Diabetes mellitus Überblick
Augenerkrankungen bei Diabetes mellitus
 Auge und Diabetes Augenerkrankungen bei Diabetes mellitus Retinopathie und Makulopathie Traktionsablatio Rubeosis Iridis und neovaskuläres Glaukom Katarakt Transitorische Refraktionsstörungen Trockenes
Auge und Diabetes Augenerkrankungen bei Diabetes mellitus Retinopathie und Makulopathie Traktionsablatio Rubeosis Iridis und neovaskuläres Glaukom Katarakt Transitorische Refraktionsstörungen Trockenes
Diabetes und Auge Die Zuckerkrankheit (Diabetes mellitus) ist eine schleichende Krankheit. Bei ihr treten infolge der erhöhten Blutzuckerkonzentration
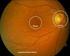 Augenärzte informieren: Zuckerbedingte Netzhauterkrankung (Diabetische Retinopathie) Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Diabetes und Auge
Augenärzte informieren: Zuckerbedingte Netzhauterkrankung (Diabetische Retinopathie) Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Diabetes und Auge
Diabetes: Millionen Menschen von Blindheit bedroht
 Themenpaket der CBM, Stand: April 2016 Christoffel-Blindenmission Deutschland e.v. Stubenwald-Allee 5 64625 Bensheim Tel.: (0 62 51) 1 31-1 90 Fax: (0 62 51) 1 31-1 99 E-Mail: presse@cbm.de www.cbm.de
Themenpaket der CBM, Stand: April 2016 Christoffel-Blindenmission Deutschland e.v. Stubenwald-Allee 5 64625 Bensheim Tel.: (0 62 51) 1 31-1 90 Fax: (0 62 51) 1 31-1 99 E-Mail: presse@cbm.de www.cbm.de
Die altersabhängige Makuladegeneration
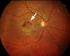 Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
Erlanger Augenärzte Fortbildungs Abend am
 Evaluationsbogen zum Erlanger Augenärzte Fortbildungs Abend am 30.04.04 Thema: Altersassoziierte Makuladegeneration (AMD) 1. An welcher Stelle der Häufigkeit der Erblindungen im Sinne des Gesetzes älterer
Evaluationsbogen zum Erlanger Augenärzte Fortbildungs Abend am 30.04.04 Thema: Altersassoziierte Makuladegeneration (AMD) 1. An welcher Stelle der Häufigkeit der Erblindungen im Sinne des Gesetzes älterer
Rechtzeitig vorsorgen Augen gesund erhalten
 Patientenratgeber Begleit- und Folgeerkrankungen Rechtzeitig vorsorgen Augen gesund erhalten Informationen für Teilnehmer an AOK-Curaplan Diabetes 2 AOK-Curaplan Diabetes mellitus Im Interesse Ihrer Gesundheit
Patientenratgeber Begleit- und Folgeerkrankungen Rechtzeitig vorsorgen Augen gesund erhalten Informationen für Teilnehmer an AOK-Curaplan Diabetes 2 AOK-Curaplan Diabetes mellitus Im Interesse Ihrer Gesundheit
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star. Patienteninformation
 Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Diabetische Netzhauterkrankung
 Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Diagnose Diabetes Was nun?
 Diagnose Diabetes Was nun? Fachtagung Mit Diabetes leben 29.04.2014 Chemnitz Was ist Diabetes mellitus? Diabetes ist eine Stoffwechselerkrankung, die sich auszeichnet durch einen zu hohen Blutzucker, in
Diagnose Diabetes Was nun? Fachtagung Mit Diabetes leben 29.04.2014 Chemnitz Was ist Diabetes mellitus? Diabetes ist eine Stoffwechselerkrankung, die sich auszeichnet durch einen zu hohen Blutzucker, in
PATIENTEN-INFORMATION. Diabetische Augenerkrankungen
 PATIENTEN-INFORMATION Diabetische Augenerkrankungen A U G E N Ä R Z T E i n f o r m i e r e n Dr.Mann Pharma PATIENTEN-INFORMATION Diabetes und Auge Die Zuckerkrankheit (Diabetes mellitus) ist eine schleichende
PATIENTEN-INFORMATION Diabetische Augenerkrankungen A U G E N Ä R Z T E i n f o r m i e r e n Dr.Mann Pharma PATIENTEN-INFORMATION Diabetes und Auge Die Zuckerkrankheit (Diabetes mellitus) ist eine schleichende
Schulungsverein Ohrekreis e.v. ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden. Haldensleben, den (Welt-Diabetestag)
 ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden Haldensleben, den 14.11.2009 (Welt-Diabetestag) Diabetes in Zahlen Rund 50 Millionen Menschen mit Diabetes leben in Europa. Etwa 246 Millionen
ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden Haldensleben, den 14.11.2009 (Welt-Diabetestag) Diabetes in Zahlen Rund 50 Millionen Menschen mit Diabetes leben in Europa. Etwa 246 Millionen
LASERKOAGULATION 7/29/10 DIABETISCHES MAKULAÖDEM DIABETISCHES MAKULAÖDEM VENENASTVERSCHLUSS. HEINRICH HEIMANN Royal Liverpool University Hospital
 LASERKOAGULATION HEINRICH HEIMANN Royal Liverpool University Hospital 48-jähriger Patient Diabetisches Makulaödem Visus 0,1 Over a 2-year period, focal/grid photocoagulation is more effective and has fewer
LASERKOAGULATION HEINRICH HEIMANN Royal Liverpool University Hospital 48-jähriger Patient Diabetisches Makulaödem Visus 0,1 Over a 2-year period, focal/grid photocoagulation is more effective and has fewer
Auge und Allgemeinerkrankungen
 Auge und Allgemeinerkrankungen Prof. Dr. Georg Michelson Augenklinik mit Poliklinik Alle Bilder aus Frei zugänglicher online-atlas mit mehr als 2000 Bilder Auge und Allgemeinleiden Diabetes Arterieller
Auge und Allgemeinerkrankungen Prof. Dr. Georg Michelson Augenklinik mit Poliklinik Alle Bilder aus Frei zugänglicher online-atlas mit mehr als 2000 Bilder Auge und Allgemeinleiden Diabetes Arterieller
DIE MAKULASCHWELLUNG UND IHRE BEHANDLUNG
 DIE MAKULASCHWELLUNG UND IHRE BEHANDLUNG Lederhaut Regenbogenhaut (Iris) Netzhaut Hornhaut Aderhaut Linse Makula Sehnerv Glaskörperraum 5 4 3 2 1 Schematischer und tatsächlicher Schnitt durch eine gesunde
DIE MAKULASCHWELLUNG UND IHRE BEHANDLUNG Lederhaut Regenbogenhaut (Iris) Netzhaut Hornhaut Aderhaut Linse Makula Sehnerv Glaskörperraum 5 4 3 2 1 Schematischer und tatsächlicher Schnitt durch eine gesunde
Idiopathische Makuläre Teleangiektasien (IMT) und die MacTel-Studie
 Idiopathische Makuläre Teleangiektasien (IMT) und die MacTel-Studie Ansprechpartner: PD Dr. Hendrik P.N. Scholl, Herr Dr. Peter Charbel Issa Retinale Teleangiektasien sind eine Gruppe seltener idiopathischer
Idiopathische Makuläre Teleangiektasien (IMT) und die MacTel-Studie Ansprechpartner: PD Dr. Hendrik P.N. Scholl, Herr Dr. Peter Charbel Issa Retinale Teleangiektasien sind eine Gruppe seltener idiopathischer
durch eine Geschmacksprobe des Urins gestellt. Diese Methode war noch zu Beginn des 20. Jahrhunderts üblich. Unbehandelt führt der Diabetes mellitus
 durch eine Geschmacksprobe des Urins gestellt. Diese Methode war noch zu Beginn des 20. Jahrhunderts üblich. Unbehandelt führt der Diabetes mellitus aber nicht nur zu einer Hyperglykämie. Neben dem Kohlenhydrat-Stoffwechsel
durch eine Geschmacksprobe des Urins gestellt. Diese Methode war noch zu Beginn des 20. Jahrhunderts üblich. Unbehandelt führt der Diabetes mellitus aber nicht nur zu einer Hyperglykämie. Neben dem Kohlenhydrat-Stoffwechsel
Diabetische Retinopathie und Makulopathie
 Diabetische Retinopathie und Makulopathie Autoren Hans-Peter Hammes 1, Klaus Dieter Lemmen 2, Bernd Bertram 3 Institute 1 V. Med. Klinik, Universitätsklinikum Mannheim, Mannheim 2 Augenärztliche Praxis,
Diabetische Retinopathie und Makulopathie Autoren Hans-Peter Hammes 1, Klaus Dieter Lemmen 2, Bernd Bertram 3 Institute 1 V. Med. Klinik, Universitätsklinikum Mannheim, Mannheim 2 Augenärztliche Praxis,
Bitte tragen Sie Ihre Antworten auf dem beiliegenden Blatt ein.
 Bitte tragen Sie Ihre Antworten auf dem beiliegenden Blatt ein. Bitte beachten Sie: Eine richtige Antwort bringt einen Punkt, eine falsche Antwort einen Punkt Abzug! Sie haben bei allen Fragen auch die
Bitte tragen Sie Ihre Antworten auf dem beiliegenden Blatt ein. Bitte beachten Sie: Eine richtige Antwort bringt einen Punkt, eine falsche Antwort einen Punkt Abzug! Sie haben bei allen Fragen auch die
Diabetische Augenerkrankungen
 Diabetische Augenerkrankungen Aktiv werden Möglichkeiten nutzen Informationen für Menschen mit Diabetes, zusammengestellt von der Initiative Diabetes und Auge Akionspartner der Woche des Sehens 2016 Wie
Diabetische Augenerkrankungen Aktiv werden Möglichkeiten nutzen Informationen für Menschen mit Diabetes, zusammengestellt von der Initiative Diabetes und Auge Akionspartner der Woche des Sehens 2016 Wie
AMD Die altersabhängige Makuladegeneration
 AMD Die altersabhängige Makuladegeneration 1 L.DE.SM.03.2014.2456 Eine Patientin berichtet 2 So sieht die Patientin Einschränkungen im zentralen Gesichtsfeld Peripheres (seitliches) Gesichtsfeld nicht
AMD Die altersabhängige Makuladegeneration 1 L.DE.SM.03.2014.2456 Eine Patientin berichtet 2 So sieht die Patientin Einschränkungen im zentralen Gesichtsfeld Peripheres (seitliches) Gesichtsfeld nicht
Informationen für Sie: Zuckerbedingte Netzhauterkrankung
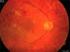 Informationen für Sie: Zuckerbedingte Netzhauterkrankung [Diabetische Retinopathie] Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Diabetes und Auge
Informationen für Sie: Zuckerbedingte Netzhauterkrankung [Diabetische Retinopathie] Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Diabetes und Auge
Diabetische Retinopathie und Makulopathie
 S99 Autoren H. P. Hammes 1, K. D. Lemmen 2, B. Bertram 3 Institute 1 V. Med. Klinik, Universitätsklinikum Mannheim, Mannheim 2 Augenärztliche Praxis, Düsseldorf 3 Augenärztliche Praxis, Aachen Letzte Aktualisierung
S99 Autoren H. P. Hammes 1, K. D. Lemmen 2, B. Bertram 3 Institute 1 V. Med. Klinik, Universitätsklinikum Mannheim, Mannheim 2 Augenärztliche Praxis, Düsseldorf 3 Augenärztliche Praxis, Aachen Letzte Aktualisierung
Informationen für Betroffene, Angehörige und Interessierte
 Informationen für Betroffene, Angehörige und Interessierte Giorgio Clementi Fotolia.com Eine Initiative der Österreichischen Diabetikervereinigung und der Hilfsgemeinschaft der Blinden und Sehschwachen
Informationen für Betroffene, Angehörige und Interessierte Giorgio Clementi Fotolia.com Eine Initiative der Österreichischen Diabetikervereinigung und der Hilfsgemeinschaft der Blinden und Sehschwachen
Der Diabetes liegt mir am Herzen
 Der Diabetes liegt mir am Herzen Priv.Doz. Dr. med. Frank Muders Fachärztliche Gemeinschaftspraxis für Innere Medizin und Kardiologie, Ärztehaus Weiden Diabetikeradern altern schneller Gefäßwandveränderungen
Der Diabetes liegt mir am Herzen Priv.Doz. Dr. med. Frank Muders Fachärztliche Gemeinschaftspraxis für Innere Medizin und Kardiologie, Ärztehaus Weiden Diabetikeradern altern schneller Gefäßwandveränderungen
Übersicht über Eylea und Begründung für die Zulassung in der EU
 EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie
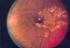 Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie Carsten Klatt 23.04.2016 Empfehlung DOG, BVA und RG, Stand April 2013 Diabetische Retinopathie Allgemeines In großen Querschnittstudien
Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie Carsten Klatt 23.04.2016 Empfehlung DOG, BVA und RG, Stand April 2013 Diabetische Retinopathie Allgemeines In großen Querschnittstudien
Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie
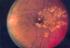 Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie Carsten Klatt 30.05.2015 Empfehlung DOG, BVA und RG, Stand April 2013 Diabetische Retinopathie Allgemeines Die Prävalenz des Diabetes
Indikation zur Laser- und IVOM- Therapie bei der diabetischen Makulopathie Carsten Klatt 30.05.2015 Empfehlung DOG, BVA und RG, Stand April 2013 Diabetische Retinopathie Allgemeines Die Prävalenz des Diabetes
KyberMetabolic. Neue Wege um Übergewicht und Diabetes zu bekämpfen
 KyberMetabolic Neue Wege um Übergewicht und Diabetes zu bekämpfen Leiden Leiden Sie an Übergewicht, Fettstoffwechselstörungen, Bluthochdruck, Typ-2-Diabetes? Sie an Diabetes vom Typ 2 und /oder lästigem
KyberMetabolic Neue Wege um Übergewicht und Diabetes zu bekämpfen Leiden Leiden Sie an Übergewicht, Fettstoffwechselstörungen, Bluthochdruck, Typ-2-Diabetes? Sie an Diabetes vom Typ 2 und /oder lästigem
Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Retinopathie-Screening
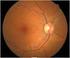 Vereinbarung zur Umsetzung von Screening-Maßnahmen nach 7 Abs. 1 der Anlage 4 des Hausarztvertrages Retinopathie-Screening zwischen der AOK Sachsen-Anhalt und dem Hausärzteverband Sachsen-Anhalt e.v. unter
Vereinbarung zur Umsetzung von Screening-Maßnahmen nach 7 Abs. 1 der Anlage 4 des Hausarztvertrages Retinopathie-Screening zwischen der AOK Sachsen-Anhalt und dem Hausärzteverband Sachsen-Anhalt e.v. unter
Erkrankungen im Auge durch Diabetes mellitus
 Erkrankungen im Auge durch Diabetes mellitus Dieses Informationsblatt soll Sie über eine Erkrankung bzw. Anomalie des Auges und über mögliche Behandlungen informieren. Es ersetzt nicht das persönliche
Erkrankungen im Auge durch Diabetes mellitus Dieses Informationsblatt soll Sie über eine Erkrankung bzw. Anomalie des Auges und über mögliche Behandlungen informieren. Es ersetzt nicht das persönliche
Vorwort zur 2. Auflage... Abkürzungsverzeichnis...
 IX Vorwort zur 2. Auflage......................................... Abkürzungsverzeichnis......................................... VII XV 1 Situation der Diabetes betreuung................... 1 1.1 Epidemiologie.......................................
IX Vorwort zur 2. Auflage......................................... Abkürzungsverzeichnis......................................... VII XV 1 Situation der Diabetes betreuung................... 1 1.1 Epidemiologie.......................................
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Innovative und multifaktorielle Therapie des Diabetes mellitus Typ 2
 Innovative und multifaktorielle Therapie des Diabetes mellitus Typ 2 Prim. Dr. Edwin Halmschlager Stoffwechsel-Rehabilitation Lebens.Resort Ottenschlag Zahl der Diabetiker weltweit nach Daten der WHO 1980
Innovative und multifaktorielle Therapie des Diabetes mellitus Typ 2 Prim. Dr. Edwin Halmschlager Stoffwechsel-Rehabilitation Lebens.Resort Ottenschlag Zahl der Diabetiker weltweit nach Daten der WHO 1980
AMD kann das scharfe Sehen zerstören, das notwendig ist für Aktivitäten wie Lesen, Autofahren und für das Erkennen von Gesichtern.
 Was ist AMD? AMD (Altersbedingte Makuladegeneration) ist eine Erkrankung des Auges, bei der im Alter zu einer Schädigung der Stelle des schärfsten Sehens (Makula) kommt. AMD kann zum Verlust der Sehkraft
Was ist AMD? AMD (Altersbedingte Makuladegeneration) ist eine Erkrankung des Auges, bei der im Alter zu einer Schädigung der Stelle des schärfsten Sehens (Makula) kommt. AMD kann zum Verlust der Sehkraft
Begleit- und Folgeerkrankungen des Diabetes. Wolf-Rüdiger Klare Radolfzell
 Begleit- und Folgeerkrankungen des Diabetes Wolf-Rüdiger Klare Radolfzell 1 Verlust der Lebenserwartung durch Diabetes Hopkinson et al: 1999 2 Einteilung der Begleit- und Folgeerkrankungen Makroangiopathie
Begleit- und Folgeerkrankungen des Diabetes Wolf-Rüdiger Klare Radolfzell 1 Verlust der Lebenserwartung durch Diabetes Hopkinson et al: 1999 2 Einteilung der Begleit- und Folgeerkrankungen Makroangiopathie
12. WAZ- Nachtforum Transplantation bei Diabetes
 12. WAZ- Nachtforum Transplantation bei Diabetes Pankreastransplantation in Bochum Dr. Peter Schenker Klinikum der Ruhr-Universität Bochum Chirurgische Klinik Knappschaftskrankenhaus Bochum Diabetes in
12. WAZ- Nachtforum Transplantation bei Diabetes Pankreastransplantation in Bochum Dr. Peter Schenker Klinikum der Ruhr-Universität Bochum Chirurgische Klinik Knappschaftskrankenhaus Bochum Diabetes in
GLAUKOM PATIENTEN-INFORMATION WISSENSWERTES ÜBER DEN GRÜNEN STAR UND SEINE BEHANDLUNG
 GLAUKOM PATIENTEN-INFORMATION WISSENSWERTES ÜBER DEN GRÜNEN STAR UND SEINE BEHANDLUNG Bei den dargestellten Personen handelt es sich um Models. Sie dienen ausschließlich illustrativen Zwecken. GLAUKOM
GLAUKOM PATIENTEN-INFORMATION WISSENSWERTES ÜBER DEN GRÜNEN STAR UND SEINE BEHANDLUNG Bei den dargestellten Personen handelt es sich um Models. Sie dienen ausschließlich illustrativen Zwecken. GLAUKOM
Diabetische Retinopathie
 Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Auf finden Sie eine größere Aufnahme von diesem Bild. Funduskopie. Linkes Auge
 Hinterabschnitt Übungsfall 00009 Fallbeschreibung 32-jähriger Patient. Er kommt im Notdienst aufgrund von anhaltenden starken Kopfschmerzen zu Ihnen. Er gibt außerdem an, seit einigen Stunden unscharf
Hinterabschnitt Übungsfall 00009 Fallbeschreibung 32-jähriger Patient. Er kommt im Notdienst aufgrund von anhaltenden starken Kopfschmerzen zu Ihnen. Er gibt außerdem an, seit einigen Stunden unscharf
SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER
 SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER Ernährungsratgeber Typ-2-Diabetes Genießen erlaubt 14 Diabetes mellitus wichtig zu wissen Die Diagnose des Diabetes mellitus: einfach und schnell Zur sicheren
SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER Ernährungsratgeber Typ-2-Diabetes Genießen erlaubt 14 Diabetes mellitus wichtig zu wissen Die Diagnose des Diabetes mellitus: einfach und schnell Zur sicheren
PATIENT. Patienten-Ratgeber für die Behandlung mit EYLEA. (Aflibercept Injektionslösung)
 PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
PRAXISEMPFEHLUNGEN DDG. Diabetologie und Stoffwechsel. Supplement CLINICAL PRACTICE RECOMMENDATIONS
 Diabetologie und Stoffwechsel Supplement S2 Oktober 2018 Seite S83 S290 13. Jahrgang This journal is listed in Science Citation Index, EMBASE and SCOPUS Offizielles Organ der Deutschen Diabetes Gesellschaft
Diabetologie und Stoffwechsel Supplement S2 Oktober 2018 Seite S83 S290 13. Jahrgang This journal is listed in Science Citation Index, EMBASE and SCOPUS Offizielles Organ der Deutschen Diabetes Gesellschaft
Zusammenfassung. Bei Patienten mit PAH zeigte sich in Lungengewebe eine erhöhte Expression von PAR-1 und PAR-2. Aktuelle Arbeiten weisen darauf
 Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
AMD = Chronisch fortschreitende Stoffwechselerkrankung der Netzhaut. Photorezeptoren. Retinales Pigmentepithel. Bruch sche Membran.
 Wenn das Recycling der Netzhaut nicht mehr funktioniert i t was ist AMD? OA Dr. med. Matthias Elling, FEBO Universitäts-Augenklinik Bochum AMD = Altersbedingte b Makula-Degenerationk l i Chronisch fortschreitende
Wenn das Recycling der Netzhaut nicht mehr funktioniert i t was ist AMD? OA Dr. med. Matthias Elling, FEBO Universitäts-Augenklinik Bochum AMD = Altersbedingte b Makula-Degenerationk l i Chronisch fortschreitende
Bedeutung der metabolischen Azidose für den Verlauf der renalen Osteopathie bei Hämodialysepatienten.
 Aus der Universitätsklinik und Poliklinik für Innere Medizin II der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Osten) Bedeutung der metabolischen Azidose für den Verlauf der renalen
Aus der Universitätsklinik und Poliklinik für Innere Medizin II der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Osten) Bedeutung der metabolischen Azidose für den Verlauf der renalen
Grundsätzlich beruhen die diabetischen
 ZEITSCHRIFT FÜR PRAKTISCHE AUGENHEILKUNDE & AUGENÄRZTLICHE FORTBILDUNG Stadieneinteilung und Therapie der diabetischen und Makulopathie Erläuterungen zur Broschüre der Initiativgruppe Früherkennung diabetischer
ZEITSCHRIFT FÜR PRAKTISCHE AUGENHEILKUNDE & AUGENÄRZTLICHE FORTBILDUNG Stadieneinteilung und Therapie der diabetischen und Makulopathie Erläuterungen zur Broschüre der Initiativgruppe Früherkennung diabetischer
Mit Therapie Aktiv Diabetes im Griff wurde ein Behandlungsprogramm für Patienten mit Diabetes mellitus Typ 2 (= Zuckerkrankheit)
 Mit Therapie Aktiv Diabetes im Griff wurde ein Behandlungsprogramm für Patienten mit Diabetes mellitus Typ 2 (= Zuckerkrankheit) ins Leben gerufen. Informationen dazu erhalten Sie bei Ihrem Arzt oder Ihrer
Mit Therapie Aktiv Diabetes im Griff wurde ein Behandlungsprogramm für Patienten mit Diabetes mellitus Typ 2 (= Zuckerkrankheit) ins Leben gerufen. Informationen dazu erhalten Sie bei Ihrem Arzt oder Ihrer
Diagnose Diabetes? Früh erkennen - richtig handeln
 Diagnose Diabetes? Früh erkennen - richtig handeln Am Telefon sitzen für Sie: Prof. Dr. med. Hilmar Stracke, Diabetologe von der Medizinischen Klinik und Poliklinik III der Universität Gießen und Marburg
Diagnose Diabetes? Früh erkennen - richtig handeln Am Telefon sitzen für Sie: Prof. Dr. med. Hilmar Stracke, Diabetologe von der Medizinischen Klinik und Poliklinik III der Universität Gießen und Marburg
PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ)
 PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ) URSACHEN THERAPIE PRÄVENTION INHALTSVERZEICHNIS DAS DIABETISCHE MAKULAÖDEM 3 8 16 Das diabetische Makulaödem Behandlungsmöglichkeiten für das diabetische
PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ) URSACHEN THERAPIE PRÄVENTION INHALTSVERZEICHNIS DAS DIABETISCHE MAKULAÖDEM 3 8 16 Das diabetische Makulaödem Behandlungsmöglichkeiten für das diabetische
Welche Blutzuckerwerte gibt es?
 Welche Blutzuckerwerte gibt es? Es gibt verschiedene Blutzuckerwerte. Einmal kennen Sie den so genannten Langzeitblutzuckerwert oder HbA1c Wert, den Ihr Arzt im allgemeinen bestimmt. Dann sind da noch
Welche Blutzuckerwerte gibt es? Es gibt verschiedene Blutzuckerwerte. Einmal kennen Sie den so genannten Langzeitblutzuckerwert oder HbA1c Wert, den Ihr Arzt im allgemeinen bestimmt. Dann sind da noch
Die Thrombin-Therapie beim Aneurysma spurium nach arterieller Punktion
 Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn. Ophthalmologische Fortbildung für medizinische Fachangestellte 25.
 Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
1. Alle Formen der feuchten AMD und der akuten CNV bei pathologischer Myopie
 Indikation zur intravitrealen Injektionstherapie bei AMD, DMÖ und RVV (Intravitreale operative Medikamenteneingabe IVOM) Krankheitsbild: 1. Alle Formen der feuchten altersbedingten Makuladegeneration (AMD)
Indikation zur intravitrealen Injektionstherapie bei AMD, DMÖ und RVV (Intravitreale operative Medikamenteneingabe IVOM) Krankheitsbild: 1. Alle Formen der feuchten altersbedingten Makuladegeneration (AMD)
U , ,00 U , ,00 U , ,00 U , ,00 U , ,00
 Anlage 3 zum Honorarvertrag 2013 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2019 bis 31. Dezember 2019 Lidkorrektur 5-096.02 U2 93101
Anlage 3 zum Honorarvertrag 2013 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2019 bis 31. Dezember 2019 Lidkorrektur 5-096.02 U2 93101
Anästhesie (Vollnarkose)
 Anlage 3 zum Honorarvertrag 2017 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2017 bis 31. Dezember 2017 Lidkorrektur 5-096.02 U2 93101
Anlage 3 zum Honorarvertrag 2017 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2017 bis 31. Dezember 2017 Lidkorrektur 5-096.02 U2 93101
Inhaltsverzeichnis. 1 Einleitung Geschichte der Insulintherapie... 7
 Inhaltsverzeichnis 1 Einleitung........................................... 1 2 Geschichte der Insulintherapie........................... 7 3 Pathophysiologie der Hyperglykämie...................... 17
Inhaltsverzeichnis 1 Einleitung........................................... 1 2 Geschichte der Insulintherapie........................... 7 3 Pathophysiologie der Hyperglykämie...................... 17
Klinik des pseudophaken zstoiden Makulaödem (PCMÖ) Zystoides Makulaödem bei Pseudophakie. PCMÖ - Pathogenese ZVV.
 Zystoides Makulaödem Pseudophakie Klinik des pseudophaken zstoiden Makulaödem (PCMÖ) J Hillenkamp OP 3-12 Wochen Klinik für Ophthalmologie Universitätsklinikum Schleswig-Holstein Campus Kiel manchmal:
Zystoides Makulaödem Pseudophakie Klinik des pseudophaken zstoiden Makulaödem (PCMÖ) J Hillenkamp OP 3-12 Wochen Klinik für Ophthalmologie Universitätsklinikum Schleswig-Holstein Campus Kiel manchmal:
Typ 2-Diabetiker: Hochrisikopatienten auf mehreren Ebenen
 Symposium Der diabetische Risikopatient` bei der Jahrestagung der Deutschen Diabetes Gesellschaft am 25. Mai 2005 in Leipzig Typ 2-Diabetiker: Hochrisikopatienten auf mehreren Ebenen Leipzig (25. Mai 2006)
Symposium Der diabetische Risikopatient` bei der Jahrestagung der Deutschen Diabetes Gesellschaft am 25. Mai 2005 in Leipzig Typ 2-Diabetiker: Hochrisikopatienten auf mehreren Ebenen Leipzig (25. Mai 2006)
Augenzentrum Ruhr. Altersbedingte Makuladegeneration Früherkennung und Therapie
 Augenzentrum Ruhr Altersbedingte Makuladegeneration Früherkennung und Therapie Was ist AMD? AMD ist vollständig gesprochen die altersbedingte Makuladegeneration. Dabei handelt es sich um eine Erkrankung
Augenzentrum Ruhr Altersbedingte Makuladegeneration Früherkennung und Therapie Was ist AMD? AMD ist vollständig gesprochen die altersbedingte Makuladegeneration. Dabei handelt es sich um eine Erkrankung
Abiturprüfung Biologie, Grundkurs
 Seite 1 von 6 biturprüfung 2008 Biologie, rundkurs ufgabenstellung: Thema: Ein Krankheitsbild unterschiedliche rsachen II.1 Werten Sie die Materialien und B hinsichtlich der Risikofaktoren für Diabetes
Seite 1 von 6 biturprüfung 2008 Biologie, rundkurs ufgabenstellung: Thema: Ein Krankheitsbild unterschiedliche rsachen II.1 Werten Sie die Materialien und B hinsichtlich der Risikofaktoren für Diabetes
Omalizumab. 2. An&asthma&ka Omalizumab Xolair /Novar&s CHO K1
 Omalizumab Omalizumab ist ein humanisierter rekombinanter, monoklonaler IgG1kappa- Antikörper, der selektiv an das menschliche Immunglobulin E (IgE) bindet. Nach Humanisierung des Maus-Moleküls durch Austausch
Omalizumab Omalizumab ist ein humanisierter rekombinanter, monoklonaler IgG1kappa- Antikörper, der selektiv an das menschliche Immunglobulin E (IgE) bindet. Nach Humanisierung des Maus-Moleküls durch Austausch
Page 1. Aktuelles. Handouts zur AAD Makulödem was tun? Makulaödem was tun? Makulaödem was tun?
 Makulödem was tun? Heinrich Heimann St. Pauls Eye Unit Royal Liverpool Hospital Thomas J. Wolfensberger Jules Gonin Eye Hospital Lausanne Liverpool Frank G. Holz Universitäts-Augenklinik Bonn Bonn Lausanne
Makulödem was tun? Heinrich Heimann St. Pauls Eye Unit Royal Liverpool Hospital Thomas J. Wolfensberger Jules Gonin Eye Hospital Lausanne Liverpool Frank G. Holz Universitäts-Augenklinik Bonn Bonn Lausanne
5 Zusammenfassung und Schlussfolgerung
 5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
Diabetisches Koma... Folgeerkrankungen bei Diabetes mellitus... Typ-1- versus Typ-2-Diabetes...
 VII 1 Symptome und Krankheitsbilder des Diabetes mellitus.................. 1 1.1 1.2 1.3 Diabetisches Koma...................... Folgeerkrankungen bei Diabetes mellitus....... Typ-1- versus Typ-2-Diabetes...............
VII 1 Symptome und Krankheitsbilder des Diabetes mellitus.................. 1 1.1 1.2 1.3 Diabetisches Koma...................... Folgeerkrankungen bei Diabetes mellitus....... Typ-1- versus Typ-2-Diabetes...............
Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Heilsame Injektionen für das Auge Wie bringt man Medikamente sicher ins Innere des Augapfels? Wenn Augenärzte Augenleiden mit Medikamenten behandeln,
 Augenärzte informieren: Intravitreale Injektion Operative Medikamenteneingabe in das Auge Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Heilsame Injektionen
Augenärzte informieren: Intravitreale Injektion Operative Medikamenteneingabe in das Auge Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Heilsame Injektionen
Plantabetics Eine ergänzende bilanzierte Diät für Diabetiker als Begleittherapie zur Diabetesbehandlung bei Diabetes Typ 2
 Das diesem Bericht zugrunde liegende Vorhaben wurde mit Mitteln des Ministeriums für Wirtschaft und Europaangelegenheiten des Landes Brandenburg und der EU gefördert. Die Verantwortung für den Inhalt der
Das diesem Bericht zugrunde liegende Vorhaben wurde mit Mitteln des Ministeriums für Wirtschaft und Europaangelegenheiten des Landes Brandenburg und der EU gefördert. Die Verantwortung für den Inhalt der
Gesunde Nieren auch mit Diabetes
 Landshuter Diabetestag 2009 Gesunde Nieren auch mit Diabetes 14. November 2009 Patrick Wiese Internistische Dres. Schwartz, Gruber, Lückhoff, Wiese Zweibrückenstr. 655 84028 Landshut Patrick Wiese 1 Aussehen
Landshuter Diabetestag 2009 Gesunde Nieren auch mit Diabetes 14. November 2009 Patrick Wiese Internistische Dres. Schwartz, Gruber, Lückhoff, Wiese Zweibrückenstr. 655 84028 Landshut Patrick Wiese 1 Aussehen
Dirk Claßen-Houben (Autor) Proteinbasierte 3D-QSAR-Analysen und virtuelles Screening an inhibitoren der Protein-Tyrosin-Phosphatase 1B
 Dirk Claßen-Houben (Autor) Proteinbasierte 3D-QSAR-Analysen und virtuelles Screening an inhibitoren der Protein-Tyrosin-Phosphatase 1B https://cuvillier.de/de/shop/publications/2663 Copyright: Cuvillier
Dirk Claßen-Houben (Autor) Proteinbasierte 3D-QSAR-Analysen und virtuelles Screening an inhibitoren der Protein-Tyrosin-Phosphatase 1B https://cuvillier.de/de/shop/publications/2663 Copyright: Cuvillier
Wahlleistungen Ihres Augenarztes
 Wahlleistungen Ihres Augenarztes Untersuchung mittels Optischer Kohärenz Tomographie (OCT) Das Auge Das Auge Anatomie und Funktion Das Auge Anatomie des Auges Aufbau des Auges Das Auge besteht aus zwei
Wahlleistungen Ihres Augenarztes Untersuchung mittels Optischer Kohärenz Tomographie (OCT) Das Auge Das Auge Anatomie und Funktion Das Auge Anatomie des Auges Aufbau des Auges Das Auge besteht aus zwei
Diabetes bedeutet, dass Sie zu viel Zucker im Blut haben
 Diabetes bedeutet, dass Sie zu viel Zucker im Blut haben Woher kommt dieser Zucker? Der Zucker in Ihrem Blut kommt aus der Nahrung, die Sie zu sich nehmen. Fast alles, was Sie essen (nicht nur Süßigkeiten)
Diabetes bedeutet, dass Sie zu viel Zucker im Blut haben Woher kommt dieser Zucker? Der Zucker in Ihrem Blut kommt aus der Nahrung, die Sie zu sich nehmen. Fast alles, was Sie essen (nicht nur Süßigkeiten)
Patientenratgeber Das diabetische Makulaödem (DMÖ)
 Patientenratgeber Das diabetische Makulaödem (DMÖ) Ursachen Therapie Prävention Inhaltsverzeichnis 3 Das diabetische Makulaödem 8 Behandlungsmöglichkeiten für das diabetische Makulaödem 16 Häufig gestellte
Patientenratgeber Das diabetische Makulaödem (DMÖ) Ursachen Therapie Prävention Inhaltsverzeichnis 3 Das diabetische Makulaödem 8 Behandlungsmöglichkeiten für das diabetische Makulaödem 16 Häufig gestellte
Untersuchungen zur Behandlung Choroidaler Neovaskularisationen. (CNV) am Augenhintergrund mittels Photodynamischer Therapie (PDT)
 1 Aus der Augenklinik und Hochschulambulanz für Augenheilkunde Campus Benjamin Franklin, Charité-Universitätsmedizin Berlin (Direktor: Univ. Prof. Dr. med. Michael H. Foerster) Untersuchungen zur Behandlung
1 Aus der Augenklinik und Hochschulambulanz für Augenheilkunde Campus Benjamin Franklin, Charité-Universitätsmedizin Berlin (Direktor: Univ. Prof. Dr. med. Michael H. Foerster) Untersuchungen zur Behandlung
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Augenzentrum Ruhr. Altersbedingte Makuladegeneration Früherkennung und Therapie
 Augenzentrum Ruhr Altersbedingte Makuladegeneration Früherkennung und Therapie Was ist AMD? Bei der altersbedingten Makuladegeneration handelt es sich um eine Erkrankung des Auges, bei der es im Alter
Augenzentrum Ruhr Altersbedingte Makuladegeneration Früherkennung und Therapie Was ist AMD? Bei der altersbedingten Makuladegeneration handelt es sich um eine Erkrankung des Auges, bei der es im Alter
Einzig wirksame Behandlungsform bei seltenen schweren Fettstoffwechselerkrankungen
 LDL-Apherese Einzig wirksame Behandlungsform bei seltenen schweren Fettstoffwechselerkrankungen Berlin (1. Dezember 2006) - In den westlichen Industrienationen stellen atherosklerotische Gefäßveränderungen
LDL-Apherese Einzig wirksame Behandlungsform bei seltenen schweren Fettstoffwechselerkrankungen Berlin (1. Dezember 2006) - In den westlichen Industrienationen stellen atherosklerotische Gefäßveränderungen
Multiple-Choice-Fragen zu Kapitel 12
 12.1.1 Fragetyp B, eine Antwort falsch Einer der folgenden Faktoren ist nicht typisch für das metabolische Syndrom. Welcher? a. Bauchbetontes Übergewicht b. Erhöhte bzw. veränderte Blutfettwerte c. niedriger
12.1.1 Fragetyp B, eine Antwort falsch Einer der folgenden Faktoren ist nicht typisch für das metabolische Syndrom. Welcher? a. Bauchbetontes Übergewicht b. Erhöhte bzw. veränderte Blutfettwerte c. niedriger
Innovatives Heilungskonzept ohne Nebenwirkungen
 EPO in der Wundtherapie Innovatives Heilungskonzept ohne Nebenwirkungen Hannover (24. März 2010) - Wissenschaftlern der Medizinischen Hochschule Hannover (MHH) ist es gelungen, mit dem körpereigenen Hormon
EPO in der Wundtherapie Innovatives Heilungskonzept ohne Nebenwirkungen Hannover (24. März 2010) - Wissenschaftlern der Medizinischen Hochschule Hannover (MHH) ist es gelungen, mit dem körpereigenen Hormon
Die periphere arterielle Verschlusskrankheit im höheren Lebensalter
 Aus der Universitätsklinik und Poliklinik für Innere Medizin III an der Martin Luther - Universität Halle - Wittenberg (Direktor: Prof. Dr. med. K. Werdan) Die periphere arterielle Verschlusskrankheit
Aus der Universitätsklinik und Poliklinik für Innere Medizin III an der Martin Luther - Universität Halle - Wittenberg (Direktor: Prof. Dr. med. K. Werdan) Die periphere arterielle Verschlusskrankheit
Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Vom unklaren Symptomkomplex zur ganzheitlichen Diagnose
 Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
