Aggregatzustände 1. Wasserdampf. Wasser. Eis Schmelzen
|
|
|
- Anneliese Förstner
- vor 6 Jahren
- Abrufe
Transkript
1 Aggregatzustände 1 Eis, Wasser und Wasserdampf. Das Wasser ist ein wesentlicher Stoff für das Leben auf der Erde. Es bedeckt zu mehr als zwei Drittel die Erdoberfläche. Auf der Erde kommen mehrere "Gestaltformen" des Wassers vor: Die Sonne verdunstet das Wasser zu Wasserdampf, als Regen kommt es wieder auf die Erde zurück. Bei niedrigen Temperaturen im Winter gefriert das Wasser zu Eis. Die Gletscher erinnern noch an die Eiszeit, als ganz Mitteleuropa mit Gletschereis überzogen war. Bei heißen Quellen wird das Wasser durch die Erdwärme erhitzt. In einem Geysir entsteht am Fuß in einer trichterförmigen Erdhöhlung gasförmiges Wasser, das durch seine plötzliche Ausdehnung beim Siedepunkt das darüber stehende heiße Wasser in die Höhe schleudert. Dadurch schießt heißer Wasserdampf in die Höhe. Wir kennen aus unserem Alltag drei Zustandsformen des Wassers. Eis ist der feste Zustand und das Wasser der flüssige. Den gasförmigen Zustand des Wassers sieht man an einem Teekessel als den unsichtbaren Teil zwischen der Austrittsstelle und dort wo der Dampf sichtbar wird. Verdampfen, Erstarren. Die drei Zustandsformen nennt man auch Aggregatzustände. Wenn Wasser zu Sieden beginnt, verdampft Wasser zu Wasserdampf. Beim starken Abkühlen gefriert flüssiges Wasser zu festem Eis. Der Fachbegriff lautet hierzu erstarren. Den umgekehrten Vorgang, wenn sich Eis wieder verflüssigt, nennt man schmelzen. Kommt Wasserdampf mit einer kalten Glasscheibe in Berührung, kondensiert der Dampf wieder zu Wasser. Erhitzt man Wasser auf den Siedepunkt, beginnt es bei 100 C zu sieden. Eis schmilzt am Schmelzpunkt bei 0 Celsius. Der Schmelzpunkt bei einem Stoff entspricht dem Erstarrungspunkt. Der Siedepunkt entspricht dem Kondensationspunkt. Erstarrungspunkt Wasser: 0 C Siedepunkt Wasser: 100 C Eis Schmelzen Erstarren Wasser Verdampfen Kondensieren Wasserdampf Schmelzpunkt Wasser: 0 C Kondensationspunkt Wasser: 100 C Im Haushalt begegnet uns das Phänomen der Aggregatzustände überall. Beim Kochen lässt man Fett oder Butter schmelzen. Schokolade schmilzt bereits bei Sonneneinstrahlung. Beim Löten schmilzt man mit einem Lötkolben das elektrisch leitfähige Lötzinn und verbindet so elektrische Kontakte. Beim Zinngießen an Silvester muss das Zinn auf seinen Schmelzpunkt von +232 Celsius erhitzt werden. Ein nicht ganz alltägliches Beispiel soll ebenfalls genannt werden: Man könnte sogar Luft verflüssigen, wenn man sie unter den Kondensationspunkt von 194,35 Celsius abkühlen würde. In der Praxis erfolgt dies mit dem Lindeverfahren. Verdunsten. Hängt man nasse Wäsche an eine Leine, dann trocknet die Wäsche allmählich. Dieses Phänomen nennt man Verdunsten. Hierbei geht das flüssige Wasser in den gasförmigen Zustand über, ohne dass es auf seinen Siedepunkt erhitzt wird. Eine große Menge an Wasser verdunstet auch über feuchten Böden, über Flüssen, Seen und den Ozeanen.
2 Aggregatzustände 2 Sublimieren. Eine weitere Besonderheit zeigen Stoffe, die beim Erhitzen des festen Zustandes direkt in den gasförmigen Zustand übergehen. Das Phänomen wird als Sublimation bezeichnet. Gefrorenes Kohlenstoffdioxid oder Trockeneis sublimiert beispielsweise bei 78,5 Celsius zu gasförmigem Kohlenstoffdioxid. Kohlenstoffdioxid bildet unter Normaldruck keine Flüssigkeit, daher erhielt das tiefkalte Kohlenstoffdioxid den Namen "Trockeneis". Beim Abkühlen unter den Sublimationspunkt von 78,5 Celsius resublimiert das Kohlenstoffdioxidgas wieder zu Trockeneis. Festes Iod geht beim Erhitzen direkt in gasförmigen Iod-Dampf über. Beim Abkühlen von Iod- Dampf bilden sich durch Resublimation wieder Iodkristalle. Probleme bei der Alltagssprache. Die Alltagssprache ist oft nicht exakt oder sie verwendet Begriffe als Synonyme, die so eigentlich gar nicht verwendet werden dürften. Betrachtet man kochendes Wasser von oben, ist der eigentliche Dampf unsichtbar. So wird umgangssprachlich sehr heißer Wassernebel und gasförmiges Wasser gleichgesetzt, beides wird dann unter Umständen "Wasserdampf" genannt. Man spricht in der chemischen Fachsprache beim Erhitzen von Wasser im Teekessel von Dampf. So nennt der Chemiker ein Gas, das immer noch mit der Flüssigkeit in Kontakt steht. Das, was man aber beim Teekessel am Dampfaustritt sieht, ist genaugenommen kein Dampf, sondern der Nebel, der durch das Abkühlen des Dampfs an der Luft entsteht. Der eigentliche Wasserdampf ist unsichtbar. Wir spüren vor allem die Hitze, wenn wir uns am Dampf verbrühen. Nebel. Werden Wasser-Tröpfchen in der Luft ganz fein verteilt, dann erhält man Nebel. In der Natur entsteht Nebel, wenn sich feuchte Luft abkühlt. Durch die Abkühlung kann die Luft nicht mehr so viel Feuchtigkeit aufnehmen, so dass das überschüssige Wasser in winzigen Tröpfchen kondensiert. Nebel entsteht vorzugsweise im Winter an Gewässern. Die Sonne verdampft tagsüber Wasser, am Abend kühlt es so stark ab, dass das Wasser auskondensiert. Reif. Die Bildung von Nebel wird noch beschleunigt, wenn Kondensationskerne wie Rußpartikel vorhanden sind. Wenn unterkühlter Wasserdampf bei Temperaturen unterhalb von 0 C an Pflanzen oder am Boden direkt aus dem gasförmigen Zustand in den festen Zustand übergeht, bildet sich Reif. Daraus können bizarre Formen und Figuren an den Pflanzen und den Gegenständen im Freien entstehen. Formänderungen bei den Aggregatzuständen. Im Chemieunterricht gelten die drei Aggregatzustände fest, flüssig und gasförmig als die drei klassischen Aggregatzustände. Der feste Zustand eines Stoffes ist dadurch gekennzeichnet, dass eine Stoffportion ihre Form behält. Eine Goldmünze bleibt im Gravitationsfeld der Erde und im Bereich der Schwerelosigkeit in ihrer Form. Im flüssigen Zustand füllen die flüssigen Stoffportionen auf der Erde die Form eines Behälters aus und bilden oben eine ebene Oberfläche, solange sie ruhen. Beim Herunterfallen wird eine Tropfenform gebildet. Im Bereich der Schwerelosigkeit bilden Flüssigkeiten tendenziell Kugeln aus. Gase haben in der Schwerelosigkeit hingegen die Tendenz, sich in alle Richtungen auszubreiten. Im Schwerefeld der Erde können Gase Schichtungen bilden. Ihre Tendenz, sich auszubreiten, ist auch im Schwerefeld gegeben. Auf Druckerhöhung reagieren Flüssigkeiten und feste Stoffe kaum mit Volumenminderung, solange sie in ihrem Aggregatzustand verbleiben. Ändern sie ihren Aggregatzustand, können sie auch ihre Volumina sprunghaft ändern. Gase dehnen sich bei Druckminderung aus, bei Druckerhöhung sind verschiedene Möglichkeiten gegeben. Welche davon eintritt, kann man am Zustandsdiagramm ablesen.
3 Aggregatzustände 3 Anomalie des Wassers. Beim Wasser besteht eine sogenannte "Anomalie": Bei +4 Celsius besitzt Wasser die höchste Dichte. Beim Abkühlen unter diesen Temperaturwert dehnt sich das Wasser aus. Eis hat eine geringere Dichte als Wasser und schwimmt daher auf dem Wasser. Im Winter gefrieren aufgrund der Anomalie des Wassers die Gewässer nicht vollständig zu. Das dichtere, 4 Celsius warme Wasser sinkt auf den Boden. Wenn das Wasser an der Wasseroberfläche 0 Celsius erreicht, wird es fest und schwimmt auf dem Wasser. An einer Zirkulation kann dieses Wasser nicht mehr teilnehmen. Es isoliert sogar die unteren Wasserschichten gegen zu schnelle Abkühlung. Aus diesem Grunde können Wasserorganismen wie Fische im Winter im zugefrorenen See überleben. Das Phänomen der Ausdehnung von Flüssigkeiten beim Erstarren kommt nur bei wenigen anderen Stoffen vor. Temperatur Dichte 0 C (Eis) 0,9168 g/ml 0 C (Wasser) 0, g/ml +4 C (Wasser) +10 C (Wasser) +20 C (Wasser) 1, g/ml 0, g/ml 0, g/ml Der Effekt, dass mit Wasser gefüllte Spalten im Gebirge im Winter ganze Felswände "sprengen" können und das Phänomen der Frostschäden im Straßenbau beruhen auf einem anderen Effekt: Kleine Kristalle sublimieren leichter als größere Kristalle, und umgekehrt resublimieren Gase an großen Kristallen besser als an kleinen. Bei längeren Frostperioden werden daher die kleinen Kristalle immer kleiner und die größeren Kristalle immer größer. Die größeren Kristalle entwickeln bei ihrem Wachstum sehr beachtliche Kräfte, so dass große Felsen abgesprengt oder faustgroße Beulen auf dem Straßenbelag entstehen können. Abhängigkeit des Siedepunkts vom Außendruck. Beim Siedepunkt geht eine Flüssigkeit in den gasförmigen Zustand über, die flüssige und die gasförmige Phase stehen dann in einem thermodynamischen Gleichgewichtszustand. Da der Siedepunkt vom Außendruck abhängig ist, gelten die tabellarischen Werte für den Siedepunkt eines Stoffes bei einem Normaldruck von 1013 Millibar. Beim Erreichen des Siedepunktes unter Normalbedingungen entspricht der Dampfdruck einer Flüssigkeit dem äußeren Druck von 1013 Millibar. Nach dieser Definition verdampft das Wasser nicht erst beim Siedepunkt von exakt +100 Celsius, sondern teilweise schon bei niedrigeren Temperaturen. Am Siedepunkt ist nur der beschriebene Gleichgewichtszustand erreicht. Beim Erwärmen einer Flüssigkeit wird die zugeführte Wärme zunächst zum Aufheizen der Flüssigkeit verwendet. Je mehr sich die Temperatur der Flüssigkeit dem Siedepunkt nähert, umso mehr wird die Wärme zum Verdampfen der Flüssigkeit verbraucht. Beim Erreichen des Siedepunktes steigt die Temperatur für längere Zeit nicht mehr an, sie bleibt konstant. Die zugeführte Wärme dient dann nur noch dem Verdampfen der Flüssigkeit. An der konstant bleibenden Temperatur erkennt man das Erreichen des Siedepunktes. So lassen sich Stoffe an ihren Siedepunkten oder auch an ihrem Schmelzpunkt erkennen. Bei der Destillation nutzt man den Siedepunkt zum Trennen von Stoffgemischen.
4 Aggregatzustände 4 Der Siedepunkt einer Flüssigkeit sinkt mit abnehmendem Druck und daher auch bei zunehmender Höhenlage. Pro 300 Höhenmeter sinkt der Siedepunkt um 1 Celsius. Wenn zum Beispiel auf dem Mount Everest bei fast 9000 Höhenmetern ein Druck von 312 Millibar vorherrscht, dann liegt der Siedepunkt von Wasser nur noch etwa bei +70 Celsius. Aufgrund der Druckabhängigkeit werden Destillationen auch unter Vakuum durchgeführt. Die Abnahme des Drucks erniedrigt die Siedetemperatur, so dass weniger Energie beim Heizen aufgewendet werden muss. Setzt man den Außendruck (p) und die Temperatur (T) in ein Diagramm, lässt sich für ein Stoff ein sogenanntes Zustandsdiagramm (oder pt-phasendiagramm) darstellen. Anhand der Linien erkennt man, bei welchem Druck und bei welcher Temperatur der Stoff seinen Zustand verändert. Auf den Linien selbst liegt der thermodynamische Gleichgewichtszustand vor. Am Tripelpunkt können alle drei Aggregatzustände gleichzeitig vorliegen. Unterhalb des Tripelpunktes tritt das Phänomen der Sublimation auf, die Trennlinie zwischen absolutem Nullpunkt und Tripelpunkt heißt Sublimationskurve. Die Trennlinie zwischen fester und flüssiger Phase nennt man Schmelzkurve, die Trennlinie zwischen flüssiger und gasförmiger Phase Siedekurve. Beim kritischen Punkt können Gas und Flüssigkeit aufgrund ihrer identischen Dichte nicht mehr unterschieden werden. Man könnte sagen: Der Stoff ist sowohl gasförmig als auch flüssig. Techniker in einem Kraftwerk, die mit Wasser am kritischen Punkt arbeiten, sprechen von "überkritischem Wasser". Es lässt sich oberhalb des kritischen Punktes keine Phasengrenzlinie mehr angeben. Ergänzende Hinweise: Die Schmelzkurve beim Wasser unterscheidet sich von anderen Stoffen. Beim Schmelzen von Eis beobachtet man bei steigendem Druck ein Absinken des Schmelzpunktes. Dieses Phänomen nennt man Schmelzanomalie des Wassers. Das obige Zustandsdiagramm ist aus didaktischen und anschaulichen Gründen vereinfacht, außerdem sind im Diagramm die Proportionen nicht korrekt dargestellt. Bei sehr hohem Druck (nicht im Diagramm dargestellt) bildet das Eis eine weitere Zustandsform, das sogenannte "Eis-II". Eis-II zeigt "normales Verhalten", sein Schmelzpunkt steigt mit zunehmendem Druck.
5 Aggregatzustände 5 Grenzen des Modells der klassischen Aggregatzustände. Nur einige Stoffe zeigen die klassischen Aggregatzustände mit den typischen Temperaturen bei den Umwandlungen. Manche Stoffe wie viele organische Stoffe zersetzen sich beim Erhitzen auch unter Luftabschluss. Es gibt Mineralien wie der Calcit, die sich gar nicht schmelzen lassen. Beim Quarz und bei vielen Gläsern ist der Übergang von fest nach flüssig fließend. Beim Erwärmen eines Glasröhrchens wird das Glas allmählich weich, beim weiteren Erhitzen zähflüssig, aber nie so flüssig wie das Wasser. Kristalliner Schwefel wird beim Erhitzen bei etwa +115 Celsius zunächst flüssig, dann tritt beim weiteren Erhitzen bei +159 Celsius eine zähflüssige Zustandsform, bevor er erneut flüssig wird und dann beim Siedepunkt bei +444 Celsius verdampft. All diese Phänomene lassen sich mit dem Modell der klassischen Aggregatzustände nicht mehr erklären. Kritik am oft verwendeten Teilchenmodell. In einigen Schulbüchern wird das Teilchenmodell als "Erklärungsversuch" für die klassischen Aggregatzustände hinzugezogen. Bei einem Feststoff sind die kleinsten Teilchen nach dieser Vorstellung nur wenig in Bewegung. Es wirken starke Anziehungskräfte, die Teilchen sind regelmäßig angeordnet und sie liegen relativ eng beieinander. Je höher die Temperatur ist, umso mehr nimmt die Eigenbewegung zu. Bei der Flüssigkeit ist die Bewegung der Teilchen so stark, dass die Teilchen nicht mehr ihren Platz halten können. Der Zusammenhalt der Teilchen ist jedoch weiter gewährleistet. Beim Gas sind die Teilchen so schnell in Bewegung, dass sie keine regelmäßige Anordnung mehr einnehmen können und auch nicht mehr zusammenhalten. Kritik. Das Problem des Teilchenmodells ist, dass es mit Bildern aus der dem Menschen sichtbaren Welt arbeitet. Der Mikrokosmos ist aber eine abstrakte und andersartige Welt als die Welt, wie wir Menschen sie wahrnehmen und erkennen. Das Teilchenmodell legt den Schwerpunkt zu stark auf die bildhafte Darstellung der Teilchen, die als abgeschlossene Einheiten wie Pingpongbälle aufeinander "stoßen" oder sich wie Magnete gegenseitig "anziehen". Die komplizierten Wechselwirkungen der Systeme im atomaren Bereich werden nur unzureichend berücksichtigt. Alternative. Die eingehende Beschäftigung mit den Phänomenen ist für ein einfaches Verstehen des Alltags aus didaktischer Sicht genügend präzise. Die komplizierteren Zusammenhänge werden durch die abstrakte Sprache der Mathematik treffend beschrieben, zum Beispiel durch eine Siedepunktkurve oder ein Zustandsdiagramm. Weitere Aggregatzustände. Bei sehr hohen Temperaturen und sehr hohem Druck erreicht die Materie einen Zustand, der oft als vierter Aggregatzustand bezeichnet wird. Die Gase zerfallen dabei in ein Plasma, wobei die Elektronen der Atomhüllen in den Atomen ganz oder teilweise frei werden. Man erhält freie, negativ geladene Elektronen und positiv geladene Ionen. Materie im Plasmazustand besitzt völlig neue Eigenschaften. Sie ist in der Regel elektrisch sehr leitfähig und durch Magnetfelder leicht beeinflussbar. Plasmazustände finden sich oft in unserer Umwelt, ohne dass wir sie direkt wahrnehmen. So bilden Kerzenflammen oder Gewitterblitze teilweise Plasmazustände aus. Im Universum sind sie sehr häufig anzutreffen. Plasmen finden sich in den Sternen, beispielsweise im Inneren unserer Sonne. Neuerdings vermutet man auch sogenannte "metallische Plasmen" im Inneren der Planeten, die dort unter hohem Druck und bei relativ niedriger Temperatur vorhanden sind. Im Labor kann man Plasmazustände durch starke Stromentladungen, durch die Verwendung von Laserstrahlen oder durch den Beschuss von Materie mit Schwerionenstrahlungen künstlich erzeugen.
6 Aggregatzustände 6 Je mehr man bei einer Abkühlung der Materie dem absoluten Nullpunkt bei 273,15 Celsius nahe kommt, umso mehr verlieren die Atome ihre Individualität und funktionieren synchron. Eine Wechselwirkung zwischen den Atomen findet kaum noch statt. Ein Quantenphysiker spricht von einem einzigen Quantenzustand bei den Atomen. Dieser fünfte Aggregatzustand wird als Bose- Einstein-Kondensat oder BEC bezeichnet. Die Atome in einem solchen Zustand sind auch nicht mehr räumlich zuzuordnen. Man könnte auch sagen, die Atome sind im Kondensat überall zugleich. Vorausgesagt wurde dieser fünfte Aggregatzustand von Satyendra Nath Bose und Albert Einstein bereits im Jahre Der experimentelle Nachweis erfolgte im Jahr 1995 durch Eric Cornell, Carl Wiemann und Wolfgang Kettele, die im Jahr 2001 dafür den Nobelpreis erhielten. Im Jahr 2003 stellte ein Wissenschaftlerteam der Universität Colorado ein weiteres Kondensat nahe dem absoluten Nullpunkt her. Das Kondensat aus Fermionen wurde gelegentlich schon als sechster Aggregatzustand bezeichnet. Ob das Fermionen-Kondensat einen sechsten Aggregatzustand oder nur eine Variante des fünften darstellt, ist noch nicht endgültig geklärt. Ob ein Vakuum als Aggregatzustand bezeichnet werden kann, ist umstritten. Ein Vakuum ist entstanden, wenn die diversen Phänomene, die aus einem Gas bekannt sind, nicht mehr auftreten: Es treten keine Strömungsphänomene wie Verwirbelungen oder Sog mehr auf. Die Schallleitung ist vollständig unterbrochen. Ein Luftwiderstand tritt nicht mehr auf. Wärme wird nur durch Wärmestrahlung übertragen. Im realen Vakuum sind also immer noch Atome enthalten, im Gegensatz zum rein theoretischen absoluten Vakuum. Im Weltall existiert ebenfalls ein Vakuum. Dieses enthält so wenige Atome auf einen Kubikmeter wie es auf der Erde bisher noch nicht technisch realisiert werden konnte.
Seilnacht Chemie Basistexte: Stoffe, Stoffgemische
 1 Seilnacht Chemie Basistexte: Stoffe, Stoffgemische Seilnacht 2 Inhaltsverzeichnis Thema Seite Der Stoffbegriff in der Chemie 3 Stoffgemische 5 Aggregatzustände 8 Der Stoffbegriff in der Chemie 1 3 Reinstoff,
1 Seilnacht Chemie Basistexte: Stoffe, Stoffgemische Seilnacht 2 Inhaltsverzeichnis Thema Seite Der Stoffbegriff in der Chemie 3 Stoffgemische 5 Aggregatzustände 8 Der Stoffbegriff in der Chemie 1 3 Reinstoff,
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
02. Was kann man über die Teilchen eines schmelzenden Stoffes aussagen?
 01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
3.4 Änderung des Aggregatzustandes
 34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
Das sind vielleicht Zustände!
 1 Das sind vielleicht Zustände! Wasser ist der einzige Stoff auf unserem Planeten, der in drei verschiedenen Formen, sogenannten Aggregatszuständen, vorkommt: fest, flüssig und gasförmig. Das heißt, Wasser
1 Das sind vielleicht Zustände! Wasser ist der einzige Stoff auf unserem Planeten, der in drei verschiedenen Formen, sogenannten Aggregatszuständen, vorkommt: fest, flüssig und gasförmig. Das heißt, Wasser
Wasservorkommen der Erde
 Woher und wofür? Ich weiss, wie das Wasservorkommen auf der Erde verteilt ist Ich weiss, wie das Wasservorkommen in der Schweiz verteilt ist Blauer Planet - und doch Wassermangel? Regen und andere Niederschläge
Woher und wofür? Ich weiss, wie das Wasservorkommen auf der Erde verteilt ist Ich weiss, wie das Wasservorkommen in der Schweiz verteilt ist Blauer Planet - und doch Wassermangel? Regen und andere Niederschläge
Wie stelle ich Kärtchen her, auf denen hinten die Lösung aufgedruckt ist?
 Wie stelle ich Kärtchen her, auf denen hinten die Lösung aufgedruckt ist? 1. Fragen- und Lösungsblätter ausdrucken! 3. Von beiden Blättern den Rand abschneiden! 2. Jeweiliges Lösungsblatt zum richtigen
Wie stelle ich Kärtchen her, auf denen hinten die Lösung aufgedruckt ist? 1. Fragen- und Lösungsblätter ausdrucken! 3. Von beiden Blättern den Rand abschneiden! 2. Jeweiliges Lösungsblatt zum richtigen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Meine eigene
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Meine eigene
Flüssigkeitsthermometer Bimetallthermometer Gasthermometer Celsius Fahrenheit
 Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
WASSER. Station 1. com. N Arbeitsblatt
 Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
Wärmelehre. Versuch. Temperatur und Temperaturmessung
 Wärmelehre Die Wärmelehre ist ein Teilgebiet der Physik, das sich mit der Temperatur von Körpern, der Zufuhr und Abgabe von Wärme und den damit verbundenen Temperaturänderungen, der Wärmeübertragung und
Wärmelehre Die Wärmelehre ist ein Teilgebiet der Physik, das sich mit der Temperatur von Körpern, der Zufuhr und Abgabe von Wärme und den damit verbundenen Temperaturänderungen, der Wärmeübertragung und
Phasenübergänge - Strukturbildung in der Natur. Prof. Dr. Clemens Laubschat TU Dresden
 Phasenübergänge - Strukturbildung in der Natur Prof. Dr. Clemens Laubschat TU Dresden Phase: Durch Grenzflächen beschränkter homogener Bereich des materieerfüllten Raums mit charakteristischen Eigenschaften
Phasenübergänge - Strukturbildung in der Natur Prof. Dr. Clemens Laubschat TU Dresden Phase: Durch Grenzflächen beschränkter homogener Bereich des materieerfüllten Raums mit charakteristischen Eigenschaften
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt.
 1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
Allgemeine Chemie. SS 2014 Thomas Loerting. Thomas Loerting Allgemeine Chemie
 Allgemeine Chemie SS 2014 Thomas Loerting 1 Inhalt 1 Der Aufbau der Materie (Teil 1) 2 Die chemische Bindung (Teil 2) 3 Die chemische Reaktion (Teil 3) 2 Definitionen von den an einer chemischen Reaktion
Allgemeine Chemie SS 2014 Thomas Loerting 1 Inhalt 1 Der Aufbau der Materie (Teil 1) 2 Die chemische Bindung (Teil 2) 3 Die chemische Reaktion (Teil 3) 2 Definitionen von den an einer chemischen Reaktion
Aufgabe: Erkläre folgende Tatsache mit Hilfe des Teilchenmodells! An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen.
 An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH
 3 Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH Physik Wärme 5 Themen Begriffsklärung Anwendungen Temperaturskalen Modellvorstellung Wärmeausdehnung Thermische Ausdehnung Phasenübergänge
3 Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH Physik Wärme 5 Themen Begriffsklärung Anwendungen Temperaturskalen Modellvorstellung Wärmeausdehnung Thermische Ausdehnung Phasenübergänge
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
(VIII) Wärmlehre. Wärmelehre Karim Kouz WS 2014/ Semester Biophysik
 Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Kreislauf 15/24 Winde verblasen die Wolken auch auf andere Teile der Erde. Wenn es an der Erdoberfläche windstill ist, weht in der Höhe trotzdem Wind.
 Kreislauf 13/24 Manche Quellen sind sehr klein: Es rinnt nur ein schmales Rinnsal daraus hervor. Aus manchen Quellen aber sprudelt ein richtiger Bach. Immer wieder fließen kleinere Bäche in den Bach, er
Kreislauf 13/24 Manche Quellen sind sehr klein: Es rinnt nur ein schmales Rinnsal daraus hervor. Aus manchen Quellen aber sprudelt ein richtiger Bach. Immer wieder fließen kleinere Bäche in den Bach, er
Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus.
 Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus. Materialien Ein dickwandiges Glas Wasser Aufbau und Durchführung
Was ist die Dichteanomalie des Wassers? Experiment Wasser dehnt sich im Gegensatz zu fast allen anderen Flüssigkeiten beim Einfrieren aus. Materialien Ein dickwandiges Glas Wasser Aufbau und Durchführung
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
DOWNLOAD. Vertretungsstunden Physik /8. Klasse: Wärmelehre Aggregatzustand. Hardy Seifert. Downloadauszug aus dem Originaltitel:
 DOWNLOAD Hardy Seifert Vertretungsstunden Physik 12 7./8. Klasse: Aggregatzustand Downloadauszug aus dem Originaltitel: Aggregatzustand 1 Wasser: Gefrierpunkt (Schmelzpunkt): Zinn: Schmelzpunkt: Butter:
DOWNLOAD Hardy Seifert Vertretungsstunden Physik 12 7./8. Klasse: Aggregatzustand Downloadauszug aus dem Originaltitel: Aggregatzustand 1 Wasser: Gefrierpunkt (Schmelzpunkt): Zinn: Schmelzpunkt: Butter:
Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler
 Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler Aufgabe 1 (Aggregatzustände nennen und Aufbau und Bewegung beschreiben) N1: Betrachte aufmerksam die Bilder und benenne
Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler Aufgabe 1 (Aggregatzustände nennen und Aufbau und Bewegung beschreiben) N1: Betrachte aufmerksam die Bilder und benenne
ALLGEMEINE CHEMIE - GRUNDLAGEN
 ALLGEMEINE CHEMIE - GRUNDLAGEN Ziel der Vorlesung: Vermittlung des Wissens allgemeiner chemischen Grundlagen und Vorstellungen, die für alle Bereiche der Naturwissenschaften notwendig sind; Modellvorstellungen
ALLGEMEINE CHEMIE - GRUNDLAGEN Ziel der Vorlesung: Vermittlung des Wissens allgemeiner chemischen Grundlagen und Vorstellungen, die für alle Bereiche der Naturwissenschaften notwendig sind; Modellvorstellungen
Fachrichtung Klima- und Kälteanlagenbauer
 Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Das ist ja nicht normal!
 1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
Kernaussagen zum Teilchenmodell
 Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
Temperaturabhängigkeit, Schmelzund Siedetemperatur
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelzund Siedetemperatur Kurzprotokoll Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelzund Siedetemperatur Kurzprotokoll Auf einen Blick: Im Folgenden
Antrieb und Wärmebilanz bei Phasenübergängen. Speyer, März 2007
 Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Süsse Chemie. Untersuche Stoffeigenschaften und wandle Stoffe um.
 Stoffe. Süsse Chemie Untersuche Stoffeigenschaften und wandle Stoffe um. 1. Betrachte den Haushaltszucker auf allen Bildern sowie einen Würfelzucker vor dir. Woran erkennst du «Haushalts zucker»? 2. Beschreibe
Stoffe. Süsse Chemie Untersuche Stoffeigenschaften und wandle Stoffe um. 1. Betrachte den Haushaltszucker auf allen Bildern sowie einen Würfelzucker vor dir. Woran erkennst du «Haushalts zucker»? 2. Beschreibe
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Arbeitsblatt Wasserkreislauf der Erde
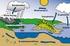 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Sublimation & Resublimation
 Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Die Aggregatzustände (Orientieren und Verstehen)
 Die Aggregatzustände (Orientieren und Verstehen) Auf der Internetseite www.chemiedidaktik.uni- bremen.de/multimedia/lernumgebung_teilchen/ aggregatzustaende.html findest Du viele Informationen zu den Aggregatzuständen.
Die Aggregatzustände (Orientieren und Verstehen) Auf der Internetseite www.chemiedidaktik.uni- bremen.de/multimedia/lernumgebung_teilchen/ aggregatzustaende.html findest Du viele Informationen zu den Aggregatzuständen.
Thema 2.2. Kondensationsfeuchte. bauphsikalische Grundlagen
 Thema 2 Kondensationsfeuchte bauphsikalische Grundlagen Inhaltsverzeichnis 1. Einleitung von 2 druck 3 diffusion 4 5 6 von 2 druck 3 diffusion 4 5 6 1. Einleitung Als physikalische Kondensation bezeichnet
Thema 2 Kondensationsfeuchte bauphsikalische Grundlagen Inhaltsverzeichnis 1. Einleitung von 2 druck 3 diffusion 4 5 6 von 2 druck 3 diffusion 4 5 6 1. Einleitung Als physikalische Kondensation bezeichnet
1. Aufgaben der Klimaanlage
 Praxiswissen Pkw-Klimaanlagen 1 1. Aufgaben der Klimaanlage In erster Linie kommt der Klimaanlage die Aufgabe zu, die Temperatur im Fahrzeug - innenraum bei entsprechend hohen Außentemperaturen auf ein
Praxiswissen Pkw-Klimaanlagen 1 1. Aufgaben der Klimaanlage In erster Linie kommt der Klimaanlage die Aufgabe zu, die Temperatur im Fahrzeug - innenraum bei entsprechend hohen Außentemperaturen auf ein
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 1. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
(c) Schulbedarfszentrum
 für die 7. Schulstufe Theoretischer Teil Wärmekapazität Elektrische Ladung Lückentexte Quiz Experimente Wärme und Temperatur Metalle Druck Das Ohm sche Gesetz Wissensüberprüfungen Merktexte Denkaufgaben
für die 7. Schulstufe Theoretischer Teil Wärmekapazität Elektrische Ladung Lückentexte Quiz Experimente Wärme und Temperatur Metalle Druck Das Ohm sche Gesetz Wissensüberprüfungen Merktexte Denkaufgaben
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
Vorwort 2 Aufbau der Lerneinheiten und allgemeine didaktische Hinweise 2
 Inhaltsverzeichnis Vorwort 2 Aufbau der Lerneinheiten und allgemeine didaktische Hinweise 2 IV Teilchenebene 4 Didaktische Hinweise 4 Tabellarischer Ablauf 6 Aggregatzustände 1 3 7 Anleitung: Wärmespiel
Inhaltsverzeichnis Vorwort 2 Aufbau der Lerneinheiten und allgemeine didaktische Hinweise 2 IV Teilchenebene 4 Didaktische Hinweise 4 Tabellarischer Ablauf 6 Aggregatzustände 1 3 7 Anleitung: Wärmespiel
8 Teilchenbewegung und Temperatur(movimiento (el) de partículas y
 8 Teilchenbewegung und Temperatur Hofer 1 8 Teilchenbewegung und Temperatur(movimiento (el) de partículas y temperatura, la) 8.1 Molekularkräfte (fuerza (la) intermolecular) A1: Wiederhole, die vier fundamental
8 Teilchenbewegung und Temperatur Hofer 1 8 Teilchenbewegung und Temperatur(movimiento (el) de partículas y temperatura, la) 8.1 Molekularkräfte (fuerza (la) intermolecular) A1: Wiederhole, die vier fundamental
THEMA Wie entsteht Regen, Schnee, Hagel, Eisregen? Warum ist Schnee weiß und Eis durchsichtig? Warum stürzen im Winter die Dächer ein?
 Kathrin Thaler 1 ZIELE Die Schüler sollen über die Entstehung einzelner Niederschlagsarten bescheid wissen und erklären können, wie sie entstehen. Sie sollen erkennen, dass es unterschiedlich Bedingung
Kathrin Thaler 1 ZIELE Die Schüler sollen über die Entstehung einzelner Niederschlagsarten bescheid wissen und erklären können, wie sie entstehen. Sie sollen erkennen, dass es unterschiedlich Bedingung
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen!
 1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
Naturwissenschaftliche Grundlagen für Maschinenbauer und Wirtschaftsingenieure
 Naturwissenschaftliche Grundlagen für Maschinenbauer und Wirtschaftsingenieure Heinz W. Siesler (Vorlesung) Miriam Unger (Übungen)( Institut für f r Physikalische Chemie Universität t Duisburg-Essen Schützenbahn
Naturwissenschaftliche Grundlagen für Maschinenbauer und Wirtschaftsingenieure Heinz W. Siesler (Vorlesung) Miriam Unger (Übungen)( Institut für f r Physikalische Chemie Universität t Duisburg-Essen Schützenbahn
Fachhochschule Flensburg. Institut für Physik
 Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Aggregatzustände (Niveau 1)
 Aggregatzustände (Niveau 1) 1. Wasser kann verschiedene Zustandsformen haben, die sogenannten Aggregatzustände. Im Frühjahr kannst du die verschiedenen Aggregatzustände beobachten. Ergänze im Text die
Aggregatzustände (Niveau 1) 1. Wasser kann verschiedene Zustandsformen haben, die sogenannten Aggregatzustände. Im Frühjahr kannst du die verschiedenen Aggregatzustände beobachten. Ergänze im Text die
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Phasengleichgewicht und Phasenübergänge. Gasförmig
 Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Azeotrope. Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch
 Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Materie ist die Gesamtheit aller Stoffe: Energie bei chemischen Reaktionen:
 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat
 1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
2. Unterrichtseinheit zum Thema Aggregatzustände: Aggregatzustände und ihre Übergänge Übertragung auf den Wasserkreislauf
 Unterrichtsentwurf 2. Unterrichtseinheit zum Thema Aggregatzustände: Aggregatzustände und ihre Übergänge Übertragung auf den Wasserkreislauf 3. Doppelstunde: Was passiert mit verdunstetem Wasser, wenn
Unterrichtsentwurf 2. Unterrichtseinheit zum Thema Aggregatzustände: Aggregatzustände und ihre Übergänge Übertragung auf den Wasserkreislauf 3. Doppelstunde: Was passiert mit verdunstetem Wasser, wenn
Die drei Aggregatzustände - Erklärung
 2.1.3 - Die drei Aggregatzustände - Erklärung VERSUCH 1 - DIE WASSERPISTOLE Versuchsdurchführung: Die Wasserpistole (Bild 4) wird zum einerseits mit Wasser und andererseits mit Luft gefüllt. Anschließend
2.1.3 - Die drei Aggregatzustände - Erklärung VERSUCH 1 - DIE WASSERPISTOLE Versuchsdurchführung: Die Wasserpistole (Bild 4) wird zum einerseits mit Wasser und andererseits mit Luft gefüllt. Anschließend
Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2)
 Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Physik kompetenzorientiert: Wärmelehre 2
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Physik kompetenzorientiert: Wärmelehre 2 Das komplette Material finden Sie hier: Download bei School-Scout.de Ausdehnung von Körpern
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Physik kompetenzorientiert: Wärmelehre 2 Das komplette Material finden Sie hier: Download bei School-Scout.de Ausdehnung von Körpern
PHYSIKTEST 3C Dezember 2015 GRUPPE A
 PHYSIKTEST 3C Dezember 2015 GRUPPE A Korrekturvorlage Aufgabe 1. (3 Punkte) Kreuze die richtigen 2 Aussagen an! Die Einheit von Energie ist Kelvin. Die Einheit von Wärmekapazität ist Joule pro Kilogramm
PHYSIKTEST 3C Dezember 2015 GRUPPE A Korrekturvorlage Aufgabe 1. (3 Punkte) Kreuze die richtigen 2 Aussagen an! Die Einheit von Energie ist Kelvin. Die Einheit von Wärmekapazität ist Joule pro Kilogramm
Versuch Nr. 7. = q + p dv
 Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Geografie, D. Langhamer. Klimarisiken. Beschreibung des Klimas eines bestimmten Ortes. Räumliche Voraussetzungen erklären Klimaverlauf.
 Klimarisiken Klimaelemente Klimafaktoren Beschreibung des Klimas eines bestimmten Ortes Räumliche Voraussetzungen erklären Klimaverlauf Definitionen Wetter Witterung Klima 1 Abb. 1 Temperaturprofil der
Klimarisiken Klimaelemente Klimafaktoren Beschreibung des Klimas eines bestimmten Ortes Räumliche Voraussetzungen erklären Klimaverlauf Definitionen Wetter Witterung Klima 1 Abb. 1 Temperaturprofil der
Antwort 1: Antwort 1:
 Hilfe 1 Hilfe 1 Erklärt euch gegenseitig die Aufgabe noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch gegenseitig die Aufgabe
Hilfe 1 Hilfe 1 Erklärt euch gegenseitig die Aufgabe noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch gegenseitig die Aufgabe
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Temperatur und Wärme - Stationenlernen
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Temperatur und Wärme - Stationenlernen Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Stationenlernen: Temperatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Temperatur und Wärme - Stationenlernen Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Stationenlernen: Temperatur
Grund- und Angleichungsvorlesung Physik der Wärme.
 2 Grund- und Angleichungsvorlesung Physik. Physik der Wärme. WS 17/18 1. Sem. B.Sc. LM-Wissenschaften Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe
2 Grund- und Angleichungsvorlesung Physik. Physik der Wärme. WS 17/18 1. Sem. B.Sc. LM-Wissenschaften Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nichtkommerziell Weitergabe
Formelsammlung Abfallwirtschaft Seite 1/6 Wärmekapazität Prof. Dr. Werner Bidlingmaier & Dr.-Ing. Christian Springer
 Formelsammlung Abfallwirtschaft Seite 1/6 1 Energiebedarf zur Erwärmung von Stoffen Der Energiebetrag, der benötigt wird, um 1 kg einer bestimmten Substanz um 1 C zu erwärmen, wird als die (auch: Spezifische
Formelsammlung Abfallwirtschaft Seite 1/6 1 Energiebedarf zur Erwärmung von Stoffen Der Energiebetrag, der benötigt wird, um 1 kg einer bestimmten Substanz um 1 C zu erwärmen, wird als die (auch: Spezifische
Zustandsänderungen. Physik
 Zustandsänderungen Aufgabe 1 Du hast schon vielerlei Erfahrungen mit dem lebensnotwendigen Wasser gemacht. In welchen Zustandsformen (Aggregatzuständen) ist dir Wasser bekannt? fest dick schön rot eckig
Zustandsänderungen Aufgabe 1 Du hast schon vielerlei Erfahrungen mit dem lebensnotwendigen Wasser gemacht. In welchen Zustandsformen (Aggregatzuständen) ist dir Wasser bekannt? fest dick schön rot eckig
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
Verwendet man ein Seil, dann kann der Angriffspunkt A der Kraft verschoben werden,
 Kraftwandler Ein Kraftwandler ist eine Vorrichtung, die den Angriffspunkt, die Richtung oder die Größe einer aufzuwendenden Kraft verändern kann. Beispiele : a) b) Verwendet man ein Seil, dann kann der
Kraftwandler Ein Kraftwandler ist eine Vorrichtung, die den Angriffspunkt, die Richtung oder die Größe einer aufzuwendenden Kraft verändern kann. Beispiele : a) b) Verwendet man ein Seil, dann kann der
3. UNTERRICHTSTUNDE: AGGREGATZUSTÄNDE DES WASSERS / TEMPERATUR
 3. UNTERRICHTSTUNDE 37 3. UNTERRICHTSTUNDE: AGGREGATZUSTÄNDE DES WASSERS / TEMPERATUR Ziel: Die Schüler sollen erkennen, dass die Temperatur auf den Zustand des Wassers Einfl uss hat. Sprache der kognitiven
3. UNTERRICHTSTUNDE 37 3. UNTERRICHTSTUNDE: AGGREGATZUSTÄNDE DES WASSERS / TEMPERATUR Ziel: Die Schüler sollen erkennen, dass die Temperatur auf den Zustand des Wassers Einfl uss hat. Sprache der kognitiven
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers
 Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers Unterrichtsfach Themenbereich/e Chemie Wasser als ohstoff und Lösungsmittel Schulstufe (Klasse) 8. (4.)
Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers Unterrichtsfach Themenbereich/e Chemie Wasser als ohstoff und Lösungsmittel Schulstufe (Klasse) 8. (4.)
4 Wasser, Wasserdampf Theorie
 4 Wasser, Wasserdampf Theorie 4.1 Der Partial- und Sättigungsdruck (Gesetz von Dalton) In einem Gasgemisch (Volumen V, Temperatur T) übt jede Gaskomponente einen Teildruck (Partialdruck) p i aus, der genau
4 Wasser, Wasserdampf Theorie 4.1 Der Partial- und Sättigungsdruck (Gesetz von Dalton) In einem Gasgemisch (Volumen V, Temperatur T) übt jede Gaskomponente einen Teildruck (Partialdruck) p i aus, der genau
Luft ist nicht Nichts
 Luft ist nicht Nichts Experiment 1 Luft im Glas: Durchführung: Ein offenes Glas wird verkehrt herum in eine Schale voller Wasser getaucht. Luft im Glas Wasser Beobachtung: Das Glas bleibt auch unter Wasser
Luft ist nicht Nichts Experiment 1 Luft im Glas: Durchführung: Ein offenes Glas wird verkehrt herum in eine Schale voller Wasser getaucht. Luft im Glas Wasser Beobachtung: Das Glas bleibt auch unter Wasser
4.6.5 Dritter Hauptsatz der Thermodynamik
 4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
Was kocht denn da? Stoffe und ihre Aggregatzustände
 en Was kocht denn da? Stoffe und ihre Aggregatzustände Ein Film von Wolfgang Voelker Beitrag: Rupert Ernhofer Inhalt Was haben Wasser, Dampf und Eis gemeinsam? Richtig: trotz unterschiedlicher Bezeichnungen
en Was kocht denn da? Stoffe und ihre Aggregatzustände Ein Film von Wolfgang Voelker Beitrag: Rupert Ernhofer Inhalt Was haben Wasser, Dampf und Eis gemeinsam? Richtig: trotz unterschiedlicher Bezeichnungen
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Geologie, Physik. Mit der Veränderung von Stoffen
 Fragen und Antworten für den ersten Physiktest der 2. Klasse Seite: 1 von 5 1. Nenne 7 Naturwissenschaften! Biologie, Chemie, Astronomie, Meteorologie, Mineralogie, Geologie, Physik 2. Womit beschäftigt
Fragen und Antworten für den ersten Physiktest der 2. Klasse Seite: 1 von 5 1. Nenne 7 Naturwissenschaften! Biologie, Chemie, Astronomie, Meteorologie, Mineralogie, Geologie, Physik 2. Womit beschäftigt
Prozesstechnik-Übung Wintersemester Es ist das Phasendiagramm des Systems Naphthalin/Biphenyl durch thermische Analyse zu bestimmen.
 Prozesstechnik-Übung Wintersemester 2008-2009 Thermische Analyse 1 Versuchsziel Es ist das Phasendiagramm des Systems Naphthalin/Biphenyl durch thermische Analyse zu bestimmen. 2 Theoretische Grundlagen
Prozesstechnik-Übung Wintersemester 2008-2009 Thermische Analyse 1 Versuchsziel Es ist das Phasendiagramm des Systems Naphthalin/Biphenyl durch thermische Analyse zu bestimmen. 2 Theoretische Grundlagen
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Das Kugelteilchenmodell und Aggregatzustände
 Das Kugelteilchenmodell und Aggregatzustände Wie kann man sich die drei Aggregatzustände im Teilchenmodell vorstellen? Siehe dazu S. 38 im Buch an! Feststoffe: Teilchen eng beieinander; feste Plätze; keine
Das Kugelteilchenmodell und Aggregatzustände Wie kann man sich die drei Aggregatzustände im Teilchenmodell vorstellen? Siehe dazu S. 38 im Buch an! Feststoffe: Teilchen eng beieinander; feste Plätze; keine
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan)
 Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
6. UNTERRICHTSTUNDE: WASSERKREISLAUF/ VERDUNSTEN (VERDAMPFEN)
 THEMA: THEMA DER WASSERKREISLAUF 2. 6. UNTERRICHTSTUNDE 59 6. UNTERRICHTSTUNDE: WASSERKREISLAUF/ VERDUNSTEN (VERDAMPFEN) Ziel: Die Schüler sollen verstehen, wie ein Wasserkreislauf entsteht. Sprache der
THEMA: THEMA DER WASSERKREISLAUF 2. 6. UNTERRICHTSTUNDE 59 6. UNTERRICHTSTUNDE: WASSERKREISLAUF/ VERDUNSTEN (VERDAMPFEN) Ziel: Die Schüler sollen verstehen, wie ein Wasserkreislauf entsteht. Sprache der
Kinetische Energie der Moleküle / Aggregatzustand
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
