Pädiatrisches Prüfkonzept (PIP) - Dos and Don ts anhand regulatorischer Erfahrung
|
|
|
- Ilse Boer
- vor 8 Jahren
- Abrufe
Transkript
1 Pädiatrisches Prüfkonzept (PIP) - Dos and Don ts anhand regulatorischer Erfahrung Reinhard Hiersemenzel Senior Medical Expert Global Clinical R&D CNS Merz Pharmaceuticals GmbH
2 - Nicht befugt, für und im Namen der EMA zu sprechen - Alle Aussagen sind als persönliche Meinungsäußerungen zu verstehen und nicht als Positionen von Merz Pharmaceuticals DISCLAIMER
3 Die pädiatrische Regulierung der EU Better medicines for children Qualitätsverbesserung der Arzneimittelforschung bei Kindern: Planung prospektiver, konklusiver Kinderstudien vor Erwachsenenzulassung für alle pädiatrischen Altersklassen, einschl. der Neugeborenen (nach Phase I, spätestens nach POC bei Erwachsenen) Mehr kindgerechte Darreichungsformen (für zugelassene und in Entwicklung befindliche Medikamente) Bessere Arzneimittelinformation für Anwendung bei Kindern Keine Verzögerung der Erwachsenenzulassung Keine unnötigen Studien an Kindern Medical need-driven Kostenlos (einschließlich entsprechendem Scientific Advice) Nahezu unbeschränkt (PDCO kann keine Anträge ablehnen, sofern sie unter die Regulierung fallen, also validiert sind) Carrot and stick (zusätzliche Vermarktungsexklusivität, Verweigerung der Erwachsenzulassung) The PDCO agrees Eingefahrene Prozedur Unvermeidlich, sofern kein Class Waiver Überwiegend Anträge nach Art. 7 und Modifications (Neuanträge nach Art. 8 abnehmend, Art. 30 PUMA selten)
4
5
6 Das Pädiatrische Komitee Decision by committee Tagt jeden Monat 3 Tage Enorme Arbeitsbelastung (70 Produkte pro Meeting) Gnadenlose Fristen (60 Tage für Waiver, 120 Tage für PIP, nur 1 Clock Stop nach Antragsvalidierung) Working Groups (Formulation, non-clinical, ad-hoc, z.b. Extrapolation, Standard PIPs) Personelle Verzahnung mit CHMP, Scientific Advice, Therapeutic area working groups, anderen Komitees, nationalen Zulassungsbehörden Abstimmung mit FDA (monatliche TC) und Informationsaustausch mit PMDA Repräsentanten von Stakeholdern (Patienten, pädiatrische Forschungsnetzwerke, etc.) Interne Konsultants (Statistiker, non-clinical, quality) Externe Konsultants (ohne Honorar, nur Reise- und Hotelkosten, Verpflegungspauschale) Workshops mit Stakeholdern (z.b. Ethik, TA-spezifische Aspekte der pädiatrischen klinischen Entwicklung)
7 Instrumente des Komitees Opinions Waiver (class, product specific, on own motion ) PIP (inkl. deferrals) PIP Modifications Compliance checks Meeting minutes (D30, D60, D90, D120) Oral explanation Day 30 (Waiver) bzw. Day 60 (PIP) Request for Modification, Clock Stop Clock Stop durch Chairman sonst nur bei zusätzlichem Informationsbedarf des Komitees (eher die Ausnahme)
8 Instrumente des Antragstellers Pre-submission meeting (Eligibility prüfen) Oral explanation Clarification TCs Eigene Experten Re-examination Withdrawal of application at any time (fast immer ohne Gesichtsverlust; lieber früher als später, wenn eine fristgerechte Einigung nicht möglich erscheint) Re-submission Modification at any time
9 PIP/Waiver Antrag Validated by Paediatric Coordinator = Gatekeeper Formale Kriterien (Vollständigkeit Part A, Gliederung) Manchmal Inhalt (Anwendbarkeit von Art. 7, 8 or 30, Definition der condition ) KISS, stand-alone document, data-driven, wissenschaftlich präzise aber konzis Anhänge: alle relevanten Scientific Advices, etc.
10 Assessment Team Validierer, 1. Reviewer, minute taker, compliance checker und Fenster zu Antragsteller, Reviewern und Committee Chair: Paediatric Coordinator 2. Review: Rapporteur 3. Review: Peer Fast immer: Formulation und Non-Clinical Group Starke Heterogenität (Qualifikation, Erfahrung, verfügbare Zeit und personelle Unterstützung)
11 Tipps zum Umgang mit dem Koordinator Direkter Kontakt durch Sponsor oder Agent (mit prozeduralem und TA-Know How) ist oft hilfreich Im Zweifel anrufen Bei spezifischen Klärungsbedarf von erheblicher Tragweite schriftlich nachfragen Der Koordinator ist selbst am stärksten an Fristen gebunden (Validation questions manchmal einzige Möglichkeit, Zeit zu gewinnen) Der Koordinator verhandelt mit Rapporteur und Peer Reviewer sowie allen Working Groups und Stakeholdern Der Koordinator trägt bei der monatlichen TC mit der FDA vor
12 Tipps zur Entwicklungsstrategie ASAP: erste Überlegungen zur pädiatrischen Strategie (Einbeziehung der Altersgruppe in Überlegungen zur Erwachsenenstrategie, Rationale für Extrapolation von Erwachsenen zu Kindern für jede Altersgruppe prüfen) Spätestens nach erfolgreichem proof of concept : dediziertes PIP-Team zusammenstellen und Einreichung vorbereiten Pädiatrische Überlegungen/Fragen von Anfang an in Scientific Advice Prozeduren miteinbeziehen
13 Tipps zum Umgang mit dem Komitee Viel Vorlauf geben, keinen Druck ausüben Eine abgerundete und integrierte (US, EU, ROW) Entwicklungsstrategie Die Regulation respektieren (das Komitee und die Agency sind daran gebunden) Strenge ethische Maßstäbe ansetzen (medical need, safety, placebo exposure): Würde ich meinem Kind in dem betreffenden Alter das Medikament geben wollen, und würde ich es an meiner Studie teilnehmen lassen? Zum Challengen der Requests for Modification und Draft Opinions eigene (möglichst unabhängige) Experten mitbringen Qualität statt Masse Bei allem Papier: Die Diskussion im Komitee ist maßgeblich
14 Tipps für Studiensynopsen Absoluter Fokus auf Key Binding Elements Standardstudiensynopsen radikal kürzen Adoleszente möglichst schon im Rahmen des Erwachsenenprogramms abdecken (klassischer Fall von Extrapolation) Innovative (adaptive, sequentielle/konditionale, nicht-balancierte) und vor allem realisierbare Designs Idealfall: Ohne Modifikationen bis zum Compliance-Check (alle Zwischenschritte sind zeit- und kostenaufwändig)
15
16 Allgemeine Tips Medicines for children Website der EMA mit sehr vielen Erläuterungen, Anweisungen und Tipps zu fast jedem denkbaren Aspekt der Prozedur Decisions zu ähnlichen Produkten und Conditions studieren Monthly Reports werden immer ausführlicher Regelmäßige Updates und Trainings unter Beteiligung von EMA und PDCO Repräsentanten (TOPRA, EFGCP, DIA) Caution: Jede Produkt/Condition-Kombination ist letztlich einmalig und wird individuell beurteilt
17
18
Die Sicht der EMEA. für Zulassungs-, Therapie- und. Berlin-Brandenburgische Akademie der
 Lebensqualität und Patientennutzen Die Sicht der EMEA PMS-Workshop: Lebensqualität als Kriterium für Zulassungs-, Therapie- und Erstattungsentscheidungen. Berlin-Brandenburgische Akademie der Wissenschaften
Lebensqualität und Patientennutzen Die Sicht der EMEA PMS-Workshop: Lebensqualität als Kriterium für Zulassungs-, Therapie- und Erstattungsentscheidungen. Berlin-Brandenburgische Akademie der Wissenschaften
FRAGEBOGEN FÜR KINDER UND JUGENDLICHE
 Meinung in Bezug auf die Anwendung von Medikamenten Warum fragen wir? Der Pädiatrische Ausschuss (Paediatric Committee (PDCO)) arbeitet zusammen mit der Europäischen Arzneimittelagentur. Dieser Ausschuss
Meinung in Bezug auf die Anwendung von Medikamenten Warum fragen wir? Der Pädiatrische Ausschuss (Paediatric Committee (PDCO)) arbeitet zusammen mit der Europäischen Arzneimittelagentur. Dieser Ausschuss
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Aussage: Das Seminar ist hilfreich für meine berufliche Entwicklung
 Nachhaltigkeitsüberprüfung der Breuel & Partner Gruppendynamikseminare In der Zeit von Januar bis Februar 2009 führten wir im Rahmen einer wissenschaftlichen Arbeit eine Evaluation unserer Gruppendynamikseminare
Nachhaltigkeitsüberprüfung der Breuel & Partner Gruppendynamikseminare In der Zeit von Januar bis Februar 2009 führten wir im Rahmen einer wissenschaftlichen Arbeit eine Evaluation unserer Gruppendynamikseminare
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
Hautkrebsscreening. 49 Prozent meinen, Hautkrebs sei kein Thema, das sie besorgt. Thema Hautkrebs. Ist Hautkrebs für Sie ein Thema, das Sie besorgt?
 Hautkrebsscreening Datenbasis: 1.004 gesetzlich Krankenversicherte ab 1 Jahren Erhebungszeitraum:. bis 4. April 01 statistische Fehlertoleranz: +/- Prozentpunkte Auftraggeber: DDG Hautkrebs ist ein Thema,
Hautkrebsscreening Datenbasis: 1.004 gesetzlich Krankenversicherte ab 1 Jahren Erhebungszeitraum:. bis 4. April 01 statistische Fehlertoleranz: +/- Prozentpunkte Auftraggeber: DDG Hautkrebs ist ein Thema,
Statuten in leichter Sprache
 Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Begrüßung mit Schwung und Begeisterung. Die Teilnehmer müssen spüren, dass die Aufgabe Spaß macht.
 Begrüßung mit Schwung und Begeisterung. Die Teilnehmer müssen spüren, dass die Aufgabe Spaß macht. Wenn Sie die Teilnehmer kennen, ein paar persönliche Worte... oder Alternativ eine Frage zum aktuellen
Begrüßung mit Schwung und Begeisterung. Die Teilnehmer müssen spüren, dass die Aufgabe Spaß macht. Wenn Sie die Teilnehmer kennen, ein paar persönliche Worte... oder Alternativ eine Frage zum aktuellen
Arbeitshilfe "Tipps für Gespräche mit Vorgesetzten und KollegInnen" Was gilt für mich?
 Arbeitshilfe "Tipps für Gespräche mit Vorgesetzten und KollegInnen" Mit dieser Arbeitshilfe können Sie Gespäche über Veränderungen an Ihrem Arbeitsplatz wirkungsvoll vorbereiten. Tipps Bereiten Sie sich
Arbeitshilfe "Tipps für Gespräche mit Vorgesetzten und KollegInnen" Mit dieser Arbeitshilfe können Sie Gespäche über Veränderungen an Ihrem Arbeitsplatz wirkungsvoll vorbereiten. Tipps Bereiten Sie sich
Erfahrungen mit Hartz IV- Empfängern
 Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Informationen zur Erstellung des Projektantrags in den IT-Berufen und zum AbschlussPrüfungOnlineSystem (CIC-APrOS)
 Informationen zur Erstellung des Projektantrags in den IT-Berufen und zum AbschlussPrüfungOnlineSystem (CIC-APrOS) Allgemeine Hinweise zum Projektantrag Den Prüferinnen und Prüfern der Industrie- und Handelskammer
Informationen zur Erstellung des Projektantrags in den IT-Berufen und zum AbschlussPrüfungOnlineSystem (CIC-APrOS) Allgemeine Hinweise zum Projektantrag Den Prüferinnen und Prüfern der Industrie- und Handelskammer
OPTI. Effizienz und Zufriedenheit von Teams steigern. Entwicklung begleiten
 OPTI Effizienz und Zufriedenheit von Teams steigern Worum es geht Die Anwendung von OPTI gibt den Auftraggebern und Teams ein vertieftes Wissen um die Stärken und Schwächen im fachlichen, organisatorischen
OPTI Effizienz und Zufriedenheit von Teams steigern Worum es geht Die Anwendung von OPTI gibt den Auftraggebern und Teams ein vertieftes Wissen um die Stärken und Schwächen im fachlichen, organisatorischen
c:\temp\temporary internet files\olk42\pct änderungen.doc
 ÄNDERUNGEN DES VERTRAGS ÜBER DIE INTERNATIONALE ZUSAMMENARBEIT AUF DEM GEBIET DES PATENTWESENS (PCT) UND DER AUSFÜHRUNGSORDNUNG ZUM VERTRAG ÜBER DIE INTERNATIONALE ZUSAMMENARBEIT AUF DEM GEBIET DES PATENTWESENS
ÄNDERUNGEN DES VERTRAGS ÜBER DIE INTERNATIONALE ZUSAMMENARBEIT AUF DEM GEBIET DES PATENTWESENS (PCT) UND DER AUSFÜHRUNGSORDNUNG ZUM VERTRAG ÜBER DIE INTERNATIONALE ZUSAMMENARBEIT AUF DEM GEBIET DES PATENTWESENS
[Customer Service by KCS.net] KEEPING CUSTOMERS SUCCESSFUL
![[Customer Service by KCS.net] KEEPING CUSTOMERS SUCCESSFUL [Customer Service by KCS.net] KEEPING CUSTOMERS SUCCESSFUL](/thumbs/39/18744977.jpg) [Customer Service by KCS.net] KEEPING CUSTOMERS SUCCESSFUL Was bedeutet Customer Service by KCS.net? Mit der Einführung von Microsoft Dynamics AX ist der erste wichtige Schritt für viele Unternehmen abgeschlossen.
[Customer Service by KCS.net] KEEPING CUSTOMERS SUCCESSFUL Was bedeutet Customer Service by KCS.net? Mit der Einführung von Microsoft Dynamics AX ist der erste wichtige Schritt für viele Unternehmen abgeschlossen.
Glaube an die Existenz von Regeln für Vergleiche und Kenntnis der Regeln
 Glaube an die Existenz von Regeln für Vergleiche und Kenntnis der Regeln Regeln ja Regeln nein Kenntnis Regeln ja Kenntnis Regeln nein 0 % 10 % 20 % 30 % 40 % 50 % 60 % 70 % 80 % 90 % Glauben Sie, dass
Glaube an die Existenz von Regeln für Vergleiche und Kenntnis der Regeln Regeln ja Regeln nein Kenntnis Regeln ja Kenntnis Regeln nein 0 % 10 % 20 % 30 % 40 % 50 % 60 % 70 % 80 % 90 % Glauben Sie, dass
I.O. BUSINESS. Checkliste Effektive Vorbereitung aktiver Telefonate
 I.O. BUSINESS Checkliste Effektive Vorbereitung aktiver Telefonate Gemeinsam Handeln I.O. BUSINESS Checkliste Effektive Vorbereitung aktiver Telefonate Telefonieren ermöglicht die direkte Kommunikation
I.O. BUSINESS Checkliste Effektive Vorbereitung aktiver Telefonate Gemeinsam Handeln I.O. BUSINESS Checkliste Effektive Vorbereitung aktiver Telefonate Telefonieren ermöglicht die direkte Kommunikation
Die neue Rolle von Kindern im Arzneimittelrecht und ihre praktischen Konsequenzen. Was hat mein Kind von der EU? Prof. Dr. med. Joachim Boos, Münster
 Die neue Rolle von Kindern im Arzneimittelrecht und ihre praktischen Konsequenzen Was hat mein Kind von der EU? Prof. Dr. med. Joachim Boos, Münster Bayer Werbung um 1900: Heroin, das ideale Sedativum
Die neue Rolle von Kindern im Arzneimittelrecht und ihre praktischen Konsequenzen Was hat mein Kind von der EU? Prof. Dr. med. Joachim Boos, Münster Bayer Werbung um 1900: Heroin, das ideale Sedativum
Zypern. Mehrwertsteuererstattungen nach der 13. MwSt-Richtlinie (86/560/EWG)
 Zypern Mehrwertsteuererstattungen nach der 13. MwSt-Richtlinie (86/560/EWG) I. GEGENSEITIGKEITSABKOMMEN Artikel 2 Absatz 2 1. Hat Ihr Land Gegenseitigkeitsabkommen abgeschlossen? Ja, Zypern hat zwei Gegenseitigkeitsabkommen
Zypern Mehrwertsteuererstattungen nach der 13. MwSt-Richtlinie (86/560/EWG) I. GEGENSEITIGKEITSABKOMMEN Artikel 2 Absatz 2 1. Hat Ihr Land Gegenseitigkeitsabkommen abgeschlossen? Ja, Zypern hat zwei Gegenseitigkeitsabkommen
Hans-Günter Rolff. Zielvereinbarungen
 Zielvereinbarungen Funktionen/Sinn Personalführung Systemführung Mehr Verbindlichkeit schaffen Schulentwicklung auf UE fokussieren Feedbackkultur anbahnen Definition von Zielvereinbarungen Zielvereinbarungen
Zielvereinbarungen Funktionen/Sinn Personalführung Systemführung Mehr Verbindlichkeit schaffen Schulentwicklung auf UE fokussieren Feedbackkultur anbahnen Definition von Zielvereinbarungen Zielvereinbarungen
Geld Verdienen im Internet leicht gemacht
 Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
Nachhaltiges Gesundheitssystem
 Nachhaltiges Gesundheitssystem publifocus «Nutzen und Kosten medizinischer Behandlungen» Dr. Sergio Bellucci, TA-SWISS Ziele des publifocus Die Meinung der Bürgerinnen und Bürger zu folgenden Punkten einholen:
Nachhaltiges Gesundheitssystem publifocus «Nutzen und Kosten medizinischer Behandlungen» Dr. Sergio Bellucci, TA-SWISS Ziele des publifocus Die Meinung der Bürgerinnen und Bürger zu folgenden Punkten einholen:
Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken?
 UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
Fragebogen zur Erhebung der Zufriedenheit und Kooperation der Ausbildungsbetriebe mit unserer Schule
 Fragebogen zur Erhebung der Zufriedenheit und Kooperation der Ausbildungsbetriebe mit unserer Schule Sehr geehrte Ausbilderinnen und Ausbilder, die bbs1celle betreiben nun bereits seit einigen Jahren ein
Fragebogen zur Erhebung der Zufriedenheit und Kooperation der Ausbildungsbetriebe mit unserer Schule Sehr geehrte Ausbilderinnen und Ausbilder, die bbs1celle betreiben nun bereits seit einigen Jahren ein
TYPO3 Tipps und Tricks
 TYPO3 Tipps und Tricks Seiten als Shortcut. Hiermit ist gemeint, dass eine Oberseite direkt auf eine tiefere Unterseite verlinkt. Dies kann bei Themen ohne gesonderte Übersichtsseite hilfreich sein. Zum
TYPO3 Tipps und Tricks Seiten als Shortcut. Hiermit ist gemeint, dass eine Oberseite direkt auf eine tiefere Unterseite verlinkt. Dies kann bei Themen ohne gesonderte Übersichtsseite hilfreich sein. Zum
Hinweise zum Fragebogen. Wir möchten Sie darum bitten, die jeweils zutreffenden Antworten in den dafür vorgesehenen
 Hinweise zum Fragebogen Wir möchten Sie darum bitten, die jeweils zutreffenden Antworten in den dafür vorgesehenen kleinen Kästchen anzukreuzen. Bei den Fragen 4 bis 8 füllen Sie bitte auf der 5er Skala
Hinweise zum Fragebogen Wir möchten Sie darum bitten, die jeweils zutreffenden Antworten in den dafür vorgesehenen kleinen Kästchen anzukreuzen. Bei den Fragen 4 bis 8 füllen Sie bitte auf der 5er Skala
Das Werk einschließlich aller seiner Texte ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechts
 Die Anzahl der Longiergurt-Ringe Marie Symbill Das Werk einschließlich aller seiner Texte ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechts ist ohne Zustimmung
Die Anzahl der Longiergurt-Ringe Marie Symbill Das Werk einschließlich aller seiner Texte ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechts ist ohne Zustimmung
mehrmals mehrmals mehrmals alle seltener nie mindestens **) in der im Monat im Jahr 1 bis 2 alle 1 bis 2 Woche Jahre Jahre % % % % % % %
 Nicht überraschend, aber auch nicht gravierend, sind die altersspezifischen Unterschiede hinsichtlich der Häufigkeit des Apothekenbesuchs: 24 Prozent suchen mindestens mehrmals im Monat eine Apotheke auf,
Nicht überraschend, aber auch nicht gravierend, sind die altersspezifischen Unterschiede hinsichtlich der Häufigkeit des Apothekenbesuchs: 24 Prozent suchen mindestens mehrmals im Monat eine Apotheke auf,
Versetzungsregeln in Bayern
 Grundschule Schüler der Jahrgangsstufen 1 und 2 rücken ohne besondere Entscheidung vor. Das Vorrücken in den Jahrgangsstufen 3 und 4 soll nur dann versagt werden, wenn der Schüler in seiner Entwicklung
Grundschule Schüler der Jahrgangsstufen 1 und 2 rücken ohne besondere Entscheidung vor. Das Vorrücken in den Jahrgangsstufen 3 und 4 soll nur dann versagt werden, wenn der Schüler in seiner Entwicklung
Betreuung durch HIGHEST über den gesamten Prozessablauf. 5. Überführung des Ideenpapiers in BP-Entwurf. 3. Erstellung des Ideenpapiers. 1.
 start-up Ziele des HIGHEST Start-up Gründerlabels Die HIGHEST-Gründungsberatung der Technischen Universität Darmstadt und externe Experten unter Führung der IHK Darmstadt haben mit dem Label HIGHEST Start-up
start-up Ziele des HIGHEST Start-up Gründerlabels Die HIGHEST-Gründungsberatung der Technischen Universität Darmstadt und externe Experten unter Führung der IHK Darmstadt haben mit dem Label HIGHEST Start-up
Angaben zur Person für die erstmalige Schulaufnahme
 Angaben zur Person für die erstmalige Schulaufnahme S c h u l j a h r 2 0 1 6 / 1 7 Die Anmeldung meines / unseres Kindes erfolgt an der Name der Schule 1. Unser / Mein Kind Familienname:... Vorname(n):...
Angaben zur Person für die erstmalige Schulaufnahme S c h u l j a h r 2 0 1 6 / 1 7 Die Anmeldung meines / unseres Kindes erfolgt an der Name der Schule 1. Unser / Mein Kind Familienname:... Vorname(n):...
Die perfekte Bewerbung richtig schreiben online & klassisch
 make-it-better (Hrsg.) Die perfekte Bewerbung richtig schreiben online & klassisch Ein gratis Bewerbungsbuch von make-it-better die Agentur für Bewerbung & Coaching Liebe Leserin, lieber Leser, ich erleben
make-it-better (Hrsg.) Die perfekte Bewerbung richtig schreiben online & klassisch Ein gratis Bewerbungsbuch von make-it-better die Agentur für Bewerbung & Coaching Liebe Leserin, lieber Leser, ich erleben
Würfelt man dabei je genau 10 - mal eine 1, 2, 3, 4, 5 und 6, so beträgt die Anzahl. der verschiedenen Reihenfolgen, in denen man dies tun kann, 60!.
 040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
Einstellungen der Deutschen gegenüber dem Beruf der Putzfrau
 Auftraggeber: Helpling GmbH Frankfurt a.m.: 5. November 05 3367/n5447 Go/Bü Untersuchungsdesign Zielgruppe: Stichprobengröße: Die in Privathaushalten in Deutschland lebenden deutschsprachigen Personen
Auftraggeber: Helpling GmbH Frankfurt a.m.: 5. November 05 3367/n5447 Go/Bü Untersuchungsdesign Zielgruppe: Stichprobengröße: Die in Privathaushalten in Deutschland lebenden deutschsprachigen Personen
DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG
 DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG von Urs Schaffer Copyright by Urs Schaffer Schaffer Consulting GmbH Basel www.schaffer-consulting.ch Info@schaffer-consulting.ch Haben Sie gewusst dass... >
DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG von Urs Schaffer Copyright by Urs Schaffer Schaffer Consulting GmbH Basel www.schaffer-consulting.ch Info@schaffer-consulting.ch Haben Sie gewusst dass... >
Der DIA Deutschland-Trend-Vorsorge
 Der DIA Deutschland-Trend-Vorsorge Einstellungen zur Altersvorsorge Köln, 19. Dezember 2012 20. Befragungswelle 4. Quartal 2012 Klaus Morgenstern Deutsches Institut für Altersvorsorge, Berlin Bettina Schneiderhan
Der DIA Deutschland-Trend-Vorsorge Einstellungen zur Altersvorsorge Köln, 19. Dezember 2012 20. Befragungswelle 4. Quartal 2012 Klaus Morgenstern Deutsches Institut für Altersvorsorge, Berlin Bettina Schneiderhan
Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele
 Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele 4. März 2015 q5337/31319 Le forsa Politik- und Sozialforschung GmbH Büro Berlin Schreiberhauer
Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele 4. März 2015 q5337/31319 Le forsa Politik- und Sozialforschung GmbH Büro Berlin Schreiberhauer
Bewerbungsformular für das Förderprogramm Teamwork gefragt! Beteiligung von Personen aus anderen Kulturen in der Gemeinde
 Bewerbungsformular für das Förderprogramm Teamwork gefragt! Beteiligung von Personen aus anderen Kulturen in der Gemeinde Die Allianz für Beteiligung setzt sich dafür ein, dass alle Personengruppen der
Bewerbungsformular für das Förderprogramm Teamwork gefragt! Beteiligung von Personen aus anderen Kulturen in der Gemeinde Die Allianz für Beteiligung setzt sich dafür ein, dass alle Personengruppen der
Anmelden und Vorträge einreichen auf der JBFOne-Website Inhalt
 Inhalt 1. Schritt: Anmelden 2 Anmelden mit Daten von 2014... 3 Neu anmelden... 3 Maske 1: Persönliche Angaben... 3 Maske 2: Angaben über Ihr Unternehmen... 3 Maske 3: Teilnahme und Rechnungsangaben...
Inhalt 1. Schritt: Anmelden 2 Anmelden mit Daten von 2014... 3 Neu anmelden... 3 Maske 1: Persönliche Angaben... 3 Maske 2: Angaben über Ihr Unternehmen... 3 Maske 3: Teilnahme und Rechnungsangaben...
Erstellung von Präsentationspostern
 Erstellung von Präsentationspostern Grundlagen der Gestaltung Für die Gestaltung gibt es einige grundsätzliche Dinge. Ein Präsentationsposter ist etwas ganz Anderes als ein gedrucktes Erzeugnis das ich
Erstellung von Präsentationspostern Grundlagen der Gestaltung Für die Gestaltung gibt es einige grundsätzliche Dinge. Ein Präsentationsposter ist etwas ganz Anderes als ein gedrucktes Erzeugnis das ich
4 Ideen zur Verbesserung des E-Mail-Marketings!
 4 Ideen zur Verbesserung des E-Mail-Marketings! Quelle: www.rohinie.eu E-Mail-Kampagnen können zu den wirksamsten Werkzeugen im Marketing-Arsenal gehören. Allerdings können sie genauso gut die Quelle großer
4 Ideen zur Verbesserung des E-Mail-Marketings! Quelle: www.rohinie.eu E-Mail-Kampagnen können zu den wirksamsten Werkzeugen im Marketing-Arsenal gehören. Allerdings können sie genauso gut die Quelle großer
Das 1x1 der Lohnverhandlung
 Das 1x1 der Lohnverhandlung Wie viel würden Sie gerne verdienen? 4 500.-- 6 000.-- mindestens 120 000.-- 80 000.-- ca. 5 000.-- mehr als 30.-- / h 50 000.-- Euro 90 000.-- 8 000.-- 25. bis 27.-- / h Themen
Das 1x1 der Lohnverhandlung Wie viel würden Sie gerne verdienen? 4 500.-- 6 000.-- mindestens 120 000.-- 80 000.-- ca. 5 000.-- mehr als 30.-- / h 50 000.-- Euro 90 000.-- 8 000.-- 25. bis 27.-- / h Themen
Wichtige Info szum Lehrabschluss!
 Wichtige Info szum Lehrabschluss! Sie stehen kurz vor Ihrer Lehrabschlussprüfung zum/zur Zahntechniker/in. Hierzu haben Sie bereits ausführliche Informationen zum Ablauf der Prüfung erhalten. Darüber hinaus
Wichtige Info szum Lehrabschluss! Sie stehen kurz vor Ihrer Lehrabschlussprüfung zum/zur Zahntechniker/in. Hierzu haben Sie bereits ausführliche Informationen zum Ablauf der Prüfung erhalten. Darüber hinaus
Partnerschaftsentwicklung für KMU
 Belziger Industriepartner Partnerschaftsentwicklung für KMU G. Delaunay, Belziger Industriepartner 1 Wer braucht einen Geschäftspartner? - Innovation: Sie wollen etwas Neues entwickeln, aber Sie schaffen
Belziger Industriepartner Partnerschaftsentwicklung für KMU G. Delaunay, Belziger Industriepartner 1 Wer braucht einen Geschäftspartner? - Innovation: Sie wollen etwas Neues entwickeln, aber Sie schaffen
Reglement. über die Mitgliedschaft für PR-Agenturen (Aufnahmereglement)
 Reglement über die Mitgliedschaft für PR-Agenturen (Aufnahmereglement) I. Allgemeines 1. Voraussetzungen Art. 1 Grundsätze Das Mitglied von LEADING SWISS AGENCIES muss: a) in der Schweiz domiziliert sein,
Reglement über die Mitgliedschaft für PR-Agenturen (Aufnahmereglement) I. Allgemeines 1. Voraussetzungen Art. 1 Grundsätze Das Mitglied von LEADING SWISS AGENCIES muss: a) in der Schweiz domiziliert sein,
Die wichtigsten ESET Smart Security Einstellungen bei Selbstinstallation durch den Kunden
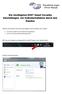 Die wichtigsten ESET Smart Security Einstellungen bei Selbstinstallation durch den Kunden Während des Ausführens des ESET-Setups folgende Punkte auswählen bzw. anhaken: Ich möchte an ESET Live Grid teilnehmen
Die wichtigsten ESET Smart Security Einstellungen bei Selbstinstallation durch den Kunden Während des Ausführens des ESET-Setups folgende Punkte auswählen bzw. anhaken: Ich möchte an ESET Live Grid teilnehmen
Serienbrieferstellung in Word mit Kunden-Datenimport aus Excel
 Sehr vielen Mitarbeitern fällt es schwer, Serienbriefe an Kunden zu verschicken, wenn sie die Serienbrieffunktion von Word nicht beherrschen. Wenn die Kunden mit Excel verwaltet werden, genügen nur ein
Sehr vielen Mitarbeitern fällt es schwer, Serienbriefe an Kunden zu verschicken, wenn sie die Serienbrieffunktion von Word nicht beherrschen. Wenn die Kunden mit Excel verwaltet werden, genügen nur ein
expopharm 30. September 2015
 expopharm 30. September 2015 Dr. Martin Zentgraf Vorsitzender des Bundesverbandes der Pharmazeutischen Industrie e.v. - Es gilt das gesprochene Wort - Seite 2 Sehr geehrter Herr Schmidt, sehr geehrter
expopharm 30. September 2015 Dr. Martin Zentgraf Vorsitzender des Bundesverbandes der Pharmazeutischen Industrie e.v. - Es gilt das gesprochene Wort - Seite 2 Sehr geehrter Herr Schmidt, sehr geehrter
ANLEITUNG - WIE UNTERSTÜTZE ICH AUF STARTNEXT?
 ANLEITUNG - WIE UNTERSTÜTZE ICH AUF STARTNEXT? Wenn Sie das Projekt DIE ANFÄNGERIN unterstützen wollen, können Sie das mit oder ohne Registrierung auf www.startnext.com tun. Sie können also als Gast unterstützen
ANLEITUNG - WIE UNTERSTÜTZE ICH AUF STARTNEXT? Wenn Sie das Projekt DIE ANFÄNGERIN unterstützen wollen, können Sie das mit oder ohne Registrierung auf www.startnext.com tun. Sie können also als Gast unterstützen
Hinweise zur Anmeldung und Bedienung des. Support Forums
 Hinweise zur Anmeldung und Bedienung des Support Forums http://www.macrosystem.de/forum Administrator: Michael Huebmer EMail bei Forum-Login Problemen: forum@macrosystem.at Anleitung zur Bedienung des
Hinweise zur Anmeldung und Bedienung des Support Forums http://www.macrosystem.de/forum Administrator: Michael Huebmer EMail bei Forum-Login Problemen: forum@macrosystem.at Anleitung zur Bedienung des
Zahnersatz. Zahnersatz fast zum Nulltarif. Eine teure Leistung wird für Sie günstiger.
 Zahnersatz Zahnersatz fast zum Nulltarif Eine teure Leistung wird für Sie günstiger. Sehr geehrte Versicherte, sehr geehrter Versicherter, die gesetzlichen Krankenkassen leisten zum Zahnersatz als Festzuschüsse
Zahnersatz Zahnersatz fast zum Nulltarif Eine teure Leistung wird für Sie günstiger. Sehr geehrte Versicherte, sehr geehrter Versicherter, die gesetzlichen Krankenkassen leisten zum Zahnersatz als Festzuschüsse
Kontaktlinsen über die neue Website bestellen eine Kurzanleitung
 Kontaktlinsen über die neue Website bestellen eine Kurzanleitung Wir möchten Ihnen die Nutzung unseres Online-Angebots Website so einfach und angenehm wie möglich gestalten und haben deshalb ein zentrales
Kontaktlinsen über die neue Website bestellen eine Kurzanleitung Wir möchten Ihnen die Nutzung unseres Online-Angebots Website so einfach und angenehm wie möglich gestalten und haben deshalb ein zentrales
Bericht für Menschen mit Hörbehinderung und gehörlose Menschen
 Bericht für Menschen mit Hörbehinderung und gehörlose Menschen Barrierefreiheit geprüft Bericht St. Michaelis 1/5 Abbildung 1: Außenansicht der Kirche St. Michaelis Anschrift St. Michaelis Turm GmbH Englische
Bericht für Menschen mit Hörbehinderung und gehörlose Menschen Barrierefreiheit geprüft Bericht St. Michaelis 1/5 Abbildung 1: Außenansicht der Kirche St. Michaelis Anschrift St. Michaelis Turm GmbH Englische
UPDATEANLEITUNG UP-TO-DATE-GARANTIE DEU. Sehr geehrte Kunden, 1. Klicken Sie auf Benutzerprofil erstellen.
 Sehr geehrte Kunden, 1. Klicken Sie auf Benutzerprofil erstellen. NavGear bietet Ihnen die Möglichkeit, das Kartenmaterial innerhalb der ersten 30 Tage der Verwendung kostenlos zu aktualisieren. Bitte
Sehr geehrte Kunden, 1. Klicken Sie auf Benutzerprofil erstellen. NavGear bietet Ihnen die Möglichkeit, das Kartenmaterial innerhalb der ersten 30 Tage der Verwendung kostenlos zu aktualisieren. Bitte
Ich beantrage die Ausstellung einer vorläufigen Sachkundebescheinigung für
 An die Kreishandwerkerschaft Münster Innung für Kälte- und Klimatechnik Münster Ossenkampstiege 111 48163 Münster Antrag auf Ausstellung einer vorläufigen Sachkundebescheinigung gem. 9 Abs. 2 Chemikalien-Klimaschutzverordnung
An die Kreishandwerkerschaft Münster Innung für Kälte- und Klimatechnik Münster Ossenkampstiege 111 48163 Münster Antrag auf Ausstellung einer vorläufigen Sachkundebescheinigung gem. 9 Abs. 2 Chemikalien-Klimaschutzverordnung
Fragen und Antworten zum Studium Produk4on und Logis4k in Hannover nach der P02012
 Fragen und Antworten zum Studium Produk4on und Logis4k in Hannover nach der P02012 Gliederung 1 Bachelor of Science in Produk4on und Logis4k 2 Master of Science in Produk4on und Logis4k 3 Allgemeines 4
Fragen und Antworten zum Studium Produk4on und Logis4k in Hannover nach der P02012 Gliederung 1 Bachelor of Science in Produk4on und Logis4k 2 Master of Science in Produk4on und Logis4k 3 Allgemeines 4
Internetpublikation des Referats K2 im Kompetenzzentrum für Personalverwaltung und Systemsteuerung (K-PVS)
 Internetpublikation des Referats K2 im Kompetenzzentrum für Personalverwaltung und Systemsteuerung (K-PVS) FACHBEREICH THEMATIK Bezüge zentral nur BADV-intern: KIDICAP-Umstellung auf eine neue Citrix-Farm
Internetpublikation des Referats K2 im Kompetenzzentrum für Personalverwaltung und Systemsteuerung (K-PVS) FACHBEREICH THEMATIK Bezüge zentral nur BADV-intern: KIDICAP-Umstellung auf eine neue Citrix-Farm
1. Was ihr in dieser Anleitung
 Leseprobe 1. Was ihr in dieser Anleitung erfahren könnt 2 Liebe Musiker, in diesem PDF erhaltet ihr eine Anleitung, wie ihr eure Musik online kostenlos per Werbevideo bewerben könnt, ohne dabei Geld für
Leseprobe 1. Was ihr in dieser Anleitung erfahren könnt 2 Liebe Musiker, in diesem PDF erhaltet ihr eine Anleitung, wie ihr eure Musik online kostenlos per Werbevideo bewerben könnt, ohne dabei Geld für
erstmalig erwähnt 1048 Bedarfsabfrage 09/2015 GEMEINDE BIBURG Bedarfserhebung
 GEMEINDE BIBURG Bedarfserhebung für eine kindgerechte Bildung, Erziehung und Betreuung nach Art. 7 BayKiBiG in der Gemeinde Biburg Seite 1 von 11 Elternbefragung zur Bedarfserhebung KITA (Kinderkrippe
GEMEINDE BIBURG Bedarfserhebung für eine kindgerechte Bildung, Erziehung und Betreuung nach Art. 7 BayKiBiG in der Gemeinde Biburg Seite 1 von 11 Elternbefragung zur Bedarfserhebung KITA (Kinderkrippe
40x wissensch. Lehrerin / wissensch. Lehrer. 2. Mit dem Thema digitales Whiteboard als Unterrichtsmittel habe ich mich bereits beschäftigt.
 Evaluationsergebnisse Nutzung der digitalen Whiteboards 1. Ich unterrichte als 40x wissensch. Lehrerin / wissensch. Lehrer. Mit dem Thema digitales Whiteboard als Unterrichtsmittel habe ich mich bereits
Evaluationsergebnisse Nutzung der digitalen Whiteboards 1. Ich unterrichte als 40x wissensch. Lehrerin / wissensch. Lehrer. Mit dem Thema digitales Whiteboard als Unterrichtsmittel habe ich mich bereits
Sehr geehrte/r Teilnehmer/in,
 Entwicklung einer neuen Lernkultur in Deutschland und Russland: Eine kulturvergleichende Studie* (Berichtsentwurf in Tabellen und Diagrammen) Dr. Alexander Porshnev. Staatliche Universität Wirtschaftshochschule
Entwicklung einer neuen Lernkultur in Deutschland und Russland: Eine kulturvergleichende Studie* (Berichtsentwurf in Tabellen und Diagrammen) Dr. Alexander Porshnev. Staatliche Universität Wirtschaftshochschule
Anleitung. Empowerment-Fragebogen VrijBaan / AEIOU
 Anleitung Diese Befragung dient vor allem dazu, Sie bei Ihrer Persönlichkeitsentwicklung zu unterstützen. Anhand der Ergebnisse sollen Sie lernen, Ihre eigene Situation besser einzuschätzen und eventuell
Anleitung Diese Befragung dient vor allem dazu, Sie bei Ihrer Persönlichkeitsentwicklung zu unterstützen. Anhand der Ergebnisse sollen Sie lernen, Ihre eigene Situation besser einzuschätzen und eventuell
Deutschland-Check Nr. 35
 Beschäftigung älterer Arbeitnehmer Ergebnisse des IW-Unternehmervotums Bericht der IW Consult GmbH Köln, 13. Dezember 2012 Institut der deutschen Wirtschaft Köln Consult GmbH Konrad-Adenauer-Ufer 21 50668
Beschäftigung älterer Arbeitnehmer Ergebnisse des IW-Unternehmervotums Bericht der IW Consult GmbH Köln, 13. Dezember 2012 Institut der deutschen Wirtschaft Köln Consult GmbH Konrad-Adenauer-Ufer 21 50668
ONLINE-AKADEMIE. "Diplomierter NLP Anwender für Schule und Unterricht" Ziele
 ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
DER MITTLERE SCHULABSCHLUSS (MSA) INFORMATIONSVERANSTALTUNG FÜR DIE ELTERN AM 17. SEPTEMBER 2015 HERZLICH WILLKOMMEN!
 DER MITTLERE SCHULABSCHLUSS (MSA) INFORMATIONSVERANSTALTUNG FÜR DIE ELTERN AM 17. SEPTEMBER 2015 HERZLICH WILLKOMMEN! Alexandra Gogolin Mittelstufen-Koordinatorin Tagesordnung 2 1. Besondere Stellung der
DER MITTLERE SCHULABSCHLUSS (MSA) INFORMATIONSVERANSTALTUNG FÜR DIE ELTERN AM 17. SEPTEMBER 2015 HERZLICH WILLKOMMEN! Alexandra Gogolin Mittelstufen-Koordinatorin Tagesordnung 2 1. Besondere Stellung der
Beratungskompetenz Existenzgründung
 Weiterbildung Beratungskompetenz Existenzgründung 11.-12.05.2015 Hoffmanns Höfe, Frankfurt, Heinrich-Hoffmann-Str. 3 Entscheidung zur Selbständigkeit Für MigrantInnen, die in ihre Heimatländer zurückkehren
Weiterbildung Beratungskompetenz Existenzgründung 11.-12.05.2015 Hoffmanns Höfe, Frankfurt, Heinrich-Hoffmann-Str. 3 Entscheidung zur Selbständigkeit Für MigrantInnen, die in ihre Heimatländer zurückkehren
1 Einleitung. Lernziele. automatische Antworten bei Abwesenheit senden. Einstellungen für automatische Antworten Lerndauer. 4 Minuten.
 1 Einleitung Lernziele automatische Antworten bei Abwesenheit senden Einstellungen für automatische Antworten Lerndauer 4 Minuten Seite 1 von 18 2 Antworten bei Abwesenheit senden» Outlook kann während
1 Einleitung Lernziele automatische Antworten bei Abwesenheit senden Einstellungen für automatische Antworten Lerndauer 4 Minuten Seite 1 von 18 2 Antworten bei Abwesenheit senden» Outlook kann während
Abwesenheitsnotiz im Exchange Server 2010
 Abwesenheitsnotiz im Exchange Server 2010 1.) Richten Sie die Abwesenheitsnotiz in Outlook 2010 ein und definieren Sie, an welche Absender diese gesendet werden soll. Klicken Sie dazu auf Datei -> Informationen
Abwesenheitsnotiz im Exchange Server 2010 1.) Richten Sie die Abwesenheitsnotiz in Outlook 2010 ein und definieren Sie, an welche Absender diese gesendet werden soll. Klicken Sie dazu auf Datei -> Informationen
Banken und FinTechs Kooperation und Wettbewerb. Pressegespräch 2. November 2015 Frankfurt am Main
 Banken und FinTechs Kooperation und Wettbewerb Pressegespräch 2. November 2015 Frankfurt am Main Übersicht (1) Banken und FinTechs: Ausgangslage (2) Entscheidungskriterien für den Kauf von Finanzdienstleistungen
Banken und FinTechs Kooperation und Wettbewerb Pressegespräch 2. November 2015 Frankfurt am Main Übersicht (1) Banken und FinTechs: Ausgangslage (2) Entscheidungskriterien für den Kauf von Finanzdienstleistungen
Frühstück. Frühstück an Werktagen? Es frühstücken an einem normalen Werktag üblicherweise. jeden Tag ab und zu gar nicht *) % % %
 Frühstück Datenbasis: 1.001 Befragte Erhebungszeitraum: 8. bis 13. August 2014 statistische Fehlertoleranz: +/- 3 Prozentpunkte Auftraggeber: DAK - Gesundheit 77 Prozent der Bundesbürger frühstücken werktags
Frühstück Datenbasis: 1.001 Befragte Erhebungszeitraum: 8. bis 13. August 2014 statistische Fehlertoleranz: +/- 3 Prozentpunkte Auftraggeber: DAK - Gesundheit 77 Prozent der Bundesbürger frühstücken werktags
Anhang. 3. Was denken Sie: An wen richtet sich das Lernprogramm für Psycholinguistik? zu nicht nicht zu
 Anhang Bitte füllen Sie den Fragebogen vollständig, ehrlich und genau aus! Es gibt keine falschen Antworten! Ihre Angaben sind anonym und werden absolut vertraulich behandelt. Sie werden nur zu Forschungs-
Anhang Bitte füllen Sie den Fragebogen vollständig, ehrlich und genau aus! Es gibt keine falschen Antworten! Ihre Angaben sind anonym und werden absolut vertraulich behandelt. Sie werden nur zu Forschungs-
Pilotierung von Unterrichtsbeispielen
 Pilotierung von Unterrichtsbeispielen Prof. Dr. Manuela Paechter Karl-Franzens-Universität Graz Kick-Off-Veranstaltung 03. Oktober 2013, Linz Übersicht 1. Ziele der Pilotierung 2. Rückblick bisherige Pilotierungen,
Pilotierung von Unterrichtsbeispielen Prof. Dr. Manuela Paechter Karl-Franzens-Universität Graz Kick-Off-Veranstaltung 03. Oktober 2013, Linz Übersicht 1. Ziele der Pilotierung 2. Rückblick bisherige Pilotierungen,
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Befragung der Mannschaftsführer und des Vorstands zum Matchtiebreak und weiteren Themen
 Befragung der Mannschaftsführer und des Vorstands zum Matchtiebreak und weiteren Themen 2015 Im Folgenden finden Sie die Ergebnisse der Befragung. Auf der Sitzung des Ausschusses für Wettkampfsport Erwachsene
Befragung der Mannschaftsführer und des Vorstands zum Matchtiebreak und weiteren Themen 2015 Im Folgenden finden Sie die Ergebnisse der Befragung. Auf der Sitzung des Ausschusses für Wettkampfsport Erwachsene
Quellen zitieren. Arten. Formatierung
 Quellen zitieren Arten wissenschaftlicher Journal Beitrag Buch (Monographie) Buch Auszug Doktor bzw. Diplomarbeit Zeitungsartikel Online Quelle Jedes Zitat besteht aus einer Fußnote im Text und einem Eintrag
Quellen zitieren Arten wissenschaftlicher Journal Beitrag Buch (Monographie) Buch Auszug Doktor bzw. Diplomarbeit Zeitungsartikel Online Quelle Jedes Zitat besteht aus einer Fußnote im Text und einem Eintrag
Die integrierte Zeiterfassung. Das innovative Softwarekonzept
 Die integrierte Zeiterfassung Das innovative Softwarekonzept projekt - ein komplexes Programm mit Zusatzmodulen, die einzeln oder in ihrer individuellen Zusammenstellung, die gesamte Abwicklung in Ihrem
Die integrierte Zeiterfassung Das innovative Softwarekonzept projekt - ein komplexes Programm mit Zusatzmodulen, die einzeln oder in ihrer individuellen Zusammenstellung, die gesamte Abwicklung in Ihrem
micura Pflegedienste München/Dachau GmbH
 micura Pflegedienste München/Dachau GmbH 2 PFLEGE UND BETREUUNG ZUHAUSE 3 Im Laufe eines Lebens verändern sich die Bedürfnisse. micura Pflegedienste München/ Dachau schließt die Lücke einer eingeschränkten
micura Pflegedienste München/Dachau GmbH 2 PFLEGE UND BETREUUNG ZUHAUSE 3 Im Laufe eines Lebens verändern sich die Bedürfnisse. micura Pflegedienste München/ Dachau schließt die Lücke einer eingeschränkten
Austrian Energy Agency
 Austrian Energy Agency Geschichte der NORM EN 16001 und weitere Entwicklungen Petra Lackner Austrian Energy Agency 13. Oktober 2010 Seite 1 Was ist Energiemanagement? Strukturelle Beschäftigung mit dem
Austrian Energy Agency Geschichte der NORM EN 16001 und weitere Entwicklungen Petra Lackner Austrian Energy Agency 13. Oktober 2010 Seite 1 Was ist Energiemanagement? Strukturelle Beschäftigung mit dem
Wie melde ich meinen Verein bei BOOKANDPLAY an?
 Wie melde ich meinen Verein bei BOOKANDPLAY an? Geben Sie in Ihrem Internet-Browser (bitte benutzen Sie immer Mozilla Firefox) als Adresse www.bookandplay.de ein. Anmerkung: Wir empfehlen Ihnen auch allgemein
Wie melde ich meinen Verein bei BOOKANDPLAY an? Geben Sie in Ihrem Internet-Browser (bitte benutzen Sie immer Mozilla Firefox) als Adresse www.bookandplay.de ein. Anmerkung: Wir empfehlen Ihnen auch allgemein
Einladung zur Bewerbung. Sehr geehrte Damen und Herren, liebe Kolleginnen und Kollegen,
 Einladung zur Bewerbung Sehr geehrte Damen und Herren, liebe Kolleginnen und Kollegen, wir bedanken uns für Ihr Interesse an der Weiterbildung. In der Anlage finden Sie ein ausführliches Expose mit Informationen
Einladung zur Bewerbung Sehr geehrte Damen und Herren, liebe Kolleginnen und Kollegen, wir bedanken uns für Ihr Interesse an der Weiterbildung. In der Anlage finden Sie ein ausführliches Expose mit Informationen
Übersicht der Refinanzierungsmöglichkeiten für die Reisen
 Übersicht der Refinanzierungsmöglichkeiten für die Reisen Auf den nächsten Seiten haben wir für Sie ausführliche Informationen über die Refinanzierungsmöglichkeiten der Reisen bei der Lebenshilfe Dortmund
Übersicht der Refinanzierungsmöglichkeiten für die Reisen Auf den nächsten Seiten haben wir für Sie ausführliche Informationen über die Refinanzierungsmöglichkeiten der Reisen bei der Lebenshilfe Dortmund
Tipps für die praktische Durchführung von Referaten Prof. Dr. Ellen Aschermann
 UNIVERSITÄT ZU KÖLN Erziehungswissenschaftliche Fakultät Institut für Psychologie Tipps für die praktische Durchführung von Referaten Prof. Dr. Ellen Aschermann Ablauf eines Referates Einleitung Gliederung
UNIVERSITÄT ZU KÖLN Erziehungswissenschaftliche Fakultät Institut für Psychologie Tipps für die praktische Durchführung von Referaten Prof. Dr. Ellen Aschermann Ablauf eines Referates Einleitung Gliederung
Zwischenablage (Bilder, Texte,...)
 Zwischenablage was ist das? Informationen über. die Bedeutung der Windows-Zwischenablage Kopieren und Einfügen mit der Zwischenablage Vermeiden von Fehlern beim Arbeiten mit der Zwischenablage Bei diesen
Zwischenablage was ist das? Informationen über. die Bedeutung der Windows-Zwischenablage Kopieren und Einfügen mit der Zwischenablage Vermeiden von Fehlern beim Arbeiten mit der Zwischenablage Bei diesen
SICHERHEIT DER KINDER im Fahrzeug
 SICHERHEIT DER KINDER im Fahrzeug Gurttragvorschriften Im Interesse der Verkehrssicherheit hat der Bundesrat mehrere Änderungen beschlossen. So sollen Kinder künftig in Personenwagen und Schulbussen noch
SICHERHEIT DER KINDER im Fahrzeug Gurttragvorschriften Im Interesse der Verkehrssicherheit hat der Bundesrat mehrere Änderungen beschlossen. So sollen Kinder künftig in Personenwagen und Schulbussen noch
Herzlich Willkommen zur Präsentation von. Erfahren Sie alles über Ihre Chancen als GDA. (c) by HaWo Holding Inc., 2015, All rights reserved
 Herzlich Willkommen zur Präsentation von Erfahren Sie alles über Ihre Chancen als GDA. Hon. Prof. Dr. Michael Sander, MLM-Experte & Yossef Bar, The Brain von GDI The Brain in Tel Aviv Die klaren Fakten
Herzlich Willkommen zur Präsentation von Erfahren Sie alles über Ihre Chancen als GDA. Hon. Prof. Dr. Michael Sander, MLM-Experte & Yossef Bar, The Brain von GDI The Brain in Tel Aviv Die klaren Fakten
Selbstcheck: Praktiziere ich einen gesundheitsförderlichen Führungsstil?
 Selbstcheck: Praktiziere ich einen gesundheitsförderlichen Führungsstil? 3 = stimme voll zu 2 = stimmt ziemlich 1 = stimmt eher nicht 0 = stimmt absolut nicht Handlungsspielraum Ich übertrage meinen Mitarbeitern
Selbstcheck: Praktiziere ich einen gesundheitsförderlichen Führungsstil? 3 = stimme voll zu 2 = stimmt ziemlich 1 = stimmt eher nicht 0 = stimmt absolut nicht Handlungsspielraum Ich übertrage meinen Mitarbeitern
Verankerung des Themas Unternehmensnachfolge in KMU
 Verankerung des Themas Unternehmensnachfolge in KMU Jahreskonferenz der Kampagne für Weitermacher Wiesbaden, 21.08.2012 I Aktualität des Themas Haben Sie sich bereits mit dem Thema Unternehmensnachfolge
Verankerung des Themas Unternehmensnachfolge in KMU Jahreskonferenz der Kampagne für Weitermacher Wiesbaden, 21.08.2012 I Aktualität des Themas Haben Sie sich bereits mit dem Thema Unternehmensnachfolge
Empathisches CRM. (Empathic CRM) Sven Bruck, die dialogagenten. die dialogagenten Agentur Beratung Service GmbH Katernberger Straße 4 42115 Wuppertal
 Empathisches CRM (Empathic CRM) Sven Bruck, die dialogagenten die dialogagenten Agentur Beratung Service GmbH Katernberger Straße 4 42115 Wuppertal +49 (0)202. 371 47 0 crmpathy@die-da.com www.die-da.com
Empathisches CRM (Empathic CRM) Sven Bruck, die dialogagenten die dialogagenten Agentur Beratung Service GmbH Katernberger Straße 4 42115 Wuppertal +49 (0)202. 371 47 0 crmpathy@die-da.com www.die-da.com
Nutzen der Zertifizierung von Qualitätsmanagementsystemen in Theorie und Praxis. Qualitäts-Kollegium Berlin-Brandenburg. 20.
 Qualitäts-Kollegium Berlin-Brandenburg Nutzen der Zertifizierung von Qualitätsmanagementsystemen in Theorie und Praxis 20. Oktober 2012 Prof. Dr.-Ing. Holger Fritz Beuth Hochschule für Technik Berlin Inhalt
Qualitäts-Kollegium Berlin-Brandenburg Nutzen der Zertifizierung von Qualitätsmanagementsystemen in Theorie und Praxis 20. Oktober 2012 Prof. Dr.-Ing. Holger Fritz Beuth Hochschule für Technik Berlin Inhalt
Elternzeit Was ist das?
 Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
Versetzungsgefahr als ultimative Chance. ein vortrag für versetzungsgefährdete
 Versetzungsgefahr als ultimative Chance ein vortrag für versetzungsgefährdete Versetzungsgefährdete haben zum Großteil einige Fallen, die ihnen das normale Lernen schwer machen und mit der Zeit ins Hintertreffen
Versetzungsgefahr als ultimative Chance ein vortrag für versetzungsgefährdete Versetzungsgefährdete haben zum Großteil einige Fallen, die ihnen das normale Lernen schwer machen und mit der Zeit ins Hintertreffen
Das BANK-now Finanzierungsmodul.
 Anleitung für auto-i Autohandel Das BANK-now Finanzierungsmodul. In diesem Dokument erfahren Sie alles, was Sie zur Einrichtung und zur Zusammenarbeit mit BANK-now wissen müssen. Schritt 1 (einmalig):
Anleitung für auto-i Autohandel Das BANK-now Finanzierungsmodul. In diesem Dokument erfahren Sie alles, was Sie zur Einrichtung und zur Zusammenarbeit mit BANK-now wissen müssen. Schritt 1 (einmalig):
Das Seminarangebot richtet sich an drei Gruppen von Frauen:
 Betriebswirtschaftliche Unternehmenssteuerung von Frau zu Frau Seminarangebot 2016 Gibt es eine weibliche Betriebswirtschaft? Nein, natürlich nicht! Zahlen sind geschlechtsneutral. Aber: Die Schlüsse,
Betriebswirtschaftliche Unternehmenssteuerung von Frau zu Frau Seminarangebot 2016 Gibt es eine weibliche Betriebswirtschaft? Nein, natürlich nicht! Zahlen sind geschlechtsneutral. Aber: Die Schlüsse,
FAQs zum Bachelorstudiengang Psychologie PO-Version 2011. Allgemeine Informationen zum Bachelorstudiengang Psychologie
 FAQs zum Bachelorstudiengang Psychologie PO-Version 2011 Allgemeine Informationen zum Bachelorstudiengang Psychologie Wann kann das Studium begonnen werden? Nur im Wintersemester Ist das Studium zulassungsbeschränkt?
FAQs zum Bachelorstudiengang Psychologie PO-Version 2011 Allgemeine Informationen zum Bachelorstudiengang Psychologie Wann kann das Studium begonnen werden? Nur im Wintersemester Ist das Studium zulassungsbeschränkt?
Avenue Oldtimer Liebhaber- und Sammlerfahrzeuge. Ihre Leidenschaft, gut versichert
 Avenue Oldtimer Liebhaber- und Sammlerfahrzeuge Ihre Leidenschaft, gut versichert Die Versicherung für aussergewöhnliche Fahrzeuge Sicherheit für das Objekt Ihrer Leidenschaft Die Versicherung von Sammlerfahrzeugen
Avenue Oldtimer Liebhaber- und Sammlerfahrzeuge Ihre Leidenschaft, gut versichert Die Versicherung für aussergewöhnliche Fahrzeuge Sicherheit für das Objekt Ihrer Leidenschaft Die Versicherung von Sammlerfahrzeugen
Fragebogen Weisse Liste-Ärzte
 www.weisse-liste.de Fragebogen Weisse Liste-Ärzte Der Fragebogen ist Teil des Projekts Weisse Liste-Ärzte. DIMENSION: Praxis & Personal trifft voll und ganz zu trifft eher zu trifft eher trifft überhaupt
www.weisse-liste.de Fragebogen Weisse Liste-Ärzte Der Fragebogen ist Teil des Projekts Weisse Liste-Ärzte. DIMENSION: Praxis & Personal trifft voll und ganz zu trifft eher zu trifft eher trifft überhaupt
Abi online Für das Abitur lernen wann ich will, wo ich will!
 Abi online Für das Abitur lernen wann ich will, wo ich will! Wo finde ich mehr Informationen? Sie können sich auf der Homepage des Weiterbildungskollegs und Abendgymnasiums oder auf der Seite des Ministeriums
Abi online Für das Abitur lernen wann ich will, wo ich will! Wo finde ich mehr Informationen? Sie können sich auf der Homepage des Weiterbildungskollegs und Abendgymnasiums oder auf der Seite des Ministeriums
Schön, dass ich jetzt gut
 Schön, dass ich jetzt gut versorgt werde. Und später? Unsere private Pflegezusatzversicherung ermöglicht im Pflegefall eine optimale Betreuung. Solange es geht sogar zu Hause und das schon für monatlich.*
Schön, dass ich jetzt gut versorgt werde. Und später? Unsere private Pflegezusatzversicherung ermöglicht im Pflegefall eine optimale Betreuung. Solange es geht sogar zu Hause und das schon für monatlich.*
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Qualifikationsspezifische Arbeitslosenquoten
 Aktuelle Daten und Indikatoren Qualifikationsspezifische Arbeitslosenquoten 21. November 2013 Inhalt 1. In aller Kürze...2 2. Entwicklung in Deutschland...2 3. Arbeitslosigkeit nach Qualifikation...2 4.
Aktuelle Daten und Indikatoren Qualifikationsspezifische Arbeitslosenquoten 21. November 2013 Inhalt 1. In aller Kürze...2 2. Entwicklung in Deutschland...2 3. Arbeitslosigkeit nach Qualifikation...2 4.
