ACTELION PRODUKTE AUF DEM MARKT
|
|
|
- Bettina Hertz
- vor 7 Jahren
- Abrufe
Transkript
1 ACTELION Actelion beschäftigt mehr als 1000 erfahrene Spezialisten im Bereich Vertrieb, Marketing und Medizin, mit nachgewiesener Expertise in der Spezialitäten- und Allgemeinmedizin. Das Unternehmen unterhält über 30 eigene Niederlassungen und zusätzlich Vertriebspartnerschaften in über 30 weiteren Märkten. Dank dieser globalen Reichweite ist Actelion bestens aufgestellt, um aus den bestehenden Geschäftsopportunitäten optimale Erträge zu erwirtschaften und künftige Umsatzträger einzuführen und zu kommerzialisieren. Unsere kommerziellen Aktivitäten orientieren sich an folgenden Grundsätzen: Wir nutzen die kommerziellen Chancen, die sich Actelion bieten, und pflegen enge, von Vertrauen getragene Kundenbeziehungen. Wir richten unsere Organisation und unsere Geschäftstätigkeit an den gegebenen Wachstumsmöglichkeiten aus. Wir fördern die effiziente und reibungslose Interaktion innerhalb des Unternehmens und mit unseren Geschäftspartnern. Der Bereich Business Strategy & Operations kann sich auf sehr erfahrene Mitarbeitende mit ausgewiesenen Kompetenzen in der Spezialitäten- und Allgemeinmedizin stützen und dadurch die Wettbewerbsfähigkeit des Unternehmens in einem zunehmend komplexen Marktumfeld behaupten. So ist die Geschäftseinheit gut aufgestellt, um hervorragende kommerzielle Leistungen zu erbringen und auf unserer unbestrittenen Führungsrolle im Bereich PAH sowie unserer Kompetenz bei seltenen Krankheiten aufzubauen. Gleichzeitig übernimmt sie die Führungsrolle bei der Umsetzung von Wachstumsinitiativen, der Erschliessung von Märkten und neuen medizinischen Anwendungsgebieten, um das Potenzial unserer künftigen Unternehmenstätigkeit vollumfänglich auszuschöpfen. INHALT Unsere PAH-Franchise Opsumit Tracleer Uptravi Veletri Ventavis Unsere Spezialitäten-Produkte Valchlor Zavesca
2 Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohliche Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Das PAH-Portfolio von Actelion umfasst Formulierungen zur Einnahme, Inhalation und intravenösen Applikation für Patienten in verschiedenen Erkrankungsstadien (PAH- Funktionsklassen II-IV) und deckt damit das gesamte Behandlungsspektrum auf dem Gebiet der PAH ab. Opsumit Tracleer Uptravi Veletri Ventavis Opsumit (Macitentan) ist ein oral verfügbarer dualer Endothelin-Rezeptor- Antagonist (ERA), der aus einem zielgerichteten Entdeckungsprozess in den Labors von Actelion hervorgegangen ist. Tracleer (Bosentan) wurde als erster oral verfügbarer Endothelin-Rezeptor- Antagonist für die Behandlung der PAH zugelassen. Uptravi (Selexipag), ursprünglich von Nippon Shinyaku entdeckt und synthetisiert, ist der einzige zugelassene orale, selektive IP-Rezeptor-Agonist, der auf den Prostazyklin-Signalweg bei PAH abzielt. Veletri (Epoprostenol zur Injektion), ein intravenös zu verabreichendes Prostazyklin, ist bei Raumtemperatur (77 F, 25 C) bis zu 24 Stunden lang stabil. Dadurch sind Patienten nicht mehr darauf angewiesen, Kühlelemente bei sich zu tragen. Ventavis (Iloprost), eine inhalierbare Formulierung von Iloprost, ist ein Wirkstoff, der strukturelle Ähnlichkeiten mit Prostazyklin (PGI2) aufweist. Es wird von Actelion in den USA und von Bayer Healthcare in anderen Ländern vermarktet. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
3 Opsumit (Macitentan) ist ein oral verfügbarer Endothelin-Rezeptor-Antagonist, der aus einem zielgerichteten Entdeckungsprozess in den Labors von Actelion hervorgegangen ist. ZUGELASSENE INDIKATIONEN In den USA ist Opsumit für die Behandlung der PAH (WHO-Gruppe I) zur Verzögerung der Krankheitsprogression zugelassen. Zur Krankheitsprogression zählen: Tod, Beginn einer Behandlung mit intravenös (IV) oder subkutan verabreichten Prostanoiden, Verschlechterung der klinischen Befunde der PAH (Verminderung der Wegstrecke beim 6-Minuten-Gehtest, Verschlechterung der Symptome der PAH sowie Notwendigkeit zusätzlicher PAH-Therapie). Darüber hinaus sind unter Opsumit weniger Hospitalisierungen infolge PAH erforderlich. Die Wirksamkeit von Opsumit wurde im Rahmen einer Langzeitstudie nachgewiesen, bei der PAH-Patienten mit Symptomen gemäss WHO- Funktionsklasse II-III im Schnitt zwei Jahre lang behandelt worden waren. Die Patienten erhielten Opsumit als Monotherapie oder in Kombination mit Phosphodiesterase-5- Inhibitoren bzw. inhalierbaren Prostanoiden. Die Patienten litten unter idiopathischer oder erblich bedingter PAH (57%), PAH infolge von Bindegewebserkrankungen (31%) und PAH aufgrund angeborener Herzkrankheiten mit Shunts-Korrektur (8%). In Europa ist Opsumit als Monooder Kombinationstherapie für die Langzeitbehandlung von erwachsenen PAH- Patienten (WHO-Funktionsklasse II bis III) indiziert. Die Wirksamkeit konnte in einer Patientenpopulation mit idiopathischer, bzw. erblich bedingter PAH, PAH in Verbindung mit Bindegewebserkrankungen und PAH aufgrund angeborener Herzkrankheit mit Shunts-Korrektur nachgewiesen werden. PRODUKTVERFÜGBARKEIT UND REGISTRIERUNGSSTATUS Opsumit ist in über 35 Märkten kommerziell verfügbar, einschliesslich den USA (seit November 2013), Deutschland (seit Januar 2014) und Japan (seit Juni 2015). In weiteren Ländern befindet sich Opsumit im Zulassungsprozess. Aktuelle Informationen zur Verfügbarkeit des Produkts können über eingesehen werden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
4 VERFÜGBARES KLINISCHES DATENMATERIAL SERAPHIN, eine globale, zulassungsrelevante Phase-III-Studie, war darauf ausgelegt, die Wirksamkeit und Sicherheit von Macitentan bei Patienten mit symptomatischer PAH über den primären Endpunkt der Zeit bis zum ersten Morbiditäts-/Mortalitätsereignisses zu untersuchen. Insgesamt 742 Patienten enthielten entweder Placebo (n=250), 3 mg Macitentan (n=250), oder 10 mg Macitentan (n=242). Der primäre Endpunkt wurde bei 46,4%, 38,0% und 31,4% der Patienten in der entsprechenden Gruppe erreicht. Die Hazard Ratio für 3 mg Macitentan gegenüber Placebo lag bei 0,70 (97,5% Konfidenzintervall, 0,52 bis 0,96; p=0,0108), die Hazard Ratio für 10 mg Macitentan gegenüber Placebo lag bei 0,55 (97,5% Konfidenzintervall, 0,39 bis 0,76; p<0,0001). Eine Verschlechterung der pulmonalen arteriellen Hypertonie war das beim primären Endpunkt am häufigsten auftretende Ereignis. Die Patienten durften während der Studie zusätzlich mit einer PAH-Grundtherapie in Form eines PDE-5- Inhibitors oder oraler/inhalierter Prostanoide behandelt werden. Die Wirkung von Macitentan auf diesen Endpunkt wurde unabhängig davon beobachtet, ob eine Grundtherapie der pulmonalen arteriellen Hypertonie erfolgt war. Die häufigsten beobachteten Nebenwirkungen bei einer Behandlung mit Opsumit waren Nasopharyngitis (Entzündungen des Nasenraums) (14,0%), Kopfschmerzen (13,6%) und Anämie (13,2%). MEILENSTEINE 2014 Opsumit in der EU eingeführt 2013 Opsumit in den USA eingeführt 2013 FDA und EMA erteilen Zulassung für Opsumit bei PAH 2012 SERAPHIN-Studie erreicht primären Endpunkt 2007 Aufnahme der Phase-III-Studie SERAPHIN mit PAH-Patienten LITERATURHINWEIS Pulido T et al. N Engl J Med 2013;369: Sidharta PN et al. Eur J Clin Pharmacol. 2011;67(10): Gatfield J et al. PloS ONE. 2012;7(10):e47662 Iglarz M et al. J Pharmacol Exp Ther. 2008;327(3): Iglarz M et al. Am J Respir Crit Care Med. 2011;183:A6445 TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
5 TRACLEER Tracleer (Bosentan) wurde als erster oral verfügbarer Endothelin-Rezeptor-Antagonist für die Behandlung der PAH zugelassen. ZUGELASSENE INDIKATIONEN In den USA ist Tracleer für die Behandlung der PAH (WHO Gruppe 1) zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verzögerung der klinischen Verschlechterung indiziert. An Studien zum Nachweis der Wirksamkeit waren vor allem Patienten mit Symptomen der NYHA Funktionsklassen II bis IV sowie idiopathischer oder erblich bedingter PAH (60%) beteiligt, ausserdem Patienten mit PAH in Verbindung mit Bindegewebserkrankungen (21%) und Patienten mit PAH in Verbindung mit angeborenen systemisch pulmonalen Shunts (18%). Sicherheitshinweis: Bei Patienten mit Symptomen der WHO-Klasse II wurde eine Verminderung der klinischen Symptome und ein Trend zur Verbesserung der Gehstrecke verzeichnet. Der behandelnde Arzt muss entscheiden, ob diese Vorteile das Risiko einer möglichen Leberschädigung bei Patienten der WHO-Klasse II aufwiegen. Sollte es zu Leberschädigungen kommen, so kann das Präparat im weiteren Krankheitsverlauf nicht mehr verabreicht werden. In Europa ist Tracleer bei Patienten mit PAH der Funktionsklasse III zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verminderung der Symptome zugelassen, ebenso wie bei Patienten der Funktionsklasse II, für die ebenfalls Verbesserungen aufgezeigt werden konnten. In der EU ist Tracleer ausserdem zur Reduktion der Anzahl neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose zugelassen, die an digitalen Ulzerationen leiden. In der EU wurde Tracleer in Form einer kleeblattförmigen, dispergierbaren Tablette mit einer Dosisstärke von 32 mg für Kinder zugelassen. Ausserdem ist Tracleer für die Behandlung von PAH bei Kindern ab dem 1. Lebensjahr zugelassen. Tracleer kann schwerwiegende Leberschäden verursachen, die in seltenen Fällen zu Leberversagen führen. Zudem besteht eine hohes teratogenes Risiko. Tracleer ist kontraindiziert bei gleichzeitiger Verwendung von Cyclosporin A und Glyburid und darf nicht an schwangere und stillende Frauen verabreicht werden. In den USA darf Tracleer nur in Abstimmung mit einer Risikomanagementstrategie vertrieben werden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
6 PRODUKTVERFÜGBARKEIT UND REGISTRIERUNGSSTATUS Tracleer ist in über 60 Ländern zugelassen. Hierzu zählen die USA (seit November 2001), die Europäische Union (seit Mai 2002) und Japan (seit April 2005). Alle aktuellen Informationen können über eingesehen werden. VERFÜGBARES KLINISCHES DATENMATERIAL Zur Untersuchung der Wirksamkeit und Sicherheit von Tracleer wurde ein umfassendes klinisches Studienprogramm unter Einbeziehung einer breiten PAH-Patientenpopulation durchgeführt. Eine detaillierte Analyse der Studienergebnisse findet sich in den wissenschaftlichen Publikationen, die unter Literaturhinweis aufgeführt sind. MEILENSTEINE 2015 Aufnahme von ergänzenden pädiatrischen Daten in Europäische Produktinformation zu Tracleer 2009 EU erteilt Zulassung für pädiatrische Formulierung von Tracleer zur Behandlung der PAH 2005 Einführung von Tracleer in Japan 2002 Einführung von Tracleer in der EU 2001 Einführung von Tracleer in den USA KEY SCIENTIFIC LITERATURE Study 351: Channick RN et al. Lancet. 2001;358: Breathe-1: Rubin LJ et al. N Engl J Med. 2002;346: Breathe-2: Humbert M et al. Eur Respir J. 2004;24:353-9 Breathe-3: Barst RJ et al. Clin Pharmacol Ther. 2003;73: Breathe-4: Sitbon O et al. Am J Respir Crit Care Med. 2004;170: Breathe-5: Galiè N et al. Circulation. 2006;114:48-54 Early: Galiè N et al. Lancet. 2008;371: Rapids-1: Korn JH et al. Arthritis Rheum. 2004;50: Future-1: Beghetti M et al. Br J Clin Pharmacol. 2009;68(6): TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
7 UPTRAVI Uptravi (Selexipag), ursprünglich von Nippon Shinyaku entdeckt und synthetisiert, ist der einzige zugelassene orale, selektive IP-Rezeptor-Agonist, der auf den Prostazyklin-Signalweg bei pulmonaler arterieller Hypertonie abzielt. ZUGELASSENE INDIKATIONEN In den USA ist Uptravi für die Behandlung der PAH (WHO-Gruppe I) zur Verzögerung der Krankheitsprogression und der Verminderung des Hospitalisierungsrisikos infolge PAH indiziert. Die Wirksamkeit wurde in einer langfristig angelegten Studie bei PAH-Patienten mit Symptomen gemäss WHO-Funktionsklasse II-III nachgewiesen. Die Patienten litten an idiopathischer oder erblich bedingter PAH (58%), PAH infolge von Bindegewebserkrankungen (29%) und PAH in Verbindung mit einem korrigierten angeborenen Herzfehler (10%). In Europa ist Uptravi indiziert zur langfristigen Behandlung erwachsener Patienten mit pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklassen (FC) II-III, entweder als Kombinationstherapie bei Patienten, deren Erkrankung durch den Einsatz eines Endothelin- Rezeptor-Antagonisten (ERA) ungenügend kontrolliert ist, und/oder in Verbindung mit einem Phosphodiesterase-Typ-5 (PDE-5)-Inhibitor, oder als Monotherapie bei Patienten, für welche diese Therapien nicht geeignet sind. Die Wirksamkeit wurde in einer Population von Patienten mit idiopathischer und erblich bedingter PAH, PAH infolge von Bindegewebserkrankungen sowie PAH in Verbindung mit einem korrigierten angeborenen Herzfehler gezeigt. PRODUKTVERFÜGBARKEIT UND ZULASSUNGSSTATUS Uptravi ist in den USA (seit Januar 2016), Deutschland (seit Juni 2016) und Kanada (Privatmarkt seit Juni 2016) kommerziell verfügbar. Die Marktzulassung wurde ebenfalls erteilt in Australien, der EU, Neuseeland und Südkorea. Registrierungsdossiers an andere Gesundheitsbehörden werden fortlaufend eingereicht; derzeit werden die Unterlagen in Japan, der Schweiz, Taiwan und der Türkei geprüft. Aktuelle Informationen finden Sie über VERFÜGBARES KLINISCHES DATENMATERIAL Mit GRIPHON, einer globalen, zulassungsrelevanten Phase-III-Studie, sollte aufgezeigt werden, dass Selexipag den Zeitraum bis zum ersten Auftreten eines Morbiditäts-/ Mortalitätsereignisses im Vergleich zu Placebo verlängert. Gleichzeitig sollte die Sicherheit von Selexipag bei PAH-Patienten untersucht werden. Insgesamt wurden 1156 Patienten randomisiert. In einem Dosierungsschema, in dem die Patienten bis zu ihrer individuellen Dosis auftitriert wurden, betrug die Anfangsdosis in GRIPHON 200 mcg b.i.d. Diese Dosis wurde wöchentlich in Schritten von 200 mcg bis auf maximal 1600 mcg b.i.d. erhöht. Wenn Patienten eine Dosisstärke nicht vertrugen, wurde die Dosis auf die zuvor vertragene Dosierung herabgesetzt. Bei 397 Patienten trat ein primärer Endpunkt auf - bei 41,6% der Patienten in der Placebo-Gruppe und bei 27,0% der Patienten in der Selexipag-Gruppe (Hazard Ratio in der Selexipag-Gruppe im Vergleich zur Placebo-Gruppe 0,60; 99% Konfidenzintervall, 0,46 bis 0,78, P<0,0001). Krankheitsprogression und TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
8 Hospitalisierung machten 81,9% der Ereignisse aus. Die Patienten erhielten zweimal täglich entweder Selexipag oder Placebo - dies nach Bedarf zusätzlich zu einer Hintergrundtherapie mit einem Endothelin-Rezeptor-Antagonisten (ERA) und/oder einem Phosphodiesterase-5-Inhibitor (PDE-5- Inhibitor), wenn sie vor Studienbeginn wenigstens 3 Monate lang mit einer gleichbleibenden Dosis behandelt worden waren. Zu Studienbeginn wurden fast 80% der Patienten mit einer oral verabreichten spezifischen PAH-Therapie behandelt: entweder einem ERA oder PDE-5- Inhibitor oder einer Kombination von beiden. In Bezug auf den primären Endpunkt war die Wirkung von Selexipag in der Patienten-Untergruppe, die zu Beginn der Studie noch keine PAH- Behandlung erhalten hatte, gleich der Wirkung in der Untergruppe, die zu Studienbeginn bereits in PAH-Behandlung gewesen war (einschliesslich der Patienten, die bereits mit einer Kombination aus ERA und PDE5-Inhibitor behandelt worden waren). Nebenwirkungen, die im Verlauf der Studie bei Uptravi zu 3% häufiger auftraten als bei Placebo, waren Kopfschmerzen, Diarrhoe, Kieferschmerzen, Übelkeit, Muskelschmerzen, Erbrechen, Schmerzen in den Extremitäten, Hitzewallungen, Gelenkschmerzen, Anämie, verminderter Appetit sowie Hautausschläge. Diese Nebenwirkungen traten häufiger in der Titrierungsphase auf. Bei 1% (n=8) der mit Selexipag behandelten Patienten trat eine Schilddrüsenüberfunktion auf, im Vergleich zu keinem der Patienten in der Placebo-Gruppe. MEILENSTEINE 2016 Marktzulassung von Uptravi in der EU 2016 Einführung von Uptravi in den USA 2015 Zulassung von Uptravi durch die amerikanische FDA 2014 GRIPHON-Ereignisstudie erreicht primären Endpunkt 2008 Actelion geht Lizenzvereinbarung für Selexipag mit Nippon Shinyaku ein LITERATURHINWEIS Sitbon O et al. N Engl J Med. 2015; 373: Simonneau G, et al. Eur Respir J. 2012; 40: Kuwano et al. J Pharmacol Exp Ther. 2008;326: Tetsuo Asaki et al. J. Med. Chem. 2015, 58 (18), pp Morrison et al. J Pharmacol Exp Ther. 2012;343: TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
9 VELETRI Veletri (Epoprostenol zur Injektion), ein intravenös zu verabreichendes Prostazyklin, ist bei Raumtemperatur (77 F, 25 C) bis zu 24 Stunden lang stabil. Dadurch müssen Patienten keine Kühlelemente mehr bei sich tragen. ZUGELASSENE INDIKATIONEN In den USA ist Veletri für die Behandlung der PAH (WHO Gruppe 1) zur Verbesserung der körperlichen Leistungsfähigkeit indiziert. Wirksamkeitsstudien wurden vor allem bei Patienten mit Symptomen gemäss NYHA Funktionsklasse III und IV und mit idiopathischer oder vererbbarer PAH oder PAH in Verbindung mit Bindegewebserkrankungen durchgeführt. In einigen Ländern der EU ist Veletri für die Behandlung der PAH (idiopathische oder erblich bedingte PAH und PAH in Verbindung mit Bindegewebserkrankungen) bei Patienten mit Symptomen gemäss WHO Funktionsklassen III-IV zur Verbesserung der körperlichen Leistungsfähigkeit indiziert. Veletri kann darüber hinaus bei Notfällen in der Hämodialyse eingesetzt werden, wenn der Einsatz von Heparin mit einem hohen Risiko verbunden ist, zu starken Blutungen führt oder anderweitig kontraindiziert ist. Veletri (Epoprostenol zur Injektion) darf gemäss der Gebrauchsinformation nur unter Verwendung von für Injektionen geeignetem sterilem Wasser oder 0,9% Natriumchlorid aufbereitet und verdünnt werden. Veletri darf weder vor noch während der Verabreichung mit anderen intravenös zu applizierenden Medikamenten oder Lösungen aufbereitet oder gemischt werden. Zu den häufigsten Nebenwirkungen zählen Kopfschmerzen, Kieferschmerzen, Hitzewallungen, Diarrhoe, Übelkeit und Erbrechen, niedriger Blutdruck, Bauchschmerzen, Gelenkschmerzen, grippeähnliche Symptome, Verringerung der Thrombozytenzahl, Blutungen, Tachykardie, Bradykardie, Brustschmerzen, Hautausschläge, Schmerzen sowie Angstgefühle und Nervosität. Häufig wurde von Blutvergiftungen berichtet, die meistens auf das Applikationssystem für Veletri zurückzuführen waren. Um das Risiko von katheterbedingten Blutbahninfektionen zu reduzieren, sollte die Reinigung des zentralen Venenkatheters und des Katheteraustritts gemäss gängiger medizinischer Praxis erfolgen. Eine Überdosierung von Veletri kann einen akuten systemischen Blutdruckabfall, Herzrasen, Kieferschmerzen, Kopfschmerzen, Hitzewallungen, Übelkeit und Erbrechen, Diarrhoe, grippeähnliche Symptome oder Angstgefühle zur Folge haben. Wenn regelmässig zu hohe Dosen verabreicht werden, kann dies zu extremer Unruhe und High-Output -Herzinsuffizienz führen. Das abrupte Absetzen von Veletri oder ein zu schnelles Absenken der Dosis kann Symptome wie Atemnot, Schwindel, Kraftlosigkeit zur Folge haben, wie sie bei einem verstärkten Auftreten der pulmonalen Hypertonie zu beobachten sind, und kann im Extremfall zum Tode führen. Deshalb sollte die Therapie nicht abrupt abgesetzt werden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
10 PRODUKTVERFÜGBARKEIT UND REGISTRIERUNGSSTATUS Veletri ist in 15 Märkten erhältlich. Hierzu zählen die USA (seit 2010), die Schweiz und Kanada (unter der Handelsbezeichnung Caripul ) (seit 2012), Japan, wo es als Epoprostenol ACT vermarktet wird (2012) und einige europäische Märkte (seit 2013). In anderen Ländern ist das Zulassungsverfahren noch nicht abgeschlossen. MEILENSTEINE 2013 Veletri wird in mehreren europäischen Märkten und in Japan eingeführt, wo es als Epoprostenol ACT vermarktet wird 2012 Einführung in der Schweiz und in Kanada (unter der Handelsbezeichnung Caripul ) 2010 Einführung von Veletri in den USA 2009 Actelion erwirbt Veletri von GeneraMedix Inc Epoprostenol zur Injektion wird von der FDA zur Behandlung von primärer pulmonaler Hypertonie in den USA zugelassen KEY SCIENTIFIC LITERATURE Lambert O et al. Drug Design Dev Ther. 2012;6: Sitbon O, et al. Am J Respir Crit Care Med. 2012;185:A2500 Tamura Y, et al. Adv Ther. 2013;30: Nicolas LB, et al. Clin Ther. 2013;35: Alle aktuellen Informationen zur Verfügbarkeit von Veletri können über abgerufen werden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
11 VENTAVIS Ventavis (Iloprost), eine inhalierbare Formulierung von Iloprost, ist ein synthetischer Wirkstoff, der strukturelle Ähnlichkeiten mit Prostazyklin (PGI2) aufweist. ZUGELASSENE INDIKATIONEN In den USA ist Ventavis für die Behandlung der PAH (WHO Gruppe 1) zur Verbesserung eines kombinierten Endpunkts in Bezug auf die körperlichen Belastbarkeit, die Verminderung der Symptome (NYHA-Klasse) und die Stabilisierung des Krankheitszustandes zugelassen. An den Wirksamkeitsstudien waren vor allem Patienten mit Symptomen gemäss NYHA- Funktionsklasse III-IV und mit idiopathischer oder erblicher PAH (65%) oder PAH in Verbindung mit Bindegewebserkrankungen (23%) beteiligt. PRODUKTVERFÜGBARKEIT UND ZULASSUNGSSTATUS Actelion vermarktet Ventavis seit 2007 in den USA. Bayer Healthcare vertreibt Ventavis in anderen Ländern. VERFÜGBARES KLINISCHES DATENMATERIAL In kontrollierten klinischen Studien konnte für Ventavis eine Verbesserung des kombinierten Endpunkts aus körperlicher Belastbarkeit, Symptomen gemäss NYHA-Klasse und Ausbleiben einer klinischen Verschlechterung nachgewiesen werden. Bei der Behandlung von Patienten mit PAH (WHO- Gruppe 1), die Symptome der NHYA-Klasse III oder IV aufwiesen, konnten für Ventavis folgende Nachweise erbracht werden: Signifikante Verbesserung des Befindens der Patienten (p = 0,0033) nach 12-wöchiger Behandlungszeit im Verhältnis zum Ausgangswert in Bezug auf einen kombinierten Endpunkt aus verbesserter Leistungsfähigkeit 30 Minuten nach Verabreichung, Verbesserung um mindestens ein Stadium im Rahmen der NYHA- Klassifikation und stabilem Krankheitszustand Signifikante Verbesserung der sechsminütigen Gehstrecke in Woche 12 mit einer mindestens zehnprozentigen Zunahme der individuellen Gehstrecke (p < 0,01) Signifikante Verbesserung der Funktionsklasse in Woche 12 (p = 0,03). Zu den häufigsten Nebenwirkungen (>3% Plazebo-korrigiert) zählen Gefässerweiterung (Hitzewallungen), verstärkter Husten, Kopfschmerzen, Trismus, Schlaflosigkeit, Übelkeit, niedriger Blutdruck, Erbrechen, erhöhte alkalische Phosphatase, grippeähnliche Symptome, Rückenschmerzen, Zungenschmerzen, Herzrasen, Synkopen, erhöhte GGT-Werte, Muskelkrämpfe, Hämoptyse und Lungenentzündung. Im Dezember 2006 wurden Daten der klinischen Phase II/III-Studie STEP zu Sicherheit und Zusatznutzen von Ventavis (Iloprost) Inhalationslösung bei Patienten mit PAH veröffentlicht, die bereits mit Bosentan behandelt wurden. Die Analyse dieser Studie ergab, dass die Kombination von Ventavis und Bosentan gut vertragen wurde und dem Sicherheitsprofil bei Patienten entsprach, die ausschliesslich mit Iloprost behandelt worden waren. MEILENSTEINE 2009 Stärker konzentrierte 20 mcg/ml-formulierung von Ventavis in den USA zugelassen 2007 Mit dem Erwerb von CoTherix Inc kann Actelion sein Produktangebot um Ventavis erweitern 2004 FDA erteilt Zulassung für Iloprost zur Inhalation für die Therapie von PAH in den USA LITERATURHINWEIS Ivy et al J Am Coll Cardiol. 51(2):161-9; 2008 McLaughlin et al. Am J Respir Crit Care Med. 174(11): ; 2006 Hoeper et al. Eur Respir J. 26(5):858-63; 2005 Hossein A. et al. J Am Coll Card. 42 (1): ; 2003 Olschewski et aln Engl J Med. 1;347(5):322-9; 2002 TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
12 PRODUKTSPEZIALITÄTEN Neben seinem PAH-Geschäft baut Actelion im Rahmen seiner eigenen Forschung und Entwicklung und/oder durch Einlizenzierung bzw. Akquisition von Produkten ein Spezialitätenportfolio in neuen Therapiebereichen auf. Valchlor Valchlor (Mechlorethamin) Gel 0,016% wird einmal täglich auf erkrankte Hautstellen aufgetragen. Valchlor ist zur Zeit ausschliesslich in den USA und in Israel erhältlich, wo es für die topische Behandlung von Patienten mit kutanem T-Zell- Lymphom des Typs Mycosis fungoides im Stadium IA und IB mit vorangegangener topischer Hauttherapie indiziert ist. Zavesca Zavesca (Miglustat), eine oral zu verabreichende Kapsel, ist ein Glukosylzeramid-Synthase- Inhibitor, der als Monotherapie für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit indiziert ist, für die eine Enzymersatz-Therapie therapeutisch nicht angebracht ist. Zavesca ist in 47 Ländern zugelassen. Zudem ist Zavesca in 45 Ländern für die Behandlung der Niemann-Pick Typ C-Krankheit zugelassen. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
13 VALCHLOR Valchlor (Mechlorethamin) Gel 0,016% wird einmal täglich auf erkrankte Hautstellen aufgetragen. Valchlor ist die bisher einzige von der FDA zugelassene topische Formulierung von Mechlorethamin. ZUGELASSENE INDIKATIONEN In den USA ist Valchlor-Gel 0,016% für die topische Behandlung von Patienten mit kutanem T-Zell- Lymphom (MF-CTCL) des Typs Mycosis fungoides im Stadium IA und IB mit vorangegangener topischer Hauttherapie indiziert. PRODUKTVERFÜGBARKEIT UND REGISTRIERUNGSSTATUS Valchlor ist in den USA (seit November 2013) und in Israel (seit April 2016) erhältlich. Das Zulassungsverfahren bei den europäischen Gesundheitsbehörden läuft. VERFÜGBARES KLINISCHES DATENMATERIAL Die Wirksamkeit von Valchlor wurde in einer multizentrischen, randomisierten, Obserververblindeten, Non-Inferiority-Studie untersucht, an der 260 Patienten teilnahmen. Die Patienten wurden nach dem Erkrankungsstadium (IA vs. IB und IIA) stratifiziert und erhielten randomisiert entweder Valchlor Gel 0,016% w/w Mechlorethamin (entspricht 0,02% Mechlorethamin HCl) oder 0,02% Mechlorethamin HCl-Salbe auf der Basis von Aquaphor (Mechlorethamin-Gemisch). Die Patienten waren zuvor wenigstens mit einer direkt auf die Haut ausgerichteten Therapie behandelt worden. Hierzu zählten topische Kortikosteroide, Phototherapie, Tagretin-Gel sowie topisches Stickstoff-Lost. Es wurde nicht vorausgesetzt, dass Patienten auf vorausgehende Therapien nicht mehr ansprachen oder diese nicht vertrugen. Die topische Behandlung erfolgte täglich während zwölf Monaten. 60% der Patienten, die Valchlor erhielten und 48% der in der Kontrollgruppe behandelten Patienten zeigten positive Ergebnisse auf der CAILS-Skala (Composite Assessment of Index Lesion Severity). Mit einer Gesamtansprechrate von 1,24 (95% Konfidenzintervall 0,98, 1,58) auf der CAILS-Skala war Valchlor der Kontrollgruppe nicht unterlegen. Nur in wenigen Fällen konnte ein vollständiges Ansprechen in Übereinstimmung mit der CAILS- Skala oder dem Severity Weighted Assessment Tool (SWAT) beobachtet werden. In beiden Behandlungsgruppen gab es grosse Unterschiede bezüglich des Wirkungseintritts gemäss CAILS- Skala, der von einem Monat bis elf Monate reichte. Die häufigsten Nebenwirkungen ( 5%) waren Dermatitis (56%), Pruritis (20%), bakterielle Hautinfektionen (11%), Hautulzerationen oder Blasenbildung (6%) und Hyperpigmentation (5%). Diese Reaktionen sind als mässig schwer oder schwer einzustufen und treten insbesondere bei älteren Patienten über 65 Jahren auf. Je nach Schweregrad muss die Behandlung eingeschränkt bzw. vorläufig oder endgültig eingestellt werden. MEILENSTEINE 2013 Valchlor wird in den USA eingeführt 2013 Actelion erwirbt Ceptaris Therapeutics, Inc., und ergänzt sein Spezialitätenportfolio in den USA durch Valchlor 2013 Zulassung von Valchlor in den USA LITERATURHINWEIS Lessin SR, et al. JAMA Dermatol. 2013;149(1):25-32 TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
14 ZAVESCA Zavesca (Miglustat) ist ein oral aktiver, kompetitiver und reversibler Glukosylzeramid-Synthase-Inhibitor. ZUGELASSENE INDIKATIONEN In den USA ist Zavesca als Monotherapie für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit (GD- 1) zugelassen, für die eine Enzymersatztherapie (z.b. aufgrund von Allergien, Überempfindlichkeit oder schlechtem Venenzugang) therapeutisch nicht angebracht ist. In der Europäischen Union ist Zavesca auch für die Behandlung progressiver neurologischer Manifestationen bei erwachsenen und pädiatrischen Patienten mit Niemann-Pick Typ-C- Erkrankung (NP-C) indiziert, einer sehr seltenen, kontinuierlich fortschreitenden, genetisch bedingten neurodegenerativen Erkrankung mit tödlichem Ausgang, die sowohl Kinder als auch Erwachsene betrifft. PRODUKTVERFÜGBARKEIT UND REGISTRIERUNGSSTATUS Zavesca ist für die Behandlung leichter bis mittelschwerer Typ-1-Gaucher-Krankheit in 47 Ländern zugelassen, darunter seit 2003 in den USA und der Europäischen Union. Ausserhalb der USA ist Zavesca für die Therapie der Niemann-Pick-Krankheit Typ C in 45 Ländern zugelassen, darunter seit 2009 in der Europäischen Union und seit 2012 in Japan. Eine komplette Liste der Länder, in denen Zavesca erhältlich ist, kann über eingesehen werden. VERFÜGBARES KLINISCHES DATENMATERIAL Die Zulassung von Zavesca basiert auf drei internationalen, offenen klinischen Studien. Miglustat wird bei Typ-1-Gaucher-Krankheit eingesetzt, um ausgleichend auf die Gesamtmenge von Glukosylzeramid einzuwirken. Miglustat senkt den Glukosylzeramid-Spiegel auf ein Niveau, das dem durch natürliche Glukosylzeramid-Aktivität erzielten Level entspricht. Dieses Wirkprinzip ist als Substratreduktionstherapie bekannt. In einer zusammenfassenden Analyse der Daten von drei nicht verblindeten klinischen Studien konnte gezeigt werden, dass Zavesca Monotherapie die Inzidenz von Knochenkrisen senken und die Knochendichte bei Typ-1-Gaucher-Patienten verbessern kann, auch bei Patienten, bei denen die Milz entfernt werden musste und/oder die unter Osteoporose leiden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
15 Zu den häufigsten Nebenwirkungen (Inzidenz 5%) zählen Diarrhoe, Gewichtsverlust, Magenschmerzen, Gasbildung, Übelkeit und Erbrechen, Kopfschmerzen einschliesslich Migräne, Tremor, Wadenkrämpfe, Schwindel, Mattigkeit, Sehstörungen, Thrombozytopenie, Muskelkrämpfe, Rückenschmerzen, Verstopfung, trockener Mund, Schweregefühl in Armen und Beinen, Gedächtnisverlust, Gehstörungen, Anorexie, Verdauungsbeschwerden, Parästhesie, Blähungen, nicht ernährungsbedingte Magenschmerzen sowie Menstruationsstörungen. MEILENSTEINE 2012 Zulassung und Einführung von Miglustat zur Behandlung von NP-C in Japan (unter dem Markennamen Brazaves ) 2009 Zulassung und Einführung von Zavesca für die Therapie von NP-C in der EU 2004 Einführung von Zavesca zur Behandlung von GD-1 in den USA 2003 Zulassung und Einführung von Zavesca zur Behandlung von GD-1 in der EU; Zulassung für GD-1 in den USA 2002 Einlizenzierung von Zavesca LITERATURHINWEIS FÜR TYP-1-GAUCHER-KRANKHEIT Pastores G.M. et al. Clinical Therapeutics. 2007; 29: Elstein D. et al. Blood. 2007; 110: Giraldo P. et al. Haematologica. 2006; 91:125-8 Elstein D. et al. J Inherit Metab Dis. 2004; 27: FÜR NIEMANN-PICK-KRANKHEIT TYP C Wraith JE, et al. Mol Genet Metab. 2010; 99: Patterson MC, et al. J Child Neurol ;25(3):300-5 Pineda M, et al. Mol Genet Metab. 2009; 98:243-9 Patterson MC, et al. Lancet Neurol. 2007; 6: Ausserhalb der USA erfolgte die Zulassung von Zavesca für die Indikation Niemann-Pick Typ C auf der Basis der klinischen Studie OGT und zwei multizentrischen retrospektiven Kohortenstudien bei Patienten mit NP-C. Sowohl in der klinischen Studie als auch in den Kohortenstudien wurde Miglustat mit einer klinisch relevanten Stabilisierung oder einer Verbesserung der neurologischen Symptome assoziiert. Weitere Informationen über die Studien können über www. actelion.com eingesehen werden. TRACLEER UPTRAVI VELETRI VENTAVIS VALCHLOR ZAVESCA
16 Actelion Pharmaceuticals Ltd ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung innovativer Medikamente für Krankheiten mit hohem medizinischem Bedarf konzentriert. Das Unternehmen hat seinen Hauptsitz in Allschwil, Basel, Schweiz und ist an der SIX Swiss Exchange notiert (Symbol: ATLN). Alle Marken sind gesetzlich geschützt. Haftungsausschluss Dieses Merkblatt hat den alleinigen Zweck, die Öffentlichkeit mit allgemeinen Informationen über die Aktivitäten von Actelion Ltd und deren Beteiligungsgesellschaften zu informieren. Zukunftsweisende Aussagen in diesem Merkblatt basieren auf aktuellen Erwartungen und Ansichten der Unternehmensleitung, die einer Vielzahl von Risiken und Unsicherheiten unterliegen. Stand: July 2016 Copyright 2016 Actelion Pharmaceuticals Ltd Actelion Pharmaceuticals Ltd Gewerbestrasse 16 / CH-4123 Allschwil Switzerland / investor.relations@actelion.com / Phone Fax /
ACTELION - DAS UNTERNEHMEN
 ACTELION - Actelion ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Erforschung, Entwicklung und Kommerzialisierung von innovativen Arzneimitteln für Krankheiten mit hohem medizinischem
ACTELION - Actelion ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Erforschung, Entwicklung und Kommerzialisierung von innovativen Arzneimitteln für Krankheiten mit hohem medizinischem
Kombinationstherapie nach Risikostratifizierung
 Therapie der pulmonal arteriellen Hypertonie (PAH) Kölner Konsensus-Konferenz plädiert für frühe Kombinationstherapie nach Risikostratifizierung Mannheim (20. April 2017) - Die Einführung der Risikostratifizierung
Therapie der pulmonal arteriellen Hypertonie (PAH) Kölner Konsensus-Konferenz plädiert für frühe Kombinationstherapie nach Risikostratifizierung Mannheim (20. April 2017) - Die Einführung der Risikostratifizierung
Actelion erhält positive CHMP-Beurteilung zu Opsumit (Macitentan) für die Langzeitbehandlung der pulmonalen arteriellen Hypertonie
 Medienmitteilung 25. Oktober 2013 Actelion erhält positive CHMP-Beurteilung zu Opsumit (Macitentan) für die Langzeitbehandlung der pulmonalen arteriellen Hypertonie Europäischer Arzneimittelausschuss (CHMP)
Medienmitteilung 25. Oktober 2013 Actelion erhält positive CHMP-Beurteilung zu Opsumit (Macitentan) für die Langzeitbehandlung der pulmonalen arteriellen Hypertonie Europäischer Arzneimittelausschuss (CHMP)
Actelion erhält Zulassung der US-amerikanischen FDA für Opsumit (Macitentan)
 Pulmonale arterielle Hypertonie: Actelion erhält Zulassung der US-amerikanischen FDA für Opsumit (Mac Pulmonale arterielle Hypertonie Actelion erhält Zulassung der US-amerikanischen FDA für Opsumit (Macitentan)
Pulmonale arterielle Hypertonie: Actelion erhält Zulassung der US-amerikanischen FDA für Opsumit (Mac Pulmonale arterielle Hypertonie Actelion erhält Zulassung der US-amerikanischen FDA für Opsumit (Macitentan)
Starke Performance setzt sich im ersten Quartal 2016 fort auf klinischen Ergebnissen basierendes PAH-Portfolio als Wachstumstreiber
 Page 1 of 7 Medienmitteilung 21. April 2016 Starke Performance setzt sich im ersten Quartal 2016 fort auf klinischen Ergebnissen basierendes PAH-Portfolio als Wachstumstreiber ALLSCHWIL/BASEL, SCHWEIZ
Page 1 of 7 Medienmitteilung 21. April 2016 Starke Performance setzt sich im ersten Quartal 2016 fort auf klinischen Ergebnissen basierendes PAH-Portfolio als Wachstumstreiber ALLSCHWIL/BASEL, SCHWEIZ
ACTELION S FINANZERGEBNISSE
 S Starke Performance von Actelion im ersten Quartal. Der Produktumsatz stieg auf 589 Millionen Schweizer Franken, ein Zuwachs um 11% zu konstanten Wechselkursen (kwk) 1. Actelion berechnet, berichtet und
S Starke Performance von Actelion im ersten Quartal. Der Produktumsatz stieg auf 589 Millionen Schweizer Franken, ein Zuwachs um 11% zu konstanten Wechselkursen (kwk) 1. Actelion berechnet, berichtet und
Neueste Studienergebnisse in der Therapie der PAH
 Dualer Endothelin-Rezeptor-Antagonismus: Neueste Studienergebnisse in der Therapie der PAH Von Prof. Ralf Ewert, Greifswald Lübeck (10. April 2008) - Das Wissen um die Pathophysiologie der Pulmonalen Arteriellen
Dualer Endothelin-Rezeptor-Antagonismus: Neueste Studienergebnisse in der Therapie der PAH Von Prof. Ralf Ewert, Greifswald Lübeck (10. April 2008) - Das Wissen um die Pathophysiologie der Pulmonalen Arteriellen
Aktualisierte Leitlinien für pulmonal (arterielle) Hypertonie (PAH): Zielorientierte PAH-Therapie: Treat to T
 Aktualisierte Leitlinien für pulmonal (arterielle) Hypertonie (PAH): Zielorientierte PAH-Therapie: Treat to Target ist das Gebot der Stunde Freiburg (2. März 2010) Seit 2009 gelten die neuen Leitlinien
Aktualisierte Leitlinien für pulmonal (arterielle) Hypertonie (PAH): Zielorientierte PAH-Therapie: Treat to Target ist das Gebot der Stunde Freiburg (2. März 2010) Seit 2009 gelten die neuen Leitlinien
Spezifische Therapie bei Kindern und Erwachsenen ist entscheidend
 Pulmonal arterielle Hypertonie bei angeborenen Herzfehlern (PAH-CHD) / Eisenmenger-Syndrom: Spezifische Therapie bei Kindern und Erwachsenen ist entscheidend Weimar (3. Oktober 2010) Angeborene Herzfehler
Pulmonal arterielle Hypertonie bei angeborenen Herzfehlern (PAH-CHD) / Eisenmenger-Syndrom: Spezifische Therapie bei Kindern und Erwachsenen ist entscheidend Weimar (3. Oktober 2010) Angeborene Herzfehler
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose
 Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
JAHRESBERICHT. GESCHÄFTSBERICHT 2016: INTERAKTIVES PDF
 GESCHÄFTSBERICHT 2016: INTERAKTIVES PDF Actelions Mission: Mehr Patienten mit bahnbrechenden Medikamenten behandeln Actelion Ltd. ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Entdeckung,
GESCHÄFTSBERICHT 2016: INTERAKTIVES PDF Actelions Mission: Mehr Patienten mit bahnbrechenden Medikamenten behandeln Actelion Ltd. ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Entdeckung,
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) d
 Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Sehr gute Performance im ersten Halbjahr 2016 verstärkt durch die erfolgreiche US-Markteinführung von Uptravi
 Page 1 of 8 Medienmitteilung 21. Juli 2016 Sehr gute Performance im ersten Halbjahr 2016 verstärkt durch die erfolgreiche US-Markteinführung von Uptravi ALLSCHWIL/BASEL, SCHWEIZ 21. Juli 2016 Actelion
Page 1 of 8 Medienmitteilung 21. Juli 2016 Sehr gute Performance im ersten Halbjahr 2016 verstärkt durch die erfolgreiche US-Markteinführung von Uptravi ALLSCHWIL/BASEL, SCHWEIZ 21. Juli 2016 Actelion
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
JAHRESBERICHT. GESCHÄFTSBERICHT Dies ist ein interaktives PDF zum Start bitte auf den Pfeil klicken
 GESCHÄFTSBERICHT 2015 Dies ist ein interaktives PDF zum Start bitte auf den Pfeil klicken UNSERE MISSION: MEHR PATIENTEN MIT WEGWEISENDEN MEDIKAMENTEN BEHANDELN Actelion Ltd. ist ein führendes biopharmazeutisches
GESCHÄFTSBERICHT 2015 Dies ist ein interaktives PDF zum Start bitte auf den Pfeil klicken UNSERE MISSION: MEHR PATIENTEN MIT WEGWEISENDEN MEDIKAMENTEN BEHANDELN Actelion Ltd. ist ein führendes biopharmazeutisches
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union
 Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
fortgeschrittenem Lungenemphysem
 PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
Patientenschulung. Medikamentöse Behandlung bei Osteoporose
 Patientenschulung Medikamentöse Behandlung bei Osteoporose Voraussetzung für den Beginn einer Behandlung: knochengesunde Ernährung Förderung von Koordination und Muskelkraft Sturzvermeidung Wirkprinzipien
Patientenschulung Medikamentöse Behandlung bei Osteoporose Voraussetzung für den Beginn einer Behandlung: knochengesunde Ernährung Förderung von Koordination und Muskelkraft Sturzvermeidung Wirkprinzipien
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Ausgezeichnete operative Ergebnisse gestützt durch hervorragenden Start von Uptravi Anhebung der Prognose
 Page 1 of 9 Medienmitteilung 20. Oktober 2016 Ausgezeichnete operative Ergebnisse gestützt durch hervorragenden Start von Uptravi Anhebung der Prognose ALLSCHWIL/BASEL, SCHWEIZ 20. Oktober 2016 Actelion
Page 1 of 9 Medienmitteilung 20. Oktober 2016 Ausgezeichnete operative Ergebnisse gestützt durch hervorragenden Start von Uptravi Anhebung der Prognose ALLSCHWIL/BASEL, SCHWEIZ 20. Oktober 2016 Actelion
Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
 Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Worum ging es in dieser Studie? Warum war die Studie erforderlich? Welche Medikamente wurden untersucht? BI
 Nachfolgender Text ist die Zusammenfassung einer klinischen Studie an Patienten mit idiopathischer Lungenfibrose, einer seltenen Lungenkrankheit. Der Text wurde für den medizinischen Laien geschrieben
Nachfolgender Text ist die Zusammenfassung einer klinischen Studie an Patienten mit idiopathischer Lungenfibrose, einer seltenen Lungenkrankheit. Der Text wurde für den medizinischen Laien geschrieben
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome
 Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Systemische Sklerose Pulmonal arterielle Hypertonie Diagnostik und neue Therapieansätze Michael Pfeifer Klinik Donaustauf Universität Regensburg
 Bayerische Internistenkongress 2008 Systemische Sklerose Pulmonal arterielle Hypertonie Diagnostik und neue Therapieansätze Michael Pfeifer Klinik Donaustauf Universität Regensburg Klassifizierung der
Bayerische Internistenkongress 2008 Systemische Sklerose Pulmonal arterielle Hypertonie Diagnostik und neue Therapieansätze Michael Pfeifer Klinik Donaustauf Universität Regensburg Klassifizierung der
Gebrauchsinformation: Informationen für den Anwender. Lora-ADGC. Wirkstoff: Loratadin 10 mg, Tabletten
 Gebrauchsinformation: Informationen für den Anwender Lora-ADGC Wirkstoff: Loratadin 10 mg, Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Gebrauchsinformation: Informationen für den Anwender Lora-ADGC Wirkstoff: Loratadin 10 mg, Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland
 Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
ACTELION KLINISCHE ENTWICKLUNG
 ACTELION KLINISCHE ENTWICKLUNG ENTWICKLUNGSPROZESS Actelion kann seiner Hauptaufgabe, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der
ACTELION KLINISCHE ENTWICKLUNG ENTWICKLUNGSPROZESS Actelion kann seiner Hauptaufgabe, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der
Therapie digitaler Ulzerationen bei systemischer Sklerose mit Bosentan: Die RAPIDS-Studien (RAPIDS-1 und 2)
 Therapie digitaler Ulzerationen bei systemischer Sklerose mit Bosentan: Die RAPIDS-Studien (RAPIDS-1 und 2) Prof. Dr. med. Bernhard Hellmich Epidemiologie und Pathogenese digitaler Ulzerationen Hamburg
Therapie digitaler Ulzerationen bei systemischer Sklerose mit Bosentan: Die RAPIDS-Studien (RAPIDS-1 und 2) Prof. Dr. med. Bernhard Hellmich Epidemiologie und Pathogenese digitaler Ulzerationen Hamburg
internationalen SAiL Studie, in der die Sicherheit und Wirksamkeit des VEGF Antikörpers in der täglichen Routine analysiert werden.
 DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
Marcumar? Gibt es da nichts anderes? Dr. S. Cicek-Hartvig
 Marcumar? Gibt es da nichts anderes? Dr. S. Cicek-Hartvig Schlaganfall bei VHF ist vermeidbar 2/3 derschlaganfälleaufgrund von VHF sindmitangemessenerantikoagul ationmitmarcumar(inr 2-3) 1 VKA-Auswirkungen
Marcumar? Gibt es da nichts anderes? Dr. S. Cicek-Hartvig Schlaganfall bei VHF ist vermeidbar 2/3 derschlaganfälleaufgrund von VHF sindmitangemessenerantikoagul ationmitmarcumar(inr 2-3) 1 VKA-Auswirkungen
Medienmitteilung. Basel, 22. Oktober 2013
 Medienmitteilung Basel, 22. Oktober 2013 Roche erhält FDA-Zulassung der neuen subkutanen Darreichungsform von ACTEMRA für erwachsene Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis
Medienmitteilung Basel, 22. Oktober 2013 Roche erhält FDA-Zulassung der neuen subkutanen Darreichungsform von ACTEMRA für erwachsene Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Wirksamkeit und Sicherheit von Thalidomid in der primären Therapie des multiplen Myeloms
 AMB 2006, 40, 89 Wirksamkeit und Sicherheit von Thalidomid in der primären Therapie des multiplen Myeloms Mit Thalidomid, Lenalidomid und Bortezomib (Velcade ) stehen inzwischen neue Wirkstoffe für die
AMB 2006, 40, 89 Wirksamkeit und Sicherheit von Thalidomid in der primären Therapie des multiplen Myeloms Mit Thalidomid, Lenalidomid und Bortezomib (Velcade ) stehen inzwischen neue Wirkstoffe für die
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
Beginn der Behandlung mit Uptravi
 Die europäischen Gesundheitsbehörden haben bestimmte Bedingungen an die Vermarktung des Arzneimittels Uptravi geknüpft. Die vorliegenden Informationen sind Bestandteil des obligatorischen belgischen Risikomanagementplans
Die europäischen Gesundheitsbehörden haben bestimmte Bedingungen an die Vermarktung des Arzneimittels Uptravi geknüpft. Die vorliegenden Informationen sind Bestandteil des obligatorischen belgischen Risikomanagementplans
Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen
 Monotherapie bipolar affektiver Störung Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen Bonn (8. März 2010) Mit der Zulassung von Seroquel Prolong (Quetiapin) zur Phasenprophylaxe
Monotherapie bipolar affektiver Störung Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen Bonn (8. März 2010) Mit der Zulassung von Seroquel Prolong (Quetiapin) zur Phasenprophylaxe
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
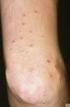 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Actelion gibt herausragende Performance für 2016 bekannt
 Page 1 of 10 Medienmitteilung 14. Februar 2017 Actelion gibt herausragende Performance für 2016 bekannt ALLSCHWIL/BASEL, SCHWEIZ 14. Februar 2017 Actelion Ltd (SIX: ATLN) gab heute die Ergebnisse für das
Page 1 of 10 Medienmitteilung 14. Februar 2017 Actelion gibt herausragende Performance für 2016 bekannt ALLSCHWIL/BASEL, SCHWEIZ 14. Februar 2017 Actelion Ltd (SIX: ATLN) gab heute die Ergebnisse für das
Filmtabletten. Titrationsleitfaden. Beginn der Therapie mit Uptravi
 Filmtabletten Titrationsleitfaden Beginn der Therapie mit Uptravi Bitte lesen Sie vor Beginn der Therapie die beigefügte Gebrauchsinformation. Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Filmtabletten Titrationsleitfaden Beginn der Therapie mit Uptravi Bitte lesen Sie vor Beginn der Therapie die beigefügte Gebrauchsinformation. Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
PACKUNGBEILAGE: INFORMATIONEN FÜR DEN ANWENDER. Broncho-Pectoralis Carbocystein 250 mg/ 5 ml Sirup Carbocystein
 PACKUNGBEILAGE: INFORMATIONEN FÜR DEN ANWENDER Broncho-Pectoralis Carbocystein 250 mg/ 5 ml Sirup Carbocystein Lesen Sie sich die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
PACKUNGBEILAGE: INFORMATIONEN FÜR DEN ANWENDER Broncho-Pectoralis Carbocystein 250 mg/ 5 ml Sirup Carbocystein Lesen Sie sich die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Biogen Idec erhält europäische Zulassung für FAMPYRA
 Verbesserung der Gehfähigkeit für MS-Patienten Biogen Idec erhält europäische Zulassung für FAMPYRA Ismaning (26. Juli 2011) Die europäische Arzneimittelbehörde (EMA) hat Fampridin Retardtabletten (FAMPYRA
Verbesserung der Gehfähigkeit für MS-Patienten Biogen Idec erhält europäische Zulassung für FAMPYRA Ismaning (26. Juli 2011) Die europäische Arzneimittelbehörde (EMA) hat Fampridin Retardtabletten (FAMPYRA
Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien mit Riociguat
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien
Aktuelle Publikation im Chest-Journal Signifikant weniger kardiovaskuläre Ereignisse unter Roflumilast (Daxas )
 Aktuelle Publikation im Chest-Journal Signifikant weniger kardiovaskuläre Ereignisse unter Roflumilast (Daxas ) Berlin (6. Mai 2013) Eine Add-on-Therapie mit Roflumilast (Daxas ) kann positiven Einfluss
Aktuelle Publikation im Chest-Journal Signifikant weniger kardiovaskuläre Ereignisse unter Roflumilast (Daxas ) Berlin (6. Mai 2013) Eine Add-on-Therapie mit Roflumilast (Daxas ) kann positiven Einfluss
Therapie und Therapiemonitoring bei Kollagenose-assoziierter PAH
 Therapie und Therapiemonitoring bei Kollagenose-assoziierter PAH Dr. med. Keihan Ahmadi-Simab Hamburg (16. September 2010) - Pulmonal arterielle Hypertonie (PAH) ist eine der schwerwiegendsten Komplikationen
Therapie und Therapiemonitoring bei Kollagenose-assoziierter PAH Dr. med. Keihan Ahmadi-Simab Hamburg (16. September 2010) - Pulmonal arterielle Hypertonie (PAH) ist eine der schwerwiegendsten Komplikationen
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom
 Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
NOXAFIL (POSACONAZOL) ORALSUSPENSION IN DER EUROPÄISCHEN UNION ZUR BEHANDLUNG INVASIVER PILZINFEKTIONEN ZUGELASSEN
 NOXAFIL (POSACONAZOL) ORALSUSPENSION IN DER EUROPÄISCHEN UNION ZUR BEHANDLUNG INVASIVER PILZINFEKTIONEN ZUGELASSEN München, den 14. November 2005 Die Europäische Kommission hat NOXAFIL (Posaconazol) Oralsuspension
NOXAFIL (POSACONAZOL) ORALSUSPENSION IN DER EUROPÄISCHEN UNION ZUR BEHANDLUNG INVASIVER PILZINFEKTIONEN ZUGELASSEN München, den 14. November 2005 Die Europäische Kommission hat NOXAFIL (Posaconazol) Oralsuspension
Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestätigt
 Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestät Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin Bedeutung von Roflumilast
Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestät Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin Bedeutung von Roflumilast
Basiswissen OPSUMIT. Langzeitbehandlung der PAH FUTURE. FORWARD.
 Basiswissen OPSUMIT Langzeitbehandlung der PAH FUTURE. FORWARD. DYsPnoe - Hinweis Auf eine PulMonAl-ArTerielle HYPerTonie (PAH)? 1 Häufig Unspezifisch Unabhängiger Prognosefaktor für erhöhtes Sterblichkeitsrisiko
Basiswissen OPSUMIT Langzeitbehandlung der PAH FUTURE. FORWARD. DYsPnoe - Hinweis Auf eine PulMonAl-ArTerielle HYPerTonie (PAH)? 1 Häufig Unspezifisch Unabhängiger Prognosefaktor für erhöhtes Sterblichkeitsrisiko
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Früher Einsatz sichert protektive Wirkung von Tiotropium
 Früher Einsatz sichert protektive Wirkung von Tiotropium Mannheim (19. März 2009) Die chronisch obstruktive Lungenerkrankung (COPD) hat große Auswirkungen auf die Lebensqualität der betroffenen Patienten.
Früher Einsatz sichert protektive Wirkung von Tiotropium Mannheim (19. März 2009) Die chronisch obstruktive Lungenerkrankung (COPD) hat große Auswirkungen auf die Lebensqualität der betroffenen Patienten.
Zielorientiertes Management der pulmo nalen Hypertonie - das individuelle Patientenziel im Fokus
 8. Deutsches P(A)H-Forum: Zielorientiertes Management der pulmo nalen Hypertonie - das individuelle P 8. Deutsches P(A)H-Forum Zielorientiertes Management der pulmo nalen Hypertonie - das individuelle
8. Deutsches P(A)H-Forum: Zielorientiertes Management der pulmo nalen Hypertonie - das individuelle P 8. Deutsches P(A)H-Forum Zielorientiertes Management der pulmo nalen Hypertonie - das individuelle
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Zavesca (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome bei Patienten mit Niemann-Pick Typ C
 Zavesca (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome be Zavesca (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome bei Patienten
Zavesca (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome be Zavesca (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome bei Patienten
DR. ARZT MUSTER MEIN TEAM MEIN TEAM. Ich freue mich, dass Sie meine Ordination gewählt haben. Herzlich willkommen in meiner Ordination!
 1 DR. ARZT MUSTER Facharzt für Neurologie und Psychiatrie 2 Herzlich willkommen in meiner Ordination! Ich freue mich, dass Sie meine Ordination gewählt haben. 3 4 Dr. Arzt Muster MEIN TEAM MEIN TEAM Medizinstudium
1 DR. ARZT MUSTER Facharzt für Neurologie und Psychiatrie 2 Herzlich willkommen in meiner Ordination! Ich freue mich, dass Sie meine Ordination gewählt haben. 3 4 Dr. Arzt Muster MEIN TEAM MEIN TEAM Medizinstudium
WERTSCHÖPFUNG AUF DIE ACTELION ART
 WERTSCHÖPFUNG AUF DIE ART CORPORATE GOVERNANCE UND CSR REPORT VERGÜTUNGSBERICHT FINANZBERICHT Geschäftsbericht 2014 WERTSCHÖPFUNG AUF DIE ART DIES IST EIN INTERAKTIVES PDF - DRÜCKEN, UM ZU BEGINNEN www.actelion.com
WERTSCHÖPFUNG AUF DIE ART CORPORATE GOVERNANCE UND CSR REPORT VERGÜTUNGSBERICHT FINANZBERICHT Geschäftsbericht 2014 WERTSCHÖPFUNG AUF DIE ART DIES IST EIN INTERAKTIVES PDF - DRÜCKEN, UM ZU BEGINNEN www.actelion.com
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 04.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 04.11.2015 Kontakt: Mag. Rudolf
Worum ging es in dieser Studie? Warum war die Studie notwendig? Welche Medikamente wurden untersucht? BI
 Hierbei handelt es sich um eine Zusammenfassung einer klinischen Studie mit Patienten, die an idiopatischer Lungenfibrose, einer seltenen Lungenerkrankung, leiden. Sie wurde für die breite Öffentlichkeit
Hierbei handelt es sich um eine Zusammenfassung einer klinischen Studie mit Patienten, die an idiopatischer Lungenfibrose, einer seltenen Lungenerkrankung, leiden. Sie wurde für die breite Öffentlichkeit
Phase-II-Studie. VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration: Nachhaltige Sehkraftverbes
 VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose
 Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose Wiesbaden (29. September 2011) - Fampridin (Fampyra ) ist seit Juli dieses Jahres zur Behandlung von erwachsenen Patienten mit
Fampyra Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose Wiesbaden (29. September 2011) - Fampridin (Fampyra ) ist seit Juli dieses Jahres zur Behandlung von erwachsenen Patienten mit
mit symptomatischen Knochenmetastasen beim CRPC
 Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC
 SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
DAUER DER STUDIE: Läuft seit Nov mindestens bis 2017.
 KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
ANHANG NEBENWIRKUNGEN
 ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen
 Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
TOP Papers Innere Medizin / Intensivmedizin. Martin J. Hug Apotheke des Universitätsklinikums Freiburg
 TOP Papers 2013 Innere Medizin / Intensivmedizin Martin J. Hug Apotheke des Universitätsklinikums Freiburg Einsatz von Hypnotika am UKF 40% 35% Anteil aller Patienten 30% 25% 20% 15% 10% 10,99% 23,07%
TOP Papers 2013 Innere Medizin / Intensivmedizin Martin J. Hug Apotheke des Universitätsklinikums Freiburg Einsatz von Hypnotika am UKF 40% 35% Anteil aller Patienten 30% 25% 20% 15% 10% 10,99% 23,07%
PACKUNGSBEILAGE 1. WAS IST DAFALGAN UND IN WELCHEM FALL WIRD ES VERWENDET?
 PACKUNGSBEILAGE Bitte lesen Sie diese Gebrauchsinformation aufmerksam durch, bevor Sie dieses Medikament verabreichen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn Sie andere Fragen oder
PACKUNGSBEILAGE Bitte lesen Sie diese Gebrauchsinformation aufmerksam durch, bevor Sie dieses Medikament verabreichen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn Sie andere Fragen oder
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Dacogen zur Therapie der Akuten Myeloischen Leukämie
 Epigenetische Behandlungsoption Dacogen zur Therapie der Akuten Myeloischen Leukämie München (20. Februar 2017) - Der epigenetisch wirkende DNA-Methyltransferase-Inhibitor Decitabin (Dacogen ) stellt seit
Epigenetische Behandlungsoption Dacogen zur Therapie der Akuten Myeloischen Leukämie München (20. Februar 2017) - Der epigenetisch wirkende DNA-Methyltransferase-Inhibitor Decitabin (Dacogen ) stellt seit
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
MabThera SC erhält positives CHMP-Votum für die Therapie von Non-Hodgkin-Lymphomen
 Zulassungsempfehlung MabThera SC erhält positives CHMP-Votum für die Therapie von Non-Hodgkin-Lymphomen Grenzach-Wyhlen (27. Januar 2014) - Der wissenschaftliche Ausschuss für Humanarzneimittel (CHMP)
Zulassungsempfehlung MabThera SC erhält positives CHMP-Votum für die Therapie von Non-Hodgkin-Lymphomen Grenzach-Wyhlen (27. Januar 2014) - Der wissenschaftliche Ausschuss für Humanarzneimittel (CHMP)
Dossierbewertung A15-15 Version 1.0 Insulin degludec/liraglutid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
Bundesministerium für Gesundheit
 Bundesministerium für Gesundheit Bekanntmachung [1053 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie in Anlage 13: Verordnung besonderer Arzneimittel
Bundesministerium für Gesundheit Bekanntmachung [1053 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie in Anlage 13: Verordnung besonderer Arzneimittel
Stand: Besondere Arzneimittel. Inhaltsverzeichnis: Bosentan. Iloprost zur Inhalation. Sildenafil. Sitaxentan.
 Anlage XI zum Abschnitt N der Arzneimittel-Richtlinie Verordnung besonderer Arzneimittel (Verfahren zur Verordnung besonderer Arzneimittel nach 73d SGB V) Besondere Arzneimittel Inhaltsverzeichnis: Bosentan
Anlage XI zum Abschnitt N der Arzneimittel-Richtlinie Verordnung besonderer Arzneimittel (Verfahren zur Verordnung besonderer Arzneimittel nach 73d SGB V) Besondere Arzneimittel Inhaltsverzeichnis: Bosentan
Pulmonale Hypertonie. Patricia Demont, Pneumologie
 Pulmonale Hypertonie Patricia Demont, Pneumologie Begriff der pulmonalen Hypertonie Keine Diagnose, beschreibt ein hämodynamischer Zustand Pulmonal arterieller Mitteldruck (PAPm) 25mmHg in Ruhe Norm: 14mmHg
Pulmonale Hypertonie Patricia Demont, Pneumologie Begriff der pulmonalen Hypertonie Keine Diagnose, beschreibt ein hämodynamischer Zustand Pulmonal arterieller Mitteldruck (PAPm) 25mmHg in Ruhe Norm: 14mmHg
Bewährte Therapien, neue Optionen
 Behandlung der Migräne Bewährte Therapien, neue Optionen Hamburg/Berlin (27. September 2012) In Deutschland leiden über 10 Millionen Menschen unter Migräne. Somit gehört die Migräne zu den häufigsten Gesundheitsproblemen,
Behandlung der Migräne Bewährte Therapien, neue Optionen Hamburg/Berlin (27. September 2012) In Deutschland leiden über 10 Millionen Menschen unter Migräne. Somit gehört die Migräne zu den häufigsten Gesundheitsproblemen,
Prüfmedikamente von Roche für Patienten mit spinaler Muskelatrophie (SMA)
 Prüfmedikamente von Roche für Patienten mit spinaler Muskelatrophie (SMA) SMA Schweiz Tag Nottwil - 13. May 2017 Dominik Kraus - Clinical Scientist Specialist Rare Diseases SMA betrifft den ganzen Körper
Prüfmedikamente von Roche für Patienten mit spinaler Muskelatrophie (SMA) SMA Schweiz Tag Nottwil - 13. May 2017 Dominik Kraus - Clinical Scientist Specialist Rare Diseases SMA betrifft den ganzen Körper
Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg
 Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg Fampyra Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfügbar
Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg Fampyra Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfügbar
Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg
 Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg Fampyra Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfügbar
Fampyra : Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfüg Fampyra Erstes Medikament zur Verbesserung der Gehfähigkeit bei Multipler Sklerose ab sofort verfügbar
ACTELION KLINISCHE ENTWICKLUNG
 ACTELION KLINISCHE ENTWICKLUNG ENTWICKLUNGSPROZESS Actelion kann seiner Hauptaufgabe, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der
ACTELION KLINISCHE ENTWICKLUNG ENTWICKLUNGSPROZESS Actelion kann seiner Hauptaufgabe, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der
KLINISCHE ENTWICKLUNG BEI ACTELION
 KLINISCHE ENTWICKLUNG BEI ACTELION ENTWICKLUNGSPROZESS Actelion kann seinen Auftrag, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der Produkte-
KLINISCHE ENTWICKLUNG BEI ACTELION ENTWICKLUNGSPROZESS Actelion kann seinen Auftrag, Patienten innovative Medikamente zur Verfügung zu stellen, nur durch eine umfassende Prüfung der Wirkstoffe in der Produkte-
Patienten können von früherem Behandlungsbeginn profitieren
 Morbus Parkinson Patienten können von früherem Behandlungsbeginn profitieren Düsseldorf (24. September 2015) - Erhaltung der Selbstständigkeit in den Aktivitäten des täglichen Lebens (ADL) und der gesundheitsbezogenen
Morbus Parkinson Patienten können von früherem Behandlungsbeginn profitieren Düsseldorf (24. September 2015) - Erhaltung der Selbstständigkeit in den Aktivitäten des täglichen Lebens (ADL) und der gesundheitsbezogenen
Perjeta für die neoadjuvante Therapie zugelassen
 HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
Periphere neuropathische Schmerzen: Topische Therapie mit QutenzaTM gewinnt weiter an Bedeutung
 Periphere neuropathische Schmerzen Topische Therapie mit Qutenza TM gewinnt weiter an Bedeutung Mannheim (16. Oktober 2015) - Auf einer Pressekonferenz im Rahmen des deutschen Schmerzkongresses referierten
Periphere neuropathische Schmerzen Topische Therapie mit Qutenza TM gewinnt weiter an Bedeutung Mannheim (16. Oktober 2015) - Auf einer Pressekonferenz im Rahmen des deutschen Schmerzkongresses referierten
Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen
 Blutzuckerkontrolle Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen Mainz (27. April 2010) Die erste direkte Vergleichsstudie eines GLP-1-Analogons mit einem DPP-IV-Inhibitor
Blutzuckerkontrolle Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen Mainz (27. April 2010) Die erste direkte Vergleichsstudie eines GLP-1-Analogons mit einem DPP-IV-Inhibitor
Bewertung relevanter pharmakodynamischer Interaktionen von Antidiabetika
 46. Jahrestagung Deutsche-Diabetes Diabetes- Gesellschaft 01.- 04. Juni 2011, Leipzig Bewertung relevanter pharmakodynamischer Interaktionen von Antidiabetika Dr. Nina Griese Zentrum für Arzneimittelinformation
46. Jahrestagung Deutsche-Diabetes Diabetes- Gesellschaft 01.- 04. Juni 2011, Leipzig Bewertung relevanter pharmakodynamischer Interaktionen von Antidiabetika Dr. Nina Griese Zentrum für Arzneimittelinformation
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Tragende Gründe. Vom 6. April 2017
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Kein Hand-Fuß-Syndrom unter Behandlung mit UFT (Tegafur Uracil)
 ESMO: Kein Hand-Fuß-Syndrom unter Behandlung mit UFT (Tegafur Uracil) Darmstadt (8. Oktober 2008) Auf der 33. Jahrestagung der European Society for Medical Oncology (ESMO) wurden die Ergebnisse einer Untersuchung
ESMO: Kein Hand-Fuß-Syndrom unter Behandlung mit UFT (Tegafur Uracil) Darmstadt (8. Oktober 2008) Auf der 33. Jahrestagung der European Society for Medical Oncology (ESMO) wurden die Ergebnisse einer Untersuchung
Ibuprofen zur trans-dermalen Anwendung als Pflaster
 Ibuprofen zur trans-dermalen Anwendung als Pflaster Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Antrag
Ibuprofen zur trans-dermalen Anwendung als Pflaster Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Antrag
V o t en. Sachverständigen-Ausschusses für Verschreibungspflicht nach 53 AMG
 ANLAGE 1 Bundesinstitut für Arzneimittel und Medizinprodukte V o t en des Sachverständigen-Ausschusses für Verschreibungspflicht nach 53 AMG 64. Sitzung, 12.01.2010 zu Positionen, deren Änderung abgestimmt
ANLAGE 1 Bundesinstitut für Arzneimittel und Medizinprodukte V o t en des Sachverständigen-Ausschusses für Verschreibungspflicht nach 53 AMG 64. Sitzung, 12.01.2010 zu Positionen, deren Änderung abgestimmt
GEBRAUCHSINFORMATION FÜR
 GEBRAUCHSINFORMATION FÜR NexGard 11 mg Kautabletten für Hunde 2-4 kg NexGard 28 mg Kautabletten für Hunde >4-10 kg NexGard 68 mg Kautabletten für Hunde >10-25 kg NexGard 136 mg Kautabletten für Hunde >25-50
GEBRAUCHSINFORMATION FÜR NexGard 11 mg Kautabletten für Hunde 2-4 kg NexGard 28 mg Kautabletten für Hunde >4-10 kg NexGard 68 mg Kautabletten für Hunde >10-25 kg NexGard 136 mg Kautabletten für Hunde >25-50
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
