3.2. Säure - Base-Gleichgewichte
|
|
|
- Andrea Magdalena Sauer
- vor 7 Jahren
- Abrufe
Transkript
1 .. äure BaseGleichgewichte..0. Wiederholung einiger Grundbegriffe (siehe.0.) äurebasereaktionen erstellung von äuren und Basen aus xiden Neutralisation und Maßanalyse Übungen: Aufgaben zu äurebasereaktionen Nr.... trukturformeln einiger äuren. alpetersäure: N N N N N N N owohl das alpetersäuremolekül als auch das NitratIon sind mesomeriestabilisiert mit sp hybridisiertem tickstoff: Mesomerie Viele in der Natur vorkommende Moleküle sind stabil, obwohl sich keine trukturformel angeben lässt, die für jedes Atom die ktettregel erfüllt. Man erklärt dieses Phänomen mit der Vorstellung, dass sich die Elektronenwolke zweier Bindungselektronen auch über drei oder vier Atome ausdehnen kann und dadurch die Edelgaskonfiguration mehrerer Atome zumindest teilweise erfüllen kann. In der trukturformel stellt man diese über mehrere Atome delokalisierten Bindungselektronen durch mesomere Grenzformeln dar. Jede Grenzformel gibt einen möglichen Aufenthaltsort für die beiden delokalisierten Bindungselektronen an. Der tatsächliche Aufenthaltsort liegt dann irgendwo zwischen diesen mögliche Grenzstrukturen. Um das chemische Verhalten des Moleküls beurteilen zu können, versucht man zunächst klären, welche der möglichen Grenzstrukturen der tatsächlichen Elektronenverteilung am nächsten kommt. Eine Grenzform ist stabil und kommt der wirklichen Verteilung am nächsten, wenn Die Anzahl der Bindungen möglichst groß ist Die Anzahl der formalen Ladungen möglichst klein ist Die negative Ladung beim elektronegativeren Atom liegt. Kohlensäure:. Protolysestufe: C C NitratIon ydroxoniumion C C C ydrogencarbonation ydroxoniumion. Protolysestufe: C C C C C C C ydrogencarbonation CarbonatIon
2 Mehrprotonige äuren und Ampholyte Bei mehrprotonigen äuren wird die Bereitschaft zur Abgabe weiterer Protonen mit jedem verlorenen Proton geringer bzw. die übrigen Protonen werden immer fester gebunden. Das Gleichgewicht verschiebt sich bei jeder Protolysestufe weiter nach links. Das ydrogencarbonation kann sowohl als Base als auch als äure mit Wasser reagieren: Als Base: C C Als äure: C C toffe, die sowohl als Base als auch als äure reagieren können, nennt man Ampholyte.. chwefelsäure:. Protolysestufe: 4 4 ydrogensulfation ydroxoniumion. Protolysestufe: 4 4 ydrogensulfation ulfation chwefelsäure, ydrogensulfation und ulfation mit dsp hybridisiertem chwefelatom und Bindungselektronen erreichen keine Edelgaskonfiguration! 4. Phosphorsäure:. Protolysestufe: P 4 P 4 P P P DihydrogenphosphatIon ydroxoniumion. Protolysestufe: P 4 P 4 (ydrogenphosphation). Protolysestufe: P 4 P 4 (PhosphatIon) Phosphorsäuremolekül und die Dihydrogenphosphation mit dsp hybridisiertem Phosphoratom und 0 Bindungselektronen erreichen ebenfalls keine Edelgaskonfiguration, sind aber trotzdem stabil! 5. Essigsäure: C C C C C C C C C C AcetatIon Das AcetatIon ist mesomeriestabilisiert mit sp hybridisiertem Kohlenstoff ydroxoniumion
3 6. ydroxoniumion: Das ydroxoniumion selbst lässt sich ebenfalls als sehr starke äure betrachten. Da sich Produkte und Edukte nicht unterscheiden, ist diese Reaktion nur über die Leitfähigkeit nachzuweisen. Die extrem hohe Leitfähigkeit von sauren Lösungen ist nicht mit der Wanderung der wenigen vorhandenen ydroxoniumionen zu erklären. Die ydroxoniumionen geben stattdessen nur ihr Proton an das benachbarte Wassermolekül ab. Das Proton springt von einem Wassermolekül zum nächsten und ermöglicht so einen schnellen tromfluß.... Das Ionenprodukt des Wassers und der pwert Wasser ist ein Ampholyt: Mit äuren reagiert es als Base: A A Mit Basen reagiert es als äure: B B Autoprotolyse des Wassers Da auch destilliertes Wasser eine geringe Leitfähigkeit zeigt und also Ionen enthalten muss, reagieren Wassermoleküle offensichtlich auch miteinander als äure und Basen. Dabei entstehen ydroxoniumionen und ydroxidionen in gleichen Mengen: endotherme Autoprotolyse mit exotherme Neutralisation Base äure äure Base [ ] =, In heißem Wasser wird die Eigenprotolyse begünstigt, daher hat Wasser bei einer Temperatur von 90 C einen pwert von ungefähr 6. (Prinzip vom kleinsten Zwang) Das Ionenprodukt des Wassers Infolge der Autoprotolyse enthält jede (saure, neutrale oder basische) wässrige Lösung sowohl ydroxidionen als auch ydroxoniumionen. Da auch in recht stark sauren Lösungen weniger als % der Wassermoleküle als Ionen vorliegen, ist die Konzentration der Wassermoleküle aber trotzdem nahezu konstant: 000 g 55,6 mol [ ] = = = 55,6 mol/l Liter Liter Um die Konzentrationen dieser Ionen besser abschätzen zu können, vereinfacht man das MWG durch Multiplikation mit dem Nenner [ ] = 09,6 mol /L : =, [ ] [ ] [ ] = 0 4 mol /L Einheiten weggelassen [ ] [ ] = 0 4 Mit dieser Gleichung (dem Ionenprodukt des Wassers) lässt sich [ ] berechnen, wenn [ ] bekannt ist und umgekehrt. Man erkennt, dass es i.a. genügt, die Exponenten zu betrachten: Die umme der negativen ochzahlen muss 4 sein. Aus diesem Grund gibt man anstelle der vollständigen Konzentration [ ] oder [ ] in mol/l meist nur die negative ochzahl des Zahlenwertes an: Der pwert bzw. pwert einer Lösung ist der negative dekadische Logarithmus der in mol/l angegebenen Konzentration der ydroxoniumionen bzw. ydroxidionen: [ ] = 0 p bzw. log[ ] = p. [ ] = 0 p bzw. log[ ] = p. Je kleiner der pwert bzw. pwert, desto größer ist [ ] bzw. [ ]
4 Ionenprodukt des Wassers [ ] [ ] = 0 4 bzw. p p = 4 In destilliertem Wasser ist [ ] = [ ] = 0 7, d.h. p < 7 saure Lösung p = 7 neutrale Lösung p > 7 basische Lösung Übungen: Aufgaben zu äurebasereaktionen Nr Die tärke von äuren und Basen Das MWG für die Protolyse einer äure oder Base in Wasser lässt sich durch Multiplikation mit der annähernd konstanten Konzentration [ ] = 55,6 mol/l vereinfachen (vgl. Autoprotolyse des Wassers): äure A: Base B : A A B B A [ B] = K [ ] = K [ ] [ A][ ] B A [ B] = K = K B [ A] B Die äurekonstante K und die Basekonstante K B sind ein Maß für die tärke einer äure oder Base. Je größer K bzw. K B, desto stärker liegt das GGW auf der rechten eite und desto mehr bzw. Ionen liegen in der Lösung vor. Beispiel: Man stellt drei saure Lösungen her: 0, m Cl mit K 0 6 (p = ) 0, m P 4 mit K =, 0 (. Protolysestufe) (p = ) 0, m C C mit K =, (p = ) Welche der drei Lösungen hat den kleinsten pwert? Antwort: Die äure mit dem größten K Wert bildet die meisten Ionen und hat daher den geringsten pwert. Da K und K B meist sehr klein sind und sich um viele Zehnerpotenzen unterscheiden können, beschränkt man sich wie beim pwert auf die Angabe des negativen Exponenten: pk und pk B Werte Der pk (pk B ) Wert ist der negative dekadische Logarithmus des Zahlenwertes der äurenkonstanten K (Basenkonstanten K B ): K = 0 pks bzw. logk = pk. K B = 0 pkb bzw. logk B = pk B. Je kleiner der pk Wert (pk B Wert), desto größer ist K (K B ) und desto stärker ist die äure A (die Base B ) pk und pk B bei korrspondierenden äurebasepaaren owohl die äure A als auch die korrespondierende Base A können mit Wasser reagieren: A A A A A [ A] = K = K B [ A] A Multipliziert man die beiden Konstanten, so erhält man das Ionenprodukt des Wassers: A K K B = A [ A] A [ ] [ ] = 0 4 4
5 Es gilt also der gleiche Zusammenhang wie bei pwert und pwert: pk und pk B bei korrspondierenden äurebasepaaren Für die äurekonstante einer äure A und die Basekonstante ihrer korrepondierenden Base A gilt K K B = 0 4 bzw. pk pk B = 4 Je stärker die äure A, desto schwächer ist die korrespondierende Base A und umgekehrt. Übungen: Aufgaben zu äurebasereaktionen Nr Berechnung von pwerten pwerte von wäßrigen Lösungen starker äuren und Basen (pk < 0) Eine starke äure A reagiert nahezu vollständig mit Wasser, so daß die Konzentration [ ] der gebildeten Ionen nahezu der Konzentration c 0 der ursprünglich zugegebenen äure entspricht. Entsprechendes gilt für starke Basen, insbesondere alle Metallhydroxide: tarke äure A mit pk < 0 und Anfangskonzentration c 0 A A läuft nahezu vollständig ab [ ] = c 0 bzw. p = log c 0 tarke Base B mit pk B < 0 und Anfangskonzentration c 0 : B B läuft nahezu vollständig ab [ ] = c 0 bzw. p = log c 0 Beispiele: In einer 0,0 m alpetersäure ist [ ] = c 0 = 0,0 mol/l = 0 mol/l p = und p = 4 = In einer 0, m Kalilauge ist [ ] = c 0 = 0, mol/l = 0 mol/l p = und p = 4 = Übungen: Aufgaben zu äurebasereaktionen Nr. 7 pwerte von wässrigen Lösungen schwacher äuren und Basen (pk > 0) chwache äure: A A läuft nur in geringem Maße ab [A] = c 0 und [ ] = [A ] chwache Base: B B läuft nur in geringem Maße ab [B ] = c 0 und [ ] = [B] Die durch Autoprotolyse gebildeteten Ionen können vernachlässigt werden. Durch Einsetzen in das MWG erhält man A [ B] = K = K B Einsetzen [ A] B = K = K B c 0 ; c c 0 [ ] = K c0 [ ] = KB c0 pwerte schwacher äuren und Basen (pk > 0) In einer wäßrigen Lösung einer schwachen äure A mit pk > 0 und Anfangskonzentration c 0 ist [ ] = K c0 bzw. p = (pk log c 0 ) In einer wäßrige Lösung einer schwachen Base B mit pk B > 0 und Anfangskonzentration c 0 ist [ ] = KB c0 bzw. p = (pkb log c 0 ) 0 Bemerkung: schwache äuren und Basen treten oft als Anionen oder Kationen von alzen auf: Beispiel: Das CarbonatIon C lässt sich nur in Lösung bringen, wenn es in Verbindung mit einem Kation wie z.b. Na, K oder Mg vorliegt. Bei der erstellung einer 0, m KaliumcarbonatLösung (K C ) löst sich das alz zunächst auf: K C (fest) K (gel) C (aq). Die K Ionen können keine Protonen aufnehmen (und erst recht keine abgeben!) und haben daher keinen Einfluß auf den pwert. Die CarbonatAnionen dagegen nehmen Protonen vom Wasser auf: C C mit pk B =,60. p = (pkb log c 0 ) = (,60 ) =,0 p = 4,0 =,70. 5
6 weitere Beispiele: In einer 0,0 m Methansäure C ist p = (,70 ) =,85 In einer 0,0 m NatriumformiatLösung CNa ist p = (0,0 ) = 6, p = 4 6, = 7,88 In einer 0, m Ammoniaklauge N ist p = (4,75 ) =,87 p = 4,87 =, In einer 0, m Ammoniumchloridlösung N 4 Cl ist p = (9,5 ) = 5, Übungen: Aufgaben zu äurebasereaktionen Nr. 8 pwerte von Pufferlösungen In einer Pufferlösung sind eine schwache äure A und ihre korrespondierende schwache Base A in ungefähr gleichen Anteilen enthalten. Zusätzlich hinzugefügte Ionen bzw. Ionen werden dann durch A bzw. A abgefangen, so dass der pwert nahezu erhalten bleibt: Abfangen der Ionen: A A Abfangen der Ionen: A A aus der schwachen äure A und ihrer schwachen Base A berechnet sich dann nach dem MWG: A = K [A]; :[A ] A [ ] = K [ A] A A A p = pk log log (Puffergleichung) Übungen: pwerte von alzsäure pwerte von Natronlauge Neutralisation von alzsäure Neutralisation von Essigsäure..5. Neutralisationskurve und Puffergleichgewichte der Kohlensäure Neutralisation von 00 ml einer 0,molaren Kohlensäure mit molarer Natronlauge p ml Na
7 Anfangspunkt: zugegebene C C 0 ~ 0 mmol ~ 0 mmol 0 C 0, molare Kohlensäure: Durch die. Protolysestufe C C mit pk = 6,5 ist p = (pk log c 0 ) =,76 Wegen pk = 6,5 bzw. K = 0 6,5 =,0 0 7 reagiert nur ein sehr geringer Teil der 0 mmol C mit Wasser zu C und. Der Bestand von ~ 0 mmol C und ~ 0 mmol C ändert sich dadurch kaum. Die wenigen dabei freigesetzten ~ 0 4 mmol/ml fallen jedoch im Verhältnis zu den durch die Autoprotolyse des Wassers freigesetzten 0 7 mmol/ml sehr wohl ins Gewicht und führen zu dem sauren pwert. Bei der. Protolysestufe mit pk = 0,40 liegt das Gleichgewicht noch viel weiter auf der eite der Edukte, so dass sie gegenüber der. Protolysestufe vernachlässigt werden kann!. Pufferpunkt: zugegebene C C 5 mmol ~ 5 mmol ~ 5 mmol 0 C Durch Zugabe von 5 mmol wird die. Protolysestufe zu 50% neutralisiert: 5 mmol C 5 mmol 5 mmol C 5 mmol 5 mmol C bleiben übrig. Man erhält also einen ydrogencarbonatpuffer mit p = pk = 6,5 Die Neutralisation der äure C durch ihre korrespondierede Base C hat keinen Einfluß auf den p Wert: C C C C. Der pwert ergibt sich allein aus der Reaktion von C mit Wasser!. Äquivalenzpunkt zugegebene C C C 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol Nach Zugabe von insgesamt 0 mmol ist die. Protolysestufe 00 % neutralisiert. Man erhält eine 0, molare ydrogencarbonatlösung. Der pwert ergibt sich durch die Reaktion des Ampholyten C mit Wasser und die Autoprotolyse: als äure mit Wasser: C C mit pk = 0,40 als Base mit Wasser: C C mit pk B = 4 pk = 7,48 Autoprotolyse: C C C C mit pk A = pk pk =,88, denn K A = C C [ C] C = K = C C C K. Die Konzentration von C und C wird also im wesentlichen von der Autoprotolyse bestimmt: [C ] = [ C ]. Der pwert ergibt sich mit ilfe dieser Näherung aus dem MWG für die beiden Reaktionen mit Wasser: C K K B = [ C] K C C K B C K K = C [C C C ] = [ C ] K K = [ ], also p = (pk pk ) = 8,46 7
8 Auch hier lässt sich aus den großen pkwerten entnehmen, dass das Gleichgewicht bei beiden Reaktionen stark auf der eite der Edukte liegt, d.h., von den 0 mmol C wird nur ein vernachlässigbar geringer Anteil wieder in C oder C umgesetzt. Die dabei entstandenen und Ionen fallen aber gegenüber den durch das Wasser freigesetzten 0 7 mmol/ml bzw. sehr viel mehr ins Gewicht und führen zu dem sauren pwert.. Pufferpunkt: C zugegebene C C 5 mmol ~ 0 mmol ~ 5 mmol ~ 5 mmol Durch Zugabe von weiteren 5 mmol wird die. Protolysestufe zu 50 % neutralisiert: 5 mmol C 5 mmol 5 mmol C. Man erhält einen Carbonatpuffer mit p = pk = 0,40 Die Neutralisation der äure C durch ihre korrespondierede Base C hat keinen Einfluß auf den p Wert: C C C C.Der pwert ergibt sich auch hier aus der Reaktion von C mit Wasser (s.o.).. Äquivalenzpunkt = Endpunkt C zugegebene C C 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol Nach Zugabe von insgesamt 0 mmol sind beide Protolysestufe zu 00 % neutralisiert und man erhält eine 0, molare Carbonatlösung Der pwert ergibt sich durch die Reaktion der schwachen Base C mit Wasser: C C mit pk B = 4 pk =,60. Man erhält also p = (pkb log c 0 ) =,0 p = 4,0 =,70 Zugabe von weiteren 0 ml m Na Die 0 ml 0, m Carbonatlösung mit p =,0 bzw. [ ] = 0,0 = 0,005 mmol/ml enthalten bereits 0,5 mmol Ionen. Durch Zugabe von weiteren 0 mmol erhält man insgesamt 0,5 mmol auf 0 ml, d.h., [ 0,5 mmol ] = = 0,08 mmol/ml und p = log 0,04 =,09 bzw. p = 4 p =,9 0 ml Carbonatpuffer Menschliches Blut enthält Kohlensäure C und Natriumhydrogencarbonat NaC in den Konzentrationen [C ] 4 mmol/l und [ C ], mmol/l. Die im Blut unter physiologischen Bedingungen vorliegende Kohlensäure hat einen geringeren pk Wert (pk = 6,) als die reine Kohlensäure (pk = 6,5). Durch das in den Zellen gebildete C kann nämlich C nachproduziert werden, wodurch sich das Protolysegleichgewicht etwas auf die rechte eite verschiebt: C C C Der pwert dieses Puffers ist also p = pk log [ C ] 4 = 6, log = 7,4., C und C Wird infolge eines toffwechselvorganges die Konzentration auf [ ] = 4 mmol/l erhöht, so reagiert die starke Base nahezu vollständig mit Kohlensäure zu Wasser und ydrogencarbonat. Die dabei verbrauchte Kohlensäure wird aber durch C sehr schnell wieder ersetzt, so daß nach kurzer Zeit wieder [ C ] =, mmol/l erreicht ist: 4 mmol C 4 mmol 4 mmol C 4 mmol C 4 mmol C 4 mmol. Die 4 mmol/l setzen sich vollständig zu 4 mmol/l C um, so dass die Gesamtkonzentration an ydrogencarbonat von [C ] = 4 mmol/l auf 8 mmol/l ansteigt. C 8 = 6, log = 7,47. C, Der neue pwert dieses Puffers ist also p = pk log 8
9 ..6. Neutralisationskurve und Puffergleichgewichte der Phosphorsäure Neutralisation von 00 ml einer 0,molaren Phosphorsäure mit molarer Natronlauge p ml Na Anfangspunkt: zugegebene P 4 P 4 P 4 0 ~ 0 mmol ~ 0 mmol 0 mmol 0 P 4 0, molare Phosphorsäure: Durch die. Protolysestufe P 4 P 4 mit pk =,96 ist p = (pk log c 0 ) =,48 Wegen pk =,96 bzw. K 0 = 0,0 reagiert nur ein sehr geringer Teil der 0 mmol P 4 mit Wasser zu P 4 und. Der Bestand von ~ 0 mmol P 4 und ~ 0 mmol P 4 ändert sich dadurch kaum. Die wenigen dabei freigesetzten ~ 0 mmol/ml fallen jedoch im Verhältnis zu den durch die Autoprotolyse des Wassers freigesetzten 0 7 mmol/ml sehr wohl ins Gewicht und führen zu dem sauren pwert. Bei den nachfolgenden Protolysestufen mit pk = 7, und pk =, liegt das Gleichgewicht noch viel weiter auf der eite der Edukte, so dass sie gegenüber der. Protolysestufe vernachlässigt werden können!. Pufferpunkt: zugegebene P 4 P 4 P 4 5 mmol ~ 5 mmol ~ 5 mmol 0 0 Durch Zugabe von 5 mmol wird die. Protolysestufe zu 50 % neutralisiert: P 4 5 mmol P 4 5 mmol 5 mmol P 4 5 mmol 5 mmol P 4 bleiben übrig. Man erhält also einen Dihydrogenphosphatpuffer mit p = pk =,96 Die Neutralisation der äure P 4 durch ihre korrespondierede Base P 4 hat keinen Einfluss auf den p Wert: P 4 P 4 P 4 P 4. Der pwert ergibt sich allein aus der Reaktion von P 4 mit Wasser! 9
10 . Äquivalenzpunkt P 4 zugegebene P 4 P 4 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol 0 P 4 Nach Zugabe von insgesamt 0 mmol ist die. Protolysestufe 00 % neutralisiert. Man erhält eine 0, molare Dihydrogenphosphatlösung. Der pwert ergibt sich durch die Reaktion des Ampholyten P 4 mit Wasser sowie die Autoprotolyse: als äure mit Wasser: P 4 P 4 mit pk = 7, als Base mit Wasser: P 4 P 4 mit pk B = 4 pk =,04 Autoprotolyse: P 4 P 4 P 4 P 4 mit pk A = pk pk = 5,6 Mit der Näherung [ P 4 ] = ]P 4 ] ergibt sich p = (pk pk ) = 4,58. Pufferpunkt: P 4 P 4 zugegebene P 4 P 4 5 mmol ~ 0 mmol ~ 5 mmol ~ 5 mmol ~ 0 mmol p = pk = 7,. Äquivalenzpunkt zugegebene P 4 P 4 P 4 P 4 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol p = (pk pk ) = 9,7. Pufferpunkt: zugegebene P 4 P 4 P 4 P 4 5 mmol ~ 0 mmol ~ 0 mmol ~ 5 mmol ~ 5 mmol p = pk =,. Äquivalenzpunkt = Endpunkt zugegebene P 4 P 4 P 4 P 4 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol ~ 0 mmol p = (pkb log c g ) =,4 p = 4,4 =,66. Zugabe von weiteren 0 ml m Na Die 0 ml 0, m Phosphatlösung mit p =,4 bzw. [ ] = 0,4 = 0,046 mmol/ml enthalten bereits 4,6 mmol Ionen. Durch Zugabe von weiteren 0 mmol erhält man insgesamt 4,6 mmol auf 40 ml, d.h., [ 4,6 mmol ] = = 0,04 mmol/ml und p = log 0,04 = 0,98 bzw. p = 4 p =,0. 40 ml Übungen: Aufgaben zu äurebasereaktionen Nr. 9 0
11 ..7. erstellung von Pufferlösungen zu gegebenem pwert Beispiel Acetatpuffer: Es sollen 000 ml eines Acetatpuffers mit p 4,5 und einer Gesamtkonzentration von c 0 = 0, mol/l hergestellt werden. Zur Verfügung stehen die folgenden Chemikalien: molare Essigsäure C C, molare Natriumacetatlösung C CNa, molare alzsäure Cl, molare Natronlauge Na und festes Natriumacetat C CNa Beschreibe drei Möglichkeiten, den gewünschten Puffer aus diesen Chemikalien herzustellen. Gib die erforderlichen toffmengen in g bzw. ml an und begründe. Lösung Damit insgesamt l 0, mol/l = 0, mol = 00 mmol äure und Base enthalten sind, müssen x mmol C C und 00 x mmol C C zugegeben werden. Außerdem ist pks = 4,75 und es soll p = 4,5 sein. Einsetzen ergibt CC Einsetzen C C p = pk log 00 x mmol 4,5 = 4,75 log 000 ml x mmol Kürzen 000 ml 4,5 = 4,75 log 00 x x 4,75 0,5 = log 00 x x 0 0 0,5 = 00 x x x; x (0 0,5 )x = 00 : (0 0,5 ) 00 x = 0,5 0 8 Man benötigt also x = 8 mmol äure C C und 00 x = 7 mmol Base C C. Für die praktische erstellung gibt es drei Möglichkeiten. Einfaches Zusammengeben der beiden Komponenten Man gibt 8 mmol C C = 8 ml m Essigsäure und 7 mmol = 5,9 g Natriumacetat C CNa in = 87 ml destilliertes Wasser.. Teilweise Neutralisation einer Ethansäurelösung vom Anfangspunkt bis zum gewünschten p Liter der molaren Essigsäurelösung werden mit 7 mmol = 7 ml m Na versetzt. Dadurch werden genau 7 mmol von insgesamt 00 mmol C C in C C umgewandelt. Man erhält dann 07 ml eines leicht verdünnten Puffers, dafür kommt man ohne Waage aus.. Teilweise Neutralisation einer Acetatlösung vom Äquivalenzpunkt bis zum gewünschten p Liter der molaren Natriumacetatlösung werden mit 8 mmol = 8 ml m Cl versetzt. Dadurch werden genau 8 mmol von insgesamt 00 mmol C C in C C umgewandelt. Man erhält dann 8 ml eines leicht verdünnten Puffers, dafür kommt man ohne Waage aus.
12 erstellung von Pufferlösungen zu gegebenem pwert, Gesamtkonzentration c 0 und Volumen V. Berechnung der erforderlichen toffmengen Man berechnet die insgesamt erforderliche toffmenge n 0 = c 0 V Man setzt x = toffmenge der Base A und n 0 x = toffmenge der äure A Man setzt den gewünschten p, den pkswert aus der Tabelle und das berechnete n 0 in die Puffergleichung n p = pk log 0 x ein und berechnet x. x. Praktische erstellung Man gibt direkt n 0 x mmol A (in Form einer konzentrierten Lösung) und x mmol Base A (i.d.r. in Form ihres alzes) in destilliertes Wasser mit dem Volumen V oder Man geht von einer Lösung des äure A mit der Konzentration c 0 und dem Volumen V aus und neutralisiert genau x mmol davon zur Base A durch Zugabe von x ml m Na oder Man geht von einer Lösung des äure A mit der Konzentration c 0 und dem Volumen V aus und neutralisiert genau x mmol davon zur äure A durch Zugabe von x ml m Cl Beispielaufgabe zur Pufferwirkung Gibt man einen Tropfen m Essigsäure 0, mmol C C in Liter Wasser, so erhält man eine Lösung 0, mmol mit c 0 = = 5,5 0 5 mmol/ml und p = 000 ml (4,75 log c 0) 4,5. Wie ändert sich der pwert dieser Lösung bei Zugabe von 0 ml m Cl bzw. 0 ml m Na? Wie ändert sich der pwert des obigen Puffers bei Zugabe von 0 ml m Cl bzw. 0 ml m Na? Vergleiche. Lösung Zugabe von äure zur ungepufferten Lösung: Gibt man 0 ml m Cl = 0 mmol in Liter der ungepufferten Lösung mit p = 4,5, so erhöht sich [ ] von 0 4,5 0 mmol mmol/ml auf ca. = 0 mmol/ml und der p sinkt deutlich von 4,5 auf. 000 ml Zugabe von äure zur gepufferten Lösung Gibt man 0 ml m Cl = 0 mmol in Liter des obigen Acetatpuffers mit p = 4,5, so reagiert die starke äure vollständig mit der Base C zu C C und Cl : 0 mmol C C 0 mmol 0 mmol C C 0 mmol. Es werden also 0 mmol C C verbraucht und 0 mmol CC 70 = 4,75 log = 4,. C C 8 0 C C zusätzlich gebildet, so dass p = pk log Der p sinkt also nur minimal von 4,5 auf 4,. Zugabe von Base zur ungepufferten Lösung: Gibt man 0 ml m Na = 0 mmol in Liter der ungepufferten Lösung mit p = 9,5, so erhöht sich [ ] von 0 9,5 0 mmol mmol/ml auf ca. = 0 mmol/ml und der p sinkt von 9,5 auf. 000 ml Entsprechend steigt der p deutlich von 4,5 auf. Zugabe von Base zur gepufferten Lösung Gibt man 0 ml m Na = 0 mmol in Liter des obigen Acetatpuffers mit p = 4,5, so reagiert die starke Base vollständig mit der äure C zu C C und : 0 mmol C C 0 mmol 0 mmol C C 0 mmol. Es werden also 0 mmol C C verbraucht und 0 mmol CC 7 0 = 4,75 log = 4,64. C C 8 0 C C zusätzlich gebildet, so dass p = pk log Der p steigt also nur minimal von 4,5 auf 4,64. Übungen: Aufgaben zu äurebasereaktionen Nr. 0
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
HA + B A - + HB + Säuren und Basen. Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor!
 Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Lösung 7. Allgemeine Chemie I Herbstsemester Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf.
 Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Sommersemester 2016 Seminar Stöchiometrie
 Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
3. Säure-Base-Beziehungen
 3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
+ - H3O(aq) + OH(aq) H2O(l) + H2O(l) 1/19. Autoprotolyse des Wassers
 Autoprotolyse des Wassers 1/19 Autoprotolyse des Wassers 2/19 c(h3o + ) = 10-7 mol/l c(h2o) = 55,4 mol/l c(oh - ) = 10-7 mol/l Autoprotolyse des Wassers 3/19 K = [H 3 O+ ][OH ] [H 2 O][H 2 O] Autoprotolyse
Autoprotolyse des Wassers 1/19 Autoprotolyse des Wassers 2/19 c(h3o + ) = 10-7 mol/l c(h2o) = 55,4 mol/l c(oh - ) = 10-7 mol/l Autoprotolyse des Wassers 3/19 K = [H 3 O+ ][OH ] [H 2 O][H 2 O] Autoprotolyse
Bundesrealgymnasium Imst. Chemie Klasse 7. Säuren und Basen
 Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Wintersemester 2017 Seminar Stöchiometrie
 Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Wintersemester 2016 Seminar Stöchiometrie
 Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
3.2. Fragen zu Säure-Base-Gleichgewichten
 3.2. Fragen zu Säure-Base-Gleichgewichten Säure-Base-Gleichgewicht (5) a) Formuliere die Reaktionsgleichungen und das Massenwirkungsgesetz für die Reaktion von Fluorwasserstoff HF und Kohlensäure H 2 3
3.2. Fragen zu Säure-Base-Gleichgewichten Säure-Base-Gleichgewicht (5) a) Formuliere die Reaktionsgleichungen und das Massenwirkungsgesetz für die Reaktion von Fluorwasserstoff HF und Kohlensäure H 2 3
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Säuren- und Basendefinition nach Arrhenius
 Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren- und Basendefinition nach Arrhenius
 Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier.
 Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
[H3O+] [A-] [M+] - [Y-] >> [HA] [OH-] [Y - ] = Menge an M + (Base) welche zur Neutralisation der starkesäure gebraucht wurde!
![[H3O+] [A-] [M+] - [Y-] >> [HA] [OH-] [Y - ] = Menge an M + (Base) welche zur Neutralisation der starkesäure gebraucht wurde! [H3O+] [A-] [M+] - [Y-] >> [HA] [OH-] [Y - ] = Menge an M + (Base) welche zur Neutralisation der starkesäure gebraucht wurde!](/thumbs/55/37326984.jpg) Analytik 4.29 Einige wichtige Punkte der Titrationskurve: A: Beginn der Titration. Da starke Säure zur Essigsäure gegeben wurde ist f < 1. B,E: f = 0; Die starke Säure wurde titriert. Essigsäure in einer
Analytik 4.29 Einige wichtige Punkte der Titrationskurve: A: Beginn der Titration. Da starke Säure zur Essigsäure gegeben wurde ist f < 1. B,E: f = 0; Die starke Säure wurde titriert. Essigsäure in einer
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
Kurstag 3. Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers
 Kurstag 3 Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers Stichworte zur Vorbereitung Pufferlösungen, Henderson-Hasselbalch, Pufferkapazität, Pufferoptimum, Herstellen eines Puffers, physiologische
Kurstag 3 Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers Stichworte zur Vorbereitung Pufferlösungen, Henderson-Hasselbalch, Pufferkapazität, Pufferoptimum, Herstellen eines Puffers, physiologische
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Arbeitsblatt Titration von Säuren / Berechnung von Pufferlösungen
 Arbeitsblatt Titration von Säuren / Berechnung von Pufferlösungen Titriert man schwache Säuren mit starken Basen (z.b. Essigsäure mit Natronlauge), werden die Oxonium-Ionen bei jeder Zugabe von Natronlauge
Arbeitsblatt Titration von Säuren / Berechnung von Pufferlösungen Titriert man schwache Säuren mit starken Basen (z.b. Essigsäure mit Natronlauge), werden die Oxonium-Ionen bei jeder Zugabe von Natronlauge
1/37. Das Protolysegleichgewicht. Wie könnte man die Stärke einer Säure quantitativ definieren?
 Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
VI Säuren und Basen (Mortimer: Kap. 17 u 18 Atkins: Kap. 14, 15)
 VI Säuren und Basen (Mortimer: Kap. 17 u 18 Atkins: Kap. 14, 15) 19. Säure-Base-Theorien Stichwörter: Arrhenius- u. Brönstedt-Theorie von Säuren und Basen, konjugiertes Säure- Base-Paar, Amphoterie, nivellierender
VI Säuren und Basen (Mortimer: Kap. 17 u 18 Atkins: Kap. 14, 15) 19. Säure-Base-Theorien Stichwörter: Arrhenius- u. Brönstedt-Theorie von Säuren und Basen, konjugiertes Säure- Base-Paar, Amphoterie, nivellierender
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DAS CHEMISCHE GLEICHGEWICHT Schwefel schmilzt bei 119 C. Bei dieser Temperatur
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DAS CHEMISCHE GLEICHGEWICHT Schwefel schmilzt bei 119 C. Bei dieser Temperatur
Anorganisch-chemisches Praktikum für Human- und Molekularbiologen
 Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Säure-Base-Definition
Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Säure-Base-Definition
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
Säure/Base - Reaktionen. 6) Titration starker und schwacher Säuren/Basen. Elektrolytische Dissoziation. AB(aq)
 Säure/Base - Reaktionen 1) Elektrolytische Dissoziation ) Definitionen Säuren Basen ) Autoprotolyse 4) p- und po-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Säure/Base - Reaktionen 1) Elektrolytische Dissoziation ) Definitionen Säuren Basen ) Autoprotolyse 4) p- und po-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Titration von Aminosäuren, Lösung. 1. Aufnahme der Titrationskurve
 1. Aufnahme der Titrationskurve Beobachtung: Zu Beginn hat die Lösung einen ph-wert von etwa 2. Der ph-wert steigt nur langsam. Nach Zugabe von etwa 9 ml Natronlauge steigt der ph-wert sprunghaft an. Anschießend
1. Aufnahme der Titrationskurve Beobachtung: Zu Beginn hat die Lösung einen ph-wert von etwa 2. Der ph-wert steigt nur langsam. Nach Zugabe von etwa 9 ml Natronlauge steigt der ph-wert sprunghaft an. Anschießend
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler
 Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
A B - AB K D. Elektrolytische Dissoziation. AB(aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz
 Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Säuren und Basen Säure-Base-Konzepte Säure-Base-Gleichgewichte Säurestärke, Basenstärke ph-, poh-, pk-werte Pufferlösungen Titrationen 1 Säure-Base-Definition nach ARRHENIUS
Praktikumsrelevante Themen Säuren und Basen Säure-Base-Konzepte Säure-Base-Gleichgewichte Säurestärke, Basenstärke ph-, poh-, pk-werte Pufferlösungen Titrationen 1 Säure-Base-Definition nach ARRHENIUS
LeWis» ph-wert Berechnungen «Kapitel 5
 Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Wasser. Flora und Fauna. Wichtigste chemische Verbindung in Lebewesen. Menschen benötigt mindestens 1kg H 2 O pro Tag
 Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
AC2 A. Soi 11
 0.09.017 AC A. Soi 11 Die wichtigsten starken Säuren und ydroxidbasen (Metallhydroxide) Protolysieren vollständig. liegen in Wasser zu 100% in Ionenform, vor. Liegen in Wasser zu 100% dissoziiert, also
0.09.017 AC A. Soi 11 Die wichtigsten starken Säuren und ydroxidbasen (Metallhydroxide) Protolysieren vollständig. liegen in Wasser zu 100% in Ionenform, vor. Liegen in Wasser zu 100% dissoziiert, also
EinFaCh 4. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 4: Säuren und Basen. tu-freiberg.de
 Studienvorbereitung Chemie EinFaCh Einstieg in Freibergs anschauliches Chemiewissen Teil : Säuren und Basen tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was ist eine Säure oder Base? Gemäß der heute
Studienvorbereitung Chemie EinFaCh Einstieg in Freibergs anschauliches Chemiewissen Teil : Säuren und Basen tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was ist eine Säure oder Base? Gemäß der heute
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Säuren und Basen. Säure-Base- Definition n. Arrhenius
 Säuren und Basen Säure-Base- Definition n. Arrhenius Säuren sind Verbindungen, die in Wasser in Protonen (H +, positiv geladene Wasserstoffionen) und in negativ geladene Säurerestionen dissoziieren (zerfallen).
Säuren und Basen Säure-Base- Definition n. Arrhenius Säuren sind Verbindungen, die in Wasser in Protonen (H +, positiv geladene Wasserstoffionen) und in negativ geladene Säurerestionen dissoziieren (zerfallen).
Chem. Grundlagen. ure-base Begriff. Das Protonen-Donator-Akzeptor-Konzept. Wasserstoff, Proton und Säure-Basen. Basen-Definition nach Brønsted
 Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Elektrolyte. (aus: Goldenberg, SOL)
 Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
(Atommassen: Ca = 40, O = 16, H = 1;
 1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
Der ph-wert ist als der negative dekadische Logarithmus der Wasserstoffionenkonzentration
 Einleitung Pufferlösungen Eine Pufferlösung enthält hohe Konzentrationen einer schwachen Säure und ihrer konjugierten Base, z.b. Essigsäure und Acetat. Für eine Lösung, die eine schwache Säure und ihre
Einleitung Pufferlösungen Eine Pufferlösung enthält hohe Konzentrationen einer schwachen Säure und ihrer konjugierten Base, z.b. Essigsäure und Acetat. Für eine Lösung, die eine schwache Säure und ihre
Übungsaufgaben zum Kapitel Protolysegleichgewicht mit Hilfe des Lernprogramms phwert
 1. Fähigkeit: Berechnung des ph-werts einer starken einprotonigen Säure bei gegebener Säurekonzentration. Achtung: Sinnvolle Mindestkonzentration von 10-6 mol/l, da sonst der Anteil der Oxoniumionen aus
1. Fähigkeit: Berechnung des ph-werts einer starken einprotonigen Säure bei gegebener Säurekonzentration. Achtung: Sinnvolle Mindestkonzentration von 10-6 mol/l, da sonst der Anteil der Oxoniumionen aus
Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess.
 Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Vertiefende Überlegungen zum ph-wert A ph-werte von Säuren und Basen
 Vertiefende Überlegungen zum ph-wert A ph-werte von Säuren und Basen Starke Elektrolyte dissoziieren in wässriger Lösung praktisch vollständig. HCl + H O H 3 O + + Cl - ; NaOH (+ H O) Na + + OH - + (H
Vertiefende Überlegungen zum ph-wert A ph-werte von Säuren und Basen Starke Elektrolyte dissoziieren in wässriger Lösung praktisch vollständig. HCl + H O H 3 O + + Cl - ; NaOH (+ H O) Na + + OH - + (H
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
AC I (AC) HS 2011 Übungen mit Lösungen Serie 3
 Prof. A. Togni, D-CAB, CI 239 AC I (AC) S 2011 Übungen mit Lösungen Serie 3 Säure-Base-Gleichgewichte B 1. Leiten Sie die Ausdrücke der Verteilungskoeffizientenαfür eine dreiprotonige Säure her (siehe
Prof. A. Togni, D-CAB, CI 239 AC I (AC) S 2011 Übungen mit Lösungen Serie 3 Säure-Base-Gleichgewichte B 1. Leiten Sie die Ausdrücke der Verteilungskoeffizientenαfür eine dreiprotonige Säure her (siehe
Säure - Base - Theorien
 Säure Base Theorien S. Arrhenius (1887) Säuren sind Stoffe, die in wässriger Lösung H + (aq) Ionen bilden, während Basen OH (aq) Ionen bilden. H 2 SO 4, HNO 3, HCl, NaOH, Ba(OH) 2, aber: NH 3, CH 3, OCH
Säure Base Theorien S. Arrhenius (1887) Säuren sind Stoffe, die in wässriger Lösung H + (aq) Ionen bilden, während Basen OH (aq) Ionen bilden. H 2 SO 4, HNO 3, HCl, NaOH, Ba(OH) 2, aber: NH 3, CH 3, OCH
1 Säuren und Basen. 1.1 Denitionen. 1.2 Protolyse und Autoprotolyse des Wassers
 Praktikum Allgemeine und Analytische Chemie I WS 008/09 Seminar zum Anorganisch-chemischen Teil Säuren und Basen Praktikumsleiter: Professor Dr. U. Simon 1 Säuren und Basen 1.1 Denitionen Arrhenius denierte
Praktikum Allgemeine und Analytische Chemie I WS 008/09 Seminar zum Anorganisch-chemischen Teil Säuren und Basen Praktikumsleiter: Professor Dr. U. Simon 1 Säuren und Basen 1.1 Denitionen Arrhenius denierte
ph-zusammensetzungsdiagramm zweiwertiger Säuren
 LMPG2 B 14 zweiwertige Säuren Lösungen Seite 1 von 7 p-zusammensetzungsdiagramm zweiwertiger Säuren Aufgabe 1: Wir betrachten die Phthalsäure. a) Formulieren Sie die Protolysegleichgewichte für diese Säure.
LMPG2 B 14 zweiwertige Säuren Lösungen Seite 1 von 7 p-zusammensetzungsdiagramm zweiwertiger Säuren Aufgabe 1: Wir betrachten die Phthalsäure. a) Formulieren Sie die Protolysegleichgewichte für diese Säure.
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
Berechnung des ph-wertes einer schwachen Säure
 Berechnung des ph-wertes einer schwachen Säure 1/32 Schwefelwasserstoff H2S hat einen pks-wert von 6,92. Wie groß ist der ph-wert einer 0,01-molaren H2S-Lösung? Berechnung des ph-wertes einer schwachen
Berechnung des ph-wertes einer schwachen Säure 1/32 Schwefelwasserstoff H2S hat einen pks-wert von 6,92. Wie groß ist der ph-wert einer 0,01-molaren H2S-Lösung? Berechnung des ph-wertes einer schwachen
Säure/Base - Reaktionen. 6) Titration starker und schwacher Säuren/Basen
 Säure/Base - Reaktionen 1) Elektrolytische Dissoziation 2) Definitionen Säuren Basen 3) Autoprotolyse 4) ph- und poh-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Säure/Base - Reaktionen 1) Elektrolytische Dissoziation 2) Definitionen Säuren Basen 3) Autoprotolyse 4) ph- und poh-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Säure-Base-Titrationen
 Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
1902-KLAUSURVORBEREITUNG ALLGEMEINE CHEMIE
 1902-KLAUSURVORBEREITUNG ALLGEMEINE CHEMIE ATOMBAU 1) (6 Punkte) Der Atomkern eines Reinelements enthält 78 Neutronen. a) Geben Sie ein vollständiges Elementsymbol für dieses Reinelement an. b) Geben Sie
1902-KLAUSURVORBEREITUNG ALLGEMEINE CHEMIE ATOMBAU 1) (6 Punkte) Der Atomkern eines Reinelements enthält 78 Neutronen. a) Geben Sie ein vollständiges Elementsymbol für dieses Reinelement an. b) Geben Sie
Grundlagen der Chemie Säuren und Basen
 Säuren und Basen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Säure-Base-Theorien Die Begriffe Säure und Base
Säuren und Basen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Säure-Base-Theorien Die Begriffe Säure und Base
Protokoll. Basismodul Chemie I, Praktikum: Säure-Base Gleichgewichte
 Protokoll Basismodul Chemie I, Praktikum: Säure-Base Gleichgewichte Veranstalter: Dr. Ulrich Neuert Jörg Mönnich () Betreuer: Carolin, Christian Versuchstag: Freitag, 04.03.2005 Schwache Säuren und Basen;
Protokoll Basismodul Chemie I, Praktikum: Säure-Base Gleichgewichte Veranstalter: Dr. Ulrich Neuert Jörg Mönnich () Betreuer: Carolin, Christian Versuchstag: Freitag, 04.03.2005 Schwache Säuren und Basen;
Das Hydroxidion ist eine starke Base; der pk B -Wert beträgt. Berechnung der Ausgangskonzentration c 0 :
 Aufgabe 1a) Das Hydroxidion ist eine starke Base; der pk B -Wert beträgt -1,74. Berechnung der Ausgangskonzentration c 0 : n = m/m = 2,5 g / 40 g/mol = 0,0625 mol c 0 = n/v = 0,0625 mol/l Für starke Basen
Aufgabe 1a) Das Hydroxidion ist eine starke Base; der pk B -Wert beträgt -1,74. Berechnung der Ausgangskonzentration c 0 : n = m/m = 2,5 g / 40 g/mol = 0,0625 mol c 0 = n/v = 0,0625 mol/l Für starke Basen
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Einteilung der Maßanalyse
 Einteilung der Maßanalyse Neutralisation (Säure-Base-Titration Acidimetrie Alkalimetrie Fällungstitration Redoxtitration Iodometrie Dichromatometrie Manganometrie etc. Komplexometrie Säure/Basen Theorien
Einteilung der Maßanalyse Neutralisation (Säure-Base-Titration Acidimetrie Alkalimetrie Fällungstitration Redoxtitration Iodometrie Dichromatometrie Manganometrie etc. Komplexometrie Säure/Basen Theorien
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Von der Summenformel zur Strukturformel und weiter zu den Oxidationszahlen
 trukturformeln_2005.doc 1 Von der ummenformel zur trukturformel und weiter zu den xidationszahlen ummenformel gibt Auskunft über die Art der Atome, aus denen das Molekül aufgebaut ist und über das Zahlenverhältnis
trukturformeln_2005.doc 1 Von der ummenformel zur trukturformel und weiter zu den xidationszahlen ummenformel gibt Auskunft über die Art der Atome, aus denen das Molekül aufgebaut ist und über das Zahlenverhältnis
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
(2-8): x = c 2 + c2 (3-3) [H + ] = K S
![(2-8): x = c 2 + c2 (3-3) [H + ] = K S (2-8): x = c 2 + c2 (3-3) [H + ] = K S](/thumbs/71/64115208.jpg) Konkrete Beispiele: Es soll mit den vorher genannten Näherungsformeln gerechnet werden! Die Ergebnisse der "exakten" Rechnung (Berücksichtigung aller Gleichgewichte) werden zum Vergleich angegeben. (Teilweise
Konkrete Beispiele: Es soll mit den vorher genannten Näherungsformeln gerechnet werden! Die Ergebnisse der "exakten" Rechnung (Berücksichtigung aller Gleichgewichte) werden zum Vergleich angegeben. (Teilweise
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Säure Base Reaktionen
 Säure Base Reaktionen 1. In einem Praktikum wird eine Lösung von 1,48 g Calciumhydroxid in 200 ml Salzsäure c=0,50 M zubereitet. Berechne den ph-wert dieser Lösung. 2. a. Berechne unter Angabe der Protolysegleichung
Säure Base Reaktionen 1. In einem Praktikum wird eine Lösung von 1,48 g Calciumhydroxid in 200 ml Salzsäure c=0,50 M zubereitet. Berechne den ph-wert dieser Lösung. 2. a. Berechne unter Angabe der Protolysegleichung
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Chemie Mathematik * Jahrgangsstufe 10 * ph-wert und Logarithmen
 Chemie Mathematik * Jahrgangsstufe 10 * p-wert und Logarithmen Vorkenntnisse über Säuren und Basen Säuren sind Protonendonatoren: Cl 2 O Cl O Salzsäure Cl Clor-Ion Cl Oxonium-Ion O Basen sind Protonenakzeptoren:
Chemie Mathematik * Jahrgangsstufe 10 * p-wert und Logarithmen Vorkenntnisse über Säuren und Basen Säuren sind Protonendonatoren: Cl 2 O Cl O Salzsäure Cl Clor-Ion Cl Oxonium-Ion O Basen sind Protonenakzeptoren:
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7
 AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
Säure-Basen-Reaktionen
 Lösung 6 SäureBasenReaktionen Aufgabe 1 Wie sauer ist unser Mineralwasser? Im System CO (g)/hco * (aq)/hco (aq)/co (aq) sind folgende Gleichgewichte zu berücksichtigen: CO (g) + H O (l) H CO * (aq) logk
Lösung 6 SäureBasenReaktionen Aufgabe 1 Wie sauer ist unser Mineralwasser? Im System CO (g)/hco * (aq)/hco (aq)/co (aq) sind folgende Gleichgewichte zu berücksichtigen: CO (g) + H O (l) H CO * (aq) logk
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
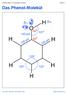 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Säuren und Basen nach Brönsted
 Säuren und Basen nach Brönsted Es gibt versch. Definitionen von Säuren und Basen. Nach Brönsted ist eine Säure (HA) ein Protonendonator und eine Base (B) ein Protonenakzeptor, d.h. eine Säure reagiert
Säuren und Basen nach Brönsted Es gibt versch. Definitionen von Säuren und Basen. Nach Brönsted ist eine Säure (HA) ein Protonendonator und eine Base (B) ein Protonenakzeptor, d.h. eine Säure reagiert
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6
 Prof. A. Togni, D-CHAB, HCI H 239 Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6 Säure-Base-Gleichgewichte E 1. Sie möchten 200 ml einer Pufferlösung mit ph = 5.00 mit dem Säure-Base-Paar Essigsäure
Prof. A. Togni, D-CHAB, HCI H 239 Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6 Säure-Base-Gleichgewichte E 1. Sie möchten 200 ml einer Pufferlösung mit ph = 5.00 mit dem Säure-Base-Paar Essigsäure
E3: Potentiometrische Titration
 Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
Säuren und Basen. Definition nach Brönsted
 Säuren und Basen Folie129 Leitung von Strom in wässrigen Lösungen Elektrolyse Beim Lösen in H 2 Dissoziation von kovalenten oder ionischen Bindungen Beispiele: Chlorwasserstoff H H Cl (g) 2 H + (aq) +
Säuren und Basen Folie129 Leitung von Strom in wässrigen Lösungen Elektrolyse Beim Lösen in H 2 Dissoziation von kovalenten oder ionischen Bindungen Beispiele: Chlorwasserstoff H H Cl (g) 2 H + (aq) +
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 10.11.2004) MILESS: Chemie für Biologen 78 Beispiele
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 10.11.2004) MILESS: Chemie für Biologen 78 Beispiele
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:... Pseudonym für Ergebnisveröffentlichung:... Schreiben Sie bitte gut leserlich:
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:... Pseudonym für Ergebnisveröffentlichung:... Schreiben Sie bitte gut leserlich:
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal Stoff: Chemische Reaktionen, Chemisches Gleichgewicht.
 Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal 42 110. Stoff: Chemische Reaktionen, Chemisches Gleichgewicht. Künftig bitte alles tackern, mit Klebstreifen kleben oder große Blätter (A3) falten. Heftstreifen
Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal 42 110. Stoff: Chemische Reaktionen, Chemisches Gleichgewicht. Künftig bitte alles tackern, mit Klebstreifen kleben oder große Blätter (A3) falten. Heftstreifen
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Puffersysteme. Diese Lerneinheit befasst sich mit den Grundlagen der Puffersysteme: Was ist der Pufferbereich und wovon ist er abhängig?
 Puffersysteme Diese Lerneinheit befasst sich mit den Grundlagen der Puffersysteme: Was ist ein Puffersystem? Wie wirkt ein Puffer? Was ist der Pufferbereich und wovon ist er abhängig? Welche biochemisch
Puffersysteme Diese Lerneinheit befasst sich mit den Grundlagen der Puffersysteme: Was ist ein Puffersystem? Wie wirkt ein Puffer? Was ist der Pufferbereich und wovon ist er abhängig? Welche biochemisch
Chemisches Grundpraktikum für Ingenieure. 2. Praktikumstag. Andreas Rammo
 Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
3.1. Fragen zum chemischen Gleichgewicht
 .1. Fragen zum chemischen Gleichgewicht Reaktionsgeschwindigkeiten (5) Beschreibe die Reaktion von Salzsäure HCl mit Magnesium Mg mit einer Reaktionsgleichung und gib den Reaktionstyp an. () Verwendet
.1. Fragen zum chemischen Gleichgewicht Reaktionsgeschwindigkeiten (5) Beschreibe die Reaktion von Salzsäure HCl mit Magnesium Mg mit einer Reaktionsgleichung und gib den Reaktionstyp an. () Verwendet
1) Typische Eigenschaften
 1) Typische Eigenschaften Saure Lösungen und Laugen sind durch bestimmte Eigenschaften gekennzeichnet. Lies dir dazu den Infotext durch und notiere typische Eigenschaften. Formuliere die im Text erwähnte
1) Typische Eigenschaften Saure Lösungen und Laugen sind durch bestimmte Eigenschaften gekennzeichnet. Lies dir dazu den Infotext durch und notiere typische Eigenschaften. Formuliere die im Text erwähnte
Crashkurs Säure-Base
 Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Martin Raiber Chemie Protokoll Nr Gruppe 2 (Schrankseite) Untersuchung von Glycin
 Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
