Häufig gestellte Fragen (FAQs)
|
|
|
- Eike Lichtenberg
- vor 8 Jahren
- Abrufe
Transkript
1 Häufig gestellte Fragen (FAQs) EU-Register für klinische Prüfungen (EU-CTR) (Inoffizielle Übersetzung des englischen Originaltextes durch das Paul-Ehrlich-Institut) URL: Was ist das EU-Register für klinische Prüfungen? Was sind seine Aufgaben? Die Webseite des EU-Registers für Klinische Prüfungen (EU Clinical Trials Register, EU-CTR) gehört zu EudraPharm. EudraPharm ist die Datenbank der europäischen Gemeinschaft für zugelassene Arzneimittel, und mit der Einführung der neuen Webseite stellt EudraPharm jetzt auch Informationen über klinische Prüfungen von Arzneimitteln mit und ohne Zulassung zur Verfügung. Der Benutzer hat von hier aus Zugriff auf Informationen, die der Datenbank für klinische Prüfungen der EU, EudraCT entnommen sind. Die Website liefert der Öffentlichkeit Informationen zu im europäischen Wirtschaftsraum (EWR) genehmigten klinischen Prüfungen, oder die Teil eines pädiatrisches Prüfkonzepts (Paediatrician Investigation Plan, PIP) sind. So kann der Benutzer nach in EudraCT registrierten Informationen über jede klinische Prüfung zu einem Arzneimittel, das in Kindern und Jugendlichen angewendet wird oder einem Arzneimittel für Erwachsene, das sich in den Phasen II-IV befindet, suchen. Klinische Prüfungen von Kinderarzneimitteln umfassen Prüfungen mit Standort des Prüfarztes im EWR und solchen mit Standorten außerhalb des EWR, die Teil eines PIPs sind. Warum wurde die Website ins Internet gestellt? Die Webseite des EU-Registers für klinische Prüfungen macht der Öffentlichkeit Informationen zugänglich, die in der Datenbank der EU für klinische Prüfungen, EudraCT, enthalten sind. EudraCT wird von nationalen Zulassungsbehörden zur Überwachung klinischer Prüfungen genutzt und wurde als vertrauliche Datenbank gemäß Artikel 11 der Richtlinie 2011/20/EG eingerichtet. Das Arzneimittelrecht der EU schreibt vor, dass die Europäische Arzneimittelagentur (European Medicines Agency, EMA), die die Datenbank EudraCT im Namen der EU-Mitgliedstaaten führt, die in EudraCT enthaltenen Informationen der Öffentlichkeit zugänglich machen muss. Diese Anforderung ist auch in Artikel 57 der Verordnung (EG) Nr. 724/2006 und Artikel 41 der Verordnung (EG) Nr. 1901/2006 über Kinderarzneimittel verankert. Zusammen besagen diese Vorschriften, dass die Daten zu an Erwachsenen und Kindern durchgeführten klinischen Studien der Öffentlichkeit zugänglich gemacht werden müssen. Mit der Webseite des EU-Register für klinische Prüfungen wird diese Anforderung umgesetzt.
2 Warum wurde die Webseite des EU-Registers für klinische Prüfungen später als erwartet ins Internet gestellt? Als die EU-Datenbank für klinische Studien, EudraCT, am 1. Mai 2004 geschaffen wurde, sah das juristische Regelwerk vor, dass sie als vertrauliche Datenbank operieren sollte. Die Vertraulichkeitsplicht wurde durch Verordnung (EG) Nr. 726/2004 und Verordnung (EG) Nr. 1901/2006 teilweise aufgehoben. Für beide Verordnungen mussten Anleitungen zur Umsetzung erstellt werden, und die Veröffentlichung erfolgte durch die Europäische Kommission im Juli 2008 und im Februar Ursprünglich sollte die EU-CTR- Webseite Ende 2009 zur Veröffentlichung freigegeben werden. Der Umbau der Webseite zu ihrer aktuellen Struktur, die der aktuellen und der zukünftigen Entwicklung besser gerecht wird, gestaltete sich jedoch schwierig. Hinzu kamen Probleme bei der Datenmigration und Softwaretestung. Dadurch verzögerte sich die Veröffentlichung der Datenbank bis März Welche Informationen befinden sich im EU-Register für klinische Prüfungen? Inhalte, die Sie im Register finden werden: Daten zu klinischen Prüfungen der Phase II-IV von Arzneimitteln für Erwachsene, die in einem Prüfzentrum durchgeführt werden, das seinen Standort in einem Mitgliedstaat der Europäischen Union oder dem Europäischen Wirtschaftsraum hat; Daten zu allen klinischen Prüfungen mit Kinderarzneimitteln, die in einem Prüfzentrum durchgeführt werden, das seinen Standort in der Europäischen Union hat, sowie alle klinischen Prüfungen, die Teil eines pädiatrischen Prüfkonzepts (paediatric investigation plan, PIP) sind. Der Standort dieser klinischen Prüfungen kann auch außerhalb der Europäischen Union liegen. Inhalte, die Sie nicht im Register finden werden: Informationen über die Ergebnisse von klinischen Prüfungen; Informationen zu nicht-interventionellen Studien (Anwendungsbeobachtungen zu zugelassenen Arzneimitteln); * für den Zeitraum von Mai 2004-März 2011: Informationen zu sämtlichen klinischen Prüfungen, deren Prüfzentren außerhalb der Europäischen Union oder dem europäischen Wirtschaftsraum angesiedelt sind (mit Ausnahme der Prüfungen, die Teil eines genehmigten pädiatrischen Prüfplans(paediatric investigation plan, PIP) sind, und außerhalb der Europäischen Union und dem europäischen Wirtschaftsraum durchgeführt werden; diese werden bis März 2012 rückwirkend auf die Webseite gestellt); Zugriff auf den Zulassungsbescheid der nationalen Zulassungsbehörde oder das positive Votum der zuständigen Ethikkommission; Informationen über klinische Studien zu chirurgischen Verfahren, Medizinprodukten sowie psychotherapeutischen Verfahren; die Bearbeitung eines Antrags für die Teilnahme an allen klinischen Prüfungen, die auf der Webseite veröffentlicht ist; * Informationen zu nicht-interventionellen Unbedenklichkeitsstudien nach der Zulassung befinden sich im elektronischen ENCePP- Register für klinische Studien. Hierbei handelt es sich um eine für die Öffentlichkeit zugängliche Quelle zur Registrierung pharmakoepidemiologischer und Arzneimittelsicherheitsstudien. Seite 2/6
3 Navigationsanleitungen und Inhalte in anderen Sprachen als Englisch. Welche Informationen stehen derzeit zur Verfügung? Zurzeit kann der Benutzer Informationen über das Studiendesign für jede klinische Prüfung, deren Sponsor, das Prüfpräparat sowie die betreffenden Anwendungsgebiete und den Status der Prüfung (genehmigt, noch laufende Prüfung, beendet) einsehen. Er kann sämtliche Daten mittels Freitextsuche oder durch Filtern nach den Kriterien Mitgliedstaat, Alter oder Geschlecht der Probanden oder auch Phase der Prüfung durchsuchen. Im Register befinden sich sowohl klinische Prüfungen, die durch die nationale Genehmigungsbehörde des Mitgliedstaates, in dem sie durchgeführt werden bzw. wurden, genehmigt wurden und die ein positives Votum von der Ethikkommission erhalten haben. Darüber hinaus werden auch klinische Prüfungen für Kinderarzneimittel, die ein negatives Votum von der Ethikkommission erhalten haben, veröffentlicht. Klinische Studien der Phase I in Erwachsenen werden hier nicht veröffentlicht, sofern sie nicht Teil eines genehmigten PIP sind. Diese Kriterien wurden durch die von der Europäischen Kommission veröffentlichten Leitlinien festgelegt. Von dem Zeitpunkt an, zu dem die erste klinische Prüfung auf der Webseite einsehbar ist, werden sämtliche künftigen in EudraCT registrierten klinischen Prüfungen, die diese Kriterien erfüllen, veröffentlicht. Ferner enthält die EudraCT-Datenbank für die Veröffentlichung in Frage kommende klinische Prüfungen, die seit der Einführung von EudraCT im Mai 2004 erfasst wurden, d.h. sogenannte historische Daten. In EudraCT bereits erfasste klinische Prüfungen, die die Kriterien für die Veröffentlichung erfüllen sind ab 22. März 2011 zugänglich. Die EMA arbeitet daran, die Funktionalität der Suchhilfen zu verbessern, um die Suchkriterien für die klinischen Prüfungen zu verfeinern. Somit soll der Benutzer z.b. nach klinischen Prüfungen unter dem Aspekt bestimmter therapeutischer Anwendungsgebiete, Krankheiten, Arzneimittel und anderer Kriterien, die er nützlich findet, suchen können. Hierzu steht das Entwicklungsteam der EMA in engem Kontakt mit den Stakeholdern wie Patientenvertretern, Verbrauchergruppen, Angehörigen medizinischer Fachkreise, Sponsoren von klinischen Prüfungen und den nationalen zuständigen Behörden der EU. Wie finde ich die EU-CTR-Webseite? Die Webseite ist Teil von EudraPharm. Sie können hierauf über die Homepage von EudraPharm zugreifen: Wer stellt die Informationen zur Verfügung? Informationen über die in den EU-Mitgliedstaaten durchgeführten klinischen Prüfungen werden den nationalen Zulassungsbehörden durch die Sponsoren als Teil der Anträge auf Genehmigung dieser klinischen Prüfung in elektronischer Form zur Verfügung gestellt. Die Informationen werden dann durch die nationalen Genehmigungsbehörden in die Datenbank eingegeben. Dabei fügt die nationale Genehmigungsbehörde die Informationen über die Zulassung und das Votum der Ethikkommission hinzu, und später die Informationen über die Beendigung der Prüfung. Informationen zu klinischen Prüfungen in Drittländern werden von Erstellern des PIP zur Verfügung gestellt, die die Informationen über die EMA direkt in das System einstellen. Seite 3/6
4 Wie sehen die Pläne für die Zukunft aus? Es ist geplant, künftig auch Zusammenfassungen der Ergebnisse zu veröffentlichen. Dies wird mit der Einführung von EudraCT V 9.0 möglich sein. Die Zusammenfassungen sind noch nicht in EudraCT erfasst und daher noch nicht für die Öffentlichkeit zugänglich. Diese Funktion ist für Ende 2012 geplant und ihre Struktur wird auf einer Leitlinie aufgebaut sein, die durch die Europäische Kommission (EG) veröffentlicht werden soll. Ein Entwurf dieser Leitlinie wurde zur Beratung von Mai bis September 2010 veröffentlicht. Die Leitlinie finden sie unter diesem Link: 2.pdf Die EMA arbeitet eng mit dem Nationalen Institut für Gesundheit (National Institute of Health) in den USA zusammen, welches das online Register betreibt, und außerdem mit dem Projekt HL7 s CTRR (Health Level 7 - Clinical Trial Registration and Results, Gesundheitsstufe 7 Erfassung klinischer Studien und deren Ergebnisse), um die durch den Sponsor vorzulegenden Daten für die klinischen Prüfungsregister zu harmonisieren. Ferner arbeitet die EMA bezüglich der internationalen Plattform für die Registrierung klinischer Studien (ICTRP) mit der WHO zusammen. Für einige klinische Prüfungen sind die angezeigten Daten unvollständig. Was wird zur Verbesserung der Datenqualität unternommen? Die nationalen Zulassungsbehörden und die EMA arbeiten, soweit möglich, an der Vervollständigung der Datensätze zu älteren klinischen Prüfungen (von der EudraCT-Datenbank erfasste Daten von Mai 2004-März 2011), und darüber hinaus auch an der Verbesserung der Qualität neuer Datensätze durch verstärkte automatische Überprüfungen und Qualitätskontrollen ab der Einführung von EudraCT V8.0 und durch vermehrte Nutzung genormter Daten. Nach der Einführung des EU-Registers für klinische Prüfungen haben diese Aufgaben höchste Priorität. Die Eckpfeiler der Datenqualität sind: - Vollständigkeit aller maßgeblichen Felder - zeitnahe Dateneingabe - Verwendung von kontrollierten Begriffslisten statt Freitext, wo möglich. Mit der Einführung der EudraCT Version 8.0 im März 2011 wird ein viel umfassender Katalog von Validierungsregeln als bisher etabliert. Dadurch wird auch der Vollständigkeit und Einheitlichkeit der Daten besser Rechnung getragen. Die Wirkstoffe von Arzneimitteln sollen einheitliche Kennungen aus kontrollierten Begriffslisten erhalten. Hierzu werden später im Jahr 2011 weitere Verbesserungen vorgenommen. Weitere Neuregelungen kommen 2012 hinzu, die die Kennung aller Arzneimittel nach internationalen Normen vorsehen. Die nationalen Genehmigungsbehörden und die EMA bemühen sich um eine zeitnahe Datenerfassung. Hierzu gehört die Eingabe der durch den Sponsor gelieferten Eingangsdaten, später die Eingabe der Seite 4/6
5 Genehmigung durch die nationale Genehmigungsbehörden,, das Votum der Ethikkommission, und schließlich die Daten über den Abschluss der klinischen Prüfung. Besonders das mit der Einführung von EudraCT verfügbare neue Data Warehouse ermöglicht den Behörden die Erstellung regelmäßiger Berichte über die Vollständigkeit der Daten und gewährleistet somit, dass eventuelle Lücken rasch gefüllt werden. Ferner werden Links eingerichtet, so dass nationale Zulassungsbehörden, die ihre eigenen Datenbanken betreiben, die Daten direkt in ihre Systeme herunterladen können. Datenqualität und historische Daten: Informationen über klinische Prüfungen, die zwischen 1. Mai 2004 und der Einführung der aktuellsten Version von EudraCT (Version 8.0) in der Datenbank erfasst wurden, werden als historische Daten bezeichnet. Diese sind eventuell unvollständig oder enthalten Unstimmigkeiten. So ist z.b. für eine klinische Prüfung kein Abschlussdatum eingegeben worden, sodass die klinische Prüfung als laufende Studie erscheint, sie aber tatsächlich bereits abgeschlossen ist. Die Umsetzung der Richtlinie und Nutzung von EudraCT erfolgte durch die Mitgliedstaaten zu unterschiedlichen Zeiten zwischen 2004 und 2006, und es mussten die entsprechenden Verknüpfungen zu den Ethikkommissionen eingerichtet werden. Die Validierungsregeln für die Daten wurden deutlich verbessert, und die EMA arbeitet mit den nationalen Zulassungsbehörden zusammen um zu gewährleisten, dass die Eckdaten für bestehende klinische Prüfungen vollständig sind. Wo bekomme ich nähere Informationen über eine bestimmte klinische Prüfung? Ein Benutzer, der sich für zusätzliche Informationen über eine bestimmte klinische Prüfung interessiert, sollte sich mit seiner Anfrage direkt an den Sponsor der klinischen Prüfung wenden. Eine Kontaktliste der Sponsoren findet sich unter einem Link auf der Homepage des EU-CTR, um die Kommunikation zwischen der Öffentlichkeit und interessierten Kreisen zu erleichtern. Zu beachten ist jedoch, dass hier noch nicht alle Sponsoren aufgeführt sind. Die Liste wird von der EMA durch Informationen, die die Sponsoren liefern, ständig erweitert. Diese Informationen sind an den Link zu schicken. Die Erfordernisse, dass öffentliche Kontaktdaten übermittelt werden, ist ein neues Merkmal von EudraCT Version 8.0. Früher waren diese Daten nicht erforderlich. Folglich stehen sie bei den klinischen Prüfungen vor der Version 8 nicht zur Verfügung, da sie ja durch den Sponsor nicht übermittelt wurden. Für die neue Version von EudraCT wurden dagegen Änderungen eingeführt, so dass diese Informationen in Zukunft für alle neuen klinischen Prüfungen zur Verfügung stehen. Wenn Sie die Kontaktdaten des Sponsors nicht in den Daten einer klinischen Prüfung oder der verfügbaren Liste finden, sollten Sie danach im Internet auf den jeweiligen Webseiten ihres Patienten- bzw. Ärzteverbands, ihres Krankenhauses oder in anderen Quellen nachschlagen. Was muss ich tun, wenn ich an einer klinischen Prüfung teilnehmen möchte? Wenn Sie der Meinung sind, dass eine klinische Prüfung für Sie interessant sein könnte, so ist zu empfehlen, dass sie dies zunächst mit ihrem Arzt besprechen. Um den Sponsor zu kontaktieren, um nähere Informationen zu erhalten, gehen Sie bitte zum Kontaktpunkt des betreffenden Datensatzes für die klinische Prüfung oder der Liste der Ansprechpartner für den jeweiligen Sponsor, die sich auf der betreffenden Seite im Register befindet. Patienten sollten jedoch beachten, dass die Informationen im Register nicht als Empfehlung für das betreffende Arzneimittel oder für die die Teilnahme an der klinischen Prüfung zu verstehen sind. Sie sollten daher auf jeden Fall zunächst mit ihrem behandelnden Arzt oder dem Prüfarzt über geeignete Behandlungsoptionen sprechen. Seite 5/6
6 Die klinische Prüfung, die mich interessiert, befindet sich nicht im EU-Register für klinische Prüfungen. Warum nicht? Die wahrscheinlichsten Erklärungen hierfür sind nachstehend aufgeführt: - Die klinische Prüfung wird nicht im Europäischen Wirtschaftsraum durchgeführt und ist nicht Teil eines pädiatrischen Prüfkonzepts (Paediatric Investigation Plan, PIP); - Die klinische Prüfung wurde vor der Umsetzung von Richtlinie 2001/20/EG über klinische Prüfungen im Jahre 2004 begonnen; - Die klinische Prüfung gehört zu den historischen Daten, die noch nicht öffentlich zugänglich sind; - Die klinische Prüfung erfüllt nicht die Kriterien für die Veröffentlichung, d.h. es handelt sich um eine Prüfung der Phase I an Erwachsenen oder um eine Studie, die nicht mit einem Arzneimittel sondern einem Medizinprodukt oder einem psychotherapeutischen Verfahren durchgeführt wird. Warum erscheint in manchen Feldern der Ansicht für detaillierte Anwendungen der klinischen Prüfung der Text Information not present in EudraCT (Keine Information in EudraCT vorhanden)? Mögliche Gründe hierfür: Es handelt sich um ein neues Feld, für welches Daten erst ab dem 10. März 2011 eingegeben wurden für ältere klinische Prüfungen wurde diese Information noch nicht eingegeben. Historische Datensätze enthalten weniger Informationen, da die Anforderungen für die Datenerfassung früher weniger streng waren, oder einige Felder in früheren Versionen von EudraCT noch nicht vorhanden waren. Die Daten wurden vom Sponsor nicht eingegeben. Einige Felder sind für bestimmte klinische Prüfungsdesigns oder das Prüfpräparat nicht relevant. Zu technischen Fragen der Funktion des Back/Forward Buttons Ihres Internet Browsers und zur Kopierbarkeit von Internetadressen (URLs) innerhalb des Registers gehen Sie bitte auf die englischsprachigen Seiten der Fragen und Antworten Seite 6/6
IMI-Grundlagen 1. EINLEITUNG... 2 2. GRUNDLAGEN... 2
 IMI-Grundlagen 1. EINLEITUNG... 2 2. GRUNDLAGEN... 2 2.1. WAS IST IMI?... 2 2.2. WIE FUNKTIONIERT IMI?... 3 2.3. ÜBERWINDUNG VON SPRACHBARRIEREN... 3 2.4. WER MACHT WAS IN IMI?... 4 2.4.1. ZUSTÄNDIGE BEHÖRDEN...
IMI-Grundlagen 1. EINLEITUNG... 2 2. GRUNDLAGEN... 2 2.1. WAS IST IMI?... 2 2.2. WIE FUNKTIONIERT IMI?... 3 2.3. ÜBERWINDUNG VON SPRACHBARRIEREN... 3 2.4. WER MACHT WAS IN IMI?... 4 2.4.1. ZUSTÄNDIGE BEHÖRDEN...
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Hilfe zur Urlaubsplanung und Zeiterfassung
 Hilfe zur Urlaubsplanung und Zeiterfassung Urlaubs- und Arbeitsplanung: Mit der Urlaubs- und Arbeitsplanung kann jeder Mitarbeiter in Coffee seine Zeiten eintragen. Die Eintragung kann mit dem Status anfragen,
Hilfe zur Urlaubsplanung und Zeiterfassung Urlaubs- und Arbeitsplanung: Mit der Urlaubs- und Arbeitsplanung kann jeder Mitarbeiter in Coffee seine Zeiten eintragen. Die Eintragung kann mit dem Status anfragen,
Anleitung zum School Education Gateway
 Anleitung zum School Education Gateway Das School Education Gateway wird in 23 europäischen Sprachen zur Verfügung gestellt und bietet einen zentralen Zugangspunkt für Lehrkräfte, Schulen, Experten und
Anleitung zum School Education Gateway Das School Education Gateway wird in 23 europäischen Sprachen zur Verfügung gestellt und bietet einen zentralen Zugangspunkt für Lehrkräfte, Schulen, Experten und
Mitteilung der Kommission. Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03)
 20.5.2003 Amtsblatt der Europäischen Union C 118/5 Mitteilung der Kommission Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03) Durch diese Mitteilung soll
20.5.2003 Amtsblatt der Europäischen Union C 118/5 Mitteilung der Kommission Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03) Durch diese Mitteilung soll
Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion
 Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
EU-Verordnung Nr. 1907/2006 (REACH)
 Was bedeutet REACH? REACH ist die EG-Verordnung Nr. 1907/2006 zur Registration, Evaluation, Authorization and Restriction of CHemicals (Registrierung, Bewertung und Zulassung von Chemikalien). Mit dieser
Was bedeutet REACH? REACH ist die EG-Verordnung Nr. 1907/2006 zur Registration, Evaluation, Authorization and Restriction of CHemicals (Registrierung, Bewertung und Zulassung von Chemikalien). Mit dieser
In diesem Tutorial lernen Sie, wie Sie einen Termin erfassen und verschiedene Einstellungen zu einem Termin vornehmen können.
 Tutorial: Wie erfasse ich einen Termin? In diesem Tutorial lernen Sie, wie Sie einen Termin erfassen und verschiedene Einstellungen zu einem Termin vornehmen können. Neben den allgemeinen Angaben zu einem
Tutorial: Wie erfasse ich einen Termin? In diesem Tutorial lernen Sie, wie Sie einen Termin erfassen und verschiedene Einstellungen zu einem Termin vornehmen können. Neben den allgemeinen Angaben zu einem
Bedienungsanleitung. Matthias Haasler. Version 0.4. für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof
 Bedienungsanleitung für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof Matthias Haasler Version 0.4 Webadministrator, email: webadmin@rundkirche.de Inhaltsverzeichnis 1 Einführung
Bedienungsanleitung für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof Matthias Haasler Version 0.4 Webadministrator, email: webadmin@rundkirche.de Inhaltsverzeichnis 1 Einführung
Nachricht der Kundenbetreuung
 Cisco WebEx: Service-Pack vom [[DATE]] für [[WEBEXURL]] Sehr geehrter Cisco WebEx-Kunde, Cisco WebEx sendet diese Mitteilung an wichtige Geschäftskontakte unter https://[[webexurl]]. Ab Samstag, 1. November
Cisco WebEx: Service-Pack vom [[DATE]] für [[WEBEXURL]] Sehr geehrter Cisco WebEx-Kunde, Cisco WebEx sendet diese Mitteilung an wichtige Geschäftskontakte unter https://[[webexurl]]. Ab Samstag, 1. November
Pflegende Angehörige Online Ihre Plattform im Internet
 Pflegende Angehörige Online Ihre Plattform im Internet Wissen Wichtiges Wissen rund um Pflege Unterstützung Professionelle Beratung Austausch und Kontakt Erfahrungen & Rat mit anderen Angehörigen austauschen
Pflegende Angehörige Online Ihre Plattform im Internet Wissen Wichtiges Wissen rund um Pflege Unterstützung Professionelle Beratung Austausch und Kontakt Erfahrungen & Rat mit anderen Angehörigen austauschen
e-books aus der EBL-Datenbank
 e-books aus der EBL-Datenbank In dieser Anleitung wird erklärt, wie Sie ein ebook aus der EBL-Datenbank ausleihen und mit dem Programm Adobe Digital Edition öffnen. Folgende Vorraussetzungen sind eventuell
e-books aus der EBL-Datenbank In dieser Anleitung wird erklärt, wie Sie ein ebook aus der EBL-Datenbank ausleihen und mit dem Programm Adobe Digital Edition öffnen. Folgende Vorraussetzungen sind eventuell
Updatehinweise für die Version forma 5.5.5
 Updatehinweise für die Version forma 5.5.5 Seit der Version forma 5.5.0 aus 2012 gibt es nur noch eine Office-Version und keine StandAlone-Version mehr. Wenn Sie noch mit der alten Version forma 5.0.x
Updatehinweise für die Version forma 5.5.5 Seit der Version forma 5.5.0 aus 2012 gibt es nur noch eine Office-Version und keine StandAlone-Version mehr. Wenn Sie noch mit der alten Version forma 5.0.x
Ihre Interessentendatensätze bei inobroker. 1. Interessentendatensätze
 Ihre Interessentendatensätze bei inobroker Wenn Sie oder Ihre Kunden die Prozesse von inobroker nutzen, werden Interessentendatensätze erzeugt. Diese können Sie direkt über inobroker bearbeiten oder mit
Ihre Interessentendatensätze bei inobroker Wenn Sie oder Ihre Kunden die Prozesse von inobroker nutzen, werden Interessentendatensätze erzeugt. Diese können Sie direkt über inobroker bearbeiten oder mit
Diese Ansicht erhalten Sie nach der erfolgreichen Anmeldung bei Wordpress.
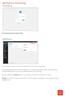 Anmeldung http://www.ihredomain.de/wp-admin Dashboard Diese Ansicht erhalten Sie nach der erfolgreichen Anmeldung bei Wordpress. Das Dashboard gibt Ihnen eine kurze Übersicht, z.b. Anzahl der Beiträge,
Anmeldung http://www.ihredomain.de/wp-admin Dashboard Diese Ansicht erhalten Sie nach der erfolgreichen Anmeldung bei Wordpress. Das Dashboard gibt Ihnen eine kurze Übersicht, z.b. Anzahl der Beiträge,
Umzug der abfallwirtschaftlichen Nummern /Kündigung
 Umzug der abfallwirtschaftlichen Nummern /Kündigung Um sich bei ebegleitschein abzumelden/ zu kündigen sind folgende Schritte notwendig: Schritt 1: Sie erteilen bifa Umweltinstitut GmbH den Auftrag, Ihre
Umzug der abfallwirtschaftlichen Nummern /Kündigung Um sich bei ebegleitschein abzumelden/ zu kündigen sind folgende Schritte notwendig: Schritt 1: Sie erteilen bifa Umweltinstitut GmbH den Auftrag, Ihre
Zugriff auf das Across-Ticketsystem
 Zugriff auf das Across-Ticketsystem Februar 2014 Version 2.2 Copyright Across Systems GmbH Die Inhalte dieses Dokumentes dürfen nur nach schriftlicher Zustimmung der Across Systems GmbH reproduziert oder
Zugriff auf das Across-Ticketsystem Februar 2014 Version 2.2 Copyright Across Systems GmbH Die Inhalte dieses Dokumentes dürfen nur nach schriftlicher Zustimmung der Across Systems GmbH reproduziert oder
Anleitung zum Login. über die Mediteam- Homepage und zur Pflege von Praxisnachrichten
 Anleitung zum Login über die Mediteam- Homepage und zur Pflege von Praxisnachrichten Stand: 18.Dezember 2013 1. Was ist der Mediteam-Login? Alle Mediteam-Mitglieder können kostenfrei einen Login beantragen.
Anleitung zum Login über die Mediteam- Homepage und zur Pflege von Praxisnachrichten Stand: 18.Dezember 2013 1. Was ist der Mediteam-Login? Alle Mediteam-Mitglieder können kostenfrei einen Login beantragen.
Benutzerhandbuch zur Lieferantenregistrierung
 Benutzerhandbuch zur Lieferantenregistrierung Benutzerhandbuch zur Benutzung der Lieferantenregistrierung / des Lieferantenportals der Remmers Baustofftechnik GmbH Inhaltsverzeichnis 1. Allgemeine Firmen-
Benutzerhandbuch zur Lieferantenregistrierung Benutzerhandbuch zur Benutzung der Lieferantenregistrierung / des Lieferantenportals der Remmers Baustofftechnik GmbH Inhaltsverzeichnis 1. Allgemeine Firmen-
Checkliste fu r Lieferanten
 1 Checkliste fu r Lieferanten Um die Daten in den E- Control Tarifkalkulatoren (TK Neu Haushalte, TK Gewerbe und TK Admintool Neu) vor ihren Livegang zu vervollständigen und zu aktualisieren, sollen die
1 Checkliste fu r Lieferanten Um die Daten in den E- Control Tarifkalkulatoren (TK Neu Haushalte, TK Gewerbe und TK Admintool Neu) vor ihren Livegang zu vervollständigen und zu aktualisieren, sollen die
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Zimmertypen. Zimmertypen anlegen
 Zimmertypen anlegen Hier legen Sie Ihre Zimmer an, damit sie auf der Homepage dargestellt werden und online buchbar gemacht werden können. Wobei wir ausdrücklich darauf hinweisen möchten, dass es ganz
Zimmertypen anlegen Hier legen Sie Ihre Zimmer an, damit sie auf der Homepage dargestellt werden und online buchbar gemacht werden können. Wobei wir ausdrücklich darauf hinweisen möchten, dass es ganz
Serviceanforderung online
 Serviceanforderung online Eine online-service-anforderung kann über einen Web-Browser oder direkt über das cosymed-programm gestellt werden. Das cosymed-programm verwendet die gleichen Webseiten, die auch
Serviceanforderung online Eine online-service-anforderung kann über einen Web-Browser oder direkt über das cosymed-programm gestellt werden. Das cosymed-programm verwendet die gleichen Webseiten, die auch
Universal Dashboard auf ewon Alarmübersicht auf ewon eigener HTML Seite.
 ewon - Technical Note Nr. 003 Version 1.2 Universal Dashboard auf ewon Alarmübersicht auf ewon eigener HTML Seite. Übersicht 1. Thema 2. Benötigte Komponenten 3. Downloaden der Seiten und aufspielen auf
ewon - Technical Note Nr. 003 Version 1.2 Universal Dashboard auf ewon Alarmübersicht auf ewon eigener HTML Seite. Übersicht 1. Thema 2. Benötigte Komponenten 3. Downloaden der Seiten und aufspielen auf
8. 1. 2013 Wie stelle ich fest, ob mein Antrag erfolgreich in dem Mautrabattsystem zugestellt wurde?
 Mautrabattsystem Aktualitäten 14. 1. 2013 Wie bei der Verlust oder Entwendung des Nummernschilder fortzugehen, um das Anrecht auf Mautrabatt nicht zu verlieren oder das Mautrabatt zu reduzieren. Wurde
Mautrabattsystem Aktualitäten 14. 1. 2013 Wie bei der Verlust oder Entwendung des Nummernschilder fortzugehen, um das Anrecht auf Mautrabatt nicht zu verlieren oder das Mautrabatt zu reduzieren. Wurde
Faktura. IT.S FAIR Faktura. Handbuch. Dauner Str.12, D-41236 Mönchengladbach, Hotline: 0900/1 296 607 (1,30 /Min)
 IT.S FAIR Faktura Handbuch Dauner Str.12, D-41236 Mönchengladbach, Hotline: 0900/1 296 607 (1,30 /Min) 1. Inhalt 1. Inhalt... 2 2. Wie lege ich einen Kontakt an?... 3 3. Wie erstelle ich eine Aktion für
IT.S FAIR Faktura Handbuch Dauner Str.12, D-41236 Mönchengladbach, Hotline: 0900/1 296 607 (1,30 /Min) 1. Inhalt 1. Inhalt... 2 2. Wie lege ich einen Kontakt an?... 3 3. Wie erstelle ich eine Aktion für
Kurzanleitung zur Übermittlung der mündlichen Prüfungsergebnisse mit DSD-Online. Stand: Dezember 2006. Schulmanagement weltweit
 Kurzanleitung zur Übermittlung der mündlichen Prüfungsergebnisse mit DSD-Online Stand: Dezember 2006 Schulmanagement weltweit Einleitung Ab sofort werden die Ergebnisse der mündlichen Prüfung in DSD-Online
Kurzanleitung zur Übermittlung der mündlichen Prüfungsergebnisse mit DSD-Online Stand: Dezember 2006 Schulmanagement weltweit Einleitung Ab sofort werden die Ergebnisse der mündlichen Prüfung in DSD-Online
Um sich zu registrieren, öffnen Sie die Internetseite www.doodle.de und wählen Sie dort rechts oben
 Doodle Anleitung Konto erstellen Die Registrierung eines Benutzerkontos ist für Umfragen nicht erforderlich. Sollten Sie jedoch öfters Umfragen erstellen, ist dies aus Gründen der Übersicht und Einfachheit
Doodle Anleitung Konto erstellen Die Registrierung eines Benutzerkontos ist für Umfragen nicht erforderlich. Sollten Sie jedoch öfters Umfragen erstellen, ist dies aus Gründen der Übersicht und Einfachheit
DOKUMENTATION PASY. Patientendaten verwalten
 DOKUMENTATION PASY Patientendaten verwalten PASY ist ein Programm zur einfachen und zuverlässigen Verwaltung von Patientendaten. Sämtliche elektronisch gespeicherten Dokumente sind sofort verfügbar. Neue
DOKUMENTATION PASY Patientendaten verwalten PASY ist ein Programm zur einfachen und zuverlässigen Verwaltung von Patientendaten. Sämtliche elektronisch gespeicherten Dokumente sind sofort verfügbar. Neue
Bereich METIS (Texte im Internet) Zählmarkenrecherche
 Bereich METIS (Texte im Internet) Zählmarkenrecherche Über die Zählmarkenrecherche kann man nach der Eingabe des Privaten Identifikationscodes einer bestimmten Zählmarke, 1. Informationen zu dieser Zählmarke
Bereich METIS (Texte im Internet) Zählmarkenrecherche Über die Zählmarkenrecherche kann man nach der Eingabe des Privaten Identifikationscodes einer bestimmten Zählmarke, 1. Informationen zu dieser Zählmarke
Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt?
 DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
Die Bundes-Zentrale für politische Bildung stellt sich vor
 Die Bundes-Zentrale für politische Bildung stellt sich vor Die Bundes-Zentrale für politische Bildung stellt sich vor Deutschland ist ein demokratisches Land. Das heißt: Die Menschen in Deutschland können
Die Bundes-Zentrale für politische Bildung stellt sich vor Die Bundes-Zentrale für politische Bildung stellt sich vor Deutschland ist ein demokratisches Land. Das heißt: Die Menschen in Deutschland können
Angenommen am 14. April 2005
 05/DE WP 107 Arbeitsdokument Festlegung eines Kooperationsverfahrens zwecks Abgabe gemeinsamer Stellungnahmen zur Angemessenheit der verbindlich festgelegten unternehmensinternen Datenschutzgarantien Angenommen
05/DE WP 107 Arbeitsdokument Festlegung eines Kooperationsverfahrens zwecks Abgabe gemeinsamer Stellungnahmen zur Angemessenheit der verbindlich festgelegten unternehmensinternen Datenschutzgarantien Angenommen
ISAP Kundencenter. Alles. Einfach. Online. Das Handbuch zum neuen ISAP Kundencenter. 1992 2014 ISAP AG. All rights reserved.
 ISAP Kundencenter Alles. Einfach. Online. Das Handbuch zum neuen ISAP Kundencenter. 1992 2014 ISAP AG. All rights reserved. ISAP Kundencenter Im Rahmen unseres Supports möchten wir Ihnen über unterschiedliche
ISAP Kundencenter Alles. Einfach. Online. Das Handbuch zum neuen ISAP Kundencenter. 1992 2014 ISAP AG. All rights reserved. ISAP Kundencenter Im Rahmen unseres Supports möchten wir Ihnen über unterschiedliche
D i e n s t e D r i t t e r a u f We b s i t e s
 M erkblatt D i e n s t e D r i t t e r a u f We b s i t e s 1 Einleitung Öffentliche Organe integrieren oftmals im Internet angebotene Dienste und Anwendungen in ihre eigenen Websites. Beispiele: Eine
M erkblatt D i e n s t e D r i t t e r a u f We b s i t e s 1 Einleitung Öffentliche Organe integrieren oftmals im Internet angebotene Dienste und Anwendungen in ihre eigenen Websites. Beispiele: Eine
OLXTeamOutlook 1.5 für Outlook 2003, 2002/XP, 2000 und 97/98
 OLXTeamOutlook 1.5 für Outlook 2003, 2002/XP, 2000 und 97/98 Neue Version: Outlook-Termine, Kontakte, Mails usw. ohne Exchange-Server auf mehreren Rechnern nutzen! Mit der neuesten Generation intelligenter
OLXTeamOutlook 1.5 für Outlook 2003, 2002/XP, 2000 und 97/98 Neue Version: Outlook-Termine, Kontakte, Mails usw. ohne Exchange-Server auf mehreren Rechnern nutzen! Mit der neuesten Generation intelligenter
1 Einleitung. Lernziele. Symbolleiste für den Schnellzugriff anpassen. Notizenseiten drucken. eine Präsentation abwärtskompatibel speichern
 1 Einleitung Lernziele Symbolleiste für den Schnellzugriff anpassen Notizenseiten drucken eine Präsentation abwärtskompatibel speichern eine Präsentation auf CD oder USB-Stick speichern Lerndauer 4 Minuten
1 Einleitung Lernziele Symbolleiste für den Schnellzugriff anpassen Notizenseiten drucken eine Präsentation abwärtskompatibel speichern eine Präsentation auf CD oder USB-Stick speichern Lerndauer 4 Minuten
SEPA-Anleitung zum Release 3.09
 Hier folgt nun eine kurze Information was sich mit dem neuen Release 3.08 zum Thema SEPA alles ändert. Bitte diese Anleitung sorgfältig lesen, damit bei der Umsetzung keine Fragen aufkommen. Bitte vor
Hier folgt nun eine kurze Information was sich mit dem neuen Release 3.08 zum Thema SEPA alles ändert. Bitte diese Anleitung sorgfältig lesen, damit bei der Umsetzung keine Fragen aufkommen. Bitte vor
Google Analytics einrichten
 Technik Autor: Yves Lüthi 19.10.2011 Google Analytics einrichten Google bietet ein kostenloses Web-Analyse Tool an, das es erlaubt, genaue Statistiken über Ihre Webseite zu erstellen. Damit Sie diesen
Technik Autor: Yves Lüthi 19.10.2011 Google Analytics einrichten Google bietet ein kostenloses Web-Analyse Tool an, das es erlaubt, genaue Statistiken über Ihre Webseite zu erstellen. Damit Sie diesen
Benutzeranleitung Superadmin Tool
 Benutzeranleitung Inhalt 1 Einleitung & Voraussetzungen... 2 2 Aufruf des... 3 3 Konto für neuen Benutzer erstellen... 3 4 Services einem Konto hinzufügen... 5 5 Benutzer über neues Konto informieren...
Benutzeranleitung Inhalt 1 Einleitung & Voraussetzungen... 2 2 Aufruf des... 3 3 Konto für neuen Benutzer erstellen... 3 4 Services einem Konto hinzufügen... 5 5 Benutzer über neues Konto informieren...
Ihr CMS für die eigene Facebook Page - 1
 Ihr CMS für die eigene Facebook Page Installation und Einrichten eines CMS für die Betreuung einer oder mehrer zusätzlichen Seiten auf Ihrer Facebook Page. Anpassen der "index.php" Installieren Sie das
Ihr CMS für die eigene Facebook Page Installation und Einrichten eines CMS für die Betreuung einer oder mehrer zusätzlichen Seiten auf Ihrer Facebook Page. Anpassen der "index.php" Installieren Sie das
MORE Profile. Pass- und Lizenzverwaltungssystem. Stand: 19.02.2014 MORE Projects GmbH
 MORE Profile Pass- und Lizenzverwaltungssystem erstellt von: Thorsten Schumann erreichbar unter: thorsten.schumann@more-projects.de Stand: MORE Projects GmbH Einführung Die in More Profile integrierte
MORE Profile Pass- und Lizenzverwaltungssystem erstellt von: Thorsten Schumann erreichbar unter: thorsten.schumann@more-projects.de Stand: MORE Projects GmbH Einführung Die in More Profile integrierte
Anleitung zum Öffnen meiner Fotoalben bei web.de
 Anleitung zum Öffnen meiner Fotoalben bei web.de Ich begrüße Sie auf das Herzlichste. Das sind die Adressen meiner Fotoalben: https://fotoalbum.web.de/gast/erwin-meckelbrug/anna https://fotoalbum.web.de/gast/erwin-meckelburg/tra_my
Anleitung zum Öffnen meiner Fotoalben bei web.de Ich begrüße Sie auf das Herzlichste. Das sind die Adressen meiner Fotoalben: https://fotoalbum.web.de/gast/erwin-meckelbrug/anna https://fotoalbum.web.de/gast/erwin-meckelburg/tra_my
Family Safety (Kinderschutz) einrichten unter Windows 7
 Family Safety (Kinderschutz) einrichten unter Windows 7 Family Safety ist eine Gratissoftware von Microsoft, welche es ermöglicht, dem Kind Vorgaben bei der Nutzung des Computers zu machen und die Nutzung
Family Safety (Kinderschutz) einrichten unter Windows 7 Family Safety ist eine Gratissoftware von Microsoft, welche es ermöglicht, dem Kind Vorgaben bei der Nutzung des Computers zu machen und die Nutzung
PROSTEP AG: Anmelden für eine mehrtägige Schulung für Opel-Zulieferer
 PROSTEP AG: Anmelden für eine mehrtägige Schulung für Opel-Zulieferer Für eine reibungslose Zusammenarbeit fordert Opel von jedem seiner Zulieferunternehmen, dass es für das General Motors-Zulieferer-Portal
PROSTEP AG: Anmelden für eine mehrtägige Schulung für Opel-Zulieferer Für eine reibungslose Zusammenarbeit fordert Opel von jedem seiner Zulieferunternehmen, dass es für das General Motors-Zulieferer-Portal
Nach der Anmeldung im Backend Bereich landen Sie im Kontrollzentrum, welches so aussieht:
 Beiträge erstellen in Joomla Nach der Anmeldung im Backend Bereich landen Sie im Kontrollzentrum, welches so aussieht: Abbildung 1 - Kontrollzentrum Von hier aus kann man zu verschiedene Einstellungen
Beiträge erstellen in Joomla Nach der Anmeldung im Backend Bereich landen Sie im Kontrollzentrum, welches so aussieht: Abbildung 1 - Kontrollzentrum Von hier aus kann man zu verschiedene Einstellungen
Wie Sie mit PO Convert eine Rechnung aus einer Bestellung erstellen können.
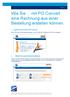 1 / 7 Wie Sie mit PO Convert eine Rechnung aus einer Bestellung erstellen können. 1. Loggen Sie sich in das OB10 Portal ein. Wenn Sie dabei Unterstützung benötigen, lesen Sie bitte die Anleitung Wie Sie
1 / 7 Wie Sie mit PO Convert eine Rechnung aus einer Bestellung erstellen können. 1. Loggen Sie sich in das OB10 Portal ein. Wenn Sie dabei Unterstützung benötigen, lesen Sie bitte die Anleitung Wie Sie
OP-LOG www.op-log.de
 Verwendung von Microsoft SQL Server, Seite 1/18 OP-LOG www.op-log.de Anleitung: Verwendung von Microsoft SQL Server 2005 Stand Mai 2010 1 Ich-lese-keine-Anleitungen 'Verwendung von Microsoft SQL Server
Verwendung von Microsoft SQL Server, Seite 1/18 OP-LOG www.op-log.de Anleitung: Verwendung von Microsoft SQL Server 2005 Stand Mai 2010 1 Ich-lese-keine-Anleitungen 'Verwendung von Microsoft SQL Server
SEPA Lastschriften. Ergänzung zur Dokumentation vom 27.01.2014. Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299
 SEPA Lastschriften Ergänzung zur Dokumentation vom 27.01.2014 Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
SEPA Lastschriften Ergänzung zur Dokumentation vom 27.01.2014 Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
Berechtigungsgruppen TimeSafe Leistungserfassung
 Keep your time safe. Berechtigungsgruppen TimeSafe Leistungserfassung Infotech AG T +423 380 00 00 Im alten Riet 125 F +423 380 00 05 9494 Schaan info@infotech.li Liechtenstein www.infotech.li www.timesafe.ch
Keep your time safe. Berechtigungsgruppen TimeSafe Leistungserfassung Infotech AG T +423 380 00 00 Im alten Riet 125 F +423 380 00 05 9494 Schaan info@infotech.li Liechtenstein www.infotech.li www.timesafe.ch
Kurzleitfaden für Schüler
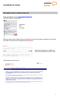 Wie melde ich mich in Schüler Online an? Geben Sie folgenden Link ein: www.schueleranmeldung.de Sie erhalten folgende Anmeldemaske: Mustermann Frank 31.05.1994 Nimmt Ihre Schule nicht an Schüler Online
Wie melde ich mich in Schüler Online an? Geben Sie folgenden Link ein: www.schueleranmeldung.de Sie erhalten folgende Anmeldemaske: Mustermann Frank 31.05.1994 Nimmt Ihre Schule nicht an Schüler Online
Bedienungsanleitung für die Online Kinderbetreuungsbörse des Landkreises Osnabrück
 Bedienungsanleitung für die Online Kinderbetreuungsbörse des Landkreises Osnabrück I. Betreuungsangebot finden 1. Wählen Sie auf der linken Seite die Schaltfläche Betreuung finden aus. 2. Auf der nun erscheinenden
Bedienungsanleitung für die Online Kinderbetreuungsbörse des Landkreises Osnabrück I. Betreuungsangebot finden 1. Wählen Sie auf der linken Seite die Schaltfläche Betreuung finden aus. 2. Auf der nun erscheinenden
Einleitung: Frontend Backend
 Die Internetseite des LSW Deutschland e.v. hat ein neues Gesicht bekommen. Ab dem 01.01.2012 ist sie in Form eines Content Management Systems (CMS) im Netz. Einleitung: Die Grundlage für die Neuprogrammierung
Die Internetseite des LSW Deutschland e.v. hat ein neues Gesicht bekommen. Ab dem 01.01.2012 ist sie in Form eines Content Management Systems (CMS) im Netz. Einleitung: Die Grundlage für die Neuprogrammierung
Internationales Altkatholisches Laienforum
 Internationales Altkatholisches Laienforum Schritt für Schritt Anleitung für die Einrichtung eines Accounts auf admin.laienforum.info Hier erklären wir, wie ein Account im registrierten Bereich eingerichtet
Internationales Altkatholisches Laienforum Schritt für Schritt Anleitung für die Einrichtung eines Accounts auf admin.laienforum.info Hier erklären wir, wie ein Account im registrierten Bereich eingerichtet
Wie nutze ich den Einheitlichen Ansprechpartner?
 Wie nutze ich den Einheitlichen Ansprechpartner? Leitfaden zum österreichischen Einheitlichen Ansprechpartner für EU/EWR Dienstleister Sie sind Staatsangehörige/r eines EU- bzw. EWR-Staates oder für eine
Wie nutze ich den Einheitlichen Ansprechpartner? Leitfaden zum österreichischen Einheitlichen Ansprechpartner für EU/EWR Dienstleister Sie sind Staatsangehörige/r eines EU- bzw. EWR-Staates oder für eine
SEMINAR Modifikation für die Nutzung des Community Builders
 20.04.2010 SEMINAR Modifikation für die Nutzung des Community Builders Step by Step Anleitung ecktion SEMINAR Modifikation für die Nutzung des Community Builders Step by Step Anleitung Bevor Sie loslegen
20.04.2010 SEMINAR Modifikation für die Nutzung des Community Builders Step by Step Anleitung ecktion SEMINAR Modifikation für die Nutzung des Community Builders Step by Step Anleitung Bevor Sie loslegen
Anmeldung zu Seminaren und Lehrgängen
 Anmeldung zu Seminaren und Lehrgängen Seit Anfang 2013 erfolgen Anmeldungen zu Seminaren und Lehrgängen ausschließlich online über den Seminarkalender. Der Seminarkalender ist integriert in die Plattform
Anmeldung zu Seminaren und Lehrgängen Seit Anfang 2013 erfolgen Anmeldungen zu Seminaren und Lehrgängen ausschließlich online über den Seminarkalender. Der Seminarkalender ist integriert in die Plattform
Kostenstellen verwalten. Tipps & Tricks
 Tipps & Tricks INHALT SEITE 1.1 Kostenstellen erstellen 3 13 1.3 Zugriffsberechtigungen überprüfen 30 2 1.1 Kostenstellen erstellen Mein Profil 3 1.1 Kostenstellen erstellen Kostenstelle(n) verwalten 4
Tipps & Tricks INHALT SEITE 1.1 Kostenstellen erstellen 3 13 1.3 Zugriffsberechtigungen überprüfen 30 2 1.1 Kostenstellen erstellen Mein Profil 3 1.1 Kostenstellen erstellen Kostenstelle(n) verwalten 4
Aufruf der Weboberflache des HPM- Warmepumpenmanagers aus dem Internet TIPPS
 Aufruf der Weboberflache des HPM- Warmepumpenmanagers aus dem Internet TIPPS Oktober 2015 Tipp der Woche vom 28. Oktober 2015 Aufruf der Weboberfläche des HPM-Wärmepumpenmanagers aus dem Internet Der Panasonic
Aufruf der Weboberflache des HPM- Warmepumpenmanagers aus dem Internet TIPPS Oktober 2015 Tipp der Woche vom 28. Oktober 2015 Aufruf der Weboberfläche des HPM-Wärmepumpenmanagers aus dem Internet Der Panasonic
How to do? Projekte - Zeiterfassung
 How to do? Projekte - Zeiterfassung Stand: Version 4.0.1, 18.03.2009 1. EINLEITUNG...3 2. PROJEKTE UND STAMMDATEN...4 2.1 Projekte... 4 2.2 Projektmitarbeiter... 5 2.3 Tätigkeiten... 6 2.4 Unterprojekte...
How to do? Projekte - Zeiterfassung Stand: Version 4.0.1, 18.03.2009 1. EINLEITUNG...3 2. PROJEKTE UND STAMMDATEN...4 2.1 Projekte... 4 2.2 Projektmitarbeiter... 5 2.3 Tätigkeiten... 6 2.4 Unterprojekte...
Lehrer: Einschreibemethoden
 Lehrer: Einschreibemethoden Einschreibemethoden Für die Einschreibung in Ihren Kurs gibt es unterschiedliche Methoden. Sie können die Schüler über die Liste eingeschriebene Nutzer Ihrem Kurs zuweisen oder
Lehrer: Einschreibemethoden Einschreibemethoden Für die Einschreibung in Ihren Kurs gibt es unterschiedliche Methoden. Sie können die Schüler über die Liste eingeschriebene Nutzer Ihrem Kurs zuweisen oder
Kapitel I: Registrierung im Portal
 Kapitel I: Registrierung im Portal Um zu unserem Portal zu gelangen, rufen Sie bitte die folgende Internetseite auf: www.arag-forderungsmanagement.de Bei Ihrem ersten Besuch des ARAG Portals ist es notwendig,
Kapitel I: Registrierung im Portal Um zu unserem Portal zu gelangen, rufen Sie bitte die folgende Internetseite auf: www.arag-forderungsmanagement.de Bei Ihrem ersten Besuch des ARAG Portals ist es notwendig,
Instruktionsheft für neue Webshop Hamifleurs
 Instruktionsheft für neue Webshop Hamifleurs Instruktionen für neue Webshop Hamifleurs Gehen Sie zu www.hamifleurs.nl. Klicken Sie auf Login Kunden und es erscheint der Bildschirm auf der nächsten Seite.
Instruktionsheft für neue Webshop Hamifleurs Instruktionen für neue Webshop Hamifleurs Gehen Sie zu www.hamifleurs.nl. Klicken Sie auf Login Kunden und es erscheint der Bildschirm auf der nächsten Seite.
Mit der Maus im Menü links auf den Menüpunkt 'Seiten' gehen und auf 'Erstellen klicken.
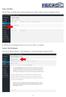 Seite erstellen Mit der Maus im Menü links auf den Menüpunkt 'Seiten' gehen und auf 'Erstellen klicken. Es öffnet sich die Eingabe Seite um eine neue Seite zu erstellen. Seiten Titel festlegen Den neuen
Seite erstellen Mit der Maus im Menü links auf den Menüpunkt 'Seiten' gehen und auf 'Erstellen klicken. Es öffnet sich die Eingabe Seite um eine neue Seite zu erstellen. Seiten Titel festlegen Den neuen
Kapsch Carrier Solutions GmbH Service & Support Helpdesk
 Kapsch Carrier Solutions GmbH Kundenanleitung Tickets erstellen und bearbeiten 1 Das Helpdesk ist über folgende Webseite erreichbar https://support-neuss.kapschcarrier.com 2 Sie haben die Möglichkeit,
Kapsch Carrier Solutions GmbH Kundenanleitung Tickets erstellen und bearbeiten 1 Das Helpdesk ist über folgende Webseite erreichbar https://support-neuss.kapschcarrier.com 2 Sie haben die Möglichkeit,
Mediumwechsel - VR-NetWorld Software
 Mediumwechsel - VR-NetWorld Software Die personalisierte VR-NetWorld-Card wird mit einem festen Laufzeitende ausgeliefert. Am Ende der Laufzeit müssen Sie die bestehende VR-NetWorld-Card gegen eine neue
Mediumwechsel - VR-NetWorld Software Die personalisierte VR-NetWorld-Card wird mit einem festen Laufzeitende ausgeliefert. Am Ende der Laufzeit müssen Sie die bestehende VR-NetWorld-Card gegen eine neue
macs Support Ticket System
 macs Support Ticket System macs Software GmbH Raiffeisenstrasse 8 78658 Zimmern ob Rottweil Tel. (0741)9422880 1 ALLGEMEIN... 3 2 ABLAUF TICKET-SYSTEM... 4 2.1 Ticket Erstellung... 4 2.2 Ablauf... 4 2.3
macs Support Ticket System macs Software GmbH Raiffeisenstrasse 8 78658 Zimmern ob Rottweil Tel. (0741)9422880 1 ALLGEMEIN... 3 2 ABLAUF TICKET-SYSTEM... 4 2.1 Ticket Erstellung... 4 2.2 Ablauf... 4 2.3
Kunde Online. Ihr Leitfaden für die ersten Schritte mit dem neuen System
 Kunde Online Ihr Leitfaden für die ersten Schritte mit dem neuen System INHALT 01 WILLKOMMEN 02 ÜBERBLICK ÜBER DAS SYSTEM 03 VORBEREITUNG 04 DIE ARBEIT MIT UNS 05 SCHULUNG & BENUTZERLEITFÄDEN 06 ANTWORTEN
Kunde Online Ihr Leitfaden für die ersten Schritte mit dem neuen System INHALT 01 WILLKOMMEN 02 ÜBERBLICK ÜBER DAS SYSTEM 03 VORBEREITUNG 04 DIE ARBEIT MIT UNS 05 SCHULUNG & BENUTZERLEITFÄDEN 06 ANTWORTEN
qk online FAQs Fragen und Antworten rund um qk der neue Benachrichtigungsservice der Qualitätskontrolle der Milch
 der neue Benachrichtigungsservice der Qualitätskontrolle der Milch 22. November 2007 FAQs Fragen und Antworten rund um qk Auf den folgenden Seiten finden Sie Antworten zu den nachstehenden Themen: 1. Allgemeines
der neue Benachrichtigungsservice der Qualitätskontrolle der Milch 22. November 2007 FAQs Fragen und Antworten rund um qk Auf den folgenden Seiten finden Sie Antworten zu den nachstehenden Themen: 1. Allgemeines
Hinweise zur Bio-Kontrolle
 Hinweise zur Bio-Kontrolle 1. Hinweise auf dem Lieferschein Soweit ich das Regelwerk verstehe, müssen auf dem Lieferschein 2 Informationen vorliegen. a) das EU LOGO: wichtig dabei ist, dass die Kurzform
Hinweise zur Bio-Kontrolle 1. Hinweise auf dem Lieferschein Soweit ich das Regelwerk verstehe, müssen auf dem Lieferschein 2 Informationen vorliegen. a) das EU LOGO: wichtig dabei ist, dass die Kurzform
Handbuch. NAFI Online-Spezial. Kunden- / Datenverwaltung. 1. Auflage. (Stand: 24.09.2014)
 Handbuch NAFI Online-Spezial 1. Auflage (Stand: 24.09.2014) Copyright 2016 by NAFI GmbH Unerlaubte Vervielfältigungen sind untersagt! Inhaltsangabe Einleitung... 3 Kundenauswahl... 3 Kunde hinzufügen...
Handbuch NAFI Online-Spezial 1. Auflage (Stand: 24.09.2014) Copyright 2016 by NAFI GmbH Unerlaubte Vervielfältigungen sind untersagt! Inhaltsangabe Einleitung... 3 Kundenauswahl... 3 Kunde hinzufügen...
Der vorliegende Konverter unterstützt Sie bei der Konvertierung der Datensätze zu IBAN und BIC.
 Anleitung Konverter Letzte Aktualisierung dieses Dokumentes: 14.11.2013 Der vorliegende Konverter unterstützt Sie bei der Konvertierung der Datensätze zu IBAN und BIC. Wichtiger Hinweis: Der Konverter
Anleitung Konverter Letzte Aktualisierung dieses Dokumentes: 14.11.2013 Der vorliegende Konverter unterstützt Sie bei der Konvertierung der Datensätze zu IBAN und BIC. Wichtiger Hinweis: Der Konverter
II. Systemhandling. 10. Einkaufswagengenehmigung. Landeshauptstadt München Referat für Bildung und Sport. Workflows bei der LHM
 10. Einkaufswagengenehmigung Workflows bei der LHM Ein Workflow kennzeichnet ein zuvor definiertes Regelwerk, das steuert, welche Einkaufswagen abhängig von verschiedenen Faktoren von wem in welcher Weise
10. Einkaufswagengenehmigung Workflows bei der LHM Ein Workflow kennzeichnet ein zuvor definiertes Regelwerk, das steuert, welche Einkaufswagen abhängig von verschiedenen Faktoren von wem in welcher Weise
Tutorial: Wie kann ich Dokumente verwalten?
 Tutorial: Wie kann ich Dokumente verwalten? Im vorliegenden Tutorial lernen Sie, wie Sie in myfactory Dokumente verwalten können. Dafür steht Ihnen in myfactory eine Dokumenten-Verwaltung zur Verfügung.
Tutorial: Wie kann ich Dokumente verwalten? Im vorliegenden Tutorial lernen Sie, wie Sie in myfactory Dokumente verwalten können. Dafür steht Ihnen in myfactory eine Dokumenten-Verwaltung zur Verfügung.
Grundfunktionen und Bedienung
 Kapitel 13 Mit der App Health ist eine neue Anwendung in ios 8 enthalten, die von vorangegangenen Betriebssystemen bislang nicht geboten wurde. Health fungiert dabei als Aggregator für die Daten von Fitness-
Kapitel 13 Mit der App Health ist eine neue Anwendung in ios 8 enthalten, die von vorangegangenen Betriebssystemen bislang nicht geboten wurde. Health fungiert dabei als Aggregator für die Daten von Fitness-
Fotostammtisch-Schaumburg
 Der Anfang zur Benutzung der Web Seite! Alles ums Anmelden und Registrieren 1. Startseite 2. Registrieren 2.1 Registrieren als Mitglied unser Stammtischseite Wie im Bild markiert jetzt auf das Rote Register
Der Anfang zur Benutzung der Web Seite! Alles ums Anmelden und Registrieren 1. Startseite 2. Registrieren 2.1 Registrieren als Mitglied unser Stammtischseite Wie im Bild markiert jetzt auf das Rote Register
tentoinfinity Apps 1.0 EINFÜHRUNG
 tentoinfinity Apps Una Hilfe Inhalt Copyright 2013-2015 von tentoinfinity Apps. Alle Rechte vorbehalten. Inhalt der online-hilfe wurde zuletzt aktualisiert am August 6, 2015. Zusätzlicher Support Ressourcen
tentoinfinity Apps Una Hilfe Inhalt Copyright 2013-2015 von tentoinfinity Apps. Alle Rechte vorbehalten. Inhalt der online-hilfe wurde zuletzt aktualisiert am August 6, 2015. Zusätzlicher Support Ressourcen
Die Dateiablage Der Weg zur Dateiablage
 Die Dateiablage In Ihrem Privatbereich haben Sie die Möglichkeit, Dateien verschiedener Formate abzulegen, zu sortieren, zu archivieren und in andere Dateiablagen der Plattform zu kopieren. In den Gruppen
Die Dateiablage In Ihrem Privatbereich haben Sie die Möglichkeit, Dateien verschiedener Formate abzulegen, zu sortieren, zu archivieren und in andere Dateiablagen der Plattform zu kopieren. In den Gruppen
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Bedienungsanleitung Joomla 3.xx für Redakteure mit Admin-Rechten
 Artikel eingeben Mit den Admin-Zugangsdaten einloggen. Den Link finden Sie im Haupt- oder im Topmenü unter Login/Abmelden Im Nutzermenü wählen Sie Beitrag erstellen Eingabe des Textes im dafür vorgesehenen
Artikel eingeben Mit den Admin-Zugangsdaten einloggen. Den Link finden Sie im Haupt- oder im Topmenü unter Login/Abmelden Im Nutzermenü wählen Sie Beitrag erstellen Eingabe des Textes im dafür vorgesehenen
HintergrÜnde. zur Urheberrechtsabgabe. rechnen sie mit uns.
 HintergrÜnde zur Urheberrechtsabgabe. rechnen sie mit uns. Sehr geehrter Geschäftspartner, aufgrund vieler Anfragen und diverser Diskussionen im Markt über die neu erhobene Urheberrechtsabgabe auf Drucker
HintergrÜnde zur Urheberrechtsabgabe. rechnen sie mit uns. Sehr geehrter Geschäftspartner, aufgrund vieler Anfragen und diverser Diskussionen im Markt über die neu erhobene Urheberrechtsabgabe auf Drucker
Beschaffung mit. Auszug aus dem Schulungshandbuch: Erste Schritte im UniKat-System
 Beschaffung mit Auszug aus dem Schulungshandbuch: Erste Schritte im UniKat-System Stand: 31. Oktober 2014 Inhaltsverzeichnis 1 Erste Schritte im UniKat-System... 2 1.1 Aufruf des Systems... 2 1.2 Personalisierung...
Beschaffung mit Auszug aus dem Schulungshandbuch: Erste Schritte im UniKat-System Stand: 31. Oktober 2014 Inhaltsverzeichnis 1 Erste Schritte im UniKat-System... 2 1.1 Aufruf des Systems... 2 1.2 Personalisierung...
Online bezahlen mit e-rechnung
 Online bezahlen mit e-rechnung Einfach online zahlen mit "e- Rechnung", einem Service von führenden österreichischen Banken! Keine Erlagscheine und keine Erlagscheingebühr. Keine Wartezeiten am Bankschalter.
Online bezahlen mit e-rechnung Einfach online zahlen mit "e- Rechnung", einem Service von führenden österreichischen Banken! Keine Erlagscheine und keine Erlagscheingebühr. Keine Wartezeiten am Bankschalter.
Statuten in leichter Sprache
 Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
E-Government Sondertransporte (SOTRA) Registrierung von Benutzerkennung
 E-Government Sondertransporte (SOTRA) Registrierung von Benutzerkennung Projektteam Sondertransporte Land OÖ Version September 2012 Alle Rechte, insbesondere das Recht der Vervielfältigung, Verbreitung
E-Government Sondertransporte (SOTRA) Registrierung von Benutzerkennung Projektteam Sondertransporte Land OÖ Version September 2012 Alle Rechte, insbesondere das Recht der Vervielfältigung, Verbreitung
Doku zur Gebäudebrüter Datenbank
 Autor: Christina Baradari, christina.baradari@berlin.de, 0162 2008 114 Doku zur Gebäudebrüter Datenbank Team Web Programmierer: Rahim Baradari Inhaltsverzeichnis 1 Suchen nach Kartierungsdaten... 2 1.1
Autor: Christina Baradari, christina.baradari@berlin.de, 0162 2008 114 Doku zur Gebäudebrüter Datenbank Team Web Programmierer: Rahim Baradari Inhaltsverzeichnis 1 Suchen nach Kartierungsdaten... 2 1.1
Registrierung im Datenraum
 Brainloop Secure Dataroom Version 8.20 Copyright Brainloop AG, 2004-2014. Alle Rechte vorbehalten. Sämtliche verwendeten Markennamen und Markenzeichen sind Eigentum der jeweiligen Markeninhaber. Inhaltsverzeichnis
Brainloop Secure Dataroom Version 8.20 Copyright Brainloop AG, 2004-2014. Alle Rechte vorbehalten. Sämtliche verwendeten Markennamen und Markenzeichen sind Eigentum der jeweiligen Markeninhaber. Inhaltsverzeichnis
L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016
 L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016 Referentin: Dr. Kelly Neudorfer Universität Hohenheim Was wir jetzt besprechen werden ist eine Frage, mit denen viele
L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016 Referentin: Dr. Kelly Neudorfer Universität Hohenheim Was wir jetzt besprechen werden ist eine Frage, mit denen viele
Leichte-Sprache-Bilder
 Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
Handbuch ECDL 2003 Professional Modul 3: Kommunikation Kalender freigeben und andere Kalender aufrufen
 Handbuch ECDL 2003 Professional Modul 3: Kommunikation Kalender freigeben und andere Kalender aufrufen Dateiname: ecdl_p3_02_03_documentation.doc Speicherdatum: 08.12.2004 ECDL 2003 Professional Modul
Handbuch ECDL 2003 Professional Modul 3: Kommunikation Kalender freigeben und andere Kalender aufrufen Dateiname: ecdl_p3_02_03_documentation.doc Speicherdatum: 08.12.2004 ECDL 2003 Professional Modul
Content Management System mit INTREXX 2002.
 Content Management System mit INTREXX 2002. Welche Vorteile hat ein CM-System mit INTREXX? Sie haben bereits INTREXX im Einsatz? Dann liegt es auf der Hand, dass Sie ein CM-System zur Pflege Ihrer Webseite,
Content Management System mit INTREXX 2002. Welche Vorteile hat ein CM-System mit INTREXX? Sie haben bereits INTREXX im Einsatz? Dann liegt es auf der Hand, dass Sie ein CM-System zur Pflege Ihrer Webseite,
SRM - Supplier Self Service (Lieferant) Author: Dennis Vater; Version: 01, January 1th, 2013
 Inhalt 0. Systemlandschaft 2 1. Benachrichtigung über neue oder geänderte Belege 2 2. Anmeldung am Lieferantenportal 2 2.1 Erläuterungen der Bereiche 3 2.2 Erläuterungen des Status 4 3. Bestätigung pflegen
Inhalt 0. Systemlandschaft 2 1. Benachrichtigung über neue oder geänderte Belege 2 2. Anmeldung am Lieferantenportal 2 2.1 Erläuterungen der Bereiche 3 2.2 Erläuterungen des Status 4 3. Bestätigung pflegen
Sich einen eigenen Blog anzulegen, ist gar nicht so schwer. Es gibt verschiedene Anbieter. www.blogger.com ist einer davon.
 www.blogger.com Sich einen eigenen Blog anzulegen, ist gar nicht so schwer. Es gibt verschiedene Anbieter. www.blogger.com ist einer davon. Sie müssen sich dort nur ein Konto anlegen. Dafür gehen Sie auf
www.blogger.com Sich einen eigenen Blog anzulegen, ist gar nicht so schwer. Es gibt verschiedene Anbieter. www.blogger.com ist einer davon. Sie müssen sich dort nur ein Konto anlegen. Dafür gehen Sie auf
Registration von bereits bewilligten klinischen Versuchen
 SNCTP - Anleitung Teil 2: Registration von bereits bewilligten klinischen Versuchen Version 1.2 Wichtige Hinweise: 1. Es müssen nur klinische Versuche (vgl. Definition Art. 3 Bst. l HFG) gemäss Art. 56
SNCTP - Anleitung Teil 2: Registration von bereits bewilligten klinischen Versuchen Version 1.2 Wichtige Hinweise: 1. Es müssen nur klinische Versuche (vgl. Definition Art. 3 Bst. l HFG) gemäss Art. 56
Benutzeranleitung Service Desk Tool Erizone
 Benutzeranleitung Service Desk Tool Erizone Benutzeranleitung EriZone Seite 1 von 9 Ausgedruckt am 26.09.2014 Inhalt 1 Einleitung... 3 1.1 Zweck des Dokuments... 3 2 EriZone Service Desk Portal... 3 2.1
Benutzeranleitung Service Desk Tool Erizone Benutzeranleitung EriZone Seite 1 von 9 Ausgedruckt am 26.09.2014 Inhalt 1 Einleitung... 3 1.1 Zweck des Dokuments... 3 2 EriZone Service Desk Portal... 3 2.1
Fragen und Antworten
 Fragen und Antworten im Umgang mit dem elektronischen Abfallnachweisverfahren eanv in Bezug auf die ZKS-Abfall -Allgemeine Fragen- www.zks-abfall.de Stand: 19.05.2010 Einleitung Auf den folgenden Seiten
Fragen und Antworten im Umgang mit dem elektronischen Abfallnachweisverfahren eanv in Bezug auf die ZKS-Abfall -Allgemeine Fragen- www.zks-abfall.de Stand: 19.05.2010 Einleitung Auf den folgenden Seiten
Deutsches Forschungsnetz
 Deutsches Forschungsnetz In fünf Schritten in die DFN-Cloud Jochem Pattloch 68. Mitgliederversammlung 3. Juni 2014, Berlin Schritt 1: Rahmenvertrag n Zunächst ist es erforderlich, dass Sie einen Rahmenvertrag
Deutsches Forschungsnetz In fünf Schritten in die DFN-Cloud Jochem Pattloch 68. Mitgliederversammlung 3. Juni 2014, Berlin Schritt 1: Rahmenvertrag n Zunächst ist es erforderlich, dass Sie einen Rahmenvertrag
Stellvertretenden Genehmiger verwalten. Tipps & Tricks
 Tipps & Tricks INHALT SEITE 1. Grundlegende Informationen 3 2.1 Aktivieren eines Stellvertretenden Genehmigers 4 2.2 Deaktivieren eines Stellvertretenden Genehmigers 11 2 1. Grundlegende Informationen
Tipps & Tricks INHALT SEITE 1. Grundlegende Informationen 3 2.1 Aktivieren eines Stellvertretenden Genehmigers 4 2.2 Deaktivieren eines Stellvertretenden Genehmigers 11 2 1. Grundlegende Informationen
EMPFEHLUNG DER KOMMISSION. vom 13.1.2010
 EUROPÄISCHE KOMMISSION Brüssel, den 13.1.2010 K(2010)19 endgültig EMPFEHLUNG R KOMMISSION vom 13.1.2010 für den sicheren elektronischem Datenaustausch zwischen den Mitgliedstaaten zur Überprüfung der Einzigkeit
EUROPÄISCHE KOMMISSION Brüssel, den 13.1.2010 K(2010)19 endgültig EMPFEHLUNG R KOMMISSION vom 13.1.2010 für den sicheren elektronischem Datenaustausch zwischen den Mitgliedstaaten zur Überprüfung der Einzigkeit
Einfügen von Bildern innerhalb eines Beitrages
 Version 1.2 Einfügen von Bildern innerhalb eines Beitrages Um eigene Bilder ins Forum einzufügen, gibt es zwei Möglichkeiten. 1.) Ein Bild vom eigenem PC wird auf den Webspace von Baue-die-Bismarck.de
Version 1.2 Einfügen von Bildern innerhalb eines Beitrages Um eigene Bilder ins Forum einzufügen, gibt es zwei Möglichkeiten. 1.) Ein Bild vom eigenem PC wird auf den Webspace von Baue-die-Bismarck.de
