Bibliografische Informationen der Deutschen Bibliothek
|
|
|
- Katarina Kerstin Dressler
- vor 7 Jahren
- Abrufe
Transkript
1 Hannover 2005 Aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover Immunhistologische Charakterisierung primärer Neoplasien des ZNS bei Hund und Katze Inaugural-Dissertation zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH Gießen Frankfurter Str. 89 Tel.: 06 41/ Fax: 06 41/ Geschaeftsstelle@dvg.net Homepage: Tanja Recker ISBN vorgelegt von Tanja Recker aus Warendorf Hannover 2005
2
3
4 Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über abrufbar. 1. Auflage by Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH, Gießen Printed in Germany ISBN Verlag: DVG Service GmbH Frankfurter Straße Gießen 0641/
5 Aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover Immunhistologische Charakterisierung primärer Neoplasien des ZNS bei Hund und Katze I N A U G U R A L D I S S E R T A T I O N zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Tanja Recker aus Warendorf Hannover 2005
6 Wissenschaftliche Betreuung: Univ.-Prof. Dr. Wolfgang Baumgärtner 1. Gutachter: Univ.-Prof. Dr. Wolfgang Baumgärtner 2. Gutachter: Univ.-Prof. Dr. Andrea Meyer-Lindenberg Tag der mündlichen Prüfung:
7 Für meine Eltern, die mir gezeigt haben, wie man die Welt mit wahrem Verständnis sieht, und mich meine Flügel haben ausbreiten lassen
8
9 Inhaltsverzeichnis 1 Einleitung Literaturübersicht Tumoren des zentralen Nervensystems Neuroektodermale Tumoren Meningotheliale Tumoren Lymphome und hämatopoietische Tumoren Selläre Tumoren Andere primitive Tumoren und Zysten Lokal invasiv wachsende Tumoren mit ZNS-Beteiligung Tumoren des peripheren Nervensystems Das Multiblocksystem ( tissue microarray ) Material und Methoden Untersuchungsmaterial Herstellung der konventionellen Paraffinblöcke Herstellung der konventionellen Paraffinschnitte und lichtmikroskopische Klassifizierung der Gehirntumoren Parameter für die histologische Untersuchung und Klassifizierung der Tumoren Makroskopische Befunde Histologische Befunde Zytologische Befunde Sonstige histologische Kennzeichen Herstellung der Multiblöcke Markierung Übertragung der Markierung Stanzung des Donorblockes Erstellung des Stanzarchivs Auswahl der Stanzen und Zusammensetzung der Multiblöcke...43
10 3.6 Herstellung der Multiblockschnitte Immunhistologie Antikörper und Seren Durchführung der immunhistologischen Untersuchung Kontrollen Auswertung Statistische Auswertung Ergebnisse Untersuchungsmaterial Merkmale der von 1980 bis 2003 im Institut für Pathologie der Tierärztlichen Hochschule Hannover sezierten Hunde und Katzen Merkmale der untersuchten Hunde und Katzen mit primären Tumoren des ZNS (Institut für Pathologie, Tierärztliche Hochschule Hannover) Merkmale der untersuchten Hunde und Katzen mit primären Tumoren des ZNS (Gießen/OSU) Verteilung der Tumoren bei den von 1980 bis 2003 im Institut für Pathologie der Tierärztliche Hochschule Hannover sezierten Hunden Verteilung der Tumoren bei den von 1980 bis 2003 im Institut für Pathologie der Tierärztliche Hochschule Hannover sezierten Katzen Verteilung der Tumoren bei den Hunden aus Gießen und der OSU Alters-, Rassen- und Geschlechtsverteilung der aus Gießen und der OSU zur Verfügung gestellten Hunde und Katzen mit Tumoren des ZNS Metastasen Methodenvergleich Prozentualer Anteil von Tumorgewebe in den Stanzen (Treffsicherheit) Vergleich histologischer Befunde Immunhistologische vergleichende Befunde Histologische und immunhistologische Untersuchungs-ergebnisse der Tumoren Positivkontrollen Topographie sowie histologische und immunhistologische Befunde bei den astrozytären Tumoren Histologische Befunde der astrozytären Tumoren...84
11 4.3.4 Immunhistologische Befunde der astrozytären Tumoren Topographie sowie histologische und immunhistologische Befunde bei den oligodendroglialen Tumoren Topographie sowie histologische und immunhistologische Befunde bei dem oligoastrozytären Tumor Topographioe sowie histologische und immunhistologische Befunde bei den ependymalen Tumoren Topographie sowie histologische und immunhistologische Befunde bei den Choroid-Plexustumoren Topographie sowie histologische und immunhistologische Befunde bei den Medulloblastomen Topographie sowie histologische und immunhistologische Befunde bei dem thorako-lumbalen, spinalen Tumor junger Hunde (intraspinales Nephroblastom) Topographie sowie histologische und immunhistologische Befunde bei den Meningeomen Topographie sowie histologische und immunhistologische Befunde bei den Lymphomen Topographie sowie histologische und immunhistologische Befunde bei den Non-B, Non-T lymphozytären Neoplasien (neoplastische Retikulose) Topographie sowie histologische und immunhistologische Befunde bei der Mikrogliomatose Topographie sowie histologische und immunhistologische Befunde bei den malignen Histiozytosen Topographie sowie histologische und immunhistologische Befunde bei den suprasellären Keimzelltumoren Topographie sowie histologische und immunhistologische Befunde bei dem Hypophysenadenom Topographie sowie histologische und immunhistologische Befunde bei den peripheren Nervenscheidentumoren Topographie sowie histologische und immunhistologische Befunde bei sekundären und nicht klassifizierbaren Tumoren Fotografische Dokumentation Diskussion Geschlechts-, Rassen- und Altersverteilung Tumoren aus Hannover...158
12 5.1.2 Tumoren von der OSU und aus Gießen Methodenvergleich Antikörper gegen CD79, CD3, Trk und CNPase CD CD Tyrosinkinase-Rezeptor (Trk) CNPase Tumoren Astrozytome Oligodendrogliome Oligoastrozytom Ependymale Tumoren Choroid-Plexustumoren Medulloblastom Thorako-lumbaler, spinaler Tumor der jungen Hunde (intraspinales Nephroblastom) Meningeome Lymphome Non-B, Non-T lymphozytäre Neoplasie (neoplastische Retikulose) Mikrogliomatose Maligne Histiozytose Supraselläre Keimzelltumoren Adenom der Hypophyse Periphere Nervescheidentumoren (BPNST und MPNST) Sekundäre und nicht zu klassifizierende Tumoren Meningeales Karzinom metastatischen Ursprungs Nicht zu klassifizierender Tumor Immunhistologischen Untersuchung Zusammenfassung Summary Literaturverzeichnis Anhang
13 9.1 Tabellarische Übersicht der kasuistischen, histologischen und immunhistologischen Befunde der Hunde und Katzen mit primären Neoplasien des ZNS Zusammenstellung der Multiblöcke Multiblock-1 (ZNS-T )/ positiv Kontrollen Multiblock-2(ZNS-T ) und Multiblock-3 (ZNS-T ) Multiblock-4 (ZNS-T ) und Multiblock-5 (ZNS-T ) Lösungen und Puffer für die Immunhistologie Phosphatgepufferte Kochsalzlösung (PBS) DAB-Gebrauchslösung Verfahren zur Antigen-Maskierung bei der Immunhistologie Pronase E Tween Triton X Mikrowellenbehandlung mit Citratpuffer Bezugsquellen für Chemikalien, Enzyme und Antikörper Bezugsquellen für Geräte und Einmalartikel Abkürzungen
14
15 Einleitung 1 Einleitung Primäre Neoplasien des Nervensystems kommen bei Haustieren relativ selten vor. Die Inzidenz von intrakranialen Neoplasien wird bei Hunden mit 14,5 auf und bei der Katze mit 3,5 auf Tieren angegeben. Die Klassifikation der Tumoren erfolgt nach den Kriterien der World Health Organisation von Beurteilt werden Histologie, Zytologie und Immunhistologie sowie Wachstumscharakteristika und Differenzierungsgrad. Die routinemäßige Diagnostik von Hirntumoren erfolgt an konventionellen Schnitten mittels H.E.-Färbung, darüber hinausgehend durch histologische Spezialfärbungen, Immunhistologie und teilweise Elektronenmikroskopie. Informationen über die Immunophänotypisierung von Nervensystemtumoren sind extrem limitiert und es finden sich nur wenige umfangreiche Studien. Zurzeit stammt die Mehrzahl der Ergebnisse immunhistologischer Untersuchungen von Neoplasien des Nervensystems aus Fallberichten, die die Befunde von 1 oder 2 Tieren aufarbeiten. Veröffentlichungen über Serienuntersuchungen gibt es nur wenige und diese beschäftigen sich häufig nur mir einer Tumorart. Die immunhistologische Untersuchung von Tumorserien erfordert durch das immens hohe Materialaufkommen einen erheblichen Aufwand an Zeit, Geld und Reagenzien. Im Vergleich dazu bietet das Multiblocksytem tissue microarry, bei dem eine Vielzahl von Gewebeproben zur gleichen Zeit unter identischen Laborbedingungen immunhistologisch untersucht werden können, eine zeitsparende und kostengünstigere Alternative. Zudem bleibt der Originalblock des Tumors durch die Verwendung kleiner Stanzen weitgehend erhalten und kann somit für weiterführende Studien genutzt werden. Ziel dieser Arbeit ist es erstens, die von 1980 bis 2003 im Institut für Pathologie der Tierärztlichen Hochschule Hannover sezierten Hunde und Katzen mit primären ZNS- Tumoren hinsichtlich ihrer Rasse-, Alters- und Geschlechtsverteilung retrospektiv aufzuarbeiten. Zweitens soll die Anwendbarkeit des Multiblocksystems in der Veterinärmedizin untersucht werden und anhand histologischer und immunhistologischer Kriterien die Reproduzierbarkeit der Ergebnisse, am Beispiel von ZNS-Tumoren, aufgezeigt werden. Als drittes Ziel soll anhand einer Serienuntersuchung eine Über- 1
16 Einleitung sicht über die vorkommenden Tumoren des Nervensystems bei Hund und Katze sowie die histologischen und immunhistologischen Eigenschaften gegeben und Übereinstimmungen bzw. Abweichungen mit humanen Neoplasien aufgezeigt werden. 2
17 Literaturübersicht 2 Literaturübersicht 2.1 Tumoren des zentralen Nervensystems Das Auftreten primärer Neoplasien des zentralen Nervensystems (ZNS) ist bei Haustieren relativ selten zu beobachten. Tumoren des ZNS kommen im Vergleich zu anderen Spezies am häufigsten beim Hund und etwas weniger häufig bei der Katze vor (ZAKI, 1977; WOODS et al., 1992; TIPOLD, 2000). Ein Grund dafür ist die längere Lebenserwartung von Hund und Katze. Von allen ZNS-Tumoren betreffen 60-80% den Hund, 10-20% die Katze und die übrigen 10-20% andere Tierspezies (LUGIN- BÜHL et al., 1968; HAYES et al., 1975). Nach VANDEVELDE (1984) beträgt die Inzidenz von Hirntumoren bei Hunden 14,5 von Im Vergleich zur Humanmedizin mit 4 bis 5 Tumoren auf Menschen liegt dieser Wert relativ hoch (STOICA et al., 2004). Bei der Katze liegt die Inzidenz nur bei 3,5 Hirntumoren pro Tieren (VANDEVELDE, 1984). Tumoren des ZNS stellen bei Haustieren primär eine Erkrankung älterer Tiere dar. 70% der primären ZNS-Tumoren kommen bei Hunden über 5 Jahren vor. Das entspricht dem Vorkommen von Hirntumoren bei adulten Menschen (WOODS et al., 1992). Die Erkrankungsrate junger Hunde (10% sind 3 Jahre und jünger) spielt in der Veterinärmedizin im Gegensatz zur Humanmedizin nur eine untergeordnete Rolle (KOESTNER und HIGGINS, 2002). Tumoren stellen die häufigste ZNS-Erkrankung bei über 10 Jahre alten Katzen dar (TIPOLD, 2000). Der häufigste primäre Gehirntumor bei der Katze ist das Meningeom (ZAKI und HURVITZ, 1976). Hingegen ist das Gliom der am meisten verbreitete Tumortyp des Hundes (KOESTNER und. HIGGINS, 2002). Über 50% der Gliome treten bei brachizephalen Rassen, wie Boxer und Boston Terrier, auf (FANKHAUSER und LU- GINBÜHL, 1968; KOESTNER und HIGGINS, 2002). Männliche Hunde erkranken eher an Oligodendrogliomen (MOORE et al., 1996) und Plexuspapillomen (HOLLI- DAY et al., 1987). Bei Katzen ist keine Rassedisposition bekannt (MOORE et al., 1996; TIPOLD, 2000). ZAKI und HURVITZ (1976) finden keine Geschlechtdisposition bei Katzen, während NAFE (1979) und LECOUTEUR (1990) eine höhere Inzidenz von Meningeomen bei männlichen Katzen beobachten. In das Gehirn metastasierende Tumoren sind seltener als primäre Neoplasien (LECOUTEUR, 1999; TI- POLD, 2000), jedoch variieren die Literaturangaben hinsichtlich der Inzidenz. So 3
18 Literaturübersicht betragen die sekundären Tumoren nach JOHNSON (1990) 30-50% aller ZNS- Tumoren. TIPOLD (2000) gibt das Verhältnis von Metastasen zu primären Neoplasien mit 1:3 an. Das Vorkommen von Metastasen im Gehirn wird als selten beschrieben (BRAUND, 1894), sie sollen im Gehirn aber häufiger auftreten als im Rückenmark (ZAKI, 1977; BRAUND, 1984). Histogenetisch können Tumoren des ZNS neuroektodermalen, mesenchymalen oder ektodermalen Ursprungs sein (ZAKI, 1977). Darüber hinaus stammen intrakraniale Keimzelltumoren von den Keimzellen ab und weisen Anteile von allen drei Keimblättern auf (HOLLIDAY et al., 1987; HA- RE, 1993). In Anlehnung an die Humanmedizin wurde 1999 die dritte internationale Klassifikation der Tumoren des Nervensystems bei Haustieren von der World Health Organistation neu aufgelegt (KOESTNER et al., 1999). Die erste WHO-Klassifikation stammt aus dem Jahr 1974, eine zweite wurde 1976 aufgelegt. Die Klassifikation der Neoplasien erfolgt nach histologischen und zytologischen Parametern, Wachstumskriterien und dem Differenzierungsgrad. Die in der Veterinärmedizin noch unzureichend erforschte Genetik der jeweiligen Tumoren findet, im Gegensatz zur Humanmedizin, noch keine Berücksichtigung. Einzelne Differenzierungsgrade werden zwar terminologisch unterschieden, jedoch nicht wie in der Humanmedizin nach Grad I bis IV klassifiziert Neuroektodermale Tumoren Astrozytäre Tumoren Anhand histologischer Kriterien werden Astrozytome beim Tier in drei verschiedene Malignitätsgrade eingeteilt (KOESTNER et al., 1999). Das diffuse Astrozytom stellt mit seinen 3 Varianten (fibrillär, protoplasmatisch und gemistozytär) den am besten differenzierten Tumor dar ( low grade ). Weniger gut differenziert ist das anaplastische Astrozytom ( medium grade ) und das Glioblastoma multiforme ( high grade ). Astrozytäre Tumoren findet man bei der Katze sehr selten (MILKS und OLAFSON, 1936; NAFE, 1990; SUMMERS et al., 1995; DAHME und SCHMAHL, 1999). Beim Hund hingegen gehören gliale Tumoren zu den häufigsten Neoplasien (LUGINBÜHL et al., 1968; SUMMERS et al., 1995). Es wird kontrovers diskutiert, ob oligodendrogliale oder astrozytäre Tumoren die weit verbreitesten sind. Unklassifizierte Gliome können bis zu 20% der Gliome ausmachen (HOLLIDAY et al., 1987). Brachizephale Rassen weisen eine höhere Inzidenz für Astrozytome auf (FANKHAUSER 4
19 Literaturübersicht und LUGINBÜHL, 1968). Eine Geschlechtsdisposition wurde bis jetzt nicht beschrieben. Die betroffenen Tiere sind meistens über 5 Jahre alt (FANKHAUSER und LU- GINBÜHL, 1968). Bevorzugte Lokalisationen sind der Lobus piriformis, die zerebralen Hemisphären, Thalamus, Hypothalamus und der Hirnstamm (FANKHAUSER und LUGINBÜHL, 1968; STOICA et al., 2004). Mit Ausnahme des gemistozytären Subtyps stellen die gut differenzierten Astrozytome unscharf demarkierte Tumoren dar. Die gelblichen bis grau-weißen Neoplasien sehen dem Neuroparenchym sehr ähnlich. Schlecht differenzierte Astrozytome sind marmoriert und haben eine weiche Konsistenz. Intratumorale Nekrosen, Blutungen, Zysten und Ödeme können in variierendem Umfang gefunden werden (FANKHAUSER und LUGINBÜHL, 1968). Beim Glioblastom kann es zur Hirnschwellung und Kleinhirnherniation kommen (SUM- MERS et al., 1995; KOESTNER und HIGGINS, 2002) Gut differenziertes (diffuses) Astrozytom Das gut differenzierte Astrozytom besteht je nach histologischem Untertyp aus unterschiedlich großen und geformten, jedoch meistens locker gebündelten Zellen. Anzeichen für Malignität, Nekrosen, eine erhöhte Mitoserate und Gefäßproliferation sind nicht zu erkennen. Fibrilläre Astrozytome stellen den häufigsten astrozytären Untertyp bei Hund und Katze dar. Die Tumoren bilden mit ihren länglichen, spindelförmigen und teilweise polygonalen Zellen ein fibrilläres Netzwerk. Die Zellkerne sind rund, rundoval oder irregulär geformt und weisen häufig eine Hyperchromasie auf. Das Zytoplasma ist spärlich; Mitosen sind nicht zu finden (LUGINBÜHL et al., 1968; FRENIER et al., 1990; KOESTNER et al., 1999). Das protoplasmatische Astrozytom ist durch sternförmige, kleine Zellen mit wenigen, kurzen Fortsätzen und runde, chromatinreiche Kerne gekennzeichnet. Mitosen sind selten und vereinzelt finden sich mikrozystische Areale (LUGINBÜHL et al., 1968; ZAKI, 1977; FRENIER et al., 1990; SUMMERS et al., 1995; KOESTNER et al., 1999). Das Charakteristikum der gemistozytären Astrozytome sind große, polygonale Zellen mit reichlich eosinophilem Zytoplasma. Die Zellen haben kurze, plumpe Zellfortsätze, einen oder mehrere, runde bis rundovale Kerne mit meist mehreren Nukleoli. Mitosen werden selten beobachtet. Eine Infiltration mit Lymphozyten tritt bei dieser 5
20 Literaturübersicht Variante bevorzugt auf (ZAKI, 1977; FRENIER et al., 1990; KOESTNER et al., 1999). Zu den in der WHO-Klassifikation genannten Varianten finden sich in der Literatur Beschreibungen von astrozytären Tumoren, die dem Bild des pilozystischen Astrozytoms der Humanmedizin entsprechen (SANT`ANA et al., 2002; STOICA et al., 2004). Histologische Kriterien sind: bipolare, haarförmige Zellen, Rosenthal Fasern (sich verjüngende, korkenzieherförmige, eosinophile, hyaline, intrazytoplasmatische Konglomerate), granuläre, hyaline Tropfen, eosinophile Einschlusskörperchen (meist in den Fortsätzen), Mikrozysten und glomeruloide Gefäßproliferationen. Mitosen werden nicht beschrieben. Zudem fanden STOICA et al. (2004) in ihrer Studie bei 2 Hunden Astroblastome. Diese zeigen ein papilläres Wachstum, eine radiale Anordnung von spindelförmigen Tumorzellen um Gefäße und eine ausgeprägte Sklerosierung der Gefäße. Es können keine Gefäßendothelproliferationen, Kernpleomorphien und erhöhte Mitoseraten nach-gewiesen werden. DUNIHO et al. (2000) beschrieben ein subependymales, großzelliges Astrozytom bei einer 6 Jahre alten Katze. Ein solcher Fall wurde auch schon in der Humanmedizin publiziert (SIMA und ROBERTSON, 1979). Histologisch zeigt der umschriebene, mäßig zellreiche Tumor pleomorphe, spindelförmige bis polygonale Zellen in ineinander vernetzten Zügen und perivaskuläre Pseudorosetten. MEYERHOLZ und HAYNES (2004) veröffentlichten einen Fall eines solitären, retinalen Astrozytoms bei einem Hund Anaplastisches Astrozytom Anaplastische Astrozytome besitzen neben den typischen Merkmalen eines Astrozytoms eine erhöhte Zelldichte, pleomorphe Zellen, nukleäre Atypien, teilweise multinukleäre Riesenzellen und Mitosen. Laut veterinärmedizinischer WHO (1999) kommen glomeruloide Gefäßproliferationen und Nekrosen nicht in diesem Tumor vor. Andere Autoren haben in Anlehnung an die Humanmedizin das Vorkommen von Gefäßproliferationen in anaplastischen Astrozytomen beschrieben (MOULTON, 1961; SUMMERS et al., 1995) Glioblastoma multiforme Das Glioblastom ist der bösartigste Tumor unter den Astrozytomen und in der Humanmedizinischen WHO als Grad IV eingeteilt. Das Vorkommen bei Hund und Katze ist selten (LUGINBÜHL et al., 1968; SCHIEFER und DAHME, 1962; SARFATY et 6
21 Literaturübersicht al., 1987; LENZ et al., 1991; SATO et al., 2003). Die histologischen Charakteristika bestehen in einer erhöhten Zelldichte, wenig differenzierten, pleomorphen Zellen, Anaplasie, Pseudopalisaden aus neoplastischen Zellen um Nekrosefelder, einer hohen Anzahl glomeruloider Gefäßproliferationen, multi-nukleären Zellen und Mitosen (DAHME und SCHIEFER, 1960). Die Gefäß-proliferationen und die Nekrosen mit Pseudopalisaden bilden das wichtigste Kriterium für die Abgrenzung vom anaplastischen Astrozytom (LIPSITZ et al., 2003). Die in der Humanmedizin von KLEIHUES und OHGAKI (1997) beschriebenen, genetisch bedingten unterschiedlichen Entstehungswege für primäre und sekundäre Glioblastome sind in der Veterinärmedizin noch nicht untersucht. Aufgrund der morphologischen Ähnlichkeit zum anaplastischen Olidogendrogliom akzeptieren manche Autoren das Glioblastom als ein Gliom vierten Grades unterschiedlichen Ursprungs (astroglial, oligodendroglial oder ependymal). Aber auch die Möglichkeit eines gemischten Tumors mit astroglialen und oligodendroglialen Anteilen (siehe gemischte Gliome) wird erwogen (SUMMERS et al., 1995). Eine großzellige Variante des Glioblastoms stellt das sogenannte Giant cell Glioblastom dar, das beim Tier sehr selten vorkommt (UCHIDA et. al., 1995; KOESTNER et al., 1999, KLEIHUES und CAVENEE, 2000). Histologisch handelt es sich um eine sehr pleomorphe Tumorzellpopulation mit eingestreuten Nekrosefeldern und randständigen Zell-palisaden. Die Zellen sind groß, bizarr oder plump mit eosinophilem Zytoplasma und atypischem, häufig multinukleärem Kern. Die Mitoserate ist erhöht und es gibt eine Infiltration mit lymphatischen Zellen (UCHIDA et al., 1995) Immunhistologische Phänotypisierung astrozytärer Tumoren Der wichtigste immunhistologische Marker für Astrozytome ist das saure Gliafaserprotein (GFAP). Dieses ist ein gliales Intermediärfilament, das im Zytoplasma von normalen, besonders aber in reaktiven und neoplastischen Astrozyten nachweisbar ist. Je undifferenzierter der Tumor ist, desto weniger GFAP-positive Zellen findet man (KOESTNER und HIGGINS, 2002). Von den gut differenzierten Astrozytomen zeigt jedoch das protoplasmatische Astrozytom nur einen geringen Gehalt an GFAP (KOESTNER et al., 1999). Häufig exprimieren die runden Zellen mit wenig Zytoplasma mäßig GFAP, während die gut differenzierten elongierten Zellen eine deutliche Kennzeichnung aufweisen (STOICA et al., 2004). Die Markierung kann in den 7
22 Literaturübersicht fibrösen Zellfortsätzen, im Zytoplasma oder auch in beiden Komponenten lokalisiert sein (VANDEVELDE et al., 1985). Vergleichbar mit der Humanmedizin (HERPERS et al., 1986) gibt es eine Koexpression von GFAP und dem Intermediärfilament Vimentin (KOESTNER und HIGGINS, 2002). Vimentin verhält sich beim Glioblastom in seinem Markierungsmuster wie GFAP (LIPSITZ et al., 2003). Während KOESTNER et al. (1999) bei manchen Glioblastomen eine Zytokeratinexpression finden, können LIPSITZ et al. (2003) das für 5 kanine Glioblastome nicht bestätigen. Veterinärmedizinisch gibt es für die Unterscheidung von Astrozytomen und Oligodendrogliomen keinen weiteren Marker, jedoch beschreiben WANG et al. (1998) einen Tyrosinkinaserezeptor der beim Menschen vorwiegend in Astrozyten und astrozytären Gliomen exprimiert wird. Reaktive Astrozyten und astrozytäre Gliome zeigen eine starke Markierung mit dem Tyrosinkinase (Trk) A, B, und C spezifischen Antikörpern (WANG et al., 1998). Oligodendrozyten und die von ihnen ausgehenden Neoplasien färben sich in dieser Studie nicht an. Im solitären retinalen Astrozytom zeigt sich eine GFAP- Markierung in 30% der neoplastischen Astrozyten sowie eine Markierung für das S100-Protein, Vimentin und NSE. Die Neurofilament-Färbung ist negativ. Obwohl NSE eigentlich spezifisch für Neuronen und deren Fortsätze ist, werden auch in der Humanmedizin NSE-positive reaktive Astrozyten und Astrozytome gefunden (VINO- RES und RUBINSTEIN, 1985). SANT`ANA et al. (2002) finden bei einem felinen pilozytischen Astrozytom eine starke, multifokale Immunreaktion für S100-Protein und GFAP. STOICA et al. (2004) lokalisieren GFAP im pilozystischen Astrozytom in den pilozytischen Zellen, den Rosenthal Fasern und den eosinophilen Einschlusskörperchen. Die in der Veterinärmedizin äußerst selten vorkommenden Astroblastome, welche nicht in der WHO-Klassifikation (1999) aufgeführt sind, sind positiv für GFAP und S100-Protein (STOICA et al., 2004). Beim Menschen wird darüber hinaus eine Markierung für Vimentin nachgewiesen (CABELLO et al., 1991; PIZER et al., 1995; RUSSELL und RUBINSTEIN, 1998). Die Reaktivität dieser Tumoren für NSE wird in der humanmedizinischen Literatur teils als positiv (CABELLO et al., 1991; PIZER et al., 1995) und teils als negativ (HUSAIN und LEESTMA, 1986) angegeben. Das von DUNIHO et al. (2000) beschriebene subependymale, großzellige Astrozytom bei der Katze zeigt eine diffuse S100-Protein-, multifokal eine GFAP- und nur wenig NSE- Expression. Es ist negativ für NF, während in der Humanmedizin positive Fälle beschrieben worden sind (LOPES et al., 1996). Vom großzelligen Subtyp des Gli- 8
23 Literaturübersicht oblastoms waren alle Zellen intensiv mit Vimentin markiert. Die Kennzeichnung von S100-Protein ist mäßig, die von GFAP (monoklonaler Antikörper) geringgradig, während die Riesenzellen kein GFAP (monoklonaler Antikörper) exprimieren. Eine positive Reaktion der Zellen kann allerdings mit einem polyklonalen Antikörper gegen GFAP beobachtet werden (UCHIDA et al., 1995) Oligodendrogliale Tumoren Oligodendrogliome kommen gehäuft beim Hund vor, allerdings liegen widersprüchliche Angaben vor, ob das Oligodendrogliom oder das Astrozytom der häufigste ZNS- Tumor der Kaniden ist. Die Ursache liegt wahrscheinlich in der unterschiedlichen Rasseverteilung in den einzelnen Studien, da Boxer, Boston Terrier und Bulldoggen besonders häufig von Oligodendrogliomen betroffen sind (LUGINBÜHL, 1962; HAY- ES und SCHIEFER, 1969; SUMMERS et al., 1995; KOESTNER und HIGGINS, 2002). Katzen weisen im Gegensatz zum Hund sehr selten Oligodendrogliome auf (LECOUTEUR et al., 1983; SUMMERS et al., 1995; WILSON und BECKMAN, 1995). Es sind vorwiegend ausgewachsene Hunde, die älter als 5 Jahre sind (HAY- ES und SCHIEFER, 1969; TAYLOR et al., 1972) und männliche Tiere betroffen (LUGINBÜHL et al., 1968). Bevorzugte Lokalisationen sind die graue und weiße Substanz der Großhirnhemisphären oder das Dienzephalon, wobei sie teilweise um die Lateralventrikel wachsen (TRIOLO et al., 1994; SUMMERS et al., 1995). Selten kommen sie auch im Hirnstamm und im Rückenmark vor (KOESTNER und HIG- GINS, 2002). Typischerweise sind Oligodendrogliome scharf demarkiert (MAMOM et al., 2004). Beim Hund brechen sie häufig in die Seitenventrikel ein und bei der Katze infiltrieren sie eher die Meningen (KOESTNER und HIGGINS, 2002). Die Konsistenz der oft großen Tumoren wird als gelatinös und mukoid beschrieben und ihre Farbe variiert von grau-blau bis rosa (LUGINBÜHL et al., 1968; KOESTNER und HIGGINS, 2002) Oligodendrogliom Charakteristisches histologisches Kriterium ist die Honigwabenstruktur (Folge eines Fixationsartefaktes) des Tumors in der Übersichtsvergrößerung (DAVIS und NEU- BUERGER, 1940; DAHME und SCHIEFER, 1960). Der Tumor besteht aus solide proliferierenden, teils in Ketten und Strängen angeordneten (LUGINBÜHL et al., 1968; MAMOM et al., 2004), uniformen Zellen, die einen chromatinreichen, kleinen 9
24 Literaturübersicht Kern, schwach eosinophiles Zytoplasma und deutliche Zellgrenzen besitzen. Weitere histologische Eigenschaften sind multifokale Verkalkungen und in Reihen oder Haufen angeordnete Gefäße, die häufig am Rand des Tumors liegen (TAYLOR et al., 1972; SUMMERS et al., 1995; KOESTNER und HIGGINS, 2002). In manchen Oligodendrogliomen sind muzinreiche Degenerationen mit interzellulären Akkummulationen von blassem, grau-blauen Material zu sehen Anaplastisches Oligodendrogliom Kennzeichen des anaplastischen Olidodendroglioms sind eine erhöhte mitotische Aktivität (1-2 Mitosen/high power field (hpf)), eine höhere Zelldichte, Anisokaryosen, glomeruloide Gefäßproliferationen (DAHME und SCHIEFER, 1960) und teilweise Nekrosen mit Pseudopalisaden (KOESTNER und HIGGINS, 2002) Immunhistologische Phänotypisierung oligodendroglialer Tumoren Für formalinfixierte und in Paraffin eingebettete Oligodendrogliome gibt es bis heute keine spezifischen Marker. Das von humanen Oligodendrogliomen exprimierte Myelin-basische-Protein und Myelin-assoziierte-Glykoprotein ist in kaninen (VANDEVEL- DE et al., 1985) und felinen (DICKINSON et al., 2000) Oligo-dendrogliomen immunhistologisch nicht nachweisbar. Intratumorale vaskuläre Proli-ferationen zeigen eine immunhistologische Markierung mit von Willebrand Faktor VIII (DICKINSON et al., 2000; KOESTNER und HIGGINS, 2002). Eine GFAP-Expression in Oligodendrogliomen kann sowohl in intratumorösen, reaktiven Astrozyten, als auch in Minigemistozyten beobachtet werden (VANDEVELDE et al., 1985; DICKINSON et al., 2000). Auch in der Humanmedizin sind GFAP-positive Minigemistozyten gefunden worden. Zusätzlich werden dort auch GFAP-positive, neoplastische, gliofibrilläre Oligodendrozyten beschrieben (HERPERS und BUDKA, 1984; KROS et al., 1990; MATY- JA et al., 2001). Manche humane Oligodendrogliome exprimieren S100-Protein, Vimentin und Leu7, allerdings sind diese Marker nicht als spezifisch für diesen Tumortyp anzusehen (CRUZ et al., 1991; KOESTNER et al., 1999). Das Vorkommen neuronaler Marker, wie Synaptophysin, NSE und NF (Klon 2F11) wurde in einem kaninen Oligodendrogliom beschrieben (PARK, 2003). Auch human-medizinisch wurden Neoplasien beschrieben, welche eine Expression von Synaptophysin und NF (nicht phosphoriliert) aufweisen (WHARTON et al., 1998). Galaktozerebroside (KENNEDY et al., 1987; SUNG et al., 1996), Proteolipid-Protein, andere Ganglioside und ver- 10
25 Literaturübersicht schiedene Enzyme, wie die 2-3 -zyklische Nukleotid-3 -phophatase (CPNase), markieren nur eine kleine Anzahl humaner, neoplastischer Oligodendrozyten (SUNG et al., 1996; KLEIHUES und CAVENEE, 2000; MAMOM et al., 2004) Andere Gliome Gemischtes Gliom (Oligoastrozytom) Dieser Tumor beinhaltet sowohl astrozytäre, als auch oligodendrogliale Anteile, die gemischt oder getrennt in unterschiedlichen Bereichen vorkommen (VERNAU et al., 2001). Liegt keine strikte Trennung der beiden Zelltypen vor, muss der Tumor von einem Oligodendrogliom mit Astrozytenproliferation unterschieden werden. Die beiden Komponenten können sowohl regional abgegrenzt, als auch ineinander übergehend auftreten. Der oligodendrogliale Anteil überwiegt meist beim Hund (KOESTNER und HIGGINS, 2002). Die anaplastische Variante besitzt die gleichen histologischen Eigenschaften wie anaplastische Oligodendrogliome und Astrozytome (siehe und ). Die histologische Abgrenzung vom Glioblastoma multiforme ist schwierig (KOESTNER et al., 1999) Gliosarkom In diesem beim Haustier selten vorkommenden Tumor finden sich neben einem a- naplastischen Gliom unterschiedliche Anteile sarkomatöser Strukturen, beispielsweise ein Fibrosarkom oder Angiosarkom (KOESTNER et al., 1999) Gliomatosis cerebri Bei der seltenen, vorwiegend brachizephale Hunderassen betreffenden Gliomatose sind weite Areale des Gehirns und des Rückenmarkes mit elongierten Zellen infiltriert. Die Zellen in den hochgradig infiltrierten Bereichen sind größer und weisen eine höhere Polymorphie auf (KOESTNER et al., 1999; PORTER et al., 2003) Spongioblastom Das vereinzelt beim Hund vorkommende Spongioblastom besteht aus in Palisaden angeordneten, uni- oder bipolaren Zellen mit länglichem Kern. Es treten vermehrt Gefäßproliferationen und Mitosen, jedoch keine Nekrosen auf. Die Umgebung der ependymalen Auskleidung, die Mittellinie, Hirnstamm, Kleinhirn und der Nervus opti- 11
26 Literaturübersicht cus sind oft betroffen (ZÜLCH, 1956; JUBB und HUXTABLE, 1963; KOESTNER et al., 1999) Immunhistologische Phänotypisierung anderer Gliome Beim Oligoastrozytom findet sich eine starke GFAP-Markierung in den astrozytären Bereichen (KOESTNER und HIGGINS, 2002). Andere bei den Astrozytomen und O- ligodendrogliomen aufgezählten Marker können in den jeweiligen Bereichen vorkommen. Bei den Gliosarkomen werden Antikörper gegen GFAP, S100-Protein und Vimentin benutzt, um die glialen und sarkomatösen Anteile differenzieren zu können (KOESTNER et al., 1999). Da der sarkomatöse Anteil des Tumors Retikulin produziert, verwendet man in der Humanmedizin eine Retikulin-/ GFAP-gekoppelte Markierung, um eine sichere Diagnose stellen zu können (KLEIHUES und CAVENEE, 2000). Die langen Fortsätze der Zellpopulation der Gliomatosis cerebri färben sich oft für GFAP an (KOESTNER et al., 1999). Andere Autoren beschreiben das Fehlen der Reaktion mit GFAP in der Mehrzahl der Fälle (VANDEVELDE et al., 1985; POR- TER et al., 2003). In der Humanmedizin ist eine variable Markierung mit GFAP und S100-Protein beschrieben (ARTIGAS et al., 1985; KLEIHUES und CAVENEE, 2000). Über die immunhistologische Untersuchung des Spongioblastoms beim Tier ist bis jetzt noch nichts bekannt Ependymale Tumoren Das Ependymom kommt nur selten bei Hund und Katze vor (LUGINBÜHL et al., 1968; FOX et al., 1973; INGWERSEN et al., 1989; MCKAY et al., 1999; VERNAU et al., 2001). Diese Tumoren entwickeln sich aus der zellulären Auskleidung der Ventrikel und des Zentralkanals. Aus diesem Grund sind ihre bevorzugten Lokalisationen die lateralen Ventrikel, weniger häufig der dritte und vierte Ventrikel und selten der Zentralkanal des Rückenmarks (LUGINBÜHL et al., 1968; CHAFFEE, 1977; ZA- CHARY et al., 1981). In der Literatur werden keine Angaben über Rassedispositionen und das durchschnittliche Alter der betroffenen Tiere gemacht, wobei in manchen Studien vorwiegend Boxer befallen waren (LUGINBÜHL et al., 1968; BAUM- GÄRTNER und PEIXOTO, 1987). Makroskopisch sind Ependymome intraventrikuläre, gut umschriebene, weiche, graue bis rote (je nach Anzahl und Größe der Blutungen) Tumoren, die bei der Katze eher eine granuläre Beschaffenheit aufweisen (KOESTNER und HIGGINS, 2002). 12
27 Literaturübersicht Ependymom Mikroskopisch sind Ependymome durch eine hohe Zelldichte, runde bis ovale, meist hyperchromatische Kerne und wenig eosinophiles Zytoplasma mit scharfen Zellgrenzen gekennzeichnet. Das Charakteristikum stellen die zu Pseudorosetten (perivaskulär angeordnete Kerne) (SCHIEFER und DAHME, 1962) und teilweise echten Rosetten (um ein Lumen angeordnete Kerne) geformten, neoplastischen Zellen dar (BAUMGÄRTNER und PEIXOTO, 1987). Dazwischen liegen die Zellen in Reihen oder Ballen, ohne ein bestimmtes Muster zu formen. Bei felinen Ependymomen findet man im Gegensatz zum Hund häufiger perivaskuläre Pseudorosetten und ependymale Rosetten (KOESTNER und HIGGINS, 2002). Die in der WHO-Klassifikation genannte Variante ist das papilläre Ependymom (KOESTNER et al., 1999). Dieses besteht aus einem ein- oder mehrreihigen Zylinderepithel, welches einem fibrovaskulären Grundstock aufsitzt. Das Epithel ist in Form von Pseudorosetten arrangiert. Ependymale Rosetten kommen nur selten vor. Andere Autoren beschreiben zusätzlich einen zellulären Subtyp (zelluläres Ependymom) (KOESTNER und HIG- GINS, 2002). In Ahnlehnung an die humanmedizinische Einteilung wurde bei der Katze ein tanyzytisches Ependymom beschrieben (MCKAY et al., 1999) Anaplastisches Ependymom Das anaplastische Ependymom kann infiltrativ wachsen und zeigt deutliche Anzeichen von Anaplasie, in Form von Verlust der typischen Rosettenstruktur, einem verschobenen Kern-Zytoplasma-Verhältnis, einer erhöhten Zelldichte und erhöhten Mitoserate (FOX et al., 1973; KOESTNER et al., 1999; MICHIMAE et al., 2004) Immunhistologische Phänotypisierung ependymaler Tumoren Für Ependymome beschrieben KOESTNER et al. (1999) eine positive Vimentin- Reaktion und eine sich vorwiegend auf die Pseudorosetten bezogene GFAP- Markierung. VANDEVELDE et al. (1985) veröffentlichten jedoch eine Studie, in der 8 von 9 untersuchten Ependymomen negativ für GFAP waren, sowie auch die von BAUMGÄRTNER und PEIXOTO (1987) untersuchten Ependymome keine GFAP- Markierung zeigten. Eine positive Reaktion für GFAP, Vimentin und S100-Protein wurde bei einem felinen Ependymom gefunden (MCKAY et al., 1999). Humane E- pendymome exprimieren typischerweise mehr GFAP, Vimentin, S100-Protein und 13
28 Literaturübersicht fokal Zytokerantin (KIMURA et al., 1986; MANNOJI und BECKER, 1988). MICHIMAE et al. (2004) beschreiben einen Hund mit einem GFAP-negativen und schwach Vimentin- und Zytokeratin (AE1/AE3)-positiven anaplastischen Ependymom. Eine reduzierte Reaktion mit GFAP ist auch beim Menschen bekannt (KLEIHUES und CA- VENEE, 2000) Tumoren des Plexus choroideus Ursprung dieser meist gutartigen Tumoren sind die Epithelzellen der Plexus choroidei der vier Ventrikel (COTCHIN, 1953; LIESEGANG, 1958; KURTZ und HANLON, 1971; ZAKI, 1977; KOESTNER und HIGGINS, 2002). Eine Rassedisposition ist nicht bekannt, es wird jedoch ein gehäuftes Vorkommen beim Rüden beschrieben (ZAKI und NAFE, 1980; RIBAS et al., 1989; CANTILE et al., 2002). Die betroffenen Tiere sind meist älter als 6 Jahre. Bei der Katze sind nur einzelne Fälle von Plexustumoren beschrieben (TROXEL et al., 2003). Bevorzugte Lokalisation ist der 4. Ventrikel (ZA- KI und NAFE, 1980), andere Autoren fanden die Tumoren eher supratentorial (RI- BAS et al., 1989) Choroid-Plexuspapillom (CPP) Es handelt sich um gut umschriebene, gräuliche bis weiße, teils rote, blumenkohlartige Gewächse ohne Kapsel. Das Charakteristikum der Choroid-Plexuspapillome ist das verzweigte blumenkohlartige Wachstum auf einem fibrovaskulärem Grundstock (LIESEGANG, 1958). Die einreihig angeordneten, kuboidalen bis säulenförmigen Zellen sitzen auf einer Basalmembran (KOESTNER und HIGGINS, 2002). Die Kerne sind ovoid und zeigen häufig eine geringgradige Anisokaryose. Mitosen finden sich nur selten, während Blutungen, Nekrosen und Mineralisationen häufiger auftreten (KOESTNER et al., 1999) Choroid-Plexuskarzinom (CPK) Die Choroid-Plexuskarzinome zeigen ein lokal invasives Wachstum und metastasieren häufig über den Liquor in den subarachnoidalen Raum und andere Ventrikel (CANTILE et al., 2002). Infolge der Anaplasie geht die typische Papillenarchitektur, je nach Malignitätsgrad, verloren. Zelluläre Pleomorphie, nukleäre Atypie, eine erhöhte Mitoserate und Nekrosen prägen das Bild des Plexuskarzinoms (WILSON et al., 1989). CANTILE et al. (2002) schlagen aufgrund der unterschiedlichen Morpho- 14
29 Literaturübersicht logie das Vorkommen von zwei möglichen Subtypen vor: das gut differenzierte und das anaplastische Plexuskarzinom Immunhistologische Phänotypisierung der Plexustumoren Angaben über die immunhistologische Markierung von Plexuspapillomen variieren in der Tiermedizin relativ stark. Hinsichtlich der Zytokeratinexpression (Panzytokeratine und AE1/AE3) reichen die Angaben von positiv (KOESTNER und HIGGINS, 2002) über variabel (SUMMERS et al., 1995; KOESTNER et al., 1999; CANTILE et al., 2002) bis zu vorwiegend negativ (RIBAS et al., 1989). CANTILE et al. (2002) fanden eine multifokale Markierung von weniger gut differenzierten Tumoren mit Pankeratin und AE1 und eine multifokale Kennzeichnung von gut differenzierten Neoplasien mit AE3. GFAP-positive Tumoren werden nur selten (CANTILE et al., 2002) oder gar nicht beobachtet (VANDEVELDE et al., 1985; RIBAS et al., 1989; WILSON et al., 1989; KOESTNER und HIGGINS, 2002). Zwei von elf untersuchten Papillomen weisen in einer Studie von RIBAS et al. (1989) eine Markierung mit CEA auf. Bei den Plexuskarzinomen zeigen sich multifokal zytokeratin-positive Bereiche (CANTILE et al., 2002). Ein weniger gut differenzierter Tumor ist in derselben Studie positiv für GFAP und zeigt eine diffuse Vimentin-Markierung Die gut differenzierten Plexuskarzinome sind hingegen multifokal positiv für Vimentin und teilweise für CEA. In der Humanmedizin exprimieren die Mehrzahl der Plexustumoren Zytokeratin (AE1/AE3, Panepithelialer Marker: lu-5) und Vimentin (MIETTINEN et al., 1986; MANNOJI und BECKER, 1988; KLEIHUES und CAVENEE, 2000). 90% der Tumoren reagieren mit dem S100-Protein Antikörper, wohingegen nur 20-25% fokal GFAP positiv sind. Andere positive Marker sind CEA und NSE (COFFIN et al., 1986) Neuronale und gemischt glioneuronale Tumoren Es kommen 3 verschiedene neuronale und gemischt glioneuronale Tumoren bei Hund und Katze vor. Dazu gehören das Gangliozytom, das Gangliogliom und das Ästhesioneuroblastom. Die beim Hund selten vorkommenden, aus reifen, neoplastischen Ganglienzellen bestehenden, benignen Gangliozytome zeigen ein relativ monomorphes Zellbild (MILKS und OLAFSON, 1936; NYSKA et al., 1995; KOESTNER et al., 1999). Die großen, pyramidenzellählichen, teils bi- oder multinukleären Zellen haben ein homogenes, eosinophiles oder vakuolisiertes Zytoplasma mit einem großen, runden bis ovalen Nukleus und ein bis zwei markante Kern- 15
30 Literaturübersicht körperchen. Mitosen sind selten oder gar nicht nachweisbar (KOESTNER et al., 1999). Beim Gangliogliom handelt es sich um einen extrem seltenen, benignen Tumor, der neben den entarteten neuronalen Zellen auch neoplastische, gliale Zellen enthält (KOESTNER et al., 1999). Das Ästhesioneuroblastom (olfaktorisches Neuroblastom) besteht aus unreifen, neuronalen Zellen, die aus den Vorläuferzellen des nasalen Riechepithels hervorgehen. Der Tumor tritt selten ein- oder beidseitig in der Nasenhöhle bei Hunden und Katzen auf und kann durch das Siebbein in den Lobus frontalis des Großhirns einbrechen (POSPISCHIL und DAHME, 1981; COX und POWERS, 1989; MATTIX, 1994; PAES DE LIMA et al., 1994). Bei der Katze wurden Lymphknotenmetastasen beschrieben und ein Zusammenhang mit dem felinen Leukämie-Virus diskutiert (SCHRENZEL et al., 1990) Immunhistologische Phänotypisierung neuronaler Tumoren Vergleichbar dem Gangliogliom exprimieren Gangliozytome in Arealen mit neoplastischen Ganglienzellen NSE, NF und Synaptophysin, während GFAP nicht nachweisbar ist (NYSKA et al., 1995; KOESTNER et al., 1999). Beim Gangliogliom zeigen die glialen Zellen eine Markierung für GFAP (KOESTNER et al., 1999). Im Ästhesioneuroblastom findet sich eine Expression von glialen und neuronalen Markern, wie SP, NSE, NF, S100-Protein und GFAP (KOESTNER et al., 1999). Bei einem Deutschen Schäferhund mit Ästhesioneuroblastom, der zwar eine Immunreaktivität mit NSE und NF zeigte, konnte keine Reaktion mit Chromogranin A, Synaptophysin und S100- Protein nachgewiesen werden (MATTIX et al., 1994) Embryonale Tumoren Embryonale Tumoren entstehen aus einer neuroepithelialen, germinativen Ausgangszelle mit glialem, neuronalem, ependymalem und eventuell mesenchymalem Differenzierungspotential. Daher wurde auch der Ausdruck primitiver, neuroektodermaler Tumor (PNET) als Oberbegriff für alle embryonalen Tumoren, unabhängig von dem histologischen Bild und der Lokalisation, verwendet. In Anlehnung an die humanmedizinische Nomenklatur wurden aber in der aktuellen Klassifikation nur embryonale Tumoren die dem Medulloblastom zugeordnet werden unter dem Begriff PNET zusammengefaßt (KOESTNER et al., 1999, KOESTNER und HIGGINS, 2002). 16
31 Literaturübersicht Primitive neuroektodermale Tumoren (PNET s) Das Vorkommen von Medulloblastomen bei Hund und Katze ist wesentlich geringer als in der Humanmedizin (NEUBUERGER und DAVIS, 1943; LIESEGANG, 1958; KOESTNER et al., 1999). Bestimmte Rassen- oder Geschlechtsdispositionen sind bisher nicht bekannt (PETERS et al., 1999). Makroskopisch handelt es sich bei diesen bösartigen Tumoren um intrazerebellär (Vermis cerebelli oder Kleinhirnhemisphären) lokalisierte Neoplasien, die gut abgegrenzt sind und keine Kapsel aufweisen. Sie besitzen eine eher weiche Konsistenz und weisen eine graue bis rötliche Farbe auf. Oft entsteht durch die Kompression des vierten Ventrikels ein Hydrocephalus acquisitus. Mikroskopisch sind dicht gepackte, runde bis polygonale, in Reihen oder Banden angeordnete Zellen zu finden. Eine Pseudopalisadenbildung sowie das Vorkommen von Homer-Wright- (Anordnung von Kernen neuroblastischer Zellen um einen runden, soliden, zentral fibrillären Bereich) oder Flexner- Wintersteiner-ähnliche Rosetten (Kernanordnung um ein zentrales Lumen) sind kein konstantes Merkmal (LUGINBÜHL et al., 1968; STEINBERG und GALBREATH, 1998; PETERS et al., 1999). Die Kernform und der Gehalt an Chromatin werden als variabel beschrieben (KOESTNER et al., 1999). Mitosen sind in diesem malignen Tumor relativ häufig (DAHME und SCHIEFER, 1960). PNET s außerhalb des Zerebellums sind histologisch nicht vom Medulloblastom zu unterscheiden (KOESTNER et al., 1999) Neuroblastom Dieser maligne Tumor zeigt eine primitive neuronale Differenzierung und ist selten bei Hunden beobachtet worden. Neuroblastome können sowohl im zentralen als auch im peripheren Nervensystem vorkommen (SUMMERS et al., 1995). Die kleinen, runden, proliferativ aktiven Zellen sind in Nestern angeordnet, die durch Neuropil voneinander getrennt sind (KOESTNER et al., 1999). Auch prägen Pseudo- (CA- PUCCHIO et al., 2003) und Homer-Wright-Rosetten das histologische Bild (SUM- MERS et al., 1995) Ependymoblastom Das Ependymoblastom ist ein sehr seltener, maligner Tumor und besteht aus primitiven ependymalen Zellen (KOESTNER et al., 1999). 17
32 Literaturübersicht Thorako-lumbaler, spinaler Tumor junger Hunde Die betroffenen Hunde sind meistens zwischen 6 Monaten und 3 Jahren alt und es besteht eine Rassedisposition für Deutsche Schäferhunde und Retriever (BRIDGES et al., 1984; SUMMERS et al., 1988). Der Tumor zeichnet sich durch ein intradurales, extra- oder intramedulläres Wachstum in den thorako-lumbalen Rückenmarkssegmenten aus (SCHIEFER und DAHME, 1962; CLARK und PICUT, 1986; SUM- MERS und DE LAHUNTA, 1986; DAHME et al., 1987; NEEL und DEAN, 2000). Die Histiogenese des Tumors ist bis heute nicht eindeutig geklärt. Lange Zeit wurde ein neuroepithelialer Ursprung angenommen und der Tumor daher als Ependymom, Medulloepitheliom oder Neuroepitheliom bezeichnet. Neuere Erkenntnisse lassen jedoch auf ein ektopisches Nephroblastom schließen, das nicht neuronalen Ursprungs ist (BRIDGES et al., 1984; PEARSON et al., 1997). Histologisch finden sich kompakte, spindelförmige, deutlich abgrenzbare Tumorzellen in ineinander verwobenen Strängen, epitheliale Zellen mit Tubulusformation, seltener glomeruloide Strukturen und Rosetten. Die runden bis ovoiden Kerne der epithelialen Strukturen sind hyperchromatisch mit vergrößertem Nukleolus. Mitosefiguren sind in unterschiedlicher Anzahl zu finden (BAUMGÄRTNER und PEIXOTO, 1987; KOESTNER und HIGGINS, 2002) Immunhistologische Phänotypisierung embryonaler Tumoren Abhängig vom Grad der Differenzierung exprimieren Medulloblastome und außerhalb des Zerebellums liegende PNET s einen oder mehrere neuronale Marker. Synaptophysin und NF führen häufiger zu positiven Ergebnissen, als der Nachweis von NSE. Die Reaktivität des GFAP-Antikörpers hängt von dem Vorkommen astrozytärer Komponenten ab. Im Falle hochgradiger Anaplasie können sowohl gliale als auch neuronale Marker zu negativen Ergebnissen führen (VANDEVELDE et al., 1985; KOESTNER und HIGGINS, 2002). In einer Studie konnte eine Vimentin-Expression nachgewiesen werden (VAN WINKLE et al., 1996). Humanmedizinisch wird die positive Reaktion mit dem Synaptophysin-Antikörper als ein charakteristisches Merkmal angesehen (COFFIN et al., 1990). Die von KOESTNER und HIGGINS (2000) untersuchten Neuroblastome exprimieren entweder Neurofilament oder Synaptophysin und in einigen Arealen beide Marker. In der Tiermedizin sind bis jetzt keine immunhistologischen Studien über Ependymoblastome veröffentlicht worden. Der Thorako- 18
33 Literaturübersicht lumbale Rückenmarkstumor junger Hunde exprimiert weder gliale noch neuronale Antigene (SUMMERS et al., 1988). Die Tubulusformationen und rosettenähnlichen Strukturen weisen eine für diesen Tumor typische Zytokeratin-Markierung (Keratin 5, 6, 8 und 14) auf (BAUMGÄRTNER und PEIXOTO, 1987; KOESTNER et al., 1999). Die in der Humanmedizin auch Wilms Tumor genannte Neoplasie exprimiert ein Wilms Tumor Gen Produkt (WT1 Antikörper), welches auch in einem kaninen Nephroblastom nachgewiesen werden konnte (PEARSON et al., 1997) Tumoren der Glandula pinealis Die von der Glandula pinealis ausgehenden Umfangsvermehrungen lassen sich in einen benignen (Pineozytom) und einen malignen (Pineoblastom) Tumor einteilen. Sie kommen beim Hund und der Katze sehr selten vor (ZÜLCH, 1957; SUMMERS et al., 1995). Das zellreiche, lobulierte Pineozytom geht von den pinealen Parenchymzellen aus und besteht aus polygonalen Zellen, die perivaskuläre Pseudo- und pineozytomatöse Rosetten (irreguläre fibrilläre Zonen) bilden (KOESTNER et al., 1999). Das Pineoblastom ist ein wahrscheinlich von den pinealen Stammzellen ausgehender Tumor, der in Reihen oder Bändern angeordnete, meist kleine Zellen mit relativ wenig Zytoplasma aufweist. Zellulärer Polymorphismus, Nekrosen, Flexner- Wintersteiner- und Homer-Wright-ähnliche Rosetten kommen ebenfalls in den teils invasiv wachsenden Tumoren vor (KOESTNER et al., 1999) Immunhistologische Phänotypisierung der Zwirbeldrüsentumoren Immunhistochemisch exprimieren Pineozytome in den fibrillären Zonen Synaptophysin, NSE und manchmal Neurofilament (KOESTNER et al., 1999). Das Zentrum der rosettenähnlichen Strukturen des Pineoblastoms zeigt ebenso eine positive Markierung mit Synaptophysin und NSE (KOESTNER et al., 1999) Meningotheliale Tumoren Meningeom Das Meningeom stellt bei Hund und Katze einen der häufigsten und am besten untersuchten intrakranialen Tumoren dar (DAVIS et al., 1948; ZAKI und HURVITZ, 1976; NAFE, 1979; LECOUTEUR, 1990; WOODS et al., 1992; LEPPIN et al., 1998; 19
34 Literaturübersicht LECOUTEUR, 1999; YEOMANS, 2000; BARNHART et al., 2002). Es ist der häufigste Tumor der Katze (LUGINBÜHL et al., 1968; SUMMERS et al., 1995; MORRISON, 1998). Sie treten vorwiegend bei adulten Hunden (> 7 Jahre) und Katzen (> 9 Jahre) auf (KOESTNER und HIGGINS, 2002). Dolichozephale Rassen, wie Golden Retriever und Deutscher Schäferhund (DSH), sind besonders disponiert (MCGRATH, 1962; FANKHAUSER und LUGINBÜHL, 1968; ANDREWS, 1973; FINGEROTH et al., 1987). Bei der Katze ist weder eine Rasse-, noch eine Geschlechtdisposition bekannt (KOESTNER und HIGGINS, 2002). Das kanine Meningeom, soll vergleichbar dem humanen, häufiger bei weiblichen Individuen auftreten (SUMMERS et al., 1995), welches wiederum von anderen Autoren nicht bestätigt werden konnte (KOESTNER und HIGGINS, 2002). Topographisch finden sich über 82% der Meningeome des Hundes intrakranial, 15% spinal und ca. 3% retrobulbär. Die Mehrzahl der Neoplasien wächst expansiv und demarkiert unter Verdrängung des umliegenden Gewebes. Meningeome beim Hund entstehen gewöhnlich über den Großhirnhemisphären in der Falx cerebri, den Konvexitäten oder in der Fossa caudalis am Hirnstamm. Im Rückenmark liegen sie meistens im Halsbereich, breiten sich oft auf die Spinalnervenwurzeln aus und zeigen eine extradurale Infiltration (ZAKI et al., 1975; FINGEROTH et al., 1987). Bei der Katze sind die Meningeome häufig supratentorial in den lateralen Ventrikeln lokalisiert. Kaudotentoriale und spinal lokalisierte Tumoren kommen relativ selten vor (KOESTNER und HIGGINS, 2002). Bei 20% der Katzen mit Meningeomen werden multiple kleinere Tumoren gefunden. Makroskopisch handelt es sich um feste, granuläre, gut demarkierte Neoplasien, die häufig lobuliert sind. Die mit den Meningen verbundenen Tumoren haben eine rötliche Farbe und sind teilweise mineralisiert (KOESTNER und HIGGINS, 2002). Während in der Humanmedizin 15 Meningeomvarianten unterschieden werden, sind es in der veterinärmedizinischen WHO-Klassifikation folgende neun Typen: das meningotheliomatöse, fibröse, transitionelle, psammomatöse, angiomatöse, papilläre, granularzellige, myxoide und das anaplastische Meningeom. Darüberhinaus gibt es Fallbeschreibungen über mikrozystische, atypische, lipomatöse und osteomatöse Varianten (RASKIN, 1984; FINGEROTH et al., 1987; PATNAIK, 1993; SUMMERS et al., 1995; BARNHARD et al., 2002). Laut PATNAIK et al. (1986) sollen die menigotheliomatöse und die transitionelle Form am häufigsten verbreitet sein. 20
35 Literaturübersicht Meningotheliomatöses Meningeom Diese Meningeomvariante besteht aus einer in Strängen, multifokal in Wirbeln ( whorls ) angeordneten, mäßig zelldichten, polygonalen Zellpopulation. Der Zytoplasmagehalt ist mäßig und die Zellgrenzen erscheinen undeutlich. Die Zellkerne sind rund bis oval. Es können jedoch auch Riesenzellen zu sehen sein, die bizarr geformte Nuklei enthalten. Mitosefiguren kommen selten vor (ANDREWS, 1973; PAT- NAIK et al., 1986; KOESTNER et al., 1999; KOESTNER und HIGGINS, 2002; YEO- MANS, 2000; BARNHART et al., 2002) Fibröses (fibroblastisches) Meningeom Die Zellen dieses Tumortyps liegen in ineinander verwobenen Strängen und zeigen ein spindelförmiges Aussehen mit länglichen Kernen und nur wenig eosinophilem Zytoplasma. Zwischen den Strängen ist in unterschiedlichem Maße ein retikuläres und kollagenes Maschenwerk zu erkennen (PATNAIK et al., 1986; KOESTNER et al., 1999) Transitionelles Meningeom Ein transitionelles Meningeom enthält Komponenten der meningotheliomatösen und fibrösen Variante. In den whorls werden gelegentlich geschichtete Verkalkungen (Psammomkörperchen) beobachtet (PATNAIK et al., 1986; ALTMAN et al., 1998; KOESTNER und HIGGINS, 2002; BARNHART et al., 2002) Psammomatöses Meningeom Ein psammomatöses Meningeom liegt dann vor, wenn das histologische Bild eines transitionellen Meningeoms durch whorls mit Psammomkörperchen bestimmt wird (ANDREWS, 1973; KOESTNER und HIGGINS, 2002) Angiomatöses Meningeom Das histologische Kriterium für diese Variante sind zahlreiche, unterschiedlich große Blutgefäße in einem transitionellen oder menigothelialen Meningeom (PATNAIK et al., 1986; KOESTNER und HIGGINS, 2002). 21
36 Literaturübersicht Papilläres Meningeom Dieser Tumor besteht aus papillär wachsenden, menigothelialen Zellen auf einem fibrovaskulären Grundstock. Zwischen den papillären Bereichen des Tumors sind große Flächen mit solide angeordneten Meningothelzellen zu finden (SCHULMAN et al., 1992; FERNÁNDEZ et al., 1995; KALDRYMIDOU et al., 2000; KOESTNER und HIGGINS, 2002; BARNHART et al., 2002) Granularzelliges Meningeom Im Zytoplasma der ovalen oder polygonalen Tumorzellen dieses Typs kommt eine PAS-positive und Diastase-resistente Granula vor (KOESTNER et al., 1999) Myxoides Meningeom Die Fossa caudalis und das Halsrückenmark sind bevorzugte Lokalisationen dieses seltenen Tumors. Das Zytoplasma der Tumorzellen ist vakuolisiert und interzellulär findet sich reichlich myxoide Grundsubstanz (VAN WINKLE et al., 1994; BARNHART et al., 2002) Anaplastisches (malignes) Meningeom Dieser Tumor ist sehr zellreich und durch großflächige Nekrosen, invasives Wachstum, Metastasierung und eine hohe Mitoserate gekennzeichnet (DAVIS et al., 1948; SCHMIDT et al., 1991; KOESTNER et al., 1999; BARNHART et al., 2002) Immunhistologische Phänotypisierung meningealer Tumoren Unabhängig von ihrem Subtyp reagieren Meningeome einheitlich und sehr stark mit Vimentin. Die meningothelialen Tumorvarianten exprimieren im Gegensatz zu den transitionellen oder papillären Meningeomen wesentlich häufiger Zytokeratin (Panzytokeratin, Klon MNF116; AE1/AE3). Die Markierung ist zumeist fokal und beschränkt sich auf wenige neoplastische Zellen. Eine diffuse GFAP-Markierung wurde in einem anaplastischem Meningeom beschrieben (BARNHART et al., 2002). Die Verteilung und Intensität der Markierung für S100 Protein und NSE ist sehr variabel. 80% der untersuchten Tumoren wiesen jedoch eine Kennzeichnung mit diesen Antiköpern auf, während Synaptophysin nicht nachgewiesen werden konnte (BARNHART et al., 2002). Der charakteristische Nachweis von epithelialem Membranantigen (EMA) in 22
37 Literaturübersicht humanen Meningeomen gelang beim Tier nicht. Ebenso konnte man die Ko- Expression von Vimentin und Desmoplakin in humanen Meningeomen (Immunfluoreszenz und Immunelektronemikroskopie) immunhisto-logisch nicht in der Veterinärmedizin nachvollziehen (KARTENBECK et al., 1984; KOESTNER und HIGGINS, 2002) Mesenchymale, nicht-meningotheliale Tumoren Fibrosarkom Das Fibrosarkom entspricht morphologisch seinem Pendant in der Haut und den Weichteilen (KOESTNER et al., 1999) Diffuse, meningeale Sarkomatose Diese sehr seltene, fokale oder diffuse Neoplasie ist bisher nur beim Hund beschrieben worden. Der Tumor ist vorwiegend in der gesamten Zirkumferenz der Leptomeninx spinalis lokalisiert und infiltriert entlang der Virchow-Robinschen-Räume. Das Zytoplasma der polymorphen, undeutlich begegrenzten Zellen ist oft vakuolisiert und die ovalen Kerne sind hyperchromatisch (ZÜLCH, 1957, 1960, 1964; KOESTNER et al., 1999) Immunhistologische Phänotypisierung mesenchymaler, nicht meningothelialer Tumoren Immunhistologisch färben sich Fibrosarkome mit mesenchymalen Markern wie Vimentin an. Bei der diffusen, meningealen Sarkomatose trägt die Immunhistologie dazu bei, Lymphome (CD3- oder CD79-positiv) und maligne Histiozytosen (Lysozym-, Alpha 1-antitrypsin- und Lektin RCA-1-positiv) differentialdiagnostisch abzugrenzen (KOESTNER et al., 1999) Lymphome und hämatopoietische Tumoren Zu den primären Gehirntumoren werden auch Lymphome gezählt, die nicht systemisch, sondern nur im Gehirn vorkommen (JOHNSON, 1990; LECOUTEUR, 1990). Bei der Katze gehören die Lymphome zusammen mit den Meningeomen zu den häufigsten ZNS-Tumoren (TIPOLD, 2000). Hingegen beschreiben TROXEL et al. (2003) in einer retrospektiven Studie das Lymphom nur als zweithäufigsten felinen Gehirntumor. Hunde sind weitaus seltener betroffen (MOORE et al., 1996). Der Hirn- 23
38 Literaturübersicht stamm, das Zerebellum und die Meningen (meist sekundär-metastatisch) sind die topographisch bevorzugten Lokalisationen (KOESTNER und HIGGINS, 2002; TRO- XEL et al., 2003) Lymphom (Lymphosarkom) Primäre B- und T-Zell Lymphome kommen bei Hund und Katze vor (VANDEVELDE et al., 1981; COUTO, 1984; FERRER et al., 1993; CALLANAN et al., 1996). 90% der Neoplasien sind aufgrund ihres Immunphänotyps T-Zell Lymphome (KOESTNER und HIGGINS, 2002). Makroskopisch sind die meist solitär wachsenden Tumoren von grauer Farbe und können aufgrund der Gefäßassoziation eine granuläre Struktur aufweisen (KOESTNER et al., 1999). Eine Ausbreitung über die Meningen ist möglich (KOESTNER und HIGGINS, 2002). Histologisch sind unimorphe, lymphoblastoide bis lymphoide, meist perivaskulär akzentuierte Zellinfiltrate mit einer Mitoserate von 2 Mitosen/hpf zu sehen. Einzelne Nekrosen und eine perivaskuläre Retikulinfaserbildung sind mikroskopisch auffällig (KOESTNER et al., 1999) Non-B, non-t leukozytäre Tumoren (neoplastische Retikulose) Es handelt sich um einen perivaskulär angeordneten, malignen ZNS-Tumor mit unbekannter Histiogenese. Dieser Tumor wird vorwiegend bei älteren Hunden und nur selten bei Katzen nachgewiesen (KOESTNER und ZEMAN, 1962; KOESTNER, 1975; BRAUND et al., 1978; VANDEVELDE et al., 1978; VANDEVELDE, 1980). Der bevorzugt in der weißen Substanz lokalisierte Tumor tritt als solitärer oder multifokaler, gut demarkierter Knoten von grau-weißer Farbe und feingranulärer Textur auf (FANKHAUSER et al., 1972; KOESTNER und HIGGINS, 2002). Histologisch sind konzentrische, perivaskuläre Infiltrationen histiozytoider Zellen markant, zwischen denen Nekrosen auftreten können. Die perivaskulär liegenden Zellen sind groß und elongiert und haben reichlich eosinophiles Zytoplasma und einen prominenten Nukleolus. Mitosen sind selten. Neben den mutmaßlichen neoplastischen Zellen können wenige B- und T-Lymphozyten vorkommen (KOESTNER et al., 1999; KOESTNER und HIGGINS, 2002) Mikrogliomatose Die Mikrogliomatose des Hundes hielt man zunächst für einen von der Mikroglia ausgehenden Tumor und teilte sie mit den Retikulosen in eine Klasse ein. Während 24
39 Literaturübersicht die Mikrogliomatose in der Humanmedizin als primäres ZNS-Lymphom klassifiziert wird bildet sie in der Veterinärmedizin eine eigenständige Entität, die aufgrund des Fehlens angiozentrisch angeordneter Tumorzellen von der Retikulose differenziert wird (FRAUCHIGER und FANKHAUSER, 1957; RUSSEL und RUBINSTEIN, 1963; RUBINSTEIN, 1964; VANDEVELDE et al., 1981). Betroffen sind vorwiegend ausgewachsene und alte Hunde (WILLARD und DE LAHUNTA, 1982). Die meist nur mikroskopisch erkennbaren Veränderungen finden sich diffus in der weißen Substanz der zerebralen Hemisphären, dem Hirnstamm oder dem Kleinhirn (VANDEVELDE et al., 1985; SUMMERS et al., 1995). Morphologisch ähneln die Zellen der sogenannten rod-shaped Mikroglia mit länglichen, stark basophilen Kernen und undeutlichen Zellgrenzen. Die Zahl der Mitosen variiert. Ob der Tumor nun eine wirkliche mikrogliomatöse Neoplasie darstellt oder den primitiven neuroektodermalen Tumoren zugeteilt werden kann, ist noch unklar (KOESTNER et al., 1999) Maligne Histiozytose Dieser Tumor ist kein primärer ZNS-Tumor, sondern gehört zu den generalisierten multizentrischen Erkrankungen. Der Berner Sennenhund ist besonders disponiert für die maligne Histiozytose, jedoch können auch andere Rassen erkranken. Der destruierend wachsende Tumor infiltriert diffus die Meningen oder bildet große Knoten im Parenchym (SUZUKI et al., 2003). Histologisch sind bizarre, große, histiozytoide und oft multinukleäre Zellen mit abnormalen Mitosefiguren zu finden (CHANDRA et al., 1999; KOESTNER et al., 1999) Immunhistologische Phänotypisierung der Lymphome und hämatopoietischen Tumoren Im Gegensatz zum Menschen sind über 90% der Lymphome bei Hund und Katze mit dem T-Zell Lymphozyten Antikörper (CD3) darstellbar (FERRER et al., 1993; FON- DEVILA et al., 1998; KOESTNER et al., 1999). Primäre zentrale B-Zell-Lymphome treten beim Hund auf und zeigen eine Immunreaktivität mit dem B-Zell-Marker CD79. Immunhistologische Studien der neoplastischen Retikulose ergaben Hinweise auf einen histiozytären und Makrophagen-ähnlichen Ursprung (KOESTNER und HIGGINS, 2002), da die Mehrzahl der Zellen CD18 exprimiert, während eine Färbung mit CD3 und CD79 (Klon: HM57) negativ ausfällt. Manche der Tumoren sind positiv für Makrophagen-Marker und exprimieren monoklonale Immunglobuline. Für 25
40 Literaturübersicht die differentialdiagnostische Abgrenzung der Mikrogliomatose vom Astrozytom wird der Nachweis von GFAP herangezogen (KOESTNER und HIGGINS, 2002). Die Zellen der Malignen Histiozytose reagieren mit histiozytären Markern wie Lysozym, Alpha 1-Antitrypsin und dem Lektin RCA-1 (SUZUKI et al., 2003) Selläre Tumoren Suprasellärer Keimzelltumor Dieser Tumor geht von dem ektopischen Keimdrüsenepithel aus. Man erklärt sich das extragonadale Auftreten solcher Tumoren mit der ektopischen Migration und Ansiedlung von Keimdrüsenepithel in andere Areale. Die Tumoren liegen meist supraund perisellär in der Mittellinie des Gehirns (CORDY, 1984). Betroffen sind junge bis mittelalte Hunde von 3-5 Jahren (VALENTINE et al., 1988). Die Rasse Dobermann scheint besonders prädisponiert zu sein. Makroskopisch sind Keimzelltumoren von grau-weißer Farbe und komprimieren durch ihre Größe häufig die Hypophyse und den Hypothalamus. Das heterogene Bild ist durch eine Septierung und gelegentlich durch Nekrosen und fokale Mineralisation gekennzeichnet. Histologisch können germinative, hepatoide und epitheliale Zellen unterschieden werden (PATNAIK und NAFE, 1980; VALENTINE et al., 1988; HARE, 1993). Die germinativen Zellen stellen eine mäßig polymorphe Population mit runden bis ovalen Kernen, granulärem Chromatin, einem Nukleolus und unterschiedlich viel Zytoplasma dar. Es können bis zu 4 Mitosen 4/hpf zu sehen sein. Die in Nestern liegenden, hepatoiden Zellen haben einen runden Kern und wenig Zytoplasma mit lipid-haltigen Vakuolen. Die säulenförmigen, epithelialen Zellen können azinöse und tubuläre Strukturen bilden (SUM- MERS et al., 1995) Hypophysenadenom Der benigne Tumor der Hypophyse kommt beim Hund häufiger als bei der Katze vor (MOORE et al., 1996). Während beim älteren Tier der häufigste Tumor das hormonell aktive Adenom des Hypophysenvorderlappens ist, tritt beim Menschen vorwiegend und bei der Katze gelegentlich das azidophile Adenom auf (ZAKI und HUR- VITZ, 1976; SCHMIDT und DAHME, 1999). Histologisch besitzen die Tumoren aus polygonalen bis spindelförmigen Zellen einen runden bis ovalen Kern mit 1 bis 2 Nukleoli. Mitosefiguren sind selten (SARFATY et al., 1988; KOESTNER et al., 1999). 26
41 Literaturübersicht Hypophysenkarzinom Das seltene Hypophsenkarzinom zeigt eine entlang der Gehirnbasis bis in das Os sphenoidale reichende Invasion, einen Einbruch in die Gefäße und Metastasierung (SARFATY et al., 1988; KOESTNER et al., 1999) Kraniopharyngeom Dieser selten beim Hund vorkommende Tumor geht von den Resten der Epithelzellen des embryonalen Hypophysenganges aus (ZÜLCH, 1956; KOESTNER et al., 1999; SCHMIDT und DAHME, 1999). Der Tumor wächst infiltrativ und expansiv in das umliegende Gewebe und besteht aus polygonalen bis säulenförmigen, solide wachsenden Zellen mit fokalen, zystischen oder tubulären Arealen (ZAKI, 1977; HAWKINS et al., 1985). Nekrosen, Mineralisation und Entzündungszellen werden häufig gesehen (KOESTNER et al., 1999) Immunhistologische Phänotypisierung sellärer Tumoren Der wesentliche Marker der kaninen, suprasellären Keimzelltumoren ist - Fetoprotein (-FP). Eine Markierung mit den Antikörpern Humanes, choriogenes Gonadotropin (HCG) und Plazentale, alkalische Phosphatase (PLAP) fällt im Gegensatz zu den humanen Keimzelltumoren negativ aus (VALENTINE, 1988). Hypophysenadenome und karzinome können immunhistologisch für adrenokortikotrophes Hormon (ACTH), Thyroid stimulierendes Hormon (TSH), luteinisierendes Hormom (LH), ß-Endorphin und das ß-Lipoprotein positiv sein (KOESTNER et al,. 1999). Kanine, feline und auch humane Zellen des Kraniopharyngeoms exprimieren immunhistologisch Zytokeratin (Panzytokeratin) (KOESTNER et al., 1999; KLEIHUES und CAVENEE, 2000) Andere primitive Tumoren und Zysten Vaskuläres Hamartom Das Hamartom (Angiomatose, meningozerebrale Angiomatose) des ZNS ist eine sehr selten vorkommende Umfangsvermehrung mit exzessivem, aber limitiertem Wachstum lokaler Gewebeelemente. Das pleomorphe histologische Bild ist durch stark pigmentierte Melanozyten, große Nervenzellen und Zellen mit astrozytärer und 27
42 Literaturübersicht oligodendroglialer Differenzierung charakterisiert (STEBBINS und MCGRATH, 1988; RIBAS et al., 1990; PUMAROLA et al., 1996; KOESTNER und HIGGINS, 2002). Vaskuläre Hamartome bestehen aus einer Vielzahl dünnwandiger Gefäße (KOESTNER et al., 1999) Epidermoidzyste Histogenetisch handelt es sich bei dieser beim Hund selten vorkommenden Zyste um versprengtes epidermales Ektoderm mit bevorzugter Lokalisation am zerebellopontinen Winkel und im vierten Ventrikel (KORNEGAY und GORGACZ, 1982; KA- WAMINAMI et al., 1991). Das gehäufte Vorkommen bei jungen Hunden könnte für ein genetisch bedingtes Auftreten sprechen (SUMMERS et al., 1995). Makroskopisch handelt es sich um gut abgegrenzte, derbe, weiße Umfangsvermehrungen mit einer glatt-glänzende Oberfläche ( pearly tumor ). Die Zysten bestehen aus verhornendem Plattenepithel und Bindegewebe mit luminaler Akkumulation desquamierter Keratinlamellen (SUMMERS et al., 1995; KOESTNER und HIGGINS, 2002) Hypophysenzyste Hypophysenzysten stellen Überreste des kraniopharyngealen Ganges dar und kommen beim Hund in der Pars distalis und tuberalis der Hypophyse vor. Die Wände bestehen aus muzinhaltigen, kuboidalen bis säulenförmigen, zilierten Zellen (KOESTNER et al., 1999) Andere Zysten Arachnoidalzysten sind vereinzelt bei Hund und Katze beschrieben (GALLOWAY et al., 1999; RYLANDER et al., 2002; SKEEN et al., 2003; JURINA und GREVEL, 2004). Sie treten bevorzugt im dorsalen und ventralen Halsmark intradural und extramedullär auf (SUMMERS et al., 1995) Immunhistologie der Zysten Angaben über immunhistologische Markierungen bei Hund und Katze liegen nicht vor. 28
43 Literaturübersicht Metastatische Tumoren Metastatische, sekundäre Neoplasien des ZNS gehen von einem extrakranialen Primärtumor aus und gelangen auf direktem oder indirektem Weg meist hämatogen in das zentrale Nervensystem (LUGINBÜHL et al. 1968; LECOUTEUR, 1990; LE- COUTEUR, 1999). Im Gegensatz zum Menschen wird die sekundäre Beteiligung des ZNS beim Tier nicht so häufig gesehen. Die Möglichkeit der Euthanasie in einem früheren Stadium der Erkrankung oder das unterschiedliche Tumorspektrum könnten dafür eine Erklärung sein (SUMMERS et al., 1995). Eine Metastasierung in das ZNS wird bei zahlreichen Karzinomen (Mamma, Prostata, Lunge (MOORE und TAYLOR, 1988; MORI et al., 1991), Schilddrüse, Pankreas, Nebennierenrinde und Niere) gesehen. Zudem können das Hämangiosarkom, das maligne Melanom, das Osteosarkom und das systemische Lymphom in das ZNS metastasieren (HOLLIDAY et al., 1987; JOHNSON, 1990). Im Gegensatz zum Menschen sind die Lokalisation und die Ausbreitung der einzelnen Metastasen beim Tier noch nicht so genau untersucht. Beim malignen Lymphom und dem Hämangiosarkom werden eher multiple kleinere Metastasen beobachtet (WATERS et al., 1989). Im Gegensatz dazu zeigen die Metastasen der anderen Neoplasien eher wenige, große, sekundäre Tumoren. Allerdings bestehen erhebliche individuelle Unterschiede. Die selektierte Besiedlung von Leptomeninx und Plexus choroideus ist beim Tier selten (SUMMERS et al., 1995). Laut JOHNSON (1990) sind die bevorzugten Orte für Metastasen die oberflächlichen Arteriengebiete. Aufgrund der höheren Durchblutung und der relativ hohen Masse dieses Gehirnabschnittes sind die Mehrzahl der Metastasen kortikal im Großhirn zu finden, seltener sind Hirnstamm und Kleinhirn betroffen (BAGLEY und GAVIN, 1998). Beim systemischen Lymphom der Katze (und seltener des Hundes) ist meistens der Zentralkanal des Rückenmarks und nicht das Rückenmarksparenchym selbst betroffen. Bei jungen bis mittelalten Katzen befinden sich sekundäre Lymphome intrakranial vor allem im Vorderhirn oder zeigen eine leptomeningeale Infiltration (BRITT et al., 1984; COUTO et al., 1994; KLINE, 1998) Immunhistologische Phänotypisierung metastatischer Tumoren Das immunhistologische Expressionsmuster der Gehirnmetastase entspricht, wie das histologische Bild, dem des primären Tumors. 29
44 Literaturübersicht Lokal invasiv wachsende Tumoren mit ZNS-Beteiligung Zu dieser Gruppe werden die direkt aus dem Nachbargewebe infiltrierenden primären Nasentumoren (Adenokarzinome, Chondrosarkome und Fibrosarkome) gezählt (JOEST, 1921; SMITH et al., 1989). Auch osteolytische Plattenepithel-karzinome, Chondro- und Osteosarkome sowie das multilobuläre Osteochondro-sarkom des Knochens können in das Neuroparenchym infiltrieren (STRAW et al., 1989). An der Wirbelsäule können lokal invasive Tumoren wie das multiple Myelom, der maligne, periphere Nervenscheidentumoren oder das Fibrosarkom zur Osteolyse, Wirbelkörperfrakturen und Rückenmarkskompressionen und -infiltrationen führen (LUTTGEN et al., 1980; WRIGHT, 1985) Tumoren des peripheren Nervensystems Ganglioneurom Dieser selten vorkommende Tumor befällt häufig die nervale Strukturen des Darms und ist selten intrakranial lokalisiert (HAWKINS und SUMMER, 1987; RIBAS et al., 1990; KOESTNER et al., 1999) Peripheres Neuroblastom Das maligne periphere Neuroblastom kommt selten beim Hund vor, ist neuronalen Ursprungs und besteht aus wenig differenzierten, in Reihe liegenden Zellen, die Rosetten formen können (FORREST et al., 1997; KOESTNER et al., 1999) Paragangliom Dieser neuroendokrine Tumor kommt sehr selten bei Hund und Katze vor und besteht aus in Nestern angeordneten, runden bis ovoiden Zellen (KOESTNER, et al. 1999). Die Zellen sind scharf begrenzt und weisen ein eosinophiles, granuläres Zytoplasma mit einem exzentrischen, runden bis ovalen Kern auf. Die Mitoserate kann sehr hoch sein. Teilweise vorhandene reife Ganglienzellen liegen in Nestern und besitzen deutlich Nissl sche Substanz (KOESTNER und HIGGINS, 2002) Periphere Nervenscheidentumoren Ursprungszellen dieses Tumors können Schwannsche Zellen, perineuronale Fibroblasten oder beide sein (KOESTNER et al., 1999). Man unterteilt diese Tumo- 30
45 Literaturübersicht ren aufgrund ihrer morphologischen Eigenschaften in benigne Nervenscheidentumoren (BPNST) und maligne Nervenscheidentumoren (MPNST) (SUMMERS et al., 1995) Benigner peripherer Nervenscheidentumor (Schwannom, Neurofibrom) Vergleichbar mit dem Schwannom beim Menschen (SCHEITHAUER et al., 1999) findet man den benignen, peripheren Nervenscheidentumor (BPNST) bei Hund und Katze extrem selten. Die Neoplasien sind gut umschrieben und bestehen aus Bündeln spindelförmiger Zellen. Sogenannte Antoni-A-Bereiche, in denen die Kerne palisadenförmig angeordnet sind und Verocay-Körper (parallele Anordnung von Zellkernen und Zytoplasmafortsätzen) können mikroskopisch erkennbar sein (KOESTNER et al., 1999). CHIJIWA et al. (2004) untersuchten sechs BPNST s und nur ein Fall besaß fokal typische Anotni A und eher zellarme Antoni-B-Bereiche (zellärmere, faserarme Bereiche mit regressiven Veränderungen). Vier der 6 Tumoren zeigen die oben beschriebenen, in Bündeln angeordneten spindelförmigen Zellen. Es wird weder Nekrose noch aggressives Wachstum beobachtet und Mitosen sind selten. Bei einem der beiden untypischen BPNST s finden sie plexiforme oder multinoduläre Knötchen mit hochgradiger Hyalinisation, erhöhter Zelldichte und Mitoserate. Der andere Tumor zeigt kleine, spindelförmige, neoplastische Zellen, die in Wirbeln angeordnet sind. Dazwischen finden sich große, polygonale Zellen mit bizarren Kernen. Diese wird, nach den in der Humanmedizin beschriebenen und benannten Pseudoeinschlüssen bei BPNST s, als degenerative Veränderungen bezeichnet. Aufgrund der teilweise atypischen Veränderungen und der epitheloiden Eigenschaften der Tumoren ist die Differenzierung des BPNST s von dem malignen peripheren Nervenscheidentumor (MPNST) nicht einfach. CHIJIWA et al. (2004) beschreiben in ihrer Studie einen dem zellreichen Schwannom des Menschen ähnlichen Tumor mit vakuolisierten, siegelringförmigen Zellen bei einem Hund Maligner peripherer Nervenscheidentumor (malignes Schwannom, Neurofibrosarkom) Dieser Tumor tritt bei Hunden häufiger als bei der Katze auf. Der Plexus brachialis oder lumbalis ist öfter betroffen als die Kopfnerven (KOESTNER et al., 1999). Vergleichbar der Humanmedizin sind beim Hund verschiedene Differenzierungen be- 31
46 Literaturübersicht schrieben: epitheloid (GARCÍA et al., 2004), melanotisch (PATNAIK et al., 1984), kartilaginös und knöchern (ANDERSON et al., 1999), rhabdomyoblastisch (KOESTNER et al. 1999) und glandulär (PATNAIK et al., 2002). KUWAMURA et al. (1998) veröffentlichten einen Fall eines unscharf demarkierten, zelldichten MPNST s mit atypischer Zellmorphologie und eosinophiler, intrazytoplasmatischer Granula der subkutan am oberen Vorderbein lokalisiert war. Es können atypische, mono- und multinukleäre Zellen vorkommen. In den meisten Fällen sind mehr als 4 Mitosen/hpf zu sehen. Nekrotische Bereiche mit angrenzenden Pseudopalisaden und eine große Anzahl an infiltrierenden Lymphozyten, Plasmazellen und CHIJIWA et al. (2004) finden in 4 von 11 malignen Neoplasien Antoni-A-und B-Areale Immunhistologische Phänotypisierung der Tumoren des peripheren Nervensystems Die Ganglienzellen des Ganglioneuroms und deren Fortsätze färben sich intensiv mit dem Neurofilament-Antikörper an. Die Synaptophysin- und NSE-Reaktivität sind in den Tumoren unterschiedlich ausgeprägt (KOESTNER und HIGGINS, 2002). Über die immunhistologische Untersuchung des peripheren Neuroblastoms gibt es in der Literatur keine Angaben. Die Markierung für Synaptophysin und Chromogranin A ist beim Paragangliom meistens positiv. NSE wird variabel exprimiert. Eine positive Markierung für Neurofilament wird nur bei der Anwesenheit von reifen Ganglienzellen im Tumor beobachtet (KOESTNER und HIGGINS, 2002). Immunhistologisch sind Nervenscheidentumoren generell positiv für Vimentin und S100-Protein, allerdings kann eine diffuse und intensive S100-Protein Markierung in Einzelfällen auch fehlen (CHIJIWA et al., 2004). Meistens exprimieren anaplastische und heterogene Tumoren weniger S100-Protein (SUMMERS et al., 1995; KOESTNER et al., 1999). Benigne Nervenscheidentumoren reagieren im Gegensatz zu den malignen Neoplasien mit Myoglobin. Eine Markierung mit Zytokeratin (AE1/AE3) konnte in einem gutartigen und einem bösartigen Tumor nachgewiesen werden. Eine von Willebrand Faktor VIII-positive endotheliale Differenzierung ist für Nervenscheiden-neoplasien sehr selten. BPNST s sind häufiger positiv für GFAP als MPNST s. NSE wird bei beiden Tumoren nicht sehr intensiv exprimiert (CHIJIWA et al., 2004). 32
47 Literaturübersicht 2.2 Das Multiblocksystem ( tissue microarray ) Die routinemäßige Diagnostik von Hirntumoren erfolgt an konventionellen Schnitten mittels H.E.-Färbung und darüber hinaus durch histologische Spezialfärbungen und die Immunhistologie sowie teilweise durch die Elektronenmikroskopie. Das bedeutet für Serienuntersuchungen einen sehr hohen Aufwand von Material und Zeit. Das in den vergangenen Jahren in der Humanmedizin von KONONEN et al. (1998) etablierte Multiblocksystem, auch tissue microarray genannt, bietet eine Alternative, in dem bis zu 1000 verschiedene Gewebeproben auf einem einzigen Paraffinschnitt untersucht werden können. Kleine Stanzbiopsien werden aus den zu untersuchenden Geweben des Donorblockes entnommen und in einen Empfängerblock ( recipient block ) eingebettet. Besonders geeignet ist das System für die Fluoreszenz-in-situ-Hybridisierung (FISH), RNA-in-situ-Hybridisierung und immunhistologische Untersuchungen (KONONEN et al., 1999; MOCH et al., 2001). Im Vergleich zu Untersuchungen an konventionellen Schnitten weist das Multiblocksystem zahlreiche Vorteile auf: Zeitersparnis, verminderter Verbrauch von Reagenzien, geringerer finanzieller Aufwand, gleichzeitige Untersuchung einer großen Probenanzahl unter identischen Bedingungen, Reduktion des Archiv- und Untersuchungsmaterials und die Erhaltung des Originalblocks (MILLS et al., 1995; SCHRAML et al., 1996). Ein möglicher Nachteil dieser Methodik besteht in der Tumorheterogenität, die aufgrund der kleinen Fläche der Tumorstanze nicht immer einen für das Tumorgewebe repräsentativen Bereich enthält (CAMP et al., 2000; GILLETT et al., 2000; HOOS et al., 2001). Die Untersuchung mehrerer Stanzen eines Tumors aus unterschiedlichen Arealen wirkt diesem Nachteil entgegen (KALLIONIEMI et al., 2001). Vergleichende Studien zeigen, dass die Ergebnisse der Immunhistologie von 1 bis 2 Stanzen pro Tumor mit den Ergebnissen der konventionellen Schnitte zu über 95% übereinstimmen (TORHORST et al., 1999; CAMP et al., 2000; GILLETT et al., 2000). Die Vergrößerung des Stanzendurchmessers (> 2 bis 4 mm, sonst 0,6-1,2 mm) nimmt keinen Einfluss auf die Repräsentativität (KALLIONIEMI et al., 2001). In der Veterinärmedizin ist diese Methode bis jetzt noch nicht für die immunhistologische Untersuchung von Tumoren bei Haustieren eingesetzt worden. 33
48 Literaturübersicht 34
49 Material und Methoden 3 Material und Methoden 3.1 Untersuchungsmaterial Untersuchungsgegenstand waren primäre Neoplasien des ZNS von 111 Hunden und 24 Katzen (Tab. 9.1). 102 der insgesamt 135 Tumoren stammten aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover aus den Jahren 1980 bis Hunde und Katzen mit peripheren Nervenscheidentumoren, sekundären Gehirntumoren und Hypophysentumoren wurden bei der Durchsicht des Archivs nicht berücksichtigt. Vom Institut für Veterinär-Pathologie der Justus-Liebig-Universität in Gießen wurden 15 und vom Department of Veterinary Biosciences der Ohio State University, USA (OSU) 18 weitere Fälle in die Studie mit einbezogen. Das Untersuchungsmaterial stand soweit vorhanden als formalinfixierte und in Paraffin eingebettete Gewebeprobe zur Verfügung oder wurde im Rahmen dieser Studie als formalinfixiertes Nassmaterial von aktuellen Einsendungs- oder Sektionsfällen histologisch aufgearbeitet. Das Gewebe wurde in 10%igem Formalin (Fa. CVH Chemie Vertrieb, Hannover) mindestens 24 Stunden fixiert. Die Anwendbarkeit des Multiblocksystems wurde anhand histologischer und immunhistologischer Kriterien am Beispiel von 10 ZNS-Tumoren untersucht. Von den insgesamt 135 Neoplasien wurden 117 ZNS- Tumoren histologisch und immunhistologisch mit dem Multiblock (Multiblock-Studie) untersucht. 18 Fälle, bei denen das Archivmaterial nicht vorhanden war (15 Fälle) oder die Schichtdicke des Gewebes im archivierten Paraffinblock weniger als 2 mm betrug (3 Fälle), wurden nicht in die Multiblock-Studie einbezogen und sind im Anhang (Tab. 9.1) gesondert gekennzeichnet. Die Daten und Sektionsbefunde wurden, soweit verfügbar, aus den archivierten Falldokumenten entnommen (Anhang 9). Alle für die immunhistologischen Untersuchungen verwendeten Kontrollgewebe sind unter aufgelistet. 3.2 Herstellung der konventionellen Paraffinblöcke Die Einbettung der fixierten und zugeschnittenen Gewebeproben erfolgte nach einem standardisierten Laborprotokoll mit Hilfe eines Gewebeeinbettungsautomaten (Pathcentre, Fa. Thermo Electron Cooperation, Dreieich) in Paraffinwachs (Histokomb Plus, Fa. Vogel, Gießen). Danach wurden die Paraffinblöcke bei Zimmer- 35
50 Material und Methoden temperatur im Dunkeln gelagert. 3.3 Herstellung der konventionellen Paraffinschnitte und lichtmikroskopische Klassifizierung der Gehirntumoren Von den Paraffinblöcken wurde ein 2-4 m dicker Schnitt mit einem Schlittenmikrotom (Fa. Mikrom, Heidelberg) angefertigt, in einem Wasserbad mit Eiweiß-Glyzerin- Zusatz (Fa. Chroma, Münster) gestreckt und für die histologische Untersuchung auf einem mit Chromalaun-Gelatine beschichteten Objektträger (Fa. Engelbrecht, Edermünde) aufgezogen. Dieser wurde mit Hämatoxylin-Eosin (H.E.) in einem Färbeautomaten (Fa. Leica Microsystems, Nussloch GmbH, Nussloch) nach einem standardisierten Laborprotokoll gefärbt. Auf der Basis der WHO-Klassifikation von Tumoren des Nervensystems bei Haustieren (KOESTNER et al., 1999) wurden die Neoplasien histologisch klassifiziert. Dabei wurden die unter 3.4 aufgelisteten Parameter verwendet. Von den Hunden mit der Nr. 6, 28, 37, 47, 60, 69 und 74, und den Katzen mit der Nr. 15, 48 und 89 sind zusätzlich für die vergleichenden immunhistologischen Untersuchungen ca. 20 (2-3 m dicke) Serienschnitte pro Block angefertigt worden, die auf Superfrost Plus Objektträger (Fa. Engelbrecht, Edermünde) aufgezogen wurden. Es wurden jeweils 2 Tumoren aus der Gruppe der Astrozytome, Oligodendrogliome, Ependymome, Plexustumoren und Meningeomen ausgewählt. 3.4 Parameter für die histologische Untersuchung und Klassifizierung der Tumoren Makroskopische Befunde Bei der makroskopischen Beurteilung der Tumoren wurde als erstes die Lokalisation und Ausbreitung beschrieben. Es wurde unterschieden, ob der Tumor intrakranial (innerhalb der Schädelhöhle) oder intraspinal (im Wirbelkanal) lokalisiert war. Die Lage der Umfangsvermehrungen wurde mit extraaxial (außerhalb des Neuroparenchyms liegend) und /oder intraaxial (innerhalb des Neuroparenchyms liegend) und /oder intraventrikulär (innerhalb eines Ventrikel liegend) beschrieben. Es wurde festgestellt, ob die Neoplasien kaudotentorial (hinter dem Tentorium cerebelli liegend) und/ oder rostrotentorial (vor dem Tentorium cerebelli liegend) lokalisiert waren. In der Nähe der Sella turcica konnte eine periselläre (in der Umgebung der Sella turcica 36
51 Material und Methoden liegend) oder intraselläre (darin liegend) Lage unterschieden werden. Bei den im Rückenmark befindlichen Neoplasien konnte eine epidurale (auf der Dura befindlich) und /oder durale (in der Dura) und /oder leptomeningeale (in der Leptomeninx liegen) und /oder parenchymatöse (im Neuroparenchym liegend) Lokalisation diagnostiziert werden. Zudem wurde beurteilt, ob es sich um solitäre oder multiple Tumoren handelt. Als zweites wurde die Größe und als drittes die Tumorgrenzen und das Wachstum festgestellt. Dabei wurde zwischen umschriebenen (gegenüber dem umliegenden Gewebe gut abgegrenzter Tumor) oder diffusen (gegenüber dem umliegenden Gewebe nicht gut abgegrenzter Tumor, fließender Übergang zwischen gesundem und neoplastischem Gewebe) Tumorgrenzen unterschieden. Es wurde festgestellt, ob ein infiltratives (in das umliegende Gewebe wachsend) oder expansives (das umliegende Gewebe verdrängend wachsend) Wachstum vorlag und ob der Tumor eine Kapsel aufwies. Weiter wurden die verschiedenen Tumorformen mit den Begriffen nodulär und multinodulär (in Form eines Knotens), verrukös (in Form einer Warze), papillär (in Form einer Papille) und plexiform (geflechtartig) beschrieben. Konnten diese Parameter anhand des Gewebes auf dem Schnitt nicht festgestellt werden, wurde wenn möglich auf die Beschreibungen in den archivierten Falldokumenten zurückgegriffen Histologische Befunde Bei der Untersuchung der histologischen Befunde wurde die Anordnung der Tumorzellen zueinander und das Vorhandensein von fibrösem und /oder vaskulärem Stroma beschrieben Zytologische Befunde Die zytologischen Befunde umfassten die Beschreibung der Form und Größe der Zelle sowie der Zellgrenzen und des Zytoplasmas. Bei der Beurteilung des Nukleus wurde die Größe, die Position, die Färbung und die Verteilung des Chromatins, der Nukleolus, Mitosen und Apoptosen beurteilt. 37
52 Material und Methoden Sonstige histologische Kennzeichen Zusätzlich wurde das Vorkommen von einer kapsulären und/ oder vaskulären Invasion, Hämorrhagien, Nekrosen, Mineralisationen und Zysten beschrieben. 3.5 Herstellung der Multiblöcke Markierung Zunächst wurden die repräsentativen Bereiche auf dem H.E.-Schnitt lichtmikroskopisch ausgewählt und mit einem feinen Permanentmarker auf dem Objektträger markiert (Abb. 3.1). Es wurden gut fixierte Areale in der Peripherie und dem Zentrum des Tumors ausgewählt und mit einem roten (Peripherie) oder schwarzen Edding (Zentrum) gekennzeichnet. Nekrosen, Blutungen und Verkalkungen wurden möglichst nicht gestanzt (Abb. 3.2). Auch die Kontrollgewebe wurden mikroskopiert und in einem für das Gewebe repräsentativen Bereich auf dem Objektträger markiert. Abb. 3.1: Auswahl und Markierung der zu stanzenden Bereiche Quelle: 38
53 Material und Methoden Normales Gewebe Nekrose/Blutungen Solides Tumorgewebe Abb. 3.2: Beispiel eines H.E. gefärbten Schnittpräparates mit markierten Bereichen; schraffierter Bereich mit Nekrose und Blutungen, schwarz umrandeter Bereich mit stanzbarem Tumorgewebe Übertragung der Markierung Anschließend erfolgte die Übertragung der Markierung vom H.E.-Schnitt auf den korrespondierenden Paraffinblock (sogenannter Donorblock ). Um die Anschnittsoberfläche der Stanze zu kennzeichnen, wurde der ausgewählte Bereich mit einem wasserfesten Edding flächenhaft markiert (Abb. 3.3 und Abb. 3.4). In den Fällen in denen der Paraffinblock, bezogen auf die Größe, nicht exakt mit dem Gewebeschnitt identisch war wurden markante Gewebestrukturen, wie z. B. Gefäßanschnitte, auf der Anschnittsfläche des Paraffinblockes als Orientierungshilfe ausgewählt. 39
54 Material und Methoden Abb. 3.3: Übertragung der Markierung auf den Paraffinblock Quelle: Abb. 3.4: Beispiele für markierte Paraffinblöcke mit Tumorgewebe; Links: markiertes Tumorzentrum schwarz, Tumorperipherie rot; Rechts: ein bereits im Zentrum gestanzter Tumor (Pfeile) 40
55 Material und Methoden Stanzung des Donorblockes Die Gewinnung der Gewebeproben erfolgte mit einer senkrecht in den Block gestochenen Handstanze (Leihgabe: Fa. Zytomed, Berlin) unter leicht drehenden Bewegungen (Abb. 3.5). Der in dieser Studie gewählte Durchmesser aller Stanzen betrug 1,2 mm (Abb. 3.6 und Abb. 3.7). Je nach Größe des Tumorgewebes wurden aus einem Donorblock maximal 10 Stanzen aus dem Tumorzentrum und bis zu 10 Stanzen aus der Tumorperipherie entnommen. Als Tumorzentrum wurden Areale definiert, die nur Tumorgewebe enthalten. Mit Tumorperipherie wurde der Übergang vom gesunden Gewebe zum Tumorgewebe bezeichnet. Abb. 3.5: Stanzung mit leicht drehenden Bewegungen Quelle: Abb. 3.6: Handstanze mit 1,2 mm Durchmesser geschliffener Hohlnadel 41
56 Material und Methoden Abb. 3.7: Gestanzter Gewebezylinder im Vergleich zu einem 1 Cent Stück Erstellung des Stanzarchivs Die gewonnenen Gewebezylinder wurden in mit Studiennummern (Identitäts (ID)- Nummern) beschrifteten Eppendorfgefäßen, getrennt nach Zentrum und Peripherie, archiviert (Tab. 9.1; Abb. 3.8 und Abb. 3.9). Die Stanzen des Zentrums eines Tumors und der Peripherie bekamen jeweils eine eigene ID- Nummer zugeteilt. Beispielsweise bekam die Stanze des Zentrums des Tumors mit der Sektionsnummer S 4742/80 die ID A1 und die dazugehörige Stanze mit dem peripheren Tumorgewebe die ID A2. Für diese Studie wurden nur die Stanzen aus dem Tumorzentrum verwendet. Zum besseren Verständnis wurde jedem in der Multiblockstudie untersuchten Tier zusätzlich eine Tier Nummer zugewiesen (Tab. 9.1). Abb. 3.8: Überführen der Gewebestanzen in Eppendorfgefäße Quelle: 42
57 Material und Methoden Abb. 3.9: Stanzarchiv; beschriftete Eppendorfgefäße mit ID und schwarzer und roter Kappenkennzeichnung für Tumorzentrum (schwarz) und peripherie (rot) Auswahl der Stanzen und Zusammensetzung der Multiblöcke Pro Tumor wurden 2 Stanzen ausgewählt. Es wurden 5 Multiblöcke mit jeweils 60 Stanzen von der Firma Zytomed in Berlin hergestellt. Der erste Multiblock (Tab. 9.8) enthielt die für die Immunhistologie benötigten Positivkontrollen. Die restlichen vier Multiblöcke beinhalteten die verschiedenen Tumoren, die auf der Basis der vorläufigen morphologischen Diagnose gruppiert worden waren. Eine genaue Auflistung der Zusammensetzung der Multiblöcke ist im Anhang 9.2 (Tab. 9.8, 9.9, 9.10) zu finden. 3.6 Herstellung der Multiblockschnitte Von den Multiblöcken wurden dreißig 2-4 m dicke Schnitte angefertigt, die für die histologische Untersuchung auf Chromalaun-Gelatine beschichtete Objektträger und für die immunhistologischen Untersuchungen auf Superfrost Plus Objektträger (Fa. Engelbrecht, Edermünde) aufgezogen wurden (Abb. 3.10). Die in der Abb mit blauen Pfeilen markierten Stanze diente zur Orientierung auf dem Objekträger. 43
58 Material und Methoden Abb. 3.10: H.E.-Schnitt eines Multiblocks, blaue Pfeile markieren die Orientierungsstanze, gelber Pfeil markiert die Position 1, roter Pfeil die Position Immunhistologie Bei allen in der Studie verwendeten Antikörpern wurde zur immunhistologischen Phänotypisierung der Tumoren die Avidin-Biotin-Peroxidase-Komplex-Methode (ABC-Methode) als Detektionssystem eingesetzt. Dabei wurden biotinilierte, speziesspezifische Sekundärantikörper verwendet. Die immunhistologische Färbung wurde mit 15 kommerziell erhältlichen, monoklonalen und polyklonalen Antikörpern durchgeführt (Tab. 3.1) Antikörper und Seren Primär- und Sekundärantikörper wurden in Phospat-gepufferter Kochsalzlösung (PBS, Herstellung siehe Anhang 9.3.1) mit 1%igem bovinem Serumalbumin verdünnt. Zur Verdünnung der Komponenten des Detektionssystems wurde nur PBS verwendet Blocking-Seren Zum Blockieren unspezifischer Bindungsstellen im Gewebe wurde je nach Antikörper Ziegen-Normalserum (ZS) oder Pferde-Normalserum (PS) (siehe Tab. 3.2) eingesetzt. Die Seren stammen von in der Klink für kleine Klauentiere und Klinik für Pferde der Tierärztlichen Hochschule Hannover eingestellten gesunden Tieren. Nach mehrstündigem Stehen des Blutes wurden sie durch Zentrifugation für 10 Minuten bei 370 x g (Minifuge RF; Fa. Kendro Laboratory Products, Langenselbold) gewonnen. Durch 44
59 Material und Methoden eine Inkubation für 30 Minuten bei 56 C im Wasserbad wurden Komplementkomponenten inaktiviert. Die Lagerung erfolgte portioniert bei 20 C Primärantikörper Die verwendeten Antikörper mit der genauen Spezifität sind in Tab. 3.1 und die Ü- bersicht der verwendeten Primär- und Sekundärantikörper sowie der verschiedenen Vorbehandlungen und eingesetzten Blocking-Seren sind in Tab. 3.2 zusammengefaßt. a) Polyklonaler Antikörper aus dem Kaninchen gegen bovines saures Gliafaserprotein (GFAP) (DakoCytomation, Hamburg) b) Monoklonaler Antikörper aus der Maus gegen porzines Vimentin, Klon V9 (DakoCytomation, Hamburg) c) Monoklonaler Antikörper aus der Maus gegen humanes Zytokeratin, Klon LP34 (DakoCytomation, Hamburg) d) Monoklonaler Antikörper aus der Maus gegen humanes Zytokeratin, Klon AE1/AE3 (DakoCytomation, Hamburg) e) Monoklonaler Antikörper aus der Maus gegen humanes Neurofilament (NF), Klon 2F11 (Santa Cruz Biotechnology, Inc., Heidelberg) f) Polyklonaler Antikörper aus dem Kaninchen gegen porzinen Tyrosinkinase- Rezeptor (Trk), Klon c-14 (Santa Cruz Biotechnology, Inc., Heidelberg) g) Polyklonaler Antikörper aus dem Kaninchen gegen bovines S100- Protein (Sigma-Aldrich, Inc., München) h) Polyklonaler Antikörper aus dem Kaninchen gegen humanes Karzinoembryonales Antigen (CEA) (DakoCytomation, Hamburg) i) Monoklonaler Antikörper aus der Maus gegen bovines Synaptophysin (SP) (DakoCytomation, Hamburg) j) Monoklonaler Antikörper aus der Maus gegen humanes CD79cy, Klon HM57 (DakoCytomation, Hamburg) k) Polyklonaler Antikörper aus dem Kaninchen gegen humanes CD3 (DakoCytomation, Hamburg) l) Polyklonaler Antikörper aus dem Kaninchen gegen humanen von- Willebrand-Faktor (DakoCytomation, Hamburg) 45
60 Material und Methoden m) Monoklonaler Antikörper aus der Maus gegen humanes alpha Fetoprotein Ab-1 (-FP), Klon C3 ( NeoMarkers, Newmarket Suffolk, England) n) Monoklonaler Antikörper aus der Maus gegen humane Neuronen- Spezifische-Enolase (NSE), Klon BBS/NC/VI-H14 (DakoCytomation, Hamburg) o) Monoklonaler Antikörper aus der Maus gegen humane 2`,3`-zyklische Nulkleotid 3`-phosphodiesterase (CNPase) (Chemicon, Temecula, Kanada) Tab. 3.1: Spezifität und Gebrauchsverdünnung der verwendeten Primärantikörper Primärantikörper Anti-bovines sures Gliafaserprotein (GFAP) Anti-porzines Vimentin (Klon V9) Anti-humanes Zytokeratin (Klon LP34) Anti-humanes Zytokeratin (Klon AE1 und AE3) Anti-humanes Neurofilament (Klon 2F11) Anti-porciner Trk-Rezeptor (Klon c-14) Anti-bovines S100-Protein Anti-humanes karzinoembryonales Antigen Anti-bovines Synaptophysin (Klon SY38) Anti-humanes CD79cy (Klon HM57) Anti-humanes CD3 Spezifität Intermediärfilament in Astrozyten, einigen Ependymzellgruppen, Schwannsche-Zellen, Satellitenzellen Intermediärfilamentprotein in mesenchymalen Zellen Intermediärfilament (Keratin 18, 5 und 6) in epithelialen Zellen Intermediärfilament (Keratin 1,2,3,4,5,6,7,8 10,13,14,15,16 und 19) in epithelialen Zellen Intermediärfilament der Untereinheit NF-L (70 kda) in Neuronen Tyrosinkinase-Rezeptor A, B und C der Astrozyten Gliale und ependymale Zellen, Schwannsche Zellen und viele andere extraneuronale Zellen CEA und CEA-ähnliche Proteine (neutrophile Granulozyten, Gallengangsepithelien, Adenokarzinom des Kolons) Integrales Membran-Glykoprotein, Komponente der nervenendständigen präsynaptischen Vesikel Membrangebundenes Immunglobulin auf B-Lymphozyten Intrazytoplasmatischer Anteil des CD3- Antigens von T-Lymphozyten Verdünnung 1:800 1:15 1:100 1:500 1:200 1:40 1:800 1:350 1:100 Anti-humaner von Willebrand-Faktor Endothelzellen und Megakaryozyten 1:200 Leber, Darmtrakt, Dottersack, Anti-humanes alpha Fetoprotein Ab-1 Keimzelltumoren und hepatozelluläre 1:40 (Klon C3) Karzinome Anti-humane Neuronen-spezifische- Enolase (Klon BBS/NC/VI-H14) Anti-humane 2`,3`-zyklische Nukleotid 3`-phosphodiesterase (CNPase) Gesunde und neoplastische Zellen neuronalen und neuroendokrinen Ursprungs Oligodendrozyten und Schwannsche Zellen 1:60 1:10 1:100 1:100 46
61 Material und Methoden Tab. 3.2: Übersicht der verwendeten Primär- und Sekundärantikörper sowie der verschiedenen Vorbehandlungen und eingesetzten Blocking-Seren Antikörper Vorbehandlung Blocking-Serum Anti-bovines saures Gliafaserprotein Anti-bovines S100-Protein Anti-humanes karzinoembryonales Antigen Keine PS 1:5 in PBS Sekundärantikörper Biotiniliertes Ziege-anti- Kanninchen-Ig 1:200 Anti-porzines Vimentin (Klon V9) Anti-humane Neuronenspezifische Enolase (Klon BBS/NC/VI-H14) Anti-humanes Zytokeratin (Klon LP34) Triton X-100 0,25% Pronase E 0,05% und Tween 0,25% ZS 1:5 in PBS Biotiniliertes Ziege-anti-Maus- Ig 1:200 Anti-humanes Zytokeratin (Klon AE1 und AE3) Anti-humaner von Willebrand- Faktor Anti-porziner Trk-Rezeptor (Klon c-14) Pronase E 0,05% Biotiniliertes Ziege-anti- Kaninchen-Ig 1:200 Anti-bovines-Synaptophysin (Klon SY38) PS 1:5 in PBS Biotiniliertes Pferd-anti-Maus- Ig 1:110 Anti-humanes CD79cy (Klon HM57) Anti-humanes alpha Fetoprotein Ab-1 (Klon C3) Anti-humanes Neurofilament (Klon 2F11) Citratpuffer in der Mikrowelle 10mM ZS 1:5 in PBS Biotiniliertes Ziege-anti-Maus- Ig 1:200 Anti-humane CNPase Anti-humanes CD3 Biotiniliertes Ziege-anti- Kanninchen-Ig 1:200 Abk.: ZS: Ziegen-Normalserum, PS: Pferde-Normalserum, Ig : Immunglobulin 47
62 Material und Methoden Als Sekundärantikörper wurde biotiniliertes Ziege-anti-Kaninchen-Ig und Ziege-anti- Maus-Ig Hyperimmunserum (Firma Vektor Laboratories; Peterborough, England) 1:200 in PBS verdünnt. Der Pferde-anti-Maus-Ig Sekundärantikörper von der Firma Vektor Laboratories (Peterborough, England) wurde 1:110 in PBS verdünnt verwendet. Der Avidin-Biotin-Peroxidase-Komplex (Vectastain Elite ABC-Kit, Fa. Vector Laboratories, Peterborough, England) diente als Detektionssystem. Die Vorbehandlungen sind ausführlich im Anhang 9.4 beschrieben Durchführung der immunhistologischen Untersuchung (ABC- Methode) Der immunhistologische Nachweis der Antigene erfolgte nach der von HSU, RAINE und FANGER (1981) beschriebenen und von WÜNSCHMANN et al. (1997) modifizierten Avidin-Biotin-Peroxidase-Komplex (ABC)-Methode. Die Inkubationen der Antikörper und des Detektionssystems wurden, soweit nicht anders angegeben, bei Raumtemperatur durchgeführt. Zum Auftragen der Antikörper und für die Waschschritte befanden sich die Objektträger in Coverplates (Thermo Elektron Cooperation, Dreieich) und Sequenza -Einsätzen (Thermo Elektron Cooperation, Dreieich): 1. Entparaffinieren der Schnitte in Roti-Histol zweimal für 5 Minuten, in Isopropylalkohol einmal für 5 Minuten und in 96%-igem Alkohol einmal für 3 Minuten 2. Inaktivierung der endogenen Peroxidase mittels 197 ml 85%-igem Ethanol und 3 ml frisch zugesetztem, 30%-igem H 2 O 2 für 30 Minuten unter Rühren 3. Dreimaliges Waschen der Schnitte in PBS für je 5 Minuten 4. Demaskierung in Abhängikeit des verwendeten Antikörpers (siehe Tab. 3.2) 5. Dreimaliges Waschen der Schnitte in PBS für je 5 Minuten 6. Verbringen der Schnitte in Coverplates 7. Inkubation der Schnitte mit dem jeweiligen Blocking-Serum (siehe Tab. 3.2) für 30 Minuten 8. Auftragen des primären Antikörpers und Inkubation über Nacht bei 4 C im Kühlschrank 9. Dreimaliges Waschen der Schnitte in PBS für je 5 Minuten 10. Auftragen des sekundären Antikörpers und Inkubation für 30 Minuten (siehe Tab. 3.2) 48
63 Material und Methoden 11. Dreimaliges Waschen der Schnitte in PBS für je 5 Minuten 12. Inkubation der Schnitte mit dem ABC- Komplex für 30 Minuten 13. Dreimaliges Waschen der Schnitte in PBS für je 5 Minuten 14. Auftauen des DAB (3,3`-Diaminobenzidin-Tetrahydrochlorid) stock solution a- liquot (100 mg DAB in 50 ml PBS auflösen, bei 20 C einfrieren) in Dunkelheit, mit 150 ml PBS verdünnen und durch zwei unsterile Faltfilter (Fa. Sartorius AG; Göttingen) laufen lassen; dann 3 ml 3%iges H 2 O 2 zur DAB-Lösung hinzugeben und Schnitte unter Rühren für 10 Min. bei Zimmer-temperatur inkubieren 15. Waschen der Schnitte für 5 Minuten in PBS 16. Waschen der Schnitte mit laufendem Leitungswasser für 10 Minuten 17. Gegenfärbung der Schnitte in Mayer s Hämatoxylin- Lösung (1:20 verdünnt in Aqua bidest.) für Sekunden; Bläuen der Schnitte für 10 Minuten in Leitungswasser; Entwässern der Schnitte in einer aufsteigenden Alkoholreihe für je 3 Minuten in 50-,70-, 96%-igem Alkohol, für 3 Minuten in 100%igem Isopropylalkohol und für zweimal 5 Minuten in Essigsäurebutylester (EBE; Fa. Roth, Karlsruhe) als Intermedium 18. Maschinelles Eindecken der Schnitte mit dem Eindeckungsfilm Histokit (Fa. Roth, Karlsruhe) im Eindeckautomaten RC M 2000 (Medite Medizintechnik, Burgdorf) Kontrollen Als Negativkontrollen wurden anstatt des Primärantikörpers die in der Tab. 3.3 aufgelisteten Seren aufgetragen. Als Kontrollserum für die polyklonalen Antikörper diente Serum aus dem Blut gesunder Kaninchen in PBS verdünnt, das nach 2-4 stündigem Stehen bei Raumtemperatur durch Zenfrifugation für 10 Minuten bei 370 x g gewonnen und bei -20 C gelagert wurde. Für die monoklonalen Antikörper diente Aszitesflüssigkeit von Balb/cJ- Mäusen in PBS verdünnt (Fa. Biologo, Kronshagen) oder Gewebekulturüberstand als Negativkontrolle. Die Positivkontrollen sind detailliert im Anhang dargestellt. 49
64 Material und Methoden Tab. 3.3: Übersicht der verwendeten Positiv- und Negativkontrollen in Abhängigkeit vom primären Antikörper Antikörper Positivkontrollen Negativkontrollen Großhirn und Kleinhirn von Anti-bovines saures Gliafaserprotein Hund (A 232 und A 233) und Kaninchenserum Katze (A 223 und A224) Anti-porzines Vimentin (Klon V9) Anti-humanes Zytokeratin (Klon LP34) Anti-humanes Zytokeratin (Klon AE1 und AE3) Anti-humanes Neurofilament (Klon 2F11) Anti-porziner Trk-Rezeptor (Klon c-14) Anti-bovines S100-Protein Anti-humanes karzinoembryonales Antigen Anti-bovines Synaptophysin (Klon SY38) Anti-humanes CD79cy (Klon HM57) Anti-humanes CD3 Anti-humaner von Willebrand Faktor Anti-humanes alpha Fetoprotein Ab-1 (Klon C3) Anti-humane Neuronenspezifische Enolase (Klon BBS/NC/VI-H14) Anti-humane CNPase Haut und Fibrosarkom von Hund (A231 und A234) und Katze (A222 und A225) Haut von Hund (A231) und Katze (A222) Niere von Hund (A228) und Katze (A219) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Leber von Hund ( A226) und Katze (A217); Darm von Hund (A227) und Katze (A218) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Milz und Lymphknoten von Hund (A229 und A230) und Katze (A220 und A221) Milz und Lymphknoten von Hund (A229 und A230) und Katze (A220 und A221) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Plazenta, Hund (V 466/03) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Großhirn und Kleinhirn von Hund (A 232 und A 233) und Katze (A 223 und A224) Gewebekulturüberstand Gewebekulturüberstand Balb/cJ-Aszites Balb/cJ-Aszites Kaninchenserum Kaninchenserum Kaninchenserum Balb/cJ-Aszites Gewebekulturüberstand Kaninchenserum Kaninchenserum Balb/cJ-Aszites Balb/cJ-Aszites Balb/cJ-Aszites A: ID-Nummern der Kontrollen siehe Anlage V: Untersuchungsnummer der Kontrolle siehe Anlage
65 Material und Methoden 3.8 Auswertung Alters-, Rasse- und Geschlechtsverteilung der Fälle Die 102 im Zeitraum von 1980 bis 2003 im Institut für Pathologie der Tierärztlichen Hochschule Hannover mit primären ZNS-Tumoren erfassten Hunde und Katzen sowie die 33 Fälle aus Gießen und OSU wurden hinsichtlich des Auftretens von primären ZNS-Neopasien und der Verteilung von Alter, Rasse und Geschlecht ausgewertet. Dadurch soll ein Überblick über die Häufigkeit des Auftretens gegeben werden und mögliche Häufigkeiten für bestimmte ZNS-Tumoren erfasst werden. Da es sich bei den 33 aus Gießen und Ohio stammenden Tumoren um Stichproben handelt, werden diese im Weiteren getrennt von den aus Hannover stammenden Tumoren beschrieben und sind hinsichtlich vorkommender Häufigkeiten nicht auswertbar. Die Beurteilung der prozentualen Häufigkeiten der aus Hannover stammenden ZNS- Tumoren wurde auf das gesamte Sektionsgut des Institutes für Pathologie der Tierärztlichen Hochschule Hannover bezogen. Die 18 nicht mit in die Multiblockstudie einbezogenen Fälle werden aus logistischen Gründen nicht mit Tier Nummern, sondern mit den dazugehörigen Sektionsnummern gekennzeichnet Methodenvergleich Untersuchungsmaterial waren 10 primäre ZNS-Tumoren von Hund und Katze: Hunde mit der Nr. 6, 28, 37, 47, 60, 69, 74 und Katzen mit der Nr. 15, 48, 89. Dabei handelte es sich um 1 protoplasmatisches Astrozytom (Nr. 6) und 1 Glioblastoma multiforme (Nr. 15), 1 Oligodendrogliom (Nr. 28), 1 anaplastisches Oligodendrogliom (Nr. 37), 2 Ependymome (Nr. 48, 47), 1 Choroid-Plexuspapillom (Nr. 60), 1 Choroid- Plexuskarzinom (Nr. 69), 2 Ependymome (Nr. 48, 47), 1 transitionelles Meningeom (Nr. 89), 1 meningotheliomatöses Meningeom (Nr. 74). Die genauen Daten der betroffenen Hunde und Katzen sind im Anhang 9.1 aufgelistet. Als erstes wurde das in der Stanze enthaltene Tumorgewebe mit dem des konventionellen Schnittes verglichen, um zu prüfen, ob ein repräsentativer Bereich des Tumors getroffen worden ist. Die konventionellen Schnitte als auch die korrespondierenden Multiblockstanzen sind histologisch nach folgenden Parametern beurteilt worden: Anordnung der Tumorzellen, Kern- und Zellform, Nukleoli pro Kern, Mitosen, Blutungen, Nekrosen und Entzündungszellen. Immunhistologisch wurden die unter aufgeführten Anti- 51
66 Material und Methoden körper eingesetzt. Hierzu ist der gesamte Tumoranschnitt bei den 10 konventionellen Schnitten und bei dem Multiblock die komplette Fläche der Stanze beurteilt worden. Die Auswertung wurde wie unter beschrieben durchgeführt Auswertung der histologischen und immunhistologischen Untersuchungen Von den 135 Tumoren wurden 15 aufgrund von fehlendem Archivmaterial (Paraffinblöcke fehlten) und 3 aufgrund des Ausschlusskriteriums der Schichtdicke des Gewebes (mindestens 2 mm) nicht untersucht, so dass insgesamt 117 Tumoren in die Multiblock-Studie einbezogen wurden. Die histologische Untersuchung erfolgte bei den 117 Tumoren am konventionellen H.E.-Schnitt. Die beurteilten Parameter sind unter 3.4 aufgelistet. Von den 117 Tumoren wurden jeweils 2 Stanzen immunhistologisch untersucht. Bei der Auflistung und Beurteilung der Ergebnisse wurde aufgrund der statistischen Auswertung mit dem Mittelwert der beiden Stanzen gearbeitet. Im Rahmen der immunhistologischen Untersuchung wurden in der Schnittebene liegende, mittel- bis dunkelbraune zytoplasmatische, beim S100-Protein Antikörper zyto-plasmatische und intranukleäre und beim Trk-Antikörper nur intranukleäre Markierungen als positiv gewertet, die im Kontrollschnitt nicht nachweisbar waren. Beige-braune Farbniederschläge, die auch in vergleichbarer Intensität in den Kontrollschnitten zu erkennen waren, wurden als unspezifisch gewertet. Die Schnitte wurden semiquantitativ von zwei Untersuchern ausgewertet, indem die Anzahl positiver Zellen in der 20er Vergrößerung und die Intensität der Immunreaktivität geschätzt wurden. Die Anzahl der spezifisch markierten Zellen wurde in Prozent (+++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen), der Grad der Intensität gemessen an dem braunen Signal negativ (-), mäßig (+) und stark positiv (++) angegeben. 52
67 Material und Methoden Statistische Auswertung Die Datenauswertung sowie die Erstellung der graphischen Abbildungen erfolgten mit Hilfe des Tabellenkalkulationsprogramms EXCEL 5.0 (Fa. Microsoft-Cooperation, Redmond, USA). Zur statistischen Prüfung eines signifikanten Unterschiedes zwischen den konventionellen Schnitten und dem Multiblock hinsichtlich der histologischen Parameter, des prozentualen Anteils positiver Tumorzellen und dem Grad der Immunreaktion wurde bei den annähernd normal verteilten Ergebnissen ein Student T-Test mit dem SAS-Programm durchgeführt. Als signifikant wurde ein p-wert von kleiner als 0,05 angesehen. Von jedem Tumor wurden die Stanze 1 mit der Stanze 2 und der Mittelwert der beiden Stanzen mit dem konventionellen Schnitt verglichen und statistisch ausgewertet. Die Statistik wurde im Institut für Biometrie, Epidemiologie und Informationsverarbeitung der Tierärztlichen Hochschule Hannover mit Hilfe von Herrn Dr. Rohn durchgeführt. 53
68 Material und Methoden 54
69 Ergebnisse 4 Ergebnisse 4.1 Untersuchungsmaterial In der vorliegenden Studie wurden primäre ZNS-Tumoren von Hunden und Katzen hinsichtlich der Häufigkeit des Auftretens, ihres histologischen Aussehens und ihres immunhistologischen Expressionsmusters, mit dem Ziel der Klassifikation, untersucht. Dazu wurden alle im Zeitraum der Jahre 1980 bis 2003 im Institut für Pathologie der Tierärztlichen Hochschule Hannover sezierten Hunde und Katzen retrospektiv auf das Vorkommen von primären ZNS-Neoplasien überprüft. Ebenfalls wurden 33 Hunde mit ZNS-Tumoren aus dem Sektionsgut des Institutes für Veterinär- Pathologie der Justus-Liebig-Universität Gießen und dem Department of Veterinary Biosciences der Ohio State University, USA (OSU) mit aufgenommen. Von 8548 Hunden und 4326 Katzen wiesen in Hannover 78 Hunde (0,9%) und 24 Katzen (0,5%) einen primären Tumor des ZNS auf. Von den insgesamt 135 Tumoren wurden 117 histologisch und immunhistologisch mit Hilfe des Multiblocksystems untersucht. 18 Fälle aus Hannover, bei denen das Archivmaterial nicht vorhanden war (15 Fälle) oder die Schichtdicke des Gewebes im archivierten Paraffinblock weniger als 2 mm betrug (3 Fälle), wurden nicht in die Multiblock-Studie einbezogen Merkmale der von 1980 bis 2003 im Institut für Pathologie der Tierärztlichen Hochschule Hannover sezierten Hunde und Katzen Insgesamt wurden in den 24 untersuchten Jahren 8548 Hunde und 4326 Katzen seziert Altersklassenverteilung Bei 7837 Hunden und 3392 Katzen war das Alter angegeben. Die Hunde hatten ein Durchschnittsalter von 4,0 Jahren mit einer Variation von wenigen Stunden bis über 15 Jahren. Das Alter der Katzen betrug im Durchschnitt 3,5 Jahre und hatte eine Variation von postnatal bis 22 Jahren. Die genaue Aufteilung der Altersgruppen ist der Abb. 4.1 zu entnehmen. 55
70 Ergebnisse Anzahl Tiere Hunde Katzen Jahre 3-6 Jahre 7-10 Jahre Jahre > 14 Jahre Abb. 4.1: Verteilung der Altersgruppen bei den von 1980 bis 2003 sezierten Hunden und Katzen Rassenverteilung Insgesamt wurden in dem Zeitraum von 1980 bis verschiedene Hunderassen seziert. Bei 944 Tieren war keine Rasse angegeben. Die Deutschen Schäferhunde stellten die häufigste Rasse dar, gefolgt von Mischlingen, Dackeln und Yorkshire Terriern. Alle Rassen mit weniger als 150 Tieren wurden in der Abb. 4.2 nicht namentlich berücksichtigt Anzahl Tiere DSH 1033 Mischling Dackel Yorkshire T. 353 Boxer 330 Rottweiler Pudel Cocker WHW T B. Sennenhd. Andere DSH: Deutscher Schäferhund, Yorkshire T.: Yorkshire Terrier, WHW T.: West Highland White Terrier, B. Sennenhd.: Berner Sennenhund Abb. 4.2: Verteilung der Rassen bei den von 1980 bis 2003 sezierten Hunden 56
71 Ergebnisse Bei 2602 von insgesamt 4326 sezierten Katzen wurde keine Rassezugehörigkeit aufgeführt. Die restlichen 1724 Tiere konnten 31 verschiedenen Rassen zugeteilt werden. Die Europäische Kurzhaarkatze stellte die häufigste Rasse dar, gefolgt von Perser, Siam und Maine Coon. Die Rassen mit weniger als 20 Tieren wurden in der Abb. 4.3 nicht namentlich erwähnt Anzahl Tiere EKH Perser 404 Siam Maine Coon BKH Norw. KH Birma Somali Burma Abessinier Andere 87 EKH: Europäisch Kurzhaar, BKH: Britisch Kurzhaar, Norw. KH: Norwegische Kurzhaar Abb. 4.3: Rassenverteilung bei den von 1980 bis 2003 sezierten Katzen Geschlechtsverteilung Das Geschlecht war bei 8333 Hunden und 4025 Katzen angegeben und verteilt sich wie in Abb. 4.4 dargestellt Anzahl Tiere M MK W WK Hunde Katzen Geschlecht M: Männlich, MK: Männlich kastriert, W: weiblich, WK: weiblich kastriert Abb. 4.4: Verteilung des Geschlechts bei den von 1980 bis 2003 sezierten Hunde und Katzen 57
72 Ergebnisse Merkmale der untersuchten Hunde und Katzen mit primären Tumoren des ZNS (Institut für Pathologie, Tierärztliche Hochschule Hannover) Aus dem Institut für Pathologie der Tierärztliche Hochschule Hannover wurden in dem Zeitraum von 1980 bis 2003 insgesamt 78 Hunde und 24 Katzen mit primären ZNS-Tumoren seziert Altersklassenverteilung Das Alter der Hunde war bei 74 Tieren angegeben und betrug im Durchschnitt 6,8 Jahre. Das jüngste Tier war 6 Monate, das Älteste 13 Jahre alt. Zur Berechnung des Durchschnittsalters der Katzen (11,2 Jahre) konnten die Angaben von 22 Tieren herangezogen werden. Die Variation reichte von 6 Monaten bis 20 Jahre. Eine genaue Altersverteilung ist in Abb. 4.5 dargestellt Anzahl Tiere 20 Hund Katze Jahre 3-6 Jahre 7-10 Jahre Jahre > 14 Jahre Abb. 4.5: Verteilung der Altersklassen bei Hunden und Katzen mit ZNS- Tumoren Rassenverteilung Die 78 ZNS-Tumoren der Hunde verteilten sich auf insgesamt 27 Rassen. Bei einem Hund war keine Rasse angegeben. Die 4 häufigsten betroffenen Rassen waren Boxer (22 Tiere), Mischlinge (11 Tiere), DSH (8 Tiere) und Briard (4 Tiere). Die übrigen Rassen sind jeweils mit weniger als 3 Tieren vertreten. Bei 8 von 24 untersuchten Katzen wurde keine Angabe über die Rasse gemacht. Die Europäische Kurzhaarkatze war mit 14 Tieren die häufigste Rasse. Bei einem Tier 58
73 Ergebnisse handelte es sich um eine Britisch Kurzhaarkatze, das andere Tier war eine Perserkatze Geschlechtsverteilung Bei 77 Hunden und 22 Katzen war das Geschlecht angegeben. Es waren 43 männliche und 34 weibliche Hunde sowie 11 Kater und 11 Katzen betroffen. Die genaue Verteilung ist der Abb. 4.6 zu entnehmen Anzahl Tiere Hund Katze 0 M MK W WK Geschlecht M: Männlich, MK: Männlich kastriert, W: weiblich, WK: weiblich kastriert Abb. 4.6: Geschlechtsverteilung bei Hunden und Katzen mit ZNS-Tumoren 59
74 Ergebnisse Merkmale der untersuchten Hunde und Katzen mit primären Tumoren des ZNS (Gießen/OSU) Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität in Gießen wurden 15 und aus dem Department of Veterinary Biosciences der Ohio State University, USA (OSU) 18 ZNS-Tumoren von Hunden zur Verfügung gestellt. Diese sind stichprobenartig aus den Archiven herausgesucht worden Altersklassenverteilung Aus beiden Instituten lagen bei je einem Hund keine Angabe über das Alter vor. Das Durchschnittsalter lag bei 6,8 Jahren. Die genaue Verteilung ist der Abb. 4.7 zu entnehmen. 10 Anzahl Hunde Ohio Gießen Jahre 3-6 Jahre 7-10 Jahre Jahre > 14 Jahre Abb. 4.7 Altersklassenverteilung der Hunde mit ZNS-Tumor (OSU und Gießen) Rassenverteilung Untersuchungsmaterial aus Gießen Die 15 untersuchten Hunde verteilten sich auf 8 verschiedene Rassen. Am häufigsten war der DSH vertreten (5 Tiere). Danach folgten mit 2 Tieren pro Rasse Dackel, Yorkshire Terrier und Cocker. Boxer, Zwergpudel, Pyrenäenberghund und Mischlinge waren mit je einem Tier pro Rasse vertreten. 60
75 Ergebnisse Untersuchungsmaterial der OSU Das Probenmaterial umfasste ZNS-Tumoren 12 unterschiedlicher Rassen, von denen 4 Proben von Mischlingen und 3 von Boxern stammten. Die Rasse Golden Retriever war mit 2 Tieren vertreten. Mit einem Tier pro Rasse folgten Samojede, Englische Bulldogge, Chow-Chow, Husky, Sheltie, Pointer, Boston Terrier, DSH und Zwergpudel Geschlechtsverteilung Untersuchungsmaterial aus Gießen Von den 15 Hunden waren 6 Tiere männlich. Die restlichen 9 Tiere waren weiblich Untersuchungsmaterial der OSU Von den 18 Hunden handelte es sich bei 7 Tieren um Rüden, von denen 4 kastriert waren. Die restlichen 11 Tiere waren weiblichen Geschlechts. 3 der Tiere waren kastriert. 61
76 Ergebnisse Verteilung der Tumoren bei den von 1980 bis 2003 im Institut für Pathologie der Tierärztliche Hochschule Hannover sezierten Hunden Bei den 78 untersuchten Hunden wurden 15 verschiedene Tumorarten diagnostiziert. Zwei Tumoren konnten nicht eindeutig klassifiziert werden. Die Häufigkeit der einzelnen Tumortypen ist der Abb. 4.8 zu entnehmen. Oligoastrozytom Meningeales Karzinom Mikrogliomatose Neoplastische Retikulose Primäres, zentrales Lymphom Nicht klassifizierbarer Tumor Maligne Histiozytose Medulloblastom Nervenscheidentumor Suprasellärer Keimzelltumor Ependymom 1= 1,3% 1= 1,3% 1= 1,3% 1= 1,3% 2= 2,6% 2= 2,6% 2= 2,6% 2= 2,6% 3= 3,8% 3= 3,8% 5= 6,4% Choroid-Plexus Tumor Astrozytom Meningeom Oligodendrogliom 10= 12,8% 12= 15,4% 15= 19,2% 18= 23,1% Anzahl Hunde Abb. 4.8: Verteilung der Tumoren bei den Hunden aus Hannover 62
77 Ergebnisse Verteilung der Tumoren bei den von 1980 bis 2003 im Institut für Pathologie der Tierärztliche Hochschule Hannover sezierten Katzen Es wurden bei den insgesamt 24 betroffenen Katzen 5 verschiedene Tumorarten festgestellt. Die Verteilung dieser ist der Abb. 4.9 zu entnehmen. Lymphom Oligodendrogliom Ependymome 1= 4,2% 1= 4,2% 2= 8,3% Astrozytome Meningeome 6=25% 14= 58,3% Abb. 4.9: Verteilung der Tumoren bei den Katzen aus Hannover Verteilung der Tumoren bei den Hunden aus Gießen und der OSU Die 33 aus Gießen und OSU mit in die Studie einbezogenen Fälle konnten wie in der Abb dargestellt klassifiziert werden. Insgesamt wurden 8 verschiedene Tumoren diagnostiziert. Hypophysenadenom Medulloblastom Intraspinales Nephroblastom Ependymom Choroid-Plexus Tumor Meningeom Oligodedrogliom Astrozytom Anzahl Hunde Gießen OSU Abb Verteilung der Tumoren beim Hund aus Gießen (n=15) und der OSU (n=18) 63
78 Ergebnisse Alters-, Rassen- und Geschlechtsverteilung der von 1980 bis 2003 im Institut für Pathologie der Tierärztliche Hochschule Hannover sezierten Hunde und Katzen mit Tumoren des ZNS Von insgesamt 102 Tumoren wurden 18 (17,6%) Neoplasien als Astrozytom eingeteilt. Die Fälle verteilten sich auf 12 Hunde (66,7%) und 6 Katzen (33,3%). Bei den Hunden stellten sich 3 Tumoren als gut differenzierte Astrozytome dar, von denen 2 als fibrilläres (Nr. 1, 2) und eines als protoplasmatisches Astrozytom (Nr. 6) charakterisiert wurden. Bei 3 der kaninen Neoplasien (Nr. 8, 9 und S 4865/86) handelte es sich um anaplastische Astrozytome, bei 6 (Nr. 12, 14, 17, 19 und S 2011/85, S 4951/88) um Glioblastome. Von den Katzen wiesen 2 Tiere (S 147/95, S 5277/83) ein anaplastisches Astrozytom und 4 (Nr. 13, 15, 16, 18) ein Glioblastom auf. Das Durchschnittsalter der betroffenen Hunde lag bei 5,7, das der Katzen bei 7,7 Jahren. 2 der Hunde waren 2 Jahre (Nr. 2, 9), zwei 5 Jahre (S 4865/86, S 4951/88), zwei 6 Jahre (Nr. 8, 17), vier 7 Jahre (Nr.6, 12, 19 und S 2011/85) und ein Hund 9 Jahre (Nr. 1) alt. Bei einem Hund (Nr. 14) wurde kein Alter angegeben. Bei den Katzen war eine 5 (S 147/95), eine 6 (S 5277/83), eine 7 (Nr. 13), eine 8 (Nr. 15) und zwei 10 Jahre alt (Nr. 16, 18). Die 12 Hunde teilten sich auf folgende Rassen auf: 6 Boxer (Nr. 8, 9, 12, 17 und S 2011/85, S 4951/88), 3 Briards (Nr. 1, 2, 6), ein Berner Sennenhund (Nr. 14)und 2 Mischlinge (Nr. 10, 19). 3 der betroffenen Katzen waren Europäische Kurzhaarkatzen (Nr. 15, 16, 18), bei einer handelte es sich um einen Perser (S 5277/83). Bei zwei Katzen (Nr. 13 und S 147/95) war die Rasse nicht angegeben. Von den 12 Hunden waren 5 Tiere weiblich (Nr. 1, 2, 6, 12 und S 2011/85), von denen eine Hündin kastriert war (Nr. 6). Die restlichen 7 Hunde waren Rüden (Nr. 8, 9, 14, 17, 19 und S4865/86, S4951/88). Bei den Katzen waren 3 männliche (Nr. 15 und S 147/95, S 5277/83) ein männlich kastriertes (Nr. 18) und ein weibliches Tier (Nr. 16) betroffen. Das Geschlecht einer Katze war unbekannt (Nr. 13). Insgesamt wurde bei 19 (18,6%) Tieren ein Oligodendrogliom diagnostiziert. Es waren 18 Hunde (94,7%) und eine Katze (5,3%) betroffen. Bei den Hunden konnten 12 Tumoren (Nr. 21, 22, 23, 24, 25, 26, 27, 28, 29, 33 und S 1077/93, S 84/89) als Oligodenrogliom und 6 (Nr. 34, 35, 36, 37, 42, 43) als anaplastisches Oligodendrogliom eingeteilt werden. Die Katze (Nr. 41) wies ein anaplastisches Oligodendrogliom auf. 64
79 Ergebnisse Das Durchschnittsalter der Hunde lag bei 6,6 Jahren. Jeweils 4 Hunde waren 5 (Nr. 26, 35, 36, 37), 6 (Nr. 24, 25, 27, 34), 7 (Nr. 29, 42 und S 1077/93, S 84/89) und 8 (Nr. 21, 22, 28, 33) Jahre alt. Eines der Tiere war 3 (Nr. 43) und ein Tier (Nr. 23) 11 Jahre. Die betroffene Katze hatte ein Alter von 5 Jahren. Die Oligodendrogliome der Hunde verteilten sich auf 6 Rassen. Bei einem Hund (Nr. 35) war keine Rasse angegeben. Jeweils mit einem Tier waren die Rassen Langhaardackel (Nr. 23), Boston Terrier (Nr. 26), Deutscher Schäferhund (Nr. 36) und Y- orkshire Terrier (Nr. 29) betroffen. Bei 11 (Nr. 21, 22, 24, 25, 27, 28, 33, 34, 42, 43, und S 1077/93) der erkrankten Hunde handelte es sich um Boxer, 2 Hunde waren Doggen (Nr. 37 und S 84/89). Bei der Katze handelte es sich um eine weiblich kastrierte Karthäuserkatze. Bei den Hunden waren 9 Tiere (Nr. 21, 23, 26, 28, 36, 37, 42, 43 und S 84/89) männlich, von denen ein Tier (Nr. 36) kastriert war. Sieben Tiere waren weiblich (Nr. 22, 25, 27, 33, 34, 35 und S 1077/93) und ein Tier (Nr. 24) weiblich kastriert. Bei einem Hund (Nr. 29) war vorberichtlich kein Geschlecht angegeben. Bei einem Hund (1%) wurde ein Oligoastrozytom festgestellt (Nr. 45), dabei handelte es sich um einen 4 Jahre alten, männlich kastrierten Briard. Von den insgesamt 102 Tumoren wurden 7 (6,9%) als Ependymom charakterisiert. Es waren 5 Hunde und 2 Katzen betroffen. Die Tumoren der Hunden wurden in 4 gut differenzierte (Nr. 46, 47 und S 5883/83, S 442/84) und ein (Nr. 54) anaplastisches Ependymom eingeteilt. Bei den Katzen konnte ein gut differenziertes (Nr. 48) und ein anaplastisches Ependymom (Nr. 51) diagnostiziert werden. Das Durchschnittsalter der Hunde lag bei 7,4 Jahren. Ein Hund war 5 (Nr. 46), einer 6 (Nr. 54), einer 7 (Nr. 47), einer 8 (S 5883/83) und einer 11 (S 442/84) Jahre alt. Die erkrankten Katzen hatten ein Alter von 6 (Nr. 51) und 10 Monaten (Nr. 48). Die 5 Hunde verteilten sich auf die Rassen Yorkshire Terrier (Nr 47), Bordeaux Dogge (Nr. 46), Pinscher (S5883/83), Cocker (S 422/84) und Boxer (Nr. 54). Bei einer Katze (Nr. 48) handelte es sich um eine männliche Europäische Kurzhaarkatze, bei der anderen weiblichen Katze (Nr. 51) wurde keine Angabe über die Rassenzugehörigkeit gemacht. 3 (Nr. 46, 54 und S 442/84) der 5 Hunde waren weiblich. Ein Hund war männlich (S 5883/83) und einer (Nr. 47) männlich kastriert. Von den 102 in Hannover klassifizierten ZNS-Tumoren wurden 10 (9,8%) Tumoren 65
80 Ergebnisse als Choroid-Plexustumoren eingeteilt. Es waren nur Hunde betroffen. 8 (80%) Tumoren (Nr. 55, 56, 57, 58, 59, 60, 61 und S 1894/90) waren als Choroid- Plexuspapillom (CPP) und 2 (20%); (Nr. 68, 69) als Choroid-Plexuskarzinom (CPK) zu diagnostizieren. Die betroffenen Hunde hatten ein Durchschnittsalter von 5,2 Jahren. 5 (Nr. 55, 56, 57, 62 und S1894/90) der 8 Hunde waren 5 Jahre alt. Ein Hund war 3 (Nr. 58), einer 4 (Nr. 60), einer 6 (Nr. 59) und einer 9 (Nr. 61) Jahre alt. Bei einem Tier (Nr. 69) wurde keine Altersangabe gemacht. Die 8 Hunde mit CPP s gehörten den Rassen Boxer (Nr. 55), Deutscher Schäferhund (Nr. 62), Collie (Nr. 57), Stafford Terrier (Nr. 58), Afghane (Nr. 59), Rottweiler (S 1894/90) und Schnauzer (Nr. 60) an. Bei einem Hund (Nr. 61) mit CPP und den Hunden mit CPK s (Nr. 68, 69) handelte es sich um Mischlinge. Von den insgesamt 10 Hunden waren 6 Tiere männlich (Nr. 56, 57, 60, 68 und S1894/90) und ein Rüde (Nr. 59) war kastriert. Bei dem Rest der Tiere handelte es sich um Hündinnen (Nr. 55, 58, 61, 69), wovon 2 (Nr. 61, 69) kastriert waren. Es wurden 2 Medulloblastome (2%) bei den 102 in Hannover untersuchten Tumoren diagnostiziert. Die Hunde waren sehr jung mit einem Durchschnittsalter von 1,8 Jahren. Der Rhodesian Ridgeback (Nr. 70) war 2,5 Jahre alt und männlich, die Rottweilerhündin (Nr. 71) war 13 Monate. Von den 102 Neoplasien wurden 29 (29,4%) als Meningeome eingeteilt. Dabei waren 15 Hunde (51,72%); (Nr. 74, 75, 78, 79, 82, 93, 94, 95, 98, 101, S 1575/97, S 300/98, S 3341/96, S 123/96, S 1508/02) und 14 Katzen (48,28%); (Nr. 81, 84, 85, 86, 87, 88, 89, 90, 91, 92, 96, 97, S 226/03, S 2443/94) betroffen. Der Tumor eines Hundes (Nr. 101) wurde als anaplastisches Meningeom eingeteilt. Die Verteilung der verschiedenen Tumorvarianten der Meningeome bei Hund und Katze ist der Abb zu entnehmen. 66
81 Ergebnisse Anzahl Tiere Menigotheliomatös Transitionell Psammomatös 2 2 Fibrös Angiomatös Gemischt 1 Anaplastisch Hund Katze Abb. 4.11: Verteilung der Meningeomvarianten bei Hund und Katze Das Durchschnittsalter der Katzen lag bei 12,2 Jahren, das der Hunde bei 8,3. Zwei der 15 Hunde waren jeweils 5 (Nr. 98, S 300/98), 6 (Nr. 82, 93), 8 (Nr. 74, 75) und 10 Jahre (Nr. 78, 94). Jeweils ein Hund war 10 Monate (S1508/02), 2 (S 123/96), 7 (Nr. 95), 11 (Nr. 101), 12 (Nr. 79) und 13 Jahre (S 1575/97). Bei einem Hund (S 3341/96) wurde keine Altersangabe gemacht. Zwei der 14 Katzen waren 8 (Nr. 89, 90) und 3 waren 16 (Nr. 88, 96, S 2443/94) Jahre alt. Die restlichen Katzen hatten ein Alter von 5 (Nr. 92), 10 (Nr. 86), 11 (Nr. 85), 13 (Nr. 87), 14 (Nr. 84), 17 (Nr. 91) und 20 (S 226/93) Jahren. Bei 2 Katzen (Nr. 88, 97) wurde keine Angabe über das Alter gemacht. Bei den Hunden waren die folgenden Rassen betroffen: 4 Mischlinge (Nr. 97, 99, S 1575/97, S 300/98), 4 Deutsche Schäferhunde (Nr. 75, 78, 95, S 3341/96), je ein West Highland White Terrier (Nr. 82), Boxer (Nr. 93), Golden Retriever (Nr. 74), Deutsch Langhaar (Nr. 94), Hovawart (S 1508/02), Rhodesian Ridgeback (Nr. 98) und Labrador (S 123/96). Bei den Katzen waren 9 Europäische Kurzhaarkatzen (Nr. 84, 85, 86, 87, 89, 90, 97, S 226/03, S 2443/94) betroffen, die Rassezugehörigkeit der restlichen 5 Tiere (Nr. 81, 88, 91, 92, 96) war nicht bekannt. 8 (Nr. 75, 78, 79, 93, 95, 101, S 1575/97, S 1508/02) der 15 Hunde waren männlichen Geschlechts. Bei den restlichen Tieren (Nr. 74, 82, 94, 98, S 3341/96) handelte es sich um Hündinnen, von denen 2 (S 300/98, S 123/96) kastriert waren. Drei (Nr. 90, 97, S 226/03) der 14 Katzen waren weiblich, wiederum 5 (Nr. 84, 85, 89, 92, S 2443/94) waren weiblich kastriert. Von den 5 Katern (Nr. 86, 87, 88, 91, 96) war ein Tier (Nr. 86) nicht kastriert. Bei einer Katze (Nr. 81) wurde keine Angabe über das 67
82 Ergebnisse Geschlecht gemacht. Es wurden von 102 Neoplasien 3 (2,9%) als primäre Lymphome des ZNS klassifiziert. Die erkrankte weibliche Europäische Kurzhaarkatze (Nr. 103) war 10 Jahre alt, die Hunde waren 4 Jahre. Es handelte es sich um eine Deutschen Schäferhündin (Nr. 104) und eine kastrierte Mischlingshündin (Nr. 103). Ein Tumor (1%) wurde als Non-B, Non-T lymphozytäre Neoplasie eingeteilt. Bei dem Hund handelte es sich um einen sieben Jahre alten, männlichen Teckel (Nr. 105). Ein Fall (1%) wurde als Mikrogliomatose diagnostiziert. Der betroffene männliche Cocker war 7 Jahre alt (Nr. 106). 3 (2,9%) der 102 Tumoren wurden als supraselläre Keimzellzumoren klassifiziert. Es waren nur Hunde betroffen. Das Durchschnittsalter der Hunde lag bei 4,7 Jahren. Der männlich kastrierte Boxer war 4 Jahre alt (Nr. 109). Bei den anderen Tieren handelte es sich um eine 4 Jahre alte Airdale Terrier Hündin (Nr. 110) und eine 7 Jahre alte Eurasier Hündin (Nr. 111). Es wurden 2 Tumoren (2%) als maligne Histiozytose des zentralen Nervensystems klassifiziert. Der betroffene Dobermann war 6 Jahre (Nr. 107), der Berner Sennenhund 5 Jahre alt (Nr. 108). Bei beiden handelte es sich um Rüden. 3 (2,9%) der ursprünglich als primäre ZNS-Tumoren klassifizierten Neoplasien wurden als periphere Nervenscheidentumoren reklassifiziert. 2 der Tumoren wurden als zelluläres Schwannom und einer als maligner peripherer Nervenscheidentumor (MPNST) diagnostiziert. Das Durchschnittsalter der betroffenen Hunde lag bei 4 Jahren. Bei den Tieren mit den Schwannomen handelte es sich um einen ein Jahr alten weiblichen Golden Retriever (Nr. 113) und einen 3 Jahre alten männlichen Bouvier (Nr. 114). Der Cocker-Rüde (Nr. 115) mit dem MPNST war 8 Jahre. Von den 102 Tumoren wurde ein Tumor (1%) als meningeales, metastatisches Karzinom klassifiziert und 2 (2%) als nicht klassifizierbar eingeteilt. Der männliche Collie mit dem Karzinom war 8 Jahre (Nr. 116). Bei den Hunden mit den ungeklärten ZNS-Tumoren handelte es sich um einen 3 Jahre alten, weiblichen Mischling (Nr. 117) und einen 8 Jahre alten, männlichen DSH (S 2080/00). 68
83 Ergebnisse Alters-, Rassen- und Geschlechtsverteilung der aus Gießen und der OSU zur Verfügung gestellten Hunde und Katzen mit Tumoren des ZNS Von den insgesamt 33 Tumoren wurden 7 als Astrozytom klassifiziert. Als fibrilläres Astrozytom wurden 3 (Nr. 3, 4, 5), als gemistozytäres Astrozytom eine (Nr. 7), als anaplastisches Astrozytom 2 (Nr. 10, 11) und als Glioblastom eine (Nr. 20) Umfangsvermehrung bezeichnet. Das Durchschnittsalter der Hunde lag bei 6,7 Jahren. 2 der Hunde waren jeweils 7 (Nr. 4, 20) und 8 (Nr. 5, 10) Jahre alt. Jeweils ein Tier war 3 (Nr. 11), 4 (Nr. 3) und 10 Jahre (Nr. 7) alt. Betroffen waren die Rassen Yorkshire Terrier (Nr. 3), Dackel (Nr. 4), Pudel (Nr. 5), Deutscher Schäferhund (Nr. 7), Golden Retriever (Nr. 11) und Mischlinge (Nr. 10, 20). Von den 5 männlichen Hunden (Nr. 4, 5, 7, 10, 20) waren 2 Tiere (Nr. 7, 10) kastriert. Es waren 2 weibliche Tiere (Nr. 3, 11) betroffen, von denen eins (Nr. 11) kastriert war. Als Oligodendrogliom wurden 3 Tumoren (Nr. 30, 31, 32) und als anaplastisches Oligodendrogliom 4 Tumoren (Nr. 38, 39, 40, 44) eingelteilt. Die Hunde hatten ein Durchschnittsalter von 7,6 Jahren. Jeweils ein Hund war 3 (Nr. 31), 4 (Nr. 38), 5 (Nr. 40), 7 (Nr. 39) und 14 (Nr. 44) Jahre alt. Das Alter von 10 Jahren erreichten 2 Hunde (Nr. 30, 32). Es waren 2 Boxer (Nr. 38, 39), eine Bulldogge (Nr. 31), ein Boston Terrier (Nr. 32), ein Pudel (Nr. 30), ein Samojede (Nr. 40) und ein Cocker (Nr. 44) betroffen. Bei 4 Hunden (Nr. 31, 32, 39, 44) handelte es sich um Rüden. Von den 3 weiblichen Tieren (Nr. 30, 38, 40) war ein Tier (Nr. 38) kastriert. 4 der 33 Hunde wiesen ein Ependymom auf. Bei einem Tumor handelte es sich um ein papilläres Ependymom (Nr. 49), bei einem um ein klarzelliges Ependymom (Nr. 50) und 2 (Nr. 52, 53) wurden als anaplastisches Ependymom klassifiziert. Das Durchschnittsalter lag bei 8,8 Jahren. Ein Hund war 6 (Nr. 49), einer 8 (Nr. 53), einer 10 (Nr. 50) und einer 11 (Nr. 52) Jahre alt. Es handelte sich um 2 Boxer und 2 Deutsche Schäferhunde (Nr. 52, 53). 2 der Tiere waren männlich (Nr. 52, 53), eins weiblich (Nr. 50) und ein Hund weiblich kastriert (Nr. 49). Insgesamt wurden 6 Choroid-Plexuspapillome (Nr. 62, 63, 64, 65, 66, 67) diagnostiziert. Das Durchschnittsalter lag bei 5,7 Jahre. Jeweils ein Hund waren 3 (Nr. 64), 7 (Nr. 63) und 9 Jahre alt. 3 Tiere (Nr. 62, 65, 66) waren 5 Jahre alt. Folgende Rassen waren betroffen: Deutscher Schäferhund (Nr. 62, 64), Pyrenäenberghund (Nr. 63), Golden Retriever (Nr. 65), Chow-Chow (Nr. 66) und Sheltie (Nr. 67). Von den 5 (Nr. 69
84 Ergebnisse 62, 63, 65, 66, 67) Rüden war einer (Nr. 67) kastriert. Ein Tier war weiblichen Geschlechts (Nr. 64). Von den 33 Tumoren wurde eine Umfangsvermehrung als Medulloblastom klassifiziert. Das Alter des männlichen Pointers (Nr. 71) war nicht bekannt. Bei einem Tumor handelte es sich um ein intraspinales Nephroblastom. Der betroffene weibliche Husky (Nr. 73) war 1 Jahr alt. 6 der 33 Tumoren konnten als Meningeom diagnostiziert werden. 2 wurden als menigotheliomathöses Menigeom (Nr. 76, 77), eins als fibromatöses Meningeom (Nr. 80), 2 als transitionelles Meningeom (Nr. 83, 100) und eins als myxoides Meningeom (Nr. 99) klassifiziert. Die Hunde hatten ein Durchschnittsalter von 8 Jahren. 2 der Hunde waren 6 (Nr. 76, 80), einer 5 (Nr. 99), einer 11 (Nr. 77) und einer 12 (Nr. 83) Jahre alt. Bei einem Hund (Nr. 100) war das Alter nicht bekannt. Es waren 3 Mischlinge (Nr. 76, 77, 99), ein Deutscher Schäferhund (Nr. 80), ein Cocker (Nr. 83) und ein Teckel (Nr. 100) betroffen. 2 Hunde waren männlich (Nr. 80, 100), 3 weiblich (Nr. 76, 83, 99) und ein Tier weiblich kastriert (Nr. 77). Ein Tumor wurde als Hypophysenadenom reklassifiziert. Es handelte sich dabei um einen 10 Jahre alten, männlich kastrierten Yorkshire Terrier (Nr. 112) Metastasen Bei den hier untersuchten Hunden und Katzen wurden vorberichtlich keine Metastasen von den primären Gehirntumoren in der Peripherie beobachtet. 70
85 Ergebnisse 4.2 Methodenvergleich Die Einsatzmöglichkeit des Multiblocksystems wurde anhand der vergleichenden, histologischen und immunhistologischen Untersuchung von konventionellen Schnitten und Multiblocksystem überprüft. Untersuchungsmaterial waren 10 primäre ZNS- Tumoren von Hund und Katze (Nr. 74, 89, 37, 28, 69, 60, 48, 47, 6, 15) Prozentualer Anteil von Tumorgewebe in den Stanzen (Treffsicherheit) Als erstes wurde das in der Stanze enthaltene Tumorgewebe mit dem des konventionellen Schnittes verglichen, um zu prüfen, ob ein repräsentativer Bereich des Tumors getroffen worden ist. In Einzelfällen wurden beispielsweise Übergangsbereiche zwischen normalem Gewebe und Tumor (Abb und Abb. 4.13), größere Nekroseflächen oder Blutungen gestanzt. Pro Tumor wurden 2 Stanzen (für 10 Tumoren = 20 Stanzen) entnommen und bewertet. In 12 Stanzen (60%) wurde das Tumorzentrum getroffen (Abb und Abb. 4.15). 4 Stanzen (20%) enthielten Anteile mit normalem Gehirngewebe, während eine Stanze weniger als 5% Tumorgewebe enthielt und immunhistologisch nicht auswertbar war. Bei 2 Stanzen (10%) konnte ein hoher Anteil an Nekrosen festgestellt werden, während dieser jedoch auch im konventionellen Schnitt sehr hoch war. Wiederum 2 Stanzen (10%) zeigten einen hohen prozentualen Anteil an Blutungen, die auch im konventionellen Schnitt gefunden wurden. Eine der beiden Stanzen war jedoch zusätzlich im Übergangsbereich zum normalen Gewebe gestanzt worden und enthielt somit nur wenige Tumorzellen. Zusammengefaßt enthielten 2 der 20 Stanzen einen für die sichere immunhistologische Auswertung zu geringen Anteil an Tumorzellen. Die Stanzen waren jedoch nicht von einem Tumor. Es war also in jedem Fall mindestens eine Stanze vorhanden. In den den beiden Fällen wurde die auswertbare Stanze und nicht der Mittelwert der beiden Stanzen für die Beurteilung der Immunhistologie herangezogen. Die Sensitivität der Methode liegt aufgrund der vorliegenden Ergebnisse bei 90%. 71
86 Ergebnisse Abb. 4.12: Beispiel für die geringe Übereinstimmung der Treffsicherheit: Oligodendrogliom (Stern) mit verzweigter Gefäßproliferation (Pfeile), konventioneller Schnitt; Hund: Nr. 28; H.E.-Färbung, Balken = 200m Abb. 4.13: Beispiel für die geringe Übereinstimmung der Treffsicherheit: Oligodendrogliom, Wenig Tumorgewebe (Stern) mit Blutungen (Pfeile) und normalem Neuroparenchym (Pfeilspitzen), Multiblock; Hund: Nr. 28; H.E.-Färbung, Balken = 200m 72
87 Ergebnisse Abb. 4.14: Beispiel für die hohe Übereinstimmung der Treffsicherheit: Glioblastoma multiforme mit Nekrosen (Stern) und Pseudopalisaden (Pfeil), konventioneller Schnitt; Katze: Nr. 15, H.E.-Färbung, Balken = 200m Abb. 4.15: Beispiel für die hohe Übereinstimmung der Treffsicherheit: Glioblastoma multiforme mit Nekrosen (Stern) und Pseudopalisaden (Pfeil), Multiblock; Katze: Nr. 15, H.E.-Färbung, Balken = 200m 73
88 Ergebnisse Vergleich histologischer Befunde Sowohl die konventionellen Schnitte als auch die dazugehörigen Stanzen wurden nach definierten histologische Kriterien (siehe ) untersucht. Die normal verteilten Werte wurden unter Zuhilfenahme der Statistik-Software SAS 8.2. für Windows mit einem gepaarten t-test beurteilt. Die Ergebnisse der histologischen Untersuchung der Stanzen und der konventionellen Schnitte sind im Anhang in Tab. 9.5 zu finden. Die statistische Untersuchung hinsichtlich der Übereinstimmung der histologischen Parameter in Stanze 1 und Stanze 2 ergab keine signifikanten Unterschiede (siehe Tab. 4.1). Tab. 4.1: p-werte der statistischen Untersuchung hinsichtlich der Übereinstimmung der histologischen Parameter zwischen Stanze 1 und 2 Parameter p-wert Anordnung der Tumorzellen 0,3434 Anisokaryose 0,3434 Nukleolus Mitosen 0,6783 Blutungen 0,4620 Entzündungszellen Nekrosen 0,3091 +: Mittelwert der Gruppen zeigten keinen Unterschied und waren somit nicht statistisch signifikant Ebenso ergaben sich keine statistisch signifikanten Unterschiede bei dem Vergleich des Mittelwertes der Stanzen mit den Ergebnissen der konventionellen Schnitte (siehe Tab. 4.2). Tab. 4.2: p-werte der statistischen Untersuchung hinsichtlich der Übereinstimmung der histologischen Parameter zwischen dem Mittelwert der Stanzen und dem konventionellen Schnitt Parameter + + p-wert Anordnung der Tumorzellen 0,3434 Anisokaryose 0,3434 Nukleolus Mitosen 0,1091 Blutungen 0,1512 Entzündungszellen 0,3434 Nekrosen 0, : Mittelwert der Gruppen zeigten keinen Unterschied und waren somit nicht statistisch signifikant 74
89 Ergebnisse Immunhistologische vergleichende Befunde Bei der immunhistologischen Untersuchung wurden der Prozentsatz der positiven Zellen und der Grad der Immunreaktivität der konventionellen Schnitte und des Multiblocks semiquantitatv beschrieben. Auch diese Ergebnisse wurden mit Hilfe der Statistik-Software SAS 8.2. für Windows verglichen. Als erstes wurden die normalverteilten Werte der beiden Stanzen untereinander mit einem gepaarten t-test überprüft. Es ergaben sich sowohl im prozentualen Anteil positiver Tumorzellen als auch im Grad der Immunreaktivität keine signifikanten Unterschiede. Danach wurde der Mittelwert der beiden Stanzen sowie jede Stanze einzeln mit den Ergebnissen des konventionellen Schnittes verglichen. Auch hier ergaben sich keine signifikanten Unterschiede im prozentualen Anteil positiver Tumorzellen und im Grad der Immunreaktivität (Beispiel eines Glioblastoms: konventioneller Schnitt: Abb und Multiblock Abb. 4.17). Die jeweiligen p-werte der statistischen Untersuchung des Prozentsatzes der positiven Tumorzellen und dem Grad der Immunreaktivität sind im Anhang in Tab. 9.7 aufgelistet. Im folgenden sind die statistischen Ergebnisse am Beispiel von Vimentin und GFAP dargestellt (Abb und Abb. 4.19). 75
90 Ergebnisse Abb. 4.16: Beispiel für die Übereinstimmung des prozentualen Anteils positiver Zellen und dem Grad der Immunreaktivität. Glioblastoma multiforme mit GFAP-Expression. Nekrose (Stern) mit Pseudopalisaden (Pfeile), konventioneller Schnitt; Katze: Nr. 15; Nomarski- Beleuchtung, Balken = 100m Abb. 4.17: Beispiel für die Übereinstimmung des prozentualen Anteils positiver Zellen und dem Grad der Immunreaktivität. Glioblastoma multiforme mit GFAP-Expression. Nekrose (Stern) mit Pseudopalisaden (Pfeile), Multiblock; Katze: Nr. 15;Nomarski-Beleuchtung, Balken = 100m 76
91 Ergebnisse Abb. 4.18: Prozentualer Anteil Vimentin-positiver Zellen in den Stanzen 1 und 2 sowie im konventionellen Schnitt der 10 untersuchten Tumoren. Es konnten keine signifikanten Unterschiede zwischen dem Median der Stanzen und dem konventionellen Schnitt festgestellt werden (p= 0,3097). Maximum 75% Quartil Median 25% Quartil Minimum Konv. Schn.: konventioneller Schnitt; pos.: positiv 77
92 Ergebnisse Abb. 4.19: Prozentualer Anteil GFAP-positiver Zellen in Stanze 1 und 2 sowie im konventionellen Schnitt der 10 untersuchten Tumoren. Es konnten keine signifikanten Unterschiede zwischen dem Median der Stanzen und dem konventionellen Schnitt festgestellt werden (p= 0,3597). Maximum 75% Quartil Median 25% Quartil Minimum O: Ausreißer; Konv. Schn.: konventioneller Schnitt; pos.: positiv 78
93 Ergebnisse 4.3 Histologische und immunhistologische Untersuchungsergebnisse der Tumoren Insgesamt wurden 84 Tumoren aus Hannover, 15 aus Gießen und 18 aus der OSU histologisch am konventionellen Schnitt und immunhistologisch mit Hilfe des Multiblocksystems untersucht. Eine Auflistung der topographischen Ergebnisse sind für alle Tumoren im Anhang Tab. 9.1 zu finden. Die histologischen Befunde sind für die untersuchten Neoplasien pro Fall im Anhang Tab. 9.3 und Tab. 9.4 aufgelistet Positivkontrollen Da im Folgenden die immunhistologischen Ergebnisse nach Tumorarten geordnet sind, wird die immunhistologische Markierung der Positivkontrollen an dieser Stelle beschrieben. Die als Positivkontrolle verwendeten Gewebe stammten jeweils von Hund und Katze. Soweit sich für die immunhistologischen Untersuchungen keine speziesbezogenen Unterschiede ergaben, wurden die Ergebnisse von Hund und Katze zusammengefasst beschrieben. Als Positivkontrolle für GFAP diente das Groß- und Kleinhirn eines Hundes und einer Katze. Das Intermediärfilament konnte in Form eines stark intensiven, homogenen Signals in den Zellkörpern und fortsätzen von Astrozyten nachgewiesen werden. Diese fanden sich sowohl in der grauen und weißen Substanz, als auch perivaskulär um die Kappilaren (Membrane limitans gliae perivaskularis). In der Negativkontrolle wurden keine Signale festgestellt. Ein kanines und felines Fibrosarkom und die Haut eines Hundes und einer Katze dienten für das Intermediärfilament Vimentin als Positivkontrolle. In der Epidermis zeigten Langerhans-Zellen, im Korium Fibrozyten und Zellen der äußeren Wurzelscheide des Haares eine starke, feingranuläre, zytoplasmatische Markierung. Zusätzlich konnte eine mäßige bis starke Expression in den Mediazyten und Endothelzellen der Gefäße gefunden werden. Diffus wurden einzelne, mäßig intensiv markierte, markrophagenähnliche Zellen im Korium nachgewiesen. Im Fibrosarkom zeigten 100% der Tumorzellen eine starke, zytoplasmatische Markierung. Die Endothelzellen der Gefäße wiesen ebenfalls eine starke Kennzeichnung auf. Diese Markierung wurde auch in den Gefäßanschnitten der Tumorstanzen beobachtet und werden dort nicht mehr erwähnt. 79
94 Ergebnisse Als Positivkontrolle für das Zytokeratin LP34 diente Haut von Hund und Katze. Die Zellen der Epidermis wiesen ein starkes, homogenes und zytoplasmatisches Signal auf. Im Korium waren das Haarfollikelepithel sowie die äußere und innere Wurzelscheide und das Myoepithel der Drüsen in gleicher Intensität, zytoplasmatisch markiert. Die holokrinen Talgdrüsen wiesen eine feingranuläre, membranständige Markierung auf. Niere von Hund und Katze stellte die Positivkontrolle für das Zytokeratin AE1/AE3 dar. Es wurde eine feingranuläre, zytoplasmatische Markierung der Nierentubulusepithelien festgestellt. Die Grad der Immunreaktivität war bei der Katze wesentlich stärker ausgeprägt, als bei der Niere des Hundes. Als Positivkontrolle für das Neurofilament diente Groß- und Kleinhirn von Hund und Katze. Ein feingranuläres, stark intensives und zytoplasmatisches Signal wurde in den Neuronen und den Purkinje-Zellen beobachtet. Das Neuropil zeigte eine homogene, schwache bis mäßig intensive Markierung. Für den Trk-Antikörper diente das Groß- und Kleinhirn von Hund und Katze als Positivkontrolle. Die Markierung war feingranulär und intranukleär mit starker Intensität in den Neuronen und schwächer in den Astrozyten zu beobachten. Der Nachweis eines Signals gelang jedoch nicht in allen Neuronen und Astrozyten. Die immunhistologische Markierung zeigte allgemein eine schwache bräunliche Hintergrundfärbung. Als Positivkontrolle für das S100-Protein diente ebenfalls Groß- und Kleinhirn von Hund und Katze. Es wurden zahlreiche homogen bis grobgranulär, mäßig bis stark intensiv, zytoplasmatisch und intranukleär markierte Astrozyten nachgewiesen. Das intranukleäre Signal war dabei intensiver als das zytoplasmatische. Zusätzlich fand sich eine homogene, schwache bis mäßige Kennzeichnung des gesamten Neuropils. Die Leber und Darm von Hund und Katze dienten als Positivkontrolle für den Nachweis von CEA. Es wurde in den Gallengangsepithelien ein fein- bis grobgranuläres, zytoplasmatisches und membranassoziiertes, mäßig bis stark intensives Signal nachgewiesen. Bei der Katze zeigten nicht alle Gallengangsepithelien eine Markierung. Die apikale Zellmembran der Tunica mucosa des Darmes zeigte bei beiden Tieren ein mäßig intensive Kennzeichnung. Als Positivkontrolle für Synaptophysin diente das Groß- und Kleinhirn von Hund und Katze. Das Großhirn der Katze zeigte eine starke, grobgranuläre Markierung des Neuropils. Im Großhirn des Hundes wurde kein Signal nachgewiesen. Eine mäßig 80
95 Ergebnisse bis stark intensive Markierung wurde im Kleinhirn kappenartig um die Purkinjezellen beobachtet. Das Neuropil zeigte auch hier eine grobgranuläre Kennzeichnung. In der weißen Substanz lagen vereinzelt, grobgranuläre, in Ketten liegende positive Zellen. Das Signal beim Hund war schwächer als das der Katze. Für CD79 wurde Lymphknoten und Milz von Hund und Katze als Kontrollgewebe verwendet. In der weißen Milzpulpa zeigten Zellen der B-Zell-Areale eine membranständige, mäßig bis stark intensive Markierung. Bei einzelnen Zellen innerhalb der roten Pulpa wurde ein membrangebundenes, in den Mediazyten der Trabekelgefäße ein zytoplasmatisches, mäßig intensives Signal nachgewiesen. Die Markierung in den Gefäßen wurde auch in der Negativkontrolle nachgewiesen, so dass diese als unspezifisch gewertet wurde. Die Milz des Hundes wies keine Gefäßmarkierung auf. Im Lymphknoten der Katze wurde neben membrangebundenen markierten Lymphozyten, intranukleär, stark positive, runde Zellen im Marksinus nachgewiesen. Zusätzlich waren die Mediazyten und das Endothel der Gefäße intranukleär markiert. Beim Hund wurde eine schwache, membrangebundene Markierung einzelner Lymphozyten festgestellt, weitere Signale wurden nicht beobachtet. Da sich auch in den unterschiedlichsten Tumoren eine intranukleäre Markierung nachweisen ließ, war eine Auswertung nicht möglich. Aus diesem Grund werden die Ergebnisse mittels dieses Antikörpers bei den einzelnen Tumorarten nicht mehr berücksichtigt. Auch für CD3 dienten Milz und Lymphknoten als Positivkontrolle. Die Milz wies in der weißen Milzpulpa zahlreiche, mäßig bis stark intensiv, zytoplasmatisch und homogen markierte Zellen auf. Beim Hund war der Grad der Immunreaktivität geringer als bei der Katze und bei weniger Zellen zu beobachten. Die immunhistologische Reaktion zeigte in der Milz des Hundes allgemein eine schwach bräunliche Hintergrundfärbung. Die Lymphknoten von Hund und Katze wiesen beide eine starke, zytoplasmatische Markierung von in den Marksträngen liegenden Lymphozyten auf. Als Positivkontrolle für den von-willebrand-faktor wurde das Großhirn von Hund und Katze verwendet. Die Endothelzellen der Gefäße wiesen eine stark intensive, feingranuläre bis homogene, zytoplasmatische Markierung auf. Auch in den Gefäßanschnitten der Tumorstanzen wurde diese Markierung nachgewiesen. Sie werden im Weiteren nicht mehr bei jeder Tumorart aufgeführt. Die Plazenta eines Hundes stellte die Positivkontrolle für das -Fetoprotein dar. Im Lumen der Plazentagefäße war homogen markiertes Plasma nachzuweisen. 81
96 Ergebnisse Für NSE diente das Großhirn von Hund und Katze als Positivkontrolle. Die Neuronen wiesen ein mäßige bis starke, feingranuläre, zytoplasmatische Markierung auf. Das gesamte Neuropil zeigte eine homogene hellbraune Markierung. Als Positivkontrolle für die CNPase diente das Großhirn von Hund und Katze. Neben dem homogen, hellbraun markierten Neuropil waren sowohl in der grauen, als auch weißen Substanz kleine, stark intensiv, zytoplasmatisch gekennzeichnete Zellen nachzuweisen, bei denen es sich vermutlich um Oligodendrotyten handelt Topographie sowie histologische und immunhistologische Befunde bei den astrozytären Tumoren Von den insgesamt 117 untersuchten Neoplasien wurden 20 (17,1%) als Tumor mit astrozytärem Ursprung klassifiziert. Es waren 16 Hunde und 4 Katzen betroffen (siehe Tab. 4.3). Bei den Hunden handelte es sich um 7 gut differenzierte (diffuse) Astrozytome (Nr. 1, 2, 3, 4, 5, 6, 7), 4 anaplastische Astrozytome (Nr. 8, 9, 10, 11) und 5 Glioblastoma multiforme (Glioblastom) (Nr. 12, 14, 17, 19, 20). Die 4 Katzen (Nr. 13, 15, 16, 18) wiesen alle ein Glioblastom auf. Die genauen Daten der Hunde und Katzen mit astrozytären Tumoren und auch der anderen Neoplasien sind im Anhang 9 zu finden. Tab. 4.3: Hunde und Katzen mit astrozytären Tumoren Nr. ID UNI Diagnose Art Rasse Alter G 1 A55 H Fibrilläres Astrozytom Hund Briard 9 J w 2 A87 H Fibrilläres Astrozytom Hund Briard 2,5 J w 3 A139 G Fibrilläres Astrozytom Hund Yorkshire Terrier 4 J w 4 A142 G Fibrilläres Astrozytom Hund Dackel 7 J m 5 A181 O Fibrilläres Astrozytom Hund Zwergpudel 8 J m 6 A71 H Protopl. Astrozytom Hund Briard 7 J wk 7 A174 O Gemistozytäres Astrozytom Hund DSH 10 J mk 8 A30 H Anapl. Astrozytom Hund Boxer 6 J m 9 A127 H Anapl. Astrozytom Hund Boxer 2 J m 10 A163 O Anapl. Astrozytom Hund Mix 8 J mk 11 A196 O Anapl. Astrozytom Hund Golden Retriever 3 J wk 82
97 Ergebnisse Fortsetzung Tab. 4.3 Nr. ID UNI Diagnose Art Rasse Alter G 12 A12 H Glioblastom Hund Boxer 7 J w 13 A42 H Glioblastom Katze o. A. 7 J o.a. 14 A67 H Glioblastom Hund Berner Sennenhund Adult m 15 A95 H Glioblastom Katze EKH 8 J m 16 A46 H Glioblastom Katze EKH 10 J w 17 A16 H Glioblastom Hund Boxer 6 J m 18 A105 H Glioblastom Katze EKH 10 J mk 19 A124 H Glioblastom Hund Mix 7 J m 20 A179 O Glioblastom Hund Mix 7 J m Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, Anapl.: Anaplastisch, Protop.: Protoplasmatisch DSH: Deutscher Schäferhund, Mix: Mischling, EKH: Europäische Kurzhaarkatze, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, o.a.: ohne Angabe Topographische Befunde der astrozytären Tumoren Diffuse Astrozytome Alle 7 kaninen, diffusen Astrozytome wiesen eine intrakraniale, intraaxiale Ausbreitung auf. 5 (Nr. 1, 2, 5, 6, 7) der Neoplasien lagen rostrotentorial und 2 (Nr. 3, 4) kaudotentorial. Während es sich bei 6 Tumoren um eine solitäre Läsion handelte, wurde bei dem Tumor des Tieres Nr. 5 ein multifokales Wachstum im Großhirn beobachtet. Der Tumor des Tieres Nr. 6 zeigte umschriebene Tumorgrenzen mit fokalem infiltrativen Wachstum, während die anderen unscharfe Grenzen aufwiesen. Keiner der nodulären Tumoren wies eine Kapsel auf Anaplastisches Astrozytom 3 (Nr. 8, 10, 11) der 4 anaplastischen Astrozytome der Hunde wiesen ein intrakraniales, intraaxiales und parenchymatöses Wachstum auf. Der Tumor des Tieres Nr. 8 war kaudotentorial, die Tumoren der Tiere Nr. 10 und 11 rostrotentorial lokalisiert. Während ein Tumor (Nr. 11) multifokales Wachstum zeigte, wuchsen die anderen solitär. Ein solitär wachsendes, anaplastisches Astrozytom (Nr. 9) war intraspinal, intraaxial und intradural lokalisiert. Die nodulären, nicht abgekapselten Tumoren besaßen unscharfe Grenzen und wuchsen infiltrativ Glioblastoma multiforme (Glioblastom) Die 5 nicht abgekapselten, nodulären Glioblastome der Hunde zeigten eine intrakraniale, intraaxiale, rostrotentoriale und solitäre Ausbreitung. 83
98 Ergebnisse Die gleiche Ausbreitung wiesen auch die Tumoren bei den Katzen mit der Nr. 15 und 16 auf. Der Tumor einer anderen Katze (Nr. 15) zeigte trotz relativ umschriebener Tumorgrenzen eine geringgradige Infiltration des umliegenden Gewebes. Durch das infiltrative Wachstum erschienen die Grenzen aller kaninen und felinen Tumoren unscharf.der solitär wachsende Tumor einer Katze (Nr. 18) war intraspinal, intraaxial und intradural lokalisiert. Ein intrakraniales, kaudotentoriales und wahrscheinlich durch Metastasierung intraspinales Auftreten wurde bei dem Tumor der Katze mit der Nr. 13 beobachtet. Dieser wuchs extra- und intraaxial, leptomeningeal und intradural Histologische Befunde der astrozytären Tumoren Diffuse Astrozytome Die gering- bis mittelgradig zellreichen fibrillären Astrozytome der Hunde zeigten eine solide Anordnung der Tumorzellen, die in einem fibrillären Netzwerk lagen (Abb und Abb. 4.21). Bei einem Tumor (Nr. 5) wurden nesterartig einzelne Areale mit erhöhter Zelldichte festgestellt. Alle Fälle wiesen ein gering- bis mittelgradiges (Nr. 2), fibro-vaskuläres Stroma auf. Die ca m großen, längsovalen bis rundovalen oder spindelförmigen Zellen mit undeutlichen Zellgrenzen hatten ein schwach eosinophiles bis klares Zytoplasma. Die ca m großen, rund- bis längsovalen oder länglichen, teils gekerbten, zentral gelagerten Kerne mit gering- bis mittelgradigem Anteil an homogen verteiltem Chromatin wiesen in einem Fall (Nr. 5) eine geringgradige Polymorphie auf. Bei 2 Tumoren (Nr. 2, 4) lag die Anzahl der Mitosen pro Gesichtsfeld unter Verwendung des 40er-Objektives (hpf) bei 0 bis einer. Eine Neoplasie (Nr. 2) zeigte ebenso viele Apoptosen/hpf. Ein Tumor (Nr. 4) wies herdförmig ca. 35 m große, polymorphe Zellen mit deutlichen Zellgrenzen auf. Der Tumor des Tieres Nr. 2 wies eine mittelgradige, periphere Entzündung mit Plasmazellen, Lymphozyten und Makrophagen auf. Die polygonalen bis sternförmigen, ca. 20 m großen Zellen des kaninen protoplasmatischen Astrozytom lag in einem soliden, lockeren und netzwerkartigen Zellverband (Abb und Abb. 4.23). Mikroskopisch war eine mittelgradige Bindegewebsproliferation zu erkennen. Das Zytoplasma der deutlich bis undeutlich begrenzten Zellen erschien glasig bis schwach eosinophil. Der m große, runde, zentral lokalisierte Zellkern mit geringradiger Anisokaryose zeigte einen mittelgradi- 84
99 Ergebnisse gen Gehalt an homogen verteiltem Chromatin. Meistens waren ein Nukleolus pro Kern, 1-2 Mitosen/hpf und 1-3 Apoptosen/hpf nachweisbar. Nekrosen wurden nicht festgestellt. Im gemistozytären Astrozytom des Hundes mit der Nr. 7 fanden sich in solider Anordnung bis zu 40 m große, deutlich abgegrenzte, polygonale Zellen mit eosinophilem Zytoplasma und geringgradigem Gehalt an fibro-vaskulärem Stroma (Abb. 4.24). Der leicht exzentrisch gelegene, ca m große Kern wies eine runde bis -ovale Form auf und enthielt geringgradig, homogen verteiltes Chromatin. Es war meistens ein Nukleolus pro Kern zu erkennen. Zwischen den oben beschriebenen Zellen gab es Bereiche mit eher längsovalen, ca. 20 m großen, undeutlich begrenzten Zellen mit eosinophilem Zytoplasma. Die ca. 10 m großen, zentral gelegenen Zellkerne wiesen einen mittelgradigen, homogen verteilten Chromatingehalt auf. Mitosen, A- poptosen oder Nekrosen waren nicht zu erkennen. Der Tumor wies peripher eine gering- bis mittelgradige, lymphozytäre Entzündung auf Anaplastische Astrozytome Die kaninen Neoplasien besaßen ein zelldichteres Bild als die diffusen Astrozytome. Der Tumor des Tieres Nr. 11 erschien am zellreichsten. Das histologische Bild der Neoplasien bestand vorwiegend aus solide angeordneten Tumorzellen (Abb. 4.25). Bei einem Tumor (Nr. 9) waren zusätzlich angedeutete Rosetten und bei einem (Nr. 10) nesterartige Areale zu erkennen. In einem Fall (Nr. 9) war gering- bis mittelgradig fibro-vaskuläres Stroma vorhanden. Die Zellen hatten eine runde- bis längsovale o- der polygonale und teilweise auch polymorphe (Nr. 9, 11) Gestalt. Bei einer Größe von ca. 30 m waren die Zellgrenzen überwiegend undeutlich erkennbar und das Zytoplasma eosinophil. Die zentral gelegenen, ca m großen Kerne hatten eine runde bis rundovale oder längsovale Form und erschienen polymorpher als die der diffusen Astrozytome. Es war ein gering- bis mittelgradiger Chromatingehalt zu beschreiben, der fein- bis grobgranulär oder homogen verteilt war. Bei einem Fall war selten (Nr. 11) 1 Nukleolus pro Kern zu sehen. Der Gehalt an Mitosen variierte von unter einer Mitose/hpf (Nr. 11) bis zu 7 Mitosen/hpf (Nr. 8). Der Durchschnitt lag bei 3-4 Mitosen/hpf. Apoptosen (3-4/hpf bei Nr. 8 und 2/hpf bei Nr. 9) waren bei zwei Neoplasien nachweisbar. Eine geringgradige, periphere, lymphozytäre Entzündung war bei einem Tumor (Nr. 8) festzustellen. 85
100 Ergebnisse Gliobastoma multiforme (Glioblastom) Insgesamt war das solide angeordnete Zellbild der Glioblastome von Hund und Katze wesentlich heterogener und zellreicher, als das der anderen astrozytären Tumoren. Bei den Tumoren der Hunde und der Katzen wurde neben der gering- bis hochgradigen, glomeruloiden Gefäßproliferation in allen Tumoren ein gering- bis mittelgradig ausgebildetes, fibro-vaskuläres Stroma beobachtet. Die Anordnung der Tumorzellen bei den kaninen Neoplasien war als solide zu beschreiben. In einem Tumor waren vereinzelt Tumorzellketten (Nr. 12) zu beobachten. Alle Tumoren wiesen Nekrosen in unterschiedlichem Ausmaß auf. Bei einem Fall (Nr. 12) wurde keine Pseudopalisadenbildung um die Nekrosen festgestellt (Abb. 4.26). Durch die spindelförmigen bis polygonalen, teils auch runden bis ovalen Zellen lag insgesamt ein sehr heterogenes Zellbild vor. Die ca m großen, überwiegend undeutlich begrenzten Zellen besaßen ein schwach eosinophiles bis klares, teilweise vakuolisiertes (Nr. 19) Zytoplasma. Die zentral gelegenen, ca m großen Kerne wiesen gering- bis mittelgradig, homogen bis feingranulär verteiltes Chromatin auf. Die Kerne eines Tumors (Nr. 19) hatten überwiegend grobgranulär verteiltes Chromatin. Ein Nukleolus pro Zellkern war selten (Nr. 12, 20) sichtbar. Alle Tumoren zeigten Nekrosen (5% der Tumorfläche bis großflächig), hingegen wurden größere Blutungen nur bei 2 Tumoren (Nr. 14, 19) festgestellt. Bei einem Tumor (Nr. 20) waren Gefäßthromben nachweisbar. 2 Neoplasien (Nr. 12, 14) wiesen in der Peripherie eine geringgradige, lymphozytäre Entzündung auf. Bei den felinen Umfangsvermehrungen zeigten die Tumorzellen ebenso wie bei den Hunden eine solide Anordnung. In einem Fall waren vereinzelt Tumorzellketten (Nr. 18) und bei einem (Nr. 16) perivaskuläre Rosetten zu beobachten. Bei einem Tumor (Nr. 18) waren herdförmig große, teils binukleäre Zellen nachweisbar. Auch wiesen die Tumoren der Katzen in allen Tumoren Nekrosen in unterschiedlichem Ausmaß auf. 2 Fälle (Nr. 13, 18) hatten keine Pseudopalisadenbildung um die Nekrosen. Ein Tumor (Nr. 15) zeigte eine mittelgradige, kollagenfaserarme Bindegewebsproliferation. Die Zellmorphologie der Tumoren entsprach überwiegend dem der kaninen Glioblastome. Die Kerne eines Tumors (Nr. 19) hatten jedoch überwiegend grobgranulär verteiltes Chromatin. Ein Nukleolus pro Zellkern war selten (Nr. 13, 18) oder häufig (Nr. 15) sichtbar. Bei dem Tier mit der Nr. 16 lagen große, gemistozytenähnliche Zellen disseminiert im Tumor. Alle Tumoren zeigten Nekrosen (5% der Tu- 86
101 Ergebnisse morfläche bis großflächig), hingegen wurden größere Blutungen nur in 2 Tumoren (Nr. 15, 16) festgestellt. Zysten waren multifokal (Nr. 16) und geringgradig (Nr. 15) bei 2 Fällen nachweisbar. Ein Tumor (Nr. 13) wies eine geringgradige, lymphozytäre, peripher lokalisierte Entzündung auf Immunhistologische Befunde der astrozytären Tumoren Diffuse Astrozytome Die fibrillären Astrozytome der Hunde zeigten mit Ausnahme eines Tumors (Nr. 1= 10% der Tumorzellen) eine 100%ige, dunkelbraune, zytoplasmatische Markierung für GFAP (Abb. 4.27). Eine zytoplasmatisch lokalisierte, überwiegend mäßig intensive Vimentin-Expression wurde bei 3 Fällen (Nr. 2, 4, 5) in über 90% und bei 2 (Nr.1, 3) in unter 40% der Tumorzellen nachgewiesen. Die intranukleäre und zytoplasmatische lokalisierte Markierung für S100-Protein war in 3 Fällen (Nr. 2, 3, 4) zu beschreiben, während die Anzahl der positiven Zellen von 10% (Nr. 3, 4) bis 60% (Nr. 2) variierte. Die Intensität der Markierung war mäßig. 3 Tumoren (Nr. 1, 2, 5) zeigten in über 80% der Zellen eine überwiegend mäßig intensive, zytoplasmatische CNPase-Expression. Bei 2 Neoplasien (Nr. 3, 4) lag die Anzahl der CNPase-markierten Zellen unter 20%. Die Intensität variierte von mäßig bis stark. In allen Fällen wurde eine positive, intranukleäre, mäßig intensive Reaktion mit dem Trk-Antikörper beobachtet. Bei 4 Tumoren (Nr. 1, 2, 3, 4) lag der prozentuale Anteil markierter Zellen unter 30%, lediglich in einem Fall (Nr. 5) betrug dieser 80%. Vereinzelt wurden in den Tumoren disseminiert kleine, runde, CD3-positive Zellen nachgewiesen. Bei der Markierung mit NSE und Neurofilament fiel bei zwei Tumoren (Nr.1, 2) ein filigranes, zwischen den Tumorzellen liegendes Netzwerk auf. Das kanine protoplasmatische Astrozytom zeigte ein ähnliches Expressionsmuster, während eine GFAP-Markierung nur in ca. 80% der Zellen nachweisbar war. Die immunhistologische Färbung des gemistozytären Astrozytoms des Hundes war, aufgrund von fehlendem repräsentativen Tumorgewebe in der Stanze, nicht auswertbar. Eine Übersicht über die Anzahl immunreaktiver Tumorzellen in den diffusen, kaninen Astrozytomen stellt die Tab. 4.4 dar. 87
102 Ergebnisse Tab. 4.4: Astrozytomen Anzahl immunreaktiver Tumorzellen in den diffusen, kaninen Antigen Nr. 1 Nr. 2 Nr. 3 Nr. 4 Nr. 5 Nr. 6 Nr. 7 GFAP n.b. Vimentin n.b. S100-Protein n.b. CD n.b. CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.b. v.-w.-faktor n.b. Synaptophysin n.b. LP n.b. AE1/AE n.b. CEA n.b. -Fetoprotein n.b. NSE n.b. Neurofilament n.b. CNPase (+) n.b. Trk (+) ++ + n.b. Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, n. b. nicht beurteilbar Anaplastische Astrozytome 3 der kaninen Umfangsvermehrungen zeigten in über 80% der Tumorzellen eine mäßig bis stark intensive, zytoplasmatische Markierung mit GFAP (Abb. 4.28). Beim Tier Nr. 10 reagierten, mit weniger stark ausgeprägter Intensität, nur 45 % der Tumorzellen. In allen anaplastischen Tumoren waren nahezu 100% der Zellen mit mäßig bis starker Intensität Vimentin-positiv. 2 (Nr. 8, 9) der 4 Tumoren reagierten in 5% der Tumorzellen mit S100-Protein. Der prozentuale Anteil CNPase-markierter Zellen war geringer als bei den diffusen Astrozytomen. Bei 3 Fällen (Nr. 8, 9, 10) lag der Anteil unter 10%, im Tumor des Tieres Nr. 11 waren ca. 40% der Zellen markiert. Das Signal war überwiegend stark intensiv. Über 90 % aller Zellen wiesen eine Kennzeichnung von variabler Intensität mit dem Trk-Antikörper auf. Eine Auflistung der Anzahl immunreaktiver Tumorzellen in den anaplastischen, kaninen Astrozytomen ist der Tab. 4.5 zu entnehmen. 88
103 Ergebnisse Tab. 4.5: Anzahl immunreaktiver Tumorzellen in den anaplastischen, kaninen Astrozytomen Antigen Nr. 8 Nr. 9 Nr. 10 Nr. 11 GFAP Vimentin S100-protein (+) (+) - - Cd Cd79 n.a. n.a. n.a. n.a. Von-W.-Faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase (+) (+) (+) + Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Glioblastoma multiforme (Glioblastom) Die Glioblastome der Hunde wiesen folgende immunhistologische Reaktionen auf: Bei 3 (Nr. 14, 19, 20) von 5 Glioblastomen lag der Anteil GFAP-positiver Zellen über 90%. Ein Anteil von 20-55% positiver Zellen wurde bei den 2 anderen Tumoren (Nr. 12, 17) beobachtet. Die Signale waren überwiegend mäßig bis stark. 4 Neoplasien wiesen eine mäßig intensive Reaktion für Vimentin auf. Der prozentuale Anteil positiver Tumorzellen lag in 4 Tumoren bei ca. 50% (Nr. 12, 14, 17, 20). Der Tumor des Tieres mit der Nr. 19 zeigte keine Immunreaktivität mit Vimentin. Eine überwiegend mäßig intensive Reaktion mit S100-Protein konnte in 3 Tumoren gefunden werden. 2 der Tumoren (Nr. 12, 17) zeigten eine Expression in ca. 50% und einer (Nr. 14) in über 80% der Tumorzellen. 4 (Nr. 12, 14, 17, 19) der Glioblastome zeigten eine geringgradige (<5-15%), ein Tumor (Nr. 20) eine mittelgradige (50%) Expression von CNPase. Die Intensität der Markierung war mäßig bis stark. Alle Tumoren zeigten eine Trk-Markierung. Die überwiegend mäßig intensive Kennzeichnung war innerhalb der Tumorgruppe stark variabel (10-100%). NSE wurde von einem (Nr. 17) Tumor in <5 % der Tumorzellen mit mäßiger Intensität exprimiert. Die positiven Zellen lagen teilweise um Nekrosen oder waren am Rand der Stanze zu finden. Einzelne Infiltrate an CD3-positiven, lymphozytäre Zellen waren in dieser Tumorgruppe zu fin- 89
104 Ergebnisse den. Bei 3 (Nr. 13, 16, 18) von den 4 felinen Glioblastomen lag der Anteil GFAP-positiver Zellen bei über 90%. Einen Anteil von 30% positiven Zellen wurde bei einem Tumor (Nr. 15) beobachtet. Die Signale waren überwiegend mäßig bis stark. Der prozentuale Anteil Vimentin-positiver Tumorzellen lag bei allen Tumoren bei ca. 100% (Nr.13, 15, 16,18). Eine Reaktion mit S100-Protein konnte in 7 Tumoren gefunden werden. Die Tumoren (Nr. 13, 15, 16, 18) zeigten eine überwiegend mäßig intensive S100- Protein-Expression in in über 80% der Tumorzellen. Keiner der Tumoren zeigte eine Expression von CNPase. Alle Tumoren wiesen eine Trk-Markierung auf. Die überwiegend mäßig intensive Kennzeichnung war auch bei den felinen Tumoren stark variabel (10-100%). NSE wurde von 3 (Nr. 15, 16, 18) Tumoren in <5 bis 40% der Tumorzellen mit mäßiger Intensität exprimiert (Abb. 4.29). Die positiven Zellen lagen teilweise um Nekrosen angeordnet oder waren am Rand der Stanze zu finden. 40% der Zellen eines Tumors (Nr. 18) reagierten mit mäßigem Signal für Neurofilament. Einzelne Infiltrate an CD3-positiven, lymphozytäre Zellen waren in dieser Tumorgruppe zu finden. Die Anzahl immunreaktiver Tumorzellen in den 9 Glioblastomen ist in der Tab. 4.6 dargestellt Tab. 4.6: Anzahl immunreaktiver Tumorzellen in den Glioblastomen Antigen Nr. 12 Nr. 13 Nr. 14 Nr. 15 Nr. 16 Nr. 17 Nr.18 Nr. 19 Nr.20 GFAP Vimentin S100-Protein CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE (+) (+) (+) Neurofilament CNPase + - (+) - - (+) Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katze 90
105 Ergebnisse Topographie sowie histologische und immunhistologische Befunde bei den oligodendroglialen Tumoren Bei 24 Tieren (20,5%) wurde ein oligodendroglialer Tumor diagnostiziert (siehe Tab. 4.7). Es waren 23 Hunde und eine Katze betroffen. Bei den Hunden handelte es sich dabei in 13 Fällen (56,5%) um ein Oligodendrogliom und in 10 Fällen (43,5%) um ein anaplastisches Oligodendrogliom. Die Katze wies ein anaplastisches Oligodendrogliom auf. Tab. 4.7: Hunde und Katzen mit oligodendroglialen Tumoren Nr. ID UNI Diagnose Art Rasse Alter G 21 A44 H Oligodendrogliom Hund Boxer 8 J m 22 A6 H Oligodendrogliom Hund Boxer 8 J w 23 A8 H Oligodendrogliom Hund Langhaar Dackel 11 J m 24 A10 H Oligodendrogliom Hund Boxer 6 J wk 25 A23 H Oligodendrogliom Hund Boxer 6 J w 26 A69 H Oligodendrogliom Hund Boston Terrier 5 J. m 27 A108 H Oligodendrogliom Hund Boxer 6 J w 28 A112 H Oligodendrogliom Hund Boxer 8 J m 29 A121 H Oligodendrogliom Hund Yorkshire Terrier 7 J o. A. 30 A137 G Oligodendrogliom Hund Zwergpudel 10 J. w 31 A185 O Oligodendrogliom Hund Englische Bulldogge 3 J. m 32 A193 O Oligodendrogliom Hund Boston Terrier 10 J. m 33 A3 H Oligodendrogliom Hund Boxer 8 J. w 34 A35 H Anapl. Oligodendrogliom Hund Boxer 6 J. w 35 A31 H Anapl. Oligodendrogliom Hund o. A.. 5 J. w 36 A73 H Anapl. Oligodendrogliom Hund DSH 5 J. mk 37 A100 H Anapl. Oligodendrogliom Hund Deutsche Dogge 5 J. m 38 A160 O Anapl. Oligodendrogliom Hund Boxer 4 J. wk 39 A161 O Anapl. Oligodendrogliom Hund Boxer 7 J. m 40 A167 O Anapl. Oligodendrogliom Hund Samojede 5 J. w 41 A61 H Anapl. Oligodendrogliom Katze Karthäuser 5 J. wk 42 A4 H Anapl. Oligodendrogliom Hund Boxer 7 J. m 43 A1 H Anapl. Oligodendrogliom Hund Boxer 3 J. m 44 A141 G Anapl. Oligodendrogliom Hund Cocker 14 J. m Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, DSH: Deutscher Schäferhund, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, w: weiblich, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der oligodendroglialen Tumoren Oligodendrogliome Insgesamt zeigten 11 der 13 kaninen Oligodendrogliome ein intrakraniales, intraaxiales, rostrotentoriales, parenchymatöses und solitäres Vorkommen. Sie wiesen ein infiltratives, nicht abgekapseltes und unscharf begrenztes Wachstum auf. Ein Tumor (Nr. 121) war intraspinal lokalisiert. Bei einem Tumor (Nr. 31) konnten die Lokalisati- 91
106 Ergebnisse on und das Wachstum am H.E.-Schnitt nicht beurteilt werden. Aufgrund des Vorberichtes konnte von einem intrakranialen Geschehen ausgegangen werden. Eine meningeale Invasion der Tumorzellen wurde bei dem Tumor des Tieres Nr. 28 beobachtet. Die Tumoren zeigten alle eine noduläre Wachstumsform Anaplastische Oligodendrogliome Bei den intrakranial und rostrotentorial wachsenden anaplastischen, kaninen Tumoren wurden 7 intraaxiale, 2 (Nr. 34, 37) extraaxiale und 1 Tumor (Nr. 42) mit extraund intraaxialem Wachstum diagnostiziert. Die Tumoren der Tiere mit der Nr. 42, 34 und 37 waren auch leptomeningeal lokalisiert. Alle anderen Tumoren zeigten ein solitäres Auftreten mit unscharfen Grenzen und infiltrativem Wachstum. Ein herdförmig diffuses und infiltratives Wachstum war bei einem Tumor (Nr. 34) festzustellen, sonst zeigten die Neoplasien eine eher umschriebene, expansive Ausbreitung. Keiner der nodulären Neoplasien wies eine Kapsel auf. Ein Tumor (Nr. 37) zeigte ein flächenhaftes, plaqueartiges Wachstum. Der Tumor der Katze wies ein intrakraniales, rostrotentoriales und solitäres Wachstum auf. Die Grenzen waren unscharf und der Tumor wuchs infiltrativ in das umliegende Gewebe Histologische Befunde der oligodendroglialen Tumoren Oligodendrogliome Alle Oligodendrogliome der Hunde zeigten die für sie charakteristische Honigwabenstruktur in unterschiedlich deutlicher Ausprägung (Abb. 4.30). Die Anordnung der Tumorzellen war solide und homogen. Ein Tumor (Nr. 33) zeigte fokal eine strangartige Anordnung der Zellen. Perivaskuläre Pseudorosetten kamen bei 2 Tumoren (Nr. 21, 27) vor. 4 Fälle (Nr. 21, 22, 27, 29) wiesen Pseudopalisaden um Nekrosen auf. Intratumoröse (Nr. 23, 26) oder periphere, glomeruloide Gefäß-proliferationen waren bei allen Oligodendrogliomen bis auf 2 (Nr. 28, 33) zu beobachten. Die teils deutlich, teils undeutlich begrenzten, ca m großen Zellen zeigten ein überwiegend schwach eosinophiles bis klares Zytoplasma. Mit einer durchschnittlichen Größe von ca m lagen die runden bis rundovalen, teilweise auch polygonalen Kerne meistens zentral bis leicht exzentrisch und wiesen einen mittel- bis hochgradigen Gehalt an homogen bis feingranulär verteiltem Chromatin auf. Nukleoli waren nur bei 92
107 Ergebnisse 2 Tumoren (Nr. 21, 25) in einzelnen Zellen zu erkennen. Die Anzahl der Mitosen und Apoptosen betrug 0 bis 1/hpf. Wenige gemistozytenähnliche Zellen fanden sich in 2 Neoplasien (Nr. 26, 29). Blutungen (<5 bis 20% des Tumors) wurden in 8 Tumoren (Nr. 21, 22, 28, 29, 30, 31, 32, 33), geringgradige Nekrosen in 8 Fällen (Nr. 21, 22, 24, 26, 27, 29, 30, 32) und Mineralisationen bei 2 Tumoren (Nr. 23, 30) festgestellt. Sechs Tumoren (Nr. 21, 22, 24, 25, 30, 33) wiesen zusätzlich in unterschiedlichem Ausmaß Pseudozysten auf. Bei 2 Tumoren (Nr. 22, 31) bestand eine geringgradige, intratumoröse Entzündung mit neutrophilen Granulozyten. Geringgradige perivaskuläre, lymphozytäre Infiltrate und eine hochgradig akute, laminare Nekrose der Großhirnrinde mit Ödem des Neuropils wurden bei dem Tumor des Tieres Nr. 30 festgestellt Anaplastische Oligodendrogliome Die charakteristische Honigwabenstruktur war sowohl bei den Hunden als auch der Katze aufgrund der erhöhten Zelldichte unterschiedlich stark ausgeprägt. Das Zellbild erschien wegen der ausgeprägteren Pleomorphie weniger homogen (Abb. 4.31). Die Anordnung der Tumorzellen war bei den kaninen Tumoren solide angeordnet, bei 3 Tumoren (Nr. 36, 39, 40) lagen einige der Zellen zusätzlich in Strängen. Ein Fall (Nr. 42) wies perivaskulär angedeutete Pseudorosetten auf und 5 Tumoren (Nr. 35, 38, 39, 40, 44) zeigten eine Pseudopalisadenbildung um Nekrosen. Die Ausbildung eines fibro-vaskulären Stromas war innerhalb dieser Tumorgruppe sehr unterschiedlich und reichte von gering- bis hochgradig. 7 der Tumoren (Nr. 35, 37, 38, 39, 40, 43, 44) zeigten eine zum Teil glomeruloide, gering- bis hochgradige Gefäßproliferation. Die ca m großen, undeutlich begrenzten Zellen hatten überwiegend eine polygonale Form und schwach eosinophiles bis klares Zytoplasma. Die ca m großen, überwiegend zentral liegenden Zellkerne variierten stark von ihrem Chromatingehalt. In 7 Neoplasien wurden in wenigen Zellen 1-2 Nukleoli gefunden. Die Mitoseanzahl lag bei 2 Tumoren (Nr. 40, 42) bei 0 bis eine Mitose/hpf, bei den anderen bei ein bis zu 6 Mitosen/hpf. Ein bis 2 Apoptosen/hpf (Nr. 36, 38, 40, 43) und Blutungen (Nr. 36, 38, 40, 44) wurden bei jeweils 4 Tumoren und Nekrosen bei 6 Tumoren (Nr. 35, 38, 39, 40, 43, 44) in unterschiedlichem Ausmaß (<5 bis 10% der Umfangsvermehrung) festgestellt. Die Tiere mit der Nr. 36 und 39 wiesen geringgradige, pseudozystische Veränderungen auf. Eine mittelgradige, periphere, lymphozy- 93
108 Ergebnisse täre Entzündung wurde in einem Fall (Nr. 38) beobachtet. Ein Tumor (Nr. 40) enthielt intratumorös geringgradig Makrophagen. Das anaplastische Oligodendrogliom der Katze zeigte solide angeordnete Tumorzellen, die teilweise in kurzen Ketten lagen. Es war ein mittel- bis hochgradiges, überwiegend vaskuläres Stroma ausgebildet. Der Tumor zeigte eine zum Teil glomeruloide, geringgradige Gefäßproliferation. Die polygonalen, m, meist undeutlich abgegrenzten Zellen hatten ein klares bis schwach-eosinophiles Zytoplasma. Die Kerne mit einem mittelgradigem Gehalt an feingranulärem Chromatin wiesen eine geringgradige Polymorphie auf und waren rund bis oval, 15 m groß und zentral gelegen Immunhistologische Befunde der oligodendroglialen Tumoren Oligodendrogliome Die CNPase-Reaktivität war innerhalb der nur Hunde betreffenden Tumorgruppe sehr heterogen. Die Anzahl positiver Tumorzellen pro Neoplasie schwankte von 0 bis 100%, während die Intensität der Färbung überwiegend mäßig war. 4 Tumoren (Nr. 21, 22, 25, 26) zeigten einen Anteil von % positiver Zellen, die restlichen lagen im Bereich von 0-30%. In 2 Neoplasien gelang der Nachweis von GFAP in 10% (Nr. 26) oder 30% (Nr. 32) der Tumorzellen. In wenigen Tumoren wurden eizelne GFAP-positive reaktive Astrozyten nachgewiesen (Abb. 4.32). Bei den markierten Zellen handelte es sich vom histologischen Bild her um neoplastischen Oligodendrozyten. Diese Zellen werden auch gliofibrilläre Oligodendrozyten genannt. Vereinzelt wurden sogenannte Minigemistozyten mit perinukleärer (kappenähnlicher) GFAP- Markierung nachgewiesen. Vimentin-positive Tumorzellen kamen in einem Prozentsatz von 5-90% vor, 3 der Tumoren (Nr. 24, 25, 31) waren komplett negativ. Bei der Mehrzahl der Fälle (Nr. 21, 22, 23, 26, 27, 28, 29) waren über die Hälfte der Tumorzellen nicht markiert. Die Intensität der Markierung war mäßig und in einem Fall (Nr. 23) waren die positiven Zellen perivaskulär akzentuiert. Bis auf einen Tumor (Nr. 29) zeigten alle Oligodendrogliome eine weniger intensive Reaktion mit S100-Protein. Bei 5 Tumoren (Nr. 27, 28, 30, 31, 33) lag der prozentuale Anteil positiver Zellen unter 50%, bei 7 über 70%. Die Neoplasien mit intratumoralen, vaskulären Proliferationen zeigten in diesen eine zytoplasmatische, mäßig bis starke Markierung mit dem von-willebrand-faktor (Abb. 4.33). Die zytoplasmatische und intranukleäre Reakti- 94
109 Ergebnisse on für Trk war von mäßig bis starker Intensität. Bei 6 (Nr. 33, 22, 23, 25, 27, 32) Tumoren waren über 70%, bei 7 Tumoren zwischen 5 und 30% der Zellen positiv. 3 Tumoren (Nr. 21, 27, 30) wiesen ein filigranes, Neurofilament-positives, interzelluläres Netzwerk auf. 90% der Tumorzellen des Tieres mit der Nr. 33 zeigten eine mäßige bis starke, zytoplasmatische Markierung mit Neurofilament. Ein filigranes, fein- bis grobgranuläres Netzwerk und ca. 10% zytoplasmatisch Synaptophysin-markierter Zellen waren bei dem Tier Nr. 21 zu sehen. Alle anderen Tumoren zeigten keine Synaptophysin-Reaktion. Eine Übersicht über die Anzahl immunreaktiver Tumorzellen in den Oligodendrogliomen ist in der Tab. 4.8 dar-gestellt. Tab. 4.8: Anzahl immunreaktiver Tumorzellen in den Oligodendrogliomen Antigen Nr. 21 Nr. 22 Nr. 23 Nr. 24 Nr. 25 Nr. 26 GFAP Vimentin (+) S100-Protein CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase (+) (+) + + (+) - - (+) Trk (+) Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Anaplastische Oligodendrogliome Die anaplastischen Oligodendrogliome der Hunde reagierten wie folgt: Bei 6 CNPase-positiven anaplastischen Oligodendrogliomen (Nr. 43, 42 34, 36, 37, 38, 39) lag der Anteil der mäßig intensiv markierten Zellen mit Ausnahme eines Falles (Nr. 43) (90%) bei 5% bis 30%. 3 der anaplastischen Oligodendrogliome zeigten eine mäßige bis starke Markierung für GFAP. In einem Fall (Nr. 34) waren ca. 50%, in einem (Nr. 40) 40% und in einem (Nr. 43) unter 5% der Tumorzellen positiv. Die GFAP-positiven Zellen eines Hundes (Nr. 34) wiesen eine deutliche perinukleäre Markierung auf (Abb. 4.34), während die GFAP-positiven Zellen des Tieres mit der Nr. 40 eher dem Nr. 27 Nr. 28 Nr. 29 Nr. 30 Nr. 31 Nr. 32 Nr
110 Ergebnisse Bild von gliofibrillären Oligodendrozyten entsprachen (Abb. 4.35). 8 der 10 Tumoren wiesen eine überwiegend mäßig intensive Vimentin-Markierung auf. 4 (Nr. 34, 40, 43, 44) davon mit einem prozentualem Anteil von über 80%, 4 (Nr. 36, 37, 39, 42) mit einem Prozentsatz unter 50%. Ebenso variabel war auch die mäßig intensive Markierung für S100-Protein. Von den 9 positiven Tumoren zeigten 8 (Nr. 43, 42, 35, 34, 36, 37, 38, 44) eine Kennzeichnung von einzelnen Zellen (Nr. 42) bis 60 %. Nur bei dem Tier Nr. 40 exprimierten bis zu 90% der Tumorzellen S100-Protein. Auch bei den weniger gut differenzierten Oligodendrogliomen wurde in den intratumorösen Gefäßen eine mäßig bis starke Markierung von Endothelzellen mit dem Antikörper für von-willebrand-faktor festgestellt. Die mäßig bis starke Markierung mit Trk reichte von % positiven Zellen. Ein Tumor (Nr. 44) wies eine mäßig intensive Neurofilament-Markierung in ca. 15% der Tumorzellen auf und ein Tumor (Nr. 39) ein mittelgradig ausgeprägtes, filigranes, intrazelluläres Netzwerk. Vereinzelt waren bei allen Tumoren CD3 positive Zellen disseminiert im Tumorgewebe zu erkennen. Das anaplastischen Oligodendrogliome der Katze (Nr. 41) zeigte eine mäßige bis starke Markierung für GFAP in 10 % der Tumorzellen positiv. Zellen mit sternförmiger Markierung (reaktive Astrozyten) wurden auch beobachtet (Abb. 4.36). Der Tumor wies keine Vimentin-Markierung auf. Eine mäßig intensive Markierung für S100- Protein war in einzelnen Zellen zu erkennen. In den intratumorösen Gefäßen wurde eine mäßig bis starke Markierung von Endothelzellen mit dem Antikörper für von- Willebrand-Faktor festgestellt. Die mäßig bis starke Markierung mit Trk lag bei ca. 10% der Tumorzellen. Vereinzelt waren CD3 positive Zellen disseminiert im Tumorgewebe zu erkennen. Die Tab. 4.9 beinhaltet eine Übersicht über die Anzahl immunreaktiver Tumorzellen in den anaplastischen Oligodendrogliomen. 96
111 Tab. 4.9: Anzahl immunreaktiver Tumorzellen in den anaplastischen Oligodendrogliomen Ergebnisse Antigen Nr. 34 Nr. 35 Nr. 36 Nr. 37 Nr. 38 Nr. 39 Nr. 40 Nr. 41 Nr. 42 Nr. 43 Nr. 44 GFAP (+) - (+) - Vimentin S100-Protein (+) (+) + ++ CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase (+) + (+) Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katze Topographie sowie histologische und immunhistologische Befunde bei dem oligoastrozytären Tumor Von den insgesamt 117 ZNS-Tumoren wurde 1 Tumor (0,85%) als oligoastrozytäre Neoplasie klassifiziert. Bei dem Hund (Nr. 45) handelte es sich um einen 4 Jahre alten, männlich kastrierten Briard Topographische Befunde des oligoastrozytären Tumors Das unscharf begrenzte Oligoastrozytom zeigte eine intrakraniale, intraaxiale, rostrotentoriale und multifokale Ausbreitung mit infiltrativem Wachstum. Der Tumor hatte keine Kapsel und wies eine noduläre Wachstumsform auf Histologische Befunde des oligoastrozytären Tumors Dieser Tumor wies typische Areale eines Oligodendroglioms und eines eher fibrillären Astrozytoms auf. Die Tumorzellen waren solide angeordnet, vereinzelt jedoch auch in kleinen Strängen. Es war geringgradig fibro-vaskuläres Stroma und eine kollagenfaserarme Bindegewebsproliferation zu erkennen. Im oligodendroglialen Anteil zeigten die rundovalen bis polygonalen Zellen mit teils deutlichen, teils undeutlichen Zellgrenzen eine geringgradige Polymorphie und waren ca. 25 m groß. Die typische 97
112 Ergebnisse Honigwabenstruktur war deutlich zu erkennen. Das Zytoplasma war klar oder hatte eine schwach eosinophile Färbung. Der ca. 15 m große, zentral gelegene, runde bis rundovale Kern besaß einen mittelgradigen Gehalt an homogen verteiltem Chromatin. Im astrozytären Anteil hatten die ca. 30 m großen Zellen eine eher spindelförmige bis rundovale Gestalt und waren mit ihrem schwach eosinophilem Zytoplasma nur schwer abgrenzbar. Die ca. 15 m großen, zentral bis leicht exzentrisch lokalisierten Zellkerne waren sehr chromatinreich. Eine dritte sternförmige, ca. 40 m große, reaktiven Astrozyten ähnliche Zellpopulation mit deutlichen Zellgrenzen und eosinophilem Zytoplasma lag zwischen den astrozytären Zellen verteilt. Die rundovalen, ca. 20 m großen, leicht exzentrisch lokalisierten Zellkerne wiesen wenig grobgranuläres Chromatin auf. Selten wurde in den Zellkernen 1 Nukleolus beobachtet. Mitosen, Apoptosen und Nekrosen wurden in keiner Zellpopulation nachgewiesen Immunhistologische Befunde des oligoastrozytären Tumors In der Stanze waren ca. 90% der Tumorzellen stark positiv für GFAP (Tab ). Eine Vimentin-Markierung wurde nicht beobachtet. Eine mäßig intensive Reaktion war mit CNPase in 30% und mit Trk in 10% der Tumorzellen zu beschreiben. Die Stanzen enthielten einen vorwiegend astrozytären Tumorbereich. Tab. 4.10: Anzahl immunreaktiver Tumorzellen in dem oligoastrozytären Tumor Antigen Nr.45 GFAP ++ Vimentin - S100-Protein - CD3 - CD79 n.a. von-w.-faktor - Synaptophysin - LP34 - AE1/AE3 - CEA - -Fetoprotein - NSE - Neurofilament - CNPase + Trk + Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar. 98
113 Ergebnisse Topographie sowie histologische und immunhistologische Befunde bei den ependymalen Tumoren Von den insgesamt 117 untersuchten ZNS-Tumoren wurden 9 (7,7%) als ependymale Neoplasien eingeteilt (siehe Tab. 4.11). Es waren 7 Hunde und 2 Katzen betroffen. Bei den Hunden handelte es sich um 4 (57,1%) Ependymome. Eines davon konnte in Anlehnung an die Humanmedizin als papilläres und eines als klarzelliges Ependymom ( clear cell ependymoma ) klassifiziert werden. 3 (42,9%) wurden als anaplastisches Ependymom diagnostiziert. Bei den Katzen wies ein Tier ein Ependymom und das Zweite ein anaplastisches Ependymom auf. Tab. 4.11: Hunde und Katzen mit ependymalen Tumoren Nr. ID UNI Diagnose Art Rasse Alter M/W 46 A117 H Ependymom Hund Bordeaux Dogge 5 J w 47 A57 H Ependymom Hund Yorkshire Terrier 7 J. mk 48 A25 H Ependymom Katze EKH 10 M m 49 A172 O Papilläres Ependymom Hund Boxer 6 J. wk 50 A136 G Clear cell Ependymom Hund Boxer 10 J w 51 A28 H Anapl.Ependymom Katze o. A. 6 M w 52 A144 G Anapl. Ependymom Hund DSH 11 J m 53 A148 G Anapl. Ependymom Hund DSH 8 J m 54 A18 H Anapl. Ependymom Hund Boxer 6 J w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, DSH: Deutscher Schäferhund, EKH: Europäisch Kurzhaar, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der ependymalen Tumoren Ependymome Alle 4 solitären Ependymome der Hunde zeigten ein intrakraniales, noduläres Wachstum. 3 Tumoren (Nr. 46, 49, 50) waren intraaxial und einer (Nr. 47) intraventrikulär (Lateralventrikel) lokalisiert. Alle Ependymome (Tier Nr 46, 47, 49, 50) lagen rostrotentorial. Die intraaxial lokalisierten Tumoren zeigten eine parenchymatöse Lokalisation. Ein unscharf demarkiertes, fokal infiltratives und nicht abgekapseltes Wachstum wurde bei 3 Tumoren (Nr. 46, 49, 50) festgestellt. Die Tumorgrenzen eines Falles (Nr. 47) waren scharf. Der als klarzelliges Ependymom diagnostizierte Fall (Nr. 50) wies zu der geringgradigen, perivaskulären, lymphozytären Entzündung und mittel- bis hochgradigen leptomeningealen Entzündung mit neutrophilen Granulozyten auch eine akute, laminare Nekrose der Großhirnrinde mit Ödem des Neuropils auf. 99
114 Ergebnisse Das Ependymom der Katze (Nr. 48) wies eine intrakraniale, kaudotentoriale, teils intraaxiale und teils leptomeningeale Ausbreitung auf. Es wurde ein fokales, unscharf demarkiertes, infiltratives und nicht abgekapseltes Wachstum festgestellt Anaplastische Ependymome Die nodulär wachsenden, anaplastischen, kaninen Ependymome waren intrakranial, intraventrikulär und rostrotentorial lokalisiert. Ein Tumor (Nr. 52) trat solitär und einer (Nr. 54) multifokal auf. Einer (Nr. 53) lag zusätzlich leptomeningeal. Die Tumoren wiesen umschriebene Tumorgrenzen auf und hatten keine Kapsel. Das Tier mit der Nr. 53 zeigte eine fokale Invasion in das umliegende Gewebe. Das anaplastische Ependymom der Katze (Nr. 51) zeigte ein intraventrikuläres (4. Ventrikel), kaudotentoriales und solitäres Wachstum mit einer fokalen Invasion in das umliegende Gewebe Histologische Befunde der ependymalen Tumoren Ependymome Die Anordnung der Tumorzellen bei den Ependymomen der Hunde war überwiegend solide. Einer der Tumoren (Nr. 46) wuchs eher in Strängen. Das als klarzellige Variante (Nr. 50) diagnostizierte Ependymom war durch Stroma in Nester getrennt und zeigte zusätzlich strangartiges Wachstum. Bei dem Tier Nr. 49 wurden neben den solide angeordneten Zellen, Areale mit zylindrischen Zellen auf einem fibrovaskulären Grundstock beobachtet. Bei allen Neoplasien, mit Ausnahme von einem Tumor (Nr. 46), waren Pseudorosetten und bei einem Tumor (Nr. 50) echte Rosetten zu sehen. Ein fibro-vaskuläres Stroma war in der Mehrzahl der Fälle gering- bis mittelgradig ausgebildet. Eine der Neoplasien (Nr. 47) zeigte eine mittelgradige, kollagenfaserarme Bindegewebsproliferation und bei 3 Umfangsvermehrungen (Nr. 46, 47, 50) wurde eine gering- bis hochgradige, teils glomeruloide Gefäßproliferation beobachtet. Die runden bis rundovalen, teils polygonalen, gut begegrenzten Zellen hatten eine Größe von ca m und ein schwach eosinophiles bis klares oder milchiges Zytoplasma. Ein Tumor (Nr. 50) zeigte ein der oligodendroglialen Honigwabenstruktur ähnliches Muster (Abb. 4.37). Die rosettenbildenden Zellen hatten eine elongierte Gestalt. Ein gering- bis mittelgradiger Gehalt an Chromatin war bei den zentral bis leicht exzentrisch gelagerten, ca m großen Kernen zu erkennen. 100
115 Ergebnisse Nur vereinzelt war bei einem Tumor (Nr. 47) 1 Nukleolus pro Kern festzustellen. Die Anzahl der Mitosefiguren lag bei 0 bis 1 /hpf. 2 Tumoren (Nr. 47, 50) wiesen Apoptosen (<1/hpf) auf. Bei dem Tier Nr. 50 wurden fokal bis zu 8 Apoptosen/hpf beobachtet. Geringgradige Blutungen wurden bei 2 (Nr. 46, 47) und gering- bis mittelgradige Nekrosen in 3 Fällen (Nr. 46, 47, 50) diagnostiziert. In einem Fall (Nr. 46) wurden multifokal Mineralisationen und einzelne Zysten beobachtet. Neben dem mittelgradigen Gehalt an Zysten und interzellulärem Plasma traten bei dem als klarzelliges E- pendymom diagnostizierten Fall (Nr. 50) eine geringgradige, perivaskuläre, lymphozytäre Entzündung und mittel- bis hochgradige, leptomeningeale, granulozytäre Entzündung auch eine akute, laminare Nekrose der Großhirnrinde mit Ödem des Neuropils auf. Die Tumorzellen des Ependymoms der Katze waren solide und teilweise strangartig angeordnet. Es wurden sowohl echte Rosetten, als auch Pseudorosetten beobachtet. Bei den Katzen waren die Rosetten und Pseudorosetten wesentlich häufiger und deutlicher ausgeprägt (Abb. 4.38) als bei den Hunden (Abb. 4.39). Die rosettenbildenden Zellen hatten eine elongierte Gestalt. Die dazwischen liegenden Zellen wiesen die gleiche Morphologie auf wie die der Hunde. Partiell wurden bei der Katze bis zu 4 Mitosen/hpf gefunden Anaplastische Ependymome Die 3 kaninen, anaplastischen Ependymome zeigten eine solide Wachstumsform der Tumorzellen. Bei 2 Tumoren (Nr. 52, 53) waren perivaskuläre Pseudorosetten (Abb. 4.40) und bei einem (Nr. 54) beide Rosettenformen (Pseudorosetten und echte Rosetten) nachweisbar. Die Neoplasien beinhalteten ein gering- bis mittelgradig fibrovaskuläres Stroma. Die Form der ca m großen Tumorzellen war bei den Tieren Nr. 54 und 53 polygonal bis rundoval und bei dem Tier Nr. 52 eher als polymorph zu beschreiben. Die gut begrenzten (eher undeutlich beim Tier Nr. 53) Zellen hatten ein eosinophiles Zytoplasma. Der runde bis rundovale oder polygonale Zellkern war ca m groß, lag in einem Tumor (Nr. 52) exzentrisch, sonst zentral und besaß mittel- bis hochgradig, grobgranuläres bis kompaktes Chromatin. Die Anzahl an Mitosen und Apoptosen lag bei 1-2/hpf. Ein Tumor (Nr. 54) wies mono- und binukleäre Zellen auf. Das anaplastische Ependymom der Katze wies eine solide Anordnung der Tumorzel- 101
116 Ergebnisse len auf. Es waren beide Rosettenformen vorhanden. Die m großen, polygonalen bis rundovalen Tumorzellen mit deutlichen Zellgrenzen hatten ein eosinophiles Zytoplasma. Sie besaßen einen rundovalen, ca m großen, exzentrisch gelegenen Kern mit einem mittelgradigen Gehalt an feingranulär verteiltem Chromatin. Es waren ca. 4 Mitosefiguren und 1-3 Apoptosen /hpf zu erkennen Immunhistologische Befunde der ependymalen Tumoren Ependymome Die Tumorzellen der kaninen Ependymome waren überwiegend GFAP-negativ, während bei dem Tier Nr. 47 einzelne mäßig bis stark markierte Zellen gefunden wurden. Bei der Mehrzahl der Tumoren (Nr. 46, 47) wurden perivaskulär fein gezeichnete, astrozytenähnliche positive Zellen beobachtet (Abb. 4.41). Die Tiere mit der Nr. 49 und 50 zeigten keine Kennzeichnung, während beim klarzelligen Ependymom (Nr. 50) interzellulär liegendes Plasma markiert war. Die überwiegend mäßig intensive Markierung für Vimentin war bei allen Tumoren in über 50% der Tumorzellen nachweisbar. S100-Protein war mit mäßig brauner Kennzeichnung in 2 Tumoren (Nr. 49, 50) nachweisbar. Beim papillären (Nr. 49) und beim klarzelligen Ependymom (Nr. 50) lag der Prozentsatz bei 60%. Drei Tumoren (Nr. 46, 49, 50) zeigten eine geringgradige Reaktion mit CNPase. Hierbei waren vorwiegend astrozytär-aussehende Zellen positiv markiert. In allen Tumoren wiesen bis zu 80% der Zellen eine mäßig intensive Markierung für Trk auf. Perinekrotisch war bei einem Fall (Nr. 47) ein großer Anteil der Zellen mittelgradig positiv für NSE. Ebenso zeigten 2 Fälle (Nr. 50 und 49) hierfür eine geringgradige Markierung. CD3-positive, lymphozytäre Zellen wurden in geringer Anzahl in den Tumoren beobachtet. Die Neoplasie der Katze (Nr. 48) zeigte eine deutliche GFAP-Markierung sowohl in den Rosetten, als auch in den perivaskulären Pseudorosetten. Die überwiegend mäßig intensive Markierung für Vimentin war in über 50% der Tumorzellen nachweisbar. S100-Protein war mit mäßig brauner Kennzeichnung in lediglich 5% der Zellen festzustellen. Der Tumor wies in 80% der Zellen eine mäßig intensive Markierung für Trk auf. Eine Übersicht der immunhistologischen Ergebnisse ist der Tab zu entnehmen. 102
117 Ergebnisse Tab. 4.12: Anzahl immunreaktiver Tumorzellen in den ependymalen Tumoren Antigen Nr. 46 Nr. 47 Nr. 48 Nr. 49 Nr. 50 GFAP (+) (+) Vimentin S100-Protein - - (+) CD CD79 n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE (+) Neurofilament CNPase (+) + Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, +: 10-50% der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katze Anaplastische Ependymome Bei den kaninen anaplastischen Ependymomen waren nur wenige Zellen GFAPpositiv. Alle Tumoren zeigten in mindestens 50% der Tumorzellen eine mittelgradige positive Reaktion für Vimentin. Eine CNPase-Markierung wurde nicht beobachtet. Ein Tumor (Nr. 52) zeigte eine mäßig intensive S100-Protein-Expression in 30% der Tumorzellen. Von dem Tumor des Tieres Nr. 54 reagierten 90% der Zellen mit den Antikörpern für Trk und NSE % der Zellen des Tieres Nr. 53 reagierten mit mäßiger Intensität mit Trk. CD3-positive, lymphozytäre Zellen waren in geringer Anzahl in den Tumoren nachweisbar. Der feline Tumor (Nr. 51) zeigte, im Gegensatz zu den kaninen, eine stärkere GFAP- Expression (Abb. 4.42). Es war eine mittelgradige positive Reaktion für Vimentin in 80% der Tumorzellen nachweisbar (Abb. 4.43) % der Zellen reagierten mit mäßiger Intensität mit Trk. Tab stellt eine Zusammenfassung der immunhistologischen Ergebnisse der anaplastischen Ependymome dar. 103
118 Ergebnisse Tab. 4.13: Anzahl immunreaktiver Tumorzellen in den anaplastischen Ependymomen Antigen Nr. 51 Nr. 52 Nr. 53 Nr. 54 GFAP + (+) (+) (+) Vimentin S100-Protein CD CD79 n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katze Topographie sowie histologische und immunhistologische Befunde bei den Choroid-Plexustumoren 15 (12,8%) der 117 ZNS-Tumoren wurden als Neoplasien des Plexus choroideus eingeteilt (siehe Tab. 4.14). Von diesen stellten 13 (86,7%) Choroid-Plexuspapillome (CPP) und 2 (13,3%) Choroid-Plexuskarzinome (CPK) dar. Es waren nur Hunde betroffen. 104
119 Ergebnisse Tab. 4.14: Hunde mit Plexustumoren Nr. ID UNI Diagnose Art Rasse Alter M/W 55 A21 H Plexuspapillom Hund Boxer 5 J w 56 A22 H Plexuspapillom Hund SH 5 J m 57 A41 H Plexuspapillom Hund Collie 5 J m 58 A52 H Plexuspapillom Hund Stafford Terrier 3 J w 59 A79 H Plexuspapillom Hund Afghane 6 J mk 60 A94 H Plexuspapillom Hund Schnauzer 4 J m 61 A130 H Plexuspapillom Hund Mix 9 J wk 62 A145 G Plexuspapillom Hund DSH 5 J m 63 A150 G Plexuspapillom Hund Pyrenäenberghund 7 J m 64 A152 G Plexuspapillom Hund DSH 3 J w 65 A189 O Plexuspapillom Hund Golden Retriever 5,5 J m 66 A191 O Plexuspapillom Hund Chow-Chow 5 J m 67 A170 O Plexuspapillom Hund Sheltie 9 J mk 68 A54 H Plexuskarzinom Hund Mix 5 J m 69 A89 H Plexuskarzinom Hund Mix o. A. w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, DSH: Deutscher Schäferhund, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der Choroid-Plexustumoren Choroid-Plexuspapillome (CPP) Alle 13 Plexuspapillome wuchsen papillär, intrakranial, intraventrikulär und solitär. 8 der Tumoren (Nr. 55, 59, 60, 61, 62, 64, 65, 66) waren rostrotentorial und 5 (Nr. 56, 57, 58, 63, 67) kaudotentorial lokalisiert. 5 der Tumoren wuchsen im 3. Ventrikel (Nr. 55, 59, 61, 62, 66), 3 im Seitenventrikel (Nr. 60, 64, 65) und 5 im 4. Ventrikel (Nr. 56, 57, 58, 63, 67). Die Tumoren waren nicht abgekapselt, jedoch gegenüber dem umliegenden Gewebe gut abgegrenzt. Eine fokale, minimale Infiltration in das angrenzende Gewebe zeigten 5 Neoplasien (Nr. 55, 58, 61, 62, 63) Choroid-Plexuskarzinome (CPK) Von den beiden nicht abgekapselten Plexuskarzinomen war ein Tumor (Nr. 68) intrakranial und einer (Nr. 69) intraspinal lokalisiert. Der Tumor des Tieres Nr. 68 zeigte ein intraventrikuläres (4. Ventrikel), kaudotentoriales, teils leptomeningeales, teils parenchymatöses Wachstum. Der Tumor des Tieres Nr. 69 zeigte ein multifokales Vorkommen und war extraaxial, leptomeningeal, intradural und extramedullär lokalisiert. Beide wuchsen infiltrativ in das umliegende Gewebe ein. Ein Fall (Nr. 68) wies intratumorös eine geringgradige, lymphozytäre Entzündung auf, ein Tumor (Nr. 69) zeigte peripher eine lymphozytäre Entzündung mit Beteiligung einzelner 105
120 Ergebnisse Makrophagen Histologische Befunde der Choroid-Plexustumoren Choroid-Plexuspapillome (CPP) Alle 13 Plexuspapillome zeigten ein einreihiges, papilläres Wachstum mit Papillenbildung auf einem fibro-vaskulärem Grundstock (Abb und Abb. 4.45). Es war ein gering- bis mittelgradig ausgebildetes Stroma zu erkennen. Eine geringgradige, kollagenfaserarme Bindegewebsproliferation war bei dem Tier Nr. 60 und eine geringgradige Gefäßproliferation in der Peripherie des Tumors bei dem Tier Nr. 58 zu beobachten. Die ca m großen, teils deutlich, teils undeutlich begrenzten, kubischen bis hochprismatischen Tumorzellen hatten vorwiegend ein eosinophiles Zytoplasma. Die zentral bis apikal bzw. basal lokalisierten, ca m großen, runden bis rundovalen Zellkerne wiesen mittel- bis hochgradig, homogenes bis kompakt verteiltes Chromatin auf. Bei 2 Tumoren (Nr. 60, 61) war selten ein Nukleolus pro Zelle zu sehen, bei 3 Neoplasien (Nr. 56, 60, 66) wurden 0-1 Mitose/hpf gefunden. Geringgradige Blutungen waren in 4 Fällen (Nr. 58, 59, 60, 62), bis zu 5% der Tumorfläche einnehmende Nekrosen in 5 (Nr. 57, 58, 63, 64, 65) zu erkennen. Multifokale Mineralisationen wurden bei 4 Tumoren (Nr. 56, 58, 65, 67) festgestellt. Die Mineralisation im Tumor des Tieres Nr. 65 war plaqueartig und im Tier Nr. 67 in Form von Psammomkörperchen nachweisbar. In 2 Tumoren (Nr. 57, 59) wurden wenige Zysten festgestellt. Bei einem Tumor (Nr. 58) waren an mehreren Lokalisationen Cholesterinausfällungen sichtbar. Bei 4 Fällen (Nr. 55, 63, 65, 66) wurde eine geringbis mittelgradige periphere, lymphozytäre Entzündung festgestellt. 5 Fälle (Nr. 56, 58, 61, 62, 67) zeigten eine geringgradige, intratumoröse, Entzündung mit Beteiligung von Lymphozyten, neutrophile Granulozyten und teilweise Makrophagen Choroid-Plexuskarzinome (CPK) Die Plexuskarzinome erschienen zellreicher als die Plexuspapillome. Beide Karzinome zeigten ein papilläres Wachstum mit Bildung von Papillen auf einem fibrovaskulären Grundstock. Der Tumor des Tieres Nr. 68 wies teilweise ein mehrreihiges Wachstum auf (Abb und Abb. 4.47). Während ein Tumor (Nr. 68) ein geringgradiges, fibro-vaskuläres Stroma hatte, zeigte die Neoplasie des Tieres Nr. 69 eine mittel- bis hochgradige Bindegewebsproliferation. Die undeutlich begrenzten, 106
121 Ergebnisse ca m großen Zellen waren kubisch bis hochprismatisch und hatten eosinophiles Zytoplasma. Die Gestalt der Zellkerne war rund bis -oval. Bei dem Tier Nr. 69 war eine geringgradige Anisokaryose zu erkennen. Die ca m großen Zellen lagen zentral bis basal und zeigten einen gering- bis mittelgradigen Gehalt an homogenem, feingranulären Chromatin. Es war eine Mitosefigur/hpf nachweisbar. Bei dem Tier Nr. 69 wurden in wenigen Zellen ein Nukleolus und wenige Mineralisationen beobachtet. Im einem Fall (Nr. 69) war die Rückenmarksmetastase des primären Tumors gestanzt worden. Bei dem Tumor des Tieres Nr. 68 war über den Liquorraum eine Streuung an verschiedene Lokalisationen des Gehirns erfolgt Immunhistologische Befunde der Choroid-Plexustumoren Choroid-Plexuspapillome Alle 13 Plexuspapillome zeigten eine mäßig bis starke Markierung der Tumorzellen mit Vimentin. In 6 Fällen (Nr. 55, 56, 57, 59, 65, 66) lag der prozentuale Anteil positiver Zellen unter 40%, bei den restlichen 7 Tumoren waren über 75% der Tumorzellen positiv. 4 der CPP s (Nr. 60, 62, 63, 64) zeigten eine mäßig intensive GFAP- Expression unter 30%. Das Tier Nr. 62 wies jedoch 75% GFAP-positive Zellen auf. Ca. 5% der Zellen bei dem Tier Nr. 63 waren mäßig für S100-Protein gefärbt. 5 der Tumoren (Nr. 55, 59, 61, 63, 65) zeigten eine Markierung mit dem Zytokeratin- Antikörper AE1/AE3. Die zytoplasmatische, mäßig intensive Markierung war bei 3 Fällen (Nr. 59, 61, 63) in ca. 10% der Zellen zu erkennen, bei 2 Tumoren (Nr. 55, 65) war ca. die Hälfte der Tumorzellen markiert (Abb. 4.48). Eine relativ hohe Anzahl mäßig intensiver, Trk-markierter Zellen wurde bei allen Tumoren beobachtet. Eine Ausnahme bildete das Tier Nr. 63 mit nur 10% positiven Zellen. Eine positive Reaktion für NSE in unter 40% der Tumorzellen zeigten 3 CPP s (Nr. 58, 63, 64). Die Mehrzahl der Tumoren wiesen vereinzelt lymphozytenähnliche, CD3-positive Zellen auf. Die immunhistologischen Ergebnisse sind der Tab zu entnehmen. 107
122 Ergebnisse Tab. 4.15: Anzahl immunreaktiver Tumorzellen in den Plexuspapillomen Antigen Nr. 55 Nr. 56 Nr. 57 Nr. 58 Nr. 59 GFAP (+) Vimentin S100-Protein (+) CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE (+) CEA Fetoprotein NSE (+) NF CNPase (+) - Trk Nr. 60 Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, NF: Neurofilament, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Choroid-Plexuskarzinome Die beiden Plexuskarzinome zeigten eine annähernd 100%ige mäßig bis starke Markierung für Vimentin und Trk (Abb. 4.49). Der Tumor des Tieres Nr. 69 wies zusätzlich eine mäßig intensive CNPase-Markierung in ca. 50% der Tumorzellen auf. Eine Neurofilament-Reaktion wurde in beiden Tumoren festgestellt. Diese lag bei 5% (Nr. 69) und 30% (Nr. 68) der Tumorzellen und war von mäßiger Intensität. Eine starke Markierung für CD3 wurde in einzelnen, lymphozytäre Zellen beobachtet. Eine Übersicht der immunhistologischen Ergebnisse gibt Tab Tab. 4.16: Anzahl immunreaktiver Zellen in den Plexuskarzinomen Nr. 61 Nr. 62 Antigen Nr. 68 Nr. 69 GFAP - - Vimentin S100-Protein - - CD3 - - CD79 n.a. n.a. von-w.-faktor - - Synaptophysin - - LP AE1/AE3 - - CEA - - -Fetoprotein - - Nr. 63 Nr. 64 Nr. 65 Nr. 66 Nr
123 Ergebnisse Fortsetzung Tab Antigen Nr. 68 Nr. 69 NSE - - Neurofilament (+) + CNPase - ++ Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei den Medulloblastomen Von den insgesamt 117 untersuchten Neoplasien des ZNS wurden 3 Fälle (2,6%) als Medulloblastom klassifiziert (siehe Tab. 4.17). Es waren nur Hunde betroffen. Tab. 4.17: Hunde mit Medulloblastomen Nr. ID UNI Diagnose Art Rasse Alter G 70 A116 H Medulloblastom Hund Rhodesian Ridgeback 2,5 J m 71 A171 O Medulloblastom Hund Pointer Adult m 72 A77 H Medulloblastom Hund Rottweiler 13 M w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topagraphische Befunde der Medulloblastome Die 3 gut begrenzten, nicht abgekapselten Medulloblastome wuchsen intrakranial, kaudotentorial und solitär. Die Tumoren lagen intraaxial. Einer der Tumoren (Nr. 72) zeigte ein flächenhaft infiltratives, einer ein fokal infiltratives Wachstum (Nr. 70), während der dritte (Nr. 71) keine Infiltration des umliegenden Gewebes aufwies. Die Tumorform war nodulär Histologische Befunde der Medulloblastome Das Gesamtbild der Neoplasien wies eine gefäßassoziierte Anordnung der Tumorzellen auf (Abb. 4.50). Die 3 Tumoren erschienen sehr zellreich, während der Tumor des Tieres Nr. 70 ein eher nesterartiges Zellbild mit kurzen Zellketten, Rosetten und Pseudorosetten zeigte (Abb. 4.51), war die Anordnung der Zellen in den Umfangsvermehrungen der Tiere Nr. 71 und 72 solide und lagen teilweise in kurzen Ketten. Ein Tumor (Nr. 72) wies zusätzlich fischzugartige Tumorabschnitte auf. Alle Tumoren zeigten ein gering- bis mittelgradiges, fibro-vaskuläres Bindegewebe. Zusätzlich war 109
124 Ergebnisse eine geringgradige Gefäßproliferation bei einem Tumor (Nr. 72) zu sehen. Im Tumor des Tieres Nr. 70 bestand fokal, geringgradig eine glomeruloide Gefäßproliferation. Die ca m großen, undeutlich begrenzten Zellen hatten ein eosinophiles bis klares Zytoplasma. In einem Fall (Nr. 72) war aufgrund der sehr undeutlichen Zellgrenzen keine Beurteilung der Zellform möglich. Runde bis -ovale, ca m große Zellkerne bestimmten bei 2 Tumoren (Nr. 70 und 71) das Zellbild. Die Kerne eines Tumors (Nr. 72) waren eher längsoval. Eine zentrale bis leicht exzentrische (Nr. 71) Lage war zu erkennen. Der Gehalt an Chromatin reichte von mittel- bis hochgradig und war homogen bis grobschollig verteilt. Bei dem Tier Nr. 71 wurde vereinzelt ein Nukleolus pro Kern beobachtet. Die Anzahl der Mitosen reichte von 1-2 bis zu 4-5/hpf. Auch war mindestens eine Apoptose/hpf sichtbar. Bei der Neoplasie des Tieres Nr. 72 lagen wenige gemistozytäre Zellen zwischen den Tumorzellen. Zudem waren geringgradig Blutungen und Nekrosen zu erkennen. Geringgradige Nekrosen lagen in dem Tumor des Tieres Nr. 71 vor Immunhistologische Befunde der Medulloblastome Die 3 Medulloblastome zeigten eine mäßig intensive Markierung für Vimentin. Die Anzahl der positiven Zellen variierte in den Tumoren von 20% (Nr. 70) bis 80% (Nr. 71, 72). 2 Fälle (Nr. 70, 72) waren zu 5 und 20 % positiv für GFAP, auch hier war die Reaktion von mäßiger Intensität. Zwei Tumoren reagierten mäßig intensiv in 20% (Nr. 70) und 50% (Nr. 72) der Zellen für S100-Protein. Die Trk-Kennzeichnung war in allen Tumoren über 80%. Der Tumor des Tieres Nr. 71 wies in 50%, der des Tieres Nr. 72 in 30% und das Tier Nr. 70 in einzelnen Tumorzellen eine Reaktion mit Synaptophysin auf (Abb. 4.52). Im einem Fall (Nr. 72) wurde in 10% der Zellen eine NSE-Markierung nachgewiesen. Die immunhistologischen Ergebnisse sind der Tab zu entnehmen. Tab. 4.18: Anzahl immunreaktiver Tumorzellen in den Medulloblastomen Antigen Nr. 70 Nr. 71 Nr. 72 GFAP (+) - + Vimentin S100-Protein CD CD79 n.a. n.a. n.a. 110
125 Ergebnisse Fortsetzung Tab Antigen Nr. 70 Nr. 71 Nr. 72 von-w.-faktor Synaptophysin (+) + + LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei dem thorako-lumbalen, spinalen Tumor junger Hunde (intraspinales Nephroblastom) Der weibliche Siberian Husky mit dem intraspinalen Nephroblastom war 1 Jahr alt Topographische Befunde des intraspinalen Nephroblastoms Das Nephroblastom war thorako-lumbal im Rückenmark lokalisiert und zeigte ein durales, leptomeningeales, parenchymatöses, intradurales und solitäres Wachstum. Der umschriebene, aber nicht abgekapselte, noduläre Tumor wuchs geringgradig in das umliegende Gewebe Histologische Befunde des intraspinalen Nephroblastoms Die Anordnung der Tumorzellen war nesterartig, rosettenähnlich, oder aber tubulär bis azinös (Abb. 4.53). Der Tumor beinhaltete ein geringgradig fibro-vaskuläres Stroma. Es waren 2 verschiedene Zelltypen nachweisbar: Erstens wurden hochprismatische, ca. 30 m große, deutlich begrenzte Zellen mit eosinophilem Zytoplasma. Sie besaßen einen rund- bis längsovalen, ca. 20 m großen, zentral gelagerten Kern mit mittel- bis hochgradig, grobgranulär verteiltem Chromatin. Es wurden bis zu 2 Mitosen/hpf beobachtet. Die zweite Zellpopulation waren kuboidale, die azinösen Strukturen bildende, ca. 25 m großen Zellen mit teils deutlichen, teils undeutlichen Zellgrenzen und eosinophilem Zytoplasma. Die Kerne erschienen rund, waren zentral gelagert, ca m groß und zeigten einen mittelgradigen, feingranulären Chromatingehalt. Zwischen diesen Zellen lagen vereinzelt spindelförmige Zellen mit 111
126 Ergebnisse einem längsovalen bis spindelförmigen Kern Immunhistologische Befunde des intraspinalen Nephroblastoms Eine mäßig bis stark intensive, zytoplasmatische Markierung der vorwiegend azinöstubulären Strukturen wurde mit den Antikörpern AE1/AE3 (Abb. 4.54) und LP34 nachgewiesen. Die rosettenähnlichen Strukturen waren negativ. 90% der Tumorzellen zeigten eine mäßig intensive Markierung mit Trk. Die spindelförmigen Zellen des Tumors zeigten eine mäßig intensive, zytoplasmatische Markierung mit Vimentin. Es wurden einzelne, lymphozytäre CD3-positive Zellen beobachtet. Eine Übersicht der immunhistologischen Ergebnisse des intraspinalen Nephroblastoms ist der Tab zu entnehmen. Tab. 4.19: Anzahl immunreaktiver Tumorzellen in dem intraspinalen Nephroblastom Antigen Nr. 73 GFAP - Vimentin + S100-Protein - CD3 - CD79 n.a. von-w.-faktor - Synaptophysin - LP34 + AE1/AE3 ++ CEA - -Fetoprotein - NSE - Neurofilament - CNPase - Trk ++ Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei den Meningeomen Von den insgesamt 117 untersuchten Tumoren wurden 28 (23,9%) als Meningeom klassifiziert werden (siehe Tab. 4.20). Aufgrund von Malignitätseigenschaften (erhöhte Zelldichte und Mitoserate) wurde ein Tumor als anaplastisches Meningeom eingeteilt. Die anderen Tumoren verteilten sich auf die verschiedenen histologischen Varianten. Bei den Hunden wurden 5 menigotheliomathöse, 2 transitionelle, 2 psammo- 112
127 Ergebnisse matöse, 2 fibröse, ein angiomatöses, ein myxoides, ein teils transitionelles, teils granularzelliges und ein rhabdoides Meningeom sowie bei den Katzen 9 transitionelle, 2 psammomatöse und ein fibröses Meningeom diagnostiziert. Tab. 4.20: Hunde und Katzen mit Meningeomen Nr. ID UNI Diagnose Art Rasse Alter M/W 74 A85 H Meningotheliomatös M. Hund Golden Retriever 8 J w 75 A119 H Meningotheliomatös M. Hund DSH 8 J m 76 A158 G Meningotheliomatös M. Hund Mix 6 J w 77 A187 O Meningotheliomatös M. Hund Mix 11 J wk 78 A200 H Meningotheliomatös M. Hund DSH 10 J m 79 A198 H Fibromatös M. Hund Mix 12,5 J m 80 A156 G Fibromatös M. Hund DSH 6 J m 81 A133 H Fibromatös M. Katze o. A. o. A. o. A. 82 A27 H Transitionelles M. Hund Westhighland Terrier 6 J w 83 A153 G Transitionelles M. Hund Cocker 12 J w 84 A199 H Transitionelles M. Katze EKH 14,8 J wk 85 A92 H Transitionelles M. Katze EKH 11 J wk 86 A91 H Transitionelles M. Katze EKH 10 J mk 87 A81 H Transitionelles M. Katze EKH 13 J mk 88 A80 H Transitionelles M. Katze o. A. 16 J mk 89 A75 H Transitionelles M. Katze EKH 8 J wk 90 A43 H Transitionelles M. Katze EKH 8 J w 91 A37 H Transitionelles M. Katze o. A. 17 J mk 92 A29 H Transitionelles M. Katze o. A. 5 J wk 100 A147 G Transitionelles M. Hund Teckel adult m 93 A33 H Transitionell/Granularzellig M. Hund Boxer 6 J m 94 A93 H Psammomatös M. Hund Deutsch Langhaar 10 J w 95 A111 H Psammomatös M. Hund DSH 7 J m 96 A110 H Psammomatös M. Katze o. A. 16 J mk 97 A65 H Psammomatös M. Katze EKH o. A. w 98 A114 H Angiomatös M. Hund Rhodesian Ridgeback 5 J w 99 A186 O Myxoid M. Hund Mix 5 J w 101 A201 H Anaplastisches M. Hund Mischling 11 J m Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, M.: Meningeom, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographie der Meningeome Bei den Hunden zeigten 9 der 16 Meningeome ein intrakraniales, extraaxiales, leptomeningeales und solitäres Auftreten. Die Tumoren der Tiere Nr. 93 und 100 wiesen ein extra- und intraaxiales Wachstum auf. Bei 3 Tumoren (Nr. 78, 79, 95) konnte die genaue Lokalisation aufgrund des vorhandenen Gewebes nicht bestimmt werden. Die 2 intraspinalen Neoplasien (Nr. 83, 99) zeigten ein extraaxiales, leptomeningeales, parenchymatöses und intradurales Wachstum. Insgesamt wuchsen von den Umfangsvermehrungen 6 rostrotentorial (Nr. 74, 76, 82, 94, 100, 101) und 6 kaudotentorial (Nr. 75, 77, 80, 93, 98). 6 Tumoren (Nr. 74, 75, 77, 83, 93, 98) wiesen umschriebene Tumorgrenzen auf, jedoch infiltrierten sie fokal das umliegende Ge- 113
128 Ergebnisse webe. Alle anderen wuchsen expansiv. Bis auf einen partiell abgekapselten Fall (Nr. 83) besaß keiner der nodulären Tumoren eine Kapsel. Bei einem Fall (Nr. 74) erschien die Ausbreitung plaqueartig. Bei den felinen Meningeomen zeigten 10 der 12 Meningeome ein intrakraniales, extraaxiales, leptomeningeales und solitäres Auftreten. Bei 2 Tumoren (Nr. 84, 92) konnte die genaue Lokalisation aufgrund des vorhandenen Gewebes nicht bestimmt werden. Von den Umfangsvermehrungen wuchsen 9 rostrotentorial (Nr. 81, 85, 86, 87, 88, 89, 90, 91, 97) und einer kaudotentorial (Nr. 96). Eine umschriebene Tumorgrenze wiesen 3 Neoplasien (Nr. 86, 87, 89) auf, jedoch infiltrierten sie fokal das umliegende Gewebe. Alle anderen wuchsen expansiv. In einem Fall (Nr. 89) erschien die Ausbreitung plaqueartig Histologische Befunde der Meningeome Meningotheliomatöse Meningeome Die kaninen, meningotheliomatösen Meningeome zeigten alle eine nesterartige Anordnung der Tumorzellen und mit Ausnahme eines Tumors (Nr. 77) geringgradig whorls (Abb und Abb. 4.56). Das Tier Nr. 74 wies in wenigen Arealen zusätzlich fischzugartig angeordnete Zellen auf. In den Tumoren wurde ein geringgradiger Anteil von fibro-vaskulärem Stroma beobachtet. Zusätzlich war bei dem Tumor des Tieres Nr. 74 eine geringgradige Bindegewebs- und Gefäßproliferation nachweisbar. Die ca m großen, rundovalen bis polygonalen, wenig polymorphen (Nr. 77) und teils spindelförmigen Zellen (Nr. 75, 78) hatten undeutliche Zellgrenzen und ein deutlich bis schwach eosinophiles, teil vakuolisiertes (Nr. 75) Zytoplasma. Die Form der Kerne variierte von rund bis rundoval zu elongiert und spindelförmig in den fischzugartigen Arealen. Beim einem Fall (Nr. 74) lag zudem eine mittelgradige Anisokaryose der Zellkerne und ein geringgradige Polymorphie der Zellen vor. Der Tumor des Tieres Nr. 76 wies einige binukleäre Zellen auf. Die vorwiegend zentral liegenden Kerne erreichten eine Größe von ca m und wiesen einen gering- bis mittelgradigen, homogen verteilten Chromatingehalt auf. In allen Tumoren waren in den meisten Zellen 1-2 Nukleoli pro Zellkern nachweisbar. Die Mitoserate lag bei 3 Tumoren (Nr. 74, 76, 77) bei 0-1 Mitose/hpf, alle anderen Neoplasien wiesen keine Mitosen auf. Bei dem Tumor des Tieres Nr. 74 waren 40% der Tumorfläche nekrotisch. Geringgradige Mineralisationen bestanden in 3 Fällen (Nr. 74, 75, 78), von denen 2 114
129 Ergebnisse (Nr. 75, 78) Psammomkörperchen aufwiesen. In 2 Tumoren (Nr. 74, 76) wurde die geringgradige Bildung von Knochengewebe, beim einem Fall (Nr. 74) zusätzlich auch Knorpelgewebe, im Tumor diagnostiziert. 4 der Tumoren (Nr. 74, 75, 76, 78) wiesen in der Peripherie eine geringradige, lymphozytäre Entzündung auf. Geringgradig wurden Plasmazellen, Makrophagen und Mastzellen nachgewiesen Fibromatöse Meningeome Die spindelförmigen Zellen der Tumoren der Hunde waren fischzugartig angeordnet. Dazwischen gab es kleinere Areale mit nesterartig angeordneten und eher rund- bis längsovale Zellen (Abb und Abb. 4.58). In einem Tumor wurde eine geringgradige Anzahl an whorls gefunden (Nr. 80). In allen Tumoren war ein gering- bis mittelgradiges, fibro-vaskuläres Stroma vorhanden. Die ca m großen, undeutlich begrenzten Zellen hatten eosinophiles Zytoplasma. Der ca m große, zentral gelagerte Zellkern mit rund bis polygonaler Form wies einen gering- bis mittelgradigen Gehalt an homogen verteiltem Chromatin auf. Bei dem Tier Nr. 80 war eine gering- bis mittelgradige, periphere, lymphozytäre Entzündung zu erkennen. Das fibromatöse Meningeom der Katze wies die gleiche Morphologie wie die kaninen, fibromatösen Meningeome auf. Es wurde auch eine geringgradige Anzahl an whorls gefunden (Nr. 81). Neben dem gering bis mittelgradig, fibro-vaskulären Stroma, bestand in dem Tumor eine geringgradige, kollagenfaserarme Bindegewebsproliferation Transitionelle Meningeome Die transitionellen Meningeome der Hunde zeigten die histologischen Kriterien der menigotheliomatösen und fibromatösen Meningeome zu annähernd gleichen Anteilen. Somit waren die Zellen sowohl fischzugartig bzw. strangartig als auch in Nestern angeordnet. Alle Tumoren zeigten eine unterschiedliche Anzahl an whorls. Außer bei einem Tumor (Nr. 82) war in allen Tumoren geringgradig, fibro-vaskuläres Stroma zu erkennen. Die überwiegend spindelförmigen, rund bis -ovalen, ca m großen, undeutlich begrenzten Zellen hatten ein schwach eosinophiles bis eosinophiles Zytoplasma. Die rund bis -ovalen, teils spindelförmigen bis länglichen, ca m großen, zentral gelegenen Zellkerne wiesen einen gering- bis mittelgradigen Gehalt an überwiegend homogen verteiltem Chromatin auf. In den Tumoren der Tiere Nr. 82, 93 waren in wenigen Zellen ein Nukleolus zu beobachten. Bei 2 Tumo- 115
130 Ergebnisse ren (Nr. 82, 100) wurden 0-1 Mitosefigur/hpf festgestellt. Ein Tumor wies (Nr. 83) in geringem Maße Nekrosen auf. Mit Ausnahme von 2 Fällen (Nr. 82, 83) waren in allen Neoplasien Areale mit Mineralisationen, meistens in Form von Psammomkörperchen, zu finden. Der Tumor des Tieres Nr. 93 besaß, neben dem für ein transitionelles Meningeom typischen Zellbild, gleichermaßen Areale mit Zellen, die eine prominente, eosinophile, zytoplasmatische Granulierung enthielten (Abb. 4.59). Ein Tumor wies eine gering- bis mittelgradige Entzündung mit Lymphozyten und Plasmazellen (Nr. 83) in der Peripherie auf. Die 9 felinen transitionellen Meningeome zeigten annähernd die gleichen histologischen Eigenschaften wie die Hunde (Abb. 4.60). Alle Tumoren wiesen eine unterschiedliche Anzahl an whorls auf. In allen Tumoren war geringgradig, fibrovaskuläres Stroma zu erkennen. Bei 4 Umfangsvermehrungen (Nr. 87, 88, 89, 90) wurde zusätzlich eine gering- bis mittelgradige, kollagenfaserreiche Bindegewebsproliferation beobachtet. Das Zytoplasma von 3 Tieren war vakuolisiert (Nr. 90, 91, 92). In den Tumoren der Tiere Nr. 82, 83, 89 waren in wenigen Zellen ein Nukleolus zu beobachten. Bei einem Tumor (Nr. 89) wurden 0-1 Mitosefigur/hpf festgestellt. 2 Tumoren (Nr. 85, 87) zeigten geringgradig Blutungen und 8 Tumoren (Nr. 84, 85, 86, 87, 88, 90, 91, 92) in geringem Maße Nekrosen. Bis auf einen Fall (Nr. 84) waren in den Neoplasien wenige Areale mit Mineralisationen, meistens in Form von Psammomkörperchen, zu finden. 3 der Tumoren (Nr. 86, 89, 90) wiesen ein mittelgradiges Vorkommen von Zysten und 3 (Nr. 85, 86, 87) Cholesterolausfällungen auf. Ein Tumor wies eine gering- bis mittelgradige, peripher lokalisierte Entzündung mit Makrophagen (Nr. 87) auf Psammomatöse Meningeome Die psammomatösen Meningeome der Hunde zeigten ein überwiegend strangartiges bis fischzugartiges Zellbild mit einer hochgradigen Anzahl von whorls und Psammomkörperchen (Abb. 4.61). Ein mittelgradiger Gehalt an fibro-vaskulärem Stroma war bei allen Neoplasien festzustellen. Die ca m großen, spindel-förmigen, undeutlich begrenzten Zellen hatten schwach bis deutlich eosinophiles, teils vakuolisiertes (Nr. 94, 95) Zytoplasma. Zentral gelegene, ca m große, vorwiegend rundovale Kerne zeigten einen gering- bis mittelgradigen, homogen und feingranulär verteilten Chromatingehalt und selten einen Nukleolus pro Kern und bei 3 Tumoren 116
131 Ergebnisse lagen geringgradig Mikrozysten vor. Die 2 psammomatösen Meningeome der Katzen (Nr. 96, 97) verhielten sich histologisch wie die der Hunde. Bei dem Fall mit der Nr. 97 waren jedoch ca. 5% der Tumorfläche Nekrose Angiomatöses Meningeom Bei dem kaninen, angiomatösen Meningeom mit wenigen Psammomkörperchen waren die Zellen teils in Nestern und teils strangartig angeordnet. Es wurde ein geringgradig fibro-vaskuläres Stroma festgestellt. Deutlich zu erkennen war die mittelbis hochgradige, intratumoröse Proliferation von Gefäßen (Abb. 4.62). Die ca. 35 m großen, spindelförmigen, undeutlich begrenzten Zellen hatten ein eosinophiles Zytoplasma. Der geringgradige Gehalt an Chromatin der ca. 15 m großen, rundovalen Kerne war feingranulär und homogen verteilt. Selten war ein Nukleolus pro Zelle sichtbar. Die Tumorfläche bestand zu ca. 5% aus Blutungen und Nekrosen. Es war eine hochgradige, periphere Entzündung mit Makrophagen, neutrophilen Granulozyten und Lymphozyten nachweisbar Myxoides Meningiom Die ca. 25 m großen, polygonalen bis sternförmigen Zellen des myxoiden Meningeoms des Hundes lagen in einem lockereren Zellverband. Es wurden viele mikrozystische Bereiche nachgewiesen. Das Zytoplasma der unscharf begrenzten Zellen war eosinophil und in unterschiedlichem Maße stark vakuolisiert. Es war ein runder bis rundovaler, ca m großer, zentraler Kern erkennbar, der einen mittelgradigen Gehalt an homogen verteiltem Chromatin aufwies. Die Kerne enthielten einen Nukleolus. Die Mitoserate lag bei 0-1/hpf. Zwischen den Zellen wurde in unterschiedlichem Ausmaß myxoide Substanz nachgewiesen Anaplastisches Meningeom Bei dem insgesamt zellreichen anaplastischen Meningeom des Hundes waren die rund- bis längsovalen, bis zu ca. 30 m großen Zellen teils nesterartig, teils strangartig oder solide angeordnet. Wirbelbildungen wurden nicht nachgewiesen. Ein geringbis mittelgradiges, fibro-vaskuläres Stroma und eine herdförmige, kollagenfaserreiche Bindegewebsproliferation wurde innerhalb des Tumors beobachtet. Die Grenzen der eosinophil gefärbten Zellen erschienen undeutlich. Runde bis rundovale, ca
132 Ergebnisse 20 m große, zentral positionierte Zellkerne mit geringgradigem Gehalt an homogen verteiltem Chromatin bestimmten das Zellbild. Pro Kern war ein Nukleolus sichtbar. Die Anzahl der Mitosen und Apoptosen betrug ca. 1/hpf. Blutungen und Nekrosen traten nicht auf. Es war eine geringgradige, periphere, lymphozytäre, plasmazytäre Entzündung festzustellen Immunhistologische Befunde der Meningeom Meningeome Hinsichtlich des immunhistologischen Expressionsmuster der verschiedenen kaninen Meningeomvarianten gab es keine großen Unterschiede. Alle Meningeome zeigten eine mäßig bis stark intensive Markierung für Vimentin. Die Anzahl der positiven Tumorzellen lag bei 25 Tumoren über 80%, von denen die meisten eine 100%ige Markierung aufwiesen. Teilweise war die Vimentin-Markierung besonders stark auf die whorls bezogen. Lediglich bei einem Tumor (Nr. 77) wurden eine positive Reaktion in nur 25-40% der Tumorzellen festgestellt. 6 Tumoren (Nr. 77, 78, 82, 94, 98, 99) zeigten eine Markierung mit dem Zytokeratin-Antikörper AE1/AE3. Die mäßig intensive Markierung war in der Mehrzahl der Fälle nur in 5-10 % der Zellen zu erkennen. Lediglich in den Tumoren der Tiere Nr. 82, 98 und 77 waren über 40% bis 70% (Nr. 77) der Tumorzellen markiert (Abb. 4.63). Das Tier Nr. 77 mit der höchsten Anzahl Zytokeratin-positiver Zellen wies gleichzeitig in ca. 15% der Zellen eine mäßige Markierung mit dem Zytokeratin-Antikörper LP34 auf. In 4 Meningeomen (Nr. 74, 77, 82, 98) wurde in ca. 10% der Zellen eine mäßig intensive Markierung für S100- Protein beschrieben. In einem Fall (Nr. 82) waren bis zu 30% der Zellen markiert. Eine Kennzeichnung von überwiegend mäßiger Intensität war in allen Meningeomen für den Trk-Antikörper nachweisbar. Die Anzahl der positiven Zellen variierte dabei von %. NSE wurde als mäßig bis starke intensive Markierung in 6 Tumoren (Nr. 74, 76, 78, 95, 99, 100) nachgewiesen. Der durchschnittliche prozentuale Anteil positiver Zellen lag zwischen 30 und 60%. Die Markierung war überwiegend in den Wirbeln und um Psammomkörperchen lokalisiert. Das rhabdoide Meningeom wies in ca. 30% der Zellen eine GFAP-Markierung und in 80% eine Kennzeichnung mit CNPase auf. Die Mehrzahl der Meningeome enthielten vereinzelt bis geringgradig stark CD3 markierte lymphozytenähnliche Zellen. 118
133 Ergebnisse Die felinen Meningeome zeigten eine mäßig bis stark intensive Markierung für Vimentin. Die Anzahl der positiven Tumorzellen lag bei über 80%, von denen die meisten eine 100%ige Markierung aufwiesen (Abb und Abb. 4.65). Die Vimentin-Markierung war auch hier teilweise besonders stark auf die whorls bezogen. In einem Fall (Nr. 81) wurden eine positive Reaktion in nur 25-40% der Tumorzellen festgestellt. 2 Tumoren (Nr. 84, 86) zeigten eine mäßig intensive Markierung mit dem Zytokeratin-Antikörper AE1/AE3 in 5-10% der Zellen. In 2 Meningeomen wurde in ca. 10% (Nr. 85) bzw. 30% (Nr. 89) der Zellen eine mäßig intensive Markierung für S100-Protein beschrieben. Die Reaktion mit dem Trk-Antikörper verhielt sich wie bei den kaninen Meningeomen. Eines der transitionellen Meningeome (Nr. 89) wies eine mäßige CEA-Markierung in < 5% der Tumorzellen auf (Abb. 4.66). NSE wurde als mäßig bis starke intensive Markierung in ca. 30 bis 60% der Tumorzellen bei 6 Tumoren (Nr. 84, 86, 89, 91, 96, 97) nachgewiesen. Die Markierung war auch hier ü- berwiegend in den Wirbeln und um Psammomkörperchen lokalisiert. Die Mehrzahl der Meningeome enthielten vereinzelt bis geringgradig stark CD3 markierte Lymphozyten. Eine Übersicht über die Anzahl immunreaktiver Tumorzellen in den Meningeomen ist der Tab zu entnehmen. 119
134 Ergebnisse Tab. 4.21: Anzahl immunreaktiver Tumorzellen in den Meningeomen Antigen Nr. 74 Nr. 75 Nr. 76 Nr. 77 Nr. 78 Nr. 79 Nr. 80 Nr. 81 Nr. 82 Nr. 83 Nr. 84 Nr. 85 Nr. 86 GFAP Vimentin S100-Protein CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE (+) CEA Fetoprotein NSE Neurofilament CNPase Trk Fortsetzung Tab Antigen Nr. 87 Nr. 88 Nr. 89 Nr. 90 Nr. 91 Nr. 92 Nr. 93 Nr. 94 Nr. 95 Nr. 96 Nr. 97 Nr. 98 Nr. 99 Nr. 100 GFAP Vimentin S100-Protein CD CD79 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. Von-W.-Faktor Synaptophysin LP AE1/AE (+) (+) - CEA - - (+) Fetprotein NSE (+) Neurofilament CNPase TRK (+) Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katzen Anaplastisches Meningeom Eine Vimentin-Markierung wurde bei dem Tumor des Hundes in ca. 80% der Tumorzellen von unterschiedlicher Intensität festgestellt. Im Randbereich der Stanze zeigten ca. 10% der Zellen eine mittelbraune Kennzeichnung für S100-Protein. In 50% der Tumorzellen wurde eine mäßig intensive Markierung für Trk und in 5% für 120
135 Ergebnisse NSE festgestellt. Im Tumor wurden einzelne CD3-positive, lymphozytäre Zellen beobachtet. Die Ergebnisse der immunhistologischen Untersuchung sind der Tab zu entnehmen. Tab. 4.22: Anzahl immunreaktiver Tumorzellen in dem anaplastischen Meningeom Antigen Nr. 101 GFAP - Vimentin ++ S100-Protein (+) CD3 - CD79 n.a. von-w.-faktor - Synaptophysin - LP34 - AE1/AE3 - CEA - -Fetoprotein - NSE (+) Neurofilament - CNPase - Trk ++ Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei den Lymphomen Von 117 untersuchten Tumoren wurden 3 (2,6%) als ein primäres Lymphom des ZNS diagnostiziert (siehe Tab. 4.23). Es waren 2 Hunde (Nr. 102, 104) und eine Katze (Nr. 103) betroffen. Tab. 4.23: Hunde und Katzen mit Lymphomen Nr. ID UNI Diagnose Art Rasse Alter M/W 102 A98 H B-Zell Lymphom Hund Mix 4 J wk 103 A48 H Lymphom Katze EKH 10 J m 104 A103 H Lymphom Hund DSH 4,5 J w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, Mix: Mischling, DSH: Deutscher Schäferhund, EKH: Europäisch Kurzhaar, J: Jahre, G: Geschlecht, m: männlich, weiblich: w, wk: weiblich kastriert Topographische Befunde der Lymphome Die Lymphome waren intrakranial lokalisiert. Die Tumoren der Hunde mit der Nr. 102 und 104 wiesen ein extra- und intraaxiales, leptomeningeales und parenchymatöses, 121
136 Ergebnisse multifokales Wachstum auf. Es wurde bei einem Fall (Nr. 102) ein rostrotentoriales und bei dem Tier Nr. 104 ein kaudotentoriales Auftreten beobachtet. Sie zeigten ein infiltratives Wachstum, mit eher scharfen Grenzen bei dem Tier Nr. 102 und mit unscharfen Grenzen in dem Fall mit der Tier Nr Letzter wuchs in den Plexus choroideus des 4. Ventrikels. Beide Tumoren waren nicht bekapselt. Die Ausbreitung des felinen Lymphoms (Nr. 103) war intraaxial, kaudotentorial, solitär und wies keine Kapsel und unscharfe Grenzen auf Histologische Befunde der Lymphome Das Zellbild der Lymphome war durch solide proliferierende, relativ monomorphe Zellen innerhalb eines spärlichen, fibro-vaslulären Stromas gekennzeichnet. Die rundovalen, ca m großen, deutlich begrenzten Zellen hatten wenig eosinophiles Zytoplasma. Die runden bis rundovalen, ca m großen, zentral oder wenig exzentrischen Zellkerne besaßen einen überwiegend mittelgradigen, grobscholligen bis grobgranulären Chromatingehalt. Die Anzahl der Mitosen lag bei 2 (Nr. 102, 104), die der Apoptosen bei 1 bis 2 (Nr. 104) oder bei 2 bis 3 (Nr. 103)/hpf. Bei dem Tumor des Tieres Nr. 104 wurden ca. 5% Nekrosen nachgewiesen. Zwischen den Tumorzellen des Falles mit der Tier Nr. 104 waren in Reihen angeordnete epitheliale Zellen zu erkennen, bei denen es sich vermutlich um ortständige Ependymzellen handelt. Das Zellbild des felinen Lymphoms (Nr. 103) war gleich dem der kaninen Lymphome. Es waren jedoch teils polygonale Zellen zu beobachten (Abb. 4.67). Pro Zelle wurde ein Nukleoli erkannt. Im Gegensatz zu den kaninen Tumoren waren bis zu 10 Mitosefiguren und 1-2 Apoptosen/hpf feststellbar Immunhistologische Befunde der Lymphome Die Lymphome zeigten bei den Hunden mit der Tier Nr. 102 und 104 eine 15-30%ige, mäßig bis stark intensive Markierung der Tumorzellen mit CD3. Die Intensität der Vimentin-Markierung war schwächer als bei CD3 und in einem geringeren Prozentsatz der Zellen sichtbar (Nr. 102: 15%; 104: 40%). Eine mäßig intensive Trk- Reaktion wurde bei den Lymphomen in ca. 90% der Zellen nachgewiesen. Der Tumor des Tieres Nr. 104 wies in den Zellen mit epithelialer Morphologie eine starke Markierung mit dem Zytokeratin-Antikörper AE1/AE3 auf, ein geringerer Anteil dieser Zellen exprimierte das Zytokeratin LP34. Zusätzlich wiesen ca. 20% der Tumorzellen 122
137 Ergebnisse eine Synaptophysin-Markierung auf. Eine Markierung mit CD79 war weder im Zytoplasma noch im Kern nachweisbar. Das feline Lymphom zeigte eine fast 100%ige (Abb. 4.68) mäßig bis stark intensive Markierung der Tumorzellen mit CD3. Auch die Vimentin-Markierung war in 100% der Tumorzellen sichtbar und fiel somit wesentlich stärker aus, als in den kaninen Neoplasien. Die Intensität der Reaktion war jedoch schwächer als bei CD3. Eine mäßig intensive Trk-Reaktion wurde auch im felinen Tumor in ca. 90% der Zellen nachgewiesen. Eine CD79-Expression wurde nicht nachgewiesen. Tab. 4.24: Anzahl immunreaktiver Tumorzellen in den Lymphomen Antigen Nr. 102 Nr. 103 Nr. 104 GFAP Vimentin S100-Protein CD CD79 n.a. - - von-w.-faktor Synaptophysin LP (+) AE1/AE CEA Fetoprotein NSE Neurofilament CNPase Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar, grau unterlegt: Katze Topographie sowie histologische und immunhistologische Befunde bei den Non-B, Non-T lymphozytären Neoplasien (neoplastische Retikulose) Es wurde von den 117 Tumoren eine Neoplasie (0,9%) als Non-B, Non-T lymphozytäre Neoplasie eingeteilt. Es handelte sich um einen 7 Jahre alten, männlichen Teckel. 123
138 Ergebnisse Topographische Befunde der Non-B, Non-T lymphozytäre Neoplasie Die noduläre Umfangsvermehrung zeigte eine intraspinal lokalisierte, intraaxiale, durale, leptomeningeale, intradurale und solitäre Ausbreitung. Der umschriebene Tumor ohne Kapsel wies sowohl ein infiltratives, als auch expansives Wachstum auf Histologische Befunde der Non-B, Non-T lymphozytären Neoplasie Die überwiegend perivaskulär liegenden, elongierten, ca. 30 bis 40 m großen, undeutlich begrenzten Zellen waren teils irregulär, teils zirkulär angeordnet (Abb und Abb. 4.70). Es bestand eine geringgradige, kollagenfaserarme Bindegewebsproliferation. Das Zytoplasma war eosinophil, feingranulär gefärbt. Der runde bis rundovale oder spindelförmige, ca. 20 m große Kern lag zentral oder etwas exzentrisch und wies mittelgradig, homogen verteiltes Chromatin auf. Meistens waren 1 oder 2 Nukleoli pro Kern sichtbar. Mitosen und Apoptosen konnten nicht nachgewiesen werden. In der Peripherie bestand eine mittel- bis hochgradige Entzündung mit Makrophagen, Plasmazellen und Lymphozyten Immunhistologische Befunde der Non-B, Non-T lymphozytären Neoplasie 80% der Zellen zeigten eine mäßig intensive Markierung für Vimentin und 90% für Trk. Einzelne große Zellen, die morphologisch reaktiven Astrozyten ähnlich sahen, zeigten eine Expression von NSE. Disseminierte, einzelne, lymphozytäre Zellen wiesen eine CD3-Markierung auf. Mit dem Antikörper CD79 wurde keine Markierung des Zytoplasmas oder der Kerne nachgewiesen. Die immunhisto-logischen Ergebnisse sind in der Tab dargestellt Tab. 4.25: Anzahl immunreaktiver Tumorzellen der Non-B, Non-T lymphozytären Neoplasie Antigen Nr. 105 GFAP - Vimentin ++ S100-Protein - CD3 - CD79 - von-w.-faktor - Synaptophysin - 124
139 Ergebnisse Fortsetzung Tab Antigen Nr. 105 LP34 - AE1/AE3 - CEA - -Fetoprotein - NSE (+) Neurofilament - CNPase - Trk ++ Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen Topographie sowie histologische und immunhistologische Befunde bei der Mikrogliomatose Ein Fall (0,9%) von 117 Tumoren wurde als Mikrogliomatose diagnostiziert. Es handelte sich um eine 13 Monate alten Rottweilerhündin Topographische Befunde der Mikrogliomatose Der noduläre Tumor wuchs nicht abgekapselt, infiltrativ in das umliegende Gewebe und war intrakranial, intraaxial, rostro- und kaudotentorial lokalisiert. Er wies ein multifokales Wachstum auf Histologische Befunde der Mikrogliomatose Die ca m großen, spindelförmigen, elongierten Zellen zeigten keine deutlichen Grenzen und ein eosinophiles Zytoplasma (Abb. 4.71). Die Zellen besaßen einen mäßigen, fein- bis grobgranulären Chromatingehalt in den ca. 20 m großen, zentral gelegenen Zellkernen. Die Anzahl der Mitosen und Apoptosen lag bei 1 bis 2/hpf. In der Peripherie wurde eine Degeneration der weißen Substanz festgestellt Immunhistologische Befunde der Mikrogliomatose Insgesamt zeigten 90% der Zellen eine mäßig bis stark intensive Markierung für Vimentin und Trk. 10% der Zellen exprimierten mit gleicher Intensität S100-Protein und in 20% CNPase. Mit geringerer Intensität wurde in 5% der Zellen eine positive NSE-Reaktion festgestellt. Es waren einzelne CD3-positive Zellen mit lymphozytärer Morphologie nachweisbar. Eine Übersicht über die Anzahl der immunreaktiven Tumorzellen gibt Tab
140 Ergebnisse Tab. 4.26: Anzahl immunreaktiver Tumorzellen in der Mikrogliomatose Antigen Nr. 106 GFAP - Vimentin ++ S100-Protein + CD3 - CD79 n.a. von-w.-faktor - Synaptophysin - LP34 - AE1/AE3 - CEA - -Fetoprotein - NSE (+) Neurofilament - CNPase + Trk ++ Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei den malignen Histiozytosen Von den insgesamt 117 Neoplasien wurden 2 Tumoren (1,7%) als maligne Histiozytose des zentralen Nervensystems klassifiziert (siehe Tab. 4.27). Es waren nur Hunde betroffen. Tab. 4.27: Hunde mit maligner Histiozytose Nr. ID UNI Diagnose Art Rasse Alter G 107 A83 H Maligne Histiozytose Hund Dobermann 6 J m 108 A129 H Maligne Histiozytose Hund Berner Sennenhund 5 J m Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der malignen Histiozytosen Die beiden malignen Histiozytosen wiesen ein intrakraniales, intraaxiales, rostrotentoriales, parenchymatöses und solitäres Wachstum auf. Der Tumor des Tieres Nr. 108 zeigte im Gegensatz zum erstgenannten ein fokal infiltratives Wachstum. Die Ränder der Umfangsvermehrung des Tieres Nr. 107 waren unscharf begrenzt und zeigten ein infiltratives Wachstum. Die Tumoren waren nicht abgekapselt. 126
141 Ergebnisse Histologische Befunde der malignen Histiozytosen Es handelte sich um relativ zellreiche, solide angeordnete Tumoren, die einen geringgradigen Gehalt an fibro-vaskulärem Stroma aufwiesen. Die hochgradig polymorphen, polygonalen bis spindelförmigen Zellen hatten eine Größe von ca. 15 bis zu 150 m (Abb. 4.72). Das Zytoplasma der deutlich begrenzten Zellen erschien eosinophil. Es war eine starke Anisozytose und karyose nachweisbar. Die teilweise gekerbten Kerne lagen zentral und wiesen unterschiedlich viel Chromatin auf, vereinzelt wurden bi- oder multinukleäre Zellen beobachtet. Es wurden in einzelnen Zellen bis zu 3 Nukleoli nachgewiesen. Die Anzahl der Mitosen lag im Tumor Nr. 108 bei 4 bis 5 und bei dem Tumor des Tieres Nr. 107 bei 1 bis 3/hpf. Nekrosen wurden nur in einem Tumor (Nr. 107) nachgewiesen. Peripher (Nr. 107) und intratumorös (Nr. 107, 108) bestand eine geringgradige Infiltration mit Entzündungszellen Immunhistologische Befunde der malignen Histiozytosen Beide Tumoren zeigten eine mäßig bis stark intensive Markierung für Vimentin (108: 60% und 107: 80%). Es wurden mittelgradig CD3-positive Lymphozyten nachgewiesen. Die immunhistologischen Ergebnisse sind der Tab zu entnehmen. Tab. 4.28: Anzahl immunreaktiver Tumorzellen in den malignen Histiozytosen Antigen Nr. 107 Nr. 108 GFAP - - Vimentin S100-Protein - - CD3 - - CD79 n.a. n.a. von-w.-faktor - - Synaptophysin - - LP AE1/AE3 - - CEA - - -Fetoprotein - - NSE - - Neurofilament - - CNPase - - Trk - - Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar. 127
142 Ergebnisse Topographie sowie histologische und immunhistologische Befunde bei den suprasellären Keimzelltumoren Drei (2,6%) der 117 primären ZNS-Tumoren wurden als supraselläre Keimzellzumoren klassifiziert (siehe. Tab. 4.29). Tab. 4.29: Hunde mit suprasellären Keimzelltumoren Nr. ID UNI Diagnose Art Rasse Alter G 109 A14 H Suprasellärer Keimzelltumor Hund Boxer 4 J m 110 A84 H Suprasellärer Keimzelltumor Hund Airdale Terrier 3 J w 111 A204 H Suprasellärer Keimzelltumor Hund Êurasier 7 J w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der suprasellären Keimzelltumoren Die nodulären Tumoren wiesen ein intrakraniales, extraaxiales, leptomeningeales und solitäres Wachstum auf. Während 2 Fälle (Nr. 110 und 111) rostrotentorial lokalisiert waren, lag der Tumor des Tieres Nr. 109 perisellär. Die nicht abgekapselten Tumoren hatten umschriebene Tumorgrenzen, während 2 Neoplasien (Tier Nr. 109 und 111) fokal in das umliegende Gewebe infiltrierten Histologische Befunde der suprasellären Keimzelltumoren Bei den solide wachsenden Keimzelltumoren wurde ein nesterartiger Tumoraufbau mit gering- bis mittelgradig fibro-vaskulärem Stroma nachgewiesen. Die Tumoren bestanden aus 3 verschiedenen Zelltypen: germinativen, hepatoiden und epithelialen Zellen. Während im Tumor des Tieres Nr. 109 fast nur hepatoide Zellen zu finden waren, wurden bei den anderen alle 3 Zelltypen nachgewiesen. Die runden bis polygonalen, ca. 25 m großen, undeutlich begrenzten, germinativen Zellen zeigten ein eosinophiles Zytoplasma (Abb. 4.73). Die in azinösen Strukturen angeordneten, bis ca. 40 m großen, epithelialen Zellen hatten eine kuboidale Form, eosinophiles Zytoplasma und teils deutliche, teils undeutliche Zellgrenzen. Der hepatoide Zelltyp war durch runde bis polygonale Zellen mit einer Größe von ca. 35 m, undeutlichen Grenzen und schwach eosinophilem, vakuolisierten Zytoplasma gekennzeichnet (Abb. 4.73). Die Zellkerne aller Zelltypen waren rund bis rundoval und hatten eine Größe von ca m. Während die Zellkerne der germinativen Zellen eher zent- 128
143 Ergebnisse ral lagen, zeigten die der hepatoiden Zellen eine geringgradig exzentrische und die der epitheloiden Zellen eine basale Lage. In den germinativen Zellen lag ein mäßiger Gehalt an grobgranulärem Chromatin vor, während der Gehalt bei den anderen geringer und feingranulär war. In den epithelialen Zellen waren 1-2 Nukleoli pro Zelle zu erkennen. Die Anzahl der Mitosen lag bei 0 bis 1/hpf. In allen Tumoren wurden geringgradig Nekrosen festgestellt. Die nodulären Tumoren zeigten eine gering- bis mittelgradig intratumoröse, lymphozytäre Entzündung. In der Peripherie wurden bei der Neoplasie des Tieres Nr. 109 eine Entzündung und bei dem Tier Nr. 111 Blutungen beobachtet Immunhistologische Befunde der suprasellären Keimzelltumoren Bei den intrakranialen Keimzelltumoren wurde eine zytoplasmatische Markierung mit -Fetoprotein in nahezu allen hepatoiden Tumorzellen festgestellt, während nur einzelne epitheloide und germinative Zellen positiv waren (Abb. 4.74). Die Intensität der Markierung war in 2 Tumoren (Nr. 110, 111) stark ausgebildet, während der Tumor des Tieres Nr. 109 nur eine mäßig intensive Markierung aufwies. Eine mäßig bis stark intensive positive Reaktion war in allen drei Tumoren mit dem Zytokeratin AE1/AE3 zu erkennen, während die hepatoiden und epithelialen, aber nicht die germinativen Zellen markiert waren. In 2 Tumoren (Nr. 109, 111) wurden disseminiert einzelne, lymphozytäre Zellen mit einer CD3-Expression beobachtet, während diese im Tier Nr. 109 zum Teil perivaskulär akzentuiert lagen. 90% aller Zellarten wiesen eine mäßig intensive Markierung für Trk auf. Bei 2 Fällen (Nr. 109, 110) wurde in weniger als 30% der Zellen eine CNPase-Expression festgestellt. Eine Übersicht der Anzahl immunreaktiver Tumorzellen ist der Tab zu entnehmen. Tab. 4.30: Anzahl immunreaktiver Tumorzellen in den suprasellären Keimzelltumoren Antigen Nr. 109 Nr. 110 Nr. 111 GFAP Vimentin S100-Protein CD CD79 n.a. n.a. n.a. von-w.-faktor Synaptophysin
144 Ergebnisse Fortsetzung Tab Antigen Nr. 109 Nr. 110 Nr. 111 LP AE1/AE CEA Fetoprotein NSE Neurofilament CNPase + (+) - Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei dem Hypophysenadenom Von den insgesamt 117 Tumoren wurde 1 Tumor (0,9%) als Hypophysenadenom reklassifiziert. Es handelte sich um einen 10 Jahre alten, männlichen Yorkshire Terrier Topographische Befunde des Hypophysenadenoms Das solitäre, nicht bekapselte Hypophysenadenom zeigte ein intrakraniales, intraaxiales, rostrotentoriales, leptomeningeal und parenchymatös lokalisiertes, umschriebenes Wachstum Histologische Befunde des Hypophysenadenoms Der zellreiche, solide Tumor wies sowohl Pseudorosetten, als auch echte Rosetten auf und besaß ein geringgradig, fibro-vaskuläres Stroma. Die ca. 35 m großen, deutlich begrenzten, polygonalen Zellen hatten ein eosinophiles Zytoplasma und wiesen eine gering- bis mittelgradige Polymorphie auf. Die Gestalt der ca. 15 m großen, exzentrisch positionierten Zellkerne war rund bis rundoval. Sie zeigten einen mittelgradigen Gehalt an feingranulärem Chromatin. Es wurden ein Nukleolus pro Zelle und 1-2 Mitosen/hpf nachgewiesen Immunhistologische Befunde des Hypophysenadenoms Die Tumorzellen zeigten annähernd alle eine mäßig intensive Markierung für Synaptophysin. In 20% der Zellen, vorwiegend die Rosetten betreffend, wurde eine mäßige Expression mit dem Zytokeratin-Antikörper AE1/AE3 nachgewiesen. Eine mäßig intensive Markierung für Trk wurde in 80% und für NSE in 10% der Tumorzellen 130
145 Ergebnisse festgestellt. Die immunhistologischen Ergebnisse des Hypophysenadenoms sind in der Tab dargestellt. Tab. 4.31: Anzahl immunreaktiver Tumorzellen in dem Hypophysenadenom Antigen Nr. 112 GFAP - Vimentin - S100-Protein - CD3 - CD79 n.a. von-w.-faktor - Synaptophysin +++ LP34 - AE1/AE3 + CEA - -Fetoprotein - NSE + Neurofilament - CNPase - Trk ++ Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen,n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei den peripheren Nervenscheidentumoren Bei 3 Hunden (2,6%) wurde ein peripherer Nervenscheidentumor festgestellt (siehe Tab. 4.32). 2 der Tumoren (66,7%) wurden als gutartige Nervenscheidentumoren (Schwannom/ BPNST) klassifiziert. Der dritte Tumor (33,3%) wurde als maligner peripherer Nervenscheidentumor charakterisiert (MPNST). Tab. 4.32: Hunde mit peripheren Nervenscheidentumoren Nr. ID UNI Diagnose Art Rasse Alter G 113 A19 H Zelluläres Schwannom Hund Golden Retriever 1 J w 114 A20 H Zelluläres Schwannom Hund Bouvier 3 J m 115 A122 H MPNST Hund Cocker 8 J m Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, G: Gießen, O: OSU, J: Jahre, G: Geschlecht, m: männlich, mk: männlich kastriert, weiblich: w, wk: weiblich kastriert, o.a.: ohne Angabe Topographische Befunde der peripheren Nervenscheidentumoren Die zellulären Schwannome waren intrakranial lokalisiert. Der Tumor des Tieres Nr. 113 wuchs rostrotentorial, extraaxial, leptomeningeal und solitär, während die Neoplasie des Tieres Nr. 114 kaudotentorial, intraaxial, parenchymatös und solitär auf- 131
146 Ergebnisse trat. Das Wachstum war bei einem Fall (Nr. 113) umschrieben, fokal infiltrativ, expansiv und ohne Kapsel. Die Umfangsvermehrung des Tieres Nr. 114 wuchs infiltrativ mit segmentaler Abkapselung. Der MPNST trat intrakranial, extraaxial, rostrotentorial, teils leptomeningeal, teils parenchymatös und solitär auf. Trotz umschriebener Tumorgrenzen wurde fokal eine Infiltration des umliegenden Gewebes festgestellt Histologische Befunde der peripheren Nervenscheidentumoren Zelluläre Schwannome Der Aufbau der relativ zellreichen Tumoren bestand aus fischzugartig, teilweise nesterartig angeordneten Zellen mit unterschiedlich großen Antoni-A-Bereichen (Abb. 4.75). Fibro-vaskuläres Stroma wurde bei einem Tumor (Nr. 114), eine geringgradige, glomeruloide Gefäßproliferation bei dem Tumor des Tieres Nr. 113 und eine mittelgradige kollagenfaserarme Bindegewebsproliferation bei beiden festgestellt. Die spindelförmigen, bis ca. 35 m großen Zellen hatten undeutliche Zellgrenzen und ein schwach eosinophiles bis klares Zytoplasma. Die spindelförmigen bis rundovalen, ca m großen, zentralen Kerne zeigten einen mäßigen Gehalt an homogen verteiltem Chromatin. Es wurden 1-3 Nukleoli pro Kern beobachtet. In einem Fall (Nr. 113) waren 1-2 Mitosen und Apoptosen/hpf nachweisbar. 15% der Tumorfläche wurde von nekrotischem Gewebe eingenommen. Zwischen den spindelförmigen Zellen lagen bei dem Tumor des Tieres Nr. 114 wenige, ca. 100 m große rundovale Zellen (Neuronen) mit deutlichen Grenzen und eosinophilem Zytoplasma, das Nissl sche Substanz enthielt. Lipidbeladene Histiozyten wurden nicht nachgewiesen Maligner peripherer Nervenscheidentumor (MPNST) Die spindelförmigen bis rundovalen, ca. 25 m großen, undeutlich begrenzten Zellen waren solide angeordnet und hatten ein eosinophiles, vakuolisiertes Zytoplasma. Antoni-A-Bereiche waren angedeutet zu erkennen. Es fand sich wenig fibro-vaskuläres Stroma. Runde bis ovale, m große Kerne mit zentral gelagertem Kern und einem mittelgradigen Gehalt an homogen verteiltem Chromatin waren zu erkennen. Es wurden ein bis 2 Mitosen und ca. eine Apoptose/hpf beobachtet. Der Tumor zeigte eine geringgradige, fokale Entzündung mit lymphozytärer Beteiligung und eine peritumoröse Degeneration des Hirngewebes. 132
147 Ergebnisse Immunhistologische Befunde der peripheren Nervenscheidentumoren Zelluläres Schwannom Beide Tumoren exprimierten zu 100% Vimentin und Trk. Der Tumor des Tieres Nr. 113 (90% der Zellen) zeigte im Gegensatz zum Tumor des Tieres Nr. 114 (15-20% der Zellen) eine hohe Anzahl GFAP (Abb. 4.76) und CNPase positiver Zellen. Beide Tumoren wiesen in ca. 50% der Zellen eine Immunreaktion für S100-Protein auf. Der Grad der Immunreaktivität war bei allen Markern überwiegend mäßig. Die immunhistologischen Ergebnisse sind im Überblick in Tab dargestellt Maligner peripherer Nervenscheidentumor (MPNST) 90% der Tumorzellen des MPNST s wiesen eine mäßig bis stark intensive Markierung für GFAP auf. Der Prozentsatz Vimentin-positiver Zellen lag ebenso hoch, jedoch war die Intensität der Markierung nicht so stark. Von mäßiger Intensität waren die für den Antikörper AE1/AE3 5% positiven, die 80% Trk-positiven, die 70% CNPase-positiven und die 50% S100-Protein-positiven Zellen. Vereinzelt wurden stark CD3-positive, lymphozytäre Zellen beobachtet. Eine Auflistung der Anzahl immunreaktiver Tumorzellen der MPNST s sind der Tab zu entnehmen. Tab. 4.33: Anzahl immunreaktiver Tumorzellen der peripheren Nervenscheidentumoren Antigen Nr. 113 Nr. 114 Nr. 115 GFAP Vimentin S100-Protein CD CD79 n.a. n.a. n.a. von-w.-faktor Synaptophysin LP AE1/AE3 - - (+) CEA Fetoprotein NSE
148 Ergebnisse Fortsetzung Tab Antigen Nr. 113 Nr. 114 Nr. 115 Neurofilament CNPase Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar Topographie sowie histologische und immunhistologische Befunde bei dem sekundären und dem nicht klassifizierbaren Tumor Von den 117 Tumoren wurde ein Tumor als leptomeningeales Karzinom vermutlich metastatischen Ursprungs reklassifiziert. Ein anderer Tumor war im Rahmen dieser Studie nicht eindeutig zu klassifizieren. Bei beiden Tieren handelte es sich um Hunde (siehe Tab. 4.34). Tab. 4.34: Sekundärer und nicht klassifiziertbarer Tumor Nr. ID UNI Diagnose Art Rasse Alter G 116 A102 H Meningeales Karzinom metastatischen Hund Collie 8 J m Ursprungs 117 A90 H Tumor unklarer Histogenese Hund Mix 3 J w Abk.: Nr.: Tier Nummer, ID: Identitätsnummer, Uni: Herkunft der Tumoren, H: Hannover, Mix: Mischling, J: Jahre, G: Geschlecht, m: männlich, w: weiblich Topographie des sekundären und nicht klassifizierbaren Tumors Das meningeale Karzinom (Nr. 116) war aufgrund von fehlendem umliegenden Gewebe neuroanatomisch nicht genau zu lokalisieren. Laut Vorbericht lag der Tumor ventral der Medulla oblongata. Der Tumor des Tieres Nr. 117 wuchs an mehreren Stellen intrakranial, intraaxial, rostrotentorial und parenchymatös. Der nicht abgekapselte Tumor zeigte ein infiltratives Wachstum Histologische Befunde des sekundären und nicht klassifizierbaren Tumors Bei dem meningealen Karzinom (Nr. 116) waren 2 Zelltypen zu erkennen. Die einen waren ca. 30 m groß, sternförmig und wuchsen netzartig in einem retikulären Gerüst. Der andere Zelltyp mit ca. 25 m großen, kuboidalen bis rundovalen Zellen wuchs strangartig an einer hyalinen, feinfibrillären Matrix entlang. Beide Zelltypen hatten deutliche Grenzen und ein schwach eosinophiles, vakuolisiertes Zytoplasma. 134
149 Ergebnisse Die runden, ca m großen Kerne waren zentral lokalisiert. Der Gehalt an Chromatin war gering- (sternförmige Zellen) bis mittelgradig (kuboidale Zellen) und feingranulär verteilt. Vereinzelt wurde in den kuboidalen Zellen 1 Nukleolus pro Kern beobachtet. Der solide wachsende, nicht eindeutig klassifizierbare Tumor (Nr. 117) wies eine gering- bis mittelgradige Bindegewebsproliferation auf. In der Tumorperipherie schienen die teilweise azidophilen Zellen bandförmig angeordnet zu sein. Die rundovalen bis polygonalen, ca. 20 m großen, deutlich begrenzten Zellen hatten ein eosinophiles Zytoplasma. Die ca.10 m großen, runden, exzentrischen Kerne wiesen einen mittel- bis hochgradiger Gehalt an grobgranulär verteiltem Chromatin auf. Disseminiert wurden Lymphozyten und Sternhimmelzellen nachgewiesen. In einzelnen Zellen war ein Nukleolus nachweisbar. Die Mitoserate lag bei 5-6/hpf, während 1-2 A- poptosen/hpf und geringgradig Nekrosen zu erkennen waren Immunhistologische Befunde des sekundären und nicht klassifizierbaren Tumors Der Tumor (Nr. 116) zeigte eine mäßig bis starke Reaktion in ca. 70% der Tumorzellen mit dem Zytokeratin- Antikörper AE1/AE3. Eine mäßig intensive Markierung für Trk war in 85% der Zellen zu erkennen. Bei dem unklaren Tumor des Tieres Nr. 117 zeigten ca. 5% der Zellen eine mäßig intensive Markierung für den Zytokeratin- Antikörper AE1/AE3. 90% der Zellen wiesen eine positive Reaktion für Trk auf. Die immunhistologischen Ergebnisse der Anzahl immunreaktiver Tumorzellen sind in der Tab dargestellt. 135
150 Ergebnisse Tab. 4.35: Anzahl immunreaktiver Tumorzellen Antigen Nr. 116 Nr. 117 GFAP - - Vimentin - - S100-Protein - - CD3 - - CD79 n.a. n.a. von-w.-faktor - - Synaptophysin - - LP AE1/AE3 ++ (+) CEA - - -Fetoprotein - - NSE - - Neurofilament - - CNPase - - Trk Abk.: Nr.: Tier Nummer, von-w.-faktor: von-willebrand-faktor, +++: mehr als 90% der Tumorzellen positiv, ++: 50-90% der Tumorzellen positiv, % der Tumorzellen positiv, (+): <10% oder einzelne Zellen positiv, -: keine Immunreaktivität in den Tumorzellen, n.a.: nicht auswertbar. 136
151 Ergebnisse 4.4 Fotografische Dokumentation Abb. 4.20: Fibrilläres Astrozytom mit geringer Zelldichte und länglichen bis irregulär geformten Kernen in einem dichten fibrillären Netzwerk, wenige kleinzystische Areale (Pfeile). Hund, Nr. 1 H.E.-Färbung, Balken = 100µm Abb. 4.21: Fibrilläres Astrozytom mit geringer Zelldichte und länglichen bis irregulär geformten Kernen in einem dichten fibrillären Netzwerk, wenige kleinzystische Areale (Pfeile). Hund, Nr. 1 (stärkere Vergrößerung von Abb. 4.20) H.E.-Färbung, Balken = 50µm Abb. 4.22: Protoplasmatisches Astrozytom mit erhöhter kleinzystischer Degeneration (Pfeile) und Zellen mit deutlichem Zytoplasmasaum. Hund, Nr. 6 H.E.-Färbung, Balken = 100µm 137
152 Ergebnisse Abb. 4.23: Protoplasmatisches Astrozytom mit erhöhter kleinzystischer Degeneration (Pfeile) und Zellen mit deutlichem Zytoplasmasaum. Hund, Nr. 6 (stärkere Vergrößerung von Abb. 4.22) H.E.-Färbung, Balken = 50µm Abb. 4.24: Gemistozytäres Astrozytom mit vorwiegend großen, plumpen Tumorzellen und exzentrischem Kern (Pfeile). Hund, Nr. 7 H.E.-Färbung, Balken = 50µm Abb. 4.25: Anaplastisches Astrozytom. Fibrilläre Variante mit deutlich erhöhter Zelldichte und Mitoserate. Hund, Nr. 8 H.E.-Färbung, Balken = 100µm 138
153 Ergebnisse Abb. 4.26: Glioblastoma multiforme mit Tumor-gewebsnekrose (Stern) und typischen Pseudopalisaden (Pfeile) Hund, Nr. 15 HE-Färbung, Balken = 100µm Abb. 4.27: Fibrilläres Astrozytom mit starker, homogener GFAP-Expression in den Tumorzellen. Hund, Nr. 3 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.28: Anaplastisches Astrozytom mit geringerer GFAP-Expression im Zytoplasma und den Zellfortsätzen der Zellen. Hund, Nr. 8 Nomarski-Beleuchtung, Balken = 50µm 139
154 Ergebnisse Abb. 4.29: Glioblastoma multiforme. Starke NSE-Expression in den Pseudopalisaden-bildenden Zellen (Pfeile) um die Nekrose (Stern). Katze, Nr. 15 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.30: Oligodedrogliom. Kapillarreicher (Pfeilspitzen) Tumor mit uniformen, neoplastischen Zellen und typischer Honigwabenarchitektur (Pfeile). Hund, Nr. 27 H.E.-Färbung, Balken = 100µm Abb. 4.31: Anaplastisches Oligodendrogliom mit erhöhter Zelldichte und nukleärer Pleomorphie. Hund, Nr. 39 Nomarski-Beleuchtung, Balken = 100µm 140
155 Ergebnisse Abb Oligodendrogliom (Stern) mit negativer GFAP-Expression in den Tumorzellen und angrenzendem Neuroparenchym (N) mit GFAP-positiven Astrozyten. Einige wenige GFAPpositive Zellen innerhalb des Tumorgewebes wurden als reaktive Astrozyten interpretiert (Pfeilspitzen). Hund, Nr. 37 Nomarski-Beleuchtung, Balken = 200µm Abb. 4.33: Oligodendrogliom. Von- Willebrand-Faktor-Expression in den glomeruloiden Gefäßproliferationen (Pfeile). Hund, Nr. 25 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.34: Anaplastisches Oligodendrogliom. Einzelne Tumorzellen mit kappenähnlicher, perinukleärer GFAP-Markierung (Pfeile), die als Minigemistozyten interpretiert worden sind. Hund, Nr. 43 Nomarski-Beleuchtung, Balken = 20µm 141
156 Ergebnisse Abb. 4.35: Anaplastisches Oligodendrogliom. GFAP-positive Tumorzellen mit oligodedroglialer Morphologie (Pfeile), die als gliofibrilläre Oligodendrozyten interpretiert worden sind. Hund, Nr. 43 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.36: Anaplastisches Oligodendrogliom mit GFAP-positiven, sternförmigen Zellen (Pfeile), die als reaktive Astrozyten interpretiert worden sind. Katze, Nr. 41 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.37: Klarzelliges Ependymom mit Oligodendrogliom-ähnlicher Struktur. Hund, Nr. 50 H.E.-Färbung, Balken = 100µm 142
157 Ergebnisse Abb. 4.38: Ependymom. Mäßig zellreicher Tumor mit typischer Rosettenbildung (Pfeile). Katze, Nr. 48 H.E.-Färbung, Balken = 100µm Abb. 4.39: Ependymom eines Hundes mit weniger deutlich ausgeprägten Pseudorosetten (Pfeile). Hund, Nr. 47 H.E.-Färbung, Balken = 50µm Abb. 4.40: Anaplastisches Ependymom mit Pseudorosetten (Pfeile) und mittelgradig polymorphen Zellen. Hund, Nr. 52 H.E.-Färbung, Balken = 50µm 143
158 Ergebnisse Abb. 4.41: Ependymom mit perivaskulär akzentuierter, feinfibrillärer GFAP- Markierung (Pfeil). Hund, Nr. 47 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.42: Anaplastisches Ependymom mit rosettenbezogener GFAP- Expression. Katze, Nr. 51 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.43: Anaplastisches Ependymom mit intensiver Vimentin- Markierung. Katze, Nr. 51 Nomarski-Beleuchtung, Balken = 50µm 144
159 Ergebnisse Abb. 4.44: Choroid-Plexuspapillom mit dem typischen, blumenkohlartigen Wachstum auf einem fibro-vaskulären Grundstock. Hund, Nr. 61 H.E.-Färbung, Balken = 200µm Abb. 4.45: Choroid-Plexuspapillom mit dem typischen, blumenkohlartigen Wachstum auf einem fibro-vaskulären Grundstock. Hund, Nr. 61 (stärkere Vergrößerung von Abb an anderer Stelle) H.E.-Färbung, Balken = 100µm Abb. 4.46: Choroid-Plexuskarzinom mit erhöhter Zellpleomorphie und teilweise mehrreihigem Epithel (Pfeile). Hund, Nr. 68 H.E.-Färbung, Balken = 100µm 145
160 Ergebnisse Abb. 4.47: Choroid-Plexuskarzinom mit erhöhter Zellpleomorphie und teilweise mehrreihigem Epithel. Hund, Nr. 68 (stärkere Vergrößerung von Abb. 4.46) H.E.-Färbung, Balken = 50µm Abb. 4.48: Choroid-Plexuspapillom. Immunreaktivität mit dem Zytokeratin- Antikörper AE1/AE3. Hund, Nr. 55 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.49: Choroid-Plexuskarzinom mit Vimentin-Expression. Hund, Nr. 68 Nomarski-Beleuchtung, Balken = 50µm 146
161 Ergebnisse Abb. 4.50: Medulloblastom. Zellreicher Tumor mit gefäßassoziiert angeordneten Zellen. Hund, Nr. 70 H.E.-Färbung, Balken = 200µm Abb. 4.51: Medulloblastom. Zellreicher Tumor mit polygonalen, teilweise in Reihen angeordneten Zellen (Pfeile) und angedeuteten Rosetten (Pfeilspitzen). Hund, Nr. 70 (stärkere Vergrößerung von Abb. 4.50) H.E.-Färbung, Balken = 50µm Abb. 4.52: Medulloblastom mit Synaptophysin-Expression in den Tumorzellen Hund, Nr. 70 HE-Färbung, Balken = 50µm 147
162 Ergebnisse Abb. 4.53: Intraspinales Nephroblastom. Biphasischer Tumor bestehend aus epithelialen Zellen in Tubulusformation (Pfeilspitzen) und glomeruloiden Strukturen (Pfeil) sowie dazwischen liegenden spindelförmigen Zellen. Hund, Nr. 73 HE-Färbung, Balken = 200µm Abb. 4.54: Intraspinales Nephroblastom. Intensive Immunreaktion mit dem Zytokeratin-Antikörper AE1/AE3 in den epithelialen Tubusformationen. Hund, Nr. 73 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.55: Meningotheliomatöses Meningeom mit in Inseln angeordneten Zellen und multifokaler Wirbelbildung ( whorls ). Hund, Nr. 76 H.E.-Färbung, Balken = 200µm 148
163 Ergebnisse Abb. 4.56: Meningotheliomatöses Meningeom mit in Inseln angeordneten Zellen und multifokaler Wirbelbildung ( whorls ). Hund, Nr. 76 (stärkere Vergrößerung von Abb. 4.50) H.E.-Färbung, Balken = 100µm Abb. 4.57: Fibröses Meningeom mit in Strängen angeordneten, spindelförmigen Zellen. Hund, Nr. 80 H.E.-Färbung, Balken = 200µm Abb. 4.58: Fibröses Meningeom mit in Strängen angeordneten, spindelförmigen Zellen Hund, Nr. 80 (stärkere Vergrößerung von Abb. 4.57) H.E.-Färbung, Balken = 100µm 149
164 Ergebnisse Abb. 4.59: Transitionelles/ Granularzelliges Meningeom. Areale mit großen, runden bis polygonalen Zellen mit feingranulärem Zytoplasma (Pfeile) in einem überwiegend transitionellem Meningeom. Hund, Nr. 93 H.E.-Färbung, Balken = 32µm Abb. 4.60: Transitionelles Meningeom mit meningothelialen und fibrösen Anteilen. Katze, Nr. 84 H.E.-Färbung, Balken = 200µm Abb. 4.61: Psammomatöses Meningeom mit zahlreichen Psammomkörperchen. Hund, Nr. 94 H.E.-Färbung, Balken = 50µm 150
165 Ergebnisse Abb. 4.62: Angiomatöses Meningeom mit zahlreichen Gefäßanschnitten. Hund, Nr. 98 H.E.-Färbung, Balken = 50µm Abb. 4.63: Meningotheliomatöses Meningeom. Mäßig intensive Markierung mit dem Zytokeratin-Antikörper AE1/AE3 (Pfeile). Hund, Nr. 77 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.64: Transitionelles Meningeom mit intensiver Vimentin-Expression vorwiegend in den whorls. Katze, Nr. 84 Nomarski-Beleuchtung, Balken = 100µm 151
166 Ergebnisse Abb. 4.65: Transitionelles Meningeom mit intensiver Vimentin-Expression. Katze, Nr. 89 Nomarski-Beleuchtung, Balken = 200µm Abb. 4.66: Transitionelles Meningeom mit mäßig intensiver CEA-Expression in einzelnen Tumorzellen. Katze, Nr. 89 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.67: Lymphom mit monomorpher Zellpopulation. Katze, Nr. 103 H.-E.-Färbung, Balken = 100µm 152
167 Ergebnisse Abb. 4.68: Lymphom mit CD3- positiven Tumorzellen. Katze, Nr. 103 Nomarski-Beleuchtung, Balken = 50µm Abb. 4.69: Non-B, Non-T leukozytärer Tumor mit perivaskulärer Anordnung (Pfeile) der relativ uniformen Tumorzellen. Hund, Nr. 105 H.E-Färbung, Balken = 100µm Abb. 4.70: Non-B, Non-T leukozytärer Tumor mit perivaskulärer Anordnung der relativ uniformen Tumorzellen. Hund, Nr. 105 (stärkere Vergrößerung von Abb. 4.69) H.E-Färbung, Balken = 100µm 153
168 Ergebnisse Abb. 4.71: Mikrogliomatose mit teilweise parallel angeordneten hyperchromatischen Kernen. Hund, Nr. 106 H.E.-Färbung, Balken = 50µm Abb. 4.72: Maligne Histiozytose bestehend aus pleomorphen, histiozytären Zellen. Hund, Nr. 108 H.E.-Färbung, Balken = 50µm Abb. 4.73: Suprasellärer Keimzelltumor mit germinativen Zellen (Raute) und hepatoiden Zellen (Stern). Hund, Nr. 111 H.E.-Färbung, Balken = 50µm 154
169 Ergebnisse Abb. 4.74: Suprasellärer Keimzelltumor mit intensiver -FetoproteinExpression. Hund, Nr. 111 Nomarski-Beleuchtung, Balken = 100µm Abb. 4.75: Zelluläres Schwannom mit spindelförmigen Zellen und Antoni-ABereichen. Hund, Nr. 113 H.E.-Färbung, Balken = 50µm Abb. 4.76: Zelluläres Schwannom mit einer diffusen, ztoplasmatischen GFAP-Expression. Hund, Nr. 113 Nomarski-Beleuchtung, Balken = 100µm 155
Tumor des Zentralen Nervensystems (ZNS) (1)
 Tumor des Zentralen Nervensystems (ZNS) (1) Epidemiologie: Die Inzidenz bösartiger ZNS-Tumoren in Deutschland wird auf etwa 6 Neuerkrankungen pro 100 000 Einwohner pro Jahr geschätzt. Risikofaktoren: genetische
Tumor des Zentralen Nervensystems (ZNS) (1) Epidemiologie: Die Inzidenz bösartiger ZNS-Tumoren in Deutschland wird auf etwa 6 Neuerkrankungen pro 100 000 Einwohner pro Jahr geschätzt. Risikofaktoren: genetische
Pathologie des Nervensystems IV
 Pathologie des Nervensystems IV Spezielle Immunmorphologie neurogener Geschwülste Von K. Schwechheimer Mit 53 zum Teil farbigen Abbildungen in 227 Einzeldarstellungen ' Springer-Verlag Berlin Heidelberg
Pathologie des Nervensystems IV Spezielle Immunmorphologie neurogener Geschwülste Von K. Schwechheimer Mit 53 zum Teil farbigen Abbildungen in 227 Einzeldarstellungen ' Springer-Verlag Berlin Heidelberg
Tumor-Pathologie allgemeine
 Tumor-Pathologie allgemeine Systematisches Vorgehen bei der Diagnostik (1): Tumoren werden beurteilt anhand folgender Ebenen: - Gewebe-Ebene - Zell-Ebene - Klinisches Verhalten Systematisches Vorgehen
Tumor-Pathologie allgemeine Systematisches Vorgehen bei der Diagnostik (1): Tumoren werden beurteilt anhand folgender Ebenen: - Gewebe-Ebene - Zell-Ebene - Klinisches Verhalten Systematisches Vorgehen
Prognostisch wichtige Faktoren: Histologie. Lokalisation Ausdehnung/Infiltration
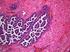 Hirntumoren Prognostisch wichtige Faktoren: Histologie Malignitätsgrad Lokalisation Ausdehnung/Infiltration Die aktuelle WHO- Klassifikation der Tumoren des Nervensystem (von 2000): ca. 120 verschiedene
Hirntumoren Prognostisch wichtige Faktoren: Histologie Malignitätsgrad Lokalisation Ausdehnung/Infiltration Die aktuelle WHO- Klassifikation der Tumoren des Nervensystem (von 2000): ca. 120 verschiedene
Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II)
 Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II) (Dieses Skript ersetzt auf keinen Fall die Vorlesungen und dient lediglich zur Vorbereitung des Kurses und als Erinnerungshilfe
Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II) (Dieses Skript ersetzt auf keinen Fall die Vorlesungen und dient lediglich zur Vorbereitung des Kurses und als Erinnerungshilfe
Neuropathologie glialer Hirntumoren
 CURRICULUM Schweiz Med Forum Nr. 29/30 24. Juli 2002 698 Neuropathologie glialer Hirntumoren M. Tolnay Klassifikation und Gradierung Gliome sind pathomorphologisch als Tumoren definiert, die aufgrund ihrer
CURRICULUM Schweiz Med Forum Nr. 29/30 24. Juli 2002 698 Neuropathologie glialer Hirntumoren M. Tolnay Klassifikation und Gradierung Gliome sind pathomorphologisch als Tumoren definiert, die aufgrund ihrer
Hirntumore. Extrazerebrale Tumore. Welche Informationen sind für die Diagnose wichtig? Extra- oder intrazerebral multiplanares MRT.
 Hirntumore Welche Informationen sind für die Diagnose wichtig? Extra- oder intrazerebral multiplanares MRT Patientenalter Symptombeginn, maligne Grunderkrankung Infra- oder supratentoriell umschrieben,
Hirntumore Welche Informationen sind für die Diagnose wichtig? Extra- oder intrazerebral multiplanares MRT Patientenalter Symptombeginn, maligne Grunderkrankung Infra- oder supratentoriell umschrieben,
Modul Onkologie. Interdisziplinäre Therapie der Hirntumore. Priv. Doz. Dr. med. H. C. Ludwig
 Modul Onkologie Interdisziplinäre Therapie der Hirntumore Priv. Doz. Dr. med. H. C. Ludwig Neurochirurgische Klinik und Poliklinik Direktor: Prof. Dr. med. M. Buchfelder Hirntumore 20 % aller Todesfälle
Modul Onkologie Interdisziplinäre Therapie der Hirntumore Priv. Doz. Dr. med. H. C. Ludwig Neurochirurgische Klinik und Poliklinik Direktor: Prof. Dr. med. M. Buchfelder Hirntumore 20 % aller Todesfälle
Histopathologie. Fall 30
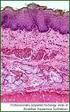 Histopathologie Fall 30 Präp.-Nr.: 30 Färbung: HE Organ: Knochen Tierart: Hund Allgemeines (1): Osteosarkome kommen in unterschiedlichen Lokalisationen vor Axiales Skelett: - Wirbelsäule - Rippen - Brustbein
Histopathologie Fall 30 Präp.-Nr.: 30 Färbung: HE Organ: Knochen Tierart: Hund Allgemeines (1): Osteosarkome kommen in unterschiedlichen Lokalisationen vor Axiales Skelett: - Wirbelsäule - Rippen - Brustbein
Im Fokus: F. Primäre Hirntumoren bei Erwachsenen: Gliome PAUL KLEIHUES ONKOLOGIE 5/2007 5
 Klassifikation, Grading und genetisches Profil der Gliome Astrozytome und Oligodendrogliome Das Glioblastom bleibt mit 70% aller Gliom-Diagnosen häufigster Hirntumortyp mit noch immer sehr ungünstiger
Klassifikation, Grading und genetisches Profil der Gliome Astrozytome und Oligodendrogliome Das Glioblastom bleibt mit 70% aller Gliom-Diagnosen häufigster Hirntumortyp mit noch immer sehr ungünstiger
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Gliederung. Diagnostik Therapie/Behandlung
 Gliome Gliederung Allgemeine Fakten Gliazellen Gliom-Was ist das? Astrozytome Glioblastoma multiforma Oligodendrogliom Ependymom Diagnostik Therapie/Behandlung Allgemeine Fakten Hirntumore in den Gliazellen
Gliome Gliederung Allgemeine Fakten Gliazellen Gliom-Was ist das? Astrozytome Glioblastoma multiforma Oligodendrogliom Ependymom Diagnostik Therapie/Behandlung Allgemeine Fakten Hirntumore in den Gliazellen
12. Gemeinsame Jahrestagung, September, Radebeul. Sächsische Radiologische Gesellschaft,
 12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
Lymphomen. Bernhard Opitz Zytologiekurs KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE)
 Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Spezielle Pathologie des Atmungstraktes. 13. Teil
 Spezielle Pathologie des Atmungstraktes 13. Teil 7. Staublungen-Erkrankungen Pneumokoniosen Anthrakose Allgemeines (1): - Partikel bleiben je nach ihrer Größe im Atmungstrakt hängen - Nasenhöhle > 5 μm
Spezielle Pathologie des Atmungstraktes 13. Teil 7. Staublungen-Erkrankungen Pneumokoniosen Anthrakose Allgemeines (1): - Partikel bleiben je nach ihrer Größe im Atmungstrakt hängen - Nasenhöhle > 5 μm
Primäre intrakranielle und spinale Tumoren ISBN
 W. Wick, J.C. Tonn, M. Weller Primäre intrakranielle und spinale Tumoren ISBN 978-3-17-024557-0 Kapitel H1 aus T. Brandt, H.C. Diener, C. Gerloff (Hrsg.) Therapie und Verlauf neurologischer Erkrankungen
W. Wick, J.C. Tonn, M. Weller Primäre intrakranielle und spinale Tumoren ISBN 978-3-17-024557-0 Kapitel H1 aus T. Brandt, H.C. Diener, C. Gerloff (Hrsg.) Therapie und Verlauf neurologischer Erkrankungen
Vorlesung Interdisziplinäre Onkologie Hirntumore bei Erwachsenen
 Vorlesung Interdisziplinäre Onkologie Hirntumore bei Erwachsenen Abteilung für Neuroradiologie Universität Würzburg Standardverfahren Konventionelle Röntgenaufnahme nur zur präoperativen Beurteilung des
Vorlesung Interdisziplinäre Onkologie Hirntumore bei Erwachsenen Abteilung für Neuroradiologie Universität Würzburg Standardverfahren Konventionelle Röntgenaufnahme nur zur präoperativen Beurteilung des
Die WHO-Klassifikation der Tumoren des Nervensystems
 MANUAL Hirntumoren und spinale Tumoren 1 2016 by Tumorzentrum München und W. Zuckschwerdt Verlag München WHO-Klassifikation der Tumoren des Nervensystems J. Schlegel, J. Herms, U. Schüller Abstrakt Die
MANUAL Hirntumoren und spinale Tumoren 1 2016 by Tumorzentrum München und W. Zuckschwerdt Verlag München WHO-Klassifikation der Tumoren des Nervensystems J. Schlegel, J. Herms, U. Schüller Abstrakt Die
Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen. Betreuer: Prof. Dr. M. Reinacher
 Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. M. Reinacher Untersuchungen zur Klassifikation maligner Lymphome sowie zur differentiellen Expression
Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. M. Reinacher Untersuchungen zur Klassifikation maligner Lymphome sowie zur differentiellen Expression
Zytologie der Speicheldrüsen
 Zytologie der Speicheldrüsen 25. Tagung für klinische Zytologie 2017 Konstanz Dr. med. René Schönegg Institut für Pathologie Zytopathologie Häufigkeit der Neoplasien benigne pleom. Adenom: 60-70% Warthin-Tumor:
Zytologie der Speicheldrüsen 25. Tagung für klinische Zytologie 2017 Konstanz Dr. med. René Schönegg Institut für Pathologie Zytopathologie Häufigkeit der Neoplasien benigne pleom. Adenom: 60-70% Warthin-Tumor:
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Ergebnisse Immunhistochemie
 3.2.2.6 Immunhistochemie Zum Nachweis von Mikrometasasen wurden Antikörper gegen humanes Zytokeratin verwendet. Da alle implantierten Tumorgewebe epithelialen Ursprungs waren, konnte dieser Marker bei
3.2.2.6 Immunhistochemie Zum Nachweis von Mikrometasasen wurden Antikörper gegen humanes Zytokeratin verwendet. Da alle implantierten Tumorgewebe epithelialen Ursprungs waren, konnte dieser Marker bei
Eosinophilie. Zytologie. Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV
 Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome
 3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
Primäre Hirntumoren (maligne) Tumoren der Meningen (benigne und maligne) Tumoren des Rückenmarks Primär maligne Lymphome des ZNS Tumoren von
 Primäre Hirntumoren (maligne) Tumoren der Meningen (benigne und maligne) Tumoren des Rückenmarks Primär maligne Lymphome des ZNS Tumoren von Hirnnerven (benigne) sekundäre Hirntumoren (Metastasen) Tumoren
Primäre Hirntumoren (maligne) Tumoren der Meningen (benigne und maligne) Tumoren des Rückenmarks Primär maligne Lymphome des ZNS Tumoren von Hirnnerven (benigne) sekundäre Hirntumoren (Metastasen) Tumoren
Immunhistochemische Studie von Hirntumorgewebe mit spezifischen Antikörpern gegen GFAP, MAP 2, NOGO A, OLIG 2 und WT 1
 Aus dem Department für Diagnostische Labormedizin der Universität Tübingen Institut für Pathologie und Neuropathologie Abteilung Neuropathologie Immunhistochemische Studie von Hirntumorgewebe mit spezifischen
Aus dem Department für Diagnostische Labormedizin der Universität Tübingen Institut für Pathologie und Neuropathologie Abteilung Neuropathologie Immunhistochemische Studie von Hirntumorgewebe mit spezifischen
Vielfalt von Auswirkungen der exokrinen Pankreasinsuffizienz mehr als nur eine Steatorrhoe!
 Institut für Tierernährung Tierärztliche Hochschule Hannover Vielfalt von Auswirkungen der exokrinen Pankreasinsuffizienz mehr als nur eine Steatorrhoe! Neue Erkenntnisse aus Studien am Modelltier Pankreasgang-ligiertes
Institut für Tierernährung Tierärztliche Hochschule Hannover Vielfalt von Auswirkungen der exokrinen Pankreasinsuffizienz mehr als nur eine Steatorrhoe! Neue Erkenntnisse aus Studien am Modelltier Pankreasgang-ligiertes
Hirntumore - Was taugen MRT- Bilder und radiologische Befunde?
 Hirntumore - Was taugen MRT- Bilder und radiologische Befunde? G.Schuierer Zentrum Neuroradiologie des Universitätsklinikums und des Bezirksklinikums Regensburg Hirntumore - Was taugen MRT- Bilder und
Hirntumore - Was taugen MRT- Bilder und radiologische Befunde? G.Schuierer Zentrum Neuroradiologie des Universitätsklinikums und des Bezirksklinikums Regensburg Hirntumore - Was taugen MRT- Bilder und
Krebs bei Kindern Leukämien
 Krebs bei Kindern Krebserkrankungen im Kindesalter werden seit 19 in den alten Bundesländern und seit 1991 auch in den neuen Bundesländern systematisch im bundesweiten Deutschen Kinderkrebsregister an
Krebs bei Kindern Krebserkrankungen im Kindesalter werden seit 19 in den alten Bundesländern und seit 1991 auch in den neuen Bundesländern systematisch im bundesweiten Deutschen Kinderkrebsregister an
Sachregister. Auf die Abbildungen wird in kursiver Schrift verwiesen.
 131 Sachregister Auf die Abbildungen wird in kursiver Schrift verwiesen. A Abrissmetastasen 60, 77, 81 Abtropfmetastasen 60, 77, 81 Adenokarzinome Bronchien 107 f Cervix/Uterus 103 f Colon 101 f Gallenblasen
131 Sachregister Auf die Abbildungen wird in kursiver Schrift verwiesen. A Abrissmetastasen 60, 77, 81 Abtropfmetastasen 60, 77, 81 Adenokarzinome Bronchien 107 f Cervix/Uterus 103 f Colon 101 f Gallenblasen
Schädel-Hirn-Trauma. Univ. Prof. Dr. Eduard Auff
 Schädel-Hirn-Trauma Univ. Prof. Dr. Eduard Auff Schädel-Hirn-Trauma Inzidenz Ca. 8.000/1,000.000 EW pro Jahr Hohe Mortalität (ca. 20%) Schädel-Hirn-Trauma Phasen 1. Primäre Verletzung Abhängig von unmittelbarer
Schädel-Hirn-Trauma Univ. Prof. Dr. Eduard Auff Schädel-Hirn-Trauma Inzidenz Ca. 8.000/1,000.000 EW pro Jahr Hohe Mortalität (ca. 20%) Schädel-Hirn-Trauma Phasen 1. Primäre Verletzung Abhängig von unmittelbarer
Gliederung der Unterrichtseinheit. Charakteristika benignen und malignen Wachstums Metastasierung
 Neoplasie Gliederung der Unterrichtseinheit Definitionen und Nomenklatur Charakteristika benignen und malignen Wachstums Metastasierung Theorien der Krebsentstehung Definition der Neoplasie Neoplasie:
Neoplasie Gliederung der Unterrichtseinheit Definitionen und Nomenklatur Charakteristika benignen und malignen Wachstums Metastasierung Theorien der Krebsentstehung Definition der Neoplasie Neoplasie:
Zentrales Nervensystem (ZNS)
 Kurstag 8 Zentrales Nervensystem (ZNS) Themen Großhirn Mittelhirn Dopaminerge Nervenzellen Kleinhirn Lernziele Prüfungsrelevante Lerninhalte ZNS: (Übergeordnete Gliederung und allgemeine Begriffe: ZNS/PNS,
Kurstag 8 Zentrales Nervensystem (ZNS) Themen Großhirn Mittelhirn Dopaminerge Nervenzellen Kleinhirn Lernziele Prüfungsrelevante Lerninhalte ZNS: (Übergeordnete Gliederung und allgemeine Begriffe: ZNS/PNS,
5.4 Lymphknotenzytologie
 Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Expression und Funktion. von Neurotransmitterrezeptoren auf Astrozyten im intakten. Hirngewebe der Maus
 Expression und Funktion von Neurotransmitterrezeptoren auf Astrozyten im intakten Hirngewebe der Maus Dissertation zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) von Dipl.-Biochem.
Expression und Funktion von Neurotransmitterrezeptoren auf Astrozyten im intakten Hirngewebe der Maus Dissertation zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) von Dipl.-Biochem.
Bau des Nervengewebes
 Bau des Nervengewebes Das Nervengewebe hat eine zelluläre Gliederung und wird prinzipiell in die erregbaren Neuronen und die nicht erregbaren Zellen der Neuroglia unterteilt. Das Nervengewebe organisiert
Bau des Nervengewebes Das Nervengewebe hat eine zelluläre Gliederung und wird prinzipiell in die erregbaren Neuronen und die nicht erregbaren Zellen der Neuroglia unterteilt. Das Nervengewebe organisiert
Plattenepithelkarzinom
 Hallesches Seminar Klinische Zytologie in der Pneumologie, Grundlagenkurs Teil II Plattenepithelkarzinom 31.Mai 01. Juni 2013, Halle KRANKENHAUS ST. ELISABETH & ST. BARBARA L. Welker Zytologisches Labor
Hallesches Seminar Klinische Zytologie in der Pneumologie, Grundlagenkurs Teil II Plattenepithelkarzinom 31.Mai 01. Juni 2013, Halle KRANKENHAUS ST. ELISABETH & ST. BARBARA L. Welker Zytologisches Labor
Zahl der weiblichen und männlichen Neuerkrankungsfällen mit einem bösartigen. männliche und weibliche Erkrankungsfallzahlen
 3. Ergebnisse 3.1. Patientengut Von den 95 Erkrankungsfällen mit einem bösartigen intrakraniellen Tumor des ZNS im Alter zwischen 0 bis
3. Ergebnisse 3.1. Patientengut Von den 95 Erkrankungsfällen mit einem bösartigen intrakraniellen Tumor des ZNS im Alter zwischen 0 bis
Gießener Kleintierabend Lymphknotenzytologie
 Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Kopf-Hals-Pathologie Teil II
 Kopf-Hals-Pathologie Teil II Kieferpathologie - neoplastisch PathoBasic 29.04.14 Daniel Baumhoer Pathologie Odontogenes Epithel mit reifem fibrösen Stroma Ameloblastom Plattenepithelialer odontogener Tumor
Kopf-Hals-Pathologie Teil II Kieferpathologie - neoplastisch PathoBasic 29.04.14 Daniel Baumhoer Pathologie Odontogenes Epithel mit reifem fibrösen Stroma Ameloblastom Plattenepithelialer odontogener Tumor
Einleitung zur Pathologie des ZNS
 Einleitung zur Pathologie des ZNS Gehirn von dieser Ansicht ausgehend ein Querschnitt durch das Gehirn >> nächste Folie Pferd, Gehirn, aus: Ellenberger, Baum (1908) Gehirn die wichtigsten Anteile Pferd,
Einleitung zur Pathologie des ZNS Gehirn von dieser Ansicht ausgehend ein Querschnitt durch das Gehirn >> nächste Folie Pferd, Gehirn, aus: Ellenberger, Baum (1908) Gehirn die wichtigsten Anteile Pferd,
Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET)
 Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET) Andrea Tannapfel Institut für Pathologie Ruhr-Universität Bochum Andrea.Tannapfel@rub.de Neuroendokrine Tumoren (NET)
Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET) Andrea Tannapfel Institut für Pathologie Ruhr-Universität Bochum Andrea.Tannapfel@rub.de Neuroendokrine Tumoren (NET)
Krebs - was kann ich tun?
 Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
GEHIRN UND ZENTRALES NERVENSYSTEM (C70-C72)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
Zelltypen des Nervensystems
 Zelltypen des Nervensystems Im Gehirn eines erwachsenen Menschen: Neurone etwa 1-2. 10 10 Glia: Astrozyten (ca. 10x) Oligodendrozyten Mikrogliazellen Makrophagen Ependymzellen Nervenzellen Funktion: Informationsaustausch.
Zelltypen des Nervensystems Im Gehirn eines erwachsenen Menschen: Neurone etwa 1-2. 10 10 Glia: Astrozyten (ca. 10x) Oligodendrozyten Mikrogliazellen Makrophagen Ependymzellen Nervenzellen Funktion: Informationsaustausch.
Am RPTC Bisher behandelte Tumoren
 Astrozytäre Tumoren niedriger Malignitätsgrad Anaplastisch* Glioblastom* Oligodendriogliome niedriger Malignitätsgrad Anaplastisch* Ependymale Tumoren niedriger Malignitätsgrad Anaplastisch ZNS-Tumoren
Astrozytäre Tumoren niedriger Malignitätsgrad Anaplastisch* Glioblastom* Oligodendriogliome niedriger Malignitätsgrad Anaplastisch* Ependymale Tumoren niedriger Malignitätsgrad Anaplastisch ZNS-Tumoren
Vorwort. TAKO - Neuroonkologie
 Vorwort Der Aufgabenbereich Neuroonkologie umfaßt die Diagnostik und Therapie primärer Hirn- und Rückenmarkstumoren, sowie metastatischer und nicht-metastatischer neurologischer Komplikationen extracerebraler
Vorwort Der Aufgabenbereich Neuroonkologie umfaßt die Diagnostik und Therapie primärer Hirn- und Rückenmarkstumoren, sowie metastatischer und nicht-metastatischer neurologischer Komplikationen extracerebraler
Thomas G. Wendt. Universitäts- Klinikum Jena
 Thomas G. Wendt 1. Meningeom 2. Hypophysenadenom, Craniopharyngeom 3. Akusticusneurinom = Vestibularisschwannom Diagnostik: Größe und Lage des Tumors sowie Beziehung zu Nachbarorganen: MRT, in Einzelfällen
Thomas G. Wendt 1. Meningeom 2. Hypophysenadenom, Craniopharyngeom 3. Akusticusneurinom = Vestibularisschwannom Diagnostik: Größe und Lage des Tumors sowie Beziehung zu Nachbarorganen: MRT, in Einzelfällen
Zytologie der Malignen Lymphome
 Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Aus der Kinderklinik und Poliklinik der Universität Würzburg Direktor: Professor Dr. med. Christian P. Speer
 Aus der Kinderklinik und Poliklinik der Universität Würzburg Direktor: Professor Dr. med. Christian P. Speer Zytologie von Hirntumoren in der Pädiatrie Inaugural-Dissertation zur Erlangung der Doktorwürde
Aus der Kinderklinik und Poliklinik der Universität Würzburg Direktor: Professor Dr. med. Christian P. Speer Zytologie von Hirntumoren in der Pädiatrie Inaugural-Dissertation zur Erlangung der Doktorwürde
3.1 Ergebnisse des endoskopischen Screenings. Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals-
 32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
Kooperative multizentrische Studie für Kinder und Jugendliche mit einem Gliom niedrigen Malignitätsgrades
 1 von 5 15.12.2010 14:38» Home» Fachinformationen» Studien-Portal» Studien und Register der GPOH» SIOP-LGG 2004 Autor: Dr. med. Astrid Gnekow, erstellt 13.08.2003, Zuletzt geändert: 16.08.2010 Titel Erkrankung,
1 von 5 15.12.2010 14:38» Home» Fachinformationen» Studien-Portal» Studien und Register der GPOH» SIOP-LGG 2004 Autor: Dr. med. Astrid Gnekow, erstellt 13.08.2003, Zuletzt geändert: 16.08.2010 Titel Erkrankung,
3 ERGEBNISSE 19. Altersverteilung des gesamten Patientenkollektives Altersgruppen in Jahren
 3 ERGEBNISSE 9 3. ERGEBNISSE 3. Allgemeine Aussagen 3.. Alter 54 Patienten konnten in die Auswertung aufgenommen werden. Das mittlere Alter des gesamten Patientengutes lag zum Zeitpunkt der Diagnosestellung
3 ERGEBNISSE 9 3. ERGEBNISSE 3. Allgemeine Aussagen 3.. Alter 54 Patienten konnten in die Auswertung aufgenommen werden. Das mittlere Alter des gesamten Patientengutes lag zum Zeitpunkt der Diagnosestellung
Inhaltsverzeichnis. Das Gehirn des Kindes
 Das Gehirn des Kindes 1 Embryologische Entwicklung des Gehirns... 3 1.1 FrüheEntwicklungdeszentralenNervensystems... 3 1.2 EntwicklungdesGehirns... 3 1.2.1 Telenzephalon... 4 1.2.2 Dienzephalon... 7 1.2.3
Das Gehirn des Kindes 1 Embryologische Entwicklung des Gehirns... 3 1.1 FrüheEntwicklungdeszentralenNervensystems... 3 1.2 EntwicklungdesGehirns... 3 1.2.1 Telenzephalon... 4 1.2.2 Dienzephalon... 7 1.2.3
Krebs bei Kindern Leukämien ZNS-Tumoren
 Am Deutschen Kinderkrebsregister werden seit 1980 (seit 1991 auch aus den neuen Bundesländern) alle bei unter 15-Jährigen auftretende maligne Krebserkrankungen sowie histologisch gutartige Hirntumoren
Am Deutschen Kinderkrebsregister werden seit 1980 (seit 1991 auch aus den neuen Bundesländern) alle bei unter 15-Jährigen auftretende maligne Krebserkrankungen sowie histologisch gutartige Hirntumoren
D D D Bestimmung des Zytokeratinprofils
 54 D D D D Abb. 17: Defekte Desmosomen, die zwei atypische Keratinozyten miteinander verbinden. Durch fehlende interzelluläre Zytokeratinverbindungen im Bereich der Desmosomen dense lines (D) erscheint
54 D D D D Abb. 17: Defekte Desmosomen, die zwei atypische Keratinozyten miteinander verbinden. Durch fehlende interzelluläre Zytokeratinverbindungen im Bereich der Desmosomen dense lines (D) erscheint
Lungenkarzinome- ein Vorschlag für die zytologische Klassifikation
 Hier Ihr gewünschtes Bilder einfügen und auf Format des grauen Bereiches beschneiden wie folgt: 1. Bild anklicken und auf gewünschte Größe skalieren 2. dann oben rechts im Menü, Format auswählen 3. dann
Hier Ihr gewünschtes Bilder einfügen und auf Format des grauen Bereiches beschneiden wie folgt: 1. Bild anklicken und auf gewünschte Größe skalieren 2. dann oben rechts im Menü, Format auswählen 3. dann
Symptomatik bei Hirntumoren
 Symptomatik bei Hirntumoren fokal-neurologische Defizite sensomotorische Hemiparese, Hemianopsie Hirndrucksymptome Kopfschmerzen, Übelkeit/Erbrechen organisches Psychosyndrom Verlangsamung, reduzierte
Symptomatik bei Hirntumoren fokal-neurologische Defizite sensomotorische Hemiparese, Hemianopsie Hirndrucksymptome Kopfschmerzen, Übelkeit/Erbrechen organisches Psychosyndrom Verlangsamung, reduzierte
Etablierung, Validierung und praktische Anwendung einer multiplex real-time RT-PCR zum Nachweis des Rabbit Haemorrhagic Disease Virus
 Aus dem Institut für Virologie der Tierärztlichen Hochschule Hannover und dem Institut für Virusdiagnostik des Friedrich-Loeffler-Instituts, Insel Riems Etablierung, Validierung und praktische Anwendung
Aus dem Institut für Virologie der Tierärztlichen Hochschule Hannover und dem Institut für Virusdiagnostik des Friedrich-Loeffler-Instituts, Insel Riems Etablierung, Validierung und praktische Anwendung
Klinikum Veterinärmedizin Klinik für Kleintiere - Chirurgie der Justus-Liebig-Universität Gießen. Bildgebung Prostata
 Klinikum Veterinärmedizin Klinik für Kleintiere - Chirurgie der Justus-Liebig-Universität Gießen Bildgebung Prostata Sebastian Schaub Res. ECVDI, FTA Klein- und Heimtiere Dr. K. Amort, Dr. N. Ondreka,
Klinikum Veterinärmedizin Klinik für Kleintiere - Chirurgie der Justus-Liebig-Universität Gießen Bildgebung Prostata Sebastian Schaub Res. ECVDI, FTA Klein- und Heimtiere Dr. K. Amort, Dr. N. Ondreka,
Neuroradiologie. Zerebrale Tumoren
 Neuroradiologie Zerebrale Tumoren Zerebrale Tumoren Untersuchungsmodalitäten/-technik Allgemeine Regeln zur Beurteilung Hirntumore im einzelnen Untersuchungsmethoden Computertomographie (CT) Akutdiagnostik
Neuroradiologie Zerebrale Tumoren Zerebrale Tumoren Untersuchungsmodalitäten/-technik Allgemeine Regeln zur Beurteilung Hirntumore im einzelnen Untersuchungsmethoden Computertomographie (CT) Akutdiagnostik
Porcines Dermatitis Nephropathie Syndrom. Postweaning Multisystemic Wasting Disease
 Porcines Dermatitis Nephropathie Syndrom PDNS Postweaning Multisystemic Wasting Disease PMWS Ätiologie (1): - derzeitig wird eine Reihe von Krankheitsbildern mit dem Porcinen Circovirus-2 assoziiert -
Porcines Dermatitis Nephropathie Syndrom PDNS Postweaning Multisystemic Wasting Disease PMWS Ätiologie (1): - derzeitig wird eine Reihe von Krankheitsbildern mit dem Porcinen Circovirus-2 assoziiert -
Immunbiologie. Teil 6
 Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
Tumor des Nervensystems (1)
 Tumor des Nervensystems (1) Epidemiologie: Die Inzidenz bösartiger Tumoren des zentralen Nervensystems in Deutschland wird auf 9,6 Neuerkrankungen bei Männern und 7,8 Neuerkrankungen bei Frauen pro 100
Tumor des Nervensystems (1) Epidemiologie: Die Inzidenz bösartiger Tumoren des zentralen Nervensystems in Deutschland wird auf 9,6 Neuerkrankungen bei Männern und 7,8 Neuerkrankungen bei Frauen pro 100
Tierärztliche Hochschule Hannover
 Tierärztliche Hochschule Hannover Zur Diagnostik intrakranieller Neoplasien bei Hund und Katze durch vergleichende Anwendung der Magnetresonanztomographie und der Computertomographie INAUGURAL DISSERTATION
Tierärztliche Hochschule Hannover Zur Diagnostik intrakranieller Neoplasien bei Hund und Katze durch vergleichende Anwendung der Magnetresonanztomographie und der Computertomographie INAUGURAL DISSERTATION
Familienanamnese, Tumorlokalisation, Tumorabrenzung, Tumorgröße, TNM-Stadien
 Prognosefaktoren beim Die Prognose dieser Studie untersucht die Dauer des rezidivfreien Intervalls und die Gesamtüberlebenszeit. Folgende Prognosefaktoren wurden berücksichtigt: 1.klinische Daten 2. histopathologischer
Prognosefaktoren beim Die Prognose dieser Studie untersucht die Dauer des rezidivfreien Intervalls und die Gesamtüberlebenszeit. Folgende Prognosefaktoren wurden berücksichtigt: 1.klinische Daten 2. histopathologischer
Th1-Th2-Zytokine bei entzündlicher Herzmuskelerkrankung
 Aus der medizinischen Klinik II, Abteilung für Kardiologie und Pulmonologie des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin Direktor: Univ.-Prof. Dr. med. H.-P. Schultheiss Th1-Th2-Zytokine
Aus der medizinischen Klinik II, Abteilung für Kardiologie und Pulmonologie des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin Direktor: Univ.-Prof. Dr. med. H.-P. Schultheiss Th1-Th2-Zytokine
Neuroendokrine Tumoren des Gastrointestinaltrakts. Katharina Glatz 28. September 2011
 Neuroendokrine Tumoren des Gastrointestinaltrakts Katharina Glatz 28. September 2011 Nomenklatur neuroendokrine Neoplasien G1, G2 neuroendokriner Tumor (NET) Heissen nicht Karzinom, obwohl potentiell metastasierungsfähig
Neuroendokrine Tumoren des Gastrointestinaltrakts Katharina Glatz 28. September 2011 Nomenklatur neuroendokrine Neoplasien G1, G2 neuroendokriner Tumor (NET) Heissen nicht Karzinom, obwohl potentiell metastasierungsfähig
3 Ergebnisse. 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren
 3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
Immunhistochemische Färbung F Immunfluoreszenz. Vortrag Immunologie am von Christopher Tollrian
 Immunhistochemische Färbung F und Immunfluoreszenz Vortrag Immunologie am 22.05.2009 von Christopher Tollrian Inhalt Grundlagen Immunhistochemische Färbung Immunfluoreszenz Proben-Vorbereitung Methoden
Immunhistochemische Färbung F und Immunfluoreszenz Vortrag Immunologie am 22.05.2009 von Christopher Tollrian Inhalt Grundlagen Immunhistochemische Färbung Immunfluoreszenz Proben-Vorbereitung Methoden
29. Fortbildungsveranstaltung. Klinische Cytologie in Hannover
 29. Fortbildungsveranstaltung Klinische Cytologie in Hannover Cytodiagnostik des Urogenitaltraktes/Urincytologie Teil 2 Morphologische Kriterien, cytochemische und immuncytochemische Befunde von malignen
29. Fortbildungsveranstaltung Klinische Cytologie in Hannover Cytodiagnostik des Urogenitaltraktes/Urincytologie Teil 2 Morphologische Kriterien, cytochemische und immuncytochemische Befunde von malignen
Brustkrebs aktuell - OSP am Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms?
 Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Pathologie des Ovars
 Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
CD5 + B-Lymphozyten und Immunglobulin-Leichtketten bei HIV-Infizierten - Korrelation mit klinischen und immunologischen Parametern
 Aus der 2. Klinik für Innere Medizin des Städtischen Klinikums St. Georg Leipzig (Leiter: Prof. Dr. med. Bernhard R. Ruf) CD5 + B-Lymphozyten und Immunglobulin-Leichtketten bei HIV-Infizierten - Korrelation
Aus der 2. Klinik für Innere Medizin des Städtischen Klinikums St. Georg Leipzig (Leiter: Prof. Dr. med. Bernhard R. Ruf) CD5 + B-Lymphozyten und Immunglobulin-Leichtketten bei HIV-Infizierten - Korrelation
Das urotheliale Harnblasenkarzinom Der schwierige Weg zu einer Standardisierungsleitlinie
 Das urotheliale Harnblasenkarzinom Der schwierige Weg zu einer Standardisierungsleitlinie Bettina Eisinger Gemeinsames Krebsregister der Länder Berlin, Brandenburg, Mecklenburg-Vorpommern, Sachsen-Anhalt
Das urotheliale Harnblasenkarzinom Der schwierige Weg zu einer Standardisierungsleitlinie Bettina Eisinger Gemeinsames Krebsregister der Länder Berlin, Brandenburg, Mecklenburg-Vorpommern, Sachsen-Anhalt
Pathologie Bochum. Sarkome Pathologie und Molekularpathologie. Ingo Stricker Institut für Pathologie Ruhr-Universität Bochum
 Pathologie Bochum Sarkome Pathologie und Molekularpathologie Ingo Stricker Institut für Pathologie Ruhr-Universität Bochum Weichteiltumoren Epidemiologie Inzidenz: ca. 1,5-2 pro 100.000 Einwohner 1% aller
Pathologie Bochum Sarkome Pathologie und Molekularpathologie Ingo Stricker Institut für Pathologie Ruhr-Universität Bochum Weichteiltumoren Epidemiologie Inzidenz: ca. 1,5-2 pro 100.000 Einwohner 1% aller
Struktur der SOP. Zeichenerklärung. Entscheidungsfrage? Diagnostik. Therapie. Tumorboard. Nachsorge. individuelle Therapie. Studienfrage?
 Gliome Verantwortlich: PD Dr. Machein, PD Dr. Schnell, Dr. Oehlke, Dr. Fritsch, Dr. Doostkam, Prof. Dr. Mader, Dr. Reinacher, Prof. Dr. Zentner, Prof. Dr. Grosu Freigabe: interdisziplinärer Qualitätszirkel
Gliome Verantwortlich: PD Dr. Machein, PD Dr. Schnell, Dr. Oehlke, Dr. Fritsch, Dr. Doostkam, Prof. Dr. Mader, Dr. Reinacher, Prof. Dr. Zentner, Prof. Dr. Grosu Freigabe: interdisziplinärer Qualitätszirkel
Hunderasse. 2 8 Spitz-Mischling 14 Karzinoma in situ Deutscher Schäferhund 13 Komplexes Karzinom Cocker-Spaniel 10 Karzinoma in situ
 4 Ergebnisse Anhand humaner Forschungsarbeiten konnte gezeigt werden, dass das Expressionsprofil der Cyclin-abhängigen Cyclinkinase-Inhibitoren (CKIs) p21 und p27 im Rahmen der Karzinogenese von Mammatumoren
4 Ergebnisse Anhand humaner Forschungsarbeiten konnte gezeigt werden, dass das Expressionsprofil der Cyclin-abhängigen Cyclinkinase-Inhibitoren (CKIs) p21 und p27 im Rahmen der Karzinogenese von Mammatumoren
Epi Histopathologische Untersuchung auf metastatische Aktivität
 49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten
 Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten Dissertation zur Erlangung des akademischen Grades doctor
Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten Dissertation zur Erlangung des akademischen Grades doctor
Charakterisierung von CD25+ regulatorischen T Zellen
 Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Ergebnisse Kasuistiken Beispiel für einen kurzen Krankheitsverlauf
 - 37-3. Ergebnisse 3.1. Kasuistiken T1 T2 3.1.1. Beispiel für einen kurzen Krankheitsverlauf 53-jähriger Mann mit einem Glioblastom des Hirnstamms. 1/5 MRT wegen einer seit 6 Monaten zunehmenden Halbseitensymptomatik.
- 37-3. Ergebnisse 3.1. Kasuistiken T1 T2 3.1.1. Beispiel für einen kurzen Krankheitsverlauf 53-jähriger Mann mit einem Glioblastom des Hirnstamms. 1/5 MRT wegen einer seit 6 Monaten zunehmenden Halbseitensymptomatik.
Tumoren der Schilddrüse
 456. Tutorial der Deutschen Abteilung der Internationalen Akademie für Pathologie e.v. Tumoren der Schilddrüse am 31. Oktober 2015 von Prof. Dr. med. Kurt Werner Schmid, Essen Tagungsort: Fortbildungszentrum
456. Tutorial der Deutschen Abteilung der Internationalen Akademie für Pathologie e.v. Tumoren der Schilddrüse am 31. Oktober 2015 von Prof. Dr. med. Kurt Werner Schmid, Essen Tagungsort: Fortbildungszentrum
III. Ergebnisteil CD8 CD4. III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut
 27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
Neurobiologie der Magnetorientierung im Trigeminalen System und Hippocampus der Taube (Columba livia)
 Berichte aus der Medizin Clemens Poth Neurobiologie der Magnetorientierung im Trigeminalen System und Hippocampus der Taube (Columba livia) Eine experimentelle immunhistochemische Untersuchung Shaker Verlag
Berichte aus der Medizin Clemens Poth Neurobiologie der Magnetorientierung im Trigeminalen System und Hippocampus der Taube (Columba livia) Eine experimentelle immunhistochemische Untersuchung Shaker Verlag
Multiple Sklerose ohne oligoklonale Banden in Liquor: Prävalenz und klinischer Verlauf
 Aus der Klinik für Neurologie des Jüdischen Krankenhaus Berlin Akademisches Lehrkrankenhaus der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Multiple Sklerose ohne oligoklonale
Aus der Klinik für Neurologie des Jüdischen Krankenhaus Berlin Akademisches Lehrkrankenhaus der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Multiple Sklerose ohne oligoklonale
Diagnosen der pädiatrischen Onkologie und Hämatologie nach ICD-10-GM Version 2008
 Anlage 1 Diagnosen der pädiatrischen Onkologie und Hämatologie nach ICD-10-GM Version 2008 Hinweis: Onkologisch-hämatologische Hauptdiagnosen (gemäß Liste 1): Diese Krankheiten müssen in den Zentren für
Anlage 1 Diagnosen der pädiatrischen Onkologie und Hämatologie nach ICD-10-GM Version 2008 Hinweis: Onkologisch-hämatologische Hauptdiagnosen (gemäß Liste 1): Diese Krankheiten müssen in den Zentren für
Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht.
 37 3 ERGEBNISSE 3.1 Telomeraseaktivität bei Nierentumoren Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht. Die histologische
37 3 ERGEBNISSE 3.1 Telomeraseaktivität bei Nierentumoren Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht. Die histologische
Hirntumor. Was ist ein Tumor? Was ist ein Hirntumor?
 Hirntumor Was ist ein Tumor? Das Wort Tumor stammt aus dem Lateinischen und bedeutet Schwellung. Es handelt sich hierbei um eine Zellwucherung, bei der entartete Zellen ungebremst wachsen und Geschwulste
Hirntumor Was ist ein Tumor? Das Wort Tumor stammt aus dem Lateinischen und bedeutet Schwellung. Es handelt sich hierbei um eine Zellwucherung, bei der entartete Zellen ungebremst wachsen und Geschwulste
Diagnostik bei Tumorerkrankungen
 Radiologisches Institut Bonn- Bad Godesberg Priv. Doz. Dr. med. Werner Dewes Am Michaelshof 4a 53177 Bonn Bad Godesberg Diagnostik bei Tumorerkrankungen Remagen 17. September 2016 Eigenschaften von Tumoren
Radiologisches Institut Bonn- Bad Godesberg Priv. Doz. Dr. med. Werner Dewes Am Michaelshof 4a 53177 Bonn Bad Godesberg Diagnostik bei Tumorerkrankungen Remagen 17. September 2016 Eigenschaften von Tumoren
Externe Qualitätssicherung in der Schlaganfallversorgung Baden-Württemberg. Zuordnung zum Modul 80/1 Schlaganfallversorgung gemäß ICD-Schlüssel
 Zuordnung zum Modul 80/1 Schlaganfallversorgung gemäß ICD-Schlüssel Es soll die relevante Entlassungs-/Verlegungsdiagnose (Haupt- oder Nebendiagnose) aus den Einschlussdiagnosen angegeben werden, die in
Zuordnung zum Modul 80/1 Schlaganfallversorgung gemäß ICD-Schlüssel Es soll die relevante Entlassungs-/Verlegungsdiagnose (Haupt- oder Nebendiagnose) aus den Einschlussdiagnosen angegeben werden, die in
Krebs der großen Speicheldrüsen (1)
 Krebs der großen Speicheldrüsen (1) Epidemiologie: Nur etwa 0,3 % aller Tumoren sind epitheliale Speicheldrüsentumoren mit einer geschätzten Inzidenz von 1-3 pro 100 000 Einwohner pro Jahr. Sie kommen
Krebs der großen Speicheldrüsen (1) Epidemiologie: Nur etwa 0,3 % aller Tumoren sind epitheliale Speicheldrüsentumoren mit einer geschätzten Inzidenz von 1-3 pro 100 000 Einwohner pro Jahr. Sie kommen
NERVENSYSTEM. M. Hirn (Ratte), Nissl : - Die
 NERVENSYSTEM M. Hirn (Ratte), Nissl : - Die Nissl-Färbung macht das rer der Neuronen mit einem basischen Farbstoff spezifisch sichtbar. Die Nissl- Schollen stellen Anhäufungen von rer dar. - Die Neuronen
NERVENSYSTEM M. Hirn (Ratte), Nissl : - Die Nissl-Färbung macht das rer der Neuronen mit einem basischen Farbstoff spezifisch sichtbar. Die Nissl- Schollen stellen Anhäufungen von rer dar. - Die Neuronen
Entzündung. Teil 18.
 Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Embryonale Tumore bei Erwachsenen
 Pädiatrische Onkologie herausgegeben von Prof. Dr. med. Peter Gutjahr Universitäts-Kinderklinik Mainz Band 5 Stefan Eder / Peter Gutjahr Embryonale Tumore bei Erwachsenen Shaker Verlag Aachen 2010 Bibliografische
Pädiatrische Onkologie herausgegeben von Prof. Dr. med. Peter Gutjahr Universitäts-Kinderklinik Mainz Band 5 Stefan Eder / Peter Gutjahr Embryonale Tumore bei Erwachsenen Shaker Verlag Aachen 2010 Bibliografische
Epidemiologische Untersuchung zur Verbreitung der Räude beim Rotfuchs (Vulpes vulpes) in Baden-Württemberg
 Aus dem Chemischen-und Veterinäruntersuchungsamt Karlsruhe Außenstelle Heidelberg und aus dem Institut für Parasitologie und Internationale Tiergesundheit des Fachbereiches Veterinärmedizin der Freien
Aus dem Chemischen-und Veterinäruntersuchungsamt Karlsruhe Außenstelle Heidelberg und aus dem Institut für Parasitologie und Internationale Tiergesundheit des Fachbereiches Veterinärmedizin der Freien
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
