1.2 Herkunft von Wasserinhaltsstoffen. Kationen H + - in natürlichen Wässern 6,5 < ph < 7,5, c(h + ) verursacht durch CO 2 (aq) und HCO 3
|
|
|
- Gert Fuchs
- vor 6 Jahren
- Abrufe
Transkript
1 1.2 Herkunft von Wasserinhaltsstoffen Kationen H + in natürlichen Wässern 6,5 < ph < 7,5, c(h + ) verursacht durch CO 2 (aq) und HCO 3 CO 2 (aq) + H 2 O H + + HCO 3 saure Spurengase SO 2, NO x, HCl und H 2 S aus natürlichen und anthropogenen Quellen, verantwortlich für Säureeintrag in Wasser und Boden SO 2 (aq) + H 2 O H + + HSO 3 Stoff Anteil an der Acidität des Niederschlages SO 2 83 % NO, NO 2 12 % HCl 5 %
2 Erniedrigung des phwertes durch natürliche Fulvosäuren und Huminsäuren in Humus, Torf, Braunkohle Wo steckt die Säure? Niedriger phwert von Grubenwässern in Erz und Braunkohlegebieten durch Verwitterung von Pyrit und Markasit ( s. Eisen), vielfach 2,3 < ph < 3,5! FeS 2 + 3½ O 2 + H 2 O Fe H SO Fe 2+ + ½ O H 2 O 2 Fe(OH) H +
3 Na + und K + Na + Ionen in der Regel > 50 % der im Wasser vorhandenen Kationen entstammen Salzlagerstätten und Verwitterungsprodukten der Gesteine NaCl (Halit) Kalknatronfeldspat (Plagioklas) Natronfeldspat NaAlSi 3 O 8 (Albit) K + Ionen nur 10 % des Na + Gehaltes, K + Ionen werden besser in Böden und Gesteinen gebunden K + Ionen aus der Verwitterung von Gesteinen, aus Düngemitteln, Salzfracht der Kaliindustrie Kalifeldspat KAlSi 3 O 8 (Orthoklas) Granit Kalifeldspat rosa bis gelb Quarz farblos transparent Kalknatronfeldspat weiß bis grau Glimmer schwarz (Biotit)
4 NH 4 + primäres Abbauprodukt organischer Stickstoffverbindungen, z. B. Harnstoff CO(NH 2 ) 2 + H 2 O CO NH 3 und NH 3 + H + + NH 4 Reduktionsprozesse von Nitraten (Denitrifikation) NO 3 + NO 2 ( N 2 ) NH 3 / NH 4 Ca 2+ und Mg 2+ Kohlensäureverwitterung von Carbonatgestein, Lösungsverwitterung von Anhydrit bzw. Gipsstein CaMg(CO 3 ) 2, CaSO 4 bzw. CaSO 4 2 H 2 O Verwitterung von Granit Kalknatronfeldspat (Plagioklas) bzw. CaAl 2 Si 2 O 8 (Anorthit) Mg 2+ mit geringerer Konzentration in natürlichen Wässern, c(ca 2+ ) : c(mg 2+ ) = 4 bis 5 : 1 aufgrund der geringeren Häufigkeit in Gesteinen
5 Fe(II) / Fe(III)Ionen bzw. Verbindungen in natürlichen Wässern als hellgrünes Fe 2+ bzw. [Fe(H 2 O) 6 ] 2+, Pyritoxidation in Tagebaurestlochseen FeS 2 + 3½ O 2 + H 2 O Fe H SO 4 2 Hydrolyse von FeS 2, Fe 2 O 3 oder FeCO 3 oder in Grundwässern FeS CO H 2 O Fe HCO 3 + H 2 S + S Tagebausee Lausitz phwert: zwischen 2,3 und 3,5 hohe Konzentrationen an Sulfat sowie Eisenund Aluminium 2 Fe 2+ + ½ O H 2 O 2 Fe(OH) 3 * + 4 H + *Fe 2 O 3 3 H 2 O
6 Mn(II) / Mn(IV)Ionen bzw. Verbindungen neben Eisen am meisten verbreitet, häufig gemeinsam in der Erdkruste anzutreffen im Wasser häufig als Mn 2+ (neben Fe 2+ ), weniger leicht als Fe 2+ oxidierbar bei geeigneten phwerten Oxidation zu dunkelbraunem MnO 2 möglich
7 Anionen Cl Chloridionen kommen in allen natürlichen Wässern aufgrund der guten Löslichkeit von Alkali und Erdalkalichloriden vor Hauptquellen sind insbesondere Salzlagerstätten (NaCl, KCl) und die Gesteinsverwitterung SO 4 2 Sulfationen sind ebenso in allen natürlichen Wässern enthalten Lösung von natürlichem Gipsstein CaSO 4 2 H 2 O Ca SO H 2 O Endprodukt der bakteriellen Oxidation schwefelhaltiger organischer Stoffe H 2 S + O 2 2 H SO 4 oder S + 1½ O 2 + H 2 O 2 H SO 4
8 NO 3 Nitrationen werden hauptsächlich durch aeroben Abbau organischer Stickstoffverbindungen erzeugt (Nitrifikation) organische Düngemittel, fäkale Verschmutzungen NH 3 + 1½ O 2 NO 2 + H + + H 2 O NO 2 + ½ O 2 NO 3 HCO 3 Reaktion von carbonatischen Gesteinen mit gelöstem CO 2 CaCO 3 + H 2 O + CO 2 Ca HCO 3
9 Kieselsäure Verwitterung von Gesteinen, Bildung kolloider Lösungen
10 Typische Verwitterungsreaktionen von Mineralien Chemische Verwitterung Mineral Wasser CO 2 Kation Anion Kieselsäure Tonmineral Gips / Kalk CaSO 4 Ca SO 4 CaCO 3 + H 2 O Ca 2+ + HCO 3 + OH CaCO 3 + H 2 O + CO 2 Ca HCO 3 Quarz SiO H 2 O + H 4 SiO 4 Feldspat Na[AlSi 3 O 8 ] + 11/2 H 2 O Na + + OH + 2 H 4 SiO 4 +½Al 2 (OH) 4 [Si 2 O 5 ] Na[AlSi 3 O 8 ] + 11/2 H 2 O + CO 2 Na + + HCO 3 Na[AlSi 3 O 8 ] + 11/2 H 2 O + CO 2 K + + HCO H 4 SiO 4 +½Al 2 (OH) 4 [Si 2 O 5 ] + 2 H 4 SiO 4 +½Al 2 (OH) 4 [Si 2 O 5 ]
11 Chemischbiologische Verwitterung Durch Mikroorganismen, Pflanzen und Tiere verursacht Speicherung von Feuchtigkeit (Moose) Mineralisierung von Boden und Gestein durch Säuren Huminsäuren infolge Abbau Kohlensäure aus CO 2 Organische Säuren (Mineralstoffaufnahme über Pflanzenwurzeln) Schwefel und Salpetersäure (Oxidationsprodukt des Stoffwechsels von Mikroorganismen) Steinflechten auf Sandstein Niedere Pflanzen (z. B. Flechten) sind in der Lage, den Silikaten unmittelbar Ionen zu entziehen.
12 Organische Wasserinhaltsstoffe Huminstoffe schwer abbaubare, hochmolekulare Verbindungen, Bildung beim Abbauprozess von organischem Material, insbesondere in Torf, Moorboden, Braunkohle, humushaltigen Böden Kohlenhydrate, Eiweiße, Aminosäuren, Stoffwechselprodukte von Lebewesen, Verunreinigungen aus Abwässern Fette und Öle, Steroide Verunreinigungen aus Abwässern, Steroid Koprosterin aus Cholesterin, Indikator für Fäkalien Spurenstoffe Tenside, Arzneimittel, Riechstoffe aus Abwässern der Haushalte und Industrie, Pflanzenschutzmittel aus der Landwirtschaft Kohlenwasserstoffe, chlororganische Verbindungen, Phenole u. a. Stoffe aus Industrie, Verkehr, Kraftwerken, Altlasten Algenbürtige Schadstoffe (Cyanotoxine) aus Cyanobakterien (Blaualgen)
13 Einige Umwelthormone im Wasser Vo UCh (Schädigung des Hormonsystems) Substanz Herkunft BisphenolA Kunststoffe, Antioxidans Ethinylestradiol Wirkstoff Antibabypille Diethylhexylphthalat Weichmacher Benzo(a)pyren Verbrennungsrückstand Terbutryn Herbizid Nonylphenole Emulgator, Tensid
14 Herkunft der Gase Zusammensetzung trockener Luft und Löslichkeit der Gase in Wasser Gas Anteil in Vol.% K in mol/l bar 1) (25 C) N 2 78,08 Vol.% 0, O 2 20,94 Vol.% 1, Ar 0,93 Vol.% 1, CO 2 0,038 Vol.% 33, ) HenryKonstanten von Luftgasen in mol mol mol = = L bar m 10 Pa 10 m Pa Der Stoffaustausch zwischen Wasseroberfläche und Atmosphäre erfolgt durch Diffusion. Deshalb erfolgt in ruhendem Wasser eine sehr langsame Gleichgewichtseinstellung.
15 O 2 Assimilation grüner Pflanzen (auch Wasserpflanzen und Algen) 6 H 2 O + 6 CO 2 + h ν C 6 H 12 O O 2 CO 2 Stoffwechseltätigkeit von Organismen C 6 H 12 O O 2 6 H 2 O + 6 CO 2 + E Biochemische Abbauprozesse im aeroben Milieu Anreicherung von CO 2 im Boden Freisetzung von CO 2 aus Carbonaten durch sauren Regen Aufschmelzen von Carbonaten und Freisetzung von CO 2 (Vulkane) Ozeane als CO 2 Speicher (Aufnahme und Abgabe)
16 Spurengase in trockener Luft und Löslichkeit in Wasser (Frimmel, 1999) Gas Anteil in Vol.% K in mol/l bar 1) (25 C) CH 4 1,7 1,8 ppm 1, NO 1) 1, NO 2 1) ppb O ppb H 2 S 1) ) SO 2 1) NH 3 1) chemische Folgereaktionen mit Wasser < 1 50 ppb
17 CH 4 Energieerzeugung, Verbrennung fossiler Energieträger Wiederkäuer, Reisanbau NO X vorrangig Verbrennung fossiler Brennstoffe (Verbrennungsgase von Motoren) Gewitter, anaerobe Bodenorganismen (NO) O 3 Bildung aus NO 2 in der Troposphäre und aus O 2 in der Stratosphäre O 2 + O O 3 NO 2 NO + O λ < 420 nm O 2 2 O λ < 242 nm
18 SO 2 vorrangig Verbrennung fossiler Brennstoffe (Kraftwerke) Vulkangase, Oxidation von H 2 S Oxidation von Dimethylsulfid aus ozeanischem Phytoplankton (Algen) (CH 3 ) 2 S + 4½ O 2 2 CO H 2 O + SO 2 H 2 S Umsetzung von Eisenkies (Pyrit) im Boden FeS CO H 2 O Fe HCO 3 + H 2 S + S anaerobe bakterielle Umwandlung von schwefelhaltigen Eiweißstoffen und Sulfaten Vulkane, Industrie und Landwirtschaft
4 Boden. 4.1 Grundlagen. Boden mit charakteristischen Bodenhorizonten Bodenprofil Bodentyp. Aufbau und Zusammensetzung
 4 Boden 4.1 Grundlagen Aufbau und Zusammensetzung Lithosphäre - feste Gesteinshülle, ca. 100 km dick (griech. lithos, Stein; lat. sphaira, Kugel) Pedosphäre - Bodenhülle, wenige Dezimeter bis einige Meter
4 Boden 4.1 Grundlagen Aufbau und Zusammensetzung Lithosphäre - feste Gesteinshülle, ca. 100 km dick (griech. lithos, Stein; lat. sphaira, Kugel) Pedosphäre - Bodenhülle, wenige Dezimeter bis einige Meter
Boden Versauerung Dynamik-Gefährdung
 Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Boden Versauerung Dynamik-Gefährdung Univ. Lek. DI Hans
Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Boden Versauerung Dynamik-Gefährdung Univ. Lek. DI Hans
Natürliche ökologische Energie- und Stoffkreisläufe
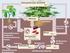 Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
2 Bodenentwicklung 3 Lebensraum Boden Fauna. 4 Stoffkreislauf 5 Bodeneigenschaften
 Gliederung 1 Definition iti Boden 2 3 Lebensraum Boden Fauna Flora 4 5 Bodeneigenschaften 6 Boden im Unterricht Fauna- Lebensraum -Flora 1 Definition Unter Boden versteht man die obere, lockere, belebte
Gliederung 1 Definition iti Boden 2 3 Lebensraum Boden Fauna Flora 4 5 Bodeneigenschaften 6 Boden im Unterricht Fauna- Lebensraum -Flora 1 Definition Unter Boden versteht man die obere, lockere, belebte
Gesteinskunde. Bestimmung magmatischer Minerale. Christopher Giehl, Uni Tübingen 20.10.2011
 Gesteinskunde Bestimmung magmatischer Minerale Christopher Giehl, Uni Tübingen 20.10.2011 Christopher Giehl (Universität Tübingen) 20.10.2011 1 / 18 1 Wiederholung 2 Klassifikation magmatischer Gesteine
Gesteinskunde Bestimmung magmatischer Minerale Christopher Giehl, Uni Tübingen 20.10.2011 Christopher Giehl (Universität Tübingen) 20.10.2011 1 / 18 1 Wiederholung 2 Klassifikation magmatischer Gesteine
Säuren, Basen, Salze
 Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Einführung in die Geographie. Klimageographie
 Einführung in die Geographie Klimageographie Klimaelemente Gliederung der Vorlesung 1. Physische Geographie 2. Geologie 3. Klima, Vegetation und Wasser 4. Pedologie / Bodengeographie 5. Geomorphologie
Einführung in die Geographie Klimageographie Klimaelemente Gliederung der Vorlesung 1. Physische Geographie 2. Geologie 3. Klima, Vegetation und Wasser 4. Pedologie / Bodengeographie 5. Geomorphologie
Grundwasser: chemische Vorgänge bei der Infiltration. Redoxprozesse im Grundwasser Transport reaktiver Spezies
 Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Übungen zur Allgemeinen Geologie, Nebenfach. Erta Ale, Afrika
 Übungen zur Allgemeinen Geologie, Nebenfach Erta Ale, Afrika Minerale anorganisch, (natürlich) Festkörper definierte chemische Zusammensetzung homogen definiert durch chemische Formel kristallin Physikalische
Übungen zur Allgemeinen Geologie, Nebenfach Erta Ale, Afrika Minerale anorganisch, (natürlich) Festkörper definierte chemische Zusammensetzung homogen definiert durch chemische Formel kristallin Physikalische
Chemisches Rechnen für Bauingenieure
 Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
3.1.2 Oberflächenwasser
 3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
Qualitative Analyse. - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch,
 - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
- Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Crashkurs Säure-Base
 Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
1.3 Chemische Reaktionen des Wassers - Bildung von Säuren und Basen
 1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
Lösungen (ohne Aufgabenstellungen)
 Lösungen (ohne Aufgabenstellungen) Aufgaben A 1 Einerseits reflektieren die Eiswolken die von der Erde abgehende Infrarotstrahlung; dadurch erhöht sich der Treibhauseffekt. Andererseits reflektieren die
Lösungen (ohne Aufgabenstellungen) Aufgaben A 1 Einerseits reflektieren die Eiswolken die von der Erde abgehende Infrarotstrahlung; dadurch erhöht sich der Treibhauseffekt. Andererseits reflektieren die
ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG
 ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG Peter Lechner & Marion Huber-Humer MVA-Schlacke LVA-Nr. 813.100 & 101 Studienjahr 2011/2012 Studienjahr 2011/12 LVA 813.100 & 101 2 Stoffströme einer MVA Restabfall
ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG Peter Lechner & Marion Huber-Humer MVA-Schlacke LVA-Nr. 813.100 & 101 Studienjahr 2011/2012 Studienjahr 2011/12 LVA 813.100 & 101 2 Stoffströme einer MVA Restabfall
Limnochemisches Praktikum
 TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
Ökopedologie I + II. Einführung in die Mineralogie und Gesteinskunde
 Ökopedologie I + II Einführung in die Mineralogie und Gesteinskunde Minerale - Definition Minerale sind stofflich einheitliche (physikalisch und chemisch homogene), feste, anorganische, meist natürlich
Ökopedologie I + II Einführung in die Mineralogie und Gesteinskunde Minerale - Definition Minerale sind stofflich einheitliche (physikalisch und chemisch homogene), feste, anorganische, meist natürlich
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Waldboden. Sucht unter einem Laubbaum Blätter in unterschiedlichem Zersetzungsgrad und klebt sie nacheinander auf ein großes Blatt Papier!
 1 Sucht unter einem Laubbaum Blätter in unterschiedlichem Zersetzungsgrad und klebt sie nacheinander auf ein großes Blatt Papier! Findet heraus, welche Tiere dies bewirken! Schaut euch im Gelände um: Zersetzen
1 Sucht unter einem Laubbaum Blätter in unterschiedlichem Zersetzungsgrad und klebt sie nacheinander auf ein großes Blatt Papier! Findet heraus, welche Tiere dies bewirken! Schaut euch im Gelände um: Zersetzen
Das chemische Gleichgewicht
 1 Grundlagen Viele Substanzen sind in Wasser praktisch nicht löslich, l d.h. sie sind nur sehr geringfügig gig löslich. (Tatsächlich nicht lösliche Stoffe gibt es nicht! Schwerlösliche Verbindungen In
1 Grundlagen Viele Substanzen sind in Wasser praktisch nicht löslich, l d.h. sie sind nur sehr geringfügig gig löslich. (Tatsächlich nicht lösliche Stoffe gibt es nicht! Schwerlösliche Verbindungen In
Elemente des Periodensystems. Natürliche Häufigkeit der Elemente
 Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Vorlesung Wasserinhaltsstoffe. Dr. Thomas Dittmar. Gase
 Vorlesung Wasserinhaltsstoffe Dr. Thomas Dittmar Gase 07/011 Gelöste Gase in der Hydrosphäre O, CO, H S, CH 4, N. Vorkommen, Quellen (natürlich, anthropogen), Wirkung (Humangesundheit, Ökologie), Entfernung
Vorlesung Wasserinhaltsstoffe Dr. Thomas Dittmar Gase 07/011 Gelöste Gase in der Hydrosphäre O, CO, H S, CH 4, N. Vorkommen, Quellen (natürlich, anthropogen), Wirkung (Humangesundheit, Ökologie), Entfernung
Unterrichtsmaterial zur Stoff-Separation einer heterogenen Mischung am Beispiel von Granit
 Unterrichtsmaterial zur Stoff-Separation einer heterogenen Mischung am Beispiel von Granit Inhalt (je 6x) Granit Schraubdeckelgläser mit Granitsplitter Quarz Alkalifeldspat Plagioklas Schraubdeckelgläser
Unterrichtsmaterial zur Stoff-Separation einer heterogenen Mischung am Beispiel von Granit Inhalt (je 6x) Granit Schraubdeckelgläser mit Granitsplitter Quarz Alkalifeldspat Plagioklas Schraubdeckelgläser
3.4 Schadwirkungen. Toxizität
 3.4 Schadwirkungen Toxizität Toxische Wirkungen bereits in geringen Konzentrationen durch - Schwermetalle und Arsen - Cyanide - aromatische Kohlenwasserstoffe - PAK - Phenole - Halogenkohlenwasserstoffe
3.4 Schadwirkungen Toxizität Toxische Wirkungen bereits in geringen Konzentrationen durch - Schwermetalle und Arsen - Cyanide - aromatische Kohlenwasserstoffe - PAK - Phenole - Halogenkohlenwasserstoffe
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Allgemeine Grundlagen 2
 Allgemeine Grundlagen 2 1 Reaktionen und Bindung 1) Redox - Reaktionen 1. Semester 2) Säure - Base - Reaktionen 1. Semester 3) Komplexreaktionen (eigentlich kein neuer Reaktionstyp, sondern eine Säure
Allgemeine Grundlagen 2 1 Reaktionen und Bindung 1) Redox - Reaktionen 1. Semester 2) Säure - Base - Reaktionen 1. Semester 3) Komplexreaktionen (eigentlich kein neuer Reaktionstyp, sondern eine Säure
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Ei ne P ä r sentati ti on vo n T om D ro t s e, P t e er Haak k und Patrick Schürmann
 Ei P ä tti T D t P t H k d Eine Präsentation von Tom Droste, Peter Haak und Patrick Schürmann Inhaltsverzeichnis Allgemein: Was ist Stickstofffixierung? Welche Arten der Fixierung gibt es? Welchen Zweck
Ei P ä tti T D t P t H k d Eine Präsentation von Tom Droste, Peter Haak und Patrick Schürmann Inhaltsverzeichnis Allgemein: Was ist Stickstofffixierung? Welche Arten der Fixierung gibt es? Welchen Zweck
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
3.2 Korrosion zementgebundener Baustoffe. Lösender Angriff. Lösender Angriff auf Beton u. a. zementgebundene
 3.2 Korrosion zementgebundener Baustoffe Lösender Angriff Lösender Angriff auf Beton u. a. zementgebundene Baustoffe durch Säuren kalklösende Kohlensäure austauschfähige Salze weiches Wasser Fette und
3.2 Korrosion zementgebundener Baustoffe Lösender Angriff Lösender Angriff auf Beton u. a. zementgebundene Baustoffe durch Säuren kalklösende Kohlensäure austauschfähige Salze weiches Wasser Fette und
Gesteinskunde Einführung
 Gesteinskunde Einführung Christopher Giehl, Uni Tübingen 13.10.2011 Christopher Giehl (Universität Tübingen) 13.10.2011 1 / 23 1 Organisatorisches 2 Kursinhalte und -ziele 3 Grundbegriffe und Definitionen
Gesteinskunde Einführung Christopher Giehl, Uni Tübingen 13.10.2011 Christopher Giehl (Universität Tübingen) 13.10.2011 1 / 23 1 Organisatorisches 2 Kursinhalte und -ziele 3 Grundbegriffe und Definitionen
Das Chemische Gleichgewicht
 II. Gleichgewichte von Säuren S und Basen 13 Puffer-Lösungen Definition: Lösungen, die einen definierten ph-wert haben, der konstant bleibt, auch wenn Säuren S oder Basen in begrenzten Mengen zugesetzt
II. Gleichgewichte von Säuren S und Basen 13 Puffer-Lösungen Definition: Lösungen, die einen definierten ph-wert haben, der konstant bleibt, auch wenn Säuren S oder Basen in begrenzten Mengen zugesetzt
Salpetersäure. Phosphorsäure. Arrhenius: Säuren dissozieren in wässriger Lösung in positive Wasserstoffionen und negative Säurerestionen.
 Chemie Klausur I Grundwissen: Elementsymbol und seine Bezeichnungen: Gefahrensymbole: Säuren: Formel HCl HNO3 Name Salzsäure Salpetersäure Säurerest - Ion Cl NO3 Name Chlorid-Ion Nitrat-Ion einwertig H2CO3
Chemie Klausur I Grundwissen: Elementsymbol und seine Bezeichnungen: Gefahrensymbole: Säuren: Formel HCl HNO3 Name Salzsäure Salpetersäure Säurerest - Ion Cl NO3 Name Chlorid-Ion Nitrat-Ion einwertig H2CO3
Das Formelpuzzle Kopiervorlage
 Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Neues aus dem Grundwasserüberwachungsprogramm
 Neues aus dem Grundwasserüberwachungsprogramm Die aktuelle Versauerungssituation in Baden-Württemberg Neuer LUBW-Bericht (März 2010) LUBW - ARGE Versauerung Inhalt (1) Ist die Versauerung aktuell noch
Neues aus dem Grundwasserüberwachungsprogramm Die aktuelle Versauerungssituation in Baden-Württemberg Neuer LUBW-Bericht (März 2010) LUBW - ARGE Versauerung Inhalt (1) Ist die Versauerung aktuell noch
Pflanz en und ihre ph-vorlieben
 Pflanz en und ihre ph-vorlieben Extrablatt 1 zu Arbeitsblatt 1, Aufgabe 2 Beispiele für Wildpflanzen als Zeigerpflanzen Stark sauer (ph unter 4,5) Sauer (ph 4,5 bis 5,2) Basisch/alkalisch Borstengras Schafschwingel
Pflanz en und ihre ph-vorlieben Extrablatt 1 zu Arbeitsblatt 1, Aufgabe 2 Beispiele für Wildpflanzen als Zeigerpflanzen Stark sauer (ph unter 4,5) Sauer (ph 4,5 bis 5,2) Basisch/alkalisch Borstengras Schafschwingel
Geochemie I (2V) WS 2006/2007
 Geochemie I (2V) WS 2006/2007 1 Prof. Dr. K. Mengel Institut für Mineralogie und Mineralische Rohstoffe kurt.mengel@tu-clausthal.de Vorwort Die Geochemie beschäftigt sich mit der Verteilung von chemischen
Geochemie I (2V) WS 2006/2007 1 Prof. Dr. K. Mengel Institut für Mineralogie und Mineralische Rohstoffe kurt.mengel@tu-clausthal.de Vorwort Die Geochemie beschäftigt sich mit der Verteilung von chemischen
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Ökopedologie III. Magnesium und Calcium in Böden
 Ökopedologie III Magnesium und Calcium in Böden Mg als Pflanzennährstoff Funktionselement in der Pflanze: zentraler Bestandteil des Chlorophylls beteiligt an Phosphorilierungsprozessen Aktivierung von
Ökopedologie III Magnesium und Calcium in Böden Mg als Pflanzennährstoff Funktionselement in der Pflanze: zentraler Bestandteil des Chlorophylls beteiligt an Phosphorilierungsprozessen Aktivierung von
1.5 Säuren und Basen und der ph-wert
 Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Interpretation der chemischen und physikalischen Untersuchungen
 Interpretation der chemischen und physikalischen Untersuchungen in Fliessgewässern Für die Interpretation der chemischen (ph, Nitrat, Sauerstoff, Alkalinität), physikalischen (Temperatur, Transparenz,
Interpretation der chemischen und physikalischen Untersuchungen in Fliessgewässern Für die Interpretation der chemischen (ph, Nitrat, Sauerstoff, Alkalinität), physikalischen (Temperatur, Transparenz,
Prof. Dr. Christian Wolkersdorfer
 Prof. Dr. Christian Wolkersdorfer Abriss der Hydrogeologie Wechselwirkungen Wasser Gestein Veranstaltung im Wintersemester 2008/2009 Präsentation basiert auf Einführung Hydrogeologie Prof. Dr. habil Broder
Prof. Dr. Christian Wolkersdorfer Abriss der Hydrogeologie Wechselwirkungen Wasser Gestein Veranstaltung im Wintersemester 2008/2009 Präsentation basiert auf Einführung Hydrogeologie Prof. Dr. habil Broder
Rolle des S im Pflanzen- und Mikroben- Wachstum
 Rolle des S im Pflanzen- und Mikroben- Wachstum Synthese S-haltiger Aminosäuren: Cystein und Methionin, (Cystin = Disulfid) Aufbau anderer Metabolite, CoA, Biotin, Thiamine und Glutathion. Hauptfunktion:
Rolle des S im Pflanzen- und Mikroben- Wachstum Synthese S-haltiger Aminosäuren: Cystein und Methionin, (Cystin = Disulfid) Aufbau anderer Metabolite, CoA, Biotin, Thiamine und Glutathion. Hauptfunktion:
1 Grundwissenskatalog Chemie G8 SG, Inhalt der 10. Jahrgangsstufe
 1 Grundwissenskatalog Chemie G8 SG, Inhalt der 10. Jahrgangsstufe Grundwissenskatalog Chemie für die 11. bis 12. Jahrgangsstufe G 8 (sprachliches Gymnasium) mit den Inhalten der 10. Jahrgangsstufe Hinweis:
1 Grundwissenskatalog Chemie G8 SG, Inhalt der 10. Jahrgangsstufe Grundwissenskatalog Chemie für die 11. bis 12. Jahrgangsstufe G 8 (sprachliches Gymnasium) mit den Inhalten der 10. Jahrgangsstufe Hinweis:
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Erkläre die Bedeutung der negativen Blindprobe. Erkläre die Bedeutung der positiven Blindprobe. Erkläre das Prinzip der Flammenfärbung.
 Erkläre die Bedeutung der negativen Blindprobe. Durchführung einer Nachweisreaktion ohne Beteiligung der zu analysierenden Substanz. Ziel: Überprüfen der Reinheit der verwendeten Nachweisreagenzien. Erkläre
Erkläre die Bedeutung der negativen Blindprobe. Durchführung einer Nachweisreaktion ohne Beteiligung der zu analysierenden Substanz. Ziel: Überprüfen der Reinheit der verwendeten Nachweisreagenzien. Erkläre
Aufbereitung von Trinkwasser verschiedener hydrochemischer und gasphysikalischer Zusammensetzung
 Aufbereitung von Trinkwasser verschiedener hydrochemischer und gasphysikalischer Zusammensetzung Grundlagen zur Planung Dr. L. Eichinger Lannach Juni 2013 Firmenprofil Hydroisotop in Zahlen Gegründet 1982
Aufbereitung von Trinkwasser verschiedener hydrochemischer und gasphysikalischer Zusammensetzung Grundlagen zur Planung Dr. L. Eichinger Lannach Juni 2013 Firmenprofil Hydroisotop in Zahlen Gegründet 1982
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Eigenschaften von H 2 S
 Eigenschaften von H 2 S sehr giftiges, brennbares, unangenehm faulig riechendes Gas Smp. -86 C, Sdp. -60,2 C mäßig wasserlöslich, gesättigte Lösung hat c = 0,1 mol/l schwache, zweiprotonige Säure H 2 S
Eigenschaften von H 2 S sehr giftiges, brennbares, unangenehm faulig riechendes Gas Smp. -86 C, Sdp. -60,2 C mäßig wasserlöslich, gesättigte Lösung hat c = 0,1 mol/l schwache, zweiprotonige Säure H 2 S
Oxidation und Reduktion
 Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 03. Februar 2010. Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Seite 1 von Standortbestimmung / Äquivalenzprüfung. Chemie. Freitag, 23. Mai 2014, Uhr
 Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
SS Thomas Schrader. der Universität Duisburg-Essen. (Teil 8: Redoxprozesse, Elektrochemie)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
Gibbssche Phasenregel und Einführung in Phasendiagramme F = C P + 2
 Petrologie der Magmatite und Metamorphite: Teil Metamorphite - Vorlesung 3 1/6 Gibbssche Phasenregel und Einführung in Phasendiagramme Bei Vorliegen eines thermodynamischen Gleichgewichts (thermodynamic
Petrologie der Magmatite und Metamorphite: Teil Metamorphite - Vorlesung 3 1/6 Gibbssche Phasenregel und Einführung in Phasendiagramme Bei Vorliegen eines thermodynamischen Gleichgewichts (thermodynamic
Seminar zum anorganisch-chemischen Praktikum I. Quantitative Analyse. Prof. Dr. M. Scheer Patrick Schwarz
 Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Klausur zur Vorlesung "Anorganische Chemie" am
 Klausur zur Vorlesung "Anorganische Chemie" am 21.02.2007 Matrikelnummer: Name: Bitte eintragen: Vorname: Bitte eintragen Wievieltes Fachsemester: Fachrichtung: Sonstiges (bitte angeben): Bitte ankreuzen:
Klausur zur Vorlesung "Anorganische Chemie" am 21.02.2007 Matrikelnummer: Name: Bitte eintragen: Vorname: Bitte eintragen Wievieltes Fachsemester: Fachrichtung: Sonstiges (bitte angeben): Bitte ankreuzen:
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Gesamt- Brenzcatechinviolett APHA 3500 Al modifiziert Aluminium
 FIA Methodenliste Stand: 21.03.2012 Gesamt- Brenzcatechinviolett APHA 3500 Al modifiziert Aluminium 0,01 mg/l 0,05... 0,5 mg/l Al-T Wasser / Abwasser / 0,2... 2 mg/l Al-T Bodenextrakt Ammonium Gasdiffusion
FIA Methodenliste Stand: 21.03.2012 Gesamt- Brenzcatechinviolett APHA 3500 Al modifiziert Aluminium 0,01 mg/l 0,05... 0,5 mg/l Al-T Wasser / Abwasser / 0,2... 2 mg/l Al-T Bodenextrakt Ammonium Gasdiffusion
Trennungsgang. AC-I Seminar, B.
 Trennungsgang http://illumina-chemie.de/mangan-chrom-t2100.html www.chemgapedia.de, www.chemische-experimente.com 1 Trennungsgang auf einen Blick Trennungsgang Reaktionen in wässriger Lösung Fällung und
Trennungsgang http://illumina-chemie.de/mangan-chrom-t2100.html www.chemgapedia.de, www.chemische-experimente.com 1 Trennungsgang auf einen Blick Trennungsgang Reaktionen in wässriger Lösung Fällung und
Annette-Kolb-Gymnasium Traunstein Grundwissen der 9. Klasse für das Fach Chemie Aufgaben und Antworten
 1 Erkläre den Aufbau von Atomen und Ionen aus den Elementarteilchen: (Bsp. 23 Na, 1 H, 35 Cl - ). 2 Erläutere den Beriff Edelaskonfiuration und beschreibe, welche verschiedenen Mölichkeiten die Elemente
1 Erkläre den Aufbau von Atomen und Ionen aus den Elementarteilchen: (Bsp. 23 Na, 1 H, 35 Cl - ). 2 Erläutere den Beriff Edelaskonfiuration und beschreibe, welche verschiedenen Mölichkeiten die Elemente
ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1
![ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1](/thumbs/33/16365353.jpg) ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Die wichtigsten anorganischen Säuren Schwefelsäure H 2 SO 4 ihre Salze heißen Sulfate Salpetersäure HNO 3 ihre Salze
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Die wichtigsten anorganischen Säuren Schwefelsäure H 2 SO 4 ihre Salze heißen Sulfate Salpetersäure HNO 3 ihre Salze
Mecklenburg-Vorpommern
 Mecklenburg-Vorpommern Zentralabitur 2006 Chemie Grundkurs Aufgaben Abitur 2006 Chemie/Grundkurs Seite 2 Hinweise für den Schüler Aufgabenauswahl: Bearbeitungszeit: Von den 2 Prüfungsblöcken A und B ist
Mecklenburg-Vorpommern Zentralabitur 2006 Chemie Grundkurs Aufgaben Abitur 2006 Chemie/Grundkurs Seite 2 Hinweise für den Schüler Aufgabenauswahl: Bearbeitungszeit: Von den 2 Prüfungsblöcken A und B ist
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie
 Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Gegeben sind die folgenden Werte kovalenter Bindungsenthalpien:
 Literatur: Housecroft Chemistry, Kap. 22.1011 1. Vervollständigen Sie folgende, stöchiometrisch nicht ausgeglichene Reaktions gleichungen von Sauerstoffverbindungen. Die korrekten stöchiometrischen Faktoren
Literatur: Housecroft Chemistry, Kap. 22.1011 1. Vervollständigen Sie folgende, stöchiometrisch nicht ausgeglichene Reaktions gleichungen von Sauerstoffverbindungen. Die korrekten stöchiometrischen Faktoren
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7
 AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
0.3 Formeln, Gleichungen, Reaktionen
 0.3 Formeln, Gleichungen, Reaktionen Aussage von chemischen Formeln Formeln von ionischen Verbindungen - Metallkation, ein- oder mehratomiges Anion - Formel entsteht durch Ausgleich der Ladungen - Bildung
0.3 Formeln, Gleichungen, Reaktionen Aussage von chemischen Formeln Formeln von ionischen Verbindungen - Metallkation, ein- oder mehratomiges Anion - Formel entsteht durch Ausgleich der Ladungen - Bildung
allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls
 Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Integrationsphase der MSS 11
 Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol]
![Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol] Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol]](/thumbs/49/25486820.jpg) Seite 22 22 Auflösung von Si in NaOH-Lösung Weiterführende Infos Quarzsand und Alkalicarbonate werden bei ca. 1300 C zusammengeschmolzen und das Produkt ((Na/K) 2 O* n SiO 2 ) bei 150 C und 5 bar in Wasser
Seite 22 22 Auflösung von Si in NaOH-Lösung Weiterführende Infos Quarzsand und Alkalicarbonate werden bei ca. 1300 C zusammengeschmolzen und das Produkt ((Na/K) 2 O* n SiO 2 ) bei 150 C und 5 bar in Wasser
Kleines Wasserlexikon
 Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper Universität DuisburgEssen Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper http://www.unidue.de/~adb297b
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper Universität DuisburgEssen Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper http://www.unidue.de/~adb297b
Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord
 Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord Anorganische Spurenelemente Aluminium mg/l 0,2 nicht nachweisbar 0,01 Antimon mg/l 0,005 nicht nachweisbar 0,001 Arsen mg/l 0,01 nicht nachweisbar
Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord Anorganische Spurenelemente Aluminium mg/l 0,2 nicht nachweisbar 0,01 Antimon mg/l 0,005 nicht nachweisbar 0,001 Arsen mg/l 0,01 nicht nachweisbar
Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess.
 Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Grundwissen Chemie Mittelstufe (9 MNG)
 Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Gülle und CO. Hohenems 6. April Unsere Land- und Forstwirtschaft. Wertvoll fürs Land. Ing. Christian Meusburger/ Folie 1
 Gülle und CO Hohenems 6. April 2016 Ing. Christian Meusburger/ Folie 1 Ing. Christian Meusburger/ Folie 2 Stickstoff Ab-Um-Aufbau Als Nitrifikation bezeichnet man die bakterielle Oxidation von Ammoniak
Gülle und CO Hohenems 6. April 2016 Ing. Christian Meusburger/ Folie 1 Ing. Christian Meusburger/ Folie 2 Stickstoff Ab-Um-Aufbau Als Nitrifikation bezeichnet man die bakterielle Oxidation von Ammoniak
Grundlagen der Chemie für Nichtchemiker AUFGABENSAMMLUNG
 AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772 Nidfurn 055-654
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772 Nidfurn 055-654
DOMOGRAN 45 AKTIVIERT IHR NÄHRSTOFFPOTENZIAL DER STICKSTOFF-SCHWEFEL-DÜNGER AUS LEUNA
 AKTIVIERT IHR NÄHRSTOFFPOTENZIAL DER STICKSTOFF-SCHWEFEL-DÜNGER AUS LEUNA Stickstoff- und Schwefeldünger für eine positive Nährstoffdynamik Längere Ammoniumphase und stärkere Bodennährstofffreisetzung
AKTIVIERT IHR NÄHRSTOFFPOTENZIAL DER STICKSTOFF-SCHWEFEL-DÜNGER AUS LEUNA Stickstoff- und Schwefeldünger für eine positive Nährstoffdynamik Längere Ammoniumphase und stärkere Bodennährstofffreisetzung
Mikrobiologie des Abwassers
 Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
LN Vortermin SS 02. PC Teil
 LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
Dissoziation, ph-wert und Puffer
 Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Winterthurer Trinkwasser. Chemisch-physikalische Zusammensetzung des Tössgrundwassers. Mittelwerte der Jahre
 Winterthurer Trinkwasser Chemisch-physikalische Zusammensetzung des Tössgrundwassers Mittelwerte der Jahre 2008 2012 Seite 2 von 5 Chemisch-physikalische Zusammensetzung des Trinkwassers in Winterthur
Winterthurer Trinkwasser Chemisch-physikalische Zusammensetzung des Tössgrundwassers Mittelwerte der Jahre 2008 2012 Seite 2 von 5 Chemisch-physikalische Zusammensetzung des Trinkwassers in Winterthur
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie. Allgemeine Chemie. Rückblick auf vorherige Übung
 Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
