Lehrmittel Arztsekretär / Arztsekretärin Arzneimittelkunde
|
|
|
- Juliane Pohl
- vor 6 Jahren
- Abrufe
Transkript
1 Lehrmittel rztsekretär / rztsekretärin rzneimittelkunde ISBN
2 Inhaltsverzeichnis Teil Grundlagen der rzneimittelkunde SK 7 1 Einführung in die rzneimittelkunde SK Lernziele SK Einleitung SK Heutige Entwicklung eines neuen Medikaments SK Grundlagen SK rzneimittellagerung SK Informationsquellen SK 16 ufgaben SK 18 2 Der Weg der Wirkstoffe im Organismus SK Lernziele SK Pharmakokinetik SK Pharmakodynamik SK Blutspiegelkurven SK 24 3 Begriffe aus der rzneimittellehre SK Lernziele SK llgemeine Begriffe SK Dosierungsbegriffe SK 28 ufgaben SK 29 4 Lokale und systemische Wirkung SK Lernziele SK Lokale Wirkung SK Systemische Wirkung SK 31 5 rzneiformen SK Lernziele SK Einleitung SK Orale rzneiformen SK Dermatika SK Parenterale rzneiformen SK Inhalanda, erosole SK Buccale rzneiformen SK Ophtamologika SK Rectalia SK Vaginale rzneiformen SK Verschiedene pplikationswege im Vergleich SK 36 ufgaben SK 38 SK 1
3 Pharmakologie SK Grundlagen der rzneimittelkunde 6 Reglementation der rzneimittel SK Lernziele SK Listeneinteilung SK Betäubungsmittelgesetz (BetmG) SK Selbstdispensation SK LO IV SK 40 ufgaben SK 42 Teil B Spezielle rzneimittelkunde SK 43 7 nalgetika SK Lernziele SK Schmerzentstehung SK Pharmakologischer Eingriff SK Nicht-opioide nalgetika, WHO-Stufe I SK 46 8 Opioide SK Lernziele SK Historisches SK Wirkung der Opioide SK Einsatz der Opioide SK Unerwünschte rzneimittelwirkung der Opioide SK Wirkstoffe SK Toleranzbildung SK ntagonisten am Opioidrezeptor SK 55 ufgaben SK 57 9 Sedativa SK Lernziele SK Benzodiazepine SK ntidepressiva SK Lernziele SK Grundlagen SK Pathogenese SK Wirkmechanismus der ntidepressiva SK Therapeutische Wirkungen der ntidepressiva SK Unerwünschte rzneimittelwirkungen der ntidepressiva SK Wirkstoffe SK Lithiumsalze SK 67 SK 2
4 11 Neuroleptika SK Lernziele SK Grundlagen SK Pathogenese SK Wirkmechanismus der Neuroleptika SK Einsatz von Neuroleptika SK Unerwünschte rzneimittelwirkungen von Neuroleptika SK Wirkstoffe SK 71 ufgaben SK ntibakterielle Pharmakotherapie SK Lernziele SK Einleitung SK Typische Nebenwirkungen von ntibiotika SK Hemmstoffe der Zellwandsynthese SK Hemmstoffe der bakteriellen Proteinsynthese SK ntivirale Pharmakotherapie SK Lernziele SK Pharmakotherapie SK ntimykotische Therapie SK Lernziele SK Einleitung SK Pilze als Krankheitserreger SK Pharmakotherapie SK 80 ufgaben SK Protonenpumpenhemmer (PPI) SK Lernziele SK Eigenschaft und Wirkung SK Nebenwirkungen SK Wirkstoffe SK Magen- und darmmotilitätsfördernde Mittel SK Lernziele SK Eigenschaft und Wirkung SK Wirkstoffe SK Laxantien SK Lernziele SK Einleitung SK Wirkstoffe SK Diarrhö SK Lernziele SK Therapie der Diarrhö SK Wirkstoffe SK 87 SK 3
5 Pharmakologie SK Grundlagen der rzneimittelkunde 19 ntihypertensiva SK Lernziele SK Einleitung SK Pharmakotherapie SK Betablocker SK CE-Hemmer, Sartane, Renin-Hemmer SK Diuretika SK Lernziele SK Einleitung SK llgemeine Nebenwirkungen SK Schleifendiuretika SK Kaliumsparende Diuretika SK Wirkstoffe SK Koronarmittel SK Lernziele SK Einleitung SK Pharmakotherapie SK Herzglykoside SK Lernziele SK Eigenschaft und Wirkung SK Wirkstoffe SK Nebenwirkungen SK ntiarrhythmika SK Lernziele SK Einleitung SK Bradykarde Herzrhythmusstörungen SK Tachykarde Herzrhythmusstörungen SK Schwierigkeit bei der Behandlung mit ntiarrhythmika SK Wirkstoffe SK Thrombozytenaggregationshemmer SK Lernziele SK Einleitung SK Hemmung der Thrombozytenaggregation SK ntikoagulantien SK Lernziele SK Einleitung SK Heparin SK Vitamin K-ntagonisten, Cumarin-Derivate SK Rivaroxaban SK Lipidsenker SK Lernziele SK Einleitung SK Statine SK 108 SK 4
6 27 Diabetes Mellitus SK Lernziele SK Typ-1-Diabetes SK Typ-2-Diabetes SK 110 ufgaben SK sthma bronchiale SK Lernziele SK Einleitung SK Pathogenese SK Pharmakotherapie von sthma bronchiale SK Inhalative Medikamente bei sthma SK Chronisch-obstruktive temwegserkrankung (COPD) SK Lernziele SK Einleitung SK Grundlagen SK Pharmakotherapie der COPD SK Krebsleiden SK Lernziele SK Einleitung SK ngriffspunkte der Krebstherapie SK Nebenwirkungen der Zytostatikatherapie SK Gezielte onkologische Therapie SK 119 ufgaben SK 120 Teil C nhang SK 121 Literatur- und Quellenverzeichnis SK 122 Stichwortverzeichnis SK 123 bbildungsverzeichnis SK 124 SK 5
7 SK 6 Pharmakologie SK Grundlagen der rzneimittelkunde
8 Teil Grundlagen der rzneimittelkunde SK 7
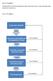
9 Pharmakologie SK Grundlagen der rzneimittelkunde 1 Einführung in die rzneimittelkunde 1 Einführung in die rzneimittelkunde 1.1 Lernziele Die Lernenden können den Begriff «Pharmakologie»erklären. die Prozessschritte der Entwicklung eines neuen Medikaments (Targeting, Vorklinische Entwicklung, Klinische Entwicklung) erklären. das Heilmittelgesetz (HMG) als regulatorisches Gesetz für rzneimittel nennen. die Begriffe rzneimittel und Medizinprodukt unterscheiden. das rzneimittelkompendium und die Swissmedic-Plattform (swissmedicinfo.ch) als Nachlagewerk für rzneimittel nennen. den Begriff Monographie erklären. wiedergeben, wo Informationen über Vergiftungen eingeholt werden können. die korrekte Lagerung von rzneimitteln beschreiben. erläutern, wie Medikamente benannt werden (Phantasienamen, TC, INN). erklären, weshalb Medikamente nicht umgefüllt werden dürfen. folgende Begriffe erklären und Beispiele nennen: Magistralrezeptur, Spezialität 1.2 Einleitung Der Begriff «Pharmakologie» beschreibt die Wissenschaft von den Wechselwirkungen zwischen den Stoffen und den Lebewesen. Ein Stoff, der mit Lebewesen wechselwirkt, wird Pharmakon (englisch «drug») genannt. 1.3 Heutige Entwicklung eines neuen Medikaments Die Entwicklung eines neuen Medikaments ist ein sehr teurer (>1.2 Milliarden CHF) und langer Prozess (acht bis zwölf Jahre). Bis zur Marktreife eines Medikaments werden über 1 Million Substanzen getestet. Letztlich tritt eine Verbindung hervor, die dann eingesetzt werden kann. Ist die Verbindung auf dem Markt, wird sie weiterhin überwacht und kann bei unerwünschten Nebenwirkungen, die zuvor unerkannt blieben, zurückgezogen werden (Bsp. Rückzug Vioxx am nach Einführung 1999 aufgrund des erhöhten Risikos für einen Herzinfarkt (Quelle Merck). bb. 1 Werdegang eines Medikaments bb. 1www.interpharma.ch SK 8
10 1 Einführung in die rzneimittelkunde bb. 2 Entwicklungskosten eines Medikaments bb. 2www.interpharma.ch Im Folgenden werden die einzelnen Entwicklungsschritte erläutert, die ein potentieller Wirkstoff bis zum Markteintritt passieren muss. bb. 3 Entwicklungsstufen eines Medikaments bb. 3gezeichnet, basiert auf Forschung Präklinik Klinische Phase Verkauf Target Identifizierung und Validierung Screening- uffinden von aktiven Substanzen Chemische Optimierung Präklinik- Frühe klinische Sicherheit und Wirksamkeit Phase-I- Studien Untersuchung mit Gesunden Phase-II- Studien Untersuchung mit wenigen Kranken Phase-III- Studien Untersuchung mit vielen Kranken Zulassung Markteinführung Forschung Target-Identifizierung und Validierung Bevor ein neuer Wirkstoff entwickelt werden kann, muss eine Krankheit identifiziert werden, resp. deren Wirkmechanismus geklärt sein. Ein Wirkmechanismus beschreibt den Prozess, wie eine Krankheit entstehen kann. Durch den Einsatz von Medikamenten versucht man genau diesen Wirkmechanismus zu manipulieren. So kann ein Wirk- bzw. Krankheitsmechanismus die Produktion eines Eiweisses sein. Jetzt besteht die Möglichkeit, entweder dieses Eiweiss zu hemmen, damit es im Körper keinen Schaden anrichten kann, oder man versucht die Entstehung dieses Eiweisses zu verhindern, wodurch die Entstehung der Krankheit unterbunden werden kann. Neben einem Eiweiss kann auch ein Rezeptor, der Prozesse in Gang setzt, ein «Target» sein, das man zu manipulieren versucht. Ist dieses «Target» gefunden, muss es zunächst validiert werden. Dass heisst, es muss geprüft werden, ob das Target wirklich für diese Krankheit verantwortlich ist. Ziel eines neuen Medikaments ist es nun, dieses Target beispielsweise zu hemmen, zu induzieren (aktivieren) oder zu substituieren (ersetzen). Ein Beispiel: Bei Diabetes Typ I ist die Insulinproduktion eingeschränkt oder nicht mehr vorhanden. Durch Substitution durch gentechnologisch hergestelltes Insulin kann die Krankheit bedingt therapiert werden. B Screening uffinden von aktiven Substanzen In einem weiteren Schritt wird eine grosse nzahl von chemischen Verbindungen in einem sogenannten «high throughput screening» (HTS) in Bezug auf das oben identifizierte Target SK 9
11 Pharmakologie SK Grundlagen der rzneimittelkunde 1 Einführung in die rzneimittelkunde getestet. Die Pharmafirmen verfügen über eine grosse nzahl chemischer Verbindungen in einer Bibliothek, die sie für diese Tests verwenden. Diese Tests sollen aufzeigen, ob die chemische Verbindung eine Reaktion auslösen kann. Durch dieses hochgradig automatisierte Verfahren ist es möglich, in relativer kurzer Zeit Moleküle zu finden, die Eigenschaften besitzen, um das Target beispielsweise zu hemmen. C Chemische Optimierung Werden potentielle Leitstrukturen («leads») gefunden, die beim Target eine gewünschte ktivität aufzeigen, werden diese in einem weiteren Verfahren optimiert. Kriterien sind Eigenschaften wie z. B. Wirksamkeit, Verträglichkeit und Verteilung im Körper. Durch chemische Modifikationen der Strukturen kann beispielsweise die Bindungsaffinität (Bindung des rzneimittels an den Wirkort) verstärkt und verbessert werden. Einige Kandidaten werden bei dieser Prüfung verworfen. Ein Beispiel der chemischen Modifikationen bildet die allseits bekannte cetylsalicylsäure (spirin ). Die Salicylsäure, gewonnen aus der Weidenrinde, war schon in der ntike bekannt. Erst 1874 gelang es dem Marburger Professor H. Kolbe, die Salicylsäure synthetisch herzustellen, wodurch die industrielle Produktion der Salicylsäure ihren Lauf nahm. Die Salicylsäure hat schmerzlindernde Wirkung. Ein Problem aber war, dass sie einen schlechten, bitteren Geschmack hatte und die Schleimhäute erheblich reizte. Der Chemiker Felix Hoffmann, der selbst unter rthritis litt und Salicylsäure einnehmen musste, entwickelte angeblich wegen dieser Nebenwirkungen eine neue Form der Salicylsäure, die cetylsalicylsäure. Dieses Produkt, das er 1897 hergestellt hat, verbesserte die Eigenschaften der Salicylsäure erheblich. Die Reizung der Schleimhäute, der unangenehme Geruch und die entzündungshemmende Wirkung wurde verbessert. Diese chemische Modifikation, die nur eine zusätzliche chemische Gruppe am Molekül ist, ist ein exemplarisches Beispiel, wie Medizinalchemiker Wirkstoffe verändern und auch verbessern können, falls dies möglich ist. bb. 4 O OH O OH OH cetylierung O CH 3 O Präklinik Frühe klinische Sicherheit und Wirksamkeit Die präklinische Phase ist die Untersuchungsphase, bevor die Struktur am Menschen getestet wird. Denn am Menschen werden nur Substanzen getestet, die sich als unbedenklich erweisen. Eine hundertprozentige Unbedenklichkeit kann allerdings nie garantiert werden (siehe Rückzug Vioxx ). Natürlich ist man versucht, toxische (giftige) Verbindungen so früh wie möglich zu eliminieren. In dieser Untersuchungsphase werden computergestützte Verfahren (sogenannte «in silico»- Verfahren) zur Erkennung von toxischen Verbindungen eingesetzt. Weiter werden toxische Wirkungen an Zellkulturen getestet und weitere Labortests («in vitro») durchgeführt. uch «in vivo»- Tests an geeigneten Versuchstieren (verschiedene Spezies) werden durchgeführt Klinische Phase Bevor der Wirkstoff an einer grossen Gruppe von Patienten in verschiedenen Zentren getestet werden kann (Phase-III-Studien), werden Machbarkeitsstudien (Proof of concept, PoC-Studien) durchgeführt, zu diesen Studien zählen Phase-I und Phase-II-Studien. SK 10
12 1 Einführung in die rzneimittelkunde Phase-I-Studien In der Regel wird in der Phase I an einer Gruppe von Gesunden getestet. Zu Beginn werden nur niedrige Wirkstoffdosen verabreicht. In dieser Phase geht es darum, die Sicherheit, sichere Dosierung, sowie die unerwünschten rzneimittelwirkungen zu ermitteln. B Phase-II-Studien Sobald die Phase-I-Studie erfolgreich abgeschlossen ist, wird die neue Wirksubstanz an Patienten mit entsprechender Erkrankung getestet. Um die Wirksamkeit oder einen Vorteil gegenüber einem bisher verfügbaren Medikament zu beweisen, wird in der Regel eine Doppelblindstudie durchgeführt. Doppelblind heisst, dass weder der Patient noch der verabreichende rzt wissen, ob sie das neue Medikament, das Vergleichsmedikament oder ein Placebo abgeben bzw. erhalten. Nach abgeschlossener Studie sollte die optimale Dosierung, Wirksamkeit und Verträglichkeit optimiert und bekannt sein. C Phase-III-Studien In dieser Phase wird das Medikament an vielen tausend Patienten an internationalen Zentren getestet. Ziel dieser grossen Verteilung ist es, möglichst viele Informationen bezüglich Wirksamkeit und Verträglichkeit zu gewinnen, auch im Hinblick auf die genetischen Unterschiede der Populationen. Schliesslich soll eine unbedenkliche nwendung der rznei bewiesen werden. Nach bschluss dieser Phase kann die Zulassung bei den rzneimittelbehörden beantragt werden Zulassung, Markteinführung Zulassung In der Schweiz werden neue Medikamente durch die schweizerische rzneimittelbehörde «Swissmedic», in der EU durch die EM (European Medicines gency, Sitz in London) zugelassen. Die Behörden beurteilen die Dossiers des Herstellers eingehend auf Qualität der Medikation, Wirksamkeit und Sicherheitsdaten. Kommt die Behörde zum Schluss, dass diese nforderungen erfüllt sind, wird die Zulassung für das neue Medikament erteilt. SK 11
13 Pharmakologie SK Grundlagen der rzneimittelkunde 1 Einführung in die rzneimittelkunde bb. 4 Zulassungsverfahren Swissmedic bb. 5Pharmamarkt Schweiz 2013 SK 12
14 1 Einführung in die rzneimittelkunde B Markteinführung Wenn das neue Produkt eingeführt ist, wird es weiterhin überwacht. Ärzte und potheker sind gesetzlich verpflichtet, auftretende Nebenwirkungen der rzneimittelbehörde zu melden ( Pharmakovigilanz). Wie unter Kapitel 1.2 erwähnt, kann es bei schweren unerwünschten rzneimittelnebenwirkungen zum Rückzug des Medikaments kommen. Ebenso werden nach Markteintritt weitere statistische Daten seitens des Herstellers für wissenschaftliche Zwecke gesammelt. Wird eine neue nwendungsmöglichkeit (Indikation) für das Medikament entdeckt, werden wiederum klinische Studien durchgeführt, um diese Erkenntnis zu belegen. Sollte sich die Entdeckung bestätigen, wird die neue Indikation im Rahmen eines neuen Zulassungsverfahrens untersucht. So werden heute frühere ntihistaminika zur Behandlung von llergien als Medikamente zur Behandlung leichter Schlafstörungen eingesetzt (Neue Indikation: leichte Schlafstörungen). 1.4 Grundlagen Definition rzneimittel Das Bundesgesetz über rzneimittel und Medizinprodukte kurz Heilmittelgesetz (HMG) vom reguliert in der Schweiz den Umgang, Vertrieb etc. von rzneimitteln. bb. 5 uszug HMG vom bb Kapitel: llgemeine Bestimmungen rt. 1 Zweck 1 Dieses Gesetz soll zum Schutz der Gesundheit von Mensch und Tier gewährleisten, dass nur qualitativ hoch stehende, sichere und wirksame Heilmittel in Verkehr gebracht werden. 2 Es soll zudem: a. Konsumentinnen und Konsumenten von Heilmitteln vor Täuschung schützen; b. dazu beitragen, dass die in Verkehr gebrachten Heilmittel ihrem Zweck entsprechend und massvoll verwendet werden; c. dazu beitragen, dass eine sichere und geordnete Versorgung mit Heilmitteln, einschliesslich der dafür nötigen fachlichen Information und Beratung, im ganzen Land angeboten wird. 3 Beim Vollzug dieses Gesetzes, insbesondere beim Erlass von Verordnungen und bei der nwendung im Einzelfall, ist darauf zu achten, dass: a. die Leistungsfähigkeit und die Unabhängigkeit der schweizerischen Heilmittelkontrolle gewahrt werden; b. für die Forschung und Entwicklung im Heilmittelbereich günstige Rahmenbedingungen bestehen; c. die miteinander im Wettbewerb stehenden Marktpartner den gleichen gesetzlichen Sicherheits- und Qualitätsanforderungen genügen. SK 13
15 Pharmakologie SK Grundlagen der rzneimittelkunde 1 Einführung in die rzneimittelkunde bb. 6 uszug HMG vom bb. 7 rt. 4 Begriffe 1 Im Sinne dieses Gesetzes gelten als: a. rzneimittel: Produkte chemischen oder biologischen Ursprungs, die zur medizinischen Einwirkung auf den menschlichen oder tierischen Organismus bestimmt sind oder angepriesen werden, insbesondere zur Erkennung, Verhütung oder Behandlung von Krankheiten, Verletzungen und Behinderungen; zu den rzneimitteln gehören auch Blut und Blutprodukte; b. Medizinprodukte: Produkte, einschliesslich Instrumente, pparate, In-vitro- Diagnostika, Software und andere Gegenstände oder Stoffe, die für die medizinische Verwendung bestimmt sind oder angepriesen werden und deren Hauptwirkung nicht durch ein rzneimittel erreicht wird; c. Herstellen: sämtliche rbeitsgänge der Heilmittelproduktion von der Beschaffung der usgangsmaterialien über die Verarbeitung bis zur Verpackung, Lagerung und uslieferung des Endproduktes sowie die Qualitätskontrollen und die Freigaben; d. Inverkehrbringen: das Vertreiben und bgeben von Heilmitteln; e. Vertreiben: die entgeltliche oder unentgeltliche Übertragung oder Überlassung eines Heilmittels mit usnahme des bgebens; f. bgeben: die entgeltliche oder unentgeltliche Übertragung oder Überlassung eines verwendungsfertigen Heilmittels für die Verwendung durch den Erwerber oder die Erwerberin sowie für die nwendung an Drittpersonen oder an Tieren; g. Pharmakopöe (Pharmacopoea Europaea und Pharmacopoea Helvetica): eine Sammlung von Vorschriften über die Qualität von rzneimitteln, pharmazeutischen Hilfsstoffen und einzelnen Medizinprodukten. 2 Der Bundesrat kann durch Verordnung die übrigen in diesem Gesetz verwendeten Begriffe sowie die Begriffe nach bsatz 1 voneinander abgrenzen, näher ausführen und gestützt auf neue Erkenntnisse in Wissenschaft und Technik sowie in nlehnung an die internationale Entwicklung usnahmen vorsehen. Das Gesetz definiert was ein rzneimittel ist und grenzt es von den Medizinprodukten ab Pharmazeutische Spezialität Eine pharmazeutische Spezialität wird gemäss der Pharmacopoea Helvetica (Schweizerisches rzneibuch) ein rzneimittel bezeichnet, welches im voraus hergestellt wurde und in seiner verwendungsfertigen Form mit einer besonderen Bezeichnung (Markenname) oder ufmachung (Verpackung etc.) angeboten wird. SK 14
16 1 Einführung in die rzneimittelkunde bb. 7 Vom Pharmakon zum Fertigarzneimittel (Spezialität) anhand des Beispiels Panadol bb. 8 Pharmakon Pharmakologische Prüfung rzneistoff it Hilfsstoffe Pharmazeutisch-technologisch (galenische) Verarbeitung Plat zhal ter Bil dw wird ge lie fer t rzneimittel Fertigarzneimittel Zulassung industrielle Fertigung Namensgebung von Spezialitäten Chemisch definierte rzneistoffe werden weltweit nach einem WHO festgelegten Freinamen (= generic name= international non- proprietary name =INN) bezeichnet. Hinter diesem Freinamen verbirgt sich ein System. Pharmakologisch verwandte Gruppen von Wirkstoffen werden charakterisiert und können anhand der Namensgebung zueinander zugeordnet werden. Beispiel Cephalosporine besitzen das Präfix «Cef-» Cefuroxim, Cefixim Corticosteroide besitzen das Infix «-cort» Hydrocortison, Fluocortolon Benzodiazepine besitzen das Suffix «-azepam» Diazepam, Nitrazepam Des Weiteren wird jedem Wirkstoff einem TC- Code zugeordnet (natomisch- Therapeutisch- Chemischen Klassifikationssystem). Mit diesem Code werden die Wirkstoffe den entsprechenden Therapeutischen Gruppen zugeordnet. Bsp. Paracetamol = N02BE N = Nervous System 02 = nalgesic B = Other nalgesics and ntipyretics E = nilides Der Markennamen, worunter die Medikamente vertrieben werden ist ein Phantasienamen, der von den Firmen selbst bestimmt wird. Dieser ist geschützt und durch ein gekennzeichnet (Bsp. Voltaren, Wirkstoff Diclofenac) Magistralrezeptur Bei einer Magistralrezeptur handelt es sich um ein rzneimittel, welches auf ärztliches Rezept für eine bestimmte Person oder Tier ad hoc (zur unmittelbaren Gabe) hergestellt wird. Die Herstellung erfolgt in einer öffentlichen potheke, Spitalapotheke oder in bestimmten Betrieben. SK 15
17 Pharmakologie SK Grundlagen der rzneimittelkunde 1 Einführung in die rzneimittelkunde Die Herstellung erfolgt gemäss einer Rezeptur, die Qualitätssicherung erfolgt gemäss dem rzneibuch (Pharmacopoe). 1.5 rzneimittellagerung rzneimittel sind während der Lagerung permanent verschiedenen Umwelteinflüssen ausgesetzt. Im Wesentlichen handelt es sich um Temperatur, Luftfeuchtigkeit, Sauerstoff, Licht und Mikroorganismen. Diese und weitere Faktoren verändern das rzneimittel von aussen, je stärker und je länger es ihnen ausgesetzt ist. Es ist daher sinnvoll, das rzneimittellager so klein und übersichtlich wie möglich zu halten, um die Lagerdauer zu begrenzen. uf folgende Punkte muss bei der rzneimittellagerung geachtet werden: Temperatur: Raumtemperatur (15 25 C), Kühllagerung (8 15 C), Kühlschrank (2 8 C), Kühlkette, Tiefkühlung (< 15 C) Licht, Luftsauerstoff, Mikroorganismen, Staub, Feuchtigkeit: Braunglas, Kartonschachtel Mechanische Einflüsse: beim Transport, beim Einfüllen, durch Fallenlassen, Haarrisse Zeit: Verfalldatum, nbruchdatum Erkennen von Veränderungen: Geruch, Farbe, Trübungen, usfällungen, Brechen von Emulsionen, Konsistenz, Oberflächenveränderungen bei festen rzneiformen (Risse, ufquellen) rzneimittelschrank: alphabetische Einordnung, Lagerung von Betäubungsmitteln, feuergefährliche Flüssigkeiten Mehrdosenbehältnisse: nbruch kennzeichnen, ufbrauchsdatum anbringen, z. B. bei Salben, Lösungen, mpullen zur Mehrfachentnahme Einen wichtigen Grundsatz im Umgang mit rzneimitteln gilt es immer zu beachten: Das Umfüllen von Medikamenten ist verboten! 1.6 Informationsquellen Sämtliche in der Schweiz von Swissmedic zugelassenen und registrierten Medikamente werden im rzneimittelkompendium der Schweiz aufgeführt. Das rzneimittelkompendium wurde im Jahr 2013 das letzte Mal gedruckt und ist ab 2014 nur noch online verfügbar. Neben der Fachinformation mit der ausführlichen Beschreibung wird auch eine Patienteninformation erstellt, die von Laien einfacher verstanden werden sollte. Jedes Medikament wird als Monographie (eine umfassende Beschreibung des Medikaments) unter seinem Markennamen ausgewiesen. SK 16
18 1 Einführung in die rzneimittelkunde Eine Monographie beinhaltet folgende Informationen über ein einzelnes Medikament: Handelsname des Produkts Zusammensetzung (Wirkstoff, Hilfsstoffe) Galenische Form(rzneiform) und Wirkstoffmenge pro Einheit Indikation/nwendungsmöglichkeiten Dosierung/ nwendung Kontraindikationen Warnhinweise und Vorsichtsmassnahmen Interaktionen Schwangerschaft/Stillzeit Wirkung auf Fahrtüchtigkeit und auf das Bedienen von Maschinen Unerwünschte Wirkungen Überdosierung Eigenschaften/Wirkungen Pharmakokinetik Präklinische Daten Sonstige Hinweise Zulassungsnummer Zulassungsinhaberin Stand der Informationen Weiter sind im rzneimittelkompendium folgende Informationen vorhanden: bgabekategorien (Btm,, B, C, D, E) Häufigkeiten von unerwünschten Wirkungen (>10 %, >5 % häufig, 5 0,1 % gelegentlich, >0,1 % selten) Die kostenpflichtige Datenbank pharmavista.ch bietet neben der regulären rzneimittelinformation auch die Möglichkeit, ausländische Präparate nachzuschlagen. Bei einem Vergiftungsfall mit einem Medikament kann das Schweizerische Toxikologische Informationszentrum unter der Nummer 145 ( während 24 h angerufen werden. Seit Januar 2013 betreibt Swissmedic (Schweizerisches Heilmittelinstitut) das rzneimittelinformations-publikationssystem (IPS), worin die aktuellsten Informationen zu allen zugelassenen rzneimitteln in der Schweiz online verfügbar sind. Diese Plattform ist unter als Datenbank für die Öffentlichkeit abrufbar. Das Hochladen der entsprechenden Fachinformation ist bei der Neuzulassung eines Medikaments Voraussetzung für die Marktzulassung. SK 17
19 Pharmakologie SK Grundlagen der rzneimittelkunde ufgaben ufgabe 1 ufgabe 2 Was wird im Rahmen der Entwicklung eines neuen Medikaments im Prozess des Targeting, der präklinischen und der klinischen Entwicklung jeweils untersucht? Sind die folgenden Beispiele rzneimittel oder Medizinprodukte? ntikörper gegen Masern Herzschrittmacher Thrombozytenkonzentrat Desinfektionsmittel rzneimittel Medizinprodukt ufgabe 3 ufgabe 4 Nennen Sie drei mögliche Gefahren, die beim Umfüllen von Medikamenten auftreten können. Zeichnen Sie bei der unten stehenden Medikamentenpackung folgende Begriffe ein: Markenname (1), INN (2), rzneiform (3), Medikamentengruppe (4) bb. 9 SK 18
Inhaltsverzeichnis. Teil A Grundlagen der Arzneimittelkunde 7
 Inhaltsverzeichnis Teil A Grundlagen der Arzneimittelkunde 7 1 Einführung in die Arzneimittelkunde 8 1.1 Lernziele 8 1.2 Einleitung 8 1.3 Heutige Entwicklung eines neuen Medikaments 8 1.4 Grundlagen 13
Inhaltsverzeichnis Teil A Grundlagen der Arzneimittelkunde 7 1 Einführung in die Arzneimittelkunde 8 1.1 Lernziele 8 1.2 Einleitung 8 1.3 Heutige Entwicklung eines neuen Medikaments 8 1.4 Grundlagen 13
Inhaltsverzeichnis. Teil A Medizinische Grundlagen 9
 Inhaltsverzeichnis Teil A Medizinische Grundlagen 9 1 Einleitung 10 1.1 Lernziele 10 1.2 Einführung in die Pharmakologie 10 1.3 Geschichte der Pharmakologie 10 Übungsfragen 12 2 Arzneimittel und Informationsquellen
Inhaltsverzeichnis Teil A Medizinische Grundlagen 9 1 Einleitung 10 1.1 Lernziele 10 1.2 Einführung in die Pharmakologie 10 1.3 Geschichte der Pharmakologie 10 Übungsfragen 12 2 Arzneimittel und Informationsquellen
Lehrmittel Arztsekretär/Arztsekretärin. Lösungen zu Arzneimittellehre
 Lehrmittel rztsekretär/rztsekretärin Lösungen zu rzneimittellehre Lehrmittel rztsekretär/rztsekretärin Lösungen zu rzneimittellehre utor: Cédric Wernli Grafisches Konzept und Satz: Mediengestaltung, Compendio
Lehrmittel rztsekretär/rztsekretärin Lösungen zu rzneimittellehre Lehrmittel rztsekretär/rztsekretärin Lösungen zu rzneimittellehre utor: Cédric Wernli Grafisches Konzept und Satz: Mediengestaltung, Compendio
Zulassung von Arzneimitteln. Klinische Untersuchungen. Katalin Müllner
 Zulassung von Arzneimitteln. Klinische Untersuchungen Katalin Müllner Arzneimittel In gesetzlicher Definition sind Arzneimittel Stoffe oder Zubereitungen aus Stoffen, die vom Hersteller, der sie in den
Zulassung von Arzneimitteln. Klinische Untersuchungen Katalin Müllner Arzneimittel In gesetzlicher Definition sind Arzneimittel Stoffe oder Zubereitungen aus Stoffen, die vom Hersteller, der sie in den
Pharmakologische Grundlagen
 Pharmakologische Grundlagen Die Pharmakologie ist die Wissenschaft von den Wechselwirkungen zwischen Stoffen und Lebewesen (Zitat: Wikipedia) Wertung der Stoffe: Arzneistoffe (Pharmakologie) Giftstoffe
Pharmakologische Grundlagen Die Pharmakologie ist die Wissenschaft von den Wechselwirkungen zwischen Stoffen und Lebewesen (Zitat: Wikipedia) Wertung der Stoffe: Arzneistoffe (Pharmakologie) Giftstoffe
Von der Idee zum Medikament Arbeitsblatt
 Lehrerinformation 1/7 Arbeitsauftrag Ziel Material Illegal hergestellte Medikamente entsprechen nicht den geforderten Qualitätskriterien. Die Unternehmen, welche legal Medikamente entwickeln und produzieren,
Lehrerinformation 1/7 Arbeitsauftrag Ziel Material Illegal hergestellte Medikamente entsprechen nicht den geforderten Qualitätskriterien. Die Unternehmen, welche legal Medikamente entwickeln und produzieren,
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung und die Meldepflicht von Arzneimitteln
 Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung und die Meldepflicht von Arzneimitteln (VAZV) vom 9. November 2001 (Stand am 28. Dezember 2001) Das Schweizerische Heilmittelinstitut
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung und die Meldepflicht von Arzneimitteln (VAZV) vom 9. November 2001 (Stand am 28. Dezember 2001) Das Schweizerische Heilmittelinstitut
100 g Gel enthalten als Wirkstoff Diclofenac Epolamin entsprechend 1 g Diclofenac Natrium.
 Effigel Zusammensetzung Wirkstoff: Diclofenacum epolaminum. Hilfsstoffe: aromatica; conserv.: alcohol isopropylicus; excip. ad gelatum. Galenische Form und Wirkstoffmenge pro Einheit 100 g Gel enthalten
Effigel Zusammensetzung Wirkstoff: Diclofenacum epolaminum. Hilfsstoffe: aromatica; conserv.: alcohol isopropylicus; excip. ad gelatum. Galenische Form und Wirkstoffmenge pro Einheit 100 g Gel enthalten
Biosimilars ähnlich, aber nicht identisch!
 Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
Arzneimittelentwicklung
 Arzneimittelentwicklung Vom Molekül zum Medikament /////////// Dr. med. Konstanze Diefenbach (Leitern Medizin Bayer Vital GmbH) Mai 2018 Vom Molekül zum Medikament: Der lange Weg der Arzneimittelentwicklung
Arzneimittelentwicklung Vom Molekül zum Medikament /////////// Dr. med. Konstanze Diefenbach (Leitern Medizin Bayer Vital GmbH) Mai 2018 Vom Molekül zum Medikament: Der lange Weg der Arzneimittelentwicklung
Wie ein neues Medikament entsteht
 Wie ein neues Medikament entsteht Bis ein neues Medikament entwickelt ist und auf den Markt kommt, braucht es eine zündende Idee der Forscher und viel Ausdauer. Zehn und mehr Jahre vergehen bis das Medikament
Wie ein neues Medikament entsteht Bis ein neues Medikament entwickelt ist und auf den Markt kommt, braucht es eine zündende Idee der Forscher und viel Ausdauer. Zehn und mehr Jahre vergehen bis das Medikament
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie. Sonderfach Grundausbildung (36 Monate)
 Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) 1. Standardisierungsmethoden und biologische Tests 2. Biometrische Methoden 3. Medikamente,
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) 1. Standardisierungsmethoden und biologische Tests 2. Biometrische Methoden 3. Medikamente,
QMS Klinische Forschung
 Standard Operating Procedures (SOP) - Prozessbeschreibung ID P2_PM_01 Version: 1.0 Gültig ab: Erstellt von: Astrid Mattes (am 04. Februar 2013) Freigegeben von: Christiane Pauli-Magnus (am 05. März 2013)
Standard Operating Procedures (SOP) - Prozessbeschreibung ID P2_PM_01 Version: 1.0 Gültig ab: Erstellt von: Astrid Mattes (am 04. Februar 2013) Freigegeben von: Christiane Pauli-Magnus (am 05. März 2013)
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten
 Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 (Stand am 1. Januar 2019) Der Institutsrat
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 (Stand am 1. Januar 2019) Der Institutsrat
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie. Sonderfach Grundausbildung (36 Monate)
 Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) A) Kenntnisse absolviert 1. Standardisierungsmethoden und biologische Tests 2. Biometrische
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) A) Kenntnisse absolviert 1. Standardisierungsmethoden und biologische Tests 2. Biometrische
Off-label-use von Arzneimittel in der Palliativmedizin
 Off-label-use von Arzneimittel in der Palliativmedizin Kurzvorstellung des Dissertationsvorhabens Katrin Seibold April 2008 Ausgangssituation Projekt betacare Schmerz & Palliativ Ziel: Aufbau eines umfassenden,
Off-label-use von Arzneimittel in der Palliativmedizin Kurzvorstellung des Dissertationsvorhabens Katrin Seibold April 2008 Ausgangssituation Projekt betacare Schmerz & Palliativ Ziel: Aufbau eines umfassenden,
Studien im Darmzentrum Oberhavel
 Studien im Darmzentrum Oberhavel? 1564484 medizinische-ausrüstung-wi.de/123rfcom Studien im Darmzentrum Oberhavel Ziel dieses Vortrages: - Sinn und Zweck von Studien zu verstehen - Aufgabenbereiche kennen
Studien im Darmzentrum Oberhavel? 1564484 medizinische-ausrüstung-wi.de/123rfcom Studien im Darmzentrum Oberhavel Ziel dieses Vortrages: - Sinn und Zweck von Studien zu verstehen - Aufgabenbereiche kennen
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 [Version 7.3.2, 10/2011] ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Theranekron D6 Injektionslösung für Tiere 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
[Version 7.3.2, 10/2011] ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Theranekron D6 Injektionslösung für Tiere 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wozu ein Gesetz, das Arzneimittel behandelt? Arzneimittelgesetz (AMG)
 Gesetzliche Regelungen für Arzneimittel Wozu ein Gesetz, das Arzneimittel behandelt? Arzneimittelgesetz (AMG) 1 Zweck des Gesetzes Es ist der Zweck dieses Gesetzes, im Interesse einer ordnungsgemäßen Arzneimittelversorgung
Gesetzliche Regelungen für Arzneimittel Wozu ein Gesetz, das Arzneimittel behandelt? Arzneimittelgesetz (AMG) 1 Zweck des Gesetzes Es ist der Zweck dieses Gesetzes, im Interesse einer ordnungsgemäßen Arzneimittelversorgung
STUDIEN PRO UND CONTRA
 V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten
 Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 Der Institutsrat des Schweizerischen Heilmittelinstituts
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 Der Institutsrat des Schweizerischen Heilmittelinstituts
Pharmakologie 1 Allgemeine Prinzipien Spezielle Arzneistoffgruppen 78
 Pharmakologie 1 Allgemeine Prinzipien 20 2 Spezielle Arzneistoffgruppen 78 I Allgemeine Prinzipien 1 Allgemeine Prinzipien 1.1 Arzneimittelherkunft Am Anfang der Entwicklung steht die Synthese neuer chemischer
Pharmakologie 1 Allgemeine Prinzipien 20 2 Spezielle Arzneistoffgruppen 78 I Allgemeine Prinzipien 1 Allgemeine Prinzipien 1.1 Arzneimittelherkunft Am Anfang der Entwicklung steht die Synthese neuer chemischer
Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG)
 Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG) 1. Zweck dieses Merkblatts Dieses Merkblatt gibt eine Übersicht darüber, welche Tätigkeiten im
Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG) 1. Zweck dieses Merkblatts Dieses Merkblatt gibt eine Übersicht darüber, welche Tätigkeiten im
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
HMG 2 / HMV IV Transparenz Veröffentlichung von Gesuchseingang, Zulassungsentscheid bis SwissPAR
 Swissmedic Regulatory News aus dem Bereich Zulassung 2017 11. Dezember 2017, Hotel Allegro/Kursaal Bern HMG 2 / HMV IV Transparenz Veröffentlichung von Gesuchseingang, Zulassungsentscheid bis SwissPAR
Swissmedic Regulatory News aus dem Bereich Zulassung 2017 11. Dezember 2017, Hotel Allegro/Kursaal Bern HMG 2 / HMV IV Transparenz Veröffentlichung von Gesuchseingang, Zulassungsentscheid bis SwissPAR
Swissmedic Regulatory News aus dem Bereich Zulassung Dezember 2017, Hotel Allegro/Kursaal Bern
 Swissmedic Regulatory News aus dem Bereich Zulassung 2017 11. Dezember 2017, Hotel Allegro/Kursaal Bern Volldeklaration Dr. Philipp Weyermann, Leiter Einheit Case Management 2 Swissmedic Schweizerisches
Swissmedic Regulatory News aus dem Bereich Zulassung 2017 11. Dezember 2017, Hotel Allegro/Kursaal Bern Volldeklaration Dr. Philipp Weyermann, Leiter Einheit Case Management 2 Swissmedic Schweizerisches
Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG
 Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG Die folgende SOP basiert auf dem EU-Guidance Dokument vom März 2010 mit seinem Decision Tree (siehe
Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG Die folgende SOP basiert auf dem EU-Guidance Dokument vom März 2010 mit seinem Decision Tree (siehe
Neuerstellung mit HMV4 fua
 Inhaltsverzeichnis 1 Definitionen, Begriffe, Abkürzungen... 1 Definitionen und Begriffe... 1 1.1.1 Radiopharmazeutika... 1 1.1.2 Formula-Radiopharmazeutika... 2 1.1.3 Wirkstoffe für Formula-Radiopharmazeutika
Inhaltsverzeichnis 1 Definitionen, Begriffe, Abkürzungen... 1 Definitionen und Begriffe... 1 1.1.1 Radiopharmazeutika... 1 1.1.2 Formula-Radiopharmazeutika... 2 1.1.3 Wirkstoffe für Formula-Radiopharmazeutika
Ein Wirkstoff ist ein Stoff der Krankheiten heilen oder lindern kann. Er kann natürlicher oder künstlicher Herkunft sein.
 Buch S. 83 Aufgabe 1 Ein Wirkstoff ist ein Stoff der Krankheiten heilen oder lindern kann. Er kann natürlicher oder künstlicher Herkunft sein. Buch S. 83 Aufgabe 2 Suche nach Wirkstoff Testen der Wirksamkeit
Buch S. 83 Aufgabe 1 Ein Wirkstoff ist ein Stoff der Krankheiten heilen oder lindern kann. Er kann natürlicher oder künstlicher Herkunft sein. Buch S. 83 Aufgabe 2 Suche nach Wirkstoff Testen der Wirksamkeit
Verordnung über die Bewilligungen im Arzneimittelbereich
 Verordnung über die Bewilligungen im Arzneimittelbereich (Arzneimittel-Bewilligungsverordnung, AMBV) Änderung vom 8. September 2010 Der Schweizerische Bundesrat verordnet: I Die Arzneimittel-Bewilligungsverordnung
Verordnung über die Bewilligungen im Arzneimittelbereich (Arzneimittel-Bewilligungsverordnung, AMBV) Änderung vom 8. September 2010 Der Schweizerische Bundesrat verordnet: I Die Arzneimittel-Bewilligungsverordnung
Zusammensetzung von Medikamenten Lehrerinformation
 02 / Medikamente Lehrerinformation 1/5 Arbeitsauftrag Ziel Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der
02 / Medikamente Lehrerinformation 1/5 Arbeitsauftrag Ziel Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der
Hedera Effervescent Tablets MODULE Product Information SPC, Labelling and Package Leaflet 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1
 Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1 Das Programm für Ihre Gesundheit 2 AOK-Curaplan Diabetes mellitus Typ 1 Was ist AOK-Curaplan? An den strukturierten Behandlungsprogrammen für chronisch
Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1 Das Programm für Ihre Gesundheit 2 AOK-Curaplan Diabetes mellitus Typ 1 Was ist AOK-Curaplan? An den strukturierten Behandlungsprogrammen für chronisch
Texte, Arbeitsblätter Zeichnungsmaterial für Werbung
 Zusammensetzung von Medikamenten Arbeitsauftrag: Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der Arbeitsblätter
Zusammensetzung von Medikamenten Arbeitsauftrag: Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der Arbeitsblätter
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Was sind klinische Prüfungen Eine Einführung. Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa
 Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose
 Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Bewilligungsantrag Nucala (Mepolizumab) - Erstdokumentation
 Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Vorlesung Medizinrecht
 Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Bezirksregierung Münster Dezernat 24 Domplatz Münster Fax: +49 (251)
 Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR-α-Tocopherol (Vitamin E), 200 I.E. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR-α-Tocopherol (Vitamin E), 200 I.E. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten
 1/5 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG In 1 Tablette sind enthalten: Capsicum
1/5 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tonsipret Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG In 1 Tablette sind enthalten: Capsicum
Bedeutung von Nebenwirkungen
 Bedeutung von Nebenwirkungen NW erhöhen Morbidität und Mortalität von Patienten erheblich: Etwa 3-6% aller stationären Aufnahmen sind durch UAW bedingt [Pirmohamed M et al., BMJ 2004; Lazarou J et al.,
Bedeutung von Nebenwirkungen NW erhöhen Morbidität und Mortalität von Patienten erheblich: Etwa 3-6% aller stationären Aufnahmen sind durch UAW bedingt [Pirmohamed M et al., BMJ 2004; Lazarou J et al.,
Von der Idee zum Medikament Forschung & Entwicklung
 Backgrounder Von der Idee zum Medikament Forschung & Entwicklung Inhalt 1. Wie wird ein Wirkstoffkandidat gefunden? 2. Welche Phasen der klinischen Prüfung gibt es? 3. Was sind die Ziele der Forschung
Backgrounder Von der Idee zum Medikament Forschung & Entwicklung Inhalt 1. Wie wird ein Wirkstoffkandidat gefunden? 2. Welche Phasen der klinischen Prüfung gibt es? 3. Was sind die Ziele der Forschung
WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht. Mittwoch, 6. Januar Pandemie - Teil IX
 Ministerium für,,, und WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht Mittwoch, 6. Januar 2010 Pandemie - Teil IX -Dr. Michael Cramer-2010-01-06 Folie 1 Ministerium für,,, und Gesegnetes und Gesundes
Ministerium für,,, und WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht Mittwoch, 6. Januar 2010 Pandemie - Teil IX -Dr. Michael Cramer-2010-01-06 Folie 1 Ministerium für,,, und Gesegnetes und Gesundes
Arzneimittelgesetz. 2.1 Arzneimittelgesetz 38
 37 2 Arzneimittelgesetz 2.1 Arzneimittelgesetz 38 38 Kapitel 2 Arzneimittelgesetz 2.1 Arzneimittelgesetz 2 Das deutsche Arzneimittelgesetz gilt als sehr streng und effektiv. Dies ist auch eine Folge der
37 2 Arzneimittelgesetz 2.1 Arzneimittelgesetz 38 38 Kapitel 2 Arzneimittelgesetz 2.1 Arzneimittelgesetz 2 Das deutsche Arzneimittelgesetz gilt als sehr streng und effektiv. Dies ist auch eine Folge der
Wissen, worauf es ankommt
 Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1
 Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1 Das Programm für Ihre Gesundheit 2 AOK-Curaplan Diabetes mellitus Typ 1 Was AOK-Curaplan ist An den strukturierten Behandlungsprogrammen für chronisch
Patienteninformation AOK-Curaplan Diabetes mellitus Typ 1 Das Programm für Ihre Gesundheit 2 AOK-Curaplan Diabetes mellitus Typ 1 Was AOK-Curaplan ist An den strukturierten Behandlungsprogrammen für chronisch
Fachinformation. Die sonstigen Bestandteile sind im Abschnitt 6.1 vollständig aufgelistet.
 Fachinformation 1. Bezeichnung des Arzneimittels Epogam Weichkapseln 500 mg Nachtkerzensamenöl 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 Weichkapsel Epogam enthält 500 mg Nachtkerzensamenöl.
Fachinformation 1. Bezeichnung des Arzneimittels Epogam Weichkapseln 500 mg Nachtkerzensamenöl 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 Weichkapsel Epogam enthält 500 mg Nachtkerzensamenöl.
Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung)
 Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung) Vom 20. Dezember 2001,Bundesgesetzblatt I Nr. 72, S. 3854 22. Dezember 2001, geändert durch Bundesgesetzblatt I S. 4456 vom 4. Dezember
Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung) Vom 20. Dezember 2001,Bundesgesetzblatt I Nr. 72, S. 3854 22. Dezember 2001, geändert durch Bundesgesetzblatt I S. 4456 vom 4. Dezember
Standalone Software. als Medizinprodukt. Matthias Hölzer-Klüpfel
 Standalone Software Standalone Software als Medizinprodukt Matthias Hölzer-Klüpfel Standalone Software MEDDEV 2.1/6 Klassifikation Beispiele Modules MDD 2007 Definition: Medizinprodukt [MDD, Artikel 1,
Standalone Software Standalone Software als Medizinprodukt Matthias Hölzer-Klüpfel Standalone Software MEDDEV 2.1/6 Klassifikation Beispiele Modules MDD 2007 Definition: Medizinprodukt [MDD, Artikel 1,
Granulat: saccharinum, aromatica, antiox. E 320, excipiens ad granulatum pro charta.
 Condrosulf Zusammensetzung Wirkstoff: chondroitini sulfas natricus. Der Wirkstoff von Condrosulf ist ichthyischer Herkunft (Fisch). Hilfsstoffe Granulat: saccharinum, aromatica, antiox. E 320, excipiens
Condrosulf Zusammensetzung Wirkstoff: chondroitini sulfas natricus. Der Wirkstoff von Condrosulf ist ichthyischer Herkunft (Fisch). Hilfsstoffe Granulat: saccharinum, aromatica, antiox. E 320, excipiens
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
ARBEITSBOGEN 11: ARZNEIMITTELBERATUNG ÄRZTLICHE VERORDNUNGEN
 I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
KLINISCHE PRÜFUNG EINE EINFÜHRUNG. ATA Conference 2003 - Elke Vogt-Arendt
 KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
Pharmakotherapie in der Hausarztpraxis
 Pharmakotherapie in der Hausarztpraxis Dr. Andreas Graf Luckner Tengen Lehrbereich Allgemeinmedizin-Universität Freiburg/09-05 1 Lernziele Rahmenbedingungen betr. hausärztlicher Pharmakotherapie kennen
Pharmakotherapie in der Hausarztpraxis Dr. Andreas Graf Luckner Tengen Lehrbereich Allgemeinmedizin-Universität Freiburg/09-05 1 Lernziele Rahmenbedingungen betr. hausärztlicher Pharmakotherapie kennen
Dr. Simon Dalla Torre Prozess Manager, Stv. Abteilungsleiter Prozessentwicklung und Support
 Informationsanlass Fach- und Medizinalpersonen 20. Juni 2018, Swissmedic Volldeklaration Dr. Simon Dalla Torre Prozess Manager, Stv. Abteilungsleiter Prozessentwicklung und Support Swissmedic Schweizerisches
Informationsanlass Fach- und Medizinalpersonen 20. Juni 2018, Swissmedic Volldeklaration Dr. Simon Dalla Torre Prozess Manager, Stv. Abteilungsleiter Prozessentwicklung und Support Swissmedic Schweizerisches
Lebensmittel - Arzneimittel: Was ist was?
 Lebensmittel - Arzneimittel: Was ist was? 8. Mai 2017 Dr. Jürg Schmid Zurich Risk Engineering Informationstagung für Underwriter der Fachkommission Haftpflicht SVV Agenda Abgrenzung Lebensmittel / Arzneimittel
Lebensmittel - Arzneimittel: Was ist was? 8. Mai 2017 Dr. Jürg Schmid Zurich Risk Engineering Informationstagung für Underwriter der Fachkommission Haftpflicht SVV Agenda Abgrenzung Lebensmittel / Arzneimittel
Zur Erleichterung des Sekretabflusses bei Affektionen der Nasennebenhöhlen.
 Rhinostop Zusammensetzung Wirkstoffe: Xylometazolini hydrochloridum. Hilfsstoffe: Natrii hyaluronas, conserv.: natrii methylparahydroxybenzoas (E 219), natrii propylparahydroxybenzoas (E 217), natrii dehydroacetas,
Rhinostop Zusammensetzung Wirkstoffe: Xylometazolini hydrochloridum. Hilfsstoffe: Natrii hyaluronas, conserv.: natrii methylparahydroxybenzoas (E 219), natrii propylparahydroxybenzoas (E 217), natrii dehydroacetas,
Ausführungsbestimmungen über die Arzneimittel und die Medizinprodukte
 Ausführungsbestimmungen über die Arzneimittel und die Medizinprodukte vom 19. Januar 2016 Der Regierungsrat des Kantons Obwalden, in Ausführung von Artikel 83 des Bundesgesetzes über Arzneimittel und Medizinprodukte
Ausführungsbestimmungen über die Arzneimittel und die Medizinprodukte vom 19. Januar 2016 Der Regierungsrat des Kantons Obwalden, in Ausführung von Artikel 83 des Bundesgesetzes über Arzneimittel und Medizinprodukte
Gebrauchsinformation Roter Ginseng Extrakt Hartkapseln
 Gebrauchsinformation Roter Ginseng Extrakt Hartkapseln Liebe Patientin, lieber Patient, lesen Sie die gesamte Gebrauchsinformation aufmerksam durch, denn sie enthält wichtige Informationen für Sie. Dieses
Gebrauchsinformation Roter Ginseng Extrakt Hartkapseln Liebe Patientin, lieber Patient, lesen Sie die gesamte Gebrauchsinformation aufmerksam durch, denn sie enthält wichtige Informationen für Sie. Dieses
Swissmedic Informationsanlass: Fach- und Medizinpersonen 20. Juni Jörg Schläpfer, Prozessentwicklung und Support, Projektleiter Umsetzung HMV IV
 Swissmedic Informationsanlass: Fach- und Medizinpersonen 20. Juni 2018 Befristete Zulassung Jörg Schläpfer, Prozessentwicklung und Support, Projektleiter Umsetzung HMV IV Swissmedic Schweizerisches Heilmittelinstitut
Swissmedic Informationsanlass: Fach- und Medizinpersonen 20. Juni 2018 Befristete Zulassung Jörg Schläpfer, Prozessentwicklung und Support, Projektleiter Umsetzung HMV IV Swissmedic Schweizerisches Heilmittelinstitut
Hilfe im Gesetzesdschungel der Medizinprodukte
 Hilfe im Gesetzesdschungel der Medizinprodukte Praktische Anwendung des Leitfadens zum Umgang mit Medizinprodukten Dr. Karin Kaster DLRG OG St. Wendel e.v. Stellv. Vorsitzende karin.kaster@stwendel.dlrg.de
Hilfe im Gesetzesdschungel der Medizinprodukte Praktische Anwendung des Leitfadens zum Umgang mit Medizinprodukten Dr. Karin Kaster DLRG OG St. Wendel e.v. Stellv. Vorsitzende karin.kaster@stwendel.dlrg.de
De-ursil - De-ursil RR - De-ursil RR mite
 Bern, 23.10.2015 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben
Bern, 23.10.2015 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben
Klinische Prüfung von Medizinprodukten in Deutschland
 Klinische Prüfung von Medizinprodukten in Deutschland Notwendigkeit und Anforderungen 9. DVMD-Fachtagung, 31.03.2006, Erlangen Anne Eichberger 3M 2006 1 Anne Eichberger 30.03.2006 Was ist ein Medizinprodukt?
Klinische Prüfung von Medizinprodukten in Deutschland Notwendigkeit und Anforderungen 9. DVMD-Fachtagung, 31.03.2006, Erlangen Anne Eichberger 3M 2006 1 Anne Eichberger 30.03.2006 Was ist ein Medizinprodukt?
SWlSSmedic VERFÜGUNG. Bewilligung zur Herstellung von Arzneimitteln zum Grasshandel mit Arzneimitteln. Bewilligung Nr I Gesuch Nr.
 Seite 1/8 Bewilligung Nr. 506115 I Gesuch Nr. 1 02594165 VERFÜGUNG Bewilligung zur Herstellung von Arzneimitteln zum Grasshandel mit Arzneimitteln Sachverhalt - Erneuerung der Bewilligung Nr. 506115 basierend
Seite 1/8 Bewilligung Nr. 506115 I Gesuch Nr. 1 02594165 VERFÜGUNG Bewilligung zur Herstellung von Arzneimitteln zum Grasshandel mit Arzneimitteln Sachverhalt - Erneuerung der Bewilligung Nr. 506115 basierend
Neue homöopathische Datenbank: Ein Projekt zur Anwendung von konventionellen Medikamenten gemäss homöopathischen Methoden
 Neue homöopathische Datenbank: Ein Projekt zur Anwendung von konventionellen Medikamenten gemäss homöopathischen Methoden Dr. Marcus Zulian Teixeira, Hospital das Clinicas da Faculdade de Medicina da Universidade
Neue homöopathische Datenbank: Ein Projekt zur Anwendung von konventionellen Medikamenten gemäss homöopathischen Methoden Dr. Marcus Zulian Teixeira, Hospital das Clinicas da Faculdade de Medicina da Universidade
Bezirksregierung Düsseldorf. Eine arzneimittelrechtliche Erlaubnis (nach 13 AMG resp. 20b/c AMG) ist immer erforderlich bei
 Bezirksregierung Düsseldorf.. Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierung Düsseldorf.. Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Medizinische Indikationen. 29. September Dr. Thomas Friede Patentanwalt European Patent Attorney
 Medizinische Indikationen 29. September 2010 Dr. Thomas Friede Patentanwalt European Patent Attorney Gliederung Patentschutz für Pharma-Erfindungen Heilverfahren Chirurgische Verfahren Diagnostizierverfahren
Medizinische Indikationen 29. September 2010 Dr. Thomas Friede Patentanwalt European Patent Attorney Gliederung Patentschutz für Pharma-Erfindungen Heilverfahren Chirurgische Verfahren Diagnostizierverfahren
Fachhandbuch für Q09 - Klinische Pharmakologie/ Pharmakotherapie (7. FS)
 Fachhandbuch für Q09 - Klinische Pharmakologie/ Pharmakotherapie (7. FS) Inhaltsverzeichnis 1. Übersicht über die Unterrichtsveranstaltungen... 2 1.1. Vorlesung... 2 1.2. Praktikum/Seminar... 4 2. Beschreibung
Fachhandbuch für Q09 - Klinische Pharmakologie/ Pharmakotherapie (7. FS) Inhaltsverzeichnis 1. Übersicht über die Unterrichtsveranstaltungen... 2 1.1. Vorlesung... 2 1.2. Praktikum/Seminar... 4 2. Beschreibung
Was ist ein Arzneimittel? Lehrerinformation
 Lehrerinformation 1/8 Arbeitsauftrag Ziel Material Sozialform Sch lesen Text, notieren eine Definition mit eigenen Worten LP fragt die Definition ab Sch beantworten die Fragen des Kurztests Sch erstellen
Lehrerinformation 1/8 Arbeitsauftrag Ziel Material Sozialform Sch lesen Text, notieren eine Definition mit eigenen Worten LP fragt die Definition ab Sch beantworten die Fragen des Kurztests Sch erstellen
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR--Tocopherol (Vitamin E) Liebe Patientin, lieber Patient, bitte lesen Sie die gesamte Gebrauchsinformation
Gebrauchsinformation: Information für den Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR--Tocopherol (Vitamin E) Liebe Patientin, lieber Patient, bitte lesen Sie die gesamte Gebrauchsinformation
GEBRAUCHSINFORMATION PRACETAM 100 mg/g, Arzneimittelvormischung zur Herstellung von Fütterungsarzneimittel für Schweine
 GEBRAUCHSINFORMATION PRACETAM 100 mg/g, Arzneimittelvormischung zur Herstellung von Fütterungsarzneimittel für Schweine 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND WENN UNTERSCHIEDLICH DES HERSTELLERS,
GEBRAUCHSINFORMATION PRACETAM 100 mg/g, Arzneimittelvormischung zur Herstellung von Fütterungsarzneimittel für Schweine 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND WENN UNTERSCHIEDLICH DES HERSTELLERS,
St. Marien-Hospital Hamm
 St. Marien-Hospital Hamm Akademisches Lehrkrankenhaus der Westfälischen Wilhelms-Universität Münster Informationen zu Klinischen Prüfungen und Therapieoptimierungsstudien Impressum Verantwortlich Dr. med.
St. Marien-Hospital Hamm Akademisches Lehrkrankenhaus der Westfälischen Wilhelms-Universität Münster Informationen zu Klinischen Prüfungen und Therapieoptimierungsstudien Impressum Verantwortlich Dr. med.
Software als Medizinprodukt im Reformprozess
 Software als Medizinprodukt im Reformprozess 9. Augsburger Forum für Medizinprodukterecht Matthias Hölzer-Klüpfel Software für medizintechnische Geräte R&D Ausgaben 84 Mrd. 28 Mrd. Software 28 Mrd. 7 Mrd.
Software als Medizinprodukt im Reformprozess 9. Augsburger Forum für Medizinprodukterecht Matthias Hölzer-Klüpfel Software für medizintechnische Geräte R&D Ausgaben 84 Mrd. 28 Mrd. Software 28 Mrd. 7 Mrd.
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Off-Label Use in der Rheumatherapie
 Abseits der Wege: Off-Label Use in der Rheumatherapie Statement von Prof. Dr. med. Klaus Krüger Köln (23. September 2009) - Laut deutschem Sozialgesetzbuch ( 70) ist der behandelnde Arzt verpflichtet,
Abseits der Wege: Off-Label Use in der Rheumatherapie Statement von Prof. Dr. med. Klaus Krüger Köln (23. September 2009) - Laut deutschem Sozialgesetzbuch ( 70) ist der behandelnde Arzt verpflichtet,
Dokumentationshilfe Einzelhändler - Arzneimittelrecht
 Dokumentationshilfe Einzelhändler - Arzneimittelrecht Besichtigung des Bestandes an Arzneimitteln Fertigarzneimittel Der Einzelhändler bringt nur freiverkäufliche Arzneimittel in den Verkehr ( 43 Abs.
Dokumentationshilfe Einzelhändler - Arzneimittelrecht Besichtigung des Bestandes an Arzneimitteln Fertigarzneimittel Der Einzelhändler bringt nur freiverkäufliche Arzneimittel in den Verkehr ( 43 Abs.
KLINISCHE STUDIEN KOMPAKT
 KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
14. Gesetz zur Änderung des Arzneimittelgesetzes 14. AMG Novelle
 1 14. Gesetz zur Änderung des Arzneimittelgesetzes 14. AMG Novelle Registrierungsverfahren für traditionelle pflanzliche Arzneimittel in 39a bis 39d (RL 2004/24/EG) Nach diesem Verfahren besteht die Möglichkeit,
1 14. Gesetz zur Änderung des Arzneimittelgesetzes 14. AMG Novelle Registrierungsverfahren für traditionelle pflanzliche Arzneimittel in 39a bis 39d (RL 2004/24/EG) Nach diesem Verfahren besteht die Möglichkeit,
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
rund 200 ausgewählte Wirkstoffe
 rund 200 ausgewählte Wirkstoffe Von der Wirkstoffverordnung sind insbesondere folgende Darreichungsformen ausgeschlossen: - Arzneimittel, die auf die Haut aufgetragen werden (z.b. Salben, Gele) - Arzneimittel
rund 200 ausgewählte Wirkstoffe Von der Wirkstoffverordnung sind insbesondere folgende Darreichungsformen ausgeschlossen: - Arzneimittel, die auf die Haut aufgetragen werden (z.b. Salben, Gele) - Arzneimittel
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Fachinformation. Sonstige Bestandteile mit bekannter Wirkung:Enthält u.a. Macrogolglycerolhydroxystearat und Ethanol.
 Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
FACHINFORMATION. 1 Hartkapsel enthält: 6 mg lysierte immunaktive Fraktionen aus ausgewählten Escherichia-coli-Stämmen.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Hartkapsel enthält: 6 mg lysierte immunaktive
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Hartkapsel enthält: 6 mg lysierte immunaktive
Wann wird Bildverarbeitungssoftware zum Medizinprodukt? 11. Linzer Forum Medizintechnik November 2014
 Wann wird Bildverarbeitungssoftware zum Medizinprodukt? 11. Linzer Forum Medizintechnik November 2014 martin.zauner@fh-linz.at Inhalt Regulatorischer Rahmen für Medizinprodukte (regulatory affairs) Medizinische
Wann wird Bildverarbeitungssoftware zum Medizinprodukt? 11. Linzer Forum Medizintechnik November 2014 martin.zauner@fh-linz.at Inhalt Regulatorischer Rahmen für Medizinprodukte (regulatory affairs) Medizinische
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien
 ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
Kosmetik kurz erklärt. Produktlebenszyklus
 Kosmetik kurz erklärt Bevor ein Kosmetikprodukt auf den Markt kommt, durchläuft es vier Phasen: Produktplanung...3 Konsumentenbedürfnis...3 Marketing...3 Neues Konzept für das Produkt...3 Forschung und
Kosmetik kurz erklärt Bevor ein Kosmetikprodukt auf den Markt kommt, durchläuft es vier Phasen: Produktplanung...3 Konsumentenbedürfnis...3 Marketing...3 Neues Konzept für das Produkt...3 Forschung und
Hochwertige Markenmedikamente müssen nicht teuer sein
 Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER
 Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Biosimilars- Die Sicht der Patienten
 Ähnlich, aber eben doch nicht gleich - Biopharmazeutika: Der Unterschied liegt im Detail Biosimilars- Die Sicht der Patienten 27. November 2012 Ludwigshafen Renate Haidinger Medozinjournalistin 1.Vorsitzende
Ähnlich, aber eben doch nicht gleich - Biopharmazeutika: Der Unterschied liegt im Detail Biosimilars- Die Sicht der Patienten 27. November 2012 Ludwigshafen Renate Haidinger Medozinjournalistin 1.Vorsitzende
WENN SOGAR UMARMUNGEN WEHTUN DIE NÄCHSTEN SCHRITTE. Informationen für Patienten. besuchen Sie
 DIE NÄCHSTEN SCHRITTE Wir danken Ihnen, dass Sie sich die Zeit genommen haben, sich über diese wichtige Studie zu informieren. Wenn Sie teilnehmen möchten, kontaktieren Sie uns bitte, damit wir einen Besuchstermin
DIE NÄCHSTEN SCHRITTE Wir danken Ihnen, dass Sie sich die Zeit genommen haben, sich über diese wichtige Studie zu informieren. Wenn Sie teilnehmen möchten, kontaktieren Sie uns bitte, damit wir einen Besuchstermin
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Nationalkonferenz zu Seltenen Erkrankungen
 Berlin 13./14. Oktober 2010 Nationalkonferenz zu Seltenen Erkrankungen Welche Rahmenbedingungen braucht die Forschung der pharmazeutischen Industrie was soll ein Nationalplan verbessern? Dr. Christian
Berlin 13./14. Oktober 2010 Nationalkonferenz zu Seltenen Erkrankungen Welche Rahmenbedingungen braucht die Forschung der pharmazeutischen Industrie was soll ein Nationalplan verbessern? Dr. Christian
Die Stellungnahme des Bundesinstitutes für Arzneimittel und Medizinprodukte ist zu diesem Thema eindeutig:
 Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
