Avastin wird zur Behandlung von Erwachsenen mit den folgenden Krebsarten in Kombination mit anderen Arzneimitteln gegen Krebs angewendet:
|
|
|
- Hertha Junge
- vor 8 Jahren
- Abrufe
Transkript
1 EMA/175824/2015 EMEA/H/C/ Zusammenfassung des EPAR für die Öffentlichkeit Bevacizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert, wie der Ausschuss für Humanarzneimittel (CHMP) das Arzneimittel beurteilt hat, um zu seinem befürwortenden Gutachten zur Erteilung der Genehmigung für das Inverkehrbringen und seinen Empfehlungen zu den Anwendungsbedingungen für zu gelangen. Was ist? ist ein Arzneimittel gegen Krebs, das den Wirkstoff Bevacizumab enthält. Es ist als Konzentrat zur Herstellung einer Infusionslösung (Tropfinfusion in eine Vene) erhältlich. Wofür wird angewendet? wird zur Behandlung von Erwachsenen mit den folgenden Krebsarten in Kombination mit anderen Arzneimitteln gegen Krebs angewendet: Krebs des Kolons oder Rektums (Dickdarm), der metastasiert (d. h. sich in andere Teile des Körpers ausgebreitet hat), in Kombination mit Chemotherapie-Arzneimitteln, die Fluoropyrimidin enthält; metastasiertes Mammakarzinom (Brustkrebs) in Kombination mit Paclitaxel oder Capecitabin; nicht-kleinzelliger Lungenkrebs, der fortgeschritten ist (d. h. begonnen hat, sich auszubreiten), metastasiert oder rezidivierend (d. h. ist nach einer Anfangsbehandlung wiederaufgetreten) ist und nicht operativ entfernt werden kann. wird in Kombination mit Chemotherapie- Arzneimitteln, die ein Arzneimittel auf Platinbasis enthalten, verabreicht; fortgeschrittener oder metastasierter Nierenkrebs in Kombination mit Interferon alfa-2a; Oviarialkarzinom (Eierstockkrebs) sowie Krebs der Eileiter (Teil des weiblichen Fortpflanzungsapparats, der die Eierstöcke mit der Gebärmutter verbindet) oder des Bauchfells 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 (Membran, die den Bauch auskleidet). wird angewendet, wenn der Krebs fortgeschritten oder rezidivierend ist, und zwar in Kombination mit bestimmten Chemotherapie-Arzneimitteln; Gebärmutterhalskrebs, der persistent, rezidivierend oder metastasiert ist. wird in Kombination mit Paclitaxel sowie entweder mit Cisplatin, einem Arzneimittel auf Platinbasis, oder, wenn dieses nicht angewendet werden kann, Topotecan, einem anderen Chemotherapie- Arzneimittel, verabreicht. Nähere Einzelheiten hierzu finden Sie in der Zusammenfassung der Merkmale des Arzneimittels (ebenfalls Bestandteil des EPAR). Das Arzneimittel ist nur auf ärztliche Verschreibung erhältlich. Wie wird angewendet? Die Behandlung mit sollte von einem Arzt beaufsichtigt werden, der Erfahrung in der Behandlung von Krebs hat. Die erste -Infusion sollte 90 Minuten dauern, bei nachfolgenden Infusionen kann die Infusionsdauer jedoch kürzer sein, wenn die erste Infusion gut vertragen wurde. Die Dosis beträgt 5 mg bis 15 mg pro Kilogramm Körpergewicht alle zwei oder drei Wochen und richtet sich nach der zu behandelnden Krebsart. Die Behandlung wird so lange fortgesetzt, bis der Patient nicht mehr davon profitiert. Der Arzt kann beschließen, die Behandlung zu unterbrechen oder abzubrechen, wenn beim Patienten bestimmte Nebenwirkungen auftreten. Wie wirkt? Der Wirkstoff in, Bevacizumab, ist ein monoklonaler Antikörper. Ein monoklonaler Antikörper ist ein Antikörper (ein Protein), der speziell entwickelt wurde, um eine bestimmte Struktur (ein sogenanntes Antigen) im Körper zu erkennen und daran zu binden. Bevacizumab wurde gezielt für die Bindung an den endothelialen Gefäßwachstumsfaktor VEGF (Vascular Endothelial Growth Factor) entwickelt, ein Protein, das im Blut zirkuliert und das Wachstum von Blutgefäßen fördert. Durch die Bindung an VEGF verhindert, dass der Wachstumsfaktor seine Wirkung entfaltet. Dadurch wird die Neubildung von Blutgefäßen in den Krebszellen und somit ihre Durchblutung beeinträchtigt, sodass sie nicht ausreichend mit Sauerstoff und Nährstoffen versorgt werden. Dies trägt wiederum dazu bei, das Tumorwachstum zu hemmen. Wie wurde untersucht? Beim metastasiertem Kolon- oder Rektumkrebs wurden in drei Hauptstudien die Auswirkungen der zusätzlichen Gabe von zur Chemotherapie, die auch ein Fluoropyrimidin beinhaltet, untersucht. An den ersten beiden Studien nahmen Patienten teil, deren metastasierte Erkrankung zum ersten Mal behandelt wurde (Erstbehandlung): In der ersten Studie (mit 923 Patienten) und der zweiten Studie (mit Patienten) wurde mit Placebo (einer Scheinbehandlung), beide in Kombination mit einer Chemotherapie, verglichen. An der dritten Studie nahmen 829 Patienten teil, die auf eine vorangegangene Behandlung mit Fluoropyrimidin und Irinotecan (ein weiteres Chemotherapie- Arzneimittel) nicht angesprochen hatten. Bei metastasiertem Brustkrebs wurde in zwei Hauptstudien untersucht. In der ersten Studie wurden bei 722 Patientinnen die Wirkungen von zusätzlich zu Paclitaxel mit der alleinigen Gabe von Paclitaxel verglichen. In der zweiten Studie wurden bei Patienten die Wirkungen von oder Placebo zusätzlich zu verschiedenen Chemotherapie-Behandlungen, einschließlich Capecitabin, verglichen. EMA/175824/2015 Seite 2/5
3 Bei fortgeschrittenem, metastasiertem oder rezidivierendem Lungenkrebs wurde bei 878 Patienten untersucht. In der Studie wurden die Wirkungen von zusätzlich zu einer Chemotherapie auf Platinbasis mit der einer alleinigen Chemotherapie verglichen. Bei fortgeschrittenem oder metastasiertem Nierenkrebs wurde bei 649 Patienten mit fortgeschrittener oder metastasierter Erkrankung untersucht. In der Studie wurde mit Placebo, beide in Kombination mit Interferon alfa-2a, verglichen. Bei Eierstock-, Eileiter- und Bauchfellkrebs wurden zwei Hauptstudien mit Patienten durchgeführt, die an neu diagnostizierten Krebserkrankungen, einschließlich fortgeschrittenen Krebserkrankungen, litten. In diesen Studien wurde in Kombination mit Carboplatin und Paclitaxel mit Carboplatin und Paclitaxel allein verglichen. Zwei weitere Studien bei Eierstock-, Eileiter- und Bauchfellkrebs wurden bei insgesamt 845 Patienten mit rezidivierendem Krebs (der nach einer vorherigen Chemotherapie auf Platinbasis wiederaufgetreten ist) durchgeführt. An der ersten Studie nahmen Patienten teil, deren Krebserkrankung mindestens sechs Monate nach der vorherigen Behandlung wieder aufgetreten war ( platinsensible Erkrankung ), während die zweite Studie bei Patienten mit einem aggressiveren Krebs, der innerhalb von sehcs Monaten nach der vorherigen Behandlung ( platinresistente Erkrankung ) zurückgekehrt war, durchgeführt wurde. In diesen Studien wurde die Wirkung von als Zusatztherapie zu einer Kombinationsbehandlung mit Carboplatin und Gemcitabin oder zu Paclitaxel, Topotecan oder pegyliertem liposomalem Doxorubicin untersucht. Bei Gebärmutterhalskrebs wurde eine Hauptstudie mit 452 Patienten durchgeführt, die an einer fortgeschrittenen persistenten, rezidivierenden oder metastasierten Erkrankung litten. In der Studie wurde die Wirkung der zusätzlichen Gabe von zu einer Chemotherapie mit Paclitaxel und Cisplatin oder Topotecan mit den Ergebnissen bei Patienten verglichen, die nur eine Chemotherapie erhielten. Der Hauptindikator für die Wirksamkeit war in allen Studien entweder die Gesamtüberlebenszeit (wie lange die Patienten noch lebten) oder die progressionsfreie Überlebenszeit (der Zeitraum, in dem sich die Krankheit nicht verschlimmerte). Welchen Nutzen hat in diesen Studien gezeigt? Bei methastasiertem Kolon- oder Rektumkrebs verlängerte sowohl die Gesamtüberlebenszeit als auch die progressionsfreie Überlebenszeit, wenn es zusätzlich zu einer fluoropyrimidinhaltigen Chemotherapie gegeben wurde. In der ersten Studie mit zuvor unbehandelten Patienten betrug die durchschnittliche Gesamtüberlebenszeit 20,3 Monate bei Patienten, denen zusätzlich gegeben wurde, und 15,6 Monate bei Patienten, die nur eine Chemotherapie erhielten. In der zweiten Studie betrug die progressionsfreie Überlebenszeit 9,4 Monate bei Patienten, die bekamen, und 8,0 Monate bei Patienten, die Placebo erhielten. Bei zuvor behandelten Patienten betrug die Gesamtüberlebenszeit 12,9 Monate bei Patienten, denen zusätzlich gegeben wurde, und 10,8 Monate bei Patienten, die nur eine Chemotherapie erhielten. Bei metastasiertem Brustkrebs verlängerte die zusätzliche Gabe von ebenfalls die progressionsfreie Überlebenszeit. Wenn zusätzlich zu Paclitaxel gegeben wurde, betrug die durchschnittliche progressionsfreie Überlebenszeit 11,4 Monate, im Vergleich zu 5,8 Monaten bei den Patienten, die nur Paclitaxel erhielten. Wenn zusätzlich zu Capecitabin gegeben wurde, betrug die durchschnittliche progressionsfreie Überlebenszeit 8,6 Monate, im Vergleich zu 5,7 Monaten bei den Patienten, die Capecitabin zusammen mit Placebo erhielten. EMA/175824/2015 Seite 3/5
4 Bei fortgeschrittenen, metastasierten oder rezidivierenden Lungenkrebs betrug die durchschnittliche Gesamtüberlebenszeit 12,3 Monate bei Patienten, denen mit Paclitaxel und Carboplatin verabreicht wurde, und 10,3 Monate bei Patienten, die nur Paclitaxel und Carboplatin erhielten. Bei fortgeschrittenen oder metastasierten Nierenkrebs betrug die durchschnittliche progressionsfreie Überlebenszeit 10,2 Monate bei Patienten, die bekamen, und 5,4 Monate bei Patienten, die Placebo erhielten. In den Studien zu neu diagnostiziertem fortgeschrittenem Eierstock-, Eileiter- und Bauchfellkrebs betrug die durchschnittliche progressionsfreie Überlebenszeit in einer Studie 19,3 Monate mit und 16,9 Monate mit Placebo und in einer zweiten Studie 14,7 bzw. 10,6 Monate. In der Studie zu Eierstock-, Eileiter- und Bauchfellkrebs, der mindestens 6 Monate nach einer vorherigen Chemotherapie wieder aufgetreten ist, betrug die progressionsfreie Überlebenszeit 12,4 Monate mit als Zusatz zu Carboplatin und Gemcitabin und 8,4 bei Placebo als Zusatztherapie. In der Studie mit Patienten mit aggressiverem Krebs betrug die progressionsfreie Überlebenszeit 6,7 Monate mit als Zusatz zu Paclitaxel, Topotecan oder pegyliertem liposomalem Doxorubicin und 3,4 Monate, wenn diese Chemotherapien allein angewendet wurden. Bei Gebärmutterhalskrebs betrug die durchschnittliche Gesamtüberlebenszeit bei einer Chemotherapie, die auch beinhaltete, 16,8 Monate im Vergleich zu 12,9 Monaten, wenn nur eine Chemotherapie angewendet wurde. Bei der Berücksichtigung der Art der Chemotherapie lebten Patienten, die eine Behandlung auf Cisplatinbasis erhielten, tendenziell durchschnittlich zwei Monate länger als Patienten, die eine Behandlung auf Topotecanbasis erhielten, unabhängig davon, ob als Teil der Behandlungsschemen verabreicht wurde. Welches Risiko ist mit verbunden? Sehr häufige Nebenwirkungen mit sind Hypertonie (Bluthochdruck), Fatigue (Erschöpfung) oder Asthenie (Schwäche), Diarrhö (Durchfall) und abdominale Schmerzen. Die schwersten Nebenwirkungen sind gastrointestinale Perforationen (Magen-Darm-Durchbrüche), Hämorrhagie (Blutungen) sowie arterielle Thromboembolie (Blutgerinnsel in den Arterien). Die vollständige Auflistung der im Zusammenhang mit berichteten Nebenwirkungen ist der Packungsbeilage zu entnehmen. darf nicht bei Patienten angewendet werden, die überempfindlich (allergisch) gegen Bevacizumab, einen der sonstigen Bestandteile oder Produkte aus Eizellen chinesischer Hamster oder andere rekombinante Antikörper sind. Es darf auch nicht bei Schwangeren angewendet werden. Warum wurde zugelassen? Der CHMP gelangte zu dem Schluss, dass der Nutzen von gegenüber den Risiken überwiegt, und empfahl, die Genehmigung für das Inverkehrbringen zu erteilen. Bei metastasiertem Brustkrebs ist zugelassen für die Anwendung in Kombination mit Paclitaxel sowie mit Capecitabin bei Patienten, für die andere Chemotherapie-Optionen mit Taxanen oder Anthrazyklinen nicht geeignet sind. Zuvor war auch für die kombinierte Anwendung mit Docetaxel (einem anderen Arzneimittel gegen Krebs) zugelassen, im Dezember 2010 wurde diese Indikation jedoch nach einer Überprüfung der einschlägigen Daten wieder entfernt. 1 1 Im Rahmen eines Befassungsverfahrens nach Artikel 20 der Verordnung (EG) Nr. 726/2004. EMA/175824/2015 Seite 4/5
5 Welche Maßnahmen werden zur Gewährleistung der sicheren und wirksamen Anwendung von ergriffen? Es wurde ein Risikomanagementplan entwickelt, um sicherzustellen, dass so sicher wie möglich angewendet wird. Auf der Grundlage dieses Plans wurden Sicherheitsinformationen in die Zusammenfassung der Merkmale des Arzneimittels und die Packungsbeilage für aufgenommen, einschließlich geeigneter Vorsichtsmaßnahmen für Angehörige der Heilberufe und Patienten. Weitere Informationen über Am 12. Januar 2005 erteilte die Europäische Kommission eine Genehmigung für das Inverkehrbringen von in der gesamten Europäischen Union. Den vollständigen Wortlaut des EPAR für finden Sie auf der Website der Agentur: ema.europa.eu/find medicine/human medicines/european Public Assessment Reports. Wenn Sie weitere Informationen zur Behandlung mit benötigen, lesen Sie bitte die Packungsbeilage (ebenfalls Teil des EPAR) oder wenden Sie sich an Ihren Arzt oder Apotheker. Diese Zusammenfassung wurde zuletzt im aktualisiert. EMA/175824/2015 Seite 5/5
metastasiertes Mammakarzinom (Brustkrebs) in Kombination mit Paclitaxel oder Capecitabin;
 EMA/302947/2017 EMEA/H/C/000582 Zusammenfassung des EPAR für die Öffentlichkeit Bevacizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/302947/2017 EMEA/H/C/000582 Zusammenfassung des EPAR für die Öffentlichkeit Bevacizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
des beeinträchtigten Sehvermögens aufgrund eines durch Diabetes verursachten Makulaödems;
 EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Stelara ist ein Arzneimittel, das zur Behandlung der folgenden Erkrankungen angewendet wird:
 EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Keytruda ist ein Arzneimittel, das zur Behandlung der folgenden Krebserkrankungen angewendet wird:
 EMA/524789/2017 EMEA/H/C/003820 Zusammenfassung des EPAR für die Öffentlichkeit Pembrolizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/524789/2017 EMEA/H/C/003820 Zusammenfassung des EPAR für die Öffentlichkeit Pembrolizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
FRAGEBOGEN FÜR KINDER UND JUGENDLICHE
 Meinung in Bezug auf die Anwendung von Medikamenten Warum fragen wir? Der Pädiatrische Ausschuss (Paediatric Committee (PDCO)) arbeitet zusammen mit der Europäischen Arzneimittelagentur. Dieser Ausschuss
Meinung in Bezug auf die Anwendung von Medikamenten Warum fragen wir? Der Pädiatrische Ausschuss (Paediatric Committee (PDCO)) arbeitet zusammen mit der Europäischen Arzneimittelagentur. Dieser Ausschuss
Opdivo wird als Einzelarzneimittel zur Behandlung von Erwachsenen mit folgenden Erkrankungen angewendet:
 EMA/303208/2017 EMEA/H/C/003985 Zusammenfassung des EPAR für die Öffentlichkeit Nivolumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/303208/2017 EMEA/H/C/003985 Zusammenfassung des EPAR für die Öffentlichkeit Nivolumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Pradaxa ist ein Arzneimittel, das den Wirkstoff Dabigatranetexilat enthält. Es ist als Kapseln (75 mg, 110 mg und 150 mg) erhältlich.
 EMA/47517/2015 EMEA/H/C/000829 Zusammenfassung des EPAR für die Öffentlichkeit Dabigatranetexilat Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird
EMA/47517/2015 EMEA/H/C/000829 Zusammenfassung des EPAR für die Öffentlichkeit Dabigatranetexilat Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Übersicht über Opdivo und Begründung für die Zulassung in der EU
 EMA/489091/2018 EMEA/H/C/003985 Übersicht über Opdivo und Begründung für die Zulassung in der EU Was ist Opdivo und wofür wird es angewendet? Opdivo ist ein Krebsarzneimittel, das zur Behandlung der folgenden
EMA/489091/2018 EMEA/H/C/003985 Übersicht über Opdivo und Begründung für die Zulassung in der EU Was ist Opdivo und wofür wird es angewendet? Opdivo ist ein Krebsarzneimittel, das zur Behandlung der folgenden
Übersicht über Opdivo und Begründung für die Zulassung in der EU
 EMA/55255/2019 EMEA/H/C/003985 Übersicht über Opdivo und Begründung für die Zulassung in der EU Was ist Opdivo und wofür wird es angewendet? Opdivo ist ein Krebsarzneimittel, das zur Behandlung der folgenden
EMA/55255/2019 EMEA/H/C/003985 Übersicht über Opdivo und Begründung für die Zulassung in der EU Was ist Opdivo und wofür wird es angewendet? Opdivo ist ein Krebsarzneimittel, das zur Behandlung der folgenden
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Xarelto ist ein Antikoagulans (Arzneimittel, das die Blutgerinnung verhindert), das bei Erwachsenen angewendet wird:
 EMA/708716/2017 EMEA/H/C/000944 Zusammenfassung des EPAR für die Öffentlichkeit Rivaroxaban Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/708716/2017 EMEA/H/C/000944 Zusammenfassung des EPAR für die Öffentlichkeit Rivaroxaban Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
Übersicht über Eylea und Begründung für die Zulassung in der EU
 EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
MabThera wird bei Erwachsenen zur Behandlung folgender Erkrankungen angewendet:
 EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
Häufig gestellte Fragen
 9. November 2011 EMA/527628/2011 Direktion Dieses Dokument liefert Antworten zu den häufigsten Fragen, die an die Europäische Arzneimittel- Agentur gerichtet werden. Wenn Sie die Antwort auf Ihre Frage
9. November 2011 EMA/527628/2011 Direktion Dieses Dokument liefert Antworten zu den häufigsten Fragen, die an die Europäische Arzneimittel- Agentur gerichtet werden. Wenn Sie die Antwort auf Ihre Frage
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Zulassungserweiterung für den adjuvanten Einsatz von Trastuzumab
 Patientinnen mit frühem HER2-positivem Mammakarzinom individuell behandeln Zulassungserweiterung für den adjuvanten Einsatz von Trastuzumab Grenzach-Wyhlen (25. Mai 2011) - Der Einsatz des monoklonalen
Patientinnen mit frühem HER2-positivem Mammakarzinom individuell behandeln Zulassungserweiterung für den adjuvanten Einsatz von Trastuzumab Grenzach-Wyhlen (25. Mai 2011) - Der Einsatz des monoklonalen
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert)
 EMA/90006/2015 EMEA/H/C/001104 Zusammenfassung des EPAR für die Öffentlichkeit Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert) Dies ist eine Zusammenfassung des Europäischen Öffentlichen
EMA/90006/2015 EMEA/H/C/001104 Zusammenfassung des EPAR für die Öffentlichkeit Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert) Dies ist eine Zusammenfassung des Europäischen Öffentlichen
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Nplate (Romiplostim) SELBSTINJEKTIONS-TAGEBUCH Zur Unterstützung der Anwendung von Nplate zu Hause
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels Nplate Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels Nplate Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Krank durch Schlafstörungen
 Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Ambulanz Chinesische Medizin
 Ambulanz Chinesische Medizin für Frauen mit Brustkrebs Gefördert durch die Dorit und Alexander Otto Stiftung In der Ambulanz für Chinesische Medizin im Mammazentrum Hamburg haben die betroffenen Frauen
Ambulanz Chinesische Medizin für Frauen mit Brustkrebs Gefördert durch die Dorit und Alexander Otto Stiftung In der Ambulanz für Chinesische Medizin im Mammazentrum Hamburg haben die betroffenen Frauen
Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom
 Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diabetes. Zulassungserweiterung: Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Mens
 Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Screening Das Programm. zur Früherkennung von Brustkrebs
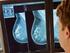 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Was ist der Her2-Status?
 Was ist der Her2-Status? Dieser Artikel knüpft an die Resultate einer Umfrage im Frühjahr 2006 mit Frauen von LEBEN WIE ZUVOR an. 1'500 Fragebogen wurden versendet und eine beeindruckende Rücklaufquote
Was ist der Her2-Status? Dieser Artikel knüpft an die Resultate einer Umfrage im Frühjahr 2006 mit Frauen von LEBEN WIE ZUVOR an. 1'500 Fragebogen wurden versendet und eine beeindruckende Rücklaufquote
POINT. of Reha Sport e.v. Reha-Sport. Der Wegweiser zum. Eine Information für Patientinnen, Patienten und Angehörige
 POINT of Reha Sport e.v. Der Wegweiser zum Reha-Sport Eine Information für Patientinnen, Patienten und Angehörige Was ist Reha Sport? Reha Sport wird in Form von Wirbelsäulengymnastik und Bewegungsschule,
POINT of Reha Sport e.v. Der Wegweiser zum Reha-Sport Eine Information für Patientinnen, Patienten und Angehörige Was ist Reha Sport? Reha Sport wird in Form von Wirbelsäulengymnastik und Bewegungsschule,
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Arbeitslos Wohnen in den Niederlanden, Arbeiten in Deutschland
 Arbeitslos Wohnen in den Niederlanden, Arbeiten in Deutschland Inhalt Wer bekommt eine Arbeitslosenleistung? 2 Kündigung in gegenseitigem Einvernehmen 2 Welche Arbeitslosenleistung bekommen Sie? 2 Wie
Arbeitslos Wohnen in den Niederlanden, Arbeiten in Deutschland Inhalt Wer bekommt eine Arbeitslosenleistung? 2 Kündigung in gegenseitigem Einvernehmen 2 Welche Arbeitslosenleistung bekommen Sie? 2 Wie
weitere Störungen des Sehvermögens, die auf eine choroidale Neovaskularisation zurückzuführen sind;
 EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Partnerportal Installateure Registrierung
 Partnerportal Installateure Registrierung Ein Tochterunternehmen der Süwag Energie AG Allgemeine Hinweise Diese Anleitung zeigt Ihnen, wie Sie sich als Nutzer für das Partnerportal Installateure registrieren
Partnerportal Installateure Registrierung Ein Tochterunternehmen der Süwag Energie AG Allgemeine Hinweise Diese Anleitung zeigt Ihnen, wie Sie sich als Nutzer für das Partnerportal Installateure registrieren
Chemotherapie -ein Bilderbuch für Kinder
 Chemotherapie -ein Bilderbuch für Kinder Unser Körper besteht aus verschiedenen Zellen, die ganz unterschiedlich aussehen. Jede Art erfüllt eine besondere Aufgabe. Da gibt es zum Beispiel Gehirnzellen,
Chemotherapie -ein Bilderbuch für Kinder Unser Körper besteht aus verschiedenen Zellen, die ganz unterschiedlich aussehen. Jede Art erfüllt eine besondere Aufgabe. Da gibt es zum Beispiel Gehirnzellen,
Du verhütest jahrelang! Mit der passenden Pille?
 Du verhütest jahrelang! Mit der passenden Pille? INHALT WAS VERSTEHT MAN UNTER VERHÜTUNGSHORMONEN? Was versteht man unter Verhütungshormonen?... 3 Verhütungshormone sind Östrogene und Gestagene, die zur
Du verhütest jahrelang! Mit der passenden Pille? INHALT WAS VERSTEHT MAN UNTER VERHÜTUNGSHORMONEN? Was versteht man unter Verhütungshormonen?... 3 Verhütungshormone sind Östrogene und Gestagene, die zur
Informationen zum Thema Europäische Krankenversicherungskarte
 Gesundheitskarte AKTUELL Informationen zum Thema Europäische Krankenversicherungskarte Von Anfang an ist die Rückseite der elektronischen Gesundheitskarte für die Aufnahme der Europäischen Krankenversicherungskarte
Gesundheitskarte AKTUELL Informationen zum Thema Europäische Krankenversicherungskarte Von Anfang an ist die Rückseite der elektronischen Gesundheitskarte für die Aufnahme der Europäischen Krankenversicherungskarte
Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit
 Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit politische Lage verlassen sich auf Familie persönliche, finanzielle Lage meinen, sich Vorsorge leisten zu können meinen, sie seien zu alt nicht mit
Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit politische Lage verlassen sich auf Familie persönliche, finanzielle Lage meinen, sich Vorsorge leisten zu können meinen, sie seien zu alt nicht mit
Kopf dicht? Nase zu? Husten?
 Kopf dicht? Nase zu? Husten? Inhalt 2 Inhalt 2-3 Wunderwerk Atemwege 4-7 Kopf dicht, Nase zu, Husten was im Körper passiert 8-11 Wie hilft GeloMyrtol forte? 12-15 Wirksamkeit klinisch bestätigt 16-17 Wie
Kopf dicht? Nase zu? Husten? Inhalt 2 Inhalt 2-3 Wunderwerk Atemwege 4-7 Kopf dicht, Nase zu, Husten was im Körper passiert 8-11 Wie hilft GeloMyrtol forte? 12-15 Wirksamkeit klinisch bestätigt 16-17 Wie
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
SOZIALVORSCHRIFTEN IM STRAßENVERKEHR Verordnung (EG) Nr. 561/2006, Richtlinie 2006/22/EG, Verordnung (EU) Nr. 165/2014
 LEITLINIE NR. 7 Gegenstand: Die Bedeutung von innerhalb von 24 Stunden Artikel: 8 Absätze 2 und 5 der Verordnung (EG) Nr. 561/2006 Leitlinien: Nach Artikel 8 Absatz 2 der Verordnung muss innerhalb von
LEITLINIE NR. 7 Gegenstand: Die Bedeutung von innerhalb von 24 Stunden Artikel: 8 Absätze 2 und 5 der Verordnung (EG) Nr. 561/2006 Leitlinien: Nach Artikel 8 Absatz 2 der Verordnung muss innerhalb von
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt?
 Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
LÄNGER LEBEN BEI GUTER GESUNDHEIT
 LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
Was meinen die Leute eigentlich mit: Grexit?
 Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
KinderPlus. Mit KinderPlus wird Ihr Kind zum Privatpatienten im Krankenhaus.
 KinderPlus. Mit KinderPlus wird Ihr Kind zum Privatpatienten im Krankenhaus. Hubi, Junior und unsere Kunden empfehlen die Württembergische Krankenversicherung AG. Für Kinder bis 7 Jahre: Günstig in die
KinderPlus. Mit KinderPlus wird Ihr Kind zum Privatpatienten im Krankenhaus. Hubi, Junior und unsere Kunden empfehlen die Württembergische Krankenversicherung AG. Für Kinder bis 7 Jahre: Günstig in die
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Häufig wiederkehrende Fragen zur mündlichen Ergänzungsprüfung im Einzelnen:
 Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Die Invaliden-Versicherung ändert sich
 Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Gemeinsam können die Länder der EU mehr erreichen
 Gemeinsam können die Länder der EU mehr erreichen Die EU und die einzelnen Mitglieds-Staaten bezahlen viel für die Unterstützung von ärmeren Ländern. Sie bezahlen mehr als die Hälfte des Geldes, das alle
Gemeinsam können die Länder der EU mehr erreichen Die EU und die einzelnen Mitglieds-Staaten bezahlen viel für die Unterstützung von ärmeren Ländern. Sie bezahlen mehr als die Hälfte des Geldes, das alle
Erläuterungen zur Untervergabe von Instandhaltungsfunktionen
 Zentrale Erläuterungen zur Untervergabe von Instandhaltungsfunktionen Gemäß Artikel 4 der Verordnung (EU) 445/2011 umfasst das Instandhaltungssystem der ECM die a) Managementfunktion b) Instandhaltungsentwicklungsfunktion
Zentrale Erläuterungen zur Untervergabe von Instandhaltungsfunktionen Gemäß Artikel 4 der Verordnung (EU) 445/2011 umfasst das Instandhaltungssystem der ECM die a) Managementfunktion b) Instandhaltungsentwicklungsfunktion
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Wiederholungsverordnung
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Stand der Revision: 13.11.2013
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Stand der Revision: 13.11.2013
Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung
 Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung ÄNDERUNG DES ÜBEREINKOMMENS ÜBER DEN ZUGANG ZU INFORMATIONEN, DIE ÖFFENTLICHKEITSBETEILIGUNG AN ENTSCHEIDUNGSVERFAHREN
Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung ÄNDERUNG DES ÜBEREINKOMMENS ÜBER DEN ZUGANG ZU INFORMATIONEN, DIE ÖFFENTLICHKEITSBETEILIGUNG AN ENTSCHEIDUNGSVERFAHREN
BAnz AT 04.04.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Das Persönliche Budget in verständlicher Sprache
 Das Persönliche Budget in verständlicher Sprache Das Persönliche Budget mehr Selbstbestimmung, mehr Selbstständigkeit, mehr Selbstbewusstsein! Dieser Text soll den behinderten Menschen in Westfalen-Lippe,
Das Persönliche Budget in verständlicher Sprache Das Persönliche Budget mehr Selbstbestimmung, mehr Selbstständigkeit, mehr Selbstbewusstsein! Dieser Text soll den behinderten Menschen in Westfalen-Lippe,
Downloadfehler in DEHSt-VPSMail. Workaround zum Umgang mit einem Downloadfehler
 Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
BAnz AT 20.11.2014 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diabetische Retinopathie
 Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
40-Tage-Wunder- Kurs. Umarme, was Du nicht ändern kannst.
 40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel
 Arbeitsblätter mit Lösungen zur DVD 14064 PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel Arbeitsblätter mit Lösungen zur DVD 14064
Arbeitsblätter mit Lösungen zur DVD 14064 PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel Arbeitsblätter mit Lösungen zur DVD 14064
Bei multiplem Myelom, einem Krebs eines Typs weißer Blutkörperchen, der sogenannten Plasmazellen, wird Revlimid angewendet:
 EMA/113870/2017 EMEA/H/C/000717 Zusammenfassung des EPAR für die Öffentlichkeit Lenalidomid Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/113870/2017 EMEA/H/C/000717 Zusammenfassung des EPAR für die Öffentlichkeit Lenalidomid Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren
 Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren Programm zur Früherkennung von Brustkrebs Praktische Hinweise Mit Ihrer persönlichen Einladung zur Teilnahme an dem Programm
Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren Programm zur Früherkennung von Brustkrebs Praktische Hinweise Mit Ihrer persönlichen Einladung zur Teilnahme an dem Programm
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
1.1.1 Test Überschrift
 1.1.1 Test Überschrift Körper: Frau - Innere Geschlechtsorgane Die inneren Geschlechtsorgane der Frau Die inneren Geschlechtsorgane der Frau sind im Körper. Ganz unten im Bauch (= Unterleib) sind: n die
1.1.1 Test Überschrift Körper: Frau - Innere Geschlechtsorgane Die inneren Geschlechtsorgane der Frau Die inneren Geschlechtsorgane der Frau sind im Körper. Ganz unten im Bauch (= Unterleib) sind: n die
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG
 Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG 1. Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung mit Selbstbeteiligung
Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG 1. Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung mit Selbstbeteiligung
Deutsches Rotes Kreuz. Kopfschmerztagebuch von:
 Deutsches Rotes Kreuz Kopfschmerztagebuch Kopfschmerztagebuch von: Hallo, heute hast Du von uns dieses Kopfschmerztagebuch bekommen. Mit dem Ausfüllen des Tagebuches kannst Du mehr über Deine Kopfschmerzen
Deutsches Rotes Kreuz Kopfschmerztagebuch Kopfschmerztagebuch von: Hallo, heute hast Du von uns dieses Kopfschmerztagebuch bekommen. Mit dem Ausfüllen des Tagebuches kannst Du mehr über Deine Kopfschmerzen
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn
 Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
INFORMATIONEN FÜR TYP-2-DIABETIKER. Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist!
 INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
INFORMATIONEN FÜR DIE PRAXIS
 INFORMATIONEN FÜR DIE PRAXIS Formulare Oktober 2015 Arbeitsunfähigkeit und Krankengeld: Einheitliches Formular ab 1. Januar 2016 Für die Bescheinigung der Arbeitsunfähigkeit (AU) gibt es ab 1. Januar 2016
INFORMATIONEN FÜR DIE PRAXIS Formulare Oktober 2015 Arbeitsunfähigkeit und Krankengeld: Einheitliches Formular ab 1. Januar 2016 Für die Bescheinigung der Arbeitsunfähigkeit (AU) gibt es ab 1. Januar 2016
Hepar-SL. Für ein ausgeglichenes Leben auch ohne Gallenblase
 Hepar-SL Für ein ausgeglichenes Leben auch ohne Gallenblase Ein Leben ohne Gallenblase betrifft immer mehr Menschen. Auch Ihre Gallenblase wurde operativ entfernt, da Sie möglicherweise unter immer wieder
Hepar-SL Für ein ausgeglichenes Leben auch ohne Gallenblase Ein Leben ohne Gallenblase betrifft immer mehr Menschen. Auch Ihre Gallenblase wurde operativ entfernt, da Sie möglicherweise unter immer wieder
