Schulversuchspraktikum. Nadja Felker. Sommersemester Klassenstufen 11 & 12. Aromaten (SSS, KKK)
|
|
|
- Viktoria Solberg
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 11 & 12 Aromaten (SSS, KKK)
2 Auf einen Blick: Das Protokoll enthält für die Klassen 11 und 12 einen Lehrerversuch und einen Schülerversuch zum Thema Aromaten (SSS, KKK) der Unterrichtseinheit Chemie der Kohlenwasserstoffe. Der Lehrerversuch zeigt die lichtinduzierte Reaktion zwischen Toluol und Brom sowie den Nachweis der in der Reaktion entstandenen Produkte. Der Schülerversuch verdeutlicht, dass Phenol im Vergleich zu anderen Alkoholen eine schwache Säurewirkung hat und dementsprechend eine schwache organische Säure ist. Das Arbeitsblatt Bromierung der Seitenkette des Toluols dient als Unterrichtsmaterial zur Durchführung des Lehrerversuchs. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 11. und 12. Jahrgangsstufe und didaktische Reduktion Lehrerversuch V 1 Bromierung der Seitenkette des Toluols Schülerversuch V 2 Säurewirkung von Phenol Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 12
3 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Beschreibung des Themas und zugehörige Lernziele Das Thema Aromaten (SSS, KKK) der Unterrichtseinheit Chemie der Kohlenwasserstoffe ist ein wesentlicher Bestandteil des Chemieunterrichts der Klassenstufen 11 und 12. Hier werden Aromaten und ihre Eigenschaften zum ersten Mal von den Schülerinnen und Schülern (SuS) untersucht und definiert. Sie lernen also, dass Aromaten ein cyclisches, planares und durchgehendes System von p-orbitalen aufweisen und die Hückel-Regel erfüllen. Des Weiteren lernen sie die Strukturen und Trivialnamen wichtiger Benzolderivate (Phenol, Toluol, Anilin) und deren Verwendung kennen. Zudem lernen sie die Reaktion der elektrophilen Substitution am aromatischen Ring als eine wichtige Reaktion der Aromaten kennen, die verschiedene Formen annehmen kann (Sulfonierung, Nitrierung, Friedelcrafts-Alkylierung). Außerdem gehören die SSS (Sonne, Siedehitze, Seitenkette)- und die KKK-Regel (Katalysator, Kälte, Kern) zu den bedeutenden Begriffen, die in der Oberstufe behandelt werden. Auch die radikalische Substitution an der Seitenkette ist hier zu thematisieren. Darüber hinaus sollte die Alltagsbedeutung der Aromaten wie z. B. ihr Vorkommen (Aminosäuren, Farbstoffe, Arzneimittel) und ihre Verwendung hervorgehoben werden. Im Kerncurriculum für das Fach Chemie werden für die Klassenstufen 11 und 12 Aromaten sowohl im Basiskonzept Stoff-Teilchen als auch im Basiskonzept Struktur-Eigenschaft genannt. Dabei sollen die SuS die Molekülstruktur und die funktionellen Gruppen von Aromaten beschreiben, die Mesomerie mithilfe von Grenzstrukturen in der Lewis-Schreibweise für das Benzolmolekül erklären, mesomere und induktive Effekte erklären, den Reaktionsmechanismus der radikalischen Substitution beschreiben, zwischen homolytischer und heterolytischer Bindungsspaltung unterscheiden und beschreiben, dass bei chemischen Reaktionen unterschiedliche Reaktionsprodukte entstehen können (Kompetenzbereich Fachwissen). Im Bezug auf die Erkenntnisgewinnung sollen sie das Mesomeriemodell zur Erklärung des aromatischen Zustands des Benzol-Moleküls anwenden, induktive und mesomere Effekte zur Erklärung der Stärke organischer Säuren nutzen, Experimente zur radikalischen Substitution durchführen, die Reaktionsmechanismen aus experimentellen Daten ableiten und induktive Effekte zur Erklärung von Reaktionsmechanismen nutzen. Daneben sollen sie die Grenzen und Möglichkeiten von Modellen diskutieren, mechanistische Darstellungsweisen versprachlichen, sachlogisch argumentieren und die entstehenden Produkte schlüssig begründen (Kompetenzbereich Kommunikation). Außerdem sollen sie mechanistische Denkweisen als wesentliches Prinzip der organischen Chemie reflektieren (Kompetenzbereich Bewertung/Reflexion). Das Lehrerexperiment zeigt eine von zwei Möglichkeiten, Toluol zu bromieren. Die SuS erkennen anhand des Versuchs, dass alkylsubstituierte Aromaten (aufgrund ihrer delokalisierten π- Elektronen) sehr stabil sind, erst durch Lichteinwirkung in einer radikalischen Substitutionsreaktion mit Brom reagieren und eine Substitution an der Seitenkette stattfindet. Des Weiteren
4 2 Relevanz des Themas für SuS der 11. und 12. Jahrgangsstufe und didaktische Reduktion 2 wiederholen sie die Substitutionsreaktion und die Beilsteinprobe als Nachweis für Halogenverbindungen. Das Schülerexperiment verdeutlicht die schwache Säurewirkung von Phenol anhand seines protonierten und deprotonierten Zustands. Die SuS erkennen anhand des Versuches, dass Phenol im Vergleich zu anderen Alkoholen schwach sauer reagiert, also eine schwache organische Säure ist. Außerdem erklären sie, dass die Säurewirkung (Acidität) des Phenols auf die Stabilisierung der konjugierten Base, des Phenolat-Ions durch Mesomerie zurückzuführen ist. 2 Relevanz des Themas für SuS der 11. und 12. Jahrgangsstufe und didaktische Reduktion Das Thema Aromaten ist schulrelevant, da Aromaten die SuS in allem möglichen Formen umgeben. Sie kommen zum Einen in Nukleotidbasen der DNA und in Aminosäuren (Tyrosin, Tryptophan und Phenylalanin) vor. Des Weiteren finden sie in Arzneimittel (Aspirin), Farbstoffen (Methylorange, Phenolphthalein, Flavonoide), Kunstoffen (Styropor) und in Benzin (Benzol) Anwendung. Die SuS kennen diese Stoffe, da sie sie im Alltag begegnen, allerdings wissen sie nicht, dass es sich dabei um aromatische Verbindungen handelt. Um ihnen dies näher zu bringen und sie darüber aufzuklären, sind Aromaten ein zu behandelndes Thema der Oberstufe. Bei der Behandlung des Themas Aromaten muss das Orbitalmodell ausgeblendet beziehungsweise nicht auf die p- oder s-orbitale der aromatischen Strukturen eingegangen werden, wenn im Unterricht dies zuvor nicht thematisiert wurde. Des Weiteren werden in den Versuchen gezielt einfach substituierte Aromaten eingesetzt, deren Strukturen überschaubar sind, um die Reaktionsmechanismen nicht noch komplizierter zu machen als sie eigentlich schon sind. In den Auswertungen der dargestellten Versuche stehen insbesondere Reaktionsmechanismen im Vordergrund.
5 3 Lehrerversuch V 1 Bromierung der Seitenkette des Toluols 3 3 Lehrerversuch V 1 Bromierung der Seitenkette des Toluols Der Versuch zeigt die Bromierung der Seitenkette des Toluols. Er veranschaulicht die SSS-Regel (Sonne, Siedehitze, Seitenkette), da erst durch Lichteinwirkung eine Reaktion zwischen Toluol und Brom stattfindet. Daneben werden Bromwasserstoff und Benzylbromid als Produkte der Reaktion zwischen Brom und Toluol mittels Universalindikatorpapier und der Beilsteinprobe nachgewiesen. Achtung: Der Versuch muss im Abzug mit geeigneten Handschuhen durchgeführt werden, da giftige Bromdämpfe entweichen können und Brom stark ätzend ist. Toluol ist gesundheitsschädlich. Den SuS sollten Substitutionsreaktionen (z. B. an Alkanen) bekannt sein beziehungsweise über ein gewisses Grundwissen über Aromaten verfügen. Toluol Gefahrenstoffe H: d P: Brom H: 318 P: Materialien: Chemikalien: Durchführung: Beobachtung: Reagenzglas, Stativ, Klemme, Muffe, Pasteurpipette, Pipettierhilfe, Lampe, Universalindikatorpapier, Pinzette, Metallklammer, Gasbrenner. Toluol, Brom, Kupferblech. 3 ml Toluol werden in ein Reagenzglas gefüllt und vier Tropfen Brom hinzugegeben. Anschließend wird das Reagenzglas mit einer Lampe bestrahlt. Sobald eine Farbänderung wahrgenommen wird, wird feuchtes Indikatorpapier mithilfe einer Pinzette in das Reagenzglas gehalten. Mit der Flüssigkeit im Reagenzglas wird nach der Farbänderung die Beilsteinprobe durchgeführt. Die rote Flüssigkeit wird hellgelb. Es entweicht ein Gas. Das Indikatorpapier färbt sich rot. Die Beilsteinprobe ist positiv (siehe Abb. 1 Abb. 4).
6 3 Lehrerversuch V 1 Bromierung der Seitenkette des Toluols 4 Abb. 1 - Toluol und Brom vor der Bestrahlung mit sichtbarem Licht. Abb. 2 - Toluol und Brom nach der Bestrahlung mit sichtbarem Licht. Abb. 3 - Das Indikatorpapier färbt sich rot. Abb. 4 - Die Beilsteinprobe ist positiv. Deutung: Die Farbänderung von rot nach hellgelb deutet darauf hin, dass eine Reaktion stattgefunden hat. Die Reaktion wird dabei erst durch die Einwirkung von Licht induziert, es wird also für die Reaktion zwischen Toluol und Brom Licht benötigt. Wenn die Mischung aus Toluol und Brom mit sichtbarem Licht bestrahlt wird, findet eine radikalische Substitutionsreaktion nur an der Seitenkette statt. Es handelt sich dabei um eine Kettenreaktion mit den folgenden Teilschritten: 1. Initiationsschritt: Homolytische Spaltung von Brom in zwei Bromradikale
7 3 Lehrerversuch V 1 Bromierung der Seitenkette des Toluols 5 2. Kettenfortpflanzungsschritt: Toluol Benzylradikal Benzylradikal Benzylbromid 3. Terminationsschritt: Abbruch durch das Aufeinandertreffen zweier Benzylradikale: Abbruch durch das Aufeinandertreffen zweier Bromradikale: Abbruch durch das Aufeinandertreffen eines Benzylradikals und eines Bromradikals: Bei der Reaktion entsteht Bromwasserstoff, welcher im Reagenzglas aufsteigt und das Indikatorpapier rot färbt. Außerdem entsteht eine Halogen-
8 4 Schülerversuch V 2 Säurewirkung von Phenol 6 verbindung, Benzylbromid, welche mittels der Beilsteinprobe nachgewiesen werden kann. Entsorgung: Benzylbromid wird im halogenhaltigen organischen Abfall entsorgt. Rotbraune Lösungen dagegen müssen zunächst mit einer Natriumthiosulfatlösung versetzt und anschließend auch im organischen Abfall entsorgt werden. Literatur: D. Wiechoczek, Professor Blumes Bildungsserver für Chemie, (Zuletzt abgerufen am um 07:04 Uhr). S. Henkel, Bromierung_von_Toluol.pdf, (Zuletzt abgerufen am um 08:57 Uhr). Im Unterricht kann mithilfe des Versuches die radikalische Substitution als eine Möglichkeit der Bromierung von Toluol sowie die SSS-Regel thematisiert werden. Er kann z. B. durchgeführt werden, nachdem die SuS erkannt haben, dass Toluol im Vergleich zu Cyclohexen nicht ohne weiteres mit Brom bzw. Baeyer-Reagenz reagiert (siehe hierzu den Versuch V2 des Kurzprotokolls). Außerdem sollte im Unterricht darauf eingegangen werden, dass bei einer hohen Bromkonzentration nicht nur ein Wasserstoffatom der Methylgruppe durch ein Bromatom substituiert wird, sondern auch die beiden anderen Wasserstoffatome durch weitere Bromatome, wodurch Phenoltribrommethan als Produkt entsteht. Bromwasserstoff kann im Versuch zusätzlich mithilfe eines mit Silbernitratlösung gefüllten Gärröhrchens als Halogenverbindung identifiziert werden. Dabei wird schwerlösliches Silberbromid gebildet, welches als hellgelber Niederschlag sichtbar ist. 4 Schülerversuch V 2 Säurewirkung von Phenol Der Versuch zeigt, dass Phenol eine schwache organische Säure ist. Der protonierte und deprotonierte Zustand des Phenol wird hier durch eine Trübung der Lösung beziehungsweise durch die Bildung einer klaren Flüssigkeit verdeutlicht. Achtung: Da Phenol ätzend und giftig ist, muss der Versuch im Abzug mit geeigneten Handschuhen durchgeführt werden. Für die Auswertung des Versuchs müssen den SuS mesomere Grenzstrukturen bekannt sein.
9 4 Schülerversuch V 2 Säurewirkung von Phenol 7 Gefahrenstoffe Phenol H: Natronlauge (1 mol/l) H: Salzsäure (konz.) H: P: P: P: Materialien: Becherglas (50 ml), 2 Reagenzgläser, Messzylinder, Indikatorpapier, 2 Stopfen, Pasteurpipetten, Pipettierhilfe. Chemikalien: Phenol, demin. Wasser, Natronlauge (1 mol/l), konz. Salzsäure. Durchführung: 2 g Phenol werden mit 5 ml Wasser versetzt und geschüttelt. Eine Hälfte der Emulsion wird in ein Reagenzglas gegeben und solange mit Wasser verdünnt, bis das ganze Phenol darin gelöst ist. Von der Lösung wird mit Indikatorpapier der ph-wert ermittelt. Die zweite Hälfte der Emulsion wird in ein weiteres Reagenzglas gegeben und unter Schütteln tropfenweise Natronlauge zugegeben, bis eine klare Lösung entstanden ist. Anschließend wird konz. Salzsäure zu der Lösung getropft. Beobachtung: Nach der Zugabe von Wasser bildet sich eine milchig weiße Emulsion. Nach Zugabe von Wasser in einem der Reagenzgläser, entsteht eine klare Lösung, welche das Indikatorpapier rot färbt (siehe Abb. 5). Nach Zugabe der Natronlauge bildet sich ebenfalls eine klare Lösung. Nach Zugabe der konz. Salzsäure tritt erneut eine deutliche Trübung der Lösung ein (siehe Abb. 6).
10 4 Schülerversuch V 2 Säurewirkung von Phenol 8 Abb. 5 - Emulsion aus Wasser und Phenol (links), mit Wasser verdünnte Emulsion und darin eingetauchtes Universalindikatorpapier (rechts). Abb. 6 - Klare Lösung nach Zugabe der Natronlauge (links), Trübung der Lösung nach Zugabe von verd. Essigsäure Deutung: Beim Lösen von Phenol in Wasser findet eine Deprotonierung der Hydroxidgruppe statt. Die Lösung ist dabei zunächst trüb, da das Phenol schwerlöslich ist und nicht vollständig deprotoniert wird. Es läuft dabei folgende Reaktion ab: Durch Verdünnen der Lösung mit Wasser wird das Gleichgewicht auf die rechte Seite verschoben, Phenol liegt hier also deprotoniert vor. Das Phenolat-Ion ist im Gegensatz zum Phenol in Wasser löslich. Gleichzeitig entstehen Hydronium-Ionen, die dafür verantwortlich sind, dass das Indikatorpapier sich rot färbt. Wird zur Phenollösung Natronlauge hinzugegeben, wird Phenol ähnlich wie beim Verdünnen mit Wasser vollständig deprotoniert. Es findet dabei folgende Reaktion statt: Das Phenolat-Ion ist in Wasser leicht löslich. Es wird wie das Phenolmolekül mesomeriestabilisert, weshalb es dazu neigt, das gebundene Proton abzugeben. Die negative Ladung wird dabei über das ganze Molekül verteilt, so dass sein realer Zustand zwischen den folgenden Grenzformeln liegt:
11 4 Schülerversuch V 2 Säurewirkung von Phenol 9 Da Phenol nur eine schwache Säure ist, wird sie durch Zugabe von Salzsäure wieder protoniert, wodurch das schwerer lösliche Phenol entsteht, welches zur einer Trübung der Lösung führt. Entsorgung: Die Natronlauge und Salzsäure werden im Säure-Base-Abfall entsorgt. Die Phenollösungen werden im organischen Abfall entsorgt. Literatur: H. Friesen, Professor Blumes Bildungsserver für Chemie, (Zuletzt abgerufen am um 08:24 Uhr). Der Versuch kann im Unterricht eingesetzt werden, um zu verdeutlichen, dass Phenol im Vergleich zu verwandten Verbindungen wie den Alkoholen aufgrund der mesomeren Grenzformeln des Phenolat-Ions eine schwache Säure ist.
12 Arbeitsblatt Bromierung der Seitenkette des Toluols Aufgabe 1 Zeichnen Sie die Strukturformeln der alkylsubstituierten Aromaten Toluol, Ethylbenzol und Xylol. Aufgabe 2 Die Bromierung von Toluol ist eine radikalische Substitutionsreaktion. Zeichnen Sie den Reaktionsmechanismus. Geben Sie dabei die einzelnen Schritte einer Kettenreaktion an. 1. Initiationsschritt: 2. Kettenfortpflanzungsschritt: 3. Terminationsschritt: Benzylbromid Aufgabe 3 Begründen Sie, warum auf die Bromierung von Toluol die SSS-Regel zutrifft.
13 5 Didaktischer Kommentar zum Schülerarbeitsblatt 11 5 Didaktischer Kommentar zum Schülerarbeitsblatt Das folgende Arbeitsblatt behandelt die Bromierung der Seitenkette des Toluols. Es kann daher unterstützend zum Lehrerversuch Bromierung der Seitenkette des Toluols zur Auswertung im Chemieunterricht verwendet werden. Wie im Versuch bereits beschrieben kann er im Unterricht zur Thematisierung der radikalischen Substitution und der SSS-Regel eingesetzt werden, nachdem die SuS erkannt haben, dass Toluol im Vergleich zu Cyclohexen nicht ohne weiteres mit Brom bzw. Baeyer-Reagenz reagiert (siehe hierzu den Versuch V2 des Kurzprotokolls). Als Vorwissen für den Versuch sollten den SuS radikalische Substitutionsreaktionen (z. B. der Alkane) bekannt sein. Außerdem sollten sie über ein gewisses Grundwissen über Aromaten verfügen. Für Aufgabe 2 der Auswertung werden Hilfskärtchen zur Verfügung gestellt, die von leistungsschwächeren SuS zur Aufgabenlösung genutzt werden können. Dabei werden folgende Hilfestellungen gegeben: 1. Kärtchen: Initiationsschritt: Brom wird durch Lichtenergie homolytisch gespalten, 2. Kärtchen: Kettenfortpflanzungsschritt: Ein Bromradikal entreißt dem Toluolmolekül ein Wasserstoffatom, 3. Kärtchen: Kettenfortpflanzungsschritt: Es entsteht ein Benzylradikal und..., 4. Kärtchen: Das Benzylradikal entreißt einem Brommolekül ein Bromatom, 5. Kärtchen: Terminationsschritt: Es kommt zum Abbruch der Kettenreaktion durch die Verbindung zweier beliebige Radikale in der Reaktionsmischung, wobei ein Molekül gebildet wird, in dem alle Elektronen gepaart sind. Es gibt hier drei verschiedene Möglichkeiten., 6. Kärtchen: Es kommt zum Abbruch der Kettenreaktion durch das Ausbilden einer kovalenten Bindung zwischen 1. zwei Benzylradikalen, 2. zwei Bromradikalen und 3. einem Benzylradikal und einem Bromradikal. 5.1 Erwartungshorizont (Kerncurriculum) Fachwissen: Die SuS beschreiben den Reaktionsmechanismus der radikalischen Substitution (Aufgabe 2). Die SuS zwischen homolytischer und heterolytischer Bindungsspaltung (Aufgabe 2). Erkenntnisgewinnung: Kommunikation: Die SuS leiten die Reaktionsmechanismen aus experimentellen Daten ab (Aufgabe 2). Die SuS argumentieren sachlogisch und begründen die entstehenden Produkte schlüssig (Aufgabe 2).
14 5 Didaktischer Kommentar zum Schülerarbeitsblatt 12 Bei Aufgabe 1 des Arbeitsblattes handelt es sich um eine Aufgabe im Anforderungsbereich I, da hier lediglich Strukturformeln von alkylsubstituierten Aromaten wiedergegeben werden sollen. Aufgabe 2 ist eine Aufgabe des Anforderungsbereichs II, da die SuS den Versuch auswerten sollen. Bei Aufgabe 3 handelt es sich um eine Aufgabe im Anforderungsbereich III, da die SuS komplexe Gedanken argumentierend entwickeln und im Zusammenhang darstellen. 5.2 Erwartungshorizont (Inhaltlich) Aufgabe 1 Zeichnen Sie die Strukturformeln der alkylsubstituierten Aromaten Toluol, Ethylbenzol und Xylol. Toluol: Ethylbenzol: o-xylol: m-xylol: p-xylol:
15 5 Didaktischer Kommentar zum Schülerarbeitsblatt 13 Aufgabe 2 Die Bromierung von Toluol ist eine radikalische Substitutionsreaktion. Zeichnen Sie den Reaktionsmechanismus. Geben Sie dabei die einzelnen Schritte einer Kettenreaktion an. 1. Initiationsschritt: Homolytische Spaltung von Brom in zwei Bromradikale 2. Kettenfortpflanzungsschritt: Toluol Benzylradikal Benzylradikal Benzylbromid 3. Terminationsschritt: Abbruch durch das Aufeinandertreffen zweier Benzylradikale: Abbruch durch das Aufeinandertreffen zweier Bromradikale: Abbruch durch das Aufeinandertreffen eines Benzylradikals und eines Bromradikals:
16 5 Didaktischer Kommentar zum Schülerarbeitsblatt 14 Aufgabe 3 Begründen Sie, warum auf die Bromierung von Toluol die SSS-Regel zutrifft. Auf die Bromierung von Toluol trifft die SSS-Regel zu, da Toluol erst unter Lichteinwirkung mit Brom reagiert. Außerdem findet bei der Bromierung von Toluol die Substitution eines H-Atoms durch ein Bromatom an der Methylgruppe, also an der Seitenkette und nicht am aromatischen Ring (Kern) statt.
Gruppe 04: Kern- und Seitenkettenbromierung von Toluol
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Aspirin und Paracetamol im chemischen Vergleich
 Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Von Arrhenius zu Brönsted dem Fehler! 2 Auf einen Blick: In diesem Protokoll werden Versuche vorgestellt, durch die die Notwendigkeit der
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Von Arrhenius zu Brönsted dem Fehler! 2 Auf einen Blick: In diesem Protokoll werden Versuche vorgestellt, durch die die Notwendigkeit der
Arbeitsblatt Wasserkreislauf der Erde
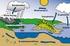 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Qualitative Nachweise von Säuren und Basen
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Haushaltsreiniger und Waschmittel
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 9 & 10. Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak)
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9 & 10 Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9 & 10 Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Gruppenarbeit physikalische und chemische Eigenschaften von Alkansäuren
 Gruppenarbeit Gruppe 1: Siedetemperaturen von Alkansäuren Löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt eine Gruppensprecherin
Gruppenarbeit Gruppe 1: Siedetemperaturen von Alkansäuren Löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt eine Gruppensprecherin
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Endersch, Jonas 26./ Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
1 Beschreibung des Themas und zugehörige Lernziele 1. Schulversuchspraktikum. Till Beuermann. Sommersemester 2013. Klassenstufen 7 & 8.
 1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Titrationen mit Alltagschemikalien
 Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Schulversuchspraktikum. Sommersemester 2013. Klassenstufen 7 & 8. Katalysatoren
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Organische Chemie 2 SPF BCH am Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema... 2
 Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Schulversuchspraktikum. Sina Bachsmann. Sommersemester. Klassenstufen 11 &12. Kosmetikartikel
 Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Versuch: Nachweis von Salicylsäure
 Philipps-Universität Marburg 11.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 12, Farb- und Wirkstoffe Versuch: Nachweis von Salicylsäure
Philipps-Universität Marburg 11.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 12, Farb- und Wirkstoffe Versuch: Nachweis von Salicylsäure
1.Klausur /12.Jg Chemiekurs m.e.a B Stunde Thema: Reaktionsverhalten von Kohlenwasserstoffen und Halogenalkanen
 1.Klausur /12.Jg Chemiekurs m.e.a B 1.-3. Stunde 17.19.2007 Name: Thema: Reaktionsverhalten von Kohlenwasserstoffen und Halogenalkanen Hinweise: Die Versuche sind ausführlich zu protokollieren, Reaktionsschemata
1.Klausur /12.Jg Chemiekurs m.e.a B 1.-3. Stunde 17.19.2007 Name: Thema: Reaktionsverhalten von Kohlenwasserstoffen und Halogenalkanen Hinweise: Die Versuche sind ausführlich zu protokollieren, Reaktionsschemata
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß)
 Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Schulversuchspraktikum. Sebastian Kuntze Sommersemester 2012 Klassenstufen 9 & 10. Titration
 Schulversuchspraktikum Sebastian Kuntze Sommersemester 2012 Klassenstufen 9 & 10 Titration Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 & 10 enthält 2 Schüler- und 2 Lehrerversuche zum Thema
Schulversuchspraktikum Sebastian Kuntze Sommersemester 2012 Klassenstufen 9 & 10 Titration Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 & 10 enthält 2 Schüler- und 2 Lehrerversuche zum Thema
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
10 Chemie I (2-stündig)
 10 Chemie I (2-stündig) Der Zusammenhang zwischen Struktur und Eigenschaften von organischen Molekülen bildet das Leitmotiv in dieser Jahrgangsstufe. Die Schüler erweitern ihre Kenntnisse über funktionelle
10 Chemie I (2-stündig) Der Zusammenhang zwischen Struktur und Eigenschaften von organischen Molekülen bildet das Leitmotiv in dieser Jahrgangsstufe. Die Schüler erweitern ihre Kenntnisse über funktionelle
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Trennverfahren auf Basis der Dichte
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum. Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10. Methan und Erdgas
 Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10 Methan und Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit zum Thema Methan und Erdgas enthält
Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10 Methan und Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit zum Thema Methan und Erdgas enthält
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Schulversuchspraktikum. Michaela Micke. Sommersemester Klassenstufen 9 & 10. Chemie der Kohlenwasserstoffe. Methan & Erdgas
 Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe.
 2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
n = V Lsg m n l mol Grundwissen 9. Klasse Chemie (NTG) Analytische Chemie Stoffmenge n Molare Masse M Molares Volumen V M Stoffmengenkonzentration c
 Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
1. a) Geben sie den Reaktionsmechanismus für die Nitrierung und die Sulfonierung von Benzol an. Beginnen sie mit der Erzeugung des Elektrophils.
 Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
6.1 Nachweis von Vitamin C. Aufgabe. Welche Lebensmittel enthalten Vitamin C? Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine
 Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine (P787800) 6. Nachweis von Vitamin C Experiment von: Anouch Gedruckt: 28.02.204 :2:46 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine (P787800) 6. Nachweis von Vitamin C Experiment von: Anouch Gedruckt: 28.02.204 :2:46 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Inhalt. 1 Atombau Die chemische Bindung Energetik chemischer Reaktionen 50. Vorwort 9
 Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
3. Säure-Base-Beziehungen
 3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
Sicherheitsvorkehrungen im Chemieunterricht
 Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Zusammenfassung: Säure Base Konzept
 Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: 2012. Klassenstufen: 11/12. Tenside
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Die sprühende Vereinigung von Aluminium und Brom
 Reaktionsgleichung 3 2 l + 2 Al s 2 Al 3 solv Zeitbedarf Vorbereitung: 10 min. Durchführung: 5 min. Nachbereitung: 10 min. Chemikalienliste Edukte Chemikalien Summen- Menge R-Sätze S-Sätze formel Schuleinsatz
Reaktionsgleichung 3 2 l + 2 Al s 2 Al 3 solv Zeitbedarf Vorbereitung: 10 min. Durchführung: 5 min. Nachbereitung: 10 min. Chemikalienliste Edukte Chemikalien Summen- Menge R-Sätze S-Sätze formel Schuleinsatz
Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse
 Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Protokoll Nr.1: 01. Oktober 2009. Eiweiße. Thema: Julia Wiegel
 Protokoll Nr.1: 01. Oktober 2009 Thema: Eiweiße 1 Julia Wiegel 1 http://images.google.de/imghp?hl=de&tab=wi (Stichwort: Eiweiße) 1 11 BG 08 Lehrer: Herr Weber Fach: Technologie Abgabetermin: 29. Oktober
Protokoll Nr.1: 01. Oktober 2009 Thema: Eiweiße 1 Julia Wiegel 1 http://images.google.de/imghp?hl=de&tab=wi (Stichwort: Eiweiße) 1 11 BG 08 Lehrer: Herr Weber Fach: Technologie Abgabetermin: 29. Oktober
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
Untersuche die Wirkung von Seife auf Trinkwasser und destilliertes Wasser.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
Welcher Unterschied besteht zwischen schwefliger Säure und Schwefelsäure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe. Einführungsphase (EF):
 Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
Schulversuchspraktikum. Name: Niklas Heier. Semester: Sommersemester 2013. Klassenstufen 9 & 10. Schwefelsäure
 Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 9 & 10 Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 9 & 10 Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
Abituraufgaben Grundkurs Chemie. Benzol. 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung!
 Abituraufgaben Grundkurs Chemie Benzol 1975/V 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung! b) Zeigen Sie, wie die Mesomerieenergie des Benzols ermittelt werden kann!
Abituraufgaben Grundkurs Chemie Benzol 1975/V 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung! b) Zeigen Sie, wie die Mesomerieenergie des Benzols ermittelt werden kann!
3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen
 Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Lernzirkel WAS Station 1 Herstellung von Seife aus Kokosfett
 Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Quantitative Analyse von Kohlenwasserstoffen
 Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH)
 Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
6.1. Kunststoffmodifizierungen (1) - Herstellung eines Phenolharzschaums. Aufgabe. Wie lassen sich Polymere weiterverarbeiten? (1)
 Naturwissenschaften - Chemie - Polymerchemie - 6 Kunststoffmodifizierungen (P78800) 6.. Kunststoffmodifizierungen () - Herstellung eines Phenolharzschaums Experiment von: Seb Gedruckt: 02.04.204 4:8:0
Naturwissenschaften - Chemie - Polymerchemie - 6 Kunststoffmodifizierungen (P78800) 6.. Kunststoffmodifizierungen () - Herstellung eines Phenolharzschaums Experiment von: Seb Gedruckt: 02.04.204 4:8:0
Saurer Regen, was ist das?
 Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Schulversuchspraktikum. Miriam Jarrar. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur April/Mai 2002. Chemie (Grundkurs) Thema 1 Wasserstoff
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2002 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Wasserstoff Thema 2 Organische Verbindungen und ihr Reaktionsverhalten
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2002 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Wasserstoff Thema 2 Organische Verbindungen und ihr Reaktionsverhalten
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Versuchsprotokoll. Nitrierung von Phenol. Gruppe 4, Typ: Pflichtversuch O O - N
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt?
 178 Farbstoffe, Aromaten 5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt? Thematik Unterrichtsmethode Grundlagen: Säure-Base-Gleichgewichte, Wechselwirkungen zwischen Farbstoff- und Faser- Molekülen, Chromophor,
178 Farbstoffe, Aromaten 5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt? Thematik Unterrichtsmethode Grundlagen: Säure-Base-Gleichgewichte, Wechselwirkungen zwischen Farbstoff- und Faser- Molekülen, Chromophor,
CH-Matura TB 1 THEMENBEREICH 1: Themenbereiche Chemie. AGMueller2014V3
 TB 1 THEMENBEREICH 1: STOFFEIGENSCHAFTEN, ATOMBAU Der Kandidat/ die Kandidatin kennt die wichtigsten Stoffeigenschaften und einfache Methoden um diese zu bestimmen. Er/Sie kann den Atombau nach BOHR erklären
TB 1 THEMENBEREICH 1: STOFFEIGENSCHAFTEN, ATOMBAU Der Kandidat/ die Kandidatin kennt die wichtigsten Stoffeigenschaften und einfache Methoden um diese zu bestimmen. Er/Sie kann den Atombau nach BOHR erklären
Welche Elemente außer Kohlenstoff und Wasserstoff können in Polymeren enthalten sein?
 Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
1.) Organometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte).
 Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Betriebsanweisung nach 20 Gefahrstoffverordnung. Verwendete Chemikalien /37/ Kupfer (Pulver) - -
 Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Anhang zum Sonderkontaktbrief 2010 Chemie
 Anhang zum Sonderkontaktbrief 2010 Chemie Kompetenzbereiche der Bildungsstandards und der EPA Die Bildungsstandards und die EPA für Chemie verwenden für die vier Kompetenzbereiche teilweise unterschiedliche
Anhang zum Sonderkontaktbrief 2010 Chemie Kompetenzbereiche der Bildungsstandards und der EPA Die Bildungsstandards und die EPA für Chemie verwenden für die vier Kompetenzbereiche teilweise unterschiedliche
Erftgymnasium der Stadt Bergheim. Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II
 Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
7.3 Kohlendioxid. Aufgabe. Wie kann Kohlendioxid nachgewiesen werden? Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser
 Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser (P78800) 7.3 Kohlendioxid Experiment von: Anouch Gedruckt: 28.02.204 :4:54 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie kann
Naturwissenschaften - Chemie - Lebensmittelchemie - 7 Wasser (P78800) 7.3 Kohlendioxid Experiment von: Anouch Gedruckt: 28.02.204 :4:54 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie kann
Schulcurriculum für die Qualifikationsphase im Fach Chemie
 Schulcurriculum für die Qualifikationsphase im Fach Chemie Fach: Chemie Klassenstufe: 11/12 Anzahl der zu unterrichtenden Wochenstunden: 3 Die Inhalte des Kerncurriculums wurden in Absprache mit den anderen
Schulcurriculum für die Qualifikationsphase im Fach Chemie Fach: Chemie Klassenstufe: 11/12 Anzahl der zu unterrichtenden Wochenstunden: 3 Die Inhalte des Kerncurriculums wurden in Absprache mit den anderen
Aromaten, Fette und Tenside Seminar zu chem2010 Stephan Bernt
 , Fette und Tenside 12.05.2010 Seminar zu chem2010 Stephan Bernt Kriterien für Aromatizität: cyclisch planar vollständig konjugiertes π-elektronensystem Hückel-Regel: 4n+2 π-elektronen Prototyp des Aromaten:
, Fette und Tenside 12.05.2010 Seminar zu chem2010 Stephan Bernt Kriterien für Aromatizität: cyclisch planar vollständig konjugiertes π-elektronensystem Hückel-Regel: 4n+2 π-elektronen Prototyp des Aromaten:
Grundwissen Chemie. 8. Jahrgangsstufe, Gruppe I
 Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Europäischer Chemielehrerkongress Leoben Österreich im April 2007
 Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
