CH CH 2 H 2 C H 2 C CH 2 CH CH CH 2 CH 2 C H H 2 C CH 2 C 2 CH 2 H CH 2 CH 2
|
|
|
- Clara Anna Pohl
- vor 6 Jahren
- Abrufe
Transkript
1 Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind ringförmig gebaut und werden als ycloalkane bezeichnet, wobei sich die Vorsilbe cyclo auf den zyklischen Molekülbau bezieht. Aufgabe 1: Zeichne die albstrukturformeln von yclopropan (n = 3), yclobutan (n = 4), yclopentan (n = 5), yclohexan (n = 6) und ycloheptan (n = 7) in Dein eft!
2 Aufgabe : Drei der genannten Verbindungen aus Aufgabe 1 sind nicht besonders stabil, d.h. sie besitzen eine hohe innere Energie und reagieren schnell bzw. heftig. Baue mithilfe eines Molekülbaukastens die Modelle der 5 ycloalkane und ermittle anhand Deines Gefühls, welche Verbindungen stabil und welche instabil sein könnten! Begründe anschließend mit Fachbegriffen, warum manche ycloalkane instabil sind! Berücksichtige dabei, dass Elektronen negativ geladen sind. yclopropan, yclobutan und ycloheptan sind nicht besonders stabil, denn die Bindungswinkel stimmen bei diesen Strukturen kaum mit dem eigentlichen Tetraederwinkel überein. yclopropan: theoretischer Innenwinkel () = 60 (statt 109,5 ) yclobutan: theoretischer Innenwinkel () = 90 (statt 109,5 ) Die Bindungselektronen zwischen den --Bindungen stehen sich also viel zu nahe und stoßen sich gegenseitig stark ab; das Molekül besitzt eine hohe Ringspannung (die Bindungen lösen sich relativ leicht, d.h. die beiden Moleküle reagieren sehr leicht! instabil; hohe innere Energie). yclopentan: theoretischer Innenwinkel () = 108 (statt 109,5 - es liegt also kaum Ringspannung vor. Zudem kann sich das Molekül im Raum so falten, dass die vorhandene Ringspannung verringert wird: Das Molekül ist daher stabil; es besitzt geringe innere Energie.) yclohexan: theoretischer Innenwinkel () = 10 (allerdings liegt das Molekül nicht flach vor, sondern in Form eines Sessels oder einer Wanne, so dass sich der optimale Winkel von ca. 109,5 gut einstellen lässt: Das Molekül ist daher sehr stabil; es besitzt sehr geringe innere Energie.) ycloheptan: theoretischer Innenwinkel () = 18,6 (statt 109,5 - aufgrund der Größe des Moleküls und der Bindungslänge ergibt sich bei großen ycloalkanen oft das Problem, dass eine räumliche Faltung des Moleküls wie bei yclohexan nicht ausreicht, um alle Bindungen zu entspannen. Manche Bindungswinkel bleiben zu groß und daher stoßen sich die Bindungselektronen der --Bindungen stark von den Bindungselektronen der --Bindungen ab. Folge: das Molekül wird instabil; es besitzt eine höhere innere Energie.)
3 Die Nomenklatur der ycloalkane folgt den üblichen Regeln nach IUPA, jedoch ergibt sich ein Problem: in einem Ring sind alle Positionen gleichwertig es gibt keinen Anfang und kein Ende. Wo soll man also mit dem Durchzählen der Kette beginnen? Sofern ein ycloalkan keine Seitengruppen besitzt, ist ein Durchzählen nicht nötig, ansonsten erhält das -Atom im Ring, welches die Seitenkette trägt, die Ziffer 1. Sind mehrere Seitenketten vorhanden, wird insgesamt darauf geachtet, dass die Ziffern möglichst klein sind, d.h. es wird im oder gegen den Uhrzeigersinn gezählt und man beginnt mit dem Zählen so, dass alle Seitenketten möglichst niedrige Ziffern erhalten. Aufgabe 3: Zeichne die albstrukturformeln der folgenden Verbindungen: 1-Propylcyclopentan, 1,1-Diethylcyclohexan, 1-yclopentylcyclohexan und 1,-Dimethylcyclopentan!
4 Aufgabe 4: Die Bezeichnung 1,-Dimethylcyclopentan ist nicht eindeutig, denn es gibt zwei unterschiedliche Verbindungen mit diesem Namen! Ermittle mithilfe eines Molekülbaukastens die dreidimensionale Struktur dieser beiden Verbindungen und zeichne die Strukturformeln der beiden Moleküle, so dass man die relative Stellung der beiden Seitenketten zueinander eindeutig erkennen kann! alternative Zeichnung; entspricht der oberen Darstellung, wenn man die Molek le einmal um ihre Achse dreht: 1,-Dimethylcyclopentan 1,-Dimethylcyclopentan (erste mögliche Form) (zweite mögliche Form) Die Methylgruppen stehen also einmal auf der gleichen Seite der Ringfläche und einmal auf den entgegen gesetzten Seiten der Ringfläche. Es handelt sich also tatsächlich um verschiedene Moleküle mit unterschiedlichen Eigenschaften, z.b. Siedepunkte: erste Form: 97, zweite Form: 91,9
5 Aufgabe 5: Eine der beiden Verbindungen wird als cis-1,-dimethylcyclopentan, die andere als trans-1,-dimethylcyclopentan bezeichnet. Ordne Deinen beiden Strukturformeln mithilfe des Auszugs aus den richtigen Namen zu! trans-, Trans- (Deutsch); Präfix Aussprache: IPA: [t ans] Bedeutungen: in Fremdwörtern aus dem Lateinischen: auf die andere Seite, über-, hindurch- Synonyme: über-, hinüber-, durch-, hindurch- erkunft: von lateinisch trans- über-, durch- Beispiele: transalpin, transatlantisch, transdermal, transgenerational, transparent, transzendent, Transaktion, Transfer, Transformation, Transformator, Transsexualität, Transistor, Transit, Transkription, Translation, Transplantation, Transport, Transposition, Transrapid, Transvestit, Transzendenz, transformieren, transportieren aus Wictionary.org: trans-, ( ) alternative Zeichnung; entspricht der oberen Darstellung, wenn man die Molek le einmal um ihre Achse dreht: trans-1,-dimethylcyclopentan cis-1,-dimethylcyclopentan trans-1,-dimethylcyclopentan cis-1,-dimethylcyclopentan
6 Zur Verringerung des Arbeitsaufwandes beim Zeichnen der Molekülstrukturen wurde bereits die so genannte albstrukturformel eingeführt. Obwohl im Vergleich zu den Valenzstrichformeln bzw. Strukturformeln das Zeichnen so wesentlich vereinfacht wurde, ist es noch immer zeitaufwändig. Es liegt nahe, dass man vor allem bei großen Molekülen eine noch einfachere und schnellere Methode wünscht, um die Molekülstrukturen zu zeichnen. Zu diesem Zweck wurden die so genannten Skelettformeln entwickelt. Die folgenden Beispiele verschiedener Octane sollen zeigen, wie Skelettformeln gezeichnet werden: Strukturformel albstrukturformel Skelettformel a) Eine Ecke bzw. ein freies Ende entspricht einem -Atom mit der nötigen Anzahl -Atomen b) Ein Strich entspricht einer Bindung zwischen zwei -Atomen Aufgabe 6: Zeichne die Skelettformeln der folgenden Verbindungen in Dein eft! n-butan, n-exan,,3-dimethylbutan, 3-Ethyl-4-methylheptan, 1-Propylcyclopentan, 1,1-Diethylcyclohexan, 1-yclopentylcyclohexan, cis-1,-dimethylcyclopentan und trans-1,-dimethylcyclopentan.
7 Aufgabe 7: Benenne die folgenden Moleküle nach IUPA! a) b) c) d) e) f) g) h) i) j) a) 3-Methylhexan b) 3-Ethylpentan c) cis-1,3-dimethylcyclopentan d) n-ethan e) n-eptan f) 4-Ethyl-3,3,7-trimethyl-6-propyldecan g) trans-1,-dibutylcyclohexan h) 3-Methyloctan i),-dimethylpropan (= Dimethylpropan) j) cis-1,4-dipentylcyclohexan
8 k) Überlege: Welches Alkan ist nicht durch eine Skelettformel darstellbar? Methan; es gibt keine --Bindung, die darstellbar wäre.
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
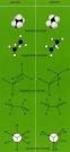 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Übungen zur VL Chemie für Biologen und Humanbiologen Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur:
 Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Clara Schumann -Gymnasium Grundlagen der organischen Chemie
 1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Systematische Nomenklatur
 Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Kapitel 9: Kohlenwasserstoffe
 Ursprünglich bezeichnete man die Stoffe, die in Lebewesen (Organismen) gebildet werden, als organische Verbindungen. Organische Stoffe sind z.b. in olz enthalten, im leisch, in lebenden Pflanzen und Bakterien,
Ursprünglich bezeichnete man die Stoffe, die in Lebewesen (Organismen) gebildet werden, als organische Verbindungen. Organische Stoffe sind z.b. in olz enthalten, im leisch, in lebenden Pflanzen und Bakterien,
Nomenklatur von Alkyl Substituenten
 Organic Chemistry 4 th Edition Paula Yurkanis uice Chapter 2 Alkane: Kohlenwasserstoffe, die nur Einfachbindungen aufweisen Allgemeine Fmel: C n 2n+2 Eine Einführung In Organische Verbindungen Nomenklatur
Organic Chemistry 4 th Edition Paula Yurkanis uice Chapter 2 Alkane: Kohlenwasserstoffe, die nur Einfachbindungen aufweisen Allgemeine Fmel: C n 2n+2 Eine Einführung In Organische Verbindungen Nomenklatur
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2
 A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
ORGANISCHE CHEMIE. Prof. Dipl.-Ing. Manfred SUSSITZ. Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt
 ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Übungsaufgaben zu Kohlenwasserstoffen, halogenierten KW und Valenzbindungsmodell
 Übungsaufgaben zu Kohlenwasserstoffen, halogenierten KW und Valenzbindungsmodell Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Einige der Fragen sind ehemalige Klassenarbeitsfragen.
Übungsaufgaben zu Kohlenwasserstoffen, halogenierten KW und Valenzbindungsmodell Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Einige der Fragen sind ehemalige Klassenarbeitsfragen.
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Übungsaufgaben zu Alkanen und Halogenalkanen
 Übungsaufgaben zu Alkanen und alogenalkanen 2L Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Die Fragen am Ende des Übungsblatts sind in der Regel ehemalige Klassenarbeitsfragen aus
Übungsaufgaben zu Alkanen und alogenalkanen 2L Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Die Fragen am Ende des Übungsblatts sind in der Regel ehemalige Klassenarbeitsfragen aus
Kohlenwasserstoffe. Alkane Alkene Alkine Cycloaliphaten. Ethin (Acetylen) Propin u.s.w. Cycloalkane Cycloalkene Cycloalkine
 Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Die Kohlenwasserstoffe und ihre Nomenklatur
 Die Kohlenwasserstoffe und ihre Nomenklatur Ein Leitprogramm für die hemie Autor Beratung Dr. Georg Graf Prof. Dr. Antonio Togni, ETZ Leitprogramm Nomenklatur Adressaten Gymnasiasten ab 2. Schuljahr im
Die Kohlenwasserstoffe und ihre Nomenklatur Ein Leitprogramm für die hemie Autor Beratung Dr. Georg Graf Prof. Dr. Antonio Togni, ETZ Leitprogramm Nomenklatur Adressaten Gymnasiasten ab 2. Schuljahr im
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Zusammenfassung Prüfung Chemie vom
 Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Alkane einfache Kohlenwasserstoffe
 Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Organische Chemie - 4 - Kohlenstoff als Bindungspartner. Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
Was ist ein Kaleidozyklus?
 Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Konformation von Polypeptiden
 1 Konformation von Polypeptiden Peter Güntert, Wintersemester 2011/12 Primärstruktur Polypeptide sind lineare Ketten, die aus 20 verschiedenen Typen von Bausteinen (Aminosäureresten, AS) aufgebaut sind.
1 Konformation von Polypeptiden Peter Güntert, Wintersemester 2011/12 Primärstruktur Polypeptide sind lineare Ketten, die aus 20 verschiedenen Typen von Bausteinen (Aminosäureresten, AS) aufgebaut sind.
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
6. Bindungslehre 6.1 Eigenschaften des PSE
 6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Alkane - eine vielseitige Stoffgruppe. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden.
 6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
2.8. Formulieren sie die Reaktionsgleichungen (in Summenformeln) für die vollständige Verbrennung von. a) Methan b) Propan c) Cyclohexan d) Ethin
 Übungsaufgaben zu Alkanen, alogenalkanen und Valenzbindungsmodell Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Einige der Fragen sind ehemalige Klassenarbeitsfragen. 1. Bindungstheorie:
Übungsaufgaben zu Alkanen, alogenalkanen und Valenzbindungsmodell Vorbemerkung: Die Fragen decken nicht das gesamte Themengebiet ab! Einige der Fragen sind ehemalige Klassenarbeitsfragen. 1. Bindungstheorie:
Isomere. 3. Bsp. C5H12
 Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 1 2 nhalt...1 nhalt... 2 Wdh. Klasse 10: Die Atombindung bei Wasserstoff & Kohlenstoff...4 Kohlenstoff als Bindungspartner... 5 Die homologe Reihe der Alkane... 6 Die Namen der homologen Reihe von Alkanen
1 2 nhalt...1 nhalt... 2 Wdh. Klasse 10: Die Atombindung bei Wasserstoff & Kohlenstoff...4 Kohlenstoff als Bindungspartner... 5 Die homologe Reihe der Alkane... 6 Die Namen der homologen Reihe von Alkanen
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Kovalenzbindungen und zwischenmolekulare Kräfte
 Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Grundlagen der Chemie Die Atombindung Kovalente Bindungen
 Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln.
 Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. CnH2n-2
 Ri 51 1.3. Alkine Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. Allgemeine Summenformel der Monoalkine: CnH2n-2 Alkine sind gestreckte MolekÄle.
Ri 51 1.3. Alkine Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. Allgemeine Summenformel der Monoalkine: CnH2n-2 Alkine sind gestreckte MolekÄle.
Die Alkane. Anna Heynkes. 22.6.2005, Aachen. 1 Was sind Alkane 1. 2 Verwendung der Alkane 1. 3 Einige Eigenschaften der Alkane 2
 Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
wir-sind-klasse.jimdo.com
 Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Konfigurationsisomerie
 Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
1. Download und Installation 2. Chemsketch einfach einrichten
 1. Download und Installation 2. Chemsketch einfach einrichten Hinweise 1 Einleitung Dieses Tutorial wurde erstellt, um die ersten Schritte, die sich meist als die frustriertendsten herausstellen, möglichst
1. Download und Installation 2. Chemsketch einfach einrichten Hinweise 1 Einleitung Dieses Tutorial wurde erstellt, um die ersten Schritte, die sich meist als die frustriertendsten herausstellen, möglichst
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Zahl der C-Atome Allgemeine Summenformel C n H 2n+ ₂
 1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
Aufbau und Konformation von Polypeptiden
 1 Aufbau und Konformation von Polypeptiden Peter Güntert, Sommersemester 2009 Hierarchie von Proteinstrukturen Primärstruktur: Aminosäuresequenz Sekundärstruktur: Helices, Faltblätter, Turns, Loops Tertiärstruktur:
1 Aufbau und Konformation von Polypeptiden Peter Güntert, Sommersemester 2009 Hierarchie von Proteinstrukturen Primärstruktur: Aminosäuresequenz Sekundärstruktur: Helices, Faltblätter, Turns, Loops Tertiärstruktur:
Stoffe im Wandel. I Stoffe in der organischen Chemie 1 Grundlagen der organischen Chemie
 Stoffe im Wandel I Stoffe in der organischen hemie 1 Grundlagen der organischen hemie II Reaktionsarten der organischen hemie 1 Substitutionsreaktion 2 Additionsreaktion 3 Eliminationsreaktion 4 Oxidationsreaktion
Stoffe im Wandel I Stoffe in der organischen hemie 1 Grundlagen der organischen hemie II Reaktionsarten der organischen hemie 1 Substitutionsreaktion 2 Additionsreaktion 3 Eliminationsreaktion 4 Oxidationsreaktion
Zeichnen von Valenzstrichformeln
 Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Definiere den Begriff Orbital. Leiten Sie die räumliche Struktur des Wassers her, zeichnen und benennen Sie sie.
 Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Leiten Sie die räumliche
Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Leiten Sie die räumliche
8. Stereochemie organischer Moleküle 8.1
 8. Stereochemie organischer Moleküle 8.1 Stereochemie organischer Moleküle Zur Darstellung der Struktur organischer Moleküle werden oft Formeln verwendet, welche den räumlichen Bau nicht zum Ausdruck bringen.
8. Stereochemie organischer Moleküle 8.1 Stereochemie organischer Moleküle Zur Darstellung der Struktur organischer Moleküle werden oft Formeln verwendet, welche den räumlichen Bau nicht zum Ausdruck bringen.
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Methan CH4. 0,6 Anzahl der C-Atome im n-alkan. Begründe die unterschiedlichen Viskositätswerte bei den angegebenen Alkanen.
 Fragenkatalog für die 0. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt der Frage.
Fragenkatalog für die 0. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt der Frage.
Beuth Hochschule für Technik Berlin, Studiengang Pharma- und Chemietechnik Tutorium Organische Chemie 1 (SS 2011), Tutor: Sascha Behne
 IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
Cyclohexan und Dekalin
 Cyclohexan und Dekalin Die wohl wichtigste ringförmige Struktur in der organischen Chemie ist der Sechsring, im gesättigten Fall Cyclohexan. Dies gilt schon deshalb, weil dieser Ring zentraler Bestandteil
Cyclohexan und Dekalin Die wohl wichtigste ringförmige Struktur in der organischen Chemie ist der Sechsring, im gesättigten Fall Cyclohexan. Dies gilt schon deshalb, weil dieser Ring zentraler Bestandteil
1. Nomenklatur (Fettgedruckt...IUPAC Namen) 1.1. Alkane
 rganisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen AAG. omenklatur (Fettgedruckt...IUPA amen).. Alkane Die längste Kohlenstoffkette wird bestimmt und daraus ergibt sich der ame Alkan:
rganisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen AAG. omenklatur (Fettgedruckt...IUPA amen).. Alkane Die längste Kohlenstoffkette wird bestimmt und daraus ergibt sich der ame Alkan:
Alkane als Kraftstoffe
 Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
