APPLICA Moderne Detektionstechniken in der Ionenchromatographie. S. Czyborra Dr. K. H. Viehweger Dr. A. Wille. Metrohm AG, Herisau, Schweiz
|
|
|
- Swen Lorenz
- vor 6 Jahren
- Abrufe
Transkript
1 Moderne Detektionstechniken in der Ionenchromatographie S. Czyborra Dr. K. H. Viehweger Dr. A. Wille Metrohm AG, Herisau, Schweiz ic_applica_200605_d.ppt 1
2 Moderne Detektionstechniken in der Ionenchromatographie Inhalt Traditionelle Techniken! Leitfähigkeit! UV/VIS! Ampèrometry Kopplungstechniken! IC/MS! IC/ICP-MS ic_applica_200605_d.ppt 2
3 Moderne Detektionstechniken in der Ionenchromatographie Leitfähigkeitsmessung ic_applica_200605_d.ppt 3
4 ic_applica_200605_d.ppt 4 APPLICA 2006 Leitfähigkeitsmessung Leitfähigkeitsmessung Kationen- und Anionenbestimmung Kationen- und Anionenbestimmung Ku Ac Ra Fr Rn At Po Bi Pb Tl Hg Au Pt Ir Os Re W Ta Hf La Ba Cs Xe I Te Sb Sn In Cd Ag Pd Rh Ru Tc Mo Nb Zr Y Sr Rb Kr Br Se As Ge Ga Zn Cu Ni Co Fe Mn Cr V Ti Sc Ca K Ar Cl S P Si Al Mg Na Ne F O N C B Be Li He H VIII VII VI V IV III II II I VIII VIII VII VII VI VI V IV IV III III II I
5 Leitfähigkeitsmessung Mit oder ohne Suppression? ic_applica_200605_d.ppt 5
6 Leitfähigkeitsmessung Ohne Suppression Ohne Suppression! Einsäulentechnik! hohe Hintergrundleitfähigkeit! Bestimmung von! Anionen! Kationen! organischen Säuren! Kohlehydraten ic_applica_200605_d.ppt 6
7 Leitfähigkeitsmessung Ohne Suppression Das Signal wird durch die unterschiedlichen Equivalentleitfähigkeiten des Analyt- - und Eluentions bestimmt ic_applica_200605_d.ppt 7
8 Leitfähigkeitsmessung Ohne Suppression Kationenbestimmung Metrosep C /2 3/ Lithium/Natrium NH 4 + /Kalium Rubidium Cesium Magnesium Mangan Zink Kalzium Strontium Barium ppm 1/5 5/ ic_applica_200605_d.ppt 8 HNO 3 ; 3 mmol/l; 20!L; 1 ml/min
9 Leitfähigkeitsmessung Ohne Suppression Anionenbestimmung Metrosep Supp Chlorid 2 Nitrit 3 Bromid 4 Nitrat 5 Sulfat ppm Phthalsäure/Azeton; 5/2 mmol/l/% (TRIS ph = 4.4) ic_applica_200605_d.ppt 9
10 Leitfähigkeitsmessung Ohne Suppression Anionenbestimmung Phenomemex Star Ion 1 Borat 2 Silikat ppb LOD (B) = 0.01, LOQ (B) = 0.04 LOD (Si) = 0.02, LOQ (Si) = 0.07 Anreicherung von ml NaOH/Na 2 CO 3 ; 3.2/0.5 mmol/l ic_applica_200605_d.ppt
11 Leitfähigkeitsmessung Mit Suppression Mit Suppression! Zweisäulentechnik! geringe Hintergrundleitfähigkeit! Bestimmung von! Anionen! organischen Säuren ic_applica_200605_d.ppt 11
12 Leitfähigkeitsmessung Mit Suppression Das Signal ergibt sich aus der Summe der Leitfähigkeiten des Probenions plus Gegenion (H + or OH ) gegen den Hintergrund von Wasser ic_applica_200605_d.ppt 12
13 Leitfähigkeitsmessung Mit Suppression Metrosep A Supp Galaktonat Fluorid Glykolat Acetate Propionat Formiat Pyruvat Methacrylat Monochloracetate Chlorid ppm H 2 O/Na 2 CO 3 ; 20 mmol/l; 5-25 % ic_applica_200605_d.ppt 13
14 Leitfähigkeitsmessung Mit Suppression Metrosep A Supp Nitrit Bromid Dichloracetat Nitrat Phosphite Phosphat Sulfat Tartrat Selenat Oxalat ppm H 2 O/Na 2 CO 3 ; 20 mmol/l; 5-25 % ic_applica_200605_d.ppt 14
15 Leitfähigkeitsmessung Mit Suppression Metrosep A Supp Arsenat 22 n.q. ppm.0 H 2 O/Na 2 CO 3 ; 20 mmol/l; 5-25 % ic_applica_200605_d.ppt 15
16 Leitfähigkeitsmessung Ohne und mit Suppression Metrosep Dual Fluorid Arsenite Chlorid Sulfide Cyanide Bromid Nitrat Sulfat Phosphat Arsenate ppm NaOH 2/7 mmol/l, step 11.2 min IC ohne Suppression IC mit Suppression ic_applica_200605_d.ppt 16
17 Moderne Detektionstechniken in der Ionenchromatographie UV/Vis ic_applica_200605_d.ppt 17
18 ic_applica_200605_d.ppt 18 APPLICA 2006 UV/Vis-Detektion UV/Vis-Detektion Direkte UV/Vis-Detektion und nach Direkte UV/Vis-Detektion und nach Derivatisierung Derivatisierung Ku Ac Ra Fr Rn At Po Bi Pb Tl Hg Au Pt Ir Os Re W Ta Hf La Ba Cs Xe I Te Sb Sn In Cd Ag Pd Rh Ru Tc Mo Nb Zr Y Sr Rb Kr Br Se As Ge Ga Zn Cu Ni Co Fe Mn Cr V Ti Sc Ca K Ar Cl S P Si Al Mg Na Ne F O N C B Be Li He H VIII VII VI V IV III II II I VIII VIII VII VII VI VI V IV IV III III II I
19 UV/Vis-Detektion Wellenlängen UV! nm! Deuterium- oder Quecksilberlampe VIS! nm! Wolfram- oder Halogenlampe ic_applica_200605_d.ppt 19
20 UV/Vis-Detektion Bromid in Salz Metrosep A Supp Bromid ppb 291 NaHCO 3 /Na 2 CO 3 ; 11/0.5 mmol/l; 1.0 ml/min; 20!L; UV 205 nm; mit chemischer Suppression zur CO 2 -Entfernung; 1 % NaCl ic_applica_200605_d.ppt 20
21 UV/Vis-Detektion Biogene Amine in Wein Metrosep C1 1 Tyramin 2 Phenylethylamin 3 Histamin ppm nm 206 nm 191 nm C H 2 SO 4 /Azetonitril; 1.5/ mmol/l/%; 1.0 ml/min ic_applica_200605_d.ppt 21
22 Leitfähigkeits- und UV/Vis-Detektion Standard Metrosep C2 150 ppm CD (Kupfer)/Nickel / Lithium 1 Zink Kobalt Natrium 5 Ammonium 5 Kalium Blei Mangan Magnesium Kadmium Kalzium Oxal-/Borsäure,8.4/12 mmol/l CD ic_applica_200605_d.ppt 22
23 Leitfähigkeits- und UV/Vis-Detektion Standard Metrosep C2 150 ppm Vis Kupfer/Nickel / Vis Zink Kobalt Blei Mangan Kadmium pcr with PAR Oxal-/Borsäure,8.4/12 mmol/l ic_applica_200605_d.ppt 23
24 Moderne Detektionstechniken in der Ionenchromatographie Ampèrometry ic_applica_200605_d.ppt 24
25 ic_applica_200605_d.ppt 25 APPLICA 2006 DC oder DC oder PAD PAD Ku Ac Ra Fr Rn At Po Bi Pb Tl Hg Au Pt Ir Os Re W Ta Hf La Ba Cs Xe I Te Sb Sn In Cd Ag Pd Rh Ru Tc Mo Nb Zr Y Sr Rb Kr Br Se As Ge Ga Zn Cu Ni Co Fe Mn Cr V Ti Sc Ca K Ar Cl S P Si Al Mg Na Ne F O N C B Be Li He H VIII VII VI V IV III II II I VIII VIII VII VII VI VI V IV IV III III II I Ampèrometry Ampèrometry
26 Ampèrometry Prinzip DC! Gleichstromampèrometrie PAD! gepulste Ampèrometrie Technik! Dreielektrodenaufbau! Arbeitselektrode (Pt, Au, Ag, GC)! Referenzelektrode (Ag/AgCl, Festphase)! Hilfselektrode (Au, SST) ic_applica_200605_d.ppt 26
27 Ampèrometry DC Anorganische Anionen Metrosep A Supp 1 ppb na Sulfid Zyanid e d i f l u s e d i n a y c 4.0 NaOH; 0 mmol/l; 1.0 ml/min; Ag 0 mv Cell min ic_applica_200605_d.ppt 27
28 Ampèrometry DC Aminosäuren Metrosep C Tyrosin 2 Tryptophan ppm na n a h p o t p y r T e n i s o r y T HNO 3 ; 5 mmol/l; 1.0 ml/min; GC 340 mv 4.0 Cell min ic_applica_200605_d.ppt 28
29 Ampèrometry PAD Kohlenhydrate Metrosep Carb Inositol Arabitol Sorbitol Fucose Arabinose Glucose Xylose Fructose Lactose Sucose NaOH; 0 mmol/l; 1 ml/min ppm ic_applica_200605_d.ppt 29
30 Ampèrometry PAD Polyfructosan: Inulin Metrosep A Supp Inulin g/l 3 na Cell % B A: NaOH/NaAc; 0/ mmol/l B: NaOH/NaAc; 0/200 mmol/l % B in 50 min min ic_applica_200605_d.ppt 30
31 Moderne Detektionstechniken in der Ionenchromatographie IC/MS ic_applica_200605_d.ppt 31
32 IC/MS «MIC-2 Advanced» plus Agilent 10! Erhöhung der Empfindlichkeit! Erhöhung der Selektivität! reduzierter Matrixeinfluss! absolute Peakidentifizierung! Strukturaufklärung von grossen Molekülen ic_applica_200605_d.ppt 32
33 IC/MS Prinzip IC inlet ic_applica_200605_d.ppt 33
34 IC/MS Prinzip ESI ic_applica_200605_d.ppt 34
35 IC/MS Anionen Standard Metrosep A Supp ppm CD Bromid Nitrat Phosphat Sulfat Oxalat Thiosulfat 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min ic_applica_200605_d.ppt 35
36 IC/MS Anionen Standard Metrosep A Supp ; 2 Bromid 3 Nitrat 4; 5 Phosphat 6; 7 Sulfat 8 Oxalate 9 ThioSulfat m/z 79; ; 97 97; MS 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 36
37 IC/MS Anionen Oxohalogenide (Standard) Metrosep A Supp ppm CD Fluorid Chlorit Bromat Chlorid Chlorat Bromid Nitrat Phosphat Sulfat ic_applica_200605_d.ppt /1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min
38 IC/MS Anionen Oxohalogenide (Standard) Metrosep A Supp m/z MS Chlorite Bromat Chlorate Bromid Nitrat Phosphat Phosphat Sulfat /1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 38
39 IC/MS Anionen Bromat im Herisauer Trinkwasser Metrosep A Supp Bromat 2 Bromat 3 Bromat Bromat TIC m/z 0.32 ppb MS 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 39
40 IC/MS Anionen Bromat Detektionsgrenzen (DIN ) Injektionsvolumen!L LOD in Reinstwasser!g/L LOD in Leitungswassermatrix*!g/L Leitfähigkeitsdetektion MS-Detektion PCR mit Vis-Detektion PCR mit UV-Detektion * Leitungswassermatrix: 0 mg/l Chlorid, Carbonat und Sulfat ic_applica_200605_d.ppt 40
41 IC/MS Anionen Perchlorat (Standard) Metrosep A Supp Perchlorat ppb MSD1 99, EIC=98.7:99.7 (ICDATA~1\ICBLK1D\IC D) API-ES, Neg, SIM, Frag: 140, "neg sim" MSD1 1, EIC=0.7:1.7 (ICDATA~1\ICBLK1D\IC D) API-ES, Neg, SIM, Frag: 140, "neg sim" M/z = M/z = MIC 2 + Agilent MSD 10 30/30 mmol/l / % NaOH/MeOH; 0.8 ml/min; m/z = 99 & min ESI: L/min; 30 psi g; 320 C; 1.5 kv MS: SIM neg.; frag. 140 V ic_applica_200605_d.ppt 41
42 IC/MS Anionen Perchlorat (Standard nach EPA) Metrosep A Supp Cl CO SO 4 2 ClO 4 ppb MS 1 MIC 2 + Agilent MSD 10 30/30 mmol/l / % NaOH/MeOH; 0.8 ml/min; m/z = 99 ESI: L/min; 30 psi g; 320 C; 1.5 kv MS: SIM neg.; frag. 140 V ic_applica_200605_d.ppt 42
43 IC/MS Anionen Perchlorat im Grundwasser von Houston Metrosep A Supp 5 0 ppb MS 1 1 ClO 4 ClO 4 (gespiked) MIC 2 + Agilent MSD 10 30/30 mmol/l / % NaOH/MeOH; 0.8 ml/min; m/z = 99 ESI: L/min; 30 psi g; 320 C; 1.5 kv MS: SIM neg.; frag. 140 V ic_applica_200605_d.ppt 43
44 IC/MS Anionen Perchlorat im Grundwasser von Houston mv CD MSD1 TIC, MS File (EPA_PA\ D) API-ES, Neg, SIM, Frag: 150 MSD1 99, EIC=98.7:99.7 (EPA_PA\ D) API-ES, Neg, SIM, Frag: 150 MSD1 1, EIC=0.7:1.7 (EPA_PA\ D) API-ES, Neg, SIM, Frag: 150 MSD1 5, EIC=4.7:5.7 (EPA_PA\ D) API-ES, Neg, SIM, Frag: 150 MSD1 7, EIC=6.7:7.7 (EPA_PA\ D) API-ES, Neg, SIM, Frag: 150 MS e t a r o l h c r e P ch min min MS mit internem Standard (5 & 7 m/z) ic_applica_200605_d.ppt 44
45 IC/MS Anionen Perchlorat (Standard) MS Kalibration ppb ic_applica_200605_d.ppt 45
46 IC/MS Anionen Phosphat Metrosep A Supp ppb CD 1 Chlorid Phosphat /1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; Düngemittel, Dialyse ic_applica_200605_d.ppt 46
47 IC/MS Anionen Phosphat Metrosep A Supp Chlorid 1 Phosphat ppb MS 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; Dialyse; m/z=79 ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 47
48 IC/MS Anionen Phosphat in Prozesswasser Metrosep A Supp ppb CD 1 Chlorid Phosphat Ölindustry 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; Dialyse ic_applica_200605_d.ppt 48
49 IC/MS Anionen Phosphat in Prozesswasser Metrosep A Supp ppb MS 1 Chlorid Phosphat Ölindustrie 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.7 ml/min; Dialyse; m/z 79 ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 49
50 IC/MS Nitrat in Sprengstoffen Wischtest Metrosep A Supp Nitrat ppm 11.6 MS Wischtest 3.2/1.0 mmol/l Na 2 CO 3 /NaHCO % ACN; 0.7 ml/min; m/z=62 ESI: L/min; 25 psi g; 300 C; 1.5 kv MS: SIM neg.; frag. 0 V ic_applica_200605_d.ppt 50
51 IC/MS Nitrat in Sprengstoffen Vergleich der Ergebnisse von Leitfähigkeits- und MS Detektion ic_applica_200605_d.ppt 51
52 IC/MS Organisch Säuren Standard Metrosep Organic Acids 0 1 Acetate 2 Propionate 3 Butyrate 4 Valeriate 5 Capronate 6 Enanthate 7 Octanate ppm CD 0.25 mmol/l Oxalsäure; 0.4 ml/min ic_applica_200605_d.ppt 52
53 IC/MS Organische Säuren Standard Metrosep Organic Acids Acetat Propionat Butyrat Valeriat Capronat Enanthat Octanat 0.25 mmol/l Oxalsäure; 0.4 ml/min; mit Ammoniumaddition; Standard ppm m/z MS ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 53
54 IC/MS Organische Säuren in Prozesswasser Metrosep Organic Acids - 1 Acetat 2 Propionat n.q. n.q. CD Ölindustrie 0.25 mmol/l Oxalsäure; 0.4 ml/min; Dialyse ic_applica_200605_d.ppt 54
55 IC/MS Organische Säuren in Prozesswasser Metrosep Organic Acids 0 1 Acetate Propionate Butyrate Valeriate Capronate 0.07 ppm MS Ölindustrie 0.25 mmol/l Oxalsäure; 0.4 ml/min; Dialys; mit Ammoniumaddition; m/z:59,73,87,1,115 ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM neg.; frag. 70 V ic_applica_200605_d.ppt 55
56 IC/MS Kationen Ethanolamine Metrosep C ppm CD MEA DEA TEA mmol/l Weinsäure; 0.5 ml/min ic_applica_200605_d.ppt 56
57 IC/MS Kationen Ethanolamine Metrosep C MEA 2 DEA 3 TEA m/z MS 4.0 mmol/l Weinsäure; 0.5 ml/min; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM pos.; frag. 70 V ic_applica_200605_d.ppt 57
58 IC/MS Kationen Methylamine Metrosep C MMA 2 DMA 3 TMA m/z MS 4.0 mmol/l Weinsäure; 0.5 ml/min; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM pos.; frag. 70 V ic_applica_200605_d.ppt 58
59 IC/MS Kationen biogene Amine Metrosep C Putrescin 2 Cadaverin 3 Histamin m/z MS 4.0 mmol/l Weinsäure; 0.5 ml/min; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM pos.; frag. 70 V ic_applica_200605_d.ppt 59
60 IC/MS Kohlenhydrate Standard Metrosep Organic Acid 250 m/z 1 Maltotriose Sucrose Glucose Fucose Xylose 171 MS 2.0 mmol/l Oxalsäure; 0.5 ml/min; Li-Suppression; ppm Standard ESI: 13 L/min; 60 psi g; 350 C; 3 kv MS: SIM pos.; frag. 70 V ic_applica_200605_d.ppt 60
61 Moderne Detektionstechniken in der Ionenchromatographie IC/ICP-MS ic_applica_200605_d.ppt 61
62 IC-ICP/MS «MIC-2 Advanced» plus Agilent 7500! Elementspeziation: Cr, As, Se, S! Analyse von organometallischen Verbindungen: Sn, As, Se, Sb,...! Analyse von Biomolekülen! Ultraspurenanalytik in starken Matrices z.b. Seewasser! Trennung von einzelnen organisch und anorganisch gebundenen Elementen ic_applica_200605_d.ppt 62
63 IC-ICP/MS Prinzip ICP torch Q-pole mass filter nebulizer & spray chamber turbo molecular pump turbo molecular pump gas controller RF power rotary pump rotary pump Ar gas system controller liquid chromatograph ChemStation ic_applica_200605_d.ppt 63
64 IC-ICP/MS Trennung von Chrom-Spezies Agilent: Cr Column G3268A ppb 1 2 Cr (III) Cr (VI) ICP/MS Reaktionsmodus mit H 2 5 mmol/l EDTA (ph 7); 1.2 ml/min; Derivatisierung mit (EDTA, 3 h, 40 C); m/z 52 ic_applica_200605_d.ppt 64
65 IC-ICP/MS Trennung von Arsen-Spezies Metrosep Anion Dual 3 1 As (III) 2 MMA 3 As (V) ppb ICP/MS Kollisionsmodus mit He 1.3/2.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.8 ml/min; m/z 75 ic_applica_200605_d.ppt 65
66 IC-ICP/MS Trennung der Selen-Spezies Metrosep Anion Dual 3 1 Se (IV) 2 Se (VI) ppb ICP/MS ohne Kollision + Reaktion 2.6/4.0 mmol/l Na 2 CO 3 /NaHCO 3 ; 0.8 ml/min; m/z 78 ic_applica_200605_d.ppt 66
67 Moderne Detektionstechniken in der Ionenchromatographie Zusammenfassung! sehr niedrige Nachweisgrenzen! präzise und reproduzierbare! matrixunabhängig! neue Applikationsbereiche! Informationsmaximierung! sehr flexibel! einfach zu bedienen! kosteneffizient ic_applica_200605_d.ppt 67
68 Moderne Detektionstechniken in der Ionenchromatographie Zusammenfassung! Vielen Dank für Ihre Aufmerksamkeit ic_applica_200605_d.ppt 68
Trace Analysis of Surfaces
 Trace Analysis of Surfaces Metall-Spurenanalyse auf Oberflächen mittels VPD- Verfahren Babett Viete-Wünsche 2 Das Unternehmen Unser Serviceportofolio Die VPD-Analyse 3 Das Unternehmen: 4 Einige unserer
Trace Analysis of Surfaces Metall-Spurenanalyse auf Oberflächen mittels VPD- Verfahren Babett Viete-Wünsche 2 Das Unternehmen Unser Serviceportofolio Die VPD-Analyse 3 Das Unternehmen: 4 Einige unserer
H Wasserstoff. O Sauerstoff
 He Helium Ordnungszahl 2 Atommasse 31,8 268,9 269,7 0,126 1,25 H Wasserstoff Ordnungszahl 1 Atommasse 14,1 252,7 259,2 2,1 7,14 1 3,45 1,38 Li Lithium Ordnungszahl 3 Atommasse 13,1 1330 180,5 1,0 0,53
He Helium Ordnungszahl 2 Atommasse 31,8 268,9 269,7 0,126 1,25 H Wasserstoff Ordnungszahl 1 Atommasse 14,1 252,7 259,2 2,1 7,14 1 3,45 1,38 Li Lithium Ordnungszahl 3 Atommasse 13,1 1330 180,5 1,0 0,53
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome. Chemische Reaktionen. Verbindungen
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
3. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 3. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 3. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen. Didaktikpool
 Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Chemische Bindung. Wie halten Atome zusammen? Welche Atome können sich verbinden? Febr 02
 Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
6. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
Periodensystem. Physik und Chemie. Sprachkompendium und einfache Regeln
 Periodensystem Physik und Chemie Sprachkompendium und einfache Regeln 1 Begriffe Das (neutrale) Wasserstoffatom kann völlig durchgerechnet werden. Alle anderen Atome nicht; ein dermaßen komplexes System
Periodensystem Physik und Chemie Sprachkompendium und einfache Regeln 1 Begriffe Das (neutrale) Wasserstoffatom kann völlig durchgerechnet werden. Alle anderen Atome nicht; ein dermaßen komplexes System
Unwanted. TRITON Error correction sheet ICP-OES V1.1 !!! !!!!!!!! TRITON GmbH Rather Broich Düsseldorf (Germany)
 Unwanted TRITON Error correction sheet ICP-OES V1.1 1 Unerwünschte Schwermetalle Quecksilber zu hoch 4x 15% wöchentlicher Wasserwechsel mit Hg Selen zu hoch 4x 15% wöchentlicher Wasserwechsel mit Se Cadmium
Unwanted TRITON Error correction sheet ICP-OES V1.1 1 Unerwünschte Schwermetalle Quecksilber zu hoch 4x 15% wöchentlicher Wasserwechsel mit Hg Selen zu hoch 4x 15% wöchentlicher Wasserwechsel mit Se Cadmium
Einführungskurs 7. Seminar
 ABERT-UDWIGS- UNIVERSITÄT FREIBURG Einführungskurs 7. Seminar Prof. Dr. Christoph Janiak iteratur: Riedel, Anorganische Chemie,. Aufl., 00 Kapitel.8.0 und Jander,Blasius, ehrb. d. analyt. u. präp. anorg.
ABERT-UDWIGS- UNIVERSITÄT FREIBURG Einführungskurs 7. Seminar Prof. Dr. Christoph Janiak iteratur: Riedel, Anorganische Chemie,. Aufl., 00 Kapitel.8.0 und Jander,Blasius, ehrb. d. analyt. u. präp. anorg.
5. Periodensystem der Elemente 5.1. Aufbauprinzip 5.2. Geschichte des Periodensystems 5.3. Ionisierungsenergie 5.4. Elektronenaffinität 5.5.
 5. Periodensystem der Elemente 5.1. Aufbauprinzip 5.2. Geschichte des Periodensystems 5.3. Ionisierungsenergie 5.4. Elektronenaffinität 5.5. Atomradien 5.6. Atomvolumina 5.7. Dichte der Elemente 5.8. Schmelzpunkte
5. Periodensystem der Elemente 5.1. Aufbauprinzip 5.2. Geschichte des Periodensystems 5.3. Ionisierungsenergie 5.4. Elektronenaffinität 5.5. Atomradien 5.6. Atomvolumina 5.7. Dichte der Elemente 5.8. Schmelzpunkte
Atombau, Periodensystem der Elemente
 Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 Voraussetzungen für die Freigabe
 BGBl. II - Ausgegeben am 22. Mai 2006 - Nr. 191 1 von 148 Anlage 1 zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 A. Allgemeines Voraussetzungen
BGBl. II - Ausgegeben am 22. Mai 2006 - Nr. 191 1 von 148 Anlage 1 zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 A. Allgemeines Voraussetzungen
Analysenservice FM-VEA-AS
 Analysenservice FM-VEA-AS Preisliste 2015 Analytik von Wasser, Abwasser, Böden, Schlämmen, Abfällen, Sonderproben Art der Leistung Probennahme nach Aufwand nach Aufwand Aufbereitung von Feststoffen Brechen
Analysenservice FM-VEA-AS Preisliste 2015 Analytik von Wasser, Abwasser, Böden, Schlämmen, Abfällen, Sonderproben Art der Leistung Probennahme nach Aufwand nach Aufwand Aufbereitung von Feststoffen Brechen
MO-Theorie: Molekülorbitale, Bindungsordnung, Molekülorbitaldiagramme von F 2, O 2, N 2, H 2 O, Benzol, Wasserstoffbrückenbindungen
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen VI Molkülorbitaltheorie II MO-Theorie: Molekülorbitale, Bindungsordnung, Molekülorbitaldiagramme von F 2, O 2, N 2, H 2 O, Benzol,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen VI Molkülorbitaltheorie II MO-Theorie: Molekülorbitale, Bindungsordnung, Molekülorbitaldiagramme von F 2, O 2, N 2, H 2 O, Benzol,
Wasser und Abwasser - Methoden und Preise
 Wasser und Abwasser - Methoden und Preise Inhalt Wasser GSchV / FIV / SLMB / EDI Allgemeine Parameter 1 Chlor-, Phosphor- und Stickstoffverbindungen 1 Elemente, gelöst oder nach Aufschluss 2 Programme
Wasser und Abwasser - Methoden und Preise Inhalt Wasser GSchV / FIV / SLMB / EDI Allgemeine Parameter 1 Chlor-, Phosphor- und Stickstoffverbindungen 1 Elemente, gelöst oder nach Aufschluss 2 Programme
7) Anwendungen radioaktiver Strahlung in Wissenschaft und Technik (1) Analytische Anwendungen (Radiometrische Titration)
 7) Anwendungen radioaktiver Strahlung in Wissenschaft und Technik (1) (Radiometrische Titration) Der radioaktive Stoff dient als Indikator Fällungsreaktionen Komplexbildungsreaktionen Prinzip einer Fällungstitration:
7) Anwendungen radioaktiver Strahlung in Wissenschaft und Technik (1) (Radiometrische Titration) Der radioaktive Stoff dient als Indikator Fällungsreaktionen Komplexbildungsreaktionen Prinzip einer Fällungstitration:
Strukturchemie. Kristallstrukturen. Elementstrukturen. Kugelpackungen. Kubisch dichte Kugelpackung. Lehramt 1a Sommersemester
 Kugelpackungen Kubisch dichte Kugelpackung Lehramt 1a Sommersemester 2010 1 Kugelpackungen: kubisch dichte Packung (kdp, ccp) C B A A C B A C B A C Lehramt 1a Sommersemester 2010 2 Kugelpackungen Atome
Kugelpackungen Kubisch dichte Kugelpackung Lehramt 1a Sommersemester 2010 1 Kugelpackungen: kubisch dichte Packung (kdp, ccp) C B A A C B A C B A C Lehramt 1a Sommersemester 2010 2 Kugelpackungen Atome
1.6. Die Ionenbindung
 1.6. Die Ionenbindung 1.6.1. Die Edelgasregel Die Edelgase gehen kaum Verbindungen ein und zeigen in ihrer Periode jeweils die höchsten Ionisierungsenergien. Ihre Elektronenkonfiguration mit jeweils Außenelektronen
1.6. Die Ionenbindung 1.6.1. Die Edelgasregel Die Edelgase gehen kaum Verbindungen ein und zeigen in ihrer Periode jeweils die höchsten Ionisierungsenergien. Ihre Elektronenkonfiguration mit jeweils Außenelektronen
Das Periodensystem der Elemente Das Periodensystem: Entdeckung der Elemente
 Das Periodensystem der Elemente Das Periodensystem: Entdeckung der Elemente 1 Das Periodensystem: Biologisch wichtige Elemente Das Periodensystem: Einteilung nach Reaktionen Bildung von Kationen und Anionen
Das Periodensystem der Elemente Das Periodensystem: Entdeckung der Elemente 1 Das Periodensystem: Biologisch wichtige Elemente Das Periodensystem: Einteilung nach Reaktionen Bildung von Kationen und Anionen
LEISTUNGSVERZEICHNIS 2015
 2 Anorganische chemische und physikalische Seite: 11 von 77 Stand: 31.01. LV_ 20010 Abdampfrückstand / Gesamttrockenrückstand DIN 38409 H1-1 DIN EN 12880 (S2) 20020 Abfiltrierbare Stoffe DIN 38409 H2 20030
2 Anorganische chemische und physikalische Seite: 11 von 77 Stand: 31.01. LV_ 20010 Abdampfrückstand / Gesamttrockenrückstand DIN 38409 H1-1 DIN EN 12880 (S2) 20020 Abfiltrierbare Stoffe DIN 38409 H2 20030
zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 Voraussetzungen für die Freigabe
 BGBl. II - Ausgegeben am 22. Mai 2006 - Nr. 191 1 von 148 Anlage 1 zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 A. Allgemees Voraussetzungen
BGBl. II - Ausgegeben am 22. Mai 2006 - Nr. 191 1 von 148 Anlage 1 zu 6 Abs. 1, 8 Abs. 1, 19 Abs. 1, 61 Abs. 1 und 4, 62 Abs. 6, 63 Abs. 3, 64 Abs. 1 sowie 79 Abs. 1 und 2 A. Allgemees Voraussetzungen
Chrom(VI)-Ersatz auf Zink
 Ulmer Gepräch 1 Chrom(VI)-Eratz auf Zink Nachbehandlungverfahren in der Praxi Dr. Rolf Janen und Patricia Preikchat,, D-64673 Zwingenberg Themen: l Wonach wird geucht? Eigenchaften echwertiger Paivierungen
Ulmer Gepräch 1 Chrom(VI)-Eratz auf Zink Nachbehandlungverfahren in der Praxi Dr. Rolf Janen und Patricia Preikchat,, D-64673 Zwingenberg Themen: l Wonach wird geucht? Eigenchaften echwertiger Paivierungen
Das Periodensystem der Elemente
 Das Periodensystem der Elemente 1 Das Periodensystem: Entdeckung der Elemente 2 Das Periodensystem: Biologisch wichtige Elemente 3 Das Periodensystem: Einteilung nach Reaktionen Bildung von Kationen und
Das Periodensystem der Elemente 1 Das Periodensystem: Entdeckung der Elemente 2 Das Periodensystem: Biologisch wichtige Elemente 3 Das Periodensystem: Einteilung nach Reaktionen Bildung von Kationen und
Periodensystem der Elemente
 Periodensystem der Elemente 1829: Döbereiner, Dreiergruppen von Elementen mit ähnlichen Eigenschaften & Zusammenhang bei Atomgewicht Gesetz der Triaden 1863: Newlands, Ordnung der Elemente nach steigender
Periodensystem der Elemente 1829: Döbereiner, Dreiergruppen von Elementen mit ähnlichen Eigenschaften & Zusammenhang bei Atomgewicht Gesetz der Triaden 1863: Newlands, Ordnung der Elemente nach steigender
Application Bulletin
 Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Typische Eigenschaften von Metallen
 Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
Emder Wasser Trinkwasser-Analysewerte
 Emder Wasser Trinkwasser-Analysewerte Die Lust auf Wasser hat viele Gesichter. An heißen Sommertagen träumen wir von einer erfrischenden Dusche und einem Glas Wasser gegen den Durst. Im Winter verwöhnt
Emder Wasser Trinkwasser-Analysewerte Die Lust auf Wasser hat viele Gesichter. An heißen Sommertagen träumen wir von einer erfrischenden Dusche und einem Glas Wasser gegen den Durst. Im Winter verwöhnt
Prüfbericht über Wasseruntersuchungen gemäß TrinkwV 2001
 Zweckverband Wassererversorgung und Abwasserbeseitigung Grimmen Grellenberger Straße 6 1857 Grimmen Tel. ( 38326 ) 63- / Fax ( 38326 ) 63-12 Zweckverband Wasserversorgung und Abwasserbeseitigung Grimmen
Zweckverband Wassererversorgung und Abwasserbeseitigung Grimmen Grellenberger Straße 6 1857 Grimmen Tel. ( 38326 ) 63- / Fax ( 38326 ) 63-12 Zweckverband Wasserversorgung und Abwasserbeseitigung Grimmen
Lösungen zu den Übungen zur Experimentalvorlesung AC
 Lösungen zu den Übungen zur Experimentalvorlesung AC 1. Stöchiometrisches Rechnen 1.1. n (S = mol n (S 8 = 0,5 mol 1.. n (P = 8 mol n (P = mol 1.3. m (P =,8 g m (P =,8 g m (P = 1, g 1.. m (1/3 As 3+ =
Lösungen zu den Übungen zur Experimentalvorlesung AC 1. Stöchiometrisches Rechnen 1.1. n (S = mol n (S 8 = 0,5 mol 1.. n (P = 8 mol n (P = mol 1.3. m (P =,8 g m (P =,8 g m (P = 1, g 1.. m (1/3 As 3+ =
Thema: Chemische Bindungen Wasserstoffbrückenbindungen
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen Wasserstoffbrückenbindungen Wasserstoffbrückenbindungen, polare H-X-Bindungen, Wasser, Eigenschaften des Wassers, andere Vbg. mit H-Brücken
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen Wasserstoffbrückenbindungen Wasserstoffbrückenbindungen, polare H-X-Bindungen, Wasser, Eigenschaften des Wassers, andere Vbg. mit H-Brücken
K L A U S U R D E C K B L A T T Name der Prüfung: Klausur Chemie für Chemieingenieure und Physiker
 K L A U S U R D E C K B L A T T Name der Prüfung: Klausur Chemie für Chemieingenieure und Physiker Datum und Uhrzeit: 09.04.2015 10:00 Institut: Theoretische Chemie Vom Prüfungsteilnehmer LESERLICH auszufüllen:
K L A U S U R D E C K B L A T T Name der Prüfung: Klausur Chemie für Chemieingenieure und Physiker Datum und Uhrzeit: 09.04.2015 10:00 Institut: Theoretische Chemie Vom Prüfungsteilnehmer LESERLICH auszufüllen:
Koordinationschemie der Übergangsmetalle
 Koordinationschemie der Übergangsmetalle adia C. Mösch-Zanetti Institut für Anorganische Chemie der Universität Göttingen Empfohlene Lehrbücher Anorganische Chemie 5. Aufl. S. 672-704 und Moderne Anorganische
Koordinationschemie der Übergangsmetalle adia C. Mösch-Zanetti Institut für Anorganische Chemie der Universität Göttingen Empfohlene Lehrbücher Anorganische Chemie 5. Aufl. S. 672-704 und Moderne Anorganische
IC Food Packs. Komplettpakete für die Lebensmittelanalytik. Gratis zu jedem IC Food Pack MagIC Net Software Ultrafiltration
 IC Food Packs Komplettpakete für die Lebensmittelanalytik Gratis zu jedem IC Food Pack MagIC Net Software Ultrafiltration 02 Mehr Leistung für Ihre Lebensmittelanalytik Die Ionenchromatographie (IC) ist
IC Food Packs Komplettpakete für die Lebensmittelanalytik Gratis zu jedem IC Food Pack MagIC Net Software Ultrafiltration 02 Mehr Leistung für Ihre Lebensmittelanalytik Die Ionenchromatographie (IC) ist
Nomenklatur einfacher anorganischer Verbindungen
 Nomenklatur einfacher anorganischer Verbindungen chemische Reaktion: Elemente verbinden sich in verschiedenen spezifischen Proportionen 2 H 2 + 2 > 2 H 2 Elementsymbol stöchiometrischer Koeffizient Atomverhältnis
Nomenklatur einfacher anorganischer Verbindungen chemische Reaktion: Elemente verbinden sich in verschiedenen spezifischen Proportionen 2 H 2 + 2 > 2 H 2 Elementsymbol stöchiometrischer Koeffizient Atomverhältnis
7 3= - 2 J G0(r) ~ a " I N dr
 Finally, for CH3C the collision frequency ratio 7mw was been determined from nonresonant microwave absorption 9. The comparison is given in Table 3. The agreement is reasonable, but far from 9 L. FRENKEL,
Finally, for CH3C the collision frequency ratio 7mw was been determined from nonresonant microwave absorption 9. The comparison is given in Table 3. The agreement is reasonable, but far from 9 L. FRENKEL,
Entsäuern und Entgiften mit Body Detox neueste wissenschaftliche Erkenntnisse
 Entsäuern und Entgiften mit Body Detox neueste wissenschaftliche Erkenntnisse Dr.Dr.med. Rainer Zierer Diplom Bio-Chemiker, Betriebsarzt und praktischer Arzt, München Physiko-chemische Schwermetallprovokation
Entsäuern und Entgiften mit Body Detox neueste wissenschaftliche Erkenntnisse Dr.Dr.med. Rainer Zierer Diplom Bio-Chemiker, Betriebsarzt und praktischer Arzt, München Physiko-chemische Schwermetallprovokation
Prüfbericht. Untersuchungsergebnisse der Parameter nach TrinkwV. Anlage 1-4, vom Gladenbach-Rachelshausen
 Betreiber : Messstellen- (HLfU) : 7101 Probenart : U-13 U13 Untersuchungs- (Labor) : B141770/CH140527 TrinkwV. Anlage 1, Teil I Parameter Einheit Prüfergebnis GW 1) BG 2) Verfahren 2. Enterokokken KBE/100ml
Betreiber : Messstellen- (HLfU) : 7101 Probenart : U-13 U13 Untersuchungs- (Labor) : B141770/CH140527 TrinkwV. Anlage 1, Teil I Parameter Einheit Prüfergebnis GW 1) BG 2) Verfahren 2. Enterokokken KBE/100ml
Aluminium. Eisen. Gold. Lithium. Platin. Neodym
 Fe Eisen Al Aluminium Li Lithium Au Gold Pt Platin Nd Neodym Zn Zink Sn Zinn Ni Nickel Cr Chrom Mo Molybdän V Vanadium Co Cobalt In Indium Ta Tantal Mg Magnesium Ti Titan Os Osmium Pb Blei Ag Silber
Fe Eisen Al Aluminium Li Lithium Au Gold Pt Platin Nd Neodym Zn Zink Sn Zinn Ni Nickel Cr Chrom Mo Molybdän V Vanadium Co Cobalt In Indium Ta Tantal Mg Magnesium Ti Titan Os Osmium Pb Blei Ag Silber
Wasseranalyse - Prüfbericht
 101 Ww.Ausgang H Grenzwert 1,2-Dichlorethan < 0,000100 0,003000 mg/l DIN EN ISO 10301 (F4) 2,6-Dichlorbenzamid < 0,000030 0,003000 mg/l DIN EN ISO 11369 (F12) Aluminium (Al), gesamt < 0,0050 0,2000 mg/l
101 Ww.Ausgang H Grenzwert 1,2-Dichlorethan < 0,000100 0,003000 mg/l DIN EN ISO 10301 (F4) 2,6-Dichlorbenzamid < 0,000030 0,003000 mg/l DIN EN ISO 11369 (F12) Aluminium (Al), gesamt < 0,0050 0,2000 mg/l
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Wasserstoff. Helium. Bor. Kohlenstoff. Standort: Name: Ordnungszahl: Standort: Name: Ordnungszahl: 18. Gruppe. Standort: Ordnungszahl: Name:
 H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
Formeln & Namen. Will man ein Kapitel nicht bearbeiten, kann man dessen Aufgabenzahl auf '0' setzen.
 Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Lösungsvorschlag 7: Grundlagen ICP-MS
 Lösungsvorschlag 7: Grundlagen ICP-MS 1. Was ist ein Plasma? Ein Plasma ist der sogenannte. Zustand der Materie, ein angeregtes, teilweise ionisiertes und nach Aussen neutrales Gas. In ihm liegen sowohl
Lösungsvorschlag 7: Grundlagen ICP-MS 1. Was ist ein Plasma? Ein Plasma ist der sogenannte. Zustand der Materie, ein angeregtes, teilweise ionisiertes und nach Aussen neutrales Gas. In ihm liegen sowohl
Reagenzien für Photometer
 Reagenzien für Photometer SERIE HI 937(00)-(00) Artikel : Reagenzien für Photometer, Cyanursäure (100 Tests) HI 93722-01 Parameter : Cyanursäure - Reagenzien für Photometer, Cyanursäure (300 Tests) HI
Reagenzien für Photometer SERIE HI 937(00)-(00) Artikel : Reagenzien für Photometer, Cyanursäure (100 Tests) HI 93722-01 Parameter : Cyanursäure - Reagenzien für Photometer, Cyanursäure (300 Tests) HI
Rohstoffe für die Energiewende Verfügbarkeit knapper Ressourcen und der Beitrag des Recyclings
 Rohstoffe für die Energiewende Verfügbarkeit knapper Ressourcen und der Beitrag des Recyclings Prof. Dr.-Ing. Daniel Goldmann IFAD Rohstoffaufbereitung und Recycling TU Clausthal Veränderungen in Rohstoffauswahl
Rohstoffe für die Energiewende Verfügbarkeit knapper Ressourcen und der Beitrag des Recyclings Prof. Dr.-Ing. Daniel Goldmann IFAD Rohstoffaufbereitung und Recycling TU Clausthal Veränderungen in Rohstoffauswahl
THEORIE UND PRAKTISCHE ANWENDUNG VON KOMPLEXBILDNERN
 THEORIE UND PRAKTISCHE ANWENDUNG VON KOMPLEXBILDNERN VON DR. FRITZ UMLAND PROFESSOR FÜR ANORGANISCH-ANALYTISCHE CHEMIE AN DER UNIVERSITÄT MÜNSTER DR. ANTON JANSSEN UNIVERSITÄT MÜNSTER DR. DETLEF THIERIG
THEORIE UND PRAKTISCHE ANWENDUNG VON KOMPLEXBILDNERN VON DR. FRITZ UMLAND PROFESSOR FÜR ANORGANISCH-ANALYTISCHE CHEMIE AN DER UNIVERSITÄT MÜNSTER DR. ANTON JANSSEN UNIVERSITÄT MÜNSTER DR. DETLEF THIERIG
Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord
 Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord Anorganische Spurenelemente Aluminium mg/l 0,2 nicht nachweisbar 0,01 Antimon mg/l 0,005 nicht nachweisbar 0,001 Arsen mg/l 0,01 nicht nachweisbar
Analyse 2015 für das Trinkwasser aus dem Wasserwerk Nord Anorganische Spurenelemente Aluminium mg/l 0,2 nicht nachweisbar 0,01 Antimon mg/l 0,005 nicht nachweisbar 0,001 Arsen mg/l 0,01 nicht nachweisbar
Workshop Ionenchromatographie: isokratisch oder Gradient?
 Workshop Ionenchromatographie: isokratisch oder Gradient? IC/LC Support Team Thermo Fisher Scientific, Dreieich The world leader in serving science Thermo Scientific Dionex Ionenchromatographie-Systeme
Workshop Ionenchromatographie: isokratisch oder Gradient? IC/LC Support Team Thermo Fisher Scientific, Dreieich The world leader in serving science Thermo Scientific Dionex Ionenchromatographie-Systeme
Chemische-technische hygienische Parameter
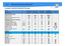 Chemische-technische hygienische Parameter Datum 13.04.2016 15.09.2016 12.04.2017 14.09.2017 Sensorische Prüfungen Färbung (vor Ort) farblos farblos farblos farblos Geruch (vor Ort) ohne ohne ohne ohne
Chemische-technische hygienische Parameter Datum 13.04.2016 15.09.2016 12.04.2017 14.09.2017 Sensorische Prüfungen Färbung (vor Ort) farblos farblos farblos farblos Geruch (vor Ort) ohne ohne ohne ohne
Prüfbericht für Probe:
 2017103940 Rosenheim, Hochbehälter Kreut, Kammer 2 1230018700555 10:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 2001, Anl. 5 I d) bb) bbb) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV
2017103940 Rosenheim, Hochbehälter Kreut, Kammer 2 1230018700555 10:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 2001, Anl. 5 I d) bb) bbb) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV
PRÜFBERICHT 925043-675912
 Tel.: +49 (843) 79, Fax: +49 (843) 724 [@ANALYNR_START=67592] [@BARCODE= R] Dr.Blasy-Dr.Busse Moosstr. 6A, 82279 Eching ZV ZUR WASSERVERSORGUNG ACHENGRUPPE Herr Jürs RATHAUSPLATZ 8 8347 KIRCHANSCHÖRING
Tel.: +49 (843) 79, Fax: +49 (843) 724 [@ANALYNR_START=67592] [@BARCODE= R] Dr.Blasy-Dr.Busse Moosstr. 6A, 82279 Eching ZV ZUR WASSERVERSORGUNG ACHENGRUPPE Herr Jürs RATHAUSPLATZ 8 8347 KIRCHANSCHÖRING
Wie kommen Metalle vor? CaO, MgO, Al 2 O 3, CaCO 3, CaSO 4 vs. Cu 2 S, HgS, PbS. Welche Kombinationen führen zu hohen Oxidationsstufen?
 HSAB-Prinzip Wie kommen Metalle vor? CaO, MgO, Al 2 O 3, CaCO 3, CaSO 4 vs. Cu 2 S, HgS, PbS Welche Kombinationen führen zu hohen Oxidationsstufen? XeO 6 4, ClO 4, MnO 4, MnS 4, ClS 4 Warum entsteht der
HSAB-Prinzip Wie kommen Metalle vor? CaO, MgO, Al 2 O 3, CaCO 3, CaSO 4 vs. Cu 2 S, HgS, PbS Welche Kombinationen führen zu hohen Oxidationsstufen? XeO 6 4, ClO 4, MnO 4, MnS 4, ClS 4 Warum entsteht der
Christine Peetz (OStRin B/C) Seite 1
 Ist Wasser ein DipolMolekül? Mit einem einfachen kann man untersuchen, ob eine Flüssigkeit ein Dipol ist. Es liegen nachfolgende Flüssigkeiten vor. Definition: Moleküle, bei denen die positiven und negativen
Ist Wasser ein DipolMolekül? Mit einem einfachen kann man untersuchen, ob eine Flüssigkeit ein Dipol ist. Es liegen nachfolgende Flüssigkeiten vor. Definition: Moleküle, bei denen die positiven und negativen
Mangangruppe: Elemente der siebten Nebengruppe
 Hermann Sicius Mangangruppe: Elemente der siebten Nebengruppe Eine Reise durch das Periodensystem essentials essentials liefern aktuelles Wissen in konzentrierter Form. Die Essenz dessen, worauf es als
Hermann Sicius Mangangruppe: Elemente der siebten Nebengruppe Eine Reise durch das Periodensystem essentials essentials liefern aktuelles Wissen in konzentrierter Form. Die Essenz dessen, worauf es als
Anlage zur Akkreditierungsurkunde D-PL nach DIN EN ISO/IEC 17025:2005
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-18317-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 31.01.2018 bis 30.01.2023 Ausstellungsdatum: 31.01.2018 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-18317-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 31.01.2018 bis 30.01.2023 Ausstellungsdatum: 31.01.2018 Urkundeninhaber:
PC III Aufbau der Materie
 07.07.2015 PC III Aufbau der Materie (1) 1 PC III Aufbau der Materie Kapitel 5 Das Periodensystem der Elemente Vorlesung: http://www.pci.tu-bs.de/aggericke/pc3 Übung: http://www.pci.tu-bs.de/aggericke/pc3/uebungen
07.07.2015 PC III Aufbau der Materie (1) 1 PC III Aufbau der Materie Kapitel 5 Das Periodensystem der Elemente Vorlesung: http://www.pci.tu-bs.de/aggericke/pc3 Übung: http://www.pci.tu-bs.de/aggericke/pc3/uebungen
Trennungsgang. AC-I Seminar, B.
 Trennungsgang http://illumina-chemie.de/mangan-chrom-t2100.html www.chemgapedia.de, www.chemische-experimente.com 1 Trennungsgang auf einen Blick Trennungsgang Reaktionen in wässriger Lösung Fällung und
Trennungsgang http://illumina-chemie.de/mangan-chrom-t2100.html www.chemgapedia.de, www.chemische-experimente.com 1 Trennungsgang auf einen Blick Trennungsgang Reaktionen in wässriger Lösung Fällung und
IC Bestimmung über 6 Grössenordnungen
 Automatische IC Bestimmungen über 6 Grössenordnungen Dr. Andrea Wille Manager Competence Center IC Metrohm International Headquarters 1 Stellen sie sich einen IC vor, der sich automatisch mit nur einem
Automatische IC Bestimmungen über 6 Grössenordnungen Dr. Andrea Wille Manager Competence Center IC Metrohm International Headquarters 1 Stellen sie sich einen IC vor, der sich automatisch mit nur einem
Periodensystem der Elemente (PSE) Z = Ordnungszahl, von 1 bis 112 (hier)
 1 1.0079 H 3 Li 6.941 19 39.098 K 23 50.942 V 27 58.933 Co 73 180.95 Ta 78 195.08 Pt 82 207.2 Pb 21 44.956 Sc 25 54.938 Mn 29 63.546 Cu 33 74.922 As 7 14.007 N 75 186.21 Re 80 200.59 Hg 84 208.98 Po* 55
1 1.0079 H 3 Li 6.941 19 39.098 K 23 50.942 V 27 58.933 Co 73 180.95 Ta 78 195.08 Pt 82 207.2 Pb 21 44.956 Sc 25 54.938 Mn 29 63.546 Cu 33 74.922 As 7 14.007 N 75 186.21 Re 80 200.59 Hg 84 208.98 Po* 55
Application Bulletin
 Nr. 260/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 7, 8, 9, 11, 12, 13, 16 IC-Glaskartusche Metrosep Anion Dual 1 (6.1006.020) für die Bestimmung von
Nr. 260/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 7, 8, 9, 11, 12, 13, 16 IC-Glaskartusche Metrosep Anion Dual 1 (6.1006.020) für die Bestimmung von
Wasserchemie Modul 4
 Wasserchemie Modul 4 Ionenchromatographie / HPLC Plausibilitätstests tstests Ionensensitive Elektroden Chromatographie Trennung von Stoffgemischen Zwei nicht mischbare Phasen - stationäre Phase (Ionentauscher)
Wasserchemie Modul 4 Ionenchromatographie / HPLC Plausibilitätstests tstests Ionensensitive Elektroden Chromatographie Trennung von Stoffgemischen Zwei nicht mischbare Phasen - stationäre Phase (Ionentauscher)
Zeichnen von Valenzstrichformeln
 Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s 2 3p 6. Geben Sie isoelektronische Ionen zu den folgenden Atomen an
 Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
BUNDESANSTALT FÜR MATERIALFORSCHUNG UND -PRÜFUNG (BAM) VEREIN DEUTSCHER EISENHÜTTENLEUTE (VDEh)
 BUNDESANSTALT FÜR MATERIALFORSCHUNG UND -PRÜFUNG (BAM) VEREIN DEUTSCHER EISENHÜTTENLEUTE (VDEh) Arbeitskreis"Primärsubstanzen zur Kalibrierung" Zertifiziertes Referenzmaterial Reinstoff Nr. Calciumcarbonat
BUNDESANSTALT FÜR MATERIALFORSCHUNG UND -PRÜFUNG (BAM) VEREIN DEUTSCHER EISENHÜTTENLEUTE (VDEh) Arbeitskreis"Primärsubstanzen zur Kalibrierung" Zertifiziertes Referenzmaterial Reinstoff Nr. Calciumcarbonat
Anordnung der Elemente nach aufsteigender Atommasse, Gesetz der Periodizität (Lothar Meyer, Dmitri Mendelejew, 1869)
 1.2 Periodensystem der Elemente Anordnung der Elemente nach aufsteigender Atommasse, Gesetz der Periodizität (Lothar Meyer, Dmitri Mendelejew, 1869) Periode I a b 1 H 1,0 2 Li 6,9 3 Na 23,0 4 5 6 K 39,1
1.2 Periodensystem der Elemente Anordnung der Elemente nach aufsteigender Atommasse, Gesetz der Periodizität (Lothar Meyer, Dmitri Mendelejew, 1869) Periode I a b 1 H 1,0 2 Li 6,9 3 Na 23,0 4 5 6 K 39,1
festem Boden ab steckte den Strom an und begab mich samt Hund auf einem Erkundungstrip.
 Nachdem mir mein Arzt einige Behandlungen verordnet hat die in Wien recht kostspielig sind deren Wirkung für mich zukunftsmäßig gesehen fraglich erschienen, ein Kuraufenthalt in Österreich von der Kassa
Nachdem mir mein Arzt einige Behandlungen verordnet hat die in Wien recht kostspielig sind deren Wirkung für mich zukunftsmäßig gesehen fraglich erschienen, ein Kuraufenthalt in Österreich von der Kassa
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Chemische und Mikrobiologische Untersuchung von mittels YVE-310-Filterkanne aufbereitetem Leitungswasser
 REPORT Chemische und Mikrobiologische Untersuchung von mittels YVE-310-Filterkanne aufbereitetem Leitungswasser DI Otmar Plank Verteiler: 1-3 Fa. YVE & BIO GmbH, Bremen 4 Otmar Plank 5 HET August 2014
REPORT Chemische und Mikrobiologische Untersuchung von mittels YVE-310-Filterkanne aufbereitetem Leitungswasser DI Otmar Plank Verteiler: 1-3 Fa. YVE & BIO GmbH, Bremen 4 Otmar Plank 5 HET August 2014
Möglichkeiten und Grenzen der Ionenchromatographie (IC) in der Weinanalytik
 Möglichkeiten und Grenzen der (IC) in der Weinanalytik Anwendertreffen Weinanalytik 2012 Horst Rudy DLR Mosel Wir wollten bestimmen. - Organische Säuren - Mineralstoffe (Na, K, Ca, Mg) - biogene Amine
Möglichkeiten und Grenzen der (IC) in der Weinanalytik Anwendertreffen Weinanalytik 2012 Horst Rudy DLR Mosel Wir wollten bestimmen. - Organische Säuren - Mineralstoffe (Na, K, Ca, Mg) - biogene Amine
Umwelthygiene Marburg GmbH & Co KG
 1305431 Umwelthygiene Marburg GmbH & Co KG Rudolf Breitscheidstr. 24, D35037 Marburg Umwelthygiene Marburg GmbH & Co KG Staatlich anerkannte Untersuchungsstelle nach 15 Abs. 4 Amtsgericht Marburg: HRB
1305431 Umwelthygiene Marburg GmbH & Co KG Rudolf Breitscheidstr. 24, D35037 Marburg Umwelthygiene Marburg GmbH & Co KG Staatlich anerkannte Untersuchungsstelle nach 15 Abs. 4 Amtsgericht Marburg: HRB
Application Bulletin
 Nr. 257/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Säule Metrosep Cation 1-2 (6.1010.000) für die Bestimmung von Alkali- und Erdalkalimetallen
Nr. 257/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Säule Metrosep Cation 1-2 (6.1010.000) für die Bestimmung von Alkali- und Erdalkalimetallen
5. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 5. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 5. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
Ausführung potentiometrischer Analysen
 Ausführung potentiometrischer Analysen nebst vollständigen Analysenvorschriften für technische Produkte Von Dr. Werner Hiltner Breslau Einleitung 1 Allgemeiner Teil. A. Grundlagen der potentiometrischen
Ausführung potentiometrischer Analysen nebst vollständigen Analysenvorschriften für technische Produkte Von Dr. Werner Hiltner Breslau Einleitung 1 Allgemeiner Teil. A. Grundlagen der potentiometrischen
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Homöostase der Mineralstoffe
 Mineralstoffversorgung auf dem Milchviehbetrieb Vetsuisse-Fakultät Zürich 24. November 2015 Homöostase der Mineralstoffe Maren Feldmann Klinik für Rinder Tierärztliche Hochschule Hannover Rindergesundheitsdienst
Mineralstoffversorgung auf dem Milchviehbetrieb Vetsuisse-Fakultät Zürich 24. November 2015 Homöostase der Mineralstoffe Maren Feldmann Klinik für Rinder Tierärztliche Hochschule Hannover Rindergesundheitsdienst
Einzelionennachweise des H2S-Trennungsgangs. Natrium Na + Kalium K + Ammonium NH4 + Blei Pb 2+ (für die Laborprüfung , LBT) Stand: 23.9.
 Einzelionennachweise des H2S-Trennungsgangs (für die Laborprüfung 771105, LBT) Stand: 23.9.2011 Natrium Na + gelbe Flammfärbung Kalium K + 1. mit Perchlorsäure im sauren Auszug der Urprobe: K + + ClO -
Einzelionennachweise des H2S-Trennungsgangs (für die Laborprüfung 771105, LBT) Stand: 23.9.2011 Natrium Na + gelbe Flammfärbung Kalium K + 1. mit Perchlorsäure im sauren Auszug der Urprobe: K + + ClO -
NADUF: Methoden der chemischen Analysen (EAWAG) Parameter Jahr Methode Prinzip Bestimmungsgrenze Angewandte Methode korrespondiert mit
 Gesamthärte (Ca 2+ + Mg 2+) bis 1974 Manuelle Nach Alkalinitätsbest. mit Komplexon III (0.05 M) bei ph 10 (Ammoniak-Puffer) und visuelle Endpunktsanzeige 0.05 mmol/l ISO 6059:1984 1975-1976 Autom. 1977-2006
Gesamthärte (Ca 2+ + Mg 2+) bis 1974 Manuelle Nach Alkalinitätsbest. mit Komplexon III (0.05 M) bei ph 10 (Ammoniak-Puffer) und visuelle Endpunktsanzeige 0.05 mmol/l ISO 6059:1984 1975-1976 Autom. 1977-2006
Kalibrier-,Kontroll- und Prüflösungen fü
 Kalibrier-,Kontroll- und Prüflösungen fü Eichlösungen- Prüflösungen für die Photometrie, ISE und Kalibrierlösungenfür Überwachungsautomaten im Klärwerksbereich Ammonium N(NH4) Kalibrierlösung Ammonium
Kalibrier-,Kontroll- und Prüflösungen fü Eichlösungen- Prüflösungen für die Photometrie, ISE und Kalibrierlösungenfür Überwachungsautomaten im Klärwerksbereich Ammonium N(NH4) Kalibrierlösung Ammonium
Lösungsbeispiel Oberflächenspannung. Schwimmende Büroklammer
 Lösungsbeispiel Oberflächenspannung Schwimmende Büroklammer Svens Klasse geht einmal im Monat in ein Schülerlabor, um Versuche zu Themen durchzuführen, die im Unterricht theoretisch behandelt wurden. Im
Lösungsbeispiel Oberflächenspannung Schwimmende Büroklammer Svens Klasse geht einmal im Monat in ein Schülerlabor, um Versuche zu Themen durchzuführen, die im Unterricht theoretisch behandelt wurden. Im
Orbitale, 4 Quantenzahlen, Hauptquantenzahl, Nebenquantenzahl, magnetische Quantenzahl, Spinquantenzahl
 Wiederholung der letzten Vorlesungsstunde: Das (wellen-)quantenchemische Atommodell Orbitalmodell Orbitale, 4 Quantenzahlen, Hauptquantenzahl, Nebenquantenzahl, magnetische Quantenzahl, Spinquantenzahl
Wiederholung der letzten Vorlesungsstunde: Das (wellen-)quantenchemische Atommodell Orbitalmodell Orbitale, 4 Quantenzahlen, Hauptquantenzahl, Nebenquantenzahl, magnetische Quantenzahl, Spinquantenzahl
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome. Chemische Reaktionen. Verbindungen
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 284 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 284 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Sehr geehrter Auftraggeber, anbei erhalten Sie den Prüfbericht zu den Proben: Probenummer Entnahmestelle Probenahme
 / S-NA-LB, Wasserversorgung weber@sw-ba.de Besucheranschrift S-NA-LB Gebäude G (Labor) Emmy-Noether-Str. 2 Techn. Leiter: Hr. Dr. Hofmann Ansprechpartner: Hr. Bader Telefon / -Fax 089 / 2361-3474/ -3453
/ S-NA-LB, Wasserversorgung weber@sw-ba.de Besucheranschrift S-NA-LB Gebäude G (Labor) Emmy-Noether-Str. 2 Techn. Leiter: Hr. Dr. Hofmann Ansprechpartner: Hr. Bader Telefon / -Fax 089 / 2361-3474/ -3453
Quarkorbitale und Quark Orbital Kombinationen
 Naturwissenschaft Clemens Wett Quarkorbitale und Quark Orbital Kombinationen Quantenalgebra der Isotopen Tabelle Wissenschaftliche Studie Quark Orbitale und Quark Orbital Kombinationen Verwendete Literatur
Naturwissenschaft Clemens Wett Quarkorbitale und Quark Orbital Kombinationen Quantenalgebra der Isotopen Tabelle Wissenschaftliche Studie Quark Orbitale und Quark Orbital Kombinationen Verwendete Literatur
Akkreditierungsumfang der Prüfstelle (EN ISO/IEC 17025:2005) K+U Umwelttechnik, Labor und Hydrologie GmbH / (Ident.Nr.: 0323)
 1 2 3 4 5 6 BGBl. II 304/2001 DIN 38402-11 DIN 38402-12 DIN 38402-13 DIN 38402-15 DIN 38402-19 2001-08 Verordnung des Bundesministers für soziale Sicherheit und Generationen über die Qualität von Wasser
1 2 3 4 5 6 BGBl. II 304/2001 DIN 38402-11 DIN 38402-12 DIN 38402-13 DIN 38402-15 DIN 38402-19 2001-08 Verordnung des Bundesministers für soziale Sicherheit und Generationen über die Qualität von Wasser
Anlage zur Akkreditierungsurkunde D-PL nach DIN EN ISO/IEC 17025:2005
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-14595-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 14.10.2016 bis 13.10.2021 Ausstellungsdatum: 14.10.2016 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-14595-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 14.10.2016 bis 13.10.2021 Ausstellungsdatum: 14.10.2016 Urkundeninhaber:
LEISTUNGSVERZEICHNIS 2017
 2017 7 Bodenluft Altlasten Deponien Seite: 43 von 71 Stand: 29.03.2017 LV_2017 70010 Bundesbodenschutzverordnung Anhang 2 Abschnitt 1.2 Maßnahmewerte Pfad Boden Mensch Dioxine, Furane (PCDD, PCDF) (Einzelbestimmung)
2017 7 Bodenluft Altlasten Deponien Seite: 43 von 71 Stand: 29.03.2017 LV_2017 70010 Bundesbodenschutzverordnung Anhang 2 Abschnitt 1.2 Maßnahmewerte Pfad Boden Mensch Dioxine, Furane (PCDD, PCDF) (Einzelbestimmung)
Text Anhang 1. Grenzwerte für die Annahme von Abfällen
 Kurztitel Deponieverordnung 2008 Kundmachungsorgan BGBl. II Nr. 39/2008 zuletzt geändert durch BGBl. II Nr. 104/2014 /Artikel/Anlage Anl. 1 Inkrafttretensdatum 01.06.2014 Text Anhang 1 Allgemeines e für
Kurztitel Deponieverordnung 2008 Kundmachungsorgan BGBl. II Nr. 39/2008 zuletzt geändert durch BGBl. II Nr. 104/2014 /Artikel/Anlage Anl. 1 Inkrafttretensdatum 01.06.2014 Text Anhang 1 Allgemeines e für
Vorlesung Allgemeine Chemie: Chemische Bindung
 Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Kleine Formelsammlung Chemie
 Karl Schwister Kleine Forelsalung Cheie ISBN-1: 3-446-41545-9 ISBN-13: 978-3-446-41545-4 Leseprobe Weitere Inforationen oder Bestellungen unter http://www.hanser.de/978-3-446-41545-4 sowie i Buchhandel.
Karl Schwister Kleine Forelsalung Cheie ISBN-1: 3-446-41545-9 ISBN-13: 978-3-446-41545-4 Leseprobe Weitere Inforationen oder Bestellungen unter http://www.hanser.de/978-3-446-41545-4 sowie i Buchhandel.
Grenzwerte für die Annahme von Abfällen
 BGBl. II - Ausgegeben am 30. Jänner 2008 - Nr. 39 1 von 11 Allgemeines e für die Annahme von Abfällen Anhang 1 Für die Untersuchung und Beurteilung, ob die e gegebenenfalls nach Maßgabe des 8 eingehalten
BGBl. II - Ausgegeben am 30. Jänner 2008 - Nr. 39 1 von 11 Allgemeines e für die Annahme von Abfällen Anhang 1 Für die Untersuchung und Beurteilung, ob die e gegebenenfalls nach Maßgabe des 8 eingehalten
Ammonium Gasdiffusion / ph-indikator DIN EN ISO (Ammoniak)
 FIA Methodenliste Stand: 24.03.2016 Gesamt- Brenzcatechinviolett APHA 3500 Al modifiziert Aluminium 0,01 mg/l 0,05... 0,5 mg/l Al-T Wasser / Abwasser 0,2... 2 mg/l Al-T Ammonium Gasdiffusion / ph-indikator
FIA Methodenliste Stand: 24.03.2016 Gesamt- Brenzcatechinviolett APHA 3500 Al modifiziert Aluminium 0,01 mg/l 0,05... 0,5 mg/l Al-T Wasser / Abwasser 0,2... 2 mg/l Al-T Ammonium Gasdiffusion / ph-indikator
ANIONENNACHWEISE Vorlesung analytische Chemie SS 2010
 ANIONENNACHWEISE Vorlesung analytische Chemie SS 2010 Übersicht Allgemeines zu Nachweisen Anionentrennungsgang Ausgewählte Einzelnachweise Grenzkonzentration Grenzkonzentration (GK, D): die Konzentration,
ANIONENNACHWEISE Vorlesung analytische Chemie SS 2010 Übersicht Allgemeines zu Nachweisen Anionentrennungsgang Ausgewählte Einzelnachweise Grenzkonzentration Grenzkonzentration (GK, D): die Konzentration,
Trinkwasseranalyse Versorgungsgebiet Kernbereich Friedrichsdorf
 Seite 1 von 3 Stadtwerke Friedrichsdorf Färberstraße 13-15 Trinkwasseranalyse Versorgungsgebiet Kernbereich Friedrichsdorf Ergebnisse der Trinkwasseranalysen 2014 und 2015 vom Institut Fresenius, Taunusstein
Seite 1 von 3 Stadtwerke Friedrichsdorf Färberstraße 13-15 Trinkwasseranalyse Versorgungsgebiet Kernbereich Friedrichsdorf Ergebnisse der Trinkwasseranalysen 2014 und 2015 vom Institut Fresenius, Taunusstein
Entwurf 6.August Jänner Anhang 1 Grenzwerte für die Annahme von Abfällen auf Deponien
 Entwurf 6.August 2007 9.Jänner 2007 Anhang 1 e für die Annahme von Abfällen auf Deponien Allgemeines Für die Untersuchung und Beurteilung, ob die e eingehalten werden, sind der Anhang 4 und gegebenenfalls
Entwurf 6.August 2007 9.Jänner 2007 Anhang 1 e für die Annahme von Abfällen auf Deponien Allgemeines Für die Untersuchung und Beurteilung, ob die e eingehalten werden, sind der Anhang 4 und gegebenenfalls
Trinkwasserbeschaffenheit 2015 zu den Entnahmestellen - Trinkwasser - des Auftraggebers Stadtwerke Schnaudertal - Eigenbetrieb der Stadt Meuselwitz
 colif. Keime E.-coli bakteriologische Untersuchungsparameter Entero kokken Kolonie zahl 22 C organoleptische und andere hygienisch relevante Kolonie zahl 36 C Trübung Färbung Geruch/ Geschmack Geruch (TON)
colif. Keime E.-coli bakteriologische Untersuchungsparameter Entero kokken Kolonie zahl 22 C organoleptische und andere hygienisch relevante Kolonie zahl 36 C Trübung Färbung Geruch/ Geschmack Geruch (TON)
Vorlesung Allgemeine Chemie: Chemische Bindung
 Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
EINFÜHRUNG IN DIE QUALITATIVE CHEMISCHE ANALYSE
 EINFÜHRUNG IN DIE QUALITATIVE CHEMISCHE ANALYSE VON PROFESSOR DR. R. FRESENIUS UND DR. PHIL. HABIL. A. GEHRING UNTER MITARBEIT VON DIPL.-CHEM. O. FUCHS UND MARIANNE VULPIUS 3. VERBESSERTE AUFLAGE MIT 5
EINFÜHRUNG IN DIE QUALITATIVE CHEMISCHE ANALYSE VON PROFESSOR DR. R. FRESENIUS UND DR. PHIL. HABIL. A. GEHRING UNTER MITARBEIT VON DIPL.-CHEM. O. FUCHS UND MARIANNE VULPIUS 3. VERBESSERTE AUFLAGE MIT 5
Redoxreaktionen. Elektrochemische Spannungsreihe
 Elektrochemische Spannungsreihe Eine galvanische Zelle bestehend aus einer Normal-Wasserstoffelektrode und einer anderen Halbzelle erzeugen eine Spannung, die, in 1-molarer Lösung gemessen, als Normal-
Elektrochemische Spannungsreihe Eine galvanische Zelle bestehend aus einer Normal-Wasserstoffelektrode und einer anderen Halbzelle erzeugen eine Spannung, die, in 1-molarer Lösung gemessen, als Normal-
