Was gab es Neues auf dem Arzneimittelmarkt 2016
|
|
|
- Jutta Kurzmann
- vor 6 Jahren
- Abrufe
Transkript
1 11. Jahrgang, 2. Ausgabe 2017, Rubrik Neue Arzneimittel Was gab es Neues auf dem Arzneimittelmarkt 2016 Teil 4: Seltene Erkrankungen Teil 2 Erythropoietische Protoporphyrie Fabry-Krankheit Pro-Opiomelanocortin pharmakologische Chaperone Afamelanotid Migalastat
2 57 Was gab es Neues auf dem Arzneimittelmarkt 2016 Seltene Erkrankungen Teil 2 Prof. Dr. Georg Kojda Fachpharmakologe DGPT, Fachapotheker für Arzneimittelinformation Institut für Pharmakologie und klinische Pharmakologie Universitätsklinikum, Heinrich-Heine-Universität Moorenstr. 5, Düsseldorf kojda@uni-duesseldorf.de Aus einem Vortrag des Autors vom im Hörsaal des LFI der Universitätsklinik Köln (organisiert durch Apothekerkammer Nordrhein/Apothekerverband Köln e.v./kassenärztliche Vereinigung Nordrhein Bezirksstelle Köln) Den Fortbildungsfragebogen zur Erlangung eines Fortbildungspunktes zum Fortbildungstelegramm Pharmazie finden Sie hier: Titelbild : Universitätsbibliothek New York, Urheber: Photoprof, Lizenz: Fotolia
3 58 Was gab es Neues auf dem Arzneimittelmarkt 2016? Prof. Dr. Georg Kojda Fachpharmakologe, Fachapotheker für Arzneimittelinformation Fortbildungsbeauftragter Apothekerkammer Nordrhein, Apothekerverband Köln e.v. Herausgeber Fortbildungstelegramm Pharmazie Institut für Pharmakologie und Klinische Pharmakologie, Universitätsklinikum, Düsseldorf, Fortbildungsvortrag vom organisiert durch Apothekerkammer Nordrhein, Apothekerverband Köln e.v., Kassenärztliche Vereinigung Nordrhein, Bezirksstelle Köln Der Autor erhielt Forschungsgelder 1 sowie dienstlich genehmigte Beratungs- 2 und Referentenhonorare 3 von folgenden Arzneimittelherstellern: Actavis 1, Allergan 2, Boehringer 3, Mundipharma 3, Schwarz Pharma 1, Pfizer 1,2, Shire 1 Übersicht Hinweise Zeitraum Da die Ausbietung der Kombination Sacubitril/Valsartan zum erfolgte und eine neue oral verfügbare Therapieoption für die häufige kardiovaskuläre Indikation Herzinsuffizienz darstellt, wurde Entresto bereits im Januar 2016 besprochen. Kosten Die Berechnung der Tages-Therapiekosten erfolgte auf der Basis des Apothekenverkaufspreises der jeweils größten erhältlichen Packung und der vom Hersteller empfohlenen Dosierung. Artikel verfügbar unter:
4 59 Übersicht 31 neue Arzneistoffe in 2016 (9 Zytostatika, 7 Orphan-Drugs!) Seltene Erkrankungen Albutrepenonacog alfa (Idelvion ) Efmoroctocog alfa (Elocta ) Eftrenonacog alfa (Alprolix ) Pitolisant (Wakix ) Tasimelteon (Hetlioz ) Zytostatika Daratumumab (Darzalex ) Dinutuximab (Unituxin ) Elotuzumab (Empliciti ) Necitumumab (Portrazza ) Olaratumab (Lartruvo ) Osimertinib (Tagrisso ) Palbociclib (Ibrance ) Talimogen laherparepvec (Imlygic ) Tipiracil (Lonsurf ), (Kombination mit Trifluridin) Antiinfektiva Dalbavancin (Xydalba ) Pivmecillinam (X-Systo ) Velpatasvir (Epclusa ) (Kombi mit Sofosbuvir) Elbasvir (Zepatier ) (Kombi mit Grazoprevir) Autoimmunerkrankungen Daclizumab (Zinbryta ) Herz-Kreislauf-Erkrankungen Selexipag (Uptravi ) Sacubitril/Valsartan (Entresto ) Andere Brivaracetam (Briviact ) Guanfacin (Intuniv ) Idarucizumab (Praxbind ) Mepolizumab (Nucala ) Milnacipran (Milnaneurax ) Opicapon (Ongentys ) Ospemifen (Senshio ) Susoctocog alfa (Obizur ) Übersicht Frühe Nutzenbewertung nach AMNOG erheblich > beträchtlich > gering und nicht quantifizierbar (z.b. bei Orphan-Drugs) Bewertung erfolgt im Verhältnis zur zweckmäßigen Vergleichstherapie. Prüfung des Dossiers innerhalb von 3 Monaten Erstattungsbetragsverhandlungen bis 12. Monat Schiedsspruch bis 15. Monat Anhörung und Beschluss zwischen Monat Einigung IQWiG G-BA Dossier Einigung Klage oder Marktrücknahme Marktrücknahme durch Hersteller möglich Für 8 der 31 neuen Arzneimittel findet sich kein g-ba Eintrag, darunter alle Antibiotika. Abb. modifiziert nach:
5 Neue Arzneimittel 2016 Seltene Erkrankungen Teil 2 Übersicht Gruppe seltene Erkrankungen Vollständige Liste erhältlich unter: Übersicht Gruppe seltene Erkrankungen In der EU gilt eine Erkrankung als selten, wenn weniger als 5 von Bürgern davon betroffen sind. Bislang sind mehr als verschiedene seltene Erkrankungen bekannt und immer wieder werden neue seltene Erkrankungen in der medizinischen Literatur beschrieben. Dementsprechend geht die EU in ihren Empfehlungen für seltene Erkrankungen von Millionen Patienten in der EU aus, die von einer seltenen Erkrankung betroffen sind. Dies entspricht immerhin 5,3 % bis 7,1 % der Bevölkerung in der EU. Verzeichnis verfügbar unter: 60
6 61 Arzneistoff Indikation Prävention von Phototoxizität bei erwachsenen Patienten mit erythropoetischer Protoporphyrie (EPP) Analogon des α-melanozyten-stimulierenden Hormons (auch 4-L-Norleucin-7-D-Phenylalanin-α-Melanozytenstimulierndes Hormon oder NDP-α-MSH) Zusatznutzen nicht quantifizierbar Hersteller Clinuvel (UK) Limited Abb.: Protoporphyrin IX + Fe 2+ Häm Ferrochelatase + 2H + Abb.: Die erythropoietische Protoporphyrie (EPP) ist eine erbliche Erkrankung mit geringer Korrelation zwischen Genotyp und Phänotyp Die Prävalenz liegt zwischen 1: und 1: (ORPHA79278, Die EPP wird durch eine zu geringe Aktivität der Ferrochelatase (<25-35 %) verursacht, welche in Mitochondrien den letzten Schritt der 8-stufigen Häm-Synthese katalysiert. Etwa 85 % der Häm-Synthese findet im Knochenmark zur Synthese von Hämoglobin statt. In der Leber dient das dort gebildete Häm z.b. zur Synthese der CYPs. Jede der enzymatisch katalysierten 8 Stufen der Häm-Synthese kann durch genetische Defekte und Umweltfaktoren gestört sein, so dass insgesamt 8 Typen von Porphyrien bekannt sind. *Horner ME. Int J Dermatol Dec;52(12):
7 62 Protoporphyrin IX + Fe 2+ Häm Ferrochelatase + 2H + Abb.: Bei EPP akkumuliert die hydrophobe Vorstufe Protoporphyrin IX u.a. in Erythrozyten, Plasma und Leber. Protoporphyrin IX reichert sich auch in der Membran von Endothelzellen kutaner Blutgefäße an. Exposition mit Tageslicht (v.a. 408 nm, Soret-Bande) induziert einen energiereichen Zustand von Protoporphyrin IX, der kutanen oxidativen Stress verursacht. Die Patienten weisen eine absolute Licht- Intoleranz auf, die auch als Phototoxie oder Phototoxizität bezeichnet wird. Phototoxische Hautreaktionen können auch durch viele verschiedene Arzneimittel verursacht werden (z.b. Johanniskraut, NSAR, Diuretika wie HCT, Antihistaminika oder Amiodaron). * *Prof. Dr. med. Silvia Schauder: Die durch normales Tageslicht innerhalb weniger Minuten in der Haut entstehenden freien Sauerstoffradikale verursachen starke neuropathische Schmerzen sowie Brennen, Stechen und Jucken. * Diese Symptome treten bei 95 % der Patienten vor sichtbaren Läsionen auf und halten mehrere Tage an. Etwa 90 % der Patienten entwickeln Hautläsionen wie Ödeme (80 %), Rötung (20 %), Bläschenbildung (17 %), Hautausschläge oder Krustenbildung (14 %), Petechien (9 %) und Fissuren (5 %). Im Verlauf treten bei 79 % der Patienten auch chronische Hautveränderungen wie Lichenifikationen, Dyspigmentierung, Hyperkeratose und Narbenbildung auf. Ein geringer Anteil der Patienten erleidet auch Leberschäden einschließlich Zirrhose oder terminales Versagen. Abb. aus Clinuvel Australia Video: *Horner ME. Int J Dermatol Dec;52(12):
8 63 Abb. aus Clinuvel Australia Video: Therapie Die bisherigen therapeutischen Möglichkeiten sind sehr begrenzt und wenig wirksam, z.b. ß-Caroten ( mg/tag für Kinder und mg/tag für Erwachsene). * Am wichtigsten ist daher die Vermeidung von Sonnenlicht (auch bei Autofahrten oder durch die Fenster im Haus). Im Freien muss die komplette Haut, einschließlich Kopf und Händen durch Kleidung abgedeckt sein. Diese Maßnahmen führen jedoch zu einer starken Beeinträchtigung der Lebensqualität ( Leben im Dunklen ). Die Beschwerden bei eingetretenen phototoxischen Reaktionen können durch Kühlung oder NSAR gelindert werden (topische Glukokortikoide kaum geeignet). *Lecha M., Orphanet J Rare Dis Sep 10;4:19 Wirkungsmechanismus CREB und MITF=Transkriptionsfaktoren Tyr=Tyrosinase, DCT=Dopachrom Tautomerase Abb. modifiziert nach Horrell et al., 2016: Afamelanotid ist ein Analogon des α- Melanozyten-stimulierenden Hormons (α-msh), welches aus dem Vorläuferprotein Pro-Opiomelanocortin (POMC) abgespalten wird. Es wirkt als Melanocortin-1-Rezeptor (MC1R) Agonist und weist eine längere Bindungsdauer auf als α-msh. Afamelanotid verstärkt die Synthese von Eumelanin unabhängig von Sonnenlicht. Eumelanin induziert eine verstärkte Pigmentierung der Haut verbunden mit photoprotektiven und antioxidativen Effekten. Die Aktivierung von MCR1 bewirkt auch eine Verbesserung der genomischen Stabilität der Melanozyten (DNA- Reparatur nach UV-Schäden). * *Abdel-Malek ZA et al., Arch Biochem Biophys Dec 1;563:4-12
9 64 Klinische Wirksamkeit Offene Phase II Studie an 5 Patienten Die Patienten erhielten alle 60 Tage ein Afamelanotid-Implantat. Primärer Endpunkt war die Toleranz einer Xenon-Licht Bestrahlung auf dem Handrücken (maximal 15 min, obere Abb.). Es zeigte sich eine 11-fach verbesserte Toleranz gegenüber Bestrahlung (P=0.004). Ebenfalls verbessert war die Melanindichte an 6 Körperstellen (untere Abb., P=0.007). Auch die Dauer der Exposition mit Sonnenlicht war bei 4 Patienten 3,5-24-fach verlängert. Afamelanotid ist in der Schweiz und in Italien seit 2006 mittels Sondergenehmigung erhältlich. Nach einer Beobachtungsstudie wird Afamelanotid gut toleriert und die Patienten zeigen eine hohe Adherenz. * Abb. modifiziert nach: N Engl J Med Jan 15;360(3):306-7 *Br J Dermatol Jun;172(6): Daten aus: N Engl J Med Jul 2;373(1):48-59 (Mittelwert±SD) Klinische Wirksamkeit zwei multizentrische, randomisierte, doppelblinde und Placebo-kontrollierte Phase III Studien in Europa (n=74, 180 Tage) und in den USA (n=94, 270 Tage) Die Patienten erhielten alle 60 Tage ein Afamelanotid-Implantat (Fettgewebe Beckenkamm). Primärer Endpunkt (Abb.) war die Anzahl der Stunden im Sonnenlicht ohne Schmerzen. In der EU-Studie reduzierte Afamelanotid die Anzahl und Dauer phototoxischer Reaktionen. In der USA- Studie war dieser Effekt nicht signifikant. In beiden Studien reduzierte Afamelanotid die Anzahl schmerzfreier Tage. In beiden Studien verbesserte Afamelanotid deutlich die Lebensqualität (EPP-QOL score). Eine Photoprovokation mittels Bestrahlung an Handrücken und Rücken (n=21, U.S. Studie) wurde unter Afamelanotid besser toleriert.
10 65 Nebenwirkungen Die am häufigsten angegebenen Nebenwirkungen sind Übelkeit, die bei etwa 19% der mit diesem Arzneimittel behandelten Patienten auftrat, sowie Kopfschmerzen (bei 20%) und Reaktionen an der Implantatstelle (bei 21%; überwiegend Verfärbungen, Schmerzen, Hämatome, Erytheme). In den meisten Fällen wurde die Schwere dieser Nebenwirkungen als leicht beschrieben Sehr häufige unerwünschte Wirkungen (>10%): - Kopfschmerzen - Übelkeit Häufige unerwünschte Wirkungen (> 1% und < 10%, Auswahl): - Infektionen der oberen Atemwege - Verminderter Appetit - Migräne - Schwindel - Lethargie, Schläfrigkeit - Hitzegefühl, Hitzewallung - Bauchschmerzen, Schmerzen im Oberbauch - Durchfall - Erbrechen - Erythem - Melanozytärer Nävus, Pigmentstörung, Verfärbung der Haut, Hyperpigmentierung der Haut, - Sommersprossen - Pruritus - Rückenschmerzen ABDA-Datenbank, Fachinformation Kontraindikationen Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile Bestehen einer schweren Lebererkrankung, Leberinsuffizienz, Niereninsuffizienz Warnhinweise Vorsicht bei klinisch bedeutsamen Erkrankungen des Gastrointestinaltrakts, des Herz-Kreislauf-Systems, der Atemwege, des endokrinen Systems (einschließlich Diabetes mellitus, Morbus Cushing, Morbus Addison, Peutz-Jeghers-Syndrom) oder zu neurologischen (einschließlich Krampfanfällen) und hämatologischen Erkrankungen (insbesondere Anämie) weil keine Daten zur Anwendung von Afamelanotid bei diesen Erkrankungen vorliegen Schwangerschaft: keine Anwendung Stillzeit: Anwendung vermeiden Fertilität: keine Daten am Menschen, kaum Einfluss in tierexperimentellen Studien ABDA-Datenbank, Fachinformation
11 66 Fazit Afamelanotid ist ein Analogon des α-melanozyten-stimulierenden Hormons (α-msh). Es wirkt als Melanocortin-1-Rezeptor (MC1R) Agonist und weist eine längere Bindungsdauer auf als α-msh. Er verstärkt die Synthese von Eumelanin unabhängig von Sonnenlicht und induziert damit eine verstärkte Pigmentierung der Haut. Es handelt sich um ein neues Wirkprinzip. Der Arzneistoff wird als Implantat alle 60 Tage eingesetzt und bewirkt bei Patienten mit erythropoetischer Protoporphyrie ( Leben im Dunklen ) eine deutliche Verbesserung ihrer Lebenssituation. Es erhöht die Anzahl der Stunden im Sonnenlicht ohne Schmerzen, verbessert deutlich die Lebensqualität und reduziert die Anzahl und Dauer phototoxischer Reaktionen sowie die Anzahl schmerzfreier Tage. Nach einer Beobachtungsstudie an Patienten in der Schweiz und in Italien wird Afamelanotid seit 2006 gut toleriert und die Patienten zeigen eine hohe Adhärenz. Sehr häufige Nebenwirkungen von Afamelanotid sind Kopfschmerzen und Übelkeit. Häufige Nebenwirkungen sind zwar zahlreich, aber in der Regel von einem nur leichten Schweregrad. Die Therapie kostet bei der empfohlenen Dosierung 449 /Tag. Arzneistoff Indikation Dauerbehandlung von Erwachsenen und Jugendlichen ab 16 Jahren und älter mit gesicherter Morbus Fabry- Diagnose (α-galaktosidase A- Mangel), die eine auf die Behandlung ansprechende Mutation aufweisen 1-Deoxygalactonojirimycin ist ein Analogon der Galactose Zusatznutzen nicht quantifizierbar Hersteller Amicus Therapeutics UK Ltd Abb.:
12 67 Fabry-Krankheit Johann Hubert Fabry ( ) Es handelt sich um eine lysosomale Speichererkrankung mit einer Prävalenz von 1-5/ Sie wurde von Johannes Fabry und William Anderson unabhängig voneinander erstmals 1898 beschrieben (Fabry-Anderson-Krankheit, auch Morbus Fabry). Sie wird verursacht durch einen hereditären Alpha- Galaktosidase A-Mangel (αgal-a), der auf Mutationen des GLA-Gens auf dem X-Chromosom beruht (Xq21.3-q22). Dementsprechend vererben betroffene Männer (hemizygot) die Erkrankung nur an Ihre Töchter, während sie an die Hälfte der Töchter und Söhne betroffener Frauen (heterozygot) vererbt wird. Der X-chromosomale Erbgang ist auch der Grund dafür, dass Frauen, die ein zweites X-Chromosom mit intaktem GLA-Gen aufweisen, weniger schwer und erst in späteren Lebensabschnitten manifest erkranken, während Jungen bereits im Kindesalter Symptome aufweisen können (klassische Form). Mehta A et.al., GeneReviews [Internet], 2017 Fabry-Krankheit Bei den vielen Mutationen des GLA-Gens handelt sich überwiegend um Punktmutationen mit unterschiedlichen Auswirkungen auf die Aktivität und Stabilität der αgal-a. Die αgal-a katalysiert den Abbau von Globotriosylceramid (Gb3) zu Lactosylceramid. Sie katalysiert ebenfalls den Abbau von Digalactosylceramid zu Galactosylceramid. Daher akkumulieren diese Ceramide in den Lysosomen vaskulärer Endothelzellen, beispielsweise in den Nieren, dem Herz und dem ZNS. Allerdings zeigen neuere Erkenntnisse, dass vor allem die Anreicherung des N-deacetylierten Gb3, das Globotriaosylshingosin (lyso-gb3), mit der Schweregrad der Erkrankung korreliert und durch eine Enzymersatztherapie deutlich reduziert wird. Bei betroffenen Männern wurden Plasmakonzentrationen von nm gemessen, während Lyso-Gb3 bei nicht betroffenen Mitgliedern derselben Familie nicht nachweisbar war. * Abb. modifiziert nach Mehta A et.al., GeneReviews [Internet], 2017 *Aerts JM et al., PNAS 2008;105(8):
13 68 Fabry-Krankheit National Fabry Disease Foundation, USA Abb. modifiziert nach Die Symptomatik der Erkrankung ist vielfältig und unspezifisch. Bei vielen Erkrankten wird deshalb die korrekte Diagnose erst Jahre zu spät oder auch nie gestellt. Typische Symptome, die auch bereits im Kindesalter auftreten können, sind: brennende Schmerzen in Händen und Füßen (Akroparästhesien, oft das erste auftretende Symptom), Hautveränderungen (Angiokeratome) Hypo- oder Anhidrosis mit eingeschränkter Belastungstoleranz (Schulsport), wirbelartige Ablagerungen im Hornhautepithel (Vortexkeratopathie), gastrointestinale Beschwerden wie Übelkeit, Erbrechen und Diarrhö sowie psychiatrische Beschwerden wie Ängstlichkeit oder Depression. Insgesamt kommt es zu einer deutlichen Einschränkung der Lebensqualität. Mehta A et.al., GeneReviews [Internet], 2017 Fabry-Krankheit Im Verlauf der Erkrankung und mit zunehmendem Lebensalter treten schwerwiegende Komplikationen auf: fortschreitender Verlust der Nierenfunktion bis hin zu Niereninsuffizienz und Dialysepflicht, Entwicklung von linksventrikulärer Hypertrophie, Herzinfarkt und Herzinsuffizienz, Entwicklung kardialer Arrhythmien, Entwicklung transienter ischämischer Attacken und Schlaganfälle, Tinnitus mit progredientem oder plötzlich auftretendem Hörverlust sowie restriktive oder obstruktive pulmonale Erkrankung mit Dyspnoe und chronischem Husten. Vor allem die kardialen und renalen Schäden treten vergleichsweise früh auf und sind die wichtigsten Ursachen für die Verminderung der Lebenserwartung, die unbehandelt bei Männern etwa 50 Jahre beträgt. Angiokeratome Abb. modifiziert nach Mehta A et.al., GeneReviews [Internet], 2017
14 69 Fabry-Krankheit Vortexkeratopathie (Cornea verticillata) Auch heterozygote Frauen mit einem nicht mutierten GLA-Gen können eine symptomatische Form der Fabry- Krankheit entwickeln. Dies wird als Folge der X-Inaktivierung angesehen, die sich im Laufe der Evolution entwickelt hat um eine erhöhte Transkription von X-chromosomaler DNA im weiblichen Organismus zu vermeiden. Zellen, die das nicht mutierte GLA-Gen inaktivieren akkumulieren somit ebenfalls beispielsweise lyso-gb3. Eine klinisch manifeste Erkrankung tritt bei Frauen jedoch in späteren Lebensabschnitten und in abgeschwächter Form auf. Häufig beobachtete Symptome sind Augenveränderungen (Bild links), Akroparästhesien, zerebrovaskuläre Ereignisse und linksventrikuläre Hypertrophie, während ein Nierenversagen zwar möglich ist, aber nur selten vorkommt.* Gewundene Blutgefäße Abb. modifiziert nach *vom Dahl S, Wendel U, Strohmeyer G. Genetisch bedingte Stoffwechselerkrankungen. Deutscher Ärzte-Verlag Köln, 2006 Fabry-Krankheit Therapeutische Möglichkeiten* Die bislang einzige spezifisch wirksame Therapie ist die Enzym-Ersatz-Therapie (EET) mit Agalsidase alpha (Replagal ) und Agalsidase beta (Fabrazyme ), beides rekombinante und mit Mannose-6-phosphat gekoppelte Varianten der αgal-a, die sich nur in den Zuckerresten unterscheiden. Diese intravenöse Therapie (alle 14 Tage) ist nur möglich, weil die rekombinanten Proteine, wie auch das native Enzym, über den Mannose-6-Phosphat-Rezeptor via Endozytose in die Zellen eingeschleust werden können. Die Therapie bessert die Symptomatik der Erkrankung sowie die Lebensqualität und reduziert die Progredienz der Organschäden. Sie kann unter bestimmten Voraussetzungen auch als Heiminfusionstherapie erfolgen. Darüber hinaus werden oft weitere Arzneimittel als Begleittherapie für die Symptomatik und Folgeschäden der Erkrankung eingesetzt. *
15 70 Wirkungsmechanismus Bild modifiziert nach einem Animationsvideo des Herstellers: Migalastat wirkt über einen neuen Mechanismus. Es bindet reversibel und kompetitiv an mutierte Formen der αgal-a im endoplasmatischen Reticulum (ER, hier raues ER). Bei dem dortigen ph-wert von 7,4 bindet Migalastat mit hoher Affinität an das katalytische Zentrum der mutierten αgal-a und hemmt deren Aktivität. Die Bindung bewirkt eine Stabilisierung der mutierten αgal-a, so dass das mutierte Protein nicht mehr vorzeitig im ER abgebaut wird. Auf diese Art und Weise erreichen die mutierten αgal-a Moleküle mit gebundenem Migalastat das Lysosom. Wirkungsmechanismus Bild modifiziert nach einem Animationsvideo des Herstellers: Im sauren ph-wert des Lysosoms kann Migalastat von den Ceramid-Substraten der αgal-a verdrängt und damit die Hemmung des Enzyms aufgehoben werden. Während Migalastat nur eine Halbwertszeit von 3-5 h aufweist, ist die einmal ins Lysosom gelangte αgal-a für mehrere Tage aktiv (daher auch Gabe nur jeden 2. Tag). Diese Art von Arzneistoffen werden als pharmakologische Chaperone bezeichnet. Die Möglichkeit einer oralen Gabe statt einer Infusionstherapie ist für die Patienten zunächst ein wichtiger Vorteil. *
16 71 Wirkungsmechanismus Bild modifiziert nach einem Animationsvideo des Herstellers: Die Wirksamkeit einer solchen Therapie setzt allerdings Mutationen der αgal-a voraus, die trotz der Mutation/en eine ausreichende Restaktivität aufweisen um die Symptome und Progression der Fabry-Krankheit zu verbessern. Daher listet die Fachinformation über fast 18 Seiten detailliert Mutationen auf, bei welchen eine Wirkung von Migalastat erwartet oder eben nicht erwartet werden kann. Somit kann Migalastat, im Gegensatz zur EET, nicht bei allen Patienten mit Fabry-Krankheit eingesetzt werden. Klinische Wirksamkeit Bild modifiziert nach einem Animationsvideo des Herstellers: Die klinische Wirksamkeit von Migalastat wurde in 2 Phase 3 Studien untersucht. Während dieser Studien wurde eine neue Methode bekannt, mit welcher sich die Mutationen, bei denen ein Therapieerfolg mit Miglastat möglich ist, besser einschätzen lassen. Die erneute Testung der Studien- Patienten vor der Entblindung ergab dann, dass einige der Patienten Mutationen aufwiesen, die nicht für eine Therapie mit Migalastat geeignet sind. Daher beruhen die Analysen nicht auf den ursprünglichen Intention-to-treat Populationen. *
17 72 Klinische Wirksamkeit Bild modifiziert nach: Germain DP et al., N Engl J Med 2016; 375: In der FACETS Studie wurde die klinische Wirksamkeit von 123 mg Migalastat alle 2 Tage an insgesamt 50 Patienten untersucht. Die randomisierte Studie war über 6 Monate doppelblind gegen Placebo angelegt, worauf eine offene Weiterbehandlung aller Patienten mit Migalastat erfolgte. Primärer Endpunkt war der prozentuale Anteil der Patienten, die eine 50 %ige Reduktion der Anzahl von Gb3- Einschlüssen pro interstitielle Nieren- Kapillare aufwiesen. Dargestellt sind die Ergebnisse von 45 Patienten mit geeigneten Mutationen. Sowohl in der doppelblinden Phase als auch in der offenen Phase bewirkte Miglustat eine signifikante Verbesserung. Klinische Wirksamkeit Bild modifiziert nach: Germain DP et al., N Engl J Med 2016; 375: Ein weiterer Endpunkt in der FACETS Studie war der mittlere Plasmaspiegel des Lyso-Gb3, eines Plasmaparameters, der gut mit dem Schweregrad der Erkrankung korreliert (siehe oben). Dargestellt sind die Ergebnisse von 31 Patienten mit geeigneten Mutationen. Sowohl in der doppelblinden Phase als auch in der offenen Phase bewirkte Miglustat eine signifikante Senkung der Plasmakonzentration von Lyso-Gb3. Weiterhin reduzierte Migalastat den linksventrikulären Massenindex, insbesondere bei bereits vorliegender kardialer Hypertrophie. Auch der Schweregrad von Diarrhö, Reflux und Verdauungsstörungen war reduziert.
18 73 Klinische Wirksamkeit In der ATTRACT Studie wurde die klinische Wirksamkeit von 123 mg Migalastat alle 2 Tage an insgesamt 57 Patienten untersucht, die zuvor für mehr als 12 Monate eine Enzymersatztherapie (EET) erhalten hatten. Die Patienten wurden in eine Migalastat und eine EET Gruppe randomisiert (1,5:1) und ohne Verblindung für 18 Monate behandelt. Ko-primäre Endpunkte waren die Änderungen bzw. Unterschiede von auf verschiedene Arten berechneten glomerulären Filtrationsraten (GFR), wobei sich kein Unterschied zwischen Migalastat und EET ergab. Renale, kardiale oder zerebrovaskuläre Ereignisse traten bei 29 % (Miglastat) und 44 % (EET) der Patienten auf (P=0,36). Migalastat und EET verminderten die linksventrikuläre Hypertrophie, wobei dieser Effekt nur in der Migalastat-Gruppe signifikant war. Die Plasmaspiegel von lyso-gb3 blieben in beiden Gruppen stabil niedrig. Somit scheint Migalastat einer EET nicht unterlegen zu sein und stellt daher für Patienten mit geeigneten Mutationen der αgal-a eine oral verfügbare Alternative zur EET dar. *Hughes DA et al., J Med Genet 2017; 54: Nebenwirkungen Die häufigste Nebenwirkung war Kopfschmerzen, die bei ungefähr 10 % der Patienten unter der Migalastat-Therapie auftrat. Sehr häufige unerwünschte Wirkungen (>10%): - Kopfschmerzen Häufige unerwünschte Wirkungen (> 1% und < 10%, Auswahl): - Depression - Parästhesie, Benommenheit, Hypästhesie - Schwindelgefühl - Herzklopfen - Dyspnoe, Nasenbluten - Durchfall, Übelkeit, Bauchschmerzen, Verstopfung, Mundtrockenheit, Stuhldrang, Dyspepsie - Hautausschlag, Juckreiz - Muskelspasmen, Myalgie, Schiefhals - Schmerzen in einer Extremität - Proteinurie - Müdigkeit, Schmerzen - erhöhte Kreatinkinase-Konzentration im Blut, Gewichtszunahme ABDA-Datenbank, Fachinformation
19 74 Kontraindikationen Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile Warnhinweise Anwendung bei schwerer Niereninsuffizienz wird nicht empfohlen Anwendung bei Frauen im gebärfähigen Alter ohne Kontrazeption wird nicht empfohlen Anwendung in der Schwangerschaft wird nicht empfohlen Anwendung in der Stillzeit wird nicht empfohlen, ggf. Stillen abbrechen Bei männlichen Ratten wurde eine innerhalb von 4 Wochen nach dem Absetzen vollständig reversible Infertilität beobachtet (keine Daten am Menschen) ABDA-Datenbank, Fachinformation Fazit Migalastat stabilisiert bestimmte mutierte und daher instabile Formen der alpha- Galaktosidase A. Es bindet als reversibler kompetitiver Inhibitor an das Enzym und verhindert damit die vorzeitige Degradation im ER. Im sauren Lysosom wird Migalastat durch die natürlichen Substrate der αgla-a vom Enzym verdrängt, so dass die Restaktivität der αgla-a die Akkumulation der Substrate im Lysosom vermindert. Diese Art von Arzneistoffen werden als pharmakologische Chaperone bezeichnet. Migalastat ist der erste zugelassene Arzneistoff mit einem solchen Mechanismus. Im Gegensatz zur Enzymersatztherapie ist Migalastat nur für die Behandlung der Fabry-Krankheit zugelassen, wenn diese auf Mutationen der αgal-a beruht, die trotz der Mutation/en eine ausreichende Restaktivität aufweisen. In diesen Fällen bessert die Therapie die Symptomatik und verlangsamt die Progredienz der Organschäden vergleichbar mit einer Enzymersatztherapie. Migalastat wird in einer Dosierung von 123 mg alle zwei Tage zur gleichen Uhrzeit eingenommen. Die Zulassung ist auf Patienten >16 Jahre beschränkt. Als sehr häufige Nebenwirkung treten Kopfschmerzen auf. Die Therapie kostet bei der empfohlenen Dosierung 792 /Tag. (Fabrazyme bei einem KG von 70 kg: 701 /Tag) (Replagal bei einem KG von 70 kg: 704 /Tag)
20 75 Hinweise 1) Die Bezeichnung Zusatznutzen bezieht sich auf das Gesetz zur Neuordnung des Arzneimittelmarkts (AMNOG), wonach der G-BA eine Nutzenbewertung neu zugelassener Arzneimittel nach 35 a SGB V durchführt. 2) Die Informationen zu den Arzneimitteln sind verkürzt dargestellt. Ausführlichere Informationen finden besonders interessierte Leser unter Weblink 1 und Weblink 2. 3) Eine vollständige Liste der im Jahr 2016 zugelassen Arzneistoffe mit Indikationen und und Zusatznutzen bei dieser Indikation ist unter folgendem Link erhältlich: Weblinks 1) wissenschaftliche Diskussion der Arzneistoffdaten einschließlich Nutzen-Risiko Einschätzung in den European Public Assessment Reports (EPARs,) der Zulassungsbehörde European Medicinal Agency (EMA), verzeichnet nach Handelsnamen, abgelegt unter Assessment History (nur in englischer Sprache) 2) Webseiten des Gemeinsamen Bundesausschuss (G-BA) mit einer Übersicht der Arzneimittel mit neuen Wirkstoffen, für die der G-BA eine Nutzenbewertung nach 35a SGB V durchführt oder bereits abgeschlossen hat. Dort sind die Gutachten des IQWiG sowie die tragenden Gründe der Beschlüsse einsehbar. Literatur Zitate zu Leitlinien, Phase III-Studien und anderer verwendeter Literatur sind - soweit nicht aufgeführt - auf Nachfrage beim Autor erhältlich Impressum:
Vom unklaren Symptomkomplex zur ganzheitlichen Diagnose
 Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Neue Arzneimittel 2016 eine kritische Bewertung
 Fortbildungsveranstaltung der Arzneimittelkommission der deutschen Ärzteschaft mit der Ärztekammer Nordrhein und der KV Nordrhein 5. Oktober 2016 in Düsseldorf Neue Arzneimittel 2016 eine kritische Bewertung
Fortbildungsveranstaltung der Arzneimittelkommission der deutschen Ärzteschaft mit der Ärztekammer Nordrhein und der KV Nordrhein 5. Oktober 2016 in Düsseldorf Neue Arzneimittel 2016 eine kritische Bewertung
Dossierbewertung A15-60 Version 1.0 Sacubitril/Valsartan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
MORBUS FABRY Morbus Fabry ist eine seltene und schwere, aber behandelbare Krankheit
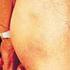 MORBUS FABRY Morbus Fabry ist eine seltene und schwere, aber behandelbare Krankheit Diese Broschüre möchte Sie über die Entstehung, Vererbung und Behandlung der Fabry-Erkrankung informieren. Hier finden
MORBUS FABRY Morbus Fabry ist eine seltene und schwere, aber behandelbare Krankheit Diese Broschüre möchte Sie über die Entstehung, Vererbung und Behandlung der Fabry-Erkrankung informieren. Hier finden
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Sanvita Meno Tabletten
 Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Forschungswerkstatt Herz Kreislauf 2007 Neue Daten zu Aspirin. Von Prof. Dr. Stefanie M. Bode Böger
 Forschungswerkstatt Herz Kreislauf 2007 Neue Daten zu Aspirin Von Prof. Dr. Stefanie M. Bode Böger Köln (15. März 2007) - Das akute Koronarsyndrom (AKS) ist durch Angina pectoris Beschwerden und Ischämie-typische
Forschungswerkstatt Herz Kreislauf 2007 Neue Daten zu Aspirin Von Prof. Dr. Stefanie M. Bode Böger Köln (15. März 2007) - Das akute Koronarsyndrom (AKS) ist durch Angina pectoris Beschwerden und Ischämie-typische
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Betahistine Apotex 8 mg Tabletten Betahistine Apotex 16 mg Tabletten. Betahistindihydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Betahistine Apotex 8 mg Tabletten Betahistine Apotex 16 mg Tabletten Betahistindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Betahistine Apotex 8 mg Tabletten Betahistine Apotex 16 mg Tabletten Betahistindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A15-31 Version 1.0 Tiotropium/Olodaterol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid
 VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
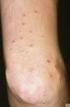 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Aus: Terbinafin Schäfer-Korting/Schmid-Wendtner Copyright 2006 ABW Wissenschaftsverlag GmbH, Kurfürstendamm 57, Berlin
 10 Verträglichkeit Bis heute haben weltweit mehr als 18 Millionen Patienten Terbinafin systemisch eingenommen. Das Auftreten unerwünschter Wirkungen sowie Interaktionen mit anderen Arzneimitteln wurden
10 Verträglichkeit Bis heute haben weltweit mehr als 18 Millionen Patienten Terbinafin systemisch eingenommen. Das Auftreten unerwünschter Wirkungen sowie Interaktionen mit anderen Arzneimitteln wurden
KHK bei Dialysepatienten aktuelle Aspekte / Antianginöse Therapie
 06.12.2013 Berliner Dialyse Seminar KHK bei Dialysepatienten aktuelle Aspekte / Antianginöse Therapie Georg Schlieper gschlieper@ukaachen.de Nephrologie & Klinische Immunologie Todesursachen bei Dialysepatienten
06.12.2013 Berliner Dialyse Seminar KHK bei Dialysepatienten aktuelle Aspekte / Antianginöse Therapie Georg Schlieper gschlieper@ukaachen.de Nephrologie & Klinische Immunologie Todesursachen bei Dialysepatienten
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
2010 Migräne Sagen Sie auf Wiedersehen! Martin Zander
 2010 Migräne Sagen Sie auf Wiedersehen! Martin Zander 2 M. Zander Migräne Sagen Sie auf Wiedersehen! Dieses Buch wurde online bezogen über: XinXii.com Der Marktplatz für elektronische Dokumente http://www.xinxii.com
2010 Migräne Sagen Sie auf Wiedersehen! Martin Zander 2 M. Zander Migräne Sagen Sie auf Wiedersehen! Dieses Buch wurde online bezogen über: XinXii.com Der Marktplatz für elektronische Dokumente http://www.xinxii.com
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage
 Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid
 Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Antikoagulation bei Vorhofflimmern
 Orale Antikoagulation bei VHF Was kommt nach Marcumar? Köln, 17. September 2011 Antikoagulation bei Vorhofflimmern Priv.-Doz. Dr. med. Jochen Müller-Ehmsen muller.ehmsen@uni-koeln.de Klinik III für Innere
Orale Antikoagulation bei VHF Was kommt nach Marcumar? Köln, 17. September 2011 Antikoagulation bei Vorhofflimmern Priv.-Doz. Dr. med. Jochen Müller-Ehmsen muller.ehmsen@uni-koeln.de Klinik III für Innere
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhaltspunkt für erheblichen Zusatznutzen
 Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Grundlagen der Medizinischen Klinik I + II. Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska
 Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Was ist Bluthochdruck? Der ideale Blutdruck liegt bei 120/80 mmhg. Bluthochdruck (Hypertonie) ist eine
Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Was ist Bluthochdruck? Der ideale Blutdruck liegt bei 120/80 mmhg. Bluthochdruck (Hypertonie) ist eine
Genetisch bedingte Stoffwechselerkrankungen
 Genetisch bedingte Stoffwechselerkrankungen Behandlung, Kosten, sozialmedizinische Aspekte von Stephan vom Dahl, Udo Wendel, Georg Strohmeyer 1. Auflage Genetisch bedingte Stoffwechselerkrankungen Dahl
Genetisch bedingte Stoffwechselerkrankungen Behandlung, Kosten, sozialmedizinische Aspekte von Stephan vom Dahl, Udo Wendel, Georg Strohmeyer 1. Auflage Genetisch bedingte Stoffwechselerkrankungen Dahl
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Wirkstoff: Natriumchondroitinsulfat
 Gebrauchsinformation: Information für Anwender CONDROSULF 800 mg - Tabletten Wirkstoff: Natriumchondroitinsulfat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender CONDROSULF 800 mg - Tabletten Wirkstoff: Natriumchondroitinsulfat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
ahus: Entstehung, Symptome und Diagnostik
 ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
Auf der 84. Jahrestagung der Deutschen Gesellschaft für Neurologie (DGN), die noch bis zum 1. Oktober in
 Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
Rheumon-Gel Wirkstoff:Etofenamat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab
 Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab 5 Jahren und Jugendlichen Voraussetzungen für Selbstmedikation
Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab 5 Jahren und Jugendlichen Voraussetzungen für Selbstmedikation
Niereninsuffizienz als kardiovaskulärer Risikofaktor
 Bayerischer Internistenkongress München, 07.-08.11.2009 Niereninsuffizienz als kardiovaskulärer Risikofaktor Ulf Schönermarck Schwerpunkt Nephrologie Medizinische Klinik I Klinikum der Universität München
Bayerischer Internistenkongress München, 07.-08.11.2009 Niereninsuffizienz als kardiovaskulärer Risikofaktor Ulf Schönermarck Schwerpunkt Nephrologie Medizinische Klinik I Klinikum der Universität München
Beschluss. Vom 17. Juli 2014
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Mycostatin - orale Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Cimicifuga racemosa. Die Wirksamkeit ist dosisabhängig. Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich
 Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich Folie 1 Menopause relevante Beschwerden Hitzewallungen Schweissausbrüche Schlafstörungen Nervosität, Gereiztheit Depression
Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich Folie 1 Menopause relevante Beschwerden Hitzewallungen Schweissausbrüche Schlafstörungen Nervosität, Gereiztheit Depression
Thrombosemanagement mit NMH Wichtiges worauf Sie achten sollten
 Thrombosemanagement mit NMH Wichtiges worauf Sie achten sollten Thrombosemanagement mit niedermolekularem Heparin (NMH) bei Niereninsuffizienz: Worauf Sie unbedingt achten sollten. Beantworten Sie die
Thrombosemanagement mit NMH Wichtiges worauf Sie achten sollten Thrombosemanagement mit niedermolekularem Heparin (NMH) bei Niereninsuffizienz: Worauf Sie unbedingt achten sollten. Beantworten Sie die
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Brentuximabvedotin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Kein Hinweis für eine andere Ursache der Demenz
 die später nach ihm benannte Krankheit. Inzwischen weiß man, dass die Alzheimer-Krankheit eine sogenannte primär-neurodegenerative Hirnerkrankung ist. Das bedeutet, dass die Erkrankung direkt im Gehirn
die später nach ihm benannte Krankheit. Inzwischen weiß man, dass die Alzheimer-Krankheit eine sogenannte primär-neurodegenerative Hirnerkrankung ist. Das bedeutet, dass die Erkrankung direkt im Gehirn
S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT
 S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT Stand: 30. September 2015 95% der Fälle durch Arteriosklerose Herzinfarkt, Schlaganfall und PAVK In ungefähr
S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT Stand: 30. September 2015 95% der Fälle durch Arteriosklerose Herzinfarkt, Schlaganfall und PAVK In ungefähr
Frage: Führt die antibiotische Behandlung der Helicobacter pylori Infektion bei Patienten mit funktioneller Dyspepsie zur Beschwerdefreiheit?
 Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Genetische Unterschiede beeinflussen die Wirkung von Anti-Brechmitteln
 Chemotherapie: Wenn die Übelkeit nicht aufhört Genetische Unterschiede beeinflussen die Wirkung von Anti-Brechmitteln Heidelberg (4. Januar 2011) Häufige Nebenwirkungen einer Chemotherapie sind Übelkeit
Chemotherapie: Wenn die Übelkeit nicht aufhört Genetische Unterschiede beeinflussen die Wirkung von Anti-Brechmitteln Heidelberg (4. Januar 2011) Häufige Nebenwirkungen einer Chemotherapie sind Übelkeit
Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns
 AMB 2000, 34, 92 Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns In einer Untersuchung von G. Cotter et al. aus Israel (1) wurden 100 Patienten (Durchschnittsalter 68 Jahre) mit seit weniger
AMB 2000, 34, 92 Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns In einer Untersuchung von G. Cotter et al. aus Israel (1) wurden 100 Patienten (Durchschnittsalter 68 Jahre) mit seit weniger
Chronische Niereninsuffizienz bei Katzen NIEREN. THERAPIE Tag für Tag
 Chronische Niereninsuffizienz bei Katzen NIEREN THERAPIE Tag für Tag NierenTHerapie Tag für Tag Wenn Ihre Katze an Niereninsuffizienz leidet Die chronische Niereninsuffizienz ( CNI ) ist eine häufig auftretende
Chronische Niereninsuffizienz bei Katzen NIEREN THERAPIE Tag für Tag NierenTHerapie Tag für Tag Wenn Ihre Katze an Niereninsuffizienz leidet Die chronische Niereninsuffizienz ( CNI ) ist eine häufig auftretende
Chloropotassuril 1 g/10 ml Lösung zum Einnehmen
 Roundup Var. IB.c.I.z. Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Chloropotassuril 1 g/10 ml Lösung zum Einnehmen Kaliumchlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Roundup Var. IB.c.I.z. Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Chloropotassuril 1 g/10 ml Lösung zum Einnehmen Kaliumchlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs
 AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
B3)
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Gebrauchsinformation: Information für Patienten. trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen. Weinblätter, in Pulverform
 PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Die α (alpha)-thalassämien- Informationen für Patienten
 Die Alpha Thalassämien Seite 1 von 1 Die α (alpha)-thalassämien- Informationen für Patienten Erstellung Prüfung Prof. Dr. med. Roswitha Dickerhoff Prof. Dr. med. R. Dickerhoff Gültigkeitsbeginn 01.05.2013
Die Alpha Thalassämien Seite 1 von 1 Die α (alpha)-thalassämien- Informationen für Patienten Erstellung Prüfung Prof. Dr. med. Roswitha Dickerhoff Prof. Dr. med. R. Dickerhoff Gültigkeitsbeginn 01.05.2013
Niereninsuffizienz und die Elimination von jodhaltigem Kontrastmittel per Dialyse
 Niereninsuffizienz und die Elimination von jodhaltigem Kontrastmittel per Dialyse M. Liebetrau - Blankenhain Helios Klinik Blankenhain Akutes Nierenversagen und chronische Nierenerkrankung in Industrienationen
Niereninsuffizienz und die Elimination von jodhaltigem Kontrastmittel per Dialyse M. Liebetrau - Blankenhain Helios Klinik Blankenhain Akutes Nierenversagen und chronische Nierenerkrankung in Industrienationen
Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar
 Einbezug neuer Studiendaten ändert nichts am Ergebnis des IQWiG-Vorberichts Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar Köln (12. Mai 2014) - Der Nutzen der therapeutischen Arthroskopie
Einbezug neuer Studiendaten ändert nichts am Ergebnis des IQWiG-Vorberichts Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar Köln (12. Mai 2014) - Der Nutzen der therapeutischen Arthroskopie
Populationsrelevanz der Hämochromatose und klinische Konsequenzen
 Populationsrelevanz der Hämochromatose und klinische Konsequenzen 60. Tagung der DGVS Köln, 15.09.2005 Prof. Dr. med. Manfred Stuhrmann-Spangenberg Institut für Humangenetik Medizinische Hochschule Hannover
Populationsrelevanz der Hämochromatose und klinische Konsequenzen 60. Tagung der DGVS Köln, 15.09.2005 Prof. Dr. med. Manfred Stuhrmann-Spangenberg Institut für Humangenetik Medizinische Hochschule Hannover
ANHANG NEBENWIRKUNGEN
 ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
Zur Situation betroffener Eltern. Karin Brosius, stellv. Sprecherin der Mito Diagnosegruppe in der Deutschen Gesellschaft für Muskelkranke e.v.
 Zur Situation betroffener Eltern Karin Brosius, stellv. Sprecherin der Mito Diagnosegruppe in der Deutschen Gesellschaft für Muskelkranke e.v. DGM L., 19 Jahre, mitochondriale Enzephalomyopathie (Leigh
Zur Situation betroffener Eltern Karin Brosius, stellv. Sprecherin der Mito Diagnosegruppe in der Deutschen Gesellschaft für Muskelkranke e.v. DGM L., 19 Jahre, mitochondriale Enzephalomyopathie (Leigh
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir
 Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
Sind dicke Kinder auch kranke Kinder? Gesundheitsrisiken und Folgeerkrankungen des Uebergewichtes im Kindes- und Jugendalter
 Sind dicke Kinder auch kranke Kinder? Gesundheitsrisiken und Folgeerkrankungen des Uebergewichtes im Kindes- und Jugendalter Dr. Gabor Szinnai Abteilung Endokrinologie und Diabetologie Universitäts-Kinderspital
Sind dicke Kinder auch kranke Kinder? Gesundheitsrisiken und Folgeerkrankungen des Uebergewichtes im Kindes- und Jugendalter Dr. Gabor Szinnai Abteilung Endokrinologie und Diabetologie Universitäts-Kinderspital
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Levocetirizin Genericon 5 mg Filmtabletten. Levocetirizindihydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Auswertung von Unterschieden der Androgene bei SBMA-Patienten
 Auswertung von Unterschieden der Androgene bei SBMA-Patienten Nicholas Di Prospero, MD, PhD National Institute of Neurological Disorders and Stroke NIH Von der Genetik zu einem Gen Spinale und Bulbäre
Auswertung von Unterschieden der Androgene bei SBMA-Patienten Nicholas Di Prospero, MD, PhD National Institute of Neurological Disorders and Stroke NIH Von der Genetik zu einem Gen Spinale und Bulbäre
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Aciclovir Mylan 800 mg Tabletten Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Mylan 800 mg Tabletten Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Mylan 800 mg Tabletten Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Rauchstopp. A. Deman/Medizinische Poliklinik M. Liechti/Klinische Pharmakologie
 Rauchstopp A. Deman/Medizinische Poliklinik M. Liechti/Klinische Pharmakologie Tabakkonsum in Europa In den meisten europäischen Ländern konsumieren > 25 % der Einwohner Tabakprodukte Kartenlegende 40
Rauchstopp A. Deman/Medizinische Poliklinik M. Liechti/Klinische Pharmakologie Tabakkonsum in Europa In den meisten europäischen Ländern konsumieren > 25 % der Einwohner Tabakprodukte Kartenlegende 40
Eine mögliche Ursache: Zöliakie auch bei Erwachsenen!
 Eine mögliche Ursache: Zöliakie auch bei Erwachsenen! Michael F., 37 Jahre, IT-Spezialist, mehrfache Besuche bei seinem Hausarzt... Beschwerden Verdacht Maßnahmen/ Labordiagnostik Ergebnis Therapie Ergebnis
Eine mögliche Ursache: Zöliakie auch bei Erwachsenen! Michael F., 37 Jahre, IT-Spezialist, mehrfache Besuche bei seinem Hausarzt... Beschwerden Verdacht Maßnahmen/ Labordiagnostik Ergebnis Therapie Ergebnis
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Ohne Zusatznutzen keine Verordnung! Stimmt das?
 Ohne Zusatznutzen keine Verordnung! Stimmt das? Kassenärztliche Vereinigung Hessen Dr. med. Wolfgang LangHeinrich 27. Mai 2015 Ohne Nutzen keine Verordnung? Ohne Mehrnutzen keine Verordnung? Ja Jein Nein
Ohne Zusatznutzen keine Verordnung! Stimmt das? Kassenärztliche Vereinigung Hessen Dr. med. Wolfgang LangHeinrich 27. Mai 2015 Ohne Nutzen keine Verordnung? Ohne Mehrnutzen keine Verordnung? Ja Jein Nein
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie
 AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
NEPHROTISCHES SYNDROM
 NEPHROTISCHES SYNDROM Dr. med. Peter Igaz PhD Klinik II. der Inneren Medizin Medizinische Fakultät Semmelweis Universität Definition Proteinurie >3.5g/24 h/1.73 m 2, in der Praktik: >3.5 g/24 h. Mikroalbuminurie:
NEPHROTISCHES SYNDROM Dr. med. Peter Igaz PhD Klinik II. der Inneren Medizin Medizinische Fakultät Semmelweis Universität Definition Proteinurie >3.5g/24 h/1.73 m 2, in der Praktik: >3.5 g/24 h. Mikroalbuminurie:
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Venosin retard 50 mg - Kapseln. Wirkstoff: Trockenextrakt aus Rosskastaniensamen.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Venosin retard 50 mg - Kapseln Wirkstoff: Trockenextrakt aus Rosskastaniensamen. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Venosin retard 50 mg - Kapseln Wirkstoff: Trockenextrakt aus Rosskastaniensamen. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung
 Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Besonders Ältere profitieren von Celebrex -Therapie
 Antiphlogistische Schmerztherapie Besonders Ältere profitieren von Celebrex -Therapie Bremen (21. November 2012) Bei der Behandlung von Rheumapatienten steht die Schmerzreduktion und der Erhalt der Alltagsfunktionen
Antiphlogistische Schmerztherapie Besonders Ältere profitieren von Celebrex -Therapie Bremen (21. November 2012) Bei der Behandlung von Rheumapatienten steht die Schmerzreduktion und der Erhalt der Alltagsfunktionen
Tinnitus nicht mehr hören. Apotheken-Service für Gesundheit und Wohlbefinden
 Tinnitus nicht mehr hören Apotheken-Service für Gesundheit und Wohlbefinden Das sollten Sie wissen Unter Tinnitus versteht man ein permanentes Ohrgeräusch, das als dauerhaftes Pfeifen oder Summen beschrieben
Tinnitus nicht mehr hören Apotheken-Service für Gesundheit und Wohlbefinden Das sollten Sie wissen Unter Tinnitus versteht man ein permanentes Ohrgeräusch, das als dauerhaftes Pfeifen oder Summen beschrieben
Einfluss einer Niereninsuffizienz auf die Korrelation von NTproBNP mit dem Schweregrad der Herzinsuffizienz
 Einfluss einer Niereninsuffizienz auf die Korrelation von NTproBNP mit dem Schweregrad der Herzinsuffizienz Dr. Andreas Rieth, et al, Bad Nauheim Hintergrund: Der Biomarker NTproBNP ist für die Diagnostik
Einfluss einer Niereninsuffizienz auf die Korrelation von NTproBNP mit dem Schweregrad der Herzinsuffizienz Dr. Andreas Rieth, et al, Bad Nauheim Hintergrund: Der Biomarker NTproBNP ist für die Diagnostik
Gebrauchsinformation: Information für den Anwender. Terbinafin-CT 1 % Creme. Wirkstoff: Terbinafinhydrochlorid
 Gebrauchsinformation: Information für den Anwender Terbinafin-CT 1 % Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Gebrauchsinformation: Information für den Anwender Terbinafin-CT 1 % Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Update Antihypertensiva
 Update Antihypertensiva Dr. med. Markus Diethelm 26.11.2015 Blutdruck-Zielwerte für Europa ESC/ESH 2004 2007 2013 < 140/90 < 140/90 < 140/90 Vaskuläre Erkrankung* < 130/80 < 130/80 < 140/90 Diabetes mellitus
Update Antihypertensiva Dr. med. Markus Diethelm 26.11.2015 Blutdruck-Zielwerte für Europa ESC/ESH 2004 2007 2013 < 140/90 < 140/90 < 140/90 Vaskuläre Erkrankung* < 130/80 < 130/80 < 140/90 Diabetes mellitus
MENINGOKOKKEN- MENINGITIS:
 MENINGOKOKKEN- MENINGITIS: Wie Sie Ihr Kind schützen können Was Sie über die Meningokokokken-Erkrankung und die verschiedenen Schutzimpfungen wissen sollten Die Produktion dieses Materials wurde durch
MENINGOKOKKEN- MENINGITIS: Wie Sie Ihr Kind schützen können Was Sie über die Meningokokokken-Erkrankung und die verschiedenen Schutzimpfungen wissen sollten Die Produktion dieses Materials wurde durch
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. MOXON 0,4 mg Filmtabletten Moxonidin
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MOXON 0,4 mg Filmtabletten Moxonidin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MOXON 0,4 mg Filmtabletten Moxonidin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation. Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen
 Gebrauchsinformation Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung erhältlich.
Gebrauchsinformation Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung erhältlich.
Diabetische Neuropathie Praxisgerechte Umsetzung der Leitlinien
 Diabetische Neuropathie Praxisgerechte Umsetzung der Leitlinien Univ. Prof. Dr. med. Jochen Seufert, FRCPE, Freiburg Dreseden (1. Juni 2011) - Die diabetischen Neuropathien können neben den Veränderungen
Diabetische Neuropathie Praxisgerechte Umsetzung der Leitlinien Univ. Prof. Dr. med. Jochen Seufert, FRCPE, Freiburg Dreseden (1. Juni 2011) - Die diabetischen Neuropathien können neben den Veränderungen
Celgene GmbH Joseph-Wild-Straße München. Telefon: (089) PRESSEMITTEILUNG
 Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
