UNTERSUCHUNGEN ZUR POSTPARTALEN INVOLUTION UND REGENERATION DES REPRODUKTIONSTRAKTES BEIM SCHWEIN BARBARA BUSCH
|
|
|
- Michael Sommer
- vor 6 Jahren
- Abrufe
Transkript
1 UNTERSUCHUNGEN ZUR POSTPARTALEN INVOLUTION UND REGENERATION DES REPRODUKTIONSTRAKTES BEIM SCHWEIN BARBARA BUSCH INAUGURAL-DISSERTATION zur Erlangung des Doktorgrades beim Fachbereich Veterinärmedizin der Justus-Liebig-Universität Gießen édition scientifique VVB LAUFERSWEILER VERLAG
2 Das Werk ist in allen seinen Teilen urheberrechtlich geschützt. Jede Verwertung ist ohne schriftliche Zustimmung des Autors oder des Verlages unzulässig. Das gilt insbesondere für Vervielfältigungen, Übersetzungen, Mikroverfilmungen und die Einspeicherung in und Verarbeitung durch elektronische Systeme. 1. Auflage 2007 All rights reserved. No part of this publication may be reproduced, stored in a retrieval system, or transmitted, in any form or by any means, electronic, mechanical, photocopying, recording, or otherwise, without the prior written permission of the Author or the Publishers. st 1 Edition by VVB LAUFERSWEILER VERLAG, Giessen Printed in Germany VVB LAUFERSWEILER VERLAG édition scientifique STAUFENBERGRING 15, D GIESSEN Tel: Fax: redaktion@doktorverlag.de
3 Aus der Klinik für Geburtshilfe, Gynäkologie und Andrologie der Groß- und Kleintiere mit Tierärztlicher Ambulanz der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. Dr. h.c. mult. H. Bostedt und aus dem Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. S. Hoy und aus dem Institut für Veterinär-Anatomie, -Histologie und -Embryologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. Dr. h.c. R. Leiser Untersuchungen zur postpartalen Involution und Regeneration des Reproduktionstraktes beim Schwein INAUGURAL-DISSERTATION zur Erlangung des Doktorgrades beim Fachbereich Veterinärmedizin der Justus-Liebig-Universität Gießen eingereicht von Barbara Busch Tierärztin aus Lippstadt Gießen, 2007
4 Mit Genehmigung des Fachbereiches Veterinärmedizin der Justus-Liebig-Universität Gießen Dekan: Prof. Dr. M. Reinacher 1. Berichterstatter: Prof. Dr. Dr. h.c. mult. H. Bostedt 2. Berichterstatter: Prof. Dr. Dr. habil. G. Reiner Tag der mündlichen Prüfung:
5 Meinen Eltern und Geschwistern in Liebe und Dankbarkeit gewidmet
6
7 1. EINLEITUNG 3 2. LITERATURÜBERSICHT Anatomie und Histologie des weiblichen Reproduktionstraktes der Sau Morphologie der Vulva, der Vagina und der Cervix Morphologie des Uterus und das zyklische Geschehen im Endometrium Morphologie und Funktion der Salpinx Morphologie des Ovars und dessen zyklische Varianz Ovarmorphologie intra und post lactationem Laktationsanöstrus Involution und Reorganisation des Uterus post partum Die hormonelle Interaktion im postpartalen Reproduktionsgeschehen EIGENE UNTERSUCHUNGEN Material Auswahl der landwirtschaftlichen Betriebe Auswahl des Tierkollektives Einteilung der Gruppen Methoden Methode zur Gewinnung des Untersuchungsgutes Makroskopische Untersuchung am frischen Präparat Verarbeitung des histologischen Materials Mikroskopische Untersuchungen Weiterführende histologische Verarbeitung Statistische Auswertung Ergebnisse Vulva Vagina Cervix Uterus Salpinx Ovar DISKUSSION ZUSAMMENFASSUNG SUMMARY 158 1
8 7. ANHANG Befundbögen Tabellen LITERATUR 190 2
9 1. Einleitung Die Schweinehaltung hat in den letzten Jahren infolge veränderter Rahmenbedingungen an Bedeutung wieder zugenommen. Dank prophylaktischer und metaphylaktischer Maßnahmen steht der Hygiene- und Gesundheitsstatus auf hohem Niveau, abgesehen von nicht vorhersehbaren Seuchen- und Krankheitseinbrüchen. Grundlage der modernen Schweinezucht stellt die Reproduktionsrate pro Zeiteinheit dar, da nur so eine dauerwährende Rentabilität der Bestände zu gewährleisten ist. Hier überschneiden sich verschiedene Faktoren, welche die Ökonomie in unterschiedlichem Maß beeinträchtigen. Eine Steigerung der Reproduktionsleistung kann auf verschiedene Weise erreicht werden. Zum einen wären die vorhandenen Ressourcen zu nutzen, in dem die Ferkelverluste zuerst bei der Geburt (Schulz et al., 1983; Rudloff und Bostedt, 1984; Stratmann, 2004; Udluft, 2004) und in der folgenden ersten und zweiten Adaptationsperiode zu reduzieren sind (Kolb, 2001; Wehrend, 2003). Echte und nachhaltige Fortschritte konnten auf diesem Gebiet durch die prophylaktischen Impfund nutritiven Ergänzungsverfahren sowie eine gewährleistete Kolostrumaufnahme erreicht werden. Beachtliche Erfolge waren in den letzten Jahren vor allem zu erzielen, indem die Physiologie der neonatalen Periode einer weiteren Bearbeitung unterzogen wurde und die Aufzuchtbedingungen wirksam verbessert wurden (Hoy, 2002). 3
10 Es hat zum anderen auch nicht an Versuchen gefehlt, die Ferkelzahl pro Wurf zu steigern oder aber die Abstände zwischen den Paritäten zu verkürzen, um die Zahl geborener und aufgezogener Ferkel pro Muttertier im Jahresverlauf zu steigern. Verschiedene Verfahren sind dazu entwickelt worden, wie beispielsweise die temporäre Unterbrechung der Laktation (Cole, 1972; Kraetzl et al., 1998; Kress et al., 1998; Wechsler, 1998) oder das Frühabsetzen der Jungtiere (Warnick et al., 1950; Self und Grummer, 1958; Crighton und Lamming, 1969; Smidt et al., 1969; Svajgr et al., 1974; Bogner et al., 1975; Marx und Hoepfner, 1976) sowie eine hormonelle Unterstützung der Brunst (Cole und Hughes, 1946; Heitmann und Cole, 1956; Kirkpatrick et al., 1965; King, 1974; Marx und Hoepfner, 1976; Holtz, 1977; Schumm et al., 1981). Für die letztgenannten Methoden bestehen jedoch limitierende Faktoren. Sie begründen sich zum einen in der Länge und Ausprägung der postpartalen Regressions- und Involutionsvorgängen des Uterus, insbesondere in der postpartalen Reorganisation des Endometriums. Zum anderen ist es aber der Wiedereintritt der ovariellen, zyklischen Funktionalität nach Absetzen der Ferkel, der hier ein Problem darstellt. Die Kenntnisse über die postpartalen Abläufe beim Schwein sind erstaunlicherweise noch nicht umfassend, welche aber letztlich die Grundlage für die Entwicklung biotechnischer Verfahren bilden würden. Die wissenschaftliche Bearbeitung dieses Themas stagniert nach den Ansätzen einer Klärung von Palmer et al. (1965), Elze et al. (1975) sowie Kudlac und Groch (1979). Sie ist es aber, die die Voraussetzung für weitere zuchthygienische Überlegungen hinsichtlich der Frage nach einer frühestmöglichen züchterischen Nutzung von Schweinen in der postpartalen Zeit darstellt. 4
11 Ziel dieser Untersuchung ist es deshalb, den möglichst genauen Zeitpunkt zu eruieren, zu dem die Involutions-, Regressions- und Regenerationsvorgänge bei einer gesunden, laktierenden Sau abgeschlossen sind, um so die Länge der postpartalen Periode bis zur Wiederherstellung praegravider Zustände exakter als bisher terminieren zu können. 5
12 2. Literaturübersicht 2.1. Anatomie und Histologie des weiblichen Reproduktionstraktes der Sau Morphologie der Vulva, der Vagina und der Cervix Die Vulva umschließt das Vestibulum vaginae mit den Labia vulvae und der Klitoris. Ihr Epithelium stratificatum squamosum non cornificatum sitzt mit einem ausgeprägten Papillarkörper dem der Lamina propria unterlagerten, lockerelastischen Bindegewebe auf. Er dient der Stabilität. Dieses Epithel beinhaltet eine große Anzahl lymphozytärer Infiltrate. Die Muskulatur setzt sich, bestehend aus glatten Faserbündeln, im Vestibulum fort, ihre äußere Schicht wird teilweise von quergestreifter Muskulatur der Musculi constrictores vestibuli durchzogen. Die Labia vulvae werden innenliegend von einem kutanen mehrschichtigen Plattenepithel überzogen, der äußere Teil wird vom Integumentum commune bedeckt, welches zahlreiche Talg- und Schweißdrüsen besitzt, jedoch nahezu haarlos ist. Kollagenes, elastisches Bindegewebe mit glatter und quergestreifter Muskulatur bildet die strukturelle Grundlage. Beim Schwein ist das Corpus clitoridis ca. 80 mm lang, es verläuft geschlängelt unter dem Vestibulum und verschwindet in der Fossa clitoridis, deren epitheliale Auskleidung mit der Epitheldecke des Spitzenteils der Klitoris vereint ist. Lediglich ein unscheinbares, kegelförmiges Ende stülpt sich aus dem Praeputium hervor. Der anatomische und histologische Aufbau der Vulva wurde auf der Grundlage der Publikationen folgender Autoren: Trautmann und Fiebiger (1949), Leiser (1999), Liebich (1999) sowie Priedkalns und Leiser (2006) geschildert. 6
13 An die Vulva schließt sich der schlauchförmige 12 bis zu 45 cm lange vestibulovaginale Bereich an (Döcke und Worch, 1963). In direkter Nachbarschaft vor dem Übergang zur Vagina mündet die lange Urethra mit ihrem Ostium urethrea externum und dem kleinen Diverticulum suburethrale. In Zweierreihen angeordnete, subepithelial gelegene Glandulae vestibulares minores enden mit ihren Ausführungsgängen und deren porenförmigen Öffnungen ebenfalls im Vestibulum. Letzteres ist cranial begrenzt mit einer 1-3 mm hohen Ringfalte, die besonders bei juvenilen Sauen ausgeprägt ist. Die Vagina endet cranial der Cervix, eine Portio vaginalis cervicis fehlt dem Schwein. Histologisch betrachtet besteht die Vagina aus dem lumenwärts gerichteten Oberflächenepithel, Epithelium stratificatum squamosum cornescens, der sich anschließenden Lamina propria mucosae, den beiden Muskelschichten Stratum circulare und longitudinale sowie der äußeren Tunica. Im retroperitonealen Bereich ist die Vagina von einer Tunica adventitia, im peritonealen Bereich des Cavum pelvis ist sie von einer lockeren Tunica serosa überzogen (Leiser, 1999). Das Oberflächenepithel besteht je nach Zyklusstand aus unterschiedlich vielen Zelllagen (3-25) (McKenzie, 1926; Busch, 1966). Auch im Zeitraum post partum variiert ihre Anzahl (2-8) (Palmer et al., 1965; Busch, 1966) Der anatomische und histologische Aufbau des vestibulo-vaginalen Bereichs wurde bearbeitet von den folgenden Arbeitsgruppen: Trautmann und Fiebiger (1949), Palmer et al. (1965), Busch (1966), Leiser (1999), Liebich (1999) sowie Priedkalns und Leiser (2006). Die Cervix uteri schließt sich cranial der Vagina an. Da die Portio vaginalis cervicis beim Schwein fehlt, beginnt der äußere Muttermund im Bereich der caudalsten Zervikalkissen, die in längsgerichteten Falten verstreichen. An der selben 7
14 Lokalisation wechselt das Plattenepithel der Vaginalschleimhaut zum Zylinderepithel. Im weiteren Verlauf des Zervikalkanals bildet es sich wieder zum Plattenepithel um (Schmaltz, 1912). In der Literatur wird diese Ansicht nicht einheitlich vertreten. Eine Differenzierung zwischen Zylinder- und Plattenepithel nahmen Heinonen (1914) und Libal (1990) vor. Zilientragende Zellen wurden ebenfalls nachgewiesen (Hafez et al., 1975; Duenbostel und Paufler, 1983). Die Schleimhaut ist drüsenfrei, sie besitzt jedoch hohlzapfenartige Vertiefungen mit schleimbildenden Zellen (Schmaltz, 1912; Grau, 1960; Leiser, 1999). Das Epithelium pseudostratificatum columnare begrenzt die Schleimhaut, die sich in Primär-, Sekundär- und Tertiärfalten aufzweigt. Die schleimsezernierende Oberfläche wird so vergrößert. Als Besonderheit beim Schwein bilden diese Falten, in ihrem Stroma bestehend aus dichten, scherengitterartig-verlaufenden Muskelfasern, die polsterförmigen derb-beschaffenen Pulvini cervicalis. Das innenliegende Stratum circulare der Tunica muscularis verschließt das Cervixlumen vollständig und ist deutlich kräftiger als das außen anliegende Stratum longitudinale (Leiser, 1990). Zusätzlich sind hier in den Pulvini elastische bindegewebige Fasern eingelagert, die nach der Geburt einen schnelleren Verschluss der Cervix garantieren (Grau, 1960; Leiser, 1990). Eine zusätzliche Längsmuskelschicht zwischen Lamina propria und der Ringmuskelschicht wurde von Schmaltz (1912) und Rigby (1967) beschrieben. Diese innere Längsmuskelschicht ist nach Schmaltz (1912) umfangreicher als die äußere, nach Rigby (1967) soll sie hingegen nur aus wenigen Muskelfasern bestehen. Äußerlich wird die Cervix vom Serosaepithel bedeckt. Der Übergang von der Cervix zum Corpus uteri, das Ostium uterinum internum, verläuft kontinuierlich mit der Längsmuskelschicht (Westermayer, 1958). Der Funktionsbereich der Cervix ist sehr vielfältig und zyklusabhängig. Im Östrus öffnet sie sich und sezerniert klares, dünnflüssiges Brunstsekret, bestehend aus 8
15 sauren und neutralen Proteoglykanen und erleichtert so das Vordringen der Spermien. Unter dem Einfluss von Progesteron während der Corpus luteum periodicum- beziehungsweise graviditatis-phase schließt sich die Cervix. Ein zäher Schleimpfropf macht ein Durchdringen von Infektionserregern unmöglich. Zum Zeitpunkt der Geburt öffnet sie sich weit, um die Passage der Feten zu ermöglichen. Ihre erhöhte Dehnbarkeit kommt durch einen massiven Abbau von Kollagen und Glykosaminoglykanen zustande (Huszar und Naftolin, 1984). Der anatomische und histologische Aufbau der Cervix wurde dargestellt nach Veröffentlichungen folgender Arbeitsgruppen: Schmaltz (1912), Trautmann und Fiebiger (1949), Westermayer (1958), Grau (1960), Rigby (1967), Leiser (1999), Liebich (1999) sowie Priedkalns und Leiser (2006) Morphologie des Uterus und das zyklische Geschehen im Endometrium Das Corpus uteri steht über die paarigen Cornu uteri mit den Tubae uterinae strukturell und funktionell in Verbindung und wird durch die Cervix von Vagina und Vulva getrennt. Es beherbergt die Konzepti in den embryonalen und fetalen Entwicklungsstadien bis zur Geburt. Seine Wandschichten bestehen aus Endometrium, Myometrium und Perimetrium (Übersicht Ellenberger und Günther, 1908). Mikroskopisch-anatomisch differenziert sich das Endometrium in ein Oberflächenepithel und eine Tunica propria mucosae. Eine Submucosa fehlt grundsätzlich. 9
16 Sehr unterschiedlich wird das Oberflächenepithel einzelner Publikationen beschrieben: geschichtet (Trautmann und Fiebiger, 1931), zwei bis dreischichtig (Schmaltz, 1921) und mehrreihig (Fabian, 1960; Prehn, 1963; Reichenbächer, 1963; Kuschma, 1980; Sidler et al., 1986). Die zylindrische Form der Epithelzellen ändert sich im jeweiligen Geschlechtszyklus (Corner, 1921). Von einem einschichtig bis mehrreihig hochprismatischen Oberflächenepithel (Epithelium pseudostratificatum columnare) wird in neueren Veröffentlichungen gesprochen (Fabian, 1960; Prehn, 1963; Reichenbächer, 1963; Kuschma, 1980; Sidler et al., 1986). Dem Oberflächenepithel schließt sich die drüsenreiche Tunica propria mucosae an: eine schmale Schicht dem Stratum cellulare, dann das Stratum reticulare und das Stratum fibrillare (Böhme, 1909; Corner, 1921; Schmaltz, 1921). Alle drei Schichten bestehen aus retikulärem Bindegewebe (Trautmann und Fiebiger, 1949). Das Stratum cellulare ist sehr zellreich. Deutlich weniger Zellen hat das Stratum reticulare, hier überwiegt ein dichtes Netzwerk von Bindegewebsfasern, während das Stratum fibrillare sein lockeres fibrilläres Bindegewebe gegen das angrenzende Myometrium ausrichtet (Ellenberger und Günther, 1908). Corner (1921) und Seiferle (1933) verwenden eine andere Einteilung der Schichten, welche die Beschaffenheit der Drüsen als Kriterium herausstellt: Das Stratum superficiale besteht aus wenigen, großlumigen Drüsen (15 bis 25 µm) mit zytoplasmareichen Zellen und zahlreichen Zilienzellen. Hingegen befinden sich im 10
17 Stratum profundum viele kleinlumigere, zytoplasmaarme Drüsen (12 bis 18 µm) und nur wenige Zilienzellen. Die Uterusdrüsen sind in der Hornmitte am häufigsten anzutreffen und nehmen cervixwärts ab (Corner, 1921; Fabian, 1960; Kuschma, 1980). Sie entwickeln sich zu verzweigten, tubulösen Schläuchen, deren Drüsenepithel einschichtig kubisch bis hochprismatisch erscheint und mit Zilien ausgestattet ist (Ellenberg und Günther, 1908; Stegu, 1912). Im Endometrium sind die Drüsenschläuche, je nach Zyklusstand, mehr oder weniger geschlängelt mit einer eher gestreckten und trichterförmigen Mündung im Durchmesser von µm (Trautmann und Fiebiger, 1949; Mehlhorn, 1975; Kuschma, 1980). Im Myometrium enden die Drüsen in Nischen, 10 bis 15 µm im Lumendurchmesser als kleine Knäule (Böhme, 1909; Trautmann und Fiebiger, 1949). Im Folgenden sei das zyklische Geschehen des Endometriums beschrieben. Das Endometrium ist im Laufe des Geschlechtszyklus einem hormonellen Regelkreis von Hypothalamus, Hypophyse und Ovarien unterworfen (Henricks et al., 1972; Wu et al., 1976; Geisinger et al., 1979; Kuschma, 1980). Die follikogenen Östrogene dominieren zur Zeit des Proöstrus und Östrus, in den übrigen Zyklusphasen überwiegen die luteogenen Gestagene (Fabian, 1960; Reichenbächer, 1963; Bazer, 1975). Zyklusunterschiede werden besonders deutlich bei der lumenseitigen Faltenbildung. Im Östrus (1. Tag) und Metöstrus ( Tag) sind die Primärfalten besonders hoch, im Diöstrus ( Tag) bilden sich zusätzlich Sekundär- und Tertiärfalten, die Faltenhöhe nimmt dabei aber deutlich ab, sie steigt erst wieder zum Proöstrus an 11
18 ( Tag) (Corner, 1921; Fabian, 1960; Sidler et al., 1986). Die Faltenbildung variiert kaum altersbedingt und nur wenig in verschiedenen Uterusregionen. Die Oberflächenepithelhöhe ändert sich ebenfalls zyklisch bedingt, nur finden sich hier in der Literatur erheblich voneinander abweichende Daten: In älteren Publikationen wurden die vom Östrusbeginn ansteigenden Maximalhöhen, bei Corner (1921) sowie Steinbach und Smidt (1970) am 4. Tag, bei Mehlhorn et al. (1975) am 5. Tag und bei Fabian (1960) sogar erst am 7. oder 8. Tag beschrieben. Sidler et al. (1986) hingegen ermittelten eine Epithelhöhe von µm zum Östrusbeginn und eine Maximalhöhe bereits am 3. Zyklustag von µm. Eine Verkürzung auf minimal µm am 12. Tag wurde übereinstimmend von Corner (1921), Fabian (1960) und Sidler et al. (1986) gemessen. Dieses Minimum ist erst am Tag erreicht, meinten Prehn (1963), Reichenbächer (1963) sowie Mehlhorn et al. (1975). Eine gleichbleibende Minimalhöhe bis zum 14. Tag beobachteten Fabian (1960) und Kuschma (1980). Nach Corners (1921) Untersuchungen ändert sich diese erst zum Proöstrus. Eine Erklärung für diese Differenzen könnte der nicht übereinstimmend definierte Zyklusbeginn (Geisinger et al., 1979) und/oder methodisch bedingte Unterschiede in der Gewebsaufbereitung (Sidler et al., 1986) sein. Variabel ist auch die Form der Oberflächenepithelzellen in direktem Zusammenhang mit der Höhe. Im Metöstrus erscheint sie extrem hochprismatisch, zur Zeit des Diöstrus isoprismatisch (Sidler et al., 1986). Ebenfalls dem zyklischen Wechsel unterworfen sind die Pseudokrypten. Vom Metöstrus bis zum Diöstrus sind sie am tiefsten und zahlreichsten, die darunter liegenden Epithelzellen sind bis zur Hälfte niedriger als diejenigen der Umgebung (Corner, 1921; Prehn, 1963; Reichenbächer, 1963; Sidler et al., 1986). 12
19 Die im Schweineendometrium relativ selten vorkommenden Drüsen sind in der Hornmitte am häufigsten (Corner, 1921; Fabian, 1960; Kuschma, 1980). Im Östrus sind ihre Mündungen im Querschnitt rundlich aufgrund des Gewebsödems, im Diöstrus dagegen trichterförmig und in Richtung der Epithelfalten ausgerichtet. In Korrelation mit der Sexualaktivität steht die Epithelhöhe der Drüsen. Minimal steigt sie im späten Diöstrus mit einem Pik um den Proöstrus bis zum mittleren Diöstrus an und fällt dann sehr schnell ab. Die Epithelhöhe der Drüsen schwankt nicht identisch mit derjenigen des Oberflächenepithels (Corner, 1921; Fabian, 1960; Kuschma, 1980; Sidler et al., 1986). Die Drüsenschlängelung ist im frühen bis mittleren Diöstrus am höchsten, im späten Diöstrus, Proöstrus und Östrus ist sie kaum erkennbar. An dieser Stelle könnten noch viele andere morphologische Untersuchungsparameter, die dem zyklischen Geschehen im Schweineendometrium unterworfen sind, aufgezählt werden (Übersicht Sidler et al., 1986). Besonders erwähnenswert sind hier die Ödembildung und die Anzahl der Abwehrzellen im Stroma. Beide Charakteristika sind im Östrus am höchsten ausgeprägt und nehmen dann bis zum mittleren Diöstrus ab, um danach wieder anzusteigen (Sidler et al., 1986) Morphologie und Funktion der Salpinx Die Salpinx ist ein paariges, schlauchförmiges Organ, das mit dem Ostium uterinum tubae am jeweiligen linken oder rechten Cornu uteri beginnt. Einem ersten engen Abschnitt, dem Isthmus tubae uterinae, schließt sich dann cranialwärts ein weitlumigerer zweiter, die Ampulla tubae uterina, an, welche mit dem Ostium abdominale in der Nähe des Ovars mündet und als Flimmerkranz ein Infundibulum 13
20 bildend, endet, wobei dieser Kranz das Ovar zusammen mit der Innenfläche der Mesosalpinx umfasst (Leiser, 1990; Liebich, 1999). Zyklusabhängige Umbauvorgänge der Salpinx gewährleisten optimale Stoffwechselbedingungen zuerst für die Kapazitation der Spermien und deren Wanderung im ganzen Eileiter, dann für die Oozyte in der Ampulla tubae, wo die Befruchtung stattfindet und für die Ernährung des Embryos während seiner ersten Entwicklung auf dem uteruswärts gerichteten Weg durch den Isthmus. Durch longitudinale Primär-, Sekundär- und Tertiärfalten der Schleimhaut wird die stoffwechselaktive Oberfläche in der Ampulle stark vergrößert. Die Tunica mucosa ist die innerste Schicht der Salpinx mit einem Epithelium simplex columnare, bestehend aus zwei unterschiedlichen Zellformen, den Flimmerzellen mit oberflächlichen Kinozilien und den Drüsenzellen (Jautze, 1968; Steinbach und Smidt, 1970). Letztere sezernieren einen sauren Schleim, der Proteine, Elektrolyte, Enzyme, Albumine, Zucker und Aminosäuren beinhaltet. Beide Zellformen unterliegen ständigen zyklischen Veränderungen (Jautze, 1968; Steinbach und Smidt, 1970; Stahlheim et al., 1975; Wu et al., 1976; Dyck, 1983). Mit rhythmischen Bewegungen der Kinozilien wird der aktive Flüssigkeitsstrom mit dem darinliegenden Keim unterstützt bis hin zum Uteruslumen. Nach der Befruchtung bleibt zunächst im distalen Abschnitt das Epithel noch sekretsaktiv. Diese Aktivität sistiert erst, wenn im Diöstrus die Implantation der Blastocyste stattgefunden hat. Kommt es zu keiner Gravidität setzt im zyklisch nachfolgenden Proöstrus die Sekretion wieder ein. Zusätzlich, als vermutlich inaktive Drüsenzellen nach Sekretabgabe oder als Übergangsform, von der Basalzelle zur ausgewachsenen Zelle, finden sich kleine Stiftchenzellen im Epithel. Sie haben einen pyknotischen Kern und ein dichtes Zytoplasma. Als Reservezellen dienen, der Basalmembran eng verbunden, die 14
21 Basalzellen (Liebich, 1999). Die Propria mucosa besteht aus einem zellreichen, kollagenen Bindegewebe, mit zahlreichen Blutgefäßen und Drüsen, deren Aktivität zyklisch variiert. Einstrahlende Muskelfasern verbinden sie mit der anliegenden Muskelschicht (Becze et al., 1982). Die Tunica muscularis ist je nach Wandabschnitt unterschiedlich stark entwickelt. Im Infundibulum und in der Ampulle sind die glatten Muskelfasern nur dünn und vor allem zirkulär verlaufend. Im Gegensatz dazu ist die Wandmuskulatur im Isthmus deutlich stärker, ihr Verlauf ist vorherrschend spiralig. In der Nachbarschaft der Tunica serosa des Isthmus tubae verlaufen longitudinale Muskelfasern. Ihr liegt innen ein starkes Stratum vasculare an. Zirkulär innen angeordnete Muskelfasern gehen fließend in das Stratum circulare der Uteruswand über, die äußeren longitudinalen strahlen dagegen mehr in das Stratum longitudinale des Uterus ein (Leiser, 1990 und 1999; Liebich, 1999) Morphologie des Ovars und dessen zyklische Varianz Die Ovarien erfüllen mit Beginn der Pubertät eine Doppelfunktion. Sie dienen zum einen der Entwicklung von Primordialfollikeln bis zum präovulatorischem Graaf schen-follikel und zum anderen werden in den Follikeln verschiedene Hormone wie Östrogene, Gestagene und Androgene synthetisiert, welche endokrin über Rückkoppelungsmechanismen die Funktion des Hypothalamus beziehungsweise der Adenohyphophyse zyklisch steuern (Crighton und Lamming, 1969; Stevenson et al., 1981; Duggan et al., 1982; Foxcroft und Hunter, 1985; Foxcroft et al., 1987). 15
22 Durch die unterschiedlichen Funktionskörper variiert die Außenansicht, die Größe und das Gewicht des Ovars im jeweiligen Entwicklungs- und Zyklusstand erheblich. Seine Konsistenz ist aber durchweg derbelastisch, seine Grundform annähernd halbrund und an einer Seite y-förmig eingekerbt. Bei geschlechtsreifen Tieren haben die Ovarien überwiegend ein traubenförmiges Aussehen. Follikel in verschiedenen Stadien, Ovulationsgruben, Corpora lutea und narbige Einziehungen wechseln sich ab oder sind gleichzeitig zu finden (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Becze et al., 1982; Leiser et al., 1988; Leiser, 1990 und Leiser, 1999). Das Epithelium superficiale überzieht das Ovar von außen. Es ist isoprismatisch, einschichtig und setzt sich im Peritonealepithel fort. Diesem Epithel unterlagert ist die gefäßarme, faserreiche Tunica albuginea. Sie setzt sich direkt mit der angrenzenden Zona parenchymatosa in Verbindung. Das Ovar ist in zwei Bereiche unterteilt, zum einen in die zentrale gefäß- und nervenführende Zona vasculosa oder Mark und zum anderen in die aus spinozellulärem Bindegewebe und stoffwechselaktiven, stromazellenreichen Zona parenchymatosa oder Rinde (Leiser, 1990). Im Hilus ovarii ist die Gefäßpforte für die Zona vasculosa. Die Gefäße verlaufen hier geschlängelt und gehen als Netzwerk in die außenliegenden Zona parenchymatosa über, welche so mit Blut versorgt wird. Ständig werden diese Kapillargeflechte umgebaut, ihre Funktion wird mit Hilfe von Sperrarterien und arteriovenösen Anastomosen sensibel gesteuert und durch vegetative Nervenfasern innerviert. Lymphbahnen verlassen das Ovar am Hilus. Die strukturelle Grundlage der Zona parenchymatosa sind die Stromazellen. Stoffwechselaktiv und fibrozytenähnlich besitzen diese eine hohe Regenerationsfähigkeit, eine hohe Teilungsrate und die Möglichkeit zur Phagozytose. Zum Teil transformieren sie sich im Corpus luteum zu epitheloiden, hormonproduzierenden Zellen (Thecaluteinzellen) und werden nach dessen Abbau 16
23 wieder zu Stromazellen. Die Zona parenchymatosa enthält Ovozyti, welche mit dem sie einschließenden Epithel Follikel in verschiedenen Entwicklungen bildet (Leiser, 1999; Priedkalns und Leiser, 2006). Die Follikel werden in verschiedenen Stadien Primordial-, Primär-, Sekundär-, Tertiär- und Graaf sche Follikel unterteilt (Übersicht bei Liebich, 1999). Der sich im Ruhestadium befindende Primordialfollikel besteht aus der primären Oozyte mit einem Durchmesser von 30 µm. Die Oozyte wird umgeben von einer Schicht abgeplatteter, undifferenzierter Follikelzellen und außen von lockerem Bindegewebe. Die Oozyte besitzt zahlreiche Golgi-Felder, Mitochondrien, Ribosomen, Endoplasmatisches Retikulum und einen exzentrischen Kern mit einem Kernkörperchen. Aktiviert wandelt sich der Primordialfollikel zum Primärfollikel, der eine einschichtige isoprismatische Schicht von Follikelzellen besitzt. Die Oozyte nimmt an Volumen zu. Durch die mitotische Teilung entsteht dann der Sekundärfollikel mit einer kugeligen Oozyte von ca. 80 µm Durchmesser und der charakteristischen Zona pellucida, die sich feinfibrillär, glykoproteinreich im perivitellinen Raum mit einer Dicke von µm zwischen der Oberfläche der Oozyte und den anliegenden geschichteten Follikelzellen entwickelt. Die außen am Follikelepithel anschließenden Stromazellen differenzieren sich zur Theca follicularis. Das Wachstum der Oozyte ist im Sekundärfollikel bereits weitgehend abgeschlossen. In der Oozyte setzt feinmikroskopisch eine strukturelle Differenzierung des Zytoplasmas ein. Stoffwechselaktive Organellen der Proteinbiosynthese nehmen zu. Die Golgi-Apparate erweitern sich. Kortikale Granula häufen sich unter dem Plasmalemm und die Zelloberfläche stülpt sich unregelmäßig durch kleinste Fortsätze aus. Durch die Zona pellucida ziehen Fortsätze der coronaradiata, der innersten Schicht der Follikelzellen, die über Desmosomen, später 17
24 zusätzlich über Nexus, mit der Oozyte in Verbindung stehen. Sie gewährleisten die Stoffwechselversorgung. Die vorrangige Aufgabe der Zona pellucida ist die Gewährleistung, dass ausschließlich artspezifische Spermien penetrieren können und dass weiterhin eine Polyspermie und die vorzeitige Implantation der Blastocyste in der Tuba uterina verhindert wird. Gleichzeitig reguliert sie die nutritive Versorgung und stabilisiert den Follikel. In diesem Stadium ist erstmals eine Differenzierung der Follikelzellen in innere Coronaradiatazellen, mittlere Intermediärzellen und äußere Basalzellen zu erkennen. Die beginnende Proliferation der Follikel beim Schwein findet im mittleren Metöstrus (3. Zyklustag) bis zum frühen Diöstrus (5. Zyklustag) statt. Es werden fast ausschließlich Follikel mit einem Durchmesser von 2-4 mm ausgebildet. Sie sind dickwandig, prall gefüllt und ihre Farbe ist gleichmäßig grauweiß ohne Vaskularisierung. Die weitere Follikelreifung stagniert zwischen dem Zyklustag nahezu vollständig (Schnurrbusch et al., 1975a, b; Kudlac und Groch, 1979; Leiser et al., 1988). Doch dann im späten Diöstrus ( Zyklustag) differenziert sich die Follikulogenese. Ein morphologischer und biochemischer Wettkampf beginnt. Während zahlreiche kleine Follikel rapide atresieren, unterstützen sie mit ihren freigesetzten Östrogenen die dominanten Follikel in ihrer Proliferation (Robinson et al., 1951; Clark et al., 1982; Britt et al., 1985). Dieses Phänomen ist bei Polytoccous-Spezies anders als bei solchen mit Einlingen. Bei Letzteren tritt bei gleichzeitigem Follikelwachstum ein eher gegenseitiges Konkurrenzverhältnis auf, aber niemals eine gegenseitige Begünstigung. Eine hohe periphere Konzentration von Ovarsteroiden ist eine Voraussetzung für die vermehrte Follikelreifung. Die Fähigkeit eines Follikels, Östradiol zu bilden und die Möglichkeit seiner Granulosazellen, es zu nutzen, entscheidet, ob er wächst oder atresiert. Die Anzahl dieser Zellen ist dabei nicht ausschlaggebend. Mit dem proportionalen 18
25 Wachstum der Granulosazellen werden vermehrt FSH- und Östrogen Rezeptoren gebildet. Die eigene Östradiolproduktion wird gesteigert (tierartlich übergreifend zusammengetragen von Foxcroft und Hunter, 1985). Das exogene GnRH fördert das Follikelwachstum ebenfalls, interne und externe Ovarfaktoren hemmen es auch wieder (Foxcroft und Hunter, 1985). Gleichzeitig sind Prolaktinrezeptoren im lutealen und granularen Ovargewebe zu finden, ihre Anzahl dominiert in kleineren Follikeln (Rolland et al., 1976; Veldhuis et al., 1980). Tertiärfollikel entwickeln sich aus Sekundärfollikeln, wenn sich die Interzellularräume zwischen den Intermediärzellen erweitern und damit das mit Hyaluronsäure und proteinreichem Liquor gefüllte Antrum folliculare entsteht. Neben dem Antrum folliculare charakterisiert den Tertiärfollikel auch die Zelldifferenzierung der Follikelwand, mit vielschichtigen Granulosazellen und die Bildung des Cumulus oophorus. Nur eine einzige Lage hochprismatischer Follikelzellen, die außen der Zona pellucida anliegt, bildet die Corona radiata, identisch wie bei den Sekundärfollikeln. Radiär angeordnet durchziehen schmale Zytoplasmafortsätze dieser Follikelzellen die Zona pellucida und gewährleisten die weitere nutritive Versorgung der Oozyte. Dieses Gebilde ist Bestandteil des Cumulus oophorus, der exzentrisch im Antrum folliculare liegt und aus Coronaradiata-, Intermediär- und Basalzellen besteht. Er steht mit der Granulosazellschicht der Follikelwand in Verbindung, die mehrschichtig ist und gleichzeitig auch das Antrum folliculare auskleidet. Diese modifizierten Follikelzellen synthetisieren den proteinreichen, hormonhaltigen Liquor follicularis. Ihre mittlere Wandschicht, die Intermediärzellen, dienen dem Stoffwechseltransport, während die der Basalmembran anliegenden Basalzellen, zusätzlich zum Stoffwechselmetabolitentransport, der Synthese von Östrogenen aus Androgenen in ihrem endoplasmatischen Retikulum obliegen. Die Androgene sind zuvor in den 19
26 epitheloiden Stromazellen der benachbarten Theca follicularis interna synthetisiert worden (Liebich, 1999). In dieser differenzierten Theca follicularis interna befinden sich entsprechend ihrer endokrinen Funktion im Plasma der Zellen Mitochondrien vom Tubulus-Typ, ein glattes endoplasmatisches Retikulum und Lipidvakuolen. Sie ist stark vaskularisiert und wird von einem dichten Kapillarnetz umgeben. Der Übergang zur Theca follicularis externa ist fließend. Letztere ist überwiegend aus zellreichem Bindegewebe aufgebaut. Im Hinblick auf den Zyklus beginnt das verstärkte Follikelwachstum mit dem Proöstrus ( Zyklustag). Die wachsenden Ovarfollikel sind durchschnittlich nun 6 8 mm groß. Sie sind prall gefüllt mit einer gelbrötlich-serösen Flüssigkeit (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Leiser et al., 1988). In den Thecazellen sind vermehrt LH Rezeptoren entstanden. Ihre Anzahl steigt mit dem Follikelwachstum kontinuierlich an. Ihr Maximum ist am 20. Zyklustag erreicht. Die Granulosazellen können erst zeitlich versetzt vermehrt FSH binden. Aber auch ihr Rezeptormaximum befindet sich am 20. Zyklustag (Foxcroft und Hunter, 1985). Die Follikelflüssigkeit, mit einer erhöhten Konzentration von Östradiol (E 2 ), steigt ab dem 17. Zyklustag, also bevor die hohe LH-Bindung stattfindet (Hunter et al., 1976). E 2 induziert die LH-Rezeptorbildung mit (Daguet, 1979). Gleichzeitig verstärkt Östradiol den stimulierenden Effekt von FSH auf die Steroidproduktion in den Granulosazellen beim Schwein (Veldhuis et al., 1980). Zusätzlich können FSH zusammen mit Insulin, Cortisol und Thyroxine die Synthese von LH-Rezeptoren in den Granulosazellen fördern. Dies geschieht aber nur in kleinen Follikeln (1-2 mm) (Loeken et al., 1985). Die ovarielle Steroidsynthese wird beim Schwein als Zwei-Zellen -Theorie bezeichnet (Evans et al., 1981; Haney und Schomberg, 1981). Die Granulosazellen synthetisieren vermehrt Progesteron sowie LH, FSH (Evans et al., 1981) und Prolaktin (Veldhuis et al., 1980). Auch bilden sie die 17 α Hydrogenase, welche aus 20
27 Progesteron die Androgene entstehen lässt (Bjersing und Carstensen, 1967). Die Thecazellen können ebenfalls Androgene synthetisieren, hier sind es vermehrt Androsteroide, welche zu den Granulosazellen transportiert und über Testosteron weiter zu Östradiol umgebildet werden (Evans et al., 1981). Im Gegensatz zu anderen Spezies sind die Thecazellen des Schweins in der Lage, Östradiol zu bilden (Evans et al., 1981; Haney und Schomberg, 1981). Um aber eine unkontrollierte Anzahl von Follikelreifungen zu verhindern, braucht es ovarielle Inhibitoren. Hier übernehmen die kleinen sich nicht weiter entwickelnden Follikel wieder eine wichtige Rolle in der endokrinen lokalen Regulation. Als hemmende Faktoren wirken zum Beispiel Androgene, sie werden ständig bei der Steroidgenese gebildet oder Inhibin, welches in den Granulosazellen der kleinen Follikel produziert wird. Die dominanten Follikel, die den morphologischen und biochemischen Wettkampf gewonnen haben, sind am 1. Zyklustag bis zum präovulatorischen Graaf schen Follikel zu einer Größe von mehr als 10 mm gereift. Diese Follikel erscheinen transparent mit einer deutlichen Gefäßzeichnung (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Leiser et al., 1988). Die von der Zona pellucida, den Zellen der Corona radiata und noch von wenigen Follikelzellen umgebene Oozyte verliert ihre Verbindung zur Follikelwand und schwimmt frei in der Follikelflüssigkeit. In dieser Phase findet beim Schwein die erste meiotische Teilung statt. Das genetische Material wird gleichmäßig auf zwei Kerne, das Zytoplasma jedoch ungleichmäßig verteilt. So entsteht der größere Ovocytus secundarius und der kleinere funktionslose Polocytus primarius. Nach der Reduktionsteilung setzt die Äquationsteilung ein. Deren Abschluß kommt erst nach der Penetration des Spermiums in der Tuba uterina zur Vollendung. Auch diese Teilung ist ungleich. Zum einen entsteht das haploide befruchtungsfähige Ovum, zum anderen der funktionslose Polocytus secundarius (Liebich, 1999). 21
28 Die Ovulation bedeutet die Ruptur der Follikelwand an dem prädisponierten Stigma folliculare. Endokrin gesteuerte Veränderungen der Mikrovaskularisation und auf das Bindegewebe lytisch wirksame Enzyme bewirken diesen Vorgang. Der Ruptur vorausgehend findet eine kurze Hyperämie statt, anschließend eine Verengung der Kapillargefäße mit Verhinderung der Blutzufuhr der Theca interna, an der Stelle des künftigen Stigma folliculare, wodurch dann eine vollständige Degeneration der Kapillaren folgt. Proteinasen und Kollagenasen bauen hier zudem enzymatisch die Tunica albuginea sowie die Theca follicularis ab und tragen zur Reduktion der Follikelzellen bei. Reguliert wird dieser Vorgang durch das luteinisierende Hormon LH, durch Östrogene und Prostaglandine, die zusätzlich in ihrer Wirkung durch lokal freigesetzte Histamine und Leukozyten unterstützt werden. Die Oozyte wird, umgeben von der Zona pellucida sowie einigen Zellen der Corona radiata und wenigen Follikelzellen, aus dem Antrum folliculare durch das Stigma verlagert und dann als Ganzes von den Fimbrien der Tuba uterina aufgenommen (Leiser, 1999; Priedkalns und Leiser, 2006). Aus den verbliebenen Zellen der Follikelwand, den Stromazellen und der Theca interna follicularis bildet sich das Corpus luteum, bewirkt durch einen LH-Anstieg. Findet nach der Ovulation keine Befruchtung statt, entwickelt sich ein Corpus luteum cyclicum, welches zyklischen Auf- und Abbauphasen unterliegt - durch eine Befruchtung allerdings entsteht das Corpus luteum graviditatis. Es ist nun eine temporäre endokrine Drüse, welche Progesteron, Östrogene und möglicherweise Oxytocin synthetisiert. Zelluläre, vaskuläre und bindegewebige Umbauvorgänge vollziehen die Neu- oder Rückbildung des Corpus luteum (Leiser, 1999; Liebich, 1999; Priedkalns und Leiser, 2006). Die Entstehung des Corpus luteum beginnt am Zyklustag mit einem Riss der Basalmembran zwischen den Basalzellen und der Theca follicularis interna. Die 22
29 Basalmembran wird fragmentiert, unmittelbar danach treten Kapillaren in die gefäßfreie Follikelwand ein und sprossen zusammen mit den Arteriolen der Theca externa in das ehemalige Antrum folliculare ein, welches mit Blutkoagulum und Resten der Follikelflüssigkeit gefüllt ist. Das Corpus haemorrhagicum ist entstanden. Sein Durchmesser beträgt 4,7 mm und es erscheint dunkelrot bis violett (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Leiser et al., 1988). Seine Konsistenz ist sehr schlaff und die Stigma-Öffnung, durch die der Austritt der Ovozyte erfolgte, ist deutlich zu sehen (Schnurrbusch et al., 1975b). Mit der Vascularisation gelangen Fibroblasten, Makrophagen und Stromazellen in das Antrum folliculare. Durch Phagozytose entsteht binnen 5 Tagen post ovulationem das Corpus luteum. Im Metöstrus beträgt sein Durchmesser bis zu 10 mm, die Konsistenz ist weich, seine Oberfläche ist rosa und die Vaskularisation beginnt (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Leiser et al., 1988). Follikelzellen und Stromazellen der Theca interna vergrößern ihren Zytoplasmaanteil und mittels Zellerneuerung transformieren sich diese Zellen zu Luteinzellen. Als Besonderheit sind die hier bei anderen Tierarten charakteristischen Lipochrome beim Schwein nicht vorhanden. Die Luteinzellen werden je nach Herkunft in Granulosaluteinzellen oder Thekaluteinzellen unterschieden. Entstanden aus den Wandzellen des Follikels, mit einer hohen mitotischen Aktivität, sind die Granulosazellen für die Größe des Corpus luteum verantwortlich. Ausgestattet mit einem großen Kern und zahlreichen Organellen dienen sie der Steroidhormonsynthese. Thekaluteinzellen, transformiert aus den Stromazellen der Theca interna, sind deutlich kleiner, wobei auch sie sich an der Hormonbildung beteiligen. Das dichte Kapillarnetz, welches das Corpus luteum durchzieht und den Hormontransport gewährleistet, weist eine Läppchenstruktur auf. Eine Gliederung durch bindegewebige Septen aus Stromazellen der Theca externa vervollständigt 23
30 den typischen Aufbau des Corpus luteum. Voll funktionsfähig synthetisiert es vorrangig Progesteron und ist im Diöstrus bis zu 12 mm groß mit deutlich gezeichneten Blutgefäßen (Schnurrbusch et al., 1975b; Kudlac und Groch, 1979; Leiser et al., 1988). Die Regression des Corpus luteum beginnt im späten Diöstrus unter dem Einfluss von Prostaglandin F 2α, welches in der Tunica mucosa des Uterus gebildet wird (Bostedt, 1987). Die Kapillarwände hypertrophieren, sie unterbinden so die Blutzufuhr und degenerieren. Lipoidvakuolen fließen zusammen, die Luteinzellen unterliegen einer Autolyse, einer Karyolyse und einer Phagozytose durch Makrophagen. Gleichzeitig findet eine deutliche Zunahme von Retikulin- und Kollagenfasern statt. Die vollständige Regression des Corpus luteum bis zum Corpus albicans erstreckt sich über einen längeren Zeitraum. Wesentliche Erkenntnisse zum anatomischen und histologischen Aufbau des Ovars stammen von den folgenden Autorengruppen: Amman (1936), Trautmann und Fiebiger (1949), Leiser (1990), Leiser (1999), Liebich (1999) sowie Priedkalns und Leiser (2006) Ovarmorphologie intra und post lactationem Bei der Zuchtsau gibt es während der Laktationsperiode keine funktionierenden Corpora lutea auf dem Ovar (Smidt et al., 1969; Crighton und Lamming, 1969). Kleine vorhandene Follikel atresieren unmittelbar post partum (Palmer et al., 1965). Die meisten Ovarien sind bis zum Absetzen klein, hart, seitlich abgeflacht und inaktiv. Nur Follikel bis 5 mm Durchmesser sind gelegentlich zu beobachten. Warnick 24
31 et al. (1950), Baker et al. (1953), Prehm (1963), Reichenbächer (1963), Palmer et al. (1965), Smidt et al. (1965), Schnurrbusch (1998) sowie Leiser et al. (1988) bestätigen gleichlautende Befunde. Ein Gewichtsverlust erfährt das Ovar besonders innerhalb der ersten Tage post partum durch die Regression der letzten Corpora lutea (Corner, 1921; Rumjancev, 1954; Palmer et al., 1965; Kudlac und Groch, 1979). In der 2. postpartalen Woche ist die Aktivität noch gering, sie steigert sich aber in der 3. Woche nach der Geburt (Kudlac und Groch, 1979). Nach dem Absetzen der Ferkel findet eine Größenzunahme der Follikel von 5 auf 8 mm innerhalb von 4 Tagen statt (Palmer et al., 1965) Laktationsanöstrus Während der Laktationsperiode (3 6 Wochen post partum) bleibt eine reguläre zyklische Aktivität der Ovarien unter üblichen Haltungsbedingungen aus. Erst 3 bis 16 Tage nach dem Absetzen der Ferkel setzt sie im Allgemeinen spontan wieder ein (Self und Grummer, 1958; Svajgr et al., 1974; Cole et al., 1975; Rieck, 1983): Als ein azyklisches postpartales Stadium, welches sich über das Puerperium hinaus erstreckt und durch mehr als ein säugendes Ferkel aufrecht erhalten wird, so definierten Ellendorf et al. (1985) den Laktationsanöstrus bei der Sau. Ein positiver Östrogen-Feedback auf die Hypophyse, der eine präovulatorische LH-Freisetzung bewirken würde, ist in den ersten Wochen der Säugezeit gehemmt (Elsaesser und Parvizi, 1980; Cox und Britt, 1982). Eine Sekretion von Oxytocin aus der Neurohypophyse könnte zusätzlich direkt oder indirekt die Ausschüttung von hypothalamischem GnRH blockieren (Ellendorf et al., 1985). Zusätzlich wirkt ein 25
32 hoher Prolaktinwert, induziert durch die säugenden Ferkel, negativ auf die LH Blutplasmakonzentration (De Rensis et al., 1993) und verhindert eine ovarielle Aktivität (Bostedt, 1987). Endogene Opioide (Naloxone), synthetisiert in der Hypophyse, sind in die hormonelle Steuerung mit eingebunden. Sie fördern die Prolaktinfreisetzung und sind gleichzeitig mitverantwortlich für die Hemmung der LH-Sekretion (Barb et al., 1986; Mattioli et al., 1986b; Armstrong et al., 1988; Barb, 1988). Der Saugakt wirkt als Stress und stimuliert somit die endogenen Opioide. Cortisol folgt dem gleichen Prinzip. Durch zusätzliche negative Einflüsse, wie zum Beispiel nutritive Unterversorgung, wird dieses Phänomen verstärkt. Mit zunehmender Säugezeit ( Woche post partum) nimmt die hemmende Wirkung der Opioide auf die LH-Sekretion ab und nach dem Trennen der Sau von ihren Ferkeln kann ein neuer Zyklus beginnen. Morphine unterdrücken ebenfalls die LH-Konzentration und verzögern unter Umständen den Östrusbeginn nach dem Absetzen (Armstrong et al., 1988). Eine Puerperale Septikämie und Toxämie beeinflusst die Länge des Laktationsanöstrus ebenfalls im negativen Sinne. Hier sollten nach Hays et al. (1978), Kudlac und Groch (1979), Berner et al. (1980), Schumm et al. (1980), Bostedt et al. (1998) und Hoy (2002 und 2003) entsprechende prophylaktische Maßnahmen getroffen werden. 26
33 2.4. Involution und Reorganisation des Uterus post partum In der postpartalen Rekonvaleszenz ist der Uterus das entscheidende Organ, dessen vollständige Regeneration maßgeblich für ein neues Konzeptionsoptimum verantwortlich ist. Das geringer werdende Uterusgewicht und die Längenverkürzung der Uterushörner sind makroskopisch die Kriterien, die eindeutig die Involution charakterisieren sollten. Ein dominanter Gewichtsverlust unter dem positiven Einfluss der Laktation in der 1. Postpartalwoche und ein sich anschließender progressiver Regressionsverlauf wurde übereinstimmend von allen Autoren beobachtet (Palmer et al., 1965; Graves et al., 1967; Smidt et al., 1969; Svajgr et al., 1974; Kudlac und Groch, 1979; Schnurrbusch, 1998). Auch die Uterushornlänge verhielt sich gleichgerichtet (Palmer et al., 1965; Svajgr et al., 1974; Kudlac und Groch, 1979). Histologisch wurde wissenschaftlich dem Oberflächenepithel die meiste Aufmerksamkeit zuteil. Am 1. Tag post partum ließ sich die Epithelhöhe mit µm messen, am 7. Tag post partum waren es nur noch 5 6 µm, sie stieg aber auf µm am 14. Tag post partum und weiter bis auf 25 µm am 21. Tag post partum an. Diese Höhen maßen bei Altsauen Palmer et al. (1965). Kudlac und Groch (1979) untersuchten dagegen primipare Sauen. Auch sie beobachteten unmittelbar nach der Geburt eine niedrige Höhe von 6-8 µm, es folgte aber ein Anstieg auf µm ab dem 4. Tag post partum und eine weitere Zunahme auf µm ab dem 10. Tag post partum. Am 13. Tag post partum ermittelten sie einen Verlust der Epithelhöhe auf µm, ab dem 16. Tag erneut eine Schichtdickenzunahme auf µm und eine etwas niedrigere Zellschicht von µm ab dem 20. Tag post partum. Die letztgenannten Autoren untersuchten auch das Stratum cellulare und das Stratum reticulare und fibrillare, wobei die beiden letztgenannten Schichten als eine Einheit betrachtet wurden. In der 1. Postpartalwoche waren im Stratum cellulare 27
34 vermehrt Erythrozyten zu finden, am 10. Tag post partum zeigte es sich sehr schmal, ab dem 13. Tag nach der Geburt vaskularisiert und zum 16. Tag post partum war diese Schicht sehr zellreich. Sie veränderte ihr Erscheinungsbild bis zum 24. Tag post partum nicht mehr. Stark ödematisiert, mit großen Blutgefäßen und vielen Drüsen, letztere mit einem Durchmesser von über 10 µm, so sah das Stratum reticulare und fibrillare in den ersten 3 Tagen nach der Geburt aus. Das Ödem verschwand kontinuierlich bis zum 10. Tag post partum, zu diesem Zeitpunkt war diese Schicht sehr schmal. Ab dem 13. Tag nach der Abferkelung konnte wieder ein schwaches Ödem beobachtet werden, welches sich bis zum 16. Tag post partum noch vermehrte. Am 20. Tag nach der Geburt zeigten sich beide Schichten wieder sehr schmal (Kudlac und Groch, 1979). Die Drüsensekretion bleibt unmittelbar postpartal erhalten, vermindert sich aber ab dem 7. Tag in der Laktation kontinuierlich. Es fand keine erneute Sekretausschüttung während der Sexualrekonvaleszenz mehr statt (Palmer et al., 1965; Smidt et al., 1969). Bei nicht laktierenden Sauen wurde bereits ein Drüsenwachstum ab der 2. Postpartalwoche beobachtet (Smidt et al., 1969). Eine geringere Sekretion, beginnend ab dem Tag post partum und sich bis zum 30. Tag nach der Geburt fortsetzend, konnten Elze et al. (1975) erkennen. Welcher Uterusabschnitt hier untersucht wurde, ist jedoch nicht nachvollziehbar. Kudlac und Groch (1979) konnten im Zeitraum Tag nach der Ferkelung eine Zellinfiltration in der Nähe der Drüsenmündungen nachweisen, jedoch keinen Sekretfluss. Der Uterus sei in der 4. Woche post partum vollständig regeneriert, meinten Graves et al. (1967), Smidt et al. (1969), Svajgr et al. (1974) und Elze et al. (1975). Als den letzten Tag des postpartalen Zeitraums definierten Palmer et al. (1965) den 21. Tag post partum. Dass die uterine Rekonvaleszenz bereits am 18. Tag nach der Geburt 28
35 abgeschlossen ist, diese Ansicht vertraten Kudlac und Groch (1979) sowie Schnurrbusch (1998) Die hormonelle Interaktion im postpartalen Reproduktionsgeschehen Die Inkretion der Hormone ist in unterschiedliche, fein aufeinander abgestimmte Regelkreisläufe eingebunden, die maßgeblich jegliche Reproduktionsabläufe beeinflussen. Nicht nur die Höhe der einzelnen Hormonkonzentrationen, inbegriffen Synthese und Sekretion, sind relevant, sondern auch ihre sensible Interaktion. Insbesondere sind hier die positiven und negativen Feedbacks zu erwähnen. Vorhandene oder nicht vorhanden Rezeptoren, Rezeptorblocker, endokrine Opioide und diverse Enzyme beeinflussen ebenfalls das komplizierte Zusammenspiel. Eine Einzelinterpretation ist somit unmöglich. Um die komplizierten Regelmechanismen zu erforschen wurden gewählt: zum einen gemessene Hormone und Enzymkonzentrationen zu unterschiedlichen Zeitpunkten im Reproduktionszyklus, zum anderen zusätzliche, individuell hohe Injektionsgaben von synthetischen Hormonen oder eine Ovarektomie. Die wichtigen Hormone im Einzelnen: Das Progesteron ist verantwortlich für die Aufrechterhaltung der Gravidität. Es stellt das Myometrium durch die Verringerung des intrazellulären Ca 2+ ruhig und vermindert gleichzeitig die Gap junctions (Hoffmann, 1993). Zwei Tage vor der Geburt fällt es von 8 ng/ml innerhalb eines Tages auf 2,0 ng/ml (Edqvist et al., 1974) und bleibt post partum, während der gesamten Laktation, auf einem Niveau von 1,5 29
36 2,0 ng/ml (Edqvist et al., 1974; Kolb, 1978). Ein niedrigerer Basiswert von 0,5 ng/ml wurde von Short (1960) und Edgerton und Erb (1971) und Molokwu und Wagner (1973) gemessen. Bei Muttertieren, deren Geburtstermin deutlich verspätet eintritt, ist eine erhöhte Östrogenkonzentration und eine verzögerte Progesteronabnahme nachzuweisen (King und Wathes, 1989). Alle Autoren, die eine Progesteronbestimmung unmittelbar vor der Geburt bis zum Ende des Laktationsanöstrus untersucht haben, stimmen überein, das dieses Hormon in der gesamten Postpartalphase eine gleichbleibend niedrige Konzentration hat (Short, 1960; Palmer et al., 1965; Edgerton und Erb, 1971; Molokwu und Wagner, 1973; Edqvist et al., 1974; Ash und Heap, 1975; Brake et al., 1976; Parvizi et al., 1976; Kolb, 1978; Varley et al., 1981; Duggan et al., 1982; Kunavongkrit et al., 1982; Shaw und Foxcroft, 1985; Bostedt, 1987; Hoffmann, 1993; Dlamini et al., 1995). Das luteinisierende Prostaglandin PGF 2α steigt ante partum kurzfristig an und fällt innerhalb von zwei Tagen auf den Ausgangswert zurück (Kunavongkit et al., 1982; Bostedt, 1987; Hoffmann, 1993). In diesem Zeitraum ist der myogene Effekt von PGF 2α zu vernachlässigen. In einer hochtragenden Sau stimuliert es die Relaxin- und Prolaktin-Ausschüttung (Li et al., 1993) und eine Abnahme von Progesteron (King und Wathes, 1989). Zu den Hormonen, die unmittelbar die Geburt beeinflussen, zählen auch die Östrogene. In der Plazenta produziert, steigert sich die Sekretion von Östron (E 1 ) 6 Tage ante partum von pg/ml auf pg/ml bis 2 Tage vor der Niederkunft, um dann wiederum auf 6 pg/ml innerhalb der ersten 6 Tage post partum zu sinken. Die Östradiol (E 2 )-Werte variieren zeitgleich von 46 auf 75 pg/ml und zurück auf 5,5 pg/ml (Molokwu und Wagner, 1973). Östrogene induzieren zum einen die Prolaktin und zum anderen im Zyklusgeschehen die LH- und FSH-Ausschüttung (Stevenson et 30
37 al., 1981). Während der Laktation sind die Östrogene konstant niedrig (Holness und Hunter, 1975; Kunavongkrit et al., 1982). Nach dem Absetzen der Ferkel findet ein Wechsel vom positiven Östrogenfeedback zum präovulatorischem LH-Pik innerhalb von 55 Stunden statt (Edwards und Foxcroft, 1983 a, b). Dieser Östrogenfeedback wird deshalb für den Laktationsanöstrus verantwortlich gemacht. Denn Edqvist et al. (1974) und Elsaesser und Parvizi (1980) beobachteten das der LH Wert in der Laktation am 35. Tag post partum geringfügig erhöht ist, trotzdem ist ihm keine Wirkung nachzuweisen. Eine verlängerte Säugezeit hat einen niedrigen E 2 Wert nach dem Absetzen zur Folge (Hulten et al., 2002). Ansonsten steigt er bis 36 Std. vor der Ovulation auf 88 ng/ml an (Cox und Britt, 1986) und sinkt dann auf ein basales Level (Ash und Heap, 1975). Eine Gabe von Östradiolbenzoaten hat einen Anstieg von LH bei praepupertären Jungsauen erzeugt (Elsaesser und Foxcroft, 1978), nicht aber in der Laktation (Elsaesser und Parvizi, 1980). Auch die Konzentration der Corticoide wurde zur Geburt und post partum von den Autoren Molokwu und Wagner (1973) untersucht. Ihre Sekretion erhöht sich in den letzten Tagen der Gravidität und sinkt in der frühen Laktation auf 101,8 ng/ml Basisniveau wieder ab. Relaxin ist ebenfalls ein Hormon, welches einen direkten Einfluss auf die Entbindung ausübt. Ab dem 110. Tag der Trächtigkeit steigt es bis 15 Stunden ante partum an. 37 Stunden post partum ist es wieder auf seinem niedrigen Ausgangswert (Hoffmann, 1993). Dlamini et al. (1995) maßen einen Maximalwert von 66 ng/ml und einen Basisniveau von 2 ng/ml. Die von Sherwood et al. (1981) gemessenen Extremwerte schwankten zwischen 257 und 0,4 ng/ml. 31
38 Ungebundenes Relaxin kann negative Auswirkungen auf die Geburt haben (Cho et al., 1998). Ein direkter Zusammenhang besteht zwischen der Relaxin- und Prolaktinausschüttung (Li et al., 1993). Der Anstieg der Prolaktin-Sekretion beginnt schon zum 99. Tag ante partum. Sie nimmt zu von 16 auf 39 ng/ml intra partum und verweilt dann konstant auf dieser Höhe bis zum Laktationsende (Dlamini et al., 1995). Kirkwood et al. (1984) stellten heraus, dass in den ersten 9 Tagen nach der Geburt dieses Hormon eine geringfügig höhere Konzentration hat als zum Ende der Säugezeit. Stetig säugende Ferkel sind hierfür eine unabdingbare Voraussetzung (Bostedt, 1987). Die Prolaktinkonzentration kann einen Werte von 125 ng/ml erreichen, besonders wenn Ferkel zeitweilig von ihrer Mutter getrennt werden (Bevers et al., 1978; Stevenson et al., 1981). [In der späten Gravidität wirkt dieses Hormon luteinisierend (Dlamini et al., 1995).] Prolaktin korreliert sehr stark mit LH und FSH. Dieser Wert verändert sich direkt mit dem Absetzen der Ferkel (Stevenson et al., 1981; Shaw und Foxcroft, 1985). Wenn er fällt, erfolgt unmittelbar eine LH und FSH Ausschüttung (Kolb, 1978; Bostedt, 1987). Laut Stevenson et al. (1981) kann eine Östrogenabgabe eine Prolaktin- Ausschüttung induzieren. Eine hoher Prolaktinwert hemmt eine LH Sekretion aber nicht (De Rensis et al., 1993) und umgekehrt eine Gabe LH beeinflusst während der Laktation den Prolaktinwert gar nicht (Bevers et al., 1981). Zwischen der Säugeperiode und dem Östrus ist kein erneuter Anstieg des Prolaktins messbar (Stevenson et al., 1981). Dieses Hormon hemmt die ovarielle Funktion (Bostedt, 1987). Die Sekrektion des follikelstimulierenden Hormons (FSH) vermindert sich während der Austreibungsphase der Ferkel, die Blutplasmakonzentration steigt im Folgenden bis zum 10. Tag post partum leicht an und bleibt bis zum Ende der Laktation auf einem konstant niedrigen Niveau (Duggan et al., 1982; Foxcroft et al., 1987). 32
39 Stevenson et al. (1981) beobachteten weiterhin, dass die Ovarien nicht nur die Freisetzung, sondern auch die FSH Synthese hemmen, denn bei ovarektomierten Tieren steigt die FSH Konzentration zum Ende der Laktation, während bei intakten Sauen die FSH Ausschüttung nach GnRH Applikation gleich blieb und gleichzeitig deutlich niedriger war. Dies bedeutet eine Hemmung, ausgehend vom Ovar. Diese Ansicht vertreten auch Edwards und Foxcroft (1983b). Duggan et al. (1982) kamen konträr zu dem Ergebnis, dass sowohl Synthese als auch die Freisetzung von FSH während der Säugezeit möglich sei. Gleichzeitig bleibt aber die Follikelreifung als Antwort auf die FSH-Einwirkung aus. Letzteres wird hervorgerufen durch den Saugakt. Mit dem Absetzen steigt erst das FSH, zeitversetzt folgt das LH, beide erreichen ihren Pik kurz vor dem Eisprung (Shaw und Foxcroft, 1985, Kolb, 1978; De Rensis et al., 1983). Direkt vor der Ovulation sinken beide Hormone ab ( Cox und Britt, 1986). Die Sekretion des luteinisierenden Hormons (LH) sinkt 5 Tage ante partum auf einen niedrigen Plasmakonzentrationsspiegel und bleibt während der gesamten Säugezeit auf Basisniveau, meistens unterhalb der Nachweisgrenze von 0,18 ng/ml (Duggan et al., 1982). Der Nichtpräsenz dieses Hormons wird die bedeutendste Rolle für den bestehenden Laktationsanöstrus zugesprochen. Es ist unerlässlich für das Follikelwachstum. Eine zu geringe LH-Konzentration führt zu einer Stillbrünstigkeit. Nach dem Absetzen der Ferkel findet ein verzögerter Anstieg bis wenige Stunden vor der Ovulation statt. In all diesen Punkten stimmen eine Vielzahl von Autoren überein (Crighton und Lamming, 1969; Kolb, 1978; Elsaesser und Parvizi, 1980; Bevers et al., 1981; Stevenson et al., 1981; Ziecik et al., 1982; Duggan et al., 1982; Edwards und Foxcroft, 1983a; Shaw und Foxcroft, 1985; Hulten et al., 2002). Geringfügige Uneinigkeit herrscht hingegen bei der LH-Wirkung. Wissenschaftler früherer 33
40 Publikationen maßen die niedrigen LH-Konzentrationen im Anöstrus, hatten aber keine Erklärung für einen plötzlichen, zufälligen oder provozierten LH-Anstieg, der am Ovar kaum einen Effekt bewirkte. Der positive Östrogenfeedback, welcher die LH Wirkung blockiert, wurde erst von Elsaesser und Parvizi (1980), Bevers et al. (1981), Stevenson et al. (1981) sowie bei Edwards und Foxcroft (1983b) beschrieben. De Rensis et al. (1993) stellten gesondert heraus, dass LH zwar während der Laktation ausgeschüttet, aber die Synthese unterdrückt wird. Genaue Konzentrationswerte ermittelten Cox und Britt (1986). Das Maximum mit 2,8 ng/ml wird 48 Stunden vor der Ovulation erreicht und sinkt im Folgenden auf 0,8 ng/ml zum Eisprung ab. Ein weiteres wichtiges Hormon ist das Gonadotropin Releasing Hormon (GnRH). Die Größe des heranreifenden Follikels ist in direkte Korrelation zur der Höhe der GnRH- Konzentration zu setzen (Cox und Britt, 1982). Östrus und Ovulation werden von diesem Hormon eingeleitet. GnRH steigt innerhalb von 60 Stunden nach dem Absetzen deutlich an. 34
41 3. Eigene Untersuchungen 3.1. Material Auswahl der landwirtschaftlichen Betriebe Die Bitte, bestimmte Sauen zur Verfügung zu stellen, wurde von fünf Ferkelerzeugerbetrieben erfüllt. Deren relevanten Bestandsdaten wurden erfasst. Diese Daten sind im Befundbogen II (siehe Anhang) festgehalten und fließen teilweise mit in die Beurteilung ein Auswahl des Tierkollektives Im Zeitraum der postpartalen Periode ( Tag) wurden von 37 Sauen der Rasse DL-DE die genauen individuellen Daten im Befundbogen I (siehe Anhang) vermerkt. Die Tiere waren im Alter von 16 bis 56 Monaten und hatten eine Wurfzahl von Sie schieden aus unterschiedlichen, jedoch nicht gynäkologischen Gründen aus den Betrieben aus. Daten, die nicht unmittelbar mit in den Ergebnisteil einfloßen, wurden trotzdem notiert, um biologische Abweichungen erklären zu können Einteilung der Gruppen Für die statistische Auswertung wurden die Sauen in vier Gruppen eingeteilt: 35
42 Gruppe I Tag post partum n 4 Tiere Gruppe II 10. Tag post partum n 3 Tiere Gruppe III Tag post partum n 24 Tiere Gruppe IV Tag post partum n 6 Tiere Diese Gruppeneinteilung wurde aus erforschten, in der Literatur festgehaltenen und biologisch bewährten Gesichtspunkten gewählt - nicht aus Managementgründen oder wirtschaftlichen Interessen. Eine weitere Betrachtung und Auswertung fand an den einzelnen Tagen nach der Abferkelung statt. Tage p.p Stichprobenumfang n Methoden Methode zur Gewinnung des Untersuchungsgutes Am gewünschten Tag x post partum wurde die Sau nach einer kurzen Allgemeinuntersuchung 1 der Schlachtung zugeführt. Ungefähr 15 min nach der Betäubung und der Entblutung wurden am Schlachtband der Uterus und die Ovarien entnommen. Vom gewonnenen Material wurden an unterschiedlichen Stellen, wie Vagina, Cervix, Corpus uteri, caudales Uterushorn, 1 siehe Daten Befundbogen I, eigene Untersuchung 36
43 mittleres Uterushorn, craniales Uterushorn, Tuba uterina und Ovar 1 cm x 1 cm große Proben entnommen und für die histologische Untersuchung sofort in Bouin scher 2 Lösung vorfixiert Makroskopische Untersuchung am frischen Präparat Mit einer Digitalwaage, einem Lineal und einer Schublehre wurden die Daten erfasst, die bei der makroskopischen Untersuchung im Befundbogen III (siehe Anhang) festgehalten wurden. Die Involution des Vulvagewebes wurde adspektorisch vor der Verwertung anhand des postpartalen Ödematisierungsgrades beurteilt. Die Unterteilung erfolgt in drei Klassen: keine Ödematisierung, leichte Ödematisierung oder mittelgradige Ödematisierung Interstitielle Flüssigkeitsansammlungen aufgrund von Verletzungen wurden gesondert vermerkt. Postmortal wurde die Vulvalänge, ausgehend von der Commissura labiorum dorsalis bis hin zur Commissura labiorum ventralis, gemessen. Die makroskopischen Daten des vestibulo-vaginalen Abschnitts, der Cervix, des Corpus uteri und der Uterushörner wurden in ihrer Ausdehnung sowohl in der Länge 2 Bouin scher Lösung: Formalin und Pikrinsäure kurz vor Gebrauch mit Eisessig mischen 37
44 als auch in der Breite ermittelt. Gleichzeitig wurde bei der Cervix auch der Lumendurchmesser erfasst. Die jeweils zugehörigen Wanddicken wurden mit der Schublehre eruiert. Die Uteri wurden zusätzlich gewogen. Auch Gewicht, Länge, Breite und Höhe der Ovarien wurden aufgenommen und ihre Follikel (Größendifferenziert in < 3 mm und > 3mm) gezählt Verarbeitung des histologischen Materials Für die Histologie wurden die in Bouin sche Lösung vorfixierten Ovar- und zahlreiche lokal definierte Querschnittsstückchen aus den Wänden des Reproduktionstraktes in 0,5 cm x 0,5 cm kleine Stücke geschnitten und nochmals bis 24 Stunden in Bouin scher Lösung belassen. Danach 7-8 mal in 70 %-igem Alkohol ausgewaschen und bei 4 C bis zum Einbetten der Proben im Kühlschrank aufbewahrt. Zur Einbettung der Proben stand der Vakuum Gewebeinfiltrationsautomat TP 1050 von der Firma Leica aus Nussloch Deutschland und die Paraffinausgießstation, Leica EG 1160, zur Verfügung. Von den Paraffinblöcken wurden 5 bis 7 µm dicke Schnitte angefertigt, die auf apesbeschichtete Objektträger gelegt und 24 Stunden bei 50 C getrocknet wurden. Die Färbung fand mit Haemulaun-Eosin statt Mikroskopische Untersuchungen Mit dem histologischen Vermessungsprogramm analys SIS 2.0 wurden die einzelnen Schichtdicken 38
45 Epithelium pseudostratificatum columnare, Stratum cellulare, Stratum reticulare, Stratum fibrillare, zirkuläre Muskelschicht, longitudinale Muskelschicht, Tunica serosa (Lamina propria serosa und Lamina epithelialis serosa) und der Lumendurchmesser der Drüsen gemessen und die Daten tabellarisch festgehalten. Auch ein Querschnitt durch die Tuba uterina wurde mikroskopisch untersucht Weiterführende histologische Verarbeitung Um immunhistochemische Untersuchungen durchführen zu können, wurde speziell die Fixation in Bouin scher Lösung gewählt. Material hierfür steht für eine weitere Dissertation zur Verfügung Statistische Auswertung Die Datenhaltung und -auswertung erfolgte mit der Standardsoftware für Statistische Auswertungen SPSS (Statistical Package for Social Science Version 11.5.) des Institutes für Tierzucht und Haustiergenetik der Universität Gießen. 39
46 Die arithmetischen Mittelwerte ( x ) mit zugehöriger Standardabweichung ( + s ), der Stichprobenumfang (n) sowie Minimal- und Maximalwerte wurden für die Interpretation der verschiedenen Gruppen herangezogen. Die Entwicklungen der einzelnen Untersuchungsmerkmale in Abhängigkeit von der Zeit post partum, der Parität oder anderen weiteren Merkmalen wurden für die einzelnen Klassifizierungen mittels der Programme Microsoft Exel und Microsoft Power Point graphisch als Säulendiagramme aufbereitet. Die Standardabweichungen der einzelnen Gruppenwerte wurden ebenfalls visualisiert. Mittelwertunterschiede wurden mit dem Verfahren des multiplen Mittelwertvergleiches nach Student-Newman-Keuls auf Signifikanz mit p < 0,05 überprüft. Für linear gerichtete Entwicklungen wurden Geradengleichungen (Regressionsgeraden) mit einer zugehörigen Korrelations-/Regressionsanalyse bestimmt Ergebnisse Vulva Zur eindeutigen makroskopischen Klassifizierung des postpartalen Involutionszeitpunktes ist der Ödematisierungsgrad der Labiae vulvae nur bedingt in den ersten Tagen post partum geeignet. Der Ödematisierungszustand der Vulva zeigt zwar bei allen multiparen Probanden zwischen dem 3. und 5. Tag post partum (Gruppe 1) noch eine mittelgradige Ausdehnung. Sie verteilt sich jedoch nicht immer gleichmäßig auf die Gesamtfläche der Labiae vulvae, sondern ist meist im ventralen Bereich umfangreicher als dorsal oder medial. Bereits am 10. Tag post partum 40
47 (Gruppe 2) ist keine interstitielle Flüssigkeitsansammlung äußerlich mehr zu erkennen. Ob also die Regenerationsvorgänge post partum folgerichtig ablaufen, lässt sich anhand dieses Merkmals nicht exakt beurteilen. Auch die Länge der Vulva ist allgemein kein geeignetes Kriterium, um den Stand der postpartalen Regenerationsvorgänge eindeutig zu bestimmen (Abb. 1; Tab. A 1). Nur bis zum 10. Tag post partum (Gruppe 1 und 2) sind die gemessenen Längenwerte homogen. Ihr Minimum liegt bei 6,0 cm, ihr Maximum bei 8,0 cm. Der gemeinsame Durchschnittswert beträgt 6,9 + 0,7 cm. Die Probanden der Gruppe 3 ( Tag post partum) und 4 ( Tag post partum) weisen hingegen sehr inhomogene Vulvalängen auf. Die Minimal- und Maximalwerte schwanken zwischen 4,9 und 9,0 cm. 9,0 8,0 7,0 Vulvalänge [cm] 6,0 5,0 4,0 3,0 2,0 1,0 0, Gruppe Gruppe Tage p.p Anzahl n Abb. 1: Veränderung der Vulvalänge bei Schweinen in der postpartalen Periode (Angaben x + s). Um den Verlauf der Regression post partum in einem altersmäßig homogenen Kollektiv differenzierter darstellen zu können, werden 20 Tiere mit einer Parität zwischen 6 und 9 gesondert betrachtet (Abb. 2; Tab. A 2). Für die Ergebnisanalyse 41
48 werden die Probanden in drei Gruppen unterteilt. Die Tiere der Untergruppe a ( Tag post partum, n = 3) haben eine durchschnittliche Vulvalänge von 7,0 + 1,0 cm. Bei den 14 Muttertieren, die für den Tag post partum (Untergruppe b) zur Verfügung stehen, beträgt der Mittelwert 6,4 + 0,9 cm und in Untergruppe c ( Tag post partum, n = 3) misst der Längenwert 5,7 + 1,1 cm. Nur der selektive Vergleich gleichaltriger Tiere zeigt demnach die erwartete Regression der Vulvalänge in der Postpartalperiode. Der kontinuierliche Längenverlust der Vulva nach der Niederkunft bei gleichaltrigen Sauen lässt sich durch die lineare Regressionsgleichung y = 7,55 0,08 x wiedergeben. Aufgrund des Korrelationskoeffizient r = - 0,98 ist somit davon auszugehen, dass ein großer linearer Zusammenhang zwischen den Merkmalen Vulvalänge und den Regressionsvorgängen in Abhängigkeit zu den Tagen post partum in einer definierten Altersgruppe besteht. Vulvalänge [cm] 9,0 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 0,0 a b c Gruppe Gruppe a b c Tage p.p Anzahl n Abb. 2: Postpartale Regression der Vulvalänge bei Schweinen in der Altersgruppe Parität (Angaben x + s). 42
49 Ein Kollektivvergleich der Tiere mit einer Parität kleiner als 6 und größer als 9 bietet sich in dieser Studie zum Nachweis des Einflusses der Regression nicht an, da aufgrund der großen Unterschiede der Lebendgewichte und der zu geringen Gruppengrößen die Abhängigkeit zur Parität nicht eindeutig herauszustellen ist. Die Zusammensetzung des Probandenkollektives erlaubt hingegen die Frage zu beantworten, welchen Einfluss das maternale Alter auf die Vulvalänge zum Zeitpunkt des 15. bis 21. Tag post partum ausübt. Dies gelingt durch die Gegenüberstellung aller 24 Sauen aus der Gruppe 3 (Abb. 3; Tab. A 3). Ebenfalls eingeteilt in 3 Unterabteilungen besitzen die 4 Probanden mit einer Parität von 3-4 eine mittlere Vulvalänge von 4,6 + 0,5 cm. Die 9 Tiere mit einer Parität von 5-7 haben einen Durchschnittswert von 6,1 + 1,0 cm und die 11 Sauen mit einer Parität von 8-11 weisen einen Wert von 6,6 + 0,8 cm auf. Auch hier bestätigt sich die Vermutung, dass die Labiae vulvae älterer Tiere im unmittelbaren Zeitraum nach der Geburt eine deutlich größere Längenausdehnung vorweisen, als die der jüngeren Probanden. Die gleichmäßige und eindeutige Längenveränderung der Vulva in Abhängigkeit zur Wurfzahl lässt sich mittels der linearen Regressionsfunktion y = 3,73 + 0,32 x abbilden. Der Korrelationskoeffizient der beiden Größen beträgt r = 0,93 und symbolisiert so die große Übereinstimmung beider Merkmale. 43
50 9,0 8,0 7,0 Vulvalänge [cm] 6,0 5,0 4,0 3,0 2,0 1,0 0,0 I II III Parität Gruppe I II III Parität Anzahl n Abb. 3: Beziehung zwischen maternalem Alter und Regression der Vulvalänge bei Sauen in der Zeit Tag post partum (Angaben x + s). Als Resultat dieses Abschnittes der Untersuchungen ist zu konstatieren, dass ein kontinuierlicher Involutionsverlauf sowie eine postpartale Zeitpunktbestimmung anhand des Ödematisierungsgrades der Vulva über alle Altersklassen hinweg nicht verifizierbar ist. Die in der Sexualrekonvaleszenzperiode auftretende Vulvaregression, gemessen anhand des Kriteriums einer Längenabnahme, ist nur bei Sauen einer Altersgruppe eindeutig nachzuweisen, altersübergreifend jedoch nicht. 44
51 Vagina Makroskopische Untersuchungen Die Messung von Länge (vestibulo-vaginale Abschnitt), Breite und Wanddicke der Vagina konnte methodenbedingt erst kurze Zeit nach der Entnahme und Aufbereitung der histologischen Proben vorgenommen werden. Die praemortale Kontraktilität der glatten Muskulatur bleibt aus diesem Grund unberücksichtigt. Die thesenhaft erwartete kontinuierliche postpartale Regression der Länge des vestibulo-vaginalen Abschnitts kann unter alleiniger Betrachtung des zeitlichen Abstandes zur Geburt über alle Altersgruppen hinaus nicht eindeutig nachgewiesen werden. Während bis zum 10. Tag post partum eine Abnahme zu verifizieren ist, nimmt die Ausdehnung des Vestibulo-vaginal-Kanales im Zeitraum Tag post partum wieder zu. Sie geht jedoch erneut zwischen dem Tag post partum zurück (Abb. 4; Tab. A 4). Besonders hervorzuheben ist die Homogenität der Gruppe 3, die das größte Probandenkollektiv darstellt und so eine nähere Beobachtung zulässt. Alle 24 Gruppenmitglieder besitzen nahezu eine identische vestibulo-vaginale Länge. 45
52 Länge [cm] Gruppe Gruppe Tage p.p Anzahl n Abb. 4: Veränderung der Länge des vestibulo-vaginalen Abschnitts bei Schweinen in der postpartalen Periode (Angaben x + s). Zur Klärung der sich daraus ergebenden Fragen, inwieweit das maternale Alter, die unterschiedliche Gruppengröße oder auch welche gegenseitige Beeinflussung die anfänglichen Regressionsvorgänge zu den folgenden Reorganisationsabläufe haben, wird eine zusätzliche Differenzierung vorgenommen. Mit einer Parität von 6-9 wurden dafür alle dazugehörigen 20 Probanden ausgewählt und in drei Unterabteilungen (a, b, c) gegliedert (Abb. 5; Tab. A 5). Diese Gegenüberstellung veranschaulicht die postpartale Regression, ohne den Einfluss des maternalen Alters der Tiere zu berücksichtigen. Auch mit dieser geänderten Klassifizierung ist der erneute Längenzuwachs des vestibulo-vaginalen Abschnitts im Zeitraum Tag post partum eindeutig, somit ist die makroskopisch sichtbare Regression bis zum Beginn dieses Zeitraums abgeschlossen. Der erneute Längenverlust zum 21. Tag post partum deutet schon auf eine abgeschlossene Reorganisation hin, wobei folgende zyklusbedingte Variationen bei einzelnen Tieren in der Länge nicht auszuschließen sind. 46
53 Länge [cm] a b c Gruppe Gruppe a b c Tage p.p Anzahl n Abb. 5: Postpartale Regression der Länge des vestibulo-vaginalen Abschnitts bei Schweinen in der Altersgruppe Parität (Angaben x +s). Ein zusätzlicher Kollektivvergleich der 24 Sauen aus der Gruppe 3 ( Tag post partum, klassifiziert in die Untergruppen I-III) dient der Problemklärung des Einflusses des maternalen Alters auf die Vaginallänge zu diesem Zeitpunkt. Konträr zu der Erwartung, dass das Alter und damit auch das Lebendgewicht einer Sau einen bedeutenden Einfluss auf die Vaginallänge besitzt, zeigt sich hier keine Altersabhängigkeit (Abb. 6; Tab. A 6). Alle Gruppenmittelwerte sind nahezu identisch. Ihre geringe kontinuierliche Abnahme kommt auch in der linearen Regressionsgerade y = 30,50-0,33 x und dem hohen Korrelationskoeffizienten r = - 0,98 zum Ausdruck. 47
54 Länge [cm] I II III Parität Gruppe I II III Parität Anzahl n Abb. 6: Beziehung zwischen maternalem Alter und der Regression des vestibulo-vaginalen Abschnitts bei Sauen in der Zeit Tag post partum (Angaben x + s). Die Darstellung der Länge des vestibulo-vaginalen Abschnitts im Verhältnis zu den Tagen post partum unterstreicht die Tendenz einer deutlichen Längenverkürzung nur bis zum 15. Tag nach der Abferkelung. Die dazugehörige lineare Regression der Mittelwerte vom Tag post partum lässt sich mit der Geradengleichung y = 30,63-0,77 x veranschaulichen, die hohe Abhängigkeit zeigt der große Korrelationskoeffizient r = - 0,95 (Abb. 7; Tab. A 7). Der erneute Längenzuwachs in diesem Bereich zwischen dem 15. bis 19. Tag post partum unterbricht diese Entwicklung. 48
55 Länge [cm] Tage p.p. Tage p.p Anzahl n Abb. 7: Regression der Länge des vestibulo-vaginalen Abschnitts an den einzelnen Tagen post partum (Angaben x + s). Als Teilergebnis dieser Auswertung kann somit gelten, dass es bei Schweinen in den ersten 10 Tagen post partum zwar zu einer Verkürzung des vestibulo-vaginalen Abschnitts im Sinne einer postpartalen Regression kommt. In den folgenden 7 Tagen wechseln sich jedoch die Verlängerungs- und Verkürzungsperioden ab. Die Längenzunahme zu Beginn der 3. Woche kann als Ausdruck der frühen Reorganisation dieses Abschnittes des Genitaltraktes hinsichtlich erneuter Reproduktionsprozesse gedeutet werden. Das Alter der Sau hat dabei keinen entscheidenden Einfluss auf die Länge des vestibulo-vaginalen Abschnitts, gleich zu welchem Involutionszeitpunkt gemessen wird. Ähnlich verhält sich die Breitenausdehnung der Vagina. In Gruppe 1 beträgt die mittlere Breite 5,5 + 0,7 cm, in Gruppe 2: 4,0 + 0,0 cm, in Gruppe 3: 4,3 + 0,7 cm und in Gruppe 4: 3,6 + 0,6 cm. Die Unterschiede zwischen der Gruppe 1 und den Gruppen 2, 3 und 4 sowie zwischen Gruppe 3 und 4 sind signifikant (p < 0,05) (Abb. 49
56 8; Tab. A 8). Der Involutionsfortschritt bis zum 10. Tag post partum wird durch dieses Kriterium bestätigt. Danach kommt es, ähnlich wie bei der Länge des vestibulo- vaginalen Bereichs, in Gruppe 3 zu einem erneuten geringen Anstieg. 7,0 6,0 Vaginalbreite [cm] 5,0 4,0 3,0 2,0 1,0 0, Gruppe Gruppe Tage p.p Anzahl n Abb. 8: Breitenmaße der Vagina bei Schweinen bis zur 4. Woche post partum (Angaben x + s). (Signifikanzen: 1:2, 1:3 und 3:4, p<0,05) Auch die Analyse der Mittelwerte der Vaginalbreite an den einzelnen Tagen post partum bestätigt die schnelle Regression innerhalb der ersten Zeit nach der Abferkelung. Zwischen dem 5. und 16. Tag post partum ist die Breitenabnahme signifikant (p < 0,05). Eine erneute deutliche Breitenzunahme zeigt sich zwischen dem Tag post partum. Auch sie steht offenbar für die wiederbeginnenden zyklischen Reorganisationsvorgänge (Abb. 9; Tab. A 9). Die Veränderung der Mittelwerte in diesem Zeitraum lässt sich mittels der linearen Regressionsgleichung y = -0,79 + 0,27 x darstellen. Der Anstieg und der Koeffizient r = 0,97 spiegeln die positive Korrelation der Merkmale wider. 50
57 7,0 6,0 Vaginalbreite [cm] 5,0 4,0 3,0 2,0 1,0 0, Tage p.p. Tage p.p Anzahl n Abb. 9: Die Regression der Breite der Vagina an den einzelnen Tagen post partum (Angaben x + s). (Signifikanz: 5:16, p<0,05) Ein differentes Geschehen zeichnet sich hinsichtlich der Vaginalwanddicke in Beziehung zur Länge der Postpartalperiode ab (Abb. 10; Tab. A 10). Hier überwiegt zunächst die Erneuerung der einzelnen Gewebsschichten. Dies wird erkennbar an den folgenden Zahlen. Die Probanden der Gruppe 1 weisen einen Mittelwert von 0,65 + 0,2 cm auf. Etwas höher liegt der Wert der Gruppe 2 mit 0,70 + 0,3 cm. Für Gruppe 3 beträgt er 0,50 + 0,2 cm und in Gruppe 4 verringert er sich weiter auf 0,40 + 0,2 cm. Die zugehörige lineare Regressionsgerade von Gruppe 2-4 lautet y = 0,90-0,02 x und der Korrelationskoeffizient r = - 0,99. 51
58 1,2 Vaginalwanddicke [cm] 1,0 0,8 0,6 0,4 0,2 0, Gruppe Gruppe Tage p.p Anzahl n Abb. 10: Die postpartale Rückbildung der Vaginalwanddicke bei Schweinen (Angaben x + s). Der Vergleich der Vaginalwanddicken an den einzelnen Tagen post partum ergibt ein detaillierteres Ergebnis (Abb. 11; Tab. A 11). Die folgende Interpretation ist allerdings vorsichtig zu bewerten, hier eignet sich die histologische Betrachtung der Uteruswand besser, da die Wandschichten unterschiedliche Regenerationsabläufe aufweisen. Zunächst findet eine schnelle Reduktion in der Zeit um den 4. Tag nach der Abferkelung statt. Sie wird offensichtlich am 10. Tag post partum schon durch Reorganisationsvorgänge unterbrochen, was sich durch eine erneute leichte Zunahme der Wanddicke zu diesem Zeitpunkt ableiten lässt. Ab dem 15. Tag nach der Abferkelung dominieren kurzfristig noch einmal die Formierungsvorgänge bis zum 22. Tag post partum. Diese eindeutig gerichtete Entwicklung innerhalb der 3. Postpartumwoche findet ihren Ausdruck in der linearen Regressionsgleichung y = 1,59-0,06 x. Der Korrelationskoeffizient r = - 0,93 zeigt wiederum eindeutig den linearen Zusammenhang von Vaginalwanddicke und den Tagen post partum. 52
59 Die Probanden, welche die folgenden Tage ( Tag post partum) repräsentieren, besitzen eine gleichmäßige, cirka 0,4 cm dicke Vaginalwand. Zur Interpretation eignet sich die histologische Betrachtung der Uteruswand besser, da die Wandschichten unterschiedliche Involutions- und Regenerationsabläufe aufweisen. 1,2 Vaginalwanddicke [cm] 1,0 0,8 0,6 0,4 0,2 0, Tage p.p. Tage p.p Anzahl n Abb. 11: Die Rückbildung der Vaginalwanddicke an den einzelnen Tagen post partum (Angaben x + s). Die Wurfgröße hat nach dieser Untersuchung also keinen Einfluss auf die vestibulovaginale Länge, Vaginalbreite und -wanddicke. Die makroskopisch sichtbare Regression der Vagina in Bezug auf vestibulo-vaginale Länge und Vaginalbreite wird bereits ab dem 10. Tag post partum durch Regenerationsvorgänge abgelöst. Die Reorganisation, sichtbar durch eine Poliferation, ist in der Mitte der 2. postpartalen Woche abgeschlossen. Dies bedeutet, dass der periphere Abschnitt des Genitaltraktes nur eine kurze postpartale Rekonvaleszenz benötigt. 53
60 Mikroskopische Untersuchungen Nähere Erkenntnisse über die makroskopisch ermittelten Veränderungen in der frühen postpartalen Periode waren mittels histologischer Befunde zu eruieren. Es war darzustellen, in welchem Umfang sich die einzelnen Schichten der Vaginalwand histologisch mit fortschreitendem postpartalen Regenerationsablauf verändern. Dazu war es notwendig, die einzelnen Wandschichten einer gesonderten Betrachtung zu unterziehen. Regression und Reorganisation des Epithelium stratificatum squamosum cornescens sind nicht allein durch die sich ändernde Schichtdicke verifizierbar. Der wechselnde Verhornungsgrad, die unterschiedlichen Zellformen, die Anzahl der Zellreihen, die Lage der Zellkerne und die Faltenbildung sind weitere Kriterien, welche zur Charakterisierung der postpartalen Veränderung herangezogen werden müssen. Die Schichtdicke erfährt in den ersten 10 Tagen post partum eine starke Reduktion. Die dann einsetzenden Regenerationsvorgänge führen jedoch zwischen dem 15. und 21. Tag post partum wieder zu einer erneuten Ausdehnung. Sie ist nicht von Dauer. Denn mit Abschluss der Sexualrekonvaleszenz kommt es wiederum zu einem reduzierten Niveau der Schichtdicke (Abb. 12; Tab. A 12) 3. Besonders hervorzuheben ist der wechselnde Verhornungsgrad des Epithelium stratificatum squamosum cornescens. Gruppe 1 weist ein mehrschichtiges, unverhorntes Plattenepithel auf. Durch Regressions- und Proliferationsvorgänge erfährt es mit Zunahme des Abstandes zur Geburt, eine Wandlung zum mehrschichtigen, teilweise verhornten Plattenepithel (Gruppe 4), welches beim Schwein für den Proöstrus und Östrus charakteristisch ist. 3 zwei Probanden sind histologisch nicht auswertbar 54
61 In den ersten Tagen post partum besitzen die Zellen große runde Nuclei und wenig Zytoplasma. Der Epithelsaum besteht aus 3 bis 5 Zelllagen. Es folgt in der zweiten Woche post partum ein Zellabbau. Lockere Zellwände und viele Kernfragmente charakterisieren nun das Oberflächenepithel. Gleichzeitig bestehen in Teilabschnitten nur noch zwei Zellreihen, deren Kerne basal angeordnet sind. Hier zeigen sich zu den sonst vorherrschenden Primär- auch wenige Sekundärfalten. In der dritten Woche post partum liegen die Zellkerne sowohl basal als auch apikal angeordnet in mehreren kompakten Zellreihen. Zum Ende des Beobachtungszeitraumes besteht das Epithel aus mehreren dichten Zellreihen mit auffallend kleinen Zellkernen Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 12: Postpartale Regeneration des Epithelium stratificatum squamosum cornescens der Vagina (Angaben x + s). Das sich anschließende Stratum cellulare ist deutlich umfangreicher als das Epithelium stratificatum squamosum cornescens. In den ersten 10 Tagen verliert 55
62 auch diese Schicht an Mächtigkeit (Abb. 13; Tab. A 13) 4. Die sich zeitlich daran anschließende Erneuerung führt zu einem kontinuierlichen Zuwachs, der sich mittels linearer Regressionsberechnung y = 49,54 + 1,35 x im Zeitraum Tag post partum darstellen lässt (Korrelationskoeffizient r = 0,92). Unmittelbar post partum befinden sich viele Erythrozyten in dieser Schicht. In der zweiten Woche sind die kollagenen Fasern sehr locker angeordnet. Zum Zeitpunkt der dritten und vierten Woche wandern viele Lymphozyten ein und die zahlreichen Zellkerne deuten auf erneuerte Zellen hin. Ein direkter Zusammenhang zum bevorstehenden neuen Zyklusbeginn ist anzunehmen Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 13: Postpartale Regeneration des Stratum cellulare der Vagina (Angaben x + s). Werden die beiden Schichten Epithelium stratificatum squamosum cornescens und Stratum cellulare von jedem einzelnen Probanden addiert und im Folgenden die 4 zwei Probanden sind histologisch nicht auswertbar 56
63 Gruppenmittelwerte neu errechnet, zeigt sich folgendes Resultat hinsichtlich der Veränderungen in der Schichtdicke: Gruppe 1 148,0 + 13,1 µm (mit Minimum 137 µm, Maximum 162 µm) Gruppe 2 96,2 + 28,6 µm (mit Minimum 78,3 µm, Maximum 129 µm) Gruppe 3 114,0 + 58,2 µm (mit Minimum 48,8 µm, Maximum 282 µm) Gruppe 4 113,5 + 23,9 µm (mit Minimum 70,4 µm, Maximum 139,6 µm) Diese Form der Auswertung bestätigt die schnelle Rückbildung der beiden inneren Epithelschichten der Tunica mucosa in den ersten 10 Tagen post partum, denen lediglich geringe Reorganisationsvorgänge folgen. Stratum reticulare und Stratum fibrillare der Vaginalwand sind dagegen nicht so eindeutig voneinander zu trennen (Abb. 14; Tab. A 14) 5. Als Einheit betrachtet weist Gruppe 1 einen Mittelwert von µm (Minimum µm, Maximum µm), Gruppe 2 einen solchen von µm (Minimum 205 µm, Maximum µm) auf. In Gruppe 3 steigt dieser Wert wieder auf µm (Minimum 519 µm, Maximum µm) und in Gruppe 4 kommt es zu einer weiteren Zunahme auf µm (Minimum 442 µm, Maximum µm). Die Regeneration dieser Vaginalwandschichten nach der Geburt entspricht somit der des Stratum cellulare. Auch hier lässt sich der Anstieg der Mittelwerte, als Ausdruck der Reorganisationsvorgänge in der Zeit vom Tag 5 zwei Probanden sind histologisch nicht auswertbar 57
64 post partum, als lineare Regressionsgleichung y = 470, ,51 x mit dem Korrelationskoeffizient r = 0,999 darstellen Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 14: Postpartale Regeneration des Stratum reticulare und des Stratum fibrillare der Vagina (Angaben x + s). Die postpartale Rekonvaleszenz der Tunica muscularis stellt sich differenziert zur Tunica mucosa dar. Das Stratum circulare erfährt eine gleichmäßige Schichtdickenzunahme, welche sich auf einem leicht erhöhten Niveau einpendelt. Schon am 15. Tag post partum sind nicht nur die Regressions- sondern auch die Reorganisationsvorgänge abgeschlossen (Abb. 15; Tab. A 15) 6. Die Gleichung der Regressionsgerade lautet y = 2.625, x, mit dem Korrelationskoeffizient r = 0,97. Durch ihren marginalen Anstieg wird trotzdem deutlich, dass in der Rekreationsphase die Reparation der Faserbündel dominiert. 6 zwei Probanden sind histologisch nicht auswertbar 58
65 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 15: Postpartale Regeneration des Stratum circulare der Vagina (Angaben x + s). Konträr dazu verläuft die Entwicklung des Stratum longitudinale (Abb. 16; Tab. A 16) 7. Die abfallende Gerade der linearen Regression mit y = 4485,97-88,19 x und der Korrelationskoeffizient r = - 0,97 spiegeln den Schichtdickenverlust wider. Auch hier ist mit dem 15. Tag post partum das Ziel der vollständigen postpartalen Genesung erreicht, unter der Vorraussetzung, dass die intra partum entstandenen Verletzungen nicht zu gravierend gewesen sind. 7 drei Probanden sind histologisch nicht auswertbar 59
66 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 16: Postpartale Regression des Stratum longitudinale der Vagina (Angaben x + s). Weiterhin nimmt der Umfang der gesamten Tunica muscularis mit zunehmendem zeitlichen Abstand von der Abferkelung stetig ab. Als Besonderheit ist herauszustellen, dass bei einigen Probanden longitudinale Muskelfasern im Stratum circulare zu finden sind, dieses Phänomen ist bei der Spezies Schwein einzigartig. Die Daten der Tunica serosa beziehungsweise Adventitia lassen keine Regressionstendenzen erkennen. Es gibt keine Übereinstimmung innerhalb der jeweilig gewählten Zeitzone post partum. In der Lamina propria der Vaginalwand war keine Drüsenstruktur nachweisbar. In der Sexualrekonvaleszenzperiode der Vagina zeigen makroskopische und histologische Parameter zunächst unterschiedliche Genesungsfortschritte innerhalb der ersten Tage post partum. Tendenziell ist die Regression mit dem 10. Tag und die Reorganisation mit dem 15. Tag post partum abgeschlossen. 60
67 Cervix Makroskopische Untersuchungen Die Cervix stellt den Übergang zwischen dem peripheren und medialen Abschnitt im Sexualtrakt jedes Säugetieres dar. Die im Rahmen dieser Arbeit gemessenen Daten bei Sauen nach der Geburt zeigen eindrucksvoll die schnelle Involution dieses Bereiches post partum. Die Darstellung in den 4 Gruppen veranschaulicht, dass schon am 10. Tag post partum sowohl die Länge als auch die Breite der Cervix und der Durchmesser des Lumens vollständig zurückgebildet sind. Die offensichtliche, jedoch nur geringfügige Zunahme der Mittelwerte aller drei Parameter in Gruppe 3 ( Tag post partum) steht ebenfalls, wie auch bei der Vagina, für die Reorganisationsvorgänge zu diesem Zeitpunkt. Signifikant (p < 0,05) ist die Involution der Breitenausdehnung von Gruppe 1 zu den Gruppen 2-4. Die Länge der Cervix verkürzt sich um 30 %, die Breite um 45 % bis zum 10. Tag post partum. Mit 2,7 + 0,7 cm ist der mittlere Durchmesser des Cervixlumens anfänglich in Gruppe 1 mehr als doppelt so groß wie der von Gruppe 2 (1,1 + 0,4 cm) und Gruppe 4 (1,1 + 0,4 cm). Die statistischen Messzahlen der Gruppe 3 lauten 1,5 + 0,6 cm. Für diesen geringen und zeitlich begrenzten Anstieg, könnte der hormonelle Einfluss des neubeginnenden Zyklus ursächlich sein (Abb. 17; Tab. A 17, Tab. A 18 und Tab. A 19). 61
68 Cervix: Länge, Breite und Durchmesser [cm] Länge Breite Durchmesser Gruppe Gruppe Tage p.p Anzahl n Abb. 17: Postpartale Regression von Länge, Breite und Lumendurchmesser der Cervix bei Schweinen. (Signifikanzen der Breite: 1:2 und 1:3, p<0,05) Eine zusätzliche Betrachtung der Mittelwerte an den einzelnen Tagen post partum verdeutlicht ebenfalls die schnelle Verkürzung der Cervixlänge von 19,5 cm am 3. Tag auf 7,7 cm am 10. Tag post partum. Im weiteren Verlauf schwankt die Länge zwischen 7,0 und 9,0 cm (Abb. 18; Tab. A 20). Die Veränderung der Mittelwerte der Cervixlänge zwischen den Tagen 3-10 post partum lässt sich mittels der linearen Regressionsfunktion y = 19,07 1,25 x darstellen. Der steile Abfall der Geraden weist auf die schnelle Regression hin. Die progressive Entwicklung spiegelt sich im zugehörigen Korrelationskoeffizienten r = - 0,76 wider. Der Verlauf vom Tag post partum ergibt hingegen die lineare Regressionsgerade y = 6,25 + 0,13 x mit dem Korrelationskoeffizient r = 0,80. Ihr horizontaler Verlauf verdeutlich allein die Reorganisation. 62
69 Eine gleiche Tendenz spiegelt sich bei der Cervixbreite wider. Am Tag post partum variiert die Breite zwischen 5,5 und 8,0 cm, ab dem 10. Tag nur noch zwischen 2,5 und 4,0 cm (Abb. 18; Tab. A 21). Die Sauen, welche zwischen dem 3. und 5. Tag post partum für die Untersuchung zur Verfügung stehen, haben einen Cervixdurchmesser von 2,0 bis 3,3 cm, während sich das Lumen im Zeitraum 10. bis 27. Tag post partum auf 0,3 bis 1,5 cm verkleinert (Abb. 18; Tab. A 22). 20 Cervix: Länge, Breite und Durchmesser [cm] Länge Breite Durchmesser Tage p.p. Tage p.p Anzahl n Abb. 18: Regression von Länge, Breite und Lumendurchmesser der Cervix an den einzelnen Tagen post partum. Ein Zusammenhang zwischen der Regression hinsichtlich Länge, Breite und Durchmesser des Cervikalkanals in Abhängigkeit zur Zeit post partum, im Vergleich zur Wurfgröße oder Parität der Tiere, kann statistisch allerdings nicht belegt werden. Resümierend kann ausgeführt werden, dass makroskopisch beobachtet, die Rückbildung der Cervix am 10. Tag post partum weitgehend abgeschlossen ist. 63
70 Lediglich geringgradige Reorganisationsabläufe sind noch bis zum 18. Tag post partum nachzuweisen. Mikroskopische Untersuchungen Die histologische Untersuchung der Cervixwand lässt folgende Aussagen zu : Das Epithelium pseudostratificatum columnare zeigt im Vergleich der Gruppen eine deutliche Verminderung seiner Ausdehnung mit fortschreitendem postpartalen Regenerationsablauf (Abb. 19; Tab. A 23). Signifikant (p < 0,05) ist der Schichtdickenverlust von Gruppe 1 zu den Gruppen 2 4. Die kontinuierliche Abnahme der Schichtdicke lässt sich von Gruppe 1 3 mit einer Geradengleichung veranschaulichen (Abb. 20). Der Korrelationskoeffizient von r = - 0,98 verdeutlicht die enge Beziehung der beiden Variablen. Der Wandel des Epithels hinsichtlich der Lage der Zellkerne und Anzahl der Zellreihen ist identisch mit dem des Vaginalepithels. Nur ist in diesem Abschnitt des Genitaltraktes das Epithel nicht verhornt. Darüber hinaus sind außer den Primär- und Sekundärfalten auch tertiäre Falten darstellbar. 64
71 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 19: Postpartale Regression des Epithelium pseudostratificatum columnare der Cervix (Angaben x + s). (Signifikanz: 1:2, p<0,05) 120 y = 80,08-3,04 x; r = - 0,98 Schichtdicke [µm] Tage p.p. Abb. 20: Postpartale lineare Regressionsfunktion des Epithelium pseudostratificatum columnare der Cervix mit Korrelationskoeffizient (r). Nahezu gleich ist der Verlauf des angrenzenden Stratum cellulare in der Postpartalphase (Abb. 21; Tab. A 24). Mit zunehmendem Abstand von der Geburt vermindert sich der Umfang dieser Gewebsschicht von Gruppe 1 mit ,7 µm 65
72 auf 82,4 + 70,5 µm in Gruppe 2 und auf 62,7 + 31,7 µm in Gruppe 3. Die Veränderung zu Gruppe 4 mit 67,1 + 41,4 µm ist nur noch marginal. Der Schichtdickenverlust der Mittelwerte der Gruppen 1-3 lässt sich mittels der linearen Regressions-Berechnung y = 145,21 4,91 x darstellen, ihr Korrelationskoeffizient beträgt r = - 0,9. Eine große Anzahl an Erythrozyten beherrscht in der ersten Woche post partum den histologischen Bildausschnitt. Abwehrzellen wie Lymphozyten und Makrophagen sind zahlreich und nahezu in der gesamten späteren Postpartalphase zu finden. Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 21: Postpartale Regression des Stratum cellulare der Cervix (Angaben x + s). Das Stratum reticulare und Stratum fibrillare lassen sich, wie zuvor bei der Vagina, auch hier strukturell nicht differenzieren (Abb. 22; Tab. A 25). Die Berechnung der statistischen Messzahlen in den einzelnen Gruppen ergibt eine Regression der Schichtdicken von Gruppe 1 mit µm (Minimum µm, Maximum µm) zu Gruppe 2 mit µm (Minimum 92,9 µm, 66
73 Maximum µm). In Gruppe 3 (n = 18 Sauen) 8 nimmt der Umfang allerdings wieder auf µm zu (Minimum 588 µm, Maximum µm) und bleibt in Gruppe 4 mit µm (Minimum µm, Maximum µm) auf diesem Niveau. Dies bedeutet, nach einer starken Regression beginnt die Reorganisation dieser Schichten bereits ab dem 10. Tag post partum. Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 22: Postpartale Regression des Stratum reticulare und des Stratum fibrillare der Cervix (Angaben x + s). Beide Muskelschichten der Cervixwand sind sehr stark ausgeprägt, insbesondere das Stratum circulare. Dennoch ist eine genaue Differenzierung beider Schichten nicht immer möglich, so bei 6 der 37 Probanden, dies entspricht 16 %. Zusätzlich ziehen Muskelfasern bis in die Lamina propria hinein und lassen diese drei Wandschichten wie eine einzige erscheinen. Alle 6 Sauen, die dieses Phänomen aufweisen, gehören in die Gruppe 3. 8 Verminderter Stichprobenumfang, da eine eindeutige Differenzierung der einzelnen histologischen Schichten nicht immer möglich ist. 67
74 Die folgenden Mittelwerte der Tunica muscularis beschränken sich auf die Tiere, bei denen eine Schichtdifferenzierung möglich ist (n = 29) 9 (Abb. 23; Tab. A 26). Die Regression des Stratum circulare verläuft wie folgt: Die Durchschnittswerte der vier Gruppen im Vergleich lassen einen starken Abfall von Gruppe 1 mit µm (Minimum µm, Maximum µm) zu Gruppe 2 mit µm (Minimum µm, Maximum µm) erkennen, gefolgt von einem Wiederanstieg der Werte in Gruppe 3 (n = 16) 10 mit µm (Minimum µm, Maximum µm) und in Gruppe 4 mit µm (Minimum µm, Maximum µm). Besonders hervorzuheben ist die enorme Mächtigkeit dieser Schicht zum Zeitpunkt der Geburt. In keinem Abschnitt des Sexualtraktes der Sau sind die zirkulären Faserbündel postpartal so ausgeprägt, wie in der Cervix. Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 23: Postpartale Regression des Stratum circulare der Cervix (Angaben x + s). 9 Verminderter Stichprobenumfang, da eine eindeutige Differenzierung der einzelnen histologischen Schichten nicht immer möglich ist. 10 Verminderter Stichprobenumfang, da eine eindeutige Differenzierung der einzelnen histologischen Schichten nicht immer möglich ist. 68
75 Das Stratum longitudinale weist in Gruppe 1 den Mittelwert µm (Minimum µm, Maximum µm) auf. Er ist somit doppelt so hoch wie der von Gruppe 2 mit µm (Minimum µm, Maximum µm), während die leicht ansteigenden Werte der Gruppen 3 und 4 mit µm (Minimum µm, Maximum µm) und µm (Minimum µm, Maximum µm) nahezu identisch sind (Abb. 24; Tab. A 27). Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 24: Postpartale Regression des Stratum longitudinale der Cervix (Angaben x + s). Eine Addition der Mittelwerte des Stratum reticulare und fibrillare sowie des Stratum circulare und longitudinale aller Probanden in den jeweiligen Gruppen ergeben, um die Gesamtveränderung der zervikalen Schichtdicke zu verifizieren, folgende Werte: Gruppe µm (Minimum µm, Maximum µm) Gruppe µm
76 (Minimum µm, Maximum µm) Gruppe µm (Minimum µm, Maximum µm) Gruppe µm (Minimum µm, Maximum µm) (Abb. 25; Tab. A 28). Es zeigt sich eine schnelle Regression aller vier Schichten in den ersten 10 Tagen post partum sowie eine in Gruppe 3 und 4 wieder aufgebaute und regenerierte Basal- und Wandmuskelschicht Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 25: Postpartale Regression des Stratum reticulare und fibrillare sowie des Stratum circulare und longitudinale der Cervix (Angaben x + s). Die Tunica serosa der Cervix zeigt im Postpartalverlauf keine eindeutigen Tendenzen. 70
77 Als Resultat für diesen Abschnitt der Untersuchung ist anzugeben, dass die an der Cervix ermittelten maroskopischen Ergebnisse mit den histologischen übereinstimmen. Während die Regression in der ersten Postpartalwoche dominiert, wird sie in den folgenden zwei Wochen mehr und mehr durch Reorganisationsvorgänge abgelöst. Die Involution ist mit wenigen unbedeutenden Verzögerungen in den ersten drei Wochen post partum vollständig abgeschlossen Uterus Uterusgewicht Makroskopische Untersuchungen Die Veränderungen am Uterus im postpartalen Zeitraum sind sehr deutlich und im Vergleich zu der Vielzahl ausgewerteter Parameter aus graviditäts- und geburtsbelastenden Gründen am ausgeprägtesten. Dies gilt insbesondere für die Uterusmasse (Abb. 26; Tab. A 29). Vom Tag post partum verliert der Uterus signifikant (p < 0,05) 53 % seines Gewichtes. Bis zum 21. Tag sinkt dieses um weitere 33,9 %, bevor es sich in den folgenden 6 Tagen wieder um 6 % erhöht. Diese Veränderungen der Mittelwerte der Gruppen 1-3 lassen sich mittels der linearen Regressionsgleichung y = 5.334,86 197,71 x wiedergeben. Ihr enormer Abfall spiegelt die Dominanz der Regression wider. Ihr schließt sich ab dem 15. Tag post partum die Reorganisation an. Die Korrelation der Variablen ist mit r = - 0,98 sehr groß. 71
78 Die erneute Gewichtszunahme in der 3. Woche post partum ist wahrscheinlich Ausdruck einer Wasserretention aufgrund der Östrogenisierung, hervorgerufen durch die wiederbeginnende Ovarfunktion. Besonders erwähnenswert sind die extremen Schwankungen der Uterusmasse zu diesem Zeitpunkt, erkennbar an der hohen Standardabweichung und einem Variationskoeffizienten von 108 %. Die Parameter deuten auf eine zeitlich verzögerte Rekonvaleszenz bei einigen Tieren hin Uterusgewicht [g] Gruppe Gruppe Tage p.p Anzahl n Abb. 26: Uterusgewichte bei Schweinen in verschiedenen Abschnitten der postpartalen Periode (Angaben x + s). (Signifikanz: 1:2, p<0,05) Die Gegenüberstellung des Uterusgewichts zu den einzelnen Tagen post partum lässt den Schluss zu, dass bis zum 16. Tag die Regression vollständig abgeschlossen ist. Proliferationsvorgänge schließen sich an. Die Reorganisation des Gewebes ist makroskopisch nicht verifizierbar (Abb. 27; Tab. A 30). 72
79 Uterusgewicht [g] Tage p.p. Tage p.p Anzahl n Abb. 27: Uterusgewichte an den einzelnen Tagen post partum (Angaben x + s) Corpus uteri Makroskopische Untersuchungen Einen kontinuierlichen Involutionsverlauf zeigt das Corpus uteri (Abb. 28; Tab. A 31). Besitzt der Uteruskörper in Gruppe 1 ( Tag post partum) noch eine Durchschnittslänge von 6,3 + 1,3 cm, so kommt es zu einer gleichmäßigen Längenverkürzung in den folgenden Wochen. In Gruppe 2 (10. Tag post partum) beträgt die mittlere Länge 5,3 + 3,2 cm, in Gruppe 3 ( Tag post partum) 4,8 + 1,7 cm und in Gruppe 4 ( Tag post partum) nur noch 3,8 + 0,8 cm. Die Gesamtreduzierung im beschriebenen Untersuchungszeitraum beläuft sich damit auf 39,7 %. Bis auf wenige Ausnahmen sind alle Sauen hinsichtlich der Größenabnahme des Corpus uteri unabhängig vom Geburtsalter sehr homogen. Eine Ausnahme bildet die 73
80 Sau Nr. 8, die am 17.Tag post partum noch eine Corpuslänge von 11,0 cm vorweist. Bei ihr scheint keine weitere Retraktion mehr stattzufinden, obwohl ihre Geburtenzahl erst bei 7 Würfen liegt. Die individuelle Variabilität, verdeutlicht durch die hohe Standardabweichung, ist teilweise durch die unterschiedliche Parität und/oder Wurfgröße zu erklären. Corpuslänge [cm] 9,0 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 0, Gruppe Gruppe Tage p.p Anzahl n Abb. 28: Die Länge des Corpus uteri bei Sauen im postpartalen Zeitraum (Angaben x + s). Der lineare Längenverlust über alle vier Gruppen lässt sich mittels der Geradengleichung y = 6,66-0,11 x beschreiben (Abb. 29), mit dem zugehörigen Korrelationskoeffizienten r = - 0,98. 74
81 y = 6,66-0,11 x; r = -0,98 Corpuslänge [cm] 9,0 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 0, Tage p.p. Abb. 29: Der lineare Längenverlust des Corpus uteri bei Sauen im postpartalen Zeitraum mit Korrelationskoeffizient (r). Die durchschnittlichen Corpuslängen im regenerierten Uterus erlangen Größenordnungen zwischen 3,0-4,8 cm. Individuelle Unterschiede sind aufgrund der teilweise nur geringen Regression visuell von einer erneuten Proliferation nicht zu unterscheiden (Abb. 30; Tab. A 32). Corpuslänge [cm] 9,0 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 0, Tage p.p. Tage p.p Anzahl n Abb. 30: Reduktion der Corpuslänge an den einzelnen Tagen im postpartalen Zeitraum (Angaben x + s). 75
82 Der Involutionsverlauf der Breitenausdehnung des Corpus uteri und der Cervix verhalten sich analog. Auch in dieser Lokalisation des Sexualtraktes zeigt sich ein signifikanter Breitenverlust (p < 0,05) in den ersten 10 Tagen post partum. Die Rekreation der Corpuswand verläuft übereinstimmend mit der caudalen Uterushornwand und wird in Kapitel dargestellt. Die Zusammenfassung der untersuchten Messdaten des Corpus uteri verdeutlicht, dass in der 3. Postpartalwoche sein praegravides Stadium erreicht ist. Zusammenhänge zwischen den Maßen des Corpus uteri und der Parität oder der Wurfgröße sind zwar tendenziell gegeben, jedoch statistisch nicht eindeutig verifizierbar. Mikroskopische Untersuchungen Eine histologische Übersicht über den Aufbau der Schichten des Endometriums und des Myometriums in der Uteruswand veranschaulicht die folgende Abbildung (Abb. 31). Unterschiedliche progressive Involutionsabläufe in den einzelnen Schichten differenzieren die Rekreationsphase post partum und erfordern eine detaillierte Betrachtung. 76
83 Epithelium pseudostratificatum columnare Stratum cellulare Stratum reticulare Stratum fibrillare Stratum circulare Stratum longitudinale Lamina propria serosae Lamina epithelialis serosae Abb. 31: Ansicht des Endometriums, Myometriums und Perimetriums bei der Sau im postpartalen Zeitraum (d = 18). Das Epithelium pseudostratificatum columnare, welches zum Lumen des Uterus gerichtet ist, ist die Wandschicht im Endometrium des Corpus, die eine deutliche histologische Veränderung post partum durchläuft (Abb. 32; Tab. A 33). 77
84 Die Höhe des Epitheliums vermindert sich signifikant (p < 0,05) zwischen dem 3. und 5. Tag post partum (Gruppe 1) bis zum 10. Tag post partum (Gruppe 2). Danach bleibt sie auf etwa gleichem Niveau Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 32: Postpartale Regeneration des Epithelium pseudostratificatum columnare des Corpus uteri (Angaben x + s). (Signifikanz: 1:2, p<0,05) Das endometriale Oberflächenepithel wandelt sich ab dem 3. Tag post partum von einem mehrreihig-hochprismatischen zu einem einschichtig bis mehrreihigen hochprismatischen Epithel am 5. Tag post partum. Große runde, deutlich gefärbte Nuclei, nur wenig Zytoplasma, zahlreiche Kernfragmente und gelegentlich sichtbare Mitosen sind charakteristisch für diesen Zeitraum. Die Mikrovillizelle ist der vorherrschende Zelltyp dieser Schicht. In der 2. Postpartalwoche stellen sich die Nuclei chromatinarm und längsoval dar. Nur wenige Zellreihen sind erkennbar. Ab der 3. Woche lagern die Kerne vermehrt wieder Chromatin ein, ihr Durchmesser nimmt deutlich zu, so dass in der 4. Woche post partum nur noch wenig lumenwärts gerichtetes Zytoplasma vorhanden ist. 78
85 Die mikroskopische Betrachtung zeigt somit am 15. Tag ein regeneriertes, mehrreihig hochprismatisches Epithelium pseudostratificatum columnare (Abb. 33), welches jederzeit proliferieren kann. M L K Abb. 33: Ansicht des regenerierten, mehrreihig hochprismatischen Epitheliums pseudostratificatum columnare am 15. Tag post partum (x = 27 µm). Mikrovillizelle (M), Lymphozyt (L), längsovaler Zellkern (K) Das Stratum cellulare ist im Bereich des Corpus uteri markant vom Stratum reticulare zu unterscheiden. Beim Stratum cellulare kommt es zu einer anderen histologisch nachweisbaren Reaktion post partum als beim Oberflächenepithel (Abb. 34; Tab. A 34). Diese Schicht nimmt vom Zeitpunkt des Frühpuerperiums bis zur 3. Woche post partum kontinuierlich zu. Die Veränderung der Mittelwerte der Gruppen 1-3 lässt sich mittels der linearen Regressionsfunktion y = 69,86 + 2,40 x darstellen. Ihr Anstieg charakterisiert die enorme Aktivität dieser Zellschicht zu diesem Zeitpunkt. Die Korrelation der Variablen ist mit r = 0,97 sehr groß. 79
86 Erst in der 4. Woche post partum erfährt diese Wandschicht eine Reduktion, die bis auf das Niveau des postpartalen Ausgangswertes führt. Unmittelbar post partum ist das Stratum cellulare sehr zellreich, zusätzlich befinden sich viele Erythrozyten und Lymphozyten in dieser Schicht. Sie lockert nach und nach auf, um schon in der dritten Woche post partum wieder vollständig regeneriert, mit vielen kompakten Zellen und erneuter Einwanderung von Lymphozyten zu erscheinen. Daraus ist zu schließen, dass dieser Zellschicht eine Führungsrolle in der Immuabwehr im Rahmen der postpartalen Regenerationsprozesse zukommt. Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 34: Postpartale Regeneration des Stratum cellulare des Corpus uteri (Angaben x + s). Davon different verhält sich das Stratum reticulare. Hier ist ähnlich wie beim Epithelium pseudostratificatum columnare wieder ein kontinuierlicher Umfangsverlust von der Geburt bis zum Ende der 3. Woche post partum zu beobachten (Abb. 35; Tab. A 35). 80
87 Die Mittelwerte der Gruppen 1-4 fallen gleichmäßig von µm über µm und µm auf µm ab. Diese Abnahme lässt sich mittels der linearen Regressionsgleichung y = 2.138,40-40,79 x darstellen, mit dem Korrelationskoeffizienten r = - 0,99. Die hohe Variabilität der Individualwerte beruht auf der jeweiligen Faltenbildung, die in der frühen Postpartalphase durch große mächtige und in der späteren durch viele kleine Falten gekennzeichnet ist. Diese Zellschicht besteht zugleich aus Gefäßen und Drüsen. Sie erscheinen je nach Regenerationszustand sowohl in ihrer Anzahl als auch in ihrem Umfang zunächst zahlreich und mächtig, im weiteren Verlauf sporadisch und klein. In der 4. Woche post partum befinden sich die Gefäße und Drüsen in einer Ruhephase Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 35: Postpartale Regeneration des Stratum reticulare des Corpus uteri (Angaben x + s). Die postpartalen Regressionsvorgänge im Bereich des Stratum fibrillare zeigen dagegen keine eindeutigen Entwicklungstendenzen (Abb. 36; Tab. A 36). Vielmehr bleibt dieser Wandanteil im Verlauf der Untersuchung, gemessen an der Schichtdicke, auf etwa gleichem Niveau. 81
88 Diese Schicht besteht unmittelbar nach der Geburt aus einem straffen Bindegewebe mit vielen Drüsen und zahlreichen Gefäßanschnitten. Im Lumen der Drüsenquerschnitte finden sich vermehrt Sekretspuren. Schon in der zweiten Woche post partum lockern sich die kollagenen Fasern allerdings stark auf, Drüsen und Gefäße nehmen in ihrer Anzahl ab. In der dritten Woche post partum findet ein Neuaufbau dieser Schicht statt. Viele Bindegewebsfasern, ein starker Durchblutungsgrad und zahlreiche kleine Drüsenanschnitte bestimmen nun das Bild. Lediglich die länglichen, schmaler werdenden Nuclei, Bindegewebszellen und die noch dichteren kollagenen Fasern charakterisieren die 4. Woche Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 36: Postpartale Regeneration des Stratum fibrillare des Corpus uteri (Angaben x + s). Einem anderen Regenerationsprozess unterliegt dagegen das Myometrium des Corpus uteri. Sowohl das Stratum circulare als auch das Stratum longitudinale weisen eine sehr deutliche Regression in der ersten Woche post partum auf. In Gruppe 1 beträgt der Mittelwert für die Ringmuskulatur µm. Bereits am 10. Tag post partum hat sich ihre Schichtdicke signifikant (p < 0,05) um 60 % 82
89 vermindert und bleibt im weiteren postpartalen Verlauf auf einem nahezu konstanten Niveau (Abb. 37; Tab. A 37). Die Muskelschicht ist in der ersten Woche post partum kompakt und nur an wenigen Stellen sind die Fasern durch die Geburt leicht verletzt. In diesem Areal befinden sich zahlreiche Erythrozytenansammlungen. In der folgenden Woche lockert der Faserverbund auf. Aber schon in der dritten Woche post partum sind die Muskelfaserbündel wieder komprimiert und besitzen viele chromatinhaltige Zellkerne. Einzelne Zelltrümmer sind stellenweise noch erkennbar. In der 4. Woche ist die Muskelschicht vollständig regeneriert Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 37: Postpartale Regeneration des Stratum circulare des Corpus uteri (Angaben x + s). (Signifikanzen: 1:2 und 1:3, p<0,05) Gleichgerichtet verhält sich das Stratum longitudinale: Unmittelbar post partum lässt sich ein Durchschnittswert von µm ermitteln. Bis zum 10. Tag post partum nimmt die Schichtdicke signifikant (p < 0,05) um 53 % ab (Abb. 38; Tab. A 38). 83
90 Ähnlich wie beim Stratum circulare kommt es in der 2. Postpartalwoche zu einer marginalen Zunahme, wobei sich in der 3. Woche post partum wieder eine geringfügige Reduktion einstellt Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 38: Postpartale Regeneration des Stratum longitudinale des Corpus uteri (Angaben x + s). (Signifikanzen: 1:2 und 1:3, p<0,05) Die Tunica serosa erfährt im postpartalen Zeitraum vorrangig eine Reorganisation ihrer Schicht, erkennbar durch den Anstieg der Schichtdicke bis zum 10. Tag post partum und der gleichbleibenden Mächtigkeit bis zum Ende der 3. Woche der Rekreationsphase (Abb. 39; Tab. A 39). 84
91 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 39: Postpartale Reorganisation der Tunica serosa des Corpus uteri (Angaben x + s). In der Wand des Corpus uteri befinden sich zusätzlich zahlreiche Drüsen, deren Lumendurchmesser ausschlaggebend für deren Sekretionsleistung ist (Abb. 40; Tab. A 40). Post partum betragen in Gruppe 1 der Drüsendurchmesser im Mittel 18,5 + 5,6 µm. Sie verkleinerten sich signifikant (p < 0,05) bis zum 10. Tag (Gruppe 2) auf 10,1 + 6,5 µm und weiter auf 6,5 + 3,8 µm (in Gruppe 3) und auf 5,0 + 1,1 µm (in Gruppe 4). 85
92 30 25 Drüsenlumen [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 40: Darstellung des Drüsenlumendurchmessers in der Wand des Corpus uteri in der postpartalen Periode (Angaben x + s). (Signifikanz: 1:2, p<0,05) Das Drüsenlumen verliert innerhalb der ersten 4 Wochen post partum kontinuierlich an Größe. Diese Entwicklung der Mittelwerte der Gruppen 1-4 ist zu veranschaulichen durch eine lineare Regressionsgleichung (Abb. 41). y = 18,88-0,63 x; r = -0,93 Schichtdicke [µm] Tage p.p. Abb. 41: Die Entwicklung des Drüsenlumendurchmessers in der Wand des Corpus uteri in der postpartalen Periode mit Korrelationskoeffizient (r). 86
93 Im Zeitraum der Untersuchung zeigt sich keine erneute Drüsensekretion. Die Menge der Drüsenanschnitte im histologischen Bild ist dagegen nicht repräsentativ für deren tatsächliche Anzahl, weil sie das Endometrium schlauchförmig durchziehen. In der nachstehenden Bildfolge (Abb ) sei die postpartale Entwicklung der Drüsen und Gefäße mikroskopisch dargestellt. D Abb. 42: Drüsenlumendurchmesser (D) am Abb. 43: Drüsenlumendurchmesser am 4. Tag post partum des Corpus uteri. 10. Tag post partum des Corpus uteri. Abb. 44: Drüsenlumendurchmesser am Abb. 45: Drüsenlumendurchmesser am 17. Tag post partum des Corpus uteri. 24. Tag post partum des Corpus uteri. Die Rekreationsphase des Corpus uteri post partum kann sowohl makroskopisch als auch histologisch bis zum 17. Tag post partum als abgeschlossen gelten. 87
94 Uterushörner Makroskopische Untersuchungen Die Uterushornlänge verändert sich innerhalb der untersuchten postpartalen Zeitspanne erheblich. Mit dem Korrelationskoeffizient r = - 0,94 und der dazugehörigen Regressionsgerade y = 147,74 2,23 x ist die Längenverkürzung linear zu verifizieren (Abb. 47). Haben die Uterushörner in der ersten Woche post partum eine Ausdehnung von ,8 cm, vermindert diese sich signifikant (p < 0,05) auf ,9 cm bis zum 10. Tag post partum. In der folgenden Zeit ( Tag post partum) ist die weitere Abnahme nur marginal. Im letzten Untersuchungszeitraum ist wieder eine deutlichere Verkürzung auf 94,2 + 14,4 cm (Abb. 46; Tab. A 41) zu beobachten Uterushornlänge [cm] Gruppe Gruppe Tage p.p Anzahl n Abb. 46: Regression der Uterushornlänge bei Schweinen in der postpartalen Periode (Angaben x + s). (Signifikanz: 1:2, p<0,05) 88
95 180 y = 147,74-2,23 x; r = - 0, Uterushornlänge [cm] Tage p.p. Abb. 47: Regressionsfunktion der Uterushornlänge bei Schweinen in der postpartalen Periode mit Korrelationskoeffizient (r). Allerdings sind individuelle Varianzen zu erkennen, wie in Abb. 48; Tab. A 42 dargestellt. Der Regressionsunterschied ist zwischen dem 15. und 17. Tag post partum signifikant (p < 0,05). Ursächlich hierfür sind unter anderem die Parameter Parität, Wurfgröße und Lebendgewicht der Sau. Ihr Einfluss ist bisweilen erheblich Uterushornlänge [cm] Gruppe Tage p.p Anzahl n Abb. 48: Die Regression der Uterushornlänge bei Schweinen an den einzelnen Tagen post partum (Angaben x + s). (Signifikanz: 15:17, p<0,05) 89
96 Eine verifizierbare Verringerung zeigt auch die Uterushornbreite (Abb. 49; Tab. A 43). Signifikant (p < 0,05) ist hier ebenfalls der Unterschied zwischen der Gruppe 1 (7,5 + 1,9 cm) zu den weiteren Gruppen. Die Breite nimmt von Gruppe 2 bis Gruppe 4 kontinuierlich von 3,6 + 2,1 cm; über 3,1 + 0,5 cm bis auf 2,4 + 0,4 cm ab. Die Entwicklung der Mittelwerte von Gruppen 1-4 lässt sich mittels der Geradengleichung y = 7,34 0,22 x darstellen. Die Korrelation der Merkmale ist aufgrund der schnellen Regression in der ersten Woche post partum etwas geringer als beispielsweise bei der Uterushornlänge. Der Koeffizient ist entsprechend mit r = - 0,88 recht gering. 12 Uterushornbreite [cm] Gruppe Gruppe Tage p.p Anzahl n Abb. 49: Regression der Uterushornbreite bei Schweinen in der postpartalen Periode (Angaben x + s). (Signifikanz: 1:2, p<0,05) 90
97 10 y = 7,34-0,22 x; r = - 0,88 Uterushornbreite [cm] Tage p.p. Abb. 50: Regressionsgerade der Uterushornbreite bei Schweinen in der postpartalen Periode mit Korrelationskoeffizient (r). Beim Vergleich der Hornbreite, bezogen auf die Tage post partum, ist ein signifikanter Unterschied (p < 0,05) zwischen dem 5. und 10. Tag post partum eindeutig (Abb. 51; Tab. A 44). Die Hornbreitenausmaße aller Tiere liegen nach dem 10. Tag post partum unter 6,0 cm, welcher in Gruppe 1 und 2 als Minimalwert erzielt wurde. Mit Sau Nr. 1 (15. Tag p.p.) und Sau Nr. 9 (17. Tag p.p.) erreichen lediglich zwei Tiere den folgenden Maximalwert von 4,0 cm, bei allen weiteren Probanden wurde eine geringere Hornbreite gemessen. Die Sau Nr. 37, die den 5. Tag post partum repräsentiert, hatte eine Parität von 11, ein Uterusgewicht von g und ein geschätztes Lebendgewicht von cirka 300 kg. 91
98 12 Uterushornbreite [cm] Tage p.p. Tage p.p Anzahl n Abb. 51: Verringerung der Uterushornbreite an den einzelnen Tagen post partum (Angaben x + s). Auch die Uterushornwand verliert innerhalb der ersten Tage post partum einen großen Teil ihrer Mächtigkeit. Hervorzuheben ist der signifikante Verlust (p < 0,05) bis zum 10. Tag post partum. Eine deutlich geringere Abnahme erfolgt bis zum Ende des Messzeitpunktes (Abb. 52; Tab. A 45). Auch diese Entwicklung kann als lineare Regressionsfunktion dargestellt werden y = 1,07-0,04 x (Abb. 53). Der Korrelationskoeffizient ergibt wie schon bei der Uterushornbreite nur r = - 0,88. Ursächlich ist wiederum die schnelle Regression der Wandschichten in der 1. Woche post partum. 92
99 Uterushornwanddicke [cm] 1,6 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0, Gruppe Gruppe Tage p.p Anzahl n Abb. 52: Postpartale Verminderung der Uterushornwanddicke (Angaben x + s). (Signifikanz: 1:2, p<0,05) 1,6 y = 1,07-0,04 x; r = - 0,88 Uterushornwanddicke [cm] 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0, Tage p.p. Abb. 53: Postpartale Verminderung der Uterushornwanddicke als lineare Funktion mit Korrelationskoeffizient (r). Insbesondere zwischen dem 5. und 10. Tag post partum kommt es zu einer progressiven Verringerung der Wanddicke (Abb. 54; Tab. A 46). Aus dem Trend der 93
100 Verminderung der Stärke der Uterushornwand fallen lediglich zwei Probanden (Sau Nr. 9, 17. Tag p.p. mit 1,0 cm und Sau Nr. 10, 19. Tag p.p. mit 0,8 cm) geringfügig heraus. Erneut zeigt die Sau Nr. 37 (5. Tag post partum) mit einer Hornwanddicke von 1,5 cm ihre Ausnahmestellung. 1,6 Uterushornwanddicke [cm] 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0, Tage p.p. Tage p.p Anzahl n Abb. 54: Verminderung der Uterushornwanddicke an den einzelnen Tagen post partum (Angaben x + s). Die makroskopisch erfassbaren Regressionsvorgänge des Uterus benötigen post partum einige Tage mehr, als die der peripheren Abschnitte des Sexualtraktes der Sau, doch generell sind auch sie bis zum 17. Tag post partum abgeschlossen. Die Reorganisationsabläufe erstrecken sich noch über einen längeren Zeitraum, werden aber jederzeit durch den Beginn eines neuen Zyklus positiv gefördert. Mikroskopische Untersuchungen Die histologischen Proben der Uterushornwand wurden in drei verschiedenen Abschnitten entnommen, nämlich im caudalen, medialen und cranialen Bereich. 94
101 Jeder einzelne Mittelwert der speziellen Wandschicht ist in seiner Dynamik sowohl in Bezug auf die drei verschiedenen Lokalisationen als auch im Verhältnis zum jeweiligen Zyklusstand unterschiedlich. Alle Differenzen, die während der Regressions- und Reorganisationsabläufe auftreten, heben sich zum Ende der Sexualrekonvaleszens auf, so dass zwischen dem 15. und 21. Tag post partum die mikroskopische Involution der Uteruswand als vollständig abgeschlossen zu betrachten ist. Der histologische Wandaufbau der Uterushörner ist mit denen des Corpus uteri identisch (Abb. 31). Nachfolgend die Ergebnisse im Einzelnen: Das Epithelium pseudostratificatum columnare im caudalen Uterushorn zeigt im mikroskopischen Bild zahlreiche vorangegangene mechanische Irritationen und besitzt eine deutlich geringere Schichtdicke als das Oberflächenepithel in anderen Bereichen des Uterushornes. Daher erfährt es bis zum 10. Tag post partum scheinbar nur einen geringen Umfangsverlust. Es folgt eine deutliche Zunahme, die vom 15. Tag post partum bis zum Ende der Untersuchung auf gleichem Niveau bleibt (Abb. 55; Tab. A 47). Die selbe Wandschicht im medialen Bereich des Uterushorns verliert dagegen signifikant (p< 0,05) an Mächtigkeit in den ersten 10 Tagen post partum, bleibt bis zum 22. Tag post partum konstant und erfährt innerhalb des späten Untersuchungsintervalls nochmals eine unbedeutende kleine Zunahme (Abb. 56; Tab. A 48). Das Epithelium pseudostratificatum columnare des cranialen Hornes vermindert sich gleichmäßig im postpartal untersuchten Zeitraum um ungefähr 25 %. Die Veränderung der Mittelwerte der Gruppen 1-4 lässt sich mittels der linearen 95
102 Regressions-Berechnung y = 41,28-0,80 x darstellen. Als Korrelationskoeffizient ergibt sich r = - 0,95 (Abb. 57; Tab. A 49). 100 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 55: Postpartale Regeneration des Epitheliums pseudostratificatum columnare im caudalen Abschnitt des Uterushornes (Angaben x + s) Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 56: Postpartale Regeneration des Epitheliums pseudostratificatum columnare im medialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanzen: 1:2, 1:3 und 1:4, p<0,05) 96
103 100 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 57: Postpartale Regeneration des Epitheliums pseudostratificatum columnare im cranialen Abschnitt des Uterushornes (Angaben x + s). Insgesamt ist das Epithelium pseudostratificatum columnare im caudalen Uterushorn dünner als im medialen und cranialen Abschnitt. Unmittelbar post partum ( Tag) ist diese Schicht im medialen Bereich am mächtigsten. Zum Versuchsende ( Tag post partum) gleichen sich jedoch alle Mittelwerte der drei Lokalisationen immer mehr an, doch auch zu diesem Zeitpunkt dominiert, wenn auch nur gering, die Uterushornmitte. Das angrenzende Stratum cellulare erfährt in allen drei Abschnitten entlang des Hornes zunächst bis zum 10. Tag post partum eine deutliche Zunahme der Schichtdicke. Zeitgleich ist die postpartale Aktivität dieser Zellschicht an der Immunabwehr groß. Zahlreiche Lymphozyten, Makrophagen und Plasmazellen sind anzutreffen. Im weiteren Verlauf zeigt auch sie die erwartete Regression. Diese Veränderung der Mittelwerte des Stratum cellulare nahe des Corpus uteri lässt sich 97
104 von Gruppe 2-4 mittels der Regressionsgeraden y = 181,49 3,60 x darstellen. Als Korrelationskoeffizient ergibt sich r = - 0,99 (Abb. 58; Tab. A 50). Die Schichtdicke in der medialen Lokalisation ist im Gegensatz zum Epithelium pseudostratificatum columnare hier von geringerer Mächtigkeit als die craniale. Die Unterschiede sind jedoch nur marginal (Abb. 59; Tab. A 51, und Abb. 60; Tab. A 52). Das Stratum cellulare in der Hornspitze erfährt von Gruppe 2-4 einen linearen Abfall. Die beschreibende Geradengleichung lautet y = 200,77 3,05 x mit dem Korrelationskoeffizient r = - 0, Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 58: Postpartale Regeneration des Stratum cellulare im caudalen Abschnitt des Uterushornes (Angaben x + s). 98
105 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 59: Postpartale Regeneration des Stratum cellulare im medialen Abschnitt des Uterushornes (Angaben x + s) Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 60: Postpartale Regeneration des Stratum cellulare im cranialen Abschnitt des Uterushornes (Angaben x + s). Das Stratum reticulare und fibrillare sind in der Uteruswand deutlich voneinander zu trennen. Ihre Ausdehnungen sind im Vergleich zu anderen Lokalisationen im Reproduktionstrakt deutlich größer und übertreffen stellenweise die Werte der 99
106 Muskelschichten. Beide Zellschichten sind mit ihren zahlreichen Gefäßen für die Versorgung der Schleimhaut und letztlich der Concepti besonders wichtig. Gleichzeitig variiert ihre Schichtdicke auch durch die unterschiedliche Aktivität der Drüsen. Das Stratum reticulare ist in der caudalen Lokalisation am höchsten, es verliert tendenziell in Richtung der Hornspitze an Umfang. Diese Wandschicht erfährt post partum eine kontinuierliche Abnahme in allen drei Abschnitten. Im medialen und cranialen Bereich ist zum Ende der Untersuchung eine Zunahme zu beobachten, deren Ausprägung nahe der Salpinx am deutlichsten ist (Abb. 61; Tab. A 53, Abb. 62; Tab. A 54 und Abb. 63; Tab. A 55). Die lineare Veränderung der Mittelwerte der Gruppen 1-4 im caudalen Uterushorn lässt sich mittels der Regressionsfunktion y = 1.956,62 31,28 x darstellen. Der Korrelationskoeffizient lautet r = - 0,99. Für den medialen Hornabschnitt ergibt sich für Gruppe 1-3 die Geradengleichung y = 1.683,73 39,41 x mit dem Korrelationskoeffizient r = - 0,99. Das Stratum reticulare im cranialen Uterushorn lässt demgegenüber keine eindeutig gerichtete, lineare Entwicklung erkennen. 100
107 2.500 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 61: Postpartale Regeneration des Stratum reticulare im caudalen Abschnitt des Uterushornes (Angaben x + s) Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 62: Postpartale Regeneration des Stratum reticulare im medialen Abschnitt des Uterushornes (Angaben x + s). 101
108 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 63: Postpartale Regeneration des Stratum reticulare im cranialen Abschnitt des Uterushornes (Angaben x + s). Die postpartale Rekreationsphase des Stratum fibrillare variiert in allen drei Abschnitten an Mächtigkeit. Nahe dem Corpus uteri überwiegt die Reorganisation, gemessen an der Zellschichtzunahme, welche bis zum 22. Tag post partum beendet ist (Abb. 64; Tab. A 56). Im medialen Uterushorn erfährt es eine kontinuierliche Regression, besonders aufgrund der Wasserretention zwischen den kollagenen Fasern (Abb. 65; Tab. A 57). Letztere lagern sich dicht aneinander. Diese Entwicklung von Gruppe 1-4 verdeutlicht auch die lineare Regressionsgleichung y = 1.789,17 39,29 x mit dem Korrelationskoeffizient r = - 0,97. In der Hornspitze ist ebenfalls nur eine Neuorganisation dieser Zellschicht zu verifizieren (Abb. 66; Tab. A 58). 102
109 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 64: Postpartale Regeneration des Stratum fibrillare im caudalen Abschnitt des Uterushornes (Angaben x + s) Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 65: Postpartale Regeneration des Stratum fibrillare im medialen Abschnitt des Uterushornes (Angaben x + s). 103
110 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 66: Postpartale Regeneration des Stratum fibrillare im cranialen Abschnitt des Uterushornes (Angaben x + s). Je größer die Entfernung vom Corpus uteri ist, desto geringer wird die myometrale Schichtdicke des Uterushornes, gleichzeitig ist die zirkuläre Schicht nicht stärker ausgebildet als die longitudinale. Beide Muskelschichten sind maßgeblich an der Uteruskontraktilität unter der Geburt beteiligt. Ihre Schichtdicke ist ausschlaggebend für die Intensität einer Kontraktionswelle im Verlauf der Wehenbildung. Das Stratum circulare zeigt in allen drei Lokalisationen den gleichen Involutionsverlauf. Bis zum 10. Tag post partum verliert diese Schicht signifikant (p < 0,05) an Ausdehnung, im caudalen und medialen Bereich sogar mehr als 50 %. In den folgenden Tagen ist der Abfall nur noch marginal. (Abb. 67; Tab. A 59, Abb. 68; Tab. A 60 und Abb. 69; Tab. A 61). 104
111 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 67: Postpartale Involution des Stratum circulare im caudalen Abschnitt des Uterushornes (Angaben x + s). (Signifikanz: 1:2, p<0,05) Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 68: Postpartale Involution des Stratum circulare im medialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanz: 1:2, p<0,05) 105
112 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 69: Postpartale Involution des Stratum circulare im cranialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanz: 1:2, p<0,05) Das Stratum longitudinale ist im corpusnahen und medialen Bereich annähernd 3 mal so mächtig wie in der Hornspitze. Der Schichtdickenverlust in den ersten 10 Tagen post partum ist in diesen beiden Abschnitten signifikant (p < 0,05) nachzuweisen. Nur geringe Zu- und Abnahmen charakterisieren in der weiteren Postpartalphase die Reorganisationsvorgänge (Abb. 70; Tab. A 62 und Abb. 71; Tab. A 63). Im cranialen Uterushorn zeigt sich keine Regression, hier ist die postpartale Rekreation nur durch Reparationsvorgänge gekennzeichnet (Abb. 72; Tab. A 64). 106
113 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 70: Postpartale Regeneration des Stratum longitudinale im caudalen Abschnitt des Uterushornes (Angaben x + s). (Signifikanzen: 1:2, 1:3 und 1:4, p<0,05) Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 71: Postpartale Regeneration des Stratum longitudinale im medialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanzen: 1:2, 1:3 und 1:4, p<0,05) 107
114 Schichtdicke [µm] Gruppen Gruppe Tage p.p Anzahl n Abb. 72: Postpartale Regeneration des Stratum longitudinale im cranialen Abschnitt des Uterushornes (Angaben x + s). Die Tunica serosa weist in allen drei Uterushornabschnitten eine schnelle Regression post partum auf. Auch ihre Schichtdicke ist in der caudalen und medialen Lokalisation mächtiger als in der cranialen (Abb. 73; Tab. A 65, Abb. 74; Tab. A 66 und Abb. 75; Tab. A 67). Die Regression ist von Gruppe 1 zu 2 deutlich zu erkennen, aber lediglich in der Hornspitze signifikant (p < 0,05) verifizierbar. Im corpusnahen Bereich kommt es zwischen dem 22. und 27. Tag erneut zu einer Zunahme dieser Schicht. 108
115 250 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 73: Postpartale Regression der Tunica serosa im caudalen Abschnitt des Uterushornes (Angaben x + s) Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 74: Postpartale Regression der Tunica serosa im medialen Abschnitt des Uterushornes (Angaben x + s). 109
116 250 Schichtdicke [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 75: Postpartale Regression der Tunica serosa im cranialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanz: 1:2, p<0,05) Uterindrüsen sind in allen Teilen des Hornes zahlreich vertreten. Die Sekretionsleistung, verdeutlicht durch vermehrte Anschnitte der Drüsen mit vergrößertem Drüsenlumendurchmesser, variiert im postpartalen Zeitraum erheblich. Eine Aussage zur konkreten Anzahl der Drüsen kann aufgrund ihrer geschlängelten Beschaffenheit nicht getätigt werden. Im caudalen Uterushorn bleibt die Leistung der einzelnen Drüsen zunächst im vollen Umfang erhalten. Erst zwischen dem 10. und 15. Tag post partum vermindert sich ihr Lumen signifikant (p < 0,05) und bleibt dann innerhalb des Beobachtungszeitraumes konstant (Abb. 76; Tab. A 68). Zum Vergleich sind die Drüsendurchmesser histologisch in Abb. 42 bis 46 dargestellt. Einen abweichenden Verlauf zeigen die Drüsen im medialen Bereich. Eine Verminderung ihrer Sekretion ist schon zum 10. Tag post partum signifikant (p < 0,05). Drei Wochen nach der Geburt ist eine erneute geringfügige Sekretausschüttung zu erkennen (Abb. 77; Tab. A 69). 110
117 Im salpinxnahen Bereich bleibt der gemessene Durchmesser nahezu identisch, zum Tag post partum vergrößert sich das Drüsenlumen geringfügig, was aber statistisch nicht verifizierbar ist (Abb. 78; Abb. 79; Tab. A 70). Dennoch könnte dies als eine deutlich schnellere hormonelle bedingte Rekreation im cranialen Bereich gefolgt vom medialen und caudalen Abschnitt interpretiert werden Drüsenlumen [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 76: Postpartale Reorganisation des Drüsenlumendurchmessers im caudalen Abschnitt des Uterushornes (Angaben x + s). (Signifikanzen: 2:3 und 2:4, p<0,05) 111
118 35 30 Drüsenlumen [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 77: Postpartale Reorganisation des Drüsenlumendurchmessers im medialen Abschnitt des Uterushornes (Angaben x + s). (Signifikanzen: 1:2, 1:3 und 1:4, p<0,05) Drüsenlumen [µm] Gruppe Gruppe Tage p.p Anzahl n Abb. 78: Postpartale Reorganisation des Drüsenlumendurchmessers im cranialen Abschnitt des Uterushornes (Angaben x + s). 112
119 D Abb. 79: Drüsendurchmesser (D) am 18. Tag post partum im cranialen Uterushorn Im Uterus laufen in der postpartalen Phase Involutions-, Reorganisations- und zum Ende geringe Proliferationsvorgänge ab, die nicht voneinander getrennt werden können. Ihre Interpretation ist daher sehr schwierig. Trotzdem ist die Rekonvaleszenz eindeutig bis zum Ende der 3. Woche post partum abgeschlossen Salpinx Fortschreitende Regressions- und Regenerationsvorgänge im Verlauf der postpartalen Periode sind auch in der Salpinxstruktur deutlich nachweisbar. Unmittelbar post partum ( Tag) ist das Epithelium simplex columnare mit µm doppelt so mächtig wie am 10. Tag post partum mit µm. Die ovalen Nuclei liegen vorwiegend im basalen Epithelbereich. Die Zellgrenzen sind nur an der Basalmembran erkennbar. Kinozilien sind lediglich bruchstückhaft vorhanden. In einigen Bereichen der Tertiärfalten sind in der Lamina propria zahlreich geschlängelte Gefäße darstellbar. 113
120 Die nicht eindeutig voneinander differenzierbaren Muskelschichten sind unmittelbar post partum mächtiger als im späteren postpartalen Zeitraum. Jedoch ist für die Interpretation der Schichtdicken eine übereinstimmende Lokalisation nötig, da sie im caudalen, medialen und cranialen Abschnitt der Salpinx stark variieren (Abb. 80). Am 10. Tag post partum sind große Teile der Tertiärfalten nur noch trümmerartig vorhanden. Die Nucleusfragmente und das Zytoplasma der Epithelzellen unterscheiden sich kaum voneinander. Auch die Propria mucosa besteht nur noch aus sehr lockeren Bindegewebsfasern (Abb. 81). Die Muscularis ist locker und erscheint zerfetzt, die Faserbündel müssen erneuert werden. Ein verändertes Bild zeigen die Probanden, welche den Tag post partum repräsentieren. Gleichzeitig laufen Reorganisationen und geringe Proliferationen ab. Erste Nuclei und vollständige Epithelzellen sind wieder erkennbar und die Propria mucosa charakterisiert ein dichtes Netzwerk aus kollagenen Fasern. Die vereinzelten Gefäße sind noch sehr klein. In einigen Bereichen der Tertiärfalten ist dieses Regenerationsstadium zu Beginn der 3. Woche post partum noch nicht erreicht. Tendenziell ist die Verästelung der Falten geringer, die Faltendicke dafür umfangreicher. Die Muskelfasern sind vollständig erneuert (Abb. 82). Eine vollständige Regeneration und Reorganisation der Salpinx zeigen die Sauen am 22. Tag post partum, trotz anhaltender Laktation. Jede Oberflächenepithelzelle ist deutlich abgrenzbar. Die Nuclei besitzen eine maximale Größe und beanspruchen mehr als zwei Drittel des jeweiligen Zellinhaltes. Sie sitzen ohne Ausnahme der Basalmembran auf. Kinozilien säumen die gesamte Zelloberfläche. Die Tertiärfalten sind sehr schmal und stark verästelt. Das angrenzende kollagene Bindegewebe ist zellreich und von dichter Konsistenz. Die vorhandenen Gefäße sind groß, mit weit geöffnetem Lumen. Gleichzeitig münden sie blutgefüllt bis in die einzelnen Falten. 114
121 Die umgebende Muskelschicht ist von geringer Mächtigkeit, dafür aber sehr kompakt (Abb. 83). Abb. 80: Querschnitt der Salpinx am 3. Tag post partum. Abb. 81: Querschnitt der Salpinx am 10. Tag post partum. Abb. 82: Querschnitt der Salpinx am 17. Tag post partum. Abb. 83: Querschnitt der Salpinx am 24. Tag post partum. 115
18 Weibliche Geschlechtsorgane
 8 Weibliche Geschlechtsorgane Ovar, Katze, HE... -0 Corpus luteum menstruationis, HE... - Corpus luteum graviditatis, HE...,4,5 Tuba uterina, Pars ampullaris, HE... 6-8 Uterus, Proliferationsphase, HE...
8 Weibliche Geschlechtsorgane Ovar, Katze, HE... -0 Corpus luteum menstruationis, HE... - Corpus luteum graviditatis, HE...,4,5 Tuba uterina, Pars ampullaris, HE... 6-8 Uterus, Proliferationsphase, HE...
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 14 Weibliche Geschlechtsorgane.
 14 Weibliche Geschlechtsorgane 2010 GmbH, Stuttgart Eierstock Primordialfollikel mit Eizellen (primäre Ovozyten und abgeplattete Follikelepithelzellen) in der Zona parenchymatosa (fibrozytenähnliche Stromazellen)
14 Weibliche Geschlechtsorgane 2010 GmbH, Stuttgart Eierstock Primordialfollikel mit Eizellen (primäre Ovozyten und abgeplattete Follikelepithelzellen) in der Zona parenchymatosa (fibrozytenähnliche Stromazellen)
Vorlesung Histologie. Die Studierenden sollen
 Kurstag 20 Weibliche Geschlechtsorgane Themen Ovar Tuba uterina Uterus Vagina Plazenta Lernziele Prüfungsrelevante Lerninhalte Weibliche Geschlechtsorgane Ovar: Mark und Rinde, Follikel und Follikulogenese,
Kurstag 20 Weibliche Geschlechtsorgane Themen Ovar Tuba uterina Uterus Vagina Plazenta Lernziele Prüfungsrelevante Lerninhalte Weibliche Geschlechtsorgane Ovar: Mark und Rinde, Follikel und Follikulogenese,
Weibliche Geschlechtsorgane (Organa genitalia feminina) 11H. E. König und P. Sótonyi
 Weibliche Geschlechtsorgane (Organa genitalia feminina) 11H. E. König und P. Sótonyi Uterushorn mit Frucht Uterushorn Eierstock, Eileiter und Uterushorn einer trächtigen Kätzin. 11 Weibliche Geschlechtsorgane
Weibliche Geschlechtsorgane (Organa genitalia feminina) 11H. E. König und P. Sótonyi Uterushorn mit Frucht Uterushorn Eierstock, Eileiter und Uterushorn einer trächtigen Kätzin. 11 Weibliche Geschlechtsorgane
Weibliches Geschlechtssystem, Menstruationszyklus, Mamma
 Weibliches Geschlechtssystem, Menstruationszyklus, Mamma Funktionelle Anatomie der Inneren Organe WS 14/15 Aufgaben der Geschlechtsorgane Bildung von Keimzellen Befruchtung Bildung von Hormonen Geschlechtsspezifische
Weibliches Geschlechtssystem, Menstruationszyklus, Mamma Funktionelle Anatomie der Inneren Organe WS 14/15 Aufgaben der Geschlechtsorgane Bildung von Keimzellen Befruchtung Bildung von Hormonen Geschlechtsspezifische
Hoden, Ovar. Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar
 Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Weiblicher Sexualzyklus
 Zyklus - Beeinflußung durch: Tageslicht Temperatur Anwesenheit eines männlichen Deckpartners Fütterung Polyoestrie Asaisonale Polyoestrie Saisonale Polyoestrie Monoestrie Anoestrie Spezifische Dauer des
Zyklus - Beeinflußung durch: Tageslicht Temperatur Anwesenheit eines männlichen Deckpartners Fütterung Polyoestrie Asaisonale Polyoestrie Saisonale Polyoestrie Monoestrie Anoestrie Spezifische Dauer des
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 14 Weibliche Geschlechtsorgane.
 14 Weibliche Geschlechtsorgane 2010 GmbH, Stuttgart Uterus Myometrium, spiralig angeordnete glatte Muskulatur (Stratum circulare) Endometrium mit einschichtigem Epithel und drüsenreicher (Stroma endometralis)
14 Weibliche Geschlechtsorgane 2010 GmbH, Stuttgart Uterus Myometrium, spiralig angeordnete glatte Muskulatur (Stratum circulare) Endometrium mit einschichtigem Epithel und drüsenreicher (Stroma endometralis)
Wintersemester 2010/2011
 Wintersemester 2010/2011 Name: Matr. Nr.: Histologie Niere, Harnwege, Geschlechtsorgane Seite 1 von 10 Herzlich willkommen zum Histologiekurs des Systemblocks Harn und Geschlechtsorgane. In diesem Kurs
Wintersemester 2010/2011 Name: Matr. Nr.: Histologie Niere, Harnwege, Geschlechtsorgane Seite 1 von 10 Herzlich willkommen zum Histologiekurs des Systemblocks Harn und Geschlechtsorgane. In diesem Kurs
Notizen zur Vorlesung der makro- und mikroskopischen Anatomie zum Thema Urogenitalsystem (Sommersemester 2007), Dozent: Dr. med. E.
 Notizen zur Vorlesung der makro- und mikroskopischen Anatomie zum Thema Urogenitalsystem (Sommersemester 2007), Dozent: Dr. med. E. Ghebremedhin Die weiblichen Geschlechtsorgane (Organa genitalia feminina)
Notizen zur Vorlesung der makro- und mikroskopischen Anatomie zum Thema Urogenitalsystem (Sommersemester 2007), Dozent: Dr. med. E. Ghebremedhin Die weiblichen Geschlechtsorgane (Organa genitalia feminina)
einschichtiges, hochprismatisches Epithel des Epithelium mucosae Tunica mucosa Lamina propria mucosae mit tubulären Eigendrüsen
 einschichtiges, hochprismatisches Epithel des Epithelium mucosae mit tubulären Eigendrüsen Tunica mucosa Blutgefäße mit Blut angefüllt Lamina muscularis mucosae Verdauungsapparat Drüsenmagen, Eigendrüsen,
einschichtiges, hochprismatisches Epithel des Epithelium mucosae mit tubulären Eigendrüsen Tunica mucosa Blutgefäße mit Blut angefüllt Lamina muscularis mucosae Verdauungsapparat Drüsenmagen, Eigendrüsen,
Die Wirkungen der ovariellen Hormone und die Regulation der Ovarfunktion
 Die Wirkungen der ovariellen Hormone und die Regulation der Ovarfunktion Weibliche Sexorgane Eileiter Uterus Ovar Zervix Vagina Endometrium Myometrium Funktionelle Einheit im Ovar: der Follikel 1 Fetale
Die Wirkungen der ovariellen Hormone und die Regulation der Ovarfunktion Weibliche Sexorgane Eileiter Uterus Ovar Zervix Vagina Endometrium Myometrium Funktionelle Einheit im Ovar: der Follikel 1 Fetale
Genitalsystem der Frau 85
 Genitalsystem der Frau 85 1: Portio vaginalis cervicis Mensch HE Cervix uteri (Gebärmutterhals) Die Cervix uteri besteht aus einem oberen von Parametrium umgebenen Teil, der Portio supravaginalis cervicis,
Genitalsystem der Frau 85 1: Portio vaginalis cervicis Mensch HE Cervix uteri (Gebärmutterhals) Die Cervix uteri besteht aus einem oberen von Parametrium umgebenen Teil, der Portio supravaginalis cervicis,
Betreuer: Prof. Dr. A. Wehrend EINFLUSS DER AKUPUNKTUR AUF DEN BEHANDLUNGSERFOLG BEI DER TORSIO UTERI DES RINDES
 Aus der Klinik für Geburtshilfe, Gynäkologie und Andrologie der Groß - und Kleintiere mit tierärztlicher Ambulanz der Justus - Liebig - Universität Gießen Betreuer: Prof. Dr. A. Wehrend EINFLUSS DER AKUPUNKTUR
Aus der Klinik für Geburtshilfe, Gynäkologie und Andrologie der Groß - und Kleintiere mit tierärztlicher Ambulanz der Justus - Liebig - Universität Gießen Betreuer: Prof. Dr. A. Wehrend EINFLUSS DER AKUPUNKTUR
Weibliche Geschlechtsorgane. Oogonie
 Weibliche Geschlechtsorgane Oogonie Physiologie eines Monatszyklus Bei Mann und Frau gibt es, was die Fruchtbarkeit betrifft, große Unterschiede: Der Mann ist - für sich alleine gesehen - von der Pubertät
Weibliche Geschlechtsorgane Oogonie Physiologie eines Monatszyklus Bei Mann und Frau gibt es, was die Fruchtbarkeit betrifft, große Unterschiede: Der Mann ist - für sich alleine gesehen - von der Pubertät
Reproduktionsphysiologie
 Reproduktionsphysiologie Hormone der Gonaden: Androgene Östrogene Gestagene Lernziele: 86 und teilweise 90 Das Geschlecht Genetik Chromosomales Geschlecht XY - XX Gonaden Gonadales Geschlecht Hoden - Ovar
Reproduktionsphysiologie Hormone der Gonaden: Androgene Östrogene Gestagene Lernziele: 86 und teilweise 90 Das Geschlecht Genetik Chromosomales Geschlecht XY - XX Gonaden Gonadales Geschlecht Hoden - Ovar
Testis Nebenhoden Ductus deferens Prostata. Vorlesung Histologie. Die Studierenden sollen
 Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Weibliche Sexualhormone
 Weibliche Sexualhormone Inhalte: 1. Die hormonelle Auswirkung der Sexualhormone bei der Frau 2. Das hormonelle Milieu des Ovars 3. Die Regelkreise des Menstruationszyklus 4. Gonadotropine der Sekretion
Weibliche Sexualhormone Inhalte: 1. Die hormonelle Auswirkung der Sexualhormone bei der Frau 2. Das hormonelle Milieu des Ovars 3. Die Regelkreise des Menstruationszyklus 4. Gonadotropine der Sekretion
hormonelle Steuerung Freisetzung - Freisetzung der Hormone aus den endokrinen Drüsen unterliegt der Steuerung des ZNS und erfolgt:
 Das Hormonsystem 1. Hormone = sind spezifische Wirkstoffe - bzw. spezifische Botenstoffe - mit spezieller Eiweißstruktur - sehr empfindlich Chemischer Aufbau der Hormone: 1.Aminosäureabkömmlinge: Sie sind
Das Hormonsystem 1. Hormone = sind spezifische Wirkstoffe - bzw. spezifische Botenstoffe - mit spezieller Eiweißstruktur - sehr empfindlich Chemischer Aufbau der Hormone: 1.Aminosäureabkömmlinge: Sie sind
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 2 Epithelgewebe.
 2 Epithelgewebe 2010 GmbH, Stuttgart Exokrine Drüsen exokrine Sekretgranula Lumen einer Schlauchdrüse (Querschnitt) mit Sekret exokrine Sekretgranula Exokrine Drüsen, Magen, Hund. Vergr. 5 500fach. ekkrine,
2 Epithelgewebe 2010 GmbH, Stuttgart Exokrine Drüsen exokrine Sekretgranula Lumen einer Schlauchdrüse (Querschnitt) mit Sekret exokrine Sekretgranula Exokrine Drüsen, Magen, Hund. Vergr. 5 500fach. ekkrine,
Histologie des Ovars
 Histologie des Ovars Einleitung: Hintergrundinformationen zu den Präparationsabenden der MGW im Sept. 2013 von Dr. Thomas Kann Es wurden im Rahmen der histologischen Präparationsabende folgende Dauerpräparate
Histologie des Ovars Einleitung: Hintergrundinformationen zu den Präparationsabenden der MGW im Sept. 2013 von Dr. Thomas Kann Es wurden im Rahmen der histologischen Präparationsabende folgende Dauerpräparate
Die Geschlechtsorgane der Frau
 Anatomie 28.07.2014 Die Geschlechtsorgane der Frau Innere Geschlechtsorgane: - Eierstöcke (Ovarien) - Eileiter (Tuben) - Gebärmutter (Uterus) - Scheide (Vagina) Äußere Geschlechtsorgane: - Große + kleine
Anatomie 28.07.2014 Die Geschlechtsorgane der Frau Innere Geschlechtsorgane: - Eierstöcke (Ovarien) - Eileiter (Tuben) - Gebärmutter (Uterus) - Scheide (Vagina) Äußere Geschlechtsorgane: - Große + kleine
VERDAUUNGSAPPARAT III
 VERDAUUNGSAPPARAT III Vormägen Pars nonglandularis des Wiederkäuermagens drei Vormagenabteilungen (Proventriculi): Pansen (Rumen) Netzmagen (Reticulum) Blättermagen (Omasum) Pansen Präparat: Pansen, Schaf,
VERDAUUNGSAPPARAT III Vormägen Pars nonglandularis des Wiederkäuermagens drei Vormagenabteilungen (Proventriculi): Pansen (Rumen) Netzmagen (Reticulum) Blättermagen (Omasum) Pansen Präparat: Pansen, Schaf,
Infertilität - Diagnostik. Dr. med. M. Goeckenjan, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum, Dresden
 Infertilität - Diagnostik Dr. med. M. Goeckenjan, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum, Dresden Konzeption und Kontrazeption... I Beim Mensch ständige Konzeptionsbereitschaft
Infertilität - Diagnostik Dr. med. M. Goeckenjan, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum, Dresden Konzeption und Kontrazeption... I Beim Mensch ständige Konzeptionsbereitschaft
Diabetes & Dialyse. Ein Praxiskompendium. von Werner Kleophas. 1. Auflage. Thieme 2000
 Diabetes & Dialyse Ein Praxiskompendium von Werner Kleophas. Auflage Thieme 000 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 0558 Zu Inhaltsverzeichnis schnell und portofrei erhältlich bei beck-shop.de
Diabetes & Dialyse Ein Praxiskompendium von Werner Kleophas. Auflage Thieme 000 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 0558 Zu Inhaltsverzeichnis schnell und portofrei erhältlich bei beck-shop.de
Bindegewebe Zellen und Extrazellulärmatrix (EZM)
 Bindegewebe Zellen und Extrazellulärmatrix (EZM) Ortsständige Zellen: Fibroblast ist für Stoffwechsel der Extrazellulärmatrix-Bestandteile zuständig (Kollagenfibrillen, elastische Fasern, retikuläre Fasern,
Bindegewebe Zellen und Extrazellulärmatrix (EZM) Ortsständige Zellen: Fibroblast ist für Stoffwechsel der Extrazellulärmatrix-Bestandteile zuständig (Kollagenfibrillen, elastische Fasern, retikuläre Fasern,
Aufbau und Funktion der weiblichen Geschlechtsorgane
 Aufbau und Funktion der weiblichen Geschlechtsorgane Allgemeines Man unterscheidet äußere und innere Geschlechtsorgane. Unter den äußeren Geschlechtsorganen versteht man die Vulva mit ihren verschiedenen
Aufbau und Funktion der weiblichen Geschlechtsorgane Allgemeines Man unterscheidet äußere und innere Geschlechtsorgane. Unter den äußeren Geschlechtsorganen versteht man die Vulva mit ihren verschiedenen
Vorlesung Grundlagen der Anatomie & Embryologie
 Vorlesung Grundlagen der Anatomie & Embryologie Embryologie 1. Entwicklungswoche Von der Befruchtung zur Implantation Martina Schmitz WS 16/17 Vesalius, De humani corporis fabrica (1543) Institut für Anatomie
Vorlesung Grundlagen der Anatomie & Embryologie Embryologie 1. Entwicklungswoche Von der Befruchtung zur Implantation Martina Schmitz WS 16/17 Vesalius, De humani corporis fabrica (1543) Institut für Anatomie
Harnkanälchen. Proximaler Tubulus
 Harnkanälchen Der Harnkanälchenapparat des Nephrons ist etwa 3-4 cm lang und gliedert sich in den proximalen, intermediäre und distalen Tubulus. Alle Tubuli bestehen aus einem einschichtigen Epithel, das
Harnkanälchen Der Harnkanälchenapparat des Nephrons ist etwa 3-4 cm lang und gliedert sich in den proximalen, intermediäre und distalen Tubulus. Alle Tubuli bestehen aus einem einschichtigen Epithel, das
Nichtneoplastische Veränderungen, die nicht vom Gewebe der Mamma ausgehen
 3 Eigene Untersuchungen - 69-3.2.5.2.3 Nichtneoplastische Veränderungen, die nicht vom Gewebe der Mamma ausgehen 3.2.5.2.3.1 Lymphknoten Im Untersuchungsgut werden zwei palpierte und sonographisch dargestellte
3 Eigene Untersuchungen - 69-3.2.5.2.3 Nichtneoplastische Veränderungen, die nicht vom Gewebe der Mamma ausgehen 3.2.5.2.3.1 Lymphknoten Im Untersuchungsgut werden zwei palpierte und sonographisch dargestellte
Histologie des Epithelgewebes. Äußere und innere Oberflächen des Körpers
 Histologie des Epithelgewebes Das Epithel ist Grenzflächengewebe der inneren und äußeren Körperoberfläche, einschließlich der Auskleidung in den Gefäßen (Blut- und Lymphgefäße). Epi, lat. oben auf, steht
Histologie des Epithelgewebes Das Epithel ist Grenzflächengewebe der inneren und äußeren Körperoberfläche, einschließlich der Auskleidung in den Gefäßen (Blut- und Lymphgefäße). Epi, lat. oben auf, steht
Studienbrief Heilpraktiker
 Studienbrief Heilpraktiker Einführung in die allgemeine Anatomie und Physiologie 3 Histologie 3. HISTOLOGIE IHRE LERNZIELE In diesem Kapitel vermitteln wir Ihnen Kenntnisse über die unterschiedlichen Formen
Studienbrief Heilpraktiker Einführung in die allgemeine Anatomie und Physiologie 3 Histologie 3. HISTOLOGIE IHRE LERNZIELE In diesem Kapitel vermitteln wir Ihnen Kenntnisse über die unterschiedlichen Formen
Ergebnisse der transmissionselektronenmikroskopischen (TEM) Untersuchungen
 4 Ergebnisse 101 4.2.2. Ergebnisse der transmissionselektronenmikroskopischen (TEM) Untersuchungen Anhand der TEM- Aufnahmen sollte untersucht werden, welche Schäden Albendazolsulfoxid allein beziehungsweise
4 Ergebnisse 101 4.2.2. Ergebnisse der transmissionselektronenmikroskopischen (TEM) Untersuchungen Anhand der TEM- Aufnahmen sollte untersucht werden, welche Schäden Albendazolsulfoxid allein beziehungsweise
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 6 Kreislaufsystem.
 6 Kreislaufsystem 2010 GmbH, Stuttgart Arterie univakuoläres Fettgewebe Adventitia (Tunica externa) Media (Tunica media) Lumen der Arterie mit Blut Intima (Tunica interna) Arterie, Gekröse, Pferd. Färbung
6 Kreislaufsystem 2010 GmbH, Stuttgart Arterie univakuoläres Fettgewebe Adventitia (Tunica externa) Media (Tunica media) Lumen der Arterie mit Blut Intima (Tunica interna) Arterie, Gekröse, Pferd. Färbung
Hoden Eierstöcke FSH (Follikel- stimulierendes Hormon) LH (Luteinisierendes Hormon). Testosteron
 Geschlechtshormone Wie ihr schon gelernt habt, bildet die Nebennierenrinde Geschlechtshormone, welche aber eher schwach wirken oder als Vorläufer dienen. Die wichtigeren Hormondrüsen für die Entwicklung
Geschlechtshormone Wie ihr schon gelernt habt, bildet die Nebennierenrinde Geschlechtshormone, welche aber eher schwach wirken oder als Vorläufer dienen. Die wichtigeren Hormondrüsen für die Entwicklung
5 Zusammenfassung und Schlussfolgerung
 5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
Weibliche Geschlechtsorgane
 Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Funktion: Verschluß der Genitalöffnung Klitoris Funktion: Vermittler sexueller
Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Funktion: Verschluß der Genitalöffnung Klitoris Funktion: Vermittler sexueller
Weibliche Geschlechtsorgane
 Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Klitoris Drüsen (Gll. vestibulares majores Bartholini, Gll. vestibulares minores,
Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Klitoris Drüsen (Gll. vestibulares majores Bartholini, Gll. vestibulares minores,
Dickdarm (Intestinum crassum)
 Dickdarm (Intestinum crassum) Aufgabe des etwa 1,2 bis 1,4 Meter langen Dickdarms ist es, den Verdauungsbrei durch Wasserentzug weiter einzudicken, die Gleitfähigkeit des Darminhaltes durch Schleimproduktion
Dickdarm (Intestinum crassum) Aufgabe des etwa 1,2 bis 1,4 Meter langen Dickdarms ist es, den Verdauungsbrei durch Wasserentzug weiter einzudicken, die Gleitfähigkeit des Darminhaltes durch Schleimproduktion
3 Eigene Untersuchungen
 3 Eigene Untersuchungen - 56-3.2.5.1.2 Zitzen Es werden 65 unveränderte, gesunde Zitzen sonographisch dargestellt. Diese stammen von 24 Hündinnen. Die Zitze stellt sich in allen Fällen als ein queroval
3 Eigene Untersuchungen - 56-3.2.5.1.2 Zitzen Es werden 65 unveränderte, gesunde Zitzen sonographisch dargestellt. Diese stammen von 24 Hündinnen. Die Zitze stellt sich in allen Fällen als ein queroval
Bibliografische Informationen der Deutschen Bibliothek
 Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über
Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über
Follikeldynamik nach Entfernung des DF und PGF 2 α-applikation am 10. Zyklustag
 3.2.2.3. Follikeldynamik nach Entfernung des DF und PGF 2 α-applikation am 10. Zyklustag Bei Eliminierung des DF am 10. Zyklustag und gleichzeitiger PGF 2 α-applikation bei sieben Kühen begann eine neue
3.2.2.3. Follikeldynamik nach Entfernung des DF und PGF 2 α-applikation am 10. Zyklustag Bei Eliminierung des DF am 10. Zyklustag und gleichzeitiger PGF 2 α-applikation bei sieben Kühen begann eine neue
Es gibt zwei verschiedene Heilungsmechanismen des Körpers: Reparatur und Regeneration.
 I Wundbeurteilung 1 Primäre und sekundäre Wundheilung Primäre Wundheilung Darunter versteht man das gleichzeitige Aneinaderlegen (Adaptieren) und Schließen der einzelnen Gewebeschichten mittels Naht, Klammern
I Wundbeurteilung 1 Primäre und sekundäre Wundheilung Primäre Wundheilung Darunter versteht man das gleichzeitige Aneinaderlegen (Adaptieren) und Schließen der einzelnen Gewebeschichten mittels Naht, Klammern
Weibliche Geschlechtsorgane
 Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Funktion: Verschluß der Genitalöffnung Klitoris Funktion: Vermittler sexueller
Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Funktion: Verschluß der Genitalöffnung Klitoris Funktion: Vermittler sexueller
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 15 Allgemeine Körperdecke.
 15 Allgemeine Körperdecke 2010 GmbH, Stuttgart Haut Haare mit anliegenden Talgdrüsen Talgdrüsen Epidermis, mit abschilferndem Stratum corneum Stratum papillare exoepitheliale, exokrine, tubuläre, apokrine
15 Allgemeine Körperdecke 2010 GmbH, Stuttgart Haut Haare mit anliegenden Talgdrüsen Talgdrüsen Epidermis, mit abschilferndem Stratum corneum Stratum papillare exoepitheliale, exokrine, tubuläre, apokrine
HISTOLOGISCHE STUDIEN AM PORCINEN EILEITER UNTER BESONDERER BERÜCKSICHTIGUNG ZYKLUSABHÄNGIGER EINFLUSSFAKTOREN SIMONE WEITEMEIER
 HISTOLOGISCHE STUDIEN AM PORCINEN EILEITER UNTER BESONDERER BERÜCKSICHTIGUNG ZYKLUSABHÄNGIGER EINFLUSSFAKTOREN SIMONE WEITEMEIER INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. med. vet. beim
HISTOLOGISCHE STUDIEN AM PORCINEN EILEITER UNTER BESONDERER BERÜCKSICHTIGUNG ZYKLUSABHÄNGIGER EINFLUSSFAKTOREN SIMONE WEITEMEIER INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. med. vet. beim
Charakteristisch für die Lymphfollikel der Milz sind die darin enthaltenen Arteriolen. Abb. 4 Pinselarteriolen Mensch, HE-Färbung
 Die ist das größte lymphatische Organ und in besonderer Weise in den Blutstrom integriert. Sie ist nicht in den Lymphstrom eingeschaltet und hat folgende Aufgaben: Reinigung des Blutes von körperfremden
Die ist das größte lymphatische Organ und in besonderer Weise in den Blutstrom integriert. Sie ist nicht in den Lymphstrom eingeschaltet und hat folgende Aufgaben: Reinigung des Blutes von körperfremden
Entzündung. Teil 18.
 Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Niere, Affe, HE , 9-13 Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE Ureter, HE Harnblase, HE... 18,19
 7 Niere, Harnwege Niere, Affe, HE... -6, 9- Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE... 4 Ureter, HE... 5-7 Harnblase, HE... 8,9 Urethra, männlich, HE... 0- Niere - Übersicht (HE) 4 5 6 5 Rinde
7 Niere, Harnwege Niere, Affe, HE... -6, 9- Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE... 4 Ureter, HE... 5-7 Harnblase, HE... 8,9 Urethra, männlich, HE... 0- Niere - Übersicht (HE) 4 5 6 5 Rinde
Korrektion für die 11. Auflage
 Korrektion für die 11. Auflage Seite 20 2.2.2 Meiose 5. Satz Kurz vor Beginn der 1. Reifeteilung verdoppeln die weiblichen und die männlichen Keimzellen, (primäre Oozyten und primäre Spermatozyten) ihre
Korrektion für die 11. Auflage Seite 20 2.2.2 Meiose 5. Satz Kurz vor Beginn der 1. Reifeteilung verdoppeln die weiblichen und die männlichen Keimzellen, (primäre Oozyten und primäre Spermatozyten) ihre
Hormon Kosmetik für die Frau
 Dr. med. Jürg Eichhorn Allgemeine Innere Medizin FMH Praxis für Allgemeine und Erfahrungsmedizin Traditionelle Chinesische Medizin ASA Sportmedizin SGSM Neuraltherapie SANTH & SRN Manuelle Medizin SAMM
Dr. med. Jürg Eichhorn Allgemeine Innere Medizin FMH Praxis für Allgemeine und Erfahrungsmedizin Traditionelle Chinesische Medizin ASA Sportmedizin SGSM Neuraltherapie SANTH & SRN Manuelle Medizin SAMM
Die Leber Entstehung der Leber. Histologie der Leber
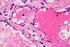 Die Leber Entstehung der Leber Die Hepatozyten sind endodermaler Herkunft und entwickeln sich aus den selben Vorläuferzellen, die auch den Darm bilden. Bindegewebe und Gefäße der Leber entstehen aus mesenchymalen
Die Leber Entstehung der Leber Die Hepatozyten sind endodermaler Herkunft und entwickeln sich aus den selben Vorläuferzellen, die auch den Darm bilden. Bindegewebe und Gefäße der Leber entstehen aus mesenchymalen
Universitätsfrauenklinik Bochum. Hauptvorlesung. Literatur. Gynäkologie und Geburtshilfe
 Datum Themen Dozent Universitätsfrauenklinik Bochum 17.10.2007 24.10.2007 Einführung, Anamnese, Befunderhebung, gynäkologische und geburtshilfliche Diagnostik Physiologie der Schwangerschaft: Konzeption,
Datum Themen Dozent Universitätsfrauenklinik Bochum 17.10.2007 24.10.2007 Einführung, Anamnese, Befunderhebung, gynäkologische und geburtshilfliche Diagnostik Physiologie der Schwangerschaft: Konzeption,
Pankreas Schilddrüse Nebenniere Hypophyse. Die Studierenden sollen. die Steuerung des endokrinen Systems erläutern können.
 Kurstag 17 Themen Endokrine Organe Pankreas Schilddrüse Nebenniere Hypophyse Prüfungsrelevante Lerninhalte Allgemeine Prinzipien: Struktur- Funktionsbeziehungen, Hormone: Regulation der Hormonsynthese
Kurstag 17 Themen Endokrine Organe Pankreas Schilddrüse Nebenniere Hypophyse Prüfungsrelevante Lerninhalte Allgemeine Prinzipien: Struktur- Funktionsbeziehungen, Hormone: Regulation der Hormonsynthese
3.2.1 Rassenverteilung der untersuchten Tiere
 3 Eigene Untersuchungen - 34-3.2 Ergebnisse Die Ergebnisse dieser Untersuchungen sind im Anhang in tabellarischer Form zusammengefasst. 3.2.1 Rassenverteilung der untersuchten Tiere Die für diese Arbeit
3 Eigene Untersuchungen - 34-3.2 Ergebnisse Die Ergebnisse dieser Untersuchungen sind im Anhang in tabellarischer Form zusammengefasst. 3.2.1 Rassenverteilung der untersuchten Tiere Die für diese Arbeit
Ovarialzysten beim Rind
 Ovarialzysten beim Rind M. Drillich Klinik für Wiederkäuer, Abteilung Bestandsbetreuung Vetmeduni Vienna Veterinärmedizinische Universität Wien Definition Ovarialzysten, Cystic Ovarian Disease > 2,5 cm
Ovarialzysten beim Rind M. Drillich Klinik für Wiederkäuer, Abteilung Bestandsbetreuung Vetmeduni Vienna Veterinärmedizinische Universität Wien Definition Ovarialzysten, Cystic Ovarian Disease > 2,5 cm
Tabelle 12: Zystendiagnosen im Verlauf der Laktation nach Palpation vom Rektum her
 4. Ergebnisse 4.1. Auswertung der klinischen Untersuchung 4.1.1. Rektale Untersuchung 320 Tiere wurden während des Untersuchungszeitraumes zur rektalen Palpation vorgestellt. Aufgrund von unterdurchschnittlicher
4. Ergebnisse 4.1. Auswertung der klinischen Untersuchung 4.1.1. Rektale Untersuchung 320 Tiere wurden während des Untersuchungszeitraumes zur rektalen Palpation vorgestellt. Aufgrund von unterdurchschnittlicher
HISTOLOGISCHE UNTERSUCHUNG ZUM SPEZIESSPEZIFISCHEN UND REGIONALEN AUFBAU DER ZERVIX VERA KLEINEN
 HISTOLOGISCHE UNTERSUCHUNG DER ZERVIX VVB LAUFERSWEILER VERLAG S TA U F E N B E R G R I N G 1 5 D - 3 5 3 9 6 G I E S S E N Tel: 0641-5599888 Fax: -5599890 redaktion@doktorverlag.de www.doktorverlag.de
HISTOLOGISCHE UNTERSUCHUNG DER ZERVIX VVB LAUFERSWEILER VERLAG S TA U F E N B E R G R I N G 1 5 D - 3 5 3 9 6 G I E S S E N Tel: 0641-5599888 Fax: -5599890 redaktion@doktorverlag.de www.doktorverlag.de
5.1 Allgemeine Untersuchungen zur Qualität und Maturationsfähigkeit von COC in Abhängigkeit vom übergeordneten Dominanten Follikel
 5 Diskussion Mit den vorliegenden Untersuchungen sollte ermittelt werden, ob der Funktionszustand des Dominanten Follikels bei weiblichen Rindern einen Einfluß auf die Eizellen aus untergeordneten Follikeln
5 Diskussion Mit den vorliegenden Untersuchungen sollte ermittelt werden, ob der Funktionszustand des Dominanten Follikels bei weiblichen Rindern einen Einfluß auf die Eizellen aus untergeordneten Follikeln
Inaugural-Dissertation zur Erlangung des Grades eines Doktor Medicinae Veterinariae an der Freien Universität Berlin
 Aus der Tierklinik für Fortpflanzung des Fachbereichs Veterinärmedizin der Freie Universität Berlin (Arbeitsgruppe Prof. Dr. Dr. habil. P. S. Glatzel) Zur Charakterisierung des dominanten Follikels der
Aus der Tierklinik für Fortpflanzung des Fachbereichs Veterinärmedizin der Freie Universität Berlin (Arbeitsgruppe Prof. Dr. Dr. habil. P. S. Glatzel) Zur Charakterisierung des dominanten Follikels der
VERDAUUNGSAPPARAT V. Leber. Bau der Leber. Gefäßsystem der Leber. Tunica serosa. Tunica subserosa. Tunica fibrosa / Glisson-Kapsel
 Leber Bau der Leber Tunica serosa Tunica subserosa Tunica fibrosa / Glisson-Kapsel Kollagenfaserbündel ziehen ins innere der Leber Gliederung in Lobuli hepatici Leberzellbalken Gefäßsystem der Leber 2
Leber Bau der Leber Tunica serosa Tunica subserosa Tunica fibrosa / Glisson-Kapsel Kollagenfaserbündel ziehen ins innere der Leber Gliederung in Lobuli hepatici Leberzellbalken Gefäßsystem der Leber 2
Skelettmuskulatur (M.uvulae) quer/längs geschnitten
 Mundhöhle, Zunge Kurspräparate: Nr.50 Uvula Nr.39 Zunge, Papillae fungiformes Nr.40 Zungenmitte Nr.42 Zunge, Papillae foliatae Nr.44 Zunge, Papillae vallatae Nr.86 Harter Gaumen Uvula- weicher Gaumen Präparat
Mundhöhle, Zunge Kurspräparate: Nr.50 Uvula Nr.39 Zunge, Papillae fungiformes Nr.40 Zungenmitte Nr.42 Zunge, Papillae foliatae Nr.44 Zunge, Papillae vallatae Nr.86 Harter Gaumen Uvula- weicher Gaumen Präparat
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 13 Männliche Geschlechtsorgane.
 13 Männliche Geschlechtsorgane 2010 GmbH, Stuttgart Nebenhoden Flachschnitte durch die Wand des Nebenhodenganges Samenflüssigkeit Nebenhodengang, im Bereich des Nebenhodenschwanzes, Katze. Färbung H.E.,
13 Männliche Geschlechtsorgane 2010 GmbH, Stuttgart Nebenhoden Flachschnitte durch die Wand des Nebenhodenganges Samenflüssigkeit Nebenhodengang, im Bereich des Nebenhodenschwanzes, Katze. Färbung H.E.,
Fortpflanzungsstrategien der Tiere
 Fortpflanzungsstrategien der Tiere Sexuelle und Asexuelle Reproduktion Asexuelle Fortpflanzung Nachkommen mit Genen von einem Individuum Keine Fusion von Ei mit Spermium Genetische Variation der Nachkommen
Fortpflanzungsstrategien der Tiere Sexuelle und Asexuelle Reproduktion Asexuelle Fortpflanzung Nachkommen mit Genen von einem Individuum Keine Fusion von Ei mit Spermium Genetische Variation der Nachkommen
EINFLUSS EINER PERINATALEN ZEARALENON-EXPOSITION AUF CERVIX, UTERUS UND EILEITER VON FERKELN DINA KNAUF
 EINFLUSS EINER PERINATALEN ZEARALENON-EXPOSITION AUF CERVIX, UTERUS UND EILEITER VON FERKELN DINA KNAUF INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. med. vet. beim Fachbereich Veterinärmedizin
EINFLUSS EINER PERINATALEN ZEARALENON-EXPOSITION AUF CERVIX, UTERUS UND EILEITER VON FERKELN DINA KNAUF INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. med. vet. beim Fachbereich Veterinärmedizin
14 Verdauungstrakt Rumpfdarm
 Verdauungstrakt Rumpfdarm Oesophagus, quer, HE... -6 Oesophagus/Cardia, Goldner... 7-0 Magen, Corpus/Fundus, HE... - Magen, Pars pylorica, HE... Duodenum, längs, HE... - Duodenum, EC-Zellen, Immunhistochemie...
Verdauungstrakt Rumpfdarm Oesophagus, quer, HE... -6 Oesophagus/Cardia, Goldner... 7-0 Magen, Corpus/Fundus, HE... - Magen, Pars pylorica, HE... Duodenum, längs, HE... - Duodenum, EC-Zellen, Immunhistochemie...
Welche Aussage trifft nicht zu?
 Welche Aussage trifft nicht zu? 1. Eine Zygote ist totipotent. 2. Die Blastomeren eines menschlichen Furchungsstadiums im 4-Zell-Stadium sind totipotent. 3. Primordiale Keimzellen sind totipotent. 4. Die
Welche Aussage trifft nicht zu? 1. Eine Zygote ist totipotent. 2. Die Blastomeren eines menschlichen Furchungsstadiums im 4-Zell-Stadium sind totipotent. 3. Primordiale Keimzellen sind totipotent. 4. Die
Untersuchungen zum Einfluss von alpha Defensinen. aus neutrophilen Granulozyten auf die. primäre Hämostase
 Aus dem Institut für Veterinär-Physiologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. Joachim Roth und Der Abteilung für Experimentelle und Klinische Hämostaseologie, Klinik und Poliklinik
Aus dem Institut für Veterinär-Physiologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. Joachim Roth und Der Abteilung für Experimentelle und Klinische Hämostaseologie, Klinik und Poliklinik
Einfluss von Anti-Inhibin und. Kokultursystemen auf die In-vitro- Maturation und Befruchtung von. Schweineeizellen
 Einfluss von Anti-Inhibin und Kokultursystemen auf die In-vitro- Maturation und Befruchtung von Schweineeizellen Manuela Ropeter-Scharfenstein Institut für Tierzucht und Haustiergenetik Universität Göttingen
Einfluss von Anti-Inhibin und Kokultursystemen auf die In-vitro- Maturation und Befruchtung von Schweineeizellen Manuela Ropeter-Scharfenstein Institut für Tierzucht und Haustiergenetik Universität Göttingen
Brustzentrum der Landeshauptstadt Stuttgart Fertilitätsprotektion unter Chemotherapie GNRH Analoga Pro und Contra
 Brustzentrum der Landeshauptstadt Stuttgart Fertilitätsprotektion unter Chemotherapie GNRH Analoga Pro und Contra Prof.Dr.med.U.Karck Ärztlicher Direktor Frauenklinik KlinikumStuttgart Zentrum für Gynäkologische
Brustzentrum der Landeshauptstadt Stuttgart Fertilitätsprotektion unter Chemotherapie GNRH Analoga Pro und Contra Prof.Dr.med.U.Karck Ärztlicher Direktor Frauenklinik KlinikumStuttgart Zentrum für Gynäkologische
Partnerpuzzle zum Thema MENSTRUATIONSZYKLUS. Didaktische Hinweise zur Durchführung des Partnerpuzzles (SOL)
 Partnerpuzzle zum Thema MENSTRUATIONSZYKLUS Didaktische Hinweise zur Durchführung des Partnerpuzzles (SOL) Das Verständnis der hormonellen und körperlichen Vorgänge während des Menstruationszyklus überfordert
Partnerpuzzle zum Thema MENSTRUATIONSZYKLUS Didaktische Hinweise zur Durchführung des Partnerpuzzles (SOL) Das Verständnis der hormonellen und körperlichen Vorgänge während des Menstruationszyklus überfordert
Befruchtung der Eizelle, Schwangerschaft, Geburt, Laktation
 Befruchtung der Eizelle, Schwangerschaft, Geburt, Laktation Samenflüssigkeit: Spermien + Sekrete der akzessorischen Geschlechtsdrüsen (Prostata, Vesicula seminalis, bulbourethrale Drüse). Das Ejakulat
Befruchtung der Eizelle, Schwangerschaft, Geburt, Laktation Samenflüssigkeit: Spermien + Sekrete der akzessorischen Geschlechtsdrüsen (Prostata, Vesicula seminalis, bulbourethrale Drüse). Das Ejakulat
Zytologische und histologische Grundlagen der Biologie
 Zytologische und histologische Grundlagen der Biologie Gefäßsystem: ) Blutkreislauf B) Lymphgefäße Gefäßsystem: ) Blutkreislauf: - Lungenkreislauf (rechter entrikel) - Körperkreislauf (linker entrikel)
Zytologische und histologische Grundlagen der Biologie Gefäßsystem: ) Blutkreislauf B) Lymphgefäße Gefäßsystem: ) Blutkreislauf: - Lungenkreislauf (rechter entrikel) - Körperkreislauf (linker entrikel)
Zusammenfassung in deutscher Sprache
 Zusammenfassung in deutscher Sprache Zusammenfassung Man schätzt, dass in den Niederlanden einer von 200 Erwachsenen (=60.000) eine verborgene Nierenschädigung hat. Ungefähr 40.000 Menschen sind bekennt
Zusammenfassung in deutscher Sprache Zusammenfassung Man schätzt, dass in den Niederlanden einer von 200 Erwachsenen (=60.000) eine verborgene Nierenschädigung hat. Ungefähr 40.000 Menschen sind bekennt
Timing der embryologischen Stadien
 Blastogenese Embryogenese - Fetogenese Blastogenese: ca. 8 Tage speziesübergreifend Embryogenese: Embroygenese Trächtigkeitsdauer = sinkt mit der Länge der Trächtigkeit Fetogenese: Fetogenese = steigt
Blastogenese Embryogenese - Fetogenese Blastogenese: ca. 8 Tage speziesübergreifend Embryogenese: Embroygenese Trächtigkeitsdauer = sinkt mit der Länge der Trächtigkeit Fetogenese: Fetogenese = steigt
7 Ergebnisse der Untersuchungen zur Sprungfreudigkeit der Rammler beim Absamen und zu den spermatologischen Parametern
 Ergebnisse 89 7 Ergebnisse der Untersuchungen zur Sprungfreudigkeit der Rammler beim Absamen und zu den spermatologischen Parametern 7.1 Einfluß des Lichtregimes 7.1.1 Verhalten der Rammler beim Absamen
Ergebnisse 89 7 Ergebnisse der Untersuchungen zur Sprungfreudigkeit der Rammler beim Absamen und zu den spermatologischen Parametern 7.1 Einfluß des Lichtregimes 7.1.1 Verhalten der Rammler beim Absamen
Prof. Dr. med. Karl Junkmann.
 Gedanken uber den Sexualzyklus Prof. Dr. med. Karl Junkmann. Herr Praesident, meine Damen und Herren! Lassen Sie mich zu Beginn meines Vortrages wiederum meiner Freude Ausdruck geben ueber die grosse Ehre,
Gedanken uber den Sexualzyklus Prof. Dr. med. Karl Junkmann. Herr Praesident, meine Damen und Herren! Lassen Sie mich zu Beginn meines Vortrages wiederum meiner Freude Ausdruck geben ueber die grosse Ehre,
Säugezeit runter Ferkelzahl hoch?
 KB-Refresherkurs 20. Febr. 2008 in Emstek Säugezeit runter Ferkelzahl hoch? -Praxiserfahrungen mit dem verkürzten 3-Wochenrhythmus Johannes Hilgers Landesverband Rheinischer Schweinezüchter Bonn KB-Refresherkurs
KB-Refresherkurs 20. Febr. 2008 in Emstek Säugezeit runter Ferkelzahl hoch? -Praxiserfahrungen mit dem verkürzten 3-Wochenrhythmus Johannes Hilgers Landesverband Rheinischer Schweinezüchter Bonn KB-Refresherkurs
Zelldifferenzierung Struktur und Funktion von Pflanzenzellen (A)
 Struktur und Funktion von Pflanzenzellen (A) Abb. 1: Querschnitt durch ein Laubblatt (Rasterelektronenmikroskop) Betrachtet man den Querschnitt eines Laubblattes unter dem Mikroskop (Abb. 1), so sieht
Struktur und Funktion von Pflanzenzellen (A) Abb. 1: Querschnitt durch ein Laubblatt (Rasterelektronenmikroskop) Betrachtet man den Querschnitt eines Laubblattes unter dem Mikroskop (Abb. 1), so sieht
Epi Histopathologische Untersuchung auf metastatische Aktivität
 49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
(Patho)Physiologie von Verdauung und Resorption
 (Patho)Physiologie von Verdauung und Resorption Gliederung Funktionelle Anatomie - Aufbau des Magens und der Magenschleimhaut Mechanismen der Magensaftbildung & der Magenschleimhaut - Mechanismen der Protonensekretion
(Patho)Physiologie von Verdauung und Resorption Gliederung Funktionelle Anatomie - Aufbau des Magens und der Magenschleimhaut Mechanismen der Magensaftbildung & der Magenschleimhaut - Mechanismen der Protonensekretion
Kreislauforgane und Blut
 Kurstag 11 Kreislauforgane und Blut Themen Blutgefäße Lymphgefäße Peripheres Blut Lernziele Prüfungsrelevante Lerninhalte Blut und Gefäße: Arterien, Wandaufbau: elastischer und muskulärer Typ und deren
Kurstag 11 Kreislauforgane und Blut Themen Blutgefäße Lymphgefäße Peripheres Blut Lernziele Prüfungsrelevante Lerninhalte Blut und Gefäße: Arterien, Wandaufbau: elastischer und muskulärer Typ und deren
Dr. med. Bernd Kleine-Gunk (*1959)
 Dr. med. Bernd Kleine-Gunk (*1959) ist Chefarzt der Gynäkologie an der EuromedClinik in Fürth, Deutschlands größter Privatklinik. Neben der operativen Gynäkologie gilt sein besonderes Interesse ernährungsmedizinischen
Dr. med. Bernd Kleine-Gunk (*1959) ist Chefarzt der Gynäkologie an der EuromedClinik in Fürth, Deutschlands größter Privatklinik. Neben der operativen Gynäkologie gilt sein besonderes Interesse ernährungsmedizinischen
Wie Hormone uns ein Leben lang begleiten
 Wie Hormone uns ein Leben lang begleiten aber auch die Befehlsgeber selbst wiederum übergeordnete Vorgesetzte, deren Anweisungen sie befolgen müssen. Am Beispiel der Schilddrüse sieht dies folgendermaßen
Wie Hormone uns ein Leben lang begleiten aber auch die Befehlsgeber selbst wiederum übergeordnete Vorgesetzte, deren Anweisungen sie befolgen müssen. Am Beispiel der Schilddrüse sieht dies folgendermaßen
Immunbiologie. Teil 6
 Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
Thomas Steck Heike Pachmann Edeltraud Hertel Christel Morgenstern. Kompendium der Geburtshilfe für Hebammen. SpringerWienNewYork
 Thomas Steck Edeltraud Hertel Christel Morgenstern Kompendium der Geburtshilfe für Hebammen SpringerWienNewYork Thomas Steck Frauenklinik der Klinikum Chemnitz GmbH, Chemnitz, Deutschland Edeltraud Hertel
Thomas Steck Edeltraud Hertel Christel Morgenstern Kompendium der Geburtshilfe für Hebammen SpringerWienNewYork Thomas Steck Frauenklinik der Klinikum Chemnitz GmbH, Chemnitz, Deutschland Edeltraud Hertel
Histologie Nachklausur 1 vom
 Histologie Nachklausur 1 vom 19.10.2011 Anatomie - mikroskopische Anatomie Frage 1: Welche Aussage zum nebenstehenden Bild trifft zu? Antwort 1.1: (A: 5 - F: 0) Es handelt sich um eine endokrine Drüse
Histologie Nachklausur 1 vom 19.10.2011 Anatomie - mikroskopische Anatomie Frage 1: Welche Aussage zum nebenstehenden Bild trifft zu? Antwort 1.1: (A: 5 - F: 0) Es handelt sich um eine endokrine Drüse
Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen möglich wird.
 Präparatedetails Organ Herkunft Färbung HYPOPHYSE MENSCH AZAN Methode Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen
Präparatedetails Organ Herkunft Färbung HYPOPHYSE MENSCH AZAN Methode Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen
Psychodynamische Kurzzeittherapie
 Hanna Levenson Psychodynamische Kurzzeittherapie Aus dem Amerikanischen übersetzt von Anni Pott Ernst Reinhardt Verlag München Basel Hanna Levenson, PhD, Professorin für Psychologie am Wright Institute,
Hanna Levenson Psychodynamische Kurzzeittherapie Aus dem Amerikanischen übersetzt von Anni Pott Ernst Reinhardt Verlag München Basel Hanna Levenson, PhD, Professorin für Psychologie am Wright Institute,
Master-Seminar Empirische Managementforschung Sommersemester 2013
 Der Einfluss von Corporate Governance-Strukturen auf die Unternehmensführung Master- Sommersemester 2013 Prof. Dr. Michael Wolff Professur für Management und Controlling Göttingen, 7. Januar 2013 Das elektronische
Der Einfluss von Corporate Governance-Strukturen auf die Unternehmensführung Master- Sommersemester 2013 Prof. Dr. Michael Wolff Professur für Management und Controlling Göttingen, 7. Januar 2013 Das elektronische
Weibliche Geschlechtsorgane
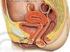 Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Klitoris Drüsen (Gll. vestibulares majores Bartholini, Gll. vestibulares minores,
Weibliche Geschlechtsorgane äußere Genitalorgane (Vulva) Mons pubis große und kleine Schamlippen (Labia majora et minora) Klitoris Drüsen (Gll. vestibulares majores Bartholini, Gll. vestibulares minores,
Pathologie des Ovars
 Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
Aus dem Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität Gießen. Betreuer: Prof. Dr. St. Hoy
 Aus dem Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. St. Hoy Eingereicht über das Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität
Aus dem Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. St. Hoy Eingereicht über das Institut für Tierzucht und Haustiergenetik der Justus-Liebig-Universität
Endokrinologie der Schwangerschaft. Ch. De Geyter Klinik für Gyn. Endokrinologie und Reproduktionsmedizin Universitäts-Frauenklinik Basel
 Endokrinologie der Schwangerschaft Ch. De Geyter Klinik für Gyn. Endokrinologie und Reproduktionsmedizin Universitäts-Frauenklinik Basel Endokrinologie der Schwangerschaft 1. Frühschwangerschaft (1. Trimenon)
Endokrinologie der Schwangerschaft Ch. De Geyter Klinik für Gyn. Endokrinologie und Reproduktionsmedizin Universitäts-Frauenklinik Basel Endokrinologie der Schwangerschaft 1. Frühschwangerschaft (1. Trimenon)
Stützgewebe 1/3. Knorpel
 Stützgewebe 1/3 Knorpel Knorpel Knorpelzellen Matrix Chondroblasten Chondrozyten Wasser (80%) Kollagen Typ II (Hauptanteil) Kollagen Typ IX (verbindet Typ II Fibrillen) Kollagen Typ X Kollagen Typ XI (Teil
Stützgewebe 1/3 Knorpel Knorpel Knorpelzellen Matrix Chondroblasten Chondrozyten Wasser (80%) Kollagen Typ II (Hauptanteil) Kollagen Typ IX (verbindet Typ II Fibrillen) Kollagen Typ X Kollagen Typ XI (Teil
Kinderwunsch. Das Syndrom der polyzystischen Ovarien (PCOS)
 Kinderwunsch Das Syndrom der polyzystischen Ovarien (PCOS) EINLEITUNG 3 Das polyzystische Ovarsyndrom (PCOS) betriff 6 7 % aller Frauen im gebärfähigen Alter. Es ist die Hauptursache einer durch einen
Kinderwunsch Das Syndrom der polyzystischen Ovarien (PCOS) EINLEITUNG 3 Das polyzystische Ovarsyndrom (PCOS) betriff 6 7 % aller Frauen im gebärfähigen Alter. Es ist die Hauptursache einer durch einen
Binde- und Fettgewebe
 Kurstag 4 Binde- und Fettgewebe Lernziele Prüfungsrelevante Lerninhalte Prinzipieller Aufbau, Klassifikation (Mesenchym, lockeres, retikuläres, retikulärfaseriges, straffes geflechtartiges, straffes parallelfaseriges
Kurstag 4 Binde- und Fettgewebe Lernziele Prüfungsrelevante Lerninhalte Prinzipieller Aufbau, Klassifikation (Mesenchym, lockeres, retikuläres, retikulärfaseriges, straffes geflechtartiges, straffes parallelfaseriges
Muskelsystem Myologie
 Muskelsystem Myologie Muskulatur Einteilung der Muskulatur Glatte Muskulatur Fasern sind glatt ohne Querstreifung max. Länge 0,5 mm, in Wänden der inneren Organe quergestreifte Muskulatur Im mikroskopischen
Muskelsystem Myologie Muskulatur Einteilung der Muskulatur Glatte Muskulatur Fasern sind glatt ohne Querstreifung max. Länge 0,5 mm, in Wänden der inneren Organe quergestreifte Muskulatur Im mikroskopischen
