Inhibitorischer Einfluss von Phospholipiden auf den Effluxtransporter P-Glykoprotein
|
|
|
- Gerd Baumann
- vor 5 Jahren
- Abrufe
Transkript
1 Inhibitorischer Einfluss von Phospholipiden auf den Effluxtransporter P-Glykoprotein INAUGURALDISSERTATION zur Erlangung der Doktorwürde der Fakultät für Chemie und Pharmazie der Albert-Ludwigs-Universität Freiburg im Breisgau vorgelegt von Silke Simon aus München 2013
2
3 Die vorliegende Dissertationsschrift wurde von Januar 2009 bis Dezember 2012 unter der Anleitung von Herrn Prof. Dr. Rolf Schubert am Lehrstuhl für Pharmazeutische Technologie und Biopharmazie des Instituts für Pharmazeutische Wissenschaften der Albert-Ludwigs-Universität Freiburg im Breisgau angefertigt. Dekan: Vorsitzender des Promotionsausschusses: Referent: Korreferentin: Drittprüfer: Prof. Dr. Andreas Bechthold Prof. Dr. Thorsten Koslowski Prof. Dr. Rolf Schubert Prof. Dr. Regine Süss Prof. Dr. Norbert Klugbauer Tag der Promotion: Bekanntgabe des Prüfungsergebnisses:
4
5 Danksagung Mein größter Dank richtet sich an meinen Doktorvater, Prof. Dr. Rolf Schubert, der mir die Möglichkeit gab, diese Doktorarbeit in seinem Arbeitskreis anzufertigen. Seine stetige Unterstützung, sein Vertrauen in meine Arbeit und sein offenes Ohr für sämtliche Fragestellungen haben mich die letzten knapp vier Jahre wohlwollend begleitet. Unser Lehrstuhl wird nicht zuletzt durch seine hervorragenden fachlichen und menschlichen Qualitäten zu einem Arbeitsplatz, an dem sich einfach jeder wohl fühlt. Gleichzeitig möchte ich auch meiner Co-Betreuerin, Prof. Dr. Regine Süss danken, die mich ebenfalls fortwährend unterstützt und mein Projekt durch diverse inhaltliche Anregungen bereichert hat. Prof. Dr. Norbert Klugbauer danke ich für die unkomplizierte Übernahme des Drittprüferamtes. Sabine Barnert gilt mein Dank für die Anfertigung der Kryo-TEM-Aufnahmen und ihre große Kompetenz in allen sicherheitstechnischen Fragen, Herrn Pfeiffer und Nicole Specht für die Durchführung der Bartlett-Assays. Birgit Erhard unterstützte mich bei den zellulären Arbeiten, Ima Ohlhoff war in den allgemeinen Labordingen eine verlässliche Ansprechpartnerin. Nuria Beltran danke ich für ihre absolute Hilfsbereitschaft im administrativem Schriftkram und für die vielen netten, wenn auch nur kurzen Gespräche zwischen Tür und Angel. Wolf Michaelis war bis zu seinem Ruhestand eine große Stütze bei der Praktikumsorganisation. Auch Dr. Fee Lewrick und Dr. Martin Holzer möchte ich für ihren Rat in praktischen und theoretischen Belangen danken. Im Zuge meines Projekts führte ich zusammen mit Prof. Dr. Gert Fricker (Lehrstuhl für Pharmazeutische Technologie und Biopharmazie) in vivo Studien am Institut für Pharmazie und Molekulare Biotechnologie der Universität Heidelberg durch. Ich danke ihm recht herzlich für seine Kooperations- und Hilfsbereitschaft und hoffe sehr, dass bei der Weiterführung meines Forschungsthemas weitere, erfolgreiche Versuche folgen werden. Dr. Jürgen Burhenne aus dem analytisch-chemischen Labor des Universitätsklinikums Heidelberg (Abt. für Klinische Pharmakologie und Pharmakoepidemiologie) hat sich in der Analytik der hierbei anfallenden Serumproben verdient gemacht. Eine weitere, überaus konstruktive und erfolgreiche Kooperation fand mit dem Lehrstuhl für Pharmazeutische Bioinformatik unserer Universität statt, wobei ich mich hier bei Jun.-Prof. Dr. Stephan Günther und Xavier Lucas für die Durchführung der Dockingstudien, den interessanten fachlichen Diskussionen und letztendlich unserer gemeinsamen Publikation bedanken möchte.
6 Dr. Christian Senger hat mich bei der statistischen Auswertung meiner experimentellen Daten sehr unterstützt. Phospholipid e.v. danke ich für die Finanzierung meines Projekts und speziell Dr. Peter van Hoogevest für sein großes Interesse an meiner Arbeit und seinen vielfältigen und äußerst hilfreichen Anregungen. Die Firma NanoAnalytics stellte uns freundlicherweise das CellZscope-Gerät zur Verfügung, das Netherlands Cancer Institute (NKI) sandte uns unentgeltlich den Zellstamm MDCKII mdr1 zu. Ganz besonderer Dank gilt meiner Uni-Mitbewohnerin im Emotion-Lab, Gesche/-i Först. Ich kann und konnte mir keine bessere/ verständnisvollere/ unkompliziertere Laborkollegin/ OJ- Zimmerkumpanin und v.a. Freundin vorstellen, mit der man in so vielen Lebenslagen Spaß haben kann: Seien es unsere über-die-laborbank-gespräche oder diverse Freizeitaktionen (Darry, MTB, Ski, Clubbing, Plätzchen, ), unsere vierjährige gemeinsame Zeit wird mir immer in allertollster Erinnerung bleiben und ich hoffe, dass es irgendwie einfach so weiter geht!! Danke auch an die Ehemaligen, Kadda Böhm, Riki Mayenfels und Moni Cwik: Mit Euch verbinde ich sooo viele schrecklich-schöne Erinnerungen (Betonsilo, TripleM, Hüttengaudi, ). Genauso mit meinen anderen Freunden = Kollegen Annette Steinbach, Ines Müller, Michael :-) Drechsler, Doris Zimmer, Manuel Weis, Shila Gurung, Judith Jakoby, Marcus Wüller und unseren Neuzugängen Kathrin Züfle, Daniel Molnar und Christoph Grapentin. Wir haben so viele coole Aktionen gestartet (Darry, Motto-Parties, Oktoberfest, Karneval, Grillabende, ), dass ich sie gar nicht alle aufzählen kann. Mit Euch hat die Promotion einfach (fast) immer Spaß gemacht!!! Besonders gedenken möchte ich zudem Alex Burghardt, der unseren Lehrstuhl menschlich und fachlich so bereichert hat, dass er mir stets unvergesslich bleiben wird. Meiner Familie und meinen Freunden aus Schul-, Studien- und Promotionszeit danke ich von ganzem Herzen für ihre permanente, seelische und moralische Unterstützung und Motivation und ihre Zuversicht, dass Alles gut wird. Mein spezieller Dank geht an meinen Freund Michi, der mich nicht nur fachlich und emotional stets herausragend betreut hat, sondern mir immer wieder gezeigt hat, was im Leben wirklich wichtig ist.
7 FÜR MEINE ELTERN, SONJA UND MICHAEL
8
9 Teile dieser Arbeit wurden veröffentlicht Publikationen Simon S., Schubert R. (2012); Inhibitory Effect of Phospholipids on P-Glycoprotein: Cellular Studies in Caco-2, MDCKII mdr1 and MDCKII wildtype cells and P-gp ATPase Activity Measurements Biochim Biophys Acta; 1821: Lucas X.*, Simon S.*, Schubert R., Günther S. (eingereicht 2012); Discovery of the inhibitory effect of a phosphatidylinositol derivative on P-glycoprotein by virtual screening followed by in vitro cellular studies *The authors wish it to be known that, in their opinion, the first two authors should be regarded as joint First Authors. Vorträge Silke Simon, Rolf Schubert Transcytosis in CaCo2 cell layers 7. Pharmazie-Workshop, Oberjoch (Allgäu), März 2009 Silke Simon, Rolf Schubert Lipid-mediated drug transport in Caco2 cell layers 8 th International Conference and Workshop on Biological Barriers, Saarbrücken, März 2010 Silke Simon, Rolf Schubert P-gp inhibitory potential of phospholipids 1 st Meeting of the Researcher Community of the Phospholipid Research Center, Heidelberg, September 2010 Silke Simon, Rolf Schubert Phospholipide als potentielle Hemmstoffe des Effluxtransporters P-Glykoprotein Förderverein für Arzneimittelforschung (FAF), Jahrestreffen, Freiburg, Januar 2011
10 Silke Simon, Rolf Schubert P-glycoprotein inhibition via Phospholipids: Influence of experimental parameters, mechanism of action and suitability in oral drug application 21 st Mountain/Sea Workshop, Oberjoch (Allgäu), März 2011 Silke Simon, Rolf Schubert Phospholipide als Hemmstoffe des Effluxtransporters P-Glykoprotein : Einfluss experimenteller Parameter, Wirkungsmechanismen und Chancen für die orale Applikation 13. Herrenalber Transporter-Tage, Bad Herrenalb, Juni 2011 Silke Simon, Rolf Schubert Specific Phospholipids as in vitro P-Glycoprotein Inhibitors 10. Pharmazie-Workshop, Oberjoch (Allgäu), März 2012 Silke Simon, Rolf Schubert Hemmung des Effluxtransporters P-Glykoprotein durch Phospholipidzubereitungen 14. Bad Herrenalber Transporter- und Barriere-Tage, Bad Herrenalb, Mai 2012 Posterpräsentationen Silke Simon, Rolf Schubert Lipid-mediated drug transport in Caco2 cell layers 8 th International Conference and Workshop on Biological Barriers, Saarbrücken, März 2010 Silke Simon, Rolf Schubert Phospholipids as potent in-vitro P-gp inhibitors Jahrestagung der Deutschen Pharmazeutischen Gesellschaft (DPhG), Braunschweig, Oktober 2010 Silke Simon, Rolf Schubert P-glycoprotein inhibition by phospholipids: Compound screening and putative mechanism of action 2 nd Symposium on Phospholipids in Pharmaceutical Research, Heidelberg, September 2011 Silke Simon, Rolf Schubert Specific Phospholipids enhance in-vitro Absorption of P-Glycoprotein Substrates Joint Meeting of the Austrian and German Pharmaceutical Societies. Innsbruck (Österreich), September 2011
11
12
13 Inhaltsverzeichnis I Inhaltsverzeichnis 1 Einleitung Perorale Arzneimittelapplikation Morphologie des menschlichen Dünndarms Intestinale Resorptionsmechanismen P-Glykoprotein Struktur Transportmechanismus Substrate Transporterinhibition Versuchssysteme in der Transporterforschung Zelluläre Studien Zelllinien Humane Colon-Adenokarzinomepithel-Zelllinie Caco Nierenepithel-Zelllinie madin darby canine kidney (MDCK) Typ II aus dem Hund Sonstige Transportstudien Akkumulations Assays Radioligand-Bindungsstudien UIC2- Shift Assay Nicht-zelluläre Studien P-gp-ATPase Aktivitätsstudien Molecular Modelling und Dockingstudien Elektronenspin-Resonanz-Spektroskopie (ESR) In vivo Studien Phospholipide Einteilung und Vorkommen Intestinale Verdauung und Resorption Aggregationsverhalten Therapeutische Anwendungen für Phospholipidzubereitungen Zielsetzungen der Arbeit Material und Geräte Chemikalien Verbrauchsmaterialien... 40
14 II Inhaltsverzeichnis 2.3 Geräte Zellmedien, Puffer und sonstige Lösungen Zellkulturmedien Standardpuffer Lösungen für den Western Blot Methoden Herstellung von Phospholipidzubereitungen Erzeugung von MLV (multilamellar large vesicles) mittels Filmmethode Extrusion Ultraschall Charakterisierung von Phospholipidzubereitungen Bestimmung der Phospholipid-Gesamtkonzentration Photonenkorrelationsspektroskopie (photon correlation spectroscopy, PCS) Kryo-Transmissions-Elektronenmikroskopie (Kryo-TEM) Bestimmung der Gallensalz-bedingten Vesikelsolubilisierung anhand von Streulichtmessungen Herstellung von Lösungen sonstiger Lipidderivate Formulierung von freien Fettsäuren (free fatty acids, FFA) Formulierung von Lyso-PC-Derivaten Zellkultivierung Humane Colonkarzinomepithel (Caco-2)-Zellkultur Madin darby canine kidney (MDCK) II-Zellkultur MDCKII mdr MDCKII Wildtyp Einfrierprozess zur Langzeitlagerung in flüssigem N Auftauprozess nach der Langzeitlagerung in flüssigem N P-Glykoproteinnachweis per Western Blot-Analytik Probengewinnung und -aufbereitung Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) Blotting, Blocking und Detektion Zellviabilität Bi-direktionale Transportstudien mit P-gp-Substraten Methodenoptimierung mittels Diffusionsversuchen im Transwell-System Beimischung von Humanplasma (HP) oder fötalem Kälberserum (FCS) Prä-Inkubation der Inserte mit FCS... 64
15 Inhaltsverzeichnis III Beschichtung der Filterinserte mit Humanplasmaprotein Zellkultivierung Transportversuche mit Digoxin Transportversuche mit Ritonavir Quantifizierung des Stofftransports Integritätsprüfung des Zellmonolayers anhand des transepithelialen elektrischen Widerstands (transepithelial electrical resistance, TEER) Calcein Akkumulations Assay (CAA) BODIPY FL Prazosin Akkumulations Assay Nicht-zelluläre Studien P-gp-ATPase Aktivitätsmessungen In silico Dockingstudien In vivo Studien mit männlichen Wistar Ratten Tiere Pharmakokinetische Ritonavir-Studien Probenanalytik und -auswertung Statistische Analyse Ergebnisse und Diskussion Methodenoptimierung von P-gp-Transportstudien im Transwell-System Diffusionsversuche mit Ciclosporin A (CsA) Variation des Filterinsertmaterials Einsatz von fötalem Kälberserum (FCS) oder Humanplasma im Transportmedium Prä-Inkubation der Filterinserte mit FCS Beschichtung der Filterinserte mit Humanplasmaprotein Diffusionsversuche mit Digoxin Entscheidung für Digoxin als Standard-P-gp-Substrat in Transportstudien Verifizierung der P-gp-Expression per Western Blot In vitro Phospholipidscreening auf P-gp-inhibitorische Eigenschaften Auswahl und Charakterisierung von Phospholipidzubereitungen Beurteilung der Rehydratisierbarkeit und visuelle Prüfung Partikelgrößenbestimmung per Photonenkorrelationsspektroskopie (PCS) Visualisierung ausgewählter PL-Formulierungen mittels Kryo- Transmissisionselektronenmikroskopie Zytotoxizität Zusammenfassung und Diskussion: Auswahl der PL-Derivate für das in vitro Screening. 94
16 IV Inhaltsverzeichnis Digoxintransportstudien in Caco-2-Zellen in HBSS ph 6, Kommerzielle PL-Mischungen aus der pharmazeutischen und Lebensmittelindustrie Gesättigte, symmetrische Phosphatidylcholin (PC)-Derivate Ungesättigte, (a)symmetrische Phosphatidylcholin (PC)-Derivate Gesättigte, symmetrische Phosphatidylethanolamin (PE)-Derivate Gesättigte, symmetrische Phosphatidylserin (PS)-Derivate Gesättigte, symmetrische Phosphatidylglycerin (PG)-Derivate Zusammenfassung und Diskussion: Auswahl potentiell wirksamer Substanzen für weiterführende Studien Calcein Akkumulations Assay in Caco-2- und MDCKII mdr1-zellen Verifizierung der P-gp Inhibition durch Vergleichsstudien in MDCKII mdr1- vs. MDCKII Wildtyp (WT)-Zellen Digoxintransportstudien mit simultaner Online-Messung des transepithelialen elektrischen Widerstandes (TEER) CAA-Studien Zusammenfassung und Diskussion des PL-Screening In vitro Einfluss von Komponenten des Darmmilieus auf ausgewählte Phospholipidzubereitungen Verwendung von modifiziertem fasted state simulated intestinal fluid (Fassif) ph 6,5 + Phospholipase A2 als Versuchsmedium Digoxintransportstudien und CAA in Caco-2-Zellen Visualisierung ausgewählter PL-Formulierungen mittels Kryo-TEM P-gp-inhibitorische Potenz von Phospholipase A2-induzierten Lipidspaltprodukten Freie Fettsäuren (FFA) Lyso-Phosphatidylcholine (LPC) Verwendung von modifiziertem fasted state simulated intestinal fluid (Fassif) ph 6,5 als Versuchsmedium (w/o Phospholipase A2) Digoxintransportstudien in Caco-2- und MDCKII mdr1-zellen CAA-Studien in MDCKII mdr1- vs. WT-Zellen Interpretation des Einflusses von mod. Fassif ph 6,5 w/o als Transportmedium Testung der Gallensalzmischung Natrium-Glykocholat + Natrium- Glykochenodesoxycholat (1:1, mol/mol) auf P-gp-Inhibition Digoxintransportstudien in Caco-2- und MDCKII-Zellen CAA-Studien in MDCKII mdr1- vs. WT-Zellen Interpretation des Gallensalz-Effektes in P-gp-Assays Gallensalz-bedingte Solubilisierung ausgewählter PL-Zubereitungen Bestimmung der konzentrationsabhängigen Solubilisierung mittels Streulichtmessungen139
17 Inhaltsverzeichnis V Interpretation Bedeutung der Lipidaggregatbildung für die P-gp-Inhibition in vitro Einfluss der Herstellungsmethode: Ultraschall vs. Extrusion Einfluss des Lipidaggregation unter Berücksichtigung der kritischen Mizellbildungskonzentration (CMC) Interpretation der Ergebnisse Mechanistische Aufklärung der Phospholipid-induzierten P-gp-Inhibition P-gp-ATPase Aktivitätsmessungen Molecular Modeling: Bestimmung einer in silico Bindungsaffinität zum P-gp- Transporter in Dockingstudien In silico Affinität etablierter P-gp-Inhibitoren In silico Affinität ausgewählter Phospholipide identifiziert im in vitro P-gp-Screening Diskussion und Interpretation der Ergebnisse In silico Screening weiterer Phospholipidklassen auf potentielle P-gp- Inhibitoren Dockingstudien mit Phosphatidsäure (PA)- und Phosphatidylinositol (PI)- Derivaten Charakterisierung der ausgewählten PA- und PI-Formulierungen mittels PCS, Kryo- TEM und ihres Einflusses auf die Zellviabilität Überprüfung der P-gp-inhibitorischen Eigenschaften in Caco-2-Transportstudien Verifizierung des PI 8:0-Na-Effekts in CAA-MDCKII-Vergleichsstudien Interpretation der Ergebnisse Einfluss ausgewählter Phospholipide auf den HIV-Proteasehemmstoff Ritonavir Transportstudien in Caco-2-Zellen In vivo Studien mit 8:0 PC in männlichen Wistar Ratten Phospholipid-bedingte Inhibition weiterer ABC-Transporter am Beispiel des BCRP Zusammenfassung und Ausblick Phospholipidscreening auf in vitro P-gp-inhibitorische Eigenschaften In vitro Einfluss der physiologischen Bedingungen im Gastrointestinaltrakt Aufklärung des Phospholipid-bedingten P-gp-Hemmmechanismus Möglichkeiten für weiterführende Studien im Bereich der Formulierungsentwicklung und einer Ausweitung des Transporterspektrums
18 VI Inhaltsverzeichnis 6 Literaturverzeichnis Wissenschaftlicher Werdegang
19 Abkürzungsverzeichnis ABC abs act., Akt. ap, AP AUC BCRP bl, BL c CAA Caco-2 CMC c p CsA Da (kda) EPC e.z. FDA GC GCDC GS h HBSS Hz i.z. K ATP-binding cassette (ATP-bindende Region) absorptive (absorptiv, resorptiv) activity, Aktivität apikal Area under the curve (Fläche unter der Kurve) breast cancer resistance protein basolateral molare Stoffmengenkonzentration (mol pro Liter) Calcein Akkumulations Assay humane Colon-Karzinomzelllinie critical micellar concentration (kritische Mizellbildungskonzentration) plasma concentration (Plasmaspiegel) Ciclosporin A Dalton (Kilodalton) Ei-Phosphatidylcholin extrazellulär Federal Drug Agency (US-amerikanische Arzneimittelzulassungsbehörde) Glykocholat Glykochenodesoxycholat Gallensalz Stunde hank s balanced salt solution Hertz intrazellulär Kelvin
20 Kryo-TEM KW L LUV m MDCK Kryo-Transmissionselektronenmikroskopie Kohlenwasserstoff Liter large unilamellar vesicles (große, unilamellare Vesikel) Masse madin darby canine kidney cell line (nach Madin und Darby benannte Nierenepithelzelllinie aus dem Hund) mdr, MDR mg min ml MLV mm multi drug resistance (multiple Wirkstoffresistenz) Milligramm Minute Milliliter multilamellar large vesicles (multilamellare, große Vesikel) millimolar (10-3 Mol pro Liter) µm mikromolar (10-6 Mol pro Liter) MVV mod. Fassif multivesicular vesicles (multivesikuläre Vesikel) modifizierter fasted state simulated intestinal fluid (simulierter Darmsaft bei Nahrungskarenz) MW molecular weight (Molmasse) n, mol Stoffmenge NBD nm nm OLV P PA P app PBS PC nucleotide binding domain (Nukleotidbindungsstelle) Nanometer nanomolar (10-9 Mol pro Liter) oligolamellar large vesicles (oligolamellare, große Vesikel) Wahrscheinlichkeit phosphatidic acid (Phosphatidsäure) apparent permeability coefficient (scheinbarer Permeationskoeffizient) phosphate buffered saline (Phosphatpuffer mit NaCl) Phosphatidylcholin
21 PCS PDI PE PG P-gp PI PIP 1 PL photon correlation spectroscopy (Photonenkorrelationsspektroskopie) polydispersity index (Polydispersitätsindex) Phosphatidylethanolamin Phosphatidylglycerin P-Glykoprotein Phosphatidylinositol Phosphatidylinositolphosphat Phospholipid(e) PL A 2 Phospholipase A 2 PS PTT Phosphatidylserin phase transition temperature (Phasenübergangstemperatur) rf relative Feuchte (%) RF RFU RI rpm RT SD sec sec SUV t TEER relative Fluoreszenz relative fluorescence units (relative Fluoreszenzeinheiten) relative Inhibition revolutions per minute (Umdrehungen pro Minute) Raumtemperatur (20 bis 25 C) Standardabweichung secretory (sekretorisch) Sekunde small unilamellar vesicles (kleine, unilamellare Vesikel) Zeit, Zeitpunkt transepithelial electrical resistance (transepithelialer elektrischer Widerstand) v, Vol. Volumen V W WT Volt Watt Wildtyp
22
23 1 - Einleitung 1 1 Einleitung 1.1 Perorale Arzneimittelapplikation Die perorale Medikamenteneinnahme stellt die am weitesten verbreitete Art der Arzneimittelapplikation dar, da sie vom Patienten meist schnell, unkompliziert und ohne fremde Hilfe durchgeführt werden kann. Die Hauptresorption des Wirkstoffs in den systemischen Kreislauf erfolgt nach der Magenpassage über die Dünndarmmukosa, bedingt durch ihre extrem große Oberfläche Morphologie des menschlichen Dünndarms Die gesamte Intestinalmukosa (Tunica mucosa) besteht aus: Lamina muscularis: glatte Muskelzellschicht Lamina propria: lockeres Bindegewebe mit Lymph- und Blutgefäßen, Abwehrzellen Lamina epithelialis: dem Darmlumen zugewandte Epithelzellschicht Mucuslayer: Schleimschicht zum Zellschutz, Trägermedium Der Dünndarm unterteilt sich in Duodenum, Jejunum und Ileum, dessen Oberfläche als glatter Hohlzylinder lediglich 0,33 m² betragen würde. Auf Grund von besonderen morphologischen Eigenheiten vergrößert sich diese Fläche aber in der Realität auf ca. 200 m² (Langner et al. 2011). Das Jejunum besitzt zur Oberflächenvergrößerung tiefe Schleimhauteinstülpungen (Kerckring- Falten) bis in die Lamina propria. Duodenum und Jejunum weisen zudem schmale, 0,5 bis 1,5 mm lange Darmzotten (Villi) auf, deren apikales, der Darminnenseite zugewandte Epithel aus mehreren Zelltypen besteht: Ca. 90 % machen die Enterozyten (Saumzellen) aus, die generell für die Absorption von Stoffen (Wasser, Nahrungsbestandteile, Gallensäuren, Arzneistoffe) aus dem Darmlumen zuständig sind. Hierfür tragen sie einen Bürstensaum von sog. Microvilli auf ihrer apikalen Membran, die die Zelloberfläche um das 25-fache vergrößern und zudem als Schutz vor einer Selbstverdauung von eine Glykokalix umgeben sind (Dehghani & Korf 2007).
24 2 1 - Einleitung Abbildung 1-1: Aufbau des menschlichen Jejunums ( ) Zwischen den Enterozyten befinden sich die Mucus-produzierenden Schleimzellen (Abb. 1-2). In den Einbuchtungen (Krypten) der Villi liegen die Paneth-Körnerzellen, die antimikrobielle Peptidasen und Lysozyme, sog. Defensine, ans Darmlumen abgeben. So leisten sie, zusammen mit den M-Zellen, einen erheblichen Beitrag zur intestinalen Immunabwehr. Eine zelluläre Dysfunktion wird mit der Pathogenese von Enterokolitis, Morbus Crohn und zystischer Fibrose in Zusammenhang gebracht (Bevins 2004). In der Tela submucosa unter der Schleimhaut befinden sich zudem diverse Drüsen, z.b. die duodenalen Brunner-Drüsen (Glandulae duodenales), die bis zum Darmlumen durchbrechen und unterschiedliche Verdauungsenzyme sezernieren. mucushaltige Becherzelle Enterozyt (dunkler Zellkern) mit endständigem Bürstensaum Lamina propria (Bindegewebsschicht) Abbildung 1-2: Elektronenmikroskopische Aufnahme des Zylinderepithels des menschlichen Jejunums im Querschnitt (Masson-Goldner-Färbung) ( )
25 1 - Einleitung 3 Zwischen den Epithelzellen bilden komplexe Proteinstrukturen die sog. tight junctions (TJ), die der Abdichtung der Schleimhaut und dem selektiven Stoffdurchlass, der sog. Epithelintegrität, dienen. Sie bestehen aus Transmembranproteinen der Claudin-Familie, dem Occludin, Tricellulin und den junctional adhesion molecules (JAM). Diese Proteine werden wiederum durch sog. Plaque-Proteine innerviert und so dynamisch in ihrer Struktur und Barrierewirkung verändert (Ulluwishewa et al. 2011). Gerade die Zona occludens (ZO)-Proteinfamilie spielt eine wichtige Rolle in der TJ- Regulation, da sie mit dem Zyoskelett der Epithelzelle interagiert Intestinale Resorptionsmechanismen Transportprozesse über Resorptionsbarrieren können allgemein passiv, aktiv oder als aktiv-passiver Cotransport ablaufen. Passive Vorgänge benötigen keine Energie und beruhen entweder auf reiner Diffusion entlang eines elektrochemischen oder konzentrationsbedingten Gradienten. Aber auch der Einbezug von bestimmten Kanälen oder Carriern ist möglich. Aktive Prozesse ohne oder gegen solch einen Gradienten benötigen ATP-Hydrolyse, entweder durch das transportierende Protein selbst oder durch eine Pumpe, die ein Konzentrations- oder Ladungsgefälle herstellt. Induziert z.b. eine Natrium-Kalium-ATPase ein elektrochemisches Membrangefälle, so kann anschließend das Natrium-Ion durch Nutzung seiner potentiellen Energie ein anderes Molekül gegen dessen Konzentrationsgefälle durch eine Membran transportieren. Dieses Phänomen tritt beim intestinalen Natrium-Glukose-Symport auf (Koggel 2003). Die unterschiedlichen Resorptionswege von molekular gelösten Stoffen durch das Intestinalepithel sind in Abb. 1-3 zusammengefasst: Abbildung 1-3: Übersicht von Resorptionswegen durch das Darmepithel ( )
26 4 1 - Einleitung parazellulär, durch den Interzellularraum zwischen den Zellen hindurch. Dieser passive Vorgang findet durch bestimmte Membrankanäle, sog. gap junctions statt, die unselektiv Aminosäuren, Proteinen und Kohlenhydraten unterschiedlicher Größe Raum geben. Eine erhöhte parazelluläre Permeabilität tritt zudem bei verminderter Integrität des Zelllayers auf, etwa bei geschädigten tight junctions. Eine besondere Form stellt die Persorption (partikuläre Absorption) dar, die durch Fehlstellen im Epithelverband bedingt wird. Diese Lücken entstehen durch Zellabstoßung an den Spitzen der Darmzotten (Langner et al. 2011). transzellulär, durch die Zellmembranen und das Zellinnere hindurch. Diese Variante kann weiter unterteilt werden in (nachzulesen in Langner Biopharmazie (Langner et al. 2011) und (Koggel 2003)): o passive Diffusion. Dieser Prozess wird von den Moleküleigenschaften pks-wert, Membranverteilungskoeffizienten (K) und Größe bzw. Molmasse gesteuert: So passieren lipophile, im Darmmilieu ungeladene Stoffe passiv die Lipiddoppelschichten der Zellmembran. Der Transport von Wasser, Ionen und kleinen polaren Molekülen kann durch dynamisch auftretende wassergefüllte Poren (Aquaporine) oder Ionenkanäle in einem Konzentrations- oder Ladungsgefälle erfolgen. o Transzytose (Zytopempsis). Dieser Vorgang beginnt mit der Endozytose, bei der die Zelle mit einem apikalen Membranabschnitt Tröpfchen oder Partikelteilchen umschließt und diese Membranvesikel ins Zellinnere abschnürt. Die am besten erforschte Variante stellt die Clathrin-vermittelte Endozytose dar, bei der die Membraninteraktion an speziellen Membranbereichen, den Clathrin-coated pits, stattfindet. Allerdings werden auf diesem Wege aufgenommene Stoffe anschließend in den Lysosomen hydrolytisch verdaut. Manche Membranabschnitte weisen vorrübergehend einen vermehrten Anteil an Glykosphingolipiden, Cholesterol und Glykosylphosphatidylinositol-verankerten Proteinen auf, was ihre Fluidität so stark einschränkt, dass sie als lipid rafts bezeichnet werden. Beinhalten sie zudem das Protein Caveolin, entstehen sog. Caveolae, breite Einstülpungen in der Plasmamembran, durch die ebenfalls Endozytose erfolgen kann. Entscheidend ist, dass auf diese Weise internalisiertes Material nicht intrazellulär degradiert wird, sondern Fusionen mit Golgi-Vesikeln oder dem Endoplasmatischen Retikulum eingeht. Auch ein Transport zur basolateralen Membran und ein anschließender
27 1 - Einleitung 5 Austritt aus der Epithelzelle sind möglich. Im Darmepithel erfolgt so die Absorption von Fetten (Monoglyceriden), fettlöslichen Vitaminen, Cholesterol und bestimmten Peptiden. Häufig findet am Anfang eine Interaktion mit einem membranständigen Rezeptor statt. Daneben existieren noch nicht-clathrin-nicht-caveolae-vermittelte Aufnahmewege, sowie die Makropinozytose für große Flüssigkeitsmengen. Die Phagozytose großer Partikel (Mikroorganismen, tote Zellen) tritt nur bei bestimmten Zelltypen, wie den Leukozyten auf und endet, wie auch die vorherig genannten Varianten, im Lysosom (Huth 2005, Schneider & Suess 2010). o Carrier-vermittelt. Mit Hilfe eines membranständigen Transportproteins kann die passive Permeation von Monosacchariden oder des Komplexes aus Vitamin B12 + intrinsic factor durch die Enterozyten extrem beschleunigt werden, so dass auch von erleichterter Diffusion gesprochen wird. Als Sonderfall kann hier der mögliche Mechanismus des Ionenpaartransports eingeordnet werden, bei dem diverse hydrophile Arzneistoffe (quartäre Ammoniumbasen, Sulfonsäuren) mit physiologischen lipophilen Gegenionen (Fett- und Gallensäuren) neutrale Ionenpaare bilden. Nach Interaktionen des Gegenions mit der Zellmembran könnte es als Carrier für den Wirkstoff fungieren (Neubert 1989, Neubert & Furst 1989). o aktiver Transport. Unter ATP-abhängiger Energiegewinnung werden Ionen (Na + /K + -ATPase) oder Wirkstoffe in die Zelle (Influx) und partiell auch aus der Zelle heraus (Efflux) gepumpt. Somit spielen diese Transporter eine entscheidende Rolle in Fragen der systemischen Resorption von Arzneistoffen, peroralem Therapieerfolg und Arzneimittelinteraktionen. Von großer Relevanz sind hier Vertreter der solute-linked-carrier-(slc)-gruppe und die ATP-binding-cassette- (ABC)-Familie. Die SLC-Gruppe umfasst derzeitig 51 Familien ( wobei laufend neue Gruppenmitglieder identifiziert werden. Unter diese Gruppierung fallen jedoch auch passive Transporter, Ionen-gekoppelte Pumpen und Antiporter (Hediger et al. 2004). Betrachtet man lediglich die für den aktiven Influx (Uptake) zuständigen Transporter, so stellen die wichtigsten Familien die organic anion transporting polypeptides (OATPs), die peptide transporters (PEPTs), die organic cation transporters (OCTs), die apical sodium/bile acid co-transporters (ASBTs), die organic anion transporters (OATs) und die
28 6 1 - Einleitung monocarboxylic acid transporters (MCTs) dar (Giacomini et al. 2010). Allgemein durchziehen bei diesen SLC-Vertretern mehrere Proteinhelices einen Membranabschnitt, in dem auch die Substratbindung erfolgt. Sie tragen intrazellulär lediglich Phosphorylierungsdomänen, aber keine Nukleotidbindungsstellen, so dass die ATP-Hydrolyse andernorts stattfinden muss (Langner et al. 2011). Die ABC-Superfamilie gliedert sich in multi drug resistance Transporter (MDRs), multi drug resistance proteins (MRPs) und mitoxantron resistance proteins (MXRs) und umfasst lediglich Effluxpumpen, die Substrate aus der Zelle hinaus ins Darmlumen oder ins basolaterale Kompartiment befördern. Die drei genannten Gruppen weisen starke Unterschiede auf in der Länge ihrer Transmembranregion und der Struktur und Platzierung ihrer Glykosilierungs- und ATP-Bindungsstellen. Man unterscheidet insgesamt sieben Subfamilien (ABCA ABCG) (Langner et al. 2011). Abbildung 1-4 veranschaulicht die Verteilung von Transportproteinen im Darmepithel. In Tabelle 1-1 werden diese Proteine hinsichtlich ihrer Familie, Substrate und Inhibitoren charakterisiert. Abbildung 1-4: Intestinale Transporter in der apikalen, dem Darmlumen zugewandten (Intestine) und der basolateralen, den Blutgefäßen (Blood) zugewandten Membran des Enterozyten (Giacomini et al. 2010) OCT: organic cation transporters; OST -OST heterodimerer organic solute transporter; MRP: multi drug resistance proteins; OATP: organic anion transporting polypeptides; PEPT: peptide transporters; ASBT: apical sodium/bile acid co-transporters; MCT: monocarboxyilc acid transporters; BCRP: breast cancer resistance protein; P-gp: P-Glykoprotein
29 1 - Einleitung 7 Tabelle 1-1: Relevante Intestinale SLC- und ABC-Transporter, ausgewählte Substrate und Inhibitoren (Galman et al. 2003, Fang et al. 2006, Langner et al. 2011)( ) Transporter Nomenklatur Substrate Inhibitoren OATPs SLC01/2 Statine, Sartane, Gallensäuren Ritonavir, Ciclosporin A, Rifampicin PEPT1 SLC15A1 ACE-Hemmer, ß-Lactam- Antibiotika Glycyl-Proline ASBT SLC10A2 Natrium-/ Gallensäure- Cotransport PR835 MCT1 SLC16A1 Benzoesäure, Milchsäure, kurzkettige Fettsäuren alpha-cyano-4- OH-Cinnamat OCT1 SLC22A1 Metformin, Dopamin, Histamin, Desipramin Chinidin, Spironolacton, Verapamil P-Glykoprotein (P-gp, MDR1) ABCB1 amphiphile und lipophile Substanzen (Digoxin, Loperamid, Doxorubicin, etc.) Verapamil, Ciclosporine, Chinidin breast cancer resistance protein (BCRP, MXR) ABCG2 amphiphile und lipophile Substanzen (Mitoxantron, Prazosin, Statine) Fumitremorgin C, Ko143 MRP2, cmoat ABCC2 organische Anionen, Glucuronide Ciclosporine, Efavirenz MRP3, cmoat2 ABCC3 Glucuronide, Gallensäuren, Methotrexat Delaviridin, Efavirenz OCT: organic cation transporters; MRP: multi drug resistance proteins; OATP: organic anion transporting polypeptides; PEPT: peptide transporters; ASBT: apical sodium/bile acid co-transporters; MCT: monocarboxyilc acid transporters Nomenklatur (SLC-Transporter): Gruppe-Familie-Abstandshalter(A)-Transporter, z.b. SLC15A1 Nomenklatur (ABC-Transporter): Superfamilie-Familie-Transporter, z.b. ABCB1
30 8 1 - Einleitung 1.2 P-Glykoprotein Der ABC-Transporter P-Glykoprotein (P-gp) wird in der apikalen Enterozytenmembran exprimiert, befindet sich aber auch in den Gehirnendothelzellen der Blut-Hirn-Schranke und in den apikalen Membranen exkretorischer Zellen wie den Hepatozyten und in den Epithelien des proximalen Tubulus und der Bronchien (Florea et al. 2001, Loscher & Potschka 2005). Auch Tumorzellen können P-gp in ihrer Membran tragen (Dassow et al. 1998). Allgemein bewirkt P-gp den Auswärtstransport unterschiedlichster Substrate aus der Zelle zurück ins apikale Kompartiment, was allgemein einen körpereigenen Schutz vor Xenobiotika darstellt (Zhou 2008) Struktur Das 170 kda große Protein besteht aus zwei homologen Bereichen, die jeweils sechs Transmembranhelices und eine intrazelluläre (i.z.) Nukleotidbindungsstelle (NBD) beinhalten und über eine Linker-Region miteinander verbunden sind (Abb. 1-5). Der Linker wird durch das Enzym Proteinkinase C an mehreren Stelle phosphoryliert und weist daher eine starke Ladung auf (Zhou 2008). N- und C-terminales Ende befinden sich ebenfalls im Intrazellularraum. An der ersten extrazellulären (e.z.) Schleife findet N-Glykosilierung statt. Jede NBD besteht aus drei sog. Motiven, die in der ABC-Familie stark konserviert vorliegen: Walker A und Walker B, die auch in anderen ATPasen zu finden sind, verknüpft durch das C-Motiv, der familienspezifischen Signatur (Sharom 2006). Die genaue Lokalisation der Substratbindungsstelle(n) wird bereits seit mehreren Jahrzehnten beforscht und konnte noch nicht allumfassend geklärt werden: So wird zum einen die Annahme einer einzigen, flexiblen großen Bindungstasche diskutiert, in die sich ein Substratmolekül einlagern kann (Sharom 2006). Vorrangig wird in der Literatur aber von mehreren Substratbindungsstellen im Transmembranbereich ausgegangen, die in der Summe eine voluminöse Substrathöhle ausbilden (Aller et al. 2009). So konnten Mutagenese-Studien zeigen, dass Substrate vermehrt innerhalb der Transmembranhelices 4-6 der N-terminalen Hälfte und 9-12 der C- terminalen Hälfte gebunden werden (Loo & Clarke 2005) (Abb. 1-6). Daneben besitzt P-gp aber auch noch mehrere modulierende Bindungsstellen, über welche eine allosterische Kontrolle der Proteinaktivität erfolgen kann, wobei hier eine Modulation durch körperfremde Stoffe im Vordergrund steht (Maki et al. 2003).
31 1 - Einleitung 9 Abbildung 1-5: 2-D Modell des humanen P-gp unter Markierung der funktionellen Einheiten (Ambudkar et al. 2003) Blaue Kreise markieren Mutationen, die Substratspezifitäten modulieren. Die ATP-Bindungsstellen (ATP Site) und Walker A, B und die C-Region sind angegeben, genauso wie Glykosilierungen an der ersten e.z. Schlaufe und Phosphorylierung in der Linker-Region (P). Die grünen Balken liegen über den Transmembranbereichen, wo Substratbindung verifziert werden konnte. Abbildung 1-6: Struktur von P-gp in der Frontansicht (A) und von hinten (B )(Aller et al. 2009) Transmembranhelices (TM) sind von 1 bis 12 durchnummeriert; NBD, C-und N-terminales Ende sind markiert; die Zellmembran ist mit waagrechten Linien angedeutet;
32 Einleitung Transportmechanismus Der erste Schritt für den Substratefflux besteht in der passiven Diffusion des Moleküls in die das Protein umgebende Lipiddoppelschicht der Zellmembran (Gatlik-Landwojtowicz et al. 2006). Von der inneren Lipidschicht dieses Bilayers gelangt das Substrat durch ein Portal geformt aus den Transmembranhelices 4 und 6 oder 10 und 12 - in den lipophilen Innenraum des Transporters und bindet dort an vorrangig hydrophobe und aromatische Seitenketten (Aller et al. 2009). Gleichzeitig erfolgt die Bindung von je einem ATP-Molekül an die beiden NBDs, was eine Dimerisierung dieser Domänen und eine komplette Konformationsänderung induziert (Abb. 1-7): Der gesamte Transporter dreht sich in der Membran 90 um die Längsachse, bildet eine Öffnung zum Extrazellularraum und die Substratbindungsaffinität reduziert sich so stark, dass das Substrat sich vom Protein ablöst (Zhou 2008). Die anschließende Nukleotidhydrolyse zu ADP und Pi durch die ATPase-Funktion der NBDs führt zu einer Dissoziation des NBD-Dimers und somit zu einem Resetting der Transporterausrichtung in den i.z. geöffneten Ausgangszustand (Sauna & Ambudkar 2000). Eine andere Möglichkeit wäre, dass die ATP-Spaltung selbst die Konformationsändeurng und die Substratfreigabe hervorruft (Aller et al. 2009). Abbildung 1-7: Modell des Substratefflux durch P-gp (Aller et al. 2009) A: Das Substrat (dunkelgrau) diffundiert in die Membran, von dort in den P-gp-Innenraum und bindet innerhalb der Substratbindungsregion (mittelgrau). ATP wird zweifach im Intrazellularraum an die NBDs gebunden, diese dimerisieren, was wiederum eine umfassende Konformationsänderung des gesamten Proteins induziert. B: Nach 90 -Drehung um die Längsachse und Öffnung des Proteins zum Extrazellularraum hin, besitzen die Substratbindungsstellen keine Substrataffinität mehr, so dass das Substrat den Proteininnenraum verlässt. Neben der Effluxaktivität übernimmt P-gp auch die Aufgabe einer Lipid-Flippase, d.h. es transportiert Membranphospholipide unidirektional von der inneren in die äußere Schicht der Lipidmembran (Bosch et al. 1997). Die Lipidbindung erfolgt simultan mit einem P-gp-Substrat, da
33 1 - Einleitung 11 beide Komponenten auf dem selben Weg aus der Lipidinnenschicht in die Bindungshöhle eintreten und scheint für einen effektiven Transportvorgang absolut notwendig zu sein (Aller et al. 2009) Substrate P-gp kann mit einer Vielzahl strukturell vollständig unterschiedlicher Moleküle interagieren: Kleine Moleküle wie organische Kationen, Aminosäuren, Antibiotika, selbst polare Kohlenhydrate sind genauso betroffen, wie voluminöse Polysaccharide und Proteine (Zhou 2008). Bezüglich einer favorisierten Zielstruktur bestand einst die Annahme, dass bevorzugt hydrophobe, planare aromatische Moleküle mit tertiärem Amin mit dem Transporter wechselwirkten (Seelig & Landwojtowicz 2000). Später entwickelte sich ein Modellsubstrat, das eine Struktur mit mehreren Elektronendonatoren oder hydrophoben Einheiten mit festem räumlichen Abstand zueinander aufweisen sollte (Cianchetta et al. 2005). Lipophilie oder Amphiphilie scheint generell von Vorteil zu sein, da so eine effektive Verteilung in den Zellmembranbilayer möglich ist, die als geschwindigkeitsbestimmender Schritt angesehen wird (Seelig & Landwojtowicz 2000, Aller et al. 2009). P-gp-Substrate sind in einer Vielzahl von Arzneimittelgruppen zu finden (Tab. 1-2). Man geht mittlerweile davon aus, dass ca. 50 % aller vermarkteten Wirkstoffe entweder von P-gp transportiert werden oder dessen Aktivität beeinflussen (Zolnerciks et al. 2011): Tabelle 1-2: Übersicht der wichtigsten Arzneistoff- und Substanzklassen mit P-gp-Substraten (Seelig 1998, Koggel 2003) Antiarrhythmika Antibiotika Antihistaminika Antihpertensiva Antipsychotika Betablocker Calciumkanalblocker Detergentien Fungizide Herzglykoside HIV-Proteaseinhibitoren HMG-CoA-Reduktasehemmer Immunsuppressiva Morphinderivate Phospholipide Protonenpumpenhemmer Steroidhormone Zytostatika
34 Einleitung Transporterinhibition Ein P-gp-bedingter Substanzefflux stellt in der medikamentösen Therapie große Hindernisse dar: So können betroffene Krebstherapeutika (Doxorubicin, Paclitaxel) bei P-gp-exprimierenden Tumorzellen nur beschränkt wirken. Die Überexpression dieses Transporters stellt in vielen Krebszellen eine typische Therapieresistenz dar (Arora et al. 2005). Substrate, die die Blut-Hirn- Schranke überwinden müssen, gelangen nur limitiert ans Ziel (Loscher & Potschka 2005) und ein interagierender Wirkstoff, der peroral appliziert wird, kann vom Dünndarmepithel nur vermindert systemisch resorbiert werden (Suzuki & Sugiyama 2000). Letzteres hat zur Folge, dass die Menge an real resorbierter Substanz generell schwer vorhersagbar ist. Oft sind für einen therapeutisch wirksamen Plasmaspiegel sehr hohe Wirkstoffdosen notwendig, was Therapiekosten und das Risiko für lokale Nebenwirkungen drastisch erhöht und somit die Patientencompliance stark in Mitleidenschaft ziehen kann (Gatti et al. 1999). Die Problematik der verminderten oralen Bioverfügbarkeit hat dazu geführt, dass schon seit mehreren Jahrzehnten an einer effektiven Inhibition des intestinalen P-gp-Transporters geforscht wird, um die Pharmakodynamik von peroral verabreichten P-gp-Substraten zu verbessern (Seelig & Gerebtzoff 2006, Palmeira et al. 2012). Generell kann eine Inhibition durch mehrere Mechanismen erfolgen, die in direkte und indirekte Inhibition unterteilt werden können. Unter die direkte Hemmung fallen: Molekülbindung an Substratbindungsstellen ohne den katalytischen Transportkreislauf zu unterbinden (kompetitive Inhibition) (Maki et al. 2003). Dieser Mechanismus setzt eine hohe Affinität zum entsprechenden Proteinbereich voraus und ist allgemein am häufigsten anzutreffen. Er wird u.a. von Verapamil, Chinidin, Vitamin E TPGS (α-tocopherylpolyethylenglycolsuccinat), Ciclosporin A, seinem Analogon PSC-833 und dem hoch-selektiven Inhibitor GF ausgeübt (Collnot et al. 2006, Zhou 2008, Collnot et al. 2010). Molekülbindung an modulierende Bindungsstellen und Induktion einer konformativen Proteinänderung, die Substratbindung und/ oder transport oder gar die ATP-Hydrolyse verhindert (allosterische Hemmung), wie durch das Anthranilinsäurederivat XR9576, das Indolizinderivat SR33557, Dexniguldipin oder Prenylamin. Auch das Thioxanthen-Derivat cis-(z)-flupentixol bindet an solch eine allosterische Stelle und führt zu einer reversiblen
35 1 - Einleitung 13 Konformationsänderung, so dass gebundenes Substrat nicht mehr dissoziieren kann und sich ein stabiler P-gp-Substratkomplex bildet (Maki et al. 2003). Molekülbindung innerhalb der Substratbindungsregion im Sinne einer sterischen Blockade, die jeglichen Konformationsshift verhindert (Collnot et al. 2010). direkte Inhibition der Proteinkinase C, da dieses Enzym durch die Phosphorylierung der P-gp-Linkerregion (Abb. 1-5) die Transporteraktivität maßgeblich beeinflusst. Allerdings sind diese Zusammenhänge noch nicht vollständig aufgeklärt (Wiese & Pajeva 2001). Molekülbindung an die intrazellulären NBDs, was die für einen Substrattransport notwendige ATP-Bindung und NBD-Dimerisierung unmöglich macht. Dies konnte für das nichtionische Tensid Pluronic P85 nachgewiesen werden (Batrakova et al. 2004). Als indirekte Hemmung können gewertet werden: physiko-chemische Veränderungen in der P-gp-umgebenden Lipidmembran. Da der erste Schritt des Effluxprozesses in der Partitionierung des Substrats in den P-gp-umgebenden Bilayer besteht, spielen die Eigenschaften dieser Membranbereiche eine entscheidende Rolle für die Transporterfunktionaliät. Auch die eigentliche Substratbindung innerhalb des Proteins, die ATPase-Aktivität und der gesamte Transportmechanismus werden durch die Lipidumgebung beeinflusst. So können Membranfluidisierung oder -rigidifizierung eine Inhibition der P-gp-Aktivität bewirken (Romsicki & Sharom 1998, 1999, Ferte 2000, Lu et al. 2001). Solch ein Mechanismus wird für die im galenischen Bereich eingesetzten Tenside Tween 80 und Cremophor EL vermutet (Rege et al. 2002). intrazelluläre ATP-Verarmung, indem Veränderungen in der Fluidität oder dem elektrochemischen Potential der Mitochondrialmembran vorgenommen werden. Da MDR- Zellen durch den aktiven Effluxprozess mehr ATP verbrauchen, könnte eine i.z. Verminderung des ATP-Angebots die Resistenz dieser Zellen aufheben. Diese Prozesse können auch simultan mit einer NBD-Bindung erfolgen, wie im Falle von Pluronic P85 (Batrakova et al. 2001a, Batrakova et al. 2001b). Auch wenn über die Jahre die P-gp-Inhibitorforschung immer weiter vorangeschritten ist, so scheitern viele Hemmstoffe entweder an ihrer mangelnden in vivo Wirksamkeit, inakzeptabler Pharmakokinetik und/ oder hoher Toxizität. Dies traf sowohl auf Inhibitoren der ersten Generation (Verapamil), als auch der zweiten (PSC-833) und dritten Generation (XR9576) zu, wobei letzterer bereits eine Phase III-Studie erreicht hatte (Jekerle et al. 2007). Somit geht die Suche nach vielversprechenden Substanzen weiter.
36 Einleitung 1.3 Versuchssysteme in der Transporterforschung Die Aufdeckung sowohl von P-gp-Substrat-, als auch von P-gp-Inhibitoreigenschaften stellt in der pharmazeutischen Entwicklung eine absolute Notwendigkeit dar, um etwaige Drug-Drug- Interaktionen abschätzen zu können. Die Identifikation muss in der prä-klinischen Periode erfolgen, um bereits in der Phase I-Studie Pharmakokinetik und dynamik realistisch einschätzen zu können. Für diese Untersuchung haben sich unterschiedliche Versuchssysteme und Assays etabliert, die grob in in vitro Studien (mit oder ohne Zellen) und in vivo Studien (meist in Nagern) eingeteilt werden. Dieses Kapitel soll einen Überblick über die gängigsten Methoden verschaffen Zelluläre Studien Zelllinien In vitro Versuche werden bevorzugt in Form zellulärer Studien durchgeführt, da hier die P-gp- Aktivität in der natürlichen Proteinumgebung untersucht werden kann. Folgende Zelllinien werden üblicherweise verwendet, wobei auch andere, hier nicht aufgeführte Stämme geeignet sind bzw. durch Transfektion und Co-Kulturen stets neue Varianten entstehen: Humane Colon-Adenokarzinomepithel-Zelllinie Caco-2 Abbildung 1-8: Lichtmikroskopaufnahme einer humanen Colon-Adenokarzinom (Caco-2)-Zellkultur ( ) Die Caco-2-Zelllinie wurde bereits in den 80er Jahren als Modellsystem zur Untersuchung von intestinalen Resorptionsvorgängen etabliert (Hidalgo et al. 1989, Burton et al. 1993). Obwohl diese Zellen aus dem Colon stammen, bilden sie nach dreiwöchiger Anwachszeit auf semi-permeablen Filterinserten einen hoch-differenzierten, Enterozyten-ähnlichen Epithelmonolayer (Abb. 1-8). Die
37 1 - Einleitung 15 Zellen sind über tight junctions miteinander verbunden, was die parazelluläre Diffusion gelöster Stoffe unterbindet. Auch die typische Polarisierung der Zellschicht unter Ausbildung eines Bürstensaums auf der apikalen, dem Darmlumen zugewandten Membran und die Sekretion von metabolischen Enzymen der Phase I und II sind gegeben (Meunier et al. 1995). Gleichzeitig werden in der apikalen und der basolateralen, an das Bindegewebe angrenzenden Membran sämtliche Dünndarm-Carrier und -transporter, wie auch P-gp, exprimiert, die funktionell und biochemisch den nativen Proteinen entsprechen (Meunier et al. 1995). Dennoch gibt es Unterschiede zwischen Enterozyten und ausdifferenzierten Caco-2-Zellen: Manche Transporter und Enzyme werden in Caco-2 zahlreicher, andere wiederum weniger zahlreich ausgebildet bzw. sezerniert: So wird das metabolisch höchst-relevante CYP3A4-Enzym nur in geringen Mengen produziert (Hubatsch et al. 2007). Die tight junctions sind bei Caco-2 stärker ausgeprägt, was die Durchlässigkeit für parazellulär permeierende Stoffe im Vergleich zu in vivo reduziert. Zudem fehlen in einer Zellkultur sämtliche physiologische Einflüsse und Faktoren des Dünndarmepithels, wie die apikale Mucusschicht, die apikale Anreicherung des pankreatischen Verdauungsenzyms Phospholipase A2, eine zentral-nervöse Steuerung, die Motilität und der systemische Blutfluss (Hidalgo & Borchardt 1990, Nordskog et al. 2001, Shah et al. 2006). Um die mehrwöchige Anwachszeit bis zum verwendbaren Zelllayer zu verkürzen, können spezielle Anwachsmedien mit Differenzierungsenhancern oder speziell gecoatete Zellkulturplatten verwendet werden, die Kultivierungszeiten von nur einer Woche ermöglichen sollen (Liang et al. 2000, Alsenz & Haenel 2003). Die Abwesenheit von Mukus kann durch Co-Kulturen von Caco-2 mit dem Mukus-sekretierenden Zellklon HT-29-H oder HT-29-MTX gelöst werden (Hilgendorf et al. 2000, Hidalgo 2001). Trotzdem stellt das Caco-2-Modell weiterhin das Standard-in vitro-werkzeug zur Beurteilung der peroralen Resorptionsfähigkeit von Arzneistoffen dar und wird auch von der US-amerikanischen Zulassungsbehörde, der Federal Drug Agency (FDA) als Screeningmethode anerkannt und empfohlen (LaRoche 2006).
38 Einleitung Nierenepithel-Zelllinie madin darby canine kidney (MDCK) Typ II aus dem Hund Abbildung 1-9: Lichtmikroskopaufnahme einer MDCKII-Zellkultur sdsff7q-g ( ) Der Wildtyp (WT) dieser nach Madin und Darby benannten Zelllinie zeigt geringe metabolische Aktivität und ein geringes Transporterexpressionslevel. Transfiziert man ihn aber mit humanem MDR1-Gen, so wird in der Variante MDCKII mdr1 humanes P-gp überexprimiert. Führt man nun Vergleichsstudien in beiden Zelllinien durch, so lassen unterschiedliche Ergebnisse bei den beiden Varianten auf eine P-gp-Interaktion schließen, da die Zelllinien abgesehen von der Expression des humanen P-gp vollkommen identisch zueinander sind (Feng et al. 2008). Zudem können MDCKII- Zellen bereits nach vier Tagen Anwachszeit verwendet werden und entsprechen hinsichtlich ihrer parazellulären Durchlässigkeit dem menschlichen Jejunum (Guo et al. 2002, Tang et al. 2002) Sonstige die intestinalen Rattenzelllinien IEC-18 und 2/4/A12/4/A1. Letztere entspricht ebenfalls nach einer ca. fünftägigen Kultivierung bezüglich ihrer Integrität dem humanem Dünndarm, exprimiert P-gp, jedoch nicht alle anderen intestinalen Transporter (Tavelin et al. 2003). die humane Alveolarepithel-Zelllinie Calu-3 (Hamilton et al. 2001) die Nierenepithel-Zelllinie LLC-MDR1 aus dem Schwein (Batrakova et al. 2004) diverse, mit humanem MDR1-Gen transfizierte Zelllinien: o die Multidrug-resistente chinesische Hamsterovarien-Zelllinie CH R B30 o die humanen Lungenkarzinom-Zelllinien SW1573, GLC4, GLC4/ADR (Eijdems et al. 1995) o die Leukämiezellkulturen HL60 und HL60/ADR (Scheffer et al. 2000)
39 1 - Einleitung 17 o die murine monozytische Leukämiezelllinie, die entweder P-gp-defizient ist (P338/par) oder murines MDR1 überexprimiert (P33/mdr) (Bogman et al. 2003) o eine MDR1-überexprimierende Variante der HeLa-Zelllinie aus dem humanen Zervixkarzinom (Kugawa et al. 2009) o murine Fibroblasten NIH3T3 (ohne P-gp) und NIHMDR1 (mit MDR1-tragenden Plasmiden transfiziert), die im direkten Vergleich Aufschluss über P-gp-Effekte geben Eine P-gp-Überexpression kann auch durch Zellkultivierung in Anwesenheit von P-gp-Induktoren wie Colchicin oder Vinblastin erzielt werden (Maki et al. 2003) Transportstudien Die aussagekräftigste zelluläre Methodik Transport- und Effluxprozesse zu untersuchen, stellt eine Transportstudie dar, in der eine Zellschicht eine Resorptionsbarriere ausbildet, die von einem zu untersuchenden Substrat überwunden werden muss. Diese Methode simuliert vergleichsweise realitätsgetreu den Permeationsprozess, den eine Substanz auch in vivo durchlaufen muss. Zu diesem Zweck wird die Zelllinie, die den Transporter von Interesse exprimiert, in einem Insert auf einer semi-permeablen Membran ausgesät und zu einem konfluenten, bei Caco-2 komplett ausdifferenzierten Monolayer kultiviert. Im Versuch selbst wird das zellbewachsene Insert sowohl von oben, auf apikaler Seite, als auch im unteren Plattenteil, auf der basolateralen Seite des 2- Kammersystems, mit Medium / Transportpuffer versehen (Abb. 1-10). Die besagte Membran kann abhängig von Material und Porendurchmesser unterschiedliche Stoffdurchlässigkeit aufweisen, sollte aber definitiv einen Zelldurchtritt verhindern und den zu untersuchenden Transportmarker sowohl von apikal nach basolateral, als auch in umgekehrter Richtung passieren lassen (Shah et al. 2006). Möchte man eine Substanz auf P-gp-Interaktion testen, kann man diese im Vergleich mit und ohne einen etablierten P-gp-Inhibitor (Verapamil, Ciclosporin A, GF120918) apikal applizieren und den Stoffdurchtritt in Abhängigkeit von der Zeit quantifizieren. Wird durch Inhibitorzugabe der Flux durch den Zelllayer erheblich erhöht, weist die Substanz höchstwahrscheinlich P-gp- Substrateigenschaften auf (Rautio et al. 2006).
40 Einleitung Abbildung 1-10: Schema eines 2-Kammerversuchssytems (Transwell) für Transportstudien Zwischen apikalem (A) und basolateralem (B) Kompartiment (apical/ basolateral chamber) befindet sich eine semi-permeable Membran, auf der eine Zellschicht (cell monolayer) adheriert ist. Der Transport einer Substanz kann von A nach B und v.v. untersucht werden. Gleichzeitig können unter Verwendung eines Standard-P-gp-Substrats Substanzen auf potentielle, P-gp-inhibitorische Eigenschaften untersucht werden. Als Modellsubstrate haben sich hier radioaktiv-markiertes Digoxin, Vinblastin, Doxorubicin, Colchicin, Calcein-Acetoxymethylester und Talinolol etabliert, aber auch Fluoreszenzfarbstoffe, wie Rhodamin123 oder BODIPY- FL Verapamil finden Verwendung (Collnot et al. 2006, Rautio et al. 2006, Zolnerciks et al. 2011). Zudem lassen sich die Permeationsmarker per Hochleistungsflüssigchromatographie mit UVmetrischer Detektion (HPLC/UV) oder per Flüssigchromatographie mit Tandem- Massenspektrometrie-Analytik (LC/MS/MS) quantifizieren (Shah et al. 2006). Um High-Throughput-Screenings zu ermöglichen, werden statt dem gängigem 12- und 24-Well- Format des 2-Kammersystems auch 96-Well-Formate verwendet (Balimane et al. 2004) Akkumulations Assays Man unterscheidet hier zwischen Akkumulation im Zellinneren (Zytoplasma) und in der Zellmembran: Ein Inhibitorscreening kann erfolgen, indem die Akkumulation eines fluoreszierenden Transportersubstrats in einer MDR-Zelllinie in Abhängigkeit von der Anwesenheit potentieller Hemmstoffe bestimmt wird. Bei effektiver Hemmung verbleibt eine signifikant höhere Substratkonzentration im Zellinneren, was an einer deutlich gesteigerten intrazellulären Fluoreszenz im Vergleich zur ungehemmten Kontrolle erkannt werden kann (Feng et al. 2008). Wie unter beschrieben kann P-gp auch durch physiko-chemische Veränderungen des Transporter-umgebenden Bilayers moduliert werden, indem etwa eine amphiphile Substanz in
41 1 - Einleitung 19 diesem Zellmembranbereich akkumuliert. Diese Akkumulation kann dadurch quantifiziert werden, dass während einer Transportstudie der potentielle Inhibitor radioaktiv-gelabelt eingesetzt wird. Isoliert man anschließend die Zellmembranen, kann nach Membranaufschluss der Isotopengehalt an angereichertem Hemmstoff gemessen werden (Batrakova et al. 2004) Radioligand-Bindungsstudien Man arbeitet hier mit durch Lysophosphatidylcholin porierten Caco-2-Zellen in Anwesenheit eines ATP-regenerierenden Systems, damit zugegebene Substanzen ungehinderten Zugang zum Zellinneren haben und von dort aus direkt mit P-gp interagieren können. Somit wird der geschwindigkeitsbestimmende Schritt der Membranverteilung umgangen. Nun kann nach Addition des vermeintlichen Substrats oder kompetitiven Inhibitors die konzentrationsabhängige Verdrängung des Radioliganden 3 H-Verapamil gemessen werden. Dies bildet die Grundlage für die Berechnung zugehöriger IC50-Werte, wo 50 % des Radioliganden von der Bindungsstelle verdrängt werden (Koggel 2003) UIC2- Shift Assay Der monoklonale Antikörper UIC2 bindet spezifisch an ein Oberflächenepitop des P-gp, das erst durch die effluxbedingte Konformationsänderung zu Tage tritt. Wird die Konformation des Proteins, etwa durch allosterische Modulation, anderweitig verändert, kann der Antikörper nicht mehr binden, was einen indirekten Nachweis für die allosterische Hemmung bedeutet. Dies kann mit einer Mutantenzelllinie, die einen anderen Efflux-Konformationskomplex ohne diese allosterische Angriffstelle aufweist, nachgewiesen werden (Maki et al. 2003) Nicht-zelluläre Studien Allerdings erfordert die Arbeit mit lebenden Zellen einen hohen Zeitaufwand und die Einhaltung strengster Handhabungsregeln um Kontaminationen zu vermeiden. Zudem kann ein simplifiziertes, allein auf P-gp reduziertes System für manche Fragestellungen, wie die Aufklärung molekularer Interaktionen, sogar besser geeignet sein. Daher haben sich u.a. folgende nicht-zelluläre Assays für die P-gp-Forschung etabliert.
42 Einleitung P-gp-ATPase Aktivitätsstudien Wie unter beschrieben ist die energieliefernde ATPase ein funktionsbestimmender Bestandteil des P-gp: Substrate aktivieren die Enzymaktivität, genauso kompetitive Hemmstoffe. Allosterische Hemmung, Bindung an die NBDs oder eine sterische Blockade in der Substratbindungstasche führt dagegen zu einer Inhibition der ATPase. Die Aktivität kann anhand der Menge an freigesetztem anorganischen Phosphat per Farbreaktion und photometrischer Absorption gemessen werden. Verwendung finden bevorzugt Membranen von Insektenzellen, die nach viraler Transfektion humanes P-gp überexprimieren (Collnot et al. 2007). Es werden aber auch inside-out Vesikel aus den Membranen P-gp-exprimierender Zellen verwendet, bei denen Substrate direkt mit dem inneren Lipidlayer der Membran interagieren können, oder Proteoliposomen, in deren Membran rekonstituiertes P-gp aus Säugerzellen integriert ist (Nervi et al. 2010). Vor diesem Hintergrund können rein qualitative Ergebnisse erzielt werden, aber auch Konstanten der Enzymkinetik berechnet werden (Maximal-/ Minimalaktivität, Konzentration für halbmaximale/ -minimale Aktivität, etc.) (Li-Blatter et al. 2009). Eine andere Methodik zur Untersuchung des ATP-Umsatzes stellen die cytosensor Messungen dar, bei denen die ATP-Synthese in lebenden Zellen anhand der extrazellulären Azidifizierungsrate bestimmt wird (Aanismaa & Seelig 2007) Molecular Modeling und Dockingstudien Protein-Ligand-Wechselwirkungen können mit computergestützten in silico Simulationen abgeschätzt werden, was im structure-based drug design bereits intensiv und erfolgreich angewandt wird. Die oft unbekannte Struktur eines Zielproteins (Rezeptor, Transportprotein oder Enzym) kann ausgehend von einem ausreichend charakterisierten Template-Modellprotein mit möglichst hoher Sequenzidentität erstellt werden. Das so gewonnene 3-D-Modell der Tertiärstruktur kann nun im High-Throughput-Maßstab mit unterschiedlichen Molekülstrukturen in allen potentiell auftretenden sterischen Konformationen gedockt werden. Anhand von Berechnungen der, bei einer Bindung frei werdenden Gibbsschen freien Energie ( G) definiert man theoretische Bindungsaffinitäten dieser Moleküle und quantifiziert sie als sog. Docking Scores (z.b. Glide XP Score). Dabei können ganze Strukturbibliotheken untersucht werden und die affinsten Verbindungen für eine spätere Synthese bzw. in vitro Studien selektiert werden (Cheng et al. 2009).
43 1 - Einleitung 21 Interessant ist dieses Tool des virtual dockings für die Entwicklung sowohl von Substraten als auch von Inhibitoren, da die Chance besteht, spezifische, für eine Bindung verantwortliche Molekülelemente zu identifizieren und detailliert Substratbindungsstellen aufzuklären (Peri et al. 2005). Allerdings handelt es sich um ein höchst abstraktes System, das nicht sämtliche in vitrooder gar in vivo-einflüsse berücksichtigen kann. Somit sollte stets eine kritische Interpretation der gewonnenen Daten und Aussagen erfolgen Elektronenspin-Resonanz (ESR)-Spektroskopie Die Elektronenspin-Resonanz-Spektroskopie untersucht den Einfluss von Testsubstanzen auf die Fluidität von Zellmembranen, die ebenfalls eine P-gp-Inhibition auslösen kann. Wird das Fettsäurederivat 5-Doxylstearinsäure (5-DSA) in die Zellmembran integriert, ist es in seiner Mobilität stark eingeschränkt. Daher ergibt sich ein substanzspezifisches, anisotropes ESR- Spektrum. Ändert sich nun durch eine zugegebene Substanz die Membranfluidität so tendiert das Spektrum in die isotrope Richtung einer Lösung (Collnot et al. 2007) In vivo Studien Können in vitro überzeugende Ergebnisse bzgl. einer P-gp-Interaktion erzielt werden, besteht die nächste Herausforderung darin, diese Effekte auch in vivo nachzuweisen. Als Versuchstiere werden meist Nager verwendet: Wildtyp-Mäuse, die MDR1a und 1b homozygot exprimieren, können in ihrer Pharmakokinetik mit double-knockout Mäusen ohne jegliche P-gp-Expression verglichen werden (Gnoth et al. 2011). Aber auch Wistar oder Sprague-Dawley Ratten werden häufig verwendet (Sababi et al. 2001, Zhang et al. 2003). Untersucht man einen neuartigen Wirkstoff auf P-gp-Substrateigenschaften, werden die auch in vitro etablierten Hemmstoffe PSC-833 oder Ciclosporin A verwendet (Giacomini et al. 2010, MacLean et al. 2010). Für die Inhibitorforschung werden ebenfalls etablierte P-gp-Substrate, wie 3 H-Digoxin, Saquinavir oder 11 C-Verapamil eingesetzt. Letzteres kann per Positronen-Emissions- Tomographie P-gp-Interaktion in der Blut-Hirn-Schranke visualisieren (Muzi et al. 2009). Soll speziell die Wechselwirkung mit intestinalem P-gp überprüft werden, erfolgt die Applikation von Substrat und Inhibitor peroral. Nach gewissen Zeitabständen werden Blutproben aus dem systemischen Kreislauf entnommen, wie dem retrobulbären Venenplexus, der Jugular- oder Schwanzvene oder der Halsschlagader (Martin-Facklam et al. 2002, Chow et al. 2011, Gnoth et al. 2011). Auch intestinale Perfusionsstudien, wo bestimmte Darmbereiche und zugehörige Mesenterialgefäße abgebunden werden, sind möglich (MacLean et al. 2010). Besitzt die zu
44 Einleitung untersuchende Substanz P-gp-Substrateigenschaften, ist ihre orale Bioverfügbarkeit oftmals gering und wird bei gleichzeitiger Gabe eines etablierten Inhibitors deutlich gesteigert. Agiert ein Compound jedoch selbst als P-gp-Hemmstoff, wird sie den Plasmaspiegel eines Modellsubstrats erkennbar erhöhen. 1.4 Phospholipide Einteilung und Vorkommen Die Klasse der Phospholipide stellt einen wichtigen Baustein von Biomembranen dar und wird abhängig von ihrem grundlegenden Strukturelement - dem Glycerol oder dem Sphingosin - in Glycero- und Sphingophospholipide untergliedert (Tab. 1-3). Diese Lipide können, bei ausreichender Kettenlänge, in wässrigem Milieu Lamellen, sog. Flüssigkristalle, ausbilden (Nordskog et al. 2001), was ihren polaren Kopfgruppen geschuldet ist. Sie ermöglicht bei den Glycerophospholipiden, die in dieser Arbeit im Fokus stehen, eine weitere, ebenfalls in Tabelle 1-3 dargestellte Unterteilung in Phosphatidylcholine (PC), -ethanolamine (PE), -glycerine (PG), -serine (PS), -inositole (PI) und dem Cardiolipin. Die Lipidmoleküle ordnen sich so in den Biomembranen an, dass die lipophilen Seitenketten einander zugewandt sind, wohingegen die hydrophilen Kopfgruppen die Ober- und Unterseite ausbilden (Abb. 1-11) (Nordskog et al. 2001). Integriert in diese Lipiddoppelschicht befinden sich Transmembranproteine wie P-gp, die die gesamte Membran vertikal durchspannen und Cholesterolmoleküle. An der hydrophilen, extrazellulären Membranoberfläche sind durch kovalente und nicht-kovalente Bindungen periphere Proteine dynamisch an Lipidkopfgruppen oder Integralproteine gebunden. Sowohl diese Kopfgruppen, als auch die Proteinreste können glykosiliert vorliegen (Langner et al. 2011).
45 Tabelle 1-3: Einteilung und Struktur der Phospholipide (Cevc 1993, Avanti(R) Polar Lipids 2012) Klasse Ladungszustand Struktur 1 - Einleitung 23 Glycerophosphatidylcholin (PC) neutral Glycerophosphatidylethanolamin (PE) neutral Glycerophosphatidylglycerin (PG) anionisch Glycerophosphatidylinositol (PI) anionisch Glycerophosphatidyl- L-Serin (PS) anionisch Cardiolipin anionisch Sphingophosphatidylcholin neutral R R: Kohlenwasserstoffreste, gesättigt oder ungesättigt
46 Einleitung Abbildung 1-11: Schema einer Biomembran nach Unwin und Henderson (1975) ( ) Die Phospholipiddoppelschicht ist so angeordnet, dass die hydrophilen Kopfgruppen (hydrophilic heads) zum Extrazellularraum (extracellular fluid) bzw. zum Zytoplasma (cytoplasm) orientiert sind. Die lipophilen Reste (hydrophobic tails) sind einander zugewandt. In der Membran befinden sich zudem Transportproteine, Cholesterol, periphere (peripheral), integrale oder Oberflächen (surface) proteine. Sowohl Lipide, als auch Proteine können glykosiliert vorliegen (glycolipid, glycoprotein) Intestinale Verdauung und Resorption Werden Lipide über die Nahrung aufgenommen, unterliegen sie im Magen-Darm-Trakt diversen Aufspaltungs- und Solubilisierungsprozessen, um in den systemischen Kreislauf zu gelangen. Im Falle der Phospholipide (PL) setzt der enzymatische Abbau erst im Dünndarm ein, im Magen findet lediglich eine Voremulgierung durch mechanische Kräfte bzw. die Hydrolyse anderer Nahrungsfette (Triglyceride) durch Magenlipase statt. Nach der Pyloruspassage formieren sich die PL in Anwesenheit von Gallensalzen und Cholesterol zu Mischmizellen in Wurm- oder Scheibenform (Abb. 1-12). Auch hier befinden sich die hydrophilen Kopfgruppen der PL und Gallensalze an der Ober- und Unterseite, während die jeweiligen lipophilen Reste einen apolaren Innenbereich bilden (Nordskog et al. 2001, Schubert 2003).
47 1 - Einleitung 25 PL A Gallensalz B Abbildung 1-12: Schematische Mischmizellbildung von Gallensalzen und Phospholipiden (Schubert 2003) Gallensalze assemblieren sich mit PL-Molekülen zu Wurmmizellen (A) und bei weiterer Gallensalzzugabe zu Scheibenmizellen (B). Gallensalze sind Cholesterolderivate, die in der Leber synthetisiert werden. Die Grundstruktur bilden meist Chol- oder Chenodesoxycholsäuren, die an der Caboxylgruppe mit Taurin oder Glycin konjugiert werden und im alkalischen Milieu der Galle primär als Natriumsalze vorliegen (Abb. 1-13) (Mutschler 2008). Abbildung 1-13: Cholsäure ( ) Das Natrium-Glykocholat trägt an der Carboxylgruppe ein amidisch gebundenes, deprotoniertes Glycin. Am Natrium-Glykochenodesoxycholat fehlt zudem die Hydroxylgruppe an C12. Im Darmlumen wird mizellar gebundenes PL durch das pankreatische Verdauungsenzym Phospholipase A2 (PL A2) an der C2-Position des Glycerols in das korrespondierende Lyso-PL und eine freie Fettsäure gespalten (Abb. 1-14). PL A2 wird als anionogenes Zymogen in der Pankreasflüssigkeit sekretiert und im Duodenum durch tryptische Abspaltung eines N-terminalen Heptapeptids aktiviert. Aber auch in den Mikrovilli der Enterozyten liegt dieses Enzym konzentriert
48 Einleitung vor. Die Anwesenheit von Calciumionen, Gallensalzen und einer Co-Lipase sind für dessen Funktionsfähigkeit genauso unerlässlich, wie ein ph-bereich von 8 bis 9 (Nordskog et al. 2001). R1 R2 R1 Phospholipid Lysophospholipid freie Fettsäure R2 Abbildung 1-14: Phospholipase A 2-bedingte Abbaureaktion von Phospholipid in Lysophospholipid und freie Fettsäure Die Abbauprodukte Lyso-PL und Fettsäure verbleiben mit Cholesterol, Gallensalzen (GS), Monoglyceriden und fettlöslichen Vitaminen als Mischmizelle gebunden und passieren so die unbewegte Wasserschicht direkt oberhalb der Intestinalmukosa. Im mizellaren Zustand erfolgt dieser Prozess um ein Vielfaches schneller, als wenn die Moleküle individuell gelöst vorliegen. Voraussetzung ist stets, dass die kritische Mizellbildungskonzentration der GS überschritten ist. Bei besonders hohem Lipidangebot bilden sich statt Mischmizellen flüssig-kristalline Vesikel (Liposomen), die ebenfalls die intestinale Aufnahme von Fettsäuren und Monoglyceriden ermöglichen (Nordskog et al. 2001). Zudem sollen GS mit Lyso-PL submizellare Aggregate bilden, die einen besonders effizienten Lyso-PL-Transport hervorrufen (Shoemaker & Nichols 1990, 1992). Die letztendliche Resorption in die Enterozyten erfolgt zum einen durch passive Diffusion der Einzelmoleküle. Membrankontakt kann zuvor über die Interaktion mit einem Scavenger Rezeptor der Klasse B Typ I (SR-BI) hervorgerufen werden. Für die Aufnahme von Monoglyceriden und Cholesterol spielt zum anderen der unter angesprochene Vorgang der Transzytose eine wichtige Rolle (Langner et al. 2011). Auch Carrier-vermittelter Transport wird angenommen: Für Fettsäuren, Cholesterol und Monoglyceride via eines fatty acid binding proteins (FABP) und für langkettige Fettsäuren via des fatty acid transport protein-4 (FATP4) Aggregationsverhalten Phospholipide können sowohl in ihren Kopfgruppen (Tab. 1-4), als auch in ihren Fettsäureresten variieren, die von kurz und gesättigt (Buttersäure) bis lang und mehrfach ungesättigt (Docosahexaensäure) reichen können. Diese Funktionalitäten haben entscheidenden Einfluss auf das Aggregationsverhalten der Lipide: Dispergiert man sie nur in geringer Konzentration in wässrigem Medium, liegen sie monomer solubilisiert vor bzw. lagern sich an Grenzflächen an. Bei
49 1 - Einleitung 27 Überschreitung der molekülspezifischen kritischen Mizellbildungskonzentration (critical micelle concentration, CMC) beginnen sich Aggregate zu bilden, im Falle von Phospholipiden entstehen spontan planare oder flexible Bilayer. Daher kann in diesem Zusammenhang auch von der kritischen Bilayerkonzentration (critical bilayer concentration, CBC) gesprochen werden (Buboltz & Feigenson 2005). Diese Lamellen bilden in bestimmten Fällen spontan oder aber durch Energieeintrag vesikuläre Strukturen, sog. Liposomen (Abb. 1-15) (Huang 1969). Sie besitzen eine Lipiddoppelschicht, bei der, wie auch in einer natürlichen Biomembran, die lipophilen Reste zueinander orientiert sind und die polaren Kopfgruppen einerseits einen hydrophilen Innenraum schaffen, andererseits nach außen hin mit dem Dispersionsmedium interagieren (Bauer 2012). Abbildung 1-15: Schematischer Querschnitt durch ein unilamellares Liposom Die hydrophilen Kopfgruppen sind als weiße Kugeln dargestellt, die lipophilen Reste als schwarze Linien. ( ) Generell lässt sich postulieren: Eine sterisch anspruchsvolle oder elektrostatisch geladene Kopfgruppe (PS, PG) zusammen mit kurzen Fettsäureresten erschwert eine Bilayerbildung, so dass vorrangig mizellare Strukturen entstehen. Lange (> 12 C-Atome) und möglichst gesättigte Fettsäureketten können jedoch durch ausgeprägte lipophile Wechselwirkungen und van-der-waals- Kräfte innerhalb der Doppelschicht, den Zusammenhalt von Membranen so unterstützen, dass PSund PG-Lipide durchaus Liposomen bilden (Demel et al. 1987). PC-Lipide bilden als zylindrisch geformte Moleküle stabile Lipiddoppelschichten und somit auch stabile Vesikel aus. Kleine Kopfgruppen, gerade in Kombination mit ungesättigten KW-Resten, die durch ihre Doppelbindung(en) keine so dichte Packung zulassen, bilden spontan inverse Hexagonalphasen und müssen für eine Vesikelbildung oft mit anderen PL kombiniert werden (van den Brink-van der Laan et al. 2004).
50 Einleitung Liposomen lassen sich je nach Größe und Anzahl der vorhandenen Lipiddoppelschichten (Lamellarität) unterteilen in: SUV (small unilamellar vesicles): kleine unilamellare Vesikel mit nur einem Bilayer und Durchmesser von < 50 nm (Thomas & Poznansky 1989). LUV (large unilamellar vesicles): große unilamellare Vesikel von > 50 nm Durchmesser. Sie zeigen hohe Stabilität und eine gute Ausgangsgrundlage zur Untersuchung von Membraneffekten. MLV (multilamellar large vesicles): große multilamellare Vesikel von mehreren Mikrometern im Durchmessern und mind. zwei Lipiddoppelschichten. MVV (multivesicular vesicles): sehr große unilamellare Vesikel, die in ihrem Innenraum kleinere Vesikel einschließen (Jesorka & Orwar 2008). Ein weiterer physiko-chemischer Parameter für die PL-Charakterisierung stellt die Phasenübergangstemperatur (phase transition temperature, PTT) dar. Sie markiert die Temperatur, bei der die ausgebildeten Lipidlamellen vom starr-kristallinen, hochgeordneten Gelzustand L in den mobil-fluiden, flüssig-kristallinen Zustand L übergehen (Lee 1977). Auch diese Größe ist abhängig von der Molekülstruktur des PL und ist umso höher, je länger und gesättigter die Fettsäurereste sind. Geladene Kopfgruppen senken die PTT wiederum, da die Bilayer durch die elektrostatischen Repulsionen weniger stabil geordnet vorliegt (van den Brink-van der Laan et al. 2004). Dieser Phasenübergang von Bilayern ist gerade für Transmembranproteine ein wichtiger Prozess, denn wie unter beschrieben, beeinflussen die Membraneigenschaften direkt deren Aktivität Therapeutische Anwendungen für Phospholipidzubereitungen Bereits seit mehreren Jahrzenten werden Liposomen in der pharmazeutischen Entwicklung eingesetzt: So ermöglicht ihr hydrophiler Innenraum die Verkapselung polarer Arzneistoffe, der lipophile Bilayer die Inkorporierung fettlöslicher Substanzen, was die Solubilisierung schwerlöslicher Substanzen deutlich verbessern kann (Schubert 1998). Zudem wird die Membranoberfläche mit Polyethylenglykolen modifiziert, um die Zirkulationszeit im systemischen Kreislauf zu erhöhen (Stealth-Konzept) bzw. mit monoklonalen Antikörpern gekoppelt, um spezifische Zielstrukturen (Rezeptoren, Zellepitope, Antigene, etc.) anzusteuern. Dieses spezifische Drug Targeting stellt gerade bei hochwirksamen, nebenwirkungsstarken Medikamenten aus der Krebstherapie eine vielversprechende Möglichkeit dar, weil so die Wirkstoffmenge im Tumorgewebe deutlich erhöht und die Belastung innerhalb der normalen Zellpopulation reduziert
51 1 - Einleitung 29 werden kann. Auch als Arzneistoffträger für Nukleinsäuren, Proteine und Kontrastmittel finden Liposomen Verwendung (Torchilin 2005b, a). Tumorzellen tragen häufig in großem Ausmaß MDR-codierte Effluxtransporter wie P-gp oder BCRP in ihrer Membran, was eine Therapie mit den jeweiligen Substraten extrem erschwert. Allerdings konnte gezeigt werden, dass die liposomal verkapselten Anthracycline Doxorubicin und Idarubicin diese Penetrationsbarriere erfolgreich überwinden (Oudard et al. 1991, Thierry et al. 1993, Gubernator et al. 2010, Hantel et al. 2012). Auch Studien mit dem Zytostatikum Adriamycin, das in multilamellaren PC- und PS-Liposomen eingeschlossen war, bewiesen eine deutlich höhere Tumortoxizität dieser Zubereitung im Vergleich zu freiem Wirkstoff (Fan et al. 1990). Transportstudien im Caco-2-System deuteten zudem darauf hin, dass eine PL-bedingte Inhibition des P-gp-Transporters selbst, die Ursache für solch eine verbesserte Resorption sein könnte (Lo 2000). Diese Annahme wurde durch Amina Alkatout genauer untersucht, indem sie die Verbesserung der Ciclosporin A-Resorption in Caco-2-Zellen durch den Einfluss bestimmter synthetischer PC-Derivate ermittelte (Alkatout 2008). Auch zur Verbesserung der intestinalen Resorption in der peroralen Arzneistofftherapie können Phospholipidzubereitungen eingesetzt werden: So kann durch Inkorporation schwerlöslicher Substanzen in Lecithinvesikel eine verbesserte Solubilisierung im Magen-Darm-Trakt erreicht werden. Auch der Einsatz von selbst-emulgierenden drug delivery Systemen (SEDDS), Nano- oder Mikroemulsionen oder liposomal besprühtem Lactosepulver für die Bildung von sog. Proliposomen wird erforscht. Es zeigte sich zudem, dass durch die parallele Verabreichung von PL das Risiko lokaler Reizungen durch mukosal-irritierende Wirkstoffe deutlich vermindert werden konnte (Fricker et al. 2010).
52 Einleitung 1.5 Zielsetzungen der Arbeit Das übergeordnete Ziel der vorliegenden Arbeit besteht darin die Bioverfügbarkeit von peroral applizierten P-gp-Substraten durch den Einsatz von Phospholipiden zu verbessern. Dabei kann das Projekt in mehrere Teilabschnitte untergliedert werden: I. Etablierung einer geeigneten Versuchsmethodik für zelluläre Transportstudien Die Überprüfung P-gp-inhibitorischer Fähigkeiten muss mit einer geeigneten Methodik erfolgen. Als übergeordneten Assay wurde sich für Transportstudien in einem 2-Kammersystem entschieden (s. Kap ), die in vielerlei Hinsicht optimiert werden sollen: Bei den zugehörigen Transwell- Platten, die mit unterschiedlichen Filtermaterialen erhältlich sind, wird das System identifiziert, das sowohl für die verwendeten Zelllinien, als auch für den ausgewählten Transportmarker am besten geeignet ist. Gute Zelladhäsion und stabile Monolayerausbildung werden ebenso berücksichtigt wie ungehinderte Markerdiffusion und eine vernachlässigbare Bindung der Substanz an die Welloberflächen. Das selektierte Testsubstrat Digoxin erfüllt dabei außerdem den Anspruch auf eine hohe Spezifität für den zu untersuchenden Transporter, zeigt keine Eigeninhibition und sehr gute analytische Detektierbarkeit. Zudem werden die verwendeten Zelllinien Caco-2 und MDCKII per Western Blot auf die tatsächliche Expression des P-gp-Transporters getestet. II. In vitro Phospholipidscreening Mit diesem optimierten Versuchssystem erfolgt ein breit angelegtes Phospholipidscreening: Unter Variation von PL-Kopfgruppe - PC, PE, PG oder PS - und Fettsäureresten - gesättigt/ ungesättigt, symmetrisch/ asymmetrisch, kurz-/ mittel-/ langkettig - werden die zugehörigen liposomalen oder molekular gelösten Zubereitungen zuerst hinsichtlich ihrer Vesikelgröße, Größenverteilung und ihrer Löslichkeit und Hydratisierbarkeit charakterisiert. Anschließend wird ihr Einfluss auf den P-gp-vermittelten Digoxintransport in ausdifferenzierten Caco-2-Zellmonolayern untersucht. Erweisen sich Substanzen als signifikant transportmodulierend, testet man sie in einem weiteren Assay, dem Calcein Akkumulations Assay (s. Kap ), um substratspezfische Effekte auszuschließen. Zudem setzt man die Zelllinie MDCKII, sowohl als Wildstamm, als auch als P-gp-
53 1 - Einleitung 31 überexprimierende mdr1-variante ein, um in direkten Vergleichsstudien den tatsächlichen P-gp- Hemmeffekt zu verifizieren. III. Einfluss des Magen-Darmmilieus auf ausgewählte Phospholipidzubereitungen Da eine perorale Applikation der selektierten PL angestrebt wird, untersucht man den Einfluss der Intestinalflüssigkeit auf ausgewählte Lipidzubereitungen. Von Interesse sind die Auswirkungen auf die Hemmpotenz in vitro, aber auch auf die Formulierungscharakteristika an sich (Aggregationsverhalten, Solubilisierung, etc.). Neben der Testung in einem kompletten, den Darmsaft simulierenden Medium mit und ohne enzymatischer Aktivität, wird auch der Einzeleinfluss von enthaltenen Gallensalzen und enzymatischen PL-Spaltprodukten betrachtet. IV. Aufklärung des Phospholipid-induzierten Inhibitionsmechanismus Nach der Identifikation potentieller P-gp-Inhibitoren rückt die Frage nach dem möglichen Hemmmechanismus in den Vordergrund. Zum einen werden Versuche durchgeführt, um die für die P-gp-Interaktion verantwortlichen Bestandteile in einer PL-Formulierung auszumachen. Auf molekular-mechanistischer Ebene sollen P-gp-ATPase Aktivitätsassays und computergestützte Dockingstudien Aufschluss geben. Zum anderen wird mit letztgenannter Methodik ein Inhibitorscreening innerhalb zweier, noch nicht untersuchter PL-Klassen durchgeführt: den Phosphatidsäuren und Phosphatidylinositolen. V. In vivo Studien mit einem ausgewählten Phospholipidderivat Ein in allen durchgeführten Assays und Zelllinien stets potentes Lipid stellt eine vielversprechende Option für das angestrebte Ziel der intestinalen Resorptionsverbesserung dar. Daher soll der positive in vitro-effekt für ein P-gp-Substrat hoher therapeutischer Relevanz und ausgeprägten lokalen Nebenwirkungen bestätigt werden, dem HIV-Proteaseinhibitor Ritonavir. Anschließend wird besagtes Lipid mit dem gleichen Wirkstoff in vivo in männlichen Wistar Ratten getestet. Eine im Vergleich zur Kontrolle gesteigerte orale Bioverfügbarkeit würde einen großen Fortschritt in der oralen Arzneistofftherapie darstellen, da somit die Grundlage für die Entwicklung eines peroralen Kombinationspräparats von Lipid und P-gp-Substrat geschaffen wäre.
54 Einleitung VI. Ausweitung des untersuchten Transporterspektrums Neben P-gp sind noch viele weitere ABC-Transporter in den zellulären Efflux von Wirkstoffen involviert (s. Kap ), die sich in ihrem Substrat- und Inhibitorspektrum häufig überlappen (Loscher & Potschka 2005, Matsson et al. 2009). Daher ist eine Kreuzreaktivität der in dieser Arbeit identifizierten Lipide mit anderen mdr-assoziierten Effluxpumpen durchaus denkbar und soll am Beispiel des BCRP-Transporters aufgedeckt werden. Wäre auch hier eine Inhibition sichtbar, könnte sich das Anwendungsspektrum der PL noch stärker ausweiten lassen.
55 2 Material und Geräte 33 2 Material und Geräte 2.1 Chemikalien Tabelle 2-1 Phospholipide und derivate Substanz Sojalecithin mit 45 % Phosphatidylcholin Sojaphospholipide mit 75 % Phosphatidylcholin Partiell hydrolysiertes Rapssamenlecithin mit 20 % Lysophosphatidylcholin Lysophosphatidylcholin der Sojabohne, 80 %-ig 1,2-Dihexanoyl-sn-glycero- 3-phosphatidylcholin 1,2-Dioctanoyl-sn-glycero- 3-phosphatidylcholin 1,2-Didecanoyl-sn-glycero- 3-phosphatidylcholin 1,2-Dilauroyl-sn-glycero-3- phosphatidylcholin 1,2-Dimyristoyl-sn-glycero- 3-phosphatidylcholin 1,2-Dipalmitoyl-sn-glycero- 3-phosphatidylcholin 1,2-Distearoyl-sn-glycero- 3-phosphatidylcholin 1,2-Dihexanoyl-sn-glycero- 3-phosphatidylethanolamin 1,2-Dioctanoyl-sn-glycero- 3-phosphatidylethanolamin 1,2-Didecanoyl-sn-glycero- 3-phosphatidylethanolamin 1,2-Dilauroyl-sn-glycero-3- phosphatidylethanolamin 1,2-Dimyristoyl-sn-glycero- 3-phosphatidylethanolamin 1,2-Dipalmitoyl-sn-glycero- 3-phosphatidylethanolamin Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) 45 % S 45 k.a. 75 % S 75 k.a. 20 % Phospholipon R LPC 20 k.a. 80 % S LPC 80 k.a. >99 % 6:0 PC 453,507 >99 % 8:0 PC 509,614 >99 % 10:0 PC 565,720 >99 % 12:0 PC 621,826 >99 % 14:0 PC, DMPC 677, % (TLC) 16:0 PC, DPPC 734,04 99 % (TLC) 18:0 PC, DSPS 790,15 >99 % 6:0 PE 411,428 >99 % 8:0 PE 467,534 >99 % 10:0 PE 523,640 >99 % 12:0 PE 579,746 >99 % 14:0 PE, DMPE 635, % 16:0 PE, DPPE 691,96 Hersteller Lipoid, Ludwigshafen Avanti Lipids, Alabaster (USA) Sigma-Aldrich, St. Louis (USA) Avanti Lipids, Alabaster (USA) Sigma-Aldrich, St. Louis (USA)
56 34 2 Material und Geräte Substanz 1,2-Distearoyl-sn-glycero- 3-phosphatidylethanolamin 1,2-Dihexanoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Dioctanoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Didecanoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Dilauroyl-sn-glycero-3- phosphatidylglycerin 1,2-Dimyristoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Dipalmitoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Distearoyl-sn-glycero- 3-phosphatidylglycerin 1,2-Dihexanoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Dioctanoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Didecanoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Dilauroyl-sn-glycero-3- phosphatidyl-l-serin (Natriumsalz) 1,2-Dimyristoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Dipalmitoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Distearoyl-sn-glycero- 3-phosphatidyl-L-serin (Natriumsalz) 1,2-Dielaidoyl-sn-glycero- 3-phosphatidylcholin 1,2-Dilinolenoyl-sn- glycero-3- phosphatidylcholin 1,2-Didocosahexaenoyl-sn- glycero-3- phosphatidylcholin 1-Myristoyl-2-oleoyl-sn- glycero-3- phosphatidylcholin Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) 99 % (TLC) 18:0 PE, DSPE 748,07 >99 % 6:0 PG 464,420 >99 % 8:0 PG 520,526 >99 % 10:0 PG 576,633 >99 % 12:0 PG 632,739 >99 % 14:0 PG, DMPG 688,845 >99 % 16:0 PG, DPPG 744,952 >99 % 18:0 PG, DSPG 801,058 >99 % 6:0 PS 477,419 >99 % 8:0 PS 533,525 >99 % 10:0 PS 589,631 >99 % 12:0 PS 645,738 >99 % 14:0 PS, DMPS 701,844 >99 % 16:0 PS, DPPS 757, % (TLC) 18:0 PS, DSPS 814,06 >99 % trans-18:1 PC 786,113 >99 % cis-18:3 PC 778,050 >99 % cis-22:6 PC 878,167 ~99 % (TLC) 14:0/ cis-18:1 PC Hersteller Avanti Lipids, Alabaster (USA) Sigma-Aldrich, St. Louis (USA) Avanti Lipids, Alabaster (USA) 732,02 Sigma-Aldrich, St. Louis (USA)
57 2 Material und Geräte 35 Substanz 2-Linoleoyl-1-palmitoyl-sn- glycero-3- phosphatidylcholin 1-Stearoyl-2- docosahexaenoyl-sn- glycero-3- phosphatidylcholin Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) 99 % (TLC) 16:0/ cis-18:3 PC 758,06 99 % (TLC) 18:0/ cis-22:6 PC 834,156 Capronsäure 98 % (GC) 6:0 FA 116,16 Caprylsäure 99 % (GC) 8:0 FA 144,21 Caprinsäure 99 % (GC) 10:0 FA 172,27 Myristinsäure 99 % 14:0 FA 228,38 Stearinsäure 98,5 % (Kapillar GC) 18:0 FA 284,48 Linolensäure 99 % cis-18:3 FA 280,45 Docosahexaensäure 98 % cis-22:6 FA 328,49 1-Hexanoyl-2-hydroxy-sn- glycero-3- phosphatidylcholin 1-Octanoyl-2-hydroxy-sn- glycero-3- phosphatidylcholin 1-Decanoyl-2-hydroxy-sn- glycero-3- phosphatidylcholin 1-Stearoyl-2-oleoyl-snglycero-3-phosphat (Natriumsalz) 1,2-Dimyristoyl-sn-glycero- 3-phosphat (Natriumsalz) 1,2-Dioctanoyl-sn-glycero- 3-phosphatidylinositol (Natriumsalz) 1,2-Dihexanoyl-sn-glycero- 3-phosphatidylinositol-(5)- P 1) (Natriumsalz) >99 % 6:0 LPC 355,364 >99 % 8:0 LPC 383,417 >99 % 10:0 LPC 411,471 >99 % cis-(18:1/18:0) PA 724,964 >99 % 14:0 PA, DMPA 614, % PI 8:0-Na 608,6 98 % PIP 1 6:0-Na 654,5 Ei-Phosphatidylcholin S -- EPC S ca. 770 Hersteller Carl Roth (Karlsruhe) Sigma-Aldrich, St. Louis (USA) Avanti Lipids, Alabaster (USA) Cayman Chemical Company, Ann Arbor (USA) Lipoid, Ludwigshafen
58 36 2 Material und Geräte Tabelle 2-2 Wirkstoffe Substanz Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) Hersteller Ciclosporin A 98,5 % (TLC) CsA 1202,6 Digoxin 98,9 % (HPLC) Dig 780,94 Ko % (HPLC) ,57 PSC-833 >98 % ,62 Ritonavir k.a ,84 Verapamil 99,0 % ,06 Sigma-Aldrich, St. Louis (USA) Tocris Bioscience, Bristol (UK) European Pharmacopoeia Reference Standard, Strassbourg (FRA) Sigma-Aldrich, St. Louis (USA) Tabelle Radioaktive Substanzen Substanz Aktivitätsvolumen (MBq ml -1 ) Spezifische Akt. (GBq mmol -1 ) Abkürzung Molmasse (g mol -1 ) 3 H-Ciclosporin A 37,0 370,0 3 H-CsA 1202,6 3 H-Digoxin 37,0 Batch-abhängig (1103 / 1309,8 / 1480) 3 H-Dig 780,94 3 H-Ritonavir 37,0 111, ,84 Hersteller Custom Radiolabelling (ehem. Amersham Radiochemicals) Perkin Elmer, Waltham (USA) Hartmann Analytic GmbH, Braunschweig Tabelle Fluoreszenzfarbstoffe Substanz Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) BODIPY FL Prazosin k.a. BP 563,41 Calcein- Acetoxymethylester 90 % (HPLC) Calcein-AM, CAM 994,9 Hersteller Invitrogen, Life Technologies, Grand Island (USA) Calbiochem, Darmstadt
59 2 Material und Geräte 37 Tabelle 2-5 Western Blot Substanzen Substanz Wässrige 40 %-ige Acrylamid-, Bisacrylamidstamm-lösung (37,5 : 1) Spezifikation -- Abkürzung oder Summenformel Rotiphorese Gel 40 (37,5:1) Molmasse (g mol -1 ) Albumin Fraktion V 98 % BSA Anti-Glykoprotein P-gpmonoklonaler Antikörper complete Mini Protease Inhibitor Cocktail Tablets Ein-Komponentenentwicklerlösung Ethylendiamintetraessigsäure Dinatriumsalz Dihydrat Ein-Komponenten- Fixiererlösung 0,058 mg ml -1 C219 p.a. APS 228, ,9 6-fach konzentriert -- G %, p.a EDTA 372,24 5-fach konzentriert Hersteller -- Carl Roth, Karlsruhe Ammoniumperoxodisulfat Bromphenolblau Natriumsalz Pierce, Thermo Scientific, Rockford, USA Merck KGaA, Darmstadt Carl Roth, Karlsruhe Hoffman- LaRoche, Basle, Schweiz Agfa Healthcare, Bonn Carl Roth, Karlsruhe G Agfa Healthcare Glycin 99 % -- 75,07 Carl Roth, Harnstoff 99,5 %, p.a. Urea 60,06 Karlsruhe HRP-gekoppelter Sekundär-AK 0,5 mg ml-1 Goat anti-mouse Poly-HRP -- Pierce, Thermo Scientific, Rockford, USA -Mercaptoethanol 99 %, p.a. -ME 78,13 Carl Roth, Milchpulver Blotting grade Karlsruhe Molecular Weight Marker SuperSignal West Pico Chemiluminscent Substrate Tetramethylethylendiamid Spectra Multicolor High Range Protein Ladder MW % p.a. TEMED 116,21 Thermo Scientific, Rockford, USA Carl Roth, Karlsruhe
60 38 2 Material und Geräte Tabelle 2-6 Zellkulturreagenzien Substanz Spezifikation Hersteller L-Alanyl-L-Glutamin 200 mmol L -1 Dulbecco s MEM (DMEM) Zellkulturmedium Fötales Kälberserum Flüssigmedium ohne Na-Pyruvat, mit stabilem Glutamin Herkunft: Australien; hitze-inaktivert Humanplasma --- Natrium-Pyruvat 100 mmol L -1 Biochrom AG, Berlin Immunhämatoglogisches Labor, Fraktionierung Haus Langerhans Blutspendeeinrichtung Universitätsklinikum Freiburg Nicht-essenzielle Aminosäuren Phosphat-gepufferte Kochsalzlösung (PBS) Trypsin (1:250)/EDTA (0,25 %/0,02 %) 100-fach konzentriert ph 7,4; ohne Ca 2+, Mg 2+ in PBS, ohne Ca 2+, Mg 2+ Biochrom AG, Berlin Tabelle 2-7 Lösungsmittel, Säuren und Laugen Substanz Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) Hersteller Aceton HPLC grade C 3H 6O 58,08 Acetonitril 99,98 %, Ultra LC- MS C 2H 3N 41,05 Ameisensäure HPLC grade CH 2O 2 46,02 Ammoniak 20 % NH 3+H 2O 17,03 Chloroform HPLC grade CHCl 3 119,38 Dimethylsulfoxid 99,5 %, für die Molekularbiologie DMSO 78,13 Essigsäure 100 % C 2H 4O 2 60,05 Carl Roth, Karlsruhe Ethanol HPLC grade C 2H 6O 46,07 Isopropanol HPLC grade C 3H 8O 60,10 Methanol HPLC grade CH 4O 32,04 Natriumhydroxid p.a. NaOH 40,00 Salzsäure, 37 % p.a. HCl 36,46 Schwefelsäure, 96 % 96,% p.a ISO. H 2SO 4 98,08 Merck, Darmstadt Carl Roth, Karlsruhe Tetrahydrofuran HPLC grade C 4H 8O (THF) 72,11
61 2 Material und Geräte 39 Tabelle 2-8 Detergentien Substanz Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) 97 % Na GCDC 414,6 Hersteller Sigma-Aldrich, St. Louis (USA) Natriumglykocholat 98 % Na GC 487,62 Carl Roth, Natriumdodecylsulfat -- SDS, Tween Karlsruhe Tabelle 2-9 Puffersubstanzen Substanz Dinatriumhydrogenphosphat, Dihydrat Hank s Balanced Salt Solution (10x, Ca 2+, Mg 2+, w/o Phenolrot) Reinheitsgrad Abkürzung oder Summenformel Molmasse (g mol -1 ) Hersteller 99 % Na 2HPO 4 2 H 2O 177,99 Merck, Darmstadt -- HBSS 10x -- Kaliumchlorid 99 % KCl 74,56 Kaliumdihydrogenphosphat, wasserfrei Gibco, Invitrogen, Life Technologies, Grand Island (USA) Carl Roth, Karlsruhe 99,5 % KH 2PO 4 136,09 Fluka, Buchs (CH) Magnesiumchlorid 98,5 % MgCl 2 95,22 Natrimglykochenodesoxycholat 2-(N-Morpholino)- ethansulfonsäure >99 % MES 195,20 Natriumchlorid >99 % NaCl 58,40 Tris-(hydroxymethyl)- aminomethan Tris-(hydroxymethyl)- aminomethanhydrochlorid 99,9 % TRIS 121,14 99 %, p. a. TRIS-HCl 157,60 Carl Roth, Karlsruhe
62 40 2 Material und Geräte Tabelle 2-10 Weitere Chemikalien und Gase Substanz Adenosin 5 -Triphosphat (Magnesiumsalz) Ammoniummolybdat- Tetrahydrat Reinheitsgrad 95 % Abkürzung oder Summenformel Molmasse (g mol -1 ) MgATP 507,18 99 % p.a. (NH 4) 6 Mo 7O 24 4 H 2O 1235,86 Fiske-Subbarow-Reducer k. A. Reducer -- Humane P-gp Membranen 5 mg ml Interner Ritonavir-MS- Standard 99 % 13 C / 98 % 2 H [ 13 C, 2 H]-Ritonavir 724,96 Kohlenstoffdioxid 4.5 CO 2 44,01 Phospholipase A 2 (Schweinepankreas) k.a. PL A 2 13,9 kda Stickstoff 4.0 N 2 14,01 Szintillationscocktail für Feststoffproben Szintillationscocktail für wässrige Proben Hersteller Sigma-Aldrich, St. Louis (USA) Carl Roth, Karlsruhe Fluka, Buchs (CH) BD Gentest, Heidelberg Alsachim, Illkirch Graffenstaden, (FRA) Sauerstoffwerk Friedrichshafen Sigma-Aldrich, St. Louis (USA) Sauerstoffwerk Friedrichshafen -- Ultima Gold F -- Perkin Elmer, Rodgau- -- Ultima Gold -- Jüdesheim Triton X 100 k.a. Triton 624 Wasserstoffperoxid-Lösung 30 % (m/m) puriss.; p.a. H 2O 2 34,02 Carl Roth, Karlsruhe Sigma-Aldrich, St. Louis (USA) 2.2 Verbrauchsmaterialien Tabelle 2-11 Herstellung und Charakterisierung von Phospholipidzubereitungen Beschreibung Artikelbezeichnung Hersteller Bördelkappen für Glasvials 10 ml Einmalküvetten für PCS und Photometrie N 20 TB/oA Butyl schwarz/ PTFE grau Plastibrand Einmalküvetten halbmikro 1,5 ml, PMMA Macherey-Nagel, Düren Brand, Wertheim Glasvials 10 ml für Lipidstammlösungen Inj BB 10R 45,0 x 24,0 Schott, Jena HPLC-Vials mit Deckel Polycarbonatmembranen zur Extrusion 1,5 ml Gewindeflaschen ND8 (32 x 11,6 mm, klar) mit schwarzen PP- Schraubkappen (5,5 mm großes zentrales Loch und Septum) Nuclepore Track-Etched Membranes (200 und 80 nm nominale, mittlere Porenweite) VWR Int., Darmstadt Whatman, Dassel
63 2 Material und Geräte 41 Tabelle 2-12 Zelllinien Ursprung Transfektion Abkürzung Passage Herkunft Humanes Colonkarzinomepithel Madin darby canine kidney: hündisches Nierenepithel Stamm II Madin darby canine kidney: hündisches Nierenepithel Stamm II -- Caco-2 10 bis Humanes mdr1-gen MDCKII Wildtyp 10 bis 23 MDCKII mdr1 5 bis 30 LS Pharm. Technologie, Universität Freiburg NKI-AVL, Amsterdam, Niederlande Tabelle 2-13 Zellkultivierung Beschreibung Spezifikation Hersteller Kryoröhrchen Sterile Einmalpipetten Transwell 2-Kammersystem Polyestermembranfilter Transwell 2-Kammersystem Polycarbonatmembranfilter Transwell 2-Kammersystem Polycarbonatmembranfilter Transwell 2-Kammersystem Kollagen-beschichtetes Polytetrafluorethylenmembranfilter Transwell 2-Kammersystem Polycarbonatmembranfilter 24-Well-Platte 96-Well-Platte Zellkulturflaschen Zellkulturschalen Tabelle 2-14 Standardkits für in vitro Studien CryoTubes Corning Costar Stripette serologische Pipetten 2,0 ml, 5,0 ml, 10,0 ml 12-Well-Platte, 0,4 µm Porengröße 12-Well-Platte, 0,4 µm Porengröße 12-Well-Platte, 3,0 µm Porengröße 12-Well-Platte, 3,0 µm Porengröße 24-Well-Platte, 0,4 µm Porengröße Flat-bottem, Tissue-culture treated Polystyren Tissue-culture treated Polystyren 50,0 ml 100 x 20 mm; Tissue-culture treated Polystyren Nunc, Thermo Scientific, Langenselbold Corning Inc. Life Sciences, MA, USA BD Falcon, Heidelberg Beschreibung Artikelbezeichnung Hersteller Bradford Reagenz zur Proteingehaltsbestimmung und BSA- Standardampullen Bestimmungs-Kit für ATPase-Aktivität von P- gp-membranen Bestimmungs-Kit zur Bestimmung der Zellviabilität Coomassie Plus (Bradford) Protein Assay Kit ATPase Assay Kit CellTiter-Glo Luminescent Cell Viability Assay Pierce, Thermo Scientific BD Gentest, Heidelberg Promega, Madison (USA)
64 42 2 Material und Geräte Tabelle 2-15 Western Blot Beschreibung Artikelbezeichnung Hersteller Fotofilme Hyperfilm ECL Amersham, GE Healthcare, Freiburg Nitrocellulosemembranen Protran BA85 Whatman, GE Saugpapier 3MM Chr Whatman paper Healthcare, Freiburg Tabelle 2-16 Wasserqualitäten Qualität Gereinigtes Wasser (Leitfähigkeit < 1 µs cm -1 ) = demin. Wasser Reinstwasser (Leitfähigkeit < 0,055 µs cm -1 ) Tabelle 2-17 In vivo Studien Herstellverfahren Herstellung durch Ionenaustausch (Mischbettverfahren) aus Trinkwasser Herstellung durch Aktivkohlebehandlung und hochreinen Ionenaustausch aus gereinigtem Wasser Gerät und Hersteller Hausanlage, Hydrotec T. Opitz, Freiburg arium 611VF Sartorius, Göttingen Beschreibung Artikelbezeichnung Hersteller Futter V R/M-H Kapillarblutentnahmesystem Microvette 200 Kapillarröhrchen 96-Well-Platte zur Festphasenextraktion minicaps Oasis MCX µelution Plate Ssniff Spezialdiäten GmbH, Soest Sarstedt AG & Co, Nümbrecht Hirschmann Laborgeräte, Eberstadt Waters Corp., Milford, MA (USA)
65 2 Material und Geräte 43 Tabelle 2-18 Sonstiges Beschreibung Artikelbezeichnung Hersteller Einmalfilter zur Puffer-Filtration Sartolab P-20 sartorius-stedim biotech, Göttingen Einmalpasteurpipetten aus LD-PE Transferpipette 3,5 ml Sarstedt, Nümbrecht Einmalspritze 1 ml Omnifix-F Einmalspritzen 10 und 20 ml Kanülen für Einmal- und Hamiltonspritzen Pasteurpipetten aus Glas Pipettenspitzen für Gilson Microman Pipetten Pipettenspitzen, verschiedene Größen PP-Probenvial 1,5 ml Injekt 10 und 20 ml Luer Kanülen Sterican 20 G x 1 ½ (0,90 x 40 mm), Gr. 1 CP-10, CP-100 und CP-1000 Reaction Tubes 1,5 ml, PP B. Braun, Melsungen Brand, Wertheim Gilson, Middleton, WI (USA) Eppendorf, Hamburg Abimed, Langenfeld Greiner Bio-One, Frickenhausen PP-Probenvial 2 ml SafeSeal Reagiergefäß 2 ml, PP Sarstedt, Nümbrecht Probenbehälter Spitzen für die Multipette, verschiedene Größen Falcon Röhrchen 15 ml und 50 ml Combitip plus Spritzenvorsatzfilter 0,22 µm Minisart 0,2 µm Spritzenvorsatzfilter 0,45 µm Minisart RC15 0,45 µm Verschlussfolie Parafilm PM996 Becton Dickinson, Franklin Lakes (USA) Eppendorf, Hamburg Sartorius, Göttingen Alcan Packaging, Paris, F 2.3 Geräte Tabelle 2-19 Waagen Gerät Typenbezeichnung Hersteller Analysenwaage AT261 Delta Range Mettler-Toledo, Giessen, CH Grobwaage Sartorius Universal PRO 32/34 R Sartorius, Göttingen Laborwaage Kern ABS Kern & Sohn, Balingen
66 44 2 Material und Geräte Tabelle 2-20 Western Blot Gerät Typenbezeichnung Hersteller Elektrophoresesystem: Gussvorrichtung/ - rahmen, Modul, Tank, Kämme, Glasplatten Spannungsgeber Mini Protean 2 Elektrophoresesystem Precision DC Power Supply12008, Wipptisch WT 17 Blottingsystem: Kammer, Kassette, Schwämme, Vorbereitungstablett, Roller criterion Blotter BioRad Lab., München Voltcraft, betreut von Conrad Electronic SE, Hirschau Biometra GmbH, Göttingen Biorad Lab., München Entwicklerkassette X-Omatic Kodak, Rochester, USA Tabelle 2-21 Herstellung und Charakterisierung von Phospholipid(derivat)zubereitungen Gerät Typenbezeichnung Hersteller Glasmurmeln -- Verschiedene Hand-Extruder Heizblock für Bartlett-Assay LiposoFast Liebisch SON/D A Avestin, Ottawa, CAN Gebr. Liebisch, Bielefeld Heizschrank für Bartlett-Assay TK-2 Ehret, Emmendingen Hochvakuumpumpe (nominell mbar) Photonenkorrelationsspektrometer und Software RD4 Zetasizer Nano und Zetasizer Software Version 6.30 Vaccubrand, Wertheim Malvern Instruments, Malvern, UK Rotationsverdampfer Rotavapor R Büchi, Göpingen, CH Temperierbares Wasserbad HB4 basic IKA, Staufen Thermostat Thermostatierbares Wasserbad mit Schüttler Julabo F12 mit Julabo ED Steuereinheit WB14 Julabo Labortechnik, Seelbach Memmert, Schwabach Ultraschall-Bad Sonorex Super RK 255 H Bandelin, Berlin UV/Vis-Spektrophotometer Lambda XLS Perkin Elmer, Überlingen Vakuumpumpe KNF Lab Vacuumcontroller KNF, Freiburg
67 2 Material und Geräte 45 Tabelle 2-22 In vitro- und nicht-zelluläre P-Glykoprotein-Assays Gerät Typenbezeichnung Hersteller Absorption-Plattenleser für 96-Well-Platten SpectraCount Canberra-Packard, Dreieich Auflichtmikroskop Axiovert 25 Carl Zeiss, Oberkochen Autoklav Tuttnauer 3870 EL Biomedis, Gießen CO 2-Brutschrank MCO-17A1 Sanyo (jetzt Panasonic Healthcare, Etten Leur Niederlande) CO 2-Brutschrank APT.Line CB 150 Binder, Tuttlingen Dosierhilfe Dispensette Digital 1-5 ml bzw. Easy Calibration 0,5-5 ml Brand, Wertheim Elektrodenkammer zur TEER-Bestimmung Endohm World Precision Technology Elektrische 8-Kanalpipette µl Research pro Eppendorf, Hamburg Fluoreszenz-Plattenleser für 96-Well-Platten FluoroCount Canberra-Packard, Dreieich Flüssigszintillationszählgerät ( -Counter) TriCarb 1900 Lumineszenzplattenleser Orbitalschüttler Pipettierhilfe TriStar Platereader PSU-10i Pipetus Perkin Elmer, Rodgau- Jüdesheim Berthold Technologies, Bad Wildbad Laboratory Technology, Buddeberg Hirschmann Laborgeräte, Eberstadt Schüttelwasserbad 1083 GFL, Burgwedel Sicherheitswerkbank Thermostatierbarer Proben-Inkubator ASW-UP-IV-1906 Thermomixer comfort mit Aufsatz für 1,5 ml PP Reaktionsgefäße Tischzentrifuge Universal 320 Wärmematte 24-Well-Elektrodenkammersystem zur kontinuierlichen TEER-Bestimmung ThermoLux, 17 x 17 cm, 6 Watt cellzscope Bleymehl Reinraumtechnik, Inden-Pier Eppendorf, Hamburg Hettich Zentrifugen, Tuttlingen AccuLux, Murrhardt NanoAnalytics, Münster Vakuumpumpe -- KNF Neuberger, Freiburg Zählkammer nach Neubauer Spezifikation: 0,0025 mm² Fläche; 0,100 mm Tiefe Superior, Marienfeld Zellzähler (manuell) -- Oramics, Eschweiler (LUX)
68 46 2 Material und Geräte Tabelle 2-23 Kryo-Transmissionselektronenmikroskopie Gerät Typenbezeichnung Hersteller Kryo-Kammer Cryo-Box Kryo-Probenhalter Kupfer-Grids mit Kohlefilm bedampft TEM-Hochvakuumpumpe Model 626-DH Quantifoil S7/2 Cu 400 mesh, holey carbon films TMH 071 P TEM-Kamera Proscan HSC 2 TEM-Software item 5.0 (Build 1054) Carl-Zeiss, Oberkochen Gatan, Warrendale, PA, USA Quantifoil Micro Tools, Jena Pfeiffer Vakuum, Aßlar Oxford Instruments, Abingdon, UK Soft Imaging System, Münster Transmissionselektronenmikroskop (TEM) Leo 912 Ω-mega Leo, Oberkochen Tabelle 2-24 In silico Dockingstudien Software Typenbezeichnung Hersteller Docking Software Glide 5.6 Ligandenbearbeitungssoftware LigPrep 2.4 Zielmodellbearbeitungssoftware Prime 2.2 Software Schrödinger Inc., Mannheim Tabelle 2-25 In vivo Studien Gerät / Tierart Elektrospray Tandem-Massenspektrometer Ultra Performance Liquid Chromatography (UPLC) Anlage UPLC Säule Typenbezeichnung / Geschlecht Waters Xevo TQ-S Waters Acquity Waters BEH C18 1,7 µm UPLC Säule Hersteller / Gewicht Waters Corp. Milford, MA, USA Wistar Ratten männlich 250 g
69 2 Material und Geräte 47 Tabelle 2-26 Sonstige Geräte Gerät Typenbezeichnung Hersteller Folienschweißgerät Vacupack Plus F Krups GmbH, Offenbach a.m. Heizrührer Ikamag Ret-G IKA, Staufen Kolbenhubpipetten für organische Lösungsmittel, verschiedene Pipettiervolumina Kolbenhubpipetten für wässrige Zubereitungen, verschiedene Pipettiervolumina Gilson Microman Gilson, Middleton, WI, USA Eppendorf, Hamburg Gilson, Middleton, WI, USA Multipette Multipette plus Eppendorf, Hamburg ph-meter Schlauchquetschpumpe zur Puffer-Filtration Stoppuhr Thermometer, elektrisch SevenEasy mit InLab 418 ph- Elektrode bzw. Seven Compact ph/ Ion mit InLab Expert Pro ph-elektrode Mesotron Quartz IKA-TRON DTM 10 mit Pt Thermofühler Mettler-Toledo, Giessen, CH Filtron, Karlstein hanhart, Hamburg bzw. TFA Dostheim, Wertheim IKA, Staufen Tischzentrifuge Biofuge pico Heraeus, Osterode Ultraschallspitze UW 3100 mit Sonopuls Bandelin, Berlin Universalzentrifuge Z 382 K Hermle, Wehingen Vortexer Heidolph reax top Heidolph, Schwabach 2.4 Zellmedien, Puffer und sonstige Lösungen Zellkulturmedien Tabelle 2-27 Zusammensetzung des Caco-2-Zellkulturmediums Substanz Dulbecco s MEM FCS, Hitze-inaktiviert Natrium-Pyruvat (100 mmol L -1 ) Nicht-essenzielle Aminosäuren (NEAA), 100-fach konzentriert L-Alanin-Glutamin (200 mmol L -1 ) Menge 500,0 ml 10 % (v/v) 1 % (v/v) 1 % (v/v) 1 % (v/v)
70 48 2 Material und Geräte Tabelle 2-28 Zusammensetzung des MDCKII-Zellkulturmediums Substanz Dulbecco s MEM FCS, Hitze-inaktiviert Menge 500,0 ml 10 % (v/v) Standardpuffer Tabelle 2-29 Hank s balanced salt solution (HBSS) ph 6,5 Substanz hank s balanced salt solution (HBSS), 10-fach konzentriert MES Menge 50,0 ml 0,98 g Reinstwasser ad 500,0 ml NaOH ad ph 6, Lösungen für den Western Blot Tabelle 2-30 Lysepuffers (NKI 2012) ph 7,4 Substanz KCl MgCl 2 Tris-HCl Menge 0,75 g 0,14 g 1,58 g Reinstwasser ad 1,0 L NaOH ad ph 7,4 SDS complete Mini Protease Inhibitor Cocktail Tablets 0,5 % (m/v) 1 pro 10,0 ml Tabelle fach konzentrierter Solubilisationspuffer ph 6,9 (5-facher Solubilisationspuffer) Substanz EDTA Harnstoff SDS TRIS Menge 0,185 g 30,0 g 7,5 g 1,9 g Reinstwasser ad 50,0 ml HCl ad ph 6,9
71 2 Material und Geräte 49 Tabelle fach konzentrierter Probenauftragspuffer (Ladepuffer) Substanz Menge Bromphenolblau (0,5 %ige-lösung in demin. Wasser) 80 µl -Mercaptoethanol 17 µl 5-facher Solubilisationspuffer 800 µl Tabelle 2-33 Phosphat-gepufferte Kochsalzlösung mit Tween 20 (phosphate-buffered saline, PBST 0,1 %) ph 7,4 Substanz KCl KH 2PO 4 NaCl Na 2HPO 4 Menge 0,20 g 0,24 g 8,00 g 1,44 g Reinstwasser ad 1,0 L HCl ad ph 7,4 Tween 20 0,1 % (m/v) Tabelle 2-34 Laufpuffer für die Gelelektrophorese ph 8,3 Substanz Glycin TRIS Menge 14,4 g 3,03 g Reinstwasser ad 1,0 L HCl ad ph 8,3 SDS 0,1 % (m/v) Tabelle 2-35 Blotting-Transferpuffer ph 8,3 Substanz Glycin Methanol TRIS Menge 14,4 g 2,0 ml 30,0 g Reinstwasser ad 1,0 L HCl ad ph 8,3
72 Methoden 3 Methoden 3.1 Herstellung von Phospholipidzubereitungen Erzeugung von MLV (multilamellar large vesicles) mittels Filmmethode Die jeweiligen Lipide wurden in gewünschter Menge einzeln in Chloroform und falls nötig unter Zusatz von 30 % (v/v) Methanol gelöst. Das organische Lösungsmittel wurde in einem Rundkolben am Rotationsverdampfer (Rotavapor R, Büchi) entfernt, bis sich an der Glaswand ein dünner Lipidfilm gebildet hatte. Nach intensiver Trocknung am Hochvakuum (RD4, Vaccubrand) wurde dieser Film anschließend im erforderlichen Volumen an Standardpuffer hank s balanced salt solution (HBSS) ph 6,5 (Tab. 2-29) oder Reinstwasser aufgenommen, worauf sich - ab einer Kettenlänge von sechs C-Atomen und wenn die kritische Mizellbildungskonzentration (critical micelle concentration, CMC; s. Kap ; Tab ) überschritten wurde - spontan große, multilamellare Vesikel (multilamellar, large vesicles, MLV) bildeten Extrusion Die MLV-Dispersionen wurden mittels eines LiposoFast Hand-Extruders (Avestin) 51-mal durch Polycarbonatmembranen von 80 nm Porenweite (Nuclepore track-etched polycarbonate membranes, Whatman) extrudiert, um Vesikel eines möglichst einheitlichen Größenbereichs zu erhalten. Damit die Vesikelneubildung im flüssig-kristallinen Lipidzustand stattfand, wurde eine Prozesstemperatur oberhalb der lipidspezifischen Phasenübergangstemperatur (phase transition temperature, PTT; s. Kap ; Tab ) gewählt. Inwiefern die produzierten Zubereitungen in den nachfolgenden Versuchen Anwendung fanden, wurde anhand visueller Qualitätskontrolle entschieden (Tab ). Alle Proben wurden bis zum Versuchstag bei 2-8 C gelagert, ungesättigte Derivate unterlagen zudem einem Lichtschutz.
73 3 - Methoden 51 Abbildung 3-1: Handextruder ( ) Ultraschall Für manche Versuche wurden bestimmte MLV-Proben nach der Filmhydratation in Puffer nicht extrudiert, sondern 15 min im Ultraschallbad (Sonorex Super RK 255 H, Bandelin) bei 30 Watt und 25 C behandelt. 3.2 Charakterisierung von Phospholipidzubereitungen Bestimmung der Phospholipid-Gesamtkonzentration Die letztendlich in den Proben enthaltene Phospholipidkonzentration wurde mittels einer 1959 von Grant Bartlett publizierten Methode bestimmt (Bartlett 1959). Organisch gebundener Phosphor wird hier nach oxidativer Veraschung mit konz. Schwefelsäure und H2O2 in anorganisches Phosphat umgesetzt, welches nach Zugabe von Ammoniummolybdat und Fiske-Subbarow-Reducer (eine Mischung aus 1-Amino-2-naphthol-4-sulfonsäure, Natriumsulfit und Natriumhydrogensulfit; (Fiske & Subbarow 1925)) als blau-gefärbtes Produkt bei λ = 830 nm photometrisch detektiert werden konnte. Die gemessene Phosphatstoffmenge entsprach somit genau dem PL-Gehalt in der Probe. Der Phosphatgehalt des verwendeten Hydratationspuffers musste ebenfalls bestimmt und berücksichtigt werden. Mit sieben Messpunkten wurde eine Kalibrierkurve im Bereich 0 bis 0,350 µmol Phosphat erstellt. Die untersuchten Probenmengen wurden so gewählt, dass sich ihr PL- Gehalt in diesem Kalibrierbereich bewegte. Zudem wurde ein dreifacher, phosphatfreier Blankwert bestimmt. Jedes Probengefäß wurde mit 500 µl 10 N H2SO4 versetzt und 3 h bei 160 C im Trockenschrank (TK-2, Ehret) verascht. Nun wurden je 200 µl H2O2 (30 % (v/v)) hinzu pipettiert, gevortext und erneut 1,5 h bei 160 C inkubiert. Den Lösungen wurde 4,5 ml einer 0,22 %-igen (m/v) Ammoniummolybdatlösung und 200 µl einer frisch hergestellten 14,8 %-igen (m/v) Lösung von
74 Methoden Fiske-Subbarow-Reducer (beides in demin. Wasser) hinzugefügt. Die Proben wurden erneut gemischt, die Gefäßöffnungen mit Glasmurmeln verschlossen und für 10 min bei 95 C in einem Heizblock (Liebisch SON/D A, Gebrüder Liebisch) erhitzt. In dieser Zeit entwickelte sich die Phosphat-abhängige Blaufärbung, deren Absorption nach dem Abkühlen am Lambda XLS UV/Vis- Spektrophotomer (Perkin Elmer) bestimmt wurde Photonenkorrelationsspektroskopie (photon correlation spectroscopy, PCS) Mit den PL-Zubereitungen, die in weiteren Studien verwendet werden sollten, wurden PCS- Messungen durchgeführt, um den durchschnittlichen hydrodynamischen Teilchendurchmesser und die Größenverteilung der entstandenen Vesikel zu bestimmen. Die Proben wurden hierfür 1:100 (v/v) mit HBSS ph 6,5 verdünnt und mittels der Zetasizer Software Version 6.30 und des Geräts Zetasizer Nano (Malvern) vermessen. Angewandt wurde eine Messmethode mit 173 Backscatterwinkel, automatischer Signaldämpfer (attenuater)- und Positionseinstellung und anschließender Datenauswertung nach general purpose (normal resolution). Es wurden drei Messungen durchgeführt, die je aus 21 Läufen (runs) von 10 sec bestanden. Der so ermittelte polysdispersity index (PDI) galt als Maß für die Größenverteilung, der mittlere intensitätsgewichtete hydrodynamische Durchmesser (Z-Average, mean average) entsprach unter den Versuchsbedingungen dem Durchschnittsdurchmesser der Partikel. Letzterer war jedoch nur dann von überzeugender Aussagekraft, wenn eine homogene Größenverteilung (PDI < 0,2) vorlag Kryo-Transmissions-Elektronenmikroskopie (Kryo-TEM) Ausgewählte PL-Dispersionen wurden mit HBSS ph 6,5 auf eine Konzentration zwischen 5 und 10 mmol L -1 verdünnt. Die Probenvorbereitung erfolgte nach einem Standardprotokoll: Ca. 5 µl dieser Verdünnung wurden auf ein Kupfernetz (Quantifoil) gegeben. Nach Entfernung überschüssiger Flüssigkeit, wurde der verbliebene Lipidfilm sofort durch Einschießen in flüssigen Ethan schockgefroren. All diese Schritte wurden unter klimatisch-kontrollierten Bedingungen in einer CryoBox durchgeführt. Die nachfolgende Netzfixierung auf dem Probenstab (D626, Gatan Inc.) und dessen Überführung in das Transmissions-Elektronenmikroskop (Leo 912 OMEGA, Zeiss) fand in Stickstoff-Atmosphäre bei 90 K (-183 C) statt. Das Gerät wurde bei 100 K (-174 C), 120 kv und zero-loss Bedingungen betrieben. Bilder wurden mit facher Vergrößerung aus 7-21 verschiedenen Positionen mit einem slow-scan CCD Kamerasystem (Proscan HSC 2) aufgenommen. Hierbei arbeitete man stets mit minimalem Unterfokus der Objektivlinse um einen ausreichenden Phasenkontrast zu gewährleisten (Holzer et al. 2009). Die Kryo-TEM-Untersuchungen wurden von Sabine Barnert durchgeführt.
75 3.2.4 Bestimmung der Gallensalz-bedingten Vesikelsolubilisierung anhand von Streulichtmessungen 3 - Methoden 53 In der vorliegenden Versuchsreihe sollte untersucht werden, inwieweit das in mod. Fassif ph 6,5 enthaltene 1:1 (mol/mol) Gallensalzgemisch aus Natrium-Glykocholat (Na GC) und Natrium- Glykochenodesoxycholat (Na GCDC) solubilisierenden Einfluss auf ausgewählte, in den Zellversuchen verwendete Lipidzubereitungen ausübte. Der Prozess wurde durch Messung der Vesikel-induzierten Streulichtsignale (Countrate) detektiert, da eine Auflösung der Strukturen an einem rapiden Abfall des Signals erkannt werden konnte (Theobald 2009). Zu Beginn wurden liposomale Zubereitungen von 1,2-Didecanoyl-sn-glycero-3-phosphocholin (10:0 PC), 1,2-Didocosahexaenoyl-sn-glycero-3-phosphocholin (cis-22:6 PC) und 1,2-Dipalmitoylsn-glycero-3-phosphocholin (16:0 PC = DPPC) in HBSS ph 6,5 wie unter und beschrieben per Extrusion hergestellt und auf 0,2 mm in Standardpuffer verdünnt. Die besagte Gallensalzmischung wurde in 12 Konzentrationen von 0 bis 11,0 mm ebenfalls in HBSS ph 6,5 gelöst. Jeweils 1,0 ml der Lipidzubereitung und 1,0 ml der Gallensalzlösung wurden gemischt und für 1 h bei 25 C im Wasserbad inkubiert. So beinhaltete die Messlösung 0,1 mm Lipid und 0 bis 5,5 mm Gallensalz. Die Detektion erfolgte mit der Zetasizer Software v am Gerät Zetasizer Nano. Verwendet wurde die Methode der manuellen Messung (manual measurement) im 173 Backscatterwinkel und einer Datenanalyse im general purpose-modus (normal resolution). Zunächst wurde mit der reinen Liposomenzubereitung ohne Gallensalz der Attenuater so eingestellt (Stufe 0-11), dass der Countrate-Messer einen stabil hohen Wert von > 400 kcps (kilo counts per sec) anzeigte. Mit dieser Einstellung wurden alle Proben des jeweiligen Lipids in aufsteigender Gallensalzkonzentration vermessen. Ein rapider Abfall der Countrate wurde als Vesikelsolubilisierung gewertet. 3.3 Herstellung von Lösungen sonstiger Lipidderivate Formulierung von freien Fettsäuren (free fatty acids, FFA) Die freien Fettsäuren wurden bei kurzen Kettenlängen in HBSS ph 6,5, bei Resten von > 12 C- Atomen in DMSO gelöst und ungesättigte Derivate anschließend unter Lichtschutz gelagert.
76 Methoden Formulierung von Lyso-PC-Derivaten Aus den Lysolipiden wurde, wie schon aus den Phospholipiden unter beschrieben, durch Herstellung einer Chloroformstammlösung und anschließender Lösemittelentfernung ein dünner Lipidfilm hergestellt, der nach Pufferzugabe eine klare Lösung zur weiteren Verwendung ergab. 3.4 Zellkultivierung Soweit wie möglich wurden sämtliche Zellkultivierungsarbeiten und Zellversuche unter einer Sicherheitswerkbank (ASW-UP-IV-1906, Bleymehl) durchgeführt. Wenn nicht anders erwähnt, wurden die verwendeten Lösungen und Reagenzien auf 37 C im Wasserbad (1083, GFL) vorgewärmt Humane Colon-Karzinomepithel (Caco-2)-Zellkultur Caco-2-Zellen wurden routinemäßig mit zelllinienspezifischen Medium (Tab. 2-27) in Petrischalen oder Zellkulturflaschen (beides von Falcon BD Biosciences) in einem Brutschrank (37 C, 5 % CO2, 90% rf; CB 150, Binder) kultiviert, wobei das Medium alle zwei Tage gewechselt wurde. Ca. einmal wöchentlich, nachdem die Zellen zu ca. 80 % konfluent gewachsen waren, wurden sie zweimal mit phosphate buffered saline (PBS) w/o Ca 2+, Mg 2+ ph 7,4 gewaschen und mit einer Lösung aus 0,25 % Trypsin und 0,02 % EDTA abgelöst Madin darby canine kidney (MDCK) II-Zellkultur MDCKII mdr1 Das NKI (Netherlands Cancer Institute, Amsterdam, Niederlande) stellte unentgeltlich einen madin darby canine kidney (MDCK) Zellstamm II zur Verfügung, welcher stabil mit humanem mdr1-gen transfiziert wurde (MDCKII mdr1), so dass diese Zellen das mdr1-genprodukt P-Glykoprotein überexprimierten. Die Zellen wurden in Dulbecco s MEM (DMEM)-Medium mit 10 % (v/v) hitzeinaktiviertem fötalen Kälberserum (FCS) angezüchtet (s. Tab. 2-28). Das Medium wurde alle zwei Tage gewechselt und die Zellen bei ca. 80 %-iger Konfluenz (zweimal wöchentlich) wie unter beschrieben abgelöst und passagiert.
77 3 - Methoden MDCKII Wildtyp Der korrespondierende Wildtyp-Stamm der MDCKII Zellen wurde ebenfalls über das NKI in Amsterdam bezogen und wie unter behandelt Einfrierprozess zur Langzeitlagerung in flüssigem N2 Der Zellinhalt einer konfluent-bewachsenen 50,0 ml-flasche wurde wie unter beschrieben abgelöst und in 2,5 ml eiskaltem DMEM aufgenommen. Hinzu gab man 2,5 ml eines sterilfiltrierten Freezing-Mix (80 % (v/v) FCS, 20 % (v/v) DMSO), mischte gründlich und pipettierte je 1 ml in ein steriles Kryoröhrchen (Nunc) (NKI 2012). Die Portionen wurden zunächst bei -80 C in einem Isopropanol-haltigen Gefäß eingefroren, um einen langsamen Einfrierprozess zu gewährleisten. Nach wenigen Wochen wurden die Röhrchen schließlich zur Langzeitlagerung in flüssigen Stickstoff eingebracht Auftauprozess nach der Langzeitlagerung in flüssigem N2 Das Kryoröhrchen mit der gewünschten Zellportion wurde dem Stickstofftank entnommen und rasch bei 37 C im Wasserbad aufgetaut. Der gesamte Röhrcheninhalt wurde sodann in einer Petrischale mit 12,0 ml Medium und die Zellen über Nacht bis zur Adhärenz kultiviert. Am nächsten Tag erfolgte ein Mediumwechsel, um das im Einfriermedium enthaltene, bei Raumtemperatur zytotoxische DMSO zu entfernen. 3.5 P-Glykoproteinnachweis per Western Blot-Analytik Das P-gp-Expressionslevel in den verwendeten Zelllinien wurde nach sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)-Proteinauftrennung und Western Blot Transfer mittels eines murinen, P-gp-spezifischen Antikörpers (AK) nachgewiesen. Als Arbeitsanleitungen dienten das Dokument Western Blot A beginner s guide der Firma Abcam ( und die Standard Operation Procedure (SOP) Western Blot des Lehrstuhls für Pharmazeutische Technologie und Biopharmazie, Universität Freiburg. Während die MDCKII-Zellen vor der Probengewinnung keiner besonderen Vorbereitung bedurften, wurden Caco-2 erst nach 21-tägiger Kultivierung auf Transwell-Inserten lysiert, um sie in ihrem ausdifferenzierten, Enterozyten-ähnlichen Zustand zu analysieren (s. Kap ).
78 Methoden Probengewinnung und -aufbereitung Caco-2-Zellen wurden, wie unter näher ausgeführt, mit Zellen Well -1 für 21 d auf 12- Well-Transwell-Platten (Corning) kultiviert. Hierzu wurden abtrypsinierte Zellen in Medium aufgenommen, mit einer Neubauer Zählkammer quantifiziert und mit Medium auf die gewünschte Zellkonzentration verdünnt. MDCKII-Zellen (mdr1 und Wildtyp) wurden für 4 d in einer Dichte von Zellen cm -2 in einer Petrischale ausgesät. Die Zellen wurden mit 37 C warmen PBS w/o Ca 2+, Mg 2+ gewaschen und mit eiskaltem Lysepuffer (0,04 ml cm -2 ; s. Tab. 2-30) benetzt. Nach 10- minütigem Schütteln (100 rpm) auf dem Orbitalschüttler PSU-10i (Laboratory Technology) wurde das Lysat abgeschabt und in ein 15 ml-falcontube überführt. Anschließend wurde es unter Eiskühlung 3-mal 30 sec mit der Ultraschallspitze (30 Watt; Sonopuls UW 3100, Bandelin) behandelt, um die membranständigen Proteine aus der Zellmembran zu gewinnen und die unlöslichen Bestandteile abzentrifugiert (4 C, 15 min, 5 10³ rpm; Tischzentrifuge Biofuge pico, Heraeus) (NKI 2012). Der Überstand wurde in 100 µl-portionen bei -20 C gelagert. Am Tag der Gelelektrophorese wurden die Proben nach folgendem Schema in Tabelle 3-1 verdünnt bzw. mit Ladepuffer (s. Tab. 2-32) versetzt (Angaben für je eine Geltasche): Tabelle 3-1: Zusammensetzung der Gelelektrophoreseproben Probe Probenbezeichnung Probenvol. Lysepuffervol. Ladepuffervol. Ladepuffer Blank µl Molmassen-Marker MW 5 µl - - MDCKII Wildtyp WT 15 µl 15 µl 15 µl 5 µl WT 30 µl 30 µl - 5 µl MDCKII mdr1 mdr1 15 µl 15 µl 15 µl 5 µl mdr1 30 µl 30 µl - 5 µl Caco-2 Caco 15 µl 15 µl 15 µl 5 µl Caco 30 µl 30 µl - 5 µl Bis auf Blank und MW wurden die Proben für 20 min bei 40 C im Wasserbad temperiert und bis zur weiteren Verwendung auf Eis gelagert.
79 3.5.2 Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) 3 - Methoden 57 Für die Herstellung von zwei Gelen, die jeweils aus Trenn- und Sammelgel bestehen, wurden je zwei gesäuberte Glasplatten in die Elektrophoresehalterung eingespannt (Abb. 3-4). Abbildung 3-4: Skizze des Halterungsaufbaus zur Herstellung eines SDS-Gels ( ) Zuerst wurde die Trenngellösung hergestellt (Tab. 3-2) und rasch in den Spacer-bedingten Spalt zwischen den Platten, bis ca. 0,5 cm unterhalb der vorher bestimmen Taschentiefe, gefüllt. Nach ca. 45 min lag das Trenngel auspolymerisiert vor und wurde mit der Sammelgellösung (Tab. 3-2) überschichtet, in welche sofort der Kamm eingesetzt wurde, der die Probentaschen generierte.
80 Methoden Tabelle 3-2: Zusammensetzung von Trenn- und Sammelgel Trenngel 7,5 % SDS Sammelgel 3,5 % Substanz Menge Substanz Menge 40 %-ige (v/v) Acrylamidlösung 4,22 ml 40 %-ige (v/v) Acrylamidlösung 1,125 ml demin. Wasser 15,25 ml demin. Wasser 9,2 ml 3 M TRIS-HCl ph 8,9 2,8 ml 1 M TRIS-HCl ph 6,7 1,5 ml 10 %-ige (m/v) SDS-Lösung in demin. Wasser 225 µl 10 %-ige (m/v) SDS-Lösung in demin. Wasser 120 µl TEMED 33,75 µl TEMED 18 µl 10 %-ige (m/v) APS-Lösung in demin. Wasser (frisch) 112,5 µl 10 %-ige (m/v) APS-Lösung in demin. Wasser (frisch) 150 µl Nach weiteren 30 min wurde der Kamm vorsichtig aus dem Sammelgel entfernt und die Glasplatten incl. Gel zügig in die Elektrodenkammer (Abb. 3-5; Mini-Protean 2 Elektrophoresesystem, BioRad) transferiert. Abbildung 3-5: Elektrodenkammer für die Gelelektrophorese (Biorad Laboratories) ( )
81 3 - Methoden 59 Die Kammer wurde bis zur Geloberkante mit Laufpuffer (s. Tab. 2-34) befüllt, mit welchem auch die Geltaschen von Polyacrylamidresten freigespült wurden. Zudem wurden mit einer puffergefüllten Kanüle Luftblasen vom Elektrodendraht entfernt, um eine gleichmäßige, störungsfreie Wanderung der Proteine im elektrischen Feld zu erzielen. Die Taschen wurden nach dem Schema in Tab. 3-3 befüllt. Der Vorgang ist in Abbildung 3-6 schematisch dargestellt. Tabelle 3-3: Laufschema der Gelektrophorese (+) Anode Polung Kathode (-) Blank MW WT WT mdr1 mdr1 Caco Caco 15 µl 30 µl 15 µl 30 µl 15 µl 30 µl Probenbeladung Kathode Plastikgehäuse Puffer Gel Anode Puffer Abbildung 3-6: Skizze der Probentaschenbefüllung vor der Gelelektrophorese ( ) Nach Anschluss der Elektroden an den Spannungsgeber (Precision DC Power Supply12008, Voltcraft) erfolgte ein ca. einstündiges Einlaufen der Proben bei 50 V. Danach wurde die Wanderungsgeschwindigkeit erhöht, indem die Spannung für die nächsten 2 h auf 80 V angehoben wurde. Sobald die blaue Bande des Ladepuffers sich dem unteren Gelrand näherte, wurde der Prozess beendet und die Gelplatten entnommen
82 Methoden Blotting, Blocking und Detektion Das Blotting diente der Übertragung der Proteinbanden vom Trenngel auf eine Nitrocellulose (NC)- Membran, auf welcher nachfolgend die Bindung spezifischer Antikörper erfolgt. Hierzu wurde zuerst das Gel von den Glasplatten abgelöst und der Sammelgelabschnitt mit einem Skalpell entfernt. In der unter Abb. 3-7 verdeutlichten Abfolge wurde nun das Gel unter eine passende NC-Membran (Protran BA85, Whatman) zwischen Schwämme und saugfähiges Papier (3MM Chr Whatman paper, Whatman) gelegt und in der Blotting-Kassette (Criterion Blotter, Biorad) eingespannt. Alle Bestandteile mussten im Vorfeld großzügig mit Transferpuffer (s. Tab. 2-35) getränkt werden. Anschließend wurde die Kassette in die ebenfalls mit Transferpuffer und einem Kühlakku gefüllte Blottingkammer (Criterion Blotter, Biorad) gestellt. Der Transfer fand unter Eiskühlung über Nacht bei 18 V statt. Klemme Schwamm Filterpapier Membran Gel Filterpapier Kassette Schwamm Abbildung 3-7: Schematischer Aufbau einer Western Blotting-Kassette ( ) Am nächsten Morgen wurde die Membranoberseite bei RT dreimal 5 min mit PBST 0,1 % (s. Tab. 2-33) auf dem Taumelmischer (WT 17, Biometra) gewaschen. Anschließend wurden unspezifische Proteinepitope mit 5 ml Blocklösung (4,5 % (m/v) Milchpulver, 0,5 % (m/v) BSA in PBST 0,1 %) für 8 h bei 4 C auf dem Taumler abgeblockt. Nach erneutem dreimaligen Waschen erfolgte bei den gleichen Bedingungen die Inkubation mit dem Primär-anti-P-gp-Antikörper C219 (Pierce, Thermo Scientic), der im Verhältnis 1:245 (v/v) in AK-Puffer (je 0,5 % (m/v) Milch und BSA in PBST 0,1 %) verdünnt vorlag. Wieder wurde dreimal 5 min gewaschen und der Maus-Fc- Teil des gebundenen Primär-AK mit einem HRP (horse radish peroxidase)-gekoppelten Sekundär- AK (Verdünnung 1:10 4 (v/v) in AK-Puffer; Pierce, Thermo Scientific) versehen. Dies erfolgte
83 3 - Methoden 61 während einer einstündigen Inkubation bei RT auf dem Taumler. Nach erneutem Waschen wurde der gebundene AK-Komplex mittels des SuperSignal West Pico Chemiluminscent Substrate- Assays (Thermo Scientific) nachgewiesen: Hierbei bewirkte die HRP des Sekundär-AK nach Zugabe von H2O2 und einem luminolbasierten Enhancer ein starkes und langanhaltendes Chemilumineszenz-Signal, welches nach 20 sec Entwickeln in der Entwicklerkassette (X-Omatic, Kodak) auf einem Fotofilm (Hyperfilm ECL, Amersham) sichtbar gemacht werden konnte. Der Film wurde anschließend in Entwicklerlösung (G150 Entwicklerkonzentrat, Agfa Healthcare, Verdünnung 1:6 (v/v)) getaucht, bis Banden sichtbar wurden, in demin. Wasser gewaschen, in Fixiererlösung (G354 Fixiererkonzentrat, Agfa Healthcare, Verdünnung 1:5 (v/v)) für 30 sec fixiert und erneut gewaschen. Nun wurden die sichtbaren Banden des MW-Markers von der ursprünglichen NC-Membran auf den Film übertragen, um eine Größenzuordnung der sichtbaren Banden zu ermöglichen. 3.6 Zellviabilität Caco-2-Zellen wurden mit 1, Zellen Well -1 für 8 d, MDCKII-Zellen mit Zellen Well -1 für 4 d in 24-Well-Platten ausgesät. Der Mediumswechsel fand alle zwei Tage bzw. täglich statt, das letzte Mal 1 h vor dem Versuch. Mit Hilfe des CellTiter-Glo (CTG) Luminescent Cell Viability Assays (Promega) sollte das zytotoxische Potential der in den Zellversuchen angewandten Wirkstoffe, Formulierungen und Transportmedien (HBSS ph 6,5 und mod. Fassif (fasted state simulated intestinal fluid) ph 6,5 ± Phospholipase A2) bestimmt werden. Hierbei wurde als Maß für die zelluläre metabolische Aktivität das intrazelluläre Level an Adenosintriphosphat (ATP) nach der Umsetzung mit einer thermostabilen Luciferase als Lumineszenzsignal quantifiziert. Die Zellen wurden mit HBSS ph 6,5 gewaschen und mit 500 µl einer Verdünnung der zu untersuchenden Testkomponente in Puffer für 4 h bei 37 C im Brutschrank inkubiert. Man wählte diese Zeitspanne, da sie der maximalen Versuchsdauer aller durchgeführten Zellstudien entsprach. Anschließend wurde die Platte 10 min bei Raumtemperatur äquilibriert und zu jedem Well 500 µl CTG-Reagenz (eine Lösung des CTG-Substrats in CTG-Puffer) hinzugegeben, 2 min stark durchmischt (ca. 300 rpm) und die Platte erneut für 10 min bei RT ruhen gelassen. Die Endmessung des ATP-abhängigen Lumineszenssignals wurde mit einem Lumineszenz-Plattenleser (TriStar Platereader, Berthold Technologies) vorgenommen. Die Zellviabilität in den jeweiligen Wells
84 Methoden wurde prozentual auf den 100 %-Kontrollwert der Zellen bezogen, welche lediglich mit reinem HBSS ph 6,5 behandelt wurden. 3.7 Bi-direktionale Transportstudien mit P-gp-Substraten Methodenoptimierung mittels Diffusionsversuchen im Transwell-System Verwendung fand hier das etablierte Transwell-2-Kammersystem von Corning, welches u.a. in der 12-Well- oder in der 24-Well-Version angeboten wird (Abb. 3-8). Abbildung 3-8: 12-Well-Transwell-2-Kammersystem ( ) Charakteristisch für dieses System ist der Membranboden des herausnehmbaren Inserts, der zum einen die Zellanwachsfläche für die gewünschte, Transporter-exprimierende Zelllinie darstellt, zum anderen das Well in ein apikales (= luminales, AP) und ein basolaterales (= Blutseite, BL) Kompartiment unterteilt (Abb. 3-9). Abhängig vom Ort der Substratzugabe kann man somit Resorptions- (AP nach BL) oder Sekretionsvorgänge (BL nach AP) unterscheiden. Die 12-Well- Variante fasst apikal 500 µl, basolateral µl. Dieser Membranboden kann sich in Material (Polyester, -carbonat, -tetrafluorethylen, etc.) und der Porengröße (0,4 µm, 3,0 µm, 8,0 µm, etc.) unterscheiden und bietet hierdurch vielerlei Variations- und Abstimmungsmöglichkeiten in der Methodenoptimierung.
85 3 - Methoden 63 Apikales Kompartiment Zellmonolayer Filtermembran Basolaterales Kompartiment Abbildung 3-9: Schematischer Querschnitt eines Transwell-Inserts ( ) In Vorgängerarbeiten wurde als P-gp-Transportmarker das Immunsuppressivum Ciclosporin A (CsA) verwendet (Alkatout 2008). Zur Aufklärung, ob CsA prinzipiell als Standardmarker für die von uns geplanten Studien in diesem Plattensystem geeignet wäre, wurde zunächst dessen Adsorptionstendenz an die Well- und Membranoberflächen im zellfreien System überprüft. Hierfür wurde die im Transportpuffer vorliegende Stoffmenge CsA vor und nach dreistündiger Inkubationszeit im Brutschrank in folgenden Transwell-Inserten bestimmt (Tab. 3-4). Tabelle 3-4: Übersicht der getesteten Filterinserte hinsichtlich Material und Porengröße Filtermaterial Porengröße [µm] Polyester (PE) 0,4 Polycarbonat (PC) 0,4 PC 3,0 Kollagen-beschichtetes Polytetrafluorethylen (COL-PTFE) 3,0 Die verwendeten 12-Well-Platten (1,12 cm² Membranfläche) wurden mit reinem Transportpuffer 30 min prä-inkubiert (37 C, 5 % CO2, 90 % rf) und anschließend 1 µm CsA (z.t. 3 H-markiert) für die Resorptionsrichtung apikal (74 kbq Well -1 ), für die Sekretionsrichtung basolateral (74 kbq Well -1 ) zugegeben. Sodann wurden aus dem jeweiligen Kompartiment Startproben (10 µl) gezogen und mit Puffer ersetzt. Nach 3 h wurden aus Gegen- und Ausgangskompartiment Proben entnommen (AP: 133 µl; BL: 400 µl). Die Proben wurden mit Puffer auf 400 µl ergänzt und anschließend mit 3,6 ml Ultima Gold Szintillationscocktail (Perkin Elmer) versetzt und gevortext. Der radioaktive CsA-Gehalt wurde nun per Flüssigszintillationszählung (liquid scintillation
86 Methoden counting, LSC) im -Counter (TriCarb 1900, Perkin Elmer) bestimmt und auf das Gesamtvolumen in den Kammern bezogen. Die Startstoffmenge entsprach demnach der Stoffmenge aus der Startprobe hochgerechnet auf 500 bzw µl. Die Endstoffmenge ergab sich aus der Stoffmengensumme gemessen und hochgerechnet aus apikalem und basolateralem Kompartiment. Auch der letztendlich ausgewählte Transportmarker, das Herzglykosid Digoxin wurde auf diese Weise hinsichtlich seines Adsorptionsverhaltens geprüft. Hier wurde zu Beginn ebenfalls 1 µm Digoxin (partiell 3 H-markiert) apikal bzw. basolateral zugegeben (je ca. 150 kbq Well -1 ) und anschließend die Start- und Endstoffmenge bestimmt Beimischung von Humanplasma (HP) oder fötalem Kälberserum (FCS) Um die ausgeprägten Adsorptionseigenschaften von CsA zu reduzieren, wurde, wie bei Lee et al. (2001) beschrieben, dem Transportpuffer HP bzw. FCS beigemengt (HP: 25 % bzw. 50 % (v/v); FCS: 10 % (v/v)). Der sonstige Versuchsablauf entsprach Prä-Inkubation der Inserte mit FCS Ein anderer Ansatz der Adsorptionsreduktion beinhaltete die 24-stündige Prä-Inkubation (37 C, 5 % CO2, 90 % rf) von Polyesterinserten (1,12 cm² Fläche, 0,4 µm Porengröße) mit einem Gemisch aus Transportpuffer und 10 % (v/v) FCS. Diese Mischung wurde anschließend entfernt, die Inserte zweimal mit Transportpuffer gewaschen und das CsA in reinem Transportpuffer zugegeben. Weiter wurde wie unter verfahren Beschichtung der Filterinserte mit Humanplasmaprotein Gemäß einer Produktspezifikation für die Wellplatten-Beschichtung mit Rattenkollagen wurden Polycarbonatinserte (1,12 cm² Fläche, 0,4 µm Porengröße) mit Humanplasmaprotein gecoated (Biosciences 2000). Auch dieses Verfahren sollte, angelehnt an Studien von Lee et al. die CsA- Adsorption an die Plattenoberfläche reduzieren (Lee et al. 2001). Zuerst wurde der Proteingehalt an Humanplasma mit dem Bradford Assay (Coomassie Plus (Bradford) Protein Assay Kit, Pierce Thermo Scientific) bestimmt, indem in einer 96-Well-Platte 5 µl an Humanplasmaverdünnungen mit 250 µl Bradford-Reagenz vermischt wurde und die Proteinkonzentrations-abhängige Absorption in einem Absorption-Plattenleser (SpectraCount, Canberra-Packard) bei = 750 nm gemessen wurde (Florea et al. 2001). Die Auswertung erfolgte
87 3 - Methoden 65 anhand einer simultan vermessenen BSA (bovine serum albumin, Rinderserumalbumin)- Standardreihe. Das Humanplasma wurde mit 0,02 N Essigsäure auf 1, 5, 10 bzw. 20 mg ml -1 (= Proteinanteil in der Lösung) verdünnt. Nun wurde jede Verdünnung apikal (500 µl) und basolateral (1500 µl) auf die unbehandelten Transwell-Platten gegeben und für eine Stunde bei RT inkubiert. Anschließend wurde vorsichtig abgesaugt und die Inserte zweimal mit sterilem Transportpuffer gewaschen. Die Platten wurden mit Caco-2-Zellkulturmedium im Brutschrank für 3 d inkubiert. Vor Versuchsbeginn wurde das Medium entfernt, die Platten zweimal mit Transportpuffer gewaschen und 30 min mit demselbigen prä-inkubiert. CsA-Zugabe und Probenentnahme erfolgte wie unter beschrieben Zellkultivierung Caco-2-Zellen wurden mit 1, Zellen Well -1 für d, MDCKII-Zellen mit 1, Zellen Well -1 für 4 d auf in Medium vorgequollenen Transwell-Inserten (Polycarbonatmembran von 0,33 cm² Anwachsfläche und 0,4 µm Porengröße) in 24-Well-Platten angezüchtet. Am Folgetag fand der erste Mediumwechsel statt, um durch die Entfernung von nichtadhärenten Zellen eine Monolayerausbildung zu erzielen. Daraufhin wurde das Medium bei MDCKII täglich und das letzte Mal 1-2 h vor Versuchsbeginn, bei Caco-2 dreimal wöchentlich und das letzte Mal am Vorabend des Versuchs ausgetauscht Transportversuche mit Digoxin Vor einer Transportstudie wurde der Zellmonolayer zweimal mit Transportpuffer gewaschen, für 30 min im Brutschrank auf dem Orbitalschüttler bei 80 rpm äquilibriert und anschließend für weitere 30 min im apikalen Kompartiment mit Transportpuffer (Negativkontrolle), Verapamil (Positivkontrolle) oder den Testsubstanzen im jeweiligen Transportmedium (HBSS ph 6,5 bzw. mod. Fassif ph 6,5 ± Phospholipase A2) prä-inkubiert. Nach dem Absaugen wurde der P-gp- Transportmarker Digoxin (1 µm, z.t. 3 H-markiert) in Anwesenheit von Testsubstanz, Verapamil oder nur in Puffer zugegeben: Entweder apikal (25 kbq Well -1 ) für die absorptive Teilstudie oder basolateral (28 kbq Well -1 ) für die sekretorische Teilstudie. Sofort entnahm man aus dem entsprechendem Donorkompartiment Startproben (10 bzw. 20 µl) zur Berechnung der anfänglichen Wirkstoffkonzentration im Well. Im Laufe der Studie wurden aus dem jeweiligen Akzeptorkompartiment (basolateral für Absorption bzw. apikal für Sekretion) nach 7, 30, 60 und 90 min Proben gezogen (BL: 200 µl bzw. AP: 30 µl), deren Volumen, wie auch bei den
88 Methoden Startproben, durch Transportpuffer ersetzt wurden (Koggel 2003). Während der handwerklichen Arbeiten wurden die Well-Platten stets auf einer Wärmematte von ca. 37 C (ThermoLux, AccuLux) platziert, um weitgehende Temperaturkonstanz zu gewährleisten. Zwischenzeitlich wurden die Zellen mit 80 rpm im Brutschrank bewegt. Alle Proben wurden am Ende mit Puffer auf 200 µl aufgefüllt und das enthaltene 3 H-Digoxin nach Zugabe des 6-fachen Volumens (= 1,2 ml) von Ultima Gold-Szintillationscocktail mittels Flüssigszintillationszählung im -Counter nachgewiesen Transportversuche mit Ritonavir Der HIV-Proteasehemmstoff Ritonavir wurde lediglich im Caco-2-System untersucht. Die Endkonzentration im Well betrug auch hier 1 µm, wobei apikal 11 kbq Well -1, basolateral 67 kbq Well -1 eingesetzt wurden. Das sonstige Vorgehen erfolgte wie unter beschrieben Quantifizierung des Stofftransports Als Maß für die Substratpermeabilität des Zellmonolayers in absorptiver (abs) bzw. sekretorischer (sec) Richtung diente der Papp-Wert (apparent permeability coefficient, Papp, abs bzw. Papp, sec), der mit der Gleichung 3-1 berechnet wurde (Alkatout 2008). Den Substanzfluss in Abhängigkeit von der Zeit (dc dt -1 ) bestimmte man anhand der Wirkstoffkonzentrationen in den im Akzeptorkompartiment in definierten Zeitintervallen gezogenen Proben. Die Anfangskonzentration im Donor konnte durch das Startsample errechnet werden (s ). P app,abs/sec = dc dt V 1 A 1 c 0 ; [cm sec -1 ] (Gleichung 3-1) dc dt -1 Substratfluss über den Monolayer [µmol ml -1 sec -1 ] V Volumen des Akzeptorkompartiments [ml] A Membranfläche [cm²] c 0 Anfangskonzentration im Donorkompartiment [µmol ml -1 ] Gleichung 3-1: Berechnung des P app-wertes P-gp-Substrate werden deutlich stärker in sekretorischer Richtung transportiert, so dass der Wert der gebildeten Papp-Ratio (Gl. 3-2) 2 liegen sollte. Demnach wurde eine Testsubstanz dann als P-gp-inhibitorisch gewertet, wenn sie, im Vergleich zur Puffer-behandelten Kontrolle, den sekretorischen Substratfluss dezimierte bzw. den absorptiven Fluss steigerte. Dies konnte anhand einer reduzierten Papp Ratio (Papp Quotient) der beiden korrespondierenden Papp-Werte erkannt werden.
89 3 - Methoden 67 P app Ratio [ sec abs ] = P app,sec P app,abs ; (Gleichung 3-2) Gleichung 3-2: Berechnung der P app Ratio (P app Quotient) Im Falle der Auswertung des Caco-2-Transportversuchs mit dem BCRP (breast cancer resistance protein) Inhibitor Ko143 wurde die Papp Ratio der Kontrolle gleich 100 % gesetzt und die sonstigen Werte prozentual auf diesen Wert bezogen. Dieses Vorgehen wurde gewählt, um die Ergebnisse aus Versuchen mit unterschiedlichen P-gp-Substraten (Digoxin und Ritonavir) vergleichbar zu machen Integritätsprüfung des Zellmonolayers anhand des transepithelialen elektrischen Widerstands (transepithelial electrical resistance, TEER) Die Ausbildung und Aufrechterhaltung eines dichten, konfluenten Zellmonolayers in den Transwell-Inserten mit, im Falle von Caco-2 intakten tight junctions, ist Voraussetzung für aussagekräftige Transportergebnisse. Fehlstellen, die im Laufe der Anwachszeit entstehen können, aber auch Membrandefekte, die durch Handhabungsfehler während der Transportstudie oder aggressive Testkomponenten erzeugt werden, ermöglichen einen unerwünschten unspezifischen Stofftransport zwischen den Zellen hindurch. Dieser parazelluläre Substanzflux kann den finalen Papp-Wert enorm verfälschen, so dass betroffene Inserte bzw. die mit ihnen generierten Daten nicht weiter verwendet werden sollten. Eine Möglichkeit die Integrität einer Zellschicht zu bestimmen, ist die Messung des transepithelialen elektrischen Widerstandes (transepithelial electrical resistance, TEER), bei welchem der Ionenstrom durch den Monolayer mittels zwei Elektroden per Widerstandsmessung quantifiziert wird. In der vorliegenden Arbeit wurde vorrangig mit der Endohm - Elektrodenkammer (WPI; Abb. 3-10) gearbeitet, bei welcher sich eine Elektrode im Boden der Apparatur befand, in die das Transwell-Insert eingesetzt wird. Durch das Aufsetzen der Deckelelektrode wird der elektrische Kreislauf geschlossen und der Zellmonolayer-bedingte Widerstand kann abgelesen werden. Auch diese Arbeiten fanden auf einer Wärmematte mit 37 C statt.
90 Methoden Abbildung 3-10: Endohm -Elektrodenkammer ( ) Zudem muss der Leerwert des zellfreien Filters gemessen werden, um den TEER-Wert nach folgender Gleichung berechnen zu können: TEER = (R R Filter ) A; [Ω cm²] (Gleichung 3-3) R R Filter A gemessener Widerstand des zellbewachsenen Inserts [Ω] gemessener Widerstand des unbewachsenen Filters [Ω] Membranfläche [cm²] Gleichung 3-3: Berechnung des TEER-Wertes TEER-Messungen mit der Elektrodenkammer wurden jeweils vor und nach jeder Transportstudie durchgeführt, um zu verifizieren, dass keine Zellschichtschädigung während des Versuchs stattfand. Der Stofftransport wurde dann als gewünscht transzellulär eingestuft, wenn der finale TEER-Wert der Versuchswells mind. 80 % bezogen auf den Endwert der Kontroll-Wells (= 100 %) betrug. Bei Caco-2-Zellen wurde sichergestellt, dass zu Versuchsbeginn mind. 250 Ω cm², bei MDCKII- Zellen mind. 30 Ω cm² vorlagen, sonst wurden die Inserte nicht in der Transportstudie eingesetzt. Für ausgewählte MDCKII mdr1-studien konnte mit Hilfe des cellzscope Geräts (Abb. 3-11), das von der Firma NanoAnalytics zur Verfügung gestellt wurde, eine kontinuierliche online-teer- Messung während der Anwachs- und Versuchsdauer durchgeführt werden. Hier erfolgte die TEER- Berechnung komplett automatisch durch die zugehörige cellzscope Software.
91 3 - Methoden 69 Abbildung 3-11: Skizze des cellzscope -Geräts, bestehend aus Bodenelektrodenblock (weiß) und Deckelelektrodenplatte (grau) ( ) 3.8 Calcein Akkumulations Assay (CAA) Für diese Methodik wurden P-gp-exprimierende Zellen mit dem P-gp-Substrat Calcein- Acetoxymethylester (CaAM, Calcein-AM; Abb. 3-12) inkubiert, das auf Grund seiner Lipophilie in die Zellmembran diffundierte und dort mit dem Transmembranbereich des Transporters interagierte. War der Effluxtransporter jedoch inhibiert oder nur in geringem Ausmaß exprimiert, so akkumulierte Calcein-AM im Zellinneren und wurde dort durch unspezifische Esterasen in den hydrophilen Fluoreszenzfarbstoff Calcein gespalten, der nicht mehr mit P-gp interagieren konnte. Demnach war eine effektive P-gp-Hemmung durch einen Anstieg der intrazellulären (i.z.) Fluoreszenz erkennbar. Der schematische Ablauf dieser Methode ist in Abbildung 3-13 dargestellt. Caco-2-Zellen wurden in einer Dichte von 1, Zellen Well -1 für 8 d, MDCKII-Zellen in einer Dichte von Zellen Well -1 für 4 d kultiviert. Die Caco-2-Zelllinie konnte schon nach dieser verkürzten Anwachszeit verwendet werden, weil für diesen Assay lediglich die P-gp-Expression, nicht aber eine komplette enterozytenähnliche Ausdifferenzierung ausschlaggebend war. Das Caco- 2-Medium wurde alle 2 d, das MDCKII-Medium täglich gewechselt. Der letzte Wechsel fand jeweils 1-2 h vor Versuchsbeginn statt. Nun wurden die Zellschichten mit HBSS ph 6,5 gewaschen und für eine angemessene Zeit mit den jeweiligen Testsubstanzen im gewünschten Puffersystem prä-inkubiert (37 C, 5 % CO2, 80 rpm). Jedes Experiment schloss komplett unbehandelte Wells für den Null-Abgleich (Blank), eine Negativkontrolle (HBSS ph 6,5) und eine Positivkontrolle (Verapamil 0,5 mm) mit ein. Anschließend wurde der Überstand abgesaugt und durch eine Mischung aus Testsubstanz und Calcein-AM (1 µm) in Transportmedium ersetzt und für weitere 30 min im Brutschrank unter Lichtschutz inkubiert. Schließlich wurde dreimal mit eiskaltem HBSS ph 6,5 gewaschen und die Zellen mit einer Triton-X-100 Lösung (1 % (m/v) in Reinstwasser)
92 Methoden 10 min lang lysiert. Zuletzt wurde die i.z. Fluoreszenz (λexc = 485 nm; λemm = 530 nm) mit einem Fluoreszenz-Plattenleser (FluoroCount, Canberra-Packard) gemessen. Calcein-AM (acetoxymethyl) Esterase Calcein Abbildung 3-12: Umwandlungsreaktion von Calcein-AM in Calcein durch Esterasen ( ) Abbildung 3-13: Schematischer Ablauf des Calcein Akkumulations Assays (CAA) ( ) Eine etwaige P-gp-Inhibition der unterschiedlichen Stoffe wurde anhand der zugehörigen i.z. Fluoreszentintensität (i.z. FluoTest) im Vergleich zu Negativ- und Positivkontrolle beurteilt. So war
93 3 - Methoden 71 es möglich, den Wert der relativen Inhibition (RI) zu berechnen, der sich prozentual auf den 100 %-Wert von Verapamil bezog: RI Test = i.z.fluo Test i.z.fluo Verapamil 100; [%] (Gleichung 3-4) Gleichung 3-4: Berechnung der relativen Inhibition (RI) Setzt man die Fluoreszenzintensität der Negativkontrolle (reiner Transportpuffer) als 100 %, ließ sich zudem die Größe der relativen Fluoreszenz (RF) errechnen: RF Test = i.z.fluo Test i.z.fluo Control 100; [%] (Gleichung 3-5) Gleichung 3-5: Berechnung der relativen Fluoreszenz (RF) 3.9 BODIPY FL Prazosin Akkumulations Assay Auch dieser Assay quantifiziert die Akkumulation eines Fluoreszenzfarbstoffs in der Zelle, wobei diesmal die Aktivität des breast cancer resistance proteins (BCRP) untersucht wurde (s. Kap ). Wurden, wie unter 3.8 beschrieben, BCRP-aktive Caco-2-Zellen mit dem fluoreszierenden BCRP-Substrat BODIPY FL Prazosin (invitrogen, Life Technologies; Abb. 3-14) inkubiert, erhielt man nur eine relativ geringe i.z. Fluoreszenz. Eine Inhibition des Transporters war demnach durch eine deutliche Steigerung des Signals detektierbar. Abbildung 3-14: Struktur von BODIPY FL Prazosin ( )
94 Methoden Die Zellvorbereitung, das methodische Vorgehen und die anschließende Berechnung der relativen Fluoreszenz (RF) erfolgte analog zu 3.8: Caco-2-Zellen wurden in 96-Well-Platten eine Stunde mit den Testlipiden und 30 min mit dem etablierten BCRP-Hemmstoff Ko143 (1-100 µm) in Transportpuffer prä-inkubiert. Nach dem Absaugen wurde BODIPY FL Prazosin (1 µm) in Kombination mit der jeweiligen Testsubstanz in Transportpuffer zu den Zellen gegeben und für weitere 30 min unter Lichtschutz inkubiert (Shen et al. 2011). Waschen und Zelllyse wurden ebenfalls wie beim CAA durchgeführt Nicht-zelluläre Studien P-gp-ATPase Aktivitätsmessungen Die P-gp-ATPase stellt das entscheidende, energieliefernde Enzym des P-gp-Transporters dar, das den Effluxtransport von Substraten unter ATP-Verbrauch ermöglicht. Für diese Studien verwendete man Membranen von rekombinanten, Baculovirus-infizierten Insektenzellen, die das humane P-gp-Protein in sich trugen. Die P-gp-ATPase Aktivität wurde anhand der Freisetzung von anorganischem Phosphat (Pi) aus ATP mittels eines handelsüblichen Analysenkits von BD Gentest quantifiziert (Biosciences 2010). Gemäß der Herstellerangabe wurden die P-gp-Membranen (20 µg Well -1 ) in einer 96-Well-Platte mit den ausgewählten Testsubstanzen und MgATP (4 mm) in Assaypuffer für 20 min bei 37 C und 300 rpm inkubiert. Manche Lipide wurden zudem noch parallel mit dem ATPase-stimulierenden P-gp-Substrat/ - Inhibitor Verapamil (50 µm) aufgegeben. Jedes Experiment wurde in Gegenwart des nichtspezifischen ATPase-Inhibitors Natrium Orthovanadat (NaOV) wiederholt, um den Wert der sog. Vanadate-sensitive ATPase activity (Gl. 3-6) ermitteln zu können. Es handelte sich hier um den Anteil der ATPase-Aktivität, der durch NaOV hemmbar war. Die Reaktion wurde durch Zugabe von 30 µl SDS-Lösung (10 % (m/v) in Reinstwasser) gestoppt, das gebildete Pi mit Ammoniummolybdat und Zinkacetat komplexiert und mit Ascorbinsäure reduziert. Dies ergab eine blaue Verbindung, die photometrisch bei = 750 nm in einem Absorption-Plattenleser vermessen werden konnte. Die Vanadate-sensitive ATPase activity [nmol min -1 mg -1 an Protein] entsprach der Differenz des freigesetzten Pi in Ab- und Anwesenheit von NaOV, bezogen auf eine Phosphat-Standardkurve und berechnete sich nach folgender Gleichung:
95 NaOV sensitive ATPase activity = (P i P i(naov) ) t Inkub m P gp ; [nmol min -1 mg -1 ] (Gl. 3-6) 3 - Methoden 73 Gleichung 3-6: Berechnung der Vanadate-sensitive ATPase activity P i P i(naov) t Inkub m P-gp anorganischer Phosphatgehalt [nmol] anorganischer Phosphatgehalt unter Zugabe von NaOV [nmol] Inkubationsdauer mit MgATP [min] Membranmenge pro Well [mg] In silico Dockingstudien Die folgenden Arbeiten wurden von Xavier Lucas (Lehrstuhl für Pharmazeutische Bioinformatik, Albert-Ludwigs-Universität Freiburg) durchgeführt. Zuerst wurde mit der Prime 2.2 Software (Schrödinger Inc.) ein Homologiemodell für den humanen P-Glykoproteintransporter entwickelt. Als Ausgangsstruktur diente das kristallisierte Protein der Hausmaus (Mus musculus) in seiner offenen Konformation (PDB ID: 3G5U, Sequenzidentität im Transmembranbereich = 87 %). Die Modellqualität wurde anschließend mittels Verify3D ( ucla.edu/verify_3d/) beurteilt, so dass man ein umfassendes Atommodell erhielt, welches mit der Aminosäurensequenz des humanen P-gp übereinstimmte. Die Qualität wurde überdies durch das Docking bekannter, an P-gp bindende Moleküle bestätigt. Für die Dockingstudien wurde eine Ligandenbibliothek erstellt, die zum einen etablierte P-gp- Inhibitoren (Verapamil, Chinidin, Elacridar), zum anderen diverse Phospholipide aus den vorhergehenden in vitro Tests beinhaltete. Alle Substanzen wurden mit der Software LigPrep 2.4 (Schrödinger Inc.) bearbeitet, wobei der Protonierungszustand bei ph 6,5 und die Molekülenantiomerie und -tautomerie berücksichtigt wurden. Die molekularen Docking-Berechnungen innerhalb des humanen Transportermodells wurden mit der Software Glide 5.6 (Schrödinger Inc.) durchgeführt, unter Verwendung des extra Precision Scoring Algorithmus mit erweiteter Messpunktabfrage. Dies sollte die hohe Eigenflexibilität der Lipid-Seitenketten gebührend einbeziehen. Die Bestimmung des Glide Scores, einer Annäherung an die experimentelle Bindungsaffinität einer Substanz an bestimmte Proteinregionen, erfolgte im Baden-Württemberg- und Black Forest-CPU (central processing unit)-netzwerk ( bzw.
96 Methoden 3.11 In vivo Studien mit männlichen Wistar Ratten Die Tierversuche wurden in Zusammenarbeit mit Prof. Gert Fricker am Institut für Pharmazie und Molekuläre Biotechnologie, Lehrstuhl für Pharmazeutische Technologie und Biopharmazie (Karl- Rupprechts-Universität Heidelberg) durchgeführt. Die anschließende UPLC/MS/MS-Analytik der Serumproben erfolgte durch Dr. Jürgen Burhenne im analytisch-chemischen Labor des Universitätsklinikums Heidelberg, Abteilung Klinische Pharmakologie und Pharmakoepidemiologie Tiere Männliche Wistar Ratten (250 g) wurden unter Standardbedingungen für tagaktive Tiere gehalten und hatten gemäß den Tierschutzregelungen ad libitum Zugang zu Essen und Wasser (MacLean et al. 2010). Alle experimentellen Abläufe wurden zuvor von den zuständigen gesetzlichen Behörden genehmigt Pharmakokinetische Ritonavir-Studien Zuerst wurde der Transportmarker Ritonavir in DMSO gelöst (0,25 g ml -1 ) und mit HBSS ph 6,5 auf die gewünschte Konzentration verdünnt. Appliziert wurden 20 mg kg -1 ohne weitere Zusätze (Control) bzw. in Kombination mit dem etablierten P-gp-Hemmstoff PSC-833 (10 mg kg -1 ) oder mit dem zu testenden PL 8:0 PC (0,1 mm = 0,2 mg kg -1 ). Die über Nacht komplett ernüchterten Tiere wurden in einer Narkosekammer mit CO2-Gas vorübergehend anästhesiert und erhielten anschließend per Schlundsonde 1,0 ml der Probelösung in den Magenfundus (Abb. 3-16). Jeweils 30, 60, 120 und 180 min nach der Arzneistoffgabe erfolgte die retrobulbäre Blutentnahme von ca. 200 µl aus dem sich hinter dem Auge befindenden Venenplexus. Diese Proben wurden 5 min bei rpm zentrifugiert und das überstehende Serum bis zur Analytik bei -20 C gelagert.
97 3 - Methoden 75 Abbildung 3-16: Verwendung einer Schlundsonde in der Ratte ( ) Probenanalytik und -auswertung Die Ritonavirkonzentration der Serumproben wurde mittels Festphasenextraktion und Ultra Performance Liquid Chromatography (UPLC) gekoppelt an ein Tandem-Massenspektrometer (MS/MS) bestimmt. Hierfür verwendete man eine Waters Acquity UPLC und ein Waters Xevo TQ- S Massenspektrometer (Waters Corp.). Die Proben (je 0,1 ml) wurden nach einem Waters Standardverfahren für Festphasenextraktion aus 96-Well-Platten extrahiert (Waters µelution MCX), die Extrakte auf einer Waters BEH C18 1,7 µm UPLC Säule in einem Gradienten aus Ameisensäure, Ammoniak und Acetonitril aufgetrennt. Ritonavir wurde mittels eines Deuterium-gelabelten internen Standards und eines positiven Elektrospray-Tandem-Massenspektrometers quantifiziert. Gearbeitet wurde hier im multiple reaction monitoring mode mit einer unteren Nachweisgrenze von 1 pg ml -1 Serum. Die Genauigkeit lag stets im Bereich von 100 ± 15 % gepaart mit einer Präzision von < 15 % des Variationskoeffizienten (coefficient of variation = CV). Der Kalibrierbereich wies im Bereich von pg ml -1 Linearität auf (Korrelationskoeffizient > 0,9900) (Gehrig et al. 2007). Die Quantifizierung erfolgte mittels eines internen Ritonavirstandards, auf dessen Peakfläche die Peakfläche der Serumproben bezogen wurde. Ausgehend von den erhaltenen Konzentrationswerten und den Probenzeitpunkten wurde mittels der Trapezregel für jedes Tier die zugehörige Fläche unter der Plasmaspiegelkurve (area under the curve, AUC) im Bereich von 0 bis 180 min berechnet
98 Methoden (AUC0 bis 180 min). Setzte man nun den AUC0 bis 180 min Wert der Kontrolltiere gleich 1, so ergab sich für die anderen Gruppen der Wert der relativen AUC Statistische Analyse Wenn nicht anders erwähnt wurden sämtliche Studien in der Fallzahl n = 3 ausgeführt; CAA, Bodipy FL Prazosin Akkumulations Assay und CTG in n = 5-6. Die statistische Analyse nach Shapiro-Wilk zeigte, dass alle Werte einer Normalverteilung folgten. Die Signifikanz der Ergebnisse wurde mittels One-way ANOVA kombiniert mit dem Tukey und Levene Test ermittelt. P < 0,05 wurde als signifikant, P < 0,01 als hoch signifikant und P < 10-3 als höchst signifikant definiert, wenn Mittelwertunterschiede zwischen Proben- und jeweiligen Kontrollwerten untersucht wurden. Sämtliche statistische Auswertung erfolgte mit der Software OriginPro 8.1G (OriginLab).
99 4 Ergebnisse und Diskussion 77 4 Ergebnisse und Diskussion 4.1 Methodenoptimierung von P-gp-Transportstudien im Transwell- System Die in vitro Bioverfügbarkeit von Arzneistoffen wird standardmäßig in zellulären Transportstudien mittels eines 2-Kammersystems durchgeführt (s. Kap und 3.7). Gleichzeitig werden Interaktionen mit resorptionsmodulierenden Transportproteinen identifiziert, so dass die Effektivität von Transportinhibitoren getestet werden kann. Hierfür werden etablierte Transportmarker eingesetzt, die neben einer hohen Affinität zum jeweiligen Transportprotein auch noch andere Anforderungen erfüllen sollten um der Studie eine hohe Aussagekraft zu verleihen: Geringes eigenes Hemmpotential, ausreichendende Detektierbarkeit mittels etablierter Analytik, kommerzielle Verfügbarkeit, unproblematische experimentelle Handhabung (Löslichkeit, Toxizität, Stabilität, etc.) und vernachlässigbare Interaktion mit anderen Transportern, umgebenden Stoffen und Materialien. Unter Letzteres fällt auch die Tendenz, an Oberflächen im Versuchssystem zu adsorbieren, die gerade bei lipophilen Substanzen sehr ausgeprägt sein kann und eine verlässliche Versuchsauswertung immens erschwert. Daher sollte vor dem standardmäßigen Einsatz eines Markers dessen Diffusionsverhalten im zellfreien System untersucht werden Diffusionsversuche mit Ciclosporin A (CsA) In vorhergehenden Studien wurde im Rahmen dieser Methodik das Immunsuppressivum Ciclosporin A (CsA) als P-Glykoprotein (P-gp)-Transportmarker eingesetzt (Alkatout 2008). Daher wurde zunächst überprüft, ob sich dieser Wirkstoff für die weiterführenden Studien des vorliegenden Projekts eignen würde Variation des Filterinsertmaterials Wie unter beschrieben, werden die beiden Kompartimente des 2-Kammer-Transwell-Systems durch ein Insert mit einem Membranboden voneinander getrennt, auf dem die Zellen ausgesät werden. Herstellerabhängig kann diese Membran aus unterschiedlichen Materialien mit unterschiedlichen Porengrößen bestehen.
100 78 4 Ergebnisse und Diskussion Für die Vorversuche wurden folgende Varianten an 12-Well-Platten der Firma Corning ausgewählt: Tabelle 4.1-1: Übersicht der getesteten Filterinserte hinsichtlich Material und Porengröße Filtermaterial Porengröße [µm] Polyester (PE) 0,4 Polycarbonat (PC) 0,4 PC 3,0 Kollagen-beschichtetes Polytetrafluorethylen (COL-PTFE) 3,0 In Abbildung wird die detektierbare CsA-Gesamtstoffmenge zu Beginn mit der Stoffmenge verglichen, die nach dreistündiger Diffusion in resorptiver (abs; von apikal nach basolateral) bzw. sekretorischer Richtung (sec; von basolateral nach apikal) im Transportpuffer hank s balanced salt solution (HBSS) ph 6,5 nachgewiesen werden konnte. Bei allen Filtermaterialien lagen die Endwerte (grau) stets deutlich unterhalb der Anfangswerte (schwarz), was auf einen erheblichen Stoffmengenverlust durch Adsorption an Oberflächen hindeutet. Signifikant sind die Unterschiede vorrangig in sekretorischer Diffusionsrichtung, was auf das große Volumen und die große umgebende Oberfläche des basolateralen Donorkompartimens zurückzuführen sein könnte. Demnach war durch Variation des Filtermaterials keine Verbesserung der CsA-Diffusion zu erreichen. Vermutlich fand aber ein Großteil der Adsorption an die umgebenden Wellwände statt, die bei allen Produkten aus demselben Material (Polystyren) bestanden.
101 4 Ergebnisse und Diskussion 79 3,0 2,5 * Start 3 h CsA Stoffmenge [nmol] 2,0 1,5 1,0 0,5 * * * * 0,0 PE 0,4 µm abs PE 0,4 µm sec PC 0,4 µm abs PC 0,4 µm sec PC 3,0 µm abs PC 3,0 µm sec COL-PTFE 3,0 µm abs COL-PTFE 3,0 µm sec Abbildung 4.1-1: Absolute Gesamtstoffmenge (apikal und basolateral) an CsA zu Versuchsbeginn (Start; schwarz) und nach 3-stündiger Diffusion (grau) in absorptiver (abs) bzw. sekretorischer Richtung (sec) Verwendet wurden Filterinserte mit PE (Polyethylen)-, PC (Polycarbonat)- oder COL-PTFE (Kollagenbeschichtetes Polytetrafluorethylen)-Membranen von 0,4 bzw. 3,0 µm Porengröße; n = 3; Werte sind als Mittelwerte + Standardabweichung angegeben; * : Signifikanzniveau von 0,05 bezogen auf den zugehörigen Startwert
102 80 4 Ergebnisse und Diskussion Einsatz von fötalem Kälberserum (FCS) oder Humanplasma im Transportmedium Eine starke CsA-Adsorption wurde auch von Lee et al., 2001, festgestellt, wobei in dieser Publikation eine Beimischung von Humanplasma zum Transportmedium den Stoffmengenverlust reduzieren konnte (Lee et al. 2001). Auch der Einsatz von fötalem Kälberserum (FCS) wurde als Lösungsansatz diskutiert. Allerdings nahm bei Humanplasmabeimischungen von 25 % und 50 % (v/v) bzw. bei FCS-Zugaben von 10 % (v/v) zum Transportpuffer die Viskosität der Probenlösung so stark zu, dass die Probenentnahme extrem erschwert wurde (ohne Abb.). Zudem befürchteten wir ein hohes Interaktionspotential mit einem im Realfall vorhandenen Zelllayer, so dass die Aussagekraft über P-gp-Hemmeffekte deutlich vermindert wäre. Daher stellte diese Modifikation keine Option dar Prä-Inkubation der Filterinserte mit FCS Um die Viskositätsproblematik zu umgehen, wurden die Filterinserte mit Polyestermembran (0,4 µm Porengröße), wie unter beschrieben, für 24 h mit einem FCS- Transportpuffergemisch (10 %, (v/v)) prä-inkubiert. Diese Mischung wurde anschließend abgesaugt und nach CsA-Zugabe in reinem Puffer die Stoffmenge zu Beginn und nach 3 h Diffusion bestimmt. Wie Abb verdeutlicht, lagen die Anfangs- und Endewerte für beide Flussrichtungen zwar nicht signifikant, aber doch sichtbar auseinander. Somit verhinderte die FCS- Prä-Inkubation die CsA-Adsorption nur geringfügig Beschichtung der Filterinserte mit Humanplasmaprotein Ein anderer Lösungsansatz, der eine direkte Beimischung von Serum oder Plasma zum Transportmedium vermied, bestand in der Beschichtung der gesamten Insertoberfläche mit Humanplasmaprotein (HPP). Auch diese Abdichtungsvariante sollte die Adsorption von Wirkstoff möglichst stark zurückdrängen (Lee et al. 2001). Abb veranschaulicht, dass bei Anwendung der höchst konzentrierten HPP-Lösung (20 mg ml -1 ) bei beiden Diffusionsrichtungen der Stoffmengenverlust, d.h. die Differenz zwischen Start- und Endstoffmenge, deutlich reduziert, wenn auch nicht eliminiert werden konnte.
103 4 Ergebnisse und Diskussion 81 2,5 2,0 Start 3 h CsA Stoffmenge [nmol] 1,5 1,0 0,5 0,0 PE 0,4 µm FCS PI abs PE 0,4 µm FCS PI sec PC 0,4 µm HP-coated abs Filtermaterial mit Vorbehandlung PC 0,4 µm HP-coated sec Abbildung 4.1-2: Absolute Gesamtstoffmenge (apikal und basolateral) an CsA zu Versuchsbeginn (Start; schwarz) und nach 3-stündiger Diffusion (grau) in absorptiver (abs) bzw. sekretorischer Richtung (sec) Verwendet wurden Filterinserte mit PE (Polyethylen)- oder PC (Polycarbonat)-Membranen von 0,4 µm Porengröße, die mit FCS prä.inkubiert (FCS PI) oder mit Humanplasma beschichtet wurden (HP-coated, 20 mg ml -1 Proteinanteil); n = 3; Werte sind als Mittelwerte + SD angegeben
104 82 4 Ergebnisse und Diskussion Diffusionsversuche mit Digoxin Alternativ zu CsA wurden weitere Diffusionsversuche mit dem Herzglykosid Digoxin (Dig) als P-gp-Transportmarker durchgeführt. Als Filtermaterial wurde hier Polycarbonat mit 0,4 µm Porengröße gewählt. Für diesen Wirkstoff entsprachen sich Start- und Endstoffmengen nahezu (Abb ), was auf eine vernachlässigbare Adsorption schließen lässt, ohne dass aufwändige Insertvorbehandlungen nötig gewesen wären. Der absolute Stoffmengenverlust bewegte sich hier bei Berücksichtigung der Standardabweichung um 0. Im Gegensatz dazu lagen bei CsA im identischen Transwell-System nach 3 h Diffusion 0,1 nmol (resorptiv), bzw. 1,0 nmol (sekretorisch) weniger Gesamtstoffmenge vor. Dies entsprach einem Verlust von ca. 20 bzw. 40 %. 3,5 3,0 * Start 3 h absolute Stoffmenge [nmol] 2,5 2,0 1,5 1,0 0,5 0,0 CsA abs CsA sec Digoxin abs Digoxin sec Diffusionsrichtung Abbildung 4.1-3: Absolute Gesamtstoffmenge (apikal und basolateral) an CsA oder Digoxin zu Versuchsbeginn (Start; schwarz) und nach 3-stündiger Diffusion (grau) in absorptiver (abs) bzw. sekretorischer Richtung (sec) Verwendet wurden Filterinserte mit PC-Membranen von 0,4 µm Porengröße; n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den zugehörigen Startwert
105 4 Ergebnisse und Diskussion Entscheidung für Digoxin als Standard-P-gp-Substrat in Transportstudien Unter Berücksichtigung der durchgeführten Diffusionsstudien und mit dem Wissen, dass Digoxin von der Food Drug Administration (FDA) als Standard-P-gp-Markersubstanz in Transportstudien eingesetzt wird, wurde diese Substanz für alle weiteren P-gp-Inhibitorstudien im Transwell-System ausgewählt (LaRoche 2006). Zudem zeigt Digoxin eine hohe P-gp-Spezifität, ohne dabei selbst P-gp-inhibitorische Eigenschaften zu besitzen, weshalb es seit mehr als einem Jahrzehnt ein etabliertes in vitro Versuchssubstrat darstellt (Fromm et al. 1999, Rautio et al. 2006). CsA zeigte nicht nur eine hohe unspezifische Adsorptionstendenz gegenüber jeglichen Oberflächen, sondern besitzt neben P-gp-Substrat- auch starke eigene P-gp-Hemmeigenschaften, die die Beurteilung der inhibitorischen Potenz anderer, parallel inkubierter Substanzen deutlich erschweren würden (Loor et al. 2002, Loscher & Potschka 2005). 4.2 Verifizierung der P-gp-Expression per Western Blot Die in vitro Untersuchungen P-gp-abhängiger Effekte wurden in drei verschiedenen Zelllinien durchgeführt: Zum einen wurde die humane Colon-Karzinomepithel-Zelllinie Caco-2 verwendete, die nach mehrtägiger Kultivierung bereits P-gp in ihrer apikalen Membran exprimiert und nach drei Wochen auf semipermeablen Filterinserten einen enterozytenähnlichen Monolayer ausbildet (Levy et al. 1995, Hubatsch et al. 2007). Die madin darby canine kidney Zelllinie (MDCK) Typ II, die aus dem Nierenepithel des Hundes isoliert wird, fand zum einen als Wildtyp (WT) mit lediglich basaler, nicht-humaner P-gp-Expression Verwendung. Zum anderen wurde die mit humanem mdr 1 (multi drug resistance type 1)-Gen transfizierte Variante eingesetzt, die humanes P-gp überexprimiert. Zur Überprüfung dieser Expressionsmuster wurden zunächst Gesamtzelllysate der jeweiligen Zelllinien gewonnen und das unlösliche Zellpellet mit Ultraschall nachbehandelt, um das membranständige P-gp quantitativ herauszulösen. Zudem wurden die Proben vor dem Gelauftrag nicht gekocht, sondern lediglich bei milden 40 C aufgeschlossen. Nach Auftrennung im SDS- Page-Gel und Blotting der Banden auf eine Nitrocellulosemembran erfolgte die Primärdetektion mit dem murinen C219-Anti-P-gp-Anitkörper (Anderle et al. 1998), die Sekundärdetektion mit einem Anti-Maus-HRP (horse radish peroxidase)-gekoppelten Antikörper, dessen Bindung anhand eines Chemoluminszenz-Signals gemessen werden konnte. Abbildung zeigt die Bandenintensitäten im Bereich von ca kda. P-gp hat ein durchschnittliches Molekulargewicht von 170 kda und ist in Reihe 2 überhaupt nicht und in
106 84 4 Ergebnisse und Diskussion Reihe 3 nur sehr schwach sichtbar. Dies entsprach den Erwartungen, da beide Proben vom MDCKII WT stammten, der P-gp nur in geringem Ausmaß exprimieren sollte. Reihe 4 entsprach 15 µl Gesamtzelllysat des mdr1-transfizierten Typus und wies eine schwache P-gp-Bande auf, wohingegen bei doppelter Proteinmenge (5) ein deutliches Signal erzielt wurde. Somit konnte eine Transfektion mit humanem mdr1-gen bestätigt werden. Reihe 6 und 7 visualisieren die P-gp- Expression in Caco-2 nach dreiwöchiger Kultivierung auf Transwell-Filterinserten. Hier ist sowohl bei 15 als auch bei 30 µl Probenvolumen eine deutliche Bande im betreffenden Größenbereich sichtbar. Zusammenfassend wurde bestätigt, dass sowohl der laborinterne Caco-2-Stamm (nach ausreichender Kultivierung im verwendeten Testsystem), als auch der externe MDCKII mdr1- Stamm deutlich P-gp exprimierten. Der ebenfalls von extern erworbene MDCKII Wildtyp-Stamm wies selbst bei hoher Probenmenge nur Spuren von Protein im P-gp-Größenbereich auf und konnte somit im direkten Vergleich mit dem mdr1-stamm als Kontrollzelllinie für P-gp-spezifische Effekte dienen. 180 kda 130 kda P-gp (~ 170 kda) 1 MW-Marker 2 MDCKII WT: 15 µl Gesamtlysat 3 MDCKII WT: 30 µl Gesamtlysat 4 MDCKII mdr1: 15 µl Gesamtlysat 5 MDCKII mdr1: 30 µl Gesamtlysat 6 Caco-2: 15 µl Gesamtlysat 7 Caco-2: 30 µl Gesamtlysat Abbildung 4.2-1: Western Blot Analytik von Gesamtzelllysaten aus MDCKII WT (Wildtyp), MDCKII mdr1 und Caco-2 Die Caco-2 Zellen wurden zuvor drei Wochen auf Polycarbonat-Transwell-Inserten kultiviert. P-Glykoprotein wurde nach Bindung des monoklonalen C219-Antikörpers und einer Chemilumineszenz-Reaktion mit einem HRP-gekoppelten Sekundär-Antikörper visualisiert.
107 4 Ergebnisse und Diskussion In vitro Phospholipidscreening auf P-gp-inhibitorische Eigenschaften Auswahl und Charakterisierung von Phospholipidzubereitungen Vorgängerarbeiten haben bereits darauf hingewiesen, dass Phospholipide (PL) in vitro einen inhibitorischen Einfluss auf den Effluxtransporter P-gp haben könnten (Alkatout 2008). Somit war die erste Zielsetzung dieser Arbeit, ein allgemeines PL-Screening durchzuführen, in dem der Einfluss unterschiedlicher Kopfgruppen und Fettsäure (fatty acid, FA)-Reste untersucht werden sollte. Bei der hydrophilen Kopfgruppe wurden sowohl die negativ geladenen Phosphatidylglycerole (PG) und Phosphatidylserine (PS) ausgewählt, als auch die neutral geladenen Phosphatidylcholine (PC) und Phosphatidylethanolamine (PE). Bezüglich der FA-Reste wurde unterschieden zwischen gesättigten Ketten, die im Bereich von 6 bis 18 C-Atomen lagen und meist symmetrisch in einem PL-Molekül angeordnet waren, d.h. mit zwei identischen FA-Ketten an C1 und C2 des Glycerolgerüst. In der PC-Gruppe wurden auch diverse ungesättigte symmetrische bzw. asymmetrische Lipide eingesetzt, wobei bei letzteren zwei unterschiedliche (z.t. gesättigt und ungesättigt) FA-Reste in einem Molekül vorlagen. Die Lipide wurden in dieser Arbeit folgendermaßen benannt: Die vorhandenen Fettsäuren wurden nach dem Schema Anzahl C- Atome: Anzahl Doppelbindungen abgekürzt, z.b. die Stearinsäure als 18:0, die Docosahexaensäure als cis-22:6 mit Bezug auf die sterische Orientierung der Doppelbindungen. Handelte es sich um ein symmetrisches Lipid mit PC-Kopfgruppe, verwendete man den Terminus 18:0 PC. Bei einem unsymmetrischen Lipid wurden die beiden unterschiedlichen FA-Reste hintereinander gelistet und mit / getrennt, z.b. 14:0/ cis-18:1 PC. Durch diese vielfältigen Variationen sollte ein möglichst großes Lipidspektrum mit möglichst unterschiedlichen physiko-chemischen Eigenschaften (Tab ) abgedeckt werden. Außerdem wurde der Einfluss ausgewählter kommerzieller Lipidmischungen getestet, die vielseitig in der pharmazeutischen und lebensmittelchemischen Industrie eingesetzt werden. So ergab sich die in Tabelle gelistete PL-Auswahl. Die durch Extrusion hergestellten Lipidzubereitungen in HBSS ph 6,5 wurden zunächst mittels Photonenkorrelationsspektroskopie (photon correlation spectroscopy, PCS) auf durchschnittliche Partikelgröße (Messgröße: hydrodynamischer Durchmesser) und Partikelgrößenverteilung (Messgröße: polydispersity index; PDI) untersucht. Zudem wurden die Lipidfilme auf ihre Rehydratisierbarkeit in Puffer und die
108 86 4 Ergebnisse und Diskussion entstandenen Formulierungen visuell auf ihre Gleichförmigkeit hin beurteilt. Diese Ergebnisse wurden ebenfalls in Tabelle zusammengefasst Beurteilung der Rehydratisierbarkeit und visuelle Prüfung Mehrere Lipidfilme mit PE- oder PS-Kopfgruppe (8:0, 12:0 bis 18:0 PE und PS 12:0), aber auch die Lipoid -Präparate Phospholipon R LPC 20 und S LPC 80, waren trotz ihres Lyso-Charakters sehr schlecht hydratisierbar und ergaben makroskopisch grob-disperse Systeme, was eine nachfolgende Extrusion durch Polycarbonatmembranen stark erschwerte bzw. ausschloss. Partiell wurde hier nur eine Filtration durch 0,22 µm Porengröße vorgenommen. Jedoch kam ein Großteil dieser Derivate nicht für weitere in vitro Tests in Frage. Die visuelle Beurteilung der PC- und PG- Zubereitungen war ausreichend bis gut, so dass diese ohne Einschränkung weiter verarbeitet und getestet werden konnten Partikelgrößenbestimmung per Photonenkorrelationsspektroskopie (PCS) Die meisten mittelkettigen PL ergaben Suspensionen mit einer sehr breiten Partikelgrößenverteilung (PDI > 0,3) und großen Unterschieden bzgl. ihres hydrodynamischen Durchmessers (Tab ). Eine Erklärung könnten die relativ hohen kritischen Mizellbildungskonzentrationen (critical micelle concentration, CMC) von Lipiden mit acht C-Atomen sein (Tab ) (Cevc 1993, Avanti(R) Polar Lipids 1999), aber auch elektrostatische und/ oder geometrische Effekte spielen hierbei eine Rolle: Die negative Ladung der PG-Gruppe führte zu einer elektrostatischen Abstoßung zwischen den Lipidmolekülen, was der Ausbildung stabiler Vesikel entgegenstand. So lagen selbst die längerkettigen Derivate ( 14:0) mit einem PDI 0,4 größentechnisch sehr heterogen vor. Zum Anderen bildete der voluminöse PS-Kopf in Kombination mit kurzen FA-Resten kleine Strukturen oder Mizellen mit gespannter Membrankurvatur aus, die eine ausgeprägte Neigung zur Bildung von größeren Aggregaten besitzen. Dies konnte ebenfalls anhand der breiten Partikelgrößenverteilungen dieser Zubereitungen festgestellt werden (PDI = 0,6). Bei solch stark heterogenen Formulierungen stellte die Kryo-Transmissionselektronenmikroskopie (Kryo-TEM) eine passendere Charakterisierungsmethodik dar, da hier die genaue Aggregatbeschaffenheit visualisiert werden konnte (Kap ). Der per PCS bestimmte hydrodynamische Durchmesser ist nur dann repräsentativ und aussagekräftig, wenn die Formulierung insgesamt homogen vorliegt, d.h. einen PDI von 0,1 bis maximal 0,2 aufweist (Baalousha & Lead 2012). Alle PC-Derivate mit Kettenlängen zehn C-Atomen (gesättigt und ungesättigt) bildeten eng verteilte Liposomenzubereitungen (PDI 0,2) von ca. 100 nm hydrodynamischem Durchmesser.
109 4 Ergebnisse und Diskussion 87 Bei den Lipoid -Lipidmischungen reichte das Spektrum von klein und homogen (S 75) bis moderat verteilt (S 45). R LPC 20 und S LPC 80 lagen als Lyso-PC vermutlich zu einem großen Anteil gelöst vor. Ersteres ergab jedoch trotzdem eine Zubereitung von mittlerer Dispersität, wohingegen S LPC 80 eine extrem hohe Partikelgrößenverteilung aufwies, was die PCS-Methodik unbrauchbar machte (Baalousha & Lead 2012). Diese Datenlage zeigte, dass ein möglicher Lipid-induzierter in vitro Effekt in dualer Hinsicht diskutiert werden musste: Sowohl die Eigenschaften des singulären PL-Moleküls als auch Vesikelgröße oder -größenverteilung innerhalb der Formulierung konnten hier als Einflussfaktoren gelten.
110 88 4 Ergebnisse und Diskussion Tabelle 4.3-1: Hydrodynamischer Durchmesser, PDI und visuelle Beurteilung der PL-Formulierungen Lipidklasse Derivat Hydrodynamischer Durchmesser [nm] PDI Visuelles Urteil Kommerzielle Lipidmischungen (Lipoid ) S ,1 ± 11,82 0,356 + S ,0 ± 0,635 0, R LPC ,5 ± 119,5 0,370 +/- S LPC 80 n.a. n.a. - Gesättigte, symmetrische Phosphatidylcholinderivate (x:0 PC) 6:0 PC 795,8 ± 80,97 0, :0 PC 238,1 ± 31,3 0, :0 PC 121 ± 33,7 0, :0 PC 87,0 ± 0,5204 0, :0 PC 102,8 ± 0,4619 0, :0 PC 115,3 ± 39,22 0, :0 PC 125,3 ± 17,27 0, Gesättigte, symmetrische Phosphatidylglycerolderivate (x:0 PG) 6:0 PG 444,8 ± 29,54 0, :0 PG 530,1 ± 201,5 0, :0 PG n.a. n.a. + 12:0 PG 249,1 ± 112,4 0, :0 PG 496,2 ± 105,8 0, :0 PG 305,8 ± 233,3 0, :0 PG n.a. n.a. +
111 4 Ergebnisse und Diskussion 89 Lipidklasse Derivat Hydrodynamischer Durchmesser [nm] PDI Visuelles Urteil Gesättigte, symmetrische Phosphatidylethanolaminderivate (x:0 PE) 6:0 PE n.a. n.a. ++ 8:0 PE n.a. n.a. - 10:0 PE 6617 ± 921,4,4 0, :0 PE n.a. n.a. - 14:0 PE n.a. n.a. - 16:0 PE n.a. n.a. +/- 18:0 PE n.a. n.a. +/- Gesättigte, symmetrische Phosphatidylserinderivate (x:0 PS) 6:0 PS n.a. n.a. ++ 8:0 PS 574,8 ± 313,5 0, :0 PS 519,7 ± 116,6 0, :0 PS n.a. n.a. - 14:0 PS n.a. n.a. - 16:0 PS n.a. n.a. - 18:0 PS n.a. n.a. - Ungesättigte, symmetrische Phosphatidylcholinderivate (z-x:y PC) 9trans-18:1 PC = trans-18:1 PC 9cis, 12cis, 15cis-18:3 PC = cis-18:3 PC 4cis, 7cis, 10 cis, 13cis, 16cis, 19cis-22:6 PC = cis-22:6 PC 157,6 ± 3,092 0, ,6 ± 4,283 0, ,8 ± 1,926 0,086 ++
112 90 4 Ergebnisse und Diskussion Lipidklasse Derivat Hydrodynamischer Durchmesser [nm] PDI Visuelles Urteil Ungesättigte, asymmetrische Phosphatidylcholinderivate (z 1-x 1:y 1/ z 2-x 2:y 2 PC) 14:0/ 9cis-18:1 PC = 14:0/ cis-18:1 PC 16:0/ 9cis, 12cis, 15cis-18:3 PC = 16:0/ cis-18:3 PC 18:0/ 4cis, 7cis, 10cis, 13cis, 16cis, 19cis-22:6 PC = 18:0/ cis-22:6 PC 139,7 ± 1,858 0, ,6 ± 6,502 0, ,6 ± 4,972 0, Lipidcharakterisierung: x: FA-Kettenlänge; y: Anzahl der Doppelbindungen; z: Orientierung der Doppelbindung(en) symmetrisch = zwei identische FA-Reste; asymmetrisch = zwei unterschiedliche FA-Reste Hydrodynamischer Durchmesser und PDI sind als Mittelwert ± SD aus drei Messungen (21 Einzelläufe) angegeben Visuelle Beurteilung angegeben als (++): gut; (+): akzeptabel; (+/-): ausreichend; (-): ungenügend; weitere Testungen wurden nur mit Formulierungen durchgeführt, die mit mind. (+/-) bewertet wurden n.a.: PCS-Daten nicht angegeben wg. mangelnder Messwerte oder ungenügender Aussagekraft (Baalousha & Lead 2012)
113 4 Ergebnisse und Diskussion Visualisierung ausgewählter PL-Formulierungen mittels Kryo- Transmissisionselektronenmikroskopie Da bereits die PCS-Daten äußerst vielschichtig ausfielen, war anzunehmen, dass trotz gleicher Herstellungsmethodik und z.t. übereinstimmenden Strukturelementen die in den jeweiligen PL- Zubereitungen vorliegenden Aggregate von sehr unterschiedlicher Gestalt waren. Daher wurde für einige exemplarische Proben eine detailliertere Charakterisierung mittels der Kryo- Transmissionselektronenmikroskopie (Kryo-TEM) vorgenommen. Anhand dieser Aufnahmen war feststellbar, dass bei einer Kettenlänge von sechs C-Atomen vermutlich keine bis kaum klassische Vesikelbildung möglich war. So lag 6:0 PE (PL-Conc. = 3 mm; Abb ) augenscheinlich komplett molekular gelöst vor. Der zugehörige intensitätsgewichtete hydrodynamische Durchmesser und der PDI wiesen zudem bei geringer Zählrate so große Standardabweichungen auf, dass die PCS-Daten nicht ausgewertet werden konnten (Tab ). 6:0 PS bildete in fünfmal höherer Lipidkonzentration Aggregate von nur 10 nm Durchmesser, die sich wiederum zu größeren Trauben zusammenlagerten (PL-Conc. = 15 mm; Abb ). Dies erklärt den extrem hohen PDI dieser Formulierung, der daher auch nicht als Zahlenwert in Tabelle gelistet wurde. Die ausladende Struktur der PS-Kopfgruppe könnte zusätzlich der Bildung von größeren Vesikeln im Wege gestanden haben. Ein Lipid mit um zwei C- Atomen längeren FA-Ketten und einer kompakten PC-Kopfgruppe ergab erwartungsgemäß deutliche, unilamellare Liposomen von nm Durchmesser (8:0 PC; PL-Conc. = 20 mm; Abb ). Allerdings bewirkte dieser breite, auch klar in den Abbildungen erkennbare Größenbereich erneut einen hohen PDI (0,460), der die Interpretation der PCS-Daten erschwerte. Das um zwei weitere KW-Einheiten verlängerte Derivat 10:0 PC formierte sich bei Einsatz von 11 mm zu prägnanten, unilamellaren Vesikeln mit einer deutlich engeren Verteilung (PDI = 0,263; Abb ). Dieses Phänomen sprach dafür, dass sich längere lipophile Reste positiv auf eine stabile und einheitliche Liposombildung auswirkten. Exemplarisch für ein PG-Lipid mit negativ geladener Kopfgruppe wurde 12:0 PG mikroskopiert (PL-Conc. = 11 mm; Abb ): Wie alle PG-Derivate wies auch dieses einen hohen PDI von 0,435 auf, der durch die stark unterschiedlichen Vesikelradii auch visuell nachweisbar war. Die Abbildungen dieser kurz- und mittelkettigen PL veranschaulichen, dass PCS-Daten allein, v.a. bei hohen Dispersitätsindeces oft nur ungenügenden Aufschluss über die genaue Beschaffenheit einer PL-Probe gaben. Eine heterogene Formulierung konnte sowohl unregelmäßige Zusammenschlüsse undefinierter Lipidaggregate (6:0 PS in Abb ), aber auch klar geformte,
114 92 4 Ergebnisse und Diskussion unilamellare Vesikel (PC-, PG-Derivate in Abb bis 5) enthalten, was aber erst per Kryo-TEM nachweisbar war. Im Falle der langkettigen, ungesättigten PC-Derivate cis-18:3 PC und cis-22:6 PC entsprachen die Aufnahmen den Erwartungen: Die zugehörigen PDI-Werte von < 0,1 ließen auf homogen vorliegende Vesikel schließen, was in Abbildung und bestätigt wurde. Diese waren ebenfalls vornehmlich unilamellar aufgebaut. Abb : 6:0 PE (PL-Conc. = 3 mm) Abb : 6:0 PS (PL-Conc. = 15 mm) Abb : 8:0 PC (PL-Conc. = 20 mm) Abb : 10:0 PC (PL-Conc. = 11 mm)
115 4 Ergebnisse und Diskussion 93 Abb : 12:0 PG (PL-Conc. = 11 mm) Abb : cis-18:3 PC (PL-Conc. = 10 mm) Abb : cis-22:6 PC (PL-Conc. = 9 mm) Abbildungen bis 4.3-7: Kryo-TEM-Aufnahmen ausgewählter PL-Zubereitungen in HBSS ph 6,5 Herstellung mittels Filmmethode, anschließender Rehydratisierung in Puffer und 51-malige Extrusion durch Polycarbonatmembranen (Porengröße von 80 nm).
116 94 4 Ergebnisse und Diskussion Zytotoxizität Der CellTiterGlo Test dient der Bestimmung des zytotoxischen Potentials von Testsubstanzen anhand des intrazellulären Levels des Energielieferanten Adenosintriphosphat (ATP). Hierfür wurden die Zellen nach Inkubation mit der Testsubstanz mit Luciferin und thermostabiler Luciferase umgesetzt. Das je nach Zellviabilität vorhandene ATP konnte durch ein proportionales Lumineszenzsignal quantifiziert und mit einer Puffer-behandelten Kontrolle verglichen werden. Alle PL, die in HBSS ph 6,5 formuliert eine für weitere Studien ausreichende Qualität aufwiesen (Tab ), wurden in Gegenwart der später verwendeten Transportmedien (HBSS ph 6,5 / modified Fassif ± PL A2, Kap ) in Caco-2, MDCKII WT und MDCKII mdr1 auf ihre Zellverträglichkeit getestet. Die hier eingesetzten PL-Konzentrationen richteten sich nach der Lipidmenge, die in den nachfolgenden Zellversuchen verwendet werden sollte. Die Zellviabilität wurde durch keine Substanz beeinträchtigt, da alle Proben ein mit der unbehandelten Kontrolle vergleichbares Signal erzielten (ohne Abb.) Zusammenfassung und Diskussion: Auswahl der PL-Derivate für das in vitro Screening Im in vitro Screening auf P-gp-inhibitorische Eigenschaften wurden die PL-Derivate untersucht, die eine visuell ausreichende Zubereitungsqualität aufwiesen, d.h. in Tabelle mind. das Urteil +/ erhielten. Somit wurden extrem grob-disperse Suspensionen, deren Lipidfilm nur unzureichend in Puffer rehydratisiert werden konnten, aus den weiterführenden Studien ausgeschlossen. Dies betraf ein kommerzielles Lipidgemisch (S LPC 80), mehrere mittelkettige PE-Derivate und alle langkettigen PS-Lipide. Uneingeschränkt weiteruntersucht wurden sämtliche Phosphatidylcholine (gesättigt und ungesättigt) und Phosphatidylglycerole. Die Qualität und Aussagekraft der PCS- Daten spielte bei der PL-Auswahl keine Rolle: Sowohl hochgradig homogene Liposomen (ungesättigte PC-Derivate), als auch sehr heterogene Formulierungen (PC, PG, PE, PS) fanden Anwendung. Schließlich sollte gerade der Einfluss unterschiedlicher Vesikelgrößen und Aggregatstrukturen mit berücksichtigt werden. Da zudem gemäß kein Derivat zytotoxische Eigenschaften in den verwendeten Zelllinien aufwies, musste keine weitere Selektion vorgenommen werden. Eine Zusammenstellung der PL, die in vitro auf P-gp-Inhibition gescreent werden sollten, erfolgt in Tabelle Für eine spätere Diskussionen etwaiger Effekte ist, sofern verfügbar, die zugehörige CMC und Phasenübergangstemperatur (phase transition temperature, PTT) angegeben.
117 4 Ergebnisse und Diskussion 95 Tabelle 4.3-2: CMC und PTT der in vitro getesteten PL (sofern verfügbar) (Cevc 1993, Zerouga et al. 1995, Avanti(R) Polar Lipids 1999) Lipidklasse Derivat Kritische Mizellbildungskonzentration (CMC) [mol L -1 ] Phasenübergangstemperatur (PTT) [ C] Kommerzielle Lipidmischungen (Lipoid ) S 45 n.a. n.a. S 75 n.a. n.a. R LPC 20 n.a. n.a. Gesättigte, symmetrische Phosphatidylcholinderivate 6:0 PC 1, n.a. 8:0 PC 2, n.a. 10:0 PC n.a. 12:0 PC :0 PC :0 PC 4, :0 PC n.a. 55 Gesättigte, symmetrische Phosphatidylglycerolderivate 6:0 PG n.a. n.a. 8:0 PG 1, n.a. 10:0 PG 4, n.a. 12:0 PG 1, :0 PG 1, :0 PG n.a :0 PG n.a. 55
118 96 4 Ergebnisse und Diskussion Lipidklasse Derivat Kritische Mizellbildungskonzentration (CMC) [mol L -1 ] Phasenübergangstemperatur (PTT) [ C] Gesättigte, symmetrische Phosphatidylethanolaminderivate 6:0 PE n.a. n.a. 10:0 PE n.a. n.a. 16:0 PE n.a :0 PE n.a. 74 Gesättigte, symmetrische Phosphatidylserinderivate 6:0 PS n.a. n.a. 8:0 PS 2, n.a. 10:0 PS 9, n.a Ungesättigte, symmetrische Phosphatidylcholinderivate trans-18:1 PC n.a. 12 cis-18:3 PC n.a cis-22:6 PC n.a. - 68,4 Ungesättigte, asymmetrische Phosphatidylcholinderivate 14:0/ cis-18:1 PC n.a. n.a. 16:0/ cis-18:3 PC n.a. n.a. 18:0/ cis-22:6 PC n.a. - 7 n.a.: nicht verfügbar
119 4 Ergebnisse und Diskussion Digoxintransportstudien in Caco-2-Zellen in HBSS ph 6,5 Die ausgewählten PL (Tab ) wurden zuerst mittels Transportstudien in der humanen, enterozytenähnlichen Zelllinie Caco-2 auf P-gp-Interferenz getestet. Diese Zelllinie ist auch in der Arzneimittelentwicklung der pharmazeutischen Industrie als in vitro Tool etabliert um Transportprotein-abhängige Drug-Drug-Interaktionen aufzudecken (LaRoche 2006). Als Messgröße für das Ausmaß der Lipid-induzierten P-gp-Inhibition wurde der Flux des P-gp- Substrates Digoxin verwendet. Eine Hemmung wurde entweder anhand einer gesteigerten Resorption und / oder einer verminderten Sekretion durch den Zelllayer hindurch angezeigt (Djuv & Nilsen 2008). Gleichzeitig musste gewährleistet sein, dass der transepitheliale elektrische Widerstand (transepithelial electrical resistance, TEER) der eingesetzten Zellschichten vor und nach dem Experiment einen ausreichend hohen Wert aufwies (mind. 80 % der pufferbehandelten Kontrolle), um unerwünschten parazellulären Stofftransport durch angegriffene tight junctions auszuschließen. Als Transportmedium wurde in dieser ersten Versuchsreihe der Standardpuffer HBSS ph 6,5 verwendet, um mediumabhängige Einflüsse möglichst gering zu halten. Wie in den Abbildungen bis erkennbar, lag der Digoxin Papp Quotient (= Papp Ratio) der unbehandelten Caco-2-Zellen (Control) stets über dem Wert von 17, d.h. es fand ein ausgeprägter asymmetrischer Stofftransport statt, bei dem der sekretorische den resorptiven (= absorptiven) Flux um das mind. 17-fache überschritt. Dieses Faktum, zusammen mit dem molekularbiologischen P-gp-Nachweis per Western Blot (Kap. 4.2) belegte eine ausreichende Expression des zu untersuchenden Transporters P-gp. Zudem konnte diese Transportasymmetrie durch Prä-Inkubation mit dem etablierten P-gp-Inhibitor Verapamil nahezu aufgehoben werden (Tab ).
120 98 4 Ergebnisse und Diskussion Kommerzielle PL-Mischungen aus der pharmazeutischen und Lebensmittelindustrie Wurden Caco-2-Layer 30 min mit Zubereitungen der drei ausgewählten kommerziellen Lipidmischungen S 45, S75 bzw. R LPC 20 prä-inkubiert, so konnte bei der niedrigsten eingesetzten PL-Konzentration von 0,05 mm keine Veränderung des Digoxintransportes erzielt werden. Wurde die Menge um das Doppelte oder um das 4-fache erhöht, so erhöhte sich gleichzeitig auch die Papp Ratio, bei S75 sogar um 100 % (Abb ). Dieses Verhalten kam durch eine gegenüber der Kontrolle erniedrigte Resorption bei gleichbleibender Sekretion zu Stande (ohne Abb.). Eine mögliche Erklärung wäre, dass die apikal applizierten Lipide lipophile Wechselwirkungen mit dem ebenfalls apikal zugegebenen, hydrophoben Digoxin (Uekama et al. 1983) eingingen und so den Marker vom Zelldurchtritt abhielten. Dies ist aber rein spekulativ, so dass wir lediglich eine Interaktion dieser PL mit P-gp sicher ausschließen können. Digoxin P app Ratio [sec/abs] Control S 45 S 75 Phospholipon R LPC 20 Control 0.05 mm 0.1 mm 0.2 mm 0.05 mm 0.1 mm 0.2 mm 0.05 mm 0.1 mm 0.2 mm Abbildung 4.3-8: Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control; schwarz) und nach 30-minütiger Prä-Inkubation mit unterschiedlichen PL-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben
121 4 Ergebnisse und Diskussion Gesättigte, symmetrische Phosphatidylcholin (PC)-Derivate Die Prä-Inkubation mit gesättigten, symmetrischen (= zwei identische FA-Reste) PC-Lipiden führte im Falle von 6:0, 8:0 und 10:0 PC (0,1 mm) zu einer höchst signifikanten Inhibition des P-gpvermittelten Digoxintransports. Sie reduzierten die Papp Ratio um 75 % bzw. 60 % im Vergleich zur unbehandelten Kontrolle (Abb ). Lediglich 8:0 PC bewirkte hierbei eine leichte Schädigung der Zellschicht, da es den TEER-Wert auf 70 % des Kontrollwertes senkte. Für alle anderen Derivate konnte vollständige Integrität gewährleistet werden (Tab ). Alle längerkettigen Compounds zeigten selbst in dreifacher Menge keinerlei Effekt auf den Digoxintransport. Da in dieser Substanzklasse eindeutig die Formulierungen mit der heterogensten Größenverteilung die besten Resultate erbrachten, konnte kein spezifischer Größenbereich oder Aggregationszustand für die Effluxinhibition identifiziert werden. Digoxin P app Ratio [sec/abs] Caco-2 *** *** *** Control 6:0 PC 0.1 mm 8:0 PC 0.1 mm 10:0 PC 0.1 mm 12:0 PC 0.1 mm 14:0 PC 0.1 mm 16:0 PC 0.3 mm 18:0 PC 0.3 mm Abbildung 4.3-9: Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit unterschiedlichen gesättigten PC-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bezogen auf den Kontrollwert
122 100 4 Ergebnisse und Diskussion Ungesättigte, (a)symmetrische Phosphatidylcholin (PC)-Derivate Zudem wurde der Einfluss diverser ungesättigter, symmetrischer, aber auch asymmetrischer (= zwei unterschiedliche FA-Reste) PC-Derivate auf den Digoxin-Efflux getestet. Mehrere Substanzen zeigten mögliche inhibitorische Eigenschaften, nämlich Linolensäure (cis-18:3)-pc, Docosahexaensäure (cis-22:6)-pc und das Derivat bestehend aus Stearinsäure und Docosahexaensäure (18:0/ cis-22:6 PC) (Abb ). Diese reduzierten den Papp Quotienten um 60 bis sogar 84 % ohne in einer Konzentration von 0,3 mm die tight junctions der Caco-2 Zellen zu beeinflussen (Tab ). 14:0/ cis-18:1 PC verminderte die Ratio zwar auch, jedoch nicht in signifikantem Ausmaß. Lediglich trans-18:1 PC zeigte keinen Effekt, was durch dessen andersartige Doppelbindungs-Konfiguration erklärt werden könnte. Möglicherweise führte die trans-anordnung zu schwächeren Zellmembran-PL- oder P-gp-PL-Interaktionen. In geringeren Konzentrationen zeigte keines der getesteten PL eine Wirkung (ohne Abb.). Auf Grund ihrer molekularen Struktur und ihrer somit sehr geringen CMC-Werte bildeten die Lipide dieser Substanzklasse gleichmäßig große Liposomen (PDI < 0,2) von nm Durchmesser (Tab ). Allerdings konnte dies nicht als Erklärung für die Potenz mancher Derivate herangezogen werden, da die wirksamen PL der gesättigten Klassen diese Eigenschaften definitiv nicht aufwiesen. Womöglich könnten die Gleichförmigkeit der Zubereitungen und die geringe Menge an gelösten PL-Monomeren die gute Zellverträglichkeit erklären, da selbst bei hohen PL-Mengen kein TEER-Einbruch zu verzeichnen war.
123 4 Ergebnisse und Diskussion Caco-2 Digoxin P app Ratio [sec/abs] ** ** ** 0 Control cis 18:3 PC 0.3 mm cis 22:6 PC 0.3 mm 18:0 cis 22:6 PC 0.3 mm 14:0 cis 18:1 PC 0.2 mm trans 18:1 PC 0.2 mm Abbildung : Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit unterschiedlichen ungesättigten PC-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,01 (**) bezogen auf den Kontrollwert
124 102 4 Ergebnisse und Diskussion Gesättigte, symmetrische Phosphatidylethanolamin (PE)-Derivate Die Herstellung liposomaler Zubereitungen aus PE-Lipiden erwies sich als äußerst schwierig (Tab ), so dass lediglich 6:0, 10:0, 16:0 und 18:0 PE im zellulären Screening berücksichtigt wurden. Auch bei den beiden langkettigen Derivaten fiel die visuelle Bewertung grenzwertig aus. Im Zellversuch bewirkten wiederum das 6:0 und das 10:0-Derivat mit 0,3 mm eine Ratio- Reduktion, wobei nur 6:0 PE dabei den Monolayer schonte (Abb ; Tab ). 35 Digoxin P app Ratio [sec/abs] ** * Control 6:0 PE 0.3 mm 10:0 PE 0.3 mm 16:0 PE 0.3 mm 18:0 PE 0.3 mm Abbildung : Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit unterschiedlichen gesättigten PE-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,01 (**) bzw. 0,05 (*) bezogen auf den Kontrollwert
125 4 Ergebnisse und Diskussion Gesättigte, symmetrische Phosphatidylserin (PS)-Derivate Unter den PS-Derivaten konnten sich nur die drei kurzkettigsten für eine weitere Analyse qualifizieren (Tab ). Die Prä-Inkubation der Zellen mit diesen Zubereitungen führte bei 6:0 und 8:0 PS zu einer höchst signifikanten Steigerung der Digoxinabsorption (Abb ). Interessanterweise verminderte 8:0 PS den TEER bereits bei einer Konzentration von 0,1 mm, während 6:0 PS in der dreifachen Menge ohne Zellschäden eingesetzt werden konnte. Somit schienen bereits kleine strukturelle Unterschiede, wie eine Verlängerung der Lipidreste um zwei C- Atome, entscheidend für eine Transporterinteraktion zu sein. Zudem muss betont werden, dass 6:0 PS eine extrem heterogene Dispersion bildete (Tab ), die keine Liposomen, sondern ungeordnete Lipidaggregate kleinerer, mizellarer Strukturen enthielt (Abb ). Diese Tatsache, welche auch für diverse gesättigte PC- und PE-Derivate zutraf, ließ Grund zu der Annahme, dass weniger spezifische PL-Agglomerate, sondern vielmehr das Lipidmonomer selbst mit P-gp oder dessen umgebenden Membranbereich interferierten. Diese Hypothese wird in Kapitel weiter beleuchtet. 30 Caco-2 Digoxin P app Ratio [sec/abs] * * *** 0 Control 6:0 PS 0.1 mm 6:0 PS 0.2 mm 6:0 PS 0.3 mm Abbildung : Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit unterschiedlichen gesättigten PS-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bezogen auf den Kontrollwert
126 104 4 Ergebnisse und Diskussion Gesättigte, symmetrische Phosphatidylglycerin (PG)-Derivate Nach Prä-Inkubation mit Vertretern der PG-Klasse konnten vier der sieben Substanzen, 6:0, 10:0, 12:0 und 14:0 PG, die in vitro Bioverfügbarkeit von Digoxin signifikant verbessern (Abb ). So wurde die Papp Ratio um mind. 40 % und im Falle von 14:0 PG sogar um 77 % reduziert. Auch 16:0 PG zeigte eine P-gp-inhibierende Tendenz jedoch ohne Signifikanz. Keines der applizierten PL verursachte parazellulären Transport, da die TEER-Werte stets konstant blieben. Die Konzentration der Stoffe reichte von 0,05 bis 0,3 mm. Wie auch bei den anderen Lipidklassen erfolgte eine Konzentrationssteigerung dann, wenn bei geringeren Mengen kein Effekt erkennbar war (ohne Abb.). 35 Caco-2 Digoxin P app Ratio [sec/abs] ** * * *** 0 Control 6:0 PG 0.1 mm 8:0 PG 0.1 mm 10:0 PG 0.3 mm 12:0 PG 0.3 mm 14:0 PG 0.05 mm 16:0 PG 0.1 mm 18:0 PG 0.3 mm Abbildung : Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit unterschiedlichen gesättigten PG-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bzw. 0,01 (**) oder 0,05 (*) bezogen auf den Kontrollwert
127 4 Ergebnisse und Diskussion Zusammenfassung und Diskussion: Auswahl potentiell wirksamer Substanzen für weiterführende Studien Das Phospholipidscreening in Caco-2-Transportstudien ergab eine sehr vielschichtige Datenlage, die in Tabelle anhand der einzelnen relativen Papp Ratio Werte (bezogen auf den Kontrollwert) und des TEER-Einflusses dargestellt ist. Alle PL die weiter getestet werden sollten, sind hier optisch hervorgehoben. Ohne Effekt waren die kommerziellen Lipidmischungen, die sogar eine schwächere Netto- Resorption des Transportmarkers hervorriefen als die pufferbehandelte Kontrolle. Im Bereich der gesättigten PC-Derivate haben 6:0, 8:0 und 10:0 PC höchst signifikante Reduktionen der Papp Ratio hervorgerufen, wobei 8:0 PC den TEER auf 70 %, 10:0 PC auf genau 80 % (bezogen auf die Kontrolle) senkte. Beide Werte liegen in einem tolerierbaren Grenzbereich, sollten aber bei weiteren Diskussionen beachtet werden. Bei den ungesättigten PC-Lipiden konnte bis auf das trans- Lipid jede Substanz z.t. hoch signifikante Hemmeffekte in der Digoxinsekretion hervorrufen, ohne dabei den Zellmonolayer in seiner Integrität zu beeinträchtigen. Die Phosphatidylethanolamine und -serine waren bis auf 6:0 PE bzw. 6:0 PS entweder unwirksam oder nicht zellkompatibel. In der PG- Klasse konnten 6:0, 10:0, 12:0 und 14:0 PG für weitere Studien identifziert werden. Interessant an dieser Übersicht war, dass kaum Gemeinsamkeiten zwischen den potenten Zubereitungen bestanden. So fanden sich wirksame Vertreter in jeder Kopfgruppenklasse und sowohl bei langkettigen, ungesättigten, als auch bei kurzkettigen, gesättigten Resten. Häufig war aber die Capronsäure als FA-Kette im Molekül vorhanden. Aus der großen Strukturvielfalt ergab sich zudem eine große Vielfalt was Art und Größe der Lipidaggregate betraf: Die langkettigen, ungesättigten Phosphatidylcholine bildeten klar definierte Liposomen gleichmäßigen Durchmessers, wohingegen die kurz- bis mittelkettigen Vertreter und sämtliche PG-Lipide stark heterogene Zubereitungen mit hohem Anteil solubilisierter Monomere ergaben. Daher konnte kein spezifischer Größenbereich oder Assoziationszustand für inhibierende Eigenschaften verantwortlich gemacht werden.
128 106 4 Ergebnisse und Diskussion Tabelle 4.3-3: Relative Digoxin P app Ratio der getesteten PL (bezogen auf den Kontrollwert in [%]) und ihr Einfluss auf die Zellintegrität (anhand des TEER) in Caco-2-Transportstudien Substanz Konzentration [mm] Relative P app Ratio [%] Control c Verapamil 0,5 25,85 *** c TEER S 45 0,2 131,64 c S 75 0,2 194,39 c R LPC 20 0,2 119,87 c 6:0 PC 0,1 / 0,3 22,87 *** c 8:0 PC 0,1 24,05 *** c - s 10:0 PC 0,1 39,76 *** c - s 12:0 PC 0,1 86,57 c 14:0 PC 0,1 115,50 c 16:0 PC 0,3 145,47 c 18:0 PC 0,3 113,88 c trans-18:1 PC 0,2 103,90 c cis-18:3 PC 0,3 15,66 ** c cis-22:6 PC 0,3 39,34 ** c 14:0/ cis-18:1 PC 0,2 / 0,3 61,71 c 16:0/ cis-18:3 PC 0,2 52,42 * c 18:0/ cis-22:6 PC 0,3 39,25 ** c
129 4 Ergebnisse und Diskussion 107 Substanz Konzentration [mm] P app Ratio [%] TEER 6:0 PE 0,3 29,86 ** c 10:0 PE 0,3 54,30 * s 16:0 PE 0,3 116,72 c 18:0 PE 0,3 64,08 c 6:0 PS 0,3 14,43 *** c 8:0 PS 0,1 11,91 *** s 10:0 PS 0,1 78,75 s 6:0 PG 0,1 / 0,3 47,33 ** c 8:0 PG 0,1 99,07 c 10:0 PG 0,3 59,81 * c 12:0 PG 0,3 58,17 * c 14:0 PG 0,05 / 0,1 23,26 *** c 16:0 PG 0,1 69,63 c 18:0 PG 0,3 128,66 c (*/ **/ ***): signifikante, prozentuale P app Ratio-Reduktion (P < 0,05/ 0,01/ 10-3 ) verglichen mit dem Kontrollwert (= 100 % relative Ratio) c : konstanter TEER (im Bereich des Kontrollwerts) s : sinkender TEER (< 80 % des Kontrollwerts) Fettdruck: Auswahl der PL für weitere Untersuchungen
130 108 4 Ergebnisse und Diskussion Calcein Akkumulations Assay in Caco-2- und MDCKII mdr1-zellen Eine Alternative zur Transportstudie stellt der Calcein Akkumulations Assay (CAA) dar. Bei P-gp- Aktivität der verwendeten Zellen wird das nicht-fluoreszierende P-gp-Substrat Calcein- Acetoxymethylester (Calcein-AM) zuerst per passiver Diffusion in die Zellmembran aufgenommen und sofort wieder aktiv in den Extrazellularraum gepumpt. Wird jedoch P-gp wirksam inhibiert, so verbleibt Calcein-AM im Zellinneren und wird durch unspezifische Esterasen in den hydrophilen Fluoreszenzfarbstoff Calcein gespalten, der nicht länger mit P-gp interagiert und fluorimetrisch quantifiziert werden kann (Polli et al. 2001, Rautio et al. 2006). Beurteilt wird das Ergebnis entweder anhand einer Steigerung der intrazellulären (i.z.) Fluoreszenz im Vergleich zur Negativkontrolle HBSS ph 6,5 (= 100 % Relative Fluoreszenz; RF) oder die Fluoreszenzintensitäten der Proben werden als relative Inhibition (RI) prozentual auf die Positivkontrolle Verapamil 0,5 mm (= 100 % RI) bezogen. Der CAA wurde zunächst mit allen im Transportversuch wirksamen PL, in den gleichen Konzentrationen wie in Tabelle gelistet, in Caco-2 und in der transfizierten Zelllinie MDCKII mdr1 durchgeführt. Als Transportmedium diente erneut HBSS ph 6,5. P-gp-Inhibition wurde dann angenommen, wenn in beiden Zelllinien eine relative Inhibition erreicht wurde, die mind. 20 % des Positivkontrollwerts von Verapamil 0,5 mm entsprach. Abbildung zeigt die RI-Werte ausgewählter Lipide von unterschiedlicher Potenz im Vergleich zu Verapamil in den beiden Zelllininen: Diverse Derivate (6:0 PS, cis-18:3 PC, 18:0/ cis- 22:6 PC) lagen hier eindeutig unter der 20 %-Grenze und hatten somit keinen oder nur vernachlässigbaren Einfluss auf die P-gp-abhängige, i.z. Calcein Akkumulation in Caco-2 oder MDCKII mdr1. Zwei Phospholipide - 8:0 PC und 10:0 PC - erzielten ähnlich hohe RI-Werte in beiden Zelllinien, nachdem man sie in den gleichen Konzentrationen wie auch im Transportversuch prä-inkubiert hatte. So führte 8:0 PC zu % RI, 10:0 PC erreichte Werte von %, was sogar den Effekt von Verapamil überstieg. Diese Daten belegten deutlich den inhibierenden Einfluss dieser Lipide auf den P-gp-vermittelten Calcein-AM-Efflux. 6:0 PC zeigte über 50 % RI in Caco-2, hatte aber interessanterweise keinen Effekt in MDCKII mdr1. Im Falle von cis-22:6 PC lag das genaue Gegenteil vor: Während eine moderate P-gp-Inhibition (50 % RI) in Caco-2 detektiert werden konnte, wurde in MDCKII mdr1 ein vierfach höherer Wert von über 200 % verzeichnet. Möglicherweise führten die unterschiedlichen Ursprünge
131 4 Ergebnisse und Diskussion 109 der beiden Zelllinien (human vs. vom Hund) zu veränderten Bilayer-Eigenschaften der Zellmembranen, was diese inkongruenten Ergebnisse von 6:0 PC und cis-22:6 PC erklären könnte. Alle weiteren PL, deren Ergebnisse nicht grafisch aufgeführt sind, hatten keinerlei Effekt auf die Calcein-Akkumulation. Eine mögliche Erklärung, warum sich allein drei Lipide in diesem Assay bewähren konnten, mag die Existenz eines Caco-2-spezifischen Digoxintransporters sein, dessen Existenz bereits in der Literatur diskutiert wurde (Lowes et al. 2003). Somit wären positive Hemmresultate der Digoxintransportversuche nicht mit anderen P-gp-Substraten und/ oder in anderen Zelllinien reproduzierbar. Ein aussagekräftiges P-gp-Inhibitorscreening sollte aber substratspezifische falsch-positive oder negative Ergebnisse bestmöglich ausschließen, daher wurde sich in weiterführenden Studien lediglich auf die Compounds konzentriert, die in allen in vitro Assays signifikante Effekte hervorriefen: 8:0 PC, 10:0 PC und cis-22:6 PC Caco-2 MDCKII mdr1 Relative Inhibition [%] Verapamil 0.5 mm 6:0 PS 0.3 mm 6:0 PC 0.3 mm 8:0 PC 0.1 mm 10:0 PC 0.1 mm cis-18:3 PC 0.2 mm cis-22:6 PC 0.2 mm 18:0/ cis-22:6 PC 0.2 mm Abbildung : Relative Inhibition des P-gp-abhängigen Calcein-AM Efflux in Caco-2- (weiß) und MDCKII mdr1-zellen (grau) nach Prä-Inkubation mit Verapamil (Positivkontrolle mit 100 % RI) oder unterschiedlichen PL-Zubereitungen in HBSS ph 6,5 Die Absolutwerte wurden durch eine mit HBSS behandelte Kontrolle korrigiert und prozentual auf die Verapamil-Positivkontrolle bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben
132 110 4 Ergebnisse und Diskussion Verifizierung der P-gp Inhibition durch Vergleichsstudien in MDCKII mdr1- vs. MDCKII Wildtyp (WT)-Zellen Des Weiteren sollte festgestellt werden, inwiefern Änderungen des Transportverhaltens einer Substanz wirklich mit der Inhibition eines Transportproteins zusammenhingen und nicht auf unspezifische Membraneffekte zurückzuführen waren, wie lipidbedingte Poren- oder Defektbildung, erleichterte Membrandiffusion durch Fluiditätssteigerung, o.ä.. Zu diesem Zweck wurden Vergleichsstudien von MDCKII mdr1 und MDCKII Wildtyp (WT) Zellen durchgeführt. Es handelte sich hier um identische Zelllinien aus dem Netherlands Cancer Institute in Amsterdam (NKI-AVL), die sich nur durch die Transfektion mit dem humanen, für P-gp codierenden mdr1-gen unterschieden (Feng et al. 2008, de Souza et al. 2009). Die Expression des humanen Transportproteins konnte für MDCKII mdr1 per Western Blot-Analytik bestätigen werden (Kap. 4.2) Digoxintransportstudien mit simultaner Online-Messung des transepithelialen elektrischen Widerstandes (TEER) Der Digoxintransport in reinem Puffer (= Control) fiel in beiden Zelllinien asymmetrisch aus, jedoch lag die Papp Ratio in mdr1 bei 27, in WT nur bei 8 (Abb ). Dies und die Tatsache, dass in beiden Zelllinien mit Verapamil 0,5 mm eine Reduktion auf ca. 5 erreicht werden konnte, zeigte, dass die erforderlichen Unterschiede in der P-gp-Expression eindeutig vorhanden waren und mit der vorliegenden Methodik nachgewiesen werden konnten. Ausgehend von den CAA-Ergebnissen in MDCKII mdr1 (Kap ) wurden die drei PL in Standardpuffer untersucht, die in dieser Zelllinie, wie auch in den Caco-2-Transportstudien positiv aufgefallen waren. 8:0 PC, 10:0 PC und cis-22:6 PC zeigten auch beim Digoxintransport durch MDCKII mdr1-zellen hoch bis höchst signifikante Reduktionen des Papp Quotienten um % (Abb , graue Balken). Im Vergleich hierzu lag die Reduktion im WT bei nur 40 % (schwarze Balken) mit einem Signifikanzniveau von nur 0,05. Diese komplett unterschiedliche Datenlage in den zwei Zelltypen, die lediglich in der P-gp-Expression voneinander abwichen, ist in Tabelle nochmals zusammengefasst. Hätten die Lipide durch unspezifische Membrandefekte die Netto- Digoxinresorption gesteigert, müsste die Ratio-Reduktion in beiden Zelllinien ähnlich stark ausfallen. Der geringe Effekt im Wildtyp zeigte, dass lediglich die wenigen vorhandenen P-gp- Transpoter gehemmt wurden und darüberhinaus keine Wirkung erzielt wurde.
133 4 Ergebnisse und Diskussion 111 Hiermit wurde die Annahme bekräftigt, dass 8:0 PC, 10:0 PC und cis-22:6 PC tatsächlich den P-gp- Transporter inhibierten und näher untersucht werden sollten MDCKII mdr1 MDCKII WT Digoxin P app Ratio [sec/abs] *** * *** * *** * ** * Control Verapamil 0.5 mm 8:0 PC 0.1 mm 10:0 PC 0.1 mm cis-22:6 PC 0.3 mm Abbildung : Digoxin P app Ratio in MDCKII mdr1- (grau) oder MDCKII WT-Zellen (schwarz) in reinem HBSS ph 6,5 (Control) und nach 30-minütiger Prä-Inkubation mit Verapamil (Positivkontrolle) oder ausgewählten PC-Zubereitungen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***), 0,01 (**) oder 0,05 (*) bezogen auf den Kontrollwert Tabelle 4.3-4: Relative Digoxin P app Ratio der getesteten PL (bezogen auf den Kontrollwert von Digoxin in reinem HBSS ph 6,5 in [%]) in MDCKII mdr1- und MDCKII WT-Transportstudien Substanz Konzentration [mm] Relative P app Ratio [%] MDCKII mdr1 Relative P app Ratio [%] MDCKII WT 8:0 PC 0,1 6,48 *** 63,10 * 10:0 PC 0,1 21,38 *** 58,00 * cis-22:6 PC 0,3 39,22 ** 60,99 *
134 112 4 Ergebnisse und Diskussion Bei den WT-Zellen wurden die zugehörigen TEER-Werte vor und nach dem Versuch mit der Endohm-Elektrodenkammer gemessen. Hierbei konnte für alle Inserte ein konstanter Wert von ca. 50 cm² festgestellt werden (ohne Abb.). Dies ist ein weiteres Indiz dafür, dass kein lipidbedingter, verstärkter Stofftransport durch die Zellmembran stattfinden konnte. Bei der transfizierten Zelllinie wurde der TEER kontinuierlich während des gesamten Versuchs mit dem CellZscope Gerät aufgenommen. Die Abbildungen und visualisieren den Widerstandsverlauf ab dem letzten Medienwechsel vor dem Versuch (I), dem Beginn der Äquilibrierung mit Transportpuffer (II), dem Beginn der apikalen Verapamil-/ Lipid-Prä-Inkubation (III) und der Zugabe des Transportmarkers Digoxin (IV) dokumentiert die absorptiven Wells mit apikaler Digoxinapplikation, die sekretorischen Inserte. Die mit Verapamil oder 10:0 PC behandelten Zellschichten lagen - genauso wie die pufferbehandelten Zellen (Abb , ; Control = blaue Kurve) - stets mind. auf dem Ausgangsniveau von 30 cm² (Abb , ; orangene und violette Kurve). Nur 8:0 PC verminderte den TEER im Verlauf von Prä-Inkubation und Transportstudie auf den Widerstand des leeren Membranfilters von 10 cm² (Abb ; grüne Kurve ab Teilstrich III) bzw. auf cm² (Abb ; grüne Kurve ab Teilstrich III). Somit konnte in Anwesenheit von 8:0 PC auch parazellulärer Digoxintransport nicht ausgeschlossen werden. Allerdings blieb in den WT-Zellschichten, wo dieses Lipid ebenfalls die Digoxin Papp Ratio signifikant reduzierte (Tab ), die Integrität komplett bestehen, so dass man vorrangig von transzellulärem Stoffdurchgang und demnach von effektiver P-gp-Modulation ausgehen darf. Zudem erholten sich die mit 8:0 PC behandelten mdr1-zellen in den sekretorischen Wells während einer nachfolgenden Inkubation mit reinem Transportpuffer soweit, dass die TEER-Werte wieder auf das Anfangsniveau anstiegen (Abb ; grüne Kurve ab Teilstrich V).
135 4 Ergebnisse und Diskussion 113 III I II IV V Abbildung : TEER-Verlauf der absorptiven (abs) Wells
136 114 4 Ergebnisse und Diskussion I II IV V III Abbildung : TEER-Verlauf der sekretorischen (sec) Wells Abb ,4.3-17: Kontinuierlich gemessener TEER-Verlauf von MDCKII mdr1-zellen über die Zeit ab dem letzten Medienwechsel (M.W.) vor der Transportstudie bis zum Endpunkt, 24 h nach Abschluss des Experiments Dunkelblau (dark blue) = Kontrolle (Control, Digoxin in reinem HBSS ph 6,5); orange = Verapamil 0,5 mm; violett (violet) = 10:0 PC 0,1 mm; grün (green) = 8:0 PC 0,1 mm. (I): letzter M.W.; (II): Beginn der Äquilibrierung der Zellen mit reinem HBSS ph 6,5; (III): Beginn der apikalen Verapamil-/ PL-Prä-Inkubation in HBSS ph 6,5; (IV): Start der Transportstudie; (V): Ende der Transportstudie und Beginn der 24-stündigen Rekonvaleszenzphase der Zellen in reinem HBSS ph 6,5; n = 3; Kurven sind als Mittelwertkurven ± SD (Schatten) angegeben
137 4 Ergebnisse und Diskussion CAA-Studien Bei der Gegenüberstellung der Calcein Akkumulation in mdr1- und WT-Zellen war ebenfalls zunächst die Anwendbarkeit und Aussagekraft der Methodik von Interesse. So zeigt Abbildung , dass die Kontrollfluoreszenz im Wildtyp (schwarz) viermal so hoch ausfiel wie in den überexprimierenden Zellen (grau). Dies belegte, dass bei uneingeschränkter P-gp-Aktivität in mdr1- Zellen viel mehr Calcein-AM aus der Zelle befördert wurde. Hemmte man nun den Transporter mit Verapamil (0,05 oder 0,5 mm), so stieg in beiden Zelllinien die Fluoreszenzintensität auf ähnliche Absolutwerte von ~ RU an. Vergleicht man jedoch den prozentualen Anstieg dieser Fluoreszenzintensität in Form der relativen Fluoreszenz (Abb ), so verursachte Verapamil im WT knapp 200 % RF, in mdr % RF. Somit konnte auch der Zelltyp-vergleichende CAA zur Identifikation P-gp-spezifischer Effekte herangezogen werden: Erhöhte nämlich eine Substanz die RF in WT und mdr1 gleichermaßen, so handelt es sich um unspezfische, nicht-p-gp-abhängige Effekte. Bei stärkeren Intensitätsanstiegen in mdr1-zellen kann jedoch von einer Transporterinteraktion ausgegangen werden. Wurden beide Zelllinien mit den drei bewährten Lipiden 8:0, 10:0 und cis-22:6 PC (0,1 bzw. 0,3 mm) prä-inkubiert, so ergaben sich in mdr1 RF-Werte von ~ 450 % (8:0 PC) bzw. ~ 800 % (10:0 PC, cis-22:6 PC) und somit partiell höhere Signale als mit der Positivkontrolle Verapamil. In der parentalen, nicht-transfizierten Variante stiegen die Werte nur auf % (Abb ). Diese erneute Diskrepanz zwischen mdr1 und Wildtyp stellte ein weiteres Indiz für den tatsächlichen P-gp-inhibitorischen Charakter dieser PL dar.
138 116 4 Ergebnisse und Diskussion 4,0x10 4 3,5x10 4 MDCKII mdr1 MDCKII WT *** Calcein-Fluoreszenz [RU] 3,0x10 4 2,5x10 4 2,0x10 4 1,5x10 4 1,0x10 4 5,0x10 3 *** * *** *** *** *** *** *** 0,0 Control Verapamil 0.05 mm Verapamil 0.5 mm 8:0 PC 0.1 mm 10:0 PC 0.1 mm cis-22:6 PC 0.3 mm Abbildung : Absolute Calcein-Fluoreszenz in MDCKII mdr1- (grau) und MDCKII WT-Zellen (schwarz) nach 30-minütiger Calcein-AM-Inkubation und Vorbehandlung mit reinem HBSS ph 6,5 (Control), Verapamil (Positivkontrolle) oder den identifizierten, wirksamen PC-Zubereitungen in HBSS ph 6,5 Die Absolutwerte wurden durch einen Calcein-AM-freien, nur mit HBSS inkubierten Blankwert korrigiert; n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bzw. 0,05 (*) bezogen auf den Kontrollwert
139 4 Ergebnisse und Diskussion 117 Relative Calcein-Fluoreszenz [%] Control MDCKII mdr1 MDCKII WT *** Verapamil 0.05 mm * *** Verapamil 0.5 mm *** 8:0 PC 0.1 mm *** *** 10:0 PC 0.1 mm *** *** cis-22:6 PC 0.3 mm *** Abbildung : P-gp-abhängige relative Calcein Fluoreszenz in MDCKII mdr1- (grau) und MDCKII WT-Zellen (schwarz) nach 30-minütiger Calcein-AM-Inkubation und Vorbehandlung mit Verapamil (Positivkontrolle) oder den identifizierten, wirksamen PC-Zubereitungen in HBSS ph 6,5 Die Absolutwerte wurden durch einen Calcein-AM-freien Blankwert korrigiert und prozentual auf eine nur mit HBSS und Calcein-AM behandelte Kontrolle (= 100 % RF) bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bzw. 0,05 (*) bezogen auf den Kontrollwert
140 118 4 Ergebnisse und Diskussion Zusammenfassung und Diskussion des PL-Screening Vorgängerarbeiten auf diesem Gebiet indizierten bereits die Möglichkeit für P-gp-inhibitorisches Potential in der Klasse der Phospholipide (Lo 2000, Alkatout 2008). Somit bestand großes Interesse darin, mittels systematischer Variation von Kopfgruppe und FA-Resten die potentesten Vertreter dieser Substanzklasse zu identifizieren und in anerkannten in vitro Assays zu verifizieren. Transportstudien in Caco-2-Zellen zeigten, dass im Allgemeinen PL mit zwei 6:0-Fettsäureresten unabhängig von ihrer Kopfgruppe (PC/ PG/ PE/ PS) die Bioverfügbarkeit des Transportmarkers Digoxin positiv beeinflussten. Prä-Inkubation mit mittel-bis langkettigen Compounds (8:0 PC, 10:0 PC; 10:0 PG; 12:0 PG; 14:0 PG), aber auch ungesättigten, z.t. asymmetrischen Resten (cis- 18:3 PC; cis-22:6 PC; 18:0/cis-22:6 PC) ergaben hier ebenfalls positive Ergebnisse. Allerdings zeigten Transportstudien in MDCKII mdr1 und Wildtyp, sowie Calcein Akkumulations Assays (CAA) in allen drei Zelllinien, dass nur drei PC Derivate - 8:0 PC, 10:0 PC, cis-22:6 PC - wirklichen Einfluss auf den P-gp-Transporter zu haben scheinen. Daher sollte sich in weiterführenden Studien auf diese Vertreter beschränkt werden. Ein möglicher Grund, warum so viele Lipide nur im Caco-2-Digoxintransportversuch Potenz aufwiesen, könnte eine Interaktion dieser Substanzen mit einem nicht-mdr1- und nicht-mrp2- codierten Digoxintransporter in der Caco-2 Membran sein, der nicht in MDCKII-Zellen auftritt und auch vom CAA nicht betroffen ist (Lowes et al. 2003). Vermutungen über die Existenz eines solchen Transporters kursieren in der Literatur auch bzgl. der Intestinalmucosa der Ratte (Yao & Chiou 2006) und des menschlichen Dünndarms (Abrahamse & Rechkemmer 2001). Momentan ist diese Theorie aber noch rein spekulativ und sollte daher in Zukunft näher untersucht werden. Möglicherweise verursachte dieser Transporter die ambivalenten Ergebnisse von Capronsäure- Derivaten, cis-ungesättigten Lipiden (außer cis-22:6 PC) und von Phosphatidylglycerolen. So könnte deren spezifische sterische Orientierung oder auch die PG-Kopfgruppe generell eine gewisse Affinität zu diesem bisher nicht identifizierten Transportprotein besitzen. Generell verdeutlichte die Uneinheitlichkeit der Screeningergebnisse die Gefahr von unspezifischen Kreuzreaktionen von Markersubstanzen mit mehreren zellulären Transportern. Dies unterstreicht die Notwendigkeit, auf der Suche nach neuen Inhibitoren experimentelle Daten stets in mehreren Zelllinien und mit mehreren Assaytypen zu bestätigen, um substrat- bzw. zelllinienspezifische Effekte zu nivellieren.
141 4 Ergebnisse und Diskussion In vitro Einfluss von Komponenten des Darmmilieus auf ausgewählte Phospholipidzubereitungen Verwendung von modifiziertem fasted state simulated intestinal fluid (Fassif) ph 6,5 + Phospholipase A2 als Versuchsmedium Der Fokus der vorliegenden Arbeit lag auf der Modulation intestinaler Transportprozesse durch Inhibition von P-gp. Um möglichst repräsentative Aussagen über die Wirksamkeit potentiell potenter Substanzen in vivo machen zu können, sollten bereits in vitro Studien die intestinal vorliegenden physiologischen Bedingungen berücksichtigen. Zu diesem Zweck haben sich diverse Versuchsmedien, die sifs (simulated intestinal fluids) etabliert, die auf Grund ihrer Zusammensetzung aus Elektrolyten, Lecithin und Gallensalzen (GS) entweder die Magen-Darm- Trakt-Flüssigkeit im nüchternen (Fassif = fasted state simulated intestinal fluid) oder im gefütterten Zustand (Fessif = fed state simulated intestinal fluid) simulieren (Ingels et al. 2002). In den vorliegenden Studien wurde Fassif verwendet, da Fessif mit einer fünfmal so hohen GS- Konzentration und einem ph-wert von 5,0 geringe Zellkompatibilität aufweist (Ingels et al. 2002). Im Gegensatz zu vielen Beispielen in der Literatur (Dressman & Reppas 2000, Jantratid et al. 2008) wurde nicht das GS Natrium-Taurocholat (Na TC), sondern eine molare 1:1-Mischung aus Natrium-Glykochenodesoxycholat (Na GCDC) und Natrium-Glykocholat (Na GC) verwendet (Tab ). Diese Kombination aus Glycin-konjugierten Trihydroxy (Na GC)- und hydrophoberen Dihydroxy-GS (Na GCDC) berücksichtigte stärker die physiologische Situation im Dünndarm. Hier wird durch die Kombination unterschiedlich hydroxylierter Detergenzien eine möglichst effiziente Emulgierfähigkeit erreicht. Außerdem erniedrigt die Glycin-Konjugierung den pks-wert der GS, so dass die Substanzen im sauren Milieu des oberen Dünndarms weiterhin deprotoniert vorliegen können, was wiederum deren passive intestinale Re-Absorption in den portalen Kreislauf verhindert (Hofmann 1999). Die äquimolare Mischung von konjugiertem Cholat und Chenodesoxycholat entspricht % der im menschlichen enterohepatischen Kreislauf vorhandenen Gallensalze und war, wie vorhergehende Studien zeigten, in einer Gesamtkonzentration von 3,0 mm (1,5 mm pro Gallensalz) was Zellviabilität und Monolayerintegrität von Caco-2-Zellen anging, sehr gut verträglich (ohne Abb.) (Alkatout 2008).
142 120 4 Ergebnisse und Diskussion Tabelle 4.4-1: Zusammensetzung des modifizierten Fassif (fasted state simulated intestinal fluid) ph 6,5 Inhaltsstoffe Konzentration [mm] KH 2PO 4 28,7 EPC S (Ei-Phosphatidylcholin S) 0,75 KCl 103,3 Na GCDC (Natrium Glykochenodesoxycholat) 1,5 Na GC (Natrium Glykocholat) 1,5 NaOH ad ph 6,5 demin.wasser ad 1,0 L Für eine noch stärkere physiologische Annäherung wurde vor Versuchsbeginn dem Medium das pankreatische Verdauungsenzym Phospholipase A2 (PL A2) in der Konzentration 2,5 U ml -1 zugesetzt, das einerseits im Darmsaft enthalten ist und zugleich bei Enterozyten in intestinalepithelialen Zellverband im Mikrovillibereich angereichert wird (Nordskog et al. 2001). Dies bewirkt die Umwandlung eines PL in sein zugehöriges Lyso-PL, indem der FA-Rest am C2-Atom des Glycerol-Backbones abgespalten wird (s. Kap ). In diesem Versuchsteil wurde lediglich mit Caco-2 Zellen gearbeitet, da diese Zelllinie für eine sinnvolle Simulation und Bewertung intestinaler Resorptionsvorgänge am besten geeignet ist (Levy et al. 1995, Hubatsch et al. 2007) Digoxintransportstudien und CAA in Caco-2-Zellen Zunächst wurden die PL, die in HBSS ph 6,5-Transportversuchen positiv getestet wurden (Tab , fett gedruckt) und stabile TEER-Werte bewirkten, in der gleichen Konzentration in mod. Fassif ph 6,5 + PL A2 mit der selben Methodik erneut untersucht. Alle Ergebnisse wurden als relative Papp Ratio prozentual auf den Quotienten bezogen, der in reinem Transportmedium erzielt wurde und in Tabelle aufgeführt. Zum direkten Vergleich sind hier zudem in Klammern die relativen Ratio-Werte, die in HBSS ph 6,5 erzielt wurden, gelistet. Wie Abbildung verdeutlicht, wurde Digoxin nach Prä-Inkubation der Zellen mit reinem Fassif + PL A2 deutlich asymmetrisch mit sekretorischem Überhang durch den Zelllayer transportiert und führte selbst zu keiner Transportmodulation verglichen mit Digoxin in
143 4 Ergebnisse und Diskussion 121 HBSS (Control). Setzte man zusätzlich PL ein, waren lediglich 10:0 PC, 12:0 PG und 16:0/ cis- 18:3 PC in der Lage den Papp Quotienten im Vergleich zur Kontrolle signifikant zu senken. Die weiteren, hier abgebildeten Lipide wiesen zwar eine Efflux-inhibierende Tendenz auf, erreichten aber nur in drei Fällen (cis-22:6 PC, 14:0/ cis-18:1 PC, 10:0 PG) vergleichbar niedrige Ratio-Werte wie in HBSS ph 6,5 (Tab ). Die anderen Lipide hatten keinen nennenswerten Effekt auf den Digoxinfluss. Hatte auch kein Lipid in diesem Medium zytotoxischen Einfluss (Kap ), so griffen doch einige PL die Integrität des Caco-2-Layers stark an und reduzierten deutlich dessen transepithelialen elektrischen Widerstand (Tab ). Da dies auch auf die meisten Derivate zutraf, die den Digoxintransport modulierten, konnten hier unerwünschte parazellulare Prozesse nicht ausgeschlossen werden. Daher wurde auch davon abgesehen, die prä-inkubierte Lipidmenge in Hoffnung auf noch stärkere P-gp-Effekte zu erhöhen. 40 Caco-2 Digoxin P app Ratio [sec/abs] *** * * 0 Control Fassif + PL A2 6:0 PE 0.3 mm 6:0 PS 0.3 mm 6:0 PC 0.1 mm 10:0 PC 0.1 mm 12:0 PG 0.3 mm 14:0 PG 0.05 mm 14:0/ cis-18:1 PC 0.2 mm cis-22:6 PC 0.3 mm 16:0/ cis-18:3 PC 0.2 mm cis-18:3 PC 0.1 mm Abbildung 4.4-1: Digoxin P app Ratio in Caco-2-Zellen in HBSS ph 6,5 (Control), in reinem mod. Fassif + PL A 2 und nach 30-minütiger Prä-Inkubation mit PL-Zubereitungen in diesem Transportmedium Getestet wurden die PL mit positiver Wirkung in den HBSS-Transportstudien in Caco-2; n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bzw. 0,05 (*) bezogen auf den Wert im reinen Transportmedium
144 122 4 Ergebnisse und Diskussion Tabelle 4.4-2: Relative Digoxin P app Ratio aller getesteten PL in mod. Fassif ph 6,5 + PL A 2 (bezogen auf den Kontrollwert von Digoxin in reinem HBSS ph 6,5 in [%]) und ihr Einfluss auf die Zellintegrität (anhand des TEER) in Caco-2-Transportstudien Substanz Konzentration [mm] Relative P app Ratio [%] Caco-2 HBSS ph 6, c TEER mod. Fassif + PL A ,14 c + 6:0 PC 0,1 78,45 (22,87 ***) c + 10:0 PC 0,1 14,37 *** (39,76 ***) s + cis-18:3 PC 0,1 77,27 (15,66 **) s + cis-22:6 PC 0,3 43,58 (39,34 **) s + 14:0/ cis-18:1 PC 0,2 65,09 (61,71) c + 16:0/ cis-18:3 PC 0,2 58,79 * (52,42 *) c + 18:0/ cis-22:6 PC 0,3 101,38 (39,25 **) s + 6:0 PE 0,3 90,42 (29,86 **) c + 6:0 PS 0,3 85,56 (14,43 ***) c bis s + 6:0 PG 0,1 106,49 (47,33**) c + 10:0 PG 0,3 85,60 (59,81 *) s + 12:0 PG 0,3 34,30 * (58,17 *) c bis s + 14:0 PG 0,05 69,24 (23,26 ***) c Die Ratio-Werte in Klammern entsprechen den Ergebnissen aus den Caco-2-Transportstudien in HBSS ph 6,5 (s. Tab ) c : konstanter TEER (im Bereich des Kontrollwertes); s : sinkender TEER (< 80 % des Kontrollwertes)
145 4 Ergebnisse und Diskussion 123 Im Calcein Akkumulations Assay in mod. Fassif + PL A2 blieben die Lipide aus Tabelle ohne detektierbaren Effekt. Auch das Transportmedium allein hatte keine Wirkung (ohne Abb.). Ein Grund, warum die in HBSS ph 6,5 wirksamen PL in diesem Milieu ihre inhibitorischen Eigenschaften meist partiell oder komplett einbüßten und sich ihre Aggressivität gegenüber dem Zelllayer oft immens steigerte, konnte zum einen der enzymatische Abbau des PL-Moleküls zu Lyso-PL und freien Fettsäuren sein. Aber auch eine GS-bedingte Solubilisierung der PL-Aggregate mochte eine entscheidende Rolle spielen, wobei vermutlich die freien Lipidmoleküle anschließend als Mischmizellen gebunden vorlagen (Nordskog et al. 2001, Woudstra & Thomson 2002). Somit konnte bereits vermutet werden, dass für eine PL-bedingte P-gp-Inhibition das intakte PL-Molekül notwendig war Visualisierung ausgewählter PL-Formulierungen mittels Kryo-TEM Die vermutete GS-bedingte Vesikelsolubilisierung konnte für 10:0 PC in mod. Fassif ph 6,5 + PL A2 anhand von Kryo-TEM Aufnahmen bestätigt werden (PL-Conc. = 17,9 mm; Abb ). Hier sind im Gegensatz zu Abbildung in HBSS (PL-Conc. = 11,4 mm) keinerlei vesikuläre Strukturen mehr sichtbar. Inwiefern sich in der Fassif-Formulierung gelöste PL-Monomere, Mischmizellen und/ oder Lyso-Lipide befanden, konnte jedoch nicht festgestellt werden. Im visuellen Vergleich mit einer 10:0 Lyso-PC-Formulierung in HBSS ph 6,5 (PL-Conc. = 5,0 mm; Abb ) und mit einer GS-enthaltenen 10:0 PC-Probe ohne enzymatische Aktivität, die somit nur intakte PL-Moleküle bzw. Mischmizellen enthielt (PL-Conc. = 14,0 mm; Abb ), konnte zumindest kein Unterschied festgestellt werden. Eine cis-22:6 PC-enthaltende Fassif-Formulierung wies weiterhin klar strukurierte Liposomen auf (PL-Conc. = 8,6 mm; Abb ), aber sie hatten sich verglichen mit der HBSS-Zubereitung (PL-Conc. = 8,6 mm; Abb ) in kleinere, partiell geschrumpfte und längliche Vesikel umgewandelt. Bedenkt man aber, dass dieses Derivat bedingt durch seine langkettige Struktur eine sehr geringe CMC besitzen muss, scheint es verständlich, dass dessen liposomale Aggregate einer geringeren GS-bedingten Solubilisierung unterlagen als 10:0 PC, selbst wenn die Konzentration des ungesättigten Derivats mit 8,6 mm nur halb so groß war, wie die des gesättigten Derivats mit 18 mm (Abb ). Gleichzeitig konnte aber auch in dieser Fassif-Zubereitung von diversen solubilisierten und daher auf den Aufnahmen nicht sichtbaren Strukturen, wie Mischmizellen, PL- Monomeren, Lyso-Lipiden und freien Fettsäuren ausgegangen werden. Schließlich hatten beide Formulierungen vergleichbar aggressive Auswirkungen auf den Caco-2-Zelllayer, so dass die
146 124 4 Ergebnisse und Diskussion Anwesenheit von Liposomen für diesen negativen zellulären Effekt vernachlässigbar zu sein schien (Tab ). Abb : 10:0 PC in mod. Fassif ph 6,5 + PL A 2 Abb : 10:0 PC in HBSS ph 6,5 Abb : 10:0 Lyso-PC in HBSS ph 6,5 Abb : 10:0 PC in mod. Fassif ph 6,5 Abbildung bis 4.4-5: Kryo-TEM-Aufnahmen von 10:0 PC- bzw. Lyso-PC-Zubereitungen in HBSS ph 6,5 oder mod. Fassif ph 6,5 ± PL A 2 Die Herstellung erfolgte mittels Filmmethode, anschließender Rehydratisierung und 51-malige Extrusion durch Polycarbonatmembranen (Porengröße von 80 nm); PL-Conc. = 17,7 mm (4.4-2)/ 11,4 mm (4.4-3)/ 5 mm (4.4-4)/ 14 mm (4.4-5)
147 4 Ergebnisse und Diskussion 125 Abb : cis-22:6 PC in mod. Fassif ph 6,5 + PL A 2 Abb : cis-22:6 PC in HBSS ph 6,5 Abbildungen und 4.4-7: Kryo-TEM-Aufnahmen von cis-22:6 PC in HBSS ph 6,5 oder mod. Fassif ph 6,5 + PL A 2 Herstellung mittels Filmmethode, anschließender Rehydratisierung und 51-malige Extrusion durch Polycarbonatmembranen (Porengröße von 80 nm); PL-Conc. = 8,6 mm P-gp-inhibitorische Potenz von Phospholipase A2-induzierten Lipidspaltprodukten Die Studien aus warfen die Frage auf, warum PL in mod. Fassif + PL A2 ihre Wirksamkeit ganz oder teilweise verloren hatten. Eine mögliche Erklärung war der enzymatische Abbau in Lyso- PL und freie Fettsäuren. Daher sollte der zelluläre Einfluss dieser Spaltprodukte unter Verwendung von Reinsubstanzen in HBSS ph 6,5 untersucht werden Freie Fettsäuren (FFA) Zum Einsatz kamen folgende FFA, die zu Beginn auf Zytotoxizität hin getestet wurden: 6:0 FA, 8:0 FA, 10:0 FA, 14:0 FA, 18:0 FA, cis-18:3 FA, cis-22:6 FA. Verwendete man die gleichen Konzentrationen wie bei den korrespondierenden PL, so konnte keine ausreichende Zellviabilität von 80 % sichergestellt werden (ohne Abb.). Daher wurde der Gehalt so lange reduziert, bis sie gut verträglich waren. Im Falle von Linolensäure (cis-18:3 FA) und Docosahexaensäure (cis-22:6 FA) war aber bereits 0,1 mm zu toxisch für einen Zellversuch
148 126 4 Ergebnisse und Diskussion (Abb ), weswegen diese beiden Derivate auch nicht weiter untersucht wurden. Im Gegensatz dazu konnten die zugehörigen PL problemlos in fünffach höherer Konzentration eingesetzt werden (Kap ). 140 Caco Zellviabilität [%] ** ** 40 Control cis-18:3 PC 0.5 mm cis-18:3 FA 0.1 mm cis-22:6 PC 0.5 mm cis-22:6 FA 0.1 mm Abbildung 4.4-8: Relative Viabilität von Caco-2-Zellen nach 4-stündiger Inkubation mit reinem HBSS ph 6,5 (Control mit 100 % Viabilität) und ausgewählten PC- bzw. FFA-Zubereitungen in HBSS Die Zellviabilität wurde anhand eines ATP-abhängigen Lumineszenzsignals quantifiziert. Die Absolutwerte wurden durch einen Reagenz-freien Blankwert korrigiert und anschließend prozentual auf den Kontrollwert bezogen. n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,01 (**) bezogen auf die Kontrolle Die verbliebenen FA wurden im Standardpuffer auf ihre P-gp-inhibierenden Eigenschaften getestet. Wie Tabelle darstellt, hatten die Säuren entweder keinen Einfluss auf den Digoxintransport in Caco-2 und/ oder schädigten den Zelllayer immens trotz der reduzierten Mengen. Somit schienen FFA keinerlei P-gp-Inhibition auszuüben, sondern besaßen vielmehr großes zytotoxisches Potential womöglich durch Interaktionen mit Zellmembranen und -organellen. Dies bestätigte unsere Annahme, dass ein intaktes PL-Molekül für eine wirksame Transporterhemmung vonnöten ist und ein enzymatischer Abbau P-gp-hemmenden Eigenschaften im Wege steht.
149 4 Ergebnisse und Diskussion 127 Tabelle 4.4-3: Relative Digoxin P app Ratio der getesteten FFA (bezogen auf den Kontrollwert von Digoxin in reinem HBSS ph 6,5 in [%]) und ihr Einfluss auf die Zellintegrität (anhand des TEER) in Caco-2-Transportstudien Substanz Konzentration [mm] Relative P app Ratio [%] Caco-2 HBSS ph 6, c TEER 6:0 FA 0,1 83,41 c 8:0 FA 0,05 146,76 c 10:0 FA 0,05 99,72 c 14:0 FA 0,05 90,59 s 18:0 FA 0,1 39,53 * s c : konstanter TEER (im Bereich des Kontrollwertes); s : sinkender TEER (< 80 % des Kontrollwertes) Lyso-Phosphatidylcholine (LPC) Außerdem wurden Lyso-Lipide, die zweite Gruppe enzymatischer PL-Spaltprodukte, am Beispiel von den drei kurz- bis mittelkettigen Derivaten 6:0, 8:0 und 10:0 LPC in Caco-2-Transportstudien untersucht. Als Konzentration wurde wie auch beim Großteil der zugehörigen PL (Tab ) 0,1 mm in HBSS ph 6,5 gewählt. Keines der Derivate hatte einen Einfluss auf den Digoxinflux (Abb ) und der TEER-Wert wurde ebenfalls nicht verändert. Als zusätzliche Bestätigung wurden zudem vergleichende CAA-Studien in MDCKII mdr1- vs. WT- Zellen durchgeführt. Auch hier konnte, ganz im Gegensatz zu Verapamil, in beiden Zelllinien keine Calcein-bedingte Fluoreszenzsteigerung und somit keine P-gp-Inhibition festgestellt werden (Abb ). Diese Resultate zeigten eindeutig, dass der Lipase-bedingte PL-Abbau zu komplett unwirksamen und z.t. sogar zytotoxischen Produkten führte, so dass der unter diskutierte Wirkungsverlust der ausgewählten PL in einem Phospholipase A2-enthaltenden Transportmedium überzeugend
150 128 4 Ergebnisse und Diskussion geklärt werden konnte. Folglich sollte eine solche Degradation bei einer womöglichen oralen PL- Applikation einkalkuliert und bestmöglich umgangen werden. 25 Caco-2 Digoxin P app Ratio [sec/abs] * Control Verapamil 0.5 mm 6:0 LPC 0.1 mm 8:0 LPC 0.1 mm 10:0 LPC 0.1 mm Abbildung 4.4-9: Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit Verapamil (Positivkontrolle) oder LPC-Zubereitungen in HBSS n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den Kontrollwert
151 4 Ergebnisse und Diskussion 129 Relative Calcein-Fluoreszenz [%] *** MDCKII mdr1 MDCKII WT Control Verapamil 0.5 mm 6:0 LPC 0.1 mm 8:0 LPC 0.1 mm 10:0 LPC 0.1 mm Abbildung : P-gp-abhängige relative Calcein-Fluoreszenz in MDCKII mdr1- (grau) und MDCKII WT-Zellen (schwarz) nach Prä-Inkubation mit Verapamil (Positivkontrolle) oder LPC-Zubereitungen in HBSS ph 6,5 Die Absolutwerte wurden durch einen Calcein-AM-freien Blankwert korrigiert und prozentual auf eine nur mit HBSS und Calcein-AM behandelte Kontrolle (= 100 % RF) bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bezogen auf den Kontrollwert
152 130 4 Ergebnisse und Diskussion Verwendung von modifiziertem fasted state simulated intestinal fluid (Fassif) ph 6,5 als Versuchsmedium (w/o Phospholipase A2) Da das Enzym PL A2 als Störelement bei der lipidinduzierten P-gp-Hemmung identifiziert werden konnte, sollte nun geprüft werden, inwiefern mod. Fassif allein (Fassif w/o) die Wirkung potenter PL beeinträchtigte. Appliziert wurden die drei Lipide, die sich im kompletten PL-Screening bewährt hatten: 8:0, 10:0 und cis-22:6 PC Digoxintransportstudien in Caco-2- und MDCKII mdr1-zellen Bezüglich des Digoxintransports in Caco-2 führte sowohl Fassif w/o allein, als auch in Kombination mit den genannten Lipiden zu einer verbesserten Netto-Resorption des Wirkstoffs ohne dabei die Integrität des Monolayers zu schädigen (Abb ; weiße Balken; Tab ). Fassif + Phospholipase A2 konnte im Gegensatz dazu keine verbesserte Digoxinresorption erreichen (Tab ). 10:0 PC in Fassif w/o ergab eine signifikante Ratio-Reduktion auf 38 % im Vergleich zur HBSS-Kontrolle und war somit deutlich hemmpotenter als reiner Fassif w/o, der nur eine Verminderung auf 59 % hervorrief (Tab ). Auch 8:0 PC hatte eine stärkere Inhibitionswirkung als Fassif w/o allein (48 % relative Ratio, Tab ). Nur cis-22:6 PC konnte den Hemmeffekt des simulierten Darmsafts nicht steigern (71 % relative Ratio, Tab ). Vergleicht man diese Werte mit den Ergebnissen, die in HBSS ph 6,5 generiert wurden (Tab , in Klammern), so waren 8:0 PC und cis-22:6 PC in HBSS ca. doppelt so wirksam wie in Fassif w/o (relative Ratios von 24 % vs. 48 % bzw. 39 % vs. 71 %). Nur 10:0 PC konnte ähnliche Werte erzielen (38-39 %). Somit schien dieses Transportmedium das hemmende Potential der simultan applizierten PL zwar partiell zu schwächen, doch nie komplett aufzuheben. Um diese nicht ganz eindeutigen Effekte zu verifizieren, wurde dieser Versuch in MDCKII mdr1 wiederholt (Abb , graue Balken). Hierbei hatten sowohl Fassif w/o, als auch 8:0 PC in Fassif w/o keinen Effekt auf P-gp. 10:0 PC konnte die Kontroll-Ratio (in HBSS) um 30 % senken, das ungesättigte Derivat sogar signifikant um über 50 %. Dies stand im klaren Gegensatz zu den HBSS- Versuchen in MDCKII mdr1, wo Reduktionen auf ca. 6 bzw. 21 oder 39 % erzielt werden konnten (Tab , in Klammern). Somit verschlechterte auch hier Fassif w/o das PL-induzierte Hemmergebnis.
153 4 Ergebnisse und Diskussion 131 Digoxin P app Ratio [sec/abs] * * * Caco-2 MDCKII mdr1 * Control Verapamil 0.5 mm Fassif w/o 8:0 PC 0.1 mm in Fassif w/o 10:0 PC 0.1 mm in Fassif w/o cis-22:6 PC 0.3 mm in Fassif w/o Abbildung : Digoxin P app Ratio in Caco-2- (weiß) und MDCKII mdr1-zellen (grau) in reinem HBSS ph 6,5 (Control) und nach 30-minütiger Prä-Inkubation mit Verapamil (Positivkontrolle), reinem mod. Fassif oder PC-Zubereitungen in mod. Fassif w/o n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den Kontrollwert
154 132 4 Ergebnisse und Diskussion Tabelle 4.4-4: Relative Digoxin P app Ratio der getesteten PL in Fassif w/o (bezogen auf den Kontrollwert von Digoxin in reinem HBSS ph 6,5 in [%]) in Caco-2- und MDCKII mdr1- Transportstudien Substanz Relative P app Ratio [%] Caco-2 Relative P app Ratio [%] MDCKII mdr1 HBSS ph 6, Verapamil 10,98 * 25,08 * Fassif w/o 59,36 128,76 + 8:0 PC 47,90 (24,05) 100,00 (6,48) + 10:0 PC 38,22 * (39,76) 69,89 (21,38) + cis-22:6 PC 70,68 (39,34) 47,65 * (39,22) Die Ratio-Werte in Klammern entsprechen den Ergebnissen aus den Transportstudien in HBSS ph 6,5 (s. Tab und 4.3-4) CAA-Studien in MDCKII mdr1- vs. WT-Zellen Zur weiteren Aufklärung wurden mit den gleichen Substanzen CAAs in einer MDCKII- Vergleichsstudie (mdr1 vs. WT) durchgeführt. In mdr1 steigerten alle PL, aber auch das reine Transportmedium mod. Fassif w/o die relative Calcein-Fluoreszenz im hoch bis höchst signifikanten Maße. Das Medium allein war sogar um ca. 150 % potenter als im Gemisch mit den Lipiden. Verglichen dazu wurde im Wildtyp keine bzw. lediglich signifikante Steigerung erreicht (Abb ). In diesem Assay konnte somit eine P-gp-Inhibition durch Fassif w/o ± ausgewählte PL gezeigt werden, auch wenn nicht der Hemmeffekt von Verapamil erreicht wurde. Mit HBSS als Transportpuffer konnte allerdings mit den gleichen Lipiden durchaus eine Verapamil-ebenbürtige Inhibition erzielt bzw. sogar übertroffen werden (Kap ). Somit ließ sich auch bei Anwesenheit von Fassif w/o für die ausgewählten Lipide eine Transporterhemmung postulieren, doch war sie weniger ausgeprägt.
155 4 Ergebnisse und Diskussion 133 Relative Calcein-Fluoreszenz [%] *** * *** ** *** MDCKII mdr1 MDCKII WT * ** Control Verapamil 0.5 mm Fassif w/o 8:0 PC 0.1 mm in Fassif w/o 10:0 PC 0.1 mm in Fassif w/o cis-22:6 PC 0.3 mm in Fassif w/o Abbildung : P-gp-abhängige relative Calcein-Fluoreszenz in MDCKII mdr1 (grau) und MDCKII WT Zellen (schwarz) nach Prä-Inkubation mit Verapamil (Positivkontrolle), reinem modifizierten Fassif oder PC-Zubereitungen in mod. Fassif w/o Die Absolutwerte wurden durch einen Calcein-AM-freien Blankwert korrigiert und prozentual auf eine nur mit HBSS und Calcein-AM behandelte Kontrolle (= 100 % RF) bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***), 0,01 (**) bzw. 0,05 (*) bezogen auf den Kontrollwert Interpretation des Einflusses von mod. Fassif ph 6,5 w/o als Transportmedium Die Datenlage war in diesem Studienteil sehr vielschichtig: Transportstudien in Caco-2 deuteten auf eine moderate Hemmleistung von Fassif alleine bzw. in Kombination mit den selektierten Lipiden hin. Der Einsatz 8:0 und 10:0 PC ergab zudem eine stärkere Hemmung als Fassif w/o in Reinform, was einen positiven zusätzlichen Hemmeffekt durch diese Substanzen nahelegte. Das PL-Ergebnis war allerdings nur für 10:0 PC vergleichbar gut wie in Studien mit HBSS als Transportpuffer. 8:0 und cis-22:6 PC wiesen in Fassif w/o lediglich halb so starke Hemmleistung auf. Der Verifzierungsversuch in MDCKII mdr1 ergab komplette Unwirksamkeit von Fassif und 8:0 PC und erneut moderate Effekte für 10:0 PC und cis-22:6 PC, was erneut den Vorteil einer Lipidbeimischung zum Fassif belegte.
156 134 4 Ergebnisse und Diskussion CAA-Studien in MDCKII mdr1 vs. WT belegten wiederum signifikante P-gp-Inhibition aller getesteten Proben incl. reinem Fassif w/o. Demnach konnte bei den PL-enthaltenen Zubereitungen die Hemmleistung entweder durch die PL oder durch das eingesetzte Transportmedium zu Stande kommen. So ließ sich schlussfolgern, dass das Transportmedium mod. Fassif im Vergleich zu HBSS die P-gp-Inhibition durch die zugemischten PL zwar einschränkte, eine gewisse P-gp-Aktivität dieser Lipide aber dennoch beibehalten wurde. Gründe für eine verminderte Wirksamkeit könnten eine GS-bedingte PL-Komplexierung oder -Solubilisierung oder aber Interaktionen mit dem in Fassif enhaltendem PC-Gemisch Lecithin sein (Nordskog et al. 2001). Womöglich wurden durch Mischmizellbildung die solubilisierten PL-Moleküle, die mit P-gp hätten interagieren können, der Lösung entzogen und so in ihrer Wirksamkeit eingeschränkt. In GS-freien Pufferlösungen wie HBSS liegt zumindest ein PL-Monomergehalt im Bereich der jeweiligen kritischen Mizellbildungskonzentration (CMC) vor (s. Kap ). Somit wäre die bereits unter getätigte Vermutung, dass für die P-gp-Hemmung primär das Vorhandensein des intakten PL- Moleküls entscheidend sei, bekräftigt. Erstaunlich war der ausgeprägte Transport- bzw. Akkumulations-modulierende Effekt von reinem Fassif w/o, der beim CAA sogar stärker ausfiel, als in Kombination mit den besagten PL. Zum einen unterstrich dies die Notwendigkeit, vermeintliche P-gp-Inhibitoren in möglichst interaktionsfreiem Transportmedium zu identifizieren, um eventuelle Medium-induzierte Inhibition auszuschließen bzw. später ausmachen zu können. Zum anderen warf es die Frage nach dem transportermodulierenden Bestandteil dieses Mediums auf, was im Folgekapitel näher untersucht werden sollte Testung der Gallensalzmischung Natrium-Glykocholat + Natrium- Glykochenodesoxycholat (1:1, mol/mol) auf P-gp-Inhibition Bestimmte Gallensalze (GS), wie Natrium-Taurocholat oder Natrium-Desoxycholat, wurden bereits als P-gp-Hemmstoffe identifiziert (Schuldes et al. 2001, Deferme et al. 2003), allerdings nicht die in unserer Fassif-Rezeptur enthaltenen Derivate Na GC und Na GCDC. Da vorherige Studien einen P-gp-modulierenden Einfluss des modifizierten Fassifs vermuten ließen, wurden auf der Suche nach dem wirksamen Bestandteil die Reinstoffe in HBSS ph 6,5 gelöst und in äquimolarer Menge in den etablierten P-gp-Assays eingesetzt.
157 4 Ergebnisse und Diskussion Digoxintransportstudien in Caco-2- und MDCKII-Zellen Die 1:1 (mol/mol)-mischung erzielte in 1,5 mm Konzentration in keiner der drei Zelllinien signifikante Hemmeffekte. Eine Steigerung auf 3,0 mm, wie sie auch in Fassif verwendet wurde, erreichte allerdings signifikante Reduktionen um ca. 65 % in Caco-2 (Abb ), 50 % in MDCKII mdr1 und 70 % in MDCKII WT (Abb ). 30 Caco-2 Digoxin P app Ratio [sec/abs] * * Control Verapamil 0.5 mm Na GC, Na GCDC (1:1) 1.5 mm Na GC, Na GCDC (1:1) 3.0 mm Abbildung : Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control) und nach 30- minütiger Prä-Inkubation mit Verapamil (Positivkontrolle) oder einer äquimolaren Gallensalzmischung von Na GC und Na GCDC in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den Kontrollwert
158 136 4 Ergebnisse und Diskussion Digoxin P app Ratio [sec/abs] * * MDCKII mdr1 MDCKII WT * * Control Verapamil 0.5 mm Na GC, Na GCDC (1:1) 1.5 mm Na GC, Na GCDC (1:1) 3.0 mm Abbildung : Digoxin P app Ratio in MDCKII mdr1- (grau) und MDCKII WT-Zellen (schwarz) in reinem HBSS ph 6,5 (Control) und nach 30-minütiger Prä-Inkubation mit Verapamil (Positivkontrolle) oder einer äquimolaren Gallensalzmischung von Na GC und Na GCDC in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den Kontrollwert
159 4 Ergebnisse und Diskussion CAA-Studien in MDCKII mdr1- vs. WT-Zellen Prä-inkubierte man für den CAA beide MDCKII-Zelllinien mit der GS-Mischung in 3,0 mm (wie in mod. Fassif), so konnte ebenfalls eine starke Transporterhemmung festgestellt werden: In mdr1 wurde die relative Calcein Fluoreszenz um ca. 400 %, im WT nur um ca. 200 % gesteigert (Abb ). Dies war zwar ein deutliches Ergebnis, jedoch vom Ausmaß der Hemmung nicht so gravierend, wie bei den die in dieser Arbeit identifizierten PL in HBSS (Kap ; Abb ), die den Verapamil-Wert von 800 % RF partiell sogar übertreffen konnten. Relative Calcein-Fluoreszenz [%] Control *** Verapamil 0.5 mm * *** Na GC, Na GCDC (1:1) 3.0 mm MDCKII mdr1 MDCKII WT * Abbildung : P-gp-abhängige relative Calcein-Fluoreszenz in MDCKII mdr1- (grau) und MDCKII WT-Zellen (schwarz) nach Prä-Inkubation mit Verapamil (Positivkontrolle) oder einer äquimolaren Gallensalzmischung von Na GC und Na GCDC in HBSS ph 6,5 Die Absolutwerte wurden durch einen Calcein-AM-freien Blankwert korrigiert und prozentual auf eine nur mit HBSS und Calcein-AM behandelte Kontrolle (= 100 % RF) bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bzw. 0,05 (*) bezogen auf den Kontrollwert
160 138 4 Ergebnisse und Diskussion Interpretation des Gallensalz-Effektes in P-gp-Assays Die durchgeführten P-gp-Assays zeigten, dass eine Lösung von Na GC und Na GCDC in der Konzentration von 3,0 mm in HBSS ph 6,5 signifikante, Transporter-modulierende Eigenschaften aufwies. Dies stellte eine interessante Erkenntnis dar, welche die durch mod. Fassif hervorgerufenen P-gp-Hemmeffekte aus Kapitel erklärte. Allerdings war Fassif in den durchgeführten Studien partiell weniger potent als die reinen Gallensalzlösungen, was womöglich auf die Anwesenheit von Lecithin (Tab ) und somit auf die Komplexierung von GC und GCDC in Form von Mischmizellbildung zurückzuführen ist (Nordskog et al. 2001). An eine PLinduzierte P-gp-Inhibition in HBSS reichten die Ergebnisse jedoch nicht heran (s. Kap. 4.3), so dass die Tenside womöglich selbst in einer Konzentration von 3,0 mm keine hohe Aktivität am Transporter besitzen. Für die in vivo Situation spielt die gezeigte Hemmleistung auf Grund der Komplexbildung mit diversen Nahrungslipiden, anderen, hier nicht berücksichtigen Darmsaftbestandteilen (Pepsin) und einer deutlich geringeren und ständig schwankenden GS-Konzentration kaum eine Rolle (Jantratid et al. 2008), so dass P-gp intestinal weiterhin hochgradig aktiv bleibt. Die exakten physiologischen Zustände lassen sich letztendlich im Zellversuch immer nur schwer simulieren. Ob nun die in mod. Fassif vorliegenden PL-Zubereitungen aus Kap durch den spezifischen Einfluss des PLs oder der im Medium enthaltenen GS P-gp-Inhibition ausübten, konnte in diesen Studien nicht endgültig aufgeklärt werden. Da die GS in 10- bis 30-fach höherer Konzentration als die PL eingesetzt wurden (3,0 mm vs. 0,1 bzw. 0,3 mm), wäre es möglich, dass P-gp nahezu quantitativ durch die Tenside abgesättigt wurde und keine PL-Transporter-Interaktion mehr stattfinden konnte. Dies würde erklären, warum bei einer Simultangabe von PL und GS nur eine moderate, GS-vermittelte Hemmleistung und kein additiver Effekt erzielt wurde. Zudem konnte bereits in Versuchen mit HBSS ph 6,5 als Transportpuffer belegt werden, dass von den ausgewählten Lipiden eine höchst signifikante und stabil reproduzierbare Transporterhemmung ausging.
161 4 Ergebnisse und Diskussion Gallensalz-bedingte Solubilisierung ausgewählter PL-Zubereitungen Mehrfach wurde in dieser Arbeit schon der Prozess der GS-induzierten Solubilisierung von PL- Vesikeln erwähnt, der bei der Formulierung dieser Lipide in Fassif vermutlich stattfand. Anhand von Kryo-TEM-Bildern (Kap ; Abb und -5) konnte bereits festgestellt werden, dass für 10:0 PC (17,7 mm) in diesem Transportpuffer eine komplette Auflösung jeglicher liposomaler Strukturen auftrat. Die Formulierung des langkettigen, ungesättigten Derivats cis-22:6 PC beinhaltete aber selbst in 8,6 mm noch deutliche, wenn partiell auch verformte oder geschrumpfte Vesikel (Abb ). Diese Diskrepanz veranschaulichte bereits, dass die Aggregate des kürzerkettigen Derivates um einiges leichter von den Tensiden solubilisiert wurden. Allerdings stellten diese mikroskopischen Aufnahmen nur einen selektiven Ausschnitt aus der jeweiligen Formulierung dar und ließen somit nur begrenzten Rückschluss über die Beschaffenheit der kompletten Zubereitung zu. Deswegen wurde mittels Streulichtmessungen am Zetasizer Nano die vesikelbedingte Zählrate (Countrate) von verschiedenen PL-Proben in GS-freiem HBSS ph 6,5 bestimmt und dieser jeweilige Anfangswert als 100 % relative Countrate gewertet. Wurden steigende Mengen an GS hinzugegeben, konnte anhand eines schlagartigen Abfalls dieser relativen Countrate der sog. PL-spezifische Solubiliserungspunkt identifiziert werden (Theobald 2009). Dieser entsprach dem Quotienten aus benötigter GS-Konzentration und verwendeter PL- Konzentration (s. Tab ) Bestimmung der konzentrationsabhängigen Solubilisierung mittels Streulichtmessungen Vermessen wurde zunächst das Referenzlipid 16:0 PC (= DPPC), was sich durch eine hohe PTT und eine extrem niedrige CMC auszeichnet (Tab ; s. Kap ). Für dieses Lipid war somit eine hohe Vesikularisierungstendenz unter Ausbildung relativ resistenter Membranen anzunehmen. Wurde diese Liposomenzubereitung (0,1 mm) mit steigenden Konzentrationen an Na GC und Na GCDC (1:1, mol/mol) versetzt, so konnte erst ab 2,0 mm GS-Mischung ein beginnender Abfall der relativen Countrate verzeichnet werden. Komplette Solubilisierung war ab 3,0 mm an Gesamt-GS erreicht (Abb , gepunktete Linie). Im Falle von cis-22:6 PC (0,1 mm) begannen sich bereits ab 1,0 mm GS-Mischung Vesikel aufzulösen, ab 2,0 mm konnten keine größeren Partikel mehr per Streulicht in der Zubereitung detektiert werden (Abb , durchgezogene Linie).
162 140 4 Ergebnisse und Diskussion Für 10:0 PC (0,1 mm) setzte die Solubilisierung sogar schon bei 0,1 mm GS-Gemisch ein, einer 10-fach geringeren Konzentration als bei cis-22:6 PC und 20-fach geringer als bei DPPC. Bei 0,5 mm Tensidmischung war bereits das Basallevel von 25 % relativer Countrate erreicht (Abb , gestrichelte Linie) DPPC cis-22:6 PC 10:0 PC Relative Countrate [%] ,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0 Na GC, Na GCDC (1:1) [mm] Abbildung : Solubilisierung von DPPC- (gepunktet), cis-22:6 PC-(durchgezogen) und 10:0 PC- Vesikeln (gestrichelt) durch steigende Konzentration an Gallensalzmischung Na GC, Na GCDC (1:1 mol/mol) in HBSS ph 6,5 Die Absolutwerte der streulichtabhängigen Countrate wurden prozentual auf den zugehörigen Wert der GSfreien Zubereitungen (= 100 %) bezogen. PL-Conc. = 0,1 mm in HBSS ph 6,5; n = 3; Werte sind als Mittelwerte + SD angegeben Interpretation Die GS-Konzentration, die für PL-Formulierungen der Konzentration 0,1 mm zur kompletten Solubilisierung notwendig waren, unterschieden sich bei den drei vermessenen Lipiden um ein Vielfaches: 10:0 PC reagierte am sensibelsten auf Tensideinflüsse, da ab 0,5 mm Gallensalz eine nahezu aggregatfreie Zubereitung entstand, d.h. es genügte ein 5-facher Überschuss an GS um vorhandenes PL komplett zu solubilisieren. Dies ergab eine sog. GS-PL-Ratio von 5 (Tab ). Dieses PL besitzt auf Grund seiner kurzen FA-Reste eine relativ hohe CMC von 5 µm (Tab ) und liegt somit schon in tensidfreiem Puffer zu einem Großteil monomer gelöst vor (Avanti(R)
163 4 Ergebnisse und Diskussion 141 Polar Lipids 1999). Die GS-Konzentration in mod. Fassif beträgt 3,0 mm, deutlich höher als 0,5 mm - wenn auch vermutlich z.t. an Lecithin gebunden-, so dass von einer kompletten Solubilisierung des Lipids in diesem Transportmedium ausgegangen werden konnte. Zumal da 10:0 PC auch im Zellversuch immer nur mit 0,1 mm eingesetzt wurde. Bei cis-22:6 PC bedurfte es einer 4-mal so hohen GS-Konzentration (2,0 mm) um die vorhandenen Vesikel quantitativ aufzulösen, genauer gesagt war ein 20-facher GS-Überschuss vonnöten, was einer GS-PL-Ratio von 20 entsprach (Tab ). Dieses PL bildete auf Grund seiner langen FA- Ketten bereitwillig liposomale Aggregate, jedoch führten die vielen Doppelbindungen zu einer hohen Membranfluidität und extrem geringen PTT von 68,4 C (Ehringer et al. 1990, Zerouga et al. 1995). Verglichen mit 10:0 PC war somit eine sehr viel höhere Solubilisierungsresistenz gegeben, was auch das unterschiedliche Aussehen der Kryo-TEM-Bilder beider Lipide in Fassif + PL A2 erklären könnte (Abb und 4.4-6). Allerdings wurde cis-22:6 PC im Zellversuch 3-mal so konzentriert appliziert wie in dieser Messung (0,3 mm), so dass bei einer GS-PL-Ratio von 20 eine 6 mm GS-Lösung zur kompletten Solubiliserung verwendet werden müsste. Da mod. Fassif aber nur 3,0 mm GS und zudem noch komplexierendes Ei-Lecithin enthielt, konnte weiterhin von Liposomen in der Versuchsformulierung ausgegangen werden, was durch Abbildung bestätigt wurde. Zur Verifizierung der Methodik wurde zudem DPPC vermessen, welches eine GS-PL-Ratio von 30 erreichte (Tab ). Bedingt durch seine molekulare Struktur bildete es bereits in geringster Konzentration sehr stabile Vesikel, die einer tensidbedingten Solubilisierung äußerst lange standhielten (Avanti(R) Polar Lipids 1999). Tabelle 4.4-5: Solubilisierungspunkt der vermessenen PL, angegeben als GS-PL-Ratio Phospholipid GS-PL-Ratio DPPC 3,0 mm : 0,1 mm = 30 cis-22:6 PC 2,0 mm : 0,1 mm = 20 10:0 PC 0,5 mm : 0,1 mm = 5
164 142 4 Ergebnisse und Diskussion 4.5 Bedeutung der Lipidaggregatbildung für die P-gp-Inhibition in vitro Einfluss der Herstellungsmethode: Ultraschall vs. Extrusion Neben den Bestandteilen des verwendeten Transportmediums könnten aber auch, wie schon mehrmals in dieser Arbeit angesprochen wurde, die Aggregationsformen innerhalb der Lipidzubereitung einen elementaren Einfluss auf die Effizienz der P-gp-Hemmung ausüben. Die Größe und Größenverteilung von Liposomen lässt sich beispielsweise durch die Art der Herstellung variieren: So führt die Ultraschallbehandlung liposomaler OLV (oligolamellar large vesicles)- oder MLV (multilamellar large vesicles)-dispersionen landläufig zu kleinen Vesikeln, den SUV (small unilamellar vesicles), von < nm Durchmesser mit einer breiten Größenverteilung (Yamaguchi et al. 2009). Extrudiert man jedoch die OLVs stattdessen durch Polycarbonat (PC)-membranen einer definierten Porengröße (z.b. 80 nm), so erhält man generell größere, unilamellare Liposomen (LUV = large unilamellar vesicles) eines relativ engen Größenbereichs (Berger et al. 2001, Jesorka & Orwar 2008). Wie stark sich Zubereitungen desselben Lipids auf Grund ihrer Herstellung in Größe und Größenverteilung voneinander unterscheiden, ist jedoch stark vom eingesetzten Lipidmolekül und seinen physiko-chemischen Eigenschaften (CMC, PTT, etc.) abhängig. Der Einfluss der Produktionsweise auf den in vitro-effekt von PL wurde am Beispiel von zwei PL in Caco-2-CAA-Studien untersucht: Das mittelkettige 10:0 PC bildete nach der Extrusion (51-mal durch eine Polycarbonatmembran mit 80 nm Porendurchmesser) relativ heterogene Liposomen mit einem PDI > 0,2. Der Vesikeldurchmesser lag mit 96 nm dennoch in guter Übereinstimmung mit den Poren der Extrusionsmembran (Tab ). Kryo-TEM Aufnahmen bestätigten zudem das Vorhandensein klar geformter, unilamellarer Vesikel (Abb ). Die Ultraschallprobe zeigte eine extrem breite Größenverteilung (PDI von 0,5), was die Beurteilung der PCS-Daten immens erschwerte (Tab ). Generell ist bei solch einem hohen PDI der zugehörige hydrodynamische Durchmesser nicht mehr realitätsgetreu (Baalousha & Lead 2012). Per Kryo-TEM ließen sich erwartungsgemäß viele kleinste Lipidpartikel oder -mizellen im Bereich nm Durchmesser nachweisen (Abb ). Im Zellversuch waren allerdings beide Zubereitungen gleichsam effektiv und erreichten relative Inhibitionswerte von % (Abb ).
165 4 Ergebnisse und Diskussion 143 Abb : 10:0 PC (Ultraschall) Abb : 10:0 PC (Extrusion) Abb : cis-22:6 PC (Ultraschall) Abb : cis-22:6 PC (Extrusion) Abbildungen bis 4.5-4: Kryo-TEM-Aufnahmen von 10:0 PC- und cis-22:6-zubereitungen in HBSS ph 6,5 Herstellung mittels Filmmethode, anschließender Rehydratisierung und 15-minütiger Behandlung im Ultraschallbad (25 C; Abb und 4.5-3) bzw. anschließender Extrusion durch PC-Membranen (51-mal 80 nm; Abb und 4.5-4) bei RT. PL-Conc. = 17,7 mm (4.5-1)/ 11,4 mm (4.5-2) bzw. 8,6 mm (4.5-3 und 4.5-4)
166 144 4 Ergebnisse und Diskussion Cis-22:6 PC zeigte ebenfalls nach Ultraschall- bzw. Extrusionsbehandlung vergleichbare Hemmeffekte von ca. 30 % RI (Abb ). Dabei beinhaltete die extrudierte Probe klar definierte Vesikel (Abb ) einer homogenen Größe von ca. 130 nm Durchmesser (Tab ). Nach Ultraschallbehandlung waren Durchmesser und PDI um % höher, was für eine heterogene Partikelgrößenverteilung sprach. Da bei der PCS-Analytik heterogener Proben kleine Teilchen weniger stark ins Gewicht fallen als große, kann anhand der Messdaten keine konkrete Aussage über das reale mengenmäßige Verhältnis der Teilchenpopulationen getroffen werden. Der durschnittliche hydrodynamische Durchmesser wird somit unverhätnismäßig in höhere Größenbereiche verschoben (Baalousha & Lead 2012). Abbildung zeigt aber deutlich das Vorhandensein von Liposomen geringster Größe (< 50 nm), die z.t. in 500 nm großen Vesikeln verkapselt vorlagen. Tabelle 4.5-1: Hydrodynamischer Durchmesser und Polydispersitätsindex (PDI) unterschiedlich hergestellter PL-Zubereitungen in HBSS ph 6,5, vermessen mittels PCS-Analytik Ultraschall (15 min, 25 C) Extrusion (51-mal 80 nm) Phospholipid Hydrdynamischer Durchmesser [nm] PDI Hydrdynamischer Durchmesser [nm] PDI 10:0 PC 1442 ± 400,6 0,513 ± 0,246 95,69 ± 1,55 0,324 ± 0,021 cis-22:6 PC 158,7 ± 4,56 0,121 ± 0, ,8 ± 0,620 0,094 ± 0,006 Hydrodynamischer Durchmesser und PDI sind als Mittelwert ± SD aus drei Messungen (21 Einzelläufe) angegeben
167 4 Ergebnisse und Diskussion Ultraschallbad Extrusion Relative Inhibition [%] Verapamil 0.5 mm 10:0 PC 0.1 mm cis-22:6 PC 0.2 mm Abbildung 4.5-5: Relative Inhibition des P-gp-abhängigen Calcein-AM-Efflux in Caco-2-Zellen nach Prä-Inkubation mit Verapamil (Positivkontrolle mit 100 % RI; weder Ultraschall- noch Extrusionsbehandlung) oder PL-Zubereitungen in HBSS ph 6,5, hergestellt mittels Ultraschallbehandlung (weiß) oder Extrusion (51-mal 80 nm; gestreift) Die Absolutwerte wurden durch eine mit HBSS behandelte Kontrolle korrigiert und prozentual auf die Verapamil-Positivkontrolle bezogen; n = 6; Werte sind als Mittelwerte + SD angegeben
168 146 4 Ergebnisse und Diskussion Einfluss des Lipidaggregation unter Berücksichtigung der kritischen Mizellbildungskonzentration (CMC) Was die genaue, P-gp-inhibierende Komponente in den wirksamen PL-Zubereitungen darstellt, konnte in den bisherigen Experimenten noch nicht eindeutig aufgeklärt werden. Die Studien aus zeigten zwar, dass die Vesikelstruktur, -gleichförmigkeit und -größe keinen Einfluss auf die in vitro Aktivität zu haben schienen, aber ob nun etwa Lipidmonomere oder Aggregate für die Hemmung verantwortlich waren, ging aus ihnen nicht hervor. Die beiden hemmpotenten mittelkettigen Derivate 8:0 und 10:0 PC besitzen relativ hohe CMC- Werte von 0,27 mm (8:0 PC) und 0,005 mm (10:0 PC) (Tab ) und lagen daher bei einer im Zellversuch verwendeten Konzentration von 0,1 mm komplett (8:0 PC) bzw. partiell (10:0 PC) als Monomere in Lösung vor (Avanti(R) Polar Lipids 1999). Zur Überprüfung, ob diese gelöste PL-Fraktion für die P-gp-inhibitorische Wirkung verantwortlich war, wurde 8:0 PC in drei unterschiedlichen Konzentrationen, unterhalb seiner CMC in Caco-2- Transportstudien eingesetzt. Wie Abbildung (graue Balken) veranschaulicht, erfolgte eine konzentrationsabhängige Reduktion der Digoxin Papp Ratio. Allerdings handelte es sich nicht um einen linearen Zusammenhang, da bei 0,04 mm Lipid nicht annähernd die 50 %-ige Hemmung von 0,1 mm erreicht wurde. Dies ließ vermuten, dass 8:0 PC zwar in der Tat als Monomer mit dem Transporter interagiert, aber ein gewisser Lipidanteil ohne P-gp-Interaktion im Versuchssystem, z.b. inkorporiert in die Zellmembran, verbleibt und erst ab einem bestimmten Schwellenwert der Transporter inhibiert wird. Das 10:0-Derivat wurde in 0,002 mm, ebenfalls unterhalb seiner CMC von 0,005 mm, und des Weiteren, wie auch in den vorherigen Assays, in 0,1 mm prä-inkubiert. In dieser Konzentration hätten sich theoretisch 0,005 mm an Lipidmonomer im Äquilibrium mit gebildeten Aggregaten befinden müssen. Die gestreiften Balken in Abbildung zeigen, dass die geringere Lipidkonzentration mit einem ca. halb so großen Monomergehalt eine Hemmung um ca. 25 % hervorrief, während die doppelte Monomermenge bei 0,1 mm den Quotienten um ca. 60 % reduzierte. An dieser Stelle muss bedacht werden, dass oberhalb der CMC PL-Vesikel und -Monomere stets im Gleichgewicht miteinander vorliegen. Daher hätte sich, nach der Verteilung von 10:0 PC-Monomeren in die apikale Zellmembran während der Prä-Inkubationsphase, durch Vesikelauflösung stets wieder die CMC-abhängige Monomerkonzentration im Zellüberstand hergestellt. Demnach könnte sich auch hier, wie bei 8:0 PC, Lipidmonomer bis zu einem
169 4 Ergebnisse und Diskussion 147 bestimmten Schwellenwert in der Caco-2-Membran angereichert haben, bis schließlich P-gp- Inhibition erfolgte. Allerdings konnte nicht absolut ausgeschlossen werden, dass auch 10:0 PC-Aggregate inhibitorischen Effekt auf P-gp ausübten, da diese Formulierung allgemein nicht in einer komplett homogenen Vesikelgröße vorlag (Tab : PCS-Daten der extrudierten Zubereitung) und es äußerst kompliziert gewesen wäre, den Einfluss aller vorhandenen Strukturen zu untersuchen. Allerdings bewirkte die Verdopplung der Monomerkonzentration eine deutliche Effektsteigerung, so dass auch hier die Monomertheorie durchaus plausibel erscheint. Digoxin P app Ratio [sec/abs] *** 8:0 PC 10:0 PC *** 0 Control 0.04 mm 0.08 mm 0.1 mm mm 0.1 mm Abbildung 4.5-6: Digoxin P app Ratio in Caco-2-Zellen in reinem HBSS ph 6,5 (Control, weiß) und nach 30-minütiger Prä-Inkubation mit 8:0 PC-Zubereitung (hellgrau) oder 10:0 PC-Zubereitung (gestreift) in unterschiedlichen Konzentrationen in HBSS ph 6,5 n = 3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 10-3 (***) bezogen auf den Kontrollwert
170 148 4 Ergebnisse und Diskussion Interpretation der Ergebnisse Die Variation der Herstellungsmethode und somit der Größe, Größenverteilung und der genauen Morphologie der in der Zubereitung vorhandenen PL-Aggregate war für die inhibitorische Potenz der getesten Derivate nahezu unerheblich. Dies ließ bereits darauf schließen, dass vielmehr die strukturelle Eigenheit der spezifischen Lipidmoleküle für den in vitro Effekt verantwortlich war. Schließlich liegen in jeder PL-Formulierung, unabhängig von den vorhandenen Aggregatstrukturen und -größen, Vesikel im dynamischen Gleichgewicht mit PL-Monomeren vor. Daher wurde bei zwei P-gp-aktiven Lipiden, 8:0 PC und 10:0 PC, die eine vergleichsweise hohe CMC besitzen, getestet, inwiefern eine Konzentrationssteigerung an reinem Monomeranteil auch eine Steigerung der Transporterhemmung nach sich zog. Solch ein Effekt trat zwar auf, folgte aber keinem linearem Zusammenhang, so dass sich schlussfolgern ließ, dass sich die PL höchstwahrscheinlich als nicht-vesikulär gebundene Monomere in die Zellmembran hineinverteilten und bis zu einem gewissen Schwellenwert anreicherten, bis sie mit dem Transportprotein interagierten. Gleichzeitig könnte mit der Monomertheorie auch erklärt werden, warum die anderen gesättigten PC-Derivate, die in ihrer Struktur nur um ein paar C-Atome von den beiden potenten Vertretern abweichen ( 12 C-Atome), keine detektierbaren Hemmeffekt ausübten (Tab ): Sie lagen auf Grund ihrer deutlich geringeren CMC (Tab ) nur zu minimalen Konzentrationen monomerisch vor und konnten kaum mit dem Transmembranprotein wechselwirken.
171 4 Ergebnisse und Diskussion Mechanistische Aufklärung der Phospholipid-induzierten P-gp- Inhibition P-gp-Inhibition kann prinzipiell durch unterschiedliche Mechanismen erfolgen. Man unterscheidet hierbei zwischen indirekter Inhibition, z.b. durch Veränderung oder Fluidisierung P-gpumgebender Membranbereiche oder intrazelluläre ATP-Verarmung, und zwischen direkter Inhibition durch kompetitive oder allosterische Hemmung bzw. durch sterische Blockade des Transmembranbreichs (Romsicki & Sharom 1999, Maki et al. 2003). Auch die Inaktivierung des energieliefernden Enzyms P-gp-ATPase, das den aktiven Substratefflux unterhält, stellt eine Option dar (Collnot et al. 2007, Collnot et al. 2010) (s. Kap ). Welcher Hemmmechanismus für die identifizierten PL zutraf, sollte mit den nachfolgenden Studien näher untersucht werden P-gp-ATPase Aktivitätsmessungen Die Inhibition von Transportproteinen wird standardmäßig in zellulären Studien geprüft, allerdings stets mit dem Risiko, dass der verwendete Transportmarker in einer Kreuzreaktion unselektiv mit anderen, in der Zelllinie vorhandenen Transportproteinen interagiert. Eine sinnvolle Ergänzung unserer Studien stellte daher der Einsatz von P-gp-exprimierenden, rekombinanten Insektenzellen dar. Deren Zellmembranen ermöglichten, den Einfluss von PL auf die Enzymaktivität der P-gp- ATPase zu untersuchen und dadurch aufzuklären, ob diese PL ihren in vitro Effekt - unbeeinträchtigt von jedweden zellulären Kreuzreaktionen - tatsächlich durch P-gp-Inhibition ausübten. ATP-Hydrolyse kann schließlich nur ablaufen, wenn parallel hierzu die transportspezifischen Konformationsänderungen im Protein erfolgen. Diese beiden Prozesse sind untrennbar miteinander gekoppelt, so dass P-gp-Inhibition direkt durch eine verminderte ATPase- Aktivität erkannt werden kann (Zhou 2008, Aller et al. 2009). Als Vergleichswerte in diesem Assay dienten zum einen die Basalaktivität des Enzyms (Blank) in Abwesenheit von Inhibitoren oder Stimulantien und zum anderen die maximal stimulierte Aktivität nach Prä-Inkubation mit Verapamil (0,05 mm), das P-gp über einen kompetitiven Hemmmechanismus interferiert und somit Substrateigenschaften aufweist. Der Begriff der Vanadat-sensitiven ATPase Aktivität (act) bezeichnet hierbei den Anteil an Enzymaktivität, der durch den unselektiven ATPase-Hemmstoff Natrium-Orthovanadat (Na OV) inhibierbar ist (Feng et al. 2008, Biosciences 2010).
172 150 4 Ergebnisse und Diskussion Abbildung zeigt, dass 6:0 PE und -PC die Enzymaktivität überhaupt nicht beeinflussten. Allerdings zeigten diese Compounds auch nur in Caco-2-Transportstudien eine Wirkung und blieben in den anderen Zellassays ohne Effekt (Kap und 4.3.4). Somit wurde bestätigt, dass beide Lipide nicht mit P-gp interagierten, sondern einen anderen, noch unbekannten Transportereffekt ausübten. Cis-22:6 PC war in allen Zellversuchen wirksam (Kap ), hatte aber ebenfalls keine Wirkung auf die P-gp-ATPase (Abb ). Möglicherweise bewirkte dieses Lipid eine Form der P-gp- Hemmung, die nicht mit dem vorliegenden Assay detektiert werden konnte, sondern nur im natürlichen Zellverband stattfand, wie die Modulation des Transporter-umgebenden Lipid-Bilayers, die ebenfalls eine verminderte Effluxaktivität hervorruft (Romsicki & Sharom 1999). Möglich wäre auch, dass die Lipid-Protein-Interaktion zwar den Substrattransport verhindert, die ATPase- Aktivität aber weiterhin gegeben ist. 8:0 PC und 10:0 PC wiesen beide höchst signifikante in vitro Wirksamkeit in allen durchgeführten Zellstudien auf (Kap ). 10:0 PC war zudem in der Lage, die basale ATPase Aktivität im Vergleich zur Kontrolle (Blank) signifikant zu reduzieren (Abb ). Wurden die jeweiligen Substanzen parallel mit dem Stimulanz Verapamil appliziert, so konnte die Verapamil-induzierte Aktivitätssteigerung effektiv durch beide Lipide gehemmt werden. Dieses Ergebnis indiziert, dass 8:0 und 10:0 PC den P-gp-Transporter vermutlich direkt hemmten und zwar nicht via Verdrängung (vgl. Verapamil), sondern entweder allosterisch, durch Bindung an nicht für den Transport verantwortliche Transmembran-Proteinbereiche, oder durch sterische Blockade von Substratbindungsstellen. Beide Mechanismen hätten die für den Efflux notwendigen konformativen Änderungen innerhalb des Transporters so unterbunden, dass auch eine weitere ATP-Spaltung nicht mehr hätte stattfinden können. Letzteres ergäbe dann die in Abbildung gezeigten Aktivitätsminderungen.
173 4 Ergebnisse und Diskussion 151 Vanadate-sensitive ATPase act (nmol*mg -1 *min -1 ) * * * * Blank Verapamil 0.05 mm 6:0 PE 0.3 mm 6:0 PC 0.3 mm 8:0 PC 0.1 mm 8:0 PC 0.1 mm + Verapamil 10:0 PC 0.1 mm 10:0 PC 0.1 mm + Verapamil cis-22:6 PC 0.3 mm Abbildung 4.6-1: Vanadat-sensitive P-gp-ATPase Aktivität (act) nach Inkubation mit reinem Assaypuffer (Blank), Verapamil 0,05 mm, Lipidzubereitungen oder einer Mischung der letzten beiden Die P-gp-Membranen (20 µg Well -1 ) wurden parallel zu den Testsubstanzen mit MgATP (0,24 µmol Well -1 ) inkubiert (37 C, 30 min; 200 rpm). Eine Hälfte der Wells enthielt zudem Na OV (6 nmol Well -1 ). Die Vanadatesensitive Enzymaktivität ergab sich aus der Differenz von freigesetztem Phosphat in An- und Abwesenheit von Na OV, dividiert durch die Inkubationsdauer und die Membranmasse pro Well. n=3; Werte sind als Mittelwerte + SD angegeben; Signifikanzniveau von 0,05 (*) bezogen auf den Blank- bzw. Verapamilwert
174 152 4 Ergebnisse und Diskussion Molecular Modeling: Bestimmung einer in silico Bindungsaffinität zum P-gp- Transporter in Dockingstudien Computergestützte Simulationen von Protein-Ligand-Wechselwirkungen stellen eine sinnvolle Ergänzung dar, um Interaktionen von Substraten und Inhibitoren mit Transportern auf molekularer Ebene zu untersuchen (Peri et al. 2005). Hierfür wird ein 3D-Strukturmodell des Transportproteins verwendet, das mit sämtlichen sterischen Konformationen einer ausgewählten Substanz gedockt wird. Die bei diesem Vorgang freiwerdende Bindungsenergie, die Gibbssche freie Energie G, kann berechnet werden (Cheng et al. 2009, Pajeva et al. 2009a). So lässt sich im High Throughput- Maßstab die theoretische Affinität von ganzen Substanzbibliotheken zu bestimmten Proteinstrukturen vorhersagen (s. Kap ). Da für manche der hier identifizierten PL eine direkte molekulare Interaktion mit P-gp angenommen wurde, sollte diese Vermutung mit derartigen Dockingstudien überprüft werden. Die zugehörigen Experimente wurden von Xavier Lucas (Lehrstuhl für Pharmazeutische Bioinformatik, Universität Freiburg) durchgeführt. Für die Kreation eines humanen P-gp-3D-Modell wurde die bereits kristallisierte Modifikation aus der Hausmaus (Mus musculus) als Ausgangstemplate verwendet, da die codierenden Bereiche für die beiden Proteine im Transmembranbereich eine Sequenzidentität von 87 % besitzen. Das Modell (Abb ) repräsentierte den Transporter in seiner offenen Konformation, in welcher die Substrat-/ Inhibitorbindung höchstwahrscheinlich stattfand und wurde mit Hilfe von Verify3D auf seine Anwendbarkeit und Aussagekraft geprüft. Als weitere Bestätigung wurde der peptidische Inhibitor QZ59-SSS, für den der genaue Bindungsmodus bereits aufgeklärt werden konnte, erfolgreich im Transmembranbereich des Proteins gedockt (Pajeva et al. 2009b) (ohne Abb.). Das nachfolgende Substanzdocking erfolgte ebenfalls im Transmembranbereich unter Berücksichtigung von Molekültautomerie und dessen Protonierungszustand bei ph 6,5. Hierbei gab es für alle Strukturen eine Vielzahl an Möglichkeiten, was deren sterische Ausrichtung während der Proteinwechselwirkung betraf. Für diese Substanz-Protein-Komplexe wurden Docking Scores, sog. XP Scores, bestimmt, die eine Annäherung an die experimentelle Bindungsaffinität der betreffenden Stoffe zu den P-gp-Seitenketten darstellten. Dieser score leitete sich u.a. von der freiwerdenden Gibbsschen freien Energie (ΔG) ab und war demnach für hoch-affine Substanzen deutlich niedriger als für schwach-bindende. Generell galt ein XP Score von < - 6,0 als Indikator für starke experimentelle Affinität.
175 4 Ergebnisse und Diskussion 153 Extrazellulärbereich Transmembranbereich Intrazellulärbereich Abbildung 4.6-2: 3D-Struktur des P-gp-Transporters von Mus musculus in seiner offenen Konformation ( ) modifziert unter farbiger Indikation des elektrostatitschen Potentials der Proteinoberfläche (rot: negativ; blau: positiv; violett: neutral) In silico Affinität etablierter P-gp-Inhibitoren Einerseits wurde die experimentelle Bindungsaffinität von etablierten P-gp-Inhibitoren ermittelt, die den Transporter durch direkte Substanz-Protein-Wechselwirkung hemmen. Verapamil, das in den durchgeführten in vitro Studien als Standardkontrollhemmstoff verwendet wurde, erreichte hierbei in seiner wirksamsten Dockingvariante einen erwartungsgemäß niedrigen minimalen XP Score von - 7,7, was einer hohen Affinität zu den Transmembransektionen von P-gp entsprach (Tab ). Auch die anderen, vielfach publizierten Inhibitoren Elacridar (Guo et al. 2002) und Chinidin (Gao et al. 2001, Zolnerciks et al. 2011) erzielten minimale scores von < - 6,0, was belegte, dass diese in silico Methode durchaus zur Verifizierung potenter Substanzen genutzt werden konnte.
176 154 4 Ergebnisse und Diskussion Tabelle 4.6-1: Minimale XP Scores etablierter P-gp-Inhibitoren Substanz Minimaler XP Score Verapamil - 7,7 Elacridar - 8,5 Chinidin - 6, In silico Affinität ausgewählter Phospholipide identifiziert im in vitro P-gp- Screening Wurden die in vitro wirksamen Lipide 8:0, 10:0 und cis-22:6 PC gedockt, so erreichten die besten Lipid-Protein-Komplexe ebenfalls sehr geringe XP Scores von - 7,2 bis - 11,3 (Tab ). Da das Docking allgemein nur mit PL-Monomeren und nicht mit Aggregaten stattfand, erhärtete dies die These, dass 8:0 PC und 10:0 PC in ihrer monomeren Form P-gp auf direktem Wege inhibierten (s. Kap ). Durch die Bindung an Proteinseitenketten innerhalb des Transmembranbereichs würde somit die Bindung und damit der Transport von P-gp-Substraten verhindert werden, genauso wie die ATP-Hydrolyse. In den Abbildungen und sind zwei Dockingvarianten für 10:0 PC im Hohlraum des Transporters (violett) zu sehen: Abb zeigt die sterische Ausrichtung mit höherer Affinität (Score = - 8,6), bedingt durch die vorteilhafte Einpassung der Phosphatgruppe (orange-rot) und der Cholin-Gruppe (blau-grün-weiß) in die Tertiärstruktur des Proteins (dunkelviolett), abgewinkelt von den beiden FA-Resten (grün-weiß). Die Phosphatgruppe scheint allgemein bevorzugt H-Brücken mit Asparagin- und Glutamin-Resen der Transmembranhelix Nr. 7 und 12 des P-gp-Modells auszubilden. Die Anordnung aus Abbildung erzielte nur einen XP Score von - 7,5. Hier sieht man deutlich, dass der hydrophile PC-Kopf in größerer Nähe zu einem lipophilen FA-Rest angeordnet war, was eine geringere experimentelle Bindungsaffinität nach sich zog.
177 4 Ergebnisse und Diskussion 155 Abbildung 4.6-3: 10:0 PC gedockt im P-gp-3D-Modell (XP Score = - 8,6) Abbildung 4.6-4: 10:0 PC gedockt im P-gp-3D-Modell (XP Score = - 7,5) Abbildung und -4: Virtuelles Docking von 10:0 PC im Transmembranbereich des humanen P-gp Das Lipid ist Element-abhängig eingefärbt: grün = Kohlenstoff; weiß = Wasserstoff; orange = Phosphor; rot = Sauerstoff; blau = Stickstoff. Die P-gp-Seitenketten sind dunkelviolett dargestellt.
178 156 4 Ergebnisse und Diskussion Eine andere Darstellungsweise des Dockings aus Abb ist in Abb zu finden, wo die Oberflächenladung des Transporters farbig hervorgehoben ist. Die lipophilen Seitenketten arrangierten sich demnach bevorzugt in den neutralen Proteinregionen (weiß), wohingegen die negativ geladene Phosphatgruppe mit positiv geladenen Aminosäureresten (blau) interagierte. Der positive Cholinanteil orientierte sich aus der Bildebene nach vorne in Richtung negativ geladener Aminosäuren (rot). Abbildung 4.6-5: Sterisch favorisierte Bindungspose von 10:0 PC im Transmembranbereich des humanen P-gp-Homologiemodells Die Oberfläche des Transporters ist abhängig von ihrem elektrostatischen Potential eingefärbt: rot = negativ; weiß = neutral; blau = positiv. Das Lipid ist Element- oder Gruppen-abhängig markiert: lila = Kohlenwasserstoffgruppe; rot = Sauerstoff; orange = Phosphor; blau = Stickstoff. Für cis-22:6 PC konnten die Ergebnisse dieser Methodik nicht eindeutig interpretiert werden, da dieses Lipid nachgewiesenermaßen eine sehr hohe Vesikularisierungstendenz besitzt (s. Kap ) und daher in wässrigen Zubereitungen nur minimal als Monomer auftritt. Allerdings sind dessen Vesikel von sehr hoher Fluidität und Flexibilität, so dass das Lipid sich durch Fusionsmechanismen in andere Membransysteme hineinverteilen kann (Ehringer et al. 1990, Zerouga et al. 1995). Der niedrige XP Score (- 8,4) hätte demnach für die Aufklärung des Hemmmechanismus nur Relevanz, wenn das Lipid aus dem aggregierten Zustand in die P-gp-nahe Zellmemban diffundieren und dort als Monomer mit dem Transporter inteagieren würde. Das Derivat 14:0 PC besitzt nur vier C-Atome mehr an seinen FA-Resten als 10:0 PC und war daher in silico als Monomer vergleichbar affin zum Transmembranbereich des P-gp (Tab ). In vitro lag es allerdings auf Grund seiner extrem niedrigen CMC von 6 nm (Avanti(R) Polar
179 4 Ergebnisse und Diskussion 157 Lipids 1999) kaum monomerisch vor. Die relativ hohe PTT von 23 C (Avanti(R) Polar Lipids 1982) bewirkt zudem eine stabile Vesikelstruktur mit geringer Lipid-Austauschneigung, so dass sich die mangelnde Wirksamkeit im Zellversuch retrospektiv erklären ließe (Tab ). Tabelle 4.6-2: Minimale XP Scores ausgewählter Phospholipide Substanz Minimaler XP Score Caco-2- Transportstudien In vitro Wirksamkeit Caco-2- CAA MDCKII- Studien 8:0 PC - 7, :0 PC - 8, :0 PC - 8,0 o o o cis-22:6 PC - 8,4-11,3 (Enantiomer) (+) : erfolgreiche P-gp-Inhibition; (o) : keine P-gp-Inhibition messbar Diskussion und Interpretation der Ergebnisse Die Untersuchung des durch 8:0, 10:0 und cis-22:6 PC vermittelten P-gp-Hemmmechanismus erfolgte einerseits mit P-gp-ATPase Studien, die eine konkrete Protein-Lipid-Interaktion für 8:0 und 10:0 PC vermuten ließen. Beide inhibierten sie die P-gp-ATPase Aktivität nach Verapamilbedingter Stimulation. Eine mögliche Ursache wäre eine Interaktion direkt an den Nukleotidbindungsstellen im Intrazellulärbereich. Dies erschien aber recht unwahrscheinlich, da die amphiphilen Lipide hierfür den Bilayerbereich der Zellmembran komplett passieren müssten, um dann im hydrophilen Zytosol der Zelle mit diesen Elementen zu interagieren. In computergestützen Dockingstudien ließ sich dieser Prozess auch nicht weiter untersuchen, da für diesen Proteinbereich nur Staphylococcus Aureus Modelle mit unzureichender Sequenzidentität (27 %) zum humanen P- gp-transporter verfügbar waren. Die andere, weitaus wahrscheinlichere Ursache für einen verminderten ATP-Umsatz fände im Transmembranbereich des Transporters statt: Eine komformative Fixierung des Proteins, die den Effluxkreislauf unterbinden würde, der auch im Basalzustand, bei Substratabwesenheit, in geringem
180 158 4 Ergebnisse und Diskussion Ausmaß stattfindet. Dieser Effekt wäre durch eine sterische Blockade im Transmembranbereich des Proteins oder durch eine allosterische Modulation an Nicht-Substratbindungsstellen denkbar (s. Kap ) (Sharom 2006, Collnot et al. 2010). Eine zumindest theoretische Affinität der beiden Lipidmoleküle zu Proteinseitenketten in diesem Transmembranbereich konnte durch in silico Dockingstudien nachgewiesen werden. Daher wurde für 8:0 PC und 10:0 PC davon ausgegangen, dass diese, wie auch schon unter erläutert, im monomeren Zustand in die Zellmembran eindrangen, dort direkt an Strukturen von P-gp banden und so den Effluxprozess zum Erliegen brachten. Im Falle von cis-22:6 PC konnte anhand von P-gp-ATPase Studien keine Wirkung detektiert und somit auch kein Mechanismus der direkten Inhibition durch das Lipidmonomer gefolgert werden. Vermutlich übte dieses Lipid seine Hemmung über Zellmembran-spezifische Effekte aus, die mit diesem Assay nicht wahrgenommen werden konnten. Zerouga et al. beschrieben bereits 1995, dass sich cis-22:6 PC sehr leicht in Membranen hineinverteilte und sich dort sogar im Sinne einer Raft -Bildung anreichern könnte, was wiederum eine deutliche Fluidisierung dieser Bilayerbereiche bewirken würde (Zerouga et al. 1995). Gleichzeitig ließe sich aber nicht ausschließen, dass das Lipid im Zellversuch nach dem Membraneintritt auch zum P-gp diffundierte und dort eine direkte Inhibition hervorriefe. Der in den Dockingstudien ermittelte, niedrige XP Score würde diese These unterstützen. Womöglich war der Substanz im ATPase Assay dieser horizontale Diffusionsweg nicht zugänglich, so dass der Hemmmechanismus dieses Lipids nicht ausreichend geklärt werden konnte. 4.7 In silico Screening weiterer Phospholipidklassen auf potentielle P-gp-Inhibitoren Dockingstudien mit Phosphatidsäure (PA)- und Phosphatidylinositol (PI)- Derivaten Das bisher durchgeführte in vitro Screening umfasste PC-, PG-, PE- und PS-Derivate unterschiedlicher Kettenlängen und - im Falle von PC - auch unterschiedlicher Sättigungsgrade und variabler Konstitution (Tab ). Es existieren aber noch weitere PL-Klassen, die potentiell P-gpinhibitorische Vertreter beinhalten könnten. Da die computergestütze Dockingstudie eine extrem ressourcensparende Methode darstellt, um experimentelle Bindungsaffinitäten abzuschätzen, wurde ein in silico Screening in weiteren PL-Gruppen durchgeführt, um vielversprechende Derivate für weiterführende in vitro Studien zu identifizieren. Dieser Arbeitsbereich wurde erneut von Xavier
181 4 Ergebnisse und Diskussion 159 Lucas (Lehrstuhl für Pharmazeutische Bioinformatik, Universität Freiburg) übernommen. Bei diesem Screening beschränkte man sich, wie auch bei den vorherig untersuchten PL-Klassen, auf Kettenlängen 6 C-Atome und es wurde der Protonierungszustand bei ph 6,5 ± 2,0. Getestet wurden Compounds aus mehreren PL-Familien, um einen Eindruck zu gewinnen, in welcher Substanzklasse sich besonders viele Treffer mit hoher experimenteller P-gp-Affinität befinden. Tabelle fasst zusammen, wie viele Substanzen pro Klasse jeweils gedockt wurden und wie viele dieser Moleküle wiederum unter den insgesamt besten 10 % der gesamten Studie zu finden waren. Diese Verteilung wurde zudem auf Signifikanz geprüft. Tatsächlich schienen unter den noch nicht in vitro getesteten Phosphatidsäuren (PA) und Phosphatidylinositolen (PI) bei einem um Zehnerpotenzen erniedrigten Signifikanzniveau von 0,15 eine vergleichsweise hohe Anzahl von sechs bzw. neun potentiell wirksamen Substanzen vertreten zu sein. Tabelle 4.7-1: Zusammenfassung des virtuellen Screenings diverser PL-Klassen PL-Klasse Anzahl gedockter Substanzen Anzahl an Substanzen, die zu den besten 10 % des Screenings gehören P PC ,92 PG ,66 PE ,78 PS ,89 PA ,15 PI , P : Signifikanzniveau
182 160 4 Ergebnisse und Diskussion Insgesamt machten 17 Lipide der PC-, PE-, PS-, PA- und PI-Klassen anhand ihres erzielten XP Scores die besten 10 % dieses Screenings aus. Von diesen wurden wiederum acht Lipide ausgewählt (Tab ), die auf Grund ihrer hervorstechend hohen virtuellen Affinität und ihrer molekularen Struktur für weiterführende Studien in Frage kamen. XP Scores von - 13 ließen dabei eine extrem hohe Wahrscheinlichkeit für eine in vitro Aktivität vermuten, wenn bereits identifizierte, potente P-gp-Inhibitoren scores von lediglich - 6 erzielten (Tab und 4.6-2). Recherchierte man jedoch deren kommerzielle Verfügbarkeit, so musste diese Auswahl auf vier Compounds reduziert werden: PI 8:0-Na, cis-(18:1/ 18:0) PA, DMPA und PIP1 6:0-Na. Letzteres trägt an der 5er-Position des Inositols eine weitere Phosphatgruppe. Häufig waren die Strukturen nur in Form ihrer Isomere erhältlich, die aber auf Grund andersartiger sterischer Ausrichtung in silico weitaus weniger potent waren. Tabelle 4.7-2: Auswahl der wirksamsten in silico Lipide und ihre kommerzielle Verfügbarkeit Substanz XP Score Kommerzielle Verfügbarkeit PI all cis-(18:2) - 17,9 N PI cis-(18:1/ 12:0) - 15,6 N PI 16:0-15,0 J PI 8:0-Na - 14,6 J cis-(18:1 / 18:0) PA - 13,9 J cis-(14:1/ 14:0) PA 14:0 PA (DMPA) - 13,2-13,3 N J PIP 1 6:0-Na - 12,9 J (Isomer) 8:0-COO - 15:0 PC - 12,3 N N : Nein; J : Ja; Fettdruck: Auswahl an Lipiden für die nachfolgende in vitro Testung
183 4 Ergebnisse und Diskussion Charakterisierung der ausgewählten PA- und PI-Formulierungen mittels PCS, Kryo-TEM und ihres Einflusses auf die Zellviabilität Die vier kommerziell erhältlichen PA- und PI-Derivate wurden zur Gewinnung liposomaler Formulierungen in Reinstwasser extrudiert (PI: 21-mal durch 80 nm) oder im Ultraschallbad behandelt (PA: 15 min bei 25 C) und deren strukturelle Eigenschaften mittels PCS und Kryo-TEM charakterisiert. Wie bereits unter diskutiert, können PL abhängig von Kopfgruppe und FA-Resten komplett solubilisiert, als kleine, ungeordnete Aggregate oder als klar definierte Vesikel in wässrigem Medium vorliegen (Simon & Schubert 2012). So führen FA-Kettenlängen von 6-8 C-Atomen, genauso wie sterisch anspruchsvolle Kopfgruppen zu hoch energetischen Membrankurvaturen und erschweren so die Liposomenbildung erheblich. Auch geladene Kopfgruppen können die Vesikelmembranen auf Grund von elektrostatischer Abstoßung zwischen den Lipidmolekülen destabilisieren. Diese Aspekte trafen auch auf die getesteten PA-Derivate zu, die als Natriumsalze eingesetzt wurden und deren negativ geladene Kopfgruppen einer Liposomenbildung im Wege stehen durften: Das langkettige Lipid cis-(18:1/ 18:0) PA bildete zwar Vesikel (PL-Conc. = 4,3 mm; Abb ), aber mit einer extrem breiten Größenverteilung (Tab ). Auch DMPA ergab wegen seines extrem hohen PDI von 0,745 eine äußerst heterogene Dispersion. Die beiden ausgewählten PI-Derivate besitzen kurze FA-Reste, die in Kombination mit der negativ geladenen Kopfgruppe eine Vesikularisierung noch stärker behindern sollten. Diese Annahme konnte durch PCS-Messungen bestätigt werden, wo auf Grund von PDI-Werte > 0,8 keine sinnvolle Größenbestimmung mehr möglich war (Tab ). Abbildung verdeutlicht, dass eine PI 8:0-Na-Formulierung von 1,0 mm weder Vesikel, noch andere Aggregate dieser Art enthielt. Bei diesem Lipid konnte demnach mit hoher Sicherheit vorwiegend von PL-Monomeren in Lösung ausgegangen werden. Zudem wurde die Zellviabilität von Caco-2, MDCKII WT und MDCKII mdr1 in Anwesenheit der Lipidformulierungen (0,5 mm) in HBSS ph 6,5 mit dem CellTiterGlo Test getestet: Zytotoxizität konnte bei allen Derivaten ausgeschlossen werden, da der intrazelluläre ATP-Stoffwechsel ungehindert ablief (ohne Abb.). Somit konnten alle vier Substanzen in den nachfolgenden in vitro P-gp-Assays angewandt werden.
184 162 4 Ergebnisse und Diskussion Abb : cis-(18:1/ 18:0) PA (PL-Conc. = 4,3 mm) Abb : PI 8:0-Na (PL-Conc. = 1,0 mm) Abbildung und -2: Kryo-TEM-Aufnahmen von PA- und PI-Zubereitungen in Reinstwasser Herstellung mittels Filmmethode, anschließender Rehydratisierung und Behandlung im Ultraschallbad (4.7-1; 15 min; 25 C) bzw. 21-malige Extrusion durch Polycarbonatmembranen (4.7-2; Porengröße von 80 nm); Tabelle 4.7-3: Hydrodynamischer Durchmeser und Polydispersitätsindex (PDI) der PA- und PI-Derivate in Reinstwasser, vermessen mittels PCS-Analytik Lipid Hydrodynamischer Durchmesser [nm] PDI 14:0 PA (DMPA) 1761 ± ,745 ± 0,442 cis-(18:1/ 18:0) PA 1006 ± ,476 ± 0,014 PI 8:0-Na n.a. n.a. PIP 1 6:0-Na n.a. n.a. Hydrodynamischer Durchmesser und PDI sind als Mittelwert ± SD aus drei Messungen (21 Einzelläufe) angegeben n.a.: nicht auswertbar
Membranen. U. Albrecht
 Membranen Struktur einer Plasmamembran Moleküle gegeneinander beweglich -> flüssiger Charakter Fluidität abhängig von 1) Lipidzusammensetzung (gesättigt/ungesättigt) 2) Umgebungstemperatur Biologische
Membranen Struktur einer Plasmamembran Moleküle gegeneinander beweglich -> flüssiger Charakter Fluidität abhängig von 1) Lipidzusammensetzung (gesättigt/ungesättigt) 2) Umgebungstemperatur Biologische
2006 Block 3 Phy 1 Aufbau und Funktion der Zellmembran
 2006 Block 3 Phy 1 Aufbau und Funktion der Zellmembran Objectives I Beschreibe die Membran-Eigenschaften in Relation zu den Komponenten der Membran Beschreibe den Aufbau einer Zellmembran Benenne unterschiedliche
2006 Block 3 Phy 1 Aufbau und Funktion der Zellmembran Objectives I Beschreibe die Membran-Eigenschaften in Relation zu den Komponenten der Membran Beschreibe den Aufbau einer Zellmembran Benenne unterschiedliche
Zellbiologie! Privatdozent Dr. T. Kähne! Institut für Experimentelle Innere Medizin! Medizinische Fakultät
 Zellbiologie! Privatdozent Dr. T. Kähne! Institut für Experimentelle Innere Medizin! Medizinische Fakultät Grundlagen Lipid-Doppelschicht als Barriere für polare Moleküle! Abgrenzung für biochemische
Zellbiologie! Privatdozent Dr. T. Kähne! Institut für Experimentelle Innere Medizin! Medizinische Fakultät Grundlagen Lipid-Doppelschicht als Barriere für polare Moleküle! Abgrenzung für biochemische
STOFFTRANSPORT DURCH BIOMEM- BRANEN
 DIE BIOMEMBRAN Vorkommen Plasmalemma Grenzt Cytoplasma nach außen ab Tonoplast Grenzt Vakuole vom Cytoplasma ab Zellkernmembran Mitochondrienmembran Plastidenmembran ER Kompartimente Durch Zellmembran
DIE BIOMEMBRAN Vorkommen Plasmalemma Grenzt Cytoplasma nach außen ab Tonoplast Grenzt Vakuole vom Cytoplasma ab Zellkernmembran Mitochondrienmembran Plastidenmembran ER Kompartimente Durch Zellmembran
1. Seminar Biotechnologie Natalia Putkaradze, Master Biotechnologie (3. Semester) Matrikel-Nr.:
 1. Seminar Biotechnologie Natalia Putkaradze, Master Biotechnologie (3. Semester) Matrikel-Nr.: 2529735 Faktoren, die von Bedeutung für eine asymmetrische Phospholipid- Verteilung an Membranen roter Blutzellen
1. Seminar Biotechnologie Natalia Putkaradze, Master Biotechnologie (3. Semester) Matrikel-Nr.: 2529735 Faktoren, die von Bedeutung für eine asymmetrische Phospholipid- Verteilung an Membranen roter Blutzellen
Die Zelle. Membranen: Struktur und Funktion
 Die Zelle Membranen: Struktur und Funktion 8.4 Die Fluidität von Membranen. 8.6 Die Feinstruktur der Plasmamembran einer Tierzelle (Querschnitt). (Zum Aufbau der extrazellulären Matrix siehe auch Abbildung
Die Zelle Membranen: Struktur und Funktion 8.4 Die Fluidität von Membranen. 8.6 Die Feinstruktur der Plasmamembran einer Tierzelle (Querschnitt). (Zum Aufbau der extrazellulären Matrix siehe auch Abbildung
Vorlesung Neurophysiologie
 Vorlesung Neurophysiologie Detlev Schild Abt. Neurophysiologie und zelluläre Biophysik dschild@gwdg.de Vorlesung Neurophysiologie Detlev Schild Abt. Neurophysiologie und zelluläre Biophysik dschild@gwdg.de
Vorlesung Neurophysiologie Detlev Schild Abt. Neurophysiologie und zelluläre Biophysik dschild@gwdg.de Vorlesung Neurophysiologie Detlev Schild Abt. Neurophysiologie und zelluläre Biophysik dschild@gwdg.de
Fettabbau: 95 % der Lipide werden im Dünndarm gespalten; vor der enzymatischen Spaltung müssen die Lipide als Öl in Wasser Emulsion vorliegen; Abbau
 Fettabbau: 95 % der Lipide werden im Dünndarm gespalten; vor der enzymatischen Spaltung müssen die Lipide als Öl in Wasser Emulsion vorliegen; Abbau erfolgt zu freien Fettsäuren und 2-Monoacylglyceriden;
Fettabbau: 95 % der Lipide werden im Dünndarm gespalten; vor der enzymatischen Spaltung müssen die Lipide als Öl in Wasser Emulsion vorliegen; Abbau erfolgt zu freien Fettsäuren und 2-Monoacylglyceriden;
Aspekte der Eisenresorption. PD Dr. F.S. Lehmann Facharzt für Gastroenterologie FMH Oberwilerstrasse Binningen
 Aspekte der Eisenresorption PD Dr. F.S. Lehmann Facharzt für Gastroenterologie FMH Oberwilerstrasse 19 4102 Binningen Chemische Eigenschaften Fe-II wird leichter aufgenommen als Fe-III wegen der besseren
Aspekte der Eisenresorption PD Dr. F.S. Lehmann Facharzt für Gastroenterologie FMH Oberwilerstrasse 19 4102 Binningen Chemische Eigenschaften Fe-II wird leichter aufgenommen als Fe-III wegen der besseren
Anatomie Mikroskopische Anatomie. Verdauungsapparat II
 Anatomie Mikroskopische Anatomie Verdauungsapparat II Verdauungsapparat II Dünndarm Funktion der Mucosa: Verdauung und Resorption Aufbau und Funktion der Tela submucosa Aufbau und Funktion der Tunica muscularis
Anatomie Mikroskopische Anatomie Verdauungsapparat II Verdauungsapparat II Dünndarm Funktion der Mucosa: Verdauung und Resorption Aufbau und Funktion der Tela submucosa Aufbau und Funktion der Tunica muscularis
Hyperforin aktiviert TRP-Kanäle - ein neuer antidepressiver. Wirkmechanismus? Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften
 Hyperforin aktiviert TRP-Kanäle - ein neuer antidepressiver Wirkmechanismus? Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften Vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie
Hyperforin aktiviert TRP-Kanäle - ein neuer antidepressiver Wirkmechanismus? Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften Vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie
Charakterisierung der pulmonalen Pharmakokinetik von Salmeterol und Insulin-like Growth Factor-1
 Charakterisierung der pulmonalen Pharmakokinetik von Salmeterol und Insulin-like Growth Factor-1 Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Julius-Maximilians-Universität Würzburg
Charakterisierung der pulmonalen Pharmakokinetik von Salmeterol und Insulin-like Growth Factor-1 Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Julius-Maximilians-Universität Würzburg
Passive Transportvorgänge
 Passive Transportvorgänge Diffusion und Osmose sind passive Transportprozesse. Denn die Zelle muss keine Energie aufwenden, um den Transport der Stoffe zu ermöglichen. Diffusion Einzelsubstanzen sind bestrebt,
Passive Transportvorgänge Diffusion und Osmose sind passive Transportprozesse. Denn die Zelle muss keine Energie aufwenden, um den Transport der Stoffe zu ermöglichen. Diffusion Einzelsubstanzen sind bestrebt,
PHARMAZEUTISCHE EIGENSCHAFTEN VON LIPOSOMEN AUS SYNTHETISCHEN PHOSPHOLIPIDEN
 - 0 PHARMAZEUTISCHE EIGENSCHAFTEN VON LIPOSOMEN AUS SYNTHETISCHEN PHOSPHOLIPIDEN INAUGURALDISSERTATION zur Erlangung der Würde eines Doktors der Philosophie vorgelegt der Philosophisch-Naturwissenschaftlichen
- 0 PHARMAZEUTISCHE EIGENSCHAFTEN VON LIPOSOMEN AUS SYNTHETISCHEN PHOSPHOLIPIDEN INAUGURALDISSERTATION zur Erlangung der Würde eines Doktors der Philosophie vorgelegt der Philosophisch-Naturwissenschaftlichen
Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe
 Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe https://cuvillier.de/de/shop/publications/334 Copyright:
Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe https://cuvillier.de/de/shop/publications/334 Copyright:
Membranen (3a) Membrane
 Membranen (3a) Biochemie Membrane Funktionen Abgrenzung der Zelle nach außen hin schaffen geeignete Voraussetzungen für einzelne enzymatische Reaktionen Signalübertragung tragen Signalstrukturen für die
Membranen (3a) Biochemie Membrane Funktionen Abgrenzung der Zelle nach außen hin schaffen geeignete Voraussetzungen für einzelne enzymatische Reaktionen Signalübertragung tragen Signalstrukturen für die
Biologie für Mediziner
 Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
INHALTSVERZEICHNIS 1 KURZFASSUNG EINLEITUNG ZIELSETZUNG Inhaltsverzeichnis
 I INHALTSVERZEICHNIS 1 KURZFASSUNG... 1 2 EINLEITUNG... 3 2.1 Die Plasmamembran Vermittler zwischen zwei Welten... 3 2.1.1 Lipide der Plasmamembran... 4 2.1.2 Proteine der Plasmamembran... 7 2.1.3 Modelle
I INHALTSVERZEICHNIS 1 KURZFASSUNG... 1 2 EINLEITUNG... 3 2.1 Die Plasmamembran Vermittler zwischen zwei Welten... 3 2.1.1 Lipide der Plasmamembran... 4 2.1.2 Proteine der Plasmamembran... 7 2.1.3 Modelle
Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab.
 4 ERGEBNISSE 4.1 Endothelin Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab. 4.1.1 Dosisabhängige Herabregulation
4 ERGEBNISSE 4.1 Endothelin Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab. 4.1.1 Dosisabhängige Herabregulation
Vergleichende Untersuchungen verschiedener partikulärer Wirkstoffträger zur topischen Anwendung am Beispiel eines Caicitriol-Anaiogons
 Vergleichende Untersuchungen verschiedener partikulärer Wirkstoffträger zur topischen Anwendung am Beispiel eines Caicitriol-Anaiogons Dissertation zur Erlangung der Doktorwürde der Fakultät für Chemie
Vergleichende Untersuchungen verschiedener partikulärer Wirkstoffträger zur topischen Anwendung am Beispiel eines Caicitriol-Anaiogons Dissertation zur Erlangung der Doktorwürde der Fakultät für Chemie
Morbus Crohn: Mechanismen der epithelialen Barrierestörung. und der therapeutische Effekt von TNFα-Antikörpern
 Medizinische Fakultät der Charité - Universitätsmedizin Berlin Campus Benjamin Franklin aus der Medizinischen Klinik I, Gastroenterologie, Infektiologie und Rheumatologie Direktor: Prof. Dr. med. M. Zeitz
Medizinische Fakultät der Charité - Universitätsmedizin Berlin Campus Benjamin Franklin aus der Medizinischen Klinik I, Gastroenterologie, Infektiologie und Rheumatologie Direktor: Prof. Dr. med. M. Zeitz
Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften
 Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften Dissertation zur Erlangung des akademischen Grades des Doktors der
Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften Dissertation zur Erlangung des akademischen Grades des Doktors der
Cholesterolmoleküle. Membranproteine können Zellen. miteinander verknüpfen. tragen Kohlenhydratketten. Manche Lipide (Glykolipide)
 Zellinnenraum Manche Lipide (Glykolipide) tragen Kohlenhydratketten. Membranproteine können Zellen miteinander verknüpfen. Manche Proteine (Glykoproteine) tragen Kohlenhydratketten. Cholesterolmoleküle
Zellinnenraum Manche Lipide (Glykolipide) tragen Kohlenhydratketten. Membranproteine können Zellen miteinander verknüpfen. Manche Proteine (Glykoproteine) tragen Kohlenhydratketten. Cholesterolmoleküle
Tobler Ackermann Fraefel Allgemeine Virologie. basics
 Tobler Ackermann Fraefel Allgemeine Virologie basics 20 Einführung in die Virologie GFP-Fluoreszenz auch in lebenden Zellen nachgewiesen werden. GFP kann mit den meisten anderen Proteinen (auch Virusproteinen),
Tobler Ackermann Fraefel Allgemeine Virologie basics 20 Einführung in die Virologie GFP-Fluoreszenz auch in lebenden Zellen nachgewiesen werden. GFP kann mit den meisten anderen Proteinen (auch Virusproteinen),
Tyrosinkinase- Rezeptoren
 Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Inhaltsverzeichnis... 6. 1 Einleitung... 14. 1.1 ATP-Binding-Cassette Transporter... 14. 1.2 ABC-Transporter Subfamilie A... 16
 Inhaltsverzeichnis Inhaltsverzeichnis... 6 1 Einleitung... 14 1.1 ATP-Binding-Cassette Transporter... 14 1.2 ABC-Transporter Subfamilie A... 16 1.2.1 ABCA2: Funktion und MDR... 16 1.3 ABC-Transporter Subfamilie
Inhaltsverzeichnis Inhaltsverzeichnis... 6 1 Einleitung... 14 1.1 ATP-Binding-Cassette Transporter... 14 1.2 ABC-Transporter Subfamilie A... 16 1.2.1 ABCA2: Funktion und MDR... 16 1.3 ABC-Transporter Subfamilie
Abkürzungen...VI. 1 Einleitung Das Immunorgan Darm Das Immunsystem des Darms (GALT)...2
 Inhaltsverzeichnis Abkürzungen...VI 1 Einleitung... 1 1.1 Das Immunorgan Darm... 1 1.1.1 Anatomischer und histologischer Aufbau des Darms... 1 1.1.2 Das Immunsystem des Darms (GALT)...2 1.1.3 Das intestinale
Inhaltsverzeichnis Abkürzungen...VI 1 Einleitung... 1 1.1 Das Immunorgan Darm... 1 1.1.1 Anatomischer und histologischer Aufbau des Darms... 1 1.1.2 Das Immunsystem des Darms (GALT)...2 1.1.3 Das intestinale
Biochemie und. chemischer Mechanismus
 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Biochemie und chemischer Mechanismus der Thiomethylierung von RNA Dorothea Maria
Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Biochemie und chemischer Mechanismus der Thiomethylierung von RNA Dorothea Maria
Grundlagen der Medizinischen Chemie Sommersemester 2016
 Grundlagen der Medizinischen Chemie Sommersemester 2016 Prof. Dr. Franz Paintner Dienstag, 9 15-11 00 Uhr, Buchner-Hörsaal Mittwoch, 8 15-9 00 Uhr, Buchner-Hörsaal Aktuelle Informationen zur Vorlesung
Grundlagen der Medizinischen Chemie Sommersemester 2016 Prof. Dr. Franz Paintner Dienstag, 9 15-11 00 Uhr, Buchner-Hörsaal Mittwoch, 8 15-9 00 Uhr, Buchner-Hörsaal Aktuelle Informationen zur Vorlesung
Diffusion. Prüfungsfrage
 Prüfungsfrage Diffusion Die Diffusion. Erstes Fick sches Gesetz. Der Diffusionskoeffizient. Die Stokes-Einstein Beziehung. Diffusion durch die Zellmembrane: passive, aktive und erleichterte Diffusion Lehrbuch
Prüfungsfrage Diffusion Die Diffusion. Erstes Fick sches Gesetz. Der Diffusionskoeffizient. Die Stokes-Einstein Beziehung. Diffusion durch die Zellmembrane: passive, aktive und erleichterte Diffusion Lehrbuch
Biochemie der Niere. Fuchs VL 2 WS 07/08. Oligopeptidresorption. Ausscheidung organischer Kationen. Sekretion organischer Anionen und Kationen (BB)
 Biochemie der Niere Glomeruli Biochemie der glomerulären Basalmembran Pathobiochemie: glomeruläre Proteinurie Struktur und Funktion des proximalen Tubulus: Rezeptor-vermittelte Aufnahme von Proteinen und
Biochemie der Niere Glomeruli Biochemie der glomerulären Basalmembran Pathobiochemie: glomeruläre Proteinurie Struktur und Funktion des proximalen Tubulus: Rezeptor-vermittelte Aufnahme von Proteinen und
NIERENPHYSIOLOGIE, HOMÖOSTASE DER EXTRAZELLULÄREN FLÜSSIGKEITSRÄUME
 NIERENPHYSIOLOGIE, HOMÖOSTASE DER EXTRAZELLULÄREN FLÜSSIGKEITSRÄUME (2) Dr. Attila Nagy 2017 Das Tubulussystem (Lernziele: 54-57) Das Tubulussystem besteht aus mehreren, morphologisch und funktionell unterschiedlichen
NIERENPHYSIOLOGIE, HOMÖOSTASE DER EXTRAZELLULÄREN FLÜSSIGKEITSRÄUME (2) Dr. Attila Nagy 2017 Das Tubulussystem (Lernziele: 54-57) Das Tubulussystem besteht aus mehreren, morphologisch und funktionell unterschiedlichen
1. Welche Arten von Zell Zell Verbindungen kennen Sie und was sind ihre Hauptaufgaben? Verschliessende Verbindungen (Permeabilitätseinschränkung)
 Fragen Zellbio 2 1. Welche Arten von Zell Zell Verbindungen kennen Sie und was sind ihre Hauptaufgaben? Verschliessende Verbindungen (Permeabilitätseinschränkung) Haftende Verbindungen (Mechanischer Zusammenhalt)
Fragen Zellbio 2 1. Welche Arten von Zell Zell Verbindungen kennen Sie und was sind ihre Hauptaufgaben? Verschliessende Verbindungen (Permeabilitätseinschränkung) Haftende Verbindungen (Mechanischer Zusammenhalt)
Untersuchungen zur Wirkung von Pasteurella multocida Toxin
 Institut fiir Experimentelle und Klinische Pharmakologie und Toxikologie der Albert-Ludwigs-Universitat Freiburg Untersuchungen zur Wirkung von Pasteurella multocida Toxin Dissertation zur Erlangung des
Institut fiir Experimentelle und Klinische Pharmakologie und Toxikologie der Albert-Ludwigs-Universitat Freiburg Untersuchungen zur Wirkung von Pasteurella multocida Toxin Dissertation zur Erlangung des
Expression und Funktion. von Neurotransmitterrezeptoren auf Astrozyten im intakten. Hirngewebe der Maus
 Expression und Funktion von Neurotransmitterrezeptoren auf Astrozyten im intakten Hirngewebe der Maus Dissertation zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) von Dipl.-Biochem.
Expression und Funktion von Neurotransmitterrezeptoren auf Astrozyten im intakten Hirngewebe der Maus Dissertation zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) von Dipl.-Biochem.
Entstehung der Eukaryontenzelle Endosymbiontentheorie
 Entstehung der Eukaryontenzelle Endosymbiontentheorie Tier-Zelle Pflanzen-Zelle Entstehung der Eukaryontenzelle Endosymbiontentheorie (aus Weiler/Nover: Allgemeine und molekulare Botanik) Tierzelle Morphologische
Entstehung der Eukaryontenzelle Endosymbiontentheorie Tier-Zelle Pflanzen-Zelle Entstehung der Eukaryontenzelle Endosymbiontentheorie (aus Weiler/Nover: Allgemeine und molekulare Botanik) Tierzelle Morphologische
Biochemische UE Alkaline Phosphatase.
 Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
dm A A = D --- (c 1 -c 2 ) = D --- δ c dt d d D: Diffusionskonstante, A: Betrachtete Fläche, d: Strecke c: Konzentration
 Diffusion ist die Bewegung von Teilchen aufgrund der brownschen Molekularbewegung in einem Lösungsmittel. Die Teilchen bewegen sich netto in Richtung der niedrigeren Konzentration. Ficksches Diffusionsgesetz:
Diffusion ist die Bewegung von Teilchen aufgrund der brownschen Molekularbewegung in einem Lösungsmittel. Die Teilchen bewegen sich netto in Richtung der niedrigeren Konzentration. Ficksches Diffusionsgesetz:
6.3 Phospholipide und Signaltransduktion. Allgemeines
 6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
1 Zusammenfassung 1. 2 Einleitung Chemische Genetik Rezeptor-vermittelte Signaltransduktion 7
 Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung 3 2.1 Chemische Genetik 4 2.2 Rezeptor-vermittelte Signaltransduktion 7 2.3 Guaninnukleotid-bindende Proteine (G-Proteine/GTPasen) 7 2.3.1 Kleine GTPasen
Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung 3 2.1 Chemische Genetik 4 2.2 Rezeptor-vermittelte Signaltransduktion 7 2.3 Guaninnukleotid-bindende Proteine (G-Proteine/GTPasen) 7 2.3.1 Kleine GTPasen
Weitere Übungsfragen
 1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
6.2 Membranen Struktur der Membranen
 6.2 Membranen Struktur der Membranen Für die Integrität und Entwicklungsfähigkeit der Zellen ist eine Abgrenzung gegenüber der Umwelt essentiell. Sie wird durch eine Lipiddoppelschicht geleistet, die Plasmamembran.
6.2 Membranen Struktur der Membranen Für die Integrität und Entwicklungsfähigkeit der Zellen ist eine Abgrenzung gegenüber der Umwelt essentiell. Sie wird durch eine Lipiddoppelschicht geleistet, die Plasmamembran.
 1. EINLEITUNG 1 1.1 Angeborene Immunität Die erste Abwehr 1 1.2 Phagozytose und Phagosomenreifung 2 1.2.1 Phagozytose 2 1.2.2 Phagosomenreifung 3 1.3 Die vakuoläre Protonenpumpe (v-atpase) 6 1.3.1 Die
1. EINLEITUNG 1 1.1 Angeborene Immunität Die erste Abwehr 1 1.2 Phagozytose und Phagosomenreifung 2 1.2.1 Phagozytose 2 1.2.2 Phagosomenreifung 3 1.3 Die vakuoläre Protonenpumpe (v-atpase) 6 1.3.1 Die
1. Einleitung Biologische Membranen...1
 I Inhaltsverzeichnis 1. Einleitung... 1 1.1 Biologische Membranen...1 1.1.1 Aufbau der Biomembran...1 1.1.2 Funktion der Plasmamembran...3 1.1.3 Membranlipide...4 1.1.4 Cholesterin als Membranbestandteil...5
I Inhaltsverzeichnis 1. Einleitung... 1 1.1 Biologische Membranen...1 1.1.1 Aufbau der Biomembran...1 1.1.2 Funktion der Plasmamembran...3 1.1.3 Membranlipide...4 1.1.4 Cholesterin als Membranbestandteil...5
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER
 Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Sophia Buhs. Dissertation. Diplom-Biochemikerin
 Beeinflussung Phosphotyrosin-abhängiger Signalwege in humanen unter Einsatz von SH2-Domänen und Phosphatasen in Kombination mit dem TAT-Transduktionssystem Dissertation Zur Erlangung der Würde des Doktors
Beeinflussung Phosphotyrosin-abhängiger Signalwege in humanen unter Einsatz von SH2-Domänen und Phosphatasen in Kombination mit dem TAT-Transduktionssystem Dissertation Zur Erlangung der Würde des Doktors
Das EM Bild der Zelle
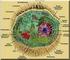 Übersicht 1 Übersicht Zellinneres ist durch Membranen unterteilt 1 Übersicht Zellinneres ist durch Membranen unterteilt Die Zelle ist kompartimentiert und ermöglicht dadurch den Ablauf unterschiedlicher
Übersicht 1 Übersicht Zellinneres ist durch Membranen unterteilt 1 Übersicht Zellinneres ist durch Membranen unterteilt Die Zelle ist kompartimentiert und ermöglicht dadurch den Ablauf unterschiedlicher
-Übersicht. 2. G-Protein-gekoppelte Rezeptoren. 5. Na + -K + -Pumpe REZEPTOREN. 1. Allgemeine Definition: Rezeptoren. 3. Tyrosin-Kinase Rezeptoren
 REZEPTOREN -Übersicht 1. Allgemeine Definition: Rezeptoren 2. G-Protein-gekoppelte Rezeptoren 3. Tyrosin-Kinase Rezeptoren Beispiel: Insulin 4. Steroidhormone 5. Na + -K + -Pumpe EINFÜHRUNG Definition
REZEPTOREN -Übersicht 1. Allgemeine Definition: Rezeptoren 2. G-Protein-gekoppelte Rezeptoren 3. Tyrosin-Kinase Rezeptoren Beispiel: Insulin 4. Steroidhormone 5. Na + -K + -Pumpe EINFÜHRUNG Definition
2.1 Die Entstehung des Gehirns aus neuralen Stammzellen Transkriptionsfaktoren in der Gehirnentwicklung...16
 Inhaltsverzeichnis Danksagung...3 Inhaltsverzeichnis...5 Abkürzungverzeichnis...1 1 Zielsetzung...4 2 Einleitung...6 2.1 Die Entstehung des Gehirns aus neuralen Stammzellen...6 2.2 Radiale Gliazellen...9
Inhaltsverzeichnis Danksagung...3 Inhaltsverzeichnis...5 Abkürzungverzeichnis...1 1 Zielsetzung...4 2 Einleitung...6 2.1 Die Entstehung des Gehirns aus neuralen Stammzellen...6 2.2 Radiale Gliazellen...9
Dünndarm (Intestinum tenue)
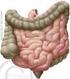 Dünndarm (Intestinum tenue) Die resorptive Leistung dieses etwa sechs Meter langen Organs ist direkt verbunden mit seiner Oberflächengestaltung. Der Oberflächenstruktur liegt das Prinzip der Oberflächenvergrößerung
Dünndarm (Intestinum tenue) Die resorptive Leistung dieses etwa sechs Meter langen Organs ist direkt verbunden mit seiner Oberflächengestaltung. Der Oberflächenstruktur liegt das Prinzip der Oberflächenvergrößerung
Aus der Klinik für Dermatologie, Venerologie und Allergologie der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION
 Aus der Klinik für Dermatologie, Venerologie und Allergologie der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Evaluation der Laser-Scan-Mikroskopie, der Laser-Doppler- Blutflussmessung
Aus der Klinik für Dermatologie, Venerologie und Allergologie der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Evaluation der Laser-Scan-Mikroskopie, der Laser-Doppler- Blutflussmessung
12. Biopolymere. daher Namensunterschied nur durch die Zusätze D (rechtsdrehend) und L (linksdrehend)
 12. Biopolymere 12.1 Die wichtigsten Bausteine a) Zucker Zucker C(H 2 O) n dienen zb als Energiespeicher (Stärke), in der Zellerkennung (Blutgruppen) und als Bausteine der Nukleinsäuren es gibt viele Isomere,
12. Biopolymere 12.1 Die wichtigsten Bausteine a) Zucker Zucker C(H 2 O) n dienen zb als Energiespeicher (Stärke), in der Zellerkennung (Blutgruppen) und als Bausteine der Nukleinsäuren es gibt viele Isomere,
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung
 3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
Die Rolle roter Blutzellen bei der Thrombusbildung. Alexandra Maas 12. Dezember 2012 Betreuer: Prof. I. Bernhardt
 Die Rolle roter Blutzellen bei der Thrombusbildung Alexandra Maas 12. Dezember 2012 Betreuer: Prof. I. Bernhardt Inhalt Grundlagen Verteilung der Phospholipide in roten Blutzellen (RBCs) Hämostase Modell
Die Rolle roter Blutzellen bei der Thrombusbildung Alexandra Maas 12. Dezember 2012 Betreuer: Prof. I. Bernhardt Inhalt Grundlagen Verteilung der Phospholipide in roten Blutzellen (RBCs) Hämostase Modell
Ruhemebranpotenzial. den 17 November Dr. Emőke Bódis
 Ruhemebranpotenzial den 17 November 2016 Dr. Emőke Bódis Prüfungsfrage Die Struktur und die Eigenschaften der Zellmembran. Das Ruhemembranpotenzial. Bernstein Kalium Hypothese, Nernst- Gleichung, Donnan-
Ruhemebranpotenzial den 17 November 2016 Dr. Emőke Bódis Prüfungsfrage Die Struktur und die Eigenschaften der Zellmembran. Das Ruhemembranpotenzial. Bernstein Kalium Hypothese, Nernst- Gleichung, Donnan-
Molekulare Mechanismen der p16-vermittelten Anoikisinduktion in humanen Pankreaskarzinom-Zellen
 Aus der Medizinischen Klinik mit Schwerpunkt Hepatologie und Gastroenterologie der Charité - Universitätsmedizin Berlin Campus Virchow-Klinikum Leiter: Prof. Dr. Bertram Wiedenmann Arbeitsgruppe Prof.
Aus der Medizinischen Klinik mit Schwerpunkt Hepatologie und Gastroenterologie der Charité - Universitätsmedizin Berlin Campus Virchow-Klinikum Leiter: Prof. Dr. Bertram Wiedenmann Arbeitsgruppe Prof.
Georg-August-Universität Göttingen
 Georg-August-Universität Göttingen Abteilung für Allgemeine Mikrobiologie Institut für Mikrobiologie und Genetik Prof. Dr. Jörg Stülke Email:jstuelk@gwdg.de http://wwwuser.gwdg.de/~genmibio/stuelke.html
Georg-August-Universität Göttingen Abteilung für Allgemeine Mikrobiologie Institut für Mikrobiologie und Genetik Prof. Dr. Jörg Stülke Email:jstuelk@gwdg.de http://wwwuser.gwdg.de/~genmibio/stuelke.html
Gruppenpuzzle: Stofftransport durch die Biomembran
 1 Bild anfertigen Text 1+2 2 Bild anfertigen Text 3+4 3 Text schreiben Bild 1+2 4 Text schreiben Bild 3+4 Arbeitsaufträge: 1 Versuchen Sie, die zwei beschriebenen Transportvorgänge in geeigneter Weise
1 Bild anfertigen Text 1+2 2 Bild anfertigen Text 3+4 3 Text schreiben Bild 1+2 4 Text schreiben Bild 3+4 Arbeitsaufträge: 1 Versuchen Sie, die zwei beschriebenen Transportvorgänge in geeigneter Weise
Permeation Nichtsteroidaler Antirheumatika durch Tierhaute. Von der Fakultat fur Lebenswissenschaften. der Technischen Universitat Carolo-Wilhelmina
 Permeation Nichtsteroidaler Antirheumatika durch Tierhaute Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades einer Doktorin
Permeation Nichtsteroidaler Antirheumatika durch Tierhaute Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades einer Doktorin
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin
 Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Physiologie für veterinärmedizinisch-technische Assistenten. B. Rudelt
 Physiologie für veterinärmedizinisch-technische Assistenten B. Rudelt 3 Zelluläre Kommunikation 15 3 Zelluläre Kommunikation Funktion und Leistung einer Zelle beruhen auf einem Netzwerk biochemischer Prozesse.
Physiologie für veterinärmedizinisch-technische Assistenten B. Rudelt 3 Zelluläre Kommunikation 15 3 Zelluläre Kommunikation Funktion und Leistung einer Zelle beruhen auf einem Netzwerk biochemischer Prozesse.
Kapitel 8, Membranstruktur und Funktion
 Kapitel 8, Membranstruktur und Funktion Verschiedene Modelle von Membranen, science as a process Die Hauptbestandteile der Membrane sind Lipide, Proteine und Kohlenhydrate. Im Laufe der Zeit haben verschiedene
Kapitel 8, Membranstruktur und Funktion Verschiedene Modelle von Membranen, science as a process Die Hauptbestandteile der Membrane sind Lipide, Proteine und Kohlenhydrate. Im Laufe der Zeit haben verschiedene
Morphologische Grundlagen der Zelle Bakterienzelle
 Morphologische Grundlagen der Zelle Bakterienzelle Entstehung der Eukaryontenzelle Endosymbiontentheorie Tier-Zelle Pflanzen-Zelle Entstehung der Eukaryontenzelle Endosymbiontentheorie (aus Weiler/Nover:
Morphologische Grundlagen der Zelle Bakterienzelle Entstehung der Eukaryontenzelle Endosymbiontentheorie Tier-Zelle Pflanzen-Zelle Entstehung der Eukaryontenzelle Endosymbiontentheorie (aus Weiler/Nover:
Membranpotential bei Neuronen
 Membranpotential bei Neuronen J. Almer 1 Ludwig-Thoma-Gymnasium 9. Juli 2012 J. Almer (Ludwig-Thoma-Gymnasium ) 9. Juli 2012 1 / 17 Gliederung 1 Aufbau der Neuronmembran 2 Ruhepotential bei Neuronen Diffusion
Membranpotential bei Neuronen J. Almer 1 Ludwig-Thoma-Gymnasium 9. Juli 2012 J. Almer (Ludwig-Thoma-Gymnasium ) 9. Juli 2012 1 / 17 Gliederung 1 Aufbau der Neuronmembran 2 Ruhepotential bei Neuronen Diffusion
Characterization o f glioblastoma stem cells upon. triggering o f CD95
 Aus dem Deutschen Krebsforschungszentrum Heidelberg Direktor (kommissarisch): Prof. Dr. rer. nat. Michael Boutros Abteilung für Molekulare Neurobiologie Abteilungsleiterin Prof. Dr. med. Ana Martin-Villalba
Aus dem Deutschen Krebsforschungszentrum Heidelberg Direktor (kommissarisch): Prof. Dr. rer. nat. Michael Boutros Abteilung für Molekulare Neurobiologie Abteilungsleiterin Prof. Dr. med. Ana Martin-Villalba
Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion
 Prof. Dr. KH. Friedrich, Institut für Biochemie II Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion Voraussetzung für einen produktiven und allseits erfreulichen Ablauf des Seminars
Prof. Dr. KH. Friedrich, Institut für Biochemie II Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion Voraussetzung für einen produktiven und allseits erfreulichen Ablauf des Seminars
Pflanzenphysiologie 2: Funktionen des Sposses
 Pflanzenphysiologie 2: Funktionen des Sposses Mechanismen des Membrantransports Aufbau des vaskulären Systems: Phloem und Xylem Funktionen des Phloems Copyright Hinweis: NATURE Vol 455 11 September 2008
Pflanzenphysiologie 2: Funktionen des Sposses Mechanismen des Membrantransports Aufbau des vaskulären Systems: Phloem und Xylem Funktionen des Phloems Copyright Hinweis: NATURE Vol 455 11 September 2008
Peptide und Proteine
 NIERENPHYSIOLOGIE, HOMÖOSTASE DER EXTRAZELLULÄREN FLÜSSIGKEITSRÄUME (3) Dr. Attila Nagy 2017 Peptide und Proteine 1. Di- und Tripeptide können im proximalen Tubulus durch Peptid- H+-Symporter resorbiert
NIERENPHYSIOLOGIE, HOMÖOSTASE DER EXTRAZELLULÄREN FLÜSSIGKEITSRÄUME (3) Dr. Attila Nagy 2017 Peptide und Proteine 1. Di- und Tripeptide können im proximalen Tubulus durch Peptid- H+-Symporter resorbiert
12. Biopolymere. Anwendungen: Sensoren, Detektoren, Displays, Komponenten in elektrischen Schlatkreisen Modellsysteme
 12. Biopolymere 12.1 Organische dünne Filme Langmuir Filme = organische Polymere auf flüssigen Oberflächen Langmuir-Blodgett Filme = organische Polymere auf festen Oberflächen Anwendungen: Sensoren, Detektoren,
12. Biopolymere 12.1 Organische dünne Filme Langmuir Filme = organische Polymere auf flüssigen Oberflächen Langmuir-Blodgett Filme = organische Polymere auf festen Oberflächen Anwendungen: Sensoren, Detektoren,
Zusammenfassung...1. Abstract...3
 INHALTSVERZEICHNIS Zusammenfassung...1 Abstract...3 1 Einleitung...4 1.1 Die Leber...4 1.1.1 Funktion der Leber...4 1.1.2 Mikroanatomie der Leber...5 1.1.3 LSEC...6 1.1.4 Hepatozyten...6 1.1.5 Effektorfunktionen
INHALTSVERZEICHNIS Zusammenfassung...1 Abstract...3 1 Einleitung...4 1.1 Die Leber...4 1.1.1 Funktion der Leber...4 1.1.2 Mikroanatomie der Leber...5 1.1.3 LSEC...6 1.1.4 Hepatozyten...6 1.1.5 Effektorfunktionen
Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod
 Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod DISSERTATION der Fakultät für Chemie und Pharmazie der
Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod DISSERTATION der Fakultät für Chemie und Pharmazie der
Zellkulturmodelle epithelialer Barrieren für die präklinische Arzneimittelentwicklung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Zellkulturmodelle epithelialer Barrieren für die präklinische Arzneimittelentwicklung PD Dr. Stephan Reichl Institut für Pharmazeutische
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Zellkulturmodelle epithelialer Barrieren für die präklinische Arzneimittelentwicklung PD Dr. Stephan Reichl Institut für Pharmazeutische
Übertragung zwischen einzelnen Nervenzellen: Synapsen
 Übertragung zwischen einzelnen Nervenzellen: Synapsen Kontaktpunkt zwischen zwei Nervenzellen oder zwischen Nervenzelle und Zielzelle (z.b. Muskelfaser) Synapse besteht aus präsynaptischen Anteil (sendendes
Übertragung zwischen einzelnen Nervenzellen: Synapsen Kontaktpunkt zwischen zwei Nervenzellen oder zwischen Nervenzelle und Zielzelle (z.b. Muskelfaser) Synapse besteht aus präsynaptischen Anteil (sendendes
1 Bau von Nervenzellen
 Neurophysiologie 1 Bau von Nervenzellen Die funktionelle Einheit des Nervensystems bezeichnet man als Nervenzelle. Dendrit Zellkörper = Soma Zelllkern Axon Ranvier scher Schnürring Schwann sche Hüllzelle
Neurophysiologie 1 Bau von Nervenzellen Die funktionelle Einheit des Nervensystems bezeichnet man als Nervenzelle. Dendrit Zellkörper = Soma Zelllkern Axon Ranvier scher Schnürring Schwann sche Hüllzelle
FOR RISK ASSESSMENT FEDERAL INSTITUTE. Können Pflanzeninhaltsstoffe den biochemischen. Schutz des menschlichen Darmes gegenüber
 H 2 N ABC CH BCRP: Breast cancer resistance protein FEDERAL INSTITUTE FR RISK ASSESSMENT Können Pflanzeninhaltsstoffe den biochemischen Schutz des menschlichen Darmes gegenüber Lebensmittelkontaminanten
H 2 N ABC CH BCRP: Breast cancer resistance protein FEDERAL INSTITUTE FR RISK ASSESSMENT Können Pflanzeninhaltsstoffe den biochemischen Schutz des menschlichen Darmes gegenüber Lebensmittelkontaminanten
Membran-Aufbau. Michael Hertrich Bielefeld University Version 2.1.3
 Membran-Aufbau Michael Hertrich Bielefeld University 27.11.2006 Version 2.1.3 Inhaltsüberblick Membranlipide - Arten und Vorkommen - Anordung - Phospholipid-Beweglichkeit - Selektive Permeabilität - Wechselwirkungen
Membran-Aufbau Michael Hertrich Bielefeld University 27.11.2006 Version 2.1.3 Inhaltsüberblick Membranlipide - Arten und Vorkommen - Anordung - Phospholipid-Beweglichkeit - Selektive Permeabilität - Wechselwirkungen
T-Zellen werden zur Kontrolle intrazellulärer Pathogene benötigt und um B Zellen gegen die meisten Antigene zu aktivieren
 Komponenten und Aufbau des Immunsystems bakterielle Toxine spezifische Antikörper Bakterien im extrazellulären Raum Bakterien im Plasma Antikörper können auf drei Arten an der Immunabwehr beteiligt sein
Komponenten und Aufbau des Immunsystems bakterielle Toxine spezifische Antikörper Bakterien im extrazellulären Raum Bakterien im Plasma Antikörper können auf drei Arten an der Immunabwehr beteiligt sein
Versuch: Enzyme (LDH)
 Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Verteilen von Proteinen innerhalb der Zelle
 Verteilen von Proteinen innerhalb der Zelle cytosolische Proteine Proteine, die direkt in Organellen transportiert werden Proteine, die über das ER transportiert werden Regulation der eukaryontischen Genexpression
Verteilen von Proteinen innerhalb der Zelle cytosolische Proteine Proteine, die direkt in Organellen transportiert werden Proteine, die über das ER transportiert werden Regulation der eukaryontischen Genexpression
Chemokin-Rezeptor-Modulation während der T-Zell-Aktivierung: Untersuchung zur Funktion der GTPase Ras
 Aus dem Institut für Immunologie der Universität Heidelberg Geschäftsführender Direktor: Herr Prof. Dr. med. Stefan Meuer Chemokin-Rezeptor-Modulation während der T-Zell-Aktivierung: Untersuchung zur Funktion
Aus dem Institut für Immunologie der Universität Heidelberg Geschäftsführender Direktor: Herr Prof. Dr. med. Stefan Meuer Chemokin-Rezeptor-Modulation während der T-Zell-Aktivierung: Untersuchung zur Funktion
Die wichtigsten Zelladhesionsmolekülen
 Zelladhesion Die wichtigsten Zelladhesionsmolekülen Homophile Wechselwirkungen Heterophile Wechselwirkungen Cadherine Vermitteln Ca 2+ -abhängige homophile Zell-Zell-Adhäsion Bestehen aus 720-750 Aminosäuren
Zelladhesion Die wichtigsten Zelladhesionsmolekülen Homophile Wechselwirkungen Heterophile Wechselwirkungen Cadherine Vermitteln Ca 2+ -abhängige homophile Zell-Zell-Adhäsion Bestehen aus 720-750 Aminosäuren
Nanocarrier in der Tumortherapie
 NEUE POTENZIALE FÜR DIE NANOTECHNOLOGIE IN DER MEDIZIN FACHVERANSTALTUNG THERAPIE 22.05.2014 INDUSTRIE- UND HANDELSKAMMER DARMSTADT Nanocarrier in der Tumortherapie Christian Schmidt, Joachim * *Abteilungsleiter
NEUE POTENZIALE FÜR DIE NANOTECHNOLOGIE IN DER MEDIZIN FACHVERANSTALTUNG THERAPIE 22.05.2014 INDUSTRIE- UND HANDELSKAMMER DARMSTADT Nanocarrier in der Tumortherapie Christian Schmidt, Joachim * *Abteilungsleiter
Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone)
 Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone) 1. - 4. Ordnen Sie die in der ersten Liste aufgeführten Membrankomponenten (A-E) den Aussagen der zweiten Liste (1-4) zu: A. Cerebroside
Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone) 1. - 4. Ordnen Sie die in der ersten Liste aufgeführten Membrankomponenten (A-E) den Aussagen der zweiten Liste (1-4) zu: A. Cerebroside
Zellmembran. Zellmembran (TEM) ( x)
 Zellmembran Zellmembran (TEM) (100.000 x) Die Zellmembran ist der äußere Abschluß des Zellinhalts jeder Zelle. Bei Pflanzen- und Bakterienzellen liegt ihr außen noch eine Zellwand auf. Die Zellmembran
Zellmembran Zellmembran (TEM) (100.000 x) Die Zellmembran ist der äußere Abschluß des Zellinhalts jeder Zelle. Bei Pflanzen- und Bakterienzellen liegt ihr außen noch eine Zellwand auf. Die Zellmembran
Medikamentöse Prävention von Stoffwechselstörungen bei Kindern
 Medikamentöse Prävention von Stoffwechselstörungen bei Kindern Ania C. Muntau Molekulare Pädiatrie Dr. von Haunersches Kinderspital Ludwig-Maximilians-Universität Tyrosinämie Typ I Tyrosin Homogentisinsäure
Medikamentöse Prävention von Stoffwechselstörungen bei Kindern Ania C. Muntau Molekulare Pädiatrie Dr. von Haunersches Kinderspital Ludwig-Maximilians-Universität Tyrosinämie Typ I Tyrosin Homogentisinsäure
Sammlung von elektronenmikroskopischen Aufnahmen
 Sammlung von elektronenmikroskopischen Aufnahmen Hilfsmaterial für die Prüfungen zusammengestellt von Prof. Dr. Pál Röhlich Zellkern Kernhülle Golgi-Apparat Transport- Vesikeln Mitochondrium Lysosom Mitochondrien
Sammlung von elektronenmikroskopischen Aufnahmen Hilfsmaterial für die Prüfungen zusammengestellt von Prof. Dr. Pál Röhlich Zellkern Kernhülle Golgi-Apparat Transport- Vesikeln Mitochondrium Lysosom Mitochondrien
Katja Bender (Autor) Entwicklung und Charakterisierung verschiedener biomimetischer Lipidmembransysteme zur Untersuchung von Membranproteinen
 Katja Bender (Autor) Entwicklung und Charakterisierung verschiedener biomimetischer Lipidmembransysteme zur Untersuchung von Membranproteinen https://cuvillier.de/de/shop/publications/2471 Copyright: Cuvillier
Katja Bender (Autor) Entwicklung und Charakterisierung verschiedener biomimetischer Lipidmembransysteme zur Untersuchung von Membranproteinen https://cuvillier.de/de/shop/publications/2471 Copyright: Cuvillier
Aufnahme der Nährstoffbausteine vom Darm in die Blutbahn durch Diffusion und aktiven Transport
 Nährstoffe 10 1 10 1 Organische Stoffe, die von heterotrophen Organismen zur Energiegewinnung bzw. zum Aufbau des Organismus aufgenommen werden müssen. Kohlenhydrate (Zucker und Stärke) Fette (ein Fettmolekül
Nährstoffe 10 1 10 1 Organische Stoffe, die von heterotrophen Organismen zur Energiegewinnung bzw. zum Aufbau des Organismus aufgenommen werden müssen. Kohlenhydrate (Zucker und Stärke) Fette (ein Fettmolekül
Das Komplementsystem. Membranangriffskomplex Regulation Komplementrezeptoren kleine C-Fragmente
 Das Komplementsystem Membranangriffskomplex Regulation Komplementrezeptoren kleine C-Fragmente Der Membranangriffskomplex C5 Konvertase alle 3 Aktivierungswege mit einem Ziel: Bildung einer C3-Konvertase
Das Komplementsystem Membranangriffskomplex Regulation Komplementrezeptoren kleine C-Fragmente Der Membranangriffskomplex C5 Konvertase alle 3 Aktivierungswege mit einem Ziel: Bildung einer C3-Konvertase
Entwicklung und Charakterisierang von Mikroemulsionen mit fettlöslichen Vitaminen zur Anwendung in Pharmaka und Lebensmitteln
 Entwicklung und Charakterisierang von Mikroemulsionen mit fettlöslichen Vitaminen zur Anwendung in Pharmaka und Lebensmitteln Inaugural-Dissertation zur Erlangung der Doktorwürde der Fakultät für Chemie
Entwicklung und Charakterisierang von Mikroemulsionen mit fettlöslichen Vitaminen zur Anwendung in Pharmaka und Lebensmitteln Inaugural-Dissertation zur Erlangung der Doktorwürde der Fakultät für Chemie
Molekularbiologische und funktionelle Charakterisierung intestinaler Arzneistoff-Transporter
 INAUGURAL-DISSERTATION zur Erlangung der Doktorwürde der Naturwissenschaftlich-Mathematischen Gesamtfakultät der Ruprecht-Karls-Universität Heidelberg Molekularbiologische und funktionelle Charakterisierung
INAUGURAL-DISSERTATION zur Erlangung der Doktorwürde der Naturwissenschaftlich-Mathematischen Gesamtfakultät der Ruprecht-Karls-Universität Heidelberg Molekularbiologische und funktionelle Charakterisierung
In vitro Untersuchungen zum Bicarbonattransport des Blättermagenepithels von Schafen
 Aus dem Institut für Veterinär-Physiologie des Fachbereichs Veterinärmedizin der Freien Universität Berlin In vitro Untersuchungen zum Bicarbonattransport des Blättermagenepithels von Schafen Inaugural
Aus dem Institut für Veterinär-Physiologie des Fachbereichs Veterinärmedizin der Freien Universität Berlin In vitro Untersuchungen zum Bicarbonattransport des Blättermagenepithels von Schafen Inaugural
https://cuvillier.de/de/shop/publications/6509
 Stefanie Franz (Autor) Effekt selektiver und nicht selektiver nichtsteroidaler Antiphlogistika auf die Entzündungsreaktion von durch Ischämie und Reperfusion geschädigtem equinen Jejunum https://cuvillier.de/de/shop/publications/6509
Stefanie Franz (Autor) Effekt selektiver und nicht selektiver nichtsteroidaler Antiphlogistika auf die Entzündungsreaktion von durch Ischämie und Reperfusion geschädigtem equinen Jejunum https://cuvillier.de/de/shop/publications/6509
Biomembranen Transportmechanismen
 Transportmechanismen Barrierewirkung der Membran: freie Diffusion von Stoffen wird unterbunden durch Lipidbilayer selektiver Stofftransport über spezielle Membranproteine = Translokatoren Semipermeabilität
Transportmechanismen Barrierewirkung der Membran: freie Diffusion von Stoffen wird unterbunden durch Lipidbilayer selektiver Stofftransport über spezielle Membranproteine = Translokatoren Semipermeabilität
(Patho)Physiologie von Verdauung und Resorption
 (Patho)Physiologie von Verdauung und Resorption Gliederung Funktionelle Anatomie - Aufbau des Magens und der Magenschleimhaut Mechanismen der Magensaftbildung & der Magenschleimhaut - Mechanismen der Protonensekretion
(Patho)Physiologie von Verdauung und Resorption Gliederung Funktionelle Anatomie - Aufbau des Magens und der Magenschleimhaut Mechanismen der Magensaftbildung & der Magenschleimhaut - Mechanismen der Protonensekretion
