Vanadylacetylacetonat
|
|
|
- Matthias Hase
- vor 5 Jahren
- Abrufe
Transkript
1 Synthese und solvatochrome Eigenschaften Geoffrey Pockay und Ramona Stark, Gruppe 2 Dozent: Dr. Gunther Steinfeld Abgabe: 5. Dezember 2011 Abgabe Version 2: 9. Januar 2012
2 Abstract Dieser Bericht behandelt die Herstellung von, ausgehend von Vanadiumpentoxid. Die Ausbeute der Synthese betrug 6.37 g, was einer relativen Ausbeute von 107.5% entspricht. Um die katalytischen Eigenschaften von zu testen, wurden drei Versuche durchgeführt. Dabei handelt es sich um die Synthese von Anthrachinon, ausgehen von Anthracen, welche nur in Anwesenheit eines Katalysators von statten geht. Versuch Nr. 1 wurde wie in der Literatur beschrieben mit Vanadylacetyacetonat umgesetzt. Beim Versuch Nr. 2 wurde der Katalysator weggelassen. Bei Versuch Nr. 3 wurde die Reaktionszeit von 2 Stunden auf 4 verdoppelt. Der Nachweis, dass das gewünschte Produkt nur bei Versuch Nr. 1 und Nr. 3 entstanden ist, wurde durch eine H-NMR Analyse erbracht. Ramona Stark / CH11-2-
3 Inhaltsverzeichnis 1 Theoretischer Teil Vorkommen und Verwendung Chemische Eigenschaften Herstellung Gillespie- Nyholm- Theorie Was wird betrachtet / beachtet Elektronegativität Einfach- / Mehrfachbindungen Ein und zwei Elektronenpaare Drei Elektronenpaare Praktischer Teil Auftrag Herstellung von [1] Chemikalien (Herstellung von Vanadylacetyacetonat) Sicherheit Materialien und Geräte Ansatz, Durchführung und Ausbeute Überprüfung der solvatochromen Eigenschaften Beweis der katalytischen Eigenschaft Auftrag Reaktionsgleichung Versuch Nr Versuch Nr Versuch Nr Ramona Stark / CH11-3-
4 3.6 Analyse des hergestellten Antrachinons Interpretation der Spektren Literaturverzeichnis...29 Ramona Stark / CH11-4-
5 1 Theoretischer Teil 1 Theoretischer Teil Vorkommen und Verwendung Acetylacetonate werden oft in Verbindung mit Übergangsmetallen in Komplexen hergestellt. Diese Komplexe finden dann Anwendung als Katalysatoren. Das ist ein gängiger Katalysator für die Oxidation von Anthracen zu Anthrachinon, welches als Basisstoff für diverse Pigmente dient. [1] Chemische Eigenschaften ist ein dunkelblauer Feststoff, der als feines Pulver vorliegt. Spezielles Merkmal ist die Solvatochromie des Stoffes, der auch als qualitätsmerkmal verwendet werden kann. [2] Herstellung Das wird in drei Teilreaktionen hergestellt. In der ersten wird Vanadiumpentoxid zu Vanadylsulfat reduziert. Im zweiten Schritt wird das Vanadylsulfat mit Acetylaceton zu oxidiert. Im dritten Schritt wird die überschüssige Schwefelsäure mit Ammoniaklösung neutralisiert bis zu einem ph von 3. [3] 1.2 Gillespie- Nyholm- Theorie Um ein Model mittels Gillespie- Nyholm- Theorie zu erstellen, stellt diese Theorie diverse Regeln auf, welche schlussendlich zu vier Regeln zusammengeführt werden können. Die Gillespie- Nyholm- Theorie dient dazu, die Struktur von Molekülen zu ermitteln. Dabei kann nur eine Vorhersage gemacht werden. Entwickelt wurde die Theorie von R. J. Gillespie und R. S. Nyholm. Die Theorie wird auch Elektronenpaar- Abstossungs- Modell genannt, was vom englischen valence- shell electron- pair repulsion (VSEPR) kommt. Weiter gilt es zu sagen, dass man hier eine Struktur ermittelt; keine Geometrie oder Architektur eines Moleküls, denn dies sind Gebiete der Mathematik bzw. die Lehre der Baukunst [4][5][6][7] Was wird betrachtet / beachtet Um eine Vorhersage über die Molekülstruktur mittels VSEPR-Modell zu machen, untersucht man das Zentralatom der Verbindung. Als Zentralatom bezeichnet man jenes Atom, welches Ramona Stark / CH11-5-
6 1 Theoretischer Teil dem Molekül zu Grunde liegt bzw. jenes Atom, welches mehrere Bindungen aufweist. Nun betrachtet man die Anzahl bindende- und nichtbindenden Elektronen und nimmt an, dass alle den gleichen energetischen Zustand haben. Ob es sich um s- oder p- Elektronen handelt wird nicht beachtet. Auch Hybridisierungen spielen keine Rolle [4][5][6][7]. Nun ordnen sich alle Elektronenpaare so auf einer gedachten Kugel an, dass sie den grössten möglichen Abstand zu einander aufweisen. Dies resultiert daraus, dass diese Bindungen negativ geladene Elektronenwolken darstellen. Dass sie den grössten möglichen Abstand einnehmen, liegt an der physikalischen Gegebenheit der Abstossung von gleichen Ladungen. Da sich allerdings entgegengesetzte Ladungen anziehen, führt dazu, dass nichtbindende Elektronenpaare (auch Lone Pair genannt) näher beim Zentralatom gelegen sind als bindenden Elektronenpaare. Das heisst, dass Lone Pairs die bindenden Elektronenpaare verdrängen [4][5][6][7] Elektronegativität Bekanntlich gibt es zwischen den verschiedenen Elementen unterschiedliche Elektronegativitäten (kurz EN). Diese führen ebenso zu Beeinflussungen der Struktur. Da Elemente mit hoher EN die Elektronen zu sich ziehen, führt dies dazu, dass sich die Elektronenwolke zum elektronegativeren Element hin aufbläht. Somit brauchen elektronegatievere Elemente weniger Platz als ihre schwächeren Nachbarn im Molekül [4][5][6][7] Einfach- / Mehrfachbindungen Doch was passiert, wenn nun Mehrfachbindungen vorliegen? Mehrfachbindungen sind im Grunde linear zu einander verlaufende Elektronenwolken. Umso mehr solche Wolken nebeneinander liegen, umso mehr Platz benötigen sie. Sie bilden zusätzlich zu ihrem grösseren Volumen auch einen negativeren Pool. Eine Dreifachbindung hat drei solche Elektronenwolken und bildet somit die grösste Bindungsblase und benötigt den meisten Platz, drängt damit also alle anderen Bindungen von sich weg. Analog dazu verhält sich die Doppelbindung. Allerdings mit dem Unterschied, dass die Doppelbindung nur zwei lineare Elektronenwolken besitzt. Daher sind das Volumen und die negative Ladung geringer als bei der Dreifachbindung. Die Einfachbindung ist im Grunde der Normalfall einer Bindung im VSEPR- Modell. Sie fügt sich den Einflüssen von Lone Pairs, Elektronegativität, Dreifach- und Doppelbindungen. Weitere Konsequenzen haben Einfach- bzw. Mehrfachbindungen nicht auf sie Molekularstruktur, denn sie sind alle wie Einfachbindungen zu behandeln [4][5][6][7]. Ramona Stark / CH11-6-
7 1 Theoretischer Teil Ein und zwei Elektronenpaare Bei Zentralatomen mit einem oder zwei Elektronenpaaren in der Valenzschale ergeben sich ausschliesslich lineare Molekülstrukturen. Bei zwei Elektronenpaaren gilt zu beachten, dass zwischen den beiden Liganden ein Winkel von 180 ergibt. Abbildung 1: Zentralatom mit einem binden Elektronenpaar, lineare Struktur Abbildung 2: Zentralatom mit zwei bindenden Elektronenpaaren, lineare Struktur Drei Elektronenpaare Sind nun drei Elektronenpaare in der Valenzschale, bildet sich ein planares Dreieck. Darin betragen die Winkel von Ligand zu Ligand, solange sich alle Bindungen gegenseitig gleichgestellt sind, 120. Abbildung 3: Zentralatom mit drei bindenden Elektronenpaaren, planartigonale Struktur Ramona Stark / CH11-7-
8 1 Theoretischer Teil Angenommen eines dieser drei Elektronenpaare ist ein Lone Pair, so wird dieses eine Lone Pair ein gewinkeltes Molekül erzeugen, da die beiden bindenden Elektronenpaare weggedrückt werden. Abbildung 4: Zentralatom mit zwei bindenden Elektronenpaaren und einem Lone Pair, gestauchte Struktur Vier Elektronenpaare Besitzt ein Zentralatom vier Valenzelektronen, bilden die Liganden die Ecken eines Tetraeders mit dem Zentralatom im Zentrum. Die Winkel gleichberechtigter Liganden sind 104,5. Abbildung 5: Zentralatom mit vier bindenden Elektronenpaaren, tetraedrische Struktur Ist nun einer dieser Liganden ein nichtbindendes Elektronenpaar, so ergibt sich eine trigonale Pyramide als räumliche Struktur des Moleküls, worin das Zentralatom die Spitze der Pyramide ist. Abbildung 6: Zentralatom mit drei bindenden Elektronenpaaren und einem Lone Pair, trigonalpyramidische Struktur Wenn nun zwei der vier Elektronenpaare nichtbindend sind entsteht ein planar gewinkeltes Molekül. Die beiden verbleibenden Liganden werden von den zwei nichtbindenden Elektronenpaaren in einen Winkel gedrückt, der kleiner als 104,5 beträgt. Das Wassermolekül ist ein Beispiel dafür. Ramona Stark / CH11-8-
9 1 Theoretischer Teil Abbildung 7: Zentralatom mit zwei bindenden Elektronenpaaren und zwei Lone Pairs, gestauchte Struktur Fünf Elektronenpaare Für fünf Elektronenpaare ergibt sich eine Anordnung in Form einer trigonalen Bipyramide. Darin liegt das Zentralatom im Zentrum eines gleichseitigen Dreiecks. Dieses Dreieck nennt man allgemein die äquatorialen Positionen. Auf beiden Seiten des Dreiecks erstreckt sich je eine Bindung in axialer Richtung zu den Liganden. Diese Bindungen sind etwas länger als jene auf der äquatorialen Ebene. Ebenso haben diese axialen Liganden andere Winkelverhältnisse als die Liganden der äquatorial Ebene. Die Winke zwischen den Liganden auf der Äquatorialebene haben alle zu ihren drei Nachbarn der Ebene einen Winkel von 120. Während die axialen Liganden einen Winkel von 90 zu ihren drei direkten Nachbarn aufweisen. Kurz gefasst haben die axialen Positionen weniger Platz zu bieten als die äquatorialen Positionen. Es sind also nicht mehr alle Ligandenbindungen gleichberechtigt. Man muss nun gut überlegen, welche Elektronegativität ein Ligand hat. Denn wenn eine hohe EN besteht, ordnen sich diese Liganden vorzugsweise axial an. Es wurde ja definiert, dass Liganden mit hoher EN weniger Platz benötigen. Abbildung 8: Zentralatom mit fünf bindenden Elektronenpaaren, trigonalbipyramidische Struktur Ramona Stark / CH11-9-
10 1 Theoretischer Teil Ist nun eines der Elektronenpaare ein Lone Pair, ordnet sich dieses in der Äquatorialebene an, da dort am meisten Platz ist. Dabei drückt es wieder seine Nachbarn von sich weg und verzerrt dabei die Struktur des Moleküls. Abbildung 9: Zentralatom mit fünf bindenden Elektronenpaaren und einem Lone Pair, verzerrte Struktur Hat das Zentralatom nun zwei Lone Pairs, ordnen sich diese, analog zum Fall mit einem Lone Pair, auf der äquatorialen Ebene an. Es findet eben falls eine Verzerrung statt. Der Struktur des Moleküls gibt man den Namen T-förmig, da die drei Liganden ein verzerrtes T darstellen, wobei der Ligand der äquatorial Ebene den Fuss des T s bilden und die beiden axialen Liganden den Querbalken. Abbildung 10: Zentralatom mit drei bindenden Elektronenpaaren und zwei Lone Pairs, T - förmige Struktur Weiter ergibt sich für den Fall von drei nichtbindenden Elektronenpaaren eine lineare Struktur, da alle drei äquatorialen Positionen von den Lone Pairs besetzt sind. Abbildung 11: Zentralatom mit zwei bindenden Elektronenpaaren und drei Lone Pairs, lineare Struktur Sechs Elektronenpaare Im Falle von sechs Valenzelektronenpaaren erweitert man das Strukturbild des Falles mit fünf Elektronenpaaren auf der Äquatorialebene um einen Liganden. Dadurch werden nun Ramona Stark / CH11-10-
11 1 Theoretischer Teil alle Liganden wieder gleichberechtigt. Nun haben alle bindenden Elektronenpaare den gleichen Zwischenwinkel von 90. Bei dieser Struktur spricht man von einem Oktaeder. Abbildung 12: Zentralatom mit sechs bindenden Elektronenpaaren, quadratischbipyramidische Struktur Anders als bei der trigonalen Bipyramide ordnen sich bei der quadratischen Bipyramide die Lone Pairs auf den axialen Positionen an, um den grössten möglichen Abstand zu gewinnen. Wenn nun ein Lone Pair am Zentralatom liegt, nimmt es eine der axialen Positionen ein und staucht die vier Liganden der äquatorial Ebene zum verbleibenden axialen Liganden hin. Abbildung 13: Zentralatom mit fünf bindenden Elektronenpaaren und einem Lone Pair, quadratischpyramidische Struktur Bei zwei Lone Pairs entsteht ein planares Quadrat als Struktur. Dazu ordnen sich die beiden nichtbindenden Elektronenpaare auf den axialen Positionen an. Nun drücken zwei Mal die gleich grossen Kräfte von den Lone Pairs auf die äquatorialen Liganden, was keine Änderung ihrer Winkel zur Folge hat. Abbildung 14: Zentralatom mit vier bindenden Elektronenpaaren und zwei Lone Pairs, quadratische Struktur Die weiteren Strukturen lassen sich gemäss den oberen Abbildungen herleiten. Will man ein Zentralatom betrachten, das mehr als sechs Elektronenpaare in der Valenzschale hat, kann man keine eindeutigen Vorhersagen für die Struktur machen. Ramona Stark / CH11-11-
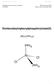
12 1 Theoretischer Teil Die vier Regeln Aus all diesen Erkenntnissen lassen sich vier Regeln formulieren, welche, nach einander angewandt, die Struktur für ein Zentralatom mit bis zu sechs Valenzelektronenpaaren erahnen lassen. 1. Da sich die Elektronenpaare gegenseitig abstossen, ordnen sich diese auf einer gedachten Kugel mit dem grössten möglichen Abstand zu einander um das Zentralatom an. 2. Nichtbindende Elektronenpaare werden nur vom Zentralatom angezogen und liegen näher am Zentralatom. Daher nehmen Lone Pairs mehr Platz ein als bindende Elektronenpaare. 3. Ein elektronegativer Ligand zieht die Elektronen der Bindung näher zu sich. So brauchen stark elektronegative Liganden weniger Platz als weniger elektronegative. 4. Der Platzbedarf von Mehrfachbindungen steigt mit ihrer Anzahl Bindungen. Dreifachbindungen > Doppelbindungen > Einfachbindungen Zu diesen Herleitungen und Regeln gilt es anzumerken, dass diese nur für Hauptgruppenelemente und kleine Moleküle anwendbar ist. Denn bei Nebengruppenelementen spielen dann die d- bzw. die f- Orbitale eine zu grosse Rolle bei der Strukturierung des Moleküls. Für grosse Moleküle ergibt sich die Schwierigkeit der molekülinternen Kräfte, welche die Struktur beeinflussen [4][5][6][7]. 1.3 im Gillespie- Modell Mit der Freeware ChemSketch von ACD Labs wurde das dreidimensional dargestellt, wobei die Software automatisch das VSEPR- Modell angewandt hat. Vanadium steht in der fünften Nebengruppe, was für dieses Modell einmal vernachlässigt wird. In der Grafik sieht man die Äquatorialebene mit gelben Linien eingezeichnet. Moleküle, mit einer trigonalen bipyramidalen Struktur, neigen dazu ihre gleichberechtigten Liganden der axialen Positionen mit denen der äquatorialen Ebene auszutauschen. Abbildung 15: trigonal- bipyramidal mit markierter Äquatorialebene. Ramona Stark / CH11-12-
13 1 Theoretischer Teil 1.4 Die Berry- Pseudorotation Wie bereits erwähnt, braucht es auf den axialen Positionen, wie auf dem Äquator, gleichartige Liganden. Nun bewegen sich bei der Berry- Pseudorotation die beiden axialen Liganden in Richtung der Äquatorebene, wodurch zwei gleichwertige Liganden des Äquators in die Achsen gedrückt werden. Dadurch wird das Äquatordreieck meist um 90 um eine räumliche Achse gedreht. Daraus entsteht dann auch der Trugschluss, dass es sich bei diesem Vorgang um eine Rotation des Moleküls handelt. Es handelt sich dabei allerdings um eine Umlagerung; ähnlich wie eine mesomere Grenzstruktur. Abbildung 16: Berry- Pseudorotation schematisch aufgezeichnet Ramona Stark / CH11-13-
14 1 Theoretischer Teil 1.5 als Katalysator findet seine Verwendung als Katalysator unter anderem bei Oxidationen. Da das Vanadiumatom im Zentrum des Moleküls einen starken positiven Pol darstellt, vermag es andere Moleküle zu beeinflussen. Das verändert die Elektronendichte in anderen Molekülen, wodurch diese reaktiver werden. Es folgt eine Skizze mir Wasserstoffperoxid. Abbildung 17: VO(acac) 2 verändert die Elektronendichte in H 2O 2 Im Wasserstoffperoxid sind die beiden Sauerstoffatome gleich. Kommt nun das in die Nähe beginnt eine Wechselwirkung zwischen dem Lone Pair des Sauerstoffs und dem partial stark positiven Vanadium. Dazu nimmt das die Struktur der quadratischen Pyramide ein. Im Wasserstoffperoxid werden nun Elektronen zum Sauerstoffatom hingezogen, mit dessen Lone Pair das interagiert. Denn bekanntlich sind die beiden Sauerstoffatome gleichberechtigt und wird nun an den Elektronen des einen Sauerstoffs herumgezogen, so gleicht sich das damit aus, dass Elektronen vom anderen Sauerstoffatom nachkommen. Daraus ergibt sich ein partial positiv geladenes Sauerstoffatom. Ein Sauerstoffatom, dem Elektronen fehlen, will diesen Mangel schnellst möglich ausgleichen. So kann nun das Wasserstoffperoxid Moleküle oxidieren, welche sich sonst nicht oxidieren liessen oder nur stark und zu schnell oxidieren würden. Beispiel dafür ist die Reaktion von Anthracen mit Wasserstoffperoxid zu Anthrachinon im Kapitel 3. Ramona Stark / CH11-14-
15 1 Theoretischer Teil 1.6 Kristallfeldtheorie Die sechs Liganden eines oktaedrischen Komplexes sind bei der Kristallfeldtheorie auf den Achsen eines kartesischen Koordinatensystems angeordnet, wie in der Abbildung 18 ersichtlich ist. Die beiden auf den Achsen liegenden Orbitale d 2 x -y und d 2 z werden wegen der nega- 2 tiven Partialladung der Liganden stärker abgestossen als die übrigen Orbitale. Daraus ergibt 2 sich die zweifach energetische Entartung der d 2 2 x -y und d z Orbitale und die dreifach Entartung der d xy, d yz und d xy Orbitale. Der Abstand zwischen den Orbitalen ist dabei die Ligandfeldaufspaltung Δ O (das tiefgestellte O bezeichnet das oktaedrische Kristallfeld). [8] im oktaedrischen Kristallfeld d x 2 -y 2, d z 2 e g in kugelsymetrischer Umgebung 3/5 Δ O Δ O 2/5 Δ O t 2g d xy, d yz und d xy Abbildung 18: Die fünf d-orbitale im oktaedrischen Kristallfeld Die Ligandfeldaufspaltung Δ O hängt vor allem von den Liganden ab. Der japanische Chemiker R. Tsuchida fand dabei heraus, dass die Absorptionsspektren eine gewisse Regelmässigkeit aufweisen, wenn die Liganden ausgetauscht werden. Er stellte dabei eine spektrochemische Reihe auf: I < Br < SCN < Cl < F < OH < H 2 O < NCS < NH 3 < NO 2 < CNO < CN < CO Die Ligandfeldaufspaltung nimmt von links nach rechts zu! Es ist allerdings nicht angebracht, aussagen über die Ligandfeldaufspaltung zu treffen, ohne das Metall-Ion zu berücksichtigen. Es sind dabei zwei wichtige Regeln zu beachten [8]: 1. Die Ligandfeldaufspaltung Δ O steigt mit zunehmender Oxidationszahl der Metallzentrums [8]. 2. Innerhalb einer Gruppe des Periodensystems nimmt Δ O von oben nach unten zu [8]. Auch hier hat Tsuchida eine Reihenfolge festlegen können: Ramona Stark / CH11-15-
16 1 Theoretischer Teil Mn 2+ < Ni 2+ < Co 2+ < Fe 2+ < V 2+ < Fe 3+ < Cr 3+ < V 3+ < Co 3+ < Mn 4+ < Mo 3+ < Rh 3+ < Pd 4+ < Ir 3+ < Re 4+ < Pt 4+ Mit diesen Erkenntnissen kann auch eine Aussage über den blau/grünen Farbeindruck von gemacht werden. Möchte man nun beim hergestellten Katalysator bestimmen, wo sich das eine Elektron des 2 2 Wasserstoffperoxids bei der Reaktion räumlich aufhält bzw. welches Orbital (d x -y, d 2 z, d xy, d yz und d xy ) besetzt wird, muss man sich die Ligandfeldaufspaltung näher anschauen. Vanadium 2+ hat insgesamt 3 Valenzelektronen: d 3 Δ O Nach den Hund schen Regeln zufolge ist der am energetisch günstigste Zustand die parallele Anordnung der Elektronen. Kommt nun noch ein Elektron hinzu, resultieren folgende Möglichkeiten: d 3 oder d 3 Δ O Δ O Das eine Elektron kann nun in ein e g oder t 2g Orbital. Geht es in ein e g so nimmt Δ O ab, geht es in ein t 2g Orbital nimmt Δ O zu. Je nachdem, welcher Zustand nun günstiger ist, nistet sich das Elektron dort ein [8]. Ramona Stark / CH11-16-
17 2 Praktischer Teil 2 Praktischer Teil 2.1 Auftrag Der Auftrag war, die Verbindung herzustellen. dient als Katalysator. Um zu testen, ob wirklich die gewünschte Verbindung entstanden ist, muss Anthracen in Anwesenheit des Produktes (dient als Katalysator) zu Anthrachinon umgesetzt werden. 2.2 Herstellung von [3] Vanadiumpentoxid, Wasser und Ethanol werden vorgelegt und unter Rühren Schwefelsäure konz. zugetropft und anschliessend zum Rückfluss erhitzt. Die zu Beginn orange Suspension färbt sich nach einer gewissen Zeit am Rückfluss zuerst grün und danach dunkelblau. Es wird Wasser und Acetylaceton zugegeben und durch Zugabe von einer wässrigen Ammoniaklösung die bei der Reaktion entstandene Schwefelsäure neutralisiert. Vanadylsulfat Abbildung 19 Oxidation von Vanadiumpentoxid zu Vanadiumsulfat (ChemSketch) Vanadylsulfat Abbildung 20 Komplexbildung zu (ChemSketch) Ramona Stark / CH11-17-
18 2 Praktischer Teil Chemikalien (Herstellung von ) Edukte Substanz Summenformel molare Masse [g * mol -1 ] Dichte [g*cm -3 ] (bei 20 C) Smp / Sdp [C ] Vanadiumpentoxid V 2 O / 1750 Aspekt oranger Feststoff Schwefelsäure H 2 SO / 280 farblos Acetylaceton C 2 H 5 OH / 140 farblos Ammoniak NH / -33 farblos Tabelle 1: Eigenschaften der Edukte, Römpp Online Produkte Substanz Summenformel molare Masse [g * mol -1 ] Dichte [g*cm -3 ] (bei 20 C) VO(C 5 H 7 O 2 ) Smp / Sdp [C ] Aspekt blau-grüner Feststoff Acetaldehyd C 2 H 4 O / 20 farblos Schwefelsäure H 2 SO / 280 farblos Tabelle 2: Eigenschaften der Produkte, Römpp Online Sicherheit Vanadiumpentoxid ist giftig, reproduktionstoxisch und Schädlich für Wasserorganismen. Jeglicher Kontakt mit der Haut oder Einatmen soll vermieden werden. Darf nicht in die Kanalisation gelangen. [9] Schwefelsäure ist eine stark ätzende Flüssigkeit. Jeglicher Kontakt mit der Haut sollte vermieden werden. [1] Acetylacetonat ist eine brennbare Flüssigkeit. Kann bei Verschlucken schädlich sein. [9] wird als toxisch behandelt, da es eine Schwermetallverbindung ist. Weitere Gefahren sind unbekannt. Ramona Stark / CH11-18-
19 2 Praktischer Teil Materialien und Geräte Kugelkühler 2 Tropftrichter 3 Thermometer 4 50 ml 3-Halskolben 5 Heizplatte / Magnetrührer 6 Wasserbad Ansatz, Durchführung und Ausbeute g Vanadiumpentoxid wurden in ein 50 ml 3-Halskolben vorgelegt und mit 6.00 g Ethanol und 7 ml Wasser suspendiert. Es entstand eine gelbe Suspension bei 21 C Innentemperatur. Mittels Tropftrichter wurde dann 6.6 g Schwefelsäure langsam zu getropft (exotherm; temp. max.: 36 C). Anschliessend wurde die ganze Apparatur mit Stickstoff für insgesamt zwei Minuten gespült. Innerhalb von 24 Minuten wurde zum Rückfluss erhitzt es bildeten sich grüne Schlieren. Es wurde 45 min bei Rückfluss gerührt. Zu Beginn der Reaktion bildete sich eine Gaswolke im Kühler, welche sich dann aber wieder verflüchtigte. Nach 13 Minuten am Rückfluss färbte sich das Reaktionsgemisch grün. Nach weiteren 7 Minuten wurde es dunkel. Nach 45 Minuten am Rückfluss lag eine dunkelblaue Lösung vor. Das Ölbad wurde entfernt und 20 ml Wasser mittels Tropftrichter innerhalb von 10 min zugegeben. Nach 10 Minuten rühren wurde 5.6 g Acetylaceton über den Tropftrichter innerhalb von 6 min. zugegeben und anschliessend auf Raumtemperatur abgekühlt. Bei Raumtemperatur wurde langsam eine im Voraus hergestellte Ammoniaklösung (40 ml dest. Wasser ml 25% Ammoniaklösung) zugegeben. Die dunkelblaue Lösung mit ph 0 wurde auf ph von 3.02 gestellt. Das begann bei ph 1.5 an auszufallen. Der blaue Niederschlag wurde über eine Glassinternutsche (por.3) abfiltriert und drei Mal mit je 20 ml dest. Wasser nachgewaschen. Man erhielt 5.67 g blaues Feuchtprodukt. Die Mutterlauge wurde mittels Rotavap bei 130 mbar und 80 C Badtemperatur eingeengt, danach zusammen mit dem Feuchtprodukt bei 50 C und 100 mbar über 25 Abbildung 21: aus der Synthese Ramona Stark / CH11-19-
20 2 Praktischer Teil Stunden getrocknet bis zur Gewichtskonstanz. Ausbeute: 6.37 g = 107.5% Ausbeute Um zu beweisen, dass es sich wirklich um handelt, wurden die solvatochromen Eigenschaften des Trockenproduktes untersucht. Dabei wurde jeweils ca. 10 mg Trockenprodukt in ein 10.0 ml Messkolben eingewogen und mit Tetrahydrofuran, Pyridin und Ethanol gelöst Überprüfung der solvatochromen Eigenschaften Um zu beweisen, dass es sich wirklich um handelt, wurden die solvatochromen Eigenschaften des Trockenproduktes untersucht. Dabei wurde jeweils ca. 30 mg Trockenprodukt in ein 10.0 ml Messkolben eingewogen und mit Tetrahydrofuran, Pyridin und Ethanol gelöst und anschliessend mit dem UV Spektroskopie bei nm gemessen (siehe Abbildung 22, Seite 21) Ramona Stark / CH11-20-
21 2 Praktischer Teil Abbildung 22 Aufgenommene Spektren von in Ethanol (blau), Pyridin (rot) und Tetrahydrofuran (grün) Ramona Stark / CH11-21-
22 3 Beweis der katalytischen Eigenschaft 3 Beweis der katalytischen Eigenschaft 3.1 Auftrag Um zu beweisen, dass die Herstellung des Katalysators erfolgreich war und das als Katalysator eingesetzt werden kann, wurde Anthracen in Anwesenheit von zu Anthrachinon umgesetzt. Dabei wurden drei verschiedene Versuche durchgeführt: 1. Versuch nach Literatur [10], 2. Versuch mit doppelter Reaktionszeit und der 3. Versuch wurde ohne durchgeführt um zu zeigen, dass ohne Katalysator keine Umsetzung stattfinden kann. [10] 3.2 Reaktionsgleichung Abbildung 23: Reaktionsschema der Synthese, gezeichnet mit ChemSketch 3.3 Versuch Nr. 1 Eingesetzte Menge: g Anthracen, 99% 25.6 mg 20 ml Ethylacetat 15 ml Wasserstoffperoxid 30% Theoretische Ausbeute: 2.81 mmol = g Anthrachinon, Reinheit: 100% Anthracen und wurde in ein 50 ml 2-Halskolben eingewogen und mit 20 ml Ethylacetat suspendiert. Mit einer Pipette wurde 15 ml Wasserstoffperoxid 30% hinzugefügt (exotherm). Die Suspension färbt sich bräunlich, es wird zum Rückfluss erhitzt und 2 Stunden gerührt. Anschliessend wird auf Raumtemperatur abgekühlt, 20 ml dest. Wasser zugegeben und 10 Minuten gerührt. Die Phasen wurden getrennt. Danach wurde die wäss. Phase beim ersten Mal mit 20 ml Dichlormethan, beim zweiten Mal mit 10 ml extrahiert und Ramona Stark / CH11-22-
23 3 Beweis der katalytischen Eigenschaft mit der Ethylacetat-Phase vereinigt und am Rotavap bei 60 C RT 200 mbar eingeengt. Zurück bleibt ein oranger, nadelförmiger Feststoff. Ausbeute: 0.65 g = 111% Ausbeute 3.4 Versuch Nr. 2 Eingesetzte Menge: g Anthracen 20 ml Ethylacetat 15 ml Wasserstoffperoxid 30% Theoretische Ausbeute: 2.81 mmol = g Anthrachinon, Reinheit: 100% Anthracen wurde in ein 50 ml 2-Halskolben eingewogen und mit 20 ml Ethylacetat suspendiert. Mit einer Pipette wurde 15 ml Wasserstoffperoxid 30% hinzugefügt (exotherm). Die Suspension bleibt farblos! Es wird zum Rückfluss erhitzt und 2 Stunden gerührt. Anschliessend wird auf Raumtemperatur abgekühlt, 20 ml dest. Wasser zugegeben und 10 Minuten gerührt. Die Phasen wurden getrennt. Danach wurde die wäss. Phase beim ersten Mal mit 20 ml Dichlormethan, beim zweiten Mal mit 10 ml extrahiert und mit der Ethylacetat-Phase vereinigt und am Rotavap bei 60 C RT 200 mbar eingeengt. Zurück bleibt ein weisser Feststoff. Ausbeute: 0.5 g = 85.5 % Ausbeute. 3.5 Versuch Nr. 3 Eingesetzte Menge: g Anthracen 25.0 mg 20 ml Ethylacetat 15 ml Wasserstoffperoxid 30% Theoretische Ausbeute: 2.81 mmol = g Anthrachinon, Reinheit: 100% Anthracen und wurde in ein 50 ml 2-Halskolben eingewogen und mit 20 ml Ethylacetat suspendiert. Mit einer Pipette wurde 15 ml Wasserstoffperoxid 30% hinzugefügt (exotherm). Die Suspension färbt sich bräunlich, es wird zum Rückfluss erhitzt und 4 Stunden gerührt. Anschliessend wird auf Raumtemperatur abgekühlt, 20 ml dest. Wasser zugegeben und 10 Minuten gerührt. Die Phasen wurden wieder getrennt, wobei diesmal allerdings Probleme beim Ablassen der wäss. Phase auftraten, da der Scheidetrichterhals verstopfte. Es wurde nochmals wenig Wasser hinzugefügt und mit einem Spatel gerührt, damit der Hals nicht mehr verstopfte. Danach wurde die wäss. Phase beim ersten Mal mit 20 ml Ramona Stark / CH11-23-
24 3 Beweis der katalytischen Eigenschaft Dichlormethan, beim zweiten Mal mit 10 ml extrahiert und mit der Ethylacetat-Phase vereinigt und am Rotavap bei 60 C RT 200 mbar eingeengt. Zurück bleibt ein oranger, nadelförmiger Feststoff. Ausbeute: 0.51 g = 87.3 % Ausbeute 3.6 Analyse des hergestellten Anthrachinons Um zu beweisen, dass bei Versuch 1 und 3 Anthrachinon hergestellt und bei Versuch 2 das Anthracen nicht umgesetzt wurde, wurde eine -NMR Analyse durchgeführt. Die Produkte löste man in wenig deuteriertem Chloroform. Die Proben von Versuch 1 und 3 wurden bei 400 MHz[11] analysiert, Probe 2 bei 90 MHz[11]. Heraus kam, wie erwartet, eine eindeutige Übereinstimmung mit den Literaturwerten (siehe Anhang). So wurde bewiesen, dass ohne keine Umsetzung zu Anthrachinon möglich ist. Ramona Stark / CH11-24-
25 3 Beweis der katalytischen Eigenschaft Versuch Nr. 1: 2h bei Rückfluss, mit Katalysator 1 1. Anthrachinon 2. unbekannte Verunreinigung aus Edukt oder VO(acac) 2 (siehe Anhang) 3. unbekannt 4. Wasser oder Nebenprodukt 5. TMS Abbildung 24: 2 Stunden bei Rückfluss, mit Katalysator Ramona Stark / CH11-25-
26 3 Beweis der katalytischen Eigenschaft Versuch Nr Anthracen 2. unbekannte Verunreinigung aus Edukt (siehe Anhang) 3. unbekannt 4. TMS Abbildung 25: 2 Stunden bei Rückfluss, ohne Katalysator Ramona Stark / CH11-26-
27 3 Beweis der katalytischen Eigenschaft Versuch Nr.3 1. Anthrachinon 2. unbekannte Verunreinigung aus Edukt oder VO(acac) 2 (siehe Anhang) 3. unbekannt 4. Wasser oder Nebenprodukt 5. TMS Abbildung 26: Versuch Nr. 3, 4 Stunden bei Rückfluss, mit Katalysator Ramona Stark / CH11-27-
28 3 Beweis der katalytischen Eigenschaft Interpretation der Spektren Vorab ist zu sagen, dass zu etwaigen Nebenprodukten keine weiteren Untersuchungen gemacht wurden. Die Interpretationen über diese Peaks sind rein spekulativ. Versuch Nr. 1: Bei Versuch Nr. 1 (nach Literatur) sieht man schön die beiden charakteristischen Anthrachinon Peaks bei ca ppm und ca ppm (siehe Anhang, Spektrum von Anthrachinon). Der Peak bei ca ppm könnte einerseits vom Edukt stammen, welches verunreinigt scheint, oder von Spuren des Katalysators. Der doch signifikante Peak bei ca. 2.0 ppm könnte von einem Nebenprodukt stammen. Interessant ist, dass dieser Peak beim Versuch bei 2 Stunden am Rückfluss kleiner ist, als der bei 4 Stunden am Rückfluss. Andererseits könnte es sich bei dem Peak auch um Wasser handeln, welches üblicherweise bei 1.58 ppm (siehe Anhang, H-NMR Spektrum von Wasser) erscheint. Versuch Nr. 2: Bei Versuch Nr. 2 gab es wie erwartet keine Umsetzung zu Anthrachinon, welches das Spektrum wiederlegt. Bei 7.5 ppm, 8 ppm und 8.5 ppm sieht man die für Anthracen charakteristischen Peaks. Der Peak bei 7.25 ppm stammt höchstwahrscheinlich vom Edukt selbst (siehe Anhang, Spektrum des Edukts). Die Peaks zwischen 1.0 ppm und 2.0 ppm könnten Zerfallsprodukte der Verunreinigung sein bei 7.25 ppm. Es wurden keine weiteren Untersuchungen zu diesen Peaks gemacht. Versuch Nr. 3: Das Spektrum zeigt, dass eine Reaktionszeit von 4 Stunden möglich ist. Es kann allerdings sein, dass die Verunreinigung bei 7.25 ppm aus dem Edukt abreagiert und es so zu einem Peak bei 2.0 ppm kommt. Dieser ist im Vergleich zum Versuch mit 2 Stunden bei Rückfluss, viel grösser! Es zeigt auch noch, dass eine Reaktionszeit von 2 Stunden vollkommen ausreichend ist, da kein Edukt mehr vorhanden ist. Wie bei Versuch Nr. 1 schon erwähnt könnte es sich aber auch um Wasser handeln. Ramona Stark / CH11-28-
29 4 Literaturverzeichnis 4 Literaturverzeichnis [1] Römpp Online, abgerufen am [2] Laborjournal, Gruppe 2, G. Pockay und R.Stark, 2011 Wädenswil [3] Technische Universität Wien, Institut für Anorganische Chemie, A-1060 Wien, Getreidemarkt 9/153, ARBEITSUNTERLAGEN, , Präparativ Anorganisches Praktikum für Verfahrenstechniker, S [4] Dr. Mortimer, C. (2010). Elektronenpaar- Abstossung und Molekülstruktur. In C. Dr. Mortimer, Chemie (U. Prof. Dr. Müller, Übers., 10. Ausg., S ). Allentown, Pennsylvania, USA: Georg Thieme Verlag KG. [5] Dr. paed. habil. Lautenschläger, K.-H. (2005). Elektornenpaar- Abstossungs- Modell. In K.-H. Dr. paed. habil. Lautenschläger, W. Schröter, & A. Prof. Dr. Wanninger, Taschenbuch der Chemie (20. überarbeitete Ausg., S ). Frankfurt am Main, Deutschland: Wissenschaftlicher Verlag Harri Deutsch GmbH. [6] Prams, A. (27. Januar 2006). Facharbeit der Kolleg- Stufe. Computergestütze Darstellung des VSEPR- Modells. Unterschliessheim. [7] Prof. Dr. Riedel, E. (2004). Das Valenzschalen- Elekronenpaar- Abstossungs- Modell. In E. Prof. Dr. Riedel, Anorganische Chemie (6. Ausg., S ). Berlin, Deutschland: Walter de Gruyter GmbH & Co.KG. [8] Heck, J., Kaim, W., Weidenbruch, M. (1997). Anorganische Chemie (S ), Weinheim, Deutschland: WILEY-VCH GmbH [9] Sigma-Aldrich Online, abgerufen am [10] Journal of Chemical Education, 2011, 88, [11] Spectral Database for organic Compounds SDBS, abgerufen am Ramona Stark / CH11-29-
30 Anhang Anhang H-NMR Spektrum von Anthrachinon, Literaturwert von.aist-database ( abgerufen am H-NMR Spektrum von Anthracen, Literaturwert von.aist-database ( abgerufen am Ramona Stark / CH11-30-
31 Anhang H-NMR Spekturm von Wasser, Literaturwert von.aist-database ( abgerufen am H-NMR Spektrum des eingesetzten Anthracens, ZHAW Wädenswil Ramona Stark / CH11-31-
32 Anhang H-NMR Spektrum des hergestellten, ZHAW Wädenswil Ramona Stark / CH11-32-
Valence Shell Electron Pair Repulsion
 Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Hybridisierung, sp3-hybridorbitale, Tetraeder, sp2-hybridorbitale: Dreieck, sp- Hybridorbitale: lineare Anordnung, Oktetterweiterung, Mesomerie/Resonanz Thema
Wiederholung der letzten Vorlesungsstunde: Hybridisierung, sp3-hybridorbitale, Tetraeder, sp2-hybridorbitale: Dreieck, sp- Hybridorbitale: lineare Anordnung, Oktetterweiterung, Mesomerie/Resonanz Thema
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Versuch VI.2: Komplexchemie des Nickels Auswertung von Lars Müller
 Name: Lars Müller Gruppe: Donati (HCI J196/168) Datum: 15. Jan. 2004 Versuch VI.2: Komplexchemie des ckels Auswertung von Lars Müller Ziel ckel(ii) kann sehr verschiedene Metallkomplexe bilden, die meist
Name: Lars Müller Gruppe: Donati (HCI J196/168) Datum: 15. Jan. 2004 Versuch VI.2: Komplexchemie des ckels Auswertung von Lars Müller Ziel ckel(ii) kann sehr verschiedene Metallkomplexe bilden, die meist
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Räumlicher Bau von Molekülen - Luftballonmodelle
 Räumlicher Bau von Molekülen - Luftballonmodelle Jahrgangsstufen 11 / 12 Fach/Fächer Zeitrahmen Benötigtes Material Chemie 90 Minuten Luftballons, Ballonpumpe, Scheren, evtl. Haushaltsgummi oder Bindfaden
Räumlicher Bau von Molekülen - Luftballonmodelle Jahrgangsstufen 11 / 12 Fach/Fächer Zeitrahmen Benötigtes Material Chemie 90 Minuten Luftballons, Ballonpumpe, Scheren, evtl. Haushaltsgummi oder Bindfaden
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Synthese von Benzalacetophenon
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von Benzalacetophenon Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 10. März 2008 page
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von Benzalacetophenon Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 10. März 2008 page
Synthese von tert-butylchlorid (2-Chloro-2-methylpropan)
 Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
Synthese von Dibenzalaceton (DBA) (1,5-Bisphenylpenta-1E,4E-dien-3-on)
 Praktikum rganische Chemie I Zürich, 08.01.2006 529-0229-00L (für Biol./arm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Dibenzalaceton (DBA)
Praktikum rganische Chemie I Zürich, 08.01.2006 529-0229-00L (für Biol./arm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Dibenzalaceton (DBA)
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
(±)-4-Methyl-3- heptanon
 Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
Komplexchemie und Molekülgeometrie. Aufbau und Nomenklatur von Komplexverbindungen
 Aufbau und Nomenklatur von Komplexverbindungen Komplexverbindungen sind chemische Verbindungen, die aus einem Zentralatom und Molekülen bzw. Ionen gebildet werden. Aufbau von Komplexverbindungen Zentralatom
Aufbau und Nomenklatur von Komplexverbindungen Komplexverbindungen sind chemische Verbindungen, die aus einem Zentralatom und Molekülen bzw. Ionen gebildet werden. Aufbau von Komplexverbindungen Zentralatom
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1. Bsp.: Grundwissen 9.Klasse NTG 2 Grundwissen 9.Klasse NTG 2
 Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
trans-(distickstoff)hydrido tris(triphenylphosphin)cobalt(i)
 trans-(distickstoff)hydrido tris(triphenylphosphin)cobalt(i) H N 2 PPh 3 Zürich, 29.01.2005 Anna Evans, ACP II ACP II 1 SYNTHESE 1.1 Methode [1], [2] Die Synthese von [H(N 2 )(PPh 3 ) 3 ] verläuft über
trans-(distickstoff)hydrido tris(triphenylphosphin)cobalt(i) H N 2 PPh 3 Zürich, 29.01.2005 Anna Evans, ACP II ACP II 1 SYNTHESE 1.1 Methode [1], [2] Die Synthese von [H(N 2 )(PPh 3 ) 3 ] verläuft über
Synthese von 1-(p-Tolyl)butan-1,4-diol
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1-(p-Tolyl)butan-1,4-diol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 07. April
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1-(p-Tolyl)butan-1,4-diol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 07. April
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Synthese 1 Herstellung von. Cyclohex-3-en-1,1-diyldimethanol
 Organisch-Chemisches Praktikum 1 (OCP 1) HS 10/11 Assistenten: Daniel Fankhauser, Lorenz Urner Synthese 1 Herstellung von Cyclohex-3-en-1,1-diyldimethanol Bastian Vögeli Versuch: 21./22. Oktober 2010 1
Organisch-Chemisches Praktikum 1 (OCP 1) HS 10/11 Assistenten: Daniel Fankhauser, Lorenz Urner Synthese 1 Herstellung von Cyclohex-3-en-1,1-diyldimethanol Bastian Vögeli Versuch: 21./22. Oktober 2010 1
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
LAF-Wiederholungsklausur. Wintersemester 2011/12
 LAF-Wiederholungsklausur Wintersemester 2011/12 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
LAF-Wiederholungsklausur Wintersemester 2011/12 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol
 Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Dietikon, 3. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Dietikon, 3. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Chloro(triphenylphosphin)gold(I)
 raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
 Praktikum rganische Chemie I Chemnitz, 07.01.2006 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
Praktikum rganische Chemie I Chemnitz, 07.01.2006 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
6. Edelgase. Gliederung. 6.1 Ursprung und physikalische Eigenschaften
 Gliederung 6. Edelgase 6.1 Ursprung und physikalische Eigenschaften 6.2 Gewinnung 6.3 Edelgasverbindungen 6.4 Das VSEPR Modell 6.5 Verwendung 6.6 Gasentladungslampen 6.7 129 Xe-NMR-Spektroskopie Folie
Gliederung 6. Edelgase 6.1 Ursprung und physikalische Eigenschaften 6.2 Gewinnung 6.3 Edelgasverbindungen 6.4 Das VSEPR Modell 6.5 Verwendung 6.6 Gasentladungslampen 6.7 129 Xe-NMR-Spektroskopie Folie
Protokoll. - Darstellung von Kaliumdibromoiodat [166,003] [159,808] [325,811]
![Protokoll. - Darstellung von Kaliumdibromoiodat [166,003] [159,808] [325,811] Protokoll. - Darstellung von Kaliumdibromoiodat [166,003] [159,808] [325,811]](/thumbs/78/78788394.jpg) Protokoll Darstellung von Kaliumdibromoiodat KI + 2 KI 2 [166,003] [159,808] [325,811] Theoretischer Teil: Es soll eine Verbindung aus der Klasse der Interhalogenverbindungen hergestellt werden; unterteilt
Protokoll Darstellung von Kaliumdibromoiodat KI + 2 KI 2 [166,003] [159,808] [325,811] Theoretischer Teil: Es soll eine Verbindung aus der Klasse der Interhalogenverbindungen hergestellt werden; unterteilt
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
Matthias Hinrichs Praktikum Anorganische Chemie II. Übergangsmetallkomplexe: [Co(en) 3 ]Br 3 *3H 2 O
![Matthias Hinrichs Praktikum Anorganische Chemie II. Übergangsmetallkomplexe: [Co(en) 3 ]Br 3 *3H 2 O Matthias Hinrichs Praktikum Anorganische Chemie II. Übergangsmetallkomplexe: [Co(en) 3 ]Br 3 *3H 2 O](/thumbs/78/78095730.jpg) Matthias Hinrichs 22.11.1999 Praktikum Anorganische Chemie II Übergangsmetallkomplexe: [Co(en) 3 ]Br 3 *3H 2 O 1. Theorie: Die rklärung zur Art und Struktur von Komplexen, werden am besten durch die Kristallfeldtheorie
Matthias Hinrichs 22.11.1999 Praktikum Anorganische Chemie II Übergangsmetallkomplexe: [Co(en) 3 ]Br 3 *3H 2 O 1. Theorie: Die rklärung zur Art und Struktur von Komplexen, werden am besten durch die Kristallfeldtheorie
Betreuer: Tobias Olbrich Literatur: Nach Organic Syntheses Coll. Vol. 10 (2004), 96.
 rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften.
 Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften. Bitte über jeden Versuch dann ein Datum schreiben. Das zu führende Laborjournal
Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften. Bitte über jeden Versuch dann ein Datum schreiben. Das zu führende Laborjournal
2.Präparat: 1,2 Dibrom -1-phenylethan
 Marcus Wolf 04.06.3 2.Präparat: 1,2 Dibrom -1-phenylethan Literatur: Autorenkollektiv; Organikum; VEB Deutscher Verlag der Wissenschaften Berlin;7. Auflage; 1967; Seite 246 Streitwieser/eathcock ; Organische
Marcus Wolf 04.06.3 2.Präparat: 1,2 Dibrom -1-phenylethan Literatur: Autorenkollektiv; Organikum; VEB Deutscher Verlag der Wissenschaften Berlin;7. Auflage; 1967; Seite 246 Streitwieser/eathcock ; Organische
Indan-1,3-dion. Reaktionsgleichung. H- und P-Sätze. Für alle Reagenzien und Produkte. Ausformulierte H- und P-Sätze. Vor(Abschluss)protokoll
 Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie
 1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
Chloro(salen*)mangan(III)
 Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
2-Methylcyclohexanon
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
Chemische Bindung. Kovalente Bindung (Atombindung) Ionenbindung Metallischer Zustand. Zwischenmolekulare Kräfte:
 Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Berichte OCP1. Manuela Bieri 17. Januar 2007
 Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Komplexchemie des Nickels Ligandenaustauschreaktionen
 Komplexchemie des Nickels Ligandenaustauschreaktionen Jorge Ferreiro, 1. Semester, D-CHAB, fjorge@student.ethz.ch Assistent: Kyrill Stanek Abstract: In diesem Versuch ging es darum, verschiedene Ligandenaustauschreaktionen
Komplexchemie des Nickels Ligandenaustauschreaktionen Jorge Ferreiro, 1. Semester, D-CHAB, fjorge@student.ethz.ch Assistent: Kyrill Stanek Abstract: In diesem Versuch ging es darum, verschiedene Ligandenaustauschreaktionen
Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on
 Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Synthese von cis- und trans-stilben
 28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
Synthese von Diphenylmethanol
 FS 2008 ET Zürich 23.06.2009 Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von Diphenylmethanol Dietikon, 18. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 FS 2008
FS 2008 ET Zürich 23.06.2009 Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von Diphenylmethanol Dietikon, 18. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 FS 2008
2. Übung Grundlagen der Hauptgruppenchemie AC02
 Allgemeine und Anorganische Chemie 2. Übung Grundlagen der Hauptgruppenchemie AC02 Aufgabe 1: Vervollständigen und gleichen Sie die folgenden Gleichungen aus: a) CaO + H 2 O Ca(OH) 2 b) Al 2 O 3 + 6 H
Allgemeine und Anorganische Chemie 2. Übung Grundlagen der Hauptgruppenchemie AC02 Aufgabe 1: Vervollständigen und gleichen Sie die folgenden Gleichungen aus: a) CaO + H 2 O Ca(OH) 2 b) Al 2 O 3 + 6 H
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Bitte prüfen Sie Ihre Klausur sofort auf Vollständigkeit und Lesbarkeit. Spätere Beanstandungen werden nicht berücksichtigt!
 Klausur zur Grundvorlesung Allg. und Anorg. Chemie vom 11.01.2005 Seite 1 von 10 Punkte: Matrikelnummer: Name: Vorname: Bitte eintragen: Fachsemester: Fachrichtung: Bitte ankreuzen: Biologie Molekulare
Klausur zur Grundvorlesung Allg. und Anorg. Chemie vom 11.01.2005 Seite 1 von 10 Punkte: Matrikelnummer: Name: Vorname: Bitte eintragen: Fachsemester: Fachrichtung: Bitte ankreuzen: Biologie Molekulare
Titanocendichlorid. AC-F Praktikum Wintersemester 2012/13. Iman Errouihi 12.12.2012. Inhaltsverzeichnis
 AC-F Praktikum Wintersemester 2012/13 Titanocendichlorid Iman Errouihi 12.12.2012 Inhaltsverzeichnis 1 Das Experiment Titanocendichlorid 2 1.1 Reaktionsgleichung............................... 2 1.2 Ansatz......................................
AC-F Praktikum Wintersemester 2012/13 Titanocendichlorid Iman Errouihi 12.12.2012 Inhaltsverzeichnis 1 Das Experiment Titanocendichlorid 2 1.1 Reaktionsgleichung............................... 2 1.2 Ansatz......................................
Dichlorobis(triphenylphosphin)nickel(II)
 Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Trisacetylacetonatoferrat(III) Fe(acac) 3
 Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
4009 Synthese von Adipinsäure aus Cyclohexen
 4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
Zuusammenfassung Klasssenarbeit Chemie
 Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Organisches Praktikum I - SS 2006 Assistentin: Gabi Marti. Synthese von. Isobutylacetat. Zürich, Balzers & Eschen, Mai 2005
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate
 Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Synthese von 4-tert-Butyl- 1,2-dimethylbenzol
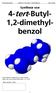 Synthese von 4-tert-Butyl- 1,2-dimethylbenzol Name des/der Assistenten/in: Geyer Karolin Datum der Versuchsdurchführung: 5.12.2005 Rémy Denzler, D-Biol 1 1. Methode o-xylol wird in einer Friedel-Crafts
Synthese von 4-tert-Butyl- 1,2-dimethylbenzol Name des/der Assistenten/in: Geyer Karolin Datum der Versuchsdurchführung: 5.12.2005 Rémy Denzler, D-Biol 1 1. Methode o-xylol wird in einer Friedel-Crafts
AC II Praktikum SoSe 04
 AC II Praktikum SoSe 04 Julia Blechinger Saal K Assistent: Constanze Vogler Durchführung: 05.05.04 Protokoll zur Präparategruppe 8: Übergangsmetallkomplexe Darstellung von [Co(NH 3 ) 5 Br]Br 2 I. Theoretischer
AC II Praktikum SoSe 04 Julia Blechinger Saal K Assistent: Constanze Vogler Durchführung: 05.05.04 Protokoll zur Präparategruppe 8: Übergangsmetallkomplexe Darstellung von [Co(NH 3 ) 5 Br]Br 2 I. Theoretischer
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol
 4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/
 Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Synthese von P,P - Tris(diphenylphosphino)hydrazincyclopentadiendylnickel(II)
 Synthese von, - Tris(diphenylphosphino)hydrazincyclopentadiendylnickel(II) [h 2 (h 2 ) 2 ]icp Dietikon, 15.12.2008 Jorge Ferreiro, OAC 2 1 1. Synthese 1.1. Methode Tris(diphenylphosphino)hydrazin wurde
Synthese von, - Tris(diphenylphosphino)hydrazincyclopentadiendylnickel(II) [h 2 (h 2 ) 2 ]icp Dietikon, 15.12.2008 Jorge Ferreiro, OAC 2 1 1. Synthese 1.1. Methode Tris(diphenylphosphino)hydrazin wurde
5007 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin
 57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b
 3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
Versuchsprotokoll. Versuch 2.5 B: Brom-Addition an Cholesterol und Brom-Eliminierung N - NaI
 Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+
![Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ Elektronenspektrum von [Ti(H 2 O) 6 ] 3+](/thumbs/66/55543366.jpg) Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan
 rganisch-chemisches Praktikum II WS 2008/2009 Gruppenpräparat Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Felix Bergler Benjamin Fröhlich Franziska Witterauf Inhaltsverzeichnis 1. Aufgabenstellung.
rganisch-chemisches Praktikum II WS 2008/2009 Gruppenpräparat Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Felix Bergler Benjamin Fröhlich Franziska Witterauf Inhaltsverzeichnis 1. Aufgabenstellung.
Farbe der anorganischen Pigmente
 Farbe der anorganischen Pigmente 1. Farbigkeit der Komplex-Ionen (Ligandenfeld-Theorie) Einführung Versuch 1 Geben Sie einen halben Löffel festes Kupfersulfat in ein grosses Reagenzglas (RG) und erwärmen
Farbe der anorganischen Pigmente 1. Farbigkeit der Komplex-Ionen (Ligandenfeld-Theorie) Einführung Versuch 1 Geben Sie einen halben Löffel festes Kupfersulfat in ein grosses Reagenzglas (RG) und erwärmen
Endersch, Jonas 26./ Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Synthese von Essigsäureisobutylester
 Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von Essigsäureisobutylester Dietikon, 3. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Der Essigsäurebutylester
Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von Essigsäureisobutylester Dietikon, 3. März 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Der Essigsäurebutylester
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Präparat 3: Isolierung und Verseifung von Trimyristin aus Muskatnuss - Naturstoff -
 hristina Sauermann 1 - A- Praktikum Präparat 3: Isolierung und Verseifung von Trimyristin aus Muskatnuss - Naturstoff - Teil I: Isolierung von Trimyristin aus Muskatnuss 1. Prinzip Gepulverte Muskatnüsse
hristina Sauermann 1 - A- Praktikum Präparat 3: Isolierung und Verseifung von Trimyristin aus Muskatnuss - Naturstoff - Teil I: Isolierung von Trimyristin aus Muskatnuss 1. Prinzip Gepulverte Muskatnüsse
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Tris(acetylacetonato)cobalt(III)
 Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Komplexbildung. CoCl 3 5 NH 3. CoCl 3 6 NH 3. CoCl 3 4 NH 3 Alfred Werner The Nobel Prize in Chemistry 1913
 Komplexbildung CoCl 3 6 NH 3 CoCl 3 5 NH 3 CoCl 3 4 NH 3 CoCl 3 4 NH 3 Alfred Werner 1866-1919 The Nobel Prize in Chemistry 1913 Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH
Komplexbildung CoCl 3 6 NH 3 CoCl 3 5 NH 3 CoCl 3 4 NH 3 CoCl 3 4 NH 3 Alfred Werner 1866-1919 The Nobel Prize in Chemistry 1913 Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH
Organisch-chemisches Praktikum Wintersemester 2005/06. 1-Phenyl-propan-1-ol. Stephan Steinmann
 Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Fakultät Mathematik und Naturwissenschaften, Anorganische Chemie Professur AC I. Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1
 Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1 Seminar zum Brückenkurs Chemie 2017 Chemische Bindung, Molekülbau, Stöchiometrie Dr. Jürgen Getzschmann Dresden, 19.09.2017 Zeichnen von Valenzstrichformeln
Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1 Seminar zum Brückenkurs Chemie 2017 Chemische Bindung, Molekülbau, Stöchiometrie Dr. Jürgen Getzschmann Dresden, 19.09.2017 Zeichnen von Valenzstrichformeln
3012 Synthese von Adamantylidenadamantan aus Adamantanon
 Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Triphenylmethanol
 Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von Triphenylmethanol Dietikon, 3. April 008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Durch die zuerst
Praktikum Anorganische und Organische Chemie I Assistent: Matthias Oberli Synthese von Triphenylmethanol Dietikon, 3. April 008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung Durch die zuerst
n = V Lsg m n l mol Grundwissen 9. Klasse Chemie (NTG) Analytische Chemie Stoffmenge n Molare Masse M Molares Volumen V M Stoffmengenkonzentration c
 Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
S YNTHESE 1: [Co(acac) 3 ] Tris(2,4-pentadionato)cobalt(III) H 3 C CH 3 O O. Zürich, WS 04/05 OACP 2
![S YNTHESE 1: [Co(acac) 3 ] Tris(2,4-pentadionato)cobalt(III) H 3 C CH 3 O O. Zürich, WS 04/05 OACP 2 S YNTHESE 1: [Co(acac) 3 ] Tris(2,4-pentadionato)cobalt(III) H 3 C CH 3 O O. Zürich, WS 04/05 OACP 2](/thumbs/77/75136495.jpg) S YNTHESE 1: [Co(acac) 3 ] Tris(2,4-pentadionato)cobalt(III) H 3 C 0 H 3 C CH 3 H 3 C Co CH 3 H 3 C Zürich, 9.11.2004 WS 04/05 ACP 2 D-CHAB, ETHZ Raphael Sigrist 1.1 Methode, Prinzip Cobalt(II)carbonat
S YNTHESE 1: [Co(acac) 3 ] Tris(2,4-pentadionato)cobalt(III) H 3 C 0 H 3 C CH 3 H 3 C Co CH 3 H 3 C Zürich, 9.11.2004 WS 04/05 ACP 2 D-CHAB, ETHZ Raphael Sigrist 1.1 Methode, Prinzip Cobalt(II)carbonat
Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0
![Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0 Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0](/thumbs/79/80348146.jpg) K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
