Tierärztliche Hochschule Hannover. Knochenmarkzytologische Befunde bei ausgewählten (neoplastischen und nicht-neoplastischen) Erkrankungen des Hundes
|
|
|
- Kristian Ziegler
- vor 7 Jahren
- Abrufe
Transkript
1 Tierärztliche Hochschule Hannover Knochenmarkzytologische Befunde bei ausgewählten (neoplastischen und nicht-neoplastischen) Erkrankungen des Hundes INAUGURAL-DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae - ( Dr. med. vet. ) vorgelegt von Annika Pukropski Solingen Hannover 2012
2 Wissenschaftliche Betreuung: Univ.-Prof. Dr. R. Mischke Klinik für Kleintiere 1. Gutachter: Univ.-Prof. Dr. R. Mischke 2. Gutachter: Univ.-Prof. Dr. M. Ganter Tag der mündlichen Prüfung:
3 Für meine Eltern
4
5 Inhaltsverzeichnis 1 Inhaltsverzeichnis 2 Einleitung Literaturübersicht Knochenmarkpunktion beim Hund Indikationen Kontraindikationen und Komplikationen der Knochenmarkpunktion Punktionsstellen Durchführung der Punktion Anfertigung des Knochenmarkausstrichs Färbung Hämatopoese: Morphologie der Entwicklungsreihen Erythropoese Myelopoese Monopoese Megakaryopoese Lymphopoese Weitere Zellen des gesunden Knochenmarks Auswertung Qualitative Prüfung des Knochenmarkausstrichs Zellularität Hämomyelogramm M:E-Quotient Reifungsindizes Beurteilung der Megakaryopoese Zytologische Befunde im erkrankten Knochenmark Neoplastische Erkrankungen Leukämien Akute lymphatische Leukämie Chronische lymphatische Leukämie... 31
6 Inhaltsverzeichnis Akute myeloische Leukämie Akute Monozyten Leukämie Lymphom Myelom Systemisches Histiozytäres Sarkom Karzinom Mastzelltumor Infektionserkrankungen Leishmaniose Ehrlichiose Material, Tiere und Methoden Material Geräte und Bezugsquellen Reagenzien, Verbrauchsmaterial und Bezugsquellen Studiendesign Tiere Methoden Gewinnung von Knochenmark und Herstellung zytologischer Präparate Aspiration Ausstrichmethode Färbung Auswertung der Knochenmarkzytologie Zellularität Bewertung der Megakaryopoese Hämomyelogramm M:E-Index und Reifungsindizes Statistische Auswertung Ergebnisse Neoplastische Erkrankungen Leukämien
7 Inhaltsverzeichnis Akute lymphatische Leukämie Chronisch lymphatische Leukämie Akute myeloische (granulozytäre) Leukämie Akute Monozyten Leukämie Lymphom Myelom Systemisches Histiozytäres Sarkom Karzinom Mastzelltumor Infektionserkrankungen Leishmaniose Ehrlichiose Anaplasmose Aktivierte Granulopoese Vergleich einzelner Parameter verschiedener Erkrankungen Zellularität Gesamtzahl der Megakaryopoese pro Blickfeld Gesamt-Granulopoese Gesamt-Erythropoese Gesamt-Monopoese Makrophagen Lymphozyten Plasmazellen M:E-Ratio I:M-Ratio I:M E -Ratio I:M G -Ratio EMI-Index MMI-Index Diskussion Akute lymphatische Leukämie
8 Inhaltsverzeichnis 6.2 Chronisch lymphatische Leukämie Akute myeloische (granulozytäre) Leukämie Akute Monozyten-Leukämie Lymphom Myelom Systemisches histiozytäres Sarkom Karzinom Mastzelltumor Leishmaniose Ehrlichiose Anaplasmose Aktivierte Granulopoese Zusammenfassung Summary Literaturverzeichnis Tabellarischer Anhang Danksagung
9 Abkürzungen Abb. ALL AML bzw. CLL ggr. Gr.* hgr. Htk* * KM* Lymphoz. mgr. PZ* Segmentk.* SHS* Stabk.* Tab. Thromboz.* u.a. z.b. z.t. Abbildung Akute lymphatische Leukämie Akute myeloische Leukämie beziehungsweise Chronische lymphatische Leukämie geringgradig Granulozyten hochgradig Hämatokrit keine Angabe Knochenmark Lymphozyten mittelgradig Plasmazellen Segmentkerniger Granulozyt Systemisches histiozytäres Sarkom Stabkerniger Granulozyt Tabelle Thrombozyten unter anderem zum Beispiel zum Teil * in Tabellen
10
11 Einleitung 2 Einleitung Die Untersuchung zytologischer Knochenmarkpräparate hat in der Diagnostik von Kleintiererkrankungen eine wichtige und immer wachsende Bedeutung. Dabei kann die Knochenmarkuntersuchung bei verschiedensten Erkrankungen maßgebend für eine klare Diagnose sein (z.b. Panzytopenien, Fieber unbekannter Genese, myeloproliferative Erkrankungen, Tumor-Staging) (HARVEY 1984; GRINDEM 1989; DUNN 1992; GRINDEM 2002; BROWN 2008). Da in der Routinediagnostik die Knochenmarkzytologie überwiegend geschätzt oder nur semiquantitativ beurteilt wird, liegen zur zellulären Veränderung bei verschiedenen Erkrankungen bislang nur wenige exakte Angaben vor. Dabei gibt es zu einigen Erkrankungen widersprüchliche Angaben zum Auftreten von Veränderungen im Knochenmark. So werden beispielsweise bei dem systemischen histiozytären Sarkom (früher: maligne Histiozytose) (SCHALM 1981; MOORE 1984; WELLMAN et al. 1985; WELLMAN et al. 1988; WEISS 2001) und beim multiplen Myelom (z.b. DOPPA et al. 1997; PETERSSON et al. 1997; VILLIERs et al. 1998; WEISS et al. 1999; WEISS 2006; LOWRIE 2010) sehr variable Angaben zum Auftreten und zur Anzahl an Histiozyten und Plasmazellen im Knochenmark gemacht. Das wesentliche Ziel der vorliegenden Studie ist es deshalb, genaue Angaben zu Veränderungen im caninen Knochenmark bei neoplastischen und nichtneoplastischen Erkrankungen unter Berücksichtigung aller Zellreihen zu erhalten, um so die Aussagekraft zu erhöhen und die zu erwartenden Veränderung besser bewerten zu können. 1
12 Literaturübersicht 3 Literaturübersicht 3.1 Knochenmarkpunktion beim Hund Indikationen Die Entscheidung zur Knochenmarkpunktion kann dann getroffen werden, wenn verschiedene Befunde des Patienten (z.b. Anamnese, klinische Untersuchung, Laborergebnisse) darauf schließen lassen, dass eine hämatologische Erkrankung vorliegt, dieses aber nicht allein anhand von Blutergebnissen erklärt werden kann (GRINDEM 2002). Die nicht-regenerative Anämie ist hier der häufigste hämatologische Befund, der eine Knochenmarkpunktion nach sich zieht (DUNN 1992). Ebenso kann bei anhaltenden Zytopenien einzeln oder in Kombination auftretend (Anämie, Neutropenie, Thrombozytopenie, Panzytopenie), sowie bei dauerhafter Erhöhung des Hämatokrits, Leukozytosen oder Thrombozytosen, die Untersuchung des Knochenmarks ein wichtiger Schritt zur richtigen Diagnose sein (HARVEY 1984; GRINDEM 1989; DUNN 1992; GRINDEM 2002; BROWN 2008). Dies schließt den Verdacht auf eine primäre myelo- oder lymphoproliferative Erkrankung ein (STERN 1983; DUNN 1992; GRINDEM 2002). Genauso wie im Rahmen des Tumorstagings die Knochenmarkpunktion Aufschluss über Metastasen im Knochenmark bei einem primär extramedullären Prozess, wie dem Lymphom oder einem Karzinom, geben kann (JACOBS u. VALLI 1988; GRINDEM 1989; GRINDEM 2002). Auch bei Hyperproteinämie (mono- oder polyklonaler Gammopathie) kann sie als diagnostisches Hilfsmittel eingesetzt werden. Diese kann sowohl im Zuge von Infektionserkrankungen wie Ehrlichia canis, Leishmania donovani/infantum, Histoplasma capsulatum-infektion oder systemischen Mykosen auftreten, als auch bei verschiedenen neoplastischen Prozessen, wie dem multiplen Myelom und dem B-Zell-Lymphom ( HARVEY 1984; JACOBS u. VALLI 1988; DUNN 1992; DUNN 1992; VILLIERS u. DOBSON 1998; GRINDEM 2002). Des Weiteren kann die Untersuchung des Knochenmarks bei rezidivierendem oder dauerhaftem Fieber unbekannter Ursache eine Hilfe sein, mögliche Neoplasien als Ursprung 2
13 Literaturübersicht auszuschließen (DUNN 1992, GRINDEM 2002). Beim Hund geht eine Hyperkalzämie oft mit einem tumorösen Geschehen einher (DUNN 1992), sodass bei unbekanntem neoplastischen Geschehen die Knochenmarkpunktion teilweise Aufschluss über die Ursache geben kann (RELFORD 1991; DUNN 1992; MÈDAILLE 1993; GRINDEM 2002). Erhöhte Kalziumwerte im Blut lassen sich so zum Beispiel bei einem Teil der Patienten mit akuter lymphatischer Leukämie (HENRY et al. 1996), malignem Lymphom (MADEWELL 1986) und seltener beim multiplen Myelom (VILLIERS u. DOBSON 1998) feststellen. Zusätzlich zur Standardfärbung können am Knochenmarkausstrich außerdem Spezialfärbungen, wie z. B. Immunzytochemie bei akuter Leukämie (MORITZ u. GRÜNBAUM 1993) oder Eisenfärbungen bei Anämie (HARVEY et al. 1982; RELFORD 1991) zur weiteren Diagnostik durchgeführt werden. Über die Diagnosefindung hinaus kann die Knochenmarkuntersuchung zur Darstellung eines Therapieerfolges, z. B. im Zusammenhang mit hämatopoetischen Neoplasien oder Hypo- und Aplasien des blutbildenden Systems, eingesetzt werden (KELLER 1986; JACOBS u. VALLI 1988; GRINDEM 2002) Kontraindikationen und Komplikationen der Knochenmarkpunktion Es gibt keine Beschreibungen zu Kontraindikationen für Knochenmarkpunktionen beim Hund. Es können als mögliche Komplikationen Blutungen, Infektionen oder Verletzungen des umliegenden Weichteilgewebes und ein Abbrechen der Nadel im Knochen auftreten, dies kommt aber nur sehr selten vor (DUNN 1992; GRINDEM 2002) und kann durch aseptisches und genaues Arbeiten vermieden werden (GRINDEM 2002). Bei Patienten mit Thrombozytopenie kann es zu Nachblutungen aus der Punktionsstelle kommen (SAAR 1973a; PERMAN et al. 1974; GRINDEM 2002), dennoch ist die Knochenmarkpunktion in diesen Fällen nicht kontraindiziert sondern ein wichtiges diagnostisches Mittel (PERMAN et al. 1974; GRINDEM 1979; DUNN 1990; GRINDEM 2002). 3
14 Literaturübersicht Punktionsstellen Beim Hund befindet sich das aktive rote Knochenmark im Bereich der Beckenknochen, der Rippen, der Sternalsegmente sowie an den Epiphysen der langen Röhrenknochen homogen verteilt (STASNEY u. HIGGINS 1937; VAN LOON u. CLARK 1943; REEKERS u. COULTER 1948; MELVEGER et al. 1969; PENNY u. CARLISLE 1970; GRINDEM 2002; ELMORE 2006; BROWN 2008; TRAVLOS 2011). Aus diesem Grund ist die Auswertung eines Präparates von einem dieser Punktionsstellen repräsentativ für den gesamten Organismus. Eine Einschränkung gibt es allerdings bei Erkrankungen mit ungleichmäßiger Verteilung der veränderten Zellen im Knochenmark, wie z.b. maligne Lymphome, multiple Myelome, metastasierende Karzinome, granulomatöse Entzündungen und Knochenmarknekrosen (JACOBS u. VALLI 1988). Der Darmbeinflügel im Bereich der Christa iliaca wird von HO et al. (1941), MEYER und BLOOM (1943), PENNY und CARLISLE (1970), DUNCAN und PRASSE (1976), SCHALM (1976) und GRINDEM (2002) als Punktionsstelle der Wahl beschrieben. Aufgrund der härteren Corticalis kann hier allerdings die Punktion bei älteren Tieren erschwert sein ( SPRANGER u. HIME 1961; PENNY u. CARLISLE 1970). Bei kleinen Hunden empfehlen SPRANGER und HIME (1961), PERMAN et al. (1974), DUNN (1992) und MÈDAILLE (1993) die Fossa trochanterica des Femurs als gute Punktionsstelle. GRINDEM (2002) und BROWN (2008) beschreiben ebenso den proximalen Humerus als Punktionsstelle und RELFORD (2001) zieht diese Methode allen anderen, unabhängig von Alter und Größe, vor. Hier ist allerdings zu beachten, dass es zu Gelenksschmerzen und zu Verletzungen des Gelenkknorpels bzw. der Wachstumsfuge bei jungen Hunden kommen kann (GRINDEM 2002). Die kielartig vorgewölbten zweiten, dritten (VOLLMERHAUS et al. 1981) und vierten (HORN et al. 1953) Sternalsegmente des Hundes eignen sich ebenso gut für die Knochenmarkpunktion. 4
15 Literaturübersicht Die Knochenmarkentnahme an der siebten, achten und neunten Rippe sollte bei kleinen Hunden aufgrund der Verletzungsgefahr intrathorakaler Organe nach Möglichkeit vermieden werden (PENNY u. CARLISLE 1970; PERMAN et al. 1974) Durchführung der Punktion Eine Vollnarkose ist zur Durchführung der Punktion nicht zwingend notwendig (SAAR 1973a; CATTELAN et al. 1990; RELFORD 1991; GRINDEM 2002). Bei wehrhaften Tieren kann aber eine Sedation oder Allgemeinanästhesie zur Schaffung von optimalen Bedingungen nötig sein (GRINDEM 2002; BROWN 2008). Es kann eine Infiltrationsanästhesie der Haut, des angrenzenden Weichteilgewebes und des Periosts durchgeführt werden (STERN 1983; RELFORD 1991; DUNN 1992; GRINDEM 2002; BROWN 2008). SAAR (1973a) und HO et al. (1941) halten dies allerdings nicht für erforderlich, da sie die Aspiration als eigentlich schmerzhafte Phase beschreiben, die durch die Lokalanästhesie unbeeinflusst bleibt (SAAR 1973a). Vor der Punktion sollte eine ausreichende Rasur und Desinfektion der Punktionsstelle durchgeführt werden. Die Kortikalis wird entweder mit einer speziellen Knochenmarkpunktionskanüle (PENNY 1974; STERN 1983; DUNN 1990 GRINDEM 2002; BROWN 2008) oder mit einer Spinalkanüle (HO et al. 1941; CATTELAN et al. 1990) mit leicht drehenden Bewegungen durchdrungen. Erreicht man den Markraum wird der Mandrin entfernt und maximal 0,5 ml Knochenmark mit einer 10 ml- oder 20ml- Spritze aspiriert (CATTELAN et al. 1990; DUNN 1990; GRINDEM 2002). Wird mehr Material aspiriert, kann es durch nachfließendes Markblut zu einer Verdünnung der Probe und somit zu einer erschwerten Auswertung kommen (HORN et al. 1953; DUNN 1992) Anfertigung des Knochenmarkausstrichs Die hohe Qualität der Präparate ist für die exakte Differenzierung der zellulären Bestandteile des Knochenmarks essentiell. Blutbeimengungen können eine gute 5
16 Literaturübersicht Auswertung stark behindern. Aus diesem Grund muss zunächst eine Differenzierung der Markbröckel vom Markblut erfolgen (HORN et al. 1953; VALLI et al. 1969; HARVEY 1984; GRINDEM 2002). Hierzu sind zwei verschiedene Methoden beschrieben: Methode 1: Einige Tropfen des gewonnenen Aspirats werden auf schräg gestellte Objektträger verteilt, sodass das Markblut nach unten abfließt und die Markbröckel am Objektträger haften bleiben (VALLI et al. 1969; SAAR 1973a; DUNCAN u. PRASSE 1976; HARVEY 1984; DUNN 1990; MÈDAILLE 1993; MORITZ 1993; TYLER et al. 1999, GRINDEM 2002). Methode 2: Das Aspirat wird in ein Auffanggefäß überführt und die Markbröckel mittels Mikrohämatokritröhrchen (TYLER et al. 1999); Kunststoffspateln (HECKNER u. FREUND 2008), Pipetten (HARVEY 1984; RELFORD 1991), Pinzetten (PENNY 1974) oder Holzstäbchen (HORN et al. 1953) getrennt und auf Objektträger übertragen. Die Anfertigung der Präparate kann dann ebenso unterschiedlich durchgeführt werden. Die Markbröckel können durch Auflegen eines zweiten Objektträgers im rechten Winkel (PENNY 1974; DUNCAN u. PRASSE 1976; HARVEY 1984; DUNN 1990; RELFORD 1991; GRINDEM 2002), in entgegengesetzter Richtung (TYLER et al. 1999) oder eines Deckgläschens (HARVEY 1984; TYLER et al. 1999) und dessen vorsichtiges Wegziehen angefertigt werden. Ebenso ist es möglich, die mit Methode 1 isolierten Markbröckel mit dem Rand eines Objektträgers ( VALLI et al. 1969; MORITZ 1993) bzw. mit einem Deckgläschen (SAAR 1973a) aufzunehmen und auf einem weiteren Objektträger kontinuierlich auszustreichen Färbung Eosin und Methylenblau kommen bei Färbungen nach Romanowsky zur Anwendung (MARSHALL 1978). Durch die kombinierte Methyl-Azur- und Eosin-Färbung modifizierte Giemsa die Färbung nach Romanowsky (BAIN u. HUHN 1997). Die kombinierte May-Grünwald-Giemsa Färbung ist die von deutschsprachigen Autoren 6
17 Literaturübersicht meist verwendete Färbung von Knochenmarkausstrichen, die auch als Pappenheim- Färbung bezeichnet wird (ALEXANDROV 1928; HORN et al. 1953; SAAR 1973a, KELLER 1986; MORITZ u. GRÜNBAUM 1993). Im englischen und amerikanischen Raum wird vor allem die Wright-Färbung zur Beurteilung von Knochenmarkpräparaten genutzt, die auch zur Romanowsky-Färbung zählt (MEYER u. BLOOM 1943; DUNCAN u. PRASSE 1976; SCHALM 1981; HARVEY 1984; HOFF et al. 1985; GRINDEM 2002; BROWN 2008). Im Gegensatz zur May-Grünwald- Giemsa-Färbung wird bei der Wright-Färbung das Methylenblau vor der Färbung erhitzt, um so einen polychromen Farbstoff zu erzeugen (BAIN u. HUHN 1997). Kommerziell erhältliche, ebenso zur Gruppe der Romanowsky-Färbungen zählende Schnellfärbungen haben den Nachteil, dass metachromatische Reaktionen fehlen und somit die Granula der Mastzellen nicht komplett angefärbt werden (TYLER et al. 1999). 3.2 Hämatopoese: Morphologie der Entwicklungsreihen Erythropoese Durch die intensivere Färbung des Zellkerns lassen sich die Vorläuferzellen der Erythropoese leicht von Zellen der Granulo- und Monopoese unterscheiden (JAIN 1993; GRINDEM 2002). Die unreifste und größte lichtmikroskopisch differenzierbare Zelle der Erythropoese ist der Proerythroblast (SAAR 1973b; AUFDERHEIDE 1981). Der Zellduchmesser beträgt beim Hund µm (HORN et al. 1953; SAAR 1973b; PENNY 1974). Der Zellkern ist rund, dunkelviolett, besitzt 3 5 Nukleoli und eine gleichmäßige, dicht gefügte Chromatinstruktur (SAAR 1973b; PENNY 1974; AUFDERHEIDE 1981; GRINDEM 2002). STASNEY und HIGGINS (1937) und HORN et al. (1953) beschreiben Ähnlichkeiten zum Kern des Myeloblasten. Das Zytoplasma ist nicht granuliert, tief blau und besitzt eine sichelförmige Aufhellungszone (SAAR 1973b; PENNY 1974; GRINDEM 2002), was für einen aktiven Golgiapparat spricht (KELLER u. FREUDIGER 1983; JAIN 1993). SAAR (1973b) beschreibt den nach der Teilung des Proerythroblasten entstehenden morphologisch ähnlichen, aber 7
18 Literaturübersicht kleineren kleinen Proerythroblasten. Beim Menschen wird dieser als Makroblast bezeichnet (HECKNER u. FREUND 2001). Als nächstes entstehen durch weitere Zellteilung die Normoblasten. Es kommt zu einer Reduktion der Zell- und Kerngröße, sowie zur Abnahme der Basophilie des Zytoplasmas (GRINDEM 2002). Durch voranschreitende Hämoglobinsynthese wird das Zytoplasma der Normoblasten zunehmend oxyphil bei fortschreitender Zellreifung (SAAR 1973b; AUFDERHEIDE 1981). Zuerst entsteht der basophile Normoblast, der gefeldertes Chromatin aufweist, das teils als Radspeichenstruktur bezeichnet wird (MULLIGAN 1941; HORN et al. 1953; PENNY 1974). Er besitzt ein noch vollständig basophiles Zytoplasma und die Nucleoli sind in der Regel nicht mehr zu erkennen (GRINDEM 2002). Der polychromatische Normoblast hingegen besitzt graublaues Zytoplasma und hat einen kleineren Zelldurchmesser. Das Chromatin verklumpt und die Größe des Zellkerns nimmt ab (SAAR 1973b; GRINDEM 2002). Der oxyphile Normoblast ist nicht mehr teilungsfähig (HARVEY 1984) und enthält einen kleinen pyknotischen Kern, der durch Verdichtung des Chromatins entsteht (SAAR 1973b; AUFDERHEIDE 1981;GRINDEM 2002). Das Zytoplasma ist grau (PENNY 1974; GRINDEM 2002). Der Retikulozyt entsteht schließlich durch Ausstoßung des pyknotischen Kerns. Retikulozyten reifen innerhalb von 31 Stunden zu reifen Erythrozyten aus (NIZET u. ROBSCHEIT-ROBBINS 1950) Myelopoese Die unreifste lichtmikroskopisch differenzierbare Zelle der Granulopoese ist der Myeloblast (SAAR 1973b; JAIN 1993; GRINDEM 2002). Dieser ist im Knochenmarkausstrich größer als der Proerythroblast (AUFDERHEIDE 1981) und besitzt beim Hund einen runden, teils seitlich abgeflachten Kern mit feinnetziger Chromatinstruktur und zwei bis fünf Nukleoli (STASNEY u. HIGGINS 1937; MULLIGAN 1941; BLOOM u. MEYER 1944; SAAR 1973b; GRINDEM 2002). Der Zytoplasmasaum ist schmal und gar nicht (SAAR 1973b; AUFDERHEIDE 1981; 8
19 Literaturübersicht HARVEY 1984) oder wenig granuliert (GRINDEM 2002). Durch Zellteilung entsteht der Promyelozyt, der die größte Zelle der Myelopoese darstellt (MULLIGAN 1941; GRINDEM 2002). Das Kern-Zytoplasma-Verhältnis ist zugunsten des Zytoplasmas verschoben (HORN et al. 1953; PENNY 1974; HARVEY 1984), aber immer noch verhältnismäßig hoch (GRINDEM 2002). Die Kernstruktur und größe entspricht der des Myeloblasten (MULLIGAN 1941). Das Zytoplasma des Promyelozyten ist leicht bläulich und weist charakteristische azurophile Granula auf (SAAR 1973b; AUFDERHEIDE 1981; HARVEY 1984; GRINDEM 2002). Nach STASNEY und HIGGINS (1937), SAAR (1973b), PENNY (1974) und JAIN (1986) können sich jetzt schon Granula der entsprechenden Zellreihe (basophile, eosinophile oder neutrophile) im Zytoplasma befinden. Bei anderen Autoren werden spezifische Granula erst in der nächsten Reifungsstufe beobachtet (HORN et al. 1953; SCHALM 1974; AUFDERHEIDE 1981; HARVEY 1984; GRINDEM 2002). Der Zelldurchmesser verringert sich beim Übergang zum Myelozyten (HARVEY 1984; GRINDEM 2002). Das Chromatin wird grobscholliger und die Nukleoli nicht mehr erkennbar (MULLIGAN 1941; PENNY 1974; GRINDEM 2002). Die azurophilen Granula werden langsam durch spezifische (eosinophile und basophile) Granula ersetzt und die Basophilie des Zytoplasmas nimmt ab (SAAR 1973b; JAIN 1986). HECKNER und FREUND (2001) beschreiben einen hellen Fleck nahe der Zentrosphäre des Zellkerns als spezifisches Charakteristikum der Myelozyten. Als nächste Reifungsstufe besitzt der Metamyelozyt typischerweise einen bohnen- bzw nierenförmigen Kern (SAAR 1973b; AUFDERHEIDe 1981; GRINDEM 2002). Die spezifischen Granula sind in dieser Reifungsstufe deutlich zu erkennen und das Chromatin ist teilweise verklumpt (SAAR 1973b, GRINDEM 2002). Metamyelozyten teilen sich nicht mehr (SAAR 1973b; SCHALM 1974; HARVEY 1984; KELLER et al. 1987; TYLER et al. 1999). Nur durch Zellreifung entsteht der stabkernige Granulozyt, dessen Kern C- oder S-förmig auftreten kann (MULLIGAN 1941; AUFDERHEIDE 1981; GRINDEM 2002). Die ausgereiften segmentkernigen Granulozyten entstehen durch Segmentierung des Kerns. Das Zytoplasma ist klar bis hell basophil, spezifische Granula sind in großer Menge vorhanden (GRINDEM 2002). Beim neutrophilen segmentkernigen Granulozyten sind meist mehrere Kernsegmente zu 9
20 Literaturübersicht finden (AUFDERHEIDE 1981), wohingegen sich beim eosinophilen und basophilen segmentkernigen Granulozyten oft zwei Kernsegmente finden, die über eine feine Brücke verbunden sind (STASNEY u. HIGGINS 1937; AUFDERHEIDE 1981) Monopoese Der Monoblast besitzt einen runden Kern mit grob strukturiertem Chromatin und zwei bis fünf Nukleoli (BLOOM u. MEYER 1944; AUFDERHEIDE 1981). Das Zytoplasma ist basophil und enthält mehrere kleine Vakuolen (HELMIN u. SAAR 1984). Der Monoblast lässt sich jedoch lichtmikroskopisch nicht sicher vom Myeloblasten unterscheiden (BLOOM u. MEYER 1944; HARVEY 1984). Durch Zellteilung entsteht der Promonozyt, dessen Kern bereits eine einseitige unregelmäßige Einbuchtung aufweist (HELMIN u. SAAR 1984). Im hell-basophilen Zytoplasma finden sich vereinzelt azurophile Granula (AUFDERHEIDE 1981; JAIN 1993). Der Promonozyt ist lichtmikroskopisch nur schwer vom neutrophilen Promyelozyten und Metamyelozyten zu unterscheiden (JAIN 1986; TYLER 1999). Charakteristisch für den ausgereiften Monozyten ist sein gelappter, vielgestaltiger Kern (HELMIN u. SAAR 1984). Im gräulichen Zytoplasma befinden sich Vakuolen von variabler Anzahl und Größe (AUFDERHEIDE 1981; JAIN 1993). GRINDEM (2002) beschreibt allerdings, dass es ohne immunhistologische oder zytochemische Methoden nicht sicher möglich ist einen Monozyten von einem Metamyelozyten zu unterscheiden. Im Zytoplasma der großen polymorphen Makrophagen befinden sich ein rund-ovaler Zellkern und zahlreiche Vakuolen mit phagozytiertem Material (BLOOM u. MEYER 1944) Megakaryopoese Megakaryoblasten, Promegakaryozyten und Megakaryozyten als lichtmikroskopisch sichtbare Vorläuferzellen der Thrombopoese entstehen durch Polyploidisierung des Zellkerns und Endoreduplikation der DNS, was sie von den Vorläuferzellen der 10
21 Literaturübersicht Erythro- und Myelopoese unterscheidet. Bei dieser Form der Teilung kommt es nie zur Teilung des Zytoplasmas, sondern nur des Zellkerns (AUFDERHEIDE 1981; SCHALM 1981; HARVEY 1984). Der Megakaryoblast stellt die unreifste Vorläuferzelle dar und ist wesentlich größer als die Blasten der anderen Zellreihen (AUFDERHEIDE 1981). Das Zytoplasma ist frei von Granulation und enthält ein bis vier runde Kerne (HORN et al. 1953; AUFDERHEIDE 1981; GRINDEM 2002), die feines Chromatin und einige Nukleoli besitzen (GRINDEM 2002). Das Zytoplasma ist tief basophil, aber oft nur in einem schmalen Saum vorhanden (GRINDEM 2002). Der Promegakaryozyt ist deutlich größer als der Megakaryoblast und enthält mehr als vier Kerne, auch sein Zytoplasma ist basophil und ohne Granulation (HORN et al. 1953; AUFDERHEIDE 1981; GRINDEM 2002). GRINDEM (2002) beschreibt, anders als andere Autoren, den basophilen Megakaryozyten als nächste Reifungsstufe. Dieser ist größer als der Promegakaryozyt aber kleiner als ein Megakaryozyt und besitzt große vielgelappte Kerne mit dichtem Chromatin. Das Zytoplasma ist hell basophil und enthält wenige Vakuolen (GRINDEM 2002). Die letzte Reifungsstufe stellt der Megakaryozyt dar, der einen vielgelappten Kern und einen deutlich breiteren Zytoplasmasaum besitzt (STASNEY u. HIGGINS 1937; BLOOM u. MEYER 1944; GRINDEM 2002). Nur beim Megakaryozyten kommt es zum Auftreten von azurophilen Granula im Zytoplasma als Ausdruck der aktiven Thrombozytenbildung (HORN et al. 1953; AUFDERHEIDE 1981; SCHALM 1981; JAIN 1986; GRINDEM 2002) Lymphopoese Morphologisch sind im Knochenmark mit Routinemethoden T- und B-Lymphozyten nicht eindeutig zu unterscheiden (DOUGLAS 1978; JAIN 1986; HECKNER u. FREUND 2001). Der Lymphoblast besitzt einen schmalen basophilen Zytoplasmasaum und einen großen Kern mit deutlichen Nukleoli. Er ist die größte Zelle dieser Zellreihe und entsteht aus den kleinen Lymphozyten (TRAVLOS 2006). Durch Zellteilung entstehen die reifen T- oder B-Lymphozyten des Hundes. Sie 11
22 Literaturübersicht besitzen im zytologischen Knochenmarkpräparat einen rund-ovalen Kern, der den Durchmesser eines Erythrozyten aufweist (FOURNEL-FLEURY 1994). Gelegentlich lassen sich im hellblauen zarten Zytoplasmasaum einige azurophile Granula erkennen (AUFDERHEIDE 1981; KELLER u. FREUDIGER 1983). Plasmazellen entwickeln sich nach Antigenkontakt aus den B-Lymphozyten. Sie besitzen einen runden exzentrisch gelegenen Kern, dessen schollenartig auftretendes Chromatin auch als Radspeichenstruktur bezeichnet wird (BLOOM u. MEYER 1944; SAAR u. ULRICH 1975; GRINDEM 2002). Häufig ist eine perinukleäre Aufhellungszone zu erkennen. Das Zytoplasma ist stark basophil und weist gelegentlich Vakuolen auf (AUFDERHEIDE 1981; KELLER u. FREUDIGER 1983; GRINDEM 2002) Weitere Zellen des gesunden Knochenmarks Osteoblasten liegen im Knochenmarkausstrich meist in Nestern vor (HORN et al. 1953). Sie besitzen einen runden streng exzentrisch gelegenen Kern (HORN et al. 1953; HARVEY 1984; GRINDEM 2002) und ein gekörntes stark basophiles Zytoplasma (HORN et al. 1953; GRINDEM 2002). Von der sehr ähnlich strukturierten Plasmazelle unterscheidet sich der Osteoblast durch sein netzartig angelegtes Chromatin (HARVEY 1984; GRINDEM 1989; GRINDEM 2002). Er ist im Knochenmark nur sehr selten zu finden, außer es handelt sich um junge Patienten oder Patienten, die sich in aktivem Knochenumbau befinden (GRINDEM 2002). Osteoklasten sind vielkernige Zellen und mit den Megakaryozyten die größten Zellen des Knochenmarks, die aber aufgrund unterschiedlicher Kernstruktur leicht voneinander zu unterscheiden sind (HARVEY 1984). Der Osteoklast besitzt im Gegensatz zum mehrfach gelappten Kern der Megakaryozyten 30 bis 50 einzeln liegende Kerne, die rund-oval geformt sind und ein strukturiertes Chromatinnetz mit ein bis drei Nukleoli aufweisen ( HORN et al. 1953; GRINDEM 2002). Sie besitzen ein basophiles und stets azurophil granuliertes Zytoplasma (HARVEY 1984; 12
23 Literaturübersicht GRINDEM 1989; GRINDEM 2002). Auch die Osteoklasten sind im Knochenmarkausstrich nur selten anzutreffende Zellen (GRINDEM 2002). Fettzellen erscheinen im Ausstrich als leere Vakuolen mit wandständig platten Zellkernen (HORN et al. 1953). Mastzellen besitzen einen charakteristischen breiten Zytoplasmasaum, der mit dunkelbraun-violetten Granula ausgefüllt ist (SAAR u. ULRICH 1975; GRINDEM 2002). Ihr Kern ist rund-oval und zentral gelegen (GRINDEM 2002). 3.3 Auswertung Qualitative Prüfung des Knochenmarkausstrichs Bevor der Ausstrich genau untersucht wird, prüft man das Präparat im Hinblick auf die Qualität des Ausstrichs und die Färbung (GRINDEM 1989). Dabei ist besonders darauf zu achten, dass makroskopisch ausreichend gefärbte Markbröckel vorliegen (HARVEY 1984), bei der mikroskopischen Betrachtung die kernhaltigen Zellen als Monolayer vorliegen und die Anzahl der rupturierten Zellen möglichst gering ist (TYLER et al. 1999; GRINDEM 2002; BROWN 2008). Ein idealer Ausstrich enthält nur eine geringe Menge Blut und beinhaltet sowohl dünne als auch dicke Bereiche (GRINDEM 2002) Zellularität Mit der Beurteilung des Zellgehaltes (hypo-, normo- oder hyerzellulär) beginnt die eigentliche Auswertung des Knochenmarkausstrichs (SAAR 1973a; PENNY 1974; SCHALM 1981; HARVEY 1984; GRINDEM 1989; GRINDEM 2002). Bei 100facher Vergrößerung wird das Verhältnis zwischen Vorläufer- und fetthaltigen Anteilen in den Markbröckeln bewertet (HARVEY 1984; TYLER et al. 2008). Hierbei sollte darauf geachtet werden, dass möglichst viele Markbröckel in die Untersuchung mit einbezogen werden, da der Zellgehalt der einzelnen Markbröckel stark variiert 13
24 Literaturübersicht (HARVEY 1984; GRINDEM 1989; GRINDEM 2002). Beim adulten Hund bestehen die Markbröckel beim normozellulären Knochenmark nach SAAR (1973a) zu 50 % und nach GRINDEM (1989; 2002) zu 50-75% aus zellhaltigen Anteilen. Hyperzelluläres Knochenmark besitzt eine Zellulariät von >75 % und hypozelluläres Knochenmark eine Zellularität von <25 % (GRINDEM 2002). Zu beachten ist, dass die physiologische Zellularität einem deutlichen Alterseinfluss unterliegt (GRINDEM 1989; TYLER et al. 2008; GRINDEM 2002). TYLER et al. (2008) gibt ohne systematische Untersuchungsergebnisse den Fettanteil bei Jungtieren mit 25 %, bei Adulten mit 50 % und bei alten Tieren mit 75 % an Hämomyelogramm Bei 1000facher Vergrößerung werden in den Knochenmarkausstrichen zur quantitativen Beurteilung 500, 700 (HORN et al. 1953) oder 1000 (SAAR u. ULRICH 1975) kernhaltige Zellen differenziert. In einem Hämomyelogramm werden die Ergebnisse prozentual zusammen gestellt. Die Differenzierung sollte dabei nur in den Bereichen stattfinden, in denen die Zellen einzeln nebeneinander liegen (SAAR 1973a). Besonders eignen sich hier die Regionen der Markbröckel, in denen kernhaltige Vorläuferzellen in großer Anzahl vorhanden sind (MISCHKE u. BUSSE 1998). Die Tabellen 1 und 2 fassen die Referenzwerte des Myelogramms von insgesamt 15 Autoren zusammen, wobei in Tabelle 1 der Altersaspekt der untersuchten Hunde mit berücksichtigt ist. Ein detaillierter Vergleich ist nur schwer möglich. Die Patientenanzahl, das Alter, die ausgewertete Zellzahl sowie die Terminologie der Zellen bei den verschiedenen Autoren sind unterschiedlich gewählt worden. Einige Teilergebnisse fallen jedoch diskrepant auf und sollen hier gegenüber gestellt werden. Auffällig ist, dass der mittlere Anteil der Granulopoese zwischen den einzelnen Studien stark variiert. STASNEY und HIGGINS (1937) entnehmen bei Hunden an unterschiedlichen Lokalisationen Knochenmark und geben einen Mittelwert von 30,7 bis 38,5% an. Der höchste angegebene Wert für den Anteil der 14
25 Literaturübersicht Granulopoese in der Literatur beträgt hingegen im Median 62,7% (36,7-90,1%) bei insgesamt 36 untersuchten gesunden Hunden (REKERS u. COULTER 1948). Dabei ist zu beachten, dass STASNEY u. HIGGINS (1937) keine Altersangabe machen, REKERS u. COULTER das Alter der untersuchten Hunde aber auf neun Monate bis zwei Jahre beschränken. Folglich lassen sich Unterschiede zwischen einzelnen Arbeiten auch beim Gesamtanteil der Erythropoese erkennen. ALEXANDROV (1928) gibt mit 23,4% (Summe der arithmetischen Mittelwerte der Erythro- und Proerythroblasten) den niedrigsten Wert für den Gesamtanteil der kernhaltigen Zellen der Erythropoese an. ALEXANDROV (1928) untersuchte hierbei 12 Hunde, zur untersuchten Zellzahl gibt es keine Angabe. Die Untersuchung von STASNEY u. HIGGING (1937) gibt mit 59,0±1,1 % bis 68,0±1,2 % ( ± s) die höchsten Mittelwerte an. Bei vier Autoren (VAN LOON u. CLARK 1943; REKERS u. COULTER 1948; COLES 1986; JAIN 1986) wird der Anteil der Lymphozyten <1 % angegeben, von MELVERGER et al. (1969) im Gegensatz dazu mit 8,2±2,7 % bis 10,7±2,7 % ( ± s). Der Anteil der Megakaryozyten beträgt, sofern er ins Hämomyelogramm mit einbezogen wird, bis zu 0,5 % (ALEXANDROV 1928; STASNEY u. HIGGINS 1937; VAN LOON u. CLARK 1943; REKERS u. COULTER 1948; MELVEGER et al. 1969; SAAR u. ULRICH 1975; COLES 1986, MISCHKE u. BUSSE 2002). Der Anteil der Megakaryoblasten ist ausschließlich in den Studien von SAAR u. ULRICH (1975) und MISCHKE u. BUSSE (2002) berücksichtigt und beträgt 0,01 % (0-0,2 %) bzw. 0,08±0,10 %. Der Anteil der Promegakaryozyten ist nur in der Studie von MISCHKE u. BUSSE (2002) untersucht worden und wird mit 0,02±0,05 % angegeben. Differenzen aufgrund von Altersunterschieden bezüglich des Hämomyelogramms bei gesunden Hunden wurden nur in drei Studien berücksichtigt. EARL et al. (1973) untersuchte die Ausstriche postmortem entnommener Knochenmarkproben mehrerer Hunde bis zum Alter von 56 Tagen, die jeweils im Intervall von einer Woche entnommen worden waren. MULLIGAN (1941) vergleicht fünf Hunde im Alter von zwei bis sieben Monaten mit 35 adulten Tieren. Der niedrigste mittlere Anteil der Erythropoese findet sich bei EARL et al. (1973) mit 15,4 % (1,8-31,3 %) bei den 21 Tage alten Welpen. Bei Junghunden bis sieben Monaten wird hingegen der Anteil 15
26 Literaturübersicht der erythropoeitischen Zellen mit 51,2 % angegeben. Der mittlere Gehalt der Granulopoese wird bei Welpen und Junghunden zwischen 48,7 % (33,4-72,4 %) (EARL et al. 1973) und 40,4% (MULLIGAN 1941) angegeben. Auffällig ist, dass der Anteil der Lymphozyten mit 54,7 % (43,3-67,8 %) bei den 21 Tage alten Welpen sehr hoch ist. Im Gegensatz dazu liegt er bei den Junghunden mit 1,2 % (0,4-3 %) im Referenzbereich der erwachsenen Hunde (MULLIGAN 1941). BUSSE (2002) beschreibt, dass der Anteil an Proerythroblasten, Makroblasten, basophilen Normoblasten, Monozyten und Lymphozyten bei Hunden <6 Monaten deutlich höher ausfällt als bei älteren Tieren, wohingegen sich der Gesamt-Anteil der Granulopoese hier am geringsten darstellt. Dementsprechend zeigen sich die M:E-Ratio niedriger bzw. die I:M E -Ratio höher als bei älteren Tieren. Erläuterungen zu Tabelle 1 und Tabelle 2: Eos = eosinophil Max. = Maximum Min. = Minimum Neutr. = neutrophil Basoph. = basophil Polychr. = polychromatisch Oxyph. = oxyphil S = Standardabweichung = arithmetischer Mittelwert M:E- Ratio = Verhältnis zwischen myeloischen und erythroischen Zellen im Knochenark I:M- Ratio = Reifungsindex der unreifen und reifen Zellen der Granulo- und Erythropoese I:M g - Ratio = Reifungsindex der Zellreihe der neutrophilen Granulozyten I:M e - Ratio = Reifungsindex der Zellreihe der Erythropoese MMI = 1/ I:M g - Ratio EMI = 1/ I:M e - Ratio * = selber errechnet 16
27 Literaturübersicht Tabelle 1: Literaturübersicht über Angaben zu Myelogrammen adulter gesunder Hunde Literaturstelle Alexandrov, 1928 Stasney u. Higgins, 1937 Mulligan, 1941 Punktionsstelle Sternum Rippe Prox. Femur Femurmitte Rippe Anzahl der Hunde n Untersuchte Zellzahl n Alter der Hunde adult <7 Monate I (min.-max.) I±s Median (Min.-Max.) Median (Min.-Max)* Stammzellen % 0,6 (0,0-1,8) 0,2 (0,0-0,6) Megaloblasten % Erythroblasten % 21,5 (14,6-32,3) 1,5 (0,4-3,8) 2,2 (1,8-7,4) Proerythroblasten % 1,9 (1,0-3,5) 0,5 (0,0-1,4) 0,6 (0,0-1,8) Basoph. Normoblasten % Polychr. Normoblasten % Oxyphile Normoblasten % Erythropoese gesamt % Leukoblasten 1,89 ± 0,98 1,51 ± 0,81 1,05 ± 0,72 Myeloblasten % 1,2 (0,5-3,2) 0,51 ± 0,40 0,35 ± 0,23 0,24 ±0,23 58,98 ± 9,86 64,95 ± 8,18 68,02 ± 7,96 38,1 (18,6-63,6) 48,4 (46,6-66,2) Promyelozyt % 0,9 (0,2-1,8) 2,83 ± 1,49 2,02 ± 1,03 1,68 ± 0,81 1,5 (0,2-4,6) 0,8 (0,6-2,4) Neutr. Myelozyten % 1,2 (0,2-2) 8,93 ± 3,14 7,24 ± 2,40 6,99 ± 3,39 4,7 (2,2-11,2) 2,4 (2,0-4,8) Neutr. Metamyelozyt % 6,7 (4,3-9,6) 15,29 ± 4,12 13,34 ± 4,67 11,12 ± 3,67 10,5 (5,6-20,0) 6,0 (5,6-8,0) Neutr. Stabkernige % 31,0 (16,8-53,8) 24,0 (10,4-34,4) 5,06 ± 3,81 4,36 ± 3,05 5,39 ± 3,5 Neutr. Segmentkernige % 35,1 (27,5-43,5) 3,9 (0,2-8,6) 3,8 (1,6-5,4) Eos. Myelozyt % 0,5 (0,3-1,2) 1,15 ± 0,65 1,25 ± 0,74 1,02 ±0,65 Eos. Metamyelozyt % 1,6 (0,7-3,1) 3,7 (1,0-6,8) 3,4 (1,4-6,0) Eos. Stabkernige % 2,83 ± 2,03 2,19 ± 1,38 1,59 ± 0,93 1,32 (0,6-3,77) Eos. Segmentkernige % Basophile % 0,05 ± 0,12 0,07± 0,39 0,04± 0,09 Myelopoese gesamt % Monozyten % 10,4 (4,1-18,6) Histiozyten % 5,1 (1,8-12,0) 0,99 ± 0,56 1,36 ±0,68 1,06 ± 0,64 Megakaryoblast % Megakaryozyten % 0,1 (0,2-1,0) 0,12 ± 0,18 0,09 ± 0,13 0,1 ± 0,13 Lymphozyten % 8,8 (3,0-13,3) 1,24 ± 0,55 1,15 ± 0,64 1,68 ± 1,19 1,9 (0,0-6,6) 1,2 (0,4-3,0) Plasmazellen % Mitosen % I:M G*- Ratio 0,08 0,60 0,54 0,54 0,14 0,09 I:M E*- Ratio 17
28 Literaturübersicht Fortsetzung Tabelle 1: Literaturstelle Van Look u. Clark, 1943 Meyer u. Bloom 1943 Horn et al., 1953 Punktionsstelle Rippe Femur Ilium Sternum Anzahl der Hunde n Untersuchte Zellzahl n Alter der Hunde 1-11 Jahre Median (Min.-Max.) I I Stammzellen % Megaloblasten % 1,02 Erythroblasten % 2,50 Proerythroblasten % 0,6 (0,2-1,2) 0,3 (0-0,7) 1,72 Basoph. Normoblasten % 7,8 (6,4-9,9) 6,1 (4,2-8,4) Polychr. Normoblasten % 16,4 (11,0-26,0) 16,5 (13,3-19,8) 35,18 27,58 Oxyphile Normoblasten % 17,4 (8,9-25,8) 16,1 (7,6-21,1) Erythropoese gesamt % Leukoblasten % Myeloblasten % 0,6 (0,2-1,0) 0,5 (0,2-1,0) 0,58 0,99 Promyelozyt % 1,6 (0,7-2,8) 0,8 (0,2-1,1) 1,60 Neutr. Myelozyten % 6 (2,7-10,0) 4,6 (1,7-8,0) 3,76 3,96 Neutr. Metamyelozyt % 3,4 (1,1-4,6) 3,3 (2,0-4,3) 8,05 Neutr. Stabkernige % 11,7 (6,8-17,4) 12,6 (10,3-18,7) 23,50 32,96 Neutr. Segmentkernige % 30,1 (16,8-44,2) 34,7 (30,1-39,7) 18,50 6,15 Eos. Myelozyt % 0,26 0,59 Eos. Metamyelozyt % 0,60 2,0 (0,4-3,8) 2,0 (0,2-3,3) Eos. Stabkernige % 0,12 1,88 Eos. Segmentkernige % 1,56 0,77 Basophile % 0,02 0,28 Myelopoese gesamt % Monozyten % 0,2 (0-0,3) 3,10 0,07 Histiozyten % 5,32 Megakaryoblast Megakaryozyten % 0,5 (0-1,4) 0,2 (0-0,3) Lymphozyten % 0,9 (0,2-2,7) 0,7 (0-3,4) 9,80 5,25 Plasmazellen % 0,82 1,08 Mitosen % I:M G*- Ratio 0,18 0,12 0,10 0,14 I:M E*- Ratio 0,25 0,20 18
29 Literaturübersicht Fortsetzung Tabelle 1: Literaturstelle Penny, 1974 Saar u. Ulrich 1975 Hoff et al.1985 Jain, 1986 Coles 1986 Mischke u. Busse 2002 Punktionsstelle Ilium Sternum Darmbeinflügel Ilium Ilium Anzahl der Hunde n Untersuchte Zellzahl n Alter der Hunde adult 1-3 Jahre 1-8 Jahre I ± s I (Min.-Max.) Median (Min.-Max.) x ±s Erythroblasten % 1,72 ± 0,69 1,3 ( 0,4-2,9) 1,22 (0-2,3) 0,2 Proerythroblasten % 4,73 ± 1,86 6,9 (2,2-15,1) 6,83 (4,0-9,4) 3,9 1,62 ± 0,65 Makroblasten % 2,82 ± 0,97 Proerythroblasten + Makroblasten % 4,43 ± 1,23 Basoph. Normoblasten % 12,74 ± 3,75 20,78 (14,3-36,3) 25,12 (7,8-34,1) 27,0 5,06 ± 2,66 Polychr. Normoblasten % 6,42 ± 2,46 5,54 (2,3-9,6) 3,09 (0,8-7,3) 15,3 26,0 ± 6,2 Oxyphile Normoblasten % 25,38 ± 6,82 36,05 (26,2-53,8) 36,27 (15,9-52,2) 46,4 42,2 9,53 ± 3,63 Erythropoese gesamt % 45,0 ± 9,81 Myeloblasten % 1,37 ± 0,55 0,94 (0,2-1,5) 0,0 0,6 0,11 ± 0,14 Promyelozyt % 1,35 ± 0,92 2,16 (1,0-4,1) 5,59 (1,9-13,4) 1,3 1,6 2,27 ± 0,99 Neutr. Myelozyten % 8,33 ± 2,21 5,28 (3,3-7,8) 9,0 6,0 2,76 ± 0,98 Neutr. Metamyelozyt % 4,87 ± 1,5 5,6 (2,5-10,1) 11,17 (4,9-26,0) 7,5 3,4 5,80 ± 1,71 Neutr. Stabkernige % 25,66 ± 5,47 20,86 (7,6-33,3) 11,76 (7,1-16,2) 13,6 11,7 26,1 ± 5,82 Neutr. Segmentkernige % 15,44 ± 6,7 4,46 (0,5-9,9) 18,59 (8,5-30,4) 18,4 30,1 3,32 ± 1,85 Eos. Promyelozyt % 0,28 ± 0,25 Eos. Myelozyt % 1,01 ± 0,61 1,75 (0,2-4,9) 0,0 0,57 ± 0,47 Eos. Metamyelozyt % 1,41 ± 0,66 2,4 0,85 ± 0,62 4,64 (1,2-9,0) 2,0 Eos. Stabkernige % 0,9 1,30 ± 0,97 Eos. Segmentkernige % 1,02 ± 0,56 2,75 (1,0-3,9) 0,3 0,20 ± 0,22 Basophile % Nur einer 0,01 (0-0,1) 0,08 (0-0,3) 0,0 0,00 ± 0,01 Myelopoese gesamt % 60,44 ± 7,46 51,82 (32,8-69,2) 53,4 43,7 ± 8,68 Monozyten % 0,77 (0,2-1,7) 0,0 0,2 0,37 ± 0,34 1,49 (0,6-4,0) Histiozyten % 0,18 ± 0,19 0,03 (0-0,3) Megakaryoblast % 0,01 (0-0,2) 0,08 ± 0,10 Promegakaryozyten % 0,02 ± 0,05 Megakaryozyten % 0,04 (0-0,2) 0,5 0,13 ± 0,13 Megakaryopoese gesamt 0,23 ± 0,20 Lymphozyten % 7,45 ± 3,14 4,16 (0,5-6,2) 6,06 (2,3-12,9) 0,2 0,9 6,39 ± 3,75 Plasmazellen % 1,05 ± 1,64 1,22 ( 0,3-2,4) 2,05 (0,6-4,4) 2,98 ± 1,65 Mitosen % 0,71±0,26 6,9 (3,0-11,1) 1,14±0,53 I:M G*- Ratio 0,24 0,27 0,13 0,3 0,2 0,15±0,05 I:M E*- Ratio 0,34 0,31 0,29 0,1 0,27±0,09 19
30 Literaturübersicht Tabelle 2: Literaturübersicht über Angaben zu Myelogrammen gesunder Hunde unter Berücksichtigung des Altersunterschiedes Literaturstelle Earl et al., 1973 Punktionsstelle Rippe Anzahl der Hunde n Jeweils 5 männliche und 5 weibliche Welpen Untersuchte Zellzahl n Alter der Hunde Tage Median (Minimum-Maximum) Proerythroblasten % 7,2 3,7 4,1 3,7 4,3 4,6 6,3 Basoph. Normoblasten % (3,5-11,8) (1,6-6,7) (2,23-7) (1,16-8,8) (1,66-8,8) (1,28-8,34) (3,88-9,13) Polychr. Normoblasten % 17,6 13,1 16, ,8 20,3 28,1 Oxyphile Normoblasten % (6,0-32,0) (5,3-19,7) (8,56-19,57) (6,46-22,5) (5,91-32,11) (8,28-31,8) (24,17-33,73) Erythropoese gesamt % 24,5 (9,9-40,3) 16,9 (8,6-25,8) 20,7 (10,8-32,2) 15,4 (7,8-31,3) 21,1 (7,6-38,7) 24,9 (10,95-37,6) 34,4 (30,7-40,9) Myeloblasten % 1,3 (0,54-3,0) 1,5 (0,75-2,6) 0,94 (0,3-1,62) 0,9 (0,48-1,5) 0,88 (0,6-1,12) 0,8 (0,62-1,25) 0,92 (0,5-1,4) Promyelozyt % 2,8 (1,1-6,1) 4,1 (1,99-6,32) 2,6 (1,0-4,2) 2,4 (0,77-3,9) 2,1 (0,85-2,76) 2,4 (1,42-3,8) 2,5 (1,87-3,19) Neutr. Myelozyten % 6,9 (2,2-11,5) 8,7 (5,8-11,5) 5,7 (2,69-8,67) 5,4 (2,89-8,17) 5 (3,0-8,15) 6,1 (3,83-8,28) 8 (6,7-10,44) Neutr. Metamyelozyt % 5,8 (3,7-8,5) 7 (5,2-9,5) 5,1 (3,21-7,27) 4,8 (3,0-6,73) 4,3 (2,7-6,73) 5,2 (2,67-7,07) 5,9 (4,0-7,4) Neutr. Stabkernige % 7,7 (4,0-11,3) 11,9 (6,1-22,7) 8,2 (4,6-12,29) 6,5 (3,7-9,68) 8 (6,4-19,2) 9,6(7,07-11,93) 11,3 (8,39-13,11) Neutr. Segmentkernige % 8,6 (4,5-13,5) 12,5 (5,5-38,3) 9,2 (5,47-16,48) 7 (1,28-9,35) 8,2 (4,62-14,32) 13,3 (9,77-16,13) 13,9 (7,55-16,38) Eos. Myelozyt % 0,21 (0,1-0,6) 0,48 (0-1,33) 0,27 (0-0,65) 0,17 (0-0,36) 0,16 (0-0,43) 0,33 (0-0,86) 0,6 (0,26-1,4) Eos. Metamyelozyt % 0,38 (0,1-0,7) 1,03 (0-1,7) 0,45 (0,16-0,81) 0,48 (0,1-0,9) 0,44 (0,1-0,86) 0,64 (0,17-1,06) 0,94 (0,61-1,46) Eos. Stabkernige % 0,52 (0,1-1,4) 0,69 (0,25-1,2) 0,44 (0,08-0,97) 0,43 (0-0,95) 0,43 (0,09-0,2) 0,58 (0,25-1,4) 1,11 (0,47-1,54) Eos. Segmentkernige % 0,35 (0,2-1,0) 0,81 (0,43-1,9) 0,57 (0,22-0,89) 0,33 (0-0,87) 0,43 (0-0,96) 0,64 (0,17-1,06) 1,05 (0,27-2,07) Basophile % 0,06 (0-0,2) 0,07 (0-0,43) 0,00 0,02 (0-0,1) 0,06 (0-0,25) 0,01 (0-0,07) 0,07(0-0,24) Myelopoese gesamt % 35 (24,4-41,7) 48,7 (33,4-72,4) 33,4 (24,1-44,8) 28,4 (22,2-33,6) 30 (22,1-37,3) 39,5 (27,1-50,5) 46,3 (38,9-50,9) Monozyten % 0,02 (0-0,22) 0,03 (0-0,1) 0,03 (0-0,16) 0,02 (0-0,15) 0,02 (0-0,15) 0,00 0,006 (0-0,06) Histiozyten % 0,51 (0-1,2) 0,44 (0,16-0,68) 0,23 (0-0,54) 0,2 (0-0,6) 0,26 (0,08-0,52) 0,26 (0-0,61) 0,25 (0,07-0,5) Megakaryozyten % 0,1 (0-0,3) 0,12 (0-0,3) 0,03 (0-0,16) 0,03 (0-0,1) 0,04 (0-0,22) 0,03 (0-0,1) 0,04 (0-0,13) Lymphozyten % 38,4 (17,3-53,1) 33,5 (18,0-45,4) 45 (29,2-64,1) 54,7 (43,3-67,8) 47,9 (24,0-67,4) 33,5 (20,6-61,4) 17,6(15,1-22,8) Plasmazellen % 0,05 (0-0,4) 0,04 (0-0,1) 0,04 (0-0,15) 0,07 (0-0,65) 0,14 (0-0,36) 0,34 (0-0,63) 0,34 (0,07-0,55) Mitosen % 0,78 (0,1-1,5) 0,64 (0,32-1,02) 0,64 (0,49-0,82) 0,55 (0,26-1,0) 0,54 (0,23-0,99) 0,79 (0,27-1,43) 1,1 (0,9-1,45) Unklassifizierte Zellen % 0,00 0,02 (0-0,09) 0,00 0,00 0,00 0,02 (0-0,16) 0,007 (0-0,7) 20
31 Literaturübersicht Fortsetzung Tabelle 2: Literaturstelle Mulligan, 1941 Reekers u. Coulter, 1948 Melveger et al., 1969 Hoff et al.1985 Punktionsstelle Rippe Rippe Sternum Rippe Darmbeinflügel Anzahl der Hunde n Untersuchte Zellzahl n Alter der Hunde adult <7 Monate 9-24 Monate 1-1,5 Jahre 1-1,5 Jahre 1-3 Jahre Median (Min.-Max.) Median (Min.-Max)* Median (Min.-Max.) I ± s Median (Min.-Max.) Stammzellen % 0,6 (0,0-1,8) 0,2 (0,0-0,6) Megaloblasten % 0,27 (0-1,33) 1,22 (0-2,3) Erythroblasten % 1,5 (0,4-3,8) 2,2 (1,8-7,4) 28,24 (7,98-53,92) 6,83 (4,0-9,4) Proerythroblasten % 0,5 (0,0-1,4) 0,6 (0,0-1,8) 6,5 ± 0,45 7,06 ± 0,84 Basoph. Normoblasten % 27,58 ± 4,44 27,6 ± 4,3 25,12 (7,8-34,1) Polychr. Normoblasten % 38,1 (18,6-63,6) 48,4 (46,6-66,2) 4,64 (0-11,2) 3,09 (0,8-7,3) Oxyphile Normoblasten % 36,27 (15,9-52,2) Erythropoese gesamt % 33,15 (8,72-60,50) 34,08 ±4,7 34,66 ± 3,6 Leukoblasten Myeloblasten % 1,89 (0,23-3,66) 0,92 ± 0,19 0,94 ± 0,25 Promyelozyt % 1,5 (0,2-4,6) 0,8 (0,6-2,4) 0,65 (0-3,26) 2,06 ± 0,35 2,34 ± 0,69 5,59 (1,9-13,4) Neutr. Myelozyten % 4,7 (2,2-11,2) 2,4 (2,0-4,8) 2,73 (0-9,47) 6,3 ± 1,01 7,38 ± 0,97 Neutr. Metamyelozyt % 10,5 (5,6-20,0) 6,0 (5,6-8,0) 5,12 (0-24,44) 7,9 ± 2,41 6,82 ± 1,30 11,17 (4,9-26,0) Neutr. Stabkernige % 31,0 (16,8-53,8) 24,0 (10,4-34,4) (16,46-62,88) 11,28 ± 2,16 11,28 ± 1,33 11,76 (7,1-16,2) Neutr. Segmentkernige % 3,9 (0,2-8,6) 3,8 (1,6-5,4) 5,01 (0,24-14,29) 23,48 ± 1,32 19,46 ± 1,71 18,59 (8,5-30,4) Eos. Myelozyt % 0,56 ± 0,23 0,66 ± 0,31 Eos. Metamyelozyt % 0,66 ± 0,28 1,1 ± 0,64 3,7 (1,0-6,8) 3,4 (1,4-6,0) 4,72 (0,23-19,30) Eos. Stabkernige % 1,2 ± 0,36 1,18 ± 0,53 4,64 (1,2-9,0) Eos. Segmentkernige % 0,8 ± 0,52 1,12 ± 0,74 Basophile % 0,19 (0-1,25) 0,02 ± 0,04 0,04 ± 0,05 0,08 (0-0,3) Myelopoese gesamt % 62,68 (36,71-90,07) 55,18 ± 5,91 52,32 ± 3,8 51,82 (32,8-69,2) Monozyten % 0,00 0,00 0,00 Histiozyten % 0,42 ± 0,22 0,34 ± 0,17 1,49 (0,6-4,0) Megakaryoblast % Megakaryozyten % 0,06 (0-1,10) 0,06 ± 0,09 0,1 ± 0,1 Lymphozyten % 1,9 (0,0-6,6) 1,2 (0,4-3,0) 0,73 (0-8,05) 8,18 ± 2,69 10,7 ± 2,67 6,06 (2,3-12,9) Plasmazellen % 0,39 (0-2,08) 0,7 ± 0,28 0,84 ± 0,29 2,05 (0,6-4,4) Mitosen % 1,38 ± 0,34 1,04 ± 0,38 Unklassifizierte Zellen % 0,07 (0-0,9) 21
32 Literaturübersicht M:E-Quotient Der M:E- Quotient drückt das Verhältnis zwischen myeloischen (M) und erythroischen (E) Zellen im Knochenmark aus (HARVEY 1984; GRINDEM 1989; GRINDEM 2002; ELMORE 2006). Die Anzahl aller kernhaltigen Zellen der myeloischen (neutrophilen, eosinophilen und basophilen) Reihe wird dazu durch die Summe aller kernhaltigen Zellen der Erythropoese dividiert (PENNY 1974; GRINDEM 1989; GRINDEM 2002). Um ein repräsentatives Ergebnis zu erhalten, müssen mindestens 500 Zellen der jeweiligen Zellreihe zugeordnet werden (DUNCAN u. PRASSE 1976; SCHALM 1980; HARVEY 1984; TVEDTEN 1999). Referenzwerte des M:E-Quotienten beim Hund reichen von 0,43:1 0,65:1 (STASNEY u. HIGGINS 1937) bis 2,66 (±1,13):1 (PENNY 1974) (siehe Tabelle 3). Zwischen den einzelnen Studien lassen sich starke Unterschiede erkennen, aber auch innerhalb der einzelnen Arbeiten treten starke Schwankungsbreiten auf (REUTNER et al. 1954: [0,77:1 6,93:1]; HOFF et al. 1985: [0,6:1 4,4:1]). PENNY und CARLISLE (1970) sowie COLES (1986) beschreiben dabei geschlechtsspezifische Unterschiede. Bei PENNY und CARLISLE (1970) zeigt sich der M:E-Quotient signifikant höher bei den männlichen Tieren, was daran liegt, dass die Gesamtzahl der Erythropoese vor allem im Gegensatz zum hohen Anteil neutrophiler Granulozyten bei den männlichen Tieren sehr niedrig ist. EARL (1973) hingegen findet in seiner Studie bei den männlichen Tieren eine signifikant höhere Anzahl an Proerythroblasten und basophilen Normoblasten als bei den weiblichen Tieren, was sich in einem niedrigeren M:E-Quotienten bei den männlichen Tieren ausdrückt. MISCHKE u. BUSSE (2002) finden in ihrer Studie hingegen keine signifikanten Geschlechtsunterschiede des M:E-Quotienten. Auf Veränderungen des M:E-Quotienten bei Tieren mit verschiedenen Erkrankungen wird im Kapitel 4 näher eingegangen. 22
33 Literaturübersicht Tabelle 3 Literaturübersicht über das Verhältnis zwischen myeloischen und erythroischen kernhaltigen Vorläuferzellen (M:E-Quotient) im Knochenmark gesunder Hunde Autor n M:E-Index Alexandrov 1928 Stasney & Higgins 1937 Mulligan 1941 Reekers & Coulter 1948 Reutner et al Lazarus & Ganapathy Melveger et al Penny & Carlisle 1970 Penny 1974 Hoff et al Coles 1986 Jain 1986 Mischke u. Busse 2002 Median (Minimum- Maximum) x ±s Mittelwert 12 2: ,6:1 (0,5:1-4,0:1) 0,43:1 bis 0,65:1 36 1,89:1 28 1,61:1 (0,77:1-6,93:1) 6 1,79:1 5 10m. 10w. 1,53(±0,23):1 1,66(±0,38):1 56 2,66(±1,13):1 21 1,6:1 (0,6:1-4,4:1) m= 2,7:1 w= 1,73:1 m= 2,7:1 w= 1,68:1 1,15:1 92 1,08(±0,61):1 n= Anzahl der Hunde; : keine Angabe; m= männlich; w= weiblich 23
34 Literaturübersicht Reifungsindizes Es werden mehrere Reifungsindizes im Hämoyelogramm berechnet. Der Reifungsindex der Myelopoese (I:M-Ratio) berechnet man durch Bildung des Verhältnisses der unreifen (immature; Myeloblast bis Myelozyt) zu den reifen (mature; Metamyelozyt bis segmentkerniger Garnulozyt) Zellen. Dabei werden die neutrophile, eosinohile und basophile Myelopoese einbezogen. Der I:M-Index beurteilt die Regenerationsfähigkeit der Myelopoese (WINQVIST 1954). Bei gesunden Hunden liegt der Normalwert nach PENNY (1974) bei 0,26 ± 0,07, nach SPURLING (1977) im Mittel bei 0,21 und nach MISCHKE und BUSSE (2002) im Mittel bei 0,16±0,05. Signifikante Unterschiede des I:M-Index zwischen männlichen und weiblichen Hunden konnten dabei nicht festgestellt werden (PENNY u. CARLISLE 1970; MISCHKE u. BUSSE 2002). Der I:M G -Index bestimmt die Regenerationsfähigkeit der Myelopoese unter Ausschluss der eosinophilen und basophilen Reihe und wurde von HEITMANN (1967) bei Untersuchungen am Rind eingeführt. Er wird beim Hund in der zugänglichen Literatur kaum angewendet. MISCHKE und BUSSE (2002) bestimmten ihn bei gesunden Hunden im Mittel mit 0,15±0,05. Die Regenerationsfähigkeit der Erythropoese wird mit dem I:M E -Index bestimmt. Genauso wie beim I:M-Index wird hier das Verhältnis der unreifen (Proerythroblast, Makroblast, basophiler Normoblast) zu den reifen (polychromatischer und oxyphiler Normoblast) Zellen der Erythropoese ermittelt (HEITMANN 1967). In der Literatur gibt es nur von MISCHKE u. BUSSE (2002) Angaben zum gesunden Hund, die bei 0,27±0,09 liegen. Errechnet man aus den Daten der Tabellen 1 und 2 die entsprechenden Werte selbst, so ergeben sich Werte zwischen 0,08 (ALEXANDROV 1928) und 0,60 (STASNEY u. HIGGING 1937) für den I:M G -Index und zwischen 0,1 (JAIN 1986) und 0,34 (PENNY 1974) für den Reifungsindex der Erythropoese. HOFF et al. (1985) führte die modifizierten Reifungsindizes MMI myeloid maturation Index und EMI erythroid maturation Index ein. Sie entsprechen den oben genannten, bis auf die Tatsache, dass Zähler und Nenner vertauscht werden. Den Mittelwert für den MMI gibt HOFF (1985) beim gesunden Hund mit 8,8 (3,4-26,7) und 24
Gießener Kleintierabend Lymphknotenzytologie
 Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Schattauer Schattauer 2010 Schattauer GmbH, Stuttgart
 7 Blut 2010 GmbH, Stuttgart Blutzellen Megakaryoblast Proerythroblasten/Erythroblasten Fettzelle Proerythroblasten/Erythroblasten Zellen der myeloischen Differenzierungsreihen Knochenmark, Rind. Färbung
7 Blut 2010 GmbH, Stuttgart Blutzellen Megakaryoblast Proerythroblasten/Erythroblasten Fettzelle Proerythroblasten/Erythroblasten Zellen der myeloischen Differenzierungsreihen Knochenmark, Rind. Färbung
Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie
 Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie Prof. Dr. med. Th. Büchner Medizinische Klinik und Poliklinik - Innere Medizin A - Universitätsklinikum Münster Albert-Schweitzer-Straße
Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie Prof. Dr. med. Th. Büchner Medizinische Klinik und Poliklinik - Innere Medizin A - Universitätsklinikum Münster Albert-Schweitzer-Straße
Stroma des roten Knochenmarks und der lymphatischen Organe. Zellen stehen über lange Fortsätze miteinander in Kontakt
 Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie
 Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie Priv.-Doz. Dr. med. Torsten Kessler Universitätsklinikum Münster Medizinische Klinik A Albert-Schweitzer-Campus 1 48149 Münster
Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie Priv.-Doz. Dr. med. Torsten Kessler Universitätsklinikum Münster Medizinische Klinik A Albert-Schweitzer-Campus 1 48149 Münster
Morphologie: BILDER und Begriffe
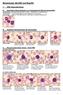 Morphologie: BILDER und Begriffe 1. WBC Besonderheiten A) Quantitative Besonderheiten im morphologischen Bild der Neutrophilen Neutrophilie (mikroskopisches Bild bei 800-1000facher Vergrößerung) mikroskopisch:
Morphologie: BILDER und Begriffe 1. WBC Besonderheiten A) Quantitative Besonderheiten im morphologischen Bild der Neutrophilen Neutrophilie (mikroskopisches Bild bei 800-1000facher Vergrößerung) mikroskopisch:
Eosinophilie. Zytologie. Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV
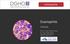 Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Bildungausstrich HD
 Februar 2012 Bildungausstrich 11-11-HD Mit dem Ringversuch 11-11-HD hat das CSCQ den Teilnehmern kostenlos einen zusätzlichen Ausstrich zu Weiterbildungszwecken angeboten. Dieses Dokument entspricht dem
Februar 2012 Bildungausstrich 11-11-HD Mit dem Ringversuch 11-11-HD hat das CSCQ den Teilnehmern kostenlos einen zusätzlichen Ausstrich zu Weiterbildungszwecken angeboten. Dieses Dokument entspricht dem
Mikroskopisches Differentialblutbild mikroskopisches Differentialblutbild Ziel (%) Ergebnisse im Akzeptanzbereich 200 Teilnehmer Ausstrich
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014
 Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014 S1 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung =
Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014 S1 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung =
Anlage zur Akkreditierungsurkunde D-PL nach DIN EN ISO/IEC 17025:2005
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-13294-06-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 26.01.2017 bis 25.01.2022 Ausstellungsdatum: 26.01.2017 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-13294-06-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 26.01.2017 bis 25.01.2022 Ausstellungsdatum: 26.01.2017 Urkundeninhaber:
Ergebnisbogen DF2/13 Differentialblutbild Mai 2013
 Ergebnisbogen DF2/13 Differentialblutbild Mai 2013 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung = richtige
Ergebnisbogen DF2/13 Differentialblutbild Mai 2013 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung = richtige
4.1. Dauer der Aplasie nach Hochdosis-Chemotherapie und Retransfusion
 4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
im 144. Durchgang des Rundversuches Hämatologie wurden folgende Ergebnisse erzielt:
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Pathophysiologie: Fallbeispiele Hämatologie
 Fall 8 Pathophysiologie: Fallbeispiele Hämatologie Eine Frau mittleren Alters fühlt sich seit zwei Wochen schwach und zunehmend müde. Ihr Familienarzt hat eine Laboruntersuchung durchgeführt und hat sie
Fall 8 Pathophysiologie: Fallbeispiele Hämatologie Eine Frau mittleren Alters fühlt sich seit zwei Wochen schwach und zunehmend müde. Ihr Familienarzt hat eine Laboruntersuchung durchgeführt und hat sie
Tab. 4: Fibrosarkom Rasse n Rasse n Rasse n. männlich: 16 keine Angabe: 3 weiblich: 6 Arithmetisches Mittel Alter: 7,94 Jahre
 39 D. ERGEBNISSE 1. Rasse und Alter der Tiere in den verschiedenen Gruppen Tab. 4: Rasse n Rasse n Rasse n Airdale Terrier 1 Cocker Spaniel 1 Riesenschnauzer 1 Alaskan Malamute 1 Dobermann 1 Rottweiler
39 D. ERGEBNISSE 1. Rasse und Alter der Tiere in den verschiedenen Gruppen Tab. 4: Rasse n Rasse n Rasse n Airdale Terrier 1 Cocker Spaniel 1 Riesenschnauzer 1 Alaskan Malamute 1 Dobermann 1 Rottweiler
Taschenatlas Hämatologie
 Taschenatlas Hämatologie Mikroskopische und klinische Diagnostik für die Praxis Torsten Haferlach Ulrike Bacher Harald Theml Heinz Diem Unter Mitarbeit von Marianne Engels 6., vollständig überarbeitete
Taschenatlas Hämatologie Mikroskopische und klinische Diagnostik für die Praxis Torsten Haferlach Ulrike Bacher Harald Theml Heinz Diem Unter Mitarbeit von Marianne Engels 6., vollständig überarbeitete
Mikroskopisches Differentialblutbild
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
144. Hämatologie Rundversuch vom
 Hämoglobin [g/dl] alle A a 725 8.8 0.3 2.95 8.8 8.8 k 8.8 691 8.8 0.2 2.61 8.8 8.8 alle B a 731 7.1 0.2 3.24 7.1 7.2 k 7.1 682 7.1 0.2 2.68 7.1 7.2 Hämatokrit [l/l] ADVIA / alle A a 0.22 75 0.22 0.01 4.55
Hämoglobin [g/dl] alle A a 725 8.8 0.3 2.95 8.8 8.8 k 8.8 691 8.8 0.2 2.61 8.8 8.8 alle B a 731 7.1 0.2 3.24 7.1 7.2 k 7.1 682 7.1 0.2 2.68 7.1 7.2 Hämatokrit [l/l] ADVIA / alle A a 0.22 75 0.22 0.01 4.55
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF1/13 im Monat: Februar 2013 Teilnehmer-Nr.: 0727110 ausgestellt am: 16.02.13 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Ringversuch: DF1/13 im Monat: Februar 2013 Teilnehmer-Nr.: 0727110 ausgestellt am: 16.02.13 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Zertifikat. Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF3/13 im Monat: August 2013 Teilnehmer-Nr.: 0727110 ausgestellt am: 10.08.13 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Ringversuch: DF3/13 im Monat: August 2013 Teilnehmer-Nr.: 0727110 ausgestellt am: 10.08.13 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
UCM united Clinic management GmbH Labor Germeringer Str Planegg Ringversuchsleiter
 Ringversuch: DF4/12 im Monat: Oktober 2012 Teilnehmer-Nr.: 0003333 ausgestellt am: 20.10.12 Referenzinstitut für Bioanalytik UCM united Clinic management GmbH Labor Germeringer Str. 32 82152 Planegg Ringversuchsleiter
Ringversuch: DF4/12 im Monat: Oktober 2012 Teilnehmer-Nr.: 0003333 ausgestellt am: 20.10.12 Referenzinstitut für Bioanalytik UCM united Clinic management GmbH Labor Germeringer Str. 32 82152 Planegg Ringversuchsleiter
UCM united Clinic management GmbH Labor Germeringer Str Planegg Ringversuchsleiter
 Ringversuch: DF3/11 im Monat: August 2011 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.08.11 Referenzinstitut für Bioanalytik UCM united Clinic management GmbH Labor Germeringer Str. 32 82152 Planegg Ringversuchsleiter
Ringversuch: DF3/11 im Monat: August 2011 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.08.11 Referenzinstitut für Bioanalytik UCM united Clinic management GmbH Labor Germeringer Str. 32 82152 Planegg Ringversuchsleiter
Taschenatlas Hämatologie
 Taschenatlas Hämatologie Mikroskopische und klinische Diagnostik für die Praxis Torsten Haferlach Ulrike Bacher Harald Theml Heinz Diem Unter Mitarbeit von Marianne Engels 6., vollständig überarbeitete
Taschenatlas Hämatologie Mikroskopische und klinische Diagnostik für die Praxis Torsten Haferlach Ulrike Bacher Harald Theml Heinz Diem Unter Mitarbeit von Marianne Engels 6., vollständig überarbeitete
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF2/14 im Monat: Mai 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 10.05.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF2/14 im Monat: Mai 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 10.05.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF1/16 im Monat: Februar 2016 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.02.16 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Ringversuch: DF1/16 im Monat: Februar 2016 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.02.16 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str Braunschweig Ringversuchsleiter
 Ringversuch: DF2/13 im Monat: Mai 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 11.05.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90 38126
Ringversuch: DF2/13 im Monat: Mai 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 11.05.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90 38126
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF1/15 im Monat: Februar 2015 Teilnehmer-Nr.: 0004711 ausgestellt am: 14.02.15 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF1/15 im Monat: Februar 2015 Teilnehmer-Nr.: 0004711 ausgestellt am: 14.02.15 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0727110 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0727110 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Akute Promyelozytenleukämie AML-M3
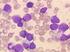 Akute Promyelozytenleukämie AML-M3 Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Edgar Jost Medizinische Klinik IV Genetik Prof. Dr. med. Detlef Haase Zentrum Innere Medizin Göttingen AML M3. Knochenmark.
Akute Promyelozytenleukämie AML-M3 Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Edgar Jost Medizinische Klinik IV Genetik Prof. Dr. med. Detlef Haase Zentrum Innere Medizin Göttingen AML M3. Knochenmark.
149. Hämatologie Rundversuch vom
 Hämoglobin [g/dl] andere A a 670 13.9 0.3 2.37 13.9 13.9 k 13.9 634 13.9 0.3 2.09 13.9 13.9 Mythic 22 A a 11.2 8 11.2 0.2 1.88 11.1 11.1 andere B a 675 13.3 0.3 2.41 13.4 13.5 k 13.4 641 13.4 0.3 2.01
Hämoglobin [g/dl] andere A a 670 13.9 0.3 2.37 13.9 13.9 k 13.9 634 13.9 0.3 2.09 13.9 13.9 Mythic 22 A a 11.2 8 11.2 0.2 1.88 11.1 11.1 andere B a 675 13.3 0.3 2.41 13.4 13.5 k 13.4 641 13.4 0.3 2.01
Chronische lymphatische Leukämie
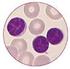 Chronische lymphatische Leukämie Zytologie Immunphänotypisierung Prof. Dr. med. Roland Fuchs Dr. med. J. Panse Medizinische Klinik IV Zytogenetik Prof. Dr. med. Detlef Haase Zentrum Innnere Medizin 1/17
Chronische lymphatische Leukämie Zytologie Immunphänotypisierung Prof. Dr. med. Roland Fuchs Dr. med. J. Panse Medizinische Klinik IV Zytogenetik Prof. Dr. med. Detlef Haase Zentrum Innnere Medizin 1/17
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF3/14 im Monat: August 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 09.08.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF3/14 im Monat: August 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 09.08.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Das Differentialblutbild Differentialdiagnosen der Leukozytose. Man sieht nur was man kennt J.W. Goethe
 Das Differentialblutbild Differentialdiagnosen der Leukozytose Man sieht nur was man kennt J.W. Goethe A Segmentkernige 50-70% Stabkernige 0-4% B C D Basophile 0-1% Eosinophile 1-4 % E lymphozytärereizform
Das Differentialblutbild Differentialdiagnosen der Leukozytose Man sieht nur was man kennt J.W. Goethe A Segmentkernige 50-70% Stabkernige 0-4% B C D Basophile 0-1% Eosinophile 1-4 % E lymphozytärereizform
Differenzialblutbild H3
 Verein für Association pour le Associazione per il medizinische Qualitätskontrolle contrôle de qualité médical controllo di qualità medico Bericht Differenzialblutbild H3 MQ 2017-2 MQ, Institut für Klinische
Verein für Association pour le Associazione per il medizinische Qualitätskontrolle contrôle de qualité médical controllo di qualità medico Bericht Differenzialblutbild H3 MQ 2017-2 MQ, Institut für Klinische
Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90 38126 Braunschweig Ringversuchsleiter
 Ringversuch: DF1/13 im Monat: Februar 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 16.02.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90
Ringversuch: DF1/13 im Monat: Februar 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 16.02.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
 Ringversuch: DF4/15 im Monat: Oktober 2015 Teilnehmer-Nr.: 0004711 ausgestellt am: 17.10.15 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF4/15 im Monat: Oktober 2015 Teilnehmer-Nr.: 0004711 ausgestellt am: 17.10.15 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Querschnittsfach
 Klinik für Kleintiere Innere Medizin (Prof. Dr. R. Neiger) und klinische Laboratoriumsdiagnostik (HDoz. Dr. A. Moritz) Justus-Liebig-Universität Gießen Querschnittsfach 10.11.2008 Dyspnoe, Schnarchen Müdigkeit,
Klinik für Kleintiere Innere Medizin (Prof. Dr. R. Neiger) und klinische Laboratoriumsdiagnostik (HDoz. Dr. A. Moritz) Justus-Liebig-Universität Gießen Querschnittsfach 10.11.2008 Dyspnoe, Schnarchen Müdigkeit,
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF3/14 im Monat: August 2014 Teilnehmer-Nr.: 0003333 ausgestellt am: 09.08.14 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Ringversuch: DF3/14 im Monat: August 2014 Teilnehmer-Nr.: 0003333 ausgestellt am: 09.08.14 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Akute Myelomonozytäre Leukämie
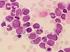 Akute Myelomonozytäre Leukämie Subtyp M4 o inv (16) Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Oliver Galm Medizinische Klinik IV Zytogenetik FISH-Diagnostik Prof. Dr. med. Detlef Haase Dr. Katayoon
Akute Myelomonozytäre Leukämie Subtyp M4 o inv (16) Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Oliver Galm Medizinische Klinik IV Zytogenetik FISH-Diagnostik Prof. Dr. med. Detlef Haase Dr. Katayoon
Ärztliche Laborgemeinschaft Bayern c/o Barmherzige Brüder Haus St. Vinzenz Prüfeninger Str. 86 93049 Regensburg Ringversuchsleiter
 Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 680660L ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Ärztliche Laborgemeinschaft Bayern c/o Barmherzige Brüder Haus St. Vinzenz Prüfeninger
Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 680660L ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Ärztliche Laborgemeinschaft Bayern c/o Barmherzige Brüder Haus St. Vinzenz Prüfeninger
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF2/15 im Monat: Mai 2015 Teilnehmer-Nr.: 0003333 ausgestellt am: 09.05.15 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Ringversuch: DF2/15 im Monat: Mai 2015 Teilnehmer-Nr.: 0003333 ausgestellt am: 09.05.15 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Chronische myeloische Leukämie. Chronische Phase
 Chronische myeloische Leukämie Chronische Phase Zytologie Prof. Dr. med. Roland Fuchs Prof. Dr. med. Tim Brümmendorf Medizinische Klinik IV Zytogenetik Molekulargenetik Prof. Dr. med. Detlef Haase Zentrum
Chronische myeloische Leukämie Chronische Phase Zytologie Prof. Dr. med. Roland Fuchs Prof. Dr. med. Tim Brümmendorf Medizinische Klinik IV Zytogenetik Molekulargenetik Prof. Dr. med. Detlef Haase Zentrum
Hierarchie der Blutzellen
 Hierarchie der Blutzellen Erythozyten Anzahl: 4,2-6,5 Mio/µl Blut (Frauen: 4,2-5,4 Mio/µl, Männer: 4,6-6,2 Mio/µl) Größe: 7-8 µm Proerythrozyten Normoblasten Auflösung des Kerns, Ausschwemmen in Blut Retikulozyten
Hierarchie der Blutzellen Erythozyten Anzahl: 4,2-6,5 Mio/µl Blut (Frauen: 4,2-5,4 Mio/µl, Männer: 4,6-6,2 Mio/µl) Größe: 7-8 µm Proerythrozyten Normoblasten Auflösung des Kerns, Ausschwemmen in Blut Retikulozyten
Hämatopoese TITAN. Dezember 2005 S.Gärtner
 Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
147. Hämatologie Rundversuch vom
 Hämoglobin [g/dl] andere A 8.9 6 8.4 9.4 677 607 70 Mythic 22 A 7.3 6 6.9 7.7 11 8 3 andere B 17.8 6 16.7 18.9 676 625 51 Mythic 22 B 15.3 6 14.4 16.2 11 9 2 Hämatokrit [l/l] andere A 0.27 10 0.24 0.30
Hämoglobin [g/dl] andere A 8.9 6 8.4 9.4 677 607 70 Mythic 22 A 7.3 6 6.9 7.7 11 8 3 andere B 17.8 6 16.7 18.9 676 625 51 Mythic 22 B 15.3 6 14.4 16.2 11 9 2 Hämatokrit [l/l] andere A 0.27 10 0.24 0.30
Entzündung. Teil 11.
 Teil 11 www.patho.vetmed.uni-muenchen.de/matnew.html Bildung von Entzündungszellen = Neutrophile Granulozytopoese Polymorphonuclear granulocytes = PMN Neutrophile Granulozytopoese (1) a.) Reifungsstadien:
Teil 11 www.patho.vetmed.uni-muenchen.de/matnew.html Bildung von Entzündungszellen = Neutrophile Granulozytopoese Polymorphonuclear granulocytes = PMN Neutrophile Granulozytopoese (1) a.) Reifungsstadien:
Erythrozyten-Morphologie Angaben der Teilnehmer
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Diagnostischer Nutzen der Knochenmarkzytologie bei Berner Sennenhunden mit histiozytären Erkankungen
 Diagnostischer Nutzen der Knochenmarkzytologie bei Berner Sennenhunden mit histiozytären Erkankungen von Christina Coenen und Andreas Moritz, Gießen Einleitung Beim Hund gibt es ähnlich wie beim Menschen
Diagnostischer Nutzen der Knochenmarkzytologie bei Berner Sennenhunden mit histiozytären Erkankungen von Christina Coenen und Andreas Moritz, Gießen Einleitung Beim Hund gibt es ähnlich wie beim Menschen
Differenzialblutbild H3
 Verein für Association pour le Associazione per il medizinische Qualitätskontrolle contrôle de qualité médical controllo di qualità medico Bericht Differenzialblutbild H3 MQ 2017-1 MQ, Institut für Klinische
Verein für Association pour le Associazione per il medizinische Qualitätskontrolle contrôle de qualité médical controllo di qualità medico Bericht Differenzialblutbild H3 MQ 2017-1 MQ, Institut für Klinische
Histopathologie. Fall 30
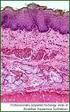 Histopathologie Fall 30 Präp.-Nr.: 30 Färbung: HE Organ: Knochen Tierart: Hund Allgemeines (1): Osteosarkome kommen in unterschiedlichen Lokalisationen vor Axiales Skelett: - Wirbelsäule - Rippen - Brustbein
Histopathologie Fall 30 Präp.-Nr.: 30 Färbung: HE Organ: Knochen Tierart: Hund Allgemeines (1): Osteosarkome kommen in unterschiedlichen Lokalisationen vor Axiales Skelett: - Wirbelsäule - Rippen - Brustbein
Lymphknotenzytologie t bei benignen Erkrankungen. Klinische Zytologie in der Pneumologie Grundlagenkurs Teil II Bernhard Opitz
 Lymphknotenzytologie t bei benignen Erkrankungen Klinische Zytologie in der Pneumologie Grundlagenkurs Teil II 31.05. Bernhard Opitz Lymphknotenzytologie tologie Simple Methode Wenig Traumatisch (fast)
Lymphknotenzytologie t bei benignen Erkrankungen Klinische Zytologie in der Pneumologie Grundlagenkurs Teil II 31.05. Bernhard Opitz Lymphknotenzytologie tologie Simple Methode Wenig Traumatisch (fast)
Lymphomen. Bernhard Opitz Zytologiekurs KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE)
 Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Das komische Blutbild. André Tichelli Hämatologie
 Das komische Blutbild André Tichelli Hämatologie Zum lachend reizend, lustig, spasshaft Sonderbar, seltsam, eigenartig Unerwartet Blutbildanomalien aus Sicht des Klinikers (nicht-hämatologe) - Ein Kliniker
Das komische Blutbild André Tichelli Hämatologie Zum lachend reizend, lustig, spasshaft Sonderbar, seltsam, eigenartig Unerwartet Blutbildanomalien aus Sicht des Klinikers (nicht-hämatologe) - Ein Kliniker
Einführung-2 Block Blut und Immunologie Teil Immunologie
 Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
Vergleichbarkeitsklassen
 ÖQUASTA Seite: 1/ 5 Parameter: Hämoglobin Parameter: Hämatokrit Parameter: MCV Parameter: MCHC Parameter: RDW-CV Parameternummer,name ÖQUASTA Seite: 2/ 5 Parameter: RDW-CV Parameter: Erythrozyten Parameter:
ÖQUASTA Seite: 1/ 5 Parameter: Hämoglobin Parameter: Hämatokrit Parameter: MCV Parameter: MCHC Parameter: RDW-CV Parameternummer,name ÖQUASTA Seite: 2/ 5 Parameter: RDW-CV Parameter: Erythrozyten Parameter:
Die Verwendung von Absolutzahlen in der Hämatologie
 Die Differenzierung der zellulären Bestandteile von Leukozyten (Differenzialblutbild) ist eine der am häufigsten angewandten Labormethoden. Seit dem Beginn der manuellen Differenzierung ist diese Methode
Die Differenzierung der zellulären Bestandteile von Leukozyten (Differenzialblutbild) ist eine der am häufigsten angewandten Labormethoden. Seit dem Beginn der manuellen Differenzierung ist diese Methode
Ortsständige Zellen des Respiartionstraktes R. Heine
 Hier Ihr gewünschtes Bilder einfügen und auf Format des grauen Bereiches beschneiden wie folgt: 1. Bild anklicken und auf gewünschte Größe skalieren 2. dann oben rechts im Menü, Format auswählen 3. dann
Hier Ihr gewünschtes Bilder einfügen und auf Format des grauen Bereiches beschneiden wie folgt: 1. Bild anklicken und auf gewünschte Größe skalieren 2. dann oben rechts im Menü, Format auswählen 3. dann
Der Blast Ein diagnostisches Schwergewicht
 Der Blast Ein diagnostisches Schwergewicht Ursachen und zytologische Erscheinungsformen Xtra Vol. 17.2 2013 Nr. 01 Unter Blasten versteht man Vorläuferzellen mit den Fähigkeiten zur Selbsterhaltung durch
Der Blast Ein diagnostisches Schwergewicht Ursachen und zytologische Erscheinungsformen Xtra Vol. 17.2 2013 Nr. 01 Unter Blasten versteht man Vorläuferzellen mit den Fähigkeiten zur Selbsterhaltung durch
Klinische Angaben. Lehrserie Nr. 281
 INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 281 Knochenmarkpathologie - Basiswissen von: Annette
INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 281 Knochenmarkpathologie - Basiswissen von: Annette
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome
 3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
Differenzialblutbild
 Differenzialblutbild TEAS Themen Erythrozyten, Leukozyten, Färbung nach Pappenheim. Prinzip Beim manuellen Differenzialblutbild wird ein kleiner Blutstropfen auf einem Objektträger so ausgestrichen, dass
Differenzialblutbild TEAS Themen Erythrozyten, Leukozyten, Färbung nach Pappenheim. Prinzip Beim manuellen Differenzialblutbild wird ein kleiner Blutstropfen auf einem Objektträger so ausgestrichen, dass
47. Warthin-Tumor. Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504
 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 505 47.
47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 505 47.
RI *10/ Monate
 RI *10/2014 16 Monate CT-Thorax 3.9.2015. Großer Mediastinaltumor 13x8 cm, Perikarderguss, 1,5 cm mit einliegendem Pigtail-Katheter, Zustand nach Drainage vom 200 ml Erguss. RI *10/2014 16 Monate Labordiagnostik
RI *10/2014 16 Monate CT-Thorax 3.9.2015. Großer Mediastinaltumor 13x8 cm, Perikarderguss, 1,5 cm mit einliegendem Pigtail-Katheter, Zustand nach Drainage vom 200 ml Erguss. RI *10/2014 16 Monate Labordiagnostik
Morphologie Workshop: Lymphozytenmorphologie
 Morphologie Workshop: Lymphozytenmorphologie 16.06.2016 Margrit Bader, leitende BMA, Kantosspital Aarau, Myriam Legros, leitende BMA, Inselspital Bern BrigiBe Suter, Teamleiterin Morphologie, Universitätsspital
Morphologie Workshop: Lymphozytenmorphologie 16.06.2016 Margrit Bader, leitende BMA, Kantosspital Aarau, Myriam Legros, leitende BMA, Inselspital Bern BrigiBe Suter, Teamleiterin Morphologie, Universitätsspital
Die hämatologische Standardfärbung der DGHO nach Pappenheim bei Verwendung eines Sysmex Ausstrichund Färbeautomaten der SP-Reihe
 Die hämatologische Standardfärbung der DGHO nach Pappenheim bei Verwendung eines Sysmex Ausstrichund Färbeautomaten der SP-Reihe Xtra Vol. 16.2 2012 Nr. 04 Die morphologische Hämatologie ist sowohl im
Die hämatologische Standardfärbung der DGHO nach Pappenheim bei Verwendung eines Sysmex Ausstrichund Färbeautomaten der SP-Reihe Xtra Vol. 16.2 2012 Nr. 04 Die morphologische Hämatologie ist sowohl im
Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
 46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
Inhaltsverzeichnis. 1 Einleitung 1
 Inhaltsverzeichnis 1 Einleitung 1 2 Literaturübersicht 3 2.1. Anämie 3 2.2 Hämatologische Besonderheiten bei der Katze 3 2.2.1 Normoblasten und Retikulozyten 5 2.2.2 Howell-Jolly-Körperchen 7 2.2.3 Knochenmark
Inhaltsverzeichnis 1 Einleitung 1 2 Literaturübersicht 3 2.1. Anämie 3 2.2 Hämatologische Besonderheiten bei der Katze 3 2.2.1 Normoblasten und Retikulozyten 5 2.2.2 Howell-Jolly-Körperchen 7 2.2.3 Knochenmark
Fragen-Aufbaukurs Wilsede 2007
 Fragen-Aufbaukurs Wilsede 2007 1.) Bei welcher der aufgeführten Erkrankungen spielen vaso-okklusive Komplikationen eine wesentliche Rolle? A - Alpha-Thalassämie, Majorform B - Beta-Thalassämie, Majorform
Fragen-Aufbaukurs Wilsede 2007 1.) Bei welcher der aufgeführten Erkrankungen spielen vaso-okklusive Komplikationen eine wesentliche Rolle? A - Alpha-Thalassämie, Majorform B - Beta-Thalassämie, Majorform
quer durch s rote Blutbild
 Eine Reise quer durch s rote Blutbild Interpretation und Differentialdiagnosen Dr. Elisabeth Dietl Abteilung Hämatologie, Onkologie und Palliativmedizin Systemerkrankungen Tumor-/Infekterkrankung, Niereninsuffizienz,
Eine Reise quer durch s rote Blutbild Interpretation und Differentialdiagnosen Dr. Elisabeth Dietl Abteilung Hämatologie, Onkologie und Palliativmedizin Systemerkrankungen Tumor-/Infekterkrankung, Niereninsuffizienz,
Tabelle 1: Altersverteilung der Patienten (n = 42) in Jahren
 3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
Leitsymptome und Leitbefunde bei Hund und Katze
 MemoVet Leitsymptome und Leitbefunde bei Hund und Katze Differenzialdiagnostischer Leitfaden Bearbeitet von Christian F Schrey Neuausgabe 2005. Taschenbuch. 462 S. Paperback ISBN 978 3 7945 2384 9 Format
MemoVet Leitsymptome und Leitbefunde bei Hund und Katze Differenzialdiagnostischer Leitfaden Bearbeitet von Christian F Schrey Neuausgabe 2005. Taschenbuch. 462 S. Paperback ISBN 978 3 7945 2384 9 Format
Mikroskopie in Vollendung
 Mikroskopie in Vollendung Labmed Schweiz / Suisse / Svizzera Ambassadoren-Weiterbildung 2012 Henk Jansen Sysmex Europe GMBH Manuelle Blutausstrich Prozedur Platzieren Sie einen kleinen Tropfen des venösen
Mikroskopie in Vollendung Labmed Schweiz / Suisse / Svizzera Ambassadoren-Weiterbildung 2012 Henk Jansen Sysmex Europe GMBH Manuelle Blutausstrich Prozedur Platzieren Sie einen kleinen Tropfen des venösen
Entzündung. Teil 18.
 Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Hämatologische Diagnostik in der Tiermedizin mit dem XT-2000iV: Fallbeispiel einer immunhämolytischen Anämie bei einer Katze
 Hämatologische Diagnostik in der Tiermedizin mit dem XT-2000iV: Fallbeispiel einer immunhämolytischen Anämie bei einer Katze Eine Anämie ist ein in der tierärztlichen Praxis häufig auftretendes Symptom
Hämatologische Diagnostik in der Tiermedizin mit dem XT-2000iV: Fallbeispiel einer immunhämolytischen Anämie bei einer Katze Eine Anämie ist ein in der tierärztlichen Praxis häufig auftretendes Symptom
Großes und kleines Blutbild
 13.06.2013 Großes und kleines Blutbild Seminar Klinische Chemie und Pathobiochemie Liv Skov Christensen, Christina Deutsch, Julia Feuchter, Carina Hubert, Svenja Pahl Gliederung Blutzusammensetzung Kleines
13.06.2013 Großes und kleines Blutbild Seminar Klinische Chemie und Pathobiochemie Liv Skov Christensen, Christina Deutsch, Julia Feuchter, Carina Hubert, Svenja Pahl Gliederung Blutzusammensetzung Kleines
Reaktive Veränderungen und Anomalien. Weiterbildung Labmed 29.11.2007. Dr. Luzius Schmid. Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.
 Reaktive Veränderungen und Anomalien Weiterbildung Labmed 29.11.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Allgemeines Hämopoietische Stamm - und Vorläuferzellen
Reaktive Veränderungen und Anomalien Weiterbildung Labmed 29.11.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Allgemeines Hämopoietische Stamm - und Vorläuferzellen
3. PHYSIOLOGISCHES KNOCHENMARK
 30 PHYSIOLOGISCHES KNOCHENMARK 3. PHYSIOLOGISCHES KNOCHENMARK 3.1. Grundlagen und Lichtmikroskopie 3.1.1. Literaturübersicht Bei der Besprechung der Physiologie der Hämatopoese wird davon ausgegangen,
30 PHYSIOLOGISCHES KNOCHENMARK 3. PHYSIOLOGISCHES KNOCHENMARK 3.1. Grundlagen und Lichtmikroskopie 3.1.1. Literaturübersicht Bei der Besprechung der Physiologie der Hämatopoese wird davon ausgegangen,
5.4 Lymphknotenzytologie
 Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Einführung, Zellen und Organe
 Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 Einführung, Zellen und Organe Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Stempel für Anwesenheit in der
Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 Einführung, Zellen und Organe Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Stempel für Anwesenheit in der
Blut (sanguis, haima) Lernziele: Allgemeines über das Blut: Bestandteile des Blutes: 1. Zelluläre Bestandteile (= Blutkörperchen): Blutplasma =
 Dozent: Dr. med. E. Ghebremedhin (Vorlesungsnotizen zum SS 2006) 1 Blut (sanguis, haima) Lernziele: - Blutzusammensetzung - Blutfunktion - Blutbildung und -abbau - Klinische Relevanz Allgemeines über das
Dozent: Dr. med. E. Ghebremedhin (Vorlesungsnotizen zum SS 2006) 1 Blut (sanguis, haima) Lernziele: - Blutzusammensetzung - Blutfunktion - Blutbildung und -abbau - Klinische Relevanz Allgemeines über das
Ergebnisse und Interpretation 54
 Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
8. Statistik Beispiel Noten. Informationsbestände analysieren Statistik
 Informationsbestände analysieren Statistik 8. Statistik Nebst der Darstellung von Datenreihen bildet die Statistik eine weitere Domäne für die Auswertung von Datenbestände. Sie ist ein Fachgebiet der Mathematik
Informationsbestände analysieren Statistik 8. Statistik Nebst der Darstellung von Datenreihen bildet die Statistik eine weitere Domäne für die Auswertung von Datenbestände. Sie ist ein Fachgebiet der Mathematik
Wie funktioniert mein Knochenmark? German Edition
 Wie funktioniert mein Knochenmark? German Edition Wie funktioniert mein Knochenmark? Illustrations by Kirk Moldoff Published by the Myelodysplastic Syndromes Foundation, Inc. 2014 Inhaltsverzeichnis Woraus
Wie funktioniert mein Knochenmark? German Edition Wie funktioniert mein Knochenmark? Illustrations by Kirk Moldoff Published by the Myelodysplastic Syndromes Foundation, Inc. 2014 Inhaltsverzeichnis Woraus
Myelodysplastisches Syndrom
 Myelodysplastisches Syndrom Diagnostik in 2014 Markus Radsak 25. Juni 2014 IIII. Medizinische Klinik und Poliklinik Mainzer Update MDS und AML Mit freundlicher Unterstützung von: 500,00 Im Rahmen eines
Myelodysplastisches Syndrom Diagnostik in 2014 Markus Radsak 25. Juni 2014 IIII. Medizinische Klinik und Poliklinik Mainzer Update MDS und AML Mit freundlicher Unterstützung von: 500,00 Im Rahmen eines
III. Ergebnisteil CD8 CD4. III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut
 27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
Die Theorie des Färbeprotokolls der Sysmex SP-Serie
 Einleitung Die Färbung von Blutausstrichen ist in medizinischen Laboratorien ein bekanntes Verfahren. Die klinische Relevanz dieser Analyse und ihre Interpretation ist sehr hoch. Im Allgemeinen werden
Einleitung Die Färbung von Blutausstrichen ist in medizinischen Laboratorien ein bekanntes Verfahren. Die klinische Relevanz dieser Analyse und ihre Interpretation ist sehr hoch. Im Allgemeinen werden
Liquorzytologisches Zuordnungstraining. Teil II. Zusammengestellt von Dr. rer. nat. Hans-Jürgen Kühn
 Liquorzytologisches Zuordnungstraining Teil II Zusammengestellt von Dr. rer. nat. Hans-Jürgen Kühn ehem. Universität Leipzig für INSTAND, Gesellschaft zur Förderung der Qualitätssicherung in medizinischen
Liquorzytologisches Zuordnungstraining Teil II Zusammengestellt von Dr. rer. nat. Hans-Jürgen Kühn ehem. Universität Leipzig für INSTAND, Gesellschaft zur Förderung der Qualitätssicherung in medizinischen
Thema: Blut- ein ganz besonderer Saft (O. Ammerpohl, Kiel)
 Sitzung der Mikrobiologischen Vereinigung Samstag, 19.11.2016 des Naturwissenschaftlichen Vereins in Hamburg http://www.mikrohamburg.de/ Thema: Blut- ein ganz besonderer Saft (O. Ammerpohl, Kiel) Das Blut
Sitzung der Mikrobiologischen Vereinigung Samstag, 19.11.2016 des Naturwissenschaftlichen Vereins in Hamburg http://www.mikrohamburg.de/ Thema: Blut- ein ganz besonderer Saft (O. Ammerpohl, Kiel) Das Blut
Referat Blut Teil 3: Leukämien
 n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
Blutspuren - Diagnostische Wegweiser aus dem Labor
 Blutspuren - Diagnostische Wegweiser aus dem Labor { Fallbeispiel 1: Check up, CLL bei erstgradig Verwandtem Mikroskopisches Differentialblutbild Die Leukozyten unter die Lupe genommen Neutrophiler Granulozyt
Blutspuren - Diagnostische Wegweiser aus dem Labor { Fallbeispiel 1: Check up, CLL bei erstgradig Verwandtem Mikroskopisches Differentialblutbild Die Leukozyten unter die Lupe genommen Neutrophiler Granulozyt
Was ist denn nun das Hauptproblem AA, PNH, MDS oder?
 Was ist denn nun das Hauptproblem AA, PNH, MDS oder? Dr. med. Sixten Körper Abteilung für Blutspende, Apherese und Hämotherapie Institut für Klinische Transfusionsmedizin und Immungenetik Ulm gemeinnützige
Was ist denn nun das Hauptproblem AA, PNH, MDS oder? Dr. med. Sixten Körper Abteilung für Blutspende, Apherese und Hämotherapie Institut für Klinische Transfusionsmedizin und Immungenetik Ulm gemeinnützige
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 1 Erkrankungen 489 3 164 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 1 Erkrankungen 489 3 164 Fälle
4.6. MR-tomographische Untersuchung an Leber, Milz und Knochenmark
 4.6. MR-tomographische Untersuchung an Leber, Milz und Knochenmark Die folgenden Darstellungen sollen einen Überblick über das Signalverhalten von Leber, Milz und Knochenmark geben. Die Organe wurden zusammen
4.6. MR-tomographische Untersuchung an Leber, Milz und Knochenmark Die folgenden Darstellungen sollen einen Überblick über das Signalverhalten von Leber, Milz und Knochenmark geben. Die Organe wurden zusammen
Diagnostik an Blutzellen
 Diagnostik an Blutzellen Was ist ein Blutbild? Was ist der Hämatokrit? Wie werden Zellen im Blut Untersucht? Marker zur Identifizierung von Zellen im Blut Diagnostik an Blutzellen Blut Plasma (ca. 55%)
Diagnostik an Blutzellen Was ist ein Blutbild? Was ist der Hämatokrit? Wie werden Zellen im Blut Untersucht? Marker zur Identifizierung von Zellen im Blut Diagnostik an Blutzellen Blut Plasma (ca. 55%)
Leukämie. weißes Blut, Blutkrebs. bösartige Erkrankung der weißen Blutkörperchen
 Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
2. Aachener Mikroskopierkurs, Stufe III Spezielle Hämatologie
 Klinik für Onkologie, Hämatologie Einladung und Programm Unter der Schirmherrschaft der DGHO 2. Aachener Mikroskopierkurs, Stufe III Spezielle Hämatologie Klinik für Onkologie, Hämatologie Prof. Dr. med.
Klinik für Onkologie, Hämatologie Einladung und Programm Unter der Schirmherrschaft der DGHO 2. Aachener Mikroskopierkurs, Stufe III Spezielle Hämatologie Klinik für Onkologie, Hämatologie Prof. Dr. med.
