Amtliche Methodensammlung
|
|
|
- Sophia Luisa Haupt
- vor 8 Jahren
- Abrufe
Transkript
1 Amtliche Methodensammlung Stand: Dezember 2011 Herausgeber Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald-Insel Riems Internet: Redaktion Dr. C. Probst, H. Kubitza Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Institut für Epidemiologie Seestraße Wusterhausen
2 Inhaltsverzeichnis Einleitung... 3 Nationale Referenzlaboratorien Affenpocken Afrikanische Pferdepest Afrikanische Schweinepest (ASP) Amerikanische Faulbrut Ansteckende Blutarmut der Einhufer Ansteckende Blutarmut der Lachse (ISA) Ansteckende Schweinelähmung (Teschener Krankheit) Aujeszkysche Krankheit (AK) Aviäre Influenza Befall mit dem Kleinen Beutenkäfer (Aethina tumida) Befall mit der Tropilaelaps-Milbe Beschälseuche der Pferde Blauzungenkrankheit Bovine Herpesvirus Typ 1-Infektion (alle Formen) Bovine Spongiforme Enzephalopathie (BSE) Bovine Virus Diarrhoe (BVD) Brucellose der Rinder, Schweine, Schafe und Ziegen Campylobacteriose (thermophile Campylobacter) Echinokokkose Enzootische Leukose der Rinder Epizootische Hämatopoetische Nekrose (EHN) Epizootische Hämorrhagie der Hirsche Epizootisches Ulzeratives Syndrom (EUS) Infektion mit Bonamia exitiosa Infektion mit Bonamia ostrea Infektion mit Marteilia refringens Infektion mit Microcytos mackini Infektion mit Perkinsus marinus Infektiöse Hämatopoetische Nekrose der Salmoniden (IHN), Virale Hämorrhagische Septikämie der Forellen (VHS) Koi-Herpesvirus-Infektion (KHV) Lumpy-skin-Krankheit (Dermatitis nodularis) Lungenseuche der Rinder Maul- und Klauenseuche Milzbrand Newcastle-Krankheit (ND) Nipah/Hendra Virus Infektion Paratuberkulose Pferdeenzephalomyelitis (alle Formen) Pockenseuche der Schafe und Ziegen Psittakose Q-Fieber Rauschbrand Rifttal-Fieber (RVF) Rinderpest Rotz FLI 1
3 46. Salmonellose der Rinder Schweinepest (KSP) Stomatitis vesicularis Taura-Syndrom Tollwut Transmissible Spongiforme Enzephalopathie (Scrapie) Trichomonadenseuche des Rindes Tuberkulose der Rinder Tularämie Vesikuläre Schweinekrankheit (SVD) Vibrionenseuche der Rinder Weißpünktchenkrankheit der Krebstiere West-Nil-Virus-Infektion (WNV) Yellowhead Disease (YHD) Durch Zecken übertragene Krankheiten Frühsommer-Meningoenzephalitis FLI 2
4 Einleitung Nach 4 Absatz 3 Tierseuchengesetz (TierSG) veröffentlicht und aktualisiert das Friedrich-Loeffler-Institut (FLI) unter Mitwirkung wissenschaftlicher Sachverständiger die Amtliche Sammlung von Verfahren zur Probenahme und Untersuchung von Untersuchungsmaterial tierischen Ursprungs für anzeigepflichtige Tierseuchen (Methodensammlung). Diese stellt eine Auflistung der Testprinzipien dar, die in Deutschland zur Labordiagnose von anzeigepflichtigen Tierseuchen und (ausgewählten) meldepflichtigen Tierkrankheiten angewendet werden können. Dabei gilt stets der Grundsatz, dass die nach 17 c Absatz 1 des TierSG vom FLI zugelassenen und unter abrufbaren Diagnostika anzuwenden sind. Diese Liste wird regelmäßig aktualisiert. Im Fall, dass für bestimmte Anwendungen keine zugelassenen Diagnostika zur Verfügung stehen, sind die von den entsprechenden Nationalen Referenzlaboratorien festgelegten Methoden zu verwenden. Der Einsatz neuer Methoden und Protokolle ist mit dem zuständigen Nationalen Referenzlabor abzustimmen. Die Methodensammlung mit Stand vom 08. Dezember 2011 berücksichtigt die Verordnung über anzeigepflichtige Tierseuchen (TierSeuchAnzV) in der Fassung der Bekanntmachung vom 19. Juli 2011 (BGBl. I S. 1404) sowie die Verordnung über meldepflichtige Tierkrankheiten in der Fassung der Bekanntmachung vom 11. Februar 2011 (BGBl. I S. 252), die durch Artikel 2 der Verordnung vom 19. Juli 2011 (BGBl. I S. 1403) geändert worden ist. Da für die Ansteckende Schweinelähmung (Teschener Krankheit) die Anzeigepflicht weggefallen ist, wird in der der Methodensammlung kein nationales Referenzlabor mehr dafür benannt; Die Methodenbeschreibung finden Sie unter der Rubrik der sonstigen Krankheiten. Auch die Psittakose wurde aus der Anzeigepflicht herausgenommen. Sie wird jetzt unter der Bezeichnung Chlamydiose subsummiert und ist somit meldepflichtig. Desweiteren wurde die bei der Brucellose die Einschränkung außer B. ovis gestrichen, so dass jetzt alle Formen der Brucellose (inkldusive ovine Epididymitis) der Anzeigepflicht unterliegen. Die Falldefinitionen (Voraussetzungen für die Feststellung eines Falles und dessen Meldung im Tierseuchennachrichtensystem TSN) können unter abgerufen werden. FLI 3
5 Nationale Referenzlaboratorien Nationale Referenzlabore für anzeigepflichtige Tierseuchen: Tierseuche Affenpocken Afrikanische Pferdepest Afrikanische Schweinepest Amerikanische Faulbrut Ansteckende Blutarmut der Einhufer Ansteckende Blutarmut der Lachse (ISA) Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Frau Dr. S. Blome sandra.blome@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Marc O. Schäfer marc.schaefer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald -Insel Riems Leiter: Frau Dr. P. König patricia.koenig@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Frau Dr. H. Schütze heike.schuetze@fli.bund.de Telefon: Telefax: FLI 4
6 Tierseuche Aujeszkysche Krankheit Befall mit Kleinem Beutenkäfer (Aethina tumida) Befall mit Tropilaelaps-Milbe Beschälseuche der Pferde Blauzungenkrankheit Bovine Herpesvirus Typ 1-Infektion (alle Formen) Bovine Virus Diarrhoe Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. T. Müller Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Marc O. Schäfer marc.schaefer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Marc O. Schäfer marc.schaefer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Frau Dr. I. Moser irmgard.moser@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: PD Dr. M. Beer martin.beer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. H. Schirrmeier horst.schirrmeier@fli.bund.de Telefon: Telefax FLI 5
7 Tierseuche Brucellose der Rinder, Schweine, Schafe und Ziegen Enzootische Leukose der Rinder Epizootische Hämatopoetische Nekrose Epizootische Haemorrhagie der Hirsche Epizootisches Ulzeratives Syndrom Geflügelpest Infektion mit Bonamia exitosa Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. F. Melzer falk.melzer@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. D. Fichtner dieter.fichtner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Frau Dr. H. Schütze heike.schuetze@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. G. Kotterba guenter.kotterba@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald-Insel Riems Leiter: PD Dr. T. Harder timm.harder@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax: FLI 6
8 Tierseuche Infektion mit Bonamia ostreae Infektion mit Marteilia refringens Infektion mit Microcytos mackini Infektion mit Perkinsus marinus Infektiöse Epididymitis Infektiöse Hämatopoetische Nekrose der Salmoniden Koi Herpesvirus-Infektion der Karpfen Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: N.N. Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. D. Fichtner dieter.fichtner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax FLI 7
9 Tierseuche Lumpy-skin-Krankheit (Dermatitis nodularis) Lungenseuche der Rinder Maul- und Klauenseuche Milzbrand Newcastle-Krankheit Niedrigpathogene aviäre Influenza bei einem gehaltenen Vogel (Niedrigpathogene aviäre Influenza bei Wildvögeln ist meldepflichtig) Pest der kleinen Wiederkäuer Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. M. Heller martin.heller@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Haas bernd.haas@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Frau Dr. M. Elschner mandy.elschner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: PD Dr. C. Grund christian.grund@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald-Insel Riems Leiter: PD Dr. T. Harder timm.harder@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax FLI 8
10 Tierseuche Pferdeenzephalomyelitis (alle Formen) Pockenseuche der Schafe und Ziegen Rauschbrand Rifttal-Fieber Rinderpest Rotz Salmonellose der Rinder Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Prof. Dr. M. Groschup martin.groschup@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. C. Seyboldt christian.seyboldt@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Prof. Dr. M. Groschup martin.groschup@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Hoffmann bernd.hoffmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Frau Dr. M. Elschner mandy.elschner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. U. Methner ulrich.methner@fli.bund.de Telefon: Telefax: FLI 9
11 Tierseuche Schweinepest Stomatitis vesicularis Taura-Syndrom Tollwut Transmissible Spongiforme Enzephalopathie (alle Formen) Trichomonadenseuche der Rinder Tuberkulose der Rinder (Mycobacterium bovis und M. caprae) Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Frau Dr. S. Blome sandra.blome@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Haas bernd.haas@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Uwe Fischer uwe.fischer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. T. Müller thomas.mueller@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Prof. Dr. M. Groschup martin.groschup@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. K. Henning klaus.henning@fli.bund.de Telefon:: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Frau Dr. I. Moser irmgard.moser@fli.bund.de Telefon: Telefax: FLI 10
12 Tierseuche Vesikuläre Schweinekrankheit Vibrionenseuche der Rinder Virale Hämorrhagische Septikämie der Salmoniden Weißpünktchenkrankheit der Krebstiere West-Nil-Virus Infektion bei einem Vogel oder Pferd Yellowhead Disease Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. B. Haas bernd.haas@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. W. Müller wolfgang.mueller@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. D. Fichtner dieter.fichtner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Uwe Fischer uwe.fischer@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: PD Dr. M. Groschup martin.groschup@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. Uwe Fischer uwe.fischer@fli.bund.de Telefon: Telefax FLI 11
13 Nationale Referenzlabore für meldepflichtige Tierkrankheiten: Tierseuche Ansteckende Metritis des Pferdes (CEM) Campylobacteriose (thermophile Campylobacter) Chlamydiose Echinokokkose Equine Virus-Arteritis-Infektion Infektiöse Laryngotracheitis des Geflügels (ILT) Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. F. Melzer falk.melzer@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. H. Hotzel helmut.hotzel@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Dr. K. Sachse konrad.sachse@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: PD Dr. F. J. Conraths franz.conraths@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald -Insel Riems Leiter: Frau Dr. P. König patricia.koenig@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald -Insel Riems Leiter: Dr. W. Fuchs walter.fuchs@fli.bund.de Telefon: Telefax FLI 12
14 Tierseuche Maedi/Visna Paratuberkulose Q-Fieber Toxoplasmose Tularämie Verotoxin bildende Escherichia coli Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. D. Fichtner Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: Frau Dr. H. Köhler heike.koehler@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. K. Henning klaus.henning@fli.bund.de Telefon:: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. Gereon Schares gereon.schares@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: PD Dr. H. Tomaso herbert.tomaso@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Seestraße Wusterhausen Leiter: Dr. Lutz Geue lutz.geue@fli.bund.de Telefon: Telefax: FLI 13
15 Weitere Nationale Referenzlabore am Friedrich-Loeffler-Institut: Tierseuche Bunyavirale Erkrankungen (inklusive Hanta-Virus-Infektion) Caprine Arthritis und Enzephalitis Japanische Enzephalitis Krebstierkrankheiten (Baculovirose, Infektiöse hypodermale und hämatopoetische Nekrose, Krebspest, Spawner-isolated mortality virus disease, Infektion mit Ranavirus Muschelkrankheiten (Perkinsus olseni, Xenohalitiosis californiensis, Abalone Virussterblichkeit) Nipah / Hendra Virus Infektion Zecken-übertragene Krankheiten (ZÜK) Nationales Referenzlabor Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: PD Dr. Rainer Ulrich rainer.ulrich@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. D. Fichtner dieter.fichtner@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Prof. Dr. M. Groschup martin.groschup@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald Insel Riems Leiter: Dr. U.. Fischer uwe.fischer@fli.bund.de Telefon: Telefax: Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Dr. S. Bergmann sven.bergmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Südufer Greifswald - Insel Riems Leiter: Frau Dr. A. Balkema-Buschmann anne.buschmann@fli.bund.de Telefon: Telefax Friedrich-Loeffler-Institut Bundesforschungsinstitut für Tiergesundheit Naumburger Str. 96 a Jena Leiter: PD Dr. J. Süss jochen.suess@fli.bund.de Telefon: Telefax: FLI 14
16 1. Affenpocken In Deutschland anzeigepflichtig seit Inkrafttreten der Verordnung (EG) Nr. 1398/2003 der Kommission vom 5. August 2003 zur Änderung von Anhang A der Richtlinie 92/65/EWG des Rates zwecks Aufnahme des kleinen Bienenstockkäfers (Aethina tumida), der Tropilaelapsmilbe (Tropilaelaps spp.), der Ebola und der Affenpocken Voraussetzungen für die Feststellung eines Falles Erregernachweis (nur durch das FLI durchzuführen) Direkter Erregernachweis Virusisolierung Antigennachweis Genomnachweis Elektronenmikroskopie Zellkultur ELISA PCR FLI 15
17 2. Afrikanische Pferdepest 2.1. Charakterisierung der Infektion Erreger Der Erreger ist ein dsrna Orbivirus der Familie Reoviridae. Neun verschiedene Serotypen des Afrikanischen Pferdepest Virus (African Horse Sickness Virus, AHSV) sind bekannt Klinische Symptomatik Die Afrikanische Pferdepest ist eine meist tödlich verlaufende Erkrankung der Equiden. Der Erreger ist ein dsrna Orbivirus der Familie Reoviridae. Das Virus wird durch Arthropoden der verschiedenen Culicoides-Spezies übertragen und das Auftreten der Krankheit ist saisonal bedingt. Die klinischen Erscheinungen sind durch Kreislaufstörungen und respiratorische Symptome gekennzeichnet. Die Krankheit kommt endemisch in Afrika südlich der Sahara vor, einzelne Ausbrüche treten auch in Nordafrika, im Mittleren Osten und in Europa (Spanien u. Portugal) auf. Es gibt vier klassische klinische Verlaufsformen: 1. die pulmonale Form 2. die Herzform 3. die gemischte Verlaufsform (Herz- und Lungenaffektion) 4. das Pferdepest-Fieber Differentialdiagnostik Obwohl die klinischen Zeichen meist charakteristisch sind, ist die Labordiagnose wegen der leichten Verwechslungsmöglichkeit mit anderen Pferdekrankheiten essentiell. Als Virus-Differentialdiagnostik kommen in Frage: Arthropoden-übertragene Pferdenzephalitiden (VEE, WEE, EEE) sowie Pferde-Arteriitis Diagnostische Indikation siehe Richtlinie 92/35/EWG Zuständige Untersuchungseinrichtung FLI, Institut für Virusdiagnostik, Südufer 10, Insel Riems Rechtsgrundlagen Richtlinie 92/35/EWG, Richtlinie 90/426/EWG, Entsch. 2002/160/EC Amtliche Methodensammlung für anzeigepflichtige Tierseuchen FLI 16
18 2.2. Untersuchungsmaterial Gerinnungsgehemmtes Blut (EDTA-Blut) Gewebestücke von Milz, Lunge oder Lymphknoten (post mortem) Versand bei +4 C oder auf Trockeneis, wenn das Material bereits gefroren gelagert ist 2.3. Untersuchungsgang Erregernachweis (NUR DURCH DAS FLI DURCHZUFÜHREN) Virusisolierung In BHK- oder Vero-Zellen: cpe zwischen 2. bis 8. Tag p.i. Polymerase Kettenreaktion (PCR) Basierend auf Empfehlungen des spanischen EU-Referenzlabors wurden verschiedene real-time RT-PCR-Systeme etabliert, die eine schnelle, sensitive und spezifische Detektion der AHSV-RNA aller 9 Serotypen erlauben (Fernández-Pinero et al., 2009 und Agüero et al., 2008). Darüber hinaus stehen konventionelle PCR-Systeme zum Nachweis von AHSV-RNA zur Verfügung, wobei die Primer zum 5 - (nt 1-21) und 3 - Ende (nt ) der RNA von Segment 8 komplementär sind (Sakamoto et al., 1994). Antikörpernachweis (NUR DURCH FLI DURCHZUFÜHREN) Der Antikörpernachweis ist die wichtigste Aufgabe im Rahmen der ständigen Export-/ Import-Kontrollen. Die Antikörper-Untersuchungen werden mittels Kompetitions- ELISA durchgeführt. Als weitere ergänzende serologische Untersuchungen sind beschrieben: Immunoblotting, die KBR und der Virus-NT nach dem OIE Manual of Standards for Diagnostic Tests and Vaccines. Literatur Fernández-Pinero J, Fernández-Pacheco P, Rodríguez B, Sotelo E, Robles A, Arias M, Sánchez-Vizcaíno JM. (2009): Rapid and sensitive detection of African horse sickness virus by real-time PCR. Res Vet Sci. 86 (2) Agüero M, Gómez-Tejedor C, Angeles Cubillo M, Rubio C, Romero E, Jiménez- Clavero A. (2008): Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. J Vet Diagn Invest. 20(3) Sakamoto K, Punyahotra R, Mizukoshi N, Ueda S, Imagawa H, Sugiura T, Kamada M, Fukusho A. (1994): Rapid detection of African horsesickness virus by the reverse transcriptase polymerase chain reaction (RT-PCR) using the amplimer for segment 3 (VP3 gene). Arch Virol. 136 (1-2) FLI 17
19 3. Afrikanische Schweinepest (ASP) 3.1. Charakterisierung der Infektion Erreger Die Afrikanische Schweinepest (ASP) wird durch ein dsdns-virus aus der Familie der Asfarviridae verursacht Klinische Symptomatik ASP ist eine hochkontagiöse, perakut bis chronisch verlaufende Infektion von Hausund Wildschweinen. Sie ist klinisch nicht von der Klassischen Schweinepest (KSP) zu unterscheiden und wird durch den Nachweis von ASP-Virus oder ASPspezifischen Ak festgestellt. Latent mit ASP infizierte Wildschweine bzw. Schweine aus infizierten Gebieten bilden ein permanentes Risikopotential für deutsche Hausund Wildschweine. Als Einschleppungswege sind insbesondere lebende Schweine, Samen, tierische Erzeugnisse, tierische Rohstoffe, Speiseabfälle und infizierte Zecken denkbar. Die Virusausscheidung beginnt bei Schweinen am 1. bis 4. Tag p. i. und kann bei Tieren, die die Krankheit überleben, gelegentlich über 12 Monate andauern. Die Übertragung zwischen Hausschweinen kann durch direkte oder indirekte Kontakte bzw. über kurze Entfernungen aerogen erfolgen. Die klinischen Symptome können in Abhängigkeit von der Virulenz der Stämme sehr unterschiedlich sein. Sie reichen von deutlichen Veränderungen mit hoher Mortalität bis hin zu kaum erkennbaren subklinischen Verläufen. Infizierte Schweine serokonvertieren i.d.r. nach etwa einer Woche. Die im EU-Recht angenommene maximale Inkubationszeit beträgt 45 Tage. Gegen ASP gibt es keinen Impfstoff Differentialdiagnose Da ASP klinisch und pathologisch-anatomisch nicht von KSP unterschieden werden kann, ist eine labordiagnostische Differentialdiagnose zwingend erforderlich Diagnostische Indikation Gemäß Schweinepest-Verordnung Zuständige Untersuchungseinrichtung Friedrich-Loeffler-Institut, Südufer 10, Greifswald-Insel Riems, Tel FLI 18
20 Rechtsgrundlagen Verordnung zum Schutz gegen die Schweinepest und die Afrikanische Schweinepest in der jeweils gültigen Fassung Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Richtlinie 2002/60/EG sowie Entscheidung 2003/422/EG (Diagnostik-Handbuch) 3.2. Untersuchungsmaterial Für die Probenziehung ist die Entscheidung 2003/422/EG (Diagnostik-Handbuch) maßgeblich. Die folgenden Ausführungen dienen daher nur der Erläuterung bzw. Konkretisierung des Vorgehens in Deutschland. In Deutschland kann ein ASP-Verdacht, außer bei Hinweisen auf Kontakt mit Tieren, Personen oder Erzeugnissen aus ASP-verseuchten Gebieten (z. B. Sardinien, Afrika), dann entstehen, wenn bei klinischen und pathologisch-anatomischen Hinweisen auf Schweinepest der Verdacht auf die klassische Schweinepest im Labor nicht bestätigt werden kann. Insofern ist bei Verdacht auf Schweinepest in bisher nicht betroffenen Regionen auch daran zu denken, dass eine Untersuchung auf ASP notwendig werden könnte. Es ist daher zu empfehlen, geeignetes Probenmaterial gekühlt bei +4 C auch für eine ASP-Untersuchung zurückzuhalten. Falls ein Bestand mit unklarem Krankheitsbild, bei dem eine Untersuchung auf ASP in Frage kommen könnte, getötet und unschädlich beseitigt wird, sollten geeignete Proben gekühlt sichergestellt werden. Die Probenverpackung muss den ADR-Vorschriften entsprechen, auf jeden Fall aber flüssigkeitsdicht sein und äußerlich gut desinfiziert werden (z. B. mit 2 % NaOH). Sie darf außerhalb des zuständigen Labors nicht mehr geöffnet werden. Frische Proben sind gekühlt, aber nicht gefroren zu versenden (Hinweis: Falls nur gefroren aufbewahrte Proben zur Verfügung stehen, sind diese im Ausnahmefall einzusenden, da bestimmte Nachweisverfahren auch bei gefrorenen Proben anwendbar sind). Proben sind nach Möglichkeit per Kurier zum Friedrich-Loeffler-Institut, Südufer 10, Greifswald - Insel Riems zu schicken. Sie sind in jedem Fall telefonisch anzukündigen ( ). Bei einem ASP-Verdacht sind gekühlt, aber nicht gefroren, einzusenden: Blut, gerinnungsgehemmt (Heparin, 100 IU/ml, EDTA oder Na-Zitrat), 10 bis 20 ml je Tier. Hinweis: Empfohlen werden wassergefüllte Kühlakkus, die zu einer Temperatur von etwas über 0 C führen; CO 2 -Trockeneis ist nicht zu verwenden. Aus Untersuchungseinrichtungen oder von Schlachthöfen: Serum, 1 ml Lymphknoten, insbesondere der inneren Organe sowie Mandibular- und RetropharyngealLn Milz, Tonsillen, Lunge, Niere zusätzlich möglich: ungeöffnetes Brustbein. FLI 19
21 Blutproben mit Gerinnungshemmer und Seren sind von einer größeren Zahl von Tieren einzusenden. Das Diagnostik-Handbuch enthält Festlegungen hierzu und auch zur Untersuchung klinisch unauffälliger Kontaktbestände. Organproben sind möglichst von ausgewählten klinisch kranken bzw. pathologisch auffälligen Tieren einzusenden. Zu den Organproben ist ein Vorbericht über das Tier (Klinik, Pathologie) zu übermitteln. Abbildung 1: Diffuse Blutungen im Mandibularlymphknoten Abbildung 2: Petechien in der Niere Abbildung 3: Splenomegalie FLI 20
22 Im Anschreiben ist anzugeben: Wer sendet ein? (Veterinäramt, Bearbeiter; incl. dienstlicher und eventuell privater Telefon- und Fax-Nummer) Was wird eingesandt? (Art des Materials, von welchen Tieren, Anzahl etc.) Aus welchem Bestand stammen die Proben? Was wurde wann in dem Bestand festgestellt? (anamnestischer Kurzbericht) Zusätzliche Angaben, soweit möglich: Wie groß ist der Bestand? Tierarten? Art des Bestandes (Zucht-, Mast-, Händlerbestand etc.)? Bestehen Kontakte zu ASP-verseuchten Gebieten? Bestehen Hinweise auf Speiseabfallverfütterung? Bemerkungen und weitere Hinweise auf eine mögliche Erregereinschleppung Untersuchungsgang (NUR DURCH FLI DURCHZUFÜHREN) Für die Untersuchung ist die Entscheidung 2003/422/EG (Diagnostik-Handbuch) maßgeblich. Die folgenden Ausführungen dienen daher nur der Erläuterung bzw. Konkretisierung des Vorgehens in Deutschland. Eine ASP-Infektion wird am FLI, Insel Riems, diagnostiziert durch den Nachweis von ASP-spezifischer Nukleinsäure (DNS) in Organen, Blut oder Leukozytenkulturen, infektiösem ASP-Virus aus Organen oder Blut, ASP-spezifischem Antigen in Organen, Blut oder Leukozytenkulturen, ASP-spezifischen Antikörpern Nukleinsäurenachweis in der real-time PCR: Zeitaufwand: ca. 1 Tag; positive Ergebnisse sind in einer zweiten, konventionellen PCR (OIE-Methode) zu überprüfen (1 bis 2 Tage) Virusisolierung in Leukozytenkultur (Hämadsorption, CPE, Immunfluoreszenz): Zeitaufwand: 1. Passage ca. 10 Tage, 2. Passage ca. 10 weitere Tage. Die Hämadsorption kann in Abhängigkeit vom Virusstamm und dem Vorliegen von Antikörpern verzögert sein oder ausbleiben. Abschließend ist ein IFT durchzuführen. (Heute nur noch in Sonderfällen relevant ist die Virusisolierung mittels Tierversuch; Zeitaufwand: ca. 3 Wochen; bei deutlichen klinischen Erscheinungen im Herkunftsbestand der Proben spricht das Ausbleiben von Fieber bei parenteral infizierten Versuchstieren über etwa eine Woche gegen das Vorliegen der ASP.) FLI 21
23 Antigen-Nachweis mittels ELISA oder direkter Immunfluoreszenz: Zeitaufwand: ca. 1 Tag. Der Antigennachweis gelingt i.d.r. nur in den ersten Tagen der Infektion, da später das Antigen durch Antikörper maskiert, d. h. blockiert wird, so dass falsch negative Ergebnisse auftreten können Antikörpernachweis im ELISA (Kompetitions-ELISA) Zeitaufwand: ca. 1 Tag, positive Ergebnisse sind mittels Western Blot oder indirekter Immunfluoreszenz zu überprüfen Im Falle der Einschleppung der ASP können serologische Flächenuntersuchungen erforderlich werden, die mit kommerziell erhältlichen, nicht infektiösen ELISAs in Untersuchungsämtern durchzuführen sind. Für diese gelten dann nach der Entscheidung 2003/422/EG spezielle biohygienische Anforderungen, die aber geringer sind als für Laboratorien, in den das Virus vermehrt werden darf (u. a. kein Unterdruck erforderlich). FLI 22
24 4. Amerikanische Faulbrut 4.1. Charakterisierung der Infektion Erreger Das Bakterium Paenibacillus larvae (vormals Bacillus larvae) kann immer in an Amerikanischer Faulbrut erkrankter Brut gefunden werden. Aufgrund von DNA-Analysen konnten verschiedene Genotypen nachgewiesen werden. Als Wirt ist ausschließlich die Honigbiene bekannt. Die Sporen sind sehr widerstandsfähig und bleiben über Jahrzehnte infektiös Klinische Symptomatik Je nach Genotyp tötet der Erreger die Brut vor oder nach der Verdecklung ab. Die Zelldeckel sind eingesunken und oft löchrig. Die Brut hat sich zu einer breiigen, kaffeebraunen Masse zersetzt, die in der Regel deutlich Fäden zieht. Nach etwa einem Monat trocknet die tote Brut ein und bildet in der unteren Zellrinne schwarzbraune Schorfe, die sich nur schwer entfernen lassen. Die Inkubationszeit kann je nach Infektionsdosis und Genotyp wenige Wochen bis einige Monate betragen. Weiterhin spielt der Zustand des Bienenvolks eine wesentliche Rolle. Bei geschwächten Tieren bricht die Erkrankung in der Regel schneller aus Differentialdiagnostik Das klinische Bild der Amerikanischen Faulbrut ist dem der Europäischen (Gutartigen) Faulbrut sehr ähnlich. An Amerikanischer Faulbrut eingegangene Brut bildet aber in der Regel einen schleimigen Faden und fest mit dem Zellboden verbundenen Schorf (siehe Abbildungen 1 und 2). Nur in der vegetativen Phase in junger Brut treten keine deutlichen Symptome auf. Bei Mischinfektionen mit Melissococcus pluton, dem Erreger der Europäischen Faulbrut, oder Viren (ABPV und SBV) ist eine Differentialdiagnose anzuraten. Abbildung 1: Hinweis auf eine Infektion mit Amerikanischer Faulbrut: Der Wabeninhalt bleibt fadenartig am Streichholz kleben (= fadenziehende Masse) Abbildung 2: Von Amerikanischer Faulbrut befallene Brutwabe mit verfärbten, löchrigen Zelldeckeln. Die in der Brutzelle verbleibende Masse ist schon zu Schorfen eingetrocknet. FLI 23
25 Diagnostische Indikation Tierverkehr Klinischer oder epidemiologischer Verdacht Untersuchung im Rahmen des Nachweises der Seuchenfreiheit (Gesundheitszeugnisse für das Verbringen der Bienenvölker an einen anderen Standort) Verdacht aufgrund des hohen Sporenanteils im Futter Zuständige Untersuchungseinrichtungen Veterinäruntersuchungsämter, Tiergesundheitsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer oder die von den Ländern beauftragten staatlichen Einrichtungen. Chemisches und Veterinäruntersuchungsamt Freiburg, Tierhygiene, Am Moosweiher 2, Freiburg (Referenzlabor für Bienenkrankheiten des OIE), Tel.: 0761/ Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Südufer 10, Greifswald Insel Riems (NRL für Bienenkrankheiten), Tel.: / Rechtsgrundlagen Bienenseuchenverordnung vom (BGBl. I S. 1552) in der jeweils geltenden Fassung 4.2. Untersuchungsmaterial Untersuchungsmaterial Brut Verdächtige Brutwaben werden möglichst vollständig im Rahmen eingesandt und untersucht. Nur so ist eine Untersuchung auf klinische Symptome möglich. Um die veränderten Brutzellen identifizieren zu können und eine Kontamination durch auslaufendes Futter zu verhindern, sollten die Waben zunächst in Papier und anschließend in Plastikfolie eingepackt und in einem stabilen Karton versandt werden. Die Waben sollten möglichst frisch entnommen sein und eventuell kühl gelagert werden. Einfrieren verändert die Symptome ohne jedoch den Erregernachweis zu beeinflussen Untersuchungsmaterial Futter Futterproben werden aus dem Bereich des Futterkranzes aus Brutwaben entnommen. Die Brut sollte ebenso wie das Futter gedeckelt sein, d. h. älter bzw. länger gelagert sein. Werden Proben in anderen Bereichen des Bienenstockes entnommen oder während Nektar bzw. Honigtau oder Futter eingetragen wird, so hat ein negativer Befund keine Aussagekraft. FLI 24
26 4.3. Untersuchungsgang Mikroskopischer Erregernachweis Paenibacillus larvae ist ein grampositives, peritrich begeißeltes Stäbchen von sehr variabler Größe (zwischen 0,5 und 0,8 μm Breite bzw. 2,5 und 5 μm Länge). Die ovalen Sporen sind doppelt so lang wie breit (0,6 bis 0,7 bzw. 1,1 bis 1,9 μm). Zur mikroskopischen Untersuchung wird die verdächtige Brut oder fadenziehende Masse mit einer Pinzette oder Impföse entnommen. Schorfe sollten mit einer sterilen 0,9 %igen NaCl-Lösung suspendiert werden. Es wird entweder ein natives oder gefärbtes Präparat hergestellt. Hierzu wird das Untersuchungsmaterial direkt auf dem Objektträger ausgestrichen, luftgetrocknet und die vegetativen Formen nach Gram oder Giemsa und die Sporen nach Rakette gefärbt. Bei 1000-facher Vergrößerung (Ölimmersion) können die vegetativen Formen und die Sporen leicht erkannt werden. Die Geißeln werden erst nach ihrer Ablösung und Zusammenlagerung zu Geißelzöpfen sichtbar. Ihr Nachweis gelingt im direkten Präparat nur selten, nach vorheriger Anzucht in Columbia-Blut-Schrägagar nach Plagemann (siehe dort) aber immer Kulturmethoden Ein sicheres Erkennen und weitere biochemische Tests sind nur nach vorheriger Anzucht des Paenibacillus larvae mit speziellen Kulturmethoden möglich. Paenibacillus larvae wächst sowohl in Nährbouillon mit Pepton und Dextrose als auch in Serumbouillon mit Dextrose. Diese können auch zur Anreicherung des Bakteriums verwendet werden. Als Nährböden haben sich Columbia-Blut-Agar (CSA) und MYPGP-Agar am besten bewährt. Ein Zusatz von Nalidixinsäure (3 mg auf 1 Liter Agar) verhindert das Wachstum von vielen Keimen. Der Nachweis der Geißelzöpfe erfolgt auf Columbia-Blut-Schrägagar nach Plagemann (1985). Der beimpfte Schrägagar wird 3 bis 4 Tage bei 37 bis 38 C im Brutschrank belassen. Danach wird etwas Flüssigkeit vom Boden des Reagenzglases auf einen Objektträger gegeben und nach dem Trocknen hitzefixiert. Die Geißelzöpfe können am besten im Phasenkontrast oder mit Nigrosin sichtbar gemacht werden. Identifizierung der Kolonien Die Kolonien des Paenibacillus larvae auf MYPGP-Agar sind weiß und können leicht anhand ihrer konkaven Form und rauen Oberfläche erkannt werden. Zusätzlich kann man einen biochemischen Test, insbesondere den Katalase-Test durchführen. Auf Columbia-Blutagar sind die Kolonien je nach Typ grau-weißlich bis orange pigmentiert. Die Untersuchung von Futter- oder Honigproben auf Sporen des Paenibacillus larvae gehört zu den Standardmethoden im Routinelabor, da sie bei der staatlichen Seuchenbekämpfung anstelle einer zweiten klinischen Untersuchung gezielt eingesetzt wird. Als Nährböden eignen sich MYPGD-Agar und Columbia-Schafsblut-Agar. Neben den gezogenen Proben werden pro Untersuchungsreihe jeweils eine negative und positive Probe mitgeführt. Die Proben werden zur leichteren Verarbeitung auf 34 C erwärmt. Jeweils 5 g der bei Bedarf grob gefilterten Futter- bzw. Honigprobe und 5 ml steriles entmineralisiertes Wasser werden im Reagenzglas mit Hilfe eines Schüttlers bzw. Rührers homogenisiert. FLI 25
27 Alle Proben werden im auf 90 C ± 1 C vorgeheizten Wasserbad 6 Minuten lang erhitzt, um die Sporen anderer Bakterien und Pilze weitgehend abzutöten. Aus jedem Reagenzglas werden mindestens 100 μl der Suspension auf jeweils mindestens drei Platten pipettiert und mit einem Drigalski-Spatel ausgespatelt. Die Kulturen werden 6 Tage aerob im Brutschrank bei 37 C bebrütet. Im Begasungsbrutschrank mit 5 % Kohlendioxid reichen 4 Tage aus. Die gewachsenen Kolonien werden zunächst anhand ihrer äußeren Charakteristika differenziert. Zur weiteren Bestimmung kann ein Katalase-Test durchgeführt werden (siehe dort). Die Zahl der Kolonieformen mit negativem Katalase-Test kann man mit einem Kulturzählgerät bestimmen. Können die Kolonien nicht mehr gezählt werden, legt man entweder einen Verdünnungsausstrich an oder verdünnt die Ausgangsprobe entsprechend. Zur endgültigen Absicherung wird eine Kolonie auf Columbia-Blut-Schrägagar überimpft (Plagemann, 1985) und 3 bis 4 Tage lang bei 37 C bebrütet. In der Flüssigkeit am Boden des Reagenzglases können z. B. mit Hilfe eines Nigrosin-Präparates oder im Phasenkontrast leicht Geißelzöpfe nachgewiesen werden, die auf Paenibacuillus larvae hinweisen. Da auch andere Bakterien Geißelzöpfe bilden können, wird zum sicheren Nachweis eine molekularbiologische Methode (PCR) empfohlen (siehe dort). Die Zahl der bei dieser Methode gewachsenen Kolonien gibt einen Hinweis auf einen möglichen Ausbruch der Amerikanischen Faulbrut. Ein Ausbruch der Seuche ist unwahrscheinlich, wenn keine Kolonien wachsen. Bei positivem Befund müssen die Bienenvölker auf klinische Symptome durchgeschaut werden. Erst wenn diese nachgewiesen werden, gilt die Seuche als ausgebrochen. Wenn eine vom NRL geprüfte Standardsporensuspension als positive Kontrolle mitgeführt wurde, kann die Zahl der gewachsenen Kolonien zusätzlich zum positiven Befund mit niedrig (weniger als der Standard) oder mit hoch (höher als der Standard) angegeben werden. Diese Angabe gibt einen Hinweis auf einen möglichen Ausbruch der Amerikanischen Faulbrut: Bei niedrig ist der Ausbruch eher unwahrscheinlich, bei hoch sehr wahrscheinlich Biochemischer Erregernachweis Biochemische Tests sind nicht eindeutig und sollten nur zur zusätzlichen Absicherung verwendet werden. Katalase-Test Der Katalase-Test mit 3 %igem Wasserstoffperoxyd eignet sich besonders zur zusätzlichen Identifizierung von auf Nährböden gewachsenen Kolonien des Paenibacillus larvae. Die meisten aerobischen Bakterien reduzieren mit ihrer Katalase das Wasserstoffperoxid unter Sauerstoffabspaltung zu Wasser. Bei Paenibacillus larvae kommt es zu keiner Gasbildung, die an der schäumenden Flüssigkeit sichtbar würde. Bei Kolonien auf Columbia-Blut-Agar bringt der Test ein falsches Ergebnis. Die Kolonie muss daher auf einen sauberen Objektträger übertragen werden. FLI 26
28 Molekularbiologische Methoden: PCR Für die schnelle Untersuchung von Brut mit klinischen Symptomen der AFB wird der Inhalt von zwei Brutzellen in 1 ml sterilen Wasser suspendiert und gründlich geschüttelt. 100 μl der Suspension werden mit 900 μl destillierten Wassers verdünnt. Von der im Vortex-Schüttler bearbeiteten Suspension werden 100 μl für die DNA Extraktion verwendet. Wenn Bakterienkolonien von Nährböden identifiziert werden sollen, wird eine Kolonie in 50 μl destillierten Wassers suspendiert und für 15 Minuten auf 95 C erhitzt. Nach der anschließenden Zentrifugation bei 5000 g für 5 Minuten werden 1 bis 5 μl des Überstandes als Template-DNA in einer 50 μl PCR Mixtur verwendet. Für die PCR Reaktion verläuft in einer Mixtur aus 5 μl Template-DNA, 50 pmol forward Primer (AFB-F) und reverse Primer (AFB-R), 10 nmol von Deoxynukleosid Triphosphat und 1-2,5 U von Taq-Polymerase in geeignetem PCR Puffer (wird zusammen mit Taq Polymerase angeboten) mit 2 mm MgCl 2. Die Amplifikation eines spezifischen DNA Fragments erfolgt im Thermozycler unter den folgenden Bedingungen: ein 95 C (1 bis 15 Minuten) Schritt, 30 Zyklen bei 93 C (1 Minute), 55 C (30 Sekunden) und 72 C (1 Minute) und ein letzter Zyklus bei 72 C (5 Minuten). Die Molekulargewichte der PCR-Produkte werden mit Hilfe der Elektrophorese in 0,8 % Agarose-Gel bestimmt und mit Ethidiumbromid gefärbt. Primer: AFB-F AFB-R 5`-CTTGTGTTTCTTTCGGGAGACGCCA-3 5`-TCTTAGAGTGCCCACCTCTGCG-3 Die Länge des Amplikons aus diesen Primern beträgt 1106 bp Serologische Tests Geprüfte Antiseren sind zurzeit nicht käuflich zu erwerben. FLI 27
29 5. Ansteckende Blutarmut der Einhufer 5.1. Charakterisierung der Infektion Erreger Die Infektiöse Anämie der Einhufer, auch bezeichnet als Equine infektiöse Anämie (EIA), ist eine systemische Viruserkrankung der Pferde, Ponys, Esel, Maultiere und Zebras. EIAV, ein Lentivirus aus der Familie der Retroviren, verursacht eine persistierende Infektion und vermehrt sich in Monozyten und Makrophagen. Der Erreger besitzt ein einzelsträngiges RNA-Genom positiver Polarität. Die Glykoproteine der Virushüllmembran zeigen eine kontinuierliche, langsame Veränderung der immunitätsinduzierenden Strukturen (Antigendrift). Das Hauptstrukturprotein p26 des Virusinnenkörpers ist hingegen konserviert und wird daher für die serologische Diagnose der EIA-Infektion herangezogen. Die Krankheit ist in Deutschland anzeigepflichtig und wird durch die Verordnung zum Schutz gegen die ansteckende Blutarmut der Einhufer (Stand 2000, BGBl. I S. 531) reglementiert, die eine Tötung positiver Tiere sowie Sperrung und Untersuchung der betroffenen Bestände und der Kontaktbetriebe vorschreibt. Immunprophylaxe oder Therapie sind nicht verfügbar. Eine Gefährdung des Menschen durch EIA liegt nicht vor. Vorkommen EIA ist weltweit verbreitet und tritt regional gehäuft in Nord- und Südamerika, Afrika, Asien, Australien sowie Süd- und Osteuropa auf. Sie kommt in nord- und mitteleuropäischen Länder nur sporadisch vor. Das Virus ist in Deutschland nicht heimisch, jedoch kommt es immer wieder zu vereinzelten EIA-Ausbrüchen. Die letzten Ausbrüche wurden im Jahr 2002 in Hessen und im Jahr 2006 in Sachsen und Thüringen registriert. Epidemiologie Die Übertragung erfolgt in erster Linie mechanisch durch große blutsaugende Insekten wie Pferdebremsen und Wadenstecher (Tabanus, Stomoxys). Diese können bei einer Unterbrechung der Blutmahlzeit infektiöses Blut an ihren Mundwerkzeugen auf ein benachbartes Tier übertragen. Das EIA-Virus bleibt nur für kurze Zeit infektiös (ca. 30 Minuten), daher kommt eine Übertragung durch Insektenvektoren über größere räumliche Distanzen hinweg nicht vor. EIA-Infektionen treten saisonal gehäuft in den vektorreichen Jahreszeiten (Sommer und Herbst) auf. Infizierte Tiere scheiden Virus mit Körpersekreten wie Speichel, Milch und Sperma aus. Eine Virusübertragung durch Exkrete erfordert einen sehr engen Kontakt der Tiere. Intrauterine Infektionen sind ebenfalls beschrieben. EIAV kann darüber hinaus durch infizierte biologische Produkte übertragen werden. Eine etwaige Verschleppung durch Injektionskanülen, tierärztliche Instrumente oder Pflegezubehör ist durch Verwendung von Einwegmaterial bzw. durch geeignete Desinfektions- und Hygienemaßnahmen auszuschließen. FLI 28
30 Klinische Symptomatik Infektionen mit Lentiviren, zu denen das EIAV gehört, sind dadurch charakterisiert, dass sie zu persistierenden Infektionen führen. Spezifische Antikörper sind zwei bis drei Wochen (in Ausnahmefällen bis zu 60 Tage) nach der Infektion nachweisbar. Aufgrund der stetigen Veränderung der Antigeneigenschaften des Virus führt die induzierte Immunantwort nicht zur Eliminierung des Erregers. Infizierte Tiere bleiben lebenslang Virusträger und stellen potentielle Infektionsquellen dar. Die Erkrankung zeigt sich in akuter oder chronischer Form mit jeweils vereinzelt tödlichem Verlauf. Die akute Verlaufsform äußert sich in Fieber, Apathie, Schwäche, Ataxie, Ikterus, Tachykardie, Arrhythmie sowie petechialen Blutungen auf Schleimhäuten und Lidbindehäuten sowie insbesondere auf der Zungenunterseite. Die chronische Verlaufsform ist hingegen durch Krankheitsschübe mit rekurrierenden Fieberanfällen, Konditionsverlust, Anämie sowie Ödembildung an Unterbauch und Extremitäten gekennzeichnet. Eine Anämie (Blutarmut) entsteht nach Infektion mit EIAV vorrangig durch immunpathologische Auflösung der roten Blutkörperchen, aber auch durch eine Störung ihrer Neubildung. Pathologische Veränderungen haben im akuten Stadium eher degenerativen (Lebernekrosen, fokale Blutungen) und im chronischen Stadium eher lymphoproliferativen Charakter (Hepatosplenomegalie, Hämosiderose, Lymphadenopathie). In 30 bis 90 % der Fälle treten keine Krankheitssymptome auf, die Tiere bleiben gesund erscheinende Virusträger, sogenannte asymptomatische Carrier Differentialdiagnostik Fieber, geringgradiger Ikterus und Nachhandschwäche werden auch bei Babesiose, Ehrlichiose und Leptospirose beobachtet. Ödembildung kann auch im Rahmen von Nephrosen, Nephritiden, Herz-, Kreislaufinsuffizienz und starkem Wurmbefall auftreten. Die immunvermittelte hämolytische Anämie (IMHA) kommt bei Pferden zwar selten vor, ist in Deutschland aber die häufigste Ursache einer hämolytischen Anämie. Akute Infektionsverläufe können dem klinischen Bild der Equinen Viralen Arteritis (EVA) ähneln. Eitrige Herdinfektionen können zu ähnlichen klinischen Befunden führen, wie sie bei dem chronischen Verlauf der EIAV-Infektion zu beobachten sind Diagnostische Indikation Gemäß Verordnung zum Schutz gegen die ansteckende Blutarmut der Einhufer Zuständige Untersuchungseinrichtungen Veterinäruntersuchungseinrichtungen der Länder Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Insel Riems: Nationales Referenzlabor für EIA am Institut für Virusdiagnostik Rechtsgrundlagen Verordnung zum Schutz gegen die ansteckende Blutarmut der Einhufer (Einhufer- Blutarmut-Verordnung) vom 02. Juli 1975 (BGBl. I S. 1845) in der jeweils geltenden Fassung (letzte Fassung vom ; BGBl. I S. 531) FLI 29
31 5.2. Untersuchungsmaterial Für die hämatologische Untersuchung gerinnungsgehemmte Blutprobe (EDTA, Heparin, Citrat) Für die serologische Untersuchung: Nativblutprobe oder Serum Für die virologische Untersuchung: gerinnungsgehemmte Blutprobe (EDTA [Anzucht!], Heparin, Citrat) Organmaterial (Leber, Milz, Niere) 5.3. Untersuchung Der Agargel-Immunodiffusiontest (AGID, Coggins-Test) ist der Test der Wahl für die Diagnosestellung. Der EIAV-Antikörper-ELISA (Enzyme Linked Immunosorbent Assay) beruht auf einem enzymatischen Nachweis der Antikörper und muss bei einer positiven Reaktion durch den AGID bestätigt werden. Der direkte Nachweis des Virus ist üblicherweise nicht notwendig, da davon ausgegangen wird, dass ein serologisch positives Tier das Virus beherbergt und es potentiell weiterverbreiten kann. Der Nachweis von viralem Erbmaterial aus Blut und Organmaterial ist mittels Polymerase-Kettenreaktion (PCR) möglich. Die Untersuchungen erfolgen nach dem O.I.E. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (2005, Part 2, Section 2.5, Chapter 2.5.4). Weiterführende Ergänzungen können der AVID-Methodensammlung entnommen werden ( Antikörpernachweis Von Pferden, die sich möglicherweise in einer frühen Infektionsphase befinden, sollte nach 1 bis 2 Wochen erneut eine Blutprobe untersucht werden. Um für Fohlen eine Aussage treffen zu können, muss der Antikörperstatus der Mutterstute bekannt sein. Falls im Blut der Stute Antikörper gegen EIAV nachgewiesen werden, kann der serologische Befund des Fohlens erst nach dem sechsten Lebensmonat beurteilt werden, da erst nach dieser Periode passiv übertragene maternale Antikörper abgebaut sind Agargel-Immunodiffusiontest (AGID, Coggins-Test) In den ersten zwei bis drei Wochen nach der Infektion fällt der Test üblicherweise negativ aus. In Ausnahmefällen können bis zum Auftreten nachweisbarer Antikörper bis zu 60 Tage vergehen. Präzipitierende Antikörper aus dem Testserum diffundieren in einem Agargel gegen ein ebenfalls diffundierendes Antigen (Kapsid/Core p26). Eine entstehende Präzipitationslinie ist dann als positiver Befund zu bewerten, wenn diese Bande mit der Präzipitationsbande des positiven Kontrollserums kommuniziert. Kommerzielle Testkits beinhalten rekombinantes diagnostisches Antigen und positives Kontrollserum. FLI 30
32 EIAV-Antikörper-ELISA (Enzyme Linked Immunosorbent Assay) Kommerzielle indirekte sowie blocking ELISA-Tests sind zum Nachweis von Antikörpern gegen p26 (Kapsid) oder gp45 (Transmembran-Glykoprotein) verfügbar. Aufgrund ihrer höheren Sensitivität und der schnellen Durchführung stellen sie eine sinnvolle Ergänzung zum Agargel-Immunodiffusiontest dar, insbesondere bei der Routineuntersuchung größerer Probenzahlen. Ein positives ELISA-Testergebnis muss im AGID verifiziert werden, da in den ELISA-Tests vereinzelt falsch positive Reaktionen auftreten können Virusnachweis Da das Virus im infizierten Tier persistiert, ist ein positiver serologischer Befund ausreichend für die Diagnosestellung der EIAV-Infektion. Die Virusisolierung ist zeitaufwändig, und die Durchführung ist nicht routinemäßig erfolgreich. EIAV kann in primären Makrophagen- und Leukozytenkulturen angezüchtet werden, in Pferdehaut- und Nierenzelllinien vermehrt sich das Virus deutlich schlechter. Eine nested Polymerase-Kettenreaktion (n-pcr) kann zum Genomnachweis eingesetzt werden (Nagarajan et al. 2001, J. Virol. Methods, 94, ). Der Nachweis viraler RNA erfolgt aus zellfreiem Material (Plasma, Serum), der Nachweis von integrierter proviraler DNA aus Blutzellen oder Organmaterial. Da die Viruslast sehr niedrig sein kann und die Sequenzen der zirkulierenden EIAV-Stämme auch im gag- Bereich (p26) variieren können, ist lediglich ein positiver PCR-Befund als aussagekräftig zu bewerten. Virus-Übertragungsversuche mit dem Blut verdächtiger Pferde können in Ausnahmefällen durchgeführt werden. 1 bis 25 ml Vollblut eines infizierten Tieres, in Einzelfällen bis zu 250 ml, werden benötigt, um nach intravenöser Inokulation eine Infektion in einem Empfängertier zu etablieren (Beobachtungszeitraum 45 Tage). FLI 31
33 6. Ansteckende Blutarmut der Lachse (ISA) 6.1. Charakterisierung der Infektion Die Infektiöse Anämie (Infectious Salmon Anemia, ISA) ist eine Infektionskrankheit der Atlantischen Lachse (Salmo salar) und wird durch ein Orthomyxovirus, dem ISA- Virus (ISAV), verursacht. Infizierte Lachsbestände sind in Kanada, Norwegen, den USA, den Färöer- und den Shetland-Inseln sowie in Schottland sowie in Irland bei Regenbogenforellen (Oncorhynchus mykiss) im Salzwasser nachgewiesen worden wurde in Chile ein ISA-Ausbruch beim pazifischen Silberlachs (O. kisutch) bestätigt. Dies ist somit die zweite Spezies, die für die ISAV empfänglich ist. Neben den beiden Lachsarten konnte ISAV aus der Meerforelle (Salmo trutta trutta), der Regenbogenforelle (O. mykiss) und dem Atlantischen Hering (Clupea harengus) isoliert werden. Diese Fischarten erkranken nicht, können aber offensichtlich als Überträger des Virus fungieren. Nach der Aquakultur-Richtlinie 2006/88/EG (1) gelten Regenbogenforelle (Oncorhynchus mykiss), Atlantischer Lachs (Salmo salar) und Forelle (Salmo trutta) als empfängliche Arten. Deutschland wurde bezüglich ISA 2009 von der EU-Kommission als seuchenfrei erklärt Erreger und seine Einordnung Die ISA wird durch ein behülltes Virus hervorgerufen, welches morphologische, biochemische und genomische Eigenschaften der Orthomyxoviren besitzt. Es ist nach seinem Gefährdungspotential für Fische derzeit noch nicht in eine Risikogruppe eingeordnet. Die Krankheit ist aber als nicht exotische Krankheit im Anhang IV der Aquakultur-Richtlinie 2006/88/EG (1) aufgeführt. Laborarbeiten mit ISAV sollten unter L2-Bedingngungen nur mit zusätzlichen Auflagen (eingeschränkter Personenverkehr, 2 Tage kein Kontakt zu Nutzfischen) gestattet werden. Für Tierversuche müssen L3- Bedingungen gefordert werden Klinische und pathologisch-anatomische Symptomatik Klinisch ist die systemische und letal verlaufende Viruserkrankung durch Anämie, Ascites, geschwollene und vergrößerte Leber (sehr dunkel) und Milz, aber auch durch petechiale Blutungen im Peritoneum gekennzeichnet. Blutungen wurden ebenfalls im Auge beobachtet. Typische histopathologische Befunde sind degenerative und nekrotische Veränderungen in den Leberzellen sowie tubuläre Nekrosen und Blutungen in der Niere. Die Erkrankung tritt meist bei Fischen auf, die im Salzwasser gehalten wurden bzw. Salzwasser ausgesetzt waren. Es häufen sich aber die Berichte über das Auftreten der ISA bei Süßwasser-Lachsen. In der Regel verbreitet sich das Virus dort langsam und besitzt nur eine geringe Virulenz, wobei Ausbrüche im Salzwasser durch eine hohe Mortalität gekennzeichnet sind. Zur weiteren pheno- und genotypischen Charakterisierung werden das Virus und seine RNA gegenwärtig bearbeitet. FLI 32
34 Vorkommen Das ISAV wurde in Kanada, Norwegen, Chile, den USA, den Färöer- und den Shetland-Inseln sowie in Schottland und Irland nachgewiesen. In Kanada wurde ISA ursprünglich als Hämorrhagisches Nieren Syndrom (HKS) beschrieben. Bisher konnte das ISAV aus Lachsen, aus Meer- und Regenbogenforellen sowie aus dem Atlantischen Hering nach natürlicher oder experimenteller Infektion isoliert werden. Nach künstlicher Infektion des Steinbutt (Psetta maxima), der Wrasse (Labrus bergylta), der Seebrasse (Dicentrachus labrax) oder des Kabeljau (Gadus morhua) war eine Reisolierung des ISAV nicht möglich. Ein natürliches Reservoir des ISAV ist bisher nicht bekannt. Eine Ausbreitung des Virus als eine Folge von subklinischen Infektionen der Smolt -Lachse erfolgte nachweisbar von Farm zu Farm durch Wellboats bzw. von Schlachthäusern oder der Fischindustrie dann, wenn Fische transportiert oder Organmaterial ISA-infizierter Tiere und unbehandeltes Abwasser direkt ins Meer eingeleitet wurden. Zu den Umweltfaktoren, die die Infektion beeinflussen, zählen in latent infizierten Populationen verschiedene Stressfaktoren, wie z. B. Behandlungen gegen Forellenläuse oder Cestoden, aber auch gegen andere Infektionskrankheiten. Diese Belastungen können 2 bis 3 Wochen später zu einem ISA-Ausbruch führen Diagnostik der ISA Die ISA-Diagnostik basiert gegenwärtig auf der ISA-typischen Klinik, der pathologischen Anatomie, der Histopathologie und den hämatologischen Veränderungen sowie der Kultivierung des ISAV in SHK-1-Zellen und/oder dem Nachweis der Viren mittels Immunfluoreszenz in charakteristischen zellulären Veränderungen der Organe als Ergänzung bei einem untypischen Krankheitsgeschehen. Zur Bestätigung von positiven Befunden als auch zur primären Diagnostik wurde eine RT-PCR entwickelt. Die Methoden sind in der Entscheidung der Kommission 2001/183/EG zur Festlegung der Probennahmepläne und Diagnoseverfahren zur Erkennung und zum Nachweis bestimmter Fischseuchen (2) vorgegeben Bekämpfung Die Inzidenz der ISA kann erfolgreich durch die Einführung von allgemeinen Maßnahmen, wie der Reglementierung des Fischtransports, einer obligatorischen Kontrolle der Bestände und der Schlachthäuser, reduziert werden. Gleichzeitig müssen spezifische Maßnahmen festgelegt werden, die infizierte, infektionsverdächtige und deren Nachbarfarmen betreffen. Die Schlachthaushygiene, das Rein-Raus-Prinzip in produzierenden Farmen sowie die Desinfektion von Abwässern aus Farmen, Schlachthäusern und der fischverarbeitenden Industrie müssen ebenfalls in die Bekämpfung einbezogen werden Zuständige Untersuchungseinrichtungen Die virologischen Untersuchungen zum Nachweis der Freiheit der Fischbestände vom ISAV für die Anerkennung seuchenfreier Gebiete bzw. Fischfarmen und die Überwachung der Seuchenfreiheit werden in den zugelassenen, regionalen Untersuchungsämtern der Bundesländer durchgeführt. Die Bestätigung eines Ausbruches bzw. Verdachts erfolgt am NRL für ISA (NRL-ISA). Das NRL-ISA koordiniert die Diagnose auf Grundlage der EU- und nationalen Gesetzgebung. FLI 33
35 Rechtsgrundlagen ISA ist eine anzeigepflichtige Tierseuche. Die Diagnose und Bekämpfung der ISA ist in Deutschland durch die "Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (Fischseuchenverordnung)" geregelt. Diese Verordnungen dienen zur Umsetzung der Aquakultur-Richtlinie 2006/88/EG, die zur Harmonisierung der Diagnose und Bekämpfung von Fischseuchen innerhalb der Europäischen Union erlassen wurde. In Entscheidung 2001/183/EWG der Kommission werden die Probennahmepläne und Diagnoseverfahren zum Nachweis der ISA festgelegt. Diese Entscheidung ist für die Diagnose der ISA in der BRD verbindlich und dient daher der Erstellung der folgenden methodischen Hinweise. Eine Anleitung zur Diagnose der ISA und weiterer, gegebenenfalls differentialdiagnostisch abzugrenzender Fischkrankheiten findet man auch im "Diagnostic Manual for Aquatic Animal Diseases" des OIE von 2000 bzw. in der regelmäßig überarbeiteten Ausgabe Untersuchungsmaterial für die ISA-Überwachung Zeitplan Der Betreiber eines Fischhaltungsbetriebes hat seinen Fischbestand regelmäßig durch die zuständige Behörde und durch die mit der Gesundheit von Wassertieren befassten qualifizierten Dienste (in Deutschland sind das i. d. R. die Fischgesundheitsdienste) klinisch und ggf. auch virologisch untersuchen zu lassen. Die Kontrollhäufigkeit ist abhängig von der Einordnung des Aquakulturbetriebes in die Kategorien und der damit festgelegten Art der Überwachung laut EU-Richtlinie 2006/88/EG und ist im Anhang III, Teil B dieser Richtlinie festgelegt Probennahme Histologische Proben Proben für histologische Untersuchungen werden von frisch getöteten Fischen, die deutliche klinische Zeichen der ISA zeigen, gewonnen. Fische mit vorhandenen äußeren und inneren pathologisch-anatomischen Organveränderungen sollten ebenfalls einzeln beprobt werden. In jedem Fall werden Proben von Leber, Mittelniere, Herz und Milz eines Fisches mit einem Skalpell herausgeschnitten und in 8- bis 10 %igem neutralen Formalin fixiert. Das Verhältnis von Probe zu Fixativ sollte 1:20 betragen Proben für virologische Untersuchungen Material für die virologischen Untersuchungen wird von allen beprobten Fischen gewonnen. Teile von Leber, Kopfniere, Herz und Milz werden mit einem sterilen Skalpell herausgeschnitten und in ein Plastikgefäß mit 9 ml Transportmedium, z. B. Zellkulturmedium mit Antibiotikum, gegeben. Eine Kombination aus 12,5 μg Fungizone, 200 IU Polymyxine B und 200 μg Kanamycin pro ml Medium hat sich bewährt. Es können aber auch andere geprüfte Mischungen verwendet werden. Organteile von bis zu fünf Fischen können als Poolprobe in einem Plastikgefäß gesammelt werden. FLI 34
36 Das Gesamtgewicht der Poolprobe sollte etwa 1,0 +/- 0,5 g pro Gefäß nicht überschreiten Immunfluoreszenz vom Abklatschpräparat der Niere Ein Abklatsch der Niere darf nur vom frisch getöteten Fisch erfolgen. Dazu wird ein Teil der Mittelniere mit einem sterilen Skalpell und einer Pinzette herausgeschnitten. Das austretende Blut wird auf einer aufsaugenden Unterlage entfernt. Danach wird das Organstück wiederholt auf einen Poly-L-Lysin-beschichteten Objektträger gepresst, um eine Folge von Tupfpräparaten zu garantieren, die sich nicht überlappen sollten. Da Blut und Gewebsflüssigkeit den Test durch Koagulation stören können, wird das Präparat anschließend kurz auf eine aufsaugende Unterlage gedrückt. Das Abklatschpräparat soll lufttrocknen und anschließend bis zur Fixation, z. B. mit Aceton-Methanol Ratio 80:20, innerhalb von 72 h (nicht länger) kühl und trocken gelagert werden Proben für die Blutuntersuchung Von Fischen mit klinischen Zeichen einer Anämie wird nach Betäubung Heparinblut zur sofortigen Untersuchung von Parametern, wie z. B. die Bestimmung des Hämatokritwertes, gewonnen Proben für die RT-PCR Gewebe für die RT-PCR ist von allen untersuchten Fischen zu entnehmen. Dazu wird ein kleiner Teil der Kopfniere mit einem sterilen Skalpell entnommen und in ein Mikroröhrchen, welches 1 ml RNA-Stabilisierungslösung enthält, gegeben. Als Mittel der Wahl wird RNA-later (Ambion Inc., USA) empfohlen. Es können auch andere geprüfte RNA-Stabilisatoren mit gleicher Schutzwirkung verwendet werden. Gewebeteile von bis zu fünf Fischen können als eine Poolprobe in einem Mikroröhrchen gesammelt werden. Das Gesamtgewicht einer Poolprobe sollte 0,5 g nicht überschreiten. Im Fall der Beprobung von kleinen Fischen wird das empfohlene Gewicht von 0,5 g dadurch erreicht, indem zusätzlich Teile von Niere, Herz, Milz, Leber oder der Pylorusschläuche entnommen werden Versand von Probenmaterial Heparinisiertes Blut und Mikroröhrchen für virologische Untersuchung sowie für RT- PCR müssen in einem gekühlten Container (vorzugsweise eine dickwandige Polystyrol-Box mit Kühlaggregaten) versandt werden. Dabei ist zu sichern, dass die Kühlkapazität der Aggregate für die Transportzeit ausreichend ist und das Material gekühlt im Labor eintrifft. Ein Einfrieren des Materials ist unbedingt zu vermeiden. Ausnahmen können nur bei dem Material gemacht werden, welches für die RT-PCR verwendet wird. Durch das RNA-Schutzmedium kann die Probe bei -20 C oder darunter transportiert werden. Ein Auftauen ist dann zu vermeiden. Objektträger mit Abklatschpräparaten sollen im Objektträgerhalter oder -ständer mit ausreichendem Abstand zwischen den Objektträgern trocken und gekühlt versandt werden. FLI 35
37 Formalin-fixiertes Material für histologische Untersuchungen soll in auslaufsicheren Gefäßen in einem formalinresistenten Container (vorzugsweise eine dickwandige Polystyrol-Box) transportiert werden. Die virologischen Untersuchungen müssen schnellstmöglich begonnen werden, jedoch nicht später als 72 h nach der Probennahme. Ganze tote Fische sollten in einem aufsaugenden Papier eingeschlagen in einer Plastiktüte je nach Außentemperatur im Kühlcontainer oder ohne diesen versandt werden. Lebende Fische sollten entsprechend der Vorgaben der verantwortlichen Veterinärbehörde verschickt werden. Die RNA-stabilisierten Proben für die RT-PCR müssen entsprechend ihrer Lagerung bearbeitet werden. Für die RNA-Extraktion gelten folgende Grundregeln: Lagerung bei ( C): Bearbeitung nach: 1 Tag 1 Woche 1 Monat länger als 1 Monat Alle Verpackungen sowie deren Beschriftung müssen den nationalen und internationalen Vorschriften entsprechen Gewinnung von zusätzlichem diagnostischem Material In Abstimmung mit dem diagnostischen Labor können auch andere Organe in unterschiedlicher Präparation gesammelt werden Untersuchungsgang Aufarbeitung der Proben für virologische Untersuchungen Wenn die gesammelten und gekühlten Proben nicht innerhalb von 72 h aufgearbeitet werden können, besteht die Möglichkeit, sie für 28 d bei -80 C einzufrieren. Das Probenmaterial darf vor der Untersuchung aber nur einem Gefrier-Tau-Zyklus unterzogen werden. Jede Poolprobe ist komplett mit entsprechenden Gerätschaften zu homogenisieren. Danach wird das Material zwischen 2000 bis 4000 g für 15 Min. bei 0 bis 6 C zentrifugiert, der Überstand filtriert (0,45 μm) und mit gleicher Menge eines Antiserums oder eines Pools von Seren gegen einheimische IPNV-Stämme (vorzugsweise Serotypen Ab und Sp) in geeigneter Verdünnung für 1 h bei 15 C inkubiert. Das Serum oder der Serum-Pool sollten einen Mindesttiter von 1:2000 im 50 % Plaque- Neutralisationstest gegen die IPNV aufweisen. Diese Suspension ist das Inokulum für die Zellkultur Animpfen der Zellkultur SHK-1-Zellen (weniger als 80 Passagen) oder ASK-Zellen sollen in L-15 Medium mit 5 % FKS, 2 % 200 mm L-Glutamin und 0,08 % 50 mm 2-Mercaptoethanol in 12-well Zellkultur-Platten wachsen. Es können auch andere Zelllinien von gleicher geprüfter Effektivität und Empfänglichkeit für die Isolierung des ISAV verwendet werden. Das zu prüfende Material soll in eine aktiv wachsende Zellkultur inokuliert werden, wobei FLI 36
38 eine Endverdünnung des Gewebematerials zum Zellkulturmedium von 1:1000 erreicht werden sollte. Dazu sollte von jeder filtrierten Organanreibung 40 μl zu 2 ml Medium in eine Kavität der 12-well-Platte gegeben werden. Für jede Probennahmestelle auch innerhalb einer Farm ist eine separate 12-well-Platte zu beimpfen. Als negative Kontrolle dient eine nicht beimpfte 12-well-Platte. Eine weitere separate 12-well-Platte wird mit einem Referenzstamm des ISAV beimpft (positive Kontrolle). Hier ist folgendermaßen vorzugehen: 100 μl ISAV mit einem Mindesttiter von 107 KID50/ml wird in der ersten Kavität in der oberen Reihe der Platte mit den 2 ml Medium gut gemischt. Die Platten sind bei 14 +/- 2 C bis zu 15 Tage zu inkubieren Mikroskopie Die Zellen sollen mindestens zweimal zwischen dem 5. bis 7. und dem 12. Bis 14. Tag nach der Inokulation mikroskopisch untersucht werden. Bei auftretenden CPE muss eine Virusidentifizierung mittels RT-PCR oder IFT erfolgen. Tritt innerhalb von 14 Tagen kein CPE auf, sollte ein Hämadsorptionstest durchgeführt werden Hämadsorbtion Die Zellkulturüberstände (ZKÜ) aller zu testender Kavitäten, positive und negative Kontrollen eingeschlossen, werden in sterilen Röhrchen abgefüllt. 500 μl einer 0,2%igen Lösung gewaschener Kaninchenerythrozyten oder einer 0,5%igen Suspension von gewaschenen Regenbogenforellen oder Lachserythrozyten werden in jede Kavität gegeben und für 45 Min. bei Raumtemperatur inkubiert. Danach wird die Erythrozyten-Lösung abgenommen und die Kavitäten zweimal mit L-15-Medium gewaschen. Jede Kavität wird im Mikroskop betrachtet. Das Vorkommen von Erythrozyten-Ballungen an der Oberfläche der SHK-1-Zellen zeigt eine wahrscheinliche Infektion mit Orthomyxoviren an. Im positiven Fall ist eine Virusidentifizierung mittels RT-PCR oder IFT anzuschließen Subkultivierung oder Blindpassage Die Weiterpassage soll zwischen dem 13. bis 15. Tag post inoculationem (p.inoc.) erfolgen. Hierzu werden 225 μl des ZKÜ in eine frische SHK-1- oder ASK-Zelle auf einer 12-well-Platte überimpft. Diese wird dann bei 14 +/- 2 C für 14 bis 18 Tage bebrütet. Unter dem Mikroskop wird die Zelle am 5. bis 7. sowie am 14. bis 18. Tag auf CPE kontrolliert. Im positiven Fall ist eine Virusidentifizierung anzuschließen. Falls kein CPE zu beobachten ist, sollte ein Hämadsorptionstest durchgeführt werden. Falls das Inokulum zytotoxische Reaktionen in der Zelle vor dem 7. Tag p.inoc. induziert, ist eine sofortige zweimalige Subkultivierung für 14 bis 18 Tage anzuschließen. Tritt die Zytotoxizität nach dem 7. Tag p.inoc. auf, dann ist nur einmal zu subkultivieren. Die Dauer für beide Passagen sollte 28 bis 36 Tage seit der primären Inokulation nicht überschreiten. Sind bakterielle Kontaminationen in der primären Kultur zu erkennen, muss die Probe erneut aus dem bei -80 C eingefrorenem Material angezüchtet werden. Vor der Inokulation in die Zellkultur ist das Homogenisat zu zentrifugieren (4000 g, 30 Min., 0 FLI 37
39 bis 6 C) und der Überstand zu filtrieren (0,22 μm Filter). Ist eine der Subkultivierungen bakteriell kontaminiert, dann ist der ZKÜ ebenfalls zu filtrieren (0,22 μm) und das Filtrat in eine frische Zellkultur zu inokulieren. Diese Passage wird für weitere 14 bis 18 Tage bei 14 +/- 2 C inkubiert Methoden der Virusidentifizierung Wenn ein CPE in der Zellkultur aufgetreten bzw. der Hämadsorpionstest positiv ausgefallen ist, muss eine Virusidentifizierung folgen. Als Methoden der Wahl zur Identifizierung des ISAV stehen dabei der Immunfluoreszenztest (IFT) und die RT-PCR zur Verfügung. Falls andere Viren (z. B. VHSV, IHNV, IPNV) vermutet werden, sind diese durch geeignete diagnostische Methoden zu identifizieren. Werden die Viren innerhalb einer Woche nicht eindeutig identifiziert, ist ZKÜ der betreffenden Kulturen an das NRL-FK Insel Riems bzw. an das EU-Referenzlabor für Fischkrankheiten (Aarhus, Dänemark) zu übersenden Immunfluoreszenztest Die Zellen werden mit dem beschriebenen Medium in 24-well-Platten angezüchtet, infiziert und mikroskopisch beobachtet, bis ein konfluenter CPE von 50 % auftritt. Dazu werden 225 μl des fraglich virushaltigen ZKÜ s in zwei Kavitäten gegeben und gemischt. Aus dieser Suspension werden wiederum 225 μl in zwei weitere Kavitäten überpipettiert (Verdünnung 1:5). Zwei unbeimpfte Kavitäten dienen als negative Kontrolle. Pools von Entnahmestellen einer Fischfarm bzw. Pools von unterschiedlichen Fischfarmen sollen auf separaten Platten angezüchtet werden. Eine weiter separat zu behandelnde Platte dient nach Animpfung mit einem ISAV-Referenzstamm (z. B. Stamm Glesvaer, Norwegen) als positive Kontrolle. Die bei 14 +/- 2 C inkubierten Platten werden ab dem 7. Tag p.inoc. täglich mikroskopisch untersucht. Wird ein CPE beobachtet bzw. ist bis zum 7. Tag kein CPE vorhanden, ist die Platte zu fixieren. Der ZKÜ wird abgenommen und die Platte ist mit PBS zu waschen. Da-nach werden die Zellen mit einem Azeton-Methanol-Gemisch (Ratio 80:20) für 20 Min. bei Raumtemperatur fixiert. Die anschließend luftgetrockneten Platten werden sofort weiter verarbeitet. Sie können auch nach einer Lagerung von 24 h bei 0 bis 6 C für den IFT genutzt werden. Der Doppelansatz der Kavitäten mit beiden ISAV-Verdünnungen werden mit in Deutschland zugelassenen monoklonalen Antikörper (mak) oder mit anderen empfohlenen (z. B. in EU-Entscheidung 2001/183/EG oder im OIE Manual) mak der gleichen geprüften Effektivität und Empfindlichkeit (siehe Bezugsquellen für diagnostische Reagenzien und Zellkulturen) in der angegebenen Verdünnung (PBS) überschichtet und für 30 Min. bei 37 C inkubiert. Der ungebundene mak wird durch Waschen entfernt. Anschließend wird ein in PBS verdünntes anti-maus-fitc-konjugat zu den Kavitäten gegeben und für 30 Min. bei 37 +/- 4 C inkubiert. Die Verdünnung für den mak und das Konjugat sollte in jedem Labor ausgetestet werden. Alle Waschungen werden mit einer PBS-Tween-20-Lösung (0,05 % Tween 20, PBS-T) durchgeführt. Die Reaktion ist im geeigneten Fluoreszenzmikroskop mit den passenden Filtern für FITC zu beurteilen. Die Reaktion ist positiv, wenn fluoreszierende Zellen (Zellverband oder Einzelzellen) beobachtet werden. Der Test wird als gültig angesehen, wenn die positiven und negativen Kontrollen die erwarteten Reaktionen zeigen. FLI 38
40 Untersuchung von Abklatschpräparaten der Niere mit der IFT Das folgende Protokoll wurde zur Untersuchung von Abklatschpräparaten der Niere in der IFT ausgearbeitet Präparation und Färbung der Abklatschpräparate Die Objektträger sollen mit Methanol/Azeton (1:1) für 3 Min. fixiert und anschließend luftgetrocknet werden. Vor der Färbung muss jeder Objektträger untersucht werden und die Nierenabklatsche sollen mit einem Stift (z. B. Pap Pen oder ImmEdgeTM) eingerahmt werden. Nach der Trocknung werden die Objektträger mit einer Blockierungslösung (6 % Trockenmagermilchpulver in PBS-T) überschichtet und unter leichtem Schütteln für 30 Min. bei Raumtemperatur inkubiert. Die Objektträger sollen sich in einer feuchten Kammer befinden und immer feucht gehalten werden. Nach dem Absaugen der Blockierungslösung wird jeder Objektträger mit dem anti-isav-mak 3H6F8 (oder einem anderen geprüften mak) in einer Verdünnung von 1:10 und 1:100 mit 1 % Trockenmagermilchpulver im Verdünnungspuffer überschichtet (für jede Charge ist die optimale Verdünnung der mak in jedem Labor zu ermitteln). Diese werden für 1 h bei Raumtemperatur inkubiert. Anschließend sind die Objektträger 3 x für 2 Min. mit PBS-T (0,1 % Tween 20) zu waschen. Die Objektträger sind nun mit einem FITC-Konjugat (z. B. Ziege-anti-Maus-Ig-FITC) in der ermittelten Verdünnung (z. B. 1:1000) im Verdünnungspuffer mit 1 % Trockenmagermilchpulver zu überschichten und für 1 h in einer feuchten Kammer zu inkubieren. Danach werden die Objektträger wieder 3 x gewaschen wie bereits angegeben. Jeder Objektträger wird nun mit einer Mischung von CITIFLOURTM-Lösung (500 μl CITIFLOURTM) und 1,5 ml PBS-T (0,1 % Tween 20) für 10 Min. überschichtet und wiederum 3 x für 2 Min. gewaschen. Jetzt werden die Objektträger mit einer Propidiumjodid-Lösung (0,01 mg/ml) in PBS-T (0,1 % Tween 20) beschichtet und für 3 Min. bei Raumtemperatur inkubiert. Anschließend erfolgt eine weitere Waschung 3 x für 2 Min. Am Ende wird die Flüssigkeit um die Abklatschpräparate mit einem saugfähigen Material entfernt und der Objektträger mit CITIFLOURTM überschichtet. Die Objektträger sind bis zur Untersuchung bei 4 C in Dunkelheit zu lagern Beurteilung der Reaktion im Fluoreszenzmikroskop Jeder Objektträger wird in einem geeigneten Fluoreszenzmikroskop mit einem geeigneten Filter, der FITC anregt, beurteilt. Alle eingerahmten Gebiete auf dem Objektträger werden mit einer 10-fachen und 20-fachen Vergrößerung untersucht. Die verdächtig erscheinenden Abklatschpräparate werden mit einer 40-fachen Vergrößerung erneut beurteilt, um die Zellverbundenheit der Fluoreszenz besser zu bestätigen. Mindestens eine weitere Person sollte im positiven Fall das gefundene Ergebnis bestätigen. Dies gilt auch für positive Fluoreszenz auf weiteren Objektträgern Kontrollen für den IFT Wenigstens 3 Kontrollen sollten ständig mitgeführt werden: 1. negative Kontrolle: Nierenabklatsch von einem gesunden Fisch (Lachs) 2. negative Kontrolle: eine nicht infizierte Zellkultur (oder eine andere für ISAV empfängliche Zelle) 3. positive Kontrolle: ISAV-inf. Zellkultur FLI 39
41 Falls möglich, sollte ein Abklatschpräparat von einem mit ISAV infizierten Lachs als weitere positive Kontrolle mitgeführt werden. Wenn eine der negativen Kontrollen positiv bzw. die positive Kontrolle nicht reagiert, ist die gesamte Untersuchungsreihe zu verwerfen und der Test ist erneut mit den Duplikaten der Abklatschpräparate durchzuführen Untersuchung anderer Gewebe in der IFT Die gleiche Methode kann auch bei anderen Geweben wie Leber, Milz, Herz und, wenn in ausreichendem Maße vorhanden, auch mit Endothelzellen oder Leukozyten durchgeführt werden. Die Markierung der mak mit dem FITC-Konjugat erfolgt nach den gleichen Prinzipien wie vorher beschrieben, wobei bei einigen Geweben die Propidiumjodid-Färbung weggelassen werden sollte Histologie Paraffinschnitte sollten ca. 5 μm dick sein und dann HE-gefärbt werden. Die Charakteristik der Veränderungen im histologischen Schnitt wurde bereits beschrieben Bezugsquellen für diagnostische Reagenzien und Zellkulturen Kommerziell erhältliche Diagnostika: Bio-X Diagnostics, Belgien: Bio-X Anti-ISAV Monoklonaler Antikörper (BIO 337); mak 18B11-M. Dauber (in Deutschland zur Diagnose der ISA zugelassen, Zulassungsnummer: FLI-B 422) Referenzviren, im Handel nicht erhältliche Diagnostika und Zelllinien: Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit Südufer 10 D Greifswald Insel Riems Zentralabteilung Zellbank: Zelllinie SHK-1 (salmon head kidney); Katalog-Nr.: CCLV RIE 489, Zelllinie ASK (atlantic salmon kidney), Katalog-Nr.: CCLV RIE 926, Institut für Infektionsmedizin, NRL für ISA ISAV-Referenzstamm 390/98, Scotland ISAV-Referenzstamm Glesvaer 2/90, Norway Anti-ISAV mak 18B11, M. Dauber (Insel Riems) Anti-ISAV mak 3H6F8, K. Falk (Oslo) FLI 40
42 Literatur 1. Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung 2. Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) 3. Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L328 S. 14) 4. Entscheidung der Kommission 2001/183/EG vom 22.Februar 2001 zur Festlegung der Probennahmepläne und Diagnoseverfahren zur Erkennung und zum Nachweis bestimmter Fischseuchen und zur Aufhebung der Entscheidung 92/532/EWG. (ABl. EU Nr. L 56 S. 65) 5. OIE manual of diagnostic tests for aquatic animals. Sixth Edition 2009, World Organisation for Animal Health, Paris FLI 41
43 7. Ansteckende Schweinelähmung (Teschener Krankheit) 7.1. Charakterisierung der Infektion Erreger Erreger sind Porzine Teschoviren (PTV) aus der Familie Picornaviridae, von denen mindestens 11 Serotypen unterschieden werden können (vormals zu den Porzinen Enteroviren gerechnet). Nachdem ursprünglich ausschließlich Stämme des PTV-1 für die Teschen-Talfan-Krankheit verantwortlich gemacht wurden, gibt es inzwischen Nachweise dafür, dass auch die meisten anderen PTV-Serotypen vergleichbare Neurovirulenz besitzen und Krankheitsbilder verursachen können. Für praktische Zwecke ist es daher in der Regel ausreichend, wenn ein Speziesnachweis geführt wird. Empfänglich für PTV sind ausschließlich Schweine, die Übertragung erfolgt oral-fäkal Klinische Symptomatik Die Teschovirus-Enzephalomyelitis der Schweine tritt als fieberhafte Allgemeinerkrankung auf, wobei Ausprägung und Schweregrad klinischer Symptome stark schwanken. Bei der erstmals 1929 in der Tschechoslowakei aufgetretenen und als Teschener Krankheit beschriebenen fatalen Form traten Fieber, Anorexien und Depressionen auf, gefolgt von Inkoordinationen, Prostration, Koma und Tod. Die Mortalität erreichte bis zu 90 %. Ab Mitte der 1950er Jahre werden nur noch sporadisch überwiegend milde Verlaufsformen (Talfan Disease) mit Lähmungen der Hinterbeine beobachtet. Die Tiere gesunden gewöhnlich vollständig innerhalb weniger Tage, Todesfälle sind selten und in der Regel auf wenige Tiere beschränkt. Pathologischanatomisch sind Läsionen bis hin zur Paralyse im Zentralnervensystem zu beobachten. Die Läsionen gleichen histologisch weitgehend denen bei anderen viralen Enzephalomyelitiden, mit perivaskulären Infiltraten (Manschettenbildung), neuronaler Degradation und Gliosis. Die Ausdehnung der Läsionen korreliert mit dem Schweregrad der Klinik, bei besonders schweren Fällen können das gesamte Rückenmark, Gehirn und Meningen betroffen sein Differentialdiagnostik Polioenzephalomyelitis als Folge einer PTV-Infektion muss differenziert werden von anderen viralen Enzephalomyelitiden, insbesondere von der Aujeszkyschen Krankheit, der klassischen Schweinepest, Afrikanischer Schweinepest und Coronavirus- (Hämagglutinierender) Enzephalomyelitis. Ferner sind zu berücksichtigen Listeriose, bakterielle Meningo-Enzephalitis und Intoxikationen. Teschoviren sind ubiquitär verbreitet und es ist mit einer hohen PTV-Antikörperprävalenz in europäischen Schweinebeständen zu rechnen Diagnostische Indikation Die diagnostische Indikation einer Teschovirus-Enzephalomyelitis ist nur nach Erregernachweis unter Berücksichtigung klinischer und pathologisch-anatomischer Befunde möglich. Essentiell ist der Ausschluss von Schweinepest. Die Differenzierung zwischen der schweren Form der Erkrankung (Ansteckende Schweinelähmung) und FLI 42
44 der milden (Talfan Disease) ist schwierig und in gewissem Maße eine Ermessensfrage. Sie kann bei signifikantem Erregernachweis, vorzugsweise aus Proben von Gehirn und Rückenmark, nur an Hand des Krankheitsgeschehens erfolgen. Voraussetzung für die Feststellung eines Falles der anzeigepflichtigen Ansteckenden Schweinelähmung ist neben dem Erregernachweis und dem Vorliegen einer nichteitrigen Polioenzephalomyelitis, insbesondere das gehäufte Auftreten klinischer Erkrankungen Zuständige Untersuchungseinrichtungen Veterinäruntersuchungs-, Tiergesundheitsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer Rechtsgrundlagen Die Teschovirus-Enzephalomyelitis ist nur in ihrer schweren Ausprägung (Ansteckende Schweinelähmung) anzeigepflichtig im Sinne der Verordnung über anzeigepflichtige Tierseuchen in der Fassung der Bekanntmachung vom 3. November Ferner gilt die Verordnung über Sperrbezirke bei Ansteckender Schweinelähmung vom 24. Juli Untersuchungsmaterial Zur Virusisolierung bzw. zum direkten Nachweis am Gefrierschnitt ist Graue Substanz aus Kleinhirn (Kerne, Rinde), Hirnstamm, Rückenmark (Ventralhörner) oder eventuell Material aus der motorischen Großhirnrinde zu entnehmen. Darüber hinaus sind Virusisolierungen aus Tonsille, Lunge und Kot möglich. Das Untersuchungsmaterial sollte von Tieren, die sich in einem möglichst frühen Krankheitsstadium befinden, entnommen werden. Virusisolierungsversuche aus dem ZNS bieten Aussicht auf Erfolg nur bis zum 3. Tag nach Auftreten zentralnervöser Symptome. FLI 43
45 7.3. Untersuchungsgang Direkter Erregernachweis Der direkte Erregernachweis erfolgt vorzugsweise nach Anzüchtung des Virus in der Zellkultur. Der Nachweis an azetonfixierten Gefrierschnittpräparaten kann versucht werden, die Erfolgsaussichten sind jedoch als gering einzuschätzen. Aufbereitung des Untersuchungsmaterials Herstellung einer 10%igen Organsuspension in serumfreiem Erhaltungsmedium (EM) mit Zusatz von Antibiotika (Penicillin/Streptomycin) möglichst weiterer Aufschluss durch Ultraschallbehandlung Probe mindestens eine Stunde, besser über Nacht, bei 4-8 C aufbewahren Klärzentrifugation bei 1500 g für 10 Minuten, ggf. Filtration durch Membranfilter (0,45 μm) kurzzeitige Lagerung bei 4 C; falls längere Zwischenlagerung notwendig: Zugabe von z. B. 20 % Pferdeserum als Gefrierschutz und Lagerung bei -70 C starke Kontaminationen können durch Ausschütteln mit Chloroform reduziert werden Zellkulturen und deren Beimpfung Empfänglich sind insbesondere primäre sowie diploide und permanente Schweinenieren- und hodenzellen. Von vorbereiteten Zellkulturen wird das Medium abgesaugt und im Doppelansatz mit unverdünnter bzw. 1:10 verdünnter Organsuspension überschichtet. Die Inokulumund Medienmengen richten sich nach der Größe der Kulturgefäße (z. B. für Petrischalen mit 3,5 cm Durchmesser 0,5 ml Inokulum und 2 ml Medium). Nach einer Adsorptionszeit von 90 Minuten bei 37 C wird das Inokulum entfernt und nach ein- bis zweimaligem Waschen Erhaltungsmedium zugegeben. Positiv- und Negativkontrollen sind mitzuführen. Die Kulturen werden 3 bis 10 Tage bei 37 C inkubiert. Während dieser Zeit werden sie hinsichtlich des Auftretens zytopathischer oder zelltoxischer Effekte mikroskopisch kontrolliert. Die Anzüchtung erfolgt unter Antibiotikaschutz. Es werden in der Regel bis zu drei (Blind-)Passagen durchgeführt. Bei Auftreten eines zytopathischen Effekts ist eine Identifizierung bzw. Typisierung des Isolates durchzuführen. Virusidentifizierung mittels Immunfluoreszenz (IFT) Zellkulturen werden in für die mikroskopische Betrachtung geeigneter Form angelegt (Petrischalen, Deckgläser, Mikrotiterplatten, Diagnostika-Objektträger) und der geschlossene Zellrasen mit dem Isolat bzw. einem Referenzvirus infiziert. Die Fixierung der infizierten Zellkulturen erfolgt zu einem Zeitpunkt, bei dem erste zytopathische Veränderungen erkennbar sind. Diese äußern sich gewöhnlich durch inselartig verstärktes Auftreten abgerundeter Zellen. In Abhängigkeit von Infektiosität und Impftiter des Virus kann dies zeitlich sehr verschieden sein (8 bis 48 Stunden p. i.). Gleichzeitig sind nichtinfizierte Zellkulturen als Negativ-Kontrollen zu fixieren. Kulturen auf Deckgläsern und Objektträgern können z. B. in Azeton für 10 Minuten bei Zimmertemperatur nach kurzem Abspülen mit isotonischem Puffer (IP) und anschließendem Luft-trocknen fixiert werden. Zellkulturen auf Titerplatten lassen sich FLI 44
46 nach Absaugen des Mediums mit gekühltem Azeton (1:2 mit destilliertem Wasser verdünnt) bei -20 C (20 Minuten) fixieren. Die Zwischenlagerung fixierter Kulturen ist bei -20 C über Wochen möglich. Immunfluoreszenz mit polyklonalen Seren Geeignet sind ausschließlich solche Seren, die hochtitrig sind (mindestens 1:1000 verdünnbar), pan-ptv reagieren und keine Hintergrundmarkierungen verursachen. Polyklonale Seren kreuzreagieren häufig mit heterologen Serotypen, so dass eine Typisierung von PTV mittels IFT mit ihnen prinzipiell nicht möglich ist. Keine Kreuzreaktivität besteht dagegen zwischen PTV und PEV-8 bzw. PEV-9 und 10. Zur Durchführung des IFT werden die fixierten Präparate mit geeignetem Antiserum überschichtet, die Arbeitsverdünnung richtet sich nach Titer und Kreuzreaktionsverhalten. Inkubation z. B. 1 Stunde bei Zimmertemperatur in einer feuchten Kammer anschließend 3x mit IP ph 7,8 waschen (dritter Waschgang 10 Minuten) Puffer von den Präparaten absaugen oder abschwenken mit Konjugat (Antispezies-Fluorochrom, z. B. FITC, Carbocyanin) in geeigneter Verdünnung (etwa 1:100 bis 1:200) überschichten mindestens 45 Minuten bei Zimmertemperatur in feuchter Kammer und bei Dunkelheit inkubieren wie oben 3x waschen; Deckgläser und Objektträger zum Schluss einmal kurz in entionisiertem Wasser spülen und z. B. mit Fluoreszenz-Erhaltungspuffer (DABCO) einbetten noch feuchte bzw. eingebettete Präparate unter Auflichtfluoreszenzmikroskop beurteilen Immunfluoreszenz mit monoklonalen Antikörpern Für den Nachweis von PTV bieten sich spezies-spezifische monoklonale Antikörper (MAK) an. Eine PTV-Typisierung mit monospezifischen MAKs ist nur eingeschränkt möglich. In der Regel erkennen derartige Antikörper nur einen Teil von Virusisolaten ihres Serotyps. Für den allgemeinen Teschovirus-Nachweis werden empfohlen die MAKs 040/4B1 und 156/1B9, die Viren sämtlicher Serotypen erkennen. Zum Nachweis von PEV-8 (PEV-A) steht MAK 153/5B5 zur Verfügung. PEV-B (PEV-9 und 10) lässt sich nachweisen mit MAK 154/4H6. Die Durchführung des Testes erfolgt prinzipiell in gleicher Weise wie der IFT mit polyklonalen Seren. Es ist ein Anti-Maus-IgG- Fluorochrom-Konjugat einzusetzen. Bewertung der Fluoreszenz Mit PTV und PEV infizierte und markierte Zellen weisen eine kräftige grobkörnige, sich häufig in Kernnähe konzentrierende zytoplasmatische Fluoreszenz auf. Die Neigung infizierter Zellen zu starker Abrundung und Herauslösung aus dem Zellverband können die Entscheidung darüber, ob eine spezifische Markierung vorliegt, erschweren. Abgerundete Zellen erscheinen infolge Lichtbrechung gewöhnlich heller als ihr Umfeld. Zur Bewertung sind grundsätzlich Negativ- und Positivkontrollen einzubeziehen. FLI 45
47 Untersuchungsdauer Im Falle hochinfektiöser und leicht in der Zellkultur vermehrbarer Viren ist mit einem Ergebnis frühestens nach 5 Tagen zu rechnen, der Nachweis von in der Zellkultur schwach virulenten Virusisolaten kann bis zu 18 Tage dauern. Virusnachweis mittels Immunperoxidasetechnik Alternativ zur Immunfluoreszenz kann auch die Immunperoxidasetechnik angewendet werden. Spezielle Erfahrungen zur Eignung und Sensitivität liegen jedoch nicht vor. Virusidentifizierung und -typisierung mittels Neutralisationstest (NT) Der NT kann prinzipiell als Serumneutralisationstest (SNT) und als Virusneutralisationstest (VNT) ausgeführt werden. Hierzu sind serotypspezifische Hyperimmunseren, häufig auch stammspezifische Seren mit bekannten homologen Titern notwendig. Die Verfahren sind aufwändig und grundsätzlich ist damit zu rechnen, dass gegen Referenzvirusstämme gerichtete Immunseren nicht oder nicht ausreichend Feldvirusisolate ihres Serotyps neutralisieren. Dies bedeutet, dass ein gewisser Teil aktueller Virusisolate sich serologisch keinem der anerkannten Typen zuordnen lässt. Darüber hinaus ist mit gleichzeitiger Infektion eines Tieres mit verschiedenen PTV-Serotypen zu rechnen. Serumneutralisationstest Das Virusisolat wird auf 100 KID 50 /100 μl eingestellt und mit den auf 5 % vom jeweiligen homologen Neutralisationstiter eingestellten und bei 56 C inaktivierten Antiseren für eine Stunde bei 37 C inkubiert. Das Gemisch wird auf geeignete Zellkulturen verimpft. Das Isolat wird dem Serotyp zugeordnet, durch dessen Antiserum es neutralisiert wird. Viruskontrolltitration, Zellkontrollen und Serumkontrollen sind mitzuführen. Genauere Ergebnisse liefert das Austitrieren der Seren zur Bestimmung des jeweiligen Neutralisationstiters. Überschreitet dieser 5 % des homologen Titers eines Serums, wird das Isolat dem entsprechenden Serotyp zugeordnet. Virusneutralisationstest Hiermit können feinere antigene Unterschiede zwischen Virusstämmen erkannt werden. Das Virus wird in Anwesenheit konstanter Antiserumverdünnungen und eines Nullserums austitriert. Die Zuordnung eines Isolates zu einem Referenzvirus erfolgt auf der Grundlage des zu errechnenden Neutralisationsindex. Bei einzelnen Isolaten können im eindimensionalen NT intertypische Reaktionen auftreten. Eine Zuordnung zu einem Serotyp kann in diesen Fällen möglicherweise im Kreuzneutralisationtest erfolgen. Wegen des erheblichen Arbeitsaufwandes sollten derartige Untersuchungen in einem spezialisierten Labor durchgeführt werden. FLI 46
48 Nachweis von PTV und PEV mittels Polymerasekettenreaktion (PCR) Die RT-PCR kann zum generellen Nachweis von porzinen Tescho- bzw. Enteroviren in Zellkulturmaterial oder Organproben genutzt werden. Durchführung der RT-PCR PCR-Kit: Invitrogen Superscript III One-Step RT-PCR with Platinium Taq RT-PCR-Ansatz: 12,5 µl 2xRxn Mix; 1 µl SuperScriptIII RT/Platinum Taq Mix; 1 µl Primer 1 (15 pmol); 1 µl Primer 2 (15 pmol); 4,5 µl Wasser; 5 µl RNA PTV Temperaturprofil: 30 Min. 50 C; 2 Min. 94 C; 40x [30 Sek. 94 C; 30 Sek. 58 C; 1:30 Min. 68 C], 5 Min. 68 C; 4 C Ende Primer 1: 5 AGTTTTGGATTATCTTGTGCCC- 3 (Zell et al., 2000) 2: 5 GACCCTGTCAGGCAGCAGCAC- 3 (Zell et al., 2000, modifi ziert von G. Strebelow, unpubl.) PEV-A (PEV-8) Temperaturprofil: 30 Min. 50 C; 2 Min. 94 C; 40x [30 Sek. 94 C; 30 Sek. 56 C; 90 Sek. 68 C]; 5 Min. 68 C; 4 C Ende Primer 1: 5 -CTGGGACGAAAGAGCCTG-3 (Zell et al., 2000, modifiziert von G. Strebelow, unpubl.) 2: 5 -CCTTTAAGTAAGTAGTAAAGGG-3 (Zell et al., 2000) PEV-B (PEV-9 und PEV-10) Temperaturprofil: 30 Min. 50 C; 2 Min. 94 C; 40x [30 Sek. 94 C; 30 Sek. 58 C; 90 Sek. 68 C); 5 Min. 68 C; 4 C Ende Primer 1: 5 -GTACCTTTGTACGGCTGTTTTA-3 (Zell et al., 2000) 2: 5 -ACCCAAAGTAGTCGGTTCC-3 (Zell et al., 2000, modifiziert von G. Strebelow, unpubl.) Die resultierenden PCR-Fragmente haben eine Größe von 321 bp (PTV), 383 bp (PEV-A) und 491 bp (PEV-B) Indirekter Erregernachweis Indirekter Erregernachweis mittels SNT Auf Grund der Typenvielfalt der PTV und der zu erwartenden hohen Antikörperprävalenz ist Serodiagnostik einerseits äußerst aufwändig, andererseits ist die Herstellung eines ätiologischen Zusammenhangs vielfach zweifelhaft. Es müssen mindestens Serumpaare (Zweitprobe im Abstand von 2 bis 3 Wochen) untersucht werden. Dem direkten Virusnachweis ist in der Regel der Vorzug zu geben. Zur Möglichkeit der Anwendung eines ELISA siehe bei Nardelli et al. (1993). Generell ist festzustellen, dass eine sichere Aussage nur bei Verwendung homologer Reaktionspartner, d. h. auch eines Virusisolates aus dem betreffenden Tierbestand möglich ist. FLI 47
49 Durchführung des Tests: Anzüchtung von Zellen in Mikrotiterplatten (1 bis 3 Tage vor dem Test) Inaktivierung der Seren bei 56 C für 30 Minuten Anlegen einer log2-verdünnungsreihe mit EM Jede Verdünnungsstufe in 14 Portionen abfüllen Mischen der Serumverdünnungen mit gleichen Volumina von auf 100 KID50/100 μl eingestelltem Virus der 13 Serotypen und der Serumkontrolle mit EM Inkubation der Mischung 1 Stunde bei 37 C Entfernen des Wachstumsmediums von den Zellkulturen Inokulation der Zellkulturen mit je 150 μl des Serum-Virus-Gemischs Zellkontrollen mit 150 μl EM ansetzen Inkubation der Mikrotiterplatten bei 37 C für 8 bis 14 Tage im CO 2 - Brutschrank Auswertung: Kontrolle der Mikrotiterplatten täglich, geschützte Kulturen weisen keinen zytopathischen Effekt auf Berechnung des Neutralisationstiters Ein vierfacher Titeranstieg bei Serumpaaren spricht für eine aktuelle Infektion mit dem entsprechenden Serotyp Rezepturen und Bezugsquelle Zellzucht- und Virusvermehrungsmedien Beispiel: Medien für EFH-Zellen Medium zur Zellvermehrung Minimal Essential Medium (MEM) Hanks, mit Zusatz von 1 % nicht essentiellen Aminosäuren und 10 % FKS Erhaltungs- und Virusvermehrungsmedium (EM) L-EM: Hanks-Salzlösung mit Zusatz von 3 % Leibovitz-Medium (L-15) Bei Herstellung und Verimpfung von Organanreibungen sind den Medien Antibiotika zuzusetzen (z. B. Penicillin, Streptomycin, ggf. Baytril 10%ig 1 ml/l und Amphothericin B, wasserlöslich, 45%ig 5,6 mg/l,). Zellkulturen Für die Anzüchtung und Vermehrung von PTV/PEV geeignete Zellen (z. B. EFH, ST, PS-EK und IB-RS-2) können bezogen werden von der Zellbank des Friedrich- Loeffler-Instituts, Südufer 10, Greifswald - Insel Riems, Tel /7260. PTV/PEV-Typstämme PTV- und PEV-Referenzstämme sind erhältlich vom Nationalen Referenzlabor für Teschener Krankheit, Friedrich-Loeffler-Institut, Südufer 10, Greifswald - Insel Riems, Tel /7204. Antiseren PTV/PEV-Antiseren vom Kaninchen für den NT sind in kleinsten Mengen ebenfalls dort erhältlich. FLI 48
50 Monoklonale Antikörper Monoklonale Antikörper MAK 040/4B1, 156/1B9, 154/4H6 und 153/5B5 sind zu beziehen von Dr. M. Dauber, Friedrich-Loeffler-Institut, Südufer 10, Greifswald - Insel Riems, Tel /7204 Konjugate Z. B. DTAF/FITC-markiertes, affinitätsgereinigtes F(ab )2-Fragment der Ziege gegen Meerschweinchen-IgG, Cy3-markiertes, affinitätsgereinigtes F(ab )2-Fragment der Ziege gegen Maus-IgG(H+L) (Dianova, Hamburg) Literatur Auerbach, J. (1995): Porzine Enteroviren. AVID-Mitteilungen I/1995 Dauber, M. (1999): Identification of group I porcine enteroviruses by monoclonal antibodies in cell culture. Vet. Microbiol. 67, 1-12 La Rosa, G., Muscillo, M., Di Grazia, A., Fontana, S., Iaconelli, M., Tollis, M. (2006): Validation of RT-PCR assays for molecular characterization of porcine teschoviruses and enteroviruses. J. Vet. Med. B 53, Nardelli, S., Farina, L., Selli, L., Parpaidola, R., Zuin, A. (1993): Research on the presence of porcine enterovirus serotype 1 in North-Eastern Italy. J. Vet. Med. B 40, Zell, R., Dauber, M., Krumbholz, A., Henke, A., Birch-Hirschfeld, E., Stelzner, A., Prager, D., Wurm, R. (2001): Porcine teschoviruses comprise at least eleven distinct serotypes: Molecular and evolutionary aspects. J. Virol. 75, Zell, R., Krumbholz, A., Henke, A., Birch-Hirschfeld, E., Stelzner, A., Doherty, M., Hoey, E., Dauber, M., Prager, D., Wurm, R., (2000): Detection of porcine enteroviruses by nrt-pcr: differentiation of CPE groups I-III with specific primer sets. J. Virol. Methods 88, FLI 49
51 8. Aujeszkysche Krankheit (AK) 8.1. Charakterisierung der Infektion Erreger Das Virus der Aujeszkyschen Krankheit (Synonym Pseudorabiesvirus, PrV) gehört zur Familie der Herpesviridae, Subfamilie Alphaherpesvirinae und wird laut derzeit gültiger Taxonomie als Suid Herpesvirus 1 (SHV1) bezeichnet. Das Wirtsspektrum umfasst nahezu alle Säugetierarten; lediglich die Primaten und Einhufer weisen hohe natürliche Resistenzen auf. Als Hauptreservoir ist das Hausschwein (aber auch Schwarzwild) anzusehen, wobei die Empfänglichkeit bei diesen Tierarten stark vom Lebensalter und von der Virulenz des Erregers abhängt Klinische Symptomatik Die Inkubationszeit liegt in der Regel zwischen 1 bis 8 Tagen, in Abhängigkeit von der Infektionsdosis auch bis zu 3 Wochen. Die Pathogenität bzw. Virulenz des Erregers und die unterschiedlichen pathogenetischen Eigenheiten bestimmen die Krankheitserscheinungen bei den einzelnen Tierarten. Die klinischen Symptome beim Schwein variieren in Abhängigkeit des Lebensalters. Bei juvenilen Tieren überwiegen durch Meningoencephalitis und Virämie bestimmte Symptome (Appetitlosigkeit, Erbrechen, Mattigkeit, starker Durst, Lähmungserscheinungen, Krampfzuckungen, unphysiologische Bewegungen). Bei Adulten sind die klinischen Erscheinungen meist mild; innerhalb weniger Tage tritt Rekonvaleszenz ein (stumme Durchseuchung). In Mastbetrieben kommt es infolge der Sekundärinfektionen zu schweren katarrhalischen oder kruppösen Pneumonien. Bei den übrigen Tierarten stehen ausschließlich durch den Neurotropismus verursachte Symptome im Vordergrund (Reizungs-, Lähmungs-, vegetative Schockform), die innerhalb weniger Stunden bis Tage zum Tod führen. Das charakteristischste Symptom ist der akute Juckreiz (fehlt beim Schwein!) Differentialdiagnostik Als Differentialdiagnose sind beim Schwein hauptsächlich Coli-Enterotoxikose, Kochsalzvergiftung, ESP, Teschener Krankheit, sonstige Meningoencephalitiden, Schweineinfluenza und Pasteurellose in Betracht zu ziehen. Bei allen anderen Tierarten spielen die Tollwut und Vergiftungen die größte Rolle (Beer, J., Infektionskrankheiten der Haustiere, 1987, Gustav Fischer Verlag Jena, 881 pp) Diagnostische Indikation Tierverkehr (Tierhandel, Ausstellungen) klinischer oder epidemiologisch begründeter Verdacht Untersuchungen im Zuge von Anerkennungsverfahren und zum Nachweis der Seuchenfreiheit Quarantäne FLI 50
52 Zuständige Untersuchungseinrichtungen Veterinäruntersuchungs-, Tiergesundheitsämter bzw. Staatliche Lebensmittelund Veterinäruntersuchungsämter der Bundesländer Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Institut für Epidemiologie, Seestr. 55, Wusterhausen (nationales Referenzzentrum für Aujeszkysche Krankheit), Tel Rechtsgrundlagen Verordnung zum Schutz gegen die Aujeszkysche Krankheit vom 5. November 1993 Richtlinie 64/432/EWG des Rates vom 26. Juni 1964 zur Regelung viehseuchenrechtlicher Fragen beim innergemeinschaftlichen Handelsverkehr mit Rindern und Schweinen/* KODIFIZIERTE FASSUNG CF 375Y0820(01) */ 93/24/EWG: Entscheidung der Kommission vom 11. Dezember 1992 über ergänzende Garantien hinsichtlich der Aujeszky-Krankheit für Schweine, die für seuchenfreie Mitgliedstaaten oder Regionen bestimmt sind Amtsblatt Nr. L 016 vom 25/01/1993 S /244/EWG: Entscheidung der Kommission vom 2. April 1993 über ergänzende Garantien hinsichtlich der Aujeszky-Krankheit für Schweine, die für bestimmte Teile des Gemeinschaftsgebiets bestimmt sind Amtsblatt Nr. L 111 vom 05/05/1993 S Untersuchungsmaterial Untersuchungsmaterial Erregernachweis Nasen-, Rachen- und Genitaltupfer; Organmaterial wie Gehirn, Lunge, Tonsille (Menge: ca. 1 cm 3 ) bei verendeten bzw. geschlachteten Tieren, bei Saugferkeln evtl. auch Milz. Lagerung bei -20 C, optimal bei -80 C. Mehrfaches Einfrieren und Auftauen führt zur drastischen Senkung des Virustiters und damit der Nachweisbarkeit in der Zellkultur. Untersuchungsmaterial Antikörpernachweis Nativblutproben, Seren; Menge: mindestens 500 µl FLI 51
53 8.3. Untersuchungsgang Erregernachweis Antigennachweis mittels direkter Immunfluoreszenz (IFT) Herstellung von Kryostatschnitten auf fettfreien Objektträgern, Fixierung der Kryostatschnitte in Azeton für 10 bis 15 min bei ca. -20 C, Spülen in isotonischem Phosphatpuffer (IP) oder PBS, ph 7,2, für 5 min, Inkubation mit Konjugat in Arbeitsverdünnung bei 37 C (Dauer nach Produktinformation des Herstellers, Anti-PrV AV Gamakon B), dreimal Spülen in IP für insgesamt 10 min, kurzes Spülen in Aqua dest, lufttrocknen, Eindecken der Präparate in IP-Glycerol (9/1) IF-Mikroskopie bei 200-facher Vergrößerung unter Mitführung von Positiv- und Negativkontrollen Virusisolierung in der Zellkultur Das PrV vermehrt sich in Zellkulturen verschiedenster Herkunft mit charakteristischem cythopathogenem Effekt (CPE); am geeignetsten sind African Green Monkey (Vero)-Zellen. Folgende Methode hat sich bewährt: Virusisolierung Homogenisieren des Organmaterials, Herstellen einer Organsuspension (1:5 bis 1:10) unter Verwendung antibiotika- bzw. antimykotikahaltigen Mediums (Anlage), Lagerung für 1 bis 2 h bei 4 C im Kühlschrank, anschließende Zentrifugation. Inokulation des Überstandes auf die entsprechende Zellkultur (z. B. Vero, ML [mink lung]); zur Virusisolierung können 24-Lochplatten, Zellkulturröhrchen oder Zellkulturflaschen verwendet werden, das Zellkulturmedium sollte zur Verhinderung bakterieller Kontaminationen Antibiotika und Antimykotika in gebräuchlichen Konzentrationen enthalten (Anlage), anschließende Bebrütung bei 37 C für mindestens 7 Tage. tägliche Kontrolle des Auftretens eines CPE (bei hohem Virusgehalt diffus verteilte Zellabkugelungen nach ca. 1 bis 2 d, bei niedrigem Virusgehalt Entstehung von Synzytien oder einzelnen Plaques) bei latenten Infektionen kann unter Umständen eine bis zu vierfache Passagierung notwendig sein. Identifizierung des Virus durch Immunfluoreszenz an Deckglaskulturen Abtrypsinieren der CPE-Zellkultur, mischen mit einer Negativpopulation (1:2), vorsichtiges Abspülen der Objektträger in isotonischem Phosphatpuffer (IP), ph 7,2 (oder PBS), Auftragen der Zellen auf fett- und fluoreszenzfreie Objektträger, lufttrocknen, Fixierung in Azeton für 10 min bei Raumtemperatur (RT), 5 min IP, RT, nach kurzem Lufttrocknen Einlegen der Deckgläser in eine feuchte Kammer, FLI 52
54 Beschicken mit Konjugat (direkter IFT) bzw. monoklonalem Antikörper (indirekter IFT) (10 µl/objektträger je nach Gebrauchsverdünnung) die weitere Bearbeitung erfolgt unterschiedlich. Direkter IFT Inkubation mit FITC-Anti-AKV Konjugat (AV Gamakon B) in Gebrauchsverdünnung für 1 h bei 37 C (Gebrauchsverdünnung lt. Angaben des Herstellers) Indirekter IFT Inkubation mit monoklonalem AKV-Antikörper oder AKV-HIS vom Schwein je nach Gebrauchsverdünnung für 1 h bei RT in feuchter Kammer zweimaliges kurzes Abspülen in IP und Einlegen in frischen Spülpuffer (IP) für mindestens 5 min Inkubation mit FITC-Anti-Maus IgG (Gebrauchsverdünnung lt. Hersteller) für 1 h bei RT, zweimaliges kurzes Abspülen in IP und Einlegen in frischen Spülpuffer für mindestens 10 min, kurzes Abspülen in Aqua dest., lufttrocknen, Präparate in noch leicht feuchtem Zustand auf fluoreszenzfreie Objektträger in IP-Glycerol (9/1) eindecken. Identifizierung durch Virusneutralisationstest (siehe NT) Inkubation des vermeintlichen PrV-Isolates in log 10-Verdünnungen mit einem PrV-positiven and PrV-negativen Referenzserum vom Schwein für 2 h bei 37 C, Inokulation des Virus-Serumgemisches auf 96-well Mikrotiterplatte (Vierfachansatz) und anschließende Bebrütung für 2 bis 3 Tage bei 37 C, Kontrolle der virusneutralisierenden Aktivität Nachweis von PrV-DNA mittels Polymerasekettenrektion (PCR) Die PCR kann zum Nachweis von PrV-DNA in Organproben sowie in Tupferproben genutzt werden und kann vor allem beim Nachweis latenter AK-Infektionen von Vorteil sein. Je nach Fragestellung sind in der Literatur verschiedene PCR-Techniken für die Aujeszkysche Krankheit beschrieben. Primer und die Amplifikationsparameter müssen entsprechend der Zielstellung ausgewählt werden. Die PCR muss für die jeweiligen spezifischen Bedingungen optimiert werden, um unter Routinebedingungen erfolgreich zu funktionieren. Der hohe GC-Gehalt des PrV kann zu Schwierigkeiten führen. Generelle Arbeitsschritte sind: Homogenisierung des zu untersuchenden Probenmaterials, Proteinase K-Verdau, 3x Phenol-Chloroform-Extraktion, anschließende Fällung der DNA mittels 3m Natriumacetat und absolutem Alkohol, Amplifikation Agarosegel-Elektrophorese Am nationalen Referenzzentrum für die Aujeszkysche Krankheit am FLI ist eine PCR zum Nachweis viraler DNA etabliert, mit der Fragmente des gp50-gens und des gc- FLI 53
55 Gens nachgewiesen werden [Schang, L.M. and Orsorio, F. A. (1993). A quantitative technique for the study of the latency of Aujeszky virus. Rev. Sci. tech. Off. int. Epiz., 12, ] Indirekter Erregernachweis Enzyme Linked Immunosorbent Assay (ELISA) Bezüglich der Durchführung der einzelnen ELISA-Tests wird auf die Produktinformationen der Hersteller verwiesen. Serumneutralisationstest zur Antikörperbestimmung (SNT) Mit dem VNT (siehe NT) wird die spezifische und unspezifische virusneutralisierende Aktivität eines Testserums gemessen. Ausführung: Virusvermehrung aus Masterstockvirus (z. B. Laborstamm AK-64) auf Vero- Zellen in Zellkulturflaschen (Dichte Zellen/ml), Virusernte nach ca. 24 bis 48 h (CPE sollte ca. 80 bis 90 % des Zellrasens erfasst haben), 3x Einfrieren-Auftauen mit anschließender Zentrifugation Titration des Arbeitsvirus auf Mikrotiterplatten (Vierfachansatz), Bestimmung des Virustiters nach Kärber (nach 48 h), Arbeitsvirus aliquotieren in 1 ml Portionen, Lagerung bei -80 C Einstellen der Virussuspension auf 200 KID 50 /0,1ml Serum von Nativblutproben (keine EDTA-Plasmaproben); Inaktivierung in Mediumverdünnung (1:2) für 30 Minuten bei 56 C im Wasserbad Serumverdünnung der Test- und Referenzseren (Positiv- Negativserum) in lg2-schritten in Mikrotiterplatte oder Röhrchen (100 µl) Zugabe eines äquivalenten Volumens (100 µl) der Virussuspension (200 KID 50 /0,1ml), Inkubation für 2 h bei 37 C (Inkubation für 24 h erhöht die Sensitivität des Tests) Inokulation eines 1 d alten Monolayers (Vero-Zellen, Dichte ca Zellen/ml), bei dieser Zellkonzentration soll sich nach einem Tag ein fast konfluenter Monolayer ausgebildet haben) Platten für 3 Tage bei 37 C inkubieren mikroskopische Ablesung des Tests, Bestimmung des Ak-Titers nach Kärber (Grenzwert = 1:4). FLI 54
56 Anhang Zelllinien Virusisolierung: Vero 76: VNT Katalognummer: 228 Bezugsquelle: Zellbank für Zelllinien in der Veterinärmedizin am FLI, Institut für Infektionsmedizin, Insel Riems, Dr. Riebe Medien Medien für Zelllinie Vero 76: Anzuchtmedium: 89 % Eagle MEM Dulbecco w/l-glut 10 % Fetales Kälberserum (FKS) 1 % Antibiotika Antibiotika: Amphotericin B (250 µg/ml) Penicillin ( IE/l), Streptomycin (100 mg/l) oder Gentamycin (50mg/ml) Erhaltungsmedium: 96 % Eagle MEM Dulbecco w/l-glut 3 % FKS 1 % Antibiotika Puffer, Lösungen, Reagenzien PBS: 8,00g NaCl + 0,2g KH 2 PO 4 + 2,9g Na 2 HPO 4 x 12 H ,2g KCl ad ml Aqua bidest, ph 7,2 Isotonischer 8,28g NaCl + 3,30g Na 2 HPO 4 x 12 H 2 0 ad ml Aqua bidest Phosphatpuffer: (IP) ph 7,8 IP-Glycerol: IP - Glycerol = 9 : 1 Anti-AKV-Konjugat: FITC-markiertes Anti-AKV-Konjugat FLI 55
57 9. Aviäre Influenza 9.1. Charakterisierung der Infektion `Geflügelpest' ist ein historischer Krankheitsbegriff, der im englischen Sprachraum in den letzten Jahren generell durch avian influenza' (aviäre Influenza) ersetzt wurde. Infektionen mit aviären Influenzaviren variieren, abhängig vom viralen Sub- bzw. Pathotyp sowie wirtsspezifischen Faktoren, stark in der Schwere der Erkrankung. Neben inapparenten Formen sind perakute Verlaufsformen mit bis zu100 % Mortalität möglich. Ausschlaggebend dafür ist vor allem die Virulenz des Erregerstammes. Der Begriff `Geflügelpest' beinhaltet nur die schweren, anzeigepflichtigen Verlaufsformen der aviären Influenza, hervorgerufen durch hochpathogene Virusstämme, die sich bislang ausschließlich aus den Subtypen H5 und H7 rekrutiert haben. Alle Infektionen des Hausgeflügels mit aviären Influenzaviren der Subtypen H5 und H7, also auch solche mit Stämmen niedriger Pathogenität, sind gemäß geltendem EU-Recht bekämpfungspflichtig Erreger Influenzaviren gehören zur Familie Orthomyxoviridae. Es sind umhüllte RNA-Viren, die aufgrund der Antigenität ihrer Nukleo- und Matrixproteine in die Typen A, B und C und, im Falle des Typs A, nach den Hüllantigenen Hämagglutinin (H) und Neuraminidase (N) in Subtypen unterteilt werden. Sie zeigen eine große antigene Vielgestaltigkeit und Wandlungsfähigkeit und ein breites Virulenzspektrum. Die von Vögeln isolierten Influenzaviren gehören ausnahmslos zum Typ A und umfassen derzeit mindestens 16 H- und 9 N-Subtypen in (theoretisch) 144 Kombinationen. Reservoir aller dieser Subtypen sind aquatisch lebende Wildvögel. Alle bisher isolierten hochpathogenen aviären Influenzaviren (HPAIV) - Erreger der Geflügelpest - gehörten zum Subtyp H5 oder H7. Es gibt jedoch auch H5- und H7- Virusisolate von niedriger Pathogenität (engl. `low pathogenic avian influenza viruses', LPAIV). Letztere haben die Potenz zu einer sprunghaften Pathogenitätssteigerung und sind als potentielle Erreger der Geflügelpest anzusehen. Entscheidend für ihre Einstufung gemäß Tierseuchenrecht ist hierbei einerseits das Verhalten im Versuchshuhn (Bestimmung des intravenösen Pathogenitätsindex, IVPI) sowie gleichrangig - andererseits die Aminosäuresequenz im Bereich der endoproteolytischen Schnittstelle des Hämagglutinins (monobasisch versus polybasisch). Isolate mit einem IVPI > 1.2 werden als hochpathogen bewertet, solche mit Indices < 1.2 sind niedrig-pathogen. Alternativ hierzu werden Isolate mit monobasischer Schnittstelle definitionsgemäß als niedrig-pathogen bewertet; solche mit polybasischer Schnittstelle sind als hochpathogen einzustufen. Alle H5- und H7-Viren werden aufgrund ihrer Bedeutung in der OIE-Klassifizierung als notifiable avian influenza = NAI bezeichnet. FLI 56
58 Klinische Symptomatik Vermutlich sind alle Vogelspezies empfänglich für eine Influenzavirusinfektion; bei Wildvögeln treten jedoch nur selten Erkrankungen auf. Auch die Hausgeflügelarten erkranken nicht einheitlich. Hochempfänglich sind Hühnervögel, vor allem Puten und Hühner; bei ihnen kann die Mortalität nach Infektionen mit HPAIV bis 100 % betragen. Puten zeigen nicht selten auch bei Infektionen mit LPAIV klinische Symptome. Abbildung 1: Pekingente mit zentralnervösen Störungen (Inkoordination, Lähmungen) nach Infektion mit HPAIV H5N1 (Dr. Werner, FLI) Die Hauptsymptome der durch HPAIV ausgelösten Geflügelpest sind Rückgang des Futterverbrauchs, Apathie, Atemnot, Ödeme der Kopfregion, Zyanose und Ödeme der Kopfanhänge, Durchfall, hohe Mortalität, bei Legetieren Einbruch der Eiproduktion. Oft sterben die Tiere auch ohne vorherige klinische Symptome. Bei der Sektion können gelegentlich Hämorrhagien auf den Serosen (Abb. 2), im Drüsenmagen u. a. Organen, Pankreasveränderungen (Abb. 3) sowie bei Legetieren hämorrhagische Eierstockentzündung und Dotterperitonitis beobachtet werden. Weder klinisches Bild noch Sektionsbefund sind pathognomonisch. Abbildung 2: Subepikardiale petechiale Blutungen (Prof. Dr. Teifke, Institut für Infektionsmedizin, FLI) FLI 57
59 Abbildung 3: Umschriebene Pankreasnekrosen (Prof. Dr. Teifke, Institut für Infektionsmedizin, FLI) Differentialdiagnostik Bei plötzlichem Auftreten einer schweren Allgemeinerkrankung des Geflügels mit hoher Morbidität und Mortalität ist immer auch an Geflügelpest zu denken. Differentialdiagnostisch sind u. a. Newcastle Krankheit (engl. `Newcastle Disease', ND), Geflügelcholera und akute Vergiftungen abzuklären. Im Verdachtsfall (Meldung beim zuständigen Veterinäramt) sind Proben nach Maßgaben des EU-Handbuchs zur Diagnostik der aviären Influenza (Entscheidung 2006/437/EU) zu entnehmen, wobei frisch verendete oder moribunde Tiere sowie Tupfer- und ggf. Blutproben im zuständigen Staatlichen Veterinäruntersuchungsamt zu untersuchen sind. Kriterien, die den Verdachtsfall rechtfertigen, schildert u. a. 4 der bundesdeutschen Geflügelpestverordnung. Für die Diagnose ist die Virusisolierung oder der molekular-diagnostische Genomnachweis und die Bestimmung der Pathogenität des Erregers mittels Tierversuch oder molekular-diagnostischer Verfahren erforderlich. In der Richtlinie 2005/94/EG vom 20. Dezember 2005, auf die sich die bundesdeutsche Geflügelpest-Verordnung vom bezieht, ist für die diagnostischen Verfahren zur Bestätigung und Differentialdiagnose der Geflügelpest sinngemäß folgende Definition gegeben: Die Geflügelpest ist eine Infektionskrankheit, die von einem Influenza-A-Virus mit einem intravenösen Pathogenitätsindex (IVPI) in sechs Wochen alten Hühnern von 1,2 oder mehr verursacht wird bzw. eine Influenza-A-Infektion der Virussubtypen H5 und H7, bei der im Rahmen einer Nukleotid-Sequenzanalyse das Vorhandensein multipler basischer Aminosäuren im Spaltbereich des Hämagglutinins nachgewiesen wurde. Die oben genannten Rechtssetzungen legen in Übereinstimmung mit den Regelungen des OIE darüber hinaus fest, dass Infektionen des Hausgeflügels mit allen Viren vom Subtyp H5 und H7 (NAI), unabhängig vom jeweiligen Pathotyp, zu maßregeln sind. Weiterhin führen Nachweise des HPAIV H5N1 asiatischer Herkunft bei Wildvögeln ebenfalls zu weitreichenden Bekämpfungsmaßnahmen. FLI 58
60 Diagnostische Indikation An Geflügelpest muss generell bei schwerer Allgemeinerkrankung mit hoher Morbidität und Mortalität insbesondere in gegen ND geimpften Geflügelbeständen gedacht werden. Die Geflügelpest-VO legt fest, ab welchen Verlustraten und bei welchen Veränderungen eine Untersuchung auf Geflügelpest (Ausschlussdiagnostik) unverzichtbar ist Zuständige Untersuchungseinrichtungen Staatlich autorisierte Veterinäruntersuchungsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer FLI, Institut für Virusdiagnostik, Greifswald-Insel Riems (O.I.E. und Nationales Referenzlabor für aviäre Influenza), Tel / Rechtsgrundlagen Richtlinie 2005/94/EG vom 20. Dezember 2005 Diagnostikhandbuch der EU für Aviäre Influenza gem. Entscheidung 2006/437/EG vom 4. August 2006 Verordnung zum Schutz gegen die Geflügelpest (Geflügelpest-VO) in der jeweils gültigen Fassung Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung 9.2. Untersuchungsmaterial Erregernachweis Kloakenabstriche oder Fäzes und Abstriche aus dem Oropharynx von lebenden Vögeln. Fäzes oder Darminhalt, Hirngewebe, Luftröhre, Lunge, Niere, Milz, Leber sowie andere Organe kürzlich verendeter oder getöteter Tiere. Fäkalmaterial ist von anderen Proben getrennt zu halten. Alle Probenmaterialien sollten während des Transportes gekühlt werden. Abstriche sollten ganz in ein Stabilisierungsmedium (antibiotisch, proteinhaltig) eingetaucht werden Antikörpernachweis Blutproben, von denen Heparin-Plasma oder nach Gerinnung das Serum für die Untersuchung gewonnen wird. Anstelle von Serum kann auch Eidotter aufbereitet und untersucht werden. Die jeweils zu entnehmenden Stichprobengrößen regelt das Diagnostikhandbuch der EU im Detail. FLI 59
61 9.3. Untersuchungsgang Siehe Abbildung 4 Abbildung 4: Untersuchungsgang zum direkten Erregernachweis bei Geflügelpest gem. EU- Diagnostikhandbuch, modifiziert durch NRL FLI 60
62 Direkter Erregernachweis Probenaufbereitung Organe und Gewebe können gepoolt werden, nur Fäkalmaterial ist gesondert zu behandeln. Abstriche sollten ganz in antibiotisches Medium getaucht werden. Fäzes und Organe sind in antibiotischem Medium im geschlossenen Homogenisator zu zerkleinern (Sicherheitsvorkehrungen zur Vermeidung von Aerosolen sind zu beachten), um eine 10- bis 20%ige Suspension herzustellen. Zur Entfaltung der antibiotischen Wirkung sind die Suspensionen für mindestens 30 Minuten bei Umgebungstemperatur (bei 4 C entsprechend länger) stehen zu lassen und danach durch Zentrifugieren zu klären (z. B. 800 bis 1000 g für 10 Minuten). Virusisolierung in embryonierten Hühnereiern Pro Probe sind mindestens 4 embryonierte, 8 bis 10 Tage vorbebrütete Hühnereier mit je 0,1 bis 0,2 ml des geklärten Überstandes in die Allantoishöhle zu beimpfen. Die Eier sollten aus einer spezifiziert pathogenfreien (SPF) Herde stammen; im Notfall können auch Eier aus einem Bestand verwendet werden, der nachweislich frei von Influenza-Antikörpern ist. Die beimpften Eier werden bei 37,0 C bis 37,8 C weiterbebrütet und täglich durchleuchtet. Eier mit toten oder absterbenden Embryonen sind auf 4 C abzukühlen, ebenso alle verbliebenen Eier 5 Tage nach der Beimpfung. Die Allantois- und Amnionflüssigkeiten (AAF) sind auf Hämagglutination zu untersuchen. Lässt sich keine Hämagglutination feststellen, wird die unverdünnte AAF erneut auf Eier verimpft (2. Eipassage). Wird Hämagglutination festgestellt, so muss eine bakterielle Kontamination ausgeschlossen werden. Sind Bakterien vorhanden, so können die AAF durch 450 nm- Membranfilter gegeben werden und nach Zugabe weiterer Antibiotika erneut auf embryonierte Eier verimpft werden. Zellkulturen sind wegen ihrer geringeren Sensitivität für die Isolierung von Influenzavirus derzeit ungeeignet. Antigen-Schnelltest Für den Nachweis von Influenzavirusantigen binnen 20 bis 40 Minuten werden eine Reihe von konfektionierten Testbestecken kommerziell angeboten. Diese Tests zeichnen sich durch eine sehr einfache Handhabung aus und wären daher auch durch Laien und direkt im Stallbereich anwendbar. Derzeit liegen jedoch nur begrenzte Erfahrungen im Umgang mit diesen Tests im Felde vor. Aus experimentellen Untersuchungen, u. a. im NRL, wurde jedoch eine gegenüber der Virusisolierung und den PCR-Nachweisverfahren deutlich verminderte Sensitivität dieser Tests erkennbar. Somit sind diese Tests nicht für eine Ausschlussdiagnostik am Einzeltier einsetzbar, da ein negatives Ergebnis das Vorhandensein anzeigepflichtiger Influenzaviren des Typs A nicht sicher ausschließt. Diese Tests (auch wenn eine Zulassung des FLI vorliegt) können also derzeit bestenfalls für eine (nicht-amtliche!) grob orientierende Voruntersuchung eingesetzt werden und ersetzen niemals Untersuchungen mittels Virusisolierung oder RT-PCR. FLI 61
63 Nachweis viraler RNA mittels RT-PCR Aus Kloaken- und Rachentupferproben und aus Organ- und Fäzesmaterial kann virale RNA mittels RT-PCR oder real-time RT-PCR (rrt-pcr) nachgewiesen werden. Der rrt-pcr ist aufgrund ihrer höheren Sensitivität und des geringeren Kontaminationsrisikos der Vorzug zu geben. Die PCR kann vor der Virusisolierung, parallel dazu oder als Bestätigungstest (z. B. virushaltige AAF) eingesetzt werden. Für den Ja- /Nein-Nachweis von Influenza A-Virus-RNA wird eine rrt-pcr durchgeführt, die ein Fragment des Matrixprotein-Gens amplifiziert. Darüber hinaus werden rrt-pcr- Teste zum subtypspezifischen Nachweis von H5-, H7- und N1-AIV eingesetzt. Die durch das Referenzlabor der EU derzeit validierten Methoden sind dem Diagnostikhandbuch der EU zu entnehmen oder können im Nationalen Referenzlabor (NRL) abgefragt werden. Gegenüber den Angaben des Diagnostikhandbuchs werden im NRL erweiterte rrt-pcr Methoden eingesetzt (Abb. 1), die auch den Einsatz einer internen Kontrolle zum Ausschluss falsch-negativer Befunde durch PCR-Inhibitionen beinhalten. Methodik und Referenzmaterial können im NRL abgefordert werden. ACHTUNG! Wurde ein Influenzavirus der Subtypen H5 oder H7 bei Hausgeflügel nachgewiesen, ist die Probe zusammen mit einem Aliquot der extrahierten RNA bzw. das Isolat sofort zur weiteren Charakterisierung an das Nationale Referenzlabor für aviäre Influenza im FLI, Insel Riems weiterzuleiten. Tabelle 1: Zu kalkulierende Dauer der diagnostischen Methoden zum Nachweis und zur Charakterisierung aviärer Influenzaviren Methodik PCR mit Ergebnis Influenza Ja/Nein PCR mit Ergebnis AIV H5 oder H7 sowie rrt- Pathotypisierung (H5); Pathotypisierung mittels Nukleotidsequenzierung Virusanzucht und H-Subtypisierung (Verdacht HPAIV) Aussagen zur Pathogenität mittels Tierversuch (Bestätigung HPAIV) Ausschluss Geflügelpest mittels klassischer Methodik (Nachweis von Influenzavirus mit IVPI < 1.2) bzw. Ausschluss AIV (fortgesetzte Passagierung mit negativem Ergebnis) Dauer 1 Tag 1-3 Tage 2-4 Tage 3-6 Tage 14 Tage 21 Tage Indirekter Erregernachweis Zur allgemeinen Voruntersuchung auf Antikörper gegen eine Influenza-A- Virusinfektion sind vor allem ELISA Tests geeignet, bei denen Antikörper nachgewiesen werden, die gegen die gruppenspezifischen Antigene gerichtet sind. Die Anwendung kommerzieller ELISA-Kits erfolgt nach den Empfehlungen des Herstellers. Hierbei ist auf das Vorliegen einer Zulassung für amtliche Untersuchungen der einzusetzenden Tests durch das FLI zu achten. FLI 62
64 Im Falle positiver Reaktionen müssen die Antikörper mittels HAHT subtypisiert werden; hierbei sind zumindest Antikörper gegen die Subtypen H5 und H7 auszuschließen. Gezielte Untersuchungen auf Antikörper gegen Influenzavirus vom Subtyp H5 oder H7 oder einen anderen H-Subtyp können mit dem HAHT unter Einsatz des H- Subtyp-spezifischen Antigens erfolgen. HAHT-Untersuchungen des EUkofinanzierten Hausgeflügelmonitorings sind mit den durch das Referenzlabor der EU vorgeschriebenen Antigenen durchzuführen. Aliquots dieser Antigene können gebührenfrei beim NRL-AI des FLI abgerufen werden. HAHT Untersuchungen im Rahmen anderer Programme, insbesondere gebührenpflichtige Untersuchungen, führen die Untersuchungseinrichtungen mit kommerziell bezogenen oder selbst hergestellten Antigenen ihrer Wahl durch. Kommerziell erhältliche Diagnostika: FLI-zugelassene ELISA-Kits zum Nachweis von Antikörpern gegen aviäre Influenzaviren Avian Influenza Virus Antibody Test Kit BioChek BFAV-B 361 Kurzform: AI ELISA Avian Influenza Virus Multispezies Antikörper BioChek FLI-B 472 Testkit Kurzform: AI MSp ELISA Testkit zum Nachweis von Antikörpern gegen das IDEXX BGVV-B 219 Virus der Aviären Influenza Kurzform: FlockChek AI Testkit zum Nachweis von Antikörpern gegen das IDEXX FLI-B 444 Virus der Aviären Influenza, ELISA (MultiS-Screen) Kurzform: FlockChek AI MultiS-Screen ID Screen Influenza A Antibody Competition ID Vet FLI-B 438 Kurzform: FLUAcA ELISA Test zum Nachweis von spezifischen Antikörpern Institut Pourquier FLI-B 442 gegen das Nukleoprotein des Virus der Aviären Influenza Kurzform: AI A Blocking ELISA FLOCKTYPE recaiv Screening, ELISA-Testkit zum Labor Diagnostik FLI-B 435 Nachweis von Antikörpern gegen das Virus der Leipzig Aviären Influenza in Huhn und Pute Kurzform: FLOCKTYPE recaiv Screening FLOCKTYPE recaiv Verification, ELISA-Testkit Labor Diagnostik FLI-B 436 zum Nachweis von Antikörpern gegen das Virus der Leipzig Aviären Influenza in Huhn und Pute Kurzform: FLOCKTYPE recaiv Verification IDScreen Influenza H5 antibody Competition. Kurzform: FLUACH5 ID Vet FLI-B 506 Weitere ELISA Kits sind in Zulassung befindlich. FLI 63
65 10. Befall mit dem Kleinen Beutenkäfer (Aethina tumida) Charakterisierung des Befalls Erreger Der Kleine Beutenkäfer, Aethina tumida Murray, Coleoptera: Nitidulidae (Murray 1867), kommt natürlich in Afrika südlich der Sahara vor. Der Käfer hat sich inzwischen durch Importe von Bienen auf andere Kontinente ausgebreitet. Der Käfer sucht seine Wirte, die Bienenvölker, zur Vermehrung auf. Nach der Verpaarung im Bienenvolk werden die Eier in unregelmäßigen Gelegen bevorzugt in Spalten der Beuten oder in Waben, die Pollen und Brut enthalten, abgelegt. Nach zwei bis sechs Tagen schlüpfen die Larven und beginnen zu fressen. Nach zehn bis 29 Tagen haben die Larven ihr Wachstum abgeschlossen und sind ca. zehn bis zwölf Zentimeter lang. Die Larven wandern nun durch den Stockeingang und bohren sich meist in unmittelbarer Nähe des befallenen Volkes in den Boden. Sie können aber auch größere Entfernungen zurücklegen. Im Boden bauen sie glattwandige Erdzellen, in denen sie sich verpuppen. Die Verpuppung dauert je nach Temperatur und Feuchtigkeit drei bis vier Wochen. Danach schlüpfen die ausgewachsenen Käfer und suchen neue Beuten mit Bienenvölkern auf. Damit ist der Lebenszyklus des Kleinen Beutenkäfers abgeschlossen. Abbildung 1 Abbildung 2 Abbildung 3 Abbildungen 1 bis 3: Entwicklung des Kleinen Beutenkäfers: Larve (Wanderlarve), Puppe und Adultus FLI 64
66 Klinische Symptomatik Der Käfer lebt und vermehrt sich hauptsächlich in Bienenvölkern und gelagerten Bienenprodukten, z. B. Waben, kann sich jedoch auch auf Obst fortpflanzen. Die Larven fressen Honig, Pollen und Brut und zerstören dabei nicht nur die Waben, sondern verderben auch den Honig. Leicht befallene Waben zeigen Fressgänge der Larven, sowie Verschleimung des Honigs. Stark befallene Waben zerfallen. Am Beutenboden verbleibt bei starkem Befall häufig nur ein schwärzlich trockenes Mehl (Fraßmehl) aus dem Kot der Larven und zerstörtem Wachs. Sind Honigwaben befallen, so läuft der vergorene, schleimige Honig aus den Waben auf den Beutenboden und aus dem Flugloch. Es entsteht fauliger Geruch Differentialdiagnostik Der Kleine Beutenkäfer kann z. B. mit dem nahe verwandten Glanzkäfer, Cychramus luteus, der ebenfalls in Bienenvölkern vorkommenden kann, leicht verwechselt werden. Die Eier des Kleinen Beutenkäfers sind mit im Mittel 1,4 0,26 mm etwa um ein Drittel kleiner als Eier der Honigbiene. Käferlarven können von Wachsmottenlarven anhand ihrer morphologischen Merkmale leicht unterschieden werden: Wachsmottenlarven haben Bauchfüße am 3. und 6. Hinterleibssegment, Käferlarven besitzen sechs voll ausgebildete Beine in unmittelbarer Nähe des Kopfes und dorsale Stachelreihen (Abbildung 1) Diagnostische Indikation Tierverkehr klinischer oder epidemiologischer Verdacht Untersuchungen im Rahmen des Nachweises der Seuchenfreiheit (Gesundheitszeugnisse für das Verbringen der Bienenvölker an einen anderen Standort) Zuständige Untersuchungseinrichtungen Veterinäruntersuchungsämter, Tiergesundheitsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer. Chemisches und Veterinäruntersuchungsamt Freiburg, Tierhygiene, Am Moosweiher 2, Freiburg (Referenzlabor für Bienenkrankheiten des OIE), Tel.: 0761/ Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Südufer 10, Greifswald Insel Riems (NRL für Bienenkrankheiten), Tel.: / Rechtsgrundlagen Bienenseuchenverordnung vom (BGBl. I S. 1552), in der jeweils geltenden Fassung. FLI 65
67 10.2. Untersuchungsmaterial Zur Untersuchung bieten sich der adulte Käfer, die Larven, der Beutenboden (Bodeneinlagen), und die Waben bzw. Honigwaben an. 1. Untersuchungsmaterial Gemülle Eine einfache Methode zur Diagnose des Kleinen Beutenkäfers besteht in der Untersuchung des Beutenbodens. Bei starkem Befall trockener Waben (Pollen und/oder Brut) verbleibt häufig nur noch ein schwärzliches trockenes Pulver (Fraßmehl) aus dem Kot der Larven und zerstörtem Wachs, das sich auf dem Boden der Beute anhäuft. In diesem Pulver können sich die Larven oder Käfer verstecken. So kann der Beuteboden direkt makroskopisch auf vorhandene Käfer oder Larven untersucht werden. 2. Untersuchungsmaterial Waben Durch das Fressen und Kotabsetzen der Larven des kleinen Beutenkäfers werden die Honigwaben stark beschädigt und bekommen ein schleimiges Aussehen. Der Honig ist verdorben und unbrauchbar. Leere Waben und Brutwaben weisen Fraßgänge der Larven auf. 3. Untersuchungsmaterial aus Käferfallen Die Käfer verstecken sich vor Licht oder den attackierenden Bienen meist in Spalten und Ritzen, bevorzugt in der Nähe des Bodenbretts. Man kann daher am Beutenboden Käferfallen auslegen. Diese können im einfachsten Fall aus einem Stück Wellpappe bestehen, unter dem sich die Käfer sammeln. Effektiver kann man die Käfer in einem am Beutenboden ausgelegten Diagnose-Streifen fangen (Kunststoff- Doppelstegplatte: 0,4 7,5 50 cm) Untersuchungsgang 1. Identifizierung der adulten Käfer und Larven Die Bestimmung des Käfers und Larven erfolgt aufgrund ihres Aussehens und der morphologischen Besonderheiten. Weiteres hierzu siehe in der Broschüre des Bundesministeriums für Verbraucherschutz, Ernährung und Landwirtschaft Der kleine Beutenkäfer Erkennen und Bekämpfen. Als Vergleichsmaterial dienen abgestorbene Käfer bzw. Larven. 2. Molekularbiologische Methoden: PCR Molekulargenetische Methoden werden in Kürze angeboten. 3. Serologische Tests Antiseren sind zurzeit nicht käuflich zu erwerben. FLI 66
68 11. Befall mit der Tropilaelaps-Milbe Charakterisierung der Infektion Erreger Tropilaelaps-Milben sind braun-rot gefärbte, längliche Parasiten mit einer Größe von 0,7 bis 1 mm (Abbildung 1). Sie können sich sehr schnell auf den Waben der Honigbienen fortbewegen. Bis zu zwei Tagen halten sie sich auf erwachsenen Bienen auf (phoretische Phase). Dort parasitieren sie nicht, da sie im Gegensatz zu Varroa- Milben den Chitinpanzer der Bienen nicht durchstechen können. Die Milbenweibchen (bis zu einem Dutzend pro Zelle) legen kurz vor der Deckelung 1 bis 4 Eier in die Brutzellen der Bienen. Die Milbenentwicklung dauert ca. eine Woche, danach verlassen die ausgewachsenen Milben einschließlich des Gründerweibchens mit der schlüpfenden Biene die Zelle. Abbildung 1: Von Tropilaelaps-Milben befallene Bienenbrut (Puppe) Klinische Symptomatik Bienen mit verkürztem Abdomen und missgebildeten Flügeln, sowie missgebildeten oder fehlenden Gliedmaßen können ein Anzeichen für den Befall mit Tropilaelaps- Milben sein. Brutwaben weisen ähnlich wie bei einem Befall mit Varroa-Milben tote Brut mit eingesunkenem oder teilweise entferntem Zelldeckel auf Differentialdiagnostik Die Differentialdiagnose mit Varroamilben (Varroa destructor) oder Bienenläusen (Braula coccea) ist leicht visuell oder makroskopisch mit einer schwachen Lupe (vierfache Vergrößerung) möglich. Eine genauere Abgrenzung hinsichtlich der morphologischen Merkmale ist bei Pollenmilben und anderen auf den Waben laufenden Milben notwendig. FLI 67
69 Diagnostische Indikation Tierverkehr klinischer oder epidemiologischer Verdacht Untersuchungen im Rahmen des Nachweises der Seuchenfreiheit (Gesundheitszeugnisse für das Verbringen der Bienenvölker an einen anderen Standort) Zuständige Untersuchungseinrichtungen Veterinäruntersuchungsämter, Tiergesundheitsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer oder die von den Ländern beauftragten staatlichen Einrichtungen. Chemisches und Veterinäruntersuchungsamt Freiburg, Tierhygiene, Am Moosweiher 2, Freiburg (Referenzlabor für Bienenkrankheiten des OIE), Tel.: 0761/ Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Südufer 10, Greifswald Insel Riems (NRL für Bienenkrankheiten), Tel.: / Rechtsgrundlagen Bienenseuchenverordnung vom (BGBl. I S. 1552) in der jeweils geltenden Fassung Untersuchungsmaterial Um einen Befall in einem Volk zu erkennen, müssen die Proben gezielt gesammelt und entnommen werden. 1. Untersuchungsmaterial Gemülle Eine einfache Methode zur Diagnose des Befalls mit Tropilaelaps-Milben besteht in der Untersuchung von dem im Bienenvolk gewonnenen Gemülle, das auf einer am Boden der Beute eingelegten Einlage gesammelt wird. Die Bodeneinlagen sollten nicht länger als zwei Tage im Volk liegen, da die Milben sonst von Ameisen entfernt werden könnten. Es kann von Vorteil sein, die Bodeneinlagen mit Vaseline oder Melkfett zu bestreichen, damit die Milben darin haften. 2. Untersuchungsmaterial Bienenbrut Für die Diagnose des Befalls der Brut mit Tropilaelaps-Milben kann nur gedeckelte Brut verwendet werden. Drohnenbrut eignet sich besser als Arbeiterbrut. 3. Untersuchungsmaterial adulte Bienen Bienenproben eigen sich nur bedingt zur Untersuchung auf den Befall mit Tropilaelaps-Milben. Die Milbe sitzt sehr locker auf den Bienen und verlässt tote Bienen sofort. Am besten füllt man lebende Bienen direkt in ein Gefäß und tötet sie darin durch Einfrieren ab. FLI 68
70 11.3. Untersuchungsgang 1. Untersuchung von Wabenoberflächen Für ein Screening des Befalls mit Tropilaelaps-Milben eignet sich die Untersuchung der Oberfläche von Brutwaben einzelner Bienenvölker. Dazu werden die Bienen von der Wabe in das Bienenvolk abgefegt und anschließend die Wabe über einem offenen mit Wasser oder Alkohol gefüllten Behälter abgeklopft. Die Flüssigkeit wird anschließend durch ein Sieb (Maschenweite 2 bis 3 mm) gegossen und dieses auf Milben untersucht. 2. Untersuchung von Gemülle Ist nur wenig Gemülle vorhanden, kann die Bodeneinlage direkt makroskopisch auf vorhandene adulte Milben untersucht werden. Bei sehr großen Gemüllemengen ist es vorteilhaft, eine Untersuchung mit Hilfe des Flotationsverfahrens durchzuführen. Das Gemülle sollte vor der weiteren Verarbeitung für die Dauer von 24 Stunden getrocknet werden. Anschließend wird es mit der doppelten Menge vergälltem Alkohol aufschwemmt und für eine Minuten gerührt. Nur wenn das Gemülle Propolispartikel enthält, muss es 10 bis 20 Minuten gerührt werden. Die an der Oberfläche schwimmenden Milben können nun identifiziert und gezählt werden. 3. Untersuchung von Bienenbrut Welche der folgenden Methoden verwendet wird, hängt von dem Umfang der Probe und von der notwendigen Genauigkeit der Untersuchung ab. Soll ein Überblick über einen Befall gegeben werden, so kann die Brutfläche insgesamt untersucht werden. Untersuchung von Brutflächen Mit einem Messer werden die Zelldeckel der Brutfläche entfernt und die Brut direkt mit warmem Wasser aus der Handbrause in ein doppeltes Siebsystem gewaschen. Die Brut und andere Teile aus dem oberen groben Sieb (Maschenweite 2 bis 3 mm) kann man verwerfen. Die Milben können im unteren feinen Sieb (Maschenweite < 1 mm) gesammelt werden. Zur leichteren Identifizierung der Milben schlägt man den Inhalt des Siebes auf eine helle Unterlage. Untersuchung von einzelnen Brutzellen Zur Untersuchung von einzelnen Brutzellen werden die Zelldeckel mit einer Pinzette oder Skalpell entfernt, die Brut der Honigbienen aus der Zelle entfernt und dann die Brut sowie das Innere der Zelle unter Zuhilfenahme einer Kaltlichtlampe auf vorhandene Milben bzw. andere Anzeichen eines Milbenbefalls untersucht. 4. Untersuchung von adulten Bienen Bei einer kleinen Probe (< 50 Bienen) reicht es aus, die Bienen makroskopisch zu untersuchen. Bei großen Bienenmengen kann ein Auswaschungsverfahren verwendet werden. FLI 69
71 Auswaschungsverfahren Noch lebende Bienen mit Äther abtöten oder alternativ für die Dauer von mindestens zwei Stunden tiefkühlen. Die toten Bienen in einen Glaskolben mit der doppelten Menge an vergälltem Alkohol füllen und 10 Minuten lang schütteln. Anschließend die Bienen von den Tropilaelaps-Milben mit einem Sieb (Maschenweite 2 bis 3 mm) trennen und auszählen. Auswertung Tropilaelaps-Milben können mit bloßem Auge erkannt werden. Die Bestimmung der Milben und deren Nachkommen erfolgt aufgrund ihres Aussehens und ihrer morphologischen Besonderheiten. Nähere Angaben im Manual Standards for Diagnostic and Vaccines der OIE (2008). 5. Molekularbiologische Methoden: PCR Molekulargenetische Methoden stehen in Kürze zur Verfügung. 6. Serologische Tests Antiseren sind zurzeit nicht käuflich zu erwerben. FLI 70
72 12. Beschälseuche der Pferde Charakterisierung der Infektion Erreger Beschälseuche (Dourine) ist eine Deckseuche der Einhufer, die klassischerweise durch die Infektion mit Trypanosoma (T.) equiperdum (Doflein, 1901) verursacht wird. Im Gegensatz zu allen übrigen Trypanosomen wird der Erreger nicht durch Insekten sondern ausschließlich beim Deckakt übertragen. Neuere molekulare Untersuchungen zeigen, dass T. equiperdum sehr nahe mit T. evansi verwandt ist und mit heutigen diagnostischen Mitteln nicht sicher unterschieden werden kann. Andererseits kann auch T. evansi beim Pferd eine ähnliche Symptomatik auslösen wie T. equiperdum Klinische Symptomatik Da die Beschälseuche in Westeuropa nicht mehr vorkommt, werden kaum Pferde mit charakteristischen Symptomen angetroffen. In Ländern mit endemischem Vorkommen nimmt die Krankheit oft einen chronischen Verlauf, der sich über Jahre erstrecken kann. Gelegentlich werden aber auch akute Fälle beobachtet, die innerhalb von wenigen Wochen zum Tode führen. Typische klinische Erscheinungen im Frühstadium sind ödematöse Schwellungen im Bereich der Genitalien, kreisförmige Ödeme am Unterbauch und im Bereich der Rippen ("Talerflecken"). Später treten nervöse Symptome auf wie unkoordinierte Bewegungen der Hinterextremitäten, Lähmung des Nervus facialis u. a. Bei Importpferden aus Risikogebieten (z. B. Mongolei, Afrika) werden bei auch bei ansonsten fehlender Symptomatik hin und wieder Serumantikörper nachgewiesen, die den Verdacht auf eine Infektion nahe legen Differentialdiagnostik Einzelne ähnliche Krankheitserscheinungen treten auch bei der Deckdruse (Erreger: Streptococcus equi) und beim Bläschenausschlag (Koitales Exanthem, Erreger: Equines Herpes-Virus Typ III) oder auf Grund orthopädischer Ursachen auf Diagnostische Indikation Handelsbestimmungen, klinisch, epidemiologisch oder anamnestisch begründeter Verdacht Zuständige Untersuchungseinrichtungen Staatliche Veterinäruntersuchungsämter NRL für Beschälseuche am FLI, Naumburger Str. 96a, Jena FLI 71
73 Rechtsgrundlagen Tierseuchengesetz 79 Abs. 4 OIE Manual of Standards for Diagnostic Tests and Vaccines in der jeweils aktuellen Fassung. Entscheidung der Kommission vom 5. Februar 1993 (93/197/EWG) über tierseuchenrechtliche Bedingungen und die Beurkundung für die Einfuhr von registrierten Equiden sowie Zucht- und Nutzequiden Untersuchungsmaterial Der Nachweis des Erregers ist ausgesprochen schwierig und gelingt nur sehr selten in Vaginal- oder Präputialspülproben, noch seltener im Blut. Somit zielen die diagnostischen Verfahren nicht auf den Erregernachweis sondern auf den Nachweis von spezifischen Antikörpern im Blutserum ab. Nach der Klassifizierung serologischer Verfahren durch die O.I.E. gilt hier die Komplementbindungsreaktion (KBR) nach wie vor als Methode der Wahl. Auch der "enzyme-linked immunosorbent assay" (ELISA) sowie der indirekte Fluoreszenz - Antikörpertest (IFAT) sind im "Manual of Standards for Diagnostic Tests and Vaccines" der OIE als alternative Verfahren aufgeführt. Ein Erregernachweis mittels PCR ist nur in bestimmten frühen Krankheitsstadien möglich Untersuchung Da die Beschälseuche in Deutschland und den meisten Ländern der nördlichen Hemisphäre getilgt ist, beschränkt sich die Diagnostik hier auf den Nachweis von spezifischen Antikörpern mittels Komplement-Bindungsreaktion (OIE). Als Zusatzmethode kann auch ein ELISA oder ein Fluoreszenzantikörper-Test durchgeführt werden. Komplementbindungsreaktion (KBR) 1. Anwendungszweck Qualitativer und quantitativer Nachweis von komplementbindenden Antikörpern gegen T. equiperdum im Blutserum von Pferd, Esel und deren Kreuzungsprodukten. Allgemeine Vorbemerkung Die KBR kann bei 37 C (Wärmebindung) oder bei 4 C (Kältebindung) durchgeführt werden. Die OIE empfiehlt die Wärmebindung, das Referenzlabor empfiehlt ebenfalls, den Test bei 37 C durchzuführen. Als Verdünnungspuffer ist bei allen Teilschritten und Reagenzien HEPES- Puffer zu verwenden, da Veronalpuffer (Barbiturat) nicht mehr verwendet werden darf. Es sollten möglichst viele Reagenzien käuflich erworben werden, um ein größtmögliches Maß an Standardisierbarkeit zu erzielen (z. B. Virion/Serion, Würzburg). FLI 72
74 Zu untersuchende Serumproben, Verdünnungspuffer und Antigen sind vor Beginn der Untersuchung auf Raumtemperatur (Wasserbad) zu erwärmen. Bei Inkubation in einer feuchten Kammer sollten die Zeiten gegenüber den Zeiten bei Inkubation im Wasserbad eher etwas verlängert werden, da der Temperaturausgleich über Luft langsamer geht als über Wasser. 2. Grundlagen OIE: Manual of Standards for Diagnostic Tests and Vaccines (Paris, in der jeweils aktuellen Fassung (Fassung 2008, Chapter , S ) BMELF (1998): Arbeitsanleitungen zur Labordiagnostik von anzeigepflichtigen Tierseuchen, S Amtsblatt der Europäischen Gemeinschaften, Entscheidung der Kommission vom 5. Februar 1993, Einfuhr von Equiden - 93/197/EWG - idf vom Materialien/Geräte 3.1. Geräte Zentrifuge mit Mikrotiterplattenrotor (optional) Brutschrank/Brutraum (37 1 C) mit Sandbad, Haus 01, Raum Wasserbäder, variable Temperatureinstellung (37 C, C) Kühlschrank (5 3 C) Gefrierschrank (-21 3 C) Waage (zum Austarieren der Mikrotiterplatten) Kolbenhubpipetten ( µl, µl, 5ml) Mehrkanalkolbenhubpipette, µl Dispenser (10 µl - 5 ml) Ablesespiegel für Mikrotiterplatten 3.2. Gebrauchsmaterialien Reagenz-/Zentrifugenröhrchen (Einweg, 10 ml, 50 ml) Erlenmeyerkolben (100 ml) Mikrotiterplatten (U-Form, 8 x 12 wells) mit Deckel Pipettenspitzen ( µl, µl, 5ml) Reagenzglasständer Schwimmständer feuchte Kammer -Reagenzgefäße (Plastik; 1,5 o. 2,0 ml) Präzisionsdispensertips (PD) für 2,5 ml und 1,25 ml 3.3. Chemikalien, Reagenzien und Lösungen Aqua bidest (steril) Beschälseuche-Antigen, zugel. nach 17c TierSG; Lagerung bei 4 C Beschälseuche-Kontrollserum, positiv, zugel. nach 17c TierSG ; mit definiertem Titer (siehe Etikett); Lagerung bei 4 C Beschälseuche-Kontrollserum, negativ, zugel. nach 17c TierSG; Lagerung bei 4 C Ambozeptor (Hämolysin); z. B. Virion/Serion Lagerung bei 4 C FLI 73
75 Hammel-Erythrozyten; z. B. Virion/Serion Lagerung bei 4 C (1%ige Suspension, die alle 4 Wochen neu geliefert wird) HEPES-Puffer (seit 2009); z. B. Virion/Serion Lagerung bei 4 C Komplement; z. B. Virion/Serion Lagerung bei 4 C oder rekonstituiert und portioniert bei -20 C HEPES-Puffer (CFTB = complement fixation test buffer; Virion /Serion) Löst Veronal-Puffer ab (2009); Barbituratpuffer darf nicht mehr hergestellt werden. Die Pufferlösung ist entsprechend der Herstellerangabe zu lösen oder selbst herzustellen Antigen (siehe Anhang) Bezugsquelle Antigen Das in Deutschland zugelassene Antigen wird durch das Referenzlabor für Beschälseuche (FLI, Standort Jena) hergestellt und als Lyophilisat an die Untersuchungsämter abgegeben. Lagerung Die Lagerung des Antigens erfolgt im lyophilisierten Zustand bei 4 C. Bereits gelöstes Antigen (Stammlösung) wird portioniert (100 µl) bei -20 C bis zur Verwendung gelagert. Aufgetaute Reste von bereits gefroren gelagertem Antigen sind zu verwerfen. Herstellung der Stammlösung Lyophilisiertes Antigen wird mit sterilem Aqua dest. zu dem auf dem Etikett angegebenen Volumen gelöst (Stammlösung). Es ist am gleichen Tag zu verwenden bzw. wie oben beschrieben portioniert zu lagern. Gelöstes Antigen wird mit Puffer zur Gebrauchsverdünnung (siehe Etikett der Ampulle) verdünnt. Für die Antigentitration (siehe dort) sind pro Serum 50 µl Antigen-Stammlösung zu berechnen Beispiel: für 2 Kontrollseren + 1 Feldserum >>> 150 µl Antigen-Stammlösung Für die Serumtitration (siehe dort) sind pro Serum ca. 300 µl Antigengebrauchsverdünnung zu berechnen. Beispiel: 2 Kontrollseren + 1 Feldserum >>> 900 µl Antigengebrauchsverdünnung Für die Komplementkontrolle sind (bei Antigengebrauchsverdünnung von 1:16) 300 µl Antigengebrauchslösung zu berechnen. 4. Durchführung 4.1. Vorbehandlung der Proben- und Kontrollseren Vor der Untersuchung sind alle zu untersuchenden Serumproben einschließlich Kontrollseren im Wasserbad zu inaktivieren. Verunreinigte und hämolytische Seren sind zur Untersuchung nicht geeignet. Lyophilisierte Reagenzien sind mit Wasser zu rekonstituieren. FLI 74
76 4.2. Inaktivierung der Seren Vor der Untersuchung sind alle Serumproben einschließlich der Kontrollseren im Wasserbad in entsprechender Verdünnung mit Puffer wie folgt zu inaktivieren. 500 µl 1:5 verdünntes Serum (100 µl Serum µl Puffer) in 1,5-2ml Reagenzgefäße pipettiert. Bereits zu einem früheren Zeitpunkt inaktivierte und bei -20 C gelagerte Serumproben werden nochmals für 10 min bei der entsprechenden Temperatur inaktiviert. Serumverdünnung (in CFTB) Tierart Temperatur ( C) Zeit (min) 1:5 Pferd :5 Maultier, Maulesel, Esel Hämolytisches System Herstellung der Erythrozyten-Suspension Das Hämolytische System, auch Indikatorsystem genannt, macht die Aktivität des Komplements in Anwesenheit eines Antigen-Antikörper-Komplexes sichtbar. Es muss für jeden Test frisch angesetzt werden. OIE 2008: USDA: Andere, inkl. Referenzlabor in Jena: 3%ige Erythrozytensuspension 2%ige Erythrozytensuspension 1%ige Erythrozytensuspension Schaferythrozyten-Suspensionen können käuflich erworben werden. Erythrozyten-Suspension und Ambozeptor können in auf einander abgestimmter Form käuflich erworben werden. Damit wird die eigene Ermittlung der einzusetzenden Ambozeptorkonzentration überflüssig (3.5.5.). Sie wird dann vom Hersteller vorgegeben (z. B. Virion/Serion, Würzburg). Wird das das Hammelblut für die Erythrozytensuspension selbst gewonnen, so ist darauf zu achten, dass keine Gerinnung eintritt. Das mit Alsever s Lösung (Gerinnungshemmung) versetzte Hammelblut (Anhang 2 u. 3) 3- bis 5-mal in Puffer (Anhang 1) wird gewaschen (Zentrifugation bei 1000g, 10 min, 10 C) bis die überstehende Flüssigkeit wasserklar ist. Der Überstand wird jeweils verworfen. Das gewaschene Erythrozytensediment wird vorsichtig aufgeschüttelt (kein Vortex), so dass eine dichte Suspension entsteht, die pipettierbar ist. Mit Puffer wird eine 1%ige Suspension hergestellt. Diese sollte jedes Mal photometrisch kontrolliert werden (540 nm) Ermittlung der benötigten Ambozeptor-(Hämolysin)-Konzentration (1x pro Charge durchführen) Durchführung in der Mikrotiterplatte Doppelbestimmung Erste Verdünnungsstufe (Vol. 500 µl) in separatem Reaktionsgefäß ansetzen FLI 75
77 Ansatz geometrischer Verdünnungsreihen des Ambozeptors well Reihe A) 1: Reihe B) 1: Ausgangsverdünnung 1:100 (z. B. 20 µl Ambozeptor µl Puffer) = 2 ml I) 100 µl der Ausgangsverdünnung entnehmen und eine 1:5 Verdünnung (Puffer) herstellen = 100 µl µl Puffer = 500 µl Verdünnung 1:500 II) 100 µl der Ausgangsverdünnung entnehmen und eine 1:7,5 Verdünnung (Puffer) herstellen = 100 µl µl Puffer = 750 µl Verdünnung 1:750 Reihe A und B: Vorlage von 25 µl Puffer ab well 2 Reihe A: zu well 1 und 2 jeweils 25 µl Ambozeptorverdünnung 1:500 (I) zufügen und ab well 2 durch fortlaufendes Über-Pipettieren von jeweils 25 µl die weiteren Verdünnungen anlegen, letzte 25 µl verwerfen Reihe B: zu well 1 und 2 jeweils 25 µl Ambozeptorverdünnung 1:750 (II) zufügen und ab well 2 durch fortlaufendes Über-Pipettieren von jeweils 25 µl die weiteren Verdünnungen anlegen, letzte 25 µl verwerfen Durchführung der Ambozeptorauswertung Tabelle 1: Ansatzschema der Ambozeptorauswertung Gesamtvolumen: 100 µl pro well (Doppelbestimmung) well Puffer Ambozeptor (I) Ambozeptor (II) Erythroz.- Susp. Komplement 1:20 (µl) (25 µl) (25 µl) (µl) (µl) :500 1: : : : : : : : : : : : : Kontrollen a) Erythrozytenkontrolle: 25 µl Erythrozytensuspension (1 %) 75 µl Puffer b) Komplementkontrolle: 25 µlerythrozytensuspension (1 %) 25mlKomplement 1:20 50ml Puffer c) Ambozeptorkontrolle: 25 µl Erythrozytensuspension (1 %) 25ml Ambozeptor 1:500 50ml Puffer Mikrotiterplatte vorsichtig schütteln, Inkubation 30 min bei +37 C ± 1 C in einer feuchten Kammer. FLI 76
78 Auswertung Die höchste Ambozeptorverdünnung, die noch eine vollständige Hämolyse bewirkt, wird als 1 Ambozeptoreinheit (AE) definiert. Deutsche Vorschrift (Godglück, 1952): Die Gebrauchskonzentration beträgt 4 AE, also die vierfache Konzentration. OIE 2008: Gebrauchskonzentration beträgt 2 AE Dieser Methodische Unterschied sollte keine Bedeutung haben. Die Verwendung von 4 AE erhöht die Sicherheit, dass keine falsch positiven Ergebnisse auftreten. Diese Gefahr wird jedoch auch durch den Komplementvorversuch, der bei jeder KBR mit angesetzt wird, ausgeschlossen. Die Kontrollen dürfen keine Hämolyse aufweisen Herstellung des Hämolytischen Systems für die KBR Erythrozytensuspension (z. B. 1%ig; Virion/Serion) vorsichtig aufschütteln Ambozeptor-Gebrauchsverdünnung (je nach Herstellerangabe, oder nach eigenen Vorversuchen, z. B. 1:2500 = 25 ml VP + 10 µl Ambozeptor; siehe ) und Erythrozyten-Suspension (siehe ) zu gleichen Teilen mischen 30 min bei 37 C im Wasserbad inkubieren, damit sich der Erythrozyten- Antikörper-Komplex bilden kann 4.4. Komplement Allgemeines Komplement kann mit anderen Reagenzien für die KBR in aufeinander abgestimmter Form käuflich erworben werden (z. B. Virion / Serion). Vorversuche zur Ermittlung der Gebrauchskonzentration können dann wesentlich reduziert werden, da vom Hersteller Empfehlungen für die Gebrauchskonzentration gegeben werden. Komplement ist bei jeder KBR frisch anzusetzen. Da Komplement mit der Zeit an Aktivität verliert, ist bei jeder KBR ein Komplementvorversuch mitzuführen. Komplement kann auch aus Meerschweinchen-Blut selbst gewonnen werden (z. B. Herzpunktion, Citrat-Blut, Plasma-Herstellung). Es sollte dann portioniert und bei - 80 C gelagert werden. FLI 77
79 Ermittlung der Komplementgebrauchsverdünnung für die Durchführung der KBR (Komplementvorversuch) mit selbst gewonnenem Komplement oder käuflich erworbenem Komplement ohne Herstellerangabe zur Gebrauchskonzentration Dieser Teilversuch dient der Feststellung der Komplementgebrauchsverdünnung, die zu einer vollständigen Hämolyse des verwendeten Hämolytschen Systems (siehe 4.3.) führt. Dies ist notwendig, wenn nicht alle KBR-Reagenzien als aufeinander abgestimmtes Gesamtpaket käuflich erworben werden. Ein Ansatz enthält: 1) Puffer 2) Antigen (da das Antigen die Hämolyse beeinflussen kann) 3) Komplement 4) Hämolytisches System Das Serum fehlt in diesem Ansatz und wird durch Puffer ersetzt. Die Komplementaktivität muss bei jedem Versuch neu ermittelt werden. Auch bei Versuchen im Abstand von 24 Stunden sollte nicht der Wert vom Vortag übernommen werden. Es werden 8 Komplementverdünnungen geprüft (Herstellung siehe Tabelle 2a). Alle Komplementverdünnungen werden in einem Komplementvorversuch ohne Serum eingesetzt (Tab. 2b) Werden alle Reagenzien aufeinander abgestimmt käuflich erworben, so kann auf die Komplementauswertung am Untersuchungstag im Umfang reduziert werden (z. B. 4 Verdünnungsstufen, siehe Tab. 2a). Tabelle 2a: Herstellung der Komplementverdünnungen Komplementverdünnungen Endkonzentration 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 (%) Kompl. 1:10 (µl) Puffer (µl) Tabelle 2b: Komplementvorversuch Komplement je Verd.-Stufe (µl) 25 Antigengebrauchsverdünnung (µl) 25 Puffer (µl) 25 Hämolytisches System (1.5.) (µl) Auswertung Es wird die geringste Komplementkonzentration bestimmt, die eine vollständige Hämolyse bewirkt. Diese Komplementkonzentration wird als 1 Komplement-Einheit definiert. Nach Empfehlung der OIE ist die KBR mit 2 Komplement-Einheiten, also der doppelten Konzentration durchzuführen. Beispiel: Vollständige Hämolyse 2,0 % Gebrauchskonzentration 4,0 % FLI 78
80 Ermittlung der Komplement-Gebrauchskonzentration mit käuflich erworbenem Komplement (Komplementvorversuch) mit entsprechender Herstellerangabe Bei jeder KBR ist ein Komplementvorversuch zur Ermittlung der aktuellen Komplementaktivität durchzuführen. Das lyophilisierte Komplement wird mit sterilem Aqua dest. nach Herstellervorschrift gelöst. Bei 2 8 C ist das Komplement je nach Herstellerangaben eine gewisse Zeit haltbar. Das gelöste Komplement kann auch portioniert (100 µl) und bei -20 C oder -80 C eingefroren werden. Die Komplement-Gebrauchslösung wird durch Verdünnung von gelöstem Komplement mit Puffer vor Gebrauch frisch hergestellt. Da die Komplementaktivität im Laufe der Zeit abnimmt, die Erythrozytenkonzentration von Charge zu Charge geringe Unterschiede aufweisen kann und das Antigen die Komplementaktivität beeinflussen kann, sind bei jeder KBR zusätzlich zur Komplement-Gebrauchsverdünnung, die vom Hersteller empfohlen wird, zwei weitere Verdünnungen jeweils im Abstand von einer halben Zehnerpotenz unterhalb der vom Hersteller empfohlenen Verdünnung herzustellen. Beispiel: vom Hersteller empfohlene Verdünnung: zwei weitere Verdünnungen: 1: 55 (A) 1: 50 (B) 1: 45 (C) Für die Antigentitration sind je ca. 200 µl Komplementverdünnung zu berechnen. Für die Serumtitration sind pro Serum ca. 300 µl Komplementgebrauchsverdünnung zu berechnen. Beispiel: 2 Kontrollseren + 1 Feldserum >>> 900 µl Komplementgebrauchsverdünnung Für den Komplementvorversuch sind 3 x 50 µl Komplementverdünnung zu berechnen Komplementvorversuch Der Komplement-Vorversuch wird mit drei Komplement-Gebrauchsverdünnungen durchgeführt (Pkt ). Das Antigen wird in der auf dem Etikett der Ampulle vermerkten Gebrauchsverdünnung (in Puffer; siehe Pkt. 3.4.) verwendet. Die höchste Verdünnungsstufe der Komplement-Gebrauchslösung, die noch eine vollständige Hämolyse bewirkt, wird als 1 Komplement-Einheit bezeichnet. Für den Komplement-Hauptversuch wird derjenige Ansatz (Pkt A, B, C) verwendet, bei dem die Komplement-Gebrauchslösung sowohl unverdünnt als auch 1:2 verdünnt eine vollständige Hämolyse herbeiführt. In diesem Fall enthält die Gebrauchslösung also 2 Komplement-Einheiten. Nach Empfehlung der OIE soll die KBR mit 2 Komplement-Einheiten durchgeführt werden. Die aktuelle Komplementaktivität sollte vor jeder KBR neu überprüft werden. Dafür gibt es folgende Gründe: - Das Antigen kann die Komplementaktivität beeinflussen. - Die Komplementaktivität kann abnehmen, insbesondere nach Lagerung bei -20 C FLI 79
81 Ein Komplementansatz besteht aus Antigen Puffer (anstelle von Serum) Hämolytisches System Komplement Durchführung des Komplementvorversuches 1. Feuchte Kammer offen in den Brutschrank stellen (Temperaturausgleich) ml Puffer im Wasserbad auf 37 C temperieren (mind. 10 min) 3. Herstellung der Antigenverdünnung (siehe Etikett) in Puffer; 300 µl, warm stellen (37 C) 4. Herstellung der drei Komplementgebrauchslösungen in Puffer (siehe A, B, C) 5. Komplementverdünnungsreihen in Zweierschritten mit Komplementgebrauchslösung (siehe Pkt A, B, C): unverdünnt bis 1:16 - Reihen B E; jeweils wells 2 + 3, 5 + 6, 8 + 9: 25 µl Puffer - Reihen A und B wells 2 + 3, 5 + 6, 8 + 9: jeweils 25 µl Komplementverdünnung (Doppelbestimmung), A bzw. B bzw. C (siehe Pkt ) - Überpipettieren von 25 µl von Reihe B in Reihe C, von C in D und von D in E; 25 µl aus der Reihe E verwerfen 6. Reihe A - E, beschickte wells: Antigenzugabe, Verdünnung siehe Etikett der Antigenampulle, 25 µl 7. Reihe A E, beschickte wells: Zugabe von Puffer, 25 µl 8. Inkubation bei 37 C, 1h:05 min, in feuchter Kammer 9. Herstellung des Hämolytischen Systems 25 min nach Beginn der Inkubation der Platte 10. Inkubation des Hämolytischen Systems bei 37 C im Wasserbad. 11. Reihe A E, beschickte wells: Zugabe von Hämolytischem System, 50 µl 12. Inkubation bei 37 C (feuchte Kammer) für 35 min. 13. Platten kurz zentrifugieren (5 min/ca. 700 x g, 2000 upm); danach sofort ablesen Bewertung: Die niedrigste Komplementkonzentration (höchste Verdünnung: Pkt A, B, C), bei der die Erythrozyten in den beschickten wells der Reihen A und B vollständig lysiert sind, wird im Hauptversuch verwendet. Wenn zwei oder drei Ansätze diese Forderung erfüllen, wird der Ansatz mit der höchsten Komplementverdünnung gewählt Kontrollsysteme Kontrollseren werden als Lyophilisate vom Referenzlabor für Beschälseuche an die Untersuchungsämter abgegeben. Die Lyophilisate sind mit Aqua dest. zu rekonstituieren. In jedem Ansatz wird ein spezifisch positives (mit definiertem Titer; siehe Anhang) sowie ein antikörperfreies, d. h. negatives Kontrollserum (siehe. Anhang) mitgeführt. FLI 80
82 Resuspendierte Seren und Antigen können portioniert bei -21 C ± 3 C gelagert werden. Sie sind danach ein Jahr (Antigen) und länger (Antikörper) verwendbar. Je Platte sind folgende Kontrollen mitzuführen: Beschälseuche-Kontrollserum, positiv; alle Reaktionspartner Beschälseuche-Kontrollserum, negativ; alle Reaktionspartner Die Kontrollseren sind in den gleichen Verdünnungen mitzuführen, in welchen die Probenseren ausgetestet werden. Serumkontrolle (SK) für jedes mitgeführte Serum (1:5 verdünnt); alle Reaktionspartner außer dem Antigen (1 well) Antigenkontrolle (AK; Gebrauchsverdünnung); alle Reaktionspartner außer dem Serum (1 well) Komplementkontrolle (KK); alle Reaktionspartner außer dem Antiserum (siehe Komplementvorversuch, Doppelbestimmung) Hämolytisches System-Kontrolle (HS-K); nur Hämolytisches System und Puffer (1 well) Das Volumen der fehlenden Reaktionspartner ist jeweils durch Puffer zu ersetzen Durchführung der KBR-Wärmebindung (Hauptversuch) Anmerkungen: Der Puffer und die benötigte Menge an Erythrozytensuspension sind vor Verwendung auf 37 C zu erwärmen. Das Komplement ist auf Raumtemperatur zu erwärmen. Die KBR wird in einer 96-well-Platte durchgeführt. Im ersten Schritt wird mit einer konstanten Serumkonzentration von 1:5 die aktuelle Antigenaktivität ausgetestet. Dieser Schritt wird von der OIE als Screening Test vorgeschrieben. Ergibt ein Serum bei einer Antigen-Konzentration von 2 Antigeneinheiten eine positive Reaktion, so wird dieses Serum mit einer konstanten Antigenkonzentration von 2 Antigen-Einheiten mittels einer Serumverdünnungsreihe austitriert, um den Serumtiter zu bestimmen. Da diese Untersuchungen im Referenzlabor regelmäßig durchgeführt werden, besteht für die Nutzer des vom Referenzlabor erworbenen Antigens keine Notwendigkeit, die Antigen-Titration selbst durchzuführen. Es genügt eine Serumtitration. Gebrauchsverdünnung des Antigens siehe Etikett der Antigenampulle Antigentitration (Durchführung) Die Antigenkonzentration, bei der das Vorhandensein von Antikörpern in einem 1:5 verdünnten Serum beurteilt wird, wird bei jeder KBR neu austitriert. Probeseren und Kontrollseren werden in einer konstanten Verdünnung von 1:5 in Puffer verwendet (keine Serumtitration). Das Antigen wird mit der auf dem Etikett angegebenen Menge an Aqua dest. (0,5 ml) rekonstitutiert. Es muss völlig gelöst sein. Das Antigen wird in Zweierschritten in Puffer verdünnt (1:4 bis 1:128). FLI 81
83 Die höchste Verdünnungsstufe (geringste Konzentration) der Antigenlösung, bei der es zu einer vollständigen Sedimentation der Erythrozyten (++++) kommt, wird als 1 Antigen-Einheit bezeichnet. Nach Empfehlung des OIE wird das KBR-Ergebnis bei 2 Antigeneinheiten beurteilt, d. h. man geht einen Verdünnungsschritt zurück. Beispiel: Antigen-Verdünnung 1:64 = 1 Antigen-Einheit Antigen-Verdünnung 1:32 = 2 Antigen-Einheiten Anmerkungen: Die KBR wird in drei 96-well-Platten durchgeführt, je Komplement- Gebrauchsverdünnung (A, B, C; siehe ) eine Platte. Antigentitration 1. Puffervorlage Je 25 µl Puffer in wells 1, 3, der Reihen A - H 1: für positives Kontrollserum, 1:5 verdünnt 3: für negatives Kontrollserum, 1:5 verdünnt 5 + 6: für Probeserum, 1:5 verdünnt (Doppelbestimmung) 2. Antigenzugabe Je 25 µl Antigen-Stammlösung, 1:2 verdünnt in Puffer, jeweils in Reihe A, wells 1, 3, 5, 6 pipettieren Verdünnung in Zweierschritten von Reihe A nach Reihe H 3. Serumzugabe Je 25 µl 1:5 verdünntes (Puffer) und inaktiviertes positives oder negatives Kontroll- bzw. Patientenserum in die Kavitäten 1, 3, 5, 6 der Reihen A H pipettieren. 4. Komplementzugabe Je 25 µl Komplementgebrauchsverdünnung (siehe Pkt ) in wells 1, 3, 5, 6 der Reihen A H pipettieren. Komplementkontrolle (Reihen ; Doppelbestimmung) 1.a Puffervorlage Je 25 µl Puffer in Reihe B - H, wells a. Komplementzugabe Je 25 µl Komplementgebrauchsverdünnung (A, B, C; Pkt ) in wells der Reihen A und B Verdünnung in Zweierschritten von Reihe B nach Reihe H 3a. Pufferzugabe Je 25 µl Puffer in wells der Reihen A H (Serum-Ersatz) 4a. Antigenzugabe zu Reihen Für die Komplementkontrolle wird die auf dem Etikett der Antigenampulle angegebene Gebrauchsverdünnung verwendet. Je 25 µl Antigen in die Kavitäten A H der Reihen weitere Kontrollen In wells 12 der Reihen A H: - Antigen-Kontrolle (Verd.-Reihe; Serum durch HP ersetzen) In wells 11 der Reihen A H - Serumkontrollen (positiv, negativ, Probe; Antigen durch HP ersetzen) und Kontrolle Hämolytisches Systems 6. Inkubation Inkubation bei 37 C in feuchter Kammer 1:05 min 7. Hämolytisches System Herstellen des Hämolyt. Systems etwa 25 min nach Beginn der Inkubation Je 50 µl Hämolytisches System in wells 1, 3, 5, 6, 9, 10 der Reihen A - H FLI 82
84 8. Inkubation Ansatz bei 37 C in feuchter Kammer 35 min inkubieren 9. Zentrifugation: 5 min bei 2000 Upm (670g) zentrifugieren Sofern keine Zentrifuge verfügbar ist, können die Platten bei Raumtemperatur für ca. 2 h inkubiert werden. In dieser Zeit sedimentieren die nicht lysierten Erythrozyten spontan. Eine weitere Inkubation bei 4 C über Nacht kann bei unklarer Endpunktbestimmung zu besser ablesbaren Ergebnissen führen Serumtitration (Durchführung) 1. Puffervorlage Je 25 µl Puffer in Kavitäten 3-12 der Reihen A, B für Kontrollseren und C F, je nach der Anzahl der Probeseren, die zu testen sind A: Positives Kontrollserum B: Negatives Kontrollserum C F: Probeseren Die Reihen G und H bleiben frei für Kontrollen 2. Serumzugabe: Je 25 µl Serum (1:5 verdünnt) in wells 1 und 2 Verdünnung der Seren in jeder Reihe in Zweierschritten ausgehend von Kavität 2 bis well 11 Letzte 25 µl aus well 11 verwerfen Kavität 1: Serumkontrolle Kavität 12: Antigenkontrolle (kein Reagenz zugeben) 3. Antigenzugabe Je 25ml Antigengebrauchsverdünnung (siehe Etikett der Antigen-Ampulle oder eigener Vorversuch) in wells 2 11 der Reihen A, B und C-F, je nach Anzahl der Probeseren, die zu testen sind Kavität 1: je 25 Puffer 4. Komplementzugabe Je 25 µl Komplementgebrauchsverdünnung (siehe Komplement- Vorversuch) in wells 1 12 der Reihen A, B und C-F, je nach Anzahl der Probeseren, die zu testen sind 5. Komplementkontrolle Sollte aktuell durchgeführt werden, wenn der Komplement-Vorversuch nicht am gleichen Tag gemacht wurde wie der Hauptversuch Reihen G und H, wells 2 5: Puffervorlage je 25 µl in wells 3 5 Komplement-Gebrauchsverdünnung je 25 µl in Kavitäten 2 und 3 Herstellung einer Verdünnungsreihe (drei Schritte) in Zweierschritten ausgehend von well 3 Antigenzugabe je 25 µl in wells Inkubation Inkubation bei 37 C in feuchter Kammer 1: 05 min 7. Hämolytisches System Herstellen des Hämolyt. Systems etwa 25 min nach Beginn der Inkubation Je 50 µl Hämolytisches System in alle beschickten wells der Reihen A H, ein zusätzliche Kavität in Reihe H für die Kontrolle des Hämolytischen Systems (+ 75 µl Puffer 8. Inkubation Ansatz bei 37 C in feuchter Kammer 35 min inkubieren 9. Zentrifugation: 5 min bei 2000 Upm (670g) zentrifugieren Sofern keine Zentrifuge verfügbar ist, können die Platten bei Raumtemperatur für ca. 2 h inkubiert werden. In dieser Zeit sedimentieren die nicht lysierten Erythrozyten spontan. Eine weitere Inkubation bei 4 C über Nacht kann bei unklarer Endpunktbestimmung zu besser ablesbaren Ergebnissen führen. FLI 83
85 Kontrollsysteme und Interpretation der Ergebnisse Das Ablesen der Reaktion je Verdünnungsstufe erfolgt nach dem Grad der Hämolyse und der Größe des Erythrozytensedimentes (Knopfbildung) 100 % Hämolyse = 0 % Erythrozytensediment = negativ winziges, schwach rötliches Erythrozytensediment ist ebenfalls negativ zu bewerten Gründe: z. B. Ungenauigkeit beim Pipettieren, ungenauer Komplementvorversuch 75 % Hämolyse = 25 % Erythrozytensediment = fraglich (+ positiv) = Erythrozytensediment klein, aber noch deutlich mit rötlichem Puffer 50 % Hämolyse = 50 % Erythrozytensediment = positiv (nach OIE; ++) = Erythrozytensediment etwa halbe Größe mit rötlichem Puffer 25 % Hämolyse = 75 % Erythrozytensediment = positiv (+++) = großes Erythrozytensediment mit leicht rötlichem Puffer 0 % Hämolyse = 100 % Erythrozytensediment = positiv (++++) = großes Erythrozytensediment mit wasserklarem Puffer Bei der Durchführung des Versuches sind jeweils folgende Kontrollansätze mitzuführen: Kontrolle der antikomplementären Wirkung jedes Serums (Serumkontrolle- SK) - Serumverdünnung (1:5): 25 µl - Puffer: 25 µl - Komplement: 25 µl - Hämolyt. System: 50 µl Bewertung: 100 % Hämolyse, es darf kein Erythrozytensediment entstehen. Entsteht ein Erythrozyten-Sediment, so ist das Serum zu titrieren. Wenn die Differenz zwischen dem Titer der positiven SK und dem Titer des Hauptversuches drei Verdünnungsstufen oder mehr beträgt, so ist das Serum als positiv zu bewerten. Andernfalls ist der Test nicht auswertbar. Kontrolle des Antigens (AK) - Puffer: 25 µl - Antigen: 25 µl - Komplement: 25 µl - Hämolyt. System: 50 µl Bewertung: 100 % Hämolyse, es darf kein Erythrozytensediment entstehen FLI 84
86 Kontrolle des Komplements (KK) angesetzt in den Reihen G und H - Puffer: 25 µl - Antigen 25 µl - Komplement: 25 µl - Hämolyt. System: 50 µl Bewertung: 100 % Hämolyse in den ersten 2 wells der Komplement- Verdünnungsreihe = 2 Komplement-Einheiten Kontrolle des Hämolytischen Systems (HS) angesetzt in den Reihen G und H - Puffer: 75 µl - Hämolyt. System: 50 µl Bewertung: keine Hämolyse Positives Kontrollserum - Serumverdünnung (1:5): 25 µl - Antigen: 25 µl - Komplement: 25 µl - Hämolyt. System: 50 µl Bewertung: in Abhängigkeit vom Antikörpergehalt kommt es zur Sedimentbildung mit und ohne/ mit partieller Hämolyse. Der Titer der Positivkontrolle sollte höchstens eine Titerstufe vom erwarteten Wert (siehe Etikett) abweichen Negatives Kontrollserum - Serumverdünnung (1:5): 25 µl - Antigen: 25 µl - Komplement: 25 µl - Hämolyt. System: 50 µl Bewertung: 100 % Hämolyse, es darf kein Erythrozytensediment entstehen Alle Kontrollen müssen das erwartete Resultat zeigen, andernfalls ist der Test nicht auswertbar! Wird bei einer Serumprobe (1:5) ein positives KBR-Ergebnis erzielt, so wird die Probe erneut untersucht, indem bei konstanter Antigenverdünnung eine Serumtitration durchgeführt wird, um den Grenztiter zu bestimmen. Dabei müssen dann erneut die notwenigen Kontrollen durchgeführt werden Untersuchungsbericht Der Untersuchungsbericht dokumentiert mit eindeutigen Angaben über die getestete Serumprobe sowie die angewandte Untersuchungsmethode das Ergebnis. FLI 85
87 4.8. Referenz für die Auswertung Gemäß OIE Manual 2000 gelten Titer ab 1 : 5 ++ (Wärmebindung) als positiv. Nach der Entscheidung der EU-Kommission 93/197/EWG i.d.f. vom sind Titer ab 1 : 10 als Beschälseuche-positiv einzustufen. ELISA 1. Durchführung Das Antigen (FLI, Gebrauchsverdünnung nach Angabe des Herstellers) wird in 5 ml Karbonatpuffer rekonstituiert und dreimal 10 Sekunden bei maximal zulässiger Amplitudeneinstellung ultrabeschallt (z. B. Sonoplus-Ultraschall Homogenisator HD 200 der Firma Bandelin (Berlin) und der Sonotrode MS 73 (60 %)). Während der Beschallung wird das Antigen in Eiswasser gekühlt. Nach 5 Minuten Zentrifugation bei x g wird der Überstand in der angegebenen Gebrauchsverdünnung mit Karbonatpuffer (siehe Anhang) verdünnt. Alternativ (besser) sollte eine Proteinbestimmung vorgenommen und das Antigen in einer Konzentration von 10 µl/ml Coating-Puffer eingesetzt werden. Die Kolumnen 1, 3, 5, 7, 9 und 11 werden mit 50 µl Karbonatpuffer beschickt, die Kolumnen 2, 4, 6, 8, 10 und 12 mit 50 µl Antigen. Die Platten werden in einer feuchten Inkubationskammer 40 Minuten im Brutschrank bei +37 C± 1 C inkubiert. Die Platten werden dekantiert und mit Aqua bidest. dreimal gewaschen. Anschließend Dekantieren der Platten. Zugabe von 200 µl Blocking - Puffer (siehe Anhang) pro well. Inkubation 30 Minuten bei +37 C± 1 C in feuchter Inkubationskammer. Die Platten werden dekantiert und dreimal mit PBS - Tween (siehe Anhang) gewaschen. Anschließend Dekantieren der Platten. Trocknen der Platten bei +37 C± 1 C im Brutraum für 120 Minuten. Anschließend werden die Platten unter Vakuum in Vaku-Beuteln eingeschweißt. Bei einer Lagerungstemperatur von +7 C ± 3 C (Kühlschrank) beträgt die Haltbarkeit ½ Jahr. Vor Beginn des ELISA die benötigte Anzahl an Testplatten auf Raumtemperatur erwärmen. Verdünnung der Probandenseren und Kontrollseren 1 : 100 in PBS - Tween / FKS. Die Kolumnen 1-10 sind für den Doppelansatz der Probandenseren vorgesehen, die Kolumnen 11 und 12 für den Doppelansatz der Kontrollseren (Positives und negatives Kontrollserum, FLI Jena). Pro well werden 50 µl eingefüllt. Inkubation 30 Minuten bei +37 C ± 1 C in feuchter Inkubationskammer. Die Platten werden entleert und dreimal mit PBS - Tween gewaschen. Anschließend Dekantieren der Platten. Zugabe von 50 µl Konjugat in Gebrauchsverdünnung pro well. Inkubation 30 Minuten bei +37 C ± 1 C in feuchter Inkubationskammer. FLI 86
88 Die Platten werden dekantiert und dreimal mit PBS - Tween gewaschen. Anschließend Dekantieren der Platten. Zugabe von 100 µl Chromogen-Substrat-Lösung pro well. Messung der Platte im Plattenphotometer bei 405 nm. Mindest-O.D.-Wert der positiven Kontrolle Je nach aktuellen Testbedingungen sollte dieser Wert nach Minuten Chromogen-Substrat-Inkubation bei Raumtemperatur (+22 C ± 3 C)erreicht werden. 2. Bewertung Bestimmt wird die Netto-Extinktion, d. h. der Wert, der sich aus der Subtraktion der Extinktion des Ansatzes mit Antigen minus der Extinktion des Ansatzes ohne Antigen ergibt. Die Netto-Extinktion des schwach positiven Serums wird als 100 % angesehen. Zu diesen 100 % werden die Ergebnisse der Feldseren in Beziehung gesetzt, ebenfalls ausgedrückt in %. Ein Überschreiten der 100 % als ein positives Ergebnis. FLI 87
89 Anhang 1. Diagnostika Beschälseuche Antigen à 0.5 ml, lyophilisiert Beschälseuche-Kontrollserum positiv v. Pferd à 1,0 ml, lyophilisiert Beschälseuche-Kontrollserum negativ v. Pferd à 0,5 ml, lyophilisiert 2. Puffer, biologische und chemische Reagenzien 2.1. Verdünnungslösung für KBR Die Verdünnungsflüssigkeit für alle Reagenzien ist HEPES-Puffer-Lösung. Zur besseren Haltbarkeit wird ein HEPES-Konzentrat im Verhältnis 5:1 hergestellt und portioniert bei +5 C ± 3 C gelagert. Vor Gebrauch ist es 1:5 mit Aqua bidest. zu verdünnen. Veronalpuffer und alle anderen Reagenzien für die KBR (Erythrozyten-Suspension, Komplement, Ambozeptor) sind käuflich zu erwerben (z. B. Firma Virion/Serion in Erlangen) Alsever s Lösung zur Konservierung von Hammelbluterythrozyten - Dextrose (Glucose) 18,66 g - Natriumchlorid 4,18 g - Natriumcitrat 8,00 g - Aqua bidest. ad 1000,00 ml - Lösen im Dampftopf für 20 min 2.3. Hammelblut ("sheep red blood cells", SRBC) Das Blut wird vom Schaf unter sterilen Bedingungen durch Punktion der Vena jugularis entnommen und unter leichtem Schütteln zu gleichen Teilen mit Alsever s Lösung in einem sterilen Gefäß (im geschlossenen System) aufgefangen. Ein Zusatz von Penicillin ( IE/l) kann die Haltbarkeit erhöhen. Das konservierte Hammelblut ist bei +5 C ± 3 C ca. drei Wochen haltbar Ambozeptor (Hämolysin) Der Ambozeptor wird käuflich erworben und seine Aktivität vor erstmaligem Gebrauch jeder Charge bestimmt Komplement Das Komplement ist ein Misch-Plasma (also aus Citrat-Blut) von gesunden Meerschweinchen, die vor dem Bluten 24 Stunden nicht gefüttert werden. Das Blut kann durch Kardialpunktion gewonnen werden. Es kann portioniert bei -80 C ±3 C aufbewahrt werden. Vor jeder KBR wird eine Komplement-Auswertung vorgenommen. Besser ist es, das Komplement käuflich zu erwerben. FLI 88
90 2.6. Witte-Lösung (Kalium-Borlösung) zur Konservierung von Meerschweinchenkomplement Kaliumsulfat 10,0 g Borsäure 4,0 g Aqua bidest. ad 100,0 ml 1h bei 100 C im Dampftopf lösen, Komplement und Konservierungslösung werden zu gleichen Teilen gemischt. Der Verdünnungsfaktor des Komplements muss beim Ansatz (Komplementauswertung und Hauptversuch) berücksichtigt werden. Haltbarkeit bei geringem Titerabfall ca. acht Wochen Karbonatpuffer: (0,05 M, ph 9,6) Na 2 CO 3 1,59 g NaHCO 3 2,93 g Aqua dest. ad 1000 ml 2.8. Blocking-Puffer: Karbonatpuffer 0,05 M, ph 9,6 + 3 % fötales Kälberserum (FKS) Das Kälberserum kann portioniert bei -20 C eingefroren werden Phosphatpuffer mit Tween 20 ( PBS-Tween 0,05 % ), ph 7,4 NaCl 8,0 g Na 2 HPO 4 x 2H 2 O 2,9 g KH 2 PO 4 0,2 g KCl 0,2 g Aqua dest. ad 1000 ml Tween 20 0,5 ml Puffer für Proben, Kontrollen und Konjugat: PBS - Tween, ph 7,4 + 6 % FCS Konjugat Kaninchen anti-pferd IgG (H+L)/Meerrettich-Peroxidase konjugiert (Nordic Immunology, Tilburg, Holland, zu beziehen über TEBU, Frankfurt a. M.), Arbeitsverdünnung nach Herstellerempfehlung Chromogen-Substrat-Lösung (ABTS, Serva oder Sigma) Citrat-Puffer, ph 6 C 6 H 8 O 7 x H 2 O 4,20 g 200 ml Aqua bidest. Na 2 HPO 4 x 12 H 2 O 7,16 g 200 ml Aqua bidest. ABTS 160 mg 400 ml Citratpuffer Haltbarkeit der Chromogen-Substrat-Lösung: sollte immer frisch angesetzt werden Unmittelbar vor Gebrauch wird der Substratlösung 1 % (w/v) H 2 O 2 (Perhydrol) zugegeben. Cave: H 2 O 2 -Konz. in Perhydrol (30 %) berücksichtigen! FLI 89
91 13. Blauzungenkrankheit Charakterisierung der Infektion Erreger Das Bluetongue Virus (BTV) ist ein dsrna Orbivirus aus der Familie Reoviridae. Momentan werden 24 Serotypen unterschieden. Ein möglicher 25. Serotyp wurde 2008 bei Ziegen in der Schweiz festgestellt. In tierexperimentellen Versuchen konnte das Virus übertragen werden. Allerdings konnte bisher das sogenannte Toggenburg- Virus noch nicht isoliert werden. Die genetische Analyse deutet aber darauf hin, dass es zukünftig den Bluetongue Viren zugeordnet wird. Das komplette BTV-Partikel enthält ein Core mit Doppelkapsid, wobei die äußere Schale zwei Proteine (VP2 und VP5) enthält, von denen VP2 die Hauptdeterminante für den Serotyp ist. Das innere, ikosaedrische Core enthält zwei Haupt- und drei untergeordnete Proteine und 10 dsrna Segmente Klinische Symptomatik Bluetongue ist eine infektiöse, nicht-kontagiöse und von Insekten übertragene Krankheit der Schafe sowie anderer domestizierter und wild lebender Wiederkäuer. In vielen Gebieten der Welt hat die Krankheit wegen der insektengebundenen Übertragung ein saisonales Auftreten. Die typischen klinischen Symptome sind nur beim Schaf anzutreffen, wogegen andere befallene Wiederkäuer meist asymptomatisch infiziert sind. Klinische Symptome sind massive Ödeme und Hämorrhagien mit Fieber und Entzündungen bis hin zu Ulzera der Schleimhäute. Häufig kommt es zu Trächtigkeitsstörungen mit Aborten und Fetopathien, auch durch schwach virulente Serotypen und attenuierte Viren (Impfstoffe). Typisch und namengebend für die Krankheit ist die intensive Hyperämie und Schwellung der Zunge (Bluetongue), die aber nicht regelmäßig festgestellt werden können Differentialdiagnostik Grundsätzlich gilt, dass auch bei typischer Symptomatik die Diagnose BT anhand des klinischen Bildes lediglich mit einer Sensitivität von 76 % und einer Spezifität von 72 % gestellt werden kann (Elbers et al., 2008). Als Differentialdiagnosen kommen in erster Linie alle Zustände, die zu Fruchtbarkeitsstörungen und Aborten führen, in Frage. Als virale Infektionserreger sind hier zu nennen: MKSV, Rinderpest Virus, Akabane Virus, Border Disease Virus, ORF-Virus, EHDV, Bösartiges Katarrhalfieber Virus, BVD/MD und BHV1. Zudem sind auch Photosensibilität, Besnoitiose und Mykotoxikose als Differentialdiagnosen zu berücksichtigen Diagnostische Indikation siehe VO zum Schutz gegen die Blauzungenkrankheit FLI 90
92 Zuständige Untersuchungseinrichtungen Friedrich-Loeffler-Institut, Institut für Virusdiagnostik, Südufer 10, Greifswald - Insel Riems Rechtsgrundlagen Richtlinie 92/119/EWG Richtlinie 2000/75/EG Verordnung (EG) Nr. 1266/2007 Verordnung zum Schutz gegen die Blauzungenkrankheit vom 22. März 2002 in der jeweils geltenden Fassung Untersuchungsmaterial Gerinnungsgehemmtes Blut. Hier eignet sich am besten EDTA-Blut, da mit diesem Untersuchungsmaterial sowohl der AK-Nachweis mittels Kompetitions-ELISA (celisa) als auch die real-time RT-PCR durchgeführt werden kann. Das EDTA-Blut sollte im gekühlten (+4 C) Zustand versendet werden. Lagerung über längere Zeit sollte bei -70 C erfolgen, weil BTV bei -20 C nicht lange stabil bleibt. Post mortem sind Milz und Lymphknoten die Organe der Wahl zur Virusisolierung, schnellstmöglicher Versand erfolgt bei +4 C. Für den Antikörpernachweis können Vollblut, EDTA-Blut oder mindestens 500 μl Serum/ Plasma eingesendet werden Untersuchungsgang Für den BTV-Genom-Nachweis und den Nachweis von BTV-Antikörpern stehen zugelassene Diagnostika zur Verfügung, die angewendet werden sollten (siehe dazu auch die Einleitung der amtlichen Methodensammlung). Darüber hinaus kann auf nachfolgende BTV-Nachweisverfahren hingewiesen werden. Aktuelle Methoden zur Viruscharakterisierung sollten im NRL-BT nachgefragt werden Erregernachweis Virusisolierung Die Virusisolierung in embryonierten Hühnereiern ist sehr schwierig in der Durchführung (intravasale Inokulation von 10 bis 12 Tage alten Eiern). Routinemäßig erfolgt die Anzucht von BT-Viren aus gerinnungsgehemmten Blut auf Aorten- Endothelzellen, Verozellen, Insektenzellen bzw. auf BHK21-Zellen. Generell ist die Effizienz der Zellkulturanzucht geringer als die der Virusisolierung in embryonierten Eiern. Antigennachweis Ein indirekter Sandwich-ELISA zum BTV-Antigennachweis wurde am Institute for Animal Health in Pirbright, U.K. entwickelt. Aufgrund der höheren Sensitivität und Spezifität der RT-PCR hat der AG-ELISA im Routinelabor keine Bedeutung mehr. FLI 91
93 Polymerase Kettenreaktion (PCR) Für die Aufgaben des FLI ist in erster Linie der sichere und sensitive Nachweis von BTV wichtig. Neben den klassischen, Serotyp-übergreifenden PCR nach McColl et al. (1991) und des OIE (Katz et al. 1993) stehen verschiedene real-time RT-PCR Systeme zur Verfügung. Für den Nachweis aller 24 Serotypen werden Pan-BTV-realtime RT-PCR (nach Toussiant et al. 2007) eingesetzt. Des Weiteren werden spezifische real-time RT-PCR Systeme zum Nachweis von BTV8-Europe, BTV1 und BTV6 (Hoffmann et al. 2009) angewendet. Zusätzlich stehen klassische RT-PCR-Systeme zur Verfügung, die eine spezifische Amplifikation der 24 verschiedenen Serotypen erlauben Antikörpernachweis Ein Kompetitions-ELISA (celisa) zum spezifischen und Serotyp-übergreifenden Nachweis von BTV-Antikörpern wurde von Anderson (1984) in Pirbright, U.K. entwickelt. In Deutschland sind kommerzielle celisa für den BTV-AK-Nachweis aus Serum und Plasma zugelassen (z. B. VMRD, ID-VET, Pourquier-IDEXX). Diese Tests werden aufgrund ihrer einfachen Anwendung, verbunden mit einer hohen Spezifität und Sensitivität, routinemäßig am FLI eingesetzt. Für den sehr frühen Nachweis von BTV-Ak nach Infektion und für den sensitiven Nachweis von Impfantikörpern wurde zwei Doppel-Antigen (Sandwich)-ELISA durch das FLI zugelassen (ID Screen Bluetongue Early Detection, ID-VET; PrioCHECK BTV DR, Prionics Deutschland). Weiterhin ist es möglich, mittels kommerziellen Milch-ELISA BTV-AK auch in der Milch von Rind und Schaf zu detektieren. Auch hierzu steht ein zugelassener ELISA zur Verfügung (ID Screen Blue Tongue Milk Indirect, ID-VET) Als weitere Verfahren zum BTV-spezifischen Antikörpernachweis steht der Neutralisationstest (NT) am NRL-BT zur Verfügung. Hiermit kann der serotyp-spezifische Nachweis von BTV-Ak erfolgen. Der ebenfalls im OIE Manual of Standards for Diagnostic Tests beschriebene Agargel-Immundiffusionstest (AGIDT) wird aufgrund der reduzierten Sensitivität im Vergleich zum c-elisa nicht empfohlen. Literatur Elbers A.R.W., Backx A., Ekker H.M., van der Spek A.N., van Rijn P.A. (2008): Performance of clinical signs to detect bluetongue virus serotype 8 outbreaks in cattle and sheep during the 2006-epidemic in The Netherlands. Veterinary Microbiology 129; FLI 92
94 14. Bovine Herpesvirus Typ 1-Infektion (alle Formen) Charakterisierung der Infektion Erreger Das Bovine Herpesvirus Typ 1 (BHV1) gehört zur Familie der Herpesviridae, Subfamilie Alphaherpesvirinae, Gattung Varicellovirus. Es verursacht verschiedene Krankheitsbilder, verhält sich aber immunologisch einheitlich. Nur über Analysen des Genoms ist in vielen Fällen eine Differenzierung zwischen IBR-Stämmen" und IPV/IBP-Stämmen" möglich. Die Infektion ist weltweit verbreitet und erreicht in vielen Ländern hohe Prävalenzen. Dänemark, Österreich, Bozen, Schweden, Finnland und die Schweiz sind anerkannt BHV1-frei. Deutschland besitzt derzeit als einziges Land die EU-Anerkennung für sein BHV1-Bekämpfungsprogramm (2004/215/EG und 2004/558/EG) und damit den so genannten Artikel 9-Status gemäß der Richtlinie 64/432/EWG Klinische Symptomatik Die BHV1-Infektion ist eine überwiegend akut verlaufende, hochkontagiöse virusbedingte Allgemeinerkrankung des Rindes und anderer Boviden. Die Inkubationszeit liegt bei allen Verlaufsformen etwa zwischen 2 und 6 Tagen. Die vorwiegend respiratorische Manifestationsform wird als Infektiöse Bovine Rhinotracheitis (IBR) bezeichnet. Sie geht in ihrer akuten Form mit Fieber bis zu 42 C, serösem Nasenausfluss, einer Hyperämie der Schleimhäute von Flotzmaul und Nase sowie Speicheln einher. Bereits zu Beginn der Erkrankung sinkt die Milchleistung laktierender Tiere. Später treten Husten und Augenausfluss auf. Teils sind auf der Nasenschleimhaut stecknadelkopfgroße, pustelartige Erhebungen zu beobachten. Die Krankheitsdauer beträgt 10 bis 14 Tage. Bei Kälbern fällt die IBR in der Regel als fieberhafte Allgemeinerkrankung mit vorwiegend respiratorischen Symptomen auf. Bakteriell bedingte Pneumonien treten als schwere Sekundärinfektionen auf. Sehr selten werden innerhalb weniger Tage letal verlaufende Meningoenzephalitiden bei Kälbern im Alter von 4 bis 6 Monaten beobachtet. Trächtige Kühe können vor allem im 5. bis 8. Trächtigkeitsmonat nach einer Inkubationszeit von 3 bis 6 Wochen abortieren. Nicht selten verläuft die Infektion jedoch bei einzelnen Tieren oder in ganzen Herden klinisch inapparent. Die genitale Form der Infektion tritt als Infektiöse Pustuläre Vulvovaginitis (IPV) beim weiblichen Rind und als Infektiöse Balanoposthitis (IBP) beim Bullen auf. Sie geht oft mit leichtem Fieber, Rötung und Schwellung der Schleimhaut der äußeren Genitalien, Unruhe und schmerzhaftem Harndrang einher. Auf der Genitalschleimhaut bilden sich stecknadelkopf- bis kirschkerngroße, bläschenartige, grauweiße Erhebungen mit gerötetem Hof, die sich zu Pusteln, kruppösen Veränderungen und ulzerativen Erosionen weiterentwickeln können. Einmal infizierte Tiere bleiben wie generell bei den Herpesvirusinfektionen lebenslang latent infiziert. Nach Reaktivierungen der Infektion, die klinisch inapparent bleiben kann, kommt es zur Virusausscheidung und zur Übertragung auf andere Tiere. Auch geimpfte Tiere können Wildtypvirus aufnehmen und ohne Erkrankung zu Virusträgern werden. Die Virusausscheidung erfolgt hauptsächlich mit den Sekreten der Schleimhäute des Genitaltraktes (IPV/IBP), des Respirationstraktes und dem Konjunktivalsekret (IBR), aber auch mit dem Kot und mit dem Sperma. Die Virusausscheidung dauert selten länger FLI 93
95 als 14 Tage über den Respirationstrakt, vaginal bis zu 14 Tagen und beim Bullen bis zu 4 Wochen. In der Rekonvaleszenzphase befindliche Tiere können das Virus diskontinuierlich ausscheiden. Die Reaktivierung latenter Infektionen kann durch Immunsuppression (z. B. durch Behandlung mit Glukokortikoiden oder besondere Belastungen wie Geburtsstress)provoziert werden Differentialdiagnostik Differentialdiagnostisch kommen bei der IBR andere viral oder bakteriell bedingte Respirationserkrankungen sowie Infektionen mit Lungenwürmern in Betracht. Die IPV muss gegen bakteriell und parasitär (Tritrichomonas fetus) bedingte Deckinfektionen abgegrenzt werden. Bei der differentialdiagnostischen Abklärung infektiöser Abortursachen sind unter anderem die BVD/MD-Infektion, bakterielle Erkrankungen (z. B. Leptospirose, Chlamydiose, Coxiellose) und parasitäre Infektionen (z. B. Neosporose) in Erwägung zu ziehen Diagnostische Indikation Diagnostische Indikationen sind beim Auftreten klinischer Erkrankungen und Aborte, bei der Bestandssanierung, beim Verbringen von Rindern in Bestände mit BHV1- freien Tieren sowie beispielsweise bei An- und Verkaufsuntersuchungen gegeben (siehe auch ) Zuständige Untersuchungseinrichtungen Veterinäruntersuchungs-, Tiergesundheitsämter bzw. Staatliche Lebensmittelund Veterinäruntersuchungsämter der Bundesländer. NRL und OIE Referenzlabor für BHV1 am Institut für Virusdiagnostik des FLI, Insel Riems (Tel.: ) Abklärungsuntersuchungen Rechtsgrundlagen Verordnung zum Schutz der Rinder vor einer Infektion mit dem Bovinen Herpesvirus Typ 1 (BHV1-VO) in der Neufassung vom 03. November 2004 (Bundesgesetzblatt Jahrgang 2004 Teil I Nr. 57, Seite ). Manual of Diagnostic Tests and Vaccines for Terrestric Animals, Chapter IBR (BHV1) FLI 94
96 14.2. Untersuchungsmaterial Untersuchungsmaterial für den Erregernachweis Nasen- und Genitaltupfer; zusätzlich Abortmaterial, Organmaterial wie Lunge, Gehirn, Ganglien, Tonsille (Menge: ca. 0,5 bis 1 cm 3 ) bei verendeten bzw. geschlachteten Tieren sowie Spermaproben (Frischsperma oder abgefüllte Proben in Verdünnerlösung). Lagerung bei -20 C, optimal bei -80 C. Mehrfaches Einfrieren und Auftauen führt zur drastischen Senkung des Virustiters und damit der Nachweisbarkeit in der Zellkultur Untersuchungsmaterial für den Antikörpernachweis Plasma, Serum; Menge: mindestens 500 µl Milchproben: Einzel- oder Sammelmilch; für Nativmilchverfahren mind. 500 µl, für Konzentrierungsverfahren mind. 50 ml Untersuchungsgang Erregernachweis Virusisolierung in der Zellkultur BHV1 vermehrt sich in bovinen Zellkulturen und -linien (z. B. MDBK, KOP-R), teilweise auch in Zellen anderer Herkunft. Die Infektion verläuft zytopathisch und führt im Monolayer zur Plaque-Bildung. Bei den meisten Zelllinien runden sich die Zellen innerhalb der Plaques ab oder bilden seltener kleine Synzytien. Ausführung: Homogenisieren des Organmaterials, Herstellen einer Organsuspension (1:5 bis 1:10) unter Verwendung antibiotika- bzw. antimykotikahaltigen Mediums (Anlage), Lagerung für 1 bis 2 h bei 4 C im Kühlschrank, anschließende Zentrifugation. Tupferproben werden in Virusanzuchtmedium für etwa 15s stark geschüttelt (Vortex). Die Probenflüssigkeit kann dann direkt auf die Zellkultur aufgebracht werden. Nicht angeimpfte Proben können bei 70 C gelagert werden. Blutproben werden im Verhältnis 1:4 mit Lysispuffer versetzt und für 15 min auf Eis lysiert. Nach zwei Waschschritten mit PBS werden die Blutleukozyten pelletiert (2000 x g, 3 min) und je ml Ausgangsblutvolumen in einem ml Zellkulturmedium resuspendiert. Die Proben sollten weder gefriergetaut noch mit Ultraschall behandelt werden. Spermaproben in Verdünnerlösung (in der Regel gebrauchsfertig in Pajetten verpackt) werden unverdünnt und in einer 1:10 Verdünnung (Virusanzuchtmedium) angeimpft. Die Proben sollten tiefgefroren geliefert und sofort nach dem Auftauen bearbeitet werden. Native Spermaproben werden vor der Animpfung 1:10 und 1:100 in Virusmedium verdünnt. Nicht angeimpfte Proben können bei 70 C gelagert werden. Inokulation der bearbeiteten Probe auf die entsprechende Zellkultur (z. B. MDBK, FBTr oder KOP-R) sollte im Doppelansatz erfolgen. Zur Vermeidung von toxischen Effekten (z. B. bei Spermaproben) kann die Probe nach 4 h FLI 95
97 (Adsorption) wieder entfernt und vollständig durch Virusanzuchtmedium ersetzt werden. Zur Virusisolierung können 24-Lochplatten, Zellkulturröhrchen oder Zellkulturflaschen verwendet werden, das Medium sollte zur Verhinderung bakterieller Kontaminationen Antibiotika und eventuell Antimykotika in gebräuchlichen Konzentrationen enthalten (Anlage). Die Bebrütung sollte bei 37 C für mindestens 7 Tage erfolgen. Nach 7 Tagen werden 100 µl Zellkulturüberstand aus den beimpften Zellkulturen jeweils auf frisch angelegte Kulturen verbracht (1. Passage) und für weitere 5 bis 7 Tage bei 37 C inkubiert. Die Überstände können bei Bedarf (z. B. Rücklage für weitere Abklärung) bei -70 C gelagert werden. Eventuell sind weitere Passagen notwendig. tägliche Kontrolle des Auftretens eines CPE (bei hohem Virusgehalt diffus verteilte Zellabkugelungen nach ca. 1 bis 2 Tagen, bei niedrigem Virusgehalt einzelne Plaques mit Abrundung der Zellen oder Ausbildung kleiner Synzytien). Zur Sicherung der Diagnose kann der Zellrasen nach Fixierung mit Hilfe von BHV1-spezifischen Antikörpern (polyklonales Antiserum oder monoklonale Antikörper) angefärbt werden (Immunfluoreszenz- oder Immunperoxidasefärbung). Identifizierung durch Virusneutralisation Das vermeintliche BHV1-Isolat in log10-schritten mit einem BHV1-positiven und BHV1-negativen, monospezifischen, Referenzserum vom Rind (kann vom NRL für BHV1 angefordert werden) verdünnen und für 2 h bei 37 C inkubieren, anschließend: Inokulation des Virus-Serumgemisches auf eine 96-well Mikrotiterplatte (Vierfachansatz) und anschließende Bebrütung für 4 Tage bei 37 C, Kontrolle der virusneutralisierenden Aktivität. Nachweis von BHV1-DNA mittels Polymerasekettenrektion (PCR) Die PCR kann zum Nachweis von BHV1-DNA in Organproben, in Tupferproben und in Blutproben während der Virämie genutzt werden. Die PCR eignet sich ferner für den BHV1-Nachweis in Spermaproben. Der Nachweis latenter Infektionen mittels PCR (z. B. Nachweis in Organproben) ist schwierig und für die allgemeine Diagnostik nicht geeignet. Je nach Fragestellung sind in der Literatur verschiedene PCR-Techniken für die BHV1-Infektion beschrieben. Primer und die Amplifikationsparameter müssen entsprechend der Zielstellung ausgewählt werden. Die PCR muss für die jeweiligen spezifischen Bedingungen optimiert werden, um unter Routinebedingungen erfolgreich zu funktionieren. Generelle Arbeitsschritte sind: Homogenisierung des zu untersuchenden Probenmaterials DNA-Extraktion (z. B. Phenol-Chloroform-Extraktion nach Proteinase K- Verdau oder Verwendung fertiger Systeme wie z. B. PUREGENE DNA Kit oder QIAamp DNA Kit) Amplifikation in der PCR, in Ausnahmefällen nested-pcr Agarosegel-Elektrophorese für die Differenzierung von BHV1-Markerimpfvirus und Wildtypvirus können beispielsweise ge- und gb-spezifische Primer eingesetzt werden. FLI 96
98 Nähere Angaben zur Anwendbarkeit der PCR im Rahmen der BHV1-Diagnostik sind beim NRL für BHV1 zu erhalten (Tel ). Angaben zu Primern, Reagenzien und Zykluszeiten finden sich im Anhang. Hinweis: Die BHV1-PCR ist bisher von der OIE nicht als validierte Methode anerkannt. Standardmethode sollte daher immer die Virusisolierung sein. Positive PCR-Ergebnisse sollten möglichst durch die Virusisolierung und nachfolgende serologische Untersuchungen verifiziert werden. Neue real-time PCR-Protokolle zum Nachweis von BHV1 sind bisher nicht publiziert Indirekter Erregernachweis Enzyme Linked Immunosorbent Assay (ELISA) Mehrere kommerziell erhältliche und in Deutschland zugelassene ELISA-Systeme existieren, mit denen Antikörper gegen ganzes Virus (indirekter Vollvirus ELISA) oder gegen einzelne Glykoproteine (gb- bzw. ge-blocking ELISA) nachgewiesen werden können. ELISA-Systeme zum Nachweis von Antikörpern gegen das Glykoprotein E (IDEXX GmbH; Dr. Bommeli Diagnostics/IDEXX) dienen als spezifisches Diagnostikum zur Unterscheidung von uninfizierten Rindern und Tieren, die mit ge-markerimpfstoff immunisiert wurden, von solchen, die mit Wildtyp-BHV1 in Kontakt waren. Bezüglich der Durchführung der einzelnen ELISAs wird auf die Produktinformationen der Hersteller verwiesen. BHV1-Referenzseren für die ELISA Diagnostik können vom NRL für BHV1 angefordert werden. Derzeit werden vom NRL für BHV1 alle ge-blocking-elisa-testchargen einer Prüfung unterzogen. Andere BHV1-Antikörper-ELISAs werden nach einer Freistellung von der Chargenprüfung stichprobenartig untersucht. Die höchste Sensitivität besitzen die gb-blocking-elisas sowie moderne indirekte ELISA-Systeme (> 98 %). In der Regel ist die Sensitivität dieser Systeme sogar höher als die des Neutralisationstests. Geringere Sensitivitäten werden hingegen mit den ge-blocking-elisas erreicht. Dies ist insbesondere bei Einzeltieruntersuchungen problematisch. Im Gegensatz hierzu ist die Herdensensitivität der ge-blocking- ELISAs als hoch zu bewerten. Für Milchproben eignen sich ausschließlich die zugelassenen indirekten ELISA- Systeme. Moderne indirekte ELISAs erlauben sogar die sensitive und spezifische Untersuchung von Nativmilchpools von bis zu 50 Tieren. Diese Testsysteme sind in der Lage, ein schwach positives Tier in einer Poolprobe zu erkennen. Ein zuverlässiger Markertest für Milchproben existiert dagegen bisher nicht. Die zugelassenen geblocking-elisas reagieren mit Sammelmilchproben erst dann sicher positiv, wenn mehr als 10 % der Herde BHV1-gE-Antikörper-positive Reagenten sind. Neutralisationstest zum Nachweis von BHV1-Antikörpern (siehe NT) Der Neutralisationstest basiert auf dem Nachweis der neutralisierenden Aktivität von Rinderseren gegen das BHV1. Durch logarithmische Verdünnung der Seren wird der neutralisierende Antikörpertiter im Vergleich zu mindestens einem schwach positiven und einem negativen Standardserum bestimmt. Die Titer werden nach der Tabelle FLI 97
99 von Kärber als neutralisierende Dosis 50 % oder 100 % (ND 50 oder ND 100 ) berechnet. Eine Rücktitration des Testvirus stellt zudem die Verwendung einer korrekten Virusmenge für die Neutralisierung sicher. Aufgrund ihrer Sensitivität und der Eignung für Massenuntersuchungen haben ELISA-Testsysteme den NT für allgemeine diagnostische Zwecke weitestgehend abgelöst. Er sollte jedoch als Referenzmethode zur Verfügung stehen. In jedem Fall ist eine Serum-Virus-Inkubation von mindestens 12 besser 24 Stunden einzuhalten, da die Sensitivität damit im Vergleich zu einer 1- bis 2-stündigen Serum- Virus-Inkubation signifikant ansteigt. Ausführung: Herstellen und Titrieren von BHV1-Testvirus MDBK-Zellen niedriger Passage 1:8 in 175 cm² Kulturflaschen teilen. Nachdem sich ein konfluenter Zellrasen gebildet hat (nach 24 bis 8 h) Erhaltungsmedium zugeben und mit etwa 0,1 infektiösen Einheiten BHV1 (z. B. Stamm Schönböken) pro Zelle beimpfen (etwa 100 µl einer BHV1-haltigen Virussuspension mit einem Titer von 107 KID50/ml je 175 cm² Kulturflasche). Nach h, wenn erste Zeichen eines zytopathischen Effektes sichtbar werden, Überstand von den Kulturflaschen steril entnehmen, bei 2500 x g für 3 min zentrifugieren und in 1 ml-portionen abfüllen. Die Lagerung erfolgt sofort bei mindestens -70 C. Diese Viruspassage wird im Folgenden als Testvirus (TV) bezeichnet. Zwei Röhrchen mit eingefrorenem Testvirus schonend auftauen, in log10- Schritten von 10-1 bis 10-8 in Anzuchtmedium verdünnen und jeweils 100 µl der verdünnten Virussuspension im Achtfachansatz auf 96-Loch- Mikrotiterplatten pipettieren und für 24 h bei 37 C und 5 % CO 2 inkubieren. MDBK-Zellen auf eine 75 cm² Kulturflasche 1:6 teilen und für 24 h inkubieren. Nach 24 h Zellen mittels Trypsinlösung ablösen, zählen und auf Zellen/ml mit Anzuchtmedium verdünnen. Je 100 µl Zellsuspension auf die vorinkubierten Mikrotiterplatten geben. Nach 4 Tagen zytopathischen Effekt beurteilen (tägliche protokollierte Kontrolle!). Berechnung des BHV1-Titers erfolgt nach der Tabelle von Kaerber als kulturinfektiöse Dosis 50 % (KID50). Aus beiden Ansätzen wird das geometrische Mittel der erhaltenen 24-h-Titer berechnet (Summe der Exponenten geteilt durch Anzahl der Exponenten: z. B. 10 7,3 KID 50 /ml und 10 7,7 KID50/ml = 10 ((7,3+7,7)/2) = 10 7,5 KID 50 /ml). Vorbereiten der Seren Serum von Nativblutproben wird für 30 Minuten bei 56 C im Wasserbad inaktiviert. Testdurchführung Verdünnung der Test- und Referenzseren (Positiv-, Negativserum) in log2- Schritten in der Mikrotiterplatte: 50 µl Mediumvorlage in alle Vertiefungen außer in Reihe A (unverdünnter Ansatz) pipettieren, 100 µl Serumvorlage in Reihe A zugegeben und jeweils 50 µl in nächste Reihe überführen, achtmal pro Verdünnungsschritt mischen, in der letzten Reihe 50 µl verwerfen ( log2- Verdünnungsreihe ). Je Serum sollte mindestens ein Dreifachansatz untersucht werden. FLI 98
100 Testvirus durch Verdünnung in Anzuchtmedium auf 10 2 KID 50 /50 µl (= 10 3,3 KID 50 /ml) einstellen. Hierfür sollte pro Verdünnungsschritt nicht weniger als 0,5 ml Virussuspension und keine Einzelverdünnung größer als 1:10 verwendet werden (z. B. Ausgangstiter des Testvirus = 10 7,3 KID 50 /ml, benötigte Virussuspensionsmenge = 50 ml. Daraus folgt ein Verdünnungsfaktor von 10 7,3 10 3,3 = 10 4 = 10000; Verdünnungsreihe: 0,5 ml Virussuspension + 4,5 ml Medium 0,5 ml VS1 + 4,5 ml M 0,5 ml VS2 + 4,5 ml M 5 ml VS ml M). Zugabe von 50 µl des verdünnten Testvirus (eingestellt auf 100 KID 50 /50 µl) zu den Serumverdünnungen, Platte kurz schütteln und für 24 h bei 37 C und 5 % CO 2 inkubieren. Virusrücktitration in log10-stufen: 0,5 ml der verwendeten Virusverdünnung werden hierzu 10-1 bis 10-4 verdünnt und 50 µl der Virusverdünnung und der jeweiligen Rücktitrationsverdünnungen im Achtfachansatz pipettiert. Die Platte wird anschließend ebenfalls für 24 h bei 37 C und 5 % CO 2 inkubiert. Für alle Seren sollte eine Serumkontrolle (unverdünnt) im Doppelansatz mitgeführt werden (Toxizitätskontrolle). Nach 24 h werden 100 µl MDBK-Zellsuspension in Anzuchtmedium (ca Zellen/100 µl) zu allen Vertiefungen gegeben. Platten für 4 Tage bei 37 C und 5 % CO 2 inkubieren. Ablesen und Auswerten des NT Alle Vertiefungen werden täglich mikroskopisch kontrolliert und die Ergebnisse protokolliert. Die endgültige Bestimmung des nak-titers (z. B. ND 100 ) erfolgt am Tag 4. Bereits ein Virusplaque macht die entsprechende Vertiefung positiv. Der NT ist valide, wenn die Rücktitration einen Titer von ,5 ergibt, das positive Kontrollserum nicht mehr als eine log2-stufe vom Erwartungswert abweicht und keine Virusneutralisation in den Vertiefungen des negativen Kontrollserums nachweisbar ist. Die Serumkontrolle darf keine oder nur geringgradige Zeichen toxischer Veränderungen aufweisen Berechnung des Neutralisationstiters (ND100): (-log2) = a/b + c a = Anzahl der Vertiefungen ohne Virusvermehrung b = Anzahl der Vertiefungen pro Verdünnungsstufe c = -log2 einer evtl. Vorverdünnung des Testserums (z. B. -log2 für 1:64 = 6) BHV1-positive und negative Referenzseren sowie Referenzmilchen zur Validierung der BHV1-Serologie sowie charakterisierte BHV1-Virusstämme können vom NRL für BHV1 angefordert werden. Für den NT existiert ein spezielles NT-Panel von 10 Seren mit unterschiedlichen BHV1-Antikörper-Titern. FLI 99
101 Anhang I: Reagenzien Zelllinien Virusisolierung und VNT: MDBK oder FBTr (Fötale Bovine Trachea) oder KOP (Kälberösophagus-Zellen) Bezugsquelle: Zellbank für Zelllinien in der Veterinärmedizin, Friedrich- Loeffler-Institut (FLI) Insel Riems (Leiter: Dr. Riebe). Virusstämme BHV1-Virusstämme (z. B. Stamm Schönböken) können von der Virusbank des FLI Insel Riems angefordert werden (Leiter: Dr. Dauber). Medien Anzuchtmedium: Eagle MEM Dulbecco w/l-glut. 10 % Fetales Kälberserum (FKS) 1 % Antibiotika Antibiotika: Amphotericin B (250 µg/ml) Penicillin ( IE/l), Streptomycin (100 mg/l) oder Gentamycin (50 mg/ml) Erhaltungsmedium und Virusanzuchtmedium: Eagle MEM Dulbecco w/l-glut. 2 % FKS 1 % Antibiotika Puffer, Lösungen, Reagenzien PBS: 8,00g NaCl + 0,2g KH2PO4 + 2,9g Na2HPO4 x 12 H20 + 0,2g KCl ad ml Aqua bidest, ph 7,2 Isotonischer Phosphatpuffer: 8,28g NaCl + 3,30g Na2HPO4 x 12 H20 ad ml Aqua bidest (IP) ph 7,8 IP-Glycerol: IP - Glycerol = 9 : 1 Trypsinlösung: Saline-Versen-Trypsinlösung zum Ablösen von Zellen Lysispuffer: 8,29g NH4Cl + 1,0 g KHCO3, 1mM EDTA ad 1000 ml Aqua bidest, ph 7,4 FLI 100
102 Referenzmaterial Für die BHV1-Serologie kann beim NRL für BHV1 ein Panel an validierten Referenzseren und -milchen angefordert werden. Die deutschen Standardsera orientieren sich dabei an den EU-Standards EU1 (positiv), EU2 (schwach positiv) und EU3 (negativ). Die Seren sind als R1 (positiv), R2 (schwach positiv), R3 (sehr schwach positiv) sowie R31 (negativ) und R32 (negativ) bezeichnet. Diese Standardseren sollen jeweils als Basis für die Entwicklung laboreigener, angepasster Standardproben dienen. Zudem kann vom NRL für BHV1 auf Anfrage ein großes BHV1-Referenzpanel mit etwa 20 Seren sowie eine NT-Panel mit etwa 10 Seren zu Validierungszwecken angefordert werden. FLI 101
103 Anhang II: PCR-Protokoll Einleitung In der hier vorliegenden Labormethodenanweisung werden spezielle PCR-Protokolle zum Nachweis von Genomen des BHV1 aufgeführt (ge- und gb-spezifische Sequenzabschnitte). Material und Geräte Geräte: Thermo Cycler Pipetten variabel von 0,5 µl bis 100 µl Pipettenspitzen mit Filter ungepuderte Handschuhe 200 µl Reaktionsgefäße Reaktionsgefäßständer Mini-Zentrifuge -20 C Tiefkühltruhe -70 C Tiefkühltruhe Sterilbank Vortex Reagenzien Polymerase PFX Platinum (Gibco-BRL Life Technologies PCRx Enhancer System) 10X Puffer MgSO 4 10x Enhancer dntp mix Primer (ge und gb) mol.biol H 2 O. ca µl aufgereinigte DNA-Suspension (enthält etwa 1 bis 50 µg DNA) Durchführung Die Durchführung teilt sich in Probenaufbereitung, eigentliche Polymerase- Kettenreaktion und den Nachweis spezifischer Amplifikate. Probenvorbereitung Es werden mit Hilfe des Puregene-Kits (Fa. Biozym) oder des QIAamp-DNA- Isolierungs-Kits (Fa. Qiagen) aufgereinigte DNAs eingesetzt (Aufreinigung nach Beschreibung des Herstellers). Qualität und Quantität der DNA können im Agarosegel abgeschätzt werden. Es sind 1 bis 5 µl direkt nach der Aufreinigung gewonnene DNA-Suspension in der BHV1-PCR einzusetzen. Im Einzelfall kann von der Menge abgewichen werden und eine genaue Messung mittels Photometrie erfolgen. FLI 102
104 BHV1-PCR zum Nachweis von ge- und gb-spezifischen Genomabschnitten (PCR Protokoll) a) BHV1-gE-PCR: Mastermix PFX Platinum (Invitrogen) 10X Puffer 5 µl MgSO 4 2 µl (50 mm stock solution) 10x Enhancer 5 µl dntp mix 4 µl (2,5 mm stock solution) Primer mix 2 µl (10 pmol/µl stock solution entspricht ca. 50 ng/µl) Template 2-5 µl (10 bis 500 ng) Taq Polymerase 2,5 U (PFX Platinum Taq Polymerase H 2 O ad 50 µl Primer ge_1: GCTTCGGTCGACACGGTCTT ge_2: GGTACGTCTCCAAGCTGCCC Produktgröße: etwa 265 bp PCR-Zyklus 96 C 5 min 10x: 65 C 90 sec 72 C 100 sec 96 C 80 sec 15x: 54 C 90 sec 72 C 100 sec 96 C 80 sec 10x: 60 C 90 sec 72 C 100 sec 96 C 80 sec 72 C 10 min 4 C hold FLI 103
105 b) BHV1-gB-PCR Mastermix PFX Platinum (Invitrogen) 10x Puffer 5 µl MgSO 4 1,5 µl (50 mm stock solution) 10x Enhancer 5 µl dntp mix 4 µl (2,5 mm stock solution) Primer mix 2 µl (10 pmol/µl stock solution entspricht ca. 50 ng/µl) Template 2-5 µl (10 bis 500 ng) Taq Polymerase 2,5 U (PFX Platinum Taq Polymerase) H 2 O ad 50 µl Primer gb1: TACGACTCGTTCGCGCTCTC gb2: GGTACGTCTCCAAGCTGCCC Produktgröße: etwa 478 bp PCR-Zyklus 96 C 5 min 10x: 65 C 90 sec 72 C 100 sec 96 C 80 sec 15x: 54 C 90 sec 72 C 100 sec 96 C 80 sec 10x: 60 C 90 sec 72 C 100 sec 96 C 80 sec 72 C 10 min 4 C hold c) Kontrollen: Es sind stets Positiv- und Negativkontrollen mitzuführen und auch als so genannte Extraktionskontrollen sowie Inhibitorenkontrollen einzusetzen. Zusätzlich wird bei jeder PCR eine Wasserkontrolle mitgeführt. Im Regelfall sind daher je PCR-Ansatz mindestens zwei negative Proben sowie eine positive Kontrolle mitzuextrahieren. Wenn möglich ist zudem jede Probe vor der Extraktion zu teilen und mit einer definierten Menge BHV1-DNA zu versetzen (spiken). Der Einsatz der Kontrollen ist für jede Proben mit dem Laborleiter oder seinem Stellvertreter abzustimmen. FLI 104
106 Auswertung Die Auswertung erfolgt i.d.r. mit Hilfe der Agarosegel-Elektrophorese mit Ethidiumbromid-Färbung aufgrund der Größe im Vergleich zu den Positiv-Kontrollen und einem mitgeführten Molekulargewichtsmarker. Die Untersuchungen sind nur valide, wenn die bei den einzelnen PCR-Methoden vorgeschriebenen Negativ- und Positiv-Kontrollen korrekt detektiert werden. Referenzen Fuchs et al. J. Clin. Microbiol. 37, , 1999 FLI 105
107 15. Bovine Spongiforme Enzephalopathie (BSE) Charakterisierung der Infektion Erreger Die Bovine Spongiforme Enzephalopathie (BSE) ist eine infektiöse neurodegenerative Erkrankung des Rindes, die erstmalig 1985 in Großbritannien nachgewiesen wurde. Ätiologisch wird sie der Gruppe der TSE/Prionenerkrankungen zugeordnet, die durch Ablagerungen des pathologischen Prion-Proteins im Zentralen Nervensystem erkrankter Tiere gekennzeichnet ist. Als wichtigster Übertragungsweg wird die Verfütterung von infektiösem Tiermehl angesehen. Bisher wurden europaweit mehr als BSE-Fälle diagnostiziert, davon mehr als 99 % im Vereinigten Königreich Klinische Symptomatik Das klinische Bild der BSE ist sehr vielfältig und in Tabelle 1 dargestellt. Erkrankte Tiere zeigen ein ungewöhnliches Verhalten und verändertes Temperament und können unter Nervosität, Tremor, Hyperästhesie und Juckreiz, Bewegungsstörungen bis zum finalen Festliegen, Gewichts- und Konditionsverlust sowie Milchrückgang leiden. Häufig wird ein Treten der Tiere in die Einstreu oder nach Personen beobachtet. Fieber tritt in der Regel nicht auf. Die Krankheit verläuft protrahiert (3 Wochen bis 6 Monate Krankheitsdauer). Infolge der langen Inkubationszeit sind nur erwachsene Tiere klinisch betroffen. Das Alter erkrankter Tiere mit nachgewiesener BSE lag zwischen 22 Monaten und 15 Jahren, wobei 4 Jahre alte Tiere am häufigsten erkrankt waren. Der Ausbruch der Erkrankung ist unabhängig von Trächtigkeit, Laktationsperiode oder Jahreszeit, obwohl im Vereinigten Königreich mehr Fälle während der Kalbezeit gemeldet wurden. Die BSE-Erkrankung bei Rindern entwickelt sich anfangs schleichend und unauffällig und kann bei oberflächlicher Betrachtung übersehen werden. Deshalb kann schon die kleinste Veränderung ein Hinweis auf eine sich entwickelnde BSE sein. Selbst im fortgeschrittenen Erkrankungsstadium sind oft nur einzelne Veränderungen und nur äußerst selten alle Symptome gleichzeitig bemerkbar. FLI 106
108 Tabelle 1: Überblick über die wichtigsten klinischen Anzeichen von BSE Allgemeines Störung des Verhaltens Störungen in der Empfindlichkeit Störung in der Bewegung Rückgang der Milchleistung bei erhaltener Fresslust Langsame Abmagerung bei erhaltener Fresslust Festliegen nach dem Abkalben Zunehmende Ängstlichkeit und Nervosität z. B. Zögern vor kleinsten Hindernissen (z. B. am Boden liegende Stange) oder vor dem Überschreiten des Kotgrabens, Angst vor Durchgängen Aggressivität (Ausschlagen gegen Menschen und Tiere, Schlagen beim Melken) Erhöhte Aufmerksamkeit und Schreckhaftigkeit Absondern von der Herde Häufiges Belecken der Nase Zähneknirschen Zusammenzucken infolge geringster Umwelteinflüsse (Lärm, Bewegung von Personen oder Tieren, Türen schlagen oder Herunterfallen von Gegenständen) Zusammenzucken beim plötzlichem Einschalten von Licht in einem dunklen Raum Überreaktion bei Berührung im Kopf- und Halsbereich Zittern oder Muskelzuckungen an Lippen, Flotzmaul, Ohren, Hals, Vorderkörper, Flanken oder am ganzen Körper Steifer Gang, Traber- und Hahnentrittartige Bewegungen Einknicken mit den Hinterbeinen Schwankender Gang Differentialdiagnosen Wichtige Differentialdiagnosen bei Rindern sind: Stoffwechselstörungen: Hypomagnesiämie, nervöse Form der Ketose, Kupfermangel, cerebrocorticale Nekrose (CCN) virale und bakterielle Infektionen des zentralen Nervensystems: Listeriose, Tollwut, Aujeszkysche Krankheit Aggressionen psychogener Ursache BSE-Überwachung In der EU wird gemäß Verordnung EU 999/2001 ein aktives BSE- Überwachungsprogramm mittels zugelassener BSE-Schnelltestverfahren ( durchgeführt, das die Untersuchung aller gesund geschlachteten Rinder über 30 Monate und aller Rinder über 24 Monate vorsieht, die not-, krankgeschlachtet oder getötet wurden, oder die verendet sind. Mit der Änderungsverordnung 571/2008 wurden hierzu auf Antrag beim Vorliegen einer verbesserten epidemiologischen Situation Ausnahmen gestattet. Diese Kriterien werden von den 15 alten Mitgliedstaaten erfüllt, so dass für diese ab dem 1. Januar 2009 die Testaltersgrenze generell auf 48 Monate angesetzt wurde. FLI 107
109 Die BSE-Überwachungsmaßnahmen umfassen demnach die A B amtliche Untersuchung aller über 48 Monate alten, in Deutschland oder in Mitgliedstaaten mit vergleichbarem epidemiologischem Status geborenen und gehaltenen, normalgeschlachteten und verendeten Rinder mittels BSE-Schnelltest, ( Active surveillance ) in allen anderen EU-Mitgliedstaaten oder aus Drittländern stammenden die amtliche Untersuchung aller über 30 Monate alten normalgeschlachten Rinder mittels BSE-Schnelltest ( Active surveillance C Schnelltest-Untersuchung aller über 24 Monate alten, aus EU- Mitgliedsstaaten, in denen kein jährliches Überwachungsprogramm durchgeführt wird, oder Drittländern stammenden, not- oder krankgeschlachteten bzw. getöteten oder verendeten Rindern, ( Active surveillance ) D altersunabhängige Abklärung klinischer Verdachtsfälle ( Passive surveillance ) Zur Untersuchung dürfen nur solche Tests verwendet werden, die für die Untersuchung dieser Spezies zugelassen sind ( Die Bestätigung eines reaktiven Testergebnisses hat in allen Fällen am NRL für BSE und Scrapie am FLI auf der Insel Riems zu erfolgen, alles verfügbare Material muss daher umgehend an das FLI weitergeleitet werden. Die Untersuchungsstelle hat das BMELV und das NRL am FLI bundeseinheitlich nach einem vorgegebenen Meldesystem (siehe Untersuchungsmaterial) über das Ergebnis der jeweiligen Untersuchungen zu informieren. Im Falle des klinischen Verdachtes einer TSE kann dieser nach den derzeitigen Vorgaben (Verordnung (EG) Nr. 103/2009) des OIE nicht durch ein negatives Schnelltest-Ergebnis ausgeräumt werden. Die Abklärung eines solchen Verdachtsfalles muß am NRL durchgeführt werden. Um bei einem klinisch erkrankten Tier eine umfangreiche Asservation von Proben (siehe Untersuchungsmaterial) sicherzustellen, sollte das FLI in solchen Fällen frühzeitig benachrichtigt werden. Neben einer Verbringung des Tieres an das FLI ist auch eine Sektion vor Ort mit Unterstützung eines Mitarbeiters des FLI möglich. Abschließende Falldefinition für BSE Ein BSE-Verdacht wird auf Grund klinischer Symptomatik oder eines reaktiven Ergebnisses in einem der national und von der EU zugelassenen BSE-Schnelltests geäußert. Die Meldung eines BSE-Verdachts aufgrund eines reaktiven BSE- Schnelltest-Ergebnisses in TSN sollte keinesfalls erfolgen. Ein BSE-Fall ist nach Erhalt eines den Verdacht bestätigenden Befundes aus dem NRL für BSE/Scrapie am FLI festzustellen und in TSN einzustellen. FLI 108
110 Zuständige Untersuchungseinrichtungen Staatliche Untersuchungsstellen: BSE-Untersuchungen bei Schlachttieren, not- und krankgeschlachteten Tieren, tot aufgefundenen Tieren sowie bei klinischen Verdachtsfällen privat geführte Untersuchungslabors ausschließlich BSE-Untersuchungen bei Schlachttieren Bestätigungsuntersuchungen müssen durch das nationale Referenzlabor am FLI durchgeführt werden. Dies gilt für alle bei Tieren auftretenden TSE- Erkrankungen (z. B. auch CWD, FSE). Im NRL werden die in den geltenden Bestimmungen festgelegten Untersuchungsverfahren angewandt Rechtsgrundlagen EU: Anhang X der VO (EG) 999/2001 und alle Änderungen National: BSE-Maßnahmenkatalog BSE-Untersuchungsverordnung Internationales Tierseuchenamt (OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2008) Untersuchungsmaterial Probennahme Probennahme und Beprobung erfolgen entsprechend Anhang X, Kapitel C der VO (EG) 999/2001 sowie nach den Vorgaben des Internationalen Tierseuchenamtes OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2004) Entnahme des Hirnstammes Der Gehirnstamm ist durch Amtstierärzte, amtliche Tierärzte und Fleischkontrolleure oder durch eingewiesene Probenehmer unter direkter Aufsicht des amtlichen Tierarztes zu entnehmen. Die Proben sollten so frisch wie möglich sein und unverzüglich nach dem Tod des Tieres entnommen werden um die fortschreitende Autolyse des Gewebes zu verhindern. FLI 109
111 Zur Entnahme des Hirnstammes sind folgende Methoden bekannt: a) mit dem Entnahmelöffel (scharfer Löffel) Diese Methode ist eine geeignete Technik zur Entnahme von Hirnproben. Die Entnahme hat mit einem Entnahmelöffel durch das Foramen magnum zu erfolgen. b) mit Wasserdruck Bei dieser Methode wird das Hirngewebe mit Wasser, das mit einem geeigneten Gerät durch den Schusskanal zugeführt wird, durch das Foramen magnum herausgedrückt. Bei Anwendung dieser Entnahmetechnik kann es jedoch zu einer Verteilung von mit Risikomaterial kontaminiertem Tropfwasser kommen. Die Entnahmetechnik mit Wasserdruck ist geeignet, wenn durch eine Gummimanschette vorn am Gerät das Zurückspritzen von Wasser verhindert und der Wasserdruck am Gerät geregelt wird und die Probeentnahme in einem Kopfkabinett erfolgt. Der Gehirnstamm ist unversehrt in das mit der Untersuchung befasste Labor zu senden. Dort werden die für den jeweils verwendeten Test notwendigen Proben genommen und der Probenrest bis zum Abschluss der Untersuchung bei +4 C gelagert Probennahme im Rahmen der Schnelltestuntersuchungen Unabhängig von ihrem Zustand ist im Rahmen der aktiven Überwachung prinzipiell jede Probe mittels Schnelltest zu untersuchen. Soweit es der Gewebezustand zulässt, ist dabei das Material aus der Obex-Region des Hirnstammes (Abb. 1 und 2) zu entnehmen. Dies erhöht die Wahrscheinlichkeit auch frühe, präklinische Stadien nachweisen zu können. Andere Hirnregionen und/oder das Rückenmark dürfen im Rahmen der Schnelltestuntersuchungen unter keinen Umständen verwendet werden. Ist die Obex-Region wegen fortgeschrittener Autolyse und Fäulnis des Gewebes nicht mehr auffindbar, muss in jedem Fall eine möglichst repräsentative Probe des Hirnstammes entnommen werden. In solchen Fällen ist ein positives Ergebnis gültig. Ein negatives Ergebnis hingegen kann nur unter Vorbehalt verwendet werden. Vorgehensweise: Es sollte eine würfelförmige Gewebeprobe unilateral, unter Schonung der Gegenseite (Abb. 2), vorzugsweise mittels eines Skalpells entnommen werden; alternativ kann die Probe auch mittels spezieller Entnahmetechniken (Entnahmespritze o.ä.) gewonnen werden; näheres hierzu regeln die jeweils amtlich zugelassenen Gebrauchsanweisungen der TSE-Schnelltests. FLI 110
112 Abbildung 1: Medianschnitt durch das Gehirn (nach Budras und Wünsche) Obex; Lokalisation für Schnelltestung Entnahmestelle für Histopathologie/Immun- Histologie (Formalinprobe des Stammhirns) Medulla oblongata Reste des Kleinhirns Mittelhirn Abbildung 2: Stammhirn von dorsal nach Abtragung des Kleinhirns. FLI 111
113 Probennahme nach einem reaktiven Schnelltestergebnis (BSE- Verdacht) Reaktive BSE-Schnelltest-Ergebnisse führen zur weitergehenden Abklärung durch das nationale Referenzzentrum am INNT des FLI, Insel Riems. Einzelheiten des Versands der Proben siehe Kap. 3. Einsendungen an das NRL müssen telefonisch vorangemeldet werden. Zur Ankündigung der Einsendung ist zudem das FAX-Formular gemäß Anhang zu verwenden. Zur Untersuchung sind alle Vorergebnisse (Filme, ELISA-Werte der Probe - einschließlich des jeweiligen Cut-offs), alle zur Verfügung stehenden Proben sowie die Reste der ersten Homogenate einzusenden. Weiterhin sollte eine vollständige, transversale Scheibe (ca. 5mm) aus der Region direkt kranial des Obex entnommen werden (Abb. 2). Diese dient der späteren histopathologischen sowie immunhistologischen Untersuchung. Um einerseits die Diagnostik beeinträchtigende morphologische Verluste zu vermeiden und andererseits eine schnellstmögliche diagnostische Untersuchung zu gewährleisten sollte diese Probe unabhängig vom Autolysegrad bereits im Schnelltestlabor in neutral gepuffertes Formalin (4 %) fixiert werden. Ein Einfrieren des für die histomorphologische Untersuchung gedachten Gewebes sollte unbedingt vermieden werden Zusätzliche Probennahme nach einem reaktiven Schnelltestergebnis Bei Feststellung eines reaktiven BSE-Schnelltest-Ergebnisses müssen im Schlachthof alle noch verfügbaren Proben vom zugehörigen Tier unter amtlicher Verwahrung verbleiben. Die Aufbewahrung dieser Proben sollte getrennt von anderen Materialien und Schlachtprodukten vorerst bei +4 o C erfolgen und die Proben sollten, sofern die Laboruntersuchung länger als 36 Stunden dauert, bei Minus 20 o C tiefgefroren werden. Bei Aufhebung des Verdachts erlischt die amtliche Verwahrung. Im Falle der Bestätigung des BSE-Verdachts könnten daher, sofern diese Möglichkeit besteht, zusätzliche Proben für die nationale BSE-Probenbank genommen werden. Sollte der Kopf des Tieres bis zum Abschluß der Untersuchungen noch identifizierbar sein, kann dieser an das FLI eingesandt werden. Besteht diese Möglichkeit nicht, sollten vor dessen Entsorgung nachfolgend ausgeführte Proben entnommen werden. Ein Teil dieser Proben sollte separat bei 20 C tiefgefroren, ein Teil sollte nach Rücksprache mit Mitarbeitern des FLI in neutral gepuffertes 4%iges Formalin eingelegt werden. BSE-positiv getestetes Schlachttier bzw. ein gefallenes (TKBA-)Tier: das gesamte Gehirn (soweit noch verfügbar evtl. auch autolytisches Gewebe) Ohrmarke mit anhängender Gewebeprobe je10 g Skelettmuskulatur von M. longissimus dorsi, M. semitendinosus, M. biceps brachii) Tiere mit reaktiven Ergebnis eines BSE-Schnelltestes aus der Kohorte eines nachgewiesenen BSE-Falles Hirnstamm (verbliebenes Material nach Schnelltest; entnommen mit der Löffel- Methode) 10 ml Serum Ohrmarke mit anhängender Gewebeprobe FLI 112
114 Probennahme bei einem klinischen Verdacht auf BSE Im Falle des klinischen Verdachtes einer TSE kann dieser nach den derzeitigen Vorgaben des OIE nicht durch ein negatives Schnelltest-Ergebnis ausgeräumt werden. Sollte eine Überweisung des Tieres an das FLI bzw. eine Sektion vor Ort mit Beteiligung eines Mitarbeiters des FLI nicht möglich sein, sollte das Tier mit einer Barbiturat-Überdosis getötet werden. Nach Eintritt des Todes sollten, sofern die Gegebenheiten dies zulassen, die nachfolgend (Tab. 1) aufgeführten Proben entnommen werden. Sollte dies nicht möglich sein, kann auch der vollständige Kopf an das FLI eingesandt werden. Im Anschluss daran kann ein Schnelltest durchgeführt werden, wobei jedoch auch bei einem negativen Ergebnis alle vorhandenen ZNS-Proben an das FLI weitergeleitet werden müssen. Dies bezieht explizit auch das bereits zur Schnelltestung hergestellte Homogenat und ggfs. auch Gewebeblöcke und -schnitte für die Histologie mit ein. Die Proben sollten separat gekennzeichnet und verpackt werden. Tabelle 1: zu asservierendes Probenmaterial klinischen Verdacht auf BSE Gewebe +4 C -20 C Formalin (4 %) Nach der Sedation 400 ml EDTA- 100 ml Vollblut, Blut Vollkblut (Isolierung der Leukozy- Überstand (Serum) zentrifugieren und -- ten) einfrieren Milch ml -- Nach der Tötung Gehirn (paramedian zerteilt, ca. 1 cm neben der Medianen) Rückenmark -- kleinere Hälfte größere Hälfte -- vollständig nach Möglichkeit: Scheiben (5-10mm) aus dem Hals, Brust-, Lenden- und Sakralmark Auge -- vollständig vollständig Tonsille -- Hälfte max. 2 x 2 x 2 cm Darm (Ileum, Jejunum) -- je 10 cm mit anhängenden lymphati- max. 2 x 2 x 2 cm schen Gewebe Milz -- ca. 50 g max. 2 x 2 x 2 cm Skelettmuskulatur - M. longissimus dorsi, - M semitendinosus, - M. biceps brachii Zerebrospinalflüssigkeit (ohne Blutaspiration) erreichbare Nerven des peripheren Nervensystems (z. B. N. ischiadicus) -- je 10 g max. 2 x 2 x 2 cm -- nach Zentrifugation Überstand einfrieren -- Hälfte des Materials Hälfte des Materials -- FLI 113
115 Arbeitsschutzmaßnahmen Arbeitsschutzmaßnahmen bei der Probenentnahme bei Schlachttieren Die Entnahme von Probenmaterial bei klinisch unverdächtigen Schlachttieren kann im Rahmen der Schlachtung unter Einsatz von persönlicher Schutzausrüstung, wie flüssigkeitsdichte und feuchtigkeitsabweisende Handschuhe und Gesichtsschutz (Spritzschutz: Visier oder alternativ Schutzbrille sowie Mund- und Nasenschutz) erfolgen. Alle Instrumente, die für die Entnahme der Hirnstammproben bestimmt sind, dürfen ausschließlich zu diesem Zweck verwendet werden. Dieses Besteck ist nach jeder einzelnen Probeentnahme mechanisch (durch Abspülen oder Abwischen) zu reinigen und nach Abschluss der Arbeiten durch mindestens einstündiges Einlegen in 1 N NaOH oder Natriumhypochloritlösung mit mindestens 2 % freiem Chlor 2 zu dekontaminieren. Auf das Tragen von Augenschutz bei Tätigkeiten mit diesen Lösungen wird hingewiesen. Ein Abflammen des Besteckes reicht nicht aus und hat zu unterbleiben Arbeitsschutzmaßnahmen bei der Probenentnahme bei TKBA-Tieren und von klinischen BSE-Verdachtstieren Die Probenentnahme kann in den zur Sektion bzw. zur Zerlegung solcher Tiere zur Verfügung stehenden Räumen an der TBA, im Untersuchungsamt oder am Schlachthof durchgeführt werden. Bei der Probenentnahme sind folgende Sicherheitsmaßnahmen einzuhalten: a) Es ist persönliche Schutzausrüstung bestehend aus Geeigneter Schutzkleidung (langer geschlossener Kittel, Gummischürze), Flüssigkeitsdichten und feuchtigkeitsabweisenden Schutzhandschuhen und Gesichtschutz (Visier oder alternativ Schutzbrille und Mund- und Nasenschutz) zur Verfügung zu stellen. b) Die Schutzkleidung ist nur für diese Arbeiten zu verwenden. Die Schutzausrüstung ist bei positivem Befund einer chemischen (NaOH oder Natriumhypochloritlösung nach Nr ) oder thermischen (ABAS- Beschlüsse 602 und 603) Behandlung zur Inaktivierung der TSE-Erreger zu unterziehen. c) Bei der Entnahme der Proben müssen die Instrumente nach jeder einzelnen Probe einem Dekontaminationsschritt mit NaOH oder Natriumhypochloritlösung nach ABAS 602 und 603 unterzogen werden. d) Nach der Probennahme bzw. Sektion sind die Räume (Oberflächen, Boden) und Gegenstände mit NaOH oder Natriumhypochloritlösung nach ABAS 602 und 603 zu dekontaminieren. Die Einwirkzeit soll mindestens 60 Minuten betragen, bevor mit Wasser nachgespült wird (Wasserstrahl, kein Hochdruck). e) Das Aufsägen der Schädel ist auf ein Mindestmaß zu beschränken. Sollte es im Einzelfall dennoch notwendig sein, müssen Maßnahmen zum Schutz vor Spritzern getroffen werden, wie z. B. das Tragen eines Gesichtsschutzes. FLI 114
116 f) Flüssige Abfälle sind so weit wie möglich zu vermeiden. Ansonsten sind sie einer chemischen oder thermischen (ABAS-Beschluss 602 und 603) Behandlung zu unterziehen Beförderung von Probenmaterial (Inland) Für die gefahrgutrechtliche Klassifizierung von Probenmaterial ist prinzipiell der Absender verantwortlich. Es werden drei Kategorien von TSE-Proben unterschieden: Routineproben zur BSE-Schnelltestung (sog. A-Proben) Für Spezifisches Risikomaterial den sog. SRM-Proben aus dem Gehirn von routinemäßig geschlachteten oder verendeten Rindern ohne gezielten TSE Verdacht wird - wie auch für das übrige Risikomaterial- ein Transport nach Maßgabe der Guidelines for the Safe Transport of Infectious Substances ans Diagnostics Specimen der WHO für den Local Surface Transport zwischen Entnahmeinstitution und Untersuchungslabor empfohlen (ABAS 602). Sie sind nicht als ansteckungsgefährliche Stoffe der Klasse 6.2 nach der ADR zu klassifizieren und unterliegen daher nicht den Anforderungen des Gefahrgutrechts für den Transport. Der Transport solcher Proben kann mit Kurier-Fahrzeugen der Überwachungs- bzw. Untersuchungsämter oder der Schlachtbetriebe nach Maßgabe der probenentnehmenden Veterinärbehörden oder anderen amtlich beauftragten Institutionen erfolgen. Hierbei sollten die Proben in verschließbaren Plaste-Röhrchen in Reagenzglasgestellen und diese in verschließbaren, beschrifteten Plaste-Boxen transportiert werden, die in den Transportfahrzeugen stoßfest zu sichern sind TSE-Verdachtsproben (sog. B-Proben) Gehirnproben, die im BSE-Schnelltest kein eindeutig negatives Ergebnis (= reaktives Ergebnis) ergeben haben, sowie Gehirnproben mutmaßlich an TSE klinischerkrankter Wiederkäuer gelten als TSE-Verdachtsproben. Solche Proben gelten als Gefahrgut und werden ab dem nach der anzuwendenden neuen ADR 2005 als ansteckungsgefährliche Stoffe der Gefahrenklasse 6.2 in die Kategorie B, UN 3373 Diagnostische Proben eingeordnet. Dieses Gefahrgut unterliegt in der Gefahrgut-VO jedoch keinen weiteren Reglementierungen. Es können unter Einhaltung der Verpackungsvorschrift P 650 wesentliche Erleichterungen beim Transport über öffentliche Straßen in Anspruch genommen werden, d. h. eine ordentliche Verpackung und Beschriftung mit den entsprechenden UN-Zetteln genügt, es sind keine Gefahrgutpapiere notwendig. (bestätigt in einer Stellungnahme des Robert-Koch-Institutes als Sicherheitsbehörde des Gefahrgut-Verkehrs-Beirates vom ). FLI 115
117 Auszüge aus der Verpackungsvorschrift P 650 : Die Proben müssen in Verpackungen von guter Qualität verpackt werden, die stark genug sind, um den normalerweise während der Beförderung einschließlich Umladen zwischen Fahrzeugen und/oder Warenlagern sowie Entnehmen von einer Palette oder aus einer Umverpackung zur weiteren manuellen oder mechanischen Behandlung auftretende Stöße und Belastungen standzuhalten. Die Verpackungen müssen so gebaut und verschlossen werden, dass ein Austreten des Inhalts aus der versandfertigen Verpackung, was unter den normalen Bedingungen des Transports, durch Erschütterungen oder durch Temperatur-, Feuchtigkeits- oder Druckänderungen verursacht werden kann, verhindert wird. Die Gefäße als erste Verpackungen müssen in die zweite Verpackung so eingesetzt werden, dass sie unter den normalen Beförderungsbedingungen nicht zerbrechen oder durchstoßen werden können und dass ihr Inhalt nicht in die zweite Verpackung austreten kann. Zweite Verpackungen müssen durch geeignete Polstermittel in Außenverpackungen gesichert werden. Die Schutzeigenschaften der Polstermittel oder der Außenverpackungen dürfen durch austretenden Inhalt nicht wesentlich beeinträchtigt werden. Die Verpackung muss aus 3 Bestandteilen bestehen; Primärgefäß, Sekundärgefäß und Außenverpackung. Die ersten Gefäße müssen wasserdicht sein. Jedes Versandstück muss klar und deutlich mit der Aufschrift UN 3373 Diagnostische Proben gekennzeichnet sein. Wenn mehrere zerbrechliche Gefäße in eine einzelne zweite Verpackung eingesetzt werden, müssen sie entweder einzeln eingewickelt oder so voneinander getrennt werden, dass eine gegenseitige Berührung verhindert wird. Eine Zertifizierung der Verpackung ist nicht erforderlich Definierte TSE-Proben (positives TSE-Material) Definiert TSE-haltige SRM-Proben (z. B. bestätigte BSE-Gehirnproben zur Durchführung von Ringversuchen, Versand positiver Kontrollproben, durch das FLI-bestätigte BSE-Verdachtsproben etc.) sind ansteckungsgefährliche Stoffe der Gefahrenklasse 6.2 und fallen ebenfalls seit dem in die Kategorie B der ADR 2005 und werden unter UN 3373 Diagnostische Proben klassifiziert. Denn unter Berücksichtigung von den in den letzten Jahren bekannt gewordenen wissenschaftlichen Erkenntnissen zu Infektionswegen und risiken, insbesondere einer BSE-Übertragung auf den Menschen, besteht beim Transport der TSE-Proben nach der Verpackungsvorschrift P 650 keine Exposition für Mensch oder Tier, um bei Austritt aus der Schutzverpackung eine lebensbedrohliche oder tödliche Krankheit zu verursachen. Gleichzeitig ist in der Liste der ansteckungsgefährlichen Stoffe unter Kategorie A kein TSE-Material aufgeführt. Diese Klassifizierung wurde ebenfalls in einer Stellungnahme des Robert-Koch- Institutes als Sicherheitsbehörde des Gefahrgut-Verkehrs-Beirates vom bestätigt. FLI 116
118 15.3. Untersuchungsgang Zur Bestätigung von BSE-Fällen können ausschließlich die vom Internationalen Tierseuchenamt anerkannten Verfahren herangezogen werden Histopathologie Immunhistochemie SAF-Immunoblot ggf. der Nachweis der Infektiosität im Tierversuch Bestätigungsuntersuchungen müssen durch das nationale Referenzlabor am FLI durchgeführt werden. FLI 117
119 Anmeldung einer BSE-/Scrapie-Verdachtsprobe zur Untersuchung an das FLI Insel Riems Bitte zunächst telefonische Anmeldung unter der Nummer: /7-161 (ggfs. Pforte /7-0 (rund um die Uhr besetzt). Anschließend per FAX an /7-192 Einsendung der Probe an (bitte für jede Einzeltierprobe separates Anmeldeformular) Nationales Referenzlabor für BSE/Scrapie Institut für neue und neuartige Tierseuchenerreger am FLI Insel Riems Südufer Greifswald - Insel Riems Anschrift des Einsenders: Vorbericht zur Probe Ohrmarkennr. Ansprechpartner Name: Tel.: FAX: Geburtsdatum Rind Schaf Ziege sonst. Schlachthof TBA Klin. Verdacht Kohorte Ergebnisse der Voruntersuchung (Initial/Wdh.) TeSeE Werte: Cut-off: Prionics LIA Werte: Cut-off: Enfer Werte: Cut-off: Werte: Cut-off: Prionics WB Formalinfixierte Obexprobe anbei ja nein Versand der Probe am um Uhr Fahrer TNT sonst. voraussichtliche Ankunft am um Uhr Wir bitten um Übersendung des vollständigen Vorberichts (Vorergebnisse wie Elisa- Werte, Röntgenfilm etc.; Herkunftsnachweis des Tieres incl. Ohrmarkennr. etc.). In Formalin eingelegte Proben bitte getrennt versenden und dieses Paket mit dem Hinweis bei Raumtemperatur lagern versehen, falls die Sendung am Wochenende oder nach Uhr am FLI eintrifft. Das andere Paket mit der gekühlten Probe bitte mit dem Hinweis gekühlt lagern kennzeichnen. Wichtiger Hinweis: aus Gründen des Arbeitsablaufes können am selben Arbeitstag nur Proben bearbeitet werden, die vor 8 Uhr am FLI eingetroffen sind! Bei späterer Ankunft kann die Untersuchung der Proben erst am folgenden Tag beginnen! FLI 118
120 16. Bovine Virus Diarrhoe (BVD) Charakterisierung der Infektion Erreger Der Erreger bildet gemeinsam mit dem Virus der Klassischen Schweinepest, und dem Border Disease Virus das Genus Pestivirus in der Familie der Flaviviridae. Es werden 2 Genotypen als selbständige Spezies unterschieden, bei denen jeweils zytopathogene (cp) und nicht-zytopathogene (ncp) Biotypen vorkommen. Weitere Subtypisierungen auf genomischer Grundlage sind möglich. Es handelt sich um ein 40 bis 60 nm großes, behülltes Virus, das Genom besteht aus einer einsträngigen RNA positiver Polarität von einer Länge von ca. 12 kb Klinische Symptomatik Akute Infektionen verlaufen i.d.r. symptomlos, vor allem bei Kälbern können Fieber, Inappetenz, seröser Nasenausfluss, milde Atemwegserkrankung oder Durchfall auftreten, bei Kühen kann es zum Rückgang der Milchleistung kommen. Selten (in Amerika häufiger beschrieben) tritt ein hämorrhagisches Syndrom mit Blutungen an den Schleimhäuten und Parenchymen sowie hoher Mortalität auf. Eine Infektion trächtiger Tiere resultiert in Abhängigkeit von Zeitpunkt der Infektion in Fruchtbarkeitsstörungen (Umrindern infolge Fruchtretention), Aborten, Totgeburten, Missbildungen und Geburt von lebensschwachen Kälbern. Bei Infektionen zwischen dem 40. und dem 120. Graviditätstag werden persistent virämische Kälber geboren, die entweder kümmern (ca. 50 %), aber sich auch normal entwickeln können. Die late onset Form der BVD stellt die tödlich verlaufende Mucosal Disease dar, die entsteht, wenn persistent virämische Tiere BVD-Viren beider Biotypen (cp und ncp- BVDV) tragen. Chronische Abmagerung, Fieber, Anorexie, blutige, therapieresistente Durchfälle, Speichelfluss, Erosionen im Bereich des harten Gaumens, am Flotzmaul und Naseneingang, weniger häufig im Zwischenklauenspalt sowie an Kronsaum und Euter treten auf Pathologie Zur pathologisch-anatomischen Untersuchung gelangen in erster Linie an Mucosal Disease verendete Tiere. Neben der bereits klinisch sichtbaren erosiven und ulzerativen Stomatitis (besonders harter Gaumen, Gingiva, Papillen der Backenschleimhaut), finden sich längliche Erosionen im gesamten Oesophagus, an Pansenpfeilern und an den Rändern der Blättermagenschleimhaut, in Labmagen und im gesamten Darm. Auch bei ausgeprägten pathomorphologischen Befunden ist mitunter kein Virus nachweisbar. Bestimmte hochvirulente ncp-bvdv-stämme führen zu hochgradiger Thrombozytopenie mit nachfolgendem hämorrhagischem Syndrom. Intrauterine Infektionen bis zum 100. Graviditätstag führen zu Tod des Foetus, Aborten oder mumifizierten Früchten. Zu den nach Infektionen nach dem 100. Graviditätstag auftretenden Missbildungen zählen Mikroenzephalie, zerebellare Hypoplasia, FLI 119
121 Hydranenzephalie, Hydrozephalus, Mikrophthalmie ( okulozerebellares Syndrom ), Thymusaplasie, Hypotrichosis congenita, Brachygnathie, Wachstumsverzögerung und Hypoplasie der Lungen Differentialdiagnostik Bösartiges Katarrhalfieber, Rinderpest, Maul und Klauenseuche und andere vesikuläre Erkrankungen, Stomatitis papulosa, Verätzungen, Intoxikationen Diagnostische Indikation Antigen-, Genom- und Antikörperuntersuchungen nach BVD-Verordnung Klinischer und/oder pathologischer Verdacht auf Mucosal Disease bzw. Vorliegen eines hämorrhagischen Syndroms Zuständige Untersuchungseinrichtungen Veterinäruntersuchungseinrichtungen der Länder Nationales Referenzlabor für BVD/MD am Friedrich-Loeffler-Institut, Insel Riems (Tel.: ) Abklärungsuntersuchungen Rechtsgrundlagen Verordnung zum Schutz der Rinder vor einer Infektion mit dem Bovinen Virusdiarrhoe-Virus BVDV-Verordnung Manual of Diagnostic Tests and Vaccines for Terrestric Animals, Chapter , Bovine Viral Diarrhea, 5 th edition, Untersuchungsmaterialien und Probenschemata Der diagnostische Nachweis von persistent BVDV-infizierten Rindern kann durch die Aufnahme von BVDV-Antikörperhaltigem Kolostrum beeinträchtigt sein (Diagnostische Lücke). Diese Einschränkungen hängen von den aufgenommen Antikörpermengen, der angewendeten Diagnostik sowie vom Zeitpunkt der Probennahme ab. Im Folgenden werden zulässige diagnostische Verfahren zur Zertifizierung der BVD- Unverdächtigkeit eines Rindes bzw. Rinderbestandes und zur Bestätigung der Antikörperfreiheit unter Berücksichtigung der Diagnostischen Lücke aufgeführt. Detaillierte Protokolle sind im Abschnitt Untersuchungsgang beschrieben. FLI 120
122 Anerkannte Untersuchungen zum BVDV-Nachweis Erregernachweis bei Tieren mit positivem oder unbekanntem BVDV- Antikörperbefund Nach 17c Tierseuchengesetz zugelassene E RNS -Antigen-Fänger-ELISA- Tests Probenmaterial: Probenmenge: Probenaufbereitung: Probennahme: Serum, Plasma, EDTA-Vollblut, gereinigte und gewaschene Blutleukozyten, Organproben und Hautbiobtate eines Tieres Nach Angaben des Herstellers Einzelproben nach Angaben des Herstellers Vor Aufnahme von Kolostrum sowie im Alter von mehr als 60 Tagen für Blutproben, keine Einschränkung für Hautbioptate und andere Organproben Nach 17c Tierseuchengesetz zugelassene NS3-Antigen-Fänger-ELISA- Tests Probenmaterial: Probenmenge: Probenaufbereitung: Probennahme: Blutleukozyten eines Tieres, Hautbioptate, soweit vom Hersteller vorgesehen Nach Angaben des Herstellers Einzelproben nach Angaben des Herstellers Vor Aufnahme von Kolostrum oder im Alter von mehr als 90 Tagen; bei optimierter Leukozytenpräparation aus frischen, nicht hämolytischen EDTA-Blutproben mit intensivem Waschen von aufgereinigten Leukozytenpellets ist eine Erweiterung Probenzeitraumes auf Tag 0 bis 3 post partum zulässig. Keine Einschränkung für Hautbioptate, allerdings ist bei Tieren < 90 Tagen eine negatives Ergebnis durch eine Antikörperuntersuchung am Ohrgewebelysat und ggf. weitere Tests abzuklären Durchflusszytometrische Analyse nach NS23-Immunfluoreszenz-färbung mit nach 17c Tierseuchengesetz zugelassenen NS3-spezifischen Antikörpern Probenmaterial: Probenmenge: Probenaufbereitung: Probennahme: Aufgereinigte Leukozyten eines Tieres Leukozyten aus mindestens 50 µl Vollblut eines Tieres Hämolyse, Waschen des Leukozytenpellets Vor Aufnahme von Kolostrum oder im Alter von mehr als 90 Tagen; bei optimierter Leukozytenpräparation aus frischen, nicht hämolytischen EDTA-Blutproben mit intensivem Waschen von aufgereinigten Leukozytenpellets ist eine Erweiterung des Probenzeitraumes auf Tag 0 bis 3 post partum zulässig. FLI 121
123 Virusisolierung auf permissiven bovinen Zellkulturen, z. B. KOP-R-Zellen oder primäre bovine Zellkulturen Probenmaterial: Probenmenge: Probenaufbereitung: Probennahme: Aufgereinigte und gewaschene Leukozyten (vorzugsweise) oder Serum eines Tieres, Organproben (Milz, Lymphknoten, Thymus) Mehr als 1 x 10 6 Leukozyten eines Tieres im Doppelansatz, aufgearbeitete Organproben Hämolyse und effizientes Waschen des Leukozytenpellets; Organanreibungen. Vor Aufnahme von Kolostrum oder im Alter von mehr als 40 Tagen; bei optimierter Leukozytenpräparation aus frischen, nicht hämolytischen EDTA-Blutproben mit intensivem Waschen von aufgereinigten Leukozytenpellets ist eine Erweiterung des Probenzeitraumes auf Tag 0 bis 7 post partum zulässig. Keine Einschränkung für Organproben RT-PCR mit nach 17c Tierseuchengesetz zugelassenen Testkits Probenmaterial: Probenmenge: Probenaufbereitung: Probennahme: Serum, Plasma, Vollblut, gereinigte und gewaschene Leukozyten, Milch, Organ- oder Gewebeproben. Poolproben von bis zu 50 Tieren bzw. nach Herstellerangaben Nach den Angaben der Hersteller Nach den Angaben der Hersteller Für Einzelblutproben keine Einschränkung; für gepoolte Blutproben Tag 0 bis 7 post partum oder ab einem Alter von mehr als 40 Tagen, keine Einschränkung für Gewebeproben als Einzel- oder Poolproben Antigennachweis mittels Immunfluoreszenz mit nach 17c Tierseuchengesetz zugelassenen Antikörpern bzw. Konjugaten Probenmaterial: Probenmenge: Probenaufarbeitung: Probennahme: Organ- und Gewebeproben (Hautstanzen), ca. 6 bis 8 mm große Gewebestücke Kryoschnitte, einschließlich negativer Gewebe- und Antikörperkontrollen postmortal oder am lebenden Tier (Hautstanzen), keine zeitliche Einschränkung Erregernachweis bei Tieren mit negativem BVDV-Antikörperbefund Alle unter Punkt genannten Methoden können bei nachweislich BVDV- Antikörper-negativen Tieren ohne Altersgrenze angewendet werden. FLI 122
124 Bestätigungsuntersuchung Bei der Bestätigung von vermutlich persistent infizierten Tieren durch eine zweite Untersuchung muss die unterschiedliche Sensitivität der beschriebenen Methoden berücksichtigt werden. Es sind folgende Untersuchungsabstände einzuhalten: Reverse Transcriptase-Polymerase-Kettenreaktion (RT-PCR): mindestens 42 Tage Virusisolierung: mindestens 28 Tage Antigen-Fänger-Enzyme-Linked-Immunosorbant- Assays (ELISA): mindestens 21 Tage Durchflusszytometrie: mindestens 21 Tage Ein negativer Befund kann bereits vor Ablauf dieser Fristen hoben werden Anerkannte Untersuchungen auf BVDV-Antikörper Alle BVDV-Antikörper-Tests müssen die BVDV-Referenzseren Ref1_BVDV1 und Ref3_BVDV2 - bereitgestellt vom Friedrich-Loeffler-Institut - sicher erkennen lassen Testsysteme für die Bestätigung der Antikörperfreiheit nach Nummer 1.2 Neutralisationstest gegen BVDV-Typ 1 und BVDV-Typ 2 (BVDV-1/2-NT) mit 100 KID 50 Testvirus. Zugelassene BVDV-NS3-Antikörper-blocking-Tests. Zugelassene indirekte BVDV-Antikörper-ELISAs Testsysteme für die diagnostische Stichprobe (z. B. Jungtierfenster ) Ab einem Alter der Tiere von sechs Monaten: Zugelassene indirekte BVDV-Antikörper-ELISAs Ab einem Alter der Tiere von zwölf Monaten Neutralisationstest gegen BVDV Typ 1 und BVDV Typ 2 (BVDV-1/2-NT) mit 100 KID 50 Testvirus. Zugelassene BVDV-NS3-Antikörper-blocking-Tests Zugelassene indirekte BVDV-Antikörper-ELISAs Die unterschiedliche, zeitliche Einschränkung erfolgt aufgrund der unterschiedlich hohen Sensitivität der Testsysteme für kolostrale Antikörper. Ein negativer Befund dieser Teste ist auch im jüngeren Alter für die Stichprobenbeurteilung geeignet Testsysteme für die Untersuchung von Tankmilchproben Alle für die Untersuchung von Tankmilch zugelassenen Testsysteme. Es ist ausschließlich eine Differenzierung in Milch-positive und Milch-negative Bestände vorzunehmen. FLI 123
125 16.3. Untersuchungsgang Erregernachweis Virusisolierung Leukozyten Hämolyse und Waschen der Leukozyten, z. B. 1,5 ml EDTA-Blut + 4,5 ml Lysispuffer (8,29 g/l NH4CL, 1,0 g/l KHCO3, 1 mm EDTA), 10 min Eis, Zentrifugation bei 1000 rpm, zweimal Waschen mit Zellkulturmedium + Antibiotika (z. B. Gentamycin,50 ng/ml; Baytril, 20 µg/ml; oder Penicillin/Streptomycin), Resupendierung, in der Aufarbeitung sollten >106 Leukozyten sein. Alternativ: 5 bis 10 ml EDTA-Blut mit 1 ml Dextransulfatlösung versetzen und nach vorsichtigem Schwenken etwa 1 bis 2 Stunden bei Raumtemperatur (alternativ 30 Minuten bei 37 C) stehen lassen. In dieser Zeit setzen sich die Erythrozyten ab. Den leukozytenhaltigen milchig-trüben Überstand absaugen und für 10 Minuten bei 2000g zentrifugieren Das Sediment wird nach zweimaligem Waschen in je 5 ml Ca-Mgfreier phosphatgepufferter Salzlösung (PBS-minus) in 2 ml Kulturmedium aufgenommen. Die konzentrierte Leukozytensuspension dient als Inokulum für die weiteren Arbeitsschritte. Für den späteren Gebrauch kann das Material bei 70 C gelagert werden. Organmaterial Ca. 1 g Organmaterial wird mit der Schere fein zerkleinert und in 10 Vol serumfreiem Zellkulturmedium bzw. isotonischem Puffer mit Antibiotika in einem Mörser, bei Notwendigkeit mit sterilem Seesand homogenisiert. Andere Methoden der Homogenisierung (Homogenisatoren, tissue lyser) sind möglich. Nach mindestens einstündiger (besser über Nacht) Aufbewahrung bei 4 bis 8 C wird die Organsuspension für 15 Minuten bei 3000 rpm zentrifugiert. Der Überstand dient als Inokulum für die weiteren Arbeitsschritte. Für den späteren Gebrauch kann das Material bei 70 C gelagert werden. Inokulation der Zellkulturen Wie o.a. aufbereitetes Untersuchungsmaterial wird im Doppelansatz in einem Volumen, das 1/10 des Zellkulturmediums entspricht (z. B. 0,1 ml für 24 well, 0,3 ml für 6 well, 0,5 ml für TC12,5 usw.) auf 1 bis 2 Tage gewachsene Zellkulturen, von denen das Anzuchtmedium vorher entfernt wurde, inokuliert. Nach einer Adsorptionszeit von 30 bis 60 min bei 37oC, wird das Inokulum entfernt (nicht bei frischem Leukozytenpellet) und nach ein- bis zweimaligem Waschen Erhaltungsmedium zugegeben. Positiv- und Negativkontrollen sind mitzuführen. Die Zellkulturen werden 3, besser 5 Tage bei 37 C inkubiert. Während dieser Zeit werden die Zellkulturen auf das Auftreten zytopathischer oder zelltoxischer Effekte mikroskopisch kontrolliert. Die Zellkulturplatten können anschließend einer Immunfärbung unterzogen werden, die Kulturflaschen werden nach Gefrier-Tau-Zyklus weiter passagiert bzw. auf 96 well Zellkulturplatten mit dem Ziel einer Immunfärbung weiterverimpft. Es werden in der Regel bis zu drei Passagen durchgeführt. FLI 124
126 Immunfärbung Fixation Das Kulturmedium wird abgesaugt und der Zellrasen einmal mit isotonischem Phosphatpuffer (z. B. PBS) gewaschen. Vor der Fixation für 2h in einem Trockenschrank bei 80 C ist der Zellrasen gründlich zu trocknen (z. B. Fön). Nach dem Abkühlen der Platten erfolgt die Immunfärbung. Wenn die zu untersuchenden Platten nicht sofort weiter bearbeitet werden können, besteht die Möglichkeit sie kurzfristig (<1 Woche) bei 4 C und längerfristig (>1 Woche) bei 20 C zu lagern. Alternative laborübliche Fixationsmethoden (z. B. 80 % Azeton, 4 % Paraformaldehyd) können angewendet werden, wenn ihre Eignung gezeigt wurde. Immunfärbung Die Immunfärbung kann direkt mit einem geprüften BVDV- bzw. pan-pesti-konjugat durchgeführt werden. Alternativ besteht die Möglichkeit, indirekt mit einem monoklonalen Antikörper, der an das Testvirus bindet und einem FITC-, bzw. PODmarkierten Anti-Maus-Antikörper zu färben. Durchführung der Fluoreszenzfärbung Direkte Methode: Zugabe von 50 bis 100 µl eines Fluorochrom- (z. B. FITC-) markierten Antikörpers in Gebrauchsverdünnung in IP bzw. PBS -, (bei Bedarf 0,001 % Evans blue), Inkubation bei 37 C für 1 h, Waschen der Zellen 2x mit PBS - oder IP ph 7,2 und 1 x 10 mit PBS - oder IP ph7,2, Puffer absaugen, 1 x Waschen mit Aquadest, Eindecken der Zellen mit Fluoreszenzerhaltungspuffer (DABCO- Puffer) Indirekte Methode: Zugabe von 50 bis 100 µl eines antigenspezifischen monoklonalen Antikörpers (z. B. C16, Bommeli; Wb103/105, c.c.pro) in Gebrauchsverdünnung in PBS - oder IP ph7,2, Inkubation bei Raumtemperatur für 1 Stunde, Absaugen des Antikörpers, einmal Waschen in IP bzw. PBS Zugabe von 50 bis 100 µl des 2. Antikörpers FITC-Anti-Maus-IgG (z. B. Firma DAKO Dänemark Best.-Nr. F0479) in Gebrauchsverdünnung (bei Zugabe von Evans blue 0,001 % Endkonzentration) Inkubation bei Raumtemperatur für 1 Stunde, Absaugen des Konjugats, Waschen der Zellen 2x mit PBS - oder IP ph 7,2 und 1x 10 min Absaugen des Puffers, 1x Waschen mit Aquadest Eindecken der Zellen mit Fluoreszenzerhaltungspuffer (DABCO-Puffer) Durchführung der Peroxydasefärbung (indirekt) Zugabe des 50 bis 100 µl eines antigenspezifischen monoklonalen Antikörpers (z. B. C16, Wb103/105) in Gebrauchsverdünnung in Verdünnungspuffer (PBS bzw. IP, 0,005 % Tween 20, 2 % Pferdeserum) FLI 125
127 Inkubation bei Raumtemperatur für 1 Stunde, Absaugen des Antikörpers, einmal Waschen in Waschpuffer (PBS bzw. IP, 0,005 % Tween 20) Zugabe des 2. Antikörpers POD-Anti-Maus-IgG (z. B. Sigma, A-9044) in Gebrauchsverdünnung Inkubation bei Raumtemperatur für 1 Stunde, Absaugen des Konjugats, Waschen der Zellen in Waschpuffer (zweimal kurz, einmal 10 min) Absaugen des Puffers, Substratreaktion: Dazu wird 1 Tablette AEC (3-amino-9-Ethylcarbazol) in 2,5 ml Dimethylformamid (DMF) gelöst (Stammlösung). Zur Anwendung werden für eine Platte 0,25 ml Stammlösung in 5 ml 0,05 M Natriumazetatpuffer, ph 5,0 verdünnt, mit 15 µl 3 % H 2 O 2 versetzt und je 50 µl /well pipettiert. Nach 15 min wird die Färbelösung abgesaugt und mit PBS-Tween 20 aufgefüllt Die AEC-Stammlösung wird portioniert bei 20 C gelagert Achtung, AEC ist kanzerogen! (Laborhandschuhe tragen) Geräte und Reagenzien Zellkulturflaschen (z. B. TC12,5, TC25) Pipetten Zellkulturplatten (6-, 24, 48, 96-well) Sterile Plastikspitzen Empfängliche Zelllinien, vorzugsweise KOP-R, MDBK, Klu, (Herkunft: Zellbank des FLI) oder primäre bovine Zellkulturen Spezifische monoklonale Antikörper gegen BVDV bzw. Pestiviren (z. B. c.c.pro) FITC-markiertes anti-bvd-konjugat (z. B. BioX, c.c, pro) Peroxidasemarkierte (POD) bzw. Fluoresceinisothiocyanatmarkierte (FITC) Anti-Maus-Antikörper (z. B. Sigma, DAKO) Waschpuffer, Substrat/Chromogenlösung (Rezeptur siehe Anhang) Standardmäßige Laborausstattung für ein Viruslabor (Sterilwerkbank, Umkehrmikroskop, CO 2 -Schrank (37 C), Zentrifuge, Inkubator (80 C), Kühlschrank, Kühltruhe (-20 C, -70 C). Puffer PBS - : 8 g NaCl 0,2 g KCl 1,15 g Na 2 HPO 4 x 2H 2 O 0,2 g KH 2 PO 4 ad 1000 ml Aqua dest IP ph 7,2 - : 8,28 g NaCl 1,186 g Na 2 HPO 4 x 2H 2 O 0,2 g KH 2 PO 4 ad 1000 ml Aqua dest FLI 126
128 Fluoreszenzerhaltungspuffer (DABCO): 2,5 g 1,4-Diazobicyclo[2,2,2]-octan (DABCO) in 90 ml Glycerol lösen (37 C, Wasserbad) + 10 ml PBS ph mit HCl konz. auf 8,6 einstellen (wenige Tropfen) für rote Kernfärbung: zu 100 ml Fluoreszenzpuffer 100 µl Propidiumiodid- Stammlösung (2 mg/ml) zugeben Antigennachweis mittels ELISA Für den Antigennachweis werden amtlich zugelassene ELISA-Testkits nach Herstellerangaben eingesetzt. Folgende Testkits sind derzeit in Deutschland zugelassen: Herdchek BVDV AG/Leukozyten (IDEXX) Herdchek BVDV Ag/Serum Plus (IDEXX) BVD/MD p80 Ag (Inst. Pourquier) BVDV-antigen mix (Inst. Pourquier) PrioBVDV Ag PI plus PrioCHECK Ag PI focus Antigennachweis mittels Indirekter Immunfluoreszenz Zielstellung: Detektion persistent virämischer Tiere Hautstanzen (vorzugsweise mind. 6 mm Ø) werden in flüssigem Stickstoff oder in auf ca. -70 C herabgekühltem n-heptan schockgefrostet und bei -70 C gelagert. Etwa 5 µm dicke Kryostatschnitte werden luftgetrocknet (ca. 30 min). Die Fixierung erfolgt in auf ca. -20 C vorgekühltem Azeton für 15 bis 20 min bei ca. -20 C. Fixierte Kryostatschnitte können mehrere Monate bei ca. -20 C gelagert werden. In einem Prüfansatz werden bearbeitet: 1. Schnitte von verdächtigen Organproben, 2. Schnitte von Organproben eines BVDV-freien Rindes ( = negative Kontrollen), 3. Schnitte eines BVDV-positiven Rindes (= positive Kontrollen). In jedem Prüfansatz kommen zur Anwendung: 1. Anti-Pestivirus-mAk (z. B. WB 103/105, c.c. pro) 2. Irrelevanter mak Protokoll Alle folgenden Schritte erfolgen bei Raumtemperatur. Waschen der fixierten Kryostatschnitte in PBS für 5 min Blockierung mit 5 % bovinem Serumalbumin (BSA) in PBS für 30 min Kurz waschen in PBS Inkubation mit mak in vom Hersteller empfohlener Arbeitsverdünnung in PBS für 60 min Waschen in PBS: 3x 5 min Inkubation mit FITC-markiertem Sekundärantikörper (Anti-Maus-Ig-FITC- Konjugat) in empfohlener Arbeitsverdünnung für 60 min: FLI 127
129 Verdünnung in PBS und Zusatz des Kontrastfarbstoffes Evans blue (3 Teile Konjugat-Arbeitsverdünnung + 1 Teil 0,005 % Evans blue in PBS). Waschen in PBS: 3x 5 min Waschen in Aqua dest. für mindestens 5 min Lufttrocknung Eindecken der noch leicht feuchten Schnitte mit PBS-Glycerol-Gemisch (1 Teil PBS + 9 Teile Glycerol) oder DABCO-Fluoreszenzerhaltungs-Puffer Mikroskopische Beurteilung der Schnitte Für die mikroskopische Beurteilung der Schnitte ist ein aufrechtes Mikroskop mit Auflichtfluoreszenz (Quecksilberdampf-Kurzbogenlampe HBO 100 W) erforderlich. Die Beurteilung der Schnitte erfolgt im Vergleich mit den negativen und positiven Kontrollschnitten. Pestivirusantigen-positive Zellen zeigen zytoplasmatische, weitgehend homogene, leuchtende hellgrüne Fluoreszenz. Die Zellkerne bleiben dunkel ausgespart. Virusantigen findet sich in Keratinozyten der Epidermis, im Haarfollikelepithel, in Haarmatrixzellen der Haarzwiebel sowie in der dermalen Haarpapille Antigennachweis mittels Durchflusszytometrie Der Virusnachweis mittels Durchflusszytometrie wird nur noch in wenigen Laboren angewandt. Hier sind laborintern validierte Protokolle zu verwenden Virusgenomnachweis mittels RT-PCR Für den Nachweis von BVD-Virusgenom werden zugelassene Testkits bzw. an ihnen validierte PCR-Protokolle eingesetzt. Nachstehende PCR-Kits sind in Deutschland amtlich zugelassen: ADIAVET BVD REALTIME, (AES-Laboratoire) BVDV-LC LightCycler RT-PCR Kit, (AnDiaTec) BoVir-SL TaqMan RT-PCR-Kit (AnDiaTec) BVDV Q-PCR-HP (Inst. Pourquier) Virotype BVDV (LDL Leipzig) Protokolle für eine konventionelle pan-pesti PCR unter Verwendung der Standardprimer nach Vilcek, eine subtypenspezifische BVD-RT-PCR und eine vom AVID zur Anwendung empfohlenen real time RT-PCR sind im folgenden aufgeführt. Konventionelle pan pesti RT-PCR (Hoffmann, mod. nach Vilcek) RNA-Isolierung: Die RNA-Isolierung erfolgt mit Extraktionsverfahren, die für die Aufreinigung von viraler RNA aus den verschiedenen Ausgangsmaterialien zugelassen sind. zellfreie Proben: z.b QIAamp RNA viral Mini Kit (Qiagen), Trizol (Invitrogen) zellhaltige Proben: z. B. RNeasy Mini Kit (Qiagen), Trizol (Invitrogen) (1) Die gleichzeitige Aufreinigung von sicher negativen Proben zur Kontrolle des kreuzkontaminationsfreien Arbeitens während der RNA-Extraktion ist empfohlen. Für die Aufreinigung von bis zu 7 Feldproben sollte mindestens eine RNA- FLI 128
130 Isolierungs-Kontrolle (RIC) mitgeführt werden. Bei einer größeren Anzahl von Proben sollte die Anzahl der RIC entsprechend erhöht werden. (2) Die RNA-Extraktion erfolgt nach den Vorgaben der Hersteller und wird nur durch die Zugabe einer Internen Kontroll-RNA (IC) zu jeder Probe modifiziert. Diese IC kontrolliert den Erfolg der RNA-Extraktion und der RT-PCR. (3) Die Zugabe von Interner Kontroll-RNA (IC) zur Probe erfolgt nachdem der Lysispuffer die RNasen der Probe zerstört hat. Die Menge der eingesetzten IC-RNA richtet sich nach dem Elutionsvolumen und sollte davon 1/10 betragen. Zum Beispiel bei einem Elutionsvolumen von 50 µl werden 5 µl IC der lysierten Probe zugesetzt IC-RNA in RNA-Safe-Buffer (RSB): 2x 10 5 Kopien/µl 10 sec kräftig per Hand mixen Proben kurz zentrifugieren (4) Weitere Co-Extraktion von viraler und IC-RNA entsprechend den Protokollen der Hersteller Lagerung der RNA: kurzfristig auf Eis; mittelfristig bei 20 C; langfristig bei 70 C Durchführung der PCR: (1) Die Amplifizierung erfolgt auf Basis des Superscript III One-Step RT-PCR Kits (# ; Invitrogen) in 25 µl Gesamtvolumen. (2) Als Kontrollen werden neben der RNA-Isolierungskontrolle (RIC) eine No Template Kontrolle (NTC) und mindestens eine positive Kontrolle mitgeführt. (3) Nach Herstellung der Mastermixe werden je 20 µl vorgelegt und 5 µl Template zugefügt. FLI 129
131 Mastermix Panpesti-Nachweis 1 X N X RNase freies Wasser 4,0 µl 2x Reaction Mix 12,5 µl MgSO 4 (5 mm) 0,5 µl SS III RT/Platinum Taq-Mix 1,0 µl Primer-1: ML120 (20pmol/µl) 1,0 µl Primer-2: ML121 (20pmol/µl) 1,0 µl Total Volumen Mastermix: 20 µl Template: je 5 µl Feldprobe/n (N x) RIC NTC (SDW) T7-PK3alf (2 x 10 3 Kopien/µl) Cycler-Programm: RT 30 min 50 C Inaktiv./Aktiv. 2 min 94 C Denaturierung 30 sec 94 C Annealing 1 min 57 C 40 Zyklen Elongation 1 min 68 C Auswertung: Die eingesetzten Primer amplifizieren ein Produkt von ca. 300 bp in den allermeisten Pestiviren (Ausnahme: atypisches Pesitvirus Hobi) Für die NTC und die RIC sollte kein Amplifikat feststellbar sein. Für die PC (T7-PK3alf) sollte ein Produkt von ca. 300 bp feststellbar sein. Reagieren die positiven und negativen Kontrollen entsprechend den Erwartungen, ist eine Auswertung der Feldproben möglich. Hierbei werden alle Banden, die eine der PC ähnliche Größe aufweisen, als verdächtig angesehen. Eine abschließende Charakterisierung der positiven Feldproben ist über eine Sequenzierung von Abschnitten der 5`-NTR möglich. Primer-Sequenzen (Vilcek) Primer ML120 (=V324) 5`-ATG CCC WTA GTA GGA CTA GCA-3` Primer ML121 (=V326) 5`-TCA ACT CCA TGT GCC ATG TAC-3` FLI 130
132 Genotypspezifische RT-PCR (n. Strebelow) RNA-Isolierung Die RNA-Isolierung erfolgt üblicher Weise durch chromatographische Trennung an Silica-Oberflächen. Dafür sind in Abhängigkeit von der Probenart verschiedene kommerziell erhältliche Kits verwendbar. Denaturierungsmix Reagenzien Konzentration µl / Probe DMSO p.a. 99,5 % 0,5 Primer rev. 15 pmol 1,0 Probe 2,5 Zur Denaturierung wird der Reaktionsansatz im Thermocycler erst 5 min auf 95 C und dann für 2 min auf 42 C erhitzt. Danach erfolgt Abkühlung auf 4 C. Der Reaktionsansatz wird dann zentrifugiert (zur Entfernung evtl. vorhandener Tröpfchen vom Gefäßrand oder Deckel). Dann erfolgt die Zugabe des RT-Mix. RT-Mix Reagenzien Konzentration µl / Probe 5x RT-Puffer 1x 3,0 dntp-mix je 100 mm 0,4 Dest. Wasser Rnase frei 7,15 Rnasin 4 U 0,1 AMV-Revertase 3,5 U 0,35 Je 11 µl RT-Mix werden zur denaturierten Probe pipettiert. Der Ansatz wird geschüttelt und zentrifugiert und dann für 30 min bei 42 C inkubiert. Zur Inaktivierung der Revertase wird dann für 5 minn auf 98 C erhitzt. Dann wird der Reaktionsansatz auf 4 C abgekühlt und zentrifugiert. Danach erfolgt die Zugabe des PCR-Mix. PCR-Mix Reagenzien Konzentration µl / Probe Magnesiumchlorid 25 mm 2,1 10x Polymerasepuffer 1x 3,5 steriles dest. Wasser 28,15 Primer forw. 15 pmol 1,0 Taq-Polymerase 1,25 U 1,25 Je 35 µl PCR-Mix werden zur Probe (RT-Ansatz) pipettiert. Mit 35 µl Mineralöl wird überschichtet. Die Reaktion wird dann einem Thermocyclus aus Denaturierung, Annealing und Elongation unterzogen. FLI 131
133 Primer und Temperaturprofil für BVDV I UTR51 (rev. Primer): 5 -CAA CTC CAT GTG CCA TGT AC-3 BVD I (forw. Primer): 5 -GGT AGC AAC AGT GGT GAG TTC-3 Temperaturprofil: 3 min 92 C; 35 x (30 sec 92 C, 30 sec 55 C, 1 min 72 C); 7 min 72 C; 4 C bis Ende (258bp) Primer und Temperaturprofil für BVDV II UTR51 (rev. Primer): 5 -CAA CTC CAT GTG CCA TGT AC-3 BVD II (forw. Primer): 5 -AGC GGT AGC AGT GAG TTC ATT-3 Temperaturprofil: wie für BVDV (257bp) Auswertung und Validierung Die Auswertung der RT-PCR erfolgt durch Analyse der PCR-Produkte mittels Agarosegelelektrophorese. Die Spezifität positiver Reaktionen wird durch anschließende Direktsequenzierung der PCR-Fragmente überprüft. Real time RT-PCR (n. Gaede) Prinzip Nach der Nukleinsäure-Isolierung erfolgen mit Hilfe eines one-tube RT-PCR Kits die reverse Transkription viraler RNA in cdna und die anschließende Amplifikation im als real-time RT-PCR im geschlossenen System. Für den Virusnachweis ohne Speziesdifferenzierung werden Primer und eine Sonde mit pan-pesti-spezifität eingesetzt. Damit wird die sichere Detektion aller bisher bekannten BVDV-Stämme gewährleistet. Positive Resultate werden mit diesem System auch für KSPV und BDV erzielt. Der spezifische Nachweis einer Infektion mit BVDV 2 ist mit Hilfe spezies-spezifische Sonde in Kombination mit einem weiteren pan-pesti-primerpaar möglich. Ein analoges spezifisches System für BVDV 1 existiert nicht. Die Sonde PPV reagiert zwar negativ auf BVDV 2, detektiert aber neben BVDV 1 auch BDV und KSPV. Indirekt ist die spezifische Bestätigung des Vorliegens von BVDV 1 nur durch den Ausschluss von BVDV 2, BDV und ggf. KSPV mit für diese Virusspezies spezifischen Sonden möglich. Alternativ wird auf die Möglichkeit der Differenzierung durch die Analyse der viralen Gensequenzen bzw. durch spezifische Anfärbung von Virusisolaten mit Hilfe monoklonaler Antikörper verwiesen. RNA-Isolierung Die RNA-Isolierung erfolgt üblicher Weise durch chromatographische Trennung an Silica-Oberflächen. Dafür sind in Abhängigkeit von der Probenart verschiedene kommerziell erhältliche Kits verwendbar. In automatisierten Systemen kann die aktive Silica-Oberfläche zur Separation an Magnetpartikel gekoppelt sein. Die hier dargestellte Auflistung umfasst lediglich einige erprobte und geeignete Beispiele. FLI 132
134 Blutserum und EDTA-Plasma (auch gepoolt) Die RNA-Isolierung aus Blutproben erfolgt nach den Herstellerangaben der jeweiligen Kithersteller. RNeasy Mini Kit, (Qiagen, Hilden, Deutschland) High Pure Viral RNA Isolation Kit (Roche Diagnostics, Mannheim, Deutschland) High Pure Viral Nucleic Acid Isolation Kit*** (Roche Diagnostics, Mannheim, Deutschland) Agowa Mini Kit, manuelle und automatisierte Nukleinsäureextraktion (Agowa, Berlin, Deutschland) *** bevorzugt bei unsauberen Plasmen mit Anteil an Zellen bzw. Hämoglobin, auch bei Vollblut einsetzbar Milch (auch gepoolt) Der BVDV-Nachweis in Milchproben erfolgt im Zellsediment. Dazu werden die Zellen von ca. 10 bis 50ml (bei Poolproben) zur Sedimentation für 10min bei 3000g zentrifugiert, mit PBS gewaschen und nochmals zentrifugiert. Die weitere Bearbeitung erfolgt wiederum nach den Herstellerangaben der jeweiligen Kithersteller. RNeasy Mini Kit, (Qiagen, Hilden, Deutschland) High Pure Viral Nucleic Acid Isolation Kit (Roche Diagnostics, Mannheim, Deutschland) High Pure PCR Template Preparation Kit (Roche Diagnostics, Mannheim, Deutschland) Gewebe und Tupfer Die RNA-Isolierung aus Geweben erfolgt nach den Herstellerangaben der jeweiligen Kithersteller. RNeasy Mini Kit, (Qiagen, Hilden, Deutschland) High Pure PCR Template Preparation Kit (Roche Diagnostics, Mannheim, Deutschland) Zellkulturen Zellen von Zellkulturen mit BVDV-verdächtigem CPE werden durch Abzentrifugieren gewonnen und danach entsprechend den Herstellerangaben des verwendeten Kits zur RNA-Isolation aufbereitet. RNeasy Mini Kit, (Qiagen, Hilden, Deutschland) High Pure Viral Nucleic Acid Isolation Kit (Roche Diagnostics, Mannheim, Deutschland) Ansatz der RT-PCR Die hier beschriebenen Parameter gelten für die Verwendung des Quantitect Probe RT-PCR Kits (Qiagen, Hilden, Deutschland) auf dem Mx3000 (Stratagene Europe, Amsterdam, Niederlande) und icycler (Biorad, Hercules, USA). Bei Verwendung anderer Geräte-Systeme für die real-time PCR kann eine Anpassung erforderlich werden, insbesondere wenn diese Geräte nicht im üblichen 96er Blockformat arbeiten. Die Eignung anderer Enzymkits ist im Bedarfsfall zu prüfen. FLI 133
135 Reaktionsgemisch (20 µl): enthaltend 10 µl QuantiTect Probe RT-Mastermix, 0,2 µl QuantiTect Probe RT-Mix, 1,0 µl forward-primer (Gebrauchslösung: 10 pmol/µl), 1,0 µl reversed-primer (Gebrauchslösung: 10 pmol/µl), 1,0 µl Sonde (Gebrauchslösung: 4 pmol/µl**** ) und 2 µl RNA-Template **** Die optimale Konzentration der Sonde kann variieren und muss ggf. überprüft werden. Thermocycler-Programm für one-step RT-PCR: reverse Transkription: 50 C, 30 min, Denaturierung und Aktivierung der Taq-Polymerase: 95 C, 15 min, 45 Zyklen: Denaturierung bei 94 C für 20 Sek. und Annealing/Primer- Extension bei 60 C für 1 min. Messung der Fluoreszenz zum Ende der Annealingphase (FAM-Filter) Auswertung und Validierung: Die Spezifität und die diagnostische Sensitivität der real-time RT-PCR zum Nachweis und zur Differenzierung von BVDV 1 und BVDV 2 wurden in umfangreichen Untersuchungen an Virusisolaten der verschiedenen Pestivirus-Spezies geprüft. Die real-time RT-PCR dient in erster Linie zum qualitativen Nachweis von BVDV. Durch Erstellung von Eichkurven nach Paralleltitration von Virusstämmen für die PCR wie auch für die Virusisolierung auf der Zellkultur kann ein quantitativer Nachweis erfolgen. Eine absolute Quantifizierung bzw. die Ermittlung der laborspezifischen Nachweisgrenze sind ebenfalls durch die Verwendung eines synthetischen Standards (Bezugsquelle: FLI Insel Riems) möglich. Die typische Nachweisgrenze liegt bei ca. 50 bis 100 Viruskopien. Bei BVDV-PI werden üblicherweise ct-werte von 25 bis 30 (positive Signale zwischen dem 25. und 30. Zyklus) gemessen. Bei der Untersuchung von Poolproben, die Blut oder Milch von PI enthalten, muss ein ct-wert von ca. 30 bis 35 erwartet werden. Eine Laborvergleichsuntersuchung hat ergeben, dass bei Zykluszahlen >35 die Gefahr falschpositiver Reaktionen proportional zunimmt. Wiederholte Gefrier-Tau-Zyklen können dagegen durch die Freisetzung zellulärer RNasen zu falsch-negativen Ergebnissen führen. FLI 134
136 Tabelle 1: Primer für die BVDV real-time RT-PCR (pan-pesti) Pestivirus-spezific Primers (5 -UTR) Quelle Primer: Pesti 3 CCT GAG TAC AGG RTA GTC GTC A Hyndman ~171 bp Primer: Pesti 4 et al. (1998) GGC CTC TGC AGC ACC CTA TCA Primer: A 11 AGT ACA GGG TAG TCG TCA GTG GTT CG McGoldrick ~220bp Primer: A 14 et al. (1998) CAA CTC CAT GTG CCA TGT ACA GCA G Fragment Anwendung one-step RT-PCR zum simultanen Nachweis von BVDV 1 und BVDV 2 in Kombination mit der Sonde TQ-Pesti Differenzierung von BVDV 1 und BVDV 2 in Kombination mit den Sonden PPV oder BVD-2 Tabelle 2: TaqMan-Sonden für den simultanen Nachweis von BVDV 1 und BVDV 2 sowie zur Differenzierung von BVDV 1 und BVDV 2 TaqMan DNA-probes Quelle Spezifität (5 -FAM und 3 -TAMRA) Sonde: TQ-Pesti ( Reiting-Sonde ) Gaede et al. Genus Pestivirus TGC YAY GTG GAC GAG GGC ATG C (2005) Sonde: BVD-2 McGoldrick BVDV 2 CTG ATA GGG TGT AGC AGA GAC CCT et al. (1999) Sonde: PPV McGoldrick BVDV 1, außerdem CTG ATA GGG TGC TGC AGA GGC CCA CT et al. (1999) CSFV und BDV Indirekter Erregernachweis Neutralisationstest Prinzip Dieser Test basiert auf einer in vitro Neutralisation einer definierten Virusmenge durch spezifische (neutralisierende) Antikörper in Seren. Durch logarithmische Verdünnung der Seren wird der neutralisierende Antikörpertiter bestimmt. Die Visualisierung der Testergebnisse erfolgt mittels Immunfluoreszenz bzw. Immunperoxydasetest. Testdurchführung Probenaufarbeitung Der Neutralisationstest wird mit Serum durchgeführt. Nur in Ausnahmefällen, wenn kein Serum zur Verfügung steht oder wenn spezielle Fragestellungen zu beantworten sind, kann der Test auch mit Plasma durchgeführt werden. Dann ist aber ein höherer Grenztiter (~ 1:20) anzusetzen. Serum wird aus Blutproben ohne gerinnungshemmenden Zusatz gewonnen. Für die Verwendung im Neutralisationstest werden die Seren für 30 min bei 56 C inaktiviert. Plasma wird aus Blutproben mit gerinnungshemmenden Zusätzen gewonnen. FLI 135
137 Verdünnungsreihen Der Test wird in einer 96-Loch-Mikrotiterplatte unter Verwendung von Zellkulturmedium mit Antibiotikazusatz (siehe Anhang) durchgeführt. Es wird eine Serumverdünnungsreihe in 2er-Stufen (z. B. von 1:5 bis 1:640) mit je einem Volumen von 50 µl pro Kavität hergestellt. Pro Serumverdünnungsstufe werden zwei oder vier Kavitäten (Doppelansatz, bzw. Vierfachansatz) nebeneinander beschickt. Ein Beispiel für eine Plattenbelegung ist w. u. gezeigt. In die Kavitäten der ersten Vertiefungsreihe werden 80 µl, in die Kavitäten der anderen Reihen 50 µl Kulturmedium vorgelegt. Zur ersten Vertiefungsreihe wird dann 20 µl Serumprobe zugegeben. Mit einer Multikanalpipette werden aus der ersten Verdünnungsstufe (1:5 Verdünnung) 50 µl aufgenommen, in die nächste Reihe gegeben, durchmischt, und die Verdünnungsreihe fortgesetzt (8 bis 12 Verdünnungsstufen). Die letzten 50 µl werden verworfen. Jede Kavität enthält jetzt 50 µl einer Serum- Medium-Verdünnung. Mindestens zwei positive Referenzseren (BVD-ref1 oder 2 für BVD1-AK; BVD-ref3 für BVD2-AK; Herkunft: BVDV-NRL, FLI Insel Riems) werden in gleicher Weise als Kontrollen mitgeführt (positive Serumkontrollen). Mindestens zwei positive Referenzseren (BVD-ref1 oder 2 für BVD1-AK; BVD-ref3 für BVD2-AK; Herkunft: BVDV-NRL, FLI Insel Riems) werden in gleicher Weise als Kontrollen mitgeführt (positive Serumkontrollen). Testvirus In jede Kavität werden danach 50 µl mit 100 KID 50 der Testvirussuspension gegeben. Die Testvirussuspension muss unmittelbar vor Gebrauch mit Kulturmedium auf 100 KID 50 /50 µl (2000 KID 50 /ml) eingestellt werden. Die benötigte Menge an Testvirus (ca. 5 ml pro Mikrotiterplatte) ist in einem Ansatz herzustellen. Der Verdünnungsfaktor um die Testvirussuspension auf 100 KID 50 /50 µl einzustellen wird rechnerisch ermittelt. Ein Rechenbeispiel ist w. u. zu finden. Kontrollen Neben den positiven Serumkontrollen werden eine Zellkontrolle (100 µl Kulturmedium ohne Serum und Virus), je zu testendes Serum eine virusfreie Serumkontrolle (Grundverdünnung), eine Viruskontrolle und eine Rücktitration des Testvirus zur Bestimmung der eingesetzten KID50 mitgeführt. Mit der Rücktitratrion kontrolliert man den tatsächlichen Virusgehalt im Test. Hierbei wird die im Test eingesetzte Virusverdünnung in log-2-schritten beginnend bei 1:10 bis 1:1280 ausverdünnt. 180 µl Kulturmedium werden vorgelegt, 20 µl Testvirussuspension dazugegeben (1:10) und anschließend ausverdünnt. Pro Verdünnungsstufe werden zwei oder vier Kavitäten nebeneinander mit 100 µl Virusverdünnung beschickt. Neutralisation Die Mikrotiterplatte inkubiert daraufhin für 2 Stunden bei 37 C in einer feuchten Umgebung in einem CO 2 -Schrank (2,5 bzw. 5 % CO 2 ). Während dieser Zeit findet der Neutralisationsprozess statt. Zellsuspension Nach der Inkubationszeit werden in jede Kavität 100 µl der entsprechenden Zellsuspension hinzugefügt. Die Zelldichte muss so eingestellt sein, dass nach 24 Stunden ein konfluenter Zellrasen entsteht. (ca Zellen/ml). Die Mikrotiterplatte verbleibt für 72h zur Inkubation bei 37 C in einer feuchten Umgebung im CO 2 -Schrank (2,5 bzw. 5 % CO 2 ). FLI 136
138 Immunreaktion Grundsätzlich, d. h. auch bei Verwendung eines zytopathogenen NT-Virus sollte die Auswertung des Testes nach Detektion des Virus mittel Immunfluoreszenz- bzw. Immunperoxydasetest nach 3 Tagen erfolgen. Die Berechnung des Antikörpertiters erfolgt als ND50 nach Behrens und Kaerber. Neutralisationstiter = V-d(S-0,5) V: lg der ersten 100 % pos. Serumverdünnung d: lg des Verdünnungsfaktors (0,3) S: Summe der pos. Reagenten von 0 bis 100 % Reagentenzahl je Verdünnung Geräte und Reagenzien Mikrotiterplatten (96-well) Mehrkanalpipetten, Pipetten, sterile Plastikspitzen Empfängliche Zellkulturen, z. B.: MDBK, KOP-R, (Herkunft: Zellbank des FLI) Zellkulturmedien Referenzviren, BVD-1: NADL; BVD2: CS8644; Virusbank des FLI) monoklonale Antikörper gegen Pestiviren (Herkunft: kommerzielle Anbieter, z. B. cc pro) Peroxidasemarkierte Anti-Maus-Antikörper (Herkunft: kommerzielle Hersteller, z. B. Sigma) Positiv- und Negativreferenzen Standardmäßige Laborausstattung für ein Viruslabor (Sterilwerkbank, Umkehrmikroskop, CO 2 -Schrank (37 C), Zentrifuge, Wärmeschrank (80 C), Kühlschrank, Kühltruhe (-20 C, -70 C). Reagenzien Referenzseren: Antibiotikalösung Oder NRL BVD, FLI Insel Riems 1,25 g Penicillin 2 g Streptomycin In 20 ml sterilem Aqua bidest lösen, portionieren und bei 20 C einfrieren Gentamycin, 1 µl/ml Kulturmedium (50 ng/ml) Amphotericin, 10 µl/ml Rechenbeispiel zur Berechnung des Verdünnungsfaktors für das Testvirus Die im Neutralisationstest zum Einsatz kommende Virussuspension (Testvirus) soll einen Titer von 100 KID 50 /50 µl haben. Folglich muss das Ausgangsvirus entsprechend verdünnt werden. Die Berechnung des Verdünnungsfaktors erfolgt nach der Formel: Titer log 10 KID 50 /0,1 ml Ausgangsvirus minus * = log 10 Virusverdünnung; entlogarithmieren. Reziproker Wert = Virusverdünnung. (* 10 2,3 = 200 KID 50 pro 0,1 ml) FLI 137
139 Beispiel: Der Titer des Ausgangsvirus beträgt 10 6,3 KID 50 / ml. Das sind 10 5,3 KID 50 /0,1ml. Berechnung: 10 5,3-10 2,3 = 10 3 Entlogarithmierung 3,0 log 10 = 1000 Das Ausgangsvirus muss 1 : 1000 in Kulturmedium verdünnt werden. Plattenbelegungsschema: A B C D E F G H ND50 Serum 1 Serum 2 Serum 3 Serum 4 Serum 5 Serum Serum 7 Serum 8 Serum 9 Serum 10 Rücktitration Serum-/ Zellkontrollen A S1 S2 B S3 S4 C S5 S6 D S7 S8 E S9 S10 F ZK ZK G H VK VK ND Antikörper-ELISA Für den Antikörpernachweis werden amtlich zugelassene ELISA-Testkits nach Herstellerangaben eingesetzt. Folgende Testkits sind derzeit in Deutschland zugelassen: HerdChek BVDV Ab (IDEXX) indirekt Svanovir BVDV (2 Handelsformen) (Svanova) indirekt Ceditest BVDV (Cedi Diagn.), kompetitiv BVD/MD p80 Antikörper (Inst. Pourquier) kompetitiv Chekit BVD-Sero II (Bommeli) indirekt SERELISA BVD/MD Antikörper (Synbiotics) kompetitiv FLI 138
140 17. Brucellose der Rinder, Schweine, Schafe und Ziegen Charakterisierung der Infektion Erreger Die Brucellose wird durch eine Infektion mit Bakterien der Gattung "Brucella" verursacht. Brucella melitensis (Hauptwirt Schaf und Ziege) Brucella abortus (Hauptwirt Rind) Brucella suis (Hauptwirt Schwein) Brucella ovis (Hauptwirt Schaf) Brucella canis (Hauptwirt Hund)* Brucella neotomae (Hauptwirt Wüstenratte)* Brucella microti (Hauptwirt Feldmaus)* Brucella cetaceae (Hauptwirt Delphin)* Brucella pinnipedialis (Hauptwirt Robbe)* * Diese Spezies sind bisher bei landwirtschaftlichen Nutztieren noch nicht nachgewiesen worden Klinische Symptomatik Als Krankheitsanzeichen werden bei Tieren vorwiegend undulierendes Fieber, Arthritis, Bursitis, Orchitis, Aborte und Puerperalerkrankungen festgestellt, besonders schwer ist i.d.r. der Urogenitaltrakt betroffen. Deshalb sollten alle Aborte bei Nutztieren diagnostisch abgeklärt werden. Als Zoonoseerreger kommen Brucella (B.) melitensis, B. abortus und B. suis in Betracht. Sie führen zu akuten bis chronischen schweren Erkrankungen bei Menschen und stellen auch heute noch in vielen wirtschaftlich weniger entwickelten Ländern ein großes gesundheitliches Problem dar. Menschen infizieren sich i.d.r. durch kontaminierte Lebensmittel oder direkten Kontakt zu kranken Tieren bzw. tierischen Produkten Differentialdiagnostik Alle anderen bei Rindern, Schweinen, Schafen und Ziegen mit Aborten einhergehende Krankheiten Diagnostische Indikation siehe klinischer oder epidemiologisch begründeter Verdacht Zuständige Untersuchungseinrichtung Staatliche Veterinäruntersuchungsämter NRL Brucellose am FLI, Jena FLI 139
141 Rechtsgrundlagen Richtlinie 97/12/EG des Rates vom 17. März 1997 zur Änderung und Aktualisierung der Richtlinie 64/432/EWG zur Regelung viehseuchenrechtlicher Fragen beim innergemeinschaftlichen Handelsverkehr mit Rindern und Schweinen (ABl. EG Nr. L 109 S. 1) Richtlinie 90/429/EWG zur Festlegung der tierseuchenrechtlichen Anforderungen an den innergemeinschaftlichen Handelsverkehr mit Samen von Schweinen und an dessen Einfuhr Brucellose-Verordnung in der Fassung der Bekanntmachung vom 23. Dezember 2005 (BGBl. I S. 3602) Entscheidung 2003/467/EG zur Feststellung des amtlich anerkannt tuberkulose-, brucellose- und rinderleukosefreien Status bestimmter Mitgliedstaaten und Regionen von Mitgliedstaaten in Bezug auf die Rinderbestände Richtlinie 91/68/EWG des Rates vom 28. Januar 1991 zur Regelung tierseuchenrechtlicher Fragen beim innergemeinschaftlichen Handelsverkehr mit Schafen und Ziegen Untersuchungsmaterial Zum Nachweis des Erregers: Die zum Erregernachweis bevorzugten Organe variieren je nach Tierart, Geschlecht und Alter der Tiere sowie der zu erwartenden Brucellen - Art. Die für die einzelnen Untersuchungsgänge besonders geeigneten Proben werden dort gesondert aufgeführt. Auswahl und Entnahme: Organmaterial frisch verendeter, oder besser von getöteten erkrankten Tieren bzw. frisch abortierte Feten, Se- und Exkrete, Blut (bei Fieber), veränderte Organe. Auf sterile Entnahme achten! Die zu untersuchenden Tiere sollten nicht unmittelbar vor der Probennahme einer Antibiotikatherapie unterzogen worden sein. Transport und Lagerung: Untersuchungsmaterial umgehend vorschriftsmäßig in dicht schließenden Behältnissen verpackt, gekennzeichnet nach Gefahrgutverordnung Straße und Eisenbahn, Infektionsschutzgesetz, IATA-DGR in der jeweils gültigen Fassung, DIN EN 829, zusammen mit Vorbericht und Untersuchungsantrag an die Untersuchungseinrichtung schicken. Während des Transportes und evtl. notwendig werdender Lagerung ist das Material kühl (2 bis 7 C) aufzubewahren. FLI 140
142 17.3. Untersuchungsgang Erregernachweis Der direkte kulturelle Nachweis des Erregers der Brucellose ist als beweisend anzusehen und daher in jedem brucelloseverdächtigen Tierbestand zu versuchen. Besondere Bedeutung kommt ihm in Herden zu, in denen serologische Untersuchungen zu keiner Abklärung führten, ebenso wie bei der Verfolgung epidemiologischer Zusammenhänge Mikroskopischer Nachweis Als Untersuchungsmaterial für den mikroskopischer Nachweis werden folgende Teile empfohlen: Feten: Eihautteile: Organteile: Sekrete: Mageninhalt (Bodensatz) Kotyledonen (entzündete Areale) Karunkeln (Oberfläche), Hoden, Nebenhoden Lochialsekret, Milch Von den genannten Tierkörperteilen werden Ausstrich- und/oder Abklatschpräparate angefertigt und nach Kіster (Anhang 1.1) und/oder nach Stamp (Anhang 1.2) gefärbt. Auch immunospezifische Färbungen sind möglich, haben sich aber nicht allgemein durchgesetzt. Brucellen sind kleine, kokkoide Bakterien, 0,5 bis 0,7 x 0,6 bis 1,5 µm groß, gramnegativ und unbeweglich. Sie sind meist einzeln gelagert, oft wird auch intrazelluläre Lagerung in Phagozyten beobachtet. Brucellen bilden keine Kapseln oder Sporen und färben sich sowohl in der Kіster- als auch in der Stamp-Färbung rot an. Bewertung: Differentialdiagnose: der alleinige mikroskopische Nachweis von Bakterien, die wie Brucellen aussehen, ist als verdächtig zu bewerten. Coxiellen und Chlamydien stellen sich im Stamp-gefärbten Präparat ähnlich wie Brucellen dar (Tabelle 3). FLI 141
143 Kultureller Nachweis Als Untersuchungsmaterial für den kulturellen Nachweis werden folgende Organteile empfohlen: Feten: Labmageninhalt, Lunge, Leber (ersatzweise Niere, Gehirn) evtl. Darminhalt, Niere, und Placenta fetalis Eihautteile: Kotyledonen (ersatzweise andere Teile, bes. entzündete Areale); zur Unterdrückung der Begleitflora kann das Material für Minuten in 3%ige Kalilauge eingelegt werden. weibliche Tiere Karunkeln des Uterus, Euter-, und Darmbeinlymphknoten, Euter (alle Viertel), Milch (Bodensatz und Rahm), Lochialsekret, Vaginalschleim, männliche Tiere: Hoden, Nebenhodenkopf und -schwanz (besonders entzündete Areale), Sperma, Sediment von Präputialspülproben Bei Bedarf kann untersucht werden: Gelenk- und Bursa-Punktate, weitere Lymphknoten, Milz, Leber, Lunge, Blut, Tonsillen, Kopf- und Halslymphknoten, Abszesse Sämtliche o. g. Materialien werden direkt angelegt und evtl. zusätzlich in flüssige Anreicherungsmedien verbracht. Ein Zerkleinern des Organmaterials (z. B. mit Seesand) wird empfohlen Nährmedien Probleme in der Anzüchtung von Brucellen ergeben sich mitunter durch ihre oft sehr geringe Anzahl im Probenmaterial und in ihrem langsamen Koloniewachstum. Feste Nährmedien ohne Hemmstoffzusatz: Blutagarplatten (Anhang 1.3) Brucella - Agar (Anhang 1.4) mit Hemmstoffzusatz: Selektiv Agar (Brucella - Agar mit Antibiotikasupplement, Anhang 1.5) Für die Anzüchtung von B. ovis, B.abortus Biovar (BV) 2 und B. suis BV 2 ist der Zusatz von 5 % Serum oder Blut zum Nährmedium erforderlich. Flüssige Anreicherungsmedien Brucella-Bouillon, ohne Hemmstoffzusatz (Anhang 1.3) Selektiv-Bouillon, mit Hemmstoffzusatz (Anhang 1.5) Blutkultur: handelsübliche Blutkulturmedien (z. B. Micrognost-Blutkulturflaschen, Biotest AG) FLI 142
144 Bebrütung: sowohl aerob als auch mikroaerophil ( 5 bis 10 Vol% CO 2 ) bei einer Temperatur von 37 C Agarplatten mindestens 5 bis maximal 21 Tage bebrüten, erste Ablesung nach 1 bis 2 Tagen. Flüssiganreicherungen mindestens 10 Tage (bis 6 Wochen) bebrüten, Subkultur auf feste Medien wöchentlich, beginnend am dritten Bebrütungstag. Das Wachstum auf Selektivmedien kann um einige Tage verzögert sein. Blutkulturen bis zu 35 Tage bebrüten Ablesen (im Bedarfsfall mit Stereomikroskop) Auf festen Nährböden bilden Brucellen langsam wachsende, runde Kolonien, die in 2 bis 3 Tagen einen Durchmesser von 0,5 bis 2 mm erreichen; das Wachstum kann aber auch verzögert sein. Die Kolonien der glatten (S-) Form sind konvex, glattrandig, durchscheinend bis leicht gelblich und nicht hämolysierend. Rauh- (R) und M-Formen, wie zum Beispiel die permanent rauhe Art B.ovis ist grauweiß, opak und leicht granuliert bzw. schleimig. Flüssige Nährmedien werden nach 7 Tagen gering gleichmäßig getrübt, es bildet sich wenig lockerer Bodensatz. Verdächtige Kolonien sind auf folgende Kriterien zu überprüfen (siehe auch Tabelle 3): Auf welchem Nährboden und bei welcher Atmosphäre wachsen die verdächtigen Kolonien? Brucellen wachsen aerob und/oder mikroaerophil auf hemmstofffreiem Agar und Selektiv-Agar Auf Blutagar keine Hämolyse. nach Gram und/oder Kіster/Stamp Oxidase-Test positiv Kolonien von hemmstofffreiem, blutfreiem Agar prüfen, Glasstab oder Platinöse benutzen, Positive Reaktion: Testpapier oder -stäbchen verfärbt sich innerhalb von 2 min. in blauviolett, Ausnahme: B. ovis reagiert im Oxidase-Test negativ! Positiver Katalase-Test auf einem Objektträger einen Tropfen Wasserstoffperoxyd (Konzentration 3%ig) mit einer Kolonie verreiben. Positive Reaktion: Starke Gasbildung. Beweglichkeitsprüfung Mit der Technik "Hängender Tropfen", möglichst aus gut bewachsener Bouillon; Brucellen sind unbeweglich Dissoziationsprüfung Mit Trypaflavin (Anhang 1.6) als Objektträgertest. Mit Kristallviolett (Anhang 1.7) Platte für 15 bis 20 Sek. mit Kristallviolett-Gebrauchslösung fluten: glatte Kolonien nehmen keine Farbe an und sind weiß, raue Kolonien sind rot-violett) Weiteres Vorgehen Bakterienstämme mit Brucella - ähnlichen Eigenschaften (Tabelle 3) möglichst einer Bio-und Genotypisierung zuleiten, die auch der Klärung epidemiologischer Fragestellungen dient. Das NRL Brucellose führt solche Untersuchungen durch. FLI 143
145 Regelwidrige Stämme können vorkommen. Bei Erstisolierung liegen mitunter Stämme in der R-Form vor, die sich dann bei weiteren Passagen in die S-Form wandeln, besonders bei Isolierung von B. melitensis aus der Milch. Rauformen können mit den herkömmlichen Tests nicht komplett typisiert werden Antigen-Nachweis Antigen-Nachweise mittels Latex-Agglutination und ELISA sind beschrieben. Haben sich jedoch in der Routinediagnostik nicht durchgesetzt. In den letzten Jahren sind vermehrt Nukleinsäuredetektionsmethoden (PCR) im Labor gebräuchlich geworden. Sie sind als Ergänzung zu klassischen bakteriologischen Methoden geeignet, um z. B. verdächtige Kolonien zu überprüfen, eine Erstuntersuchung einer Probe oder weitergehende Typisierungen durchzuführen. Zur Anwendung als alleinige Methode zum Nachweis Brucella spezifischer DNA in Nativmaterial fehlen bisher ausreichende Validierungsdaten. Hier besteht vor allem das Problem der Probenaufarbeitung (PCR inhibierende Inhaltsstoffe). Bei negativen PCR- Befunden muss eine bakteriologische Untersuchung erfolgen. Eine genusspezifische PCR (siehe Anhang beruht auf dem BCSP31 Gen (Baily et al., 1992) Antikörpernachweis Untersuchungsmaterial Geeignet sind Blutserum, Plasma, Milch und Milchserum. Entnahme möglichst keimarm, um eine lange Haltbarkeit der Proben zu gewährleisten. Blutproben sind zur Gerinnung in den ersten 2 bis 3 Std. nach Entnahme bei 18 bis 20 C und dann kühl aufzubewahren. Frosteinwirkung auf Blut führt zu Hämolyse. Trübe, verunreinigte, flockige und hämolytische Seren sowie sinnfällig veränderte Milchproben (Kolostralmilch, Mastitissekrete, saure Milch, Eutersekret von altmelkenden und trockenstehenden Tieren) sind für Untersuchungen ungeeignet. Die Proben sind auslaufsicher zu verpacken, zu kennzeichnen wie Organmaterial, schnell und frostfrei zu transportieren. Untersuchungsmethoden Je nach Untersuchungsziel und Tierart sind in Deutschland folgende serologische Methoden für die staatlich reglementierten Überwachungsuntersuchungen zugelassen (EU-Richtlinie 64/432/EWG -Rinder und Schweine- vom zuletzt geändert durch Verordnung (EG) Nr. 1226/2002 vom 08. Juli 2002, Verordnung 535/2002/EG, Entscheidung der Kommission 2004/226/EG und EU-Richtlinie 91/68/EWG -Schafe und Ziegen- vom ): FLI 144
146 Rind Antikörpernachweis im Blutserum: Antikörpernachweis in der Milch: SLA, KBR, ELISA, RBT, ELISA (Poolproben), ABR Schwein Antikörpernachweis im Blutserum: RBT, SLA, KBR. Die SLA und die KBR sind einzusetzen sofern bei der Erstuntersuchung von in die Besamungsstation einzustallenden Tieren während der letzten 15 Tage der Quarantäne mittels RBT ein positives Ergebnis aufgetreten ist (RL 90/429/EWG, Anhang A, Kapitel I, 1d). Schaf und Ziege Antikörpernachweis im Blutserum: RBT, KBR SLA: Serumlangsamagglutination KBR: Komplemtentbindungsreaktion RBT: Rose - Bengal Test ABR: Abortus - Bang Ringtest ELISA: Enzyme Linked Immuno Sorbent Assay Ausführungsrichtlinien und Methodenbeschreibungen über die oben angegebenen serologischen Methoden sind gesetzlich geregelt. Bei kommerziellen ELISAs richtet sich die Durchführung nach der beiliegenden Gebrauchsinformation. Im Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2004 herausgegeben von der OIE ist eine weitere serologische Untersuchungsmethode als ein möglicher vorgeschriebener Test für den internationalen Handel angegeben. Es handelt sich dabei um den Fluoreszenzpolarisationsassay (FPA). Bisher ist diese Methode jedoch nicht in den gesetzlichen Regelungen der EU verankert. Durchführung der serologischen Untersuchungsmethoden (Anhang 2) Bewertung der Ergebnisse: Der Brucella-Antikörpergehalt von Proben und Kontrollseren ist gegenüber einem als internationales Standardserum anerkanntem Rinderserum (OIEISS, vom CVL Weybridge), das 1000 Internationale Einheiten/ml (SLA) bzw.1000 Sensibilisierende Einheiten/ml (KBR) enthält, standardisiert und wird in I.E./ml bzw. SensE/ml ausgedrückt. Die Bewertung der ELISAs bei Poolmilchproben orientiert sich an den vom Hersteller mitgelieferten Kontrollen. Die Bewertung der serologischen Ergebnisse wird durch eine Vielzahl von serologischen Kreuzreaktionen, die durch Antigenverwandtschaft mit anderen Erregern, besonders mit Yersinien (Kittelberger et al.; 1998), bedingt werden, erschwert. FLI 145
147 Tabelle 2: Infektionsspektrum, Pathogenität und Übertragung von B. melitensis, B. abortus, B. suis und B. ovis (nach Dedié et al., 1993) Brucella melitensis 3 Biovare, meist S-, auch R- Formen abortus suis 7 Biovare, (1-6, 9) meist S-, auch R- Formen 5 Biovare (auch R- Formen) Biovar 4 syn. B rangiferi ovis stets in R- Form Untertypen und Kolonieformen Hauptwirtstiere Ziegen, Schafe Rind und andere Bovine Schlachten, Behandeln von Fleisch und Wildbret, Laborarbeiten Schafbock weitere natürliche Wirtstiere Rind, Kamele, Alpaca, Fleischfresser, Wildwiederkäuer, (Schwein, Nagetiere) Einhufer, (Schafe, Kamele), Fleischfresser, (Wühlmäuse?) Biovar 1-3: Schwein Biovar 2: Hase Biovar 4: Rentier Biovar 5: Nagetiere Wildschweine, Fleischfresser, Kleinnagetiere (Biovar 3), (Wiederkäuer) (Ziege?, Nagetiere?) (konnatal), Kontakt, Geburt, (oral) Nachgeburt, Milch (genital), Zecken? (konnatal), Kontakt, Geburt (konjunktival, kutan), oral z. B. mit Nachgeburt oder Milch (genital, Besamung) genital, Kontakt, oral: Fleisch, Beutetiere, Kadaver, (stechende Insekten?) genital, (Kontakt) hoch; mehr akut erheblich bis hoch, mehr chronisch geringgradi g (Biovar 2) bis hoch (Biovar1) keine Übertragung zwischen Tieren Pathogenität für Menschen Infektionsquellen für Menschen Kontakt, Tiergeburtshilfe, Milch und Käse (unpasteurisiert), Laborarbeiten, Schlachten Kontakt, Tiergeburtshilfe, Rohmilch, Laborarbeiten bisher keine Infektionen beim Menschen nachgewiesen FLI 146
148 Tabelle 3: Differential diagnostische Charakterisierung von Brucellen im Vergleich zu anderen gramnegativen Mikroorganismen (nach Alton, et al., 1988) Tests Morphologie Beweglichkeit bei 37 C Beweglichkeit bei 20 C Laktose Fermentation auf Mac Conkey Agar Säure Produktion auf Glukoseagar Haemolyse auf Blutagar kleine Kokken kleine Kokken Brucella Bordetella bronchiseptica Campylobacter fetus Komma förmig Moraxella diplokokkoid Acinetobacter Diplokokkoid v a v v v v Katalase v Oxidase Urease v v Nitratreduktion v Zitratverbrauch v Yersinia enterocolitica O:9 Stäbchen a Positive und negative Reaktionen innerhalb des Genus b B. neotomae kann geringgradig Fermentation zeigen c Mit Ausnahme von B. ovis, B. neotomae und manchmal B. abortus Stämme, welche negativ sind d Mit Ausnahme B. ovis, und manchmal B. abortus Stämme, welche negativ sind e Mit Ausnahme von B. ovis,welcher nicht Nitrat reduziert Literatur DEDIÉ, K., J. BOCKEMÜHL, H. KÜHN, K.-J. VOLKMER und T. WEINKE (Hrsg.) (1993): Bakterielle Zoonosen bei Mensch und Tier. Ferdinand Enke Verlag Stuttgart, S , FLI 147
149 Anhang 1 1) Färbung nach Kіster Ausstrich fixieren Ausstrich mit alkalisierter Safraninlösung* für 1 min. bedecken Abspülen mit Wasser Präparat kurzzeitig (8 bis 10 Sek.) entfärben in 0,05%iger Schwefelsäure Abspülen mit Wasser Gegenfärben mit 3%iger wässriger Methylenblaulösung, etwa 8-10 Sek. Abspülen mit Wasser und Präparat trocknen lassen *Alkalisierte Safraninlösung: Unmittelbar vor jeder Färbung frisch herstellen, indem zu 1,5 ml einer 1 molaren KOH-Lіsung 5 Tropfen einer 3%igen wässrigen Safraninlösung gegeben werden. Auswertung: Brucellen färben sich rot an, andere Bakterien und der Untergrund blau. 2) Färbung nach Stamp (modifizierte Ziehl-Neelsen-Färbung) Ausstrich hitzefixieren Ausstrich mit 1:10 verdünntem Karbolfuchsin nach Ziehl-Neelsen* 10 min. bedecken Abspülen mit Wasser Präparat entfärben in 0,5%iger Essigsäure für 30 Sek. Abspülen mit Wasser Gegenfärben mit 1%iger Methylenblaulösung, etwa 20 Sek. Abspülen mit Wasser und Präparat trocknen lassen * Karbolfuchsin nach Ziehl-Neelsen, Stammlösung: 1,0 g basisches Fuchsin, gelіst in 10 ml absolutem Alkohol, zu 90 ml 5%iger Phenollösung gegeben Auswertung: Brucellen färben sich rot an, andere Bakterien und der Untergrund blau. Auch Coxiellen und Chlamydien färben sich rot an! 3) Blut-Agar Brucella-Agar mit Zusatz von 5 bis 10 % defibriniertem Blut von Schafen, Pferden, Rindern oder Kaninchen oder: Bacto-Pepton 10.0 g Natriumchlorid 5.0 g Na 2 HPO 4 x 12 H 2 O 2.0 g Fleischextrakt 6.0 g Aqua dest. ad ml Verwendung: wie Brucella-Agar, zusätzlich ist die Beurteilung von Hämolyse möglich ph = 7.2 FLI 148
150 4) Brucella-Agar/Bouillon Trypticase Pepton 10.0 g Thiotone Pepton 10.0 g Hefeextrakt 2.0 g Glucose 1.0 g Natriumchlorid 5.0 g Natriumdisulfit 0.1 g Agar (nicht bei Bouillon) 15.0 g Aqua dest. ad ml Verwendung: Isolierung, Anreicherung und Kultivierung von Brucella-Arten aus klinischem Material und Lebensmitteln (auch Milch und Milchprodukte) Brucella-Agar ist ein sehr gutes Basismedium und wird, auch mit Zusatz von 5 % defibriniertem Schafblut oder Antibiotika-Supplement, breit eingesetzt. Brucella-Agar ist zur Stammaufbewahrung geeignet ph = 7.0 5) Brucella Selektiv-Agar/Selektiv-Bouillon mit Selektiv-Supplement Polymyxin B 2500 IE Bacitracin IE Cyclohexemid 50 mg Nalidixinsäure 2,5 mg Nystatin IE Vancomycin 10 mg Verwendung: Als Zusatz zum Basismedium zur Hemmung der Begleitflora bei Direktkultivierung und Anreicherung von Brucellen. Die Zusammensetzung des Supplements variiert je nach Hersteller geringgradig. Je Röhrchen Supplement aseptisch 10 ml Methanol/Aqua dest. -Mischung (50:50) zusetzen und min. bei 37 C inkubieren. Durch Schütteln vollständig lösen, die Lösung zu 500 ml auf 50 C abgekühltem Medium geben, mischen und abfüllen. Achtung: Das Produkt ist giftig! Sicherheitshinweise beachten! Das Produkt hat eine kurze Laufzeit, Verfallsdatum beachten! Das Produkt ist bei 2 bis 8 C zu lagern! 6) Trypaflavin zur Dissoziationsprüfung 10 mg Trypaflavin (Acriflavin) auf 10 ml aqua dest. Erst unmittelbar vor Gebrauch herstellen. 7) Kristallviolett zur Dissoziationsprüfung Lösung a): Lösung b): Stammlösung: Gebrauchslösung: Kristallviolett 2,0 g abs. Alkohol 20,0 ml Ammoniumoxalat 0,8 g Aqua bidest. 80,0 ml Lösungen a) und b) mischen, Haltbarkeit 3 Monate erst unmittelbar vor Gebrauch herstellen Stammlösung 1:40 mit Aqua bidest. verdünnen FLI 149
151 Anhang 2 A) Arbeitsanleitung zur Durchführung der Serumlangsamagglutination in der Mikro-Methode (SLA) 1. Geräte Zentrifuge Brutschrank (+37 C ± 1 C) Kühlschrank (+5 C ± 3 C) Tiefkühlschrank (-21 C ± 3 C) Präzisionswaage Kolbenhubpipetten (10 µl bis 100 µl, 100 µl bis 1000 µl) nach DIN/ISO 9001 Mehrkanalkolbenhubpipette nach DIN/ISO Kanal-Multistepper (50 µl bis 200 µl) nach DIN/ISO 9001 Dispenser (10 µl bis 5 ml) nach DIN/ISO 9001 Combitips nach DIN/ISO Gebrauchsmaterialien Reagenzgläser Messpipetten DIN 12691, 12695, (1, 5, 10 ml) Messzylinder DIN Erlenmeyerkolben DIN 12380, 12385, Stehkolben DIN 12347, Bechergläser DIN Mikrotiterplatten (U-Form, 8x12 cups) Pipettenspitzen DIN/ISO 9001 Reagenzglasständer feuchte Kammer Antigen, zugel. nach 17c TierSG Kontrollserum, positiv, zugel. nach 17c TierSG Kontrollserum, negativ, zugel. nach 17c TierSG 3. Chemikalien Natriumchlorid p.a. (NaCl) Safranin Aqua bidest. 4. Rezepturen 4.1. Physiologische NaCL-Lösung Natriumchlorid p.a. 8,9 g Aqua bidest ad 1000,0 ml 20' bei 121 C autoklavieren, Lagerung bei +5 C ± 3 C, Haltbarkeit 6 Monate FLI 150
152 4.2. Safranin-Lösung Safranin 0,5 g Aqua bidest ad 100,0 ml Aqua bidest unter ständigem Schwenken dem Safranin zufügen und bis zur vollständigen Lösung rühren, Lagerung bei +22 C ± 3 C, Haltbarkeit 12 Monate 4.3. Verdünnungsflüssigkeit 1 Tropfen (ca. 50 µl) der 0,5%igen Safranin-Lösung + 20 ml physiologischer NaCl- Lösung 5. Durchführung 5.1. Antigen Das Antigen ist in der vom Hersteller angegebenen Gebrauchsverdünnung zu verwenden Kontrollsystem Kontrollseren: In jedem Ansatz wird ein dem Antigen homologes positives (mit definiertem Titer bzw. Angabe von IE/ml) sowie ein antikörperfreies, d. h. negatives Kontrollserum mitgeführt. Antigenkontrolle 5.3. Serumproben und Antigen auf Raumtemperatur erwärmen 5.4. Serumproben und Kontrollseren werden im Reagenzglas 1:5 vorverdünnt 5.5. Ansatz In der folgenden Tabelle werden die Arbeitsschritte für eine Probenuntersuchung dargestellt: Cup Arbeitsschritte : : : NaCl-Lösg. (µl) : : : Serum-Verd. 1:5 (µl) : : : - - Antigen- Kontrolle 3. Titration des Serums von 1 nach 11 durch Übertragung von 50 Еl der Serumverdünnung, 50 Еl Serumverdünnung der Reihe 11 verwerfen 4. Antigen- Gebrauchsverd. (µl) : : : Inkubation 18 bis 24 h bei 37 C ± 1 C (feuchte Kammer) FLI 151
153 6. Ablesen der Reaktionen - Positive Reaktion Bildung eines auf dem Boden gleichmäßig verteilten, mitunter an den Rändern leicht eingerolltes Agglutinat - Negative Reaktion eindeutige Knopfbildung des Antigens - Positive Kontrolle muss dem angegebenen Titer entsprechen (+/- eine Titerstufe) bzw. dient der Berechnung der IE/ml der zur untersuchenden Probe - Negative Kontrolle in jeder Serumverdünnung muss eine eindeutige Knopfbildung erkennbar sein - Antigenkontrolle eindeutige Knopfbildung 7. Bewertung: SLA ± 30 IE/ml 8. Validierung: durch Einsatz des 2, Internationalen Standard Brucella abortus Serum (ISabS) und Übersetzung der Ergebnisse in Internationale Einheiten (IE) B) Arbeitsanleitung zur Durchführung der Komplementbindungsreaktion in der Mikro-Methode Brucellose (KBR) 1. Geräte Zentrifuge Brutschrank (+37 C ± 1 C) Wasserbad, Temp. variabel (55 C bis 65 C) Wasserbad (+37 C ± 1 C) Kühlschrank (+5 C ± 3 C) Tiefkühlschrank (-21 C ± 3 C) Präzisionswaage Tafelwaage Magnetrührer (heizbar) ph-meter Kolbenhubpipetten (10 µl bis 100 µl, 100 µl bis 1000 µl) nach DIN/ISO 9001 Mehrkanalkolbenhubpipette nach DIN/ISO Kanal-Multistepper (50 µl bis 200 µl) nach DIN/ISO 9001 Dispenser (10 µl bis 5 ml) nach DIN/ISO 9001 Combitips nach DIN/ISO 9001 Pipettierhilfe 2. Gebrauchsmaterialien Reagenzgläser Messpipetten DIN 12691, 12695, (1, 5, 10 ml) Messzylinder DIN Erlenmeyerkolben DIN 12380, 12385, Stehkolben DIN 12347, FLI 152
154 Bechergläser DIN Zentrifugengläser DIN 58970, Teil 2 Mikrotiterplatten (U-Form, 8x12 Cups) Pipettenspitzen DIN/ISO 9001 Reagenzglasständer feuchte Kammer Klebeband (Breite 8 cm) Magnetrührstäbchen PTFE Antigen, zugel. nach 17c TierSG Kontrollserum, positiv, zugel. nach 17c TierSG Kontrollserum, negativ, zugel. nach 17c TierSG Ambozeptor Komplement Hammelblut 3. Chemikalien Natriumchlorid p. A (NaCl) 5,5 Diethylbarbitursäure Natrium-Salz (C 8 H 11 N 2 NaO 3 ) Magnesiumchlorid (MgCl 2 ) 6H 2 O Calciumchlorid (CaCl 2 ) 2H 2 O 1n Salzsäure (HCl) D(+)-Glucose-Monohydrat (C 6 H 12 O 6 ) H 2 O Natriumcitrat (C 6 H 5 Na 3 O 7 ) 2H 2 O Kaliumsulfat (K 2 SO 4 ) Borsäure (H 3 BO 3 ) Eichlösungen für ph-meter Penicillin Aqua bidest. 4. Rezepturen 4.1. Verdünnungslösung (VBD) Die Verdünnungsflüssigkeit für alle Ragenzien ist Veronal-Puffer-Lіsung (veronalbuffered-diluent = VBD). Zur besseren Haltbarkeit wird ein VBD-Konzentrat im Verhältnis 5:1 hergestellt und portioniert bei +5 C ± 3 C gelagert. Vor Gebrauch ist es 1:5 mit Aqua bidest. zu verdünnen Herstellung des VBD-Konzentrates 5:1, 2000ml a. Stammlösung 1 Natriumchlorid p.a. 83,00 g 5,5 Diethylbarbitursäure Natrium-Salz 10,19 g Aqua bidest. (heiß) ca. 800,00 ml b. Stammlösung 2 Magnesiumchlorid 6H 2 O 20,30 g Calciumchlorid 2H2O 4,40 g Aqua bidest. ad 100,00 ml Die Lösung kann bei +5 C ± 3 C 6 Monate aufbewahrt werden. FLI 153
155 Substanzen der Stammlösung 1 in einen Erlenmeyerkolben durch Rühren auf dem Magnetrührer heiß lösen tropfenweise Zugabe von 34,58 ml 1n Salzsäure (HCl) evtl. ausfallende Salze durch Zugabe von Aqua bidest. in Lösung bringen tropfenweise Zugabe von 5ml Stammlösung 2 nach Abkühlung der Lösung das Volumen mit Aqua bidest. auf 2000 ml auffüllen Überprüfung des ph-wertes ph 7,3 ±0,2 Verdünnung von 1 ml VBD-Konzentrates mit Aqua bidest. 1:5 Messung des ph-wertes 4.2. Alseverlösung zur Konservierung von Hammelbluterythrozyten Dextrose (Glucose) 18,66 g Natriumchlorid 4,18 g Natriumcitrat 8,00 g Aqua bidest. ad 1000,00 ml Lösen im Dampftopf für 20 min Bei längerer Erhitzung karamelisiert Dextrose in der Lösung 4.3. Hammelblut ("sheep red blood cells", SRBC) Das Blut wird vom Schaf unter sterilen Bedingungen durch Punktion der Vena jugularis entnommen und unter leichtem Schütteln zu gleichen Teilen mit Alseverlösung in einem sterilen Gefäß (im geschlossenen System) aufgefangen. Ein Zusatz von Penicillin ( IE/l) kann die Haltbarkeit erhöhen. Das konservierte Hammelblut ist bei +5 C ± 3 C ca. drei Wochen haltbar Ambozeptor Der Ambozeptor wird käuflich erworben und vor erstmaligem Gebrauch jeder Charge ausgewertet. Bei Titerverlust empfiehlt sich eine erneute Auswertung Komplement Das Komplement ist ein Mischserum von gesunden Meerschweinchen, die vor dem Entbluten 24 Stunden nicht gefüttert werden. Es kann portioniert bei -21 C ±3 C aufbewahrt werden. Vor jeder KBR wird eine Komplementauswertung vorgenommen. Witte-Lösung (Kalium-Borlösung) zur Konservierung von Meerschweinchenkomplement Kaliumsulfat 10,0 g Borsäure 4,0 g Aqua bidest. ad 100,0 ml 1 h bei 100АC im Dampftopf lösen, Komplement und Konservierungslösung werden zu gleichen Teilen gemischt. Der Verdünnungsfaktor des Komplements muss beim Ansatz (Komplementauswertung FLI 154
156 und Hauptversuch) berücksichtigt werden. Haltbarkeit bei geringem Titerabfall ca. acht Wochen. Alle Reagenzien sind auch kommerziell erhältlich und sollten möglichst aus einer Hand bezogen werden. Auf diesem Weg können die ansonsten sehr umfangreichen (s. o.) Vorarbeiten deutlich minimiert werden, was zu wesentlichen Kostenersparnissen (v.a. Personalkosten) führt! 5. Durchführung 5.1. Antigen Antigen ist in der vom Hersteller angegebenen Gebrauchsverdünnung zu verwenden Kontrollsystem Kontrollseren: In jedem Ansatz wird ein dem Antigen homologes positives (mit definiertem Titer bzw. Angabe von Sens.E./ml) sowie ein antikörperfreies, d. h. negatives Kontrollserum mitgeführt. Resuspendierte Seren können portioniert bei -21АC Б3АC gelagert werden. Serumkontrolle für jedes mitgeführte Serum (SK) Antigenkontrolle (AK) Komplementkontrolle (CK) Hämolytisches System-Kontrolle (HS-K) 5.3. Serumproben und Antigen auf Raumtemperatur erwärmen 5.4. Inaktivierung der Seren Vor der Untersuchung sind alle zu untersuchenden Proben einschließlich Kontrollseren im Wasserbad in entsprechender Verdünnung wie folgt zu inaktivieren: B.abortus/ B.melitensis/ B.suis Serumverdünnung Tierart Temp. (АC) Zeit (min) 1:5 Rd., Pfd., Meerschw., Wildwdk., Hasen, Schaf, Ziege, Schwein, Wildschwein B. ovis 1:5 und 1:10 Schafe Verunreinigte und hämolytische Seren sind zur Untersuchung nicht geeignet. FLI 155
157 5.5. Hämolytisches System (HS) Das mit Alseverlіsung versetzte Hammelblut wird 3- bis 5-mal in VBD gewaschen (bis die überstehende Flüssigkeit wasserklar ist), dazu jedes Mal 10 Minuten bei 1000 g zentrifugieren, den Überstand verwerfen und das Erythrozytensediment mit VBD aufschwemmen. Aus dem gewaschenen Erythrozytensediment wird eine 1- bis 2%ige Suspension hergestellt. Zum Gebrauch wird diese mit gleichem Volumen eines gebrauchsfertig verdünnten Ambozeptors vermischt. Bei getrennter Aufbewahrung von Erythrozytensuspension und Ambozeptorverdünnung können diese bis zu 48 h nach Herstellung verwendet werden. 6. Ambozeptorauswertung 6.1. Herstellung einer 2%igen Erythrozytensuspension (siehe. 5.5.) 6.2. Ansatz folgender geometrischer Verdünnungsreihen des Ambozeptors: Röhrchen : : : n Reihe A) 1: : : : Reihe B) 1:750 1: : : : Ausgangsverdünnung 1:500 (z. B. 0,2 ml Ambozeptor + 99,8 ml VBD) Vorlage von 5 ml VBD für Reihe A ab Röhrchen 2, für Reihe B ab Röhrchen 1 für Reihe A dem 1. und 2. Röhrchen 5 ml Ambozeptorverdünnung zufügen und ab Röhrchen 2 durch fortlaufendes Überpipettieren von jeweils 5 ml die weiteren Verdünnungen anlegen für Reihe B dem 1. Röhrchen 10 ml Ambozeptorverdünnung zufügen und durch fortlaufendes Überpipettieren vom jeweils 5 ml weitere Verdünnungen anlegen beide Titrationsreihen zu einer Verdünnungsreihe zusammenfügen 6.3. Durchführung der Ambozeptorauswertung Tabelle 4: Ansatzschema der Ambozeptorauswertung Röhrchen Amb.-Verd. VBD Erythr.-Susp. Kompl. 1:20 (0,5 ml) (ml) (ml) (ml) 1 1:500 1,0 0,5 0,5 2 1:750 1,0 0,5 0,5 3 1:1000 1,0 0,5 0,5 : : : : : : : : : : : : : : : n 1: ,0 0,5 0,5 FLI 156
158 Kontrollen a) Erythrozytenkontrolle: 0,5 ml Erythrozytensuspension 2,0 ml VBD b) Komplementkontrolle: 0,5 ml Erythrozytensuspension 0,5 ml Komplement 1:20 1,5 ml VBD c) Ambozeptorkontrolle: 0,5 ml Erythrozytenkontrolle 0,5 ml Ambozeptorverdünnung 1,5 ml VBD schütteln, Inkubation 30 bei +37 C ± 1 C im Wasserbad 6.4. Bewertung Ermittelt wird die höchste Ambozeptorverdünnung, die noch eine komplette Hämolyse bewirkt. Sie gilt als Ambozeptoreinheit (AE). Die Gebrauchsverdünnung beträgt 4 Einheiten, also die vierfache Konzentration. Beispiel: 1 AE = 1:6000 Gebrauchsverdünnung = 1:1500 Die Kontrollen dürfen keine Hämolyse aufweisen. 7. Komplementauswertung Die Komplementauswertung dient der Feststellung der Komplementgebrauchsdosis für den Hauptversuch in Gegenwart der entsprechenden Antigengebrauchsverdünnung. Zum Vergleich wird eine zweite Reihe angesetzt, bei der das Antigenvolumen durch VBD ersetzt ist Durchführung Das Komplement wird an jedem Untersuchungstag in 8 Konzentrationsstufen in der Wärmebindung geprüft. In der Tabelle 5, Teil 1, ist die Herstellung der 8 Verdünnungsstufen dargestellt. Tabelle 5: Komplementauswertung, Teil 1 Kompl. 1:10 Komplementkonzentration (%) 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 (ml) 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 VBD (ml) 1,9 1,8 1,7 1,6 1,5 1,4 1,3 1,2 Die weiteren Arbeitsschritte sind in der Tabelle 5, Teil 2, erklärt. FLI 157
159 Tabelle 5: Komplementauswertung, Teil 2 Reihe 1 Reihe 2 Komplement je Verd.-Stufe (ml) 0,5 0,5 Antigengebrauchsverdünnung (ml) - 0,5 VBD (ml) 1,0 0,5 - schütteln, Wasserbad 60 bei +37 C ± 1 C HS (ml) 1,0 1, Bewertung Es wird das Röhrchen mit der niedrigsten Komplementkonzentration bestimmt, das eine komplette Hämolyse aufweist. Die Gebrauchsverdünnung für den Hauptversuch ist die folgende höhere Konzentration. Beispiel: komplette Hämolyse = 2,0 % Gebrauchsdosis = 2,5 % 8. Hauptversuch 8.1. Ansatz In der Tabelle 6 werden die Arbeitsschritte für eine Probe und ein Antigen als Modell dargestellt. Tabelle 6: Hauptversuch Cup Arbeitsschritte : : : VBD (µl) : : : Serum (µl) : : : Titration des Serums von 1 nach 10 und von 11 nach 12 (verwerfen von 25 µl aus den Cups 10 u. 12) 4. VBD (µl) : : : Antigen (µl) : : : Komplement (µl) : : : abgedeckte Platte 18 bis 24h bei +5 C ± 3 C inkubieren und auf Raumtemperatur erwärmen* ) 8. HS (µl) : : : Inkubation 30 bei +37 C ±1 C im Wasserbad oder im Brutschrank in einer feuchten Kammer * ) Beschälseuche-KBR: Inkubation 60 bei +37 C ± 1 C im Brutschrank in einer feuchten Kammer FLI 158
160 8.2. Kontrollen Bei der Durchführung des Hauptversuches sind jeweils folgende Kontrollansätze mitzuführen: a. Kontrolle der antikomplementären Wirkung des Serums (Serumkontrolle), angesetzt in den beiden Anfangsverdünnungen (Cup 11 und 12) Serumverdünnung : 25 µlbd : 25 µl Komplement : 25 µl HS : 50 µl Bewertung : 100 % Hämolyse b. Kontrollen des Antigens VBD : 25 µl Antigen : 25 µl Komplement : 25 µl HS : 50 µl Bewertung : 100 % Hämolyse c. Kontrollen des Komplements VBD : 50 µl Komplement : 25 µl HS : 50 µl Bewertung : 100 % Hämolyse d. Kontrolle des Hämolytischen Systems (HS) VBD : 75 µl HS : 50 µl Bewertung : 0 % Hämolyse e. Positives Kontrollserum Serumverdünnung : 25 µl Antigen : 25 µl Komplement : 25 µl HS : 50 µl Bewertung : definierter Titer ± 1 Titerstufe, bei standardisierten Seren = Berechnungsgrundlage für die Sensibilisierungseinheiten/ml f. Negatives Kontrollserum Serumverdünnung : 25 µl Antigen : 25 µl Komplement : 25 µl HS : 50 µl Bewertung : 100 % Hämolyse (jede Serumverdünnung) FLI 159
161 9. Auswertung Bei der Ablesung wird unterschieden: 100 % Hämolysehemmung = 4 (++++) 75 % Hämolysehemmung = 3 (+++) 50 % Hämolysehemmung = 2 (++) 25 % Hämolysehemmung = 1 (+) keine Hämolysehemmung = negativ Bewertung: 20 sens.e./ml = positiv B. ovis: 50 sens.e./ml bezogen auf das Nationale Referenzserum. Dieses ist eingestellt am internationalen Brucella ovis Standardserum (Weybridge). C) Arbeitsanleitung zur Durchführung des Rose-Bengal-Tests (RBT) 1. Geräte Zentrifuge Kühlschrank (+5 C ± 3 C) Tiefkühlschrank (-21 C ± 3 C) Kolbenhubpipetten (10 µl µl) nach DIN/ISO 9001 Tafelwaage 2. Gebrauchsmaterialien Tüpfelplatten (eben oder mit Vertiefungen) Glasstäbe Pipettenspitzen nach DIN/ISO 9001 RBT-Antigen, zugel. nach 17c TierSG Brucellose-Kontrollserum, positiv, zugel. nach 17c TierSG Brucellose-Kontrollserum, negativ, zugel. nach 17c TierSG 3. Durchführung 3.1. Kontrollsystem In jedem Ansatz wird ein Brucellose-Kontrollserum, positiv, und ein Brucellose- Kontrollserum, negativ, mitgeführt. Resuspendierte Seren können portioniert bei - 21 C ± 3 C gelagert werden Serumproben und Antigen auf Raumtemperatur erwärmen 3.3. Übertragen von Serum auf Tüpfelplatten: 25 µl auf Platten mit Vertiefung, 30 µl auf ebene Platten µl bzw. 30 µl Antigen jedem Serum hinzufügen. Das Volumen des Antigens muss dem Volumen des Serums entsprechen. FLI 160
162 3.5. Serum und Antigen mit Glasstab mischen 3.6. Serum-Antigen-Gemisch 4' kreisend schwenken 4. Ablesen der Reaktionen - Positive Reaktion Bildung von Agglutinaten jeder Reaktionsstärke innerhalb der Beobachtungszeit - Negative Reaktion Serum-Antigen-Gemisch bleibt innerhalb der Beobachtungszeit homogen rot gefärbt - Positive Kontrolle Agglutination - Negative Kontrolle Serum-Antigen-Gemisch bleibt innerhalb der Beobachtungszeit homogen rot gefärbt Brucella abortus-antigen für die SLA, amtl. Zulassungsnummer BFAV-B370, kommerziell erhältlich Brucella abortus-antigen für die KBR, amtl. Zulassungsnummer BFAV-B371, kommerziell erhältlich Brucellose-Kontrollserum, positiv, amtl. Zulassungsnummer BFAV-K076, kommerziell erhältlich RBT-Antigen, amtl. Zulassungsnummer BFAV-B368, kommerziell erhältlich Zusätzlich wird vom FLI ein positives und ein negatives Nationales Referenzserum für Brucellose bereitgestellt. Nähere Auskünfte: FLI, NRL Brucellose, Naumburger Str. 96a, D Jena Tel.: +49 (0) Anhang 3 Nachweis von Brucella spp. genusspezifischer DNA mittels der Primer B4 und B5 aus Kulturmaterial (nach Baily et al., 1992) 1. Arbeitsvorschrift 1.1. Material Verdächtige Kolonie direkt von Platte picken und in Eppendorf-Tube in ca. 200 µl PCR-Grade Wasser einbringen und für 2 h bei 90 C im Thermoschüttler schütteln (Abtötung und Zellaufschluss) Tabelle 1: Primer B4 B5 Nukleotidsequenz 5'-3' TGG-CTC-GGT-TGC-CAA-TAT-CAA CGC-GCT-TGC-CTT-TCA-GGT-CTG FLI 161
163 Tabelle 2: PCR Mastermix Je Probe Thermocycler-Programm Wasser 18,3 µl "BRUC" 10x PCR-Puffer 2,5 µl 93 C 5 min, 35 x (90 C 1 min, dntp 10mM 1 µl 60 C 1 min, 72 C 1 min), Primer B4 10 pmol/µl 1 µl 72 C 5 min Primer B5 10 pmol/µl 1 µl Taq-DNA-Polymerase 5U/µl 0,2 µl Template 1 µl 1.2. Ergebnis und Kontrolle Bei jedem Ansatz wird eine Negativ-Kontrolle (Wasser statt DNA) und mind. eine Positiv-Kontrolle (DNA von Referenzstamm) mitgeführt. Die Analyse der PCR- Produkte erfolgt nach ihrer Größe (siehe Tabelle 3) in einem 1,5%igen Agarose-Gel. Tabelle 3: Größe des Fragmentes Ergebnis B4/B5 223 bp Brucella ssp. nachgwiesen Die Positivkontrollen müssen positiv entsprechend ausfallen, die Negativ-Kontrolle bei der PCR muss negativ sein. Literatur Alton, G.G., L.M. Jones, R.D. Angus, J.M. Verger (1988): Techniques for the Brucellosis Laboratory. Institute National de la Recherche Agronomique (INRA), Paris. Baily GG, Krahn JB, Drasar BS, Stoker NG.: Detection of Brucella melitensis and Brucella abortus by DNA amplification. J Trop Med Hyg Aug; 95(4): Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2004: FLI 162
164 18. Campylobacteriose (thermophile Campylobacter) Charakterisierung der Infektion Erreger Campylobacter bilden mit den Gattungen Arcobacter und Sulfospirillum die Familie Campylobacteraceae innerhalb der Ordnung der Campylobacterales der Epsilon- Proteobakterien. Das Genus Campylobacter besteht gegenwärtig aus 17 Spezies und 6 anerkannten Subspezies. Neben dem mikroaerophilen Metabolismus zeichnen sich Campylobacter-Isolate durch die Unfähigkeit, Kohlenhydrate zu verwerten sowie ihren geringen (Guanin + Cytosin)-Gehalt aus. Campylobacter sind zarte, Gram-negative, spiralig gewundene Stäbchen (0,5-8 µm lang und 0,2-0,5 µm breit), die unter Sauerstoff-Einwirkung oder bei Alterung der Kulturen auch kokkoide oder sphäroide Gestalt annehmen können. Sie sind keine Sporenbildner und besitzen in der Regel je eine mono- oder bipolar angeordnete Geißel, woraus die Beweglichkeit des Mikroorganismus resultiert. Die Wachstumstemperatur ist ein hilfreiches Differenzierungskriterium. Die Spezies C. jejuni, C. coli, C. lari und C. upsaliensis werden aufgrund ihres Wachstumsoptimums bei 42oC als thermophile Campylobacter bezeichnet. Campylobacter-Spezies sind ubiquitär verbreitet und kolonisieren die Schleimhäute des Intestinaltrakts, die Mundschleimhaut oder den Urogenitaltrakt bei Tier und Mensch. Verschiedene Spezies sind pathogen und führen zu Erkrankungen sowohl beim Tier als auch beim Menschen. 12 der 17 Campylobacter-Spezies sind mit humanen Erkrankungen assoziiert. Unter diesen Spezies besitzen die thermophilen C. jejuni und C. coli als wichtigste Erreger der Campylobacter-Enteritis (Campylobacteriose) die größte gesundheitspolitische Bedeutung. Die Campylobacteriose ist eine Zoonose, die im Gegensatz zum Menschen bei Vögeln, Geflügel und vielen Säugetieren meist asymptomatisch verläuft Klinische Symptomatik Thermophile Campylobacter gehören weltweit zu den häufigsten Verursachern bakteriell bedingter Durchfall-erkrankungen beim Menschen. Dabei reicht das klinische Spektrum von asymptomatischen Infektionen über wässrige bis zu schweren blutigen Durchfällen. Symptome eines akuten Abdomens werden beobachtet. Die Erkrankung verläuft meist selbstlimitierend, allerdings können Personen, die nicht antibiotisch behandelt worden sind, über 2-4 Wochen infektiös sein. Eine Campylobacteriose steht vielfach auch am Beginn der Ausbildung des Guillain-Barre- Syndroms, einer neurodegenerativen Erkrankung. Als Hauptquelle humaner Infektionen gelten Geflügelprodukte, aber auch Rind, Schwein, Hund und Katze stellen ein Keimreservoir dar. Campylobacter coli wurde bei einer Vielzahl warmblütiger Tiere gefunden und kommt häufig als Kommensale beim Schwein vor. Dieser Mikroorganismus wird beim Menschen mit Gastroenteritis und Septikämie in Verbindung gebracht. Bei Geflügel wird er als Ursache einer hepato-enteralen Erkrankung betrachtet. Campylobacter jejuni nutzt ein sehr breites Wirtsspektrum. Das Bakterium kommt häufig in verschiedenen Geflügelarten vor, wurde in vielen Säugetierarten festgestellt, aber auch in Insekten. Beim Menschen führt eine Infektion mit C. jejuni meist FLI 163
165 zu einer Gastroenteritis, aber auch Meningitis, Abort oder Proktitis sind beschrieben worden. Beim Nutzgeflügel treten enterale und hepato-enterale Erkrankungsformen auf, bei Säugern wurden zusätzlich Aborte bei verschiedenen Spezies beschrieben. Campylobacter lari wurde im Intestinaltrakt verschiedener Seevögel, Säugetiere, aber auch in Muscheln nachgewiesen. Es sind keine Beziehungen zu Erkrankungen bei Tieren bekannt. Beim Menschen kann C. lari Enteritis und Septikämie verursachen. Campylobacter upsaliensis wurde bisher bei Hund, Katze, Ente und Mensch nachgewiesen. Die Spezies wird häufiger bei Hunden als bei Katzen nachgewiesen. In beiden Arten kann C. upsaliensis eine Gastroenteritis auslösen. Beim Menschen sind folgende Erkrankungen durch C. upsaliensis beschrieben worden: Enteritis, Septikämie, Abszess, Abort Zuständige Untersuchungseinrichtungen Zuständig für die Untersuchung auf thermophile Campylobacter sind die jeweiligen Landesuntersuchungsämter. Am BfR ist das NRL für Campylobacter etabliert, welches sich vornehmlich mit Untersuchungen von Campylobacter im Zusammenhang mit der Lebensmittelproduktion und dem Handel beschäftigt (Leiter: Dr. Lüppo Ellerbroek). Am FLI wurde das NRL für Campylobacteriose (thermophile Campylobacter) errichtet. Gegenstand der Arbeiten sind u. a. Ausarbeitung, Aktualisierung von methodischen Empfehlungen zur Labordiagnostik Untersuchungen zur Prävalenz von Campylobacter in Tierbeständen Untersuchungen zu Virulenzfaktoren thermophiler Campylobacter Erarbeitung von Kontrollstrategien zur Reduktion der Campylobacter-Belastung in Beständen Rechtsgrundlagen Campylobacteriosen bei verschiedenen Tierarten, verursacht durch die thermophilen Spezies C. jejuni, C. coli, C. lari und C. upsaliensis sind meldepflichtig (Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005). FLI 164
166 18.2. Untersuchungsmaterial Untersuchungsmaterial für den Erregernachweis Als Untersuchungsmaterial finden neben kultivierten Bakterienkulturen auch Materialien wie Milch, Kotproben oder Kloakentupfer Verwendung Beförderung der Proben Wegen der Empfindlichkeit der Campylobacter gegenüber Sauerstoff sollten für den Transport spezielle Transport-Medien Verwendung finden (z. B. Amies Agar Gel with Charcoal) Untersuchungsgang Erregernachweis Der Erregernachweis aus den unterschiedlichen Ausgangsmatrizes erfolgt nach den Festlegungen von ISO :2006: Microbiology of food and animal feeding stuffs -- Horizontal method for detection and enumeration of Campylobacter spp. -- Part 1: Detection method and Part 2: Colony-count technique. Diese ISO-Norm ist eigentlich gedacht für die Untersuchung von Produkten, die für die menschliche Ernährung oder als Tierfutter Verwendung finden. Sie gilt auch für Umwelt-proben aus dem Bereich der Nahrungsmittelproduktion und Proben aus dem Handel. Sie wird aber auch zum Nachweis von Campylobacter aus oben beschriebenen Matrizes verwendet. Die Anzucht der thermophilen Campylobacter-Spezies erfolgt über einen Anreicherungsschritt in Bolton-Bouillon durch Kultivierung auf mccd-agar. Die Einzelheiten sind in der DIN beschrieben. Anschließend werden die Campylobacter-Isolate phänotypisch und molekularbiologisch charakterisiert. In den meisten konventionellen biochemischen Tests sind Campylobacter relativ inaktiv und es gibt keine geeigneten Methoden, die eine einfache Differenzierung aller Spezies ermöglichen. Die Tests zur Differenzierung sind bisher nur teilweise standardisiert und in der Literatur weit verstreut (On, 1996). Methodische Hinweise zur Durchführung und Bewertung der Reaktionen finden sich bei Lander u. Gill (1985) sowie Nachamkin (1999). Die Anwendbarkeit kommerzieller Differenzierungssysteme (z. B. API Campy, bio Merieux) wird unter-schiedlich bewertet. Diese Systeme erreichen aber nicht die Aussagekraft konventioneller Tests. FLI 165
167 Identifizierung von Campylobacter-Spezies Wuchsformen: In der Primärkultur wachsen Campylobacter sp. nach 2-5-tägiger Inkubation beeinflusst durch die Feuchtigkeit des Nährmediums in zwei Wuchsformen als flache, grau-glänzende Kultur mit Neigung zum Schwärmen und Zusammenfließen oder als runde, konvexe, glatte, glänzende Einzelkolonien von 1 3 mm Durchmesser. Auf Blutagar ist keine Hämolyse nachweisbar. Oxidase-Reaktion: Es stehen handelsübliche Oxidase-Teststreifen zur Verfügung, z. B. Bactident Oxidase-Test-Strips. Campylobacter-Spezies reagieren positiv. Bei positiver Reaktion verfärbt sich das Koloniematerial in 5 bis 10 Sek. ultramarinblau. Nativpräparat: Campylobacter sp. sind beweglich und zeigen im Phasenkontrastmikroskop eine typische, schießende Beweglichkeit, die bei Subkultivierung verloren gehen kann. Gramfärbung: Im Grampräparat handelt es sich um gramnegative, dünne, gebogene Stäbchen, 0,3 0,4 µm breit und 0,5 8,0 µm lang. Kurze Formen (kommaförmig), mittlere Formen (S-förmig) und lange Formen (spiralförmig mit mehreren Windungen) können gleichzeitig in einer Kultur beobachtet werden Phänotypische Differenzierung von Campylobacter-Isolaten Da Campylobacter sp. anspruchsvolle Keime sind, können bereits geringfügige Änderungen der Medienzusammensetzung die Differenzierungsergebnisse beeinflussen. Es müssen daher Kontrollstämme entsprechender Spezies parallel mitgeführt werden (Tab. 1). Die wichtigsten kulturellen und biochemischen Merkmale von Campylobacter-Arten zeigt Tabelle 2. Katalase-Probe: Auf einen Objektträger wird ein Tropfen einer 3%igen Wasserstoffperoxidlösung gegeben und in diesem mit der Öse Koloniematerial verrieben. Bei positiver Reaktion tritt nach wenigen Sekunden eine starke Bläschenbildung ein. H 2 S-Nachweis: Triple-Sugar-Iron (TSI)-Agar wird mit 48 h altem Kulturmaterial beimpft und 2 d bei 37 C mikroaerob bebrütet. Die positive Reaktion führt zu einer Schwärzung des Agar. Natrium-Selenit-Reduktion: Nährbouillon (z. B. Nr. 2 von Oxoid) mit Zusatz von 0,1 % Natriumselenit wird mit Kulturmaterial beimpft und 4 d bei 37 C mikroaerob bebrütet. Jede, noch so geringgradige Rotfärbung gilt als positive Reaktion. FLI 166
168 Kochsalztoleranz: Thioglykolatbouillon oder Blutagar, jeweils mit einem Gehalt von 3,5 % NaCl, werden mit Kulturmaterial beimpft, 3 4 Tage bei 37 C mikroaerob bebrütet und auf Wachstum (Trübung) kontrolliert. Glycintoleranz: Thioglykolatbouillon oder Blutagar, jeweils mit einem Gehalt von 1 % Glycin, werden mit Kulturmaterial beimpft, 3 4 Tage bei 37 C mikroaerob bebrütet und auf Wachstum (Trübung) kontrolliert. Nalidixinsäure-Resistenz: Der Test wird in der üblichen Weise auf Mueller-Hinton-Agar mit Nalidixinsäure- Test-blättchen (30 µg) angesetzt und nach 4 Tagen mikroaerober Inkubation bei 37 C abgelesen. Eine Hemmzone von wenigstens 3 mm um das Testblättchen zeigt, dass der Stamm sensitiv ist. Auf Grund der ansteigenden Quinolonresistenz bei C. jejuni und C. coli ist die Aussagekraft dieser Reaktion stark eingeschränkt. Cephalotin-Resistenz: Der Test wird mit Cephalotin-Testblättchen (30 µg) in Analogie zur Prüfung auf Nali-dixinsäure-Resistenz angesetzt und ausgewertet. Hippurat-Hydrolyse: Für die Durchführung dieser Reaktion sind zahlreiche Modifikationen beschrieben. Zur Bewertung der Reaktion ist es erforderlich, einen positiven (C. jejuni) und negativen Kontrollstamm (C. coli) mitzuführen. Folgendes Vorgehen hat sich bewährt: Ein Filter-papierstreifen wird mit 1%iger, frischer Natriumhippuratlösung getränkt (Lösung kann portioniert werden und ist bei 18 C sechs Monate haltbar). Die zu differenzierenden Isolate werden in 2 3 cm Abständen knöpfchenförmig auf die Papieroberfläche aufge-rieben. Nach 3-stündiger Inkubation bei 37 C in der feuchten Kammer werden einige Tropfen 3,5%iger frischer Ninhydrinlösung aufgetragen und die Reaktion nach 15- bis 45-minütiger Einwirkungszeit in Abhängigkeit von der Färbung der Negativkontrolle abgelesen (Ninhydrin-Reagens: 350 mg Ninhydrin in 10 ml Aceton-Butanol-Mischung (1 :1)). Die positive Reaktion ist durch eine Dunkelpurpurverfärbung der Bakterien und des Papiers um die aufgetragene Probe herum gekennzeichnet (Hofbildung). Die Negativkontrolle zeigt eine schmutzig-graue Färbung ohne Hofbildung. Indoxylazetat-Hydrolyse: Es wird eine 10%ige Indoxylazetatlösung in Azeton hergestellt, auf Teststreifen gegeben, Koloniematerial aufgebracht und ein Tropfen steriles Aqua dest. zugegeben. Die positive Reaktion zeigt sich nach 5-10 min als tiefblaue Färbung. Temperaturtoleranz: Die Prüfung kann auf Blutplatten oder in Bouillonkulturen erfolgen. Es ist 2 d (42 C) bzw. 5 d (25 C) mikroaerob im Brutkühlschrank zu inkubieren und das Wachstum zu kontrollieren. FLI 167
169 Tabelle 1: Campylobacter-Typ und -Referenzstämme Spezies Typ/Ref. Herkunft C. fetus ssp. venerealis Typ NCTC C. fetus ssp. fetus Typ DSMZ 5361 C. sputorum biovar sputorum Typ DSMZ 5363 (alte Bezeichnung: Biovar bubulus) C. sputorum biovar fecalis Ref. NCTC C. jejuni ssp. jejuni Typ DSMZ 4688 C. jejuni ssp. doylei Typ NCTC C. coli Typ DSMZ 4689 C. lari Typ DSMZ C. upsaliensis Typ DSMZ 5365 C. helveticus Typ NCTC Literatur Lander, K. P. u. Gill, K. P. W. (1985): Campylobacters. In: C. H. Collins and J. H. Grande (eds.). Isolation and identification of microorganisms of medical and veterinary importance. London, Acad. Press. p Nachamkin, I. (1999): Campylobacter and Arcobacter. In: Manual of Clinical Microbiology. 7 th Edition. Eds. Murray, P.R., Baron, E.J., Pfaller, M. A., Tenover, F. C. u. Yolken, R. H. Am. Soc. Microbiol., Washington, D. C On, S. L. W. (1996): Identification methods for Campylobacters, Helicobacters, and related organisms. Clin. Microbiol. Rev. 9, On, S. L. W., Atabay, H. I., Corry, J. E. L., Harrington, C. S. u. Vandamme, P. (1998): Emended description of Campylobacter sputorum and revision of its infrasubspecific (biovar) divisions, including C. sputorum biovar paraureolyticus, an urease-producing variant from cattle and humans. Int. J. System. Bacteriol. 48, Ursing, J. B., Lior, H. u. Owen, R. J. (1994): Proposal of minimal standards for describing new species of the family Campylobacteraceae. Int. J. System. Bacteriol. 44, Vandamme, P. u. De Ley, J. (1991): Proposal for a new family, Campylobacteraceae. Int. J. System. Bacteriol. 41, FLI 168
170 Tabelle 2: Kulturelle und biochemische Merkmale von Campylobacter spp. (Nachamkin, 1999; Vandamme und De Ley, 1991; Ursing et al., 1994; On et al., 1998) Spezies C. jejuni Katalase Reduktion Na- Sele- Nitrat Nitrit H 2S (TSI) nit-reduktion Hydrolyse Toleranz gegen Resistenz gegen Wachstum Hippurat Indoxylazetat Kochsalz 3,5 % Glycin 1 % Nalidixinsäure Cephalothin 25 C 42 C ssp. jejuni S R ssp. doylei v v S S C. coli S R C. lari R R C. upsaliensis -/ v S S C. helveticus S S C. fetus ssp. fetus R S ssp. venerealis R S C. sputorum biovar sputorum V + R/S S + - biovar fecalis V + R S + - biovar - +/V +/V R R/V paraureolyticus 1) C. hyointestinalis R S + + v C. concisus R R - + C. mucosalis R S C. curvus S C. rectus S - + C. showae v R S H 2 erforderlich V = variabel, unterschiedliche Reaktion = schwache Reaktion TSI= Triple-Sugar-Iron-Agar 1) Urease-positiv FLI 169
171 Molekularbiologische Identifizierung von Campylobacter jejuni und Campylobacter coli Zur molekularbiologischen Identifizierung von Campylobacter jejuni und Campylobacter coli hat sich eine Multiplex-PCR bewährt (Denis, M., J. Refregier- Petton, M.-J. Laisney, G. Ermel und G. Salvat (2001) Campylobacter contamination in French chicken production from farm to consumers. Use of a PCR assay for detection and identification of Campylobacter jejuni and Campylobacter coli, J. Appl. Microbiol. 91, ). Ausgangsmaterial können Campylobacter-Kulturen, aber auch Milch- oder Kotproben sein. Im ersten Schritt wird die Campylobacter-DNA durch Extraktion mit kommerziell erhältlichen DNA-Extraktionskits nach Angaben der Hersteller gewonnen. Die Multiplex-PCR wird unter folgenden Bedingungen durchgeführt: Pro 50 µl Ansatz werden die folgenden Lösungen als Mastermix (Tabelle 3) in der beschriebenen Reihenfolge eingesetzt. Die Mengen gelten für den Einsatz von 1 µl Template einer DNA-Extrakt-Konzentration von ca. 100 ng/µl. (Bei geringerer DNA-Ausbeute der Extraktion können 2-5 µl eingesetzt werden; entsprechend weniger Wasser ist zu verwenden.) Tabelle 3: Zusammensetzung des Mastermix zur Verwendung in der Multiplex-PCR Komponenten Volumen Endkonzentration steriles Wasser ad l PCR-Pufferlösung (10-fach), enthaltend c = 15 mmol/l MgCl 2 5 l PCR-Puffer einfach, enthaltend c = 1,5 mmol/l MgCl 2 Desoxynukleosidtriphosphat-Mix 2 l je 200 mol/l (datp, dctp, dgtp, dttp) Primer MD 16S1/S2 je 1 l 0,125 mol/l Primer MD mapa1 /A2 je 1 l 0,5 mol/l MD COL2/COL3 Taq-DNA-Polymerase 0,2 l 1 U pro Reaktionsansatz Zum Ausschluss einer PCR-Inhibition sind externe Amplifikationskontrollen (DNA der Typstämme C. jejuni DSMZ 4688 und C. coli DSMZ 4689) mitzuführen. Tabelle 4 gibt eigene Details zum PCR-Assay an. FLI 170
172 Tabelle 4: Target-Gene und Primersequenzen der Multiplex-PCR Target Primer Primersequenz (5`- -3 ) Amplikon Spezifität 16SrRNA MD16S1 ATC TAA TGG CTT AAC CAT TAA AC 857 bp Genus MD16S2 GGA CGG TAA CTA GTT TAG TAT T Campylobacter mapa MDmapA1 CTA TTT TAT TTT TGA GTG CTT GTG 589 bp C. jejuni MDmapA2 GCT TTA TTT GCC ATT TGT TTT ATT A ceue COL 3 AAT TGA AAA TTG CTC CAA CTA TG 462 bp C. coli MDCOL2 TGA TTT TAT TAT TTG TAG CAG CG Folgendes Temperatur-Zeit-Programm wird für die Multiplex-PCR verwendet: Inititiale Denaturierung der DNA: 60 Sek. bei 95 C 35-maliger Durchlauf des folgenden Zyklus: 30 Sek. bei 95 C (Denaturierung) 90 Sek. bei 59 C (Annealing) 60 Sek. bei 72 C (Elongation) abschließende Elongation: 5 min bei 72 C. Die PCR-Produkte werden auf einen 1,5%igem Agarose-Gel charakterisiert. C. jejuni und C. coli gelten als identifiziert, wenn in der PCR das Genus-spezifische Ampli-kon (857 bp) und das Spezies-spezifisches Amplifikat (589 bp für C. jejuni bzw. 462 bp für C. coli) detektiert werden. Für alle thermophilen Campylobacter-Arten sind in der Literatur spezifische und real-time -PCRs beschrieben; diese Methoden wurden allerdings vom NRL nicht validiert. FLI 171
173 19. Echinokokkose Charakterisierung der Infektion Erreger Die Echinokokkose wird durch Zestoden der Gattung Echinococcus hervorgerufen die zystische Echinokokkose durch den Kleinen Hundebandwurm (E. granulosus s.l.) und die alveoläre Echinokokkose durch den Kleinen Fuchsbandwurm (E. multilocularis). E. oligarthrus und E. vogeli kommen in Zentral- und Südamerika vor, Infektionen beim Menschen sind sehr selten. Die Taxonomie des E. granulosus s.l. ist derzeit im Umbruch begriffen. Eine Abgrenzung des früher als Rinderstamm bezeichneten E. ortleppi (Genotyp G5) und des so genannten Pferdestammes E. equinus (Genotyp G4) hat sich inzwischen weitgehend durchgesetzt. Die Gattung Echinococcus ist durch einen obligaten Wirtswechsel charakterisiert, bei dem die geschlechtsreifen, sehr kleinen Bandwürmer im Dünndarm von Endwirten (Fleischfresser, in Europa vor allem Hundeartige, selten Katzen) parasitieren, während sich das Larvenstadium in Organen von Zwischenwirten (meist Nagetiere und Schafe sowie Tiere, die den Endwirten als Nahrung dienen) entwickelt. Der Mensch kann als Fehlwirt von dem Larvenstadium befallen werden. E. granulosus s.l. ist ein 4 bis 7 mm langer Bandwurm (Cestoda) mit häkchenbesetztem Skolex, er besteht typischerweise aus 3 (2 bis 6) Gliedern (Proglottiden). Diese enthalten einen mit seitlichen Aussackungen versehenen Uterus, der in reifem Zustand bis zu Eier beherbergt. Die eigefüllten reifen Endglieder lösen sich vom Wurm ab und werden mit dem Kot ausgeschieden. Nach oraler Aufnahme der Eier durch den Zwischenwirt bilden sich Larven, die in der Regel hämatogen in die Leber, aber auch in die Lunge und sehr selten in andere Organe gelangen und dort verbleiben. Es bildet sich eine Zyste (Hydatide), die einen Durchmesser von einigen Dezimetern erreichen kann. Im Gegensatz zur alveolären Echinokokkose induziert die zystische Echinokokkose die Bildung einer wirtsseitigen Bindegewebskapsel. Die Zystenwand besteht aus mehreren Schichten einer äußeren Bindegewebsschicht, die vom Wirt gebildet wird, einer laminierten Membran (Cuticula) und einer Keimschicht. Aus der Keimschicht entwickeln sich Knospen (Brutkapseln), in denen sich die Protoscolices (Kopfanlagen) entwickeln. E. granulosus ist weltweit verbreitet. In Europa kommt der Parasit vor allem in Mittelmeerländern und auf dem Balkan vor, wo die Schafhaltung von großer Bedeutung ist. Hauptendwirt von E. granulosus ist der Hund, selten die Katze. Nach Fressen von rohen larvenhaltigen Innereien entwickeln sich beim Hund die adulten Bandwürmer. Wiederkäuer (vor allem Schafe) dienen als Zwischenwirt. Sie nehmen die Eier beim Grasen auf kontaminierten Weiden auf. E. multilocularis ist ein 2 bis 4 mm langer Bandwurm (Cestoda), der typischerweise 5 (2 bis 6) Glieder (Proglottiden) aufweist und einen sackförmigen Uterus, der ca. 200 Eier enthält, besitzt. Zwischen- und Fehlwirte infizieren sich durch orale Aufnahme der Eier. Fast stets ist ausschließlich die Leber von der Larve befallen. Im Gegensatz zu E. granulosus bildet sich jedoch keine geschlossene Zyste, sondern es kommt zu einem infiltrativen Wachstum der Larve, vergleichbar mit dem Wachstum eines ma- FLI 172
174 lignen Tumors. Das Keimepithel bildet Sprossen, die das Lebergewebe durchsetzen. Im natürlichen Zwischenwirt bilden sich zahlreiche Protoscolices (Kopfanlagen) aus, beim Menschen (Fehlwirt) kommt dies nur in Ausnahmefällen vor. E. multilocularis ist nur auf der nördlichen Hemisphäre verbreitet. In Europa gilt insbesondere das Gebiet als hochendemisch, das Süddeutschland (Baden-Württemberg, Bayern), die Nordschweiz, Westösterreich und Ostfrankreich umfasst. Der Großteil der in Deutschland bekannt gewordenen Fälle menschlicher Infektionen stammt aus ländlichen Regionen der südlichen Bundesländer, einzelne Erkrankungen wurden aber auch aus anderen Bundesländern gemeldet. Als Folge der zunehmenden Besiedlung von Städten und bewohnten Gebieten durch Füchse, aber auch durch Infektionen bei Hunden oder Katzen können Eier des Kleinen Fuchsbandwurms auch in das städtische Umfeld des Menschen gelangen. Hauptendwirt für E. multilocularis ist der Fuchs. Die epidemiologische Rolle der vor allem in Ostdeutschland neu etablierten, für den Erreger empfänglichen Marderhundpopulation ist noch offen. Infektionen bei Hunden sind möglich, Katzen scheinen als Wirt eine untergeordnete Bedeutung zu haben, da der Parasit sich in ihrem Darm nur langsam entwickelt und nur wenige Eier produziert. Das Larvenstadium (Metazestode) befällt Nagetiere als Zwischenwirt (z. B. Feld-, Wühlmäuse, Bisamratten) oder auch den Menschen als Fehlwirt. Die Infektion der Endwirte erfolgt durch den Verzehr infizierter Nagetiere Klinische Symptomatik Die Infektionen verlaufen beim Endwirt in der Regel klinisch inapparent Differentialdiagnostik Adulte Echinokokken im Darm können kaum mit anderen Parasiten verwechselt werden. Proglottiden sind von denen anderer Zestoden zu unterscheiden (Bauer, C., 1998) Diagnostische Indikation Monitoring, Überwachung Zuständige Untersuchungseinrichtungen Untersuchungsämter der Länder NRL für Echinokokkose am FLI, Institut für Epidemiologie, Seestr. 55, Wusterhausen; Tel ; Rechtsgrundlagen Bei der Echinokokkose handelt es sich um eine meldepflichtige Tierkrankheit (Verordnung über meldepflichtige Tierkrankheiten in der Fassung der Bekanntmachung vom ). Gemäß Artikel 4 Absatz 1 bis 3 der Richtlinie 2003/99/EG gehört die Echinokokkose zu den überwachungspflichtigen Zoonosen. FLI 173
175 19.2. Untersuchungsmaterial Für die Untersuchung von Endwirten wird deren Dünndarm benötigt. Aus Gründen der Arbeitssicherheit (Vermeiden von Infektionen mit Echinococcus spp.) werden die zu untersuchenden Tierkörper sowie die Därme von sezierten Tierkörpern für mindestens eine Woche bei -80 C eingefroren Untersuchungsgang Erregernachweis Nachweis adulter Stadien im Darm von Endwirten Intestinal Scraping Technique (IST) Aus Gründen der Arbeitssicherheit (Vermeidung von Infektionen mit Echinococcus spp.) werden die zu untersuchenden Tierkörper sowie die Därme von sezierten Tierkörpern für mindestens eine Woche bei -80 C eingefroren. Das Protokoll der Intestinal Scraping Technique (IST) beruht auf einer von Eckert et al. (1984) beschriebenen Methode. Dabei werden Abstriche der Darmschleimhaut mit Hilfe von Objektträgern gefertigt und mikroskopisch ausgewertet. Mehrere Varianten dieses Protokolls werden genutzt. Eine Evaluierung der hier beschriebenen Variante zur Untersuchung von Füchsen wurde veröffentlicht (Tackmann et al., 2006). Durchführung 1. Entnahme des Darmkonvoluts 2. Auslegen des Dünndarms in drei Teilen gleicher Länge (vorderer, mittlerer und kaudaler Dünndarmabschnitt) 3. Longitudinales Eröffnen des Darmlumens mit Hilfe einer Darmschere und visuelle Untersuchung auf E. multilocularis und andere Helminthen. 4. Vorsichtiges Entfernen der groben Anteile des Darminhalts, ohne die Darmschleimhaut zu beeinträchtigen. 5. Entnahme von mindestens 9 Darmschleimhaut-Abstrichen in regelmäßigen Abständen von 5 10 cm in Abhängigkeit von der Gesamtlänge des Dünndarms (kürzere Abstände bei kürzerer Länge des Dünndarms, größere Abstände bei größerer Dünndarmlänge. Entnahme der tiefen Schleimhautabstriche mit Hilfe von Objektträgern. 6. Aufdrücken der Objektträger mit den Schleimhautabstrichen auf quadratische Petrischalen aus Polystyren (Falcon, 100 mm x 100 mm) 7. Untersuchung der kompletten Schleimhautabstriche mit Hilfe eines Stereomikroskops bei 8- bis 50-facher Vergrößerung. 8. Dokumentation der Anzahle der in jedem Schleimhautabstrich gefundenen Exemplare von E. multilocularis. FLI 174
176 Literatur BAUER, C., 1998: Praktikum der veterinärmedizinischen Parasitologie. Gießen, ISBN ECKERT, J., GEMMELL, M. A., MATYAS, Z., and E.J.L. SOULSBY, 1984: Guidelines for surveillance, prevention and control of echinococcosis/hydatidosis, 2nd ed. Geneva: WHO, VPH/81.28 TACKMANN, K., MATTIS, R., CONRATHS, F.J., 2006: Detection of Echinococcus multilocularis in foxes: evaluation of a protocol of the intestinal scraping technique. J. Vet. Med. B 53, Nachweis von Lavalstadien im Zwischenwirt Histologische Untersuchung von Gewebeproben nach PAS-Färbung (Hotchkis) Lösungen: 10%iges gepuffertes Formaldehyd 1350 ml Formaldehyd 82 g Di-Natriumhydrogenphosphat 12H 2 O (Na 2 HPO 4 12H 2 O) 20 g Na-Dihydrogenphosphat H 2 O (NaH 2 PO 4 H 2 O) Mit Aqua bidest auf 5000 ml auffüllen Perjodsäure: Im Handel erhältlich SCHIFF'S Reagenz: Im Handel erhältlich Hämalaun nach MAYER 1 g Hämatoxylin in 1000ml Aqua dest lösen 200mg Natriumjodat(NaJO 3 ) 50 g Kalialaun unter schütteln lösen, Lösung soll blauviolett sein. 50 g Chloralhydrat 1 g Zitronensäure zugeben. Der Farbton schlägt nach rotviolett um. oder 1 g Hämatein in 50 ml Ethanol 96 % erwärmen und lösen 50 g Kalialaun in 1000 ml bidest. Wasser lösen Beide Lösungen vereinigen und etwas Thymol zugeben. FLI 175
177 Durchführung: Gewebestücke (gesundes und makroskopisch verdächtiges Gewebe in einem Stück) in 10%iges gepuffertes Formaldehyd bringen 1 Teil Gewebe 20 Teile 10%iges gepuffertes Formaldehyd mindestens 1,5 bis 2 Wochen (besser länger) fixieren lassen (dunkel stellen, öfter bewegen) Gewebe in höchstens 0.5 bis 1 cm dicke Stücke schneiden, in beschriftete Kassetten füllen mindestens 2 Stunden unter fließendem Wasser wässern Proben in Kassetten entwässern (Histokinette) 2x 70%iges Ethanol ca 2h = 4h 2x 96%iges Ethanol ca 2h = 4h 2x 99%iges Ethanol ca 1h = 2h 3x Chloroform oder Toluol ca 2h = 6h 2x Paraffin (reinst) ca 4h = 8h Insgesamt 24 h Kassetten in das Kassettenbad des Einbettautomaten bringen Gewebe in Paraffin einbetten Paraffinschnitte anfertigen, trocknen PAS Färbung nach HOTCHKIS Schnitte in absteigender alkoholischer Reihe bis zu Aqua bidest. bringen. Perjodsäure 10 min Leitungswasser (fließend) 10 min Aqua bidest kurz spülen SCHIFF'S Reagenz min (muss rot anfärben) Aqua bidest spülen Hämalaun nach MAYER 7 min Leitungswasser 3 x kurz spülen In gesonderten Küvetten in aufsteigender alkoholischer Reihe entwässern: 70 % Ethanol 10 Sek. 80 % Ethanol 1-2 min 95 % Ethanol 3-4 min 99 % Ethanol 5 min 99 % Ethanol 5 min Xylol 5-10 min Xylol 10 min Eindecken Ergebnis: Zellkerne blau, Aldehyde rot mikroskopische Untersuchung auf Larvalstadien ( Metazestoden ) von E. multilocularis FLI 176
178 Larvalstadien von Echinococcus multilocularis in der Leber einer Maus, PAS-Färbung n. Hotchkis FLI 177
179 20. Enzootische Leukose der Rinder Charakterisierung der Infektion Erreger Die enzootische Rinderleukose (ERL) ist eine bei allen Rinderrassen und vereinzelt beim Schaf auftretende virusbedingte Tumorerkrankung des retikuloendothelialen Systems. Das infektiöse Agens ist das bovine Leukosevirus (BLV), ein exogenes B- Zell-lymphotropes Retrovirus Klinische Symptomatik Nach einer unterschiedlich langen Inkubationszeit sind ein klinisch inapparentes, ein präleukotisches und ein tumoröses Stadium zu unterscheiden. Die Ausbildung von Tumoren stellt das eigentliche Krankheitsbild dar, welches aber nur bei wenigen infizierten Tieren als Endstadium der Erkrankung auftritt und je nach Lokalisation der Veränderung und in unterschiedlichen Zeiträumen zum Tode führen kann. Plötzliche Todesfälle können durch Milzrupturen verursacht werden. Die Diagnostik erfolgt pathologisch-anatomisch durch den Nachweis des Tumorstadiums (Leukoseverdacht), histologische Tumordifferenzierung (pathognomonisch) serologisch durch den Nachweis von Antikörpern in Blut- und/oder Milchserum, durch den elektronenoptischen Nachweis des Erregers, durch den Provirusnachweis mit Hilfe der PCR Eine persistierende Lymphozytose mit sehr hohen Lymphozytenwerten wird als pathognomonisch angesehen Differentialdiagnostik Je nach Verlauf des Tumorstadiums kann es zu Leistungsdepressionen, Inappetenz, Lahmheit, Exophthalmus und Blutbildveränderungen kommen, die von entsprechenden Veränderungen vielfältiger anderer Genese (Formen der sporadischen Rinderleukose, wie sporadisch auftretende Jungtierleukose, Hautleukose und Thymusleukose) unterschieden werden müssen Diagnostische Indikation Siehe Punkt 6. Zusätzlich: Abklärung von Tumorerkrankungen beim Einzeltier, als Handels oder Quarantäneuntersuchung (Import/Export, Sanierungsbetriebe u. ä.). FLI 178
180 Zuständige Untersuchungseinrichtungen Auf der Grundlage der Leukose-Verordnung und der Zuständigkeitsregelungen der Bundesländer erfolgt durch staatliche Untersuchungseinrichtungen und in Tiergesundheitsämtern die Antikörperdiagnostik im Enzyme-linked immunosorbent assay (ELISA) und /oder Agargel-Immundiffusionstest (AGIDT, IDT) Die amtlich zugelassenen, kommerziell erhältlichen Tests und entsprechend freigegebenen Chargen sind in der Liste der nach 17 c TierSG zugelassenen Mittel bei der Zulassungsstelle des FLI einzusehen ( Abklärungsuntersuchungen bei zweifelhaften Antikörper-Befunden werden durch das NRL für ERL am FLI, Institut für Infektionsmedizin, Insel Riems u. a. mittels PCR zum BLV-Provirusnachweis durchgeführt. Die amtliche Feststellung der Seuche obliegt der zuständigen Veterinärbehörde. Impfungen und Heilversuche sind verboten Rechtsgrundlagen Die erl ist in Deutschland als Tierseuche anzeigepflichtig und eine bei der OIE gelistete Erkrankung. Bestehende Rechtvorschriften sind dargelegt in: international: EG-Richtlinie 64/432, Anlage G der EWG Direktive 88/406, Änderungsrichtlinie 97/12/EG des Rates v national: Rinder-Leukose-Verordnung vom , BGBl.I, S.417 und vom , BGBl.I,16; geändert durch Art. 2 V v I 3499 Empfehlungen enthält das OIE-Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, FLI 179
181 20.2. Untersuchungsmaterial Vollblut, Serum, Plasma Durch die einschlägigen Untersuchungseinrichtungen werden Blutröhrchen zur Gewinnung von gerinnungsgehemmtem Vollblut (EDTA) bzw. Serum auf Anforderung bereitgestellt. Zur Einzeltierdiagnostik wird 3 bis 5 ml venöses Vollblut möglichst steril entnommen. Das Serum bzw. Blutplasma wird auf das Vorhandensein von Antikörpern gegen BLV untersucht. EDTA-Blut wird zur Untersuchung BLV-spezifischer proviraler DNA in den Lymphozyten verwendet. Der Transport der Blutproben zur Untersuchungseinrichtung erfolgt vorzugsweise per Kurierdienst. Das Serum sollte frühestens einen Tag nach der Blutentnahme zur Untersuchung verwendet werden. Stark hämolytische oder offensichtlich veränderte Seren sind zur Untersuchung ungeeignet. Im Kühlschrank können Serumproben ca. eine Woche, bei mindestens -20 C mehrere Monate aufbewahrt werden. Einzelmilch, Poolmilch, Sammelmilch (Tankmilch, Kannenmilch) Zur Untersuchung ist die weitgehend fettfreie, flüssige Sekretfraktion des Einzelgemelkes zu verwenden. Bis zu 50 Einzelgemelke können zu gleichen Teilen zusammengeführt werden (Poolmilch). Aus Milchtanks oder Milchkannen können Sammelgemelke entnommen werden. Hierfür dürfen in der Probe nicht mehr als 50 Gemelke laktierender Milchkühe enthalten sein. Die Milchproben können mit oder ohne Konservierungsmittel versetzt untersucht werden. Die Proben sind vor der Untersuchung zum Zwecke der Aufrahmung kühl zu lagern. Nicht genügend aufgerahmte Proben sind 20 min bei 2000 g zu zentrifugieren. Anschließend wird die Rahmschicht durch Absaugen oder Dekantieren entfernt oder mit der Pipettenspitze durchstoßen. Untersuchungsmenge: 1 bis 2 ml Milch Verunreinigte oder zersetzte Proben sind zur Untersuchung ungeeignet. Unkonserviert sind die Proben bei Kühlschranktemperatur bis zu fünf Tagen zur Untersuchung verwendbar. Eine längere Lagerfähigkeit ist bei mindestens -20 C gegeben. Präkolostrum, Erstkolostrum Im geburtsnahen Zeitraum kann im Blutserum der Antikörperspiegel unter die verfahrensbedingte Nachweisgrenze des Agargel-Immundiffusionstests (AGIDT) sinken. Im Stadium der Hochträchtigkeit erfolgt ein zunehmender Transfer von Antikörpern in das Eutersekret. Vier Wochen ante partum (Präkolostrum) bis zum ersten Gemelk post partum (Erstkolostrum) ist der BLVAntikörperspiegel im Eutersekret bis zu fünfmal höher als im Blutserum. Zur Abklärung des Leukoseverdachtes, bei Handelsuntersuchungen und während der Quarantäne von hochträchtigen Einzeltieren oder Frischabkalbern ist diese Besonderheit bei der diagnostischen Untersuchung mit dem AGIDT zu beachten. FLI 180
182 20.3. Untersuchungsgang Dem indirekten Nachweis der Infektion durch die Bestimmung spezifischer Antikörper kommt eine zentrale Bedeutung zu. Die direkten Nachweisverfahren werden bei besonderen Fragestellungen am Nationalen und OIE-Referenzlabor für EBL am Friedrich-Loeffler- Institut bei serologisch zweifelhaften Befunden eingesetzt Direkter Virusnachweis Nachweis des BLV-Provirus durch PCR Bei infizierten Rindern ist das BLV in seiner proviralen Form in die DNA der Wirtszelle integriert und kann mit Hilfe der Polymerase-Kettenreaktion (PCR) nachgewiesen werden. Die Methodik wird kontinuierlich weiterentwickelt. Eine Etablierung als diagnostische Methode zum Nachweis der BLV-Infektion wird international empfohlen (siehe "OIE-Manual of Diagnostic Tests and Vaccines for Terrestrial Animals", 2008). Die Dauer der Untersuchung beträgt ca. 24 bis 36 Stunden. Andere Verfahren zum direkten Erregernachweis Der direkte Erregernachweis (BLV) kann erfolgen durch: Elektronenmikroskopie Virusisolierung mit Nachweis synzytienbildender Eigenschaften des BLV kompetitiven Radioimmunoassay (cria) Tierversuch Von praktischer Bedeutung ist die in vitro-kultivierung von Lymphozyten mit anschließender Erregerisolierung und -charakterisierung. Diese Methoden werden ausschließlich im Rahmen der experimentellen Leukoseforschung angewendet (Nationales Referenzlabor für ERL am FLI) Indirekter Erregernachweis (Antikörpernachweis) Antikörper können im Serum, Plasma und/oder in der Milch bei infizierten Rindern mit Hilfe kommerziell erhältlicher und zugelassener Testsysteme nachgewiesen werden. Die Diagnose erfolgt in staatlichen Untersuchungseinrichtungen. Die Liste der nach 17c TierSG zugelassenen Mittel bzw. freigegebenen Chargen ist bei der Zulassungsstelle des Friedrich-Loeffler-Instituts einzusehen ( Der einheitlichen Diagnostik liegen die Rinder-Leukose-Verordnung vom in der aktuellen Fassung sowie die Zuständigkeitsregelungen der Bundesländer zugrunde. Gemäß Ausführungshinweisen zur Leukose-VO-Rinder werden folgende Testsysteme, deren Antigen gegen ein Standardserum geprüft sein muss, zum Antikörpernachweis gegen BLV eingesetzt: Diagnostischer Standard: amtliches OIE-Referenzserum E05, geliefert vom NRL des FLI. Nationale Referenzseren und Milch, geliefert vom NRL des FLI. FLI 181
183 Enzyme-linked Immunosorbent Assay (ELISA) zum Nachweis von Antikörpern gegen BLV in Blutserum und Milch, in Einzel- und Sammelproben gemäß Richtlinie 88/406/EWG des Rates zur Änderung der Richtlinie 64/432/EWG vom Die Empfindlichkeit des ELISA muss so hoch sein, dass das OIE-Referenzserum (E05) positiv reagiert, wenn es zehnmal (Blutserum) bzw. 250-mal (Milchproben) mehr verdünnt wird als die Lösung, die Einzelproben ergeben, wenn diese in Pools zusammengefasst werden. Die Sensitivität des ELISA ist ca. 100-mal höher als die des IDT. Eine Befundmitteilung ist innerhalb von 24 Stunden möglich. Die Bewertung der Untersuchungsbefunde bei Milchuntersuchungen ergibt sich aus dem jeweiligen Einsatz einer Positivkontrolle auf der Grundlage des diagnostischen Standards. Die Einsatzverdünnung für den positiven Serumstandard E05 in negativer Milch als Bezugsreferenz für Milchproben beträgt: 1: (250 x n x 2) Somit ergeben sich folgende Einsatzverdünnungen: E05/ bzw. E05/ für Tankmilch aus Beständen mit einer Obergrenze von 100 Milchkühen (bzw. 200 nach Konzentrierung der Milch), E05/ für Tankmilch aus Beständen mit max. 50 laktierenden Kühen, E05/ für Tankmilch aus Beständen mit max. 25 laktierenden Kühen oder für Laborpools aus 50 Einzelmilchproben, E05/5.000 für Laborpools aus 20 Einzelmilchproben, E05/2.500 für Laborpools aus 10 Einzelmilchproben, E05/250 für eine Einzelmilchprobe. Die Durchführung der Tests erfolgt nach den Gebrauchsanweisungen der Hersteller. Agargel-Immundiffusionstest (AGID) zum Nachweis von Antikörpern im Blutserum bei Einzeltieren. Die Dauer der Untersuchung beträgt 4 Tage. Diese Untersuchungsmethode ist auch zur Untersuchung von Prä- und/oder Erstkolostrum bei Einzeltieren geeignet. FLI 182
184 21. Epizootische Hämatopoetische Nekrose (EHN) Charakterisierung der Infektion Erreger Die Epizootische Hämatopoetische Nekrose wird durch das Virus der Epizootischen Hämatopoetischen Nekrose (EHNV) verursacht Klinische Symptomatik Das klinische Bild der EHN ist sehr unspezifisch. Bei Flussbarschen (Perca fluviatilis), offenbar dem Hauptwirt in Australien, äußert sich die Infektion durch plötzliche Todesfälle ohne jegliche äußere und innere Anzeichen. Natürliche Infektionen treten bei Regenbogenforellen (Oncorhynchus mykiss) ausschließlich in Australien auf. Experimentell lassen sich der Marquarie-Buntbarsch (Macquaria australasica), der Mosquitofisch (Gambusia affinis), der Silberbarsch (Bidyanus bidyanus), der Galaxias (Galaxias olidus), Murraydorsch (Maccullochella peelii peelii) und der Atlantische Lachs (Salmo salar) infizieren. Wahrscheinlich sind noch weitere Spezies für die Infektion empfänglich. Symptome können Dunkelfärbung der Haut, Inappetenz, Ataxie, Lethargie, Blutungen an den Flossenrändern, Geschwürbildung, Rötung und/oder Ablösung der Haut sein. Infektionen mit dem genomisch sehr nah verwandten European Sheatfish Virus (ESV, Welsiridovirus) wurden beim Europäischen Wels (Silurus glanis) beschrieben. Das European Catfish Virus (ECV), welches nicht vom ESV unterschieden werden kann, infiziert den Amerikanischen Katzenwels (Ictalurus melas), den Channel Catfish (Ictalurus punctatus), den Goldfisch (Carassius auratus) und den Kurzflossen-Aal (Anguilla australis). Systemische Infektionen mit nicht näher untersuchten Iridoviren wurden beim Steinbutt (Scophthalmus maximus) beschrieben. Die Inkubationszeit beträgt in Abhängigkeit vom Alter der Fische, von der Wassertemperatur, von der Infektionsdosis und von der Virulenz des Erregers in der Regel 3 bis 32 Tage. Bei experimentell infizierten Regenbogenforellen betrug die Inkubationszeit 3 bis 10 Tage bei 19 bis 21 C Wassertemperatur, bei 8 bis 10 C 14 bis 32 Tage. In Flussbarschen wurden Todesfälle nach 10 bis 11 Tagen bei 19 bis 21 C und nach 10 bis 28 Tagen bei 12 bis 18 C beobachtet. FLI 183
185 Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Nachweis Erregernachweis durch Virusanzucht in Zellkulturen und Identifizierung mittels Immunfluoreszenztest, Antigen-ELISA, Western Blot oder Immunperoxidasetest Erregernachweis mittels Elektronenmikroskopie oder Immun-Elektronenmikroskopie Genomnachweis mittels PCR oder realtime PCR Zur EHN-Diagnose ist mindestens eines der folgenden Verfahren anzuwenden: a) Herkömmliche Virusisolierung mit anschließendem serologischen Virusnachweis (Virusnachweis mittels Antigen-ELISA oder Immunfluoreszenztest) b) Virusisolierung kann in verschiedenen Zellen erfolgen: u. a. in CHSE-214 (Chinook Salmon Embryo), FHM (Fathead Minnow), EPC (Epithelioma Papulosum Cyprini) oder BF-2 (Bluegill Fry) c) Durch Isolierung und die zur Verfügung stehendem serologischen Verfahren lässt sich EHNV nicht von ESV oder ECV unterscheiden d) Nach Untersuchungen des OIE-Referenzlabors zur EHN bilden infizierte Tiere keine neutralisierenden Antikörper FLI 184
186 22. Epizootische Hämorrhagie der Hirsche Charakterisierung der Infektion Die Krankheit wird vor allem in Weißschwanzhirschen und anderen frei lebenden Huftieren (z. B. Antilopen) ausgelöst. Wegen serologischer Verwandschaft ist eine Differenzierung von BTV nötig. Es gibt monoklonale Antikörper, die EHDV gut von BTV differenzieren Erreger Das Virus der Epizootischen Hämorrhagie der Hirsche (EHDV) ist ein Vertreter des Orbivirus Genus der Reoviridae. Acht EHDV Serotypen sind bisher durch Neutralisationstests festgelegt worden. Überträger sind wie bei BTV Culicoides-Insekten Klinische Symptomatik Die Krankheit hat das gleiche Wirtsspektrum und zeigt einen ähnlichen Verlauf wie Bluetongue mit dem Unterschied, dass Antilopen und Weißschwanzhirsche die höchste Empfänglichkeit aufweisen und die Mortalität bei diesen Tieren am höchsten ist Differentialdiagnostik Wichtigste Differentialdiagnostik ist Bluetongue und die bei BTV angegebenen Viruskrankheiten Diagnostische Indikation siehe Richtlinie 92/119/EWG Zuständige Untersuchungseinrichtung Friedrich-Loeffler-Institut, Institut für Virusdiagnostik Südufer 10, Greifswald - Insel Riems Rechtsgrundlagen Richtlinie 92/119/EWG FLI 185
187 22.2. Untersuchungsmaterial Gerinnungsgehemmtes Blut von Tieren. Das EDTA-Blut sollte im gekühlten (+4 C) Zustand versendet werden. Lagerung über längere Zeit sollte bei -70 C erfolgen, weil das EHDV bei -20 C nicht lange stabil bleibt. Post mortem sind Milz und Lymphknoten die Organe der Wahl zur Virusisolierung, schnellstmöglicher Versand erfolgt bei +4 C. Für den Antikörpernachweis können Vollblut oder mindestens 500 µl Serum eingesendet werden Untersuchungsgang Solange die Seuche in Deutschland nicht auftritt, wird das FLI Proben an das Institut for Animal Health, Pirbirght, UK, weiterleiten Erregernachweis Zum Virusnachweis werden die gleichen Methoden wie zum BTV-Nachweis empfohlen, eine zur spezifischen EHDV-RNA Detektion (L3 Gen, Serotyp 1) entwickelte PCR ist beschrieben (Harding et al., 1996) und wird am FLI angewendet. Darüber hinaus wurde am FLI eine EHDV-real-time RT-PCR etabliert, die im Rahmen von differentialdiagnostischen Abklärungen eingesetzt wird Antikörpernachweis Am Institut for Animal Health, Pirbirght, UK, gibt es als in-house-test einen Kompetitions-ELISA zum spezifischen Antikörpernachweis. Literatur Harding, M J, I Prud'homme, J Rola, and G C Dulac (1996): Development of PCRbased tests for the identification of North American isolates of epizootic haemorrhagic disease virus. Can. J. Vet. Res. 60, FLI 186
188 23. Epizootisches Ulzeratives Syndrom (EUS) Charakterisierung der Infektion Erreger Das Epizootische Ulzerative Syndrom (EUS) wird durch den Pilz Aphanomyces invadans verursacht Klinische Symptomatik EUS-Ausbrüche sind in Asien charakterisiert durch Massensterben verschiedener Arten von Süßwasserfischen in Wildgewässern und Aquakulturen während einer Periode mit niedrigen Temperaturen (18 bis 22 C) und nach starken Regenfällen. Erste klinische Anzeichen sind verminderte Futteraufnahme und Dunkelfärbung. Infizierte Fische schwimmen unterhalb der Wasseroberfläche, zeigen Anzeichen von Hyperaktivität mit ruckartigen Bewegungsabläufen. Die Fische entwickeln anfangs kleine rote Flecken oder kleine bis größere ulzerative Hautläsionen. Diese Entzündungen können am Körper, am Kopf, auf den Kiemendeckeln oder am Schwanzstiel auftreten. Im späteren Krankheitsstadium findet man große rot bis grau gefärbte flache Ulzera, oft mit braunen Nekroseherden. Im Muskel-Quetschpräparat aus infizierten Bereichen rund um die Läsionen findet man unsegmentierte Hyphen von Aphanomyces invadans (12 bis 25 µm im Durchmesser). Die Krankheit ist hauptsächlich in Asien verbreitet. Ausbrüche sind auch aus Australien und der amerikanischen Ostküste bekannt. Empfängliche europäische Fischarten: Karausche (Carassius carasius),goldfisch (Carassius auratus auratus) in Aquakulturen: Afrikanischer Raubwels (Clarias gariepinus), Blauer Sonnenbarsch (Lepomis macro-chirus) Nach experimenteller Infektion erkrankten: Regenbogenforelle (Oncorhynchus mykiss), Rotauge (Rutilus rutilus), Rotfeder (Scardinius erythrophalmus), Europäischer Wels (Silurus glanis) Inkubationszeit: Abhängig von der Wassertemperatur und der betroffenen Fischart; bei Temperaturen um 26 C drei bis zehn Tage Im OIE Manual of Diagnostic Test for Aquatic Animals von 2009 (S. 189) sind 76 Fischspezies aufgeführt, die auf natürlicher Weise für EUS empfänglich sind. Im OIE Manual von 2006 waren es 16 Fischspezies weniger. In der Literatur gibt es z. T. widersprüchliche Angaben zu empfänglichen Arten. FLI 187
189 Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) OIE Manual of Diagnostic Tests for Aquatic Animals 2009 (Kapitel , S ) Untersuchungsmaterial Für die histologische Untersuchung und die Isolation von Oomyceten von Aphanomyces invadans sind folgende Organe geeignet: Muskulatur, Niere, Leber Labordiagnostischer Erregernachweis Induktion der Sporulation in Aphanomyces invadans-kulturen Polymerase-Kettenreaktion (PCR) Fluoreszenz-in-situ-Hybridisierung (FISH) FLI 188
190 24. Infektion mit Bonamia exitiosa Charakterisierung der Infektion Klinische Symptomatik Für die Bonamia exitiosa-infektion wird kein differenziertes klinisches Bild beschrieben. Ein Zeichen für die Infektion mit dem protozoären Parasiten ist die stark erhöhte Mortalität in der betroffenen Muschel-Population. Zeichen können offene Schalen bzw. Abfallen vom Hafthintergrund (Felsen, Stricke, Holzpfähle) sein. Während die Infektion im australischen Raum beschrieben wird, wurde der Parasit auch in Spanien und Frankreich gefunden. Empfängliche Arten sind die Ostrea chilensis und die O. angasi. Histologisch kann der Parasit meist in Hämozyten, selten auch extrazellulär beobachtet werden Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Erregernachweis Positiver Befund kann mit mindestens einer der folgenden Methoden erhoben werden: Histologie nach HE-Färbung Abklatschpräparate vom Herzen und Hemacolor-Färbung FLI 189
191 25. Infektion mit Bonamia ostrea Charakterisierung der Infektion Erreger Die Bonamiose wird durch den protozoären Parasiten Bonamia ostrea verursacht Klinische Symptomatik Für die Bonamiose wird kein klinisches Bild beschrieben. Ein Zeichen für die Infektion mit dem Parasiten ist die stark erhöhte Mortalität in der betroffenen Muschel- Population. Bonamia ostrea befällt die Europäische Flachauster (Ostrea edulis) letal. Empfängliche Spezies sind O. pulchana, O. angasi, O. conchiphila, Crassostrea angulata und C. ariakensis. Alle Entwicklungsstadien der Austern sind empfänglich. Der Parasit wird in der Regel in agranulären Hämozyten gefunden. In nekrotischen Bereichen des Bindegewebes, des Epithels von Mund, Magen und Verdauungsdrüsen sowie im Kiemengewebe kann der Parasit auch extrazellulär beobachtet werden. Bonamia ostrea wird in Europa (Frankreich, Irland, Italien, den Niederlanden, Spanien und dem Vereinigten Königreich außer Schottland), in Kanada und den USA nachgewiesen Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Erregernachweis Abklatschpräparate vom weißen Teil des Herzens und vom Bindegewebe und Haemacolor -Färbung Histologie nach HE-Färbung PCR zum Nachweis der DNA des Parasiten Elektronenmikroskopie FLI 190
192 26. Infektion mit Marteilia refringens Charakterisierung der Infektion Erreger Die Marteiliose wird durch den protozoären Parasiten Marteilia refringens verursacht Klinisches Bild Für die Marteiliose wird kein differenziertes klinisches Bild beschrieben. Ein Zeichen für die Infektion mit dem Parasiten ist die stark erhöhte Mortalität in der betroffenen Muschel-Population. Marteilia refringens befällt die Europäische Flachauster (Ostrea edulis) und Miesmuschelarten (Mytilus edulis, M. galloprovincialis) wobei die Mortalitäten bei der Europäischen Flachauster am höchsten sind. Weitere empfängliche Spezies sind O. pulchana, O. angasi und O. chilensis. Alle Entwicklungsstadien der Austern und Muscheln sind empfänglich. Der Parasit wird in der Regel im Verdauungstrakt der Austern und Muscheln gefunden. Plasmodien können auch in Kiemen- und Mantelzellen vorhanden sein. Sprorangien werden über den Kot ausgeschieden. M. refringens (auch Variante M. maurini in Mytilus galloprovincialis) wurde in Europa (Kroatien, Frankreich, Griechenland, Italien, Spanien, Portugal) und Afrika (Marokko) nachgewiesen Differentialdiagnostik Artverwandte Parasiten wie M. sydneyi, M. lenghei oder M. christenseni können von M. refringens mittels Histologie, Elektronenmikroskopie oder PCR differenziert werden Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Nachweis Positiver Befund mit mindestens einem der folgenden Verfahren: Histologie nach HE-Färbung (Verdauungsdrüsen) in-situ Hybridisierung PCR zum Nachweis der DNA des Parasiten Elektronenmikroskopie FLI 191
193 27. Infektion mit Microcytos mackini Charakterisierung der Infektion Klinisches Bild Für die Infektion mit dem Parasiten Microcytos mackini wird kein differenziertes klinisches Bild beschrieben. Es können jedoch gelblich-grüne Pusteln in allen sichtbaren Geweben sowie in der Schale der Austern auftreten. Ein Zeichen für die Infektion mit dem protozoären Parasiten ist die stark erhöhte Mortalität in der betroffenen Muschel-Population. Zeichen können offene Schalen bzw. Abfallen vom Hafthintergrund (Felsen, Stricke, Holzpfähle) sein. Befallen werden die Austernarten Crassostrea gigas, C. virginica, Ostrea edulis und O. conchaphila. Histologisch kann der Parasit in allen Geweben beobachtet werden. Die Infektion wurde bisher ausschließlich im nordamerikanischen Raum beschrieben Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Erregernachweis Histologie nach HE-Färbung PCR zum spezifischen DNA-Nachweis des Parasiten FLI 192
194 28. Infektion mit Perkinsus marinus Charakterisierung der Infektion Klinisches Bild Für die Perkinsose wird kein differenziertes klinisches Bild beschrieben. Ein Zeichen für die Infektion mit dem protozoären Parasiten Perkinsus marinus ist die stark erhöhte Mortalität in der betroffenen Muschel-Population. Histologisch stehen multifokale Läsionen im Epithel des Verdauungstraktes und im Bindegewebe im Vordergrund. In schweren Fällen der Infektionen können diese Gewebe komplett zerstört werden. Die Infektion wurde bis jetzt ausschließlich im nordamerikanischen Raum an der Ostküste (Main bis Karibik) beschrieben. Befallen werden die Austernarten Crassostrea virginica, C. gigas, C. ariakensis und C. hizophorae Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Labordiagnostischer Erregernachweis Histologie nach HE-Färbung Thioglykolat-Kultur (anerkannte Methode) PCR zum spezifischen DNA-Nachweis des Parasiten FLI 193
195 29. Infektiöse Hämatopoetische Nekrose der Salmoniden (IHN), Virale Hämorrhagische Septikämie der Forellen (VHS) Charakterisierung der Infektion Die VHS (Viral Haemorrhagic Septicaemia), auch bezeichnet als "Forellenseuche" oder Egtved-Krankheit, und die IHN (Infectious Haematopoietic Necrosis) verursachen in Europa große wirtschaftliche Schäden durch Verluste von bis zu 100 %, vor allem bei in der Aquakultur gehaltenen Regenbogenforellen Erreger Die Erreger der IHN (IHNV) und der VHS (VHSV) gehören innerhalb der Ordnung Mononegavirales zur Familie der Rhabdoviridae. Das Genom der Rhabdoviren ist einfach strukturiert und besteht aus einer einzelsträngigen RNA negativer Polarität von ca Basen. Insgesamt werden fünf Strukturproteine von einer gleichen Anzahl monocistronischer mrnas gebildet. IHNV und VHSV unterscheiden sich von anderen Rhabdoviren durch die Bildung des Nichtstrukturproteins NV ( non virion ). Basierend auf der Genomorganisation und der Bildung des NV Proteins werden IHNV und VHSV taxonomisch dem Genus Novirhabdovirus zugeordnet. Die Mehrzahl der VHS-Ausbrüche in der Aquakultur Europas wird durch Isolate des Serotyps 1 (F1) verursacht. IHNV-Isolate sind serologisch einheitlich. Unterschiede lassen sich nur bedingt mit verschiedenen mak feststellen. Auf der Grundlage der Gensequenz werden die Isolate in verschiedene Genogruppen unterteilt. Eine sichere Differenzierung von identifizierten IHNV bzw. VHSV Isolaten ist mit den bislang vorhandenen mak oft nicht möglich. Die molekularbiologische Charakterisierung (Genotypisierung) einschließlich der phylogenetischen Analyse ermöglicht eine eindeutige Identifizierung der Erreger. Basierend auf den Sequenzanalysen werden Veränderungen dieser Virusstämme verfolgt und Rückschlüsse auf die Herkunft des Erregers gezogen Klinische und pathologisch-anatomische Symptomatik VHSV und IHNV replizieren u. a. in den Endothelzellen der Blutkapillaren, den Leukozyten, in Zellen der hämatopoetischen Organen und der Niere. Das klinische Bild einer VHS ist definiert als eine mit Ödemen und Hämorrhagien einhergehende Krankheit mit folgenden Kriterien: Lethargie und sporadische Hyperaktivität Dunkelverfärbung Exophthalmus Anämie Auftreiben des Leibes (durch Aszites) Pseudofaeces (lange weißliche, aus dem Rektum heraushängende Auswürfe) Hämorrhagien, vorrangig an den Flossenansätzen. FLI 194
196 Die klinischen Symptome werden unter natürlichen Bedingungen bei Wassertemperaturen von 4 bis 14 C ausgebildet. Bei perakuten Todesfällen können diese Symptome fehlen. Die Inkubationszeit beträgt bei Wassertemperaturen von 8 bis 10 C etwa 7 Tage. Sie ist abhängig vom Alter der Fische, von der Wassertemperatur, von der Infektionsdosis und von der Virulenz des Erregers. Bei einem VHS-Ausbruch in einer bis dahin virusfreien Population unterscheidet man gewöhnlich 3 Phasen. An die erste, akute Phase, gekennzeichnet durch hohe Fischverluste in einer relativ kurzen Zeit, schließt sich eine zweite Phase mit chronischem Verlauf an. In der dritten, sogenannten "nervösen" Phase zeigen die Fische zentralnervöse Störungen, die durch Drehung um die Längsachse oder plötzliche, spiralförmige Schwimmbewegungen der Fische gekennzeichnet sind. Das klinische Bild einer IHN ist charakterisiert als eine ebenfalls mit Ödemen und Hämorrhagien einhergehende Krankheit gleicher Symptomatik: Lethargie und sporadische Hyperaktivität Dunkelverfärbung Exophthalmus Anämie Auftreiben des Leibes (durch Aszites) Pseudofaeces (lange weißliche, aus dem Rektum heraushängende Auswürfe) Hämorrhagien, vorrangig an den Flossenansätzen. Die klinischen Symptome werden bei Wassertemperaturen von 8 bis 15 C ausgebildet. Bei perakuten Todesfällen können die Symptome fehlen. Die Inkubationszeit beträgt 5 bis 15 Tage und ist auch abgängig vom Alter der Fische, von den Wassertemperaturen, von der Infektionsdosis und von der Virulenz des Erregers. Die auffälligsten klinischen bzw. pathologisch-anatomischen Symptome bei beiden Krankheiten sind Absonderung der Fische vom Schwarm, Dunkelverfärbung der Haut und Exophthalmus sowie vielfältige hämorrhagische Diathesen und katarrhalische Enteritis. Auf Grund klinischer und pathologisch-anatomischer Symptomatik lassen sich VHS und IHN nicht unterscheiden Vorkommen Die VHS hat als Infektionskrankheit vor allem Bedeutung bei Salmonidenarten. Empfänglich sind nach der Aquakultur-Richtlinie 2006/88/EG (1): Hering (Clupea spp.), Felchen (Coregonus sp.), Hecht (Esox lucius), Schellfisch (Gadus aeglefinus), Pazifischer Kabeljau (Gadus macrocephalus), Dorsch (Gadus morhua), Pazifischer Lachs (Oncorhynchus-Arten), Regenbogenforelle (Oncorhynchus mykiss), Seequappe (Onos mustelus), Forelle (Salmo trutta), Steinbutt (Scophthalmus maximus), Sprotte (Sprattus sprattus) und Esche (Thymallus thymallus). Bei Wildfischen wurden natürliche Epizootien selten festgestellt. Große Bedeutung haben die für VHS empfänglichen Wildfische allerdings als Carrier und Überträger des Erregers. In den letzten Jahren wurden von zahlreichen marinen Spezies aus dem nordamerikanischen Teil des Pazifischen Ozeans, aus dem Nordatlantik und aus der Ostsee FLI 195
197 VHS-Viren isoliert. Eine zentrale Stellung bei den Infektketten nimmt der Hering (Clupea pallasi, Clupea harengus) ein. VHSV wurden auch nachgewiesen bei der Japanischen Flunder (Paralichthys olivaceus). Die marinen Isolate galten bisher für Süßwasserfische als nicht oder nur schwach virulent. IHN ist eine Infektionskrankheit der Regenbogenforellen (Oncorhynchus mykiss), verschiedener Pazifischer Lachse und des Atlantischen Lachses (Salmo salar). Nach der EU-Richtlinie 2006/88/EG (1) gelten als IHNV-empfänglich: Keta-Lachs (Oncorhynchus keta), Silberlachs (O. kisutch), Japan-Lachs (O. masu), Regenbogenforelle (O. mykiss), Rotlachs (O. nerka), Biwa-Forelle (O. fhodurus), Königslachs (O. tshawytscha) und Atlantischer Lachs (Salmo salar). Die Bachforelle (Salmo trutta fario) gilt als IHNVwiderstandsfähig, wenngleich nicht völlig resistent. In der Vergangenheit war das Vorkommen der IHN auf die pazifische Küste Nordamerikas begrenzt. Die Krankheit hat sich später durch den Handel mit infizierten Fische oder Eiern auch nach Europa und Fernost ausgebreitet Diagnostische Indikation In Abhängigkeit von der Art der Überwachung oder, wenn als Ergebnis der klinischen und pathologisch-anatomischen Untersuchung oder auf Grund epizootiologischer Erhebungen der Verdacht des Ausbruchs der IHN oder VHS geäußert wird, sind Fische an die zuständige diagnostische Einrichtung zur virologischen Prüfung einzusenden. In den folgenden methodischen Hinweisen wird zwischen den Probennahme- und Analysever-fahren zur VHS- und IHN-Überwachung und den Maßnahmen zur Isolierung und Identifizierung von VHSV und IHNV aus Fischen bei Ausbruch oder Verdacht des Ausbruchs der VHS bzw. IHN unterschieden Bekämpfung Derzeitig konzentrieren sich die Maßnahmen in der EU auf die Bekämpfung und die Verhinderung der weiteren Ausbreitung der VHS und IHN. Die Strategie zur Zurückdrängung dieser Fischseuchen basiert auf der Schaffung anerkannt seuchenfreier Aquakulturbetriebe, Zonen oder Länder. In Deutschland hat nach der neuen Fischseuchen-VO (1) eine Registrierung aller Fischhaltungsbetriebe zu erfolgen. Nach Prüfung der Unterlagen ist zu entscheiden, ob von dem Betrieb eine Seuchengefahr ausgehen kann und deshalb das Halten von Fischen genehmigungspflichtig ist. Nach der Registrierung sind die Fischhaltungsbetriebe in die Kategorien I als seuchenfrei erklärt bis V Infektionen nachgewiesen einzuordnen. Die Kategorisierung dient in erster Linie der Feststellung der Kontrollhäufigkeit und der Feststellung der möglichen Lebendfischbewegungen. Fische dürfen zum Zwecke des Besatzes grundsätzlich nur in Betriebe gleicher oder niedrigerem Kategorie-Status (höhere Kategorie-Nr.) verbracht werden. Kategorie IV- und Kategorie II-Betriebe dürfen Fische allerdings ausschließlich nur aus Kategorie I- Betriebe, also keine Fische aus Betrieben mit gleichem Status, zukaufen. Bei amtlicher Feststellung der IHN oder VHS in einem Fischhaltungsbetrieb sind die seuchenkranken oder seuchenverdächtigen Fische zu töten und unschädlich zu beseitigen. Es werden Sperr- und Beobachtungsgebiete festgelegt und Maßnahmen zur Tilgung des Seuchenherdes erlassen. FLI 196
198 Zuständige Untersuchungseinrichtungen Die virologischen Untersuchungen zum Nachweis der Erregerfreiheit für die Anerkennung seuchenfreier Gebiete bzw. Fischhaltungsbetriebe, zur Überwachung der Seuchenfreiheit bzw. zur Bestätigung von IHN- bzw. VHS-Verdachtsfällen werden in den zugelassenen, regionalen Untersuchungsämtern der Bundesländer durchgeführt. Das Nationale Referenzlaboratorium für IHN und VHS am Friedrich-Loeffler- Institut auf der Insel Riems koordiniert die Diagnose von Fischseuchen auf der Grundlage der EU- und nationalen Gesetzgebung. Zur Klärung fraglicher Befunde oder zur Bestätigung der Ergebnisse der regionalen Diagnoselaboratorien bei Ausbruch einer Fischseuche in einem als seuchenfrei erklärten Bestand oder Gebiet sind die Virusisolate zur Identifizierung und molekularbiologischen Charakterisierung an das Referenzlabor einzusenden. Repräsentative Isolate werden an das EU- Referenzlaboratorium übergeben, das die Diagnose der Fischseuchen auf EU-Ebene koordiniert Rechtsgrundlagen IHN und VHS sind lt. Verordnung über anzeigepflichtige Tierseuchen anzeigepflichtig. Die Diagnose und Bekämpfung der VHS und IHN sind in Deutschland durch die "Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (Fischseuchen-Verordnung)" geregelt. Diese Verordnungen dienen zur Umsetzung der Aquakultur-Richtlinie 2006/88/EG, die zur Harmonisierung der Diagnose und Bekämpfung von Fischseuchen innerhalb der Europäischen Union erlassen wurden. Die Entscheidung 2001/183/EWG der Kommission in der jeweils gültigen Fassung, in der die Probennahmepläne und Diagnoseverfahren zur Überwachung und zum Nachweis der VHS und IHN festgelegt sind, ist für die Diagnose dieser Fischseuchen in Deutschland verbindlich und wurde deshalb für die Erstellung der folgenden methodischen Hinweise zugrunde gelegt. Dabei sind die anzuwendenden Methoden zum Nachweis von VHSV und IHNV identisch. Eine Anleitung zur Diagnose der VHS, IHN und weiterer, gegebenenfalls differentialdiagnostisch abzugrenzender Fischkrankheiten findet man auch im "Diagnostic Manual for Aquatic Animal Diseases" des OIE in der jeweils aktuellen Ausgabe. FLI 197
199 29.2. Untersuchungsmaterial (für die VHS- und IHN-Überwachung) Zeitplan Der Betreiber eines Fischhaltungsbetriebes hat seinen Fischbestand regelmäßig durch die zuständige Behörde und durch die mit der Gesundheit von Wassertieren befassten qualifizierten Dienste, in Deutschland sind das i. d. R. die Fischgesundheitsdienste, klinisch und ggf. auch virologisch untersuchen zu lassen. Die Kontrollhäufigkeit ist anhängig von der Einordnung des Aquakulturbetriebes in die Kategorien und der damit festgelegten Art der Überwachung (siehe EU-Richtlinie 2006/88/EG., Anhang III, Teil B) Es wird empfohlen, die klinische Untersuchung zwischen Oktober und Juni bzw. dann, wenn die Wassertemperatur unter 14 C liegt; durchzuführen. Der Abstand zwischen den Untersuchungen soll mindestens 4 Monate betragen. Alle Produktionseinheiten (Teiche, Rinnen, Behälter, Netzkäfige usw.) werden auf verendete, geschwächte oder verhaltensgestörte Fische kontrolliert. Besondere Beachtung ist nach Möglichkeit dem Wasserabflussbereich zu widmen, in dem sich geschwächte Fische strömungsbedingt meist aufhalten Wahl und Entnahme der Proben Für die Untersuchung gemäß Entscheidung 2001/183/EG werden Organ- und/oder Ovarialflüssigkeitsproben entnommen. Sind Regenbogenforellen im Bestand, sollte der gesamte Probenumfang von dieser Fischart entnommen werden. Ansonsten muss die Probe Fische aller für VHSund/oder IHN-empfängliche Arten des Betriebes umfassen. Jede Fischart muss in der Probe proportional vertreten sein. Wird für die Fischproduktion mehr als eine Wasserquelle verwendet, so müssen bei der Probenahme alle Wasserquellen berücksichtigt werden. Die Probe sollte bevorzugt geschwächte, verhaltensgestörte, moribunde oder soeben verendete Fische (ohne Anzeichen der Zersetzung) umfassen. Fehlen solche Fische, so muss sich die Probe proportional aus normal erscheinenden, gesunden Fischen aller Produktionseinheiten des Betriebes sowie aller Jahrgänge zusammensetzen. Dauer des Überwachungsprogrammes und Probenumfang sind der Entscheidung 2001/183/EG zu entnehmen. Für Untersuchungen gemäß Fischseuchenverordnung sollte die zu untersuchende Probe bei Brütlingen aus mindestens 20, bei Fischen über 5 cm Länge aus mindestens 10 Fischen bestehen Aufbereitung und Einsendung der Proben Unter sterilen Kautelen entnommene Organe (Milz, Kopf- bzw. Vorderniere, Herz oder Gehirn) und/oder Ovarialflüssigkeit sind in ein steriles Kunststoffröhrchen zu füllen, das steriles Transportmedium (Zellzuchtmedium für Fischzelllinien mit 10 % Kälberserum und Antibiotika, z. B. 200 I.E. Penicillin, 200 μg Streptomycin und 200 μg Kanamycin oder 50 μg Enrofloxacin pro ml) enthält. Ovarialflüssigkeit oder Organteile von höchstens 10 Fischen können als Sammelprobe (mindestens insgesamt 0,5 g) in je ein 10 ml-kunststoffröhrchen gefüllt werden, das 4 ml Transportmedium enthält. FLI 198
200 Die Röhrchen sind in Isolationsbehälter (z. B. dickwandige Styroporkästen mit Eis oder Kühlelementen) zu packen Es ist zu gewährleisten, dass die Proben beim Transport zum Labor bei einer Temperatur von 0 bis 5 C gehalten werden. Ein Anfrieren ist zu vermeiden. Während des Transportes darf die Temperatur zu keiner Zeit mehr als 10 C betragen. Bei der Ankunft sollten im Transportbehälter noch Eis oder gefrorene Kühlelemente vorhanden sein. Mit der virologischen Untersuchung ist so schnell wie möglich zu beginnen, spätestens jedoch 48, in Ausnahmefällen 72 Stunden nach der Entnahme, sofern das Untersuchungsmaterial durch das Transportmedium geschützt war und die Temperaturanforderungen während der Beförderung erfüllt wurden. Dauert der Transport länger als 48 Stunden, müssen die Proben gefroren (weniger als -10 C) transportiert werden. Dabei darf die Kühlkette bis zum Eintreffen im Labor nicht unterbrochen werden. Fische können unzerteilt (ganz) zum Labor gesandt werden, sofern die Temperaturanforderungen während der Beförderung erfüllt sind. Ganze Fische müssen, unter Umständen mit saugfähigem Papier umhüllt und auslaufsicher verpackt werden Entnahme von zusätzlichem Probenmaterial Im Einvernehmen mit dem Diagnoselaboratorium kann weiteres Probenmaterial entnommen und für weitere Untersuchungen aufbereitet werden Untersuchungsgang (für die VHS- und IHN-Überwachung) Aufbereitung der Proben für die virologische Untersuchung Nach dem Homogenisieren (z. B. Stomacher, Mixer, Mörser, Mikrohomogenisatorstempel) wird der Organbrei im Volumenverhältnis von 1:10 in dem ursprünglichen Transportmedium suspendiert. Ganze Fische mit weniger als 6 cm Länge werden nach Entfernung des hinter der Darmöffnung liegenden Körperteils in toto homogenisiert. Das Homogenisat wird bei 2000 bis 4000 x g und 2 bis 5 C für 15 Min. zentrifugiert. Wurde die Probe nicht in einem antibiotikahaltigem Medium versandt, ist der Überstand für 4 Stunden bei 15 C oder über Nacht bei 4 C antibiotisch (z. B. 1 mg/ml Gentamycin) zu behandeln. Bakteriell kontaminierte Proben können filtriert werden. Erfolgt die virologische Untersuchung ausnahmsweise nicht sofort oder sind Wiederholungsuntersuchungen notwendig, kann die Probe bei -80 C gelagert werden. Die Untersuchung ist jedoch innerhalb von 14 Tagen vorzunehmen. Um einen IPNV-bedingten CPE auszuschließen, kann der Überstand vor der Zellkultur-Beimpfung mit IPNV-Antiseren (Titer im 50 %-Plaquetest mindestens 1:2000 gegen die einheimischen IPNV-Serotypen) gemischt und für mindestens 1 Stunde bei 15 C oder für höchstens 18 Stunden bei 4 C inkubiert werden. FLI 199
201 Virologische Untersuchung Zellkulturen und Nährmedien BF-2- oder RTG-2- und EPC- oder FHM-Zellen werden bei 20 bis 30 C mit geeigneten Medien (z. B. Eagles Minimum Essential Medium) bei Notwendigkeit mit 10 % Rinderfetenserum und Antibiotika in Standardkonzentrationen angezüchtet. Die Medien sind bei Zellvermehrung in geschlossenen Flaschen mit Bikarbonat oder bei Zellzüchtung in offenen Systemen (z. B. Zellzuchtplatten) mit Tris-HCl (23 mm) und Natriumbikarbonat auf einen ph Wert von möglichst genau 7,6 zu puffern. Zum Zeitpunkt der Beimpfung sollten die Zellkulturen frisch (4 bis 48 Stunden alt) und noch nicht zusammengewachsen (Zellen vermehren sich noch) sein. Die Empfänglichkeit (Infektionsanfälligkeit) der Zellkulturen ist alle 6 Monate durch Titration mit VHS- und IHN-Referenzvirusproben (Lagerung bei - 80 C) zu überprüfen Beimpfen der Zellkultur Die mit Antibiotikum versetzte Organsuspension wird unverdünnt und 1:10 verdünnt auf die Zellkultur gegeben, wobei das Verhältnis Inokulum: Zellkulturmedium etwa 1:10 betragen sollte. Dadurch entsteht eine Endverdünnung des Organmaterials im Zellkulturmedium von etwa 1:100 und 1:1000. Es sind mindesten 2 Zelllinien zu beimpfen. Für jede Verdünnungsstufe und Zelllinie ist eine Zellkulturfläche von mindestens 2 cm 2 (entspricht einer Mulde einer 24-Well-Zellkulturplatte) zu verwenden Bebrüten der Zellkulturen Die beimpften Zellkulturen sind für 7 bis maximal 10 Tage zu bebrüten. Bei Übersäuerung des Mediums ist der ph-wert mit steriler Bikarbonatlösung zu korrigieren. Die Zellkulturen sind täglich auf das Auftreten eines CPE zu prüfen. Bei offenkundigem CPE ist ein Virusnachweis durchzuführen Subkultivierung Tritt nach 7- bis 10-tägiger Erstbebrütung kein CPE auf, so ist die Stammkultur auf frische Zellkulturen abzuimpfen, wobei eine ähnliche Zellfläche zu verwenden ist wie bei der Stammkultur. Die Zellen können durch einen Gefrier-Tau-Prozess zerstört werden. Aliquote Volumina von sämtlichen Kulturen (Flaschen oder Mulden) jeder Zelllinie werden zu einer Sammelprobe vereint. Die Sammelproben werden wie vorn beschrieben unverdünnt und 1:10 verdünnt im Verhältnis 1:10 (wodurch Endverdünnungen des Überstandes von 1:10 bzw. 1:100 erreicht werden) in homologe Zellkulturen verimpft. Vor dem Abimpfen können die Sammelproben mit IPNV-Antiserum gemäß Punkt inkubiert werden. Die Passagen werden erneut bei 15 C für 7, maximal 10 Tage bebrütet. Tritt bei der Stammkultur ein toxischer CPE innerhalb der ersten 3 Tage des Bebrütens auf, so ist die Kultur in diesem Stadium zu passagieren. Jedoch muss diese Passage für 7 Tage und die 3. Passage nach erneuter Abimpfung für weitere 7 Tage bebrütet werden. Wenn sich der toxische CPE später als 3 Tage entwickelt, so sollte die Stammkultur nur einmal abgeimpft werden und so lange bebrütet werden, dass eine Gesamtzeit von 14 Tagen ab der Erstbeimpfung erreicht wird. In den letzten 7 Tagen des Bebrütens sollte keine Toxizität mehr auftreten. FLI 200
202 Virusnachweis Virusnachweisverfahren Bei offenkundigem Auftreten eines CPE erfolgt die Virusidentifizierung mit mindestens einem der folgenden Verfahren: Virusneutralisationstest, Immunfluoreszenztest, Enzymimmuntest. Haben diese Tests nach einer Woche keinen eindeutigen Virusnachweis erbracht, ist das Isolat an das nationale Referenzlaboratorium für Fischkrankheiten einzusenden. Die zum Virusnachweis verwendeten Diagnostika müssen bezüglich Qualität, Titer und Spezifität vom nationalen Referenzlaboratorium zugelassen sein Virusneutralisation (VNT) Das zellfreie (Zentrifugation bei 2000 bis 4000 x g oder Filtration mit 0,45 μm- Membranfilter), virushaltige Medium wird 1:1000 und 1:10000 verdünnt. Aliquote Mengen der Verdünnungen werden jeweils mit folgenden Reagenzien versetzt und für 60 Minuten bei 15 C bebrütet: gruppenspezifische VHSV (Egtved-Virus)-Antikörper, 1:50 verdünnt* gruppenspezifische IHNV-Antikörper, 1:50 verdünnt* spezifisches Antiserum (gepoolt) gegen einheimische IPNV-Serotypen (Referenzstämme Sp, Ab, VR299), 1:50 verdünnt (oder wie vom Hersteller oder vom Referenzlabor angegeben) Zellkulturmedium. Von jedem Virus-Serum-Gemisch werden 50 μl in mindestens 2 Kavitäten einer 24- Well-Zellkulturplatte (oder im Verhältnis von etwa 1:10 in andere Zellkulturgefäße) verimpft und bei 15 C bebrütet. Alternativ können auch andere erprobte Neutralisationsteste angewandt werden Immunfluoreszenztest (IFT) Für jedes Isolat sind jeweils 8 (bei Untersuchung auf IHNV und VHSV) oder 12 (bei Untersuchung auf IHNV, VHSV und IPNV) (Kavitäten (Multitest-Objektträger, 24-, 48- oder 96-Well-Zellkulturplatten) oder Deckgläser mit Zellsuspension (EPC-Zellen haften besonders gut auf Glasflächen) zu versehen. Sobald sich die Zellen auf dem Untergrund angeheftet haben (nach etwa 1 Stunde) oder nach 24-stündiger Inkubation werden je 4 (bei Untersuchung auf IHNV und VHSV) oder 6 (bei Untersuchung auf IHNV, VHSV und IPNV) Kulturen in einem Volumenverhältnis von 1:10 und 1:100 mit dem zu identifizierenden Isolat beimpft. Frühestens nach einer Bebrütungsdauer von 20 Stunden werden die Kulturen mit PBS gespült, mit Azeton, mit einem gekühltem (- 20 C) Azeton-Ethanol-Gemisch (gleiche Volumina) bei -20 C oder durch Hitze (60 Minuten bei 70 C) fixiert und z. B. in einem Zweischichten-IFT (indirekter IFT) angefärbt. Die erste Reagenzschicht besteht aus poly- oder monoklonalen Antikörpern gegen IHNV bzw. VHSV (sowie IPNV). Die zweite Reagenzschicht ist ein FITCmarkiertes Antiserum gegen das in der ersten Schicht verwendete Immunglobulin. Für jeden zu prüfenden Antikörper sind mindestens 2 hochdosierte und 2 niedrigdosierte Impfkulturen anzufärben. Bei der Untersuchung sind geeignete Negativ- und Positivkontrollen mitzuführen. Alternativ können auch andere IFT-Techniken (Zellsysteme, Fixierung, Antikörper, direkte Verfahren) angewandt werden. FLI 201
203 Enzymimmuntest (ELISA) Beispielsweise kann ein ELISA auf Biotin-Streptavidin-Basis angewandt werden. Am Vortag der Untersuchung werden die einzelnen Vertiefungen (Wells) der Mikrotiterplatte mit über Protein-A-Säulen gereinigten Antikörpern (Fangantikörper) in der empfohlenen und geprüften Verdünnung beschichtet. Nachdem ungebundene Antikörper durch einmaliges Waschen mit PBS-Tween-20-Puffer entfernt werden, erfolgt die Zugabe des zu identifizierenden Virus in der Verdünnung 1:2 oder 1:4 für 60 Minuten bei 37 C. Nach erneutem Waschen mit PBS-Tween-20-Puffer werden mit Biotin konjugierte, spezifisch gegen das gesuchte Virus gerichtete Antikörper zugegeben und für 60 Minuten bei 20 C inkubiert. Nach nochmaligem Waschen, wie vorstehend beschrieben, wird POD-konjugiertes Streptavidin zugegeben und die Mikrotestplatte für eine Stunde bei 20 C inkubiert. Die Mikrotestplatte wird letztmalig gewaschen und das gebundene Enzym durch Substratumsatz (z. B. OPD oder TMB) sichtbar gemacht. Weitere erprobte Antigen-ELISA-Varianten können angewandt werden Weitere Nachweismethoden Mit folgenden Methoden, die allerdings in der EU-Gesetzgebung noch nicht zugelassen sind, kann bei besonderen Fragestellungen IHNV oder VHSV ebenfalls nachgewiesen werden: Reverse Transkriptase-abhängige Polymerase-Kettenreaktion (RT-PCR) Immun-Elektronenmikroskopie oder Immunoblot Probennahme und Diagnoseverfahren zur Bestätigung von VHS und IHN im Verdachtsfall Probennahme Zur Untersuchung sind mindestens 10 Fische mit IHN- bzw. VHS- spezifischen Symptomen auszuwählen. Bei chronischem Verlauf der Krankheit sind Fische mit zentralnervösen Störungen (Drehbewegungen um Längsachse, spiralförmige Schwimmbewegungen) zu untersuchen. Von zentralnervös gestörten Fischen ist das Gehirn zu entnehmen. Dem zur virologischen Untersuchung eingesandten Organmaterial sind unter Umständen zusätzliche Proben für die bakteriologische, parasitologische oder sonstige Untersuchung zur Differentialdiagnose beizufügen (siehe "Diagnostic Manual for Aquatic Animal Diseases" (5) des O.I.E.) Nachweisverfahren Zur IHN- und VHS-Diagnose können folgende Verfahren angewandt werden: Herkömmliche Virusisolierung mit anschließendem Virusneutralisationstest Virusisolierung mit gleichzeitigem Virusneutralisationstest andere Diagnoseverfahren (IFT, ELISA). Der Virusnachweis hat wie unter Punkt 3.3. beschrieben zu erfolgen. FLI 202
204 Beim Virusneutralisationstest wird nach der Zentrifugation der Organsuspension und der Behandlung mit Antibiotika und IPNV-Antiserum der Überstand in Zellkulturmedium jedoch 1:10 und 1:10000 verdünnt und anschließend mit gleichen Mengen VHSV- und IHNV-Antikörpern bzw. als Kontrollansatz mit Zellkulturmedium versetzt. Die zuletzt genannten Schnellverfahren (IFT und ELISA) müssen durch den Virusneutralisationstest (siehe Punkt. 3.3.) innerhalb von 48 Stunden nach der Probennahme ergänzt werden, wenn ein negatives Ergebnis vorliegt oder ein positives Ergebnis vorliegt und das Probenmaterial von einem IHN- oder VHS-Erstausbruch in einem zugelassenen Gebiet stammt. Organmaterial kann nach anderen Diagnoseverfahren (z. B. IFT mit Gefrierschnitten oder immunhistochemische Analysen mit Formalin-fixiertem Material) untersucht werden. Diese Verfahrenstechniken müssen stets durch Verimpfung von nicht fixiertem Material auf Zellkulturen ergänzt werden Indirekter Nachweis von IHN und VHS Serologische Methoden zur Ermittlung von Antikörpern für den indirekten Nachweis der VHS und IHN sind gegenwärtig in der europäischen Gesetzgebung noch nicht zugelassen, jedoch insbesondere für epidemiologische Untersuchungen notwendig. Folgende Methoden können angewandt werden: Serumneutralisationstest in verschiedenen Modifikationen indirekter Immunfluoreszenztest verschiedene Enzymimmunteste (ELISA) Abkürzungen BF-2 Bluegill fry-2 (Zelllinie) EPC Epithelioma papulosum cyprini (Zelllinie) FHM Fathead minnow (Zelllinie) HRP Meerettich-Peroxidase IHN(V) Infektiöse Hämatopoetische Nekrose (Virus) IPN(V) Infektiöse Pankreasnekrose (Virus) MEM Minimal Essential Medium OPD Ortho-Phenyldiamin PBS Phosphat-gepufferte Kochsalzlösung RTG-2 Rainbow trout gonad-2 (Zelllinie) VHS(V) Virale Hämorrhagische Septikämie (Virus) VNT Virusneutralisationstest FLI 203
205 Bezugsquellen für diagnostische Reagenzien und Zellkulturen FLI, Insel Riems, Institut für Infektionsmedizin - Nationales Referenzlaboratorium für IHN und VHS: VHS-Referenzvirus IHN-Referenzvirus IPN-Referenzviren (Serotypen Ab, Sp, VR299) VHSV-Antiserum IHNV-Antiserum IPNV-Antiserum FLI, Insel Riems, Zentralabteilung - Zellbank: Zelllinien FHM, Katalog-Nr. CCLV RIE 57 Zelllinien RTG-2, Katalog-Nr. CCLV RIE 686 Zelllinien BF-2, Katalog-Nr. CCLV RIE 290 Kommerziell erhältliche Diagnostika: Monoklonale Antikörper Anti-VHSV Monoklonale Antikörper Anti-IHNV Monoklonale Antikörper Anti-IPNV Monoklonale Antikörper Anti-VHSV FITC-konjugiert Monoklonale Antikörper Anti-IHNV FITC-konjugiert Monoklonale Antikörper Anti-IPNV FITC-konjugiert VHSV-Antigen-ELISA IHNV-Antigen-ELISA IHNV-VHSV-Antigen-ELISA FLI 204
206 30. Koi-Herpesvirus-Infektion (KHV) Charakterisierung der Infektion Ende der 90er Jahre hat ein als Koi-Herpesvirus (KHV) bezeichnetes, neues Virus Massensterben bei Nutzkarpfen und bei Kois (Cyprinus carpio) in Israel und in Westeuropa verursacht. Die KHV-Infektion (KHV-I) hat sich durch den unkontrollierten Handel mit infizierten Kois aber auch mit Speisekarpfen weltweit verbreitet und stellt zunehmend einen Risikofaktor für die Produktion von Nutzkarpfen dar. Vor diesem Hintergrund wurde in Deutschland 2005 für die Feststellung der KHV-I bei Nutzkarpfen und 2006 für Kois die Anzeigepflicht eingeführt. Die KHV-I wurde außerdem in die Liste der bedeutsamen, nicht exotischen Krankheiten in der Neufassung der Aquakulturrichtlinie (EU-Richtlinie 2006/88/EG) aufgenommen. Auch das OIE empfiehlt für die KHV-I die Meldepflicht Erreger Als Erreger dieser neuartigen Krankheit wurde ein Herpesvirus isoliert und später als KHV bezeichnet. Die Erkrankung wird international KHV Disease (KHVD), in Deutschland aber KHV-I genannt. Wissenschaftlich wird das Virus, in Abgrenzung vom Karpfenpockenvirus (CyHV-1) und dem Goldfisch-Hämatopoetischen- Nekrosevirus (CyHV-2), als Cyprinid Herpesvirus-3 (CyHV-3) benannt. Die erste Isolierung des KHV erfolgte mit der Zelllinie von der Flosse eines Kois (koi fin cell line) KF-1. Eine weitere Zelllinie vom Gehirn des Karpfens, die common carp brain cell line (CCB), ist ebenfalls zur Anzüchtung von KHV geeignet. Beide Zelllinien be-finden sich unter den Registriernummern 843 und 816 in der Zellbank für Zelllinien in der Veterinärmedizin (CCVM) des FLI und stehen den Untersuchungsämtern zur Verfügung. Die elektronenmikroskopischen Ultradünnschnittuntersuchungen infizierter Zellen zeigten zahlreiche Stadien einer Virusproduktion, wie sie für bisher untersuchte Herpesviren beschrieben wurden. Dazu gehörten vor allem Nukleokapsidbildung im Zellkern, primäre Umhüllung an der inneren Kernmembran und die sekundäre Umhüllung im Bereich des Golgi-Apparats. Morphogenetisch besonders auffällig war allerdings die vergleichsweise große Zahl akkumulierter Nukleokapside.im Zellkern bzw. Zytoplasma Dies führte zu zahlreichen pseudokristallinen Einschlüssen im Zellkern, die häufig aus inkompletten Nukleokapsiden bestanden. Die große Anzahl produzierter Nukleokapside stand in deutlichem Widerspruch zur geringen Ausbeute an reifen Virusnachkommen. Dieses Missverhältnis dürfte auch die Beobachtung erklären, dass bei elektronenmikroskopischer Untersuchung der Virusanzüchtungen bzw. Organanreibungen infizierter Tiere im Negativkontrastverfahren nur sehr selten komplette Virionen nachzuweisen sind. Eine relativ hohe Empfindlichkeit kompletter Virionen gegenüber äußeren Einflüssen zeigt sich besonders im Nachweis zahlreicher deformierter Nukleokapside, wie sie für andere Vertreter der Herpesviridae bisher nicht bekannt sind. Das doppelsträngige DNA-Genom des KHV ist mit etwa 295 kbp größer als die Genome aller anderen bisher bekannten Herpesviren. FLI 205
207 Abbildung 1: A: KHV markiert mit polyklonalem Hyperimmunserum vom Kaninchen und kolloi-dalem Gold (10 nm, GAR 10) B: KHV markiert mit monoklonalem Antikörper mab 11A4 und kolloidalem Gold (10 nm, GAM 10). Die Markerlänge entspricht 100 nm (Fotos: Granzow, FLI Insel Riems) Klinische und pathologisch-anatomische Symptomatik Die Krankheit zeigt sich klinisch bei Wassertemperaturen zwischen 16 und 29 C, in einigen Fällen auch bei Temperaturen zwischen 8 und 12 C. Die Inkubationszeit beträgt, abhängig von der Wassertemperatur, der Virulenz des Erregers und der Empfänglichkeit der Fische, 4 bis 21 Tage, kann aber auch einige Monate dauern. In latent infizierten Fischen kann der Viruseintrag Jahre zurück liegen. Die Morbidität beträgt bei Wassertemperaturen zwischen 18 und 26 C meist 100 %, die Mortalität ist in der Regel sehr hoch und kann ebenfalls bis zu 100 % betragen. Bei den erkrankten Fischen sind die wichtigsten Symptome Atemnot, Kiemenverfärbungen und nekrosen (Abb. 2), Inappetenz bis hin zur Anorexie, Enophthalmus (Abb. 3), Flossenerosionen, Hautläsionen (meist mit verstärkter milchig-grauer Schleimbildung), später Blutungen, Schleimhautablösung und großflächige Entzündungen (Abb. 4). Inapparente latente bzw. persistente Infektionen können auftreten. Für eine KHV-I sprechen folgende klinischen Symptome: Mortalität: % (u. a. abhängig von der Wassertemperatur, der Empfänglichkeit der Fische und der Virulenz des Erregers) Apathie Atemnot Inappetenz / Anorexie Kiemenblässe und nekrosen Enophthalmus Blutungen am Flossenansatz, in den Flossen und in der Haut kreisrunde bis konfluierende Schleimhautläsionen verbunden mit Schleimhautablösungen FLI 206
208 Abbildung 2: Kieme eines erkrankten Kois mit umfangreicher Nekrose (Foto Kleingeld, LAVES Hannover Abbildung 3: Enophthalmus beim Karpfen (Foto: Bergmann, FLI, Insel Riems) Abbildung 4: Moribunder Karpfen mit vermehrter Schleimbildung (Rücken) und Blutungen an Bauch und den Flossen. (Foto: Bergmann, FLI, Insel Riems) FLI 207
209 Vorkommen Der erste Ausbruch der Krankheit bei Nutzkarpfen wurde im Mai 1998 in Israel beobachtet. Bis zum Ende des Jahres 2000 hat die Krankheit bis zu 90 % der Fischfarmen Israels erfasst und verursachte in der Aquakultur jährlich Kosten von 300 Mill. US$. In den USA wurde die Krankheit erstmals Ende 1998 bei einem Koi beobachtet. Erste Hinweise über Massensterben bei Nutzkarpfen in Verbindung mit dem KHV wurden 1997 und 1998 in Deutschland beobachtet. In den Folgejahren wurde das KHV weltweit in zahlreichen Ländern nachgewiesen. Die wirtschaftliche Bedeutung des KHV als Erreger einer neuen Fischseuche unterstreichen zwei Ausbrüche in Deutschland. Im Sommer 2003 kam es zu Ausbrüchen in 3 Teichwirtschaften in Sachsen. Die Mortalität betrug zwischen 20 und 100 %. Die Gesamtverluste betrugen 48 t Karpfen. Der direkte Schaden durch Fischverluste wurde mit etwa beziffert. Für Folgeschäden wurden nochmals errechnet. Ein weiterer KHV-I-Ausbruch wurde 2004 in einer Teichanlage in Thüringen festgestellt. Die Gesamtverluste betrugen 80 t Karpfen, mit einem direkten Schaden in Höhe von und Folgeschäden von insgesamt Nach bisherigen Kenntnissen können nur Nutzkarpfen und Kois an der KHV-I klinisch erkranken. Offensichtlich wird das KHV in weiteren Spezies, wie z. B. in Goldfischen, Karauschen, Schleien und Graskarpfen, vermehrt und weitere Fischarten stehen in Verdacht das Virus als Carrier zu beherbergen und an empfängliche Karpfen weiterzugeben Voraussetzungen für den Verdacht Gehäufte Todesfälle mit charakteristischen pathologisch-anatomischen Befunden Typische klinische Symptome Todesfälle in Verbindung mit epidemiologischen Zusammenhängen zu einem labordiagnostisch bestätigten KHV-I-Fall Epidemiologischer Zusammenhang Lebendfischbewegungen (u. a. Transporte, Zukäufe, Abgaben, Umsetzungen) Kontakte (Personen, Geräte, Wasser) zu anderen Betrieben Aussetzen KHV-infizierter Karpfen / Koi-Karpfen in Gewässer weitere Spezies (u. a. Goldfische, Schleien, Graskarpfen, Karauschen, Störe) können Überträger des KHV sein, ohne selbst zu erkranken Bekämpfung Derzeitig konzentrieren sich die Maßnahmen in der EU auf die Bekämpfung und die Verhinderung der weiteren Ausbreitung der KHV-I. Die Strategie zur Zurückdrängung dieser Fischseuche basiert auf der Schaffung anerkannt seuchenfreier Aquakulturbetriebe, Zonen oder Länder. In Deutschland hat nach der neuen Fischseuchen-VO vom eine Registrierung aller Fischhaltungsbetriebe zu erfolgen. Nach Prüfung der Unterlagen ist zu entscheiden, ob von dem Betrieb eine Seuchengefahr ausgehen kann und deshalb das Halten von Fischen genehmigungspflichtig ist. Nach der Registrierung sind die Fischhaltungsbetriebe in die Kategorien I als seuchenfrei erklärt bis V Infektionen FLI 208
210 nachgewiesen einzuordnen. Die Kategorisierung dient in erster Linie der Feststellung der Kontrollhäufigkeit und der Feststellung der möglichen Lebendfischbewegungen. Fische dürfen zum Zwecke des Besatzes grundsätzlich nur in Betriebe gleicher oder niedrigerem Kategorie-Status (höhere Kategorie-Nr.) verbracht werden. Kategorie IV- und Kategorie II-Betriebe dürfen Fische allerdings ausschließlich nur aus Kategorie I-Betrieben, also keine Fische aus Betrieben mit gleichem Status, zukaufen. Bei amtlicher Feststellung der KHV-I in einem Fischhaltungsbetrieb sind die seuchenkranken oder seuchenverdächtigen Fische zu töten und unschädlich zu beseitigen. Es werden Sperr- und Beobachtungsgebiete festgelegt und Maßnahmen zur Tilgung des Seuchenherdes erlassen. Bei der KHV-I werden in Ergänzung zu den Festlegungen in der Fischseuchen-Verordnung gesonderte Maßnahmen getroffen Zuständige Untersuchungseinrichtungen Die labordiagnostischen Untersuchungen (virologisch/molekularbiologisch) zum Nachweis der Freiheit der Fischbestände von diesen Krankheitserregern bzw. zur Überwachung der Seuchenfreiheit sowie zur Bestätigung von KHV-I-Verdachtsfällen werden in den zugelassenen und akkreditierten Laboren und Untersuchungseinrichtungen in den Bundesländern durchgeführt. Das Nationale Referenzlaboratorium für die KHV-I (NRL KHV-I) am Friedrich-Loeffler-Institut Insel Riems koordiniert die Diagnose auf der Grundlage der EU- und nationalen Gesetzgebung. Zur Klärung fraglicher / verdächtiger Befunde oder zur Bestätigung der Ergebnisse der regionalen Diagnoselaboratorien bei Ausbruch der KHV-I in einem bisher freien Gebiet sind Virusisolate bzw. Amplifikate / Organmaterial / extrahierte DNA zur Identifizierung oder weiteren Charakterisierung an das NRL KHV-I einzusenden. Repräsentative Isolate oder Nukleinsäure-Präparationen werden dem EU-Referenzlaboratorium übergeben, das die Diagnostik der Fischseuchen auf EU-Ebene koordiniert Rechtsgrundlagen KHV-I wurde in Deutschland im Dezember 2005 in die Verordnung über anzeigepflichtige Krankheiten aufgenommen. Die Anzeigepflicht für KHV-I wurde zunächst nur auf den Nachweis bei Nutzkarpfen beschränkt, 2006 jedoch auch auf Kois ausgedehnt. In der EU-Richtlinie 2006/88/EG ist die KHV-I im Anhang IV in der Liste der nichtexotischen Krankheiten aufgeführt, für die bei Feststellung Mindestbekämpfungsmaßnahmen festgelegt wurden. Die Überführung der EU-Richtlinie in nationales Recht erfolgte durch die Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (Fischseuchen-Verordnung). Seit Januar 2006 besteht auch Meldepflicht beim OIE. Die Diagnose und Bekämpfung der KHV-I wird in Deutschland durch die Fischseuchen-Verordnung in Verbindung mit der Verordnung über anzeigepflichtige Krankheiten auf der Grundlage der EU-Richtlinie 2006/88/EG geregelt. FLI 209
211 Eine Anleitung zur Diagnose der KHV-I und weiterer, gegebenenfalls differentialdiagnostisch abzugrenzender, Fischkrankheiten ist auch im "Manual for Diagnostic Tests for Aquatic Animals" des OIE erschienen. Eine derartige Diagnose-Richtlinie für die Harmonisierung der KHV-Diagnostik in der EU in Form eines Handbuches ist im Entwurf erschienen Untersuchungsmaterial Zeitplan Der Betreiber eines Fischhaltungsbetriebes hat seinen Fischbestand regelmäßig durch die zuständige Behörde und durch die mit der Gesundheit von Wassertieren befassten qualifizierten Dienste, in Deutschland sind das i. d. R. die Fischgesundheitsdienste, klinisch und ggf. auch virologisch untersuchen zu lassen. Die Kontrollhäufigkeit ist abhängig von der Einordnung des Aquakulturbetriebes in die Kategorien und der damit festgelegten Art der Überwachung laut EU-Richtlinie 2006/88/EG und im Anhang III, Teil B dieser Richtlinie festgelegt. Es wird empfohlen, die Probennahme an Fischen, die mindestens vier Monate alt sind, durchzuführen. Dabei sollte während einer Zeitspanne von wenigstens 4 Wochen eine Wassertemperatur von C oder höher gewährleistet sein. Es wird angeraten, dass zu untersuchende, gesunde Fische mindestens 24 h vor der Beprobung separat gesetzt werden. Wird als Ergebnis der klinischen und pathologisch-anatomischen Untersuchung oder aufgrund epizootiologischer Erhebungen der Verdacht des Ausbruchs einer KHV-I geäußert, sind Fische oder Organproben an die zuständige diagnostische Einrichtung zur labordiagnostischen Prüfung einzusenden Wahl und Entnahme der Proben Die Probennahme ist beim Nutzkarpfen und beim Koi und gegebenenfalls bei weiteren empfänglichen Arten durchzuführen. Alle Produktionseinheiten (Teiche, Rinnen, Behälter, Netzkäfige usw.) sind auf verendete, geschwächte oder verhaltensgestörte Fische zu kontrollieren. Proben sind je nach Fischalter und -herkunft gesondert zu entnehmen. Bei der Probeauswahl sind bevorzugt geschwächte, verhaltensgestörte, moribunde oder frisch verendete Fische (ohne Anzeichen der Zersetzung) zu berücksichtigen. Die zu untersuchende Proben sollten bei klinisch kranken Tieren unter 5 cm aus mindestens 20 Tieren (2 Pools à 10 Fische), bei klinisch kranken Fischen über 5 cm Länge aus mindestens 10 Fischen (2 Pools à 5 Fische) bestehen. Klinisch unauffälligen Fischen sollten mindestens 24 h, aber höchsten 5 Tage vor der Beprobung, separat gehältert werden. Zur Beprobung sollten bei Fischen unter 5 cm mindestens 20 Tiere (4 Pools à 5 Fische), bei Fischen über 5 cm mindestens 10 Tiere in 5 Pools mit 2 Tieren verwendet werden. Von den Fischen sind Organe bzw. Organteile (Kiementeile und Rumpfniere) zu entnehmen. Bei Laichfischen oder anderen Fischen, bei denen eine Tötung vermieden werden soll, kann sich die Probennahme auf Blutentnahme zur Leukozytenseparation bzw. auf Kiemeabstriche nach mindestens 24-stündiger aber höchsten 5 Tage separater Haltung beschränken, wenn die zuständige Behörde nichts anderes anordnet. FLI 210
212 Kiemenabstriche Zur zusätzlichen Absicherung können Kiemeabstriche mit sterilen Ohrtupfern von gestressten Tieren (24 Stunden bis 5 Tage nach der Stressung, Einzeltieruntersuchungen) bzw. beim Ausbruch (Abb. 5 a) in Isopropanol (1 ml Isopropanol) oder direkt in einem PCR-Lysis-Puffer (z. B. 100 µl ATL mit Proteinase K, Qiagen) in einem sterilen 2 ml Eppendorfgefäß ungekühlt versandt werden. Auf den Tupfern muss Blut zu erkennen sein (Abb. 5 b). Bei der Verwendung von PCR-Lysis-Puffer muss die DNA-Extraktion spätestens 48 h nach Probennahme erfolgen. Werden die Kiemenabstriche in Isopropanol transportiert oder gelagert, müssen die Eppendorfröhrchen zentrifugiert (3000 U / min, 10 min, 4 C), das Isopropanol unter Erhalt des entstandenen Pellets abgegossen und des Ohrtupfers kurz (5-10 min) getrocknet werden. Der getrocknete Ohrtupfer wird anschließend zum Pellet gegeben und mit z. B. 100 µl ATL Lysispuffer mit Proteinase K für mindestens 3 h bei 56 C inkubiert. Während der Vorbereitung für die DNA-Extraktion mit dem z. B. Qiagen-Kit wird der Ohrtupfen danach bis Überführung der Lösung auf die Silikat-Säulchen immer im Eppendorfgefäß belassen. Abbildung 5a: Kiemenabstrich beim Karpfen (Fotos: Bergmann, FLI, Insel Riems) Abbildung 5b: Blutiger Tupfer Zum Ausschluss einer latenten / persistenten Infektion mit dem KHV sollten die Fische mittels eines simulierten (Abkeschern und für 30 sec bis 1 min an der Luft halten) oder eines tatsächlichen Transports dazu gebracht werden, das latente / persistente KHV zu reaktivieren. Die Probennahme soll frühestens nach 24 h, spätestens jedoch nach 5 Tagen nach dem Transport wie beschrieben erfolgen Aufbereitung und Einsendung der Proben Lebende Fische sind in geeigneten Transportbehältnissen gekühlt (mind. 10 C) und auf dem schnellsten Weg zur Untersuchungsstelle zu transportieren. Frisch-tote Fische können unzerteilt zum Labor gesandt werden, sofern die Temperaturanforderungen (Kühlung, mind. 10 C im Transportgefäß) während der Beförderung erfüllt werden können (nicht einfrieren). Organe/Organteile (Kieme und Niere) und/oder Blutproben (Gerinnungshemmer, z. B. Heparin) sind unter sterilen Kautelen zu entnehmen und in ein steriles Kunststoffröhrchen mit Transportmedium (z. B. Zellzuchtmedium mit 10-fachem Antibiotika- Zusatz) zu geben. Die Proben sind sofort auf unter 10 C zu kühlen. FLI 211
213 Während Blutproben und Abstriche von Einzeltieren einzusenden sind (keine Poolproben), können Organe als Sammelproben zur Untersuchung übergeben werden. Eine Sammelprobe kann Organteile von höchstens 5 klinisch erkrankten Fischen über 5 cm und von höchstens 10 klinisch erkrankten Fischen unter 5 cm (2 Pools a 10 Fische, insgesamt mindestens 0,5 g) je Probengefäß beinhalten. Bei klinisch unauffälligen Fischen sollten bei Tieren über 5 cm höchsten 2 Fische und bei Tieren unter 5 cm höchsten 5 Fische im Pool untersucht werden. Im Gegensatz dazu empfiehlt das OIE-Referenzlabor umgekehrt beim klinischen KHV-I-Ausbruch nicht mehr als 2 Fische zu poolen, bei unauffälligen, gesunden Fischen sogar bis zu 5 Tieren im Pool. Die Probengefäße sind in Isolierbehältern, gekühlt zum Labor zu transportieren. Der Einsendetermin soll mit der Untersuchungsstelle abgesprochen sein. Im Einvernehmen mit dem Diagnoselaboratorium kann weiteres Probenmaterial entnommen und für weitere Untersuchungen aufbereitet werden. Für den Versand von Probenmaterial in Alkohol, wenn nicht innerhalb von 48 h untersucht werden kann, wird Isopropanol (100 %) empfohlen bzw. ein PCR-Lysis- Puffer empfohlen. Ethanol in jeglicher Konzentration scheint ungeeignet zu sein und kann nach einer Lagerungszeit der Proben von über 7 Tagen zu falsch-negativen Ergebnissen führen Untersuchungsgang Aufbereitung der Proben für die Untersuchung Die Methode der Wahl ist die molekularbiologische Untersuchung mittels PCR (Genomnachweis). Organteile sind zu entnehmen, anzureiben und nach Extraktion (mindestens 4 h bei 15 C oder über Nacht bei 4 C) zu zentrifugieren. Der Überstand kann für die virologische Untersuchung und das Zentrifugat (Pellet) für den Genomnachweis verwendet werden. Die DNA ist sofort z. B. mit der DNAzol -Methode (Invitrogen) oder mittels Silikatsäulchen (Qiagen) zu extrahieren. Die extrahierte DNA kann bei 20 C für mindestens drei Monate eingefroren bleiben. Für den Genomnachweis können bei Fischen über 5 cm Länge die Organe von bis zu 2 Fischen (insbesondere Kieme und Niere) zusammen bearbeitet werden. Fische unter 5 cm können zu je 5 Exemplaren zusammen bearbeitet werden. Von den heparinisierten Blutproben ist für den Virusgenom-Nachweis die Leukozytenfraktion unter Verwendung von Histopaque 1077 (Sigma), Percoll (Sigma) oder Lympho-Prep (AXIS-SHIELD PoC AS, Dänemark) nach Angaben der Hersteller zu gewinnen Gewinnung der Leukozytenfraktion aus heparinisiertem Blut Fische werden betäubt und aus der Schwanzvene oder dem Herzen wird Blut mit einer passenden Spritze (je kleiner die Fische, desto kleiner die Spritze und die Kanüle) gewonnen. Mengen zwischen 0,5 und 1 ml sind optimal für die Fraktionierung. Es können aber auch wesentlich kleinere Mengen (50 bis 200 μl Blut) verwendet werden. Das Blut wird sofort nach der Entnahme in ein isotonisches Medium, bestens geeignet ist Zellkulturmedium, im Verhältnis 1:3 bis 1:4 gegeben, geringere Mengen sind möglich. Die Suspension ist sofort auf unter 10 C zu kühlen. Die weitere Bearbeitung sollte spätestens nach 30 min bis maximal 1 h erfolgen, da das Blut FLI 212
214 gerinnen könnte. Die Suspension wird auf 3 ml z. B. Histopaque 1077 überschichtet und danach für 40 min bei 800g und 4 C zentrifugiert. Die Leukozytenfraktion befindet sich i.d.r. deutlich sichtbar im klaren Überstand. Nach Abnahme der Leukozyten (ca. 1 bis 2 ml) mit einer Pipette sind diese mit 10 ml PBS- zu waschen. Nach vorsichtiger Mischung wird erneut zentrifugiert (10 min, 900 bis 1000 g, 4 C). Gegebenenfalls ist dieser Waschvorgang zu wiederholen. Das entstehende Pellet wird in 1 ml PBS- aufgenommen und es erfolgt eine Zählung der weißen Blutzellen. Zur weiteren Untersuchung bzw. zur Verwendung in der PCR bzw. der Zellkultivierung werden die Leukozyten auf 1x10 7 Zellen/ml eingestellt. Geringere Zellzahlen sind möglich, bei höheren Zellzahlen kann z. B. die PCR inhibiert werden. Für die PCR wird anschließend 1 ml mit eingestellter Zellzahl abgenommen, die Zellen wiederum pelletiert (1000 g, 10 min, 4 C), der Überstand entfernt und das Pellet in 200 μl PBSresuspendiert. Diese Leukozyten-Präparation kann für die IFT, die in-situ Hybridisierung (ISH) und für die PCR verwendet werden. Abbildung 6: Blutentnahme aus der Schwanzvene eines Koi (Foto Kleingeld, LAVES Hannover) Leukozytenproben müssen einzeln bearbeitet werden. Es wird empfohlen, die Leukozyten auf maximal 1 x 10 7 Zellen/ml einzustellen. Wurde die Probe nicht in einem antibiotikahaltigen Medium versandt, ist die Anreibung bei der Extraktion (4 Stunden bei 15 C oder über Nacht bei 10 C) mit antibiotikahaltigem Medium durchzuführen. FLI 213
215 Genomnachweis in Organanreibungen und in Leukozyten- Präparationen Empfohlen wird die Aufarbeitung von 25 bis 50 mg Organmaterial oder 1x 10 7 Leukozyten/ml von einem Fisch. Die DNA wird mittels DNAzol -Methode (Invitrogen) bzw. Silikatsäulen (Qiagen) gewonnen. Bei der Extraktion ist darauf zu achten, dass es, entsprechend der Herstellerangaben, zu keiner Überladung der Säulchen mit DNA kommt, dies besonders bei Poolproben. Die sensitivsten genomischen Methoden zum KHV-Nachweis sind: 1. die realtime PCR nach Gilad et al., 2004 (5), 2. die PCR nach Gilad et al., 2002 (4) gefolgt von der 3. nested PCR (Bergmann et al., 2006 (2)) mit den Primerpaaren KHV-1Fn-1Rn nach der Gilad-PCR (4) oder 4. die one-tube semi-nested PCR nach Bergmann et al., 2010 (3). Neue in Europa auftretende KHV reagieren nicht in der PCR nach Bercovier et al., 2005 (1), teilweise auch nicht mit den PCRs nach Gilad et al., 2002 (4), gefolgt von der nach Bergmann et al., 2006 (2). Die PCR nach Bercovier et al., 2005 (1) wird daher nicht zur Diagnostik empfohlen PCR zum KHV-Genomnachweis Neben der empfohlenen realtime PCR (5) kann die Untersuchung auch entsprechend der Empfehlungen des OIE-Referenzlabors in Weymouth (UK) auch mit einer konventionellen PCR, der sich eine nested PCR anschließt, durchgeführt werden. In diesem Untersuchungsgang besteht allerdings eine hohe Kontaminationsgefahr im Labor. Um diese Gefahr zu minimieren wurde eine one tube semi-nested PCR (3) entwickelt, welche die gleiche Sensitivität und Spezifität wie die realtime PCR (5) besitzt und ca. 5 bis 10 Viruspartikeln in 25 bis 30 mg Gewebe bzw. in 10 7 Leukozyten/ml nachweisen kann. Vom OIE-Referenzlabor wird weiterhin die Verwendung der GoTaq DNA- Polymerase (Promega) empfohlen. Als Mastermix für die PCR kann folgende Reaktionsmischung verwendet werden: 25 μl PCR-Ansatz mit verschiedenen DNA-Template-Volumina (Angaben in μl, alle Primer mit 50 pmol/µl)) PCR- 5x MgCl 2 dntp s Primer (s+) Primer GoTaq DNA Wasser buffer (s-) 13,7 5* 2,5* 0,25* 0,5 0,5 0,125* 2,5 μl 11,2 5* 2,5* 0,25* 0,5 0,5 0,125* 5,0 μl * im GoTaq Flexi-Kit (Promega) enthalten Folgende Primerpaare werden für die PCR empfohlen: Gen des KHV Fragment (ORF 89-90) Vorwärtsprimer Rückwärtsprimer Referenz / Fragmentgröße 5 -GAC GAC GCC GGA 5 -CAC AAG TTC AGT Gilad et al. (2002 GAC CTT GTG-3 CTG TTC CTC AAC-3 (4) / 484 bp FLI 214
216 Für die nested PCR im Anschluss an die PCR nach Gilad et al. (2002) werden folgende Primer empfohlen (Bergmann et al (4)): Gen des KHV Vorwärtsprimer Rückwärtsprimer Referenz Fragment 5 -CTC GCC GAG CAG 5 -TCA TGC TCT CCG Bergmann et al. (ORF 89-90) AGG AAG CGC-3 AGG CCA GCG G-3 (2006 (2)) / 414 bp Um eine Vergleichbarkeit der Reaktionen zu gewährleisten, wurde die PCRs so adaptiert, dass sie nur ein Programm benötigen. Als PCR-Programm wird empfohlen: PCR nested PCR Initiale Denaturierung 5 min, 95 C 5 min, 95 C Denaturierung 1 min, 95 C 30 sec, 95 C Annealing 1 min, 65 C 34 Zyklen 30 sec, 65 C 25 Zyklen Polymerisation 1 min, 72 C 30 sec, 72 C Finale Polymerisation 7 min, 72 C 7 min, 72 C Im negativen Fall, aber auch zur Routinediagnostik, kann eine neu etablierte ontube semi-nested PCR (2) verwendet werden. In diesem Fall werden 4 Primer (ein Vorwärts- und 3 Rückwärts-Primer) eingesetzt. Für die one-tube semi-nested PCR (sn PCR) wird folgender Mastermix (Primer je 50 pmol/µl) empfohlen (alles in µl): PCR- 5x MgCl 2 dntp s Sn F Sn R Sn R Sn R GoTaq DNA Wasser buffer x ,5 1,0 0,2 0,3 0,6 0,125 2,5 1x 7, ,5 1,0 0,2 0,3 0,6 0,125 5 Als Primer werden verwendet: Gen des Sn F 1 Sn R 1 Sn R 2 SnR 3 Referenz KHV ORF 56 ggtacttgttgg cgtacatggc cgg ttg tca gca gca cct caa gcg agg agc aca tcg cgc cgt ggt ggc cgt cgc Bergmann et al. (2010 (3)) Als Programm wird empfohlen: sn PCR Initiale Denaturierung 5 min, 95 C Denaturierung 1 min, 95 C Annealing 1 min, 68 C 5 Zyklen Polymerisation 1 min, 72 C Denaturierung 1 min, 95 C Annealing 1 min, 65 C 20 Zyklen Polymerisation 1 min, 72 C Denaturierung 1 min, 95 C Annealing 1 min, 60 C 20 Zyklen Polymerisation 1 min, 72 C Finale Polymerisation 7 min, 72 C Mögliche Produkte sind: 462 bp (F1-R1), 372 bp (F1-R2), aber hauptsächlich 182 bp (F1-R3). FLI 215
217 Virologische Untersuchung und Isolierung der KHV in Zellen Virologische Nachweise in Zellkulturen sind zum Nachweis und Charakterisierung von KHV ungeeignet, da sich das Virus selten in den zur Verfügung stehenden Zelllinien KF-1 und CCB isolieren lässt Antigen- und Erregernachweis Der Antigennachweis und die Identifizierung des Virus kann nach erfolgreicher Isolierung in der Zellkultur mittels Immunfluoreszenztest erfolgen. Es wird die Verwendung monoklonaler Antikörper gegen das KHV empfohlen. Virus-Antigen kann bei akuten Ausbrüchen mit einem kommerziellen KHV-Antigen- ELISA (Kovax, Israel) nachgewiesen werden. Der ELISA benötigt für einen positiven Nachweis jedoch große Mengen an KHV im Organ bzw. den Fäces. Die zum Nachweis verwendeten Diagnostika müssen zugelassen und vom nationalen Referenzlaboratorium geprüft sein Weitere Angaben zum Genom-, Virus- und Antikörpernachweis 1. Bercovier H., Fishman Y., Nahary R., Sinai S., Zlotkin A., Eyngor M., Gilad O., Eldar A. and R. Hedrick (2005) Cloning of the koi herpesvirus (KHV) gene encoding thymidine kinase and its use for a highly sensitive PCR based diagnosis. BMC Microbiology 5, Bergmann, S. M., Kempter, J., Sadowski, J. and Fichtner, D. (2006) First detection, confirmation and isolation of koi herpesvirus (KHV) in cultured common carp (Cyprinus carpio L.) in Poland. Bulletin of European Association of Fish Pathologists 26: Bergmann Sven. M., Meike Riechardt, Dieter Fichtner, Peiyu Lee, Jolanta Kempter (2010) Investigation on the diagnostic sensitivity of molecular tools used for detection of koi herpesvirus (KHV). Journal of Virological Methods 163: Gilad, O., Yun, S., Andree, K.B., Adkinson, M.A., Zlotkin, A., Bercovier, H., Eldar, A. and Hedrick, R.P. (2002). Initial characteristics of koi herpesvirus and development of a polymerase chain reaction assay to detect the virus in koi, Cyprinus carpio koi. Dis. Aquat. Org. 48: Gilad O, Yun S, Zagmutt-Vergara FJ, Leutenegger CM, Bercovier H, Hedrick RP (2004) Concentrations of a koi herpesvirus (KHV) in tissues of experimentally infected Cyprinus carpio koi as assessed by real-time TaqMan PCR. Dis Aquat Org 60: FLI 216
218 Abkürzungen PCR Polymerase-Kettenreaktion PBS Phosphat-gepufferte Salzlösung CCB common carp brain cells KF-1 koi fin-1 cells Cytopathischer Effekt CPE Bezugsquellen für diagnostische Reagenzien und Zellkulturen FLI, Institut für Infektionsmedizin, Insel Riems, NRL für die KHV-I: KHV-Referenzvirus (KHV-I, USA) KHV-Nukleinsäure-Präparation KHV-Antiserum (vom Kaninchen) Anti-KHV monoklonaler Antikörper Zelllinien RIE 816 (CCB) und RIE 843 (KF-1) vom CCLV Insel Riems Kommerziell erhältliche Diagnostika Monoklonale Antikörper Anti-KHV (BioX Belgien) Monoklonale Antikörper Anti-KHV (Aquadiagnostics, ADL, UK) FLI 217
219 31. Lumpy-skin-Krankheit (Dermatitis nodularis) Die Lumpy skin Erkrankung wird durch das Capripoxvirus bovis nodularis aus der Gattung Capripoxvirus verursacht. Das Virus gehört zu den Pockenviren und ist nah mit den Erregern der Schaf- und Ziegenpocken verwandt. Für weitere Informationen siehe Kapitel 32. Pockenseuche der Schafe und Ziegen. In Deutschland anzeigepflichtig seit: FLI 218
220 32. Lungenseuche der Rinder Charakterisierung der Infektion Erreger Mycoplasma mycoides subspecies mycoides Small Colony Type (MmmSC). Es handelt sich dabei um die kleinsten auf zellfreiem Medium wachsenden Bakterien (0,3 bis 0,8 µm), die zur Klasse Mollicutes gehören. Sie besitzen keine Zellwand und bilden auf festem Nährmedium typische spiegeleiförmige Kolonien Klinische Symptomatik Die Lungenseuche ist eine hochkontagiöse bakterielle Erkrankung der Rindergattung, bei der erwachsene Tiere in erster Linie am Atmungsapparat und Kälber vor allem an den Gelenken erkranken. Außer beim Hausrind kommt die Lungenseuche auch beim Büffel, Yak und Bison vor. Die Lungenseuche ist weit verbreitet in Afrika und einigen Ländern Asiens (aktuelles Vorkommen der Krankheit siehe unter ). In Europa traten die letzten Fälle 1999 in Portugal auf. Weitere Ausbrüche gab bis in den 90er Jahren in Spanien und Italien. Deutschland ist seit vielen Jahren frei von Lungenseuche. Der letzte Fall in Deutschland stammt aus dem Jahre Aufgrund des verbreiteten Tierhandels besteht allerdings jederzeit Einschleppungsgefahr für Deutschland. Der Erreger der Lungenseuche wird primär über ausgehustetes Sekret (aerogene Infektion) übertragen. Während der Inkubationszeit von 2 bis 6 Wochen (teilweise bis zu 6 Monate) wird der Erreger von den gesund erscheinenden Tieren bereits ausgeschieden. Die Krankheit beginnt mit trockenem, kurzem Husten und Fieber. Nach weiteren Wochen zeigen sich deutliche Atembeschwerden gekennzeichnet durch schmerzhaften Husten, Auswurf, schleimig-serumhaltigen Nasenausfluss, hohe Pulsfrequenz, Verstopfung und Durchfall im Wechsel, Abmagerung, geringe Harnausscheidung (dunkelgelb bis braun). Die Futteraufnahme, das Wiederkauen sowie die Milchleistung gehen zurück. Bei jungen Tieren verläuft die Krankheit oft schnell, bei älteren Tieren häufig langsamer. 50 bis 80 % der Fälle enden tödlich, wobei die Mortalitätsrate in neu infizierten Beständen höher ist als in Herden, in denen die Lungenseuche bereits vorher auftrat. Die Seuche breitet sich innerhalb eines Bestandes relativ langsam aus. Genesene chronisch infizierte Tiere bleiben jahrelang Ausscheider und sind eine ständige Ansteckungsquelle. Bei Kälbern bis zu einem Alter von ca. 6 Monaten stehen meistens Polyarthritiden im Vordergrund. Bei ihnen führt die Krankheit schnell zu schmerzhaften und heißen Umfangsvermehrungen der Gelenke an den Gliedmaßen verbunden mit Lahmheiten (besonders Karpal- und Tarsalgelenke). Gleichzeitiges Auftreten von Pneumonie-Symptomen bei erwachsenen Rindern und Arthritiden bei Kälbern geben einen wichtigen Hinweis auf das Vorliegen von Lungenseuche bei der klinischen Verdachtsdiagnose. FLI 219
221 Grundsätzlich kann zwischen akuten und chronischen Verläufen unterschieden werden, wobei die klinische Diagnose bei chronischem Verlauf ungleich schwieriger ist als bei akuter Lungenseuche. Allerdings gibt es hier viele Übergangsformen Differentialdiagnostik Für die Differentialdiagnostik relevant sind unspezifische katarrhalische und fibrinöse Pneumonien, Wurmbefall, Rinderpest, Tuberkulose und die pektorale Form der Pasteurellose Diagnostische Indikation Die Einleitung diagnostischer Untersuchungen wird auf der Grundlage folgender Feststellungen getroffen: a) klinische Symptome b) pathologische Veränderungen c) serologische Befunde d) epidemiologische Befunde Zuständige Untersuchungseinrichtungen benannte Veterinär- und Lebensmitteluntersuchungsämter der Länder (siehe Anhang 1) FLI, NRL für die Lungenseuche der Rinder, Jena Telefon: 03641/8040 Telefax: 03641/ Rechtsgrundlagen Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Untersuchungsmaterial Von lebenden Tieren ca. 10 ml Nativblut zur Serumgewinnung oder 5 ml Serum 5 ml Pleuralexsudat (Entnahme zwischen 7. und 8. Rippe im unteren Brustbereich) Nasenabstriche (mit sterilen Nasentupfern) Von getöteten oder verendeten Tieren verändertes Lungengewebe am Übergang zum gesunden Gewebe (ca. 4x 4x 4 cm) Lnn. mediastinalis in toto, tributäre Lymphknoten 5 bis 10 ml Brusthöhlenexsudat 10 ml Blut (Herzblut) von Kälbern auch Gelenkflüssigkeit FLI 220
222 Transport Die Proben sind schnellstmöglich in gekühltem, nicht gefrorenem Zustand an die untersuchende Stelle zu senden. Das Untersuchungsmaterial muss vorschriftsmäßig in dicht schließenden Behältnissen verpackt und zusammen mit dem Vorbericht und dem Untersuchungsantrag an die zuständige Untersuchungseinrichtung geschickt werden. Versandbehältnis und Probengefäße müssen eindeutig beschriftet sein. Dabei sind folgende Vorschriften einzuhalten: Gefahrgutverordnung für den Transport auf der Straße bzw. mit der Eisenbahn Infektionsschutzgesetz IATA-DGR in der jeweils gültigen Fassung für den Transport auf dem Luftweg DIN EN 829 Wegen möglicher Gefährdungen während des Transportes sollte das Untersuchungsgut durch einen Kurier übermittelt werden. Der Einsender sollte zum frühstmöglichen Zeitpunkt das Untersuchungslaboratorium von der bevorstehenden Sendung in Kenntnis setzen Untersuchungsgang Die Lungenseuche gilt als nachgewiesen, wenn der Erreger in der zuständigen Untersuchungseinrichtung zweifelfrei identifiziert wurde. Die zuständige Untersuchungseinrichtung ist das nationale Referenzlabor für die Lungenseuche der Rinder in Jena. Serologische Reaktionen in Verbindung mit einem epidemiologischem Kontakt zu einem Lungenseuche-Ausbruch oder mehrere serologisch positive Befunde in einer Rinderherde führen, unabhängig vom Vorliegen klinischer bzw. pathologischanatomischer Befunde, zu einem Lungenseuche-Verdacht. Der Verdacht kann nur durch den Amtstierarzt ausgesprochen werden. Dies gilt ebenfalls für die amtliche Feststellung eines Lungenseuche-Ausbruchs. Die KBR ist laut OIE das vorgeschriebene serologische Testverfahren. Alternativ kann ein kommerziell verfügbarer kompetetiver ELISA nach den Vorgaben der OIE angewendet werden. Dieser ist allerdings für Deutschland nicht zugelassen und somit nur im nationalen Referenzlabor Jena bzw. nur nach Ausnahmegenehmigung in den entsprechenden Landesbehörden anwendbar. Erregernachweis bei Verdacht auf Lungenseuche Die Anzucht von Mykoplasmen ist in den meisten Untersuchungsämtern möglich und dauert im Durchschnitt 5 bis 7 Tage, die darauf folgende Erregerdifferenzierung noch weitere 10 bis 12 Tage. Ein negatives Ergebnis wird innerhalb von 10 Tagen ausgewiesen. Der positive Nachweis kann bis zu 20 Tagen in Anspruch nehmen. Wichtiger Hinweis: Bei Verdacht eines Erstausbruchs ist Organmaterial einschließlich evtl. vorhandener oder verdächtiger bereits isolierter Kulturen, verdächtige Seren bzw. Blutproben parallel direkt an das Referenzlabor für die Lungenseuche der Rinder zu senden (FLI, Standort Jena, Naumburger Str. 96a, Jena, Tel ). Die Proben sind vorher telefonisch anzumelden (siehe auch unter Untersuchungsmaterial). FLI 221
223 Im positiven Fall ist mittels PCR ein sicherer Nachweis innerhalb von 48 Stunden möglich. Die PCR wird im nationalen Referenzlabor für Lungenseuche durchgeführt. Werden in den Untersuchungsämtern bei der serologischen Untersuchung auf Lungenseuche mittels KBR positive Proben festgestellt, so sind diese Tiere bis zur Abklärung im nationalen Referenzlabor als Verdachtsfälle einzustufen und der entsprechende Bestand ebenfalls als verdächtig für die Lungenseuche zu behandeln, auch wenn keine weiteren Hinweise für das Vorliegen eines Lungenseucheausbruchs sprechen. Dem Referenzlabor sind in diesem Fall neue Blutproben (ohne Gerinnungshemmer) sowie Nasentupfer der entsprechenden Tiere zuzuleiten Erregernachweis Anzüchtung mit anschließender Immunfluoreszenz Anzüchtung: Als Mykoplasmen-Nährmedien werden Medium B-Bouillon (Anhang 2) und -Agar (Anhang 3) verwendet. Zur Unterdrückung der bakteriellen Begleitflora muss bei der Primärisolierung dem flüssigen Nährmedium unmittelbar vor der Beimpfung Penicillin (1000 IE/ml) zugesetzt werden. Zur Beimpfung sind möglichst kleine Stücke des Untersuchungsmaterials in das flüssige Nährmedium einzubringen, d. h. je ein stecknadelkopfgroßes Organstückchen (Die Ausgangsproben sollten vor dem Zerkleinern zwecks Beseitigung von Begleitflora kurz abgeflammt werden.) Das beimpfte flüssige Nährmedium wird 4 bis 5 Tage bei 37 C bebrütet. Danach wird die Kultur auf Medium B-Agar übertragen und anschließend 2 bis 4 Tage bei 37 C in feuchter Umgebung und bei 3 bis 5 % CO 2 inkubiert. Das Mykoplasmenwachstum kann auf der Agarplatte mikroskopisch mit einer Lupenvergrößerung bei leicht dezentriertem grünem Licht beurteilt werden. MmmSC entwickelt auf festen Nährmedien durchscheinende Kolonien von 0,1 bis 1 mm Durchmesser, welche meist als raue, vakuolisierende granuläre Formen erscheinen. Immunfluoreszenztechnik (IFT): In der Regel wird die IFT dem nationalen Referenzlabor vorbehalten bleiben, da den meisten Untersuchungsämtern nicht alle notwendigen Antiseren und Mykoplasmenstämme zur Verfügung stehen und das Referenzlabor diese Seren und Bakterienstämme nicht zur Verfügung stellen kann. Geräte/Gebrauchsmaterialien Brutschrank 37 C 2 C und 3 bis 5 % CO 2, Fluoreszenzmikroskop Spezialküvette, Spatel, Skalpell, Meßpipetten 10 ml; Ampullensäge FLI 222
224 Rezepturen/Reagenten lyophilisierte Stämme: - die Ampulle mit dem lyophilisierten Stamm mit einer vorher 1 min mit Sterillium desinfizierten Ampullensäge öffnen, in die Ampulle 0,5 ml Bouillon (Medium B) pipettieren - nachdem sich der Inhalt der Ampulle gelöst hat: a) - eine Platte davon ausstreichen, Inkubation 2 bis 4 Tage bei 37 C und 5 % CO 2 und b) - den Rest der Ampulle in ein Röhrchen mit Bouillon geben, Inkubation 2 bis 4 Tage bei 37 C, weiter wie a) eingefrorene Stämme: - Kryo-Röhrchen auftauen lassen, und je nach Bedarf auf Platte ausstreichen und Bouillon beimpfen, Inkubation 2 bis 4 Tage bei 37 C und 5 % CO 2 Antiglobulin: - Es handelt sich um mit Fluoresceinisothiocyanat (FITC) konjugierte Anti-Kaninchen-IgG-Antikörper von der Ziege. - nur nach vorheriger Austestung der jeweiligen Gebrauchsverdünnung bei jeder neuen Charge (wenn es optimal leuchtet) den Inhalt des Fläschchens entsprechend mit Aqua dest. verdünnen 1: 5 0,2 ml konz. A.-Glob. + 0,8 ml PBS 1:10 0,5 ml 1: 5 A.-Glob. + 0,5 ml PBS 1:20 0,5 ml 1:10 A.-Glob. + 0,5 ml PBS usw. bis 1:80 - Kontrollstämme zur Ermittlung der optimalen Verdünnung des Antikaninchenglobulins: M. bovis und M. arginini PBS: NaCl 8 g Na 2 HPO 4 x 12 H 2 O 2,9 g KH 2 PO 4 0,2 g KCL 0,2 g Aqua dest. ad 1000 ml auf ph 7,2 einstellen. NaCl - Puffer: Na 2 HPO 4 x 2 H 2 O 1,72 g Na 2 HPO 4 x 12 H 2 O 3,46 g KH 2 PO 4 0,50 g NaCl 7,20 g Aqua dest. ad 1000 ml auf ph 7,1 einstellen Medium B: siehe Anhang 2 und 3 FLI 223
225 Durchführung zu testende Stämme auf Platten ausstreichen (neben der eigentlichen Probe auch eine Positivkontroll- und Negativkontrollstämme) Positivkontrolle: ein -Stamm Negativkontrolle: hierzu eignen sich beispielsweise Stämme von Mycoplasma arginini oder Mycoplasma bovis Inkubation ca. 2 Tage bei 37 C und 5 % CO 2 gut bewachsene Agarblöckchen (ca. 1,5 x 0,5 cm) mit Skalpell ausschneiden, und zur Kennzeichnung obere linke Ecke abschneiden Blöckchen in je einen Einsatz der Spezialküvette legen (Kolonien nach oben!) auf jedes Blöckchen 1 Tropfen Antiserum eines bekannten Stammes pro Spezialküvette, bzw. bei Negativ-Kontrollen 1 Tropfen NaCl-Lösung bringen zu jedem bekannten Antiserum entsprechenden Stamm als Positivkontrolle mitführen in feuchter Kammer 30 min bei 37 C inkubieren 2 x 10 min mit unsterilem NaCl-Puffer (ph 7,1) waschen auf jedes Blöckchen 1 Tropfen Anti-Kaninchen-Globulin, FITC-markiert geben in feuchter Kammer 30 min bei 37 C inkubieren 2 x 10 min mit NaCl-Puffer (ph 7,1) waschen und mit Aqua dest. spülen nach Beschriftung der Objektträger die Blöckchen auflegen Ergebnis und Kontrolle Mikroskop: Fluoreszenzeinrichtung (Blaulicht, UV-Anregung) im Auflicht Positiv: Kolonien, die bei normalem Licht gut zu erkennen sind und nach dem Umschalten auf Fluoreszenz in apfelgrüner Farbe leuchten, schwache Eigenfluoreszenzen lassen sich durch Positivkontrollen als Störfaktoren ausschließen Negativ: Kolonien, die bei normalem Licht gut zu erkennen sind und nach dem Umschalten auf Fluoreszenz nicht leuchten Durch Mitführen einer Positiv- sowie Negativkontrolle können falsch-positive sowie falsch-negative Ergebnisse ausgeschlossen werden. Bei jeder neuen Charge eines Reaktionspartners wird das Testsystem mit Positivkontrolle und Negativkontrolle neu geeicht. Differentialdiagnostisch sollten im Immunfluoreszenztest die angezüchteten Erreger neben dem MmmSC-Antiserum gegen folgende weitere Antiseren getestet werden: M. mycoides ssp. mycoides LC M. bovis M. bovirhinis M. gatae M. Gruppe 7 (Leach) A. laidlawii A. modicum A. axanthum M. arginini M. bovigenitalium M. alkalescens M. canadense M. californicum M. gallina rum FLI 224
226 Polymerase-Kettenreaktion (PCR) Der Nachweis wird nur im nationalen Referenzlabor durchgeführt. DNA-Isolierung Geräte, Materialien und Reagenzien Eppendorf-Zentrifuge (wenn möglich mit Kühlung) Vortexer Eppendorf BioPhotometer Präzisionspipetten, verschiedene Größen passende Tips, steril und DNase-frei (PCR-clean), z. B. Eppendorf Handschuhe Eppendorf-Tubes, 1,5 ml, 2 ml, steril und DNase-frei (PCR-clean) High Pure PCR Template Preparation Kit von Roche oder äquivalente Kits Zellpuffer, steril (ph 7,4): 1000 ml 0,1M Na 2 HPO 4 -Lösung ml 0,1M KH 2 PO 4 -Lösung DEPC-Wasser Durchführung Vorbereitungsschritte für alle Isolierungen: mit Handschuhen arbeiten Proteinase K (Gefäß 3 aus Roche-Kit) in 4,5 ml bidest. H 2 O aufnehmen, aliquotieren und bei -20 C lagen vor Erstgebrauch 80 ml Ethanol p.a. zu dem Waschpuffer (Gefäß 4, blauer Deckel) geben bei Beginn der DNA-Isolierung den Elutionspuffer (Gefäß 5) auf 70 C vorwärmen a) DNA-Isolierung aus Gewebe 25 bis 50 mg Gewebe im 1,5-ml-Tube einwiegen und mit der Schere soweit wie möglich zerkleinern 200 µl Gewebe-Lysepuffer (Gefäß 1, weißer Deckel) und 40 µl Proteinase K- Lösung zugeben mindestens 1 h bei 55 C inkubieren (eventuell auch 2 bis 3 h oder bei 37 C über Nacht) 200 µl Bindungspuffer (Gefäß 2, grüner Deckel) zugeben, mischen und 10min bei 72 C inkubieren (Elutionspuffer 5 kann dabei mit vorgewärmt werden) mit 100 µl Isopropanol vermischen nicht lösliche Gewebestücke mittels einer Pipettenspitze entfernen, restliche Flüssigkeit mittels einer 1ml-Pipette in das zusammengesetzte Filter-Tube ( Säule auf Sammelbehälter setzen) geben 1min bei 8000 rpm zentrifugieren (eventuell auch länger und bei höherer Drehzahl, falls der Filter vom Gewebe verstopft wird) Durchlauf verwerfen, Sammelbehälter wiederverwenden 500 µl Waschpuffer in das Filter-Tube pipettieren (Gefäß 4, blauer Deckel) 1min bei 8000rpm zentrifugieren FLI 225
227 anschließend 10 Sek. bei max. Geschwindigkeit (13000rpm) zentrifugieren Filter-Tube in ein sauberes 1,5-ml-Tube einsetzen Zur Elution der Nukleinsäuren 200 µl des auf 70 C vorgewärmten Elutionspuffers in das Filter-Tube pipettieren 1 min bei 8000rpm zentrifugieren die Nukleinsäuren sind stabil und können direkt in der PCR analysiert oder bei 4 C gelagert werden b) DNA-Isolierung aus Körperflüssigkeit 200 µl Körperflüssigkeit (bei weniger Volumen mit Zellpuffer auffüllen) in ein 1,5ml-Tube pipettieren 200 µl Bindungspuffer (Gefäß 2, grüner Deckel) und 40 µl Proteinase K-Lösung zugeben nach Proteinase K-Zugabe sofort gut mischen und 10 min bei 72 C inkubieren (Elutionspuffer 5 kann dabei mit vorgewärmt werden) mit 100 µl Isopropanol vermischen in das zusammengesetzte Filter-Tube ( Säule auf Sammelbehälter setzen) geben weiter wie bei DNA-Isolierung aus Gewebe c) DNA-Isolierung aus Nasentupfern Tupferprobe in einem 2ml-Tube mit je 500 µl Bindungspuffer (Gefäß 2, grüner Deckel) versetzen und 30 Sek. bei 1200rpm zentrifugieren 1ml-Pipettenspitze zur Hälfte abschneiden, in dieser halben Spitze im Tube Tupfer nochmals 2 min bei 1200rpm zentrifugieren, um die gesamte Flüssigkeit aus dem Tupfer zu gewinnen Probenflüssigkeit vereinigen und 15 min bei 14000rpm (höchste Drehzahl) zentrifugieren Pellet in 200 µl Zellpuffer aufnehmen 200 µl Bindungspuffer (Gefäß 2, grüner Deckel) und 40 µl Proteinase K-Lösung zugeben nach Proteinase K-Zugabe sofort gut mischen und 10 min bei 72 C inkubieren (Elutionspuffer 5 kann dabei mit vorgewärmt werden) mit 100 µl Isopropanol vermischen in das zusammengesetzte Filter-Tube ( Säule auf Sammelbehälter setzen) geben weiter wie bei DNA-Isolierung aus Gewebe Photometrische Messung: erfolgt zur Überprüfung der Reinheit und zur Einstellung eines definierten DNA- Gehaltes bei 260 nm gegen Leerwert Aqua dest. am Eppendorf-BioPhotometer in den dazugehörigen Einweg-Küvetten die Probe wird 1:10 verdünnt (6 µl Probe + 54 µl DEPC- Wasser) die Absorption von 1 OD entspricht ca. 50 µl/ml DNA mit dem Verhältnis A 260 /A 280 kann die Reinheit der DNA abgeschätzt werden, dieser Wert sollte zwischen 1,6 und 1,8 liegen FLI 226
228 PCR Geräte, Materialien und Reagenzien Thermocycler (z. B. Biometra) Eppendorf-Zentrifuge (wenn möglich mit Kühlung) Vortexer Präzisionspipetten, verschiedene Größen passende Tips, steril und DNase-frei (PCR-clean), z. B. Eppendorf Handschuhe Eppendorf-Tubes, 0,2 ml, steril HotStarTaq Master Mix (Qiagen) oder dntp-mix, Taq-Polymerase, 10 x Taq-Polymerase-Puffer (z. B. Boehringer Mannheim) oder äquivalente Reagenzien anderer Firmen DEPC-H 2 O Primer: MW 28/29 und SC3NEST1-L/R Sequenzen: siehe Tabelle 1 Tabelle 1: Primersysteme zur Untersuchung von Lungenseucheproben Primer Sequenz Spezifität MW 28 5`-CCA GAC TCC TAC GGG AGG CA-3 Klasse Mollicutes MW TGC GAG CAT ACT ACT CAG GC-3 SC3NEST1-L 5 -ACA AAA AGA AGA TAT GGT GTT GG-3 MmmSC SC3NEST1-R 5 -ATC AGG TTT ATC CAT TGG TTG G-3 Durchführung mit Handschuhen arbeiten Primer vorverdünnen: Stammlösung 100pmol/µl, Verdünnung 1:5 auf 20pmol/µl mit DEPC-Wasser DNA vorverdünnen: entsprechend der photometrischen Messung auf 5ng DNA/µl einstellen a) Durchführung mit HotStarTaq Master Mix (Qiagen): jeweils 25 µl HotStarTaq Master Mix in PCR-Tubes vorlegen, 20 µl des vorverdünnten Primerpaares hinzugeben Zugabe von jeweils 5 µl DANN alle Schritte können bei Raumtemperatur stattfinden, weil die Polymerase bei dieser nicht aktiv ist b) Durchführung mit selbst hergestelltem Mastermix mit einfacher Taq- Polymerase (z. B. Boehringer Mannheim): FLI 227
229 Herstellung des Mastermix (Angaben für eine Probe): 10 x Taq-Polymerase-Puffer 5 µl dntp - Mix 2 µl Primer 1 1 µl Primer 2 1 µl Taq-Polymerase 0,2 µl DEPC-Wasser 39,8 µl nach Zusammengabe aller Substanzen in jedes Reaktionsgefäß 45 µl Mastermix und 5 µl DNA-Extrakt der Probe pipettieren wurde die DNA nicht gemessen und auf 5 ng/µl eingestellt, werden 49 µl Mastermix und 1 µl DNA-Extrakt pipettiert Kontrollen mitführen: als Negativkontrolle wird einem Ansatz statt DNA 5 bzw. 1 µl DEPC- Wasser zugesetzt als Positivkontrolle dient für das Primersystem 1 (MW28/29) 5 bzw.1 µl DNA-Extrakt eines Typenstammes von M. bovis (Donetta PG 45) und für das System 2 (SC3NEST1-L/R) 5 bzw. 1 µl DNA-Extrakt eines Typenstammes von MmmSC (PG 1) - vortexen, kurz abzentrifugieren und in den vorprogrammierten Cycler stellen, Zyklus: Primersystem 1-MW 28/29 2-SC3NEST1-L/R Aktivierung der HotStarTaq 15min, 95 C 15 min, 95 C Polymerase dieser Schritt entfällt bei b) 3-Schritt-Zyklus: - Denaturierung: 80 Sek., 94 C 30 Sek., 94 C Annealing: 80 Sek., 55 C 30 Sek., 52 C Extension: 150 Sek., 72 C 30 Sek., 72 C Zyklenzahl : Finale Extension 5 min, 72 C - Amplikon ca. 560 bp ca. 717bp Proben anschließend auf Agarose-Gel auftragen Agarose-Gelelektrophorese Geräte, Materialien und Reagenzien Elektrophoresekammer (z. B. Biometra, Biozym) Stromversorgungsgerät Mikrowelle Gel-Auswertesystem ( z. B. Bio Imaging System von Syngene) Maßkolben (1l) Erlenmeyerkolben ( 300 ml, 500 ml) Meßzyinder (25 ml, 100 ml) FLI 228
230 Parafilm Präzisionspipetten, verschiedene Größen passende Tips, steril und DNase-frei (PCR-clean), z. B. Eppendorf Handschuhe (Nitrilhandschuhe beständig gegenüber Ethidiumbromid) Agarose (PeqGold Universal Agarose von Peqlab) 10x TBE-Puffer dest. H 2 O Ethidiumbromid (Tropfflasche, z. B. Eurobio) Molekulargewichtsmarker: peqgold Low Range DNA-Leiter, bp, gebrauchsfertig DEPC-H 2 O Ansetzen der Lösungen Herstellung des Laufpuffers (1x TBE-Puffer): 100 ml 10x TBE-Puffer ad 1000 ml dest. Wasser Zusammensetzung des Agarose-Gels: Gelkonzentration 1 % Volumen 50ml 100ml Agarose 0,5g 1g dest. Wasser 45ml 90ml 10x TBE-Puffer 5ml 10ml Ethidiumbromid 1 Tr. 2 Tr. Durchführung Elektrophoresekammer zusammensetzen, passenden Kamm auswählen Agarose einwiegen, mit dest. Wasser im Erlenmeyerkolben lösen in der Mikrowelle bei 600 W zum Kochen bringen, ca. 30 Sek. kochen 10x TBE-Puffer und Ethidiumbromid zugeben, Kolben vorsichtig schwenken zügig und luftblasenfrei in die Elektrophoresekammer gießen mind. 1 h polymerisieren lassen Kamm herausziehen, Laufpuffer in die Elektrophoresekammer füllen, bis der Puffer ca. 1cm über dem Gel steht Proben bzw. Marker wie folgt auf Parafilm mischen und in die Slots pipettieren: Marker PCR-Proben 2 µl Probenpuffer 2 µl Probenpuffer 9 µl DEPC-Wasser 10 µl Probe 1 µl Marker 10 µl/slot auftragen 10 µl/slot auftragen FLI 229
231 Laufdauer und einzustellende Spannung sind abhängig von Größe und Dicke des Gels und der Beschaffenheit der Kammer Hinweise des Herstellers beachten Spannung liegt zwischen 80 und 150 V, die Dauer des Laufes zwischen 30 und 120 min Faustregel für einzustellende Spannung: 5 V/cm Elektrodenabstand die Bromphenolblau-Front sollte mindestens zur Hälfte des Gels gewandert sein; bei schlechtem Trennergebnis kann das Gel nochmals in die Kammer gelegt und die Proben weiter getrennt werden um eine gleichmäßige Verteilung des Ethidiumbromids im Gel zu erreichen (wandert entgegengesetzt zur DNA), kann dem Laufpuffer 0,5 mg/l Ethidiumbromid zugesetzt werden (für einen gleichmäßigen und klaren Hintergrund auf dem Gel) das Gel wird unter UV-Licht mit Hilfe eines geeigneten Gel-Auswertesystems analysiert und dokumentiert Ergebnis und Kontrolle Im UV-Licht ist bei einer positiven Reaktion eine deutliche Bande bei beiden PCR- Ansätzen (im System 1 bei ca. 560 bp und bei ca. 717 bp im System 2) zu erkennen. Bei jedem Probenlauf darf die Negativkontrolle keine Bande und muss die Positivkontrolle eine deutliche Bande zeigen Antikörpernachweis durch Komplementbindungsreaktion (KBR) Die KBR für die Lungenseuche wird in der Regel zuerst von den Landesbehörden festgelegten staatlichen Untersuchungsämtern durchgeführt werden (Anhang 1). Die notwendigen Reagenzien (Antigen, positive und negative Kontrollseren) werden vom nationalen Referenzlabor in Jena für die aufgeführten Untersuchungsämter zur Verfügung gestellt. Zur Feststellung des Verdachts eines Lungenseucheausbruchs bzw. zur Eingrenzung des Kreises verdächtiger Tiere kann die jeweilige hauseigene Arbeitsvorschrift verwendet werden. Nachfolgend wird der prinzipielle Ablauf am Beispiel der von der OIE empfohlenen Mikromethode dargelegt, welche auf das Verfahren nach Campbell und Turner (1953) zurückgeht. Geräte/Gebrauchsmaterialien Zentrifuge, Wasserbad 37 C 1 C; Wasserbad 58 C 1 C; Waage; heizbarer Magnetrührer; Kühlschrank 6 C 2 C; Gefrierschrank - 20 C 3 C Ablesespiegel für Mikrotiterplatten; Bechergläser (30 ml bis 800 ml); Messzylinder (50 bis 250 ml); Kulturröhrchen (12ml); Zentrifugenröhrchen (12 ml); Ständer für Röhrchen, Klebefolie zum Abkleben der Mikrotiterplatten, Messpipetten (1, 5 und 10 ml), Kolbenhubpipetten (10 bis 1000 µl), entsprechende Pipettenspitzen, Transferpette 8-Kanal ( µl), Multistepper 8-Kanal µl, Pipettierhilfe Erlenmeyerkolben, Stehkolben, Bechergläser, Mikrotiterplatten (U-Form, 8x12 Cups), feuchte Kammer FLI 230
232 Reagenzien/Rezepturen Alseverlösung für Hammelerythrozyten: Dextrose NaCl Natriumcitrat Aqua bidest. 18,66 g 4,18 g 8,00 g 1000 ml nach gründlichem Mischen für 20 min in den Dampftopf geben Veronal - Puffer (Veronal - buffered diluent = VBD): 2000 ml Konzentrat, 5:1 NaCl 83,00 g 5,5 - Diäthylbarbitursäure Natriumsalz 10,19 g Aqua bidest. 800 ml Aqua bidest. zum Kochen bringen und mit beheizbaren Magnetrührer Substanzen darin lösen 34,58 ml 1n HCl über einen Scheidetrichter oder langsam mit einer Pipette tropfenweise hinzugeben, bei Ausfall von Salzen noch etwas Aqua bidest zugeben tropfenweise 5 ml Stammlösung hinzugeben Stammlösung: MgCl 2 x 6 H 2 O CaCl 2 x 2 H 2 O in Aqua bidest. 20,3 g 4,4 g 100 ml 10 ml der konzentrierten VBD werden 1:5 mit Aqua bidest. verdünnt und auf einen ph-wert zwischen 7,3 bis 7,5 überprüft. Sollte der ph-wert außerhalb dieser Grenzen liegen, muss ein Neuansatz erfolgen. Die konzentrierte Lösung wird in 200 ml Portionen abgefüllt und bei -20 C aufbewahrt, die bei Bedarf 1:5 verdünnt werden können. Komplement: (z. B. Fa. Virion), jede Charge ist vor erstmaligem Gebrauch auszuwerten (siehe dort) Ambozeptor: (z. B. Fa. Virion), jede Charge ist vor erstmaligem Gebrauch auszuwerten (siehe dort). Bei Titerverlust empfiehlt sich eine erneute Auswertung. Antigene sowie negative und positive Kontrollseren: werden im nationalen Referenzlabor hergestellt und den Untersuchungsämtern kostenlos zur Verfügung gestellt FLI 231
233 Hammelblut: Hammelblut Alseverlösung 37,5 ml 62,5 ml Eine sterilisierte Schraubflasche mit einer Markierung bei 100 ml wird mit Alseverlösung befüllt und mit Hammelblut direkt aus der Kanüle auf 100 ml aufgefüllt. Das Blut wird aus der Vena jugularis gewonnen. Um Kontaminationen vorzubeugen, gibt man Internat. Einheiten/l Penicillin G hinzu. Das so gewonnene Hammelblut hält sich bei Kühlschranktemperatur etwa 10 bis 14 Tage. Für den Einsatz im Hämolytischen System muss es jedoch mindestens 24 h alt sein. Alternativ kann eine 1%ige Erythrozytensuspension der Firma VIRION/SERION verwendet werden. Hämolytisches System (HS): Hammelblut in Alseverlösung bei 900 x g für 10 Minuten zentrifugieren 3- bis 5x waschen in VBD (bis Überstand wasserklar ist), dazwischen jeweils 10 min zentrifugieren bei 900 x g herstellen einer 2%igen Hammelerythrozytensuspension mit VBD zum Gebrauch wird diese mit gleichem Volumen der Ambozeptor- Gebrauchsverdünnung gemischt und 15 min bei 37 C 1 C stehen gelassen (Sensibilisierung) Bei getrennter Aufbewahrung von Erythrozytensuspension und Ambozeptorverdünnung können diese bis zu 48 h nach Herstellung verwendet werden. Durchführung Anmerkung: Alle Reagenzien sind vor der Verwendung auf Raumtemperatur zu erwärmen. Ampozeptorauswertung Die Ambozeptorauswertung sollte bei Bedarf durchgeführt werden, zumindest bei Verwendung einer neuen Charge von Ambozeptor. Ansatz folgender geometrischer Verdünnungsreihen des Ambozeptors: Röhrchen : : : n Reihe A 1:500 1:1000 1:2000 : : : 1:32000 Reihe B 1:750 1:1500 1:3000 : : : 1:24000 Ausgangsverdünnung 1:500 (z. B. 0.1 ml Ambozeptor + 49,9 ml VBD) herstellen Vorlage von 5 ml VBD für die Reihe A ab Röhrchen 2, für Reihe B ab Röhrchen 1 für die Reihe A dem 1. und 2. Röhrchen 5 ml Ambozeptorverdünnung 1:500 zufügen und ab Röhrchen 2 durch fortlaufendes Überpipettieren von jeweils 5 ml die weiteren Verdünnungen anlegen FLI 232
234 für Reihe B dem 1. Röhrchen 10 ml Ambozeptorverdünnung 1:500 zufügen und durch fortlaufendes Überpipettieren von jeweils 5 ml weitere Verdünnungen anlegen beide Titrationsreihen zu einer Verdünnungsreihe zusammenfügen Ansatzschema der Ambozeptorauswertung Röhrchen Amb.-Verd. (0,5 ml) VBD (ml) Erythr.-Susp. (ml) Kompl. Verd. 1:20 (ml) 1 1:500 1,0 0,5 0,5 2 1:750 1,0 0,5 0,5 3 1:1000 1,0 0,5 0,5 : : : : : : : : : : : : : : : n 1: ,0 0,5 0,5 Kontrollen a) Erythrozytenkontrolle: 0,5 ml Erythrozytensuspension 0,2 ml VBD b) Komplementkontrolle: 0,5 ml Erythrozytensuspension 0,5 ml Komplement 1:20 1,5 ml VBD c) Ambozeptorkontrolle: 0,5 ml Erythrozytensuspension 0,5 ml Ambozeptorverdünnung 1,5 ml VBD schütteln, Inkubation 30 Minuten bei 37 C ± 1 C im Wasserbad Auswertung Ermittelt wird die höchste Ambozeptorverdünnung, die noch eine komplette Hämolyse bewirkt. Sie gilt als Ambozeptoreinheit. Die Gebrauchsverdünnung beträgt 4 Einheiten, also die vierfache Konzentration. Beispiel: 1 Ambozeptoreinheit = 1:6000 Gebrauchsverdünnung = 1:1500 Die Kontrollen dürfen keine Hämolyse aufweisen. Komplementauswertung Die Komplementauswertung dient der Feststellung der Komplementgebrauchsdosis für den Hauptversuch in Gegenwart der entsprechenden Antigengebrauchsverdünnung. Zum Vergleich wird eine zweite Reihe angesetzt, bei der das Antigenvolumen durch VBD ersetzt ist. Das Komplement wird in 8 Konzentrationsstufen in der Wärmebindung geprüft. In der folgenden Tabelle ist die Herstellung der 8 Verdünnungsstufen dargestellt: FLI 233
235 Komplementkonzentration (%) 0,5 1,0 1,5 2,0 2,5 3,0 2,5 4,0 Kompl. 1:10 (ml) 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 VBD (ml) 1,9 1,8 1,7 1,6 1,5 1,4 1,3 1,2 Die weiteren Arbeitsschritte sind in der folgenden Tabelle dargestellt: Reihe 1 Reihe 2 Komplement je Verd.-Stufe (ml) 0,5 0,5 Antigenverdünnung (ml) - 0,5 VBD (ml) 1,0 0,5 - schütteln, Wasserbad 60 min bei 37 C 1 C HS (ml) 1,0 1,0 -schütteln, Wasserbad 30 min bei 37 C 1 C Auswertung Es wird das Röhrchen mit der niedrigsten Komplementkonzentration bestimmt, das eine komplette Hämolyse aufweist. Die Gebrauchsverdünnung für den Hauptversuch ist die folgende höhere Konzentration Beispiel komplette Hämolyse = 2,0 % Gebrauchskonzentration = 2,5 % Hauptversuch Kontroll- und Probandenseren in einer Verdünnung von 1:5 im Wasserbad bei 58 C 1 C inaktivieren (30 bis 50 min) Trennlinie zwischen Cup 10 und 11 von A bis H ziehen In der folgenden Tabelle sind die einzelnen Arbeitsschritte aufgeführt: Cup Arbeitsschritte : : : VBD (µl) : : : Serum (µl) : : : Titration des Serums von 1 nach 10 und von 11 nach 12 durch Übertragung von 25 µl und verwerfen von 25 µl aus den Cups 10 und 12 Titration der Komplementkontrollen (siehe bei Kontrollen) beim Titrieren mind. 3 x mischen durch Aufziehen und Abgeben mit der Pipette! 4. VBD : : : Antigen (µl) : : : Kompl. (µl) : : : FLI 234
236 7. schütteln und abgedeckte Platte 18 bis 24 h bei 5 C 3 C inkubieren (Kältebindung), danach die Platte wieder auf Raumtemperatur erwärmen oder für 60 min bei 37 C 1 C im Wasserbad oder im Brutschrank in einer feuchten Kammer inkubieren (Wärmebindung) Achtung: auf dem Antigen ist vermerkt, welche Inkubationsvariante anzuwenden Ist 8. HS (µl) : : : Schütteln, abdecken und Inkubation min bei 37 C 1 C im Wasserbad oder im Brutschrank in einer feuchten Kammer. Hinweis: Für die Bestimmung der optimalen Inkubationsdauer muss man die Hämolyse in den Komplementkontrollen verfolgen. Die Inkubation wird nur solange fortgesetzt, bis die Cups mit 2 und 1 Komplementeinheiten 100 % Hämolyse zeigen, bei 0,5 und 0,25 Komplementeinheiten darf keine Hämolyse auftreten. 10. Platte entweder 30 min bis 1 h bei Raumtemperatur stehen lassen oder für 5 min bei 900 x g abzentrifugieren (Erythrozytensedimentation) 11. Auswertung mit Spiegel Kontrollsystem und Interpretation der Ergebnisse Das Ablesen der Reaktionsstärke je Verdünnungsstufe erfolgt nach dem Grad der Hämolyse und der Größe des Erythrozytensedimentes (Knopfbildung) im Vergleich zur Kontrolle des Hämolytischen Systems: 100 % Hämolyse = negativ = 0 % Erythrozytensediment 75 % Hämolyse = + = 25 % Erythrozytensediment 50 % Hämolyse = ++ = 50 % Erythrozytensediment 25 % Hämolyse = +++ = 75 % Erythrozytensediment 0 % Hämolyse = ++++ = 100 % Erythrozytensediment Bei der Durchführung des Hauptversuches sind jeweils folgende Kontrollansätze mitzuführen: Kontrolle der antikomplementären Wirkung (Eigenhemmung) jedes Serums (Serumkontrolle) Serumverdünnung 25 µl VBD 25 µl Komplement 25 µl HS 50 µl Soll-Ergebnis 100 % Hämolyse, 0 % Erythrozytensediment Von Eigenhemmung spricht man bei fehlender Hämolyse (mit Erythrozytensediment). Bei Auftreten von Eigenhemmung empfiehlt sich folgende Vorbehandlung der entsprechenden Seren mit Komplement: FLI 235
237 Serum (unverdünnt) 75 µl Komplement (unverdünnt) 25 µl 30 min bei 37 C 1 C im Wasserbad inkubieren VBD 900 µl 30 min bei 58 C im Wasserbad inkubieren Hinweis: nicht bei allen Seren kann durch diese Vorbehandlung Eigenhemmung vermieden werden. In solchen Fällen muss die Untersuchung mit einem erneut von diesem Tier gewonnenen Serum wiederholt werden. Antigenkontrolle (AG) VBD 25 µl Antigen 25 µl Komplement 25 µl HS 50 µl Soll-Ergebnis 100 % Hämolyse, 0 % Erythrozytensediment Komplementkontrolle Für die Komplementkontrolle werden folgende Konzentrationen verwendet: die zweifache, die einfache, die 0,5-fache und die 0,25-fache Konzentration der in der Komplementauswertung ermittelten Konzentration ( Komplementeinheiten von 2; 1; 0,5 und 0,25). Die entsprechenden Verdünnungen können auch auf der Platte durch Überpipettieren von jeweils 25 µl erzeugt werden (siehe 3. Titration des Serums). VBD 50 µl Komplementverd. 25 µl HS 50 µl Soll-Ergebnis bei Komplementeinheiten von 2 und 1 = 100 % Hämolyse, 0 % Erythrozytensediment bei 0,5 und 0,25 Komplementeinheiten = 0 % Hämolyse (100 % Erythrozytensediment) Kontrolle des Hämolytischen Systems (HS) VBD 75 µl HS 50 µl Soll-Ergebnis 0 % Hämolyse, 100 % Erythrozytensediment Positives Kontrollserum (pos. KS) Serumverdünnung 25 µl Antigen 25 µl Komplement 25 µl HS 50 µl Soll-Ergebnis Der ermittelte Titer muss dem für das positive Kontrollserum angegebenen Titer entsprechen. FLI 236
238 Negatives Kontrollserum (neg. KS) Serumverdünnung 25 µl Antigen 25 µl Komplement 25 µl HS 50 µl Soll-Ergebnis 100 % Hämolyse, 0 % Erythrozytensediment Beispiel für Plattenbelegung Reihe Spalte Serumkontrollen Probenverdünnung Probenbezeichn 1:5 1:10 1:20 1:40 1:80 1:160 1:320 1:640 1:1280 1:2560 1:5 1:10 g. A a B b C c D d E e F pos. KS G neg. KS H Kontrollen AG AG HS HS 2 1 0,5 0,25 Komplementeinheiten Laut OIE-Manual ist ein Ergebnis bei 1:10 (++++) als positiv zu betrachten. 1:10+ bis 1:10+++ gelten als fraglich. Das negative Serum darf in der Verdünnung 1:5 keine Reaktion zeigen. Das Ergebnis ist umgehend dem zuständigen Veterinäramt zu melden. Hinweise: Alternativ können weitere kommerziell verfügbare Reagenzien verwendet werden (Hammelerythrozyten, VBD). Das NRL organisiert regelmäßig Ringtests für die KBR. Die durch die Bundesländer ausgewählten staatlichen Untersuchungsämter (Anhang 1) sind verpflichtet, an diesen Ringtests teilzunehmen. Das Referenzlabor teilt die Ergebnisse den teilnehmenden Labors mit und führt eine Wertung durch. Bei unvertretbaren Abweichungen ist den entsprechenden Landesbehörden darüber Mitteilung zu machen. Die Ursachen für die entstandenen Abweichungen sind gemeinsam mit dem Referenzlabor abzuklären und abzustellen. Der KBR-Ringversuch muss anschließend vom entsprechenden Labor wiederholt werden. Literatur OIE Manual of Standards for Diagnostic Tests and Vaccines, 5th Edition (2004) Campbell, A.D. und Turner A.W. (1953): Studies on contagious bovine pleuropneumonia of cattle. IV. An improved complement-fixation test. Austral. Vet. J. 29, Hotzel, H. und Sachse, K. (1998): Verbesserung und Beschleunigung der Rinderlungenseuche-Diagnostik durch Direktnachweis des Erregers mittels Polymerase- Kettenreaktion (PCR). BMTW 111, FLI 237
239 Anhang 1. Liste der von den Landes-Veterinärbehörden festgelegten Untersuchungsämter für die Lungenseuche-KBR Bundesland Baden-Württemberg Untersuchungsämter Staatliches Tierärztliches Untersuchungsamt Aulendorf - Diagnostikzentrum - Löwenbreitestr. 18/ Aulendorf Tel.: (07525) Fax: (07525) Poststelle@stuaau.bwl.de Chemisches- und Veterinäruntersuchungsamt Stuttgart Schaflandstr. 3/3 Sitz Fellbach Fellbach Telefon (07 11) Fax: (0711) Poststelle@CVUAS.BWL.DE Bayern Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit - Dienststelle Oberschleißheim Veterinärstr Oberschleißheim Tel.: (089) Fax: (089) poststelle@lgl.bayern.de Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit Dienststelle Erlangen Eggenreuther Weg Erlangen Tel.: (09131) Fax: (09131) poststelle@lgl.bayern.de Berlin Berliner Betrieb für Zentrale Gesundheitliche Aufgaben, Institut für Lebensmittel, Arzneimittel und Tierseuchen Berlin (ILAT) Invalidenstr Berlin Tel. 030 / Fax 030 / mail@bbges.de Brandenburg Landeslabor Brandenburg Ringstraße Frankfurt (Oder) Tel.: (0335) Fax: (0335) poststelle@llb.brandenburg.de Postanschrift: Landeslabor Brandenburg, Postfach 1469, Frankfurt (Oder) FLI 238
240 Hessen Landesbetrieb Hessisches Landeslabor Marburger Str Gießen Tel.: (0641) Fax: (0641) Mecklenburg- Vorpommern Landesamt für Landwirtschaft, Lebensmittelsicherheit und Fischerei Mecklenburg-Vorpommern (LALLF M-V) Thierfelder Str. 18/ Rostock Tel.: (0381) Fax: (0381) Postanschrift: Landesveterinär- und Lebensmitteluntersuchungsamt Mecklenburg- Vorpommern, Postfach ,18003 Rostock Niedersachsen Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Veterinärinstitut Hannover Eintrachtweg Hannover Tel.: 05 11/ Fax: 05 11/ poststelle.vi-h@laves.niedersachsen.de Nordrhein-Westfalen Staatliches Veterinäruntersuchungsamt Deutscher Ring Krefeld Tel.: (02151) Fax: (02151) poststelle@svua-krefeld.nrw.de Postanschrift: Staatliches Veterinäruntersuchungsamt, Postfach: Krefeld Rheinland-Pfalz Landesuntersuchungsamt Rheinland-Pfalz Institut für Tierseuchendiagnostik Blücherstr Koblenz Tel.: 0261/ Fax: 0261/ poststelle@lua.rlp.de Saarland Landesamt für Soziales, Gesundheit und Verbraucherschutz Abteilung Verbraucherschutz, Veterinärmedizin Hochstr Saarbrücken Tel.: (0681) Fax: (0681) poststelle@lsgv.saarland.de FLI 239
241 Sachsen Landesuntersuchungsanstalt für das Gesundheits- und Veterinärwesen Sachsen (LUA) Standort Leipzig, Außenstelle Wiederitzsch Beethovenstraße Leipzig Tel: (0341) Fax: (0341) Sachsen-Anhalt Landesamt für Verbraucherschutz des Landes Sachsen-Anhalt Fachbereich 4, Veterinärmedizin Haferbreiter Weg Stendal Tel.: (03931) Fax: (03931) Schleswig-Holstein Landeslabor des Landes Schleswig-Holstein, Lebensmittel-, Veterinär- und Umweltuntersuchungsamt Max-Eyth-Str Neumünster Tel.: (04321) Fax: (04321) Info@lvua-sh.de Thüringen Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz (TLLV), Abteilung 5 Veterinäruntersuchung Standort Bad Langensalza Tennstedter Str Bad Langensalza Tel.: Fax: Medium B-Bouillon 2,45 g Heart infusion broth (Difco) + 90,0 ml Aqua bidest. Autoklavieren 20 min bei 121 C steril filtriert aseptisch hinzugeben: 20,0 ml Pferdeserum 10,0 ml Frischhefeextrakt*, 25%ig 1,2 ml Calf thymus DNA (von Sigma oder Difco), 0,2%ig 1,0 ml Thalliumacetat, 1%ige Lösung ph-wert 7,8 einstellen FLI 240
242 3. Medium B-Agar 3,60 g Heart infusion agar (von Difco) + 90,0 ml Aqua bidest. Autoklavieren 20 min bei 121 C nach Abkühlung auf 50 C steril filtriert aseptisch hinzufügen: 20,0 ml Pferdeserum 10,0 ml Frischhefeextrakt *, 25%ig 1,2 ml Calf thymus DNA (von Sigma oder Difco), 0,2%ig ph-wert 7,8 einstellen * Frischhefeextrakt: 250 g frische Bäckerhefe ml Aqua bidest. Suspension für 15 min kochen Zentrifugieren 15 min bei 250 x g Sterilfiltrieren zu 10 ml-mengen abfüllen Aufbewahrung bei -20 C (maximal 2 Monate) FLI 241
243 33. Maul- und Klauenseuche Charakterisierung der Infektion Die Maul- und Klauenseuche (MKS) ist eine fieberhafte Allgemeinerkrankung der Klauentiere, die zur Bildung von Bläschen (Aphthen) und Erosionen an kutanen Schleimhäuten und unbehaarten Teilen der Haut führt, insbesondere im Bereich des Maules und der Klauen. Sie verläuft bei erwachsenen Tieren meist nicht letal, führt aber bei Rindern zu einem lang anhaltenden Leistungsabfall. Bei Jungtieren können hohe Verluste durch Schädigung des Herzmuskels auftreten. Die MKS gehört wegen ihrer potentiell katastrophalen Auswirkungen auch heute noch zu den wirtschaftlich bedeutsamsten Tierseuchen. Ihre besondere Bedeutung beruht auf ihrer hohen Kontagiosität sowie auf den wirtschaftlichen Verlusten infolge der zu ihrer Bekämpfung erforderlichen drastischen Sperr- und Kontrollmaßnahmen. Durch die Zunahme, Beschleunigung und Liberalisierung des internationalen Handels und Reiseverkehrs und die große Zahl der potentiellen Kontaktbetriebe bei der heutigen Struktur der Landwirtschaft sind die Bedingungen für eine Einschleppung und explosive Ausbreitung in Europa und damit auch in Deutschland jederzeit gegeben Erreger Genus Aphthovirus der Familie Picornaviridae, 7 Serotypen (O, A, C, ASIA, SAT1, SAT2, SAT3), ca. 60 Subtypen Klinische Symptomatik Beim Rind ist Fieber das erste Krankheitszeichen nach meist 2 bis 7 Tagen Inkubationszeit. Es hält i.d.r. nur 1 bis 3 Tage bis zum Auftreten der Sekundäraphthen an, kann aber aufgrund von Sekundärinfektionen später wieder ansteigen. Als weiteres Frühsymptom ist ggf. ein Abfall der Milchleistung zu beobachten. Die Tiere speicheln, die Maulschleimhaut ist gerötet und die Futteraufnahme geht zurück. Dann treten auf der Maulschleimhaut und den Klauen, u. U. auch am Euter, Aphthen auf, die nach dem Platzen rasch abheilen. Beim Schaf fallen nach einer Inkubationszeit von meist 2 bis 14 Tagen vorwiegend Lahmheiten aufgrund von Klauenaphthen auf. Die Veränderungen der Maulschleimhaut sind schwächer ausgeprägt als beim Rind oder fehlen ganz. Die meist kleinen Schleimhautläsionen konfluieren nicht. Wegen der meist langsamen und unvollständigen Durchseuchung des Schafsbestandes sind möglichst viele Tiere oberhalb des Ballenhorns, am Kronensaum und im Zwischenklauenspalt zu untersuchen. Zu achten ist auch auf Fieber, Inappetenz, Aborte und Verluste bei Lämmern (myotrope Form). Bei der Ziege verläuft die MKS i.d.r. gutartig und ohne Allgemeinstörungen. Es finden sich schnell zerplatzende Blasen in der Mundschleimhaut (Stomatitis erosiva) und eine Rhinitis. Die Klauen nur selten mitbetroffen. FLI 242
244 Beim Schwein treten nach einer Inkubationszeit von meist 1 bis 3, selten 12 Tagen Aphthen vorwiegend an den Sohlenballen, im Klauenspalt und am Kronensaum auf. Häufig sind die Aphthen zum Zeitpunkt der Untersuchung nur noch als Schorf erkennbar. Die Tiere zeigen einen "klammen Gang" oder bewegen sich bei starken Schmerzen nur noch rutschend auf den Karpalgelenken. Am Rüssel und an der Gesäugeleiste säugender Sauen können Aphthen auftreten; im Vordergrund stehen jedoch die Klauenveränderungen. Für meist 3 bis 4 Tage tritt Fieber zwischen 40 bis 41 C auf. Häufig werden schwere Verluste unter Saugferkeln (myotrope Komponente) ohne Veränderungen an den Schleimhäuten beobachtet. Betroffen sind häufig nur wenige Tiere eines Bestandes, daher ist eine intensive Bestandskontrolle erforderlich Wirtsspektrum natürlicherweise Klauentiere (Rind, Schaf, Ziege, Büffel, Wildwiederkäuer, Schwein); u. U. Giraffen, Elefanten und Kamele, selten andere Spezies, experimentell insbesondere Meerschweinchen und Mäuse Mensch nur in seltenen Ausnahmefällen bei starker Exposition; unter mitteleuropäischen Bedingungen besteht auch im Falle eines Seuchenzuges keine Gefahr für den Verbraucher Differentialdiagnostik Infektionen des Vesikulärkrankheitenkomplexes (Stomatitis vesicularis, vesikuläre Schweinekrankheit); Infektionen des Mucosal-Disease-Komplexes (keine typischen Blasen, eher herdförmige Ulzerationen, Durchfall), Rinderpest (keine Klauenveränderungen), Bösartiges Katarrhalfieber (Erosionen, Geschwüre im Maul, hohes Fieber); Krankheiten des Pocken-Herpes-Komplexes Diagnostische Indikation Seuchenverdacht, Export-/Importuntersuchungen Zuständige Untersuchungseinrichtungen Friedrich-Loeffler-Institut, Insel Riems, Südufer 10, Greifswald Rechtsgrundlagen Verordnung zum Schutz gegen die Maul- und Klauenseuche (MKS-Verordnung) in der jeweils gültigen Fassung, Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung, Richtlinie 2003/85/EG FLI 243
245 33.2. Untersuchungsmaterial Der Nachweis von infektiösem MKS-Virus bzw. MKSV-Antigen und virusspezifischer Nukleinsäure gelingt am sichersten in Aphthenlymphe sowie Aphthendeckenmaterial frischer Aphthen. Sind keine Aphthen vorhanden, ist Material am Übergang zum gesunden Gewebe zu entnehmen. Tritt der Verdacht bei Tieren nach Schlachtung, Tötung oder Verenden auf, können auch Organe (veränderte Teile von Zunge, Maulschleimhaut, Klauen, Euter, Herz, Pansenpfeiler) in dicht verschlossenen Behältnissen und gekühlt direkt zum FLI, Insel Riems gesandt werden. Beim Fehlen von Aphthen kann versucht werden, MKSV auch aus Speicheltupferproben zu isolieren. Rachenschleimproben (Probang) sind dann zu nehmen, wenn die Aphthen bereits abgeheilt sind. Sie dienen der Erkennung klinisch gesunder Virusträger (Carriere), bei denen das MKSV in der Schleimhaut von Pharynx und Oesophagus persistiert (beim Rind bis zu 3 Jahren, bei kleinen Wiederkäuern bis zu 9 Monaten). Schafe und Ziegen zeigen vielfach keine typischen MKS-Symptome. Bei diesen Tieren sind daher auch stets Blutproben und Speicheltupferproben (oder Probangproben) einzusenden. Blutproben dienen insbesondere dem Nachweis von Antikörpern. Diese sind im Serum frühestens ab dem 5. bis 7. Tag nachweisbar und erreichen bei Rindern rasch hohe Titer. Wird der Verdacht aufgrund klinischer Symptome festgestellt, sind mehrere seuchenverdächtige Tiere mit frischen Veränderungen zu beproben (Aphthen, Schleimhautfetzen). Blutproben zum Nachweis von Antikörpern sind wenn möglich, von Tieren mit älteren Veränderungen zu nehmen. Bezüglich der Probenziehung aus symptomlosen Beständen wird auf die Angaben in der Richtlinie 2003/85/EG und der MKS-Verordnung verwiesen. Den dort genannten Stichprobenschlüsseln liegt meist eine 95 % Sicherheit bei der Erkennung einer 5 % Prävalenz zugrunde. Generell sind Proben möglichst sauber zu gewinnen und nicht mit Desinfektionsmitteln und Säuren in Kontakt zu bringen. Die Probenverpackung muss den ADR-Vorschriften entsprechen, auf jeden Fall aber flüssigkeitsdicht sein und äußerlich gut desinfiziert werden (z. B. mit 2 % NaOH). Sie darf außerhalb des zuständigen Labors nicht mehr geöffnet werden. Die Proben sind möglichst per Kurier zur Friedrich-Loeffler-Institut, Insel Riems, Südufer 10, Greifswald zu senden. Proben sind telefonisch anzukündigen ( ) Im Anschreiben ist anzugeben: Wer sendet ein? (Veterinäramt, Bearbeiter; incl. dienstlicher und eventuell privater Telefon- und Fax-Nummer) Was wird eingesandt? (Art des Materials, von welchen Tieren, Anzahl etc.) Aus welchem Bestand stammen die Proben? Was wurde wann in dem Bestand festgestellt - anamnestischer Kurzbericht. Zusätzliche Angaben, soweit möglich: Wie groß ist der Bestand? Tierarten? Art des Bestandes (Zucht-, Mast-, Händlerbestand etc.)? Wurden in den letzten 6 Wochen Klauentiere neu eingestallt, wenn ja, woher (Ausland)? Bemerkungen FLI 244
246 33.3. Untersuchungsgang Untersuchungen auf MKS erfolgen am FLI, Insel Riems. Im Ausbruchsfall würden jedoch die serologischen Untersuchungen von Proben aus symptomfreien Beständen in Untersuchungsämtern durchgeführt Erregernachweis Der Nachweis virusspezifischer Nukleinsäure mittels PCR ist möglich insbesondere aus Aphthenmaterial, Nasentupfer, Probangproben und Blut. Er wird am FLI in der Regel als real-time PCR durchgeführt und dauert einen Tag. Durch die Sequenzierung von Produkten weiterer, spezieller PCR-Verfahren können epidemiologische Aussagen auf molekularer Grundlage getroffen werden. Der Virusnachweis dient zu Abklärung klinischer Verdachtsfälle. Im Rahmen von Aufhebungsuntersuchungen kann er zur Abklärung auffälliger serologischer Befunde eingesetzt werden. Geeignete Proben sind insbesondere Aphthenmaterial, Nasentupfer, Probangproben und Blut (insbesondere bei Schafen und Ziegen in der Phase der Virämie). Der Zeitbedarf beträgt mindestens 1 bis 3 Tage bis zum Auftreten von Plaques oder CPE, dann folgt bei Primärausbrüchen die nähere Charakterisierung des Isolates um Aussagen über einen möglichen Impfstoff und die Einschleppungsquelle machen zu können. Der Antigen-ELISA kann durchgeführt werden mit Aphthenmaterial und Zellkulturüberständen. Das Ergebnis liegt in der Regel am gleichen Tag vor. Der ELISA ist die schnellste Methode zur MKS-Diagnostik. Er wird in Verdachtsfällen stets mit anderen Verfahren kombiniert Antikörpernachweis Der Antikörper-ELISA wird mit Serum (falls keines zur Verfügung steht, notfalls ersatzweise gerinnungsgehemmtem Blut) durchgeführt und benötigt 1 bis 2 Tage. Man unterscheidet Verfahren zum Nachweis von Antikörpern gegen Strukturproteine (serotypspezifisch) und gegen Nichtstrukturproteine (NSP) (serotypübergreifend). Letztere Tests sind auch geeignet, infizierte Tiere in einer geimpften Population zu erkennen, da die Impfung nur Antikörper gegen Strukturproteine induziert (DIVA- Konzept). Im Ausbruchsfall würden Proben aus symptomlosen Beständen in Untersuchungseinrichtungen der Länder mit kommerziell hergestellten ELISAs zum Nachweis von Antikörpern gegen NSP des MKSV untersucht werden. Die deutschen Länder unterhalten für den Seuchenfall eine Testkitbank bei der Firma Prionics. (Web-Adresse: Diese liefert den PrioCHECK FMDV NS (früher: Ceditest FMDV NS). Bei Auftreten positiver Einzeltierreaktionen in Antikörper-ELISAs mit Proben aus ansonsten unverdächtigen Betrieben sind Nachuntersuchungen, insbesondere mit dem Virus-Neutralisationstest (NT) erforderlich. Dieser wird nur am FLI durchgeführt und dauert in der Regel 4 Tage. In bestimmten Fällen kann auch eine Untersuchung auf Antikörper gegen Strukturproteine des MKSV mittels eines kommerziellen Testkits sinnvoll sein. Es ist hierbei die Prüfung der Eignung des Testkits für das aktuelle Ausbruchsvirus am FLI abzuwarten. Zurzeit existiert diese Möglichkeit nur für den Serotyp O. Zugelassene Testkists finden sich auf der Webseite des FLI ( FLI 245
247 34. Milzbrand Charakterisierung der Infektion Erreger Bacillus (B.) anthracis ist der Erreger des Milzbrandes, einer meist akut und oft tödlich verlaufenden Infektionskrankheit mit septikämischem Charakter. Haus- und Wildwiederkäuer sind hochempfindlich für Milzbrand, Schweine, Fleischfresser und auch Menschen (eher mäßig) und Vögel (Ausnahme Strauß) gelten als fast resistent. Die Krankheit ist weltweit verbreitet und kommt am häufigsten in Asien (Naher und Ferner Osten, Indien), Afrika und Südamerika vor; in Europa sind der mediterrane Raum und Osteuropa am stärksten betroffen. Die Ansteckung erfolgt gewöhnlich durch die Aufnahme von Milzbrandsporen mit dem Futter oder Trinkwasser. Nur in Ausnahmefällen wird die Krankheit von Tier zu Tier übertragen. Auch eine Ansteckung über Milzbrandsporen enthaltende Stäube und Aerosole ist möglich. Der Milzbranderreger bildet Sporen als Dauerformen, die sich über Jahrzehnte im Erdboden als ansteckungsfähig erhalten können. Milzbrandsporen werden weder durch Fäulnis noch durch Eintrocknen oder beim Gerben der Häute vernichtet Klinische Symptomatik Milzbrand ist am lebenden Tier selten mit Sicherheit festzustellen. Beim Rind und Schaf treten meist plötzliche Todesfälle auf. Aus den Körperöffnungen (Anus, Vulva, Mund, Nase) tritt dunkles, schlecht gerinnendes Blut. Erst bei der Zerlegung ist ein Verdacht auf Milzbrand festzustellen. Wenn weitere Tiere mit hohem Fieber, unregelmäßigem Puls, beschleunigter Atmung und evtl. Kolikerscheinungen erkranken, liegt der Verdacht auf Milzbrand nahe. Tierärztliche Behandlung ist nur dann Erfolg versprechend, wenn sie frühzeitig einsetzen kann. Beim Pferd: plötzlich hochfieberhafte Erkrankung mit Kolik, Schling- und Atembeschwerden, Atemnot wegen Schwellung im Kehlgangsbereich, auch scheinbare Besserung und Tod nach mehreren Tagen. Beim Schwein können Krankheitserscheinungen am lebenden Tier fehlen, in vereinzelten Fällen sind Atembeschwerden infolge Rachenentzündung sowie Verfärbung und Schwellung im Bereich des Kehlkopfes (Milzbrandbräune) zu beobachten. Die größte Zahl der Milzbrandfälle wird erst bei der Fleischbeschau oder in der Tierkörperbeseitigungsanstalt festgestellt Differentialdiagnostik Pasteurellose, Rauschbrand, Pararauschbrand, Vergiftungen FLI 246
248 Diagnostische Indikation gemäß Milzbrand-Rauschbrand-VO siehe Zuständige Untersuchungseinrichtungen Zuständige Veterinäruntersuchungsämter NRL am FLI, Standort Jena Rechtsgrundlagen Verordnung zum Schutz gegen den Milzbrand und den Rauschbrand vom 23. Mai 1991 (BGBl. I S. 1172) in der jeweils geltenden Fassung. Manuel of Standards for Diagnostic Tests and Vaccines des OIE Untersuchungsmaterial Gewinnung Zur Untersuchung sollte nur frisch entnommenes Material verwendet werden. Vom lebenden Tier: Vom toten Tier: Aus der Umwelt: Blut aus der Ohrvene (B. anthracis ist nur 16 bis 18 h vor dem Tod im Blut nachweisbar) Ganze Kadaver, Sektionsmaterial, aber auch Blutausstriche und tierische Produkte wie Häute, Haare, Wolle, Tierkörpermehle Boden, Ziegelschutt u. ähnliche organische Materialien Transport und Lagerung Während des Transportes und evtl. notwendig werdender kurzzeitiger Lagerung ist das Material kühl bei +7 C ± 3 C aufzubewahren. Untersuchungsmaterial umgehend vorschriftsmäßig in dicht schließenden Behältnissen verpackt, gekennzeichnet gemäß der entsprechenden Gefahrgutverordnung Straße (ADR) und Eisenbahn (RID), Luftverkehr (IATA-DGR), DIN EN 829, Infektionsschutzgesetz, in der jeweils geltenden Fassung, zusammen mit Vorbericht und Untersuchungsantrag nach vorheriger telefonischer Absprache schicken. Wegen möglicher Gefährdungen während des Transportes sollte Milzbrandverdächtiges Untersuchungsgut durch Kurier übermittelt werden. FLI 247
249 34.3. Untersuchungsgang Allgemeines Der Umgang mit potentiell B.-anthracis-haltigem Material und Kulturen ist genehmigungspflichtig und darf nur in einem Labor der Sicherheitsklasse 3 vorgenommen werden. Vor Beginn der Arbeiten ist das Material einem Tierarzt zur Beurteilung vorzulegen. Bei Milzbrandverdacht ist folgende Reihenfolge der Laboruntersuchungen einzuhalten: Beim lebenden Tier zuerst Blut aus der Ohrvene entnehmen, Ausstrich anfertigen nach Färbung mikroskopieren Beim toten Tier zuerst ebenfalls Blut aus der Ohrvene entnehmen, Ausstrich anfertigen und mikroskopieren. Bei Öffnung des Kadavers auf mögliche Sporenbildung achten, um Infektionen zu vermeiden. Wenn weiterhin fragliche Diagnose: Präzipitation nach Ascoli und kulturelle Untersuchung einleiten. Bei tierischen Rohstoffen zuerst Präzipitation nach Ascoli, dann kulturelle Untersuchung und evtl. Tierversuch. Stärker verunreinigtes Untersuchungsmaterial kann zur Verbesserung der diagnostischen Sicherheit vorbehandelt werden. Empfohlen wird, die Probe in Wasser auszuschwemmen, zu schütteln und durch Glaswolle zu filtrieren und dann das Sediment weiter zu bearbeiten. Stark fauliges, verunreinigtes Material kann zur Unterdrückung der vegetativen Nichtsporenbildner etwa 20 min auf 80 C erhitzt werden Erregernachweis Mikroskopischer Nachweis Von den oben genannten veränderten Organen bzw. vom Blut werden Ausstrichund/oder Abklatschpräparate gefertigt, getrocknet und hitzefixiert. Färbungen sind in Schalen durchzuführen, die mit geeigneten Desinfektionsmitteln gefüllt sind, damit abtropfende Flüssigkeiten aufgefangen werden. Übersichtsfärbungen Gramfärbung: Die stäbchenförmigen (1,0 bis 1,25 x 5 bis 10 µm), plumpen, zylindrischen Gram-positiven Milzbranderreger liegen in Organ- und Blutausstrichen einzeln oder in kurzen Ketten von 2 bis 4 Bazillen vor. Die Enden der einzelnen Zelle sind durch die Fixierung scharf rechteckig abgegrenzt, in Ketten sieht man gerade oder doppelt konvexe helle Zwischenräume. Die Längsseiten sind mitunter durch stärkere Hitzefixierung etwas konkav eingezogen (sog. Bambusstockform ). Der Erreger ist etwas Gram-labil, daher sollten die Färbungen innerhalb 24 h nach Ausstreichen von isolierten Bazillen und Inkubation auf Blutagar erfolgen. FLI 248
250 Sporenfärbung nach Rakette: Bacillus-spp.-Sporen lassen sich gut mit dieser Färbemethode nachweisen. Die Sporulation kann bei Anwendung von Nutrient Agar (am besten eignet sich Glucose-haltiger Nähragar wie Standard I-Nähragar von Merck) mit 0,01 % MnSO 4 gefördert werden. Die Sporen bilden sich hier am besten beim Bebrüten auf trockenen Nährböden. Kapselfärbung nach Foth: Die Kapselfärbung nach Foth erlaubt eine relativ spezifische Diagnostik. Im Tierkörper oder bei Isolierung aus frischem Organmaterial lässt sich eine deutliche Kapsel erkennen, welche aber nach Kultivierung auf künstlichen Nährmedien rasch verloren gehen kann oder nur noch schwach ausgebildet wird. Da die Kapseln gegenüber äußeren Einflüssen widerstandsfähiger als die vegetativen Zellen sind, findet man in Kadaver-Ausstrichen bzw. Abklatschpräparaten oft leere Kapseln. Der Kapselnachweis in Kulturen sollte erfolgen, wenn diese auf bikarbonathaltigen Nährböden unter 5- bis 7%iger CO 2 -Atmosphäre bzw. auf Nähragar mit 0,7 % Natriumbicarbonat kultiviert wurden. Differentialdiagnose: Andere Bacillus spp, wie z. B. B. subtilis, B. mesentericus, B. cereus u. ä., die in den Übersichtsfärbungen B. anthracis sehr ähnlich sind, lassen sich durch den Nachweis der Kapselbildung abgrenzen Kultureller Nachweis Die kulturelle Anzüchtung gilt als sehr sichere Nachweismethode. Als Ausgangsmaterial werden o. g. Materialien und Vorbehandlungsarten empfohlen. Anreicherung Ist üblich besonders bei der Untersuchung von Futtermitteln, die Tierkörpermehle enthalten, aber auch bei Häuten, Haaren, Wolle, Oberflächentupfern und Bodenproben. Beimpfung einer Nährbouillon, die mindestens 18 h bei 37 C aerob bebrütet wird. In der Bouillonkultur wird dabei ein feinflockiger Bodensatz gebildet. Es kommt weder zu einer Trübung des Überstandes noch zu einer Häutchenbildung (Tab. 1). Kontaminiertes Material sollte mit der selektiven Anreicherungsbouillon für B.- anthracis/b.-cereus-sporen (Anhang Pkt. 2) angereichert werden. Schon nach 6 h Schütteln bei 37 C wird die exponentielle Wachstumsphase erreicht und man kann auf Selektivnährmedien (s. u.) überimpfen. Zur Sicherheit sollte die angesetzte Bouillonkultur bis 18 h bei 37 C weiter bebrütet und danach auf Selektivnährmedien ausgestrichen werden. Wird das Untersuchungsmaterial zur Ausschaltung der vegetativen Kontaminanten für 20 min bei 80 C erhitzt, kann die angegebene Anreicherungsbouillon für B. anthracis/b. cereus auch ohne Hemmstoffe verwendet werden. Dadurch verkürzt sich die Anreicherungszeit auf 4 h Schütteln bei 37 C (Reissbrodt, 2004). FLI 249
251 Direktkultur Diese erfolgt auf festen Nährmedien wie Blutagar oder den unten angeführten Selektivnährmedien. Hierbei sind stets mehrere Platten zu verwenden. Die Beimpfung erfolgt direkt oder nach Vorbehandlung und/oder Anreicherung (s. o.). Die Platten werden mindestens 18 h bei 37 C aerob bebrütet. Nach 18- bis 24-stündiger Bebrütung sind Kolonien von B. anthracis mittelgroß bis groß (etwa 0,5 cm Durchmesser), mattglänzend oder trocken, flach, nicht pigmentiert, mit flockig-spiraliger Oberfläche und von butterartiger Konsistenz. Bei längerer Bebrütung werden am Kolonierand fransige Ausläufer sichtbar, die durch parallele Bakterienfäden entstehen und die bogenartig zur Kolonie zurücklaufen (sog. "Medusenhauptform"). Es entstehen oft Tochterkolonien. Auf Blutagar tritt keine Hämolyse auf. Im Grampräparat lassen sich Gram-positive plumpe Stäbchen mit mittelständigen ovalen Sporen nachweisen, wobei die Sporulation bei Anwendung von Nutrient Agar mit 0,01 % MnSO 4 gefördert wird (3.2.1). Infolge morphologischer Ähnlichkeiten kommt der Abgrenzung zwischen B. anthracis und seinen taxonomisch nächsten Verwandten B. cereus, B. thuringiensis und B. mycoides (B.-cereus Gruppe) besondere praktische Bedeutung zu. Weiterhin sind differentialdiagnostisch einige Antibiotika bildende Arten von Interesse, wie z. B. B. polymyxa (Polymyxin B), B. brevis (Tyrothricin), B. subtilis bzw. B. licheniformis (Bacitracin) von Interesse. Auch B. megaterium (Erdbazillus) kann im Rahmen der Differentialdiagnostik eine Rolle spielen. Zur Identifizierung von B. anthracis sollten bereits beim Anlegen von Organproben Selektivnährmedien eingesetzt werden. Anthrax-Blutagar Auf diesem speziell für die Anthraxdiagnostik entwickelten Nährboden finden Bacillus spp. eine gute Nährstoffbasis, um schnell zu charakteristischen großen Kolonien auszuwachsen. Das Selektivsupplement hemmt B. subtilis und B. megaterium vollständig, ebenso ist das Wachstum von Staphylokokken, von Enterobacteriaceae, Pseudomonas aeruginosa und Enterokokken entweder vollständig gehemmt oder stark reduziert. Der Zusatz von Schafblut unterstützt das Wachstum, gleichzeitig ist das Auftreten einer starken Hämolyse um die Kolonien der anderen Bacillus spp. wie B. cereus, B. thuringiensis, B. mycoides, B. licheniformis ein hervorragendes Differenzierungsmerkmal zu B. anthracis. B.-anthracis-Stämme wachsen als weiße, große Kolonien (2 bis 6 mm im Durchmesser) mit charakteristischer stumpfer Oberfläche ohne Hämolyse (Tab. 2). Chromogene Selektivnährmedien Zur weiteren Differenzierung der Bacillus spp. wird das beschriebene BCM B.- cereus/b.-thuringiensis-plating-medium auch als Fertigplatte Cereus-Ident-Agar erhältlich, empfohlen. Dieses ursprünglich im Rahmen der B.-cereus-/B.-thuringiensis- Diagnostik eingesetzte Nährmedium ermöglicht eine optisch klare Differentialdiagnostik innerhalb der Bacillus spp. Alle Spezies, welche die Phosphatidylinositol- Phospholipase C (PI-PLC) enthalten und in der Lage sind, das chromogene Substrat X-myoinositol-1-phosphat zu spalten, wachsen als türkise Kolonien (z. B. B. cereus, B. thuringiensis). B. anthracis wächst mit einem Durchmesser wie B. cereus (ca. 4 mm), aber als stumpfe, weiße Kolonie (Tab. 2). Eine Gram-positive oder Gramnegative Begleitflora wird dabei weitgehend oder vollständig gehemmt (Reissbrodt et al., 2004). FLI 250
252 Die isolierten verdächtigen Kolonien müssen unbedingt und in jedem Fall mit einer geeigneten Methode der Polymerase-Ketten-Reaktion (PCR) als B. anthracis bestätigt und hinsichtlich der vorhandenen Virulenzplasmide charakterisiert werden (z. B. Beyer et al., 1995) Antigennachweis Thermopräzipitation (nach Ascoli und Valente) Dieses Verfahren zum Antigennachweis bei Milzbrand kann bei perakut verlaufendem oder lokalisiertem Milzbrand (Rachen-, Darm-, Hautmilzbrand) wegen zu geringer Antigenmengen im Probenmaterial bis zu 40 % falsch-negative Ergebnisse liefern. Andererseits können Verunreinigungen mit anderen aeroben Bazillen auch zu falsch-positiven Ergebnissen führen. Aus diesem Grunde sind Knochenmehl, Futtermittel und Bodenproben zur Ascolireaktion (Anhang Pkt. 6) ungeeignet. Polymerase-Kettenreaktion (PCR) Diese sehr spezifische und sensitive Methode steht in konventioneller Form und als Realtime-PCR zur Verfügung. Der Nachweis dreier charakteristischer genetischer Marker (Plasmid px01 kodierend für protektives Antigen, Plasmid px02 kodierend für Kapselantigen sowie ein genomischer Marker, z. B. rpob-gen oder vrra-gen) in verdächtigen Kulturen bestätigt das Vorhandensein von virulenten B.-anthracis-Stämmen im Untersuchungsmaterial Serologische Diagnostik In der Veterinärmedizin ist der Antikörpernachweis bei Milzbrand nicht üblich. Für Menschen sind mehrere Tests beschrieben (Agar-Gel-Präzipitation, Indirekte Hämagglutination, ELISA, Immunoblot), von denen bisher keiner als Standardmethode akzeptiert worden ist Phagentest Der Phagentest wird unter Anwendung des für B. anthracis spezifischen g-phagen durchgeführt. Als Ausgangskultur kann einerseits eine 3- bis 4-stündige Nährbouillonkultur oder eine leicht trübe Suspension des verdächtigen Koloniematerials in steriler physiologischer Kochsalzlösung oder auch mit dem resuspendierten Koloniematerial direkt verwendet werden. Stets sollte als Positivkontrolle ein gut charakterisierter Milzbrandstamm und als Negativkontrolle ein B.-cereus-Stamm bei gleicher Präparationstechnik in die Untersuchung einbezogen werden. Durchführung: Auf Blutagar wird auf der Rückseite der Petrischale mit Schablone eine kreisrunde Fläche (Ø 2 cm) markiert. Auf dieser Fläche wird das Probenmaterial verteilt. Den Inhalt einer Öse mit Phagensuspension (Titer ca. 1:10 000) exzentrisch auf diesen Bereich auslaufen lassen, (Flüssigkulturen müssen vorher erst eintrocknen), Bebrütung 7 bis 8 h bei 37 C, danach Ablesung. Positiver Befund: an der Stelle, wo die Phagensuspension aufgetropft wurde, ist ein Phagenloch (bakterienfreier Bereich) zu sehen. FLI 251
253 Kultureller B.-anthracis-Schnelltest Als besonders schnelle Methode des kulturellen B.-anthracis-Nachweises sollte aus der Anreicherungskultur auf die beschriebenen Selektivnährmedien (Anthrax- Blutagar oder TMSP-Agar und ein chromogenes Selektivnährmedium) ausgeimpft und anschließend der g-phage wie beschrieben aufgesetzt werden. Im günstigen Falle erkennt man schon nach 4 bis 6 Std. Bebrütung bei 37 C zartes Wachstum und das typische Phagenloch. Nach weiterer Bebrütung bei 37 C für 18 h ist das Phagenloch gut sichtbar, gleichzeitig kann man die Kolonieformen und biochemischen Reaktionen (Hämolyse, PI- PLC) ablesen. Die Differenzierungsmerkmale zwischen B. anthracis und anderen Sporenbildnern sind in Tabelle 1 und 2 im Anhang zusammengefasst. FLI 252
254 Anhang 1. Mikroskopische Färbemethoden 1.1. Sporenfärbung nach Rakette Durchführung: fixieren des luftgetrockneten Präparates: 6- bis 8-mal mit einer Halteklammer durch die Flamme ziehen Präparat mit 5%iger wässriger Malachitgrünlösung vollständig bedecken, 20 sec über Flamme aufkochen und weitere 30 sec einwirken lassen kräftig mit Leitungswasser spülen Nachfärbung: 1 min das Präparat mit 2,5%iger Eosinlösung oder mit 3%iger Safraninlösung vollständig bedecken Abspülen mit Leitungswasser und anschließend zwischen Filterpapier trocknen mikroskopische Beurteilung (bei 100-facher Vergrößerung) Ergebnis: Sporen = grün, übrige Zellbestandteile = rot 1.2. Kapselfärbung n. Foth (Giemsa-Schnellfärbung) Durchführung: Objektträgerausstrich lufttrocknen, aber nicht fixieren bedecken mit zwei Tropfen Giemsa-Stammlösung für 1 bis 2 min dann 20 Tropfen (= 1 ml) Aqua dest. zusetzen und durch leichtes Schwenken mit der Giemsa-Lösung mischen, Einwirkungszeit 2 bis 5 min abspülen und trocknen Ergebnis: Bakterienkapsel = rosarot, Bakterienzelle = blauviolett FLI 253
255 2. Nährmedien 2.1. Anreicherungsbouillon für B.-anthracis/B.-cereus-Sporen (Reissbrodt, 2002) Basis Nutrient Broth (Difco, BD) für 1 l Tryptone (Difco,BD) 5,0g NaCl 5,0g K 2 HPO 4 4,0g Sterilisation 15 min 121 C ph 7,3 ± 0,1 Supplemente (als sterile Lösungen zugeben) D-Glucose 2,0g Trimethoprim 0,0032g Sulfamethoxazol 0,016g Polymyxin B 0,020g Cycloheximid 0,200g 2.2. Blutagar Brucella-Agar (oder andere Blutagarbasis, siehe z. B. die folgende Rezeptur) mit Zusatz von 5 % defibriniertem Blut von Schafen, Pferden, Rindern oder Kaninchen. Weiter wird empfohlen: Bacto-Pepton Natriumchlorid Na 2 HPO 4 x 12H 2 O Fleischextrakt Aqua dest. ad ph = 7,2 ±0,2 10,0 g 5,0 g 2,0 g 6,0 g 1000,0 ml 2.3. Antrax-Blutagar Caseinpepton Fleischpepton Hefeextrakt NaCl Agar Schafblut Trimethoprim Sulfamethoxazol Polymyxin B Aqua dest. ad ph 7,3 ± 0,2 14,0 g 4,5 g 4,5 g 5,0 g 16,0 g 50 ml 3,2 mg 16,0 mg 20 mg 1000,0 ml FLI 254
256 2.4. TMSP-Agar Standard-Agar 40,0 g Trimethoprimlactat Salz 13,1 mg Sulfamethoxazol 20,0 mg Polymyxin B Schafblut Aqua dest. ad ph 7,3 ± 0, Einheiten 50,0 ml 1000,0 ml Die Zusätze werden als Sterilfiltrate präpariert und nach Abkühlung des autoklavierten Agarmediums auf 50 C zugesetzt. Trimethoprim kann als 100-fache Stammlösung in Wasser angesetzt und bei -20 C in Aliquots gelagert werden. Eine 100-fache Lösung von Sulfamethoxazol kann durch Zusatz von 600 µl 10 % NaOH zu 100 ml Wasser und Erhitzung der Lösung auf 80 C hergestellt werden Chromogene B.-cereus-Selektivnährmedien BCM Bacillus-cereus/Bacillus-thuringiensis Plating-Medium (Pulver) Catalog-Nr. C-0710 BCM Bacillus-cereus/Bacillus-thuringiensis-Supplement Catalog-Nr. C-0712 Zur Herstellung der Platten wird das Basismedium (Pulver) gelöst und autoklaviert, das chromogene Substrat und die Hemmstoffe werden als sterile Supplementlösung vor dem Ausgießen zugesetzt. Das BCM Bacillus-cereus/Bacillus-thuringiensis-Plating-Medium (Biosynth) steht leicht variiert als Fertigplatte unter dem Namen Cereus-Ident -Agar(Heipha Art.-Nr. 174e) zur Verfügung. Cereus-Ident-Agar Columbia-Agar Wachstumssupplement Chromogenes Selektivsupplement Aqua dest. ad ph 7,3 ± 0,1 42,5 g 4,0 g 2,45 g 1000,0 ml FLI 255
257 2.6. Halbfestes Nährmedium zur Beweglichkeitsprüfung Tetrazoliumsalze sind farblos, werden aber bei Bakteriumwachstum in die Zellen aufgenommen und zu einem roten Farbstoff (Formazan) reduziert. Die Beweglichkeit kann damit durch Ausschwärmen der Bakterien auf dem Nährmedium sichtbar gemacht werden. NB I- Bouillon Standard-Agar lösen, autoklavieren (15 min bei 121 C) 2,3,5,-triphenyltetrazolium chlorid (steril zusetzen) Aqua dest. ad für 1 L 2,5 g 0,05 g 1000,0 ml 3. Beweglichkeitstest Die Prüfung der Beweglichkeit eines Bakteriums erfolgt entweder nach der Technik des Hängenden Tropfens oder mit einer Wachstumsprüfung auf halbfestem Agar. Bouillonkulturen verdächtiger Kolonien eignen sich gut als Ausgangsmaterial für die Beweglichkeitsprüfung im Hängenden Tropfen. 4. Perlschnurtest Seine Bedeutung für die Diagnostik ist umstritten. Der Test beruht darauf, dass auf Penicillinhaltigen Nährböden Milzbrandbazillen zu kugeligen Formen degenerieren, die wie eine Perlschnur aussehen. Es gibt mehrere Varianten bei der Durchführung dieses Tests (Dedié et al., 1993), meist führt man die Kultivierung als Agar- Deckglaskultur (Hallmann, 1961) oder zur Verminderung der Infektionsgefährdung die Kultivierung auf einem ausgestanzten Agarstück durch. Durchführung: Nähragar mit einem Penicillingehalt von 0,5 IE/ml wird in 1 bis 2 mm Schichtdicke in Petrischalen ausgegossen, nach dem Erstarren wird ein Agarplättchen von ca. 1 mm Durchmesser steril ausgestanzt, auf einen sterilen Objektträger gelegt und mit der fraglichen, 6-stündigen geschüttelten Bouillonkultur beimpft. Bebrütung: 6 h in feuchter Kammer Beurteilung: in der Direktmikroskopie. Milzbrand zeigt perlschnurartige Deformation der Stäbchen. 5. Tierversuch Ein Tierversuch ist behördlich genehmigungspflichtig. Er wird nur durchgeführt, wenn durch andere Diagnostik keine eindeutige Abklärung möglich ist. Durchführung: In der Regel werden weiße Mäuse benutzt, mitunter auch Meerschweinchen. Vom Probenmaterial werden 0,5 ml subkutan oberhalb der Schwanzwurzel verabreicht. Das Material wird zuvor ggf. zerkleinert (Mörser), filtriert und kurz erhitzt (10 bis 30 min, 80 C). Kulturen werden mit physiologischer Kochsalzlösung abgeschwemmt. FLI 256
258 Beurteilung: Beim Vorliegen von Milzbrand zeigen die Tiere zuerst ein sulziges Ödem an der Injektionsstelle, dann eine Septikämie, durch die der Tod nach 1 bis 3 Tagen eintritt. 6. Thermopräzipitation nach Ascoli u. Valente 6.1. Besondere Gebrauchsmaterialien Uhlenhutröhrchen oder enge Reagenzgläser (Innendurchmesser 2 bis 3 mm, Länge ca. 3 cm) Milzbrand-Antigen, positiv- zugel. nach 17 TierSG Milzbrand-Antigen, negativ Milzbrand-Kontrollserum, positiv - zugel. nach 17 TierSG Milzbrand-Kontrollserum, negativ Physiologische Kochsalzlösung mit Phenol Natriumchlorid p. A 8,9 g Aqua bidest ad ml 2 min bei 121 C autoklavieren Phenol p. A. 0,5 g 6.2. Vorbereitung des Untersuchungsmaterials Untersuchungsmaterial: Gewebe, Organteile, Häute, Pelze, Haare, Wolle, fragliche Kultur Aufbereitung des Untersuchungsmaterials Untersuchungsmaterial mit Schere zerkleinern Mit 5- bis 10-facher Menge Phenol-NaCl-Lösung aufkochen (30 min bei 90 bis 100 C) Nach dem Abkühlen Klärung durch Filtration (Spritzenvorsatzfilter, 045 µm) Stärker verunreinigtes Untersuchungsmaterial kann zur Verbesserung der diagnostischen Sicherheit vorbehandelt werden. Empfohlen wird, die Probe in Wasser aufzuschwemmen, zu schütteln, durch Glaswolle zu filtrieren und das Sediment weiter zu bearbeiten. Stark fauliges, verunreinigtes Material kann auch zur Unterdrückung der Nichtsporenbildner etwa 20 min auf 80 C erhitzt werden. Bei fraglichen Kulturen wird ein Schrägagarröhrchen mit 10 ml physiologischer NaCl- Lösung abgeschwemmt, die Abschwemmung ebenfalls 30 min bei 90 bis 100 C erhitzt und filtriert. FLI 257
259 6.3. Durchführung Kontrollsystem Serum-Kontrollen: Positives Kontrollserum (+Ko) + Positives Milzbrand-Antigen (+Ag) Positives Kontrollserum (+Ko) + Negatives Milzbrand-Antigen ( Ag) Antigen-Kontrollen: Negatives Kontrollserum ( Ko) + Extrakt (fragliches Ag) Negatives Kontrollserum ( Ko) + Positives Milzbrand-Antigen (+Ag) Negatives Kontrollserum ( Ko) + Negatives Milzbrand-Antigen ( Ag) Resuspendierte Seren können portioniert entsprechend Herstellervorschrift aufbewahrt werden. Seren und Antigen auf Raumtemperatur erwärmen Ansatz und Bewertung In engen Röhrchen werden mit einer Kapillarpipette ca. 50 µl entsprechender Kontrollseren mit ca. 50 µl entsprechendem Antigen vorsichtig überschichtet. Die Flüssigkeiten dürfen sich nicht mischen Die Ablesung erfolgt nach 15 min Bei positiver Reaktion bildet sich innerhalb der Beobachtungszeit an der Berührungsstelle ein Präzipitationsring Ausschluss evtl. Kreuzreaktionen mit anderen Bacillus spp.!!! Die folgende Tabelle stellt ein Ansatzschema für die Untersuchung einer Probe und deren Bewertung dar. Diagn. Serumkontrollen Antigenkontrollen Reaktion Röhrchen Ko +Ko +Ko Ko Ko Ko fragliches Ag +Ag Ag fragliches Ag +Ag Ag Bewertung + oder + 7. Allgemeiner Untersuchungsgang bei Milzbrandverdacht (Organproben) Färbungen von Abklatschpräparaten Färbungen: Gramfärbung,Sporenfärbung, Kapselfärbung (Ascoli Reaktion) Kulturelle Untersuchung (evtl. Organmaterial zusätzlich auch hitzebehandelt untersuchen): Anreicherungskultur Direktkultur (Selektivnährmedien) Phagenlysis Beurteilung Koloniemorphologie, Hämolysebildungsvermögen, Beweglichkeit PCR von verdächtigen Kolonien bzw. von der Anreicherungskultur--- Endbefund FLI 258
260 Literatur BEYER, W., P. GLÖCKNER, J. OTTO and R. BÖHM (1995): A nested PCR method for the detection of Bacillus anthracis in environmental samples collected from former tannery sites. Microbiol. Res., 150, BROWN, E. R. and Cherry, W. B. (1955): Specific identification of Bacillus anthracis by means of a variant bacteriophage. J. infect. Dis. 96, DEDIÉ, K., BOCKEMÜHL, J., KÜHN, H., VOLKMER, K.-J. und WEINKE, TH. (1993): Epidemiologie, Pathologie, Klinik, Diagnostik und Bekämpfung. In: Bakterielle Zoonosen bei Mensch und Tier, Kapitel 12 Milzbrand. Ferdinand Enke Verlag Stuttgart, S HALLMANN, L. (1961):Ausgewählte Untersuchungsmethoden für das bakteriologische und serologische Laboratorium. In: Bakteriologie und Serologie. Georg Thieme Verlag Stuttgart, 3. Aufl. REISSBRODT, R, A. RASSBACH, B.BURGHARDT,I. RIENÄCKER, H. MIETKE, J. SCHLEIF, H. TSCHÄPE, M. LYTE, AND P.H.WILLIAMS (2004): Assessment of a New Selective Chromogenic Bacillus cereus Group Plating medium and Use of Enterobacterial Autoinducer of Growth for Cultural Identification of Bacillus Species. Journal of Clinical Microbiology, OIE (2004): Anthrax. In: Manuel of Standards for Diagnostic Tests and Vaccines. List A and B diseases of mammals, birds and bees, Office International des Epizooties, World organisation for animal health. Fifth Edition FLI 259
261 Tabelle 1: Differenzierungsmerkmale zwischen B. anthracis und anderen Bacillus spp. (nach Dedie et al. 1993, mod.) B. anthracis B. cereus B. mycoides B. megaterium Beweglichkeit s p e z i f i s c h e T e s t s Hämolyse Phagen- - keine Hämolyse (selten späte Vergrünung) ± (meist schwach beweglich) b- Hämolyse lysis + + (bekapselt e Stämme) Mäusepathogenität w e n i g e r s p e z i f i s c h e T e s t s Ascoli- Kolonie- Wachstum Perl- Reaktion Form in schnurtest Bouillon + kräftige Reaktion bei ca. 40 % der Fälle gewölbt, schleimig glänzend + (90 %*) meist starke b- Hämolyse - (meist) ± (positiv: Pferdeblut; variabel: Schafblut) - ± (25 bis 80 %*) flach, rau, rhizoid - - (10 %*) ± (15 bis 40 % *) schwache Reaktion Oberfläche stumpf - - (0 %*) rund, glattrandig * Zahl in Klammern: Prozentsatz der Stämme mit positiven Reaktionen klar mit feinflockigem Bodensatz trübe mit Sediment klar, anfangs mit - Häutchen, das absinkt trübe - + für Penicillinresistente Stämme Oxacillin verwenden - Tabelle 2: Wachstum und Koloniemorphologie von Bacillus spp. auf verschiedenen Nährmedien (37 C, 24 h) Nährmedien Blutagar Anthrax-Blutagar BCM Bacillus- cereus- /Bacillus- thuringiensis- Plating-Medium Spezies Wachstum Hämolyse Wachstum, Hämolyse Wachstum, Koloniefarbe Koloniefarbe Cereus-Ident- Agar Wachstum, Koloniefarbe B. anthracis weiß ø groß, weiß ø groß, weiß groß, weiß B.-cereus- weiß + groß, weiß + groß, türkis* groß, türkis* Wildstämme B.-cereusprobiotische weiß + groß, weiß + groß, helltürkis groß, türkis Stämme B. weiß + groß, weiß + groß, türkis * groß, türkis* thuringiensis B. subtilis weiß + kein - kein kein B. mycoides weiß + groß, weiß + kein groß, türkises Zentrum B. hell ø kein - klein, hell kein lichenformis B. megaterium weiß ø kein - kein kein *teilweise türkiser Hof um Kolonien FLI 260
262 35. Newcastle-Krankheit (ND) Charakterisierung der Infektion Erreger Der Erreger der Newcastle-Krankheit (Newcastle Disease, ND) war der erste Vertreter der Gattung Paramyxovirus (PMV), der von Vögeln isoliert wurde. Als in den vergangenen Jahren weitere, serologisch vom Newcastle Disease Virus (NDV) unterscheidbare aviäre PMV entdeckt wurden, bezeichnete man NDV als APMV-1 und ordnete die übrigen in die Serogruppen APMV-2 bis APMV-9. Im Gegensatz zum NDV haben APMV-2 bis APMV-9 eine geringere Bedeutung als Krankheitserreger Klinische Symptomatik APMV-1 (oder NDV) ist weltweit verbreitet und konnte bisher von mehr als 240 Vogelarten isoliert werden. Die Schwere der hervorgerufenen Erkrankung hängt ab von der Pathogenität des Virusstammes, der Wirtsspezies sowie von der Immunkompetenz der betroffenen Tiere. Beim Haushuhn kann die Erkrankung in Abhängigkeit vom Virusstamm vom plötzlichen Tod mit 100 % Mortalität bis zur subklinischen Erkrankung variieren. Virus, das bei Hühnern und Puten zu hoher Morbidität und Mortalität führt, kann z. B. bei Enten oder Gänsen nur eine inapparente Erkrankung auslösen. Andererseits führt Virus von schwer erkrankten Tauben meist nur zur leichten Erkrankung mit einem vorübergehenden Legeleistungsabfall bei Hühnern. Bei ND sind bei perakuten Verläufen plötzlich auftretende Todesfälle ohne vorherige Krankheitszeichen zu beobachten. Darüber hinaus können folgende Symptome auftreten: Legeleistungsabfall, Depressionen, Ödeme an Kopf und Kehllappen, respiratorische Störungen, Durchfall und nervale Symptome. Bei Tauben dominieren Polyurie und ZNS Störungen das klinische Bild. Bei der Sektion können hämorrhagische Veränderungen festgestellt werden, insbesondere an Drüsenmagen, Darm, Serosa und Epikard. Manchmal bestehen entzündliche Veränderungen am Respirationstrakt und histologisch eine nichteitrige Enzephalitis, bei Legehennen Follikelruptur Diagnose und Differentialdiagnostik Für die Diagnosestellung ist immer der Erregernachweis erforderlich. Wegen der großen Variationsbreite in der Virulenz wird nicht jede APMV-1-Infektion als seuchenrechtlich zu maßregelnde ND angesehen, sondern nur die durch mittelgradig virulente (mesogene) und hochvirulente (velogene) Virusstämme bedingten Erkrankungen. Der gesetzlich vorgesehene Standardtest für die Bestimmung der Virulenz ist die Ermittlung des intracerebralen Pathogenitätsindex (ICPI) an SPF-Eintagsküken. Bis zu einem ICPI von 0.7 gilt ein Virus als lentogen, von 0.7 bis 1.5 als mesogen und über 1.5 als velogen. Der höchstmögliche ICPI ist 2.0. In der Richtlinie 92/66/EWG vom 14. Juli 1992 ist für die diagnostischen Verfahren zur Bestätigung und Differentialdiagnose folgende Definition gegeben: Die ND ist eine Infektion des Geflügels, verursacht durch ein aviäres Paramyxovirus 1 mit einem intracerebralen Pathogenitätsindex (ICPI) in Eintagsküken von über 0.7. FLI 261
263 Diese Definition gilt auch für die Geflügelpest-Verordnung in der Fassung vom 20. Dezember Diagnostische Indikation Bei Anstieg der Mortalität, bei Auftreten respiratorischer und oder nervaler Symptome, bei Legeleistungsabfall, Reduktion der zu erwartenden Gewichtszunahme sowie bei Feststellung petechialer Blutungen auf Serosen ist eine Untersuchung auf ND einzuleiten (Gefl 8.1) Zuständige Untersuchungseinrichtungen staatlich autorisierte Veterinäruntersuchungsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer Friedrich-Loeffler-Institut, Greifswald - Insel Riems (O.I.E und Nationales Referenzlabor für Newcastle Disease), Tel Rechtsgrundlagen Richtlinie 92/66/EWG vom 14. Juli 1992, in der Fassung vom 01. Mai 2005 Verordnung zum Schutz gegen die Geflügelpest und die Newcastle Krankheit (Geflügelpest-VO) in der Fassung vom 20. Dezember Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Untersuchungsmaterial Erregernachweis Von lebenden Vögeln: Kloakenabstriche oder Fäzes sowie Luftröhrenabstriche. Probenmaterial von kürzlich verendeten oder getöteten Tieren: Luftröhre, Lunge, Niere, Milz, Leber, Pankreas, Darm mit Inhalt, Hirngewebe, sowie andere befallene Organe oder Fäzes. Fäkalmaterial ist von anderen Proben getrennt zu halten. Alle Probenmaterialien sind während des Transportes gekühlt zu halten. Abstriche sollten ganz in antibiotisches Medium eingetaucht werden bzw. es sind kommerzielle Tupferentnahmesysteme zu empfehlen Antikörpernachweis Blutproben, von denen Plasma oder nach Gerinnung das Serum für die Untersuchung gewonnen wird. 20 Proben pro Bestand, bei kleineren Beständen Proben von allen Tieren. Anstelle von Serum kann auch Eidotter untersucht werden. FLI 262
264 35.3. Untersuchungsgang Direkter Erregernachweis Probenaufbereitung Organe und Gewebe können gepoolt werden, nur Fäkalmaterial ist gesondert zu behandeln. Abstriche sollten ganz in antibiotisches Medium getaucht werden. Aus Fäzes und Organen sind 10- bis 20%ige Suspensionen herzustellen. Zur Entfaltung der antibiotischen Wirkung sind die Suspensionen für etwa 2 Stunden bei Umgebungstemperatur (bei 4 C entsprechend länger) stehen zu lassen und danach durch Zentrifugieren zu klären (z. B. 800 bis 1000 g für 10 Minuten). Virusisolierung in embryonierten Hühnereiern Pro Probe sind mindestens 4 embryonierte, 8 bis 10 Tage vorbebrütete Hühnereier mit je 0,1 bis 0,2 ml des geklärten Überstandes in die Allantoishöhle zu beimpfen. Die Eier sollten aus einer spezifiziert pathogenfreien (SPF) Herde stammen; im Notfall können auch Eier aus einem Bestand verwendet werden, der nachweislich frei von NDV-Antikörpern ist. Die beimpften Eier werden bei 37,0 bis 37,8 C weiterbebrütet und täglich durchleuchtet. Eier mit toten oder absterbenden Embryonen sind auf 4 C abzukühlen, ebenso alle verbliebenen Eier 6 Tage nach der Beimpfung. Die Allantois/Amnionflüssigkeiten (AF) sind auf Hämagglutination zu untersuchen. Lässt sich keine Hämagglutination feststellen, wird die unverdünnte AF erneut auf Eier verimpft (2. Eipassage). Wird Hämagglutination festgestellt, sollte eine bakterielle Kontamination ausgeschlossen werden. Sind Bakterien vorhanden, so können die AF durch 450 nm- Membranfilter gegeben werden und nach Zugabe weiterer Antibiotika erneut auf embryonierte Eier verimpft werden. Virusisolierung in Zellkulturen Obwohl embryonierte SPF-Hühnereier das empfänglichste Vermehrungssubstrat für APMV-1 sind, kann die Virusisolierung auch in verschiedenen Zellkulturen erfolgen. Dabei sind primäre Hühnerembryozellen, insbesondere Leberzellen wegen der höheren Empfänglichkeit permanenten Zelllinien vorzuziehen. Nicht alle APMV-1 verursachen einen CPE. Sie lassen sich nachweisen durch Hämagglutination des Zellkulturüberstandes, Hämadsorption von Hühnererythrozyten an den Zellrasen oder spezifische Immunfluoreszenz mit Anti-PMV-1-Konjugat. Nachweis viraler RNA mittels RT-PCR Aus Kloaken- und Rachentupferproben, aus Organ- und Fäzesmaterial kann virale RNA mittels RT-PCR nachgewiesen werden. Das kann vor der Virusisolierung, parallel dazu oder als Bestätigungstest aus infizierter Allantoisflüssigkeit geschehen. Für den Ja-/Nein-Nachweis von APMV-1-RNA wird eine real time RT-PCR durchgeführt, die einen Teil des für das Matrixprotein (M) kodierenden Gens amplifiziert. Mittels einer zweiten real time RT-PCR die ein Genfragment des Fusionsproteins (einschließlich der F 0 -Spaltstelle) detektiert generiert Hinweise auf die Virulenz des auftretenden APMV-1 Typs. Bei den jetzt zur Verfügung stehenden Methoden sind falsch negative Reaktionen nicht auszuschließen. Methodische Hinweise und Primersequenzen können vom NRL abgefordert werden. FLI 263
265 Vorläufige Virusdifferenzierung Wird aus Geflügel ein hämagglutinierendes Virus isoliert, kann es außer APMV-1 (NDV) auch ein anderes der 9 aviären PMV-Serotypen oder ein Influenzavirus sein. Die Identifizierung als APMV-1 erfolgt mit APMV-1-spezifischen polyklonalem Serum mittels Hämagglutinations-Hemmungstest (HAH), bzw. mittels real time RT-PCR. Hämagglutinations(HA)-Test (Arbeitsvorschrift) Reagenzien Phosphatgepufferte isotonische Kochsalzlösung (PBS), ph 7,1 bis 7,3 Hühnererythrozyten-Suspension, 1%ig dreimal gewaschen in PBS zu untersuchende Virussuspension - Ei- oder Zellkulturflüssigkeit oder Überstände von Organanreibungen, - als Standardantigen für Hämagglutinationshemmungsteste wird Allantoisflüssigkeit mit NDV Stamm La Sota empfohlen Arbeitsschritte 0,025 ml PBS in alle Vertiefungen einer Mikrotiterplatte mit U- oder V-Boden einfüllen. 0,025 ml Virussuspension in die erste Vertiefung geben. Eine 2er-Verdünnungsreihe des Virus über die gesamte Platte herstellen. Nochmals 0,025 ml PBS in jede Vertiefung füllen. 0,025 ml 1%ige Erythrozytensuspension in jede Vertiefung hinzugeben. Durch vorsichtiges seitliches Antippen oder Rütteln der Platten mischen. Nach 30 bis 40 Minuten bei Zimmertemperatur, wenn sich die Erythrozyten in der Erythrozytenkontrolle (ohne Virussuspension) abgesetzt haben, ist der Test abzulesen. Die Platte schräg halten und beurteilen, ob die sedimentierten Erythrozyten ablaufen. Zeigen die Erythrozyten die gleiche Strömungsrate wie die in den nichtvirushaltigen Kontrollen, liegt keine HA vor. Der HA-Titer ist die höchste Verdünnung, die Agglutination verursacht. Diese Verdünnung enthält 1 HA-Einheit (HAE). Für eine genauere HA-Titer-Bestimmung als Vortest für HAH muss bei der Virusverdünnung neben 1:2 auch von einer Anfangsverdünnung 1:3 ausgegangen werden. Hämagglutinations-Hemmungs(HAH)-Test (Arbeitsvorschrift) Reagenzien Phosphatgepufferte isotonische Kochsalzlösung (PBS), ph 7,1 bis 7,3 Virus- bzw. Antigensuspension, mit PBS verdünnt auf 4 HAE pro 0,025 ml Hühnererythrozyten-Suspension, 1%ig negatives Kontrollserum positives Kontrollserum positives Kontrollantigen zu untersuchendes Serum FLI 264
266 Arbeitsschritte 0,025 ml PBS in alle Vertiefungen einer Mikrotiterplatte mit U- oder V-Boden einfüllen. 0,025 ml Serum in die erste Vertiefung geben. Eine 2er-Verdünnungsreihe des Serums über die gesamte Platte herstellen. 0,025 ml verdünnte Virussuspension, die 4 HAE enthält, in jede Vertiefung geben. Durch vorsichtiges seitliches Antippen oder Rütteln der Platten mischen. Die Platten für 45 Minuten bei Zimmertemperatur stehenlassen. 0,025 ml 1%ige Erythrozytensuspension in jede Vertiefung zugeben. Durch vorsichtiges Antippen oder Rütteln mischen. Nach 30 bis 40 Minuten bei Zimmertemperatur, wenn sich die Erythrozyten abgesetzt haben, ist der Test auszuwerten. Die Platte schräg halten und beurteilen, ob die sedimentierten Erythrozyten ablaufen. Bei gleicher Strömungsrate wie in den nichtvirushaltigen Kontrollen liegt keine HA vor. Der HAH-Titer ist die höchste Serumverdünnung, die eine HA komplett hemmt. Die weitere Charakterisierung von Virusisolaten erfolgt im Nationalen Referenzlabor für ND im FLI Insel Riems. Gemäß Richtlinie 92/66/EWG werden folgende Untersuchungen durchgeführt: Endgültige Differenzierung des Erregers Sie erfolgt durch HAH-Tests mit spezifischen polyklonalen Seren gegen die aviären Paramyxovirus-Serotypen 1 bis 9 sowie mittels monoklonalen Antikörpern (mak). Durch mak ist zudem eine Identifikation des Taubentyp des NDV (PPMV-1) möglich sowie Hinweise auf das Vorliegen des Vakzinevirus La Sota. Bestimmung der Pathogenität Die Bestimmung der Pathogenität des Erregers erfolgt im Tierversuch durch Ermittlung des ICPI an SPF-Eintagsküken. Als Alternative zum Tierversuch kann die Spaltstelle des F-Gens des Virus sequenziert werden. Bei Nachweis von mehreren basischen Aminosäuren (mindestens 3 Arginin- und/oder Lysinreste zwischen Position 113 und 116) am C-Terminus des F2-Proteins und Phenylalanin auf Position 117, dem N-Terminus des F1- Proteins, gilt das Virus auch als ND-Seuchenvirus. Gelingt der Nachweis von multiplen basischen Aminosäuren in diesem Bereich nicht, muss bei entsprechendem Verdacht zum Ausschluss von ND-Seuchenvirus der ICPI bestimmt werden. Vereinfachtes Verfahren der Bestimmung der Absterbezeit von Hühnerembryonen zur Anwendung in regionalen Untersuchungsämtern Nach Bundesmaßnahmenkatalog Tierseuchen, Teil VI Newcastle Krankheit, kann bei vermehrten Seuchenfällen die Diagnose ND nach Zustimmung der Landesbehörden auch ohne Bestimmung des ICPI gestellt werden, wenn das Virusisolat im zuständigen Untersuchungsamt eindeutig als velogenes NDV erkannt wird. Dafür eignet sich folgendes vereinfachtes Verfahren der Bestimmung der Absterbezeit von Hühnerembryonen: FLI 265
267 Ausgangsmaterial: Bakterienfreie PMV-1-haltige AF oder Zellkulturüberstand Verfahren: 10-2 verdünnt je 0,2 ml auf 6 vorbebrütete SPF-Eier verimpfen zweimal täglich durchleuchten, abgestorbene Eier kühlen AF ernten, auf HA und bakterielle Verunreinigung prüfen Bewertung: Sind alle Embryonen bis zum Ende des 2. Tages p.i. durch die APMV-1-Infektion abgestorben und eine bakterielle Kontamination ist ausgeschlossen, liegt der ICPI des geprüften Virus mit Sicherheit über 0.7. Achtung! Mit diesem Test werden nur velogene Virusisolate erkannt, nicht aber mesogene Virusstämme, deren ICPI jedoch auch über 0.7 liegt. Aus diesem Grunde ist immer nur eine positive Testaussage möglich. Bei negativem Ergebnis muss der ICPI bestimmt werden Untersuchungsdauer Anzüchtung, Virusvermehrung und Identifizierung des APMV-1 dauert 3 bis 7 Tage, längere Zeitdauer möglich; APMV-1-Nachweis mittels real time RT-PCR 2 Tage, negative Ergebnisse sind durch Erregeranzucht abzuklären Schätzung der Pathogenität im regionalen Untersuchungsamt (führt nur zur Erkennung von velogenen Virusisolaten) 3 Tage Bestimmung des Pathotypen mittels Tierversuch und Typisierung im Nationalen Referenzlabor bis 9 Tage bei velogenem Virus bis 14 Tage bei mesogenem Virus 14 bis 16 Tage bei lentogenem Virus mit ICPI < 0.7 (Ausschluss von Seuchenvirus) Bestimmung des Pathotypen mittels Sequenzierung: 3 bis 10 Tage; differenziert nicht zwischen velogenen und mesogenen Isolaten Indirekter Erregernachweis Ist für die Seuchen-Diagnostik von untergeordneter Bedeutung, da gemäß Geflügelpest-Verordnung Impfpflicht für alle Hühner und Puten besteht und sich die Antikörper gegen Feld- und Impfvirus nicht unterscheiden lassen. Die Standardmethode für den Antikörpernachweis ist der Hämagglutinations- Hemmungstest (HAH) nach der oben beschriebenen Methode. Bei nicht immunisierten oder nicht infizierten Tieren können unspezifische HAH-Titer bis 1:8 auftreten. Für den Antikörpernachweis als Impfkontrolle kann auch der ELISA genutzt werden. Kommerzielle Test-Kits mit amtlicher Zulassung sind erhältlich und werden nach den Empfehlungen des jeweiligen Herstellers angewendet. FLI 266
268 Anlage Antibiotisches Medium für Kloakenabstriche oder Fäzes-Material: PBS mit Einheiten/ml Penizillin 10 mg/ml Streptomycin 0,25 mg/ml Gentamycin Einheiten/ml Mykostatin Für Gewebeproben und Trachealabstriche wird nur 1/5 der Antibiotikakonzentration benötigt. Anstelle von Penizillin, Streptomycin und Gentamycin können auch 0,5 bzw. 0,1 mg/ml Enrofloxacin (Baytril) zugesetzt werden. Achtung! Nach der Zugabe der Antibiotika muss der ph-wert des Mediums wieder auf 7.0 bis 7.4 eingestellt werden. NDV positives Kontrollserum für die Identifizierung von Virusisolaten mittels HAH Ist z. B. erhältlich bei C.C. pro GmbH, Moltkestr. 3, Neustadt/W. Tel.: Fax: Oder bei GD Gezondheidsdienst voor Dieren, Arnsbergstraat 7, 7419 EZ Deventer Niederlande Tel.: Fax: NDV Antigen für Hämagglutinationstest Anbieter wie bei ND-Serum FITC-markierte Antikörper gegen NDV Anbieter wie bei ND-Serum Die aufgeführten kommerziell erhältlichen Diagnostika sind nicht amtlich zugelassen. FLI 267
269 36. Nipah/Hendra Virus Infektion Infektionen mit dem Hendra-Virus und dem Nipah-Virus wurden in den 90er Jahren des 20. Jahrhunderts erstmals als Ursachen für respiratorische und neurologische Erkrankungen identifiziert, die bei einer Reihe von Tierspezies auftraten. Das Hendra-Virus verursachte 1994 erstmals schwere Atemwegserkrankungen bei Pferden, in dessen Verlauf 14 Pferde und der Trainer dieser Pferde in Brisbaine, Australien, starben. Insgesamt sind bisher drei Menschen nach einer Infektion mit dem Hendra-Virus verstorben. Zwischen September 1998 und April 1999 verbreitete sich das Nipah-Virus unerkannt als Auslöser einer respiratorischen und zentralnervösen Infektion bei Schweinen in Malaysia und manifestierte sich dann als fatale Enzephalitis bei Menschen. Mehr als eine Million Schweine wurden im Rahmen der damaligen Bekämpfungsmaßnahmen gekeult. Nipah-Viren verursachten mehr als 400 humane Erkrankungsfälle in Malaysia, Singapur Bangladesch und Indien, von denen etwa 200 Menschen starben. Die beiden eng verwandten Erreger gehören zur Gattung Henipavirus aus der Familie der Paramyxoviridae. Da beide Erkrankungen in Europa bisher nicht nachgewiesen wurden und die Erreger der Risikostufe 4 zugeordnet wurden, bleibt die Bearbeitung von Verdachtsproben ausschließlich dem nationalen Referenzlabor vorbehalten. Hier wird zunächst ein Genomnachweis mittels quantitativer Real-Time RT-PCR angestrebt, weiterhin befinden sich immunologische Nachweisverfahren für Serumantikörper und Virusantigen in der Etablierungsphase. Voraussetzungen für die Feststellung eines Falles Fälle einer Nipah-/Hendra-Virus Infektion werden von der zuständigen Behörde auf der Basis des Untersuchungsbefundes des NRL festgestellt. Dieses führt die diagnostischen Untersuchungen in Übereinstimmung mit den vom OIE festgeschriebenen Kriterien durch. FLI 268
270 37. Paratuberkulose Charakterisierung der Infektion Erreger Die Paratuberkulose wird durch Mycobacterium avium subsp. paratuberculosis (MAP) hervorgerufen. Das Wirtsspektrum umfasst Haus- und Wildwiederkäuer sowie Kameliden. MAP sind kleine, pleomorphe, gerade oder gebogene, unbewegliche, säurefeste Stäbchen von 0,3 bis 2,0 µm Länge und 0,3 bis 0,5 µm Dicke Klinische Symptomatik Klinische Symptome treten nach einer z. T. mehrjährigen Inkubationszeit erst im Finalstadium der Erkrankung auf und äußern sich in anhaltenden therapieresistenten Durchfällen, Unterhautödemen sowie fortschreitender Abmagerung bis zur Kachexie. Bei kleinen Wiederkäuern wird Durchfall nur selten beobachtet. Die Paratuberkulose ist nicht heilbar und endet infolge von Malabsorption und Proteinmangel tödlich Differentialdiagnostik Durchfallerkrankungen infektiöser und metabolischer Genese, Intoxikationen Diagnostische Indikation Handelsuntersuchungen, klinischer Verdacht, Teilnahme an einem freiwilligen Sanierungsprogramm Zuständige Untersuchungseinrichtungen Veterinäruntersuchungsämter, Tiergesundheitsämter bzw. Staatliche Lebensmittel- und Veterinäruntersuchungsämter der Bundesländer oder die von den Ländern beauftragten staatlichen Einrichtungen Friedrich-Loeffler-Institut, NRL für Paratuberkulose im Institut für molekulare Pathogenese, Naumburger Straße 96a, Jena, Tel.: Rechtsgrundlagen Leitlinien für den Umgang mit der Paratuberkulose in Wiederkäuerbeständen (Paratuberkuloseleitlinien) vom 17. Januar 2005, BAnz. v , S Verordnung über meldepflichtige Tierkrankheiten vom OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2009, Chapter Paratuberculosis (Johne s disease) FLI 269
271 37.2. Untersuchungsmaterial Erregernachweis von lebenden Tieren Kotproben von Schlachttieren, getöteten oder verendeten Tieren Darminhalt, veränderte Darmschleimhaut (vorwiegend Jejunum oder Ileum), Ileozäkalklappe und die zugehörigen Mesenterial-Lymphknoten Antikörpernachweis Blutserum, Plasma, Milch, Milchserum Untersuchungsgang Erregernachweis Mikroskopischer Nachweis Die mikroskopische Untersuchung von Kotproben empfiehlt sich nur bei klinisch kranken Tieren. Bei veränderten Darmabschnitten und den zugehörigen Lymphknoten ist die Nachweisrate relativ hoch. Vorbehandlung a) AVID-Methode alt 1 TL Untersuchungsmaterial mit 3 TL 15%iger Sputofluol-Lösung (siehe Anhang) homogenisieren Einwirkzeit ca. 10 min Zentrifugation (20 min bei 3000 U/min) Sediment auf Objektträger dünn ausstreichen b) Methode LAVES Oldenburg 5g Kot mit Seesand mörsern bis zur Gießbarkeit mit 15%igem Sputofluol verdünnen in 100 ml Glasgefäß umgießen und mit 15%igem Sputofluol auf 50 ml auffüllen, 10 min Einwirkzeit, 15 min zentrifugieren bei 3000 x g, Sediment auf Objektträger dünn ausstreichen Färbung Herstellung von Objektträger-Ausstrichpräparaten von vorbehandelten bzw. nicht vorbehandelten Untersuchungsmaterialien (dünn auftragen). Färbung nach Ziehl-Neelsen (Warm- oder Kaltfärbung möglich, siehe Anhang), bei Organproben ist auch die Akridin-Orange-Färbung sinnvoll (höhere Sensitivität, siehe Anhang) Kultureller Nachweis Nach positiver Kultur ist eine Bestätigungsuntersuchung zur Identifizierung von MAP zwingend erforderlich, sie kann durch kulturellen Nachweis der Mycobactin- FLI 270
272 Abhängigkeit und/oder durch spezifische PCR (s. u.) erfolgen. Der Nachweis der Mycobactin-Abhängigkeit ist bereits bei der Primärkultur möglich, dies erfordert die kulturelle Anzüchtung des Probenmaterials auf der gleichen Anzahl Mycobactinhaltiger und Mycobactin-freier Nährmedien. Dekontamination von Kotproben 30 ml HPC (0,75 %) in 50 ml-gefäße vorlegen Kotprobe gut durchrühren, ca. 3 g Kot in das 50 ml-gefäß mit HPC (0,75 %) geben. Gefäß fest verschließen, manuell gut schütteln, ca. 2 bis 5 min bei RT stehen lassen, damit die groben Bestandteile sedimentieren können. Ca. 15 bis 20 ml des Überstandes in ein 50 ml Zentrifugenröhrchen gießen, Röhrchen gut verschließen. Zentrifugenröhrchen auf dem Laborschüttler bei ca. 200 U/min und RT für 30 min schütteln. Röhrchen anschließend aufrecht bei RT inkubieren. Nach der Einwirkzeit (s. u.) den Überstand bis auf 1 bis 2 ml Sediment dekantieren. Um den Aufwand zu vermindern, kann auch folgendermaßen verfahren werden: 3g Kot in die Gefäße mit 30 ml 0,75 % HPC einwiegen das Gefäß verschließen und 30 min schütteln. anschließend Proben bei RT im Labor inkubieren, Überstand wie oben dekantieren. Verbliebene Grobpartikel im Sediment können sich bei der Kultivierung störend auswirken. Die Einwirkzeit des HPC (0,75) richtet sich nach dem Ausmaß der Kontamination und kann zwischen 24 und 96 h betragen. Durch die Dauer der Dekontamination wird die Nachweisrate nach einer Kulturzeit von 12 Wochen nicht wesentlich beeinflusst, die Nachweisrate nach 6 Wochen Kulturzeit ist bei einer Dekontaminationsdauer von 48 h am höchsten. Dekontamination von Organproben Das Organmaterial vom Fettgewebe befreien. Darmstücken aufschneiden, evtl. Kotrückstände mit sterilem PBS-Puffer, ph 7,2, abspülen. Lymphknoten in vergällten Alkohol tauchen, kurz abflammen, aufschneiden. Ca. 1 g Gewebe von verschiedenen Stellen entnehmen Gewebe mittels Schere zerkleinern A) Homogenisieren des Gewebes mit dem Stomacher (Methode FLI) Zerkleinertes Gewebe in sterilem Stomacherbeutel sammeln. 7 ml HPC, 0,9 %, zugeben. 6 min im Stomacher homogenisieren. Homogenisiertes Gewebe in ein steriles 50-ml-Zentrifugenröhrchen umfüllen. Röhrchen 5-10 min bei 200 U/min, RT auf dem Laborschüttler schütteln. FLI 271
273 B) Homogenisieren des Gewebes mit dem Ultraturrax (Methode CVUA-RRW Krefeld) Zugabe von ca. 7 ml HPC, 0,75 % mit Ultraturrax (niedrigste Umdrehungszahl) ca. 1-2 min zerkleinern dann mit HPC auffüllen (ca. 30 ml) Proben intensiv mit der Hand schütteln Probendekontamination (A und B) Röhrchen 24 h bei RT inkubieren. Bei hohem Grad an Autolyse bzw. Kontamination kann die Dauer der Dekontamination verlängert werden. Nach der Dekontamination 50-ml-Zentrifugenröhrchen bei 1880 x g und 20 C für 20 min zentrifugieren. Überstand verwerfen. Sediment in 1 ml PBS-Puffer ph 7,2 resuspendieren, vortexen. C) Homogenisieren des Gewebes im Mörser (Methode LAVES Oldenburg) 3g Organmaterial (Darm, Lymphknoten) in steriler Porzellanmörserschale einwiegen und mit Seesand gut mörsern Probendekontamination (C) 30 ml HPC (0,75 %) zugeben, kurz umrühren und Seesand 5 min sedimentieren lassen umfüllen in Schraubverschluss-Gefäße, 30 min auf dem Laborschüttler schütteln Proben bei RT mindestens 24 h stehen lassen Überstand in Zentrifugenröhrchen umfüllen, 30 min bei 3000 x g zentrifugieren Überstand verwerfen und Sediment verimpfen. Inokulation und Bebrütung Vor der Inokulation werden die Nährmedien auf RT temperiert. Beimpft werden mit dem dekontaminierten Untersuchungsmaterial mindestens 3 Röhrchen Herrold s Egg Yolk Medium mit Mycobactin und ANV (Rezeptur siehe Anhang, eigene Herstellung oder z. B. BD) und ggf. die gleiche Anzahl Röhrchen Herrold s Egg Yolk Medium ohne Mycobactin, mit ANV (Rezeptur siehe Anhang, eigene Herstellung oder z. B. BD). Bei kleinen Wiederkäuern und Wildwiederkäuern empfiehlt sich zusätzlich ein Röhrchen eines Vollei-Nährmediums mit Mycobactin (z B. modifizierter Mycobacterien 7H11 Agar oder Löwenstein-Jensen-Medium mit Mycobactin, siehe Anhang) Inokulation Die Nährmedien werden mit jeweils 200 µl des Sedimentes beimpft (Filterspitzen benutzen). Röhrchen anschließend für 6-7 Tage in leichter Schräglage bei 37 1 C unter aeroben Bedingungen inkubieren (Nährbodenoberfläche sollte waagerecht sein). Bei Röhrchen mit Schraubdeckel sollte der Deckel eine Viertel Drehung geöffnet sein, bei anderen Röhrchen Zellstoffstopfen oder von vornherein Bartmannstopfen (geringere Verdunstung) verwenden. Nach 6-7 d die Röhrchen aufrecht stellen, Schraubdeckel ganz zudrehen, Zellstoffstopfen durch Bartmann-Stopfen ersetzen. Weitere Bebrütung der Kulturröhrchen in senkrechter Stellung bei Proben von Rindern bis zu 12 Wochen, bei Proben von Schaf, Ziege und Wildwiederkäuern bis zu 9 Monaten. FLI 272
274 Regelmäßige Überprüfung der Kulturröhrchen auf Koloniewachstum, ggf. 3. und 4. Woche unter einem Stereomikroskop (10- bis 20-fache Vergrößerung, alternativ: Lupe), danach makroskopisch (ohne Lupe). Ggf. ab der 4. Woche Spülen der Kulturröhrchen mit 250 µl PBS-Puffer, Poolen der Spülflüssigkeit von allen Röhrchen, die zu einer Probe gehören. Untersuchung der Spülproben mit PCR (siehe dort). Kulturergebnis Nach 3 4 Wochen Bebrütung können unter dem Stereomikroskop (Lupe) auf den Mycobactin-haltigen Nährböden zarte, grau-weiße Kolonien erkennbar sein. Nach 5 6 Wochen sind die Kolonien auch makroskopisch erkennbar. Sie zeigen ein weißlich-graues, glattes, glänzendes Aussehen. Die halbkugeligen Kolonien werden mit längerer Bebrütungsdauer flacher und erreichen einen Durchmesser bis zu 5 mm. Bei kleinen Wiederkäuern und Wildtieren können extrem langsam wachsende, gelb-orange pigmentierte Kolonien von MAP auftreten. IDENTIFIZIERUNG 1. Identifizierung über Subkultur Langsamwachsende Kolonien, die auch in Subkultur nur auf Mycobactin-haltigen, nicht dagegen auf Nährböden ohne Mycobactin-Zusatz wachsen und sich in der Ziehl-Neelsen-Färbung als säurefeste Stäbchen (oft verklumpt) erweisen, können als M. avium subsp. paratuberculosis identifiziert werden. Im Interesse der Zeitersparnis wird empfohlen, die Identifizierung über Subkultur durch die Identifizierung mittels PCR zu ersetzen. Die Sicherheit des MAP-Nachweises wird durch Ergänzung mit molekularbiologischen Nachweismethoden (PCR) erhöht. 2. PCR zur Identifizierung von MAP in Kulturmaterial Diese Methode dient der Identifizierung von MAP in Spülproben von Kulturen bzw. von Koloniematerial. DNA-Isolierung A von Koloniematerial Koloniematerial einzeln von festen Nährmedien abnehmen und mittels Impföse in 100 µl Aqua dest. einreiben, Tube verschließen, vortexen. 15 min unter leichtem Schütteln bei C kochen (Wasserbad, Thermomixer). Tube abkühlen lassen. 5 min bei rpm zentrifugieren, Überstand möglichst quantitativ in ein neues Tube überführen. Erneut für 5 min bei rpm zentrifugieren, Überstand möglichst quantitativ in ein neues Tube überführen. Probe bis zur weiteren Bearbeitung bei -20 C ± 3 C aufbewahren. B durch Spülen der Kulturen mit verdächtigen Kolonien bzw. noch vor dem sichtbaren Wachstum Kräftiges Abspülen der gesamten Kulturoberfläche durch mehrfaches Hochund Runter-Pipettieren mit 250 µl PBS FLI 273
275 Mischen aller Spülflüssigkeiten einer Probe (mehrere Kulturen je Probe!) in einem Reaktionsgefäß. Spülflüssigkeiten 15 Minuten unter leichtem Schütteln bei 99 C kochen. Ansätze 5 Minuten mit ca g zentrifugieren, Überstand abnehmen. Erneute Zentrifugation für 5 Minuten mit ca g Überstand direkt in der PCR einsetzen. PCR Die PCR dient der Absicherung positiver Kulturen. Es können verschiedene Targetsequenzen verwendet werden: IS900, Primer s204 - s749 nach Englund et al., 1999 F57, Primer F57, R57 und F57Rn nach Vansnick et al., 2004 ERGEBNISMITTEILUNG UND WERTUNG Ein starker Keimgehalt ist in der Regel schon nach 4-6 Wochen Kulturdauer deutlich zu erkennen und mit Nachweis von mehr als 30 gewachsenen Kolonien auf dem Nährboden verbunden. Ein geringer Keimgehalt wird teilweise erst nach 12 Wochen Kulturdauer sichtbar in Form weniger Kolonien (ca Kolonien). Mittlere Keimgehalte werden in der Regel schon nach 6 Wochen Kulturdauer sichtbar Nachweis von Antikörpern gegen MAP Zum Nachweis von Antikörpern gegen MAP stehen mehrere zugelassene ELISA zur Verfügung (siehe Der Antikörpernachweis ist für die Einzeltierdiagnostik der Paratuberkulose nur eingeschränkt geeignet. Im Gegensatz hierzu ist die serologische Bestandsuntersuchung für eine orientierende Einstufung von Beständen durchaus geeignet, vorausgesetzt es werden alle Tiere über 24 Monate in die Untersuchung einbezogen. Aus einer einmaligen serologischen Bestandsuntersuchung kann im negativen Falle kein Bestandsstatus abgeleitet werden. Erst wiederholte serologische Untersuchungen ggf. in Verbindung mit direkten Erregernachweisen sind hinsichtlich des Bestandsstatus aussagekräftig. Der verwendete serologische Test oder die Kombination mehrerer Tests sollte eine Spezifität von mindestens 98,5 % gewährleisten. Kommerzielle Tests müssen nach Prüfung mit definierten Proben im NRL für Paratuberkulose Mindestwerte für die Sensitivität und Spezifität erreichen (derzeitiger Stand: 53,6 % Sensitivität, 98,5 % Spezifität). Die Mitteilung der Untersuchungsergebnisse sollte die Angabe der Methode bzw. der Testbezeichnung beinhalten. Literatur Englund S, Ballagi-Pordány A, Bölske G, Johansson KE. Single PCR and nested PCR with a mimic molecule for detection of Mycobacterium avium subsp. paratuberculosis. Diagn Microbiol Infect Dis Mar; 33(3): Vansnick, E., De Rijk, P., Vercammen, F., Geysen, D., Rigouts, L., Portaels, F., Newly developed primers for the detection of Mycobacterium avium subspecies paratuberculosis. Vet. Microbiol. 100, FLI 274
276 Anhang PROTOKOLLE 1. Ziehl-Neelsen-Färbung (Warmfärbung von Mykobakterien) Material Ausstrichpräparate Verzeichnis der Reagenzien Carbol Fuchsin Lösung Firma: Dr. K. Hollborn & Sohn Methylenblau Lösung nach Ziehl-Neelsen Firma: Dr. K. Hollborn & Sohn Salzsäure Alkohol: Salzsäure rauchend, Massenanteil (34 +/- 2) % 3 ml Ethanol, Volumenkonzentration (96 +/- 1) % 97 ml Immersionsöl Verzeichnis der Geräte Färbebank Bunsenbrenner Lichtmikroskop zur Hellfeld Untersuchung (90- bis 100-fache Objektivvergrößerung) Färbeküvetten Verzeichnis der Gebrauchsmaterialien Pinzetten Einmalhandschuhe Spritzflaschen Schutzbrille Durchführungsschritte fixierte Präparate werden mit Carbol-Fuchsin-Lösung übergossen diese werden dreimal bis zur Dampfbildung (etwa 80 C) mittels eines Bunsenbrenners erwärmt nach 5 min wird die Farblösung mit Wasser abgespült Präparate werden mit Salzsäure Alkohol in Färbeküvetten entfärbt, bis keine Farbschlieren mehr sichtbar sind nach Spülung mit Wasser werden die Präparate mit Methylenblau Lösung (in Färbeküvetten) etwa 2 min gegengefärbt nach erneuter Spülung mit Wasser werden die Präparate an der Luft getrocknet Hinweis: Anstelle von Fuchsin und Methylenblau können auch andere kontrastierende basische Farbstoffe verwendet werden z. B. Nachtblau- Bismarckbraun-Kombination bei Personal mit Rot-Grün-Schwäche. Bei der technischen Durchführung der Färbung muss darauf geachtet werden, dass die Übertragung säurefester Stäbchen von einem Objektträger auf einen anderen vermieden wird. FLI 275
277 die Färbungen werden im Anschluss mikroskopisch im Hellfeld untersucht Untersuchung wird bei 90- bis 100-facher Objektivvergrößerung mit Immersionsöl durchgeführt Präparat ist so lange zu durchmustern, bis eine Beurteilung entsprechend dem Bewertungsmaßstab nach Tabelle 1 möglich ist. Ergebnis Mykobakterien heben sich bei guter Färbung deutlich von dem mehr oder weniger amorphen Hintergrund ab. hier: leuchtend rot auf blauem Grund Bewertungsmaßstab Anzahl der säurefesten Stäbchen Negativ keine je Ausstrich (mindestens 100 Blickfelder) kontrollbedürftig 1) 1 3 je Ausstrich (mindestens 100 Blickfelder) je 100 Blickfelder je 10 Blickfelder je Blickfeld ++++ > 10 je Blickfeld 1) Befunde, bei denen nur einzelne säurefeste Stäbchen im ganzen Ausstrich gefunden werden, sind nicht sicher zu beurteilen. Handelt es sich dabei um einen diagnostisch noch unklaren Fall, so ist eine Kontrolle durch Wiederholungsuntersuchung sowie durch die kulturelle Methode angezeigt. 2. Acridinorange-Färbung (Fluoreszenz-Methode zum Nachweis von Mykobakterien) Material Ausstrichpräparate Bei der Herstellung der Präparate für diese Untersuchung sollte möglichst frisches, nur wenige Stunden altes Untersuchungsgut verwendet werden. Durch längere Aufbewahrung des Untersuchungsgutes bei Raumtemperatur (18 C bis 28 C) kommt es zur Vermehrung von Kontaminationskeimen. Vor allem Sporenbildner können nach Salzsäure Alkohol Behandlung eine Fluoreszenz aufweisen, welche die Beurteilung erheblich erschwert. Verzeichnis der Reagenzien Acridinorange-Lösung: farbloses Phenol (Kristalle) 5 ml Glycerin 25 ml 95 % Alkohol 25 ml Acridinorange 0,1 g Aqua dest. 50 ml - 24 h in brauner Flasche lösen FLI 276
278 Salzsäure Alkohol konz. Salzsäure 0,5 ml Alkohol, 95%ig 74,0 ml Aqua dest. 25,5 ml Methylenblau 0,2g Immersionsöl Verzeichnis der Geräte Färbebank - Mikroskop mit Filterkombinationen Verzeichnis der Gebrauchsmaterialien Pinzetten Einmalhandschuhe Spritzflaschen Schutzbrille Durchführungsschritte Acridinorangelösung auf die fixierten Präparate geben und 15 min einwirken lassen Abspülen mit Aqua dest. 2 min mit Salzsäure Alkohol entfärben Abspülen mit Aqua dest. Präparat lufttrocknen lassen Bei der technischen Durchführung der Färbung muss darauf geachtet werden, dass die Übertragung säurefester Stäbchen von einem Objektträger auf einen anderen vermieden wird. Gefärbte Ausstriche dürfen unter keinen Umständen mit Filterpapier getrocknet werden, da mikroskopisch kleine Papierfasern durch ihre Fluoreszenz Mykobakterien ähneln können. Sie müssen vor Licht geschützt werden, da unter Lichteinwirkung die Fluoreszenz der Mykobakterien nachlässt. Die Proben werden mittels Fluoreszenzmikroskopie durchmustert. Es kann mit geringer Objektivvergrößerung und Trockenobjektiven gearbeitet werden. Ergebnis und Kontrolle Präparate sind so lange zu durchmustern, bis eine Beurteilung entsprechend dem Bewertungsmaßstab nach Tabelle möglich ist. FLI 277
279 Bewertungsmaßstab Anzahl der fluoreszierenden Stäbchen Negativ keine je Ausstrich (mindestens 100 Blickfelder) kontrollbedürftig 1) 1 10 je Ausstrich (mindestens 100 Blickfelder) je 100 Blickfelder je 10 Blickfelder je Blickfeld ++++ > 50 je Blickfeld 1) Befunde, bei denen nur einzelne fluoreszierende Stäbchen im ganzen Ausstrich gefunden werden, sind nicht sicher zu beurteilen. Handelt es sich dabei um einen diagnostisch noch unklaren Fall, so ist eine Kontrolle durch Wiederholungsuntersuchung sowie durch die kulturelle Methode angezeigt. REZEPTUREN 1. Sputofluol (Merck, Darmstadt) Herstellung der 15%igen Lösung mit sterilem Aqua dest. 2. HPC Hexadecylpyridiniumchlorid Monohydrat syn. N-Cetylpyridiniumchlorid Monohydrat (Merck, SIGMA) Herstellung der 0,75%igen bzw. 0,9%igen HPC-Lösung mit sterilem Aqua dest. 3. Herrold s Egg Yolk Medium mit Mycobactin und ANV Chemikalien, Reagenzien: Herrold s Egg Yolk Agar-Basis NaCl Caseinpepton Fleischextrakt Lab-Lemco Agar Glycerin Aqua dest. Supplemente 2%ige Malachitgrün-Lösung Eigelb Natriumpyruvat Mycobactin J (Allied Monitor), die Substanz ist in Ampullen zu je 2 mg abgepackt. Amphotericin B Nalidixinsäure Vancomycin FLI 278
280 Herstellungsvorschrift: a) In einen 1-Liter-Kolben werden folgende Substanzen eingewogen: NaCl 4,0 g Caseinpepton 9,0 g Fleischextrakt Lab-Lemco 2,7 g Agar 15,0 g Glycerin 27,0 ml Die Substanzen werden in 870 ml Aqua dest. suspendiert und gelöst. ph-wert auf 7,3 ± 0,2 einstellen (NaOH). Fraktioniert im Dampftopf sterilisieren bzw. 15 min bei 121 C autoklavieren, abkühlen auf 50 C. b) Sukzessive Zugabe der folgenden Substanzen: 2%ige Malachitgrün-Lösung (steril) 5,0 ml Eigelbsuspension 100,0 ml Amphotericin B (in sterilem Wasser gelöst) 50,0 mg Nalidixinsäure (in sterilem Wasser gelöst) 50,0 mg Vanco mycin (in sterilem Wasser gelöst) 50,0 mg Natriumpyruvat (steril, gelöst) 4,1 g Mycobactin J gelöst in Ethanol 2,0 mg (durch Spritzenvorsatzfilter filtrieren) Gründlich mischen ph-wert prüfen: 7,0 ± 0,2 Abfüllen zu je 6 ml in Kulturröhrchen. Verschließen der Röhrchen. Röhrchen in Schräglage bei Raumtemperatur erstarren lassen. Weitere Aufbewahrung der Nährböden im Kühlschrank (8-10 C) bis zu maximal 8 Wochen (dazu in PE-Beutel einschweißen). c) Kontrolle: Nährmedium sollte eine grünlich-trübe Färbung aufweisen Sterilkontrolle: 7d bei 37 ± 2 C bebrüten 4. Herrold s Egg Yolk Medium ohne Mycobactin, mit ANV Herstellung des Nährmediums in o. a. Weise ohne Zusatz von Mycobactin 5. Modifizierter Mycobacterien 7H11 Agar mit Vollei und Amphotericin B Chemikalien, Reagenzien Mycobacterien 7H11 Agar-Basis Glycerin L-Asparagin-Monohydrat Aqua dest. (BD) FLI 279
281 Supplemente Vollei Middlebrook OADC Selectatabs Amphotericin B Mycobactin J Herstellungsvorschrift a) In einen 1-Liter Kolben werden folgende Substanzen eingewogen: Mycobacterien 7H11 Agar-Basis 21,0 g Glycerin 25,0 ml L-Asparagin-Monohydrat 0,3 g Die Substanzen werden in 900 ml Aqua dest. suspendiert und gelöst. ph-wert auf 6,6 ± 0,2 überprüfen und ggf. einstellen Fraktioniert im Dampftopf sterilisieren bzw. 15 min bei 121 C autoklavieren, abkühlen auf 50 C. b) Sukzessive Zugabe der folgenden Substanzen: Vollei 200,0 ml Middlebrook OADC 100,0 ml Selectatabs 2 Stk Amphotericin B 40,0 mg Mycobactin J 2,0 mg Gründlich mischen End-pH-Wert prüfen: 7,0 ± 0,2 Abfüllen zu je 6 ml in Kulturröhrchen. Verschließen der Röhrchen. Röhrchen in Schräglage bei Raumtemperatur erstarren lassen. Weitere Aufbewahrung der Nährböden im Kühlschrank (8-10 C) bis zu maximal 8 Wochen (dazu in PE-Beutel einschweißen). c) Kontrolle: Nährmedium sollte eine gelblich-trübe Färbung aufweisen Sterilkontrolle: 7d bei 37 ± 2 C bebrüten FLI 280
282 6. Modifiziertes Löwenstein-Jensen-Medium (mit Mycobactin) Chemikalien, Reagenzien Löwenstein-Jensen-Basis Kaliumdihydrogenphosphat (KH 2 PO 4 ) Magnesiumsulfat Heptahydrat (MgSO 4 x 7 H 2 O) Magnesiumcitrat L-Asparagin-Monohydrat Kartoffelmehl Malachitgrün Glycerin 87 % Aqua demin. Supplemente Polymyxin B Amphotericin B Nalidixinsäure Trimethoprim Azlocillin Mycobactin J Vollei Herstellungsvorschrift a) In einen 1-Liter Kolben werden folgende Substanzen eingewogen: Kaliumdihydrogenphosphat (KH 2 PO 4 ) 1,56 g Magnesiumsulfat Heptahydrat (MgSO 4 x 7 H 2 O) 0,15 g Magnesiumcitrat 0,37 g L-Asparagin-Monohydrat 2,25 g Kartoffelmehl 18,75 g Malachitgrün 0,25 g Glycerin 87 % 7,5 ml Die Substanzen werden in 375 ml Aqua dest. suspendiert und gelöst. ph-wert auf 4,8 ± 0,2 überprüfen und ggf. einstellen 15 min bei 121 C autoklavieren, abkühlen auf 50 C. b) Zugabe von: Vollei c) Supplemente vorsichtig einmischen: Polymyxin B Nalidixinsäure Trimethoprim Azlocillin Amphotericin B Mycobactin J 625,0 ml 6,6 mg 20,0 mg 5,0 mg 10,0 mg 50,0 mg 2,5 mg FLI 281
283 Abfüllen zu je 6 ml in Kulturröhrchen. Verschließen der Röhrchen. Röhrchen in Schräglage in strömendem Dampf etwa 10 min koagulieren lassen. Weitere Aufbewahrung der Nährböden im Kühlschrank (8 bis 10 C) bis zu maximal 8 Wochen (dazu in PE-Beutel einschweißen). d) Kontrolle Nährmedium sollte eine grünlich-trübe Färbung aufweisen Sterilkontrolle: 7 d bei 37 ± 2 C bebrüten FLI 282
284 38. Pferdeenzephalomyelitis (alle Formen) Charakterisierung der Infektion Erreger Die Erreger der Pferdeenzephalitiden sind Viren des Genus Alphavirus der Familie Togaviridae. Es handelt sich dabei um die Viren der Eastern equinen Enzephalomyelitis, der Western equinen Enzephalomyelitis und der Venezuelan equinen Enzephalomyelitis. Diese Erreger gehören zu der Gruppe der Arboviren, die bei einer Infektion mittels hämatophager Insekten aus dem ökologischen Reservoir (Vögel für Eastern und Western; kleine Nager für Venezuelan) auf neue Wirte übertragen. Pferde und Menschen stellen bei diesen Infektionen Fehlwirte dar, von denen im Fall von Eastern und Western keine direkte Übertragung auf andere Individuen der gleichen Spezies möglich ist. Bei der Venezuelan equinen Enzephalomyelitis ist eine solche Intraspeziesübertragung jedoch beschrieben Klinische Symptomatik Western und Eastern equine Enzephalomyelitis Bei Pferden sind die Enzephalomyelitiden durch Fieber, Anorexie und starke Depression charakterisiert. Infektionen von Pferden mit dem Eastern-Enzephalomyelitisvirus verlaufen meist tödlich, wohingegen Infektionen mit dem Western- Enzephalomyelitisvirus häufig einen subklinischen oder milden Verlauf zeigen. Im letzteren Fall liegt die Mortalität bei unter 30 %. Auch beim Menschen können diese Viren schwere bis tödlich verlaufende Krankheiten mit ähnlicher Symptomatik hervorrufen. Venezuelan equine Enzephalomyelitis Die Symptome einer Erkrankung mit dem Virus der Venezuelan equinen Enzephalomyelitis reichen bei Equiden und Menschen in Abhängigkeit von dem beteiligten Subtyp von milden fiebrigen Reaktionen auf die Infektion bis zu tödlich verlaufenden Enzephalomyelitiden Differentialdiagnostik Alle mit Fieber und neurologischen Symptomen einhergehenden Erkrankungen bei Pferden. Da solche Virus-Infektionen allerdings bisher noch nicht außerhalb des amerikanischen Kontinentes aufgetreten sind, sollten epidemiologische Zusammenhänge mitberücksichtigt werden Diagnostische Indikation Tierseuchendiagnostik gemäß Tierseuchengesetz FLI 283
285 Zuständige Untersuchungseinrichtungen NRL für Pferdeenzephalomyelitis (alle Formen) am FLI Rechtsgrundlagen Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Untersuchungsmaterial Vorsichtsmaßnahmen Da es sich bei den Viren der equinen Enzephalomyelitiden um Erreger handelt, die potentiell auch Menschen infizieren können, ist während der Probennahme und der Verarbeitung der Proben bei Verdacht auf equine Enzephalomyelitis für den Probennehmer ein Schutz vor einer viralen Infektion empfohlen, sofern geimpftes Personal nicht zur Verfügung steht Probenmaterial Für die serologische Untersuchung Nativblutprobe oder Serum Für die virologische Untersuchung Organmaterial (Gehirn, Rückenmark) Zeitpunkt der Probennahme Der günstigste Zeitpunkt für eine Probennahme bei Verdacht auf eine Infektion mit einem equinen Enzephalomyelitisvirus ist wenige Tage nach der Infektion, da sich zu diesem Zeitpunkt IgM-Antikörper serologisch nachweisen lassen und auch eine Virusanzucht am einfachsten gelingt. Eine Organentnahme für die Virusanzucht erfolgt post mortem Probenversand Der Versand von Probenmaterial muss in Sicherheitsbehältern für Erreger der Sicherheitsstufe L3 erfolgen. Blut- und Organproben sollten in gefrorenem Zustand versendet werden Untersuchung Antikörpernachweis Gemäß OIE-Methoden können Antikörper aus infizierten Seren mittels Plaque- Neutralisationstest, Haemagglutinations-Hemmungstest, der Complementfixierung oder einem IgM-Capture-ELISA nachgewiesen werden. Um eine sichere Diagnose abgeben zu können, ist für alle Testsysteme ein vierfacher Anstieg des Antikörpertiters Voraussetzung. FLI 284
286 Virusnachweis Der Nachweis von Viren kann direkt aus dem eingesendeten Organ-Material gemäß den Methoden der OIE erfolgen. Dabei kann das Virus aus dem Feldmaterial durch Inokulation von neugeborenen Mäusen, embryonierten Hühnereiern, Zellkulturen oder frisch geschlüpften Küken angezüchtet werden. Anschließend wird das Virus mittels Complementfixierung, Immunfluoreszenz oder den Plaque-Neutralisationstest identifiziert. Des Weiteren erfolgt der Nachweis von viraler RNA mittels einer nested-reversen Transkriptase Polymerasekettenreaktion (nrt-pcr). Hierbei wird für die Erreger der Eastern und der Western equinen Enzephalomyelitis eine kombinierte nested PCR durchgeführt. Die Identifikation erfolgt dann über die Auswertung der PCR-Produkte, die sich durch den Einsatz von spezifischen Primern leicht anhand ihrer Größe unterscheiden lassen. Virale RNA des Venezuelan equinen Enzephalomyeltis-Virus wird in einer von der OIE empfohlenen semi-nested PCR nachgewiesen. Diese Methoden des Nachweises der viralen RNA durch nrt-pcr sind Bestandteil der Diagnostik des nationalen Referenzlabors für equine Enzephalomyelitiden. FLI 285
287 39. Pockenseuche der Schafe und Ziegen Charakterisierung der Infektion Erreger Schaf- und Ziegenpockenvirus gehören zum Genus Capripoxvirus (CPV) der Familie Poxviridae Klinische Symptomatik Schaf- und Ziegenpocken kommen in Zentral- und Nordafrika, im Nahen und Mittleren Osten sowie in Indien endemisch vor. Bei hoch empfänglichen Schaf- und Ziegenrassen ist die Krankheit geprägt von einem generalisierten Verlauf mit Hautläsionen. Jedoch sind, abhängig vom Virusisolat und der infizierten Tierrasse, milde bis subklinische Verlaufsformen möglich. Bei europäischen Schaf- (z. B. Soay) und Ziegenrassen können subakute Verlaufsformen auftreten, die schon vor der Entwicklung typischer Hautveränderungen (Papeln, verhärtete, knotenförmige Hautschwellungen von 0,5 bis 1 cm Durchmesser) zum Tod führen. Schwere Verlaufsformen sind gekennzeichnet durch hämorrhagische Vesikel, generalisierte Papelbildung, Lymphangitis und Lungenaffektion. Die Ziegenpocken-Stämme infizieren Ziegen und Schafe, obwohl die gravierenderen klinischen Erscheinungen immer beim homologen Wirt auftreten. Rekombinationen zwischen Schaf- und Ziegenpocken kommen vor und können zu einem ausgeglichenen Wirtsspektrum mit gleichem Krankheitsverlauf bei Schaf und Ziege führen. CPV hat das Potential sich auszubreiten und sich in Ländern außerhalb der Hauptverbreitungsgebiete zu etablieren. Europa gilt als frei von CPV, allerdings gab es auch in jüngster Zeit immer wieder Ausbrüche, hauptsächlich in Südosteuropa (Griechenland, Bulgarien) Differentialdiagnostik Alle Hautaffektionen bei Schaf und Ziege, insbesondere das Ecthyma contagiosum (Orf, Lippengrind) Diagnostische Indikation Seuchenverdacht Zuständige Untersuchungseinrichtung FLI, Insel Riems, Südufer 10, Greifswald, Tel Rechtsgrundlagen Richtlinie 92/119/EWG sowie Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung FLI 286
288 39.2. Untersuchungsmaterial Untersuchungsmaterial Erregernachweis Am besten geeignet für die Virusisolierung sind Biopsiematerial aus frischen Hautläsionen und post mortem ebenfalls Hautveränderungen sowie befallene Lymphknoten und Lungengewebe Untersuchungsmaterial Antikörpernachweis Nativblutproben, Serum mind. 500 µl Untersuchungsgang Erregernachweis (NUR DURCH DAS FLI DURCHZUFÜHREN) Virusisolierung Am empfänglichsten für die Virusvermehrung sind primäre (bis max. 8 Passagen) Schaf- oder Ziegenzellen aus Hoden, Lunge und Niere. Die Gewebeverreibungen müssen mit Antibiotika versetzt werden, bei massiver Kontamination kann bei hohem Virusgehalt eine Filtration mit 0,45 µ Filtern empfohlen werden Elektronenmikroskopie Material aus der originalen Gewebesuspension wird kurz zentrifugiert (Beseitigung der groben Gewebetrümmer) und der Überstand wird mit dem negative Stainingverfahren untersucht. Die großen Viruspartikel (290 x 270 nm) sind backsteinförmig mit kurzen, unregelmäßig angeordneten, tubulären Hüllproteinen. Zur Differentialdiagnose wichtig ist das Aussehen der ovoiden, kleineren Parapockenpartikel (250 x 160 nm) mit regelmäßig angeordneten Hüllproteinfilamenten (Wollknäuelähnlich) Histologie Histologische Untersuchungen an Formalin-fixiertem Biopsiematerial zeigen an HE gefärbten Präparaten eosinophile Einschlusskörperchen und vakuolierte Zellkerne Immunfluoreszenz An fixierten Gewebeschnitten oder infizierten Zellen ist ein CPV-Nachweis mit Hilfe von Hyperimmunseren leicht möglich. FLI 287
289 Polymerase Kettenreaktion (PCR) Zum Nachweis geringerer Virusmengen in Biopsiematerial wurde eine PCR basierend auf publizierten CPV-Sequenzen (TK-Gen) entwickelt (J. Gen. Virol. 70, (1989), Virology 209, (1995)). Die PCR konnte bislang nur mit Impfstoff- Zellkulturvirus geprüft und optimiert werden. Eine Parapoxvirus (PPV)-DNA differenzierende PCR ist ebenfalls etabliert Antikörpernachweis Zum Nachweis von Schafpocken-Antikörpern wurde am FLI ein SNT etabliert. FLI 288
290 40. Psittakose Charakterisierung der Infektion Erreger Der Erreger der Psittakose/Ornithose gehört zur Familie der Chlamydiaceae, zum Genus Chlamydophila und zur Spezies Chlamydophila (C.) psittaci. Bei den Aves wurden ursprünglich sechs verschiedene Serovare unterschieden (A und F = Psittaziden-Serovare I und II, B und E = Tauben-Serovare I und II, C = Enten- und D = Puten-Serovar; nach ANDERSEN, ). In einer Vergleichsstudie konnte gezeigt werden, dass den Serovaren äquivalente Genotypen zugeordnet werden können, die über die variablen Domänen II und IV des ompa-gens definiert sind (VANROMPAY, ). Mittlerweile wurden noch ein weiterer aviärer Genotyp (EB; Geens, ) und zwei nicht-aviäre Genotypen eingeführt. Tabelle 1 fasst die gegenwärtig akzeptierten Typen zusammen, wobei anzumerken ist, dass die Wirtsspezifität nicht hoch ist und mit steigenden Untersuchungszahlen das Spektrum der genannten Wirtstierarten noch erweitert werden wird. Tabelle 1: Einteilung der Serovare bzw. Genotypen von Chlamydophila psittaci Serovar / Genotyp Vorkommen Humanpathogenität / Anmerkungen A Psittaciformes, Taube, Kanarienvogel, Pute hoch (insbesondere bei virulenten Stämmen) B Taube, Kanarienvogel, Küken, Fasan, Pute mittel C Ente, Schwan, Gans hoch (insbesondere in Farmen, Schlachtund Federverarbeitungsbetrieben) D Pute hoch (insbesondere in Farmen, Schlachtund Federverarbeitungsbetrieben) E Taube, Ente Pute, Strauß, Nandu hoch (identisch mit humanem Isolat von 1934; Tauben sind Reservoir; 20 % der Taubenisolate gehören zum Serovar II; eng verwandt mit A und B) F Sittich (bisher ein Isolat) nicht bekannt (evtl. neuere Mutation; evtl. Vorkommen in noch wenig untersuchten Vogelpopulationen) EB Ente vorhanden (genaue Abschätzung noch nicht möglich) WC Rind nicht bekannt M 56 Nager (Bisamratte) nicht bekannt FLI 289
291 Schon jetzt ist bekannt, dass aviäre Serovare/Genotypen auch bei anderen Tierarten wie z. B. Schwein, Rind und Schaf vorkommen. Prinzipiell sind alle aviären C.- psittaci-serovare humanpathogen. Chlamydien gehören weltweit zu den am meisten verbreiteten pathogenen Mikroorganismen. Das Wirtsspektrum von C. psittaci umfasst Arthropoden, Mollusken, Vögel (bei ca. 140 Arten nachgewiesen), eine Vielzahl von Säugetieren und den Menschen. Psittakose wird als Infektionskrankheit bezeichnet, die bei Psittaciformes (Papageien und Sittichen) vorkommt. Sie ist anzeigepflichtig 4. Die Ornithose definiert der Gesetzgeber als eine Infektionskrankheit, die bei Nutzgeflügel sowie bei Wild- und Ziervögeln vorkommt. Sie ist meldepflichtig 5. Allerdings handelt es sich vom wissenschaftlichen Standpunkt bei den historisch entstandenen Begriffen Psittakose und Ornithose um ein und dieselbe Krankheit mit dem gleichen Erreger. Man verwendet daher in der neueren Fachliteratur den übergreifenden Terminus aviäre Chlamydiose. Morphologisch gesehen erscheinen Chlamydien als unbewegliche kokkoide Bakterien. Die Zellwand enthält nur Spuren von Muraminsäure und ähnelt der Zellwand gramnegativer Bakterien. Der zweiphasige Entwicklungszyklus kennzeichnet sie als obligat intrazelluläre Mikroorganismen. Man unterscheidet zwei unterschiedliche Chlamydienformen: die 0,2 bis 0,3 µm großen infektiösen Elementarkörperchen (EK), die extrazellulär überleben können. Sie enthalten das Genom und die Ribosomen. Für das Eindringen in die Wirtszelle sind spezifische Wirtszell- und Erregerrezeptoren verantwortlich. Unterschiede in Größe und Struktur der antigenwirksamen EK-Oberflächenproteine (Major Outer Membrane Protein - MOMP) sind verantwortlich für Wirtsspezifität, Organotropismus und Virulenzverhalten. Nach Adsorption der EK an die Zellmembran der Wirtszelle gelangen diese durch Endozytose in die Zelle. die 0,8 bis 1,5 µm großen Retikularkörperchen (RK) entstehen durch Reorganisation der EK und vermehren sich durch binäre Teilung in den endozytoplasmatischen Vakuolen (Einschlusskörperchen). Eine Interaktion mit extrazellulären Abwehrmechanismen ist dadurch erschwert. Die RK reifen über sog. "kondensierte Formen" zu den infektiösen EK. Diese können durch Lysis der Zelle (Krankheit) oder durch kontinuierliches Ausschleusen aus der Zelle (klinisch inapparente Form) freigesetzt bzw. in der Zelle zurückgehalten werden (latente Verlaufsform) Klinische Symptomatik Die Psittakose/Ornithose verläuft beim Vogel akut, subakut bis protrahiert oder chronisch in Abhängigkeit von Infektionsdosis, Virulenz der Chlamydienstämme, Empfänglichkeit und Immunstatus des Wirtes sowie von Umwelteinflüssen. Die häufigste Form ist die subklinisch-persistierende Verlaufsform bei adulten Vögeln. Sie verläuft ohne klinische Symptome (siehe Tabelle 2). Nach einer Chlamydieninfektion kann zwischen perakutem Verlauf und völliger Unauffälligkeit klinisch gesunder Tiere eine breite Palette an mehr oder weniger unspezifischen Symptomen beobachtet werden. Das artspezifische Verhalten kann sich bei FLI 290
292 chlamydieninfizierten Vögeln verändern. Apathie, Schwäche, Schläfrigkeit, Hängenlassen der Flügel, Appetitlosigkeit, anfallartiges Zittern, tonisch-klonische Krämpfe und Lähmungserscheinungen können beobachtet werden. Die ältere Bezeichnung "Pneumo-Enteritis" für Psittakose/Ornithose weist darauf hin, dass Respirations- und Verdauungstrakt gleichzeitig betroffen sind. Es wird hellgrünoder grau-wässriger Kot abgesetzt. In Verbindung mit Nasenausfluss wird angestrengte Atmung beobachtet. Konjunktivitis und Keratokonjunktivitis treten bei manchen Vogelarten nicht auf, bei anderen (Tauben, Neophemaarten, Enten) sind es oft die einzigen auf Psittakose deutenden Befunde. Das unspezifische klinische Bild wird häufig durch die Symptome struppiges Gefieder und Abmagerung ergänzt. Tabelle 2: Verlaufsformen der aviären Chlamydiosen (zit. nach KALETA, ) Verlaufsform Inkubationszeit in Tagen Krankheitsdauer Symptome, Bemerkungen Akute, letale systemische Form Subakute bis protrahierte Form Tage Anorexie, Apathie, Diarrhoe; junge Vögel 7-14 > 3 Wochen Anorexie, Apathie, Diarrhoe; adulte Vögel Chronische Form > 2 Monate Apathie, Kachexie, Diarrhoe, Atemnot; adulte Vögel Subklinische persistierende Form Aktivierte persistierende Form keine ohne Häufigste Form, ohne Symptome; adulte Vögel > 3 Monate bis Jahre > 2 Monate Aktivierung durch endogene u. exogene Faktoren, dann Apathie, Anorexie, Diarrhoe, Kachexie, respiratorische Symptome Vögel mit chronischer Psittakose sind meistens anämisch. Das Serum- Gesamtprotein bewegt sich, bedingt durch Dehydration und Anstieg von - und - Globulinen Globulinen, an der Obergrenze der Norm oder ist leicht erhöht. Bei infizierten Vögeln können Leukozytenzahlen von über /mm 3 festgestellt werden. Erhöhte Lactat-Dehydrogenase (LDH) und Aspartat-Aminotransferase (AST) Serumwerte weisen auf eine Schädigung der Leber hin, erhöhte Harnsäure- und Kreatininwerte auf eine renale Dysfunktion (zit. nach JANECZEK, ) Differentialdiagnose Differentialdiagnostisch ist bei Durchfall an Salmonellose, bei Schnupfen an Mykoplasmeninfektionen zu denken Diagnostische Indikation Klinischer oder epidemiologisch begründeter Verdacht Einfuhruntersuchungen siehe auch FLI 291
293 Zuständige Untersuchungseinrichtungen Staatliche Veterinäruntersuchungsämter Friedrich-Loeffler-Institut (Nationales Referenzlabor für Psittakose) Rechtsgrundlagen Tierseuchengesetz in der Fassung der Bekanntmachung vom 22. Juni 2004 (BGBl. I S. 1260; 3588), zuletzt geändert durch Artikel 3 des Gesetzes vom 21. Dezember 2006 (BGBl. I S. 3294) Stand: Neu gefasst durch Bek. v I 1260; 3588; zuletzt geändert durch Art. 3 G v I 3294 Verordnung über das innergemeinschaftliche Verbringen sowie die Einfuhr und Durchfuhr von Tieren und Waren (Binnenmarkt- Tierseuchenschutzverordnung - BmTierSSchV). In der Fassung der Bekanntmachung vom 6. April 2005 (BGBl. I S. 997) zuletzt geändert durch: Artikel 1 der Verordnung vom 11. Dezember 2006 (BGBl. I S. 2921) Verordnung zum Schutz gegen die Psittakose und Ornithose-Psittakose vom 20. Dezember 2005 (BGBl. I Nr. 74 vom S. 3532) Gl.-Nr.: Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember Untersuchungsmaterial Untersuchungsmaterial für direkten Antigennachweis und Chlamydienanzüchtung Verendete Vögel bzw. deren Organe (Milz, Lunge, Leber, Niere, Luftsäcke, Herzbeutel) Möglichst zellreiche Tupferproben 9 (okulo-nasale, tracheale oder Kloakentupfer), Kotproben (ca. 2 bis 5 g/vogel), Sammelkotproben von bis zu 20 Vögeln Tupferproben sollten für den Nachweis von C. psittaci mittels Zellkulturmethode möglichst frisch entnommen werden. Probenmaterial jeder Art sollte gekühlt und auf dem schnellsten Weg zum Untersuchungsort transportiert werden. Zusätzlich können kommerziell verfügbare Transportmedien 10 bzw. das in der Anlage 1 angegebene Medium verwendet werden. Können die Proben nicht innerhalb von 24 h aufgearbeitet werden, müssen sie bei < -76 C eingefroren werden (ohne Transportmedium!) Untersuchungsmaterial für den Antikörpernachweis Nativblutproben 11 (Blut ohne Stabilisator), Serum FLI 292
294 40.3. Untersuchung Beachte: Alle Laborarbeiten zum Erregernachweis sind mit entsprechenden Sicherheitsvorkehrungen (Biohazard-Werkbänke bzw. L3-Laboratorien) vorzunehmen. Aufgrund der aerogenen Übertragbarkeit der Erreger haben Ultraschallarbeiten, Zentrifugationsschritte u. a. grundsätzlich im geschlossenen System zu erfolgen Antigennachweismethoden Für den Nachweis von Chlamydophila psittaci-antigen werden folgende drei Labormethoden beschrieben: Direktnachweis 12 von C.-psittaci-Einschlusskörperchen durch histologische Färbemethoden bzw. von C.-psittaci-Antigen mittels Immunfluoreszenz Herstellung der Abklatsch bzw. Tupferpräparate Bewährt hat sich folgendes Verfahren: Herstellung von Abklatschpräparaten auf fettfreien Objektträgern (Organe, Tupfer). Bei Einsendung von Tupfern ohne Transportmedium sind die Tupfer direkt auf die Objektträger auszustreichen. Werden diese mit Transportmedium eingesandt, so sind sie 15 Sek. auf einem Vortex-Schüttler zu mischen, die Suspension ist nach Entfernen des Tupfers für 5 bis 10 min bei 800 x g zu zentrifugieren und nach vorsichtigem Abhebern des Mediums das Sediment z. B. mit einer Platinöse auf Objektträger auszustreichen. Präparate lufttrocknen Präparate fixieren: Fixierung für Giménez-Färbung: 30 min in 96%igem Ethanol p.a., lufttrocknen; Fixierung für Immunfluoreszenz: 10 min Aceton p.a., lufttrocknen bzw. nach Anweisung des Konjugatherstellers verfahren Färbung nach Giménez Fixierte Präparate gründlich mit Aqua dest. spülen und 6 min mit Karbolfuchsin-Gebrauchslösung färben Farblösung abgießen und zweimal in Aqua dest. spülen mit 0,8%iger Malachitgrün-Lösung 30 bis 60 Sek. gegenfärben Malachitgrünlösung abgießen zweimal in Aqua dest. spülen Färbung mit Malachitgrün-Lösung wiederholen Malachitgrünlösung abgießen mit Aqua dest. spülen zwischen Fließpapier unter mäßigem Druck trocknen lichtmikroskopische Beurteilung bei 400- bis 1000-facher Vergrößerung FLI 293
295 Beurteilung: Als positiv werden eindeutig im Zellplasma liegende Einschlusskörperchen gewertet. Die unterschiedlich großen Einschlusskörperchen (Elementarkörperchen: 0,2 bis 0,3 µm; Retikularkörperchen: 0,8 bis 1,5 µm) färben sich intensiv rot an. Der Hintergrund zeigt eine grünliche Färbung. Die Einschlusskörperchen sind von Artefakten einmal durch ihre Lage in der Zelle und zum anderen durch ihre Form und Anordnung zu unterscheiden. Eine negative Färbung schließt nicht aus, dass eine Chlamydieninfektion vorliegt, da die Erregermenge zu gering sein kann bzw. die Erreger in anderen Organen lokalisiert sein können. Bei negativen Ergebnissen ist zum sicheren Ausschluss einer Chlamydien-Infektion ein Zellkulturverfahren durchzuführen Anzüchtung und Vermehrung von C. psittaci mittels Zellkulturmethode und Nachweis mittels histologischer Färbung bzw. Immunfluoreszenz Beachte: Alle Laborarbeiten zum Erregernachweis sind mit entsprechenden Sicherheitsvorkehrungen (Biohazard-Werkbänke bzw. L3-Laboratorien) vorzunehmen. Bei Ultraschallarbeiten sind zusätzlich Atemschutzmasken zu tragen Vorbereitung des Untersuchungsmaterials Tupferproben Tupfer mit Transportmedium 10 für 15 Sek. auf einem Vortex-Schüttler homogenisieren Suspension zur sicheren Freisetzung der Chlamydien aus den Zellen mit Ultraschall (Becherresonator z. B. Fa. Branson, Amplitude 80 %, 8 Sek. mit 10 Schlägen und 0,2 Sek. Pause) behandeln. Tupfer ausdrücken und entsorgen Tupfer ohne Transportmedium Röhrchen mit 2 ml Transportmedium auffüllen, 10 min bei Zimmertemperatur stehen lassen und anschließend wie die mit Transportmedium versandten Tupfer behandeln Organmaterialien Ca. 1 g Organmaterial im Mörser unter Zusatz von sterilem Seesand oder mit einem Ultraturrax homogenisieren, in 10 ml Transportmedium aufnehmen und in 15-ml- Zentrifugenröhrchen überführen. Zur sicheren Freisetzung der Chlamydien aus den Zellen die Proben dreimal mit Ultraschall behandeln. ca. 10 min stehen lassen (Sedimentation der "groben" Bestandteile) und Überstand in ein Zentrifugenröhrchen (mit Schraubverschluss) überführen Zentrifugation der Organanreibung bei 500 x g für 15 min bei 18 C Überstand zum Beimpfen der vorbereiteten Zellkulturen verwenden Hinweis: Zellkultur möglichst gleich beimpfen; bei Leberanreibungen Vorverdünnung von 1:10 vornehmen (Material sehr aggressiv für Zellen) FLI 294
296 Einzel- und Sammelkotproben 1 g Kot im Mörser unter Zusatz von sterilem Seesand oder mit einem Ultraturrax homogenisieren; Herstellung einer 10%igen Suspension mit Transportmedium Homogenisate ca. 10 min stehen lassen (Sedimentation der "groben" Bestandteile) und Überstand in ein Zentrifugenröhrchen (möglichst mit Schraubverschluss) überführen Zentrifugation bei 500 x g für 15 min bei 18 C Probe möglichst gleich auf die Zellkultur bringen Kotproben sind oftmals so stark kontaminiert, dass auch die obligat zugesetzten Antibiotika eine Verunreinigung der Zellkultur nicht verhindern können. Eine vorherige Filtration durch einen Spritzenfilter der Porengröße 0,45 µm ist deshalb zu empfehlen Einzel- und Sammelkotproben in Transportmedium Homogenisierung der im Transportmedium eingesandten Kotmaterialien mit einem Vortexschüttler Herstellung einer 10%igen Lösung mit Transportmedium Homogenisate ca. 10 min stehen lassen (Sedimentation der "groben" Bestandteile) Überstand in ein Zentrifugenröhrchen (mit Schraubverschluss) überführen weiteres Vorgehen wie oben beschrieben Beimpfen der Zellkulturen Vorbereitung der Zellkultur Verwendet wird die permanente Buffalo-Green-Monkey (BGM)-Zelllinie (siehe Anhang 2). Die Zellen werden bei 37 C bebrütet und ein- bis zweimal wöchentlich im Verhältnis 1:3 bis 1:10 gesplittet. Es empfiehlt sich, die Zellen einmal pro Monat auf Mykoplasmen zu untersuchen. Für die Isolierung der Chlamydien in Zellkulturen können verschiedene Kultursysteme verwendet werden (z. B. sterile Flachbodenröhrchen mit Deckgläschen oder 24- Loch-Gewebekulturplatten, in die sterile Deckgläschen mit entsprechendem Durchmesser gegeben werden). Die Zelldichte wird auf die gewünschte Zellzahl (z. B. 1x10 5 Zellen/ml) eingestellt. Nach Aussaat werden die Kulturen bis zur Beimpfung mindestens 24 Stunden bei 37 C im CO 2 -Brutschrank bebrütet. Der Zellrasen wird mikroskopisch auf Konfluenz geprüft (evtl. erst nach 2 Tagen konfluenter Zellrasen erreicht). FLI 295
297 Beimpfung der Zellkulturen im ersten Ansatz je Probe mindestens vier Röhrchen der vorbereiteten BGM- Zellkulturen (Deckglasröhrchen mit jeweils 1 ml Zellsuspension von 1x10 5 ml) entsprechend folgendem Schema beimpfen: - 1 Rö: 30 µl Überstand - 2 Rö: 100 µl Überstand - 1 Rö: 300 µl Überstand Aufzentrifugation des Überstandes auf die Zellen zur Unterstützung der Anheftung von Chlamydien an die Zellen bei 3,400 x g für 1 h bei 3 e- schlossenem System, dafür z. B. Zentrifuge Rotanta 96 RS mit ausschwingbarem Rotor verwenden Inkubation für zwei Stunden bei 37 C und 5 % CO 2 (Deckel für Gasaustausch etwas aufschrauben) Mediumwechsel: Überstand absaugen, je nach Bedarf mit PBS (mit Ca und Mg-Ionen) waschen, je Röhrchen 2 ml Medium einfüllen, Zusätze zur Unterdrückung der Begleitflora (siehe Anhang 1) Inkubation der beimpften Zellkulturen bei 37 C und 5 % CO 2 Nächster Mediumwechsel nach 18 h Nach weiteren 48 h Zellrasen mikroskopisch beurteilen: wenn Zellrasen bei allen drei Beimpfungsmengen noch fest ist, Deckgläschen von Röhrchen mit 100 µl Überstand anfärben Bei positivem Nachweis: Anreicherung der Chlamydien durch Anlegen einer Passage ausgehend vom Röhrchen mit der größten Beimpfungsmenge bei intaktem Zellrasen; dafür Zellen durch Ultraschallbehandlung im Becherresonator (Fa. Branson) ablösen bei einer Amplitude von 80 %, 8 Sek. mit 10 Schlägen und 0,2 Sek. Pause, Ultraschallbehandlung wiederholen bis Zellrasen abgelöst ist, mit je 200 µl Zellsuspension die gewünschte Anzahl Röhrchen beimpfen, Inkubation und Nachweis wie beschrieben (außer Mediumwechsel nach 18 h), Chlamydiensuspension zum Typisieren geben, chlamydieninfizierte Zellkulturröhrchen bei -76 C lagern und gegebenenfalls als Vorkultur für eine Stammkonservierung einsetzen Bei negativem Nachweis: Anlegen einer Passage ausgehend vom Röhrchen mit der größten Beimpfungsmenge bei intaktem Zellrasen, dafür Zellen im Becherresonator (Fa. Branson) ablösen bei einer Amplitude von 80 %, 8 Sek. mit 10 Schlägen und 0,2 Sek. Pause, Ultraschallbehandlung wiederholen bis Zellrasen abgelöst ist, mit 200 µl Zellsuspension je drei Röhrchen beimpfen, alle Passageröhrchen nach der Beimpfung weiterbearbeiten wie beim ersten Ansatz beschrieben (außer Medienwechsel nach 18 h), nach zwei erfolglosen Passagen Isolierungsversuch beenden Kontrollen Bei allen Anzuchtversuchen wird als Positivkontrolle ein Zellkulturröhrchen mit einem Chlamydienstamm infiziert (definierte Infektionsdosis) und als Negativkontrolle ein unbeimpftes Zellkulturröhrchen mitgeführt. FLI 296
298 Nachweis der Chlamydien in Zellkulturen Infizierten Überstand aus den Röhrchen pipettieren und für Passagierung in sterile Röhrchen überführen bzw. direkt auf vorbereitete BGM-Zellen geben einmal kurz mit Methanol spülen und anschließend 10 min mit Methanol fixieren Zellen vor dem Fixieren nicht trocken werden lassen, da sonst Ruptur der Einschlüsse möglich Deckglaskulturen im Röhrchen fixieren Färbung nach Giménez - siehe auch Der Test ist valide, wenn Negativ- und Positiv-Kontrollen entsprechend ausgewertet werden können Nachweis mittels Immunfluoreszenz Für den Immunfluoreszenz-Nachweis von Chlamydienantigen stehen verschiedene kommerzielle Konjugate zur Verfügung. Die Durchführung ist nach der entsprechenden Produktinformation durchzuführen 13. Test der Firma Dako: Der Fluoresceinisothiocyanat (FITC) - konjugierte, gattungsspezifische monoklonale Antikörper richtet sich gegen das auf der Oberfläche aller bekannten Chlamydienstämme vorkommende Lipopolysaccharid (LPS). Deckgläser mit Pinzette dem Röhrchen entnehmen, mit Mikroskopierkleber (Entellan) auf dem Objektträger befestigen (Zellschicht nach oben) und trocknen lassen. Probe mit 25 µl Testreagenz überschichten - in feuchter Kammer 15 min bei 37 o C inkubieren - Objektträger mit PBS abspülen und anschließend 5 min im PBS- Schüttelbad waschen - Flüssigkeit auf Fließpapier etwas ablaufen lassen - einen Tropfen IMAGEN TM - Eindeckmedium auf Probe geben - mit Deckglas eindecken - Auswertung unter einem Auflicht-Fluoreszenzmikroskop bei 400- bis 1000-facher Vergrößerung Der Test ist valide, wenn Negativ- und Positiv-Kontrollen entsprechend ausgewertet werden können Nachweis Chlamydophila-psittaci-spezifischer DNA mittels rtpcr Grundlagen Das nachstehende Verfahren wurde am CVLUA Stuttgart in Zusammenarbeit mit dem nationalen Referenzlabor für Psittakose (NRL) entwickelt und beruht auf der Amplifikation eines spezifischen Fragments aus dem ompa-gen von C. psittaci. Es stellt eine Duplex-PCR mit interner Amplifikationskontrolle (IC2) dar und wurde im NRL bei einer Vielzahl von Untersuchungen eingesetzt. Die bei der internen Validierung erzielten Ergebnisse weisen es als spezifische, sensitive und reproduzierbare FLI 297
299 Methode aus. Darüber hinaus hat sich diese Methode in einem bundesweiten Ringversuch des NRL Psittakose im Jahre 2006 als sehr zuverlässig erwiesen. Benötigte Reagenzien und Geräte sind dem Anhang 3 zu entnehmen Probenaufarbeitung (DNA-Extraktion) a) INFIZIERTE ZELLKULTUREN: 1ml Kultur werden in einem Eppendorf-Tube 10 min bei 14,000 rpm zentrifugiert. Das Pellet wird in 200 µl PBS-Puffer (10 mm Na 2 HPO 4, 10 mm NaH 2 PO 4, 0,145 M NaCl, ph 7,0) resuspendiert. Zur DNA-Extraktion verwendet man das High Pure PCR Template Preparation Kit (Roche), bei welchem die DNA nach der Zelllyse über eine Minisäule gereinigt wird, oder vergleichbare Erzeugnisse anderer Hersteller, wie das QIAamp DNA Mini Kit. Nach Abarbeitung des mitgelieferten Protokolls erhält man ein Eluat von 200 µl, welches zur Aufkonzentrierung der DNA mit 0,6 VT Isopropanol (30 min, RT) gefällt werden kann. Das durch Zentrifugation (mind. 12,000 g, 10 min) gesammelte Präzipitat löst man dann in 20 µl Tris-Puffer (10 mm) und setzt davon 1 µl direkt in der PCR ein. b) KLINISCHES MATERIAL: Ein Gewebestück von ca. 25 mg wird in 200 µl Lysepuffer des High Pure PCR Template Preparation Kit suspendiert und nach dem Protokoll des Herstellers verarbeitet. Nach Abarbeitung dieses Protokolls erhält man ein Eluat von 200µl, welches zwecks Aufkonzentrierung der DNA mit 0,6 VT Isopropanol (30 min, RT) gefällt werden kann. Das durch Zentrifugation (mind. 12,000 g, 10 min) gesammelte Präzipitat löst man dann in 20 µl Tris-Puffer (10 mm) und setzt davon 1 µl direkt in der PCR ein. Tupferproben können nach einem alternativen Verfahren aufgearbeitet werden. Dazu vermischt man die Tupfer mittels Vortex-Schüttler in einem 2ml-Eppendorf- Reagenzröhrchen mit 500 µl Lysepuffer (100 mm Tris, ph 8.5, 0.05 % Tween 20) und zentrifugiert 30 Sek. bei 12,000 rpm. Um sämtliche Flüssigkeit aus dem Tupfer zu gewinnen, wird dieser in einer halb abgeschnittenen 1-ml-Pipettenspitze in einem zweiten Röhrchen nochmals 2 min zentrifugiert. Die Probenflüssigkeit wird vereinigt und 15 min bei 14,000 rpm zentrifugiert. Das Pellet ist in 50 µl Lysepuffer aufzunehmen und mit 20 µl 1%iger Proteinase K zu verdauen (2 h bei 60 C, dann Inaktivierung 15 min bei 97 C). Nach 5-minütiger Zentrifugation wird 1 µl des Überstandes als Template eingesetzt. Eine Aufarbeitung des Pellets mit einem kommerziellen DNA-Präparationskit ist ebenfalls möglich Amplifikation Folgende Primer und Sonden kommen zum Einsatz: Tabelle 3: Chlamydophila-psittaci-spezifische Primer und Sonde Primer Sonde Nukleotidsequenz (5'-3') Cpps-F CAC TAT GTG GGA AGG TGC TTC A Cpps-R CTG CGC GGA TGC TAA TGG Cpps-S FAM-CGC TAC TTG GTG TGA C-BHQ1 (MGB-Sonde) Amplikonlänge: 76 bp FLI 298
300 Tabelle 4: Primer und Sonde für die interne Amplifikationskontrolle Template- IC2 Dosierung 0,25 µl je Reaktion (2500 Kopien) DNA* Primer 1 EGFP-1-F GAC CAC TAC CAG CAG AAC AC Primer 2 EGFP-10-R CTT GTA CAG CTC GTC CAT GC Sonde EGFP-HEX HEX-AGC ACC CAG TCC GCC CTG AGC A-BHQ1 Amplikonlänge: 177 bp * Kloniert und präpariert von Dr. Bernd Hoffmann, FLI Insel Riems Die Amplifikation wird in für Real-Time-PCR geeigneten 96-Well-Platten in 25 µl- Ansätzen durchgeführt. Ein Reaktionsansatz enthält: 12,5 µl rtpcr Mastermix 2X (enthält Taq DNA-Polymerase, dntps, MgCl 2, Enhancer u. a.) je 2,0 µl Primerlösung Cpps-F/R (Endkonzentration 800 nm) 1,0 µl Sonde Cpps-S (Endkonzentration 200 nm) 2 µl IC2-Primer-Sonden-Mix (F:R:S=1:1:2; Endkonz. 400 nm:400 nm:200 nm) 0.25 µl IC2 DNA-Template (enthält 250 Kopien) 2,0 µl Proben-DNA 3,25 µl H 2 O entionisiert Für jede Probe sind mindestens zwei Wells vorzusehen (Doppelbestimmung). Nach erfolgter Pipettierung werden die Platten an der Oberseite mit Plastikfolie versiegelt und 30 Sek. bei 1000 rpm zentrifugiert. Als Kopienstandards benutzt man die Verdünnungsreihe eines DNA-Extraktes aus der Zellkultur eines bekannten Chlamydienstammes mit definiertem Gehalt an Einschluss-bildenden Einheiten (EBE). Wenn eine quantitative Auswertung beabsichtigt ist, werden Konzentrationen von 10 4 bis 10-1 Kopien pro µl jeweils doppelt aufgetragen. Die Reagenzienkontrollen (NTC, non-template controls) enthalten die gleichen Volumina an universellem Master Mix, Primern und Sonde, aber 1 µl Wasser anstelle des DNA-Templates. Folgendes Temperatur-Zeit-Profil wird gefahren (Standardprogramm des Cyclers): 2 min 50 C 10 min 95 C 45 Zyklen: 15 Sek. 95 C 60 Sek. 60 C Auswertung Als positives Ergebnis gilt, wenn eine Probe in beiden Ansätzen einen Ct-Wert (Schnittpunkt der Amplifikationskurve mit dem Schwellenwert) von unter 36 erreicht. Werden höhere Ct-Werte erreicht (36,0 bis 40,0), gilt das Ergebnis als fraglich und die jeweilige Probe muss nochmals gefahren werden. Falls die NTC-Kontrollen in mindestens einem Falle einen Ct-Wert unter 40 zeigen, ist die betreffende Probenserie zu wiederholen. Die Ct-Werte der internen Amplifikationskontrolle (IC, Signal HEX) sollen sich in einem Bereich von 26,0 bis 32,0 bewegen und untereinander relativ einheitlich sein FLI 299
301 (Variationsbreite unter den Proben eines Laufes max. 2 Ct-Einheiten). Sobald eine als Chlamydien-negativ beurteilte Probe einen stark abweichenden Ct-Wert der IC zeigt, ist diese zu wiederholen. Tabelle 5: Richtlinie für die Bewertung Ct-Wert des spezifischen Signals (hier: Bewertung FAM) 2x <36 positiv 2x >36 fraglich positiv (Wiederholung) 1x <36, 1x kein Ct fraglich positiv (Wiederholung) 1x 36-40, 1x kein Ct fraglich negativ (Wiederholung) 2x kein Ct negativ Chlamydophila psittaci-antigennachweis mittels Enzyme-linked Immuno-Sorbent Assay (ELISA) Weiterhin ist der Nachweis von C.-psittaci-Antigen mittels Enzyme-linked Immuno- Sorbent Assay (ELISA) möglich. Hier müssen bei der Durchführung die Vorgaben der jeweiligen Anbieter beachtet werden (Antigen-ELISAs 14 ). Der Einsatz dieser Testsysteme, insbesondere zur Diagnose der anzeigepflichtigen Psittakose, kann nur unter Vorbehalt empfohlen werden, da infolge der gegenüber anderen Methoden eingeschränkten Spezifität falsch-positive Reaktionen auftreten können 15, Vorbereitung des Untersuchungsmaterials Die Vorbereitung von Tupferproben ohne Transportmedium, Organmaterialien und Kotproben entspricht den unter beschriebenen Arbeitsschritten (dem Transportmedium wird 0,1 % Tween 20 zugefügt, es enthält keine Antibiotika und Antimykotica). Proben sind in hitzebeständige Röhrchen zu überführen. Bei Tupferproben mit Transportmedium erfolgt keine weitere Aufarbeitung. Die Proben können bis zu 7 Tage bei 2 bis 8 C aufbewahrt werden. Bei längeren Aufbewahrungszeiten empfiehlt es sich, die Proben bei -20 C einzufrieren Antigen-ELISA-Testdurchführung Die Testdurchführung ist nach der Gebrauchsinformation des Herstellers durchzuführen. Einige wichtige Punkte bei der Durchführung des IDEIA Chlamydia Tests 14 : tiefgefrorene Proben auftauen Proben 15 Min bei 100 C in Wasserbad erhitzen (dabei ist sicherzustellen, dass kein Wasser in die Probenröhrchen gelangen kann) Proben auf Zimmertemperatur abkühlen vor Einfüllen in die ELISA-Platten die vorbereiteten Proben für 15 Sek., die Positiv-Kontrolle für 1 min auf einem Vortexschüttler gut mischen (gleichmäßige Verteilung von Antigenkonglomeraten) beim Waschen der ELISA-Platten nach der 2. Inkubation bei jedem der 4 Waschschritte eine Standzeit von jeweils 2 min einhalten FLI 300
302 in Abweichung zur Gebrauchsinformation errechnet sich der Grenzwert aus dem Extinktionsmittelwert der Negativ-Kontrollen zuzüglich des Wertes von JANECZEK 7 (1998) konnte aufgrund epidemiologischer Untersuchungen, in denen Antikörperstatus und Antigenausscheidung von Psittaciformes analysiert wurden, zeigen, dass die Grenzwertberechnung, wie sie laut Produktinformation zur Ermittlung von Chlamydia trachomatis-infektionen herangezogen wird, für die Diagnose von Chlamydophila psittaci-infektionen nicht geeignet ist. Aufgrund dieser Grenzwert- Erhöhung konnte die Anzahl falsch positiv befundeter Chlamydien-Aussscheider von 6,4 % auf 1,6 % reduziert werden. Insbesondere bei Kotmaterialien sind aufgrund evtl. Kreuzreaktionen mit Bakterien-LPS Probenextinktionen bis OD über dem Grenzwert vorsichtig zu interpretieren. Dagegen können Probenextinktionen von OD über dem Grenzwert als sicher positive Chlamydienbefunde gewertet werden (siehe AVID-Mitteilung II/1997, Anlage 8) Chlamydophila-psittaci-Antikörpernachweise Serologische Untersuchungen dienen vor allem zur Diagnose von subklinischen persistierenden Chlamydieninfektionen, da bei dieser Verlaufsform i.d.r. keine Erreger ausgeschieden werden. Sie ist die häufigste Form bei adulten Vögeln. Zum Nachweis von Antikörpern gegen C. psittaci dienen die Komplementbindungsreaktion (KBR) oder ELISA-Verfahren. Lange Zeit stellte die KBR den einzigen Test zum Nachweis von Antikörpern dar. Da bei Vögeln nach einer Chlamydieninfektion nur geringe Mengen an komplementbindenden Antikörpern gebildet werden, ist die Methode allerdings wenig sensitiv. Sie erlaubt weder eine Speziesunterscheidung noch eine Differenzierung zwischen den Antikörperklassen. Positive serologische Befunde besitzen keine seuchenrechtliche Relevanz und dienen nicht zur Seuchenfeststellung. FLI 301
303 Anhang 1 1 Medien, Puffer, Chemikalien 1.1 Transportmedien (SPGA-Stabilisator) Bovarnick, M.R.; Miller, J.C., and Snyder, J.C. (1950) Journal of Bacteriology, 59, Medium zum Transport von Tupfern, Herstellen von Organanreibungen und Kryokonservieren von Chlamydienstämmen Saccharose KH 2 PO 4 K 2 HPO 4 L-Glutaminsäure (Na-Salz) bovines Albumin, Fraktion V Aqua bidest 74,60 g 0,52 g 1,25 g 0,92 g 1,00 g ad 1000 ml Substanzen in angegebener Reihenfolge in Aqua bidest. lösen (außer bovines Albumin) bis zum Eichstrich auffüllen, danach bovines Albumin zugeben und lösen sterilfiltrieren, portionieren und bei -20 C lagern - Bevorratung ohne antibiotische und antimykotische Zusätze - Zusätze frisch zugeben und Medium innerhalb von 24 h verbrauchen Nystatin-Stammlösung: 45 mg in 5 ml Aqua dest. lösen Endkonzentration im Medium 25 E/ml Gentamicin-Stammlösung: 400 mg in 10 ml Aqua dest. lösen Endkonzentration im Medium 40 µg/ml Vancomycin-HCL-Stammlösung: 250 mg in 10 ml PBS lösen Endkonzentration im Medium 25 µg/ml - Stammlösungen mischen und in Portionen zu je 250 µl abfüllen - Zugabe von 250 µl zu 100 ml Medium ergibt die gewünschte Endkonzentration FLI 302
304 1.2 Karbolfuchsinlösung für Färbung nach Giménez Karbolfuchsin: Stammlösung 100 ml 10%ige Fuchsinlösung (10 g Fuchsin gelöst in 100 ml 95%igem Ethanol) ml Aqua dest ml 4%iges wässriges Phenol - vor Gebrauch 48 h bei 37 o C stehen lassen - Stammlösung 10 Monate haltbar Gebrauchslösung 40 ml Stammlösung ml PBS ph-wert 7,2 - Haltbarkeit 40 h - direkt vor Gebrauch filtrieren 1.3 Malachitgrünlösung für Färbung nach Giménez Malachitgrünlösung (0,8%ig): 8 g Malachitgrünoxalat in 1000 ml Aqua dest. lösen - vor Gebrauch filtrieren 1.4 Medien für Zellkulturen, Suspensionsmedien und Puffer Zellkulturmedium EMEM 500 ml Minimum Essential Medium Eagle (EMEM) mit Earle s Salzen und NaHCO 3 ohne L-Glutamin + 5 ml einer 200 mmol Glutaminstammlösung (siehe 1.4.2) Endkonz. 2 mmol/ml + 5 % fetales Kälberserum (FKS) (derzeit Fa. PAA) fest verschlossen im Kühlschrank bei 4 C 2 C lagern, nicht unnötig erwärmen und innerhalb von 4 Wochen nach Zugabe der Zusätze verbrauchen Glutaminstammlösung 2,922 g L-Glutamin (zellkulturgetestet) in 100 ml Aqua bidest. lösen, sterilfiltrieren, portionieren und bei -18 C einfrieren FLI 303
305 1.4.3 EMEM mit Zusätzen für Chlamydienanzüchtung - EMEM-Herstellung siehe unter Zusätze frisch zugeben und Medium am Tag der Zugabe verbrauchen Amphotericin B-Stammlösung: 25 mg in 10 ml Aqua dest. lösen Endkonzentration im Medium 2,5 µg/ml Gentamicin-Stammlösung: 100 mg in 10 ml Aqua dest. lösen Endkonzentration im Medium 10 µg/ml Vancomycin-HCL-Stammlösung: 250 mg in 10 ml Aqua dest. lösen Endkonzentration im Medium 25 µg/ml - Stammlösungen mischen und in Portionen zu je 300 µl abfüllen und bei -18 C einfrieren - Zugabe von 300 µl zu 100 ml Medium ergibt die gewünschte Endkonzentration Trypsin-EDTA-Lösung (ph-wert 7,2-7,3) NaCL KCL Glucose NaHCO 3 Trypsin EDTA Aqua bidest. 8,0 g 0,8 g 1,0 g 0,58 g 0,5 g 0,2 g ad 1000 ml Substanzen in angegebener Reihenfolge in Aqua bidest. lösen, dann ph- Wert einstellen bis zum Eichstrich auffüllen, sterilfiltrieren, portionieren und bei -18 C einfrieren PBS (ph-wert 7,2-7,4) ohne Ca- und Mg-Ionen Puffer zum Waschen der Zellen vor dem Umsatz NaCl 8,0 g KCl 0,2 g Na 2 HPO 4 x 12 H 2 O 2,31g KH 2 PO 4 0,2 g Aqua bidest. ad 1000 ml Substanzen in angegebener Reihenfolge in Aqua bidest. lösen, dann ph- Wert einstellen bis zum Eichstrich auffüllen, sterilfiltrieren, portionieren und im Kühlschrank lagern FLI 304
306 1.4.6 PBS (ph-wert 7,2-7,4) mit Ca- und Mg-Ionen Puffer zum Waschen der Zellen ohne Umsatz NaCl 8,0 g KCl 0,2 g Na 2 HPO 4 x 12 H 2 O 2,31 g KH 2 PO 4 0,2 g MgCl 2 0,0468 g CaCl 2 x 2 H 2 O 0,132 g Aqua bidest. ad 1000 ml Substanzen in angegebener Reihenfolge in Aqua bidest. lösen, dann ph- Wert einstellen bis zum Eichstrich auffüllen, sterilfiltrieren, portionieren und im Kühlschrank lagern 1.5 Suspensionsmedium für Verreibungen (Antigen-ELISA) Basismedium mit 0.1 % Tween 20, jedoch ohne Zusatz von NEAA, Antibiotika und Antimycotika Anhang 2 Zellkultur Verwendet wird die permanente Buffalo Green Monkey (BGM)-Zelllinie (ATCC CCL 26, BS-C-1 [Kidney, African Green Monkey, ceropithecus aethiops]) (Angaben in Klammern für Zellkulturflaschen T75) bewachsene Zellkulturflasche leicht schwenken, umdrehen und Medium absaugen 1x mit 5 ml (10 ml) PBS - Puffer waschen, um abgestorbene Zellen, Medienbestandteile und Stoffwechselprodukte zu entfernen absaugen 2 ml (5 ml) Trypsin-EDTA-Lösung auf Zellrasen geben und 5 bis 10 min bei 37 C einwirken lassen, gelegentlich schwenken und klopfen Zeitangabe nur Richtwert Einwirkzeit abhängig von dem Alter der Zellen und dem Alter der Trypsin-EDTA-Lösung Sichtkontrolle makroskopisch: Zellen fließen mit der Flüssigkeit am Flaschenboden herunter Sichtkontrolle mikroskopisch: Großteil der Zellen schwimmt in abgekugelter Form in der Flüssigkeit 2 ml (5 ml) Zellkulturmedium zugeben das im Medium enthaltene Serum neutralisiert sofort die Wirkung des Trypsins und teilweise den zytotoxischen Einfluss des EDTA) Zellen mittels Pipette gründlich suspendieren und in Röhrchen geben Suspension 12 min bei 1500 U/min und 18 o C zentrifugieren FLI 305
307 Überstand sofort vorsichtig absaugen sonst Zellschädigung durch EDTA Anwesenheit von EDTA erschwert außerdem die erneute Anheftung der Zellen bei der Aussaat 2 ml (4 ml) Kulturmedium auf Zellpellet geben und gründlich resuspendieren, um die Zellen zu vereinzeln Zellen nach Umsatzrate (z. B. 1:5) umsetzen oder Zellzahl mittels Neubauer- Zählkammer bestimmen Kulturmedium in Zellkulturflasche vorlegen und errechnete Menge Zellsuspension zugeben und durch Schwenken gleichmäßig verteilen Inkubation im Brutschrank bei 37 C und 5 % CO 2 bei Zellkulturflaschen ohne Sterilfilter in der Verschlusskappe diese ca. eine halbe Umdrehung aufschrauben, um den Gasaustausch zu gewährleisten nach zwei bis vier Tagen erfolgt die Ausbildung eines geschlossenen Zellrasens (abhängig von der Einsaatdichte der Zellen) Anzucht in Röhrchen mit Deckglas Zelle umsetzen wie oben beschrieben nach Bedarf entsprechende Menge Zellsuspension mit einer Zelldichte von 1x10 5 /ml herstellen 1ml / Röhrchen einfüllen auf gleichmäßige Durchmischung achten, da Zellen sich schnell absetzen Röhrchendeckel etwas aufschrauben, um Gasaustausch zu gewährleisten Inkubation bei 37 C und 5 % CO 2 nach 1h kontrollieren, ob noch alle Deckel locker sind Bei festgesaugtem Deckel und dadurch verhindertem Gasaustausch bleibt die Mediumfarbe unverändert, während sich das Medium durch den Gasaustausch etwas orange verfärbt. nach 2 bis 3 d Ausbildung eines geschlossenen Zellrasens (mikroskopische Kontrolle) FLI 306
308 Anhang 3 Materialien und Geräte für die Real-Time-PCR Verzeichnis der Reagenzien PBS-Puffer (10 mm Na 2 HPO 4, 10 mm NaH 2 PO 4, 0,145 M NaCl, ph 7,0) High Pure PCR Template Preparation Kit (Roche Diagnostics) od. vergleichbares Produkt zur DNA-Extraktion aus klinischen Proben Isopropanol z.a. Tris-Puffer 10 mm Lysepuffer (100 mm Tris, ph 8.5, 0.05 % Tween 20) Proteinase K (1%ige Lösung, w/v) Reinstwasser TaqMan Universal MasterMix (Fa. Applied Biosystems, Weiterstadt) od. gleichwertiges Produkt eines anderen Herstellers, enthält Hot-Start Taq-DNA- Polymerase, Reaktionspuffer, dntps und Farbstoffe Primer: Stammlösung 100 pmol/µl, Arbeitsverdünnung 1:20, ergibt Arbeitskonzentration 5 pmol/µl) (Sequenzen und andere Angaben siehe Tabellen 3 und 4) Sonde: lösen in 1mM Tris-HCl ph 8.0/0,01mM EDTA, so dass sich eine Konzentration von 5 pmol/µl bzw. 5 µm ergibt; in Portionen zu je 200µl einfrieren. (Sequenzen und andere Angaben siehe Tabellen 3 und 4) Es handelt sich um eine MGB -Sonde. Verzeichnis der Geräte GeneAmp 7700 (oder 5700) Sequence Detection System (Applied Biosystems) oder Mx3000 Real-Time PCR System (Stratagene, Amsterdam) Vortexschüttler Tischzentrifuge Laborzentrifuge mit Rotor für Mikrotiterplatten, z. B.Biofuge Stratos (Kendro Laboratory Products, Langenselbold) Automatische Pipetten, 0,1-2,5 µl, 0,5-10µl, 2-20 µl, µl, µl und µl Mehrkanalpipette, z. B. 8-Kanalpipette µl Verzeichnis der Verbrauchsmaterialien MicroAmp Optical 96-Well Reaction Plates (Applied Biosystems) oder andere für Real-Time-PCR geeignete Mikrotiterplatten Thermische Verschließfolie, z. B. MicroAmp Clear Adhesive Films (Appl. Biosystems) od. Adhesive Plate Seal (Biodeal, Markkleeberg) Filterspitzen für o.g. automatische Pipetten Reaktionsgefäße 0,2 ml, dünnwandig (für PCR) Reaktionsgefäße 1,65 ml und 2,0 ml (für Probenaufbereitung) Einmalhandschuhe (bei allen Arbeitsschritten zu tragen) FLI 307
309 Literatur (siehe Fußnoten) ANDERSEN, A.A (1997): Two new serovars of Chlamydia psittaci from North American birds. J Vet Diagn Invest 9: VANROMPAY, D., BUTAYE, P., SAYADA, C., DUCATELLE, R., HAESEBROUCK, F. (1997): Characterization of avian Chlamydia psittaci strains using omp1 restriction mapping and serovar-specific monoclonal antibodies. Res Microbiol 148: GEENS, T., DESPLANQUES, A., VAN LOOCK, M., BÖNNER, B.M., KALETA, E.F., MAGNINO, S., ANDERSEN, A.A., EVERETT, K.D.E., VANROMPAY, D. (2005): Chlamydophila psittaci ompa sequencing reveals the new genotype E/B and the need for a rapid discriminatory genotyping method. J Clin Microbiol 43: Verordnung zum Schutz gegen die Psittakose und Ornithose -Psittakose- Verordnung vom 20. Dezember 2005 (BGBl. I Nr. 74 vom S ) Gl.-Nr.: Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005 KALETA E.F. (1997): Aktuelle Fragen der Diagnose und Bekämpfung der Psittakose. Tierärztl Umschau 52, JANECZEK, F. (1989): Chlamydia psittaci - Diagnostik bei Psittaciformes: Vergleichendes Untersuchungen zum Antigennachweis in der Zellkultur und im ELISA sowie zum Antikörpernachweis in der Komplementbindungsreaktion und im Blocking ELISA. Vet Diss München NÜCHTER, H., SACHSE, K., KALETA, E.F. (2004) Die aviäre Chlamydiose und ihre Bekämpfung in der Europäischen Union. Amtstierärztlicher Dienst und Lebensmittelkontrolle, 11, (Teil 1) und (Teil 2) Bei der Gewinnung der Tupferproben ist darauf zu achten, dass möglichst viele Epithelzellen gewonnen werden. ACHTUNG: Baumwolltupfer mit HOLZ- SCHAFT sind UNGEEIGNET, da das nachzuweisende Antigen an Holz adsorbiert und dadurch Ergebnisse verfälscht werden. z. B. IDEIA Chlamydia- Probenentnahmeset (2 unterschiedlich große Tupfer und Transportmedium in Schraubflasche) der Fa. DAKO Diagnostika, Hamburg. Kommerziell verfügbare Transportmedien, z. B. von Dako oder SPGA- Stabilisator, siehe Anhang 1 (1.1) Blut ist aus der Vena jugularis zu entnehmen. Bei kleineren Vögeln (z. B. Wellensittiche) können etwa 0,5 ml und bei größeren Vögeln bis zu 1,5 ml Blut entnommen werden (Kanüle 0,70 x 30 mm). Blutproben möglichst nicht aus der Vena ulnaris entnehmen, da es häufig zu Hämatombildung kommt. Bedingung für den direkten Nachweis von Chlamydienantigen mittels histologischer bzw. fluoreszenzserologischer Methoden ist eine ausreichende Anzahl FLI 308
310 von Zellen. Da bei negativem Ergebnis weitere Untersuchungen (Zellkulturmethode bzw. Antigen-ELISA) durchzuführen sind, sollten die ohne Medium eingesandten Tupfer in geeignetes Medium verbracht werden. Bei den mit Transportmedium zu untersuchenden Tupfer, sollte das restliche Zellpellet im abgesaugten Transportmedium wieder resuspendiert werden Bei den Konjugaten z. B. der Fa. Medac, Hamburg bzw. DAKO, Hamburg handelt es sich um FITC (Fluorescein-Iso-Thio-Cyanat)-gebundene, monoklonale Antikörper gegen ein allen Chlamydienarten gemeinsames, genusspezifisches Lipopolysaccharid (LPS). ELISA Erfahrungen liegen für den IDEIA Chlamydia Test der Fa. DAKO, Hamburg, vor. Die Ausführungen gelten nur für diesen Test. Siehe dazu AVID-Mitteilung II/1997, Anlagen 8 bis 10 SACHSE, K., GROSSMANN, E., JÄGER, C., DILLER, R., HOTZEL, H. (2003): Detection of Chlamydia suis from clinical specimens: Comparison of PCR, antigen ELISA and culture. J Microbiol Meth 54: FLI 309
311 41. Q-Fieber (meldepflichtig) Charakterisierung der Infektion Erreger Der Erreger des Q-Fiebers, Coxiella burnetii, ist ein sehr kleines, gramnegatives, obligat intrazelluläres Bakterium Klinische Symptomatik Die Krankheitserscheinungen beim Tier sind meistens gering. Seine Hauptbedeutung hat der Erreger als Auslöser vom Unfruchtbarkeit und Aborten beim Wiederkäuer (Schaf, Ziege, Rind; auch Wildwiederkäuer, z. B. Damwild) sowie als Zoonosenerreger. Besonders reichlich ist der Erreger im Fruchtwasser, in den Nachgeburten und den Lochien enthalten. Die Übertragung erfolgt kongenital, oral oder aerogen. Ferner werden Coxiellen auch durch Zecken übertragen. In Deutschland spielt hierbei insbesondere die Schafzecke Dermacentor marginatus eine wichtige Rolle bei der Aufrechterhaltung des sogenannten Wildtierzyklus. Neben der kutanen Übertragung der Coxiellen durch den Saugakt kann der Erreger auch durch Inhalation erregerhaltigen Zeckenkotes übertragen werden Differentialdiagnose Als Differentialdiagnose kommen andere Abortursachen, insbesondere durch Chlamydien bedingte Aborte, in Betracht Klinische Diagnostik Ungeklärte Aborte und Fruchtbarkeitsstörungen Zuständige Untersuchungseinrichtungen Friedrich-Loeffler-Institut, Seestraße 55, Wusterhausen, Tel Rechtsgrundlagen Grundlage für die Bekämpfung des Q-Fiebers ist in Deutschland das Tierseuchengesetz in der Fassung der Bekanntmachung vom 22. Juni 2004 in der jeweils geltenden Fassung. Des Weiteren ist das Q-Fieber aufgeführt in der Verordnung über meldepflichtige Tierkrankheiten 20. Dezember FLI 310
312 41.2. Untersuchungsmaterial Der Nachweis einer Q-Fieber-Infektion erfolgt durch den Erreger-Nachweis. Serologische Befunde allein gelten als nicht beweisend für ein akutes Infektionsgeschehen. Geeignetes Untersuchungsmaterial stellen Feten bzw. Fetusteile (Lunge, Leber, Niere, Milz, Labmagen) sowie die Eihäute und Teile der Nachgeburten dar. Des Weiteren können Milchproben, Vaginaltupferproben sowie abgesammelte Zecken eingeschickt werden. Tupferproben sollten mit Hilfe einer kleinen Menge physiologischer Kochsalzlösung vor dem Austrocknen geschützt werden. Wegen der Infektionsgefahr für den Menschen (Zoonoseerreger) ist der Versand mit besonderer Vorsicht gemäß den geltenden Vorschriften durchzuführen. Das Material kann gefroren oder gekühlt versandt werden. Die Proben sind an das Friedrich- Loeffler-Institut, Seestraße 55, Wusterhausen zu schicken. Sie sind in jedem Fall telefonisch anzukündigen ( ). Im Anschreiben ist anzugeben: Wer sendet ein? (Veterinäramt, Bearbeiter; incl. dienstlicher und eventuell privater Telefon- und Fax-Nummer) Was wird eingesandt? (Art des Materials, von welchen Tieren, Anzahl etc.) Aus welchem Bestand stammen die Proben? Untersuchungsgang Erregernachweis Anzucht Versuche zur Isolierung von Coxiellen erfordern ein S3-Labor. Die Methode ist bei Henning und Sting (2000) beschriebenen. Sie erfolgt mittels Buffalo Green Monkey (BGM)-Zellen in 75 cm2 Plastikflaschen. Als Medium dient z. B. antibiotikumfreies Minimal Essential Medium (MEM) Eagle mit Earle s Salzen und Zusatz von 5 % neonatalem Kälberserum (NKS), 1 % nicht-essentiellen Aminosäuren 100x, 1 % Vitaminen 100x sowie 2 mmol L-Glutamin. Nach Anreibung der Proben werden diese in MEM aufgeschwemmt und anschließend durch einen Spritzenfilter mit einer Porengröße von 0,45 μm filtriert. Dieses Filtrat dient als Inokulum für eine BGM-Zellkultur, die über einen Zeitraum von 6 Wochen auf das Auftreten von für Coxiellen typischen Vakuolen beobachtet wird Färberischer Nachweis Die Coxiellen können mit Hilfe von nach Gieménez gefärbten Ausstrichpräparaten nachgewiesen werden (Abb. 1). FLI 311
313 Abbildung 1: Coxiella burnetii in BGM-Zellkultur (Giménez-Färbung) Polymerase Kettenreaktion (PCR) Nähere Angaben zur Probenaufbereitung sowie zu den PCR-Methoden sind bei Henning et al. (2007) zu finden. Nachfolgend wird als Beispiel eine der Möglichkeiten beschrieben. Die Aufreinigung der DNS erfolgt mit Hilfe eines kommerziellen DNS-Isolierungskits gemäß der Anleitung des Herstellers. Die PCR zum Nachweis von Coxiellen erfolgt gemäß einer modifizierten Arbeitsvorschrift von Schrader et al. (2000). Als Primer werden CoxP4 (5 -TTA AGG TGG GCT GCG TGG TGA TGG-3 ) und CoxM9 (5 - GCT TCG TCC CGG TTC AAC AAT TCG-3 ) verwendet. Der Reaktionsansatz besteht aus 1 x PCR-Puffer, 2 mm MgCl2, 0,5 U Taq DNA Polymerase, 0,2 mm dntps, jeweils 0,5 μm beider Primer und 2 μl DNA-Extrakt. Die PCR-Bedingungen sind der Tab. 1 zu entnehmen. Die Darstellung der Amplifikate erfolgt im Agarose-Gel (1 % oder 1,5 %) mittels Ethidiumbromidfärbung unter UV-Licht. Als positiver Befund gilt das Erscheinen eines 448 bp-großen PCR-Produktes als Bande im Agarose-Gel, unter der Bedingung, dass alle mitgeführten Negativkontrollen negativ sind und in der Referenzstamm-Probe ein Amplifikat der korrekten Größe gebildet wurde Antikörpernachweis Die serologischen Tests können mittels KBR oder kommerziell erhältlicher Antikörper-ELISA durchgeführt werden. Literatur Henning, K. und Sting, R.: Die Isolierung und Kultivierung des Q-Fieber-Erregers (Coxiella burnetii) mittels Zellkulturen. Tierärztl. Umschau 55, , Henning, K., Kilwinski, J., Hotzel, H., Panning, M.: Nachweis des Q-Fieber-Erregers Coxiella burnetii in Milch. Journal für Verbraucherschutz und Lebensmittelsicherheit 2 (2) : , Schrader, C., D. Protz und J. Süss (2000): Coxiella burnetii. In: Sachse, K. und Gallien, P. Molekularbiologische Nachweismethoden ausgewählter Zoonoseerreger. BgVV-Hefte 2/2000, Berlin. FLI 312
314 42. Rauschbrand Charakterisierung der Infektion Erreger Der Rauschbrand ist eine seuchenhaft und akut verlaufende, infektiöse, aber nicht kontagiöse Gasödemkrankheit, die meist junge Rinder sowie gelegentlich Schafe bzw. Ziegen befällt und durch die metastatische Bildung von Gasödemen in den großen Muskelpartien gekennzeichnet ist. Der Erreger ist Clostridium chauvoei (manchmal auch als C. feseri bezeichnet). Die Infektion des Rindes erfolgt meist über den Verdauungstrakt, die C.-chauvoei-Infektion des Schafes ist dagegen eine Wundinfektion. Der seuchenhafte Verlauf beim Rind macht die vorrangige Bekämpfung des Rauschbrandes gegenüber den anderen Clostridieninfektionen erforderlich Klinische Symptomatik Gasig-knisternde, "rauschende" Schwellungen an Hals, Schulter, Rücken, Oberschenkel, zugleich schwere Allgemeinstörungen. Tod meist schon nach mehreren Stunden, Krankheit dann erst feststellbar. Bei Schafen tritt Rauschbrand vorwiegend als reine Wundinfektionskrankheit auf, z. B. nach Verletzungen, bei Geburten, als Folge von Hundebissen oder nach dem Scheren. Auch hier knisternde Anschwellungen Differentialdiagnostik Andere Gasödemerreger, insbesondere von C. septicum, dem Erreger des Pararauschbrandes. C. septicum verursacht bei Schafen Wund- und Geburtspararauschbrand, tritt aber auch bei anderen Tieren als Gasödemerreger in Erscheinung. Bei den Gasödeminfektionen sind weitere Clostridienspezies, besonders C. novyi, C. perfringens, C. histolyticum, C. sordellii und C. fallax differentialdiagnostisch zu berücksichtigen. Des Weiteren ist Milzbrand auszuschließen Diagnostische Indikation Siehe Zuständige Untersuchungseinrichtung Staatliche Veterinäruntersuchungsämter sowie NRL am FLI, Standort Jena Rechtsgrundlagen Verordnung zum Schutz gegen den Milzbrand und den Rauschbrand vom 23. Mai 1991 (BGBl. I S. 1172) in der jeweils geltenden Fassung FLI 313
315 42.2. Untersuchungsmaterial Aufgrund des schnellen und meist letalen Krankheitsverlaufes konzentriert sich die Diagnose fast ausschließlich auf postmortale Nachweisverfahren. Bei Tieren, die später als 24 h post mortem zur Sektion gelangen, ist eine exakte Diagnosestellung infolge der schnellen postmortalen Zersetzung des Gewebes und verschiedener Clostridientoxine erschwert. Bei Gasödeminfektionen sind typisch veränderte Gewebeproben und Exsudat steril zu entnehmen. Die Aufbewahrung der Proben erfolgt bei 4 C Untersuchungsgang Clostridien haben die Fähigkeit zur Bildung von Endosporen, die im Direkt- (Original-) Präparat mittels Gram-Färbung oder Sporen-Färbung (z. B. nach Rakette, Anhang 1) nachweisbar sind und bereits wichtige Orientierungen geben können. Die primäre Anzucht von Clostridien aus Untersuchungsmaterial erfolgt vorwiegend auf festen Nährböden als anaerobe Oberflächenkultur sowie parallel in flüssigen Anreicherungskulturen, die nach erfolgtem Wachstum zur Bakterienisolierung auf feste Medien ausgeimpft werden. Eine selektive Anzüchtung von Clostridien, die in flüssigem Untersuchungsmaterial bzw. Aufschwemmung von festem Material in Sporenform vorkommen, kann nach Erhitzen der Proben für 15 min bei 75 C erfolgen Kulturmedien Für die Basisdiagnostik werden Nährmedien verwendet, auf denen Clostridien optimal wachsen und charakteristische Wuchseigenschaften zeigen: Blutagar: zur Beurteilung der Hämolyse Blut-Glukose-Agar nach Zeissler (Anhang 2): zur Beurteilung der Wuchsform Glukose-Hefeextrakt-Cystein-Agar (Anhang 3) Laktose-Eigelb-Agar (Anhang 4): zur Beurteilung wichtiger Identifizierungsmerkmale, wie Laktosespaltung, Lecithinase- und Lipasebildung. Selektivmedien sind im Handel erhältlich, haben sich aber nur für wenige Clostridien- Spezies bewährt, da durch die Empfindlichkeit der meisten Clostridien gegenüber den in den Nährböden befindlichen Hemmstoffen die Keimzahl stark reduziert wird. Geeignete flüssige Kulturmedien sind: Anaerobier-TVLS-Medium (Merck Art.-Nr ) Leber-Leberbouillon nach Tarozzi (Anhang 5) Hirnbreisuspension nach Hibler (Anhang 6): für indirekten Sporennachweis und Stammhaltung Kulturbedingungen Die Bebrütung erfolgt unter anaeroben Verhältnissen, d. h. in Anaerobiertöpfen (Gas Pak [BBL], Anaerocult A [Merck], AnaeroGen [Oxoid]) unter Einsatz von Gas- Entwickler-Kits oder der Gasaustauschtechnik bzw. in Anaerobier-Brutschränken. Es empfiehlt sich, die Anaerobiose im Kulturgefäß durch Mitführen eines Redoxindikators (Anhang 7.1. u. 7.2.) zu prüfen. Eine Vorreduzierung der Agarplatten im Anaerobiergefäß verbessert das Wachstum und damit die Isolierungsrate. FLI 314
316 Die flüssigen Nährmedien sollen vor der Verwendung 15 min ausgekocht werden und nach dem Beimpfen entweder mit flüssigem sterilem Paraffin (Merck 7162) überschichtet oder anaerob bebrütet werden. Ein geringer Agarzusatz (0,1-0,5 %) in den Bouillons verlangsamt das Wiedereindringen des Sauerstoffs aus der Atmosphäre. Da die meisten Clostridien-Spezies relativ schnell wachsen, kann die Ablesung der Kulturplatten bzw. Kontrolle der Bouillonkulturen nach einer anaeroben Bebrütung von 1 bis 3 Tagen bei 37 C erfolgen Identifizierung Ausgangspunkt für die Identifizierung sind morphologische Kriterien. Die Zuordnung der Isolate zur Gattung Clostridien erfolgt durch: Anfertigung eines Grampräparates: Clostridien sind grampositiv (Ausnahmen: C. clostridioforme, C. indolis, C. sphenoides). In älteren Kulturen treten häufig gramlabile Stäbchen auf. Prüfung des Wachstums unter aeroben Bedingungen: Clostridien wachsen nicht auf aerob bebrüteten Nährböden (Ausnahme: wenige aerotolerante Arten, z. B. C. histolyticum, C. tertium, C. ramosum, C. durum, C. carnis). Nachweis von Sporen: Die meisten Clostridien bilden auf festen Nährböden oder in flüssigen Medien Sporen, die im Phasenkontrastmikroskop oder mittels Gram- bzw. Sporenfärbung nachgewiesen werden. Die Lokalisation der Spore in der Zelle ist ein Identifizierungsmerkmal (Tab. 1). Der indirekte Sporennachweis (Hitzetest) erfolgt dann, wenn im Präparat keine Sporen zu sehen sind. Hierzu wird das zu prüfende Material bzw. die Kultur 15 min auf 75 C erhitzt und in ein flüssiges Medium überimpft. Tritt nach 48 h Bebrütung bei 37 C Wachstum auf, beweist dies, dass Sporen vorhanden waren. Keine Sporen werden bei C. perfringens, selten bei C. ramosum und C. clostridioforme gefunden Differenzierung Grampositive oder gramlabile Stäbchen mit Sporenbildung werden zur biochemischen Prüfung auf Laktose-Eigelb-Agar (Anhang 4) ausgestrichen und in ein Fermentationsmedium (Anhang 8) für die Bunte Reihe überimpft. Auf Laktose-Eigelb-Agar können folgende differentialdiagnostisch wichtige Merkmale beurteilt werden, die eine erste orientierende Identifizierung medizinisch bedeutsamer Clostridien-Spezies ermöglichen: Laktosefermentation, Lecithinase- und Lipasebildung (Abbildung 1, Tabelle 1). Die Kolonien laktosespaltender Spezies sind gelb gefärbt. Die Fähigkeit zur Lecithinasebildung ist an einer opaken Präzipitationszone um die Kolonie zu erkennen. Lipasebildende Spezies weisen dagegen eine perlmuttartig schillernde Glanzzone um die Kolonie auf. Außerdem werden auch proteolytische Eigenschaften durch eine Klärungszone um die Kolonie angezeigt. Die weitere biochemische Prüfung erfolgt in einem Fermentations-Basis-Medium mit Zuckerzusatz (Anhang 8). FLI 315
317 Die Bebrütung erfolgt mindestens 3 bis 5 Tage anaerob bei 37 C. Abgrenzung von C. chauvoei und C. septicum: Die beiden Erreger gleichen sich in vielen Eigenschaften. Eine Differenzierung ist durch die in Tabelle 1 zusammengefassten Merkmale möglich. Nach Bergey's Manual of Systematic Bacteriology lässt sich C. chauvoei am einfachsten durch die Fermentation von Saccarose und die ausbleibende Verstoffwechselung von Cellobiose und Trehalose von C. septicum unterscheiden. C. septicum und C. chauvoei besitzen ein gemeinsames Letaltoxin. Zusätzlich wird von C. septicum ein zweites Letaltoxin gebildet. Dadurch kann mit C.-septicum- Antitoxin die toxische Wirkung von C. chauvoei neutralisiert werden, aber nicht umgekehrt. Der Meerschweincheninfektionsversuch liefert unsichere Ergebnisse und sollte nur noch in Ausnahmefällen vorgenommen werden. In der Routinediagnostik gewinnt der direkte Fluoreszenztest zunehmend an Bedeutung, für welchen entsprechende Antiseren angeboten werden Anhang 9). Bezüglich der Durchführung dieser Untersuchungsverfahren wird auf die Angaben des Herstellers verwiesen. Hinweis: Da die diese Diagnostika bisher nicht zugelassen sind, ist eine Ausnahmegenehmigung der zuständigen obersten Landesbehörde notwendig. Abgrenzung von C. chauvoei von weiteren Gasödemerregern Weitere, differentialdiagnostisch bedeutsame Clostridienspezies sind C. novyi, C. perfringens, C. histolyticum, C. sordellii und C. fallax. Sie können durch das Wachstum auf Laktose-Eigelb-Agar (Abb. 1) und die Reaktionen in der Bunten Reihe (Tab. 1) abgegrenzt werden. Identifikation und Differenzierung durch PCR: Die Identifikation und Differenzierung von C. chauvoei kann auch durch PCR erfolgen. Ratsam ist die Anzucht bzw. Isolation verdächtiger Kolonien, aus denen dann die DNA extrahiert werden kann. Bezüglich der Durchführung dieser Untersuchungsverfahren wird auf die Angaben der Autoren verwiesen (Kuhnert et al. 1996, 1997). Nach der Amplifikation mit dem Primerpaar 16S UNI-L/R (Kuhnert et al. 1996, 1997) erhält man ein Amplifikat von etwa 1400 bp. Dieses Amplifikat wird mit SspI verdaut, um zwischen C. chauvoei und C. septicum unterscheiden zu können. Im Fall von C. chauvoei Isolaten erhält man 3 Restriktionsprodukte von 1020, 186 und 171 bp, während sich bei C. septicum nur 2 Fragmente nachweisen lassen (1020 und 357 bp). Mit dem Primerpaar CC 16S-L/R erhält man von C. chauvoei und C. septicum (C. septicum meist schwach oder nicht nachweisbar) ein 960 bp Amplifikat, während andere nahe verwandte Spezies wie C. carnis nicht reagieren. Durch den Verdau mit SspI kann das Vorliegen von C. chauvoei DNA (118 bp, 186 bp, 655 bp) verifiziert werden (C. septicum: 304 bp, 655 bp) (Kuhnert et al. 1996, 1997) Validierung Offizielle Methoden der Validierung stehen derzeit nicht zur Verfügung. FLI 316
318 Tabelle 1: Differenzierung von C. chauvoei und C. septicum (modif. nach Al-Khatib, 1969) Merkmale C. chauvoei C. septicum Wuchsform auf Traubenzucker-Blutagar (Zeissler-Agar) Biochemie perlmuttartige, graue weinblattförmige Kolonien mit Hämolysezone Saccharose + - Cellobiose - + Trehalose - + Salicin - +/- Äskulin - + Immunfluoreszenz C. chauvoei + - C. septicum - + Meerschweinchenversuch Leberabklatschpräparat Neutralisation der Letaltoxine mit Antitoxinen von meist einzeln liegende kurze Stäbchen C. chauvoei + - C. septicum + + Rasenbildung, Hämolyse meist lange Ketten FLI 317
319 Abbildung 1: Differenzierung der Spezies Clostridium auf Laktose-Eigelb-Agar Literatur Al-Khatib, G. (1969): Beiträge zur Clostridiendifferenzierung VI. Zur Differenzierung von Cl. septicum und Cl. chauvoei. Arch. exper. Vet. med. 23, Bergey's manual of systematic bacteriology, vol. 2 / Peter H. A. Sneath [Hrsg.]; Mair, Nicholas S. David Hendricks Bergey [Begr.] Baltimore [u. a.] : Williams & Wilkins, ISBN: Köhler, B. (1987): Clostridien-Infektionen und -Intoxikationen. In: Beer, J.: Infektionskrankheiten der Haustiere, 3. Aufl., Teil II, S , VEB Gustav Fischer Verlag, Jena. Kuhnert P, Capaul SE, Nicolet J, Frey J (1996): Phylogenetic positions of Clostridium chauvoei and Clostridium septicum based on 16S rrna gene sequences. Int J Syst Bacteriol. 46(4): Kuhnert P, Krampe M, Capaul SE, Frey J, Nicolet J (1997): Identification of Clostridium chauvoei in cultures and clinical material from blackleg using PCR. Vet Microbiol. 57 (2-3): Schallehn G. (1990): Isolierung und Identifizierung von Clostridien. Zbl. Bakt. 274, Schau, H.-P. (1988): Clostridium. In: Bernhardt, H. u. Knoke, M.: Humanpathogene Anaerobier 1. Aufl., S , VEB Gustav Fischer Verlag, Jena. FLI 318
320 ANHANG 1. Sporenfärbung nach Rakette 1. Präparat lufttrocknen 2. Fixieren, indem das Präparat sechsmal durch die Flamme gezogen wird 3. Objektträger mit 5%iger, wässriger Malachitgrünlösung bedecken Sekunden aufkochen und weitere 30 Sekunden stehen lassen 5. Kräftig abspülen 6. 1 Minute mit 2,5%iger, wässriger Eosinlösung nachfärben 7. Abspülen und abtrocknen Ergebnis: Sporen grün, Bakterienleib rosa 2. Glukose-Blutagar nach Zeissler Nähragar (z. B. Merck, Art. Nr. 5450) mit 2 % Glukose und 10 % Schaf- oder Rinderblut, ph-wert 7,4 3. Glukose-Hefeextrakt-Cystein-Schafblutagar nach Werner Pepton, tryptisch verdaut 10,0 g NaCl 5,0 g Fleischextrakt (Difco) 2,0 g Hefeextrakt (Difco) 5,0 g Cystein-HCl 0,3 g Glukose 2,0 g Bacto-Agar (Difco) 20,0 g Aqua dest. ad 1000,0 ml ph-wert 7,2-7,4 Aufkochen, autoklavieren, 10 % defibriniertes Schaf- oder Pferdeblut zusetzen. Gleichfalls geeignet ist Schaedler-Agar (Becton Dickinson, Bio-Merieux), dem die entsprechende Blutmenge zugesetzt wird. 4. Laktose-Eigelb-Agar Zu 500 ml fertig zubereitetem Columbia-Agar (Oxoid) werden 5 g Laktose zugegeben. Nach Lösen im Dampftopf Abkühlung auf 50 C. Danach Zugabe von 5 ml einer 0,4%igen Bromkresolpurpurlösung und 50 ml Eigelb-Emulsion (Oxoid). Einstellen auf einen ph-wert von 7,4. 5. Leber-Leberbouillon nach Tarozzi Frische Leber von Meerschweinchen, Schwein oder Rind, die von Bindegewebe befreit wurde, in bohnengroße Stücke schneiden, mit der zwei- bis dreifachen Menge Bouillon 30 min im Dampftopf kochen. Nach dem Abkühlen durch Faltenfilter bis zur völligen Klarheit filtrieren. Die zurückbleibenden Leberstückchen spült man unter der Wasserleitung kräftig ab, verteilt sie zu je 2 bis 3 Stück auf Reagenzgläser, übergießt sie mit der dreifachen Menge (8 bis 10 ml) der filtrierten Bouillon (ph-wert 7,4 bis 7,8) und autoklaviert 15 min bei 120 C. FLI 319
321 6. Hirnbreisuspension nach Hibler Frisches Rinder- (Schweine-) Hirn wird von Blut und Hirnhaut befreit. 2 Teile Hirn mit einem Teil physiologischer NaCl-Lösung durch ein Sieb passieren. In Röhrchen zu 8 ml abfüllen. Sterilisieren: 2x 30 min bei 100 C im Dampftopf. 7. Redoxindikatoren 7.1. Methylenblau-Indikator 60%ige Tris-Lösung 4%ige Glukose-Lösung 0,02%ige Methylenblau-Lösung Jeweils als wässrige Lösung, kühl und dunkel aufbewahren. Zum Gebrauch gleiche Teile mischen Resazurin-Indikator 25 mg Resazurin ad 100 ml Aqua dest., 15 min bei 120 C autoklavieren, 3 Monate haltbar. 8. Fermentations-Basis-Medium (Schau, 1988) Trypticase 20,0 g Hefeextrakt 2,0 g NaCl 2,5 g Na-thioglykolat 0,5 g Cystein-Hydrochlorid 0,25 g Na 2 SO 3 0,1 g Aqua dest. ad 1000,0 ml ph-wert 7,2 Jedem Röhrchen mit 5 ml Medium werden 0,5 ml einer 10%igen sterilfiltrierten Lösung des jeweils zu prüfenden Zuckers zugegeben. Nach Beimpfen werden im Anschluss an die Bebrütung 0,1 ml Indikatorlösung hinzugegeben. Indikator: Methylrot 0,1 g, Bromthymolblau 0,3 g, 96%iger Äthylalkohol 300 ml, Aqua dest. 300 ml. Der Farbumschlag des Indikators von Grünblau nach Gelb bzw. Rot zeigt eine Fermentierung des betreffenden Zuckers an. 9. FITC Konjugate für direkten FA-Nachweis von C. chauvoei und C. septicum Bestellung bei: VMRD, Inc. P.O. Box 502 NW 115 State St. Pullman, WAY Tel. (800) Fax (509) Katalog-Er. C. chauvoei FA Konjugat 1 ml CC C. septicum FA Konjugat 1 ml CS FLI 320
322 43. Rifttal-Fieber (RVF) Charakterisierung der Infektion Erreger Das Rifttalfieber-Virus (engl. Rift Valley Fever Virus) ist ein behülltes Einzelstrangvirus mit einem segmentierten RNA-Genom. Es gehört zur Familie der Bunyaviren, Genus Phlebovirus, und tritt nur in einem Serotyp auf. Die drei RNA-Segmente kodieren für die RNA-Polymerase (L-Segment), für die zwei Hüllproteine Gc und Gn (M- Segment), sowie für das Nukleokapsidprotein (S-Segment). Der Erreger ist bisher nur in Afrika sowie auf der arabischen Halbinsel nachgewiesen worden. Die Übertragung dieses vektorübertragenen (vector borne) Virus erfolgt hauptsächlich durch Insekten der Spezies Aedes und Culex Klinische Symptomatik Kennzeichnend für die Erkrankung sind hämorrhagisches Fieber sowie eine hochgradige Leberschädigung. Besonders empfänglich sind Hauswiederkäuer (Schaf, Ziege, Rind), eine Erkrankung dieser Spezies führt zu hohen Abortraten und einer hohen Mortalität bei Neugeborenen. Resistenter gegenüber einer Infektion mit dem Erreger sind ältere, nicht tragende Tiere. Nicht in Afrika beheimatete Rassen oder Stämme bzw. solche, die aus nicht-endemischen Gebieten stammen, scheinen eine höhere Empfänglichkeit aufzuweisen. Die Abortraten bei Kamelen sind vergleichbar mit denen beim Rind, jedoch erkranken Kamele meist klinisch inapparent. Eine Infektion des Menschen mit dem Rifttalfieber-Virus erfolgt durch Kontakt mit infiziertem Material oder durch Insektenstiche. Die Übertragung des Virus auf diesem Wege kommt vor allem in Gebieten mit einer geringen Wiederkäuerbestandsdichte vor. Dort kann die Erkrankung zuerst beim Menschen auffällig werden. Bei Laborpersonal ist es bereits zu schweren Erkrankungen mit Fieber, Hepatitis und Hirnhautentzündung gekommen, weshalb eine Impfung der Labormitarbeiter dringend anzuraten ist Differentialdiagnostik Alle mit Fieber und Symptomen einer Leberschädigung einhergehenden Erkrankungen bei Wiederkäuern. Da solche Virus-Infektionen allerdings bisher noch nicht außerhalb des afrikanischen Kontinentes und der arabischen Halbinsel aufgetreten sind, sollten epidemiologische Zusammenhänge mitberücksichtigt werden Diagnostische Indikation Tierseuchendiagnostik gemäß Tierseuchengesetz Zuständige Untersuchungseinrichtung NRL am FLI, Standort Riems, Telefon: , Telefax: FLI 321
323 Rechtsgrundlagen Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Untersuchungsmaterial Vorsichtsmaßnahmen Da es sich beim Rifttalfieber-Virus um Erreger handelt, die potentiell auch Menschen infizieren können, ist während der Probennahme und der Verarbeitung der Proben bei Verdacht auf RVFV für den Probennehmer ein Schutz vor einer viralen Infektion empfohlen, sofern geimpftes Personal nicht zur Verfügung steht Probenmaterial Für die serologische Untersuchung Nativblutprobe oder Serum Für die virologische Untersuchung Blut (mit Antikoagulans), Organmaterial (v.a. Leber, Milz, Gehirn) Zeitpunkt der Probennahme Der günstigste Zeitpunkt für eine Probennahme bei Verdacht auf eine Infektion mit dem RVFV ist wenige Tage nach der Infektion während der Fieberphase, da sich zu diesem Zeitpunkt IgM-Antikörper serologisch nachweisen lassen und auch eine Virusanzucht am einfachsten gelingt. Eine Organentnahme für die Virusanzucht erfolgt post mortem Probenversand Der Versand von Probenmaterial muss in Sicherheitsbehältern für Erreger der Sicherheitsstufe L3 erfolgen. Blut- und Organproben sollten in gefrorenem Zustand versendet werden Untersuchung Virusnachweis Der Nachweis von Viren kann direkt aus dem eingesendeten Organ-Material im Virus-Neutralisationstest erfolgen. Zur Virusanzucht werden Organverreibungen in Zellkultur (Vero-Zellen, BHK-Zellen, primäre Rinder-oder Schafzellen)gegeben, oder sie können in Hamster oder neugeborenen Mäuse inokuliert werden. Anschließend wird das Virus mittels Immunfluoreszenz von Abklatschpräparaten nachgewiesen. Des Weiteren erfolgt der Nachweis von viraler RNA mittels einer nested-reversen Transkriptase real-time Polymerasekettenreaktion (real time RT-PCR). Hierbei wird die virale RNA des M-Segments oder des S-Segments nachgewiesen. FLI 322
324 Antikörpernachweis Gemäß OIE-Methoden können Antikörper aus infizierten (am besten geeignet: febrile) Seren mittels Virus-Neutralisationstest bereits drei Tage nach der Infektion nachgewiesen werden. Nach ca. sechs bis sieben Tagen gelingt ein Antikörpernachweis mittels ELISA (IgM oder IgG) oder Haemagglutinations-Hemmungstest. Seltener werden eine Immunfluoreszenz, eine Komplementfixierung oder ein Immundiffusionstest durchgeführt. FLI 323
325 44. Rinderpest (analog Pest der kleinen Wiederkäuer) Charakterisierung der Infektion Erreger Die Erreger sind in beiden Fällen Vertreter des Genus Morbillivirus der Familie Paramyxoviridae Klinische Symptomatik Rinderpest (RP) und Pest der kleinen Wiederkäuer (Peste des Petits Ruminants - PPR) sind fatal verlaufende Allgemeinerkrankungen der Hausrinder und -büffel sowie der Schafe und Ziegen. Nach zweiwöchiger Inkubationszeit folgt eine akute Fieberphase, während der eine Prodromal- und eine Erosivphase unterschieden werden können. Die Prodromalphase kann 3 Tage dauern, wobei die befallenen Tiere Fieber zwischen 40 und 41,5 C zeigen sowie Anorexie, Verstopfung und seröse Schleimhaut-Hypersekretion. Zu Beginn der erosiven Phase kommt es zur Entwicklung nekrotischer Maulschleimhautläsionen, die eine spezifische klinische Diagnose der Rinderpest bzw. PPR erlauben. Bei hoch empfänglichen Tieren (z. B. Importtiere) kommen perakute Verlaufsformen vor, die kurz nach der Prodromalphase sofort zum Tod führen. Umgekehrt gibt es schwach virulentes Virus, das nur kurz dauernde und kaum sichtbare Läsionen im Maulbereich verursacht. Hier ist auf keinen Fall eine rein klinische Diagnose möglich Differentialdiagnostik Alle erosiven oder vesikulären Haut- und Schleimhauterkrankungen der Wiederkäuer mit schwerer Störung des Allgemeinbefindens (z. B. hohes Fieber, Festliegen) Diagnostische Indikation Richtlinie 92/119/EWG Zuständige Untersuchungseinrichtung Friedrich-Loeffler-Institut, Institut für Virusdiagnostik, Südufer 10, Insel Riems Rechtsgrundlagen Richtlinie 92/119/EWG Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung FLI 324
326 44.2. Untersuchungsmaterial Untersuchungsmaterial Erregernachweis Gerinnungsgehemmtes Blut eignet sich am besten zur Virusisolierung aus der Leukozytenfraktion. Für die Durchführung der PCR sollte EDTA-Blut als Untersuchungsmaterial verwendet werden. Post mortem sind am besten zur Virusisolierung lymphatische Organe wie Milz oder Lymphknoten geeignet. Transport und Kurzzeitlagerung bei +4 C, Lagerung über lange Zeit bei -70 C Untersuchungsmaterial Antikörpernachweis Nativblut, Serum, mind. 500 µl Untersuchungsgang (NUR DURCH DAS FLI DURCHZUFÜHREN) Erregernachweis Eine Virusanzucht erfolgt am besten in primären Rinder- oder Schafzellen oder in Vero-Zellen. Es entwickelt sich ein typischer zytopathogener Effekt (zpe) wobei das Virus spezifisch durch Immunfluoreszenz oder eine spezifische PCR nachgewiesen wird. Die Polymerase Kettenreaktion (PCR) zum universellen Rinderpest/ PPR-Nachweis und zur Differenzierung von RPV- und PPRV-RNA wurde am Institute for Animal Health, Pirbright, U.K., entwickelt. Die Protokolle und Primer sind am FLI, Insel Riems verfügbar und etabliert. Darüber hinaus wurden verschiedene real-time PCR- Assays zum Genom-Nachweis von PPR etabliert und in internationalen Ringtest in ihrer Funktionalität bestätigt Antikörpernachweis Antikörperuntersuchungen im Rahmen von Importanfragen werden vom FLI durchgeführt. Dafür stehen ein Kompetitions-ELISA sowohl zum Nachweis von PPRV-spezifischen Antikörpern zur Verfügung. Daneben ist der Neutralisationstest (NT) mit Impfvirus möglich (OIE Manual of Standards for Diagnostic Tests and Vaccines, 1996). FLI 325
327 45. Rotz Charakterisierung der Infektion Erreger Burkholderia (B.) mallei ist der Erreger des Rotzes (Malleus, engl. Glanders), einer oft chronisch und seuchenhaft verlaufenden Infektionskrankheit, die primär bei Einhufern aufttritt. Esel, Maulesel und Maultiere sind am empfänglichsten, Pferde, Hunde, Katzen, Kamele und auch Menschen gelten als mittelgradig prädisponiert. Rinder und Schweine sind schwer zu infizieren während Ratten sowie Geflügel praktisch resistent sein sollen. Die Krankheit ist eine Kontaktzoonose und gilt als ansteckend für den Menschen Klinische Symptomatik Rotz tritt in Form knotiger und geschwüriger Entzündungen in der Haut, in der Nasenschleimhaut und in den Lungen auf. Der Erreger wird von Tier zu Tier oder durch Zwischenträger (Futter, Streu, Putzzeug, Geschirr) übertragen. Die Eintrittspforte ist die unverletzte Schleimhaut. Rotz kommt bei Eseln und Maultieren überwiegend in der akuten, bei Pferden überwiegend in der chronischen Form vor. Beim Maultier beginnt der Rotz fast immer mit einer zeitweilig aussetzenden Lahmheit an einem der Hinterbeine. Die Inkubationszeit schwankt von wenigen Tagen bis zu mehreren Monaten. Bei der chronischen Form sind möglicherweise die Erscheinungen nicht erkennbar. Man unterscheidet: Nasenrotz mit geschwürigen Veränderungen auf der Nasenschleimhaut und grünlich-gelbem Ausfluss oft nur auf einer Seite, trotz beidseitiger Entzündung. Hautrotz mit Knoten in der Haut, die geschwürig aufbrechen. Außerdem: Husten und Atembeschwerden (Kehlkopf- und Lungenrotz), zeitweiliges Nasenbluten; der chronische Rotz kann jahrelang bestehen Differentialdiagnostik Bei Nasenrotz: Druse, Pocken, Tuberkulose, traumatische Geschwüre Bei Hautrotz: Lymphangitis epizootica, Lymphangitis ulcerosa, Sporotrichose Bei Lungenrotz: Tuberkulose, Nocardiose, Botryomykose, parasitäre Veränderungen Diagnostische Indikation Handelsuntersuchungen; klinische Symptome, positive serologische Befunde sowie epidemiologisch begründeter Verdacht Zuständige Untersuchungseinrichtungen Staatliche Veterinäruntersuchungsämter sowie NRL am FLI, Standort Jena FLI 326
328 Rechtsgrundlagen Tierseuchengesetz in der jeweils geltenden Fassung Verordnung über anzeigepflichtige Tierseuchen in der jeweils geltenden Fassung Binnenmarkt-Tierseuchenschutz-Verordnung in der jeweils geltenden Fassung RICHTLINIE DES RATES 2009/156EG zur Festlegung der tierseuchenrechtlichen Vorschriften für das Verbringen von Equiden und für ihre Einfuhr aus Drittländern ENTSCHEIDUNG der Kommission 93/623/EWG über das Dokument zur Identifizierung eingetragener Equiden (Equidenpass) Untersuchungsmaterial Gewinnung Beim lebenden Tier erfolgt die serologische Untersuchung von Serum. Der direkte Erregernachweis kann bei akut erkrankten Tieren aus Nasensekret, Lungenauswurf und Hauteiter gelingen, weniger geeignet sind Kot, Genitalausfluss, Harn, Milch, Augensekret, Speichel und Blut. Von frisch verendeten Tieren sollten pathologisch veränderte Organe, insbesondere eitrige Geschwüre und/oder bindegewebige Knoten in Leber, Lunge und Milz sowie den zugehörigen regionalen Lymphknoten untersucht werden Transport und Lagerung Untersuchungsmaterial wird als Biologischer Stoff, Kategorie B UN3373 umgehend vorschriftsmäßig in dicht schließenden Behältnissen entsprechend den Gefahrgutvorschriften für Straße und Eisenbahn (ADR), bzw. im Luftverkehr (IATA- DGR) in der jeweils gültigen Fassung mit Vorbericht und Untersuchungsantrag an die Untersuchungseinrichtung geschickt. Während des Transportes und evtl. notwendig werdender kurzzeitiger Lagerung ist das Material bei Zimmertemperatur aufzubewahren. Bei kontaminiertem Untersuchungsmaterial soll sich eine dreistündige Aufbewahrung dieses Materials in PBS, dem 1000 IE Penicillin/ml zugesetzt wurde, bei 37 C günstig auf die Nachweissicherheit auswirken. FLI 327
329 45.3. Untersuchungsgang Vorsichtsmaßnahmen Burkholderia mallei ist ein Erreger der Risikogruppe 3. Das Arbeiten mit potentiell B. mallei-infiziertem Material und mit B. mallei-kulturen in einer Untersuchungseinrichtung ist genehmigungspflichtig und kann nur in Laboratorien der Sicherheitsklasse 3 durchgeführt werden Erregernachweis Grundsätzlich ist beim Auftreten klinischer Symptome (z.b. Nasensekret, Lungenauswurf, eitrige Hautveränderungen) die Möglichkeit eines direkten Erregernachweises gegeben. Bei chronischem Krankheitsverlauf, der in der Regel ohne klinisch erkennbare Symptome auftritt, gibt es allerdings am lebenden Tier keine sichere Methode, den Erreger direkt nachzuweisen. Eine post mortem Untersuchung von inneren Organen wie Lunge, Leber und Milz auf das Vorhandensein von Rotz-typischen Veränderungen ist in diesem Fall unerlässlich, um den Erreger im veränderten Gewebe zu identifizieren. Der direkte kulturelle Nachweis des Erregers des Rotzes ist schwierig, jedoch als beweisend anzusehen und ist daher in jedem Fall durchzuführen Kulturelle Untersuchung Von den genannten Probenahmestellen werden Objektträger-Ausstrich- oder Abklatschpräparate angefertigt und nach Gram gefärbt. B. mallei ist ein kleines Gramnegatives, stäbchenförmiges Bakterium von 0,5 x 1,5 (bis 4) µm Größe, mit meist abgerundeten Enden. An den Polen fällt eine intensivere Anfärbung auf. Für die Anzucht werden folgende Nährmedien empfohlen: 1. Blutagar mit 3-4% Glycerinzusatz 2. Selektivagar (OIE, 2008; Xie et al., 1980) Mit dem Selektivagar nach Xie et al. (1980) werden Staphylokokken, Steptokokken, Proteus und Escherichia coli im Wachstum gehemmt. Identifizierung: B. mallei bildet nach 48h bis 72 h tautropfenförmige, glatte, durchscheinende runde Kolonien, die bei weiterer Bebrütung einen leicht grau-gelblichen, schleimigfadenziehenden Belag bilden. Hämolyse und Pigmentbildung werden nicht beobachtet. B. mallei in Kultur ist relativ pleomorph, je nach Alter der Kultur variiert seine Größe und Lagerung, in ganz frischen Kulturen ist es kokkoid. Bakterien aus älteren Kulturen sind mitunter keulen- oder knospenförmig und können durch Vakuolen ein körniges Aussehen haben. Sie sind meist einzeln gelagert, in älteren Kulturen sind die Stäbchen länger und täuschen aneinandergelagert mitunter fädige Strukturen vor. FLI 328
330 Verdächtige Kolonien können wie folgt geprüft werden: Wachstumsprüfung auf Ashdown-Agar (Ashdowm 1979) -B. mallei wächst nicht, im Gegensatz zu B. pseudomallei Beweglichkeitsprüfung auf halbfesten Nährmedien - B. mallei ist unbeweglich, B. pseudomallei ist beweglich. Die biochemische Aktivität von B. mallei ist relativ gering. Gelatine wird verflüssigt, Nitrat reduziert, Xylose, Glycin und Arabinose werden hydrolysiert. Bei längerer Kultivierung können sich diese Eigenschaften durch die Bildung von Rauformen eventuell verändern. Kommerzielle Tests für die biochemische Identifizierung von B. mallei sind nicht verfügbar Molekulare Nachweisverfahren (Anhang 1) Der molekulare Nachweis des Erregers aus Gewebeproben und/oder die molekulare Identifizierung von Isolaten ist als beweisend anzusehen und ist daher in jedem Fall durchzuführen. Eine schnelle und zuverlässige Identifizierung von B. mallei ist mit einem 5`-Nuclease Real-Time-PCR-Verfahren möglich (Tomaso et al., 2006). Ebenso wurde eine spezifische konventionelle PCR beschrieben (Scholz et al., 2006). Diese Methoden ermöglichen auch die sichere Unterscheidung von B. mallei und B. pseudomallei, das bei Pferden eine dem Rotz sehr ähnliche Erkrankung (sog. Pseudorotz) hervorrufen kann Serologische Diagnostik Für Einfuhruntersuchungen ist die KBR durchzuführen. Im internationalen Verkehr mit Drittländern gelten die Einfuhrbestimmungen des jeweiligen Landes. Im Manual of Standards For Diagnostic Tests and Vaccines sind die gültigen Testmethoden für den internationalen Handel beschrieben (OIE, 2008). Für Abklärungsuntersuchungen von positiven KBR-Befunden ohne vorherige Malleinisierung wurde am Nationalen Referenzlabor für Rotz ein Westernblot- Verfahren etabliert (Elschner et al., 2011). Das quantitative Verhalten spezifischer B. mallei- Antikörper ist im Krankheitsverlauf vielfachen Schwankungen unterworfen und unterliegt keiner deutlichen Gesetzmäßigkeit. Aus diesem Grunde sind mehrere zeitlich versetzte serologische Untersuchungen zur Diagnosefindung durchzuführen Komplementbindungsreaktion (Anhang 2) Die KBR ist eine sehr sensitive Nachweismethode für Rotz. Bei einer Erkrankung treten ab 12. bis 14. Tag p.i. positive Ergebnisse auf. Infektionen mit Pseudomonaden, besonders B. pseudomallei, sind serologisch nicht sicher von B. mallei- Infektionen zu trennen. Auch Infektionen mit Actinobacillus lignieresi sowie Streptococcus equi oder anderen können zu serologischen Kreuzreaktionen in der KBR führen. Esel und Maultiere zeigen häufiger antikomplementäre Reaktionen in der KBR. FLI 329
331 Weitere serologische Untersuchungsverfahren Für die serologische Bestätigungsdiagnostik wurde am Nationalen Referenzlabor ein Westernblot etabliert (Elschner et al., 2011). Mehrere ELISA-Tests wurden für die Rotz-Diagnostik bereits entwickelt, sind wegen mangelnder Spezifität jedoch für die Routineanwendung nicht zu empfehlen Allergische Diagnostik - Malleintest Der Mallein-Test kann als Option zu serologischen Tests bei antikomplementären Eigenschaften des Probenmaterials dienen, ist als Test für Handelsuntersuchungen im Rahmen der EU-Einfuhrbestimmungen jedoch nicht zugelassen. Der Mallein-Test ist im Vergleich zur KBR weniger sensitiv (Naureen et al., 2007). Eine Vorbehandlung des Tieres kann die Ergebnisse maßgeblich beeinflussen. Ein negativer Mallein-Test bei einem KBR-positiv getesteten Tier schließt eine Infektion mit B. mallei nicht sicher aus. Es ist möglich, dass infolge des Mallein Tests das Tier lange serologisch positiv reagiert. Serologische Nachuntersuchungen werden dadurch beeinträchtigt. Es wird die Verwendung eines allergenfreien Malleins oder Mallein-PPD (purified protein derivative) empfohlen, um eine Sensibilisierung zu vermeiden. Derzeit ist kein zugelassenes Mallein für den Einsatz in Deutschland verfügbar Bewertung der Ergebnisse Positive serologische Befunde in der KBR bedürfen immer einer sofortigen Abklärungsuntersuchung und ziehen 3 Nachuntersuchungen des Tieres im Abstand von 2 bis 3 Wochen nach sich. Serologische Abklärungsuntersuchungen in Verdachts- oder Ausbruchsbeständen sind mindestens 3-mal im Abstand von 2 bis 3 Wochen negativ verlaufen, bevor eine Bestandssperre aufgehoben wird. Positive serologische Befunde in der KBR, die mittels Westernblot bestätigt wurden, sind als beweisend für eine Rotzinfektion anzusehen. Der direkte kulturelle Nachweis und die molekulare Identifizierung des Erregers sind als beweisend für eine Rotzinfektion anzusehen. Da die kulturelle Isolierung von B. mallei aus Geweben eher selten gelingt, ist auch allein der molekulare Nachweis von B. mallei in Geweben als beweisend für eine Rotzinfektion anzusehen. FLI 330
332 Anhang 1 Molekularer Nachweis von spezifischen Gensequenzen des Flagellin-Apparates von Burkholderia mallei nach Scholz et al. (2006) Mastermix-Komponenten: Primer flip-f, flip-r 10µM (siehe Tabelle 1) dntp-mix 10mM (z.b. Eppendorf) Taq-DNA-Polymerase 5U/µl (z.b. Eppendorf) Taq-PCR-Puffer 10 DMSO unverdünnt (p.a.) Wasser HPLC grade Tabelle 1: Primer Nukleotidsequenz 5' 3' flip-f tcaggtttgtatgtcgctcgg flip-r ctaggtgaagctctgcgcgag PCR Mastermix (MM) je Probe (µl) Thermocycler-Programm (Mastercycler Eppendorf) Wasser 12,84 94 C 30s, PCR-Puffer (10 ) 2,00 40 x (94 C 30s, 65 C 30s, 72 C 60 s), 72 C 7min dntp (10mM) 0,80 Primer flip-f (10 µm) 0,60 Primer flip-r (10 µm) 0,60 DMSO 1,00 Taq-DNA-Polymerase (5U/µl) 0,16 Template DNA 2,00 Ergebnis: 989 bp Realtime Polymerase-Kettenreaktion zum Nachweis von Burkholderia mallei-isolaten nach Tomaso et al. (2006) Mastermix-Komponenten: Fertig-Reaktionsmix (z.b. TaqMan Universal MM Applied Biosystems # ) Primer- Stammlösung 100 pmol/µl, Arbeitsverdünnung 1:10 (entspr. 10 pmol/µl) (Sequenzen s. Tabelle 2) Sonde: Vorratslösung 10 pmol/µl bzw. 10 µm herstellen (Sequenzen s. Tabelle 1) DNase-RNase freies Wasser, PCR-Gefäße oder PCR-Platten für Realtime-PCR Tabelle 2: Primer/ Sonde BmafliP-f BmafliP-r Bma-probe Nukleotidsequenz 5'-3' cccattggccctatcgaag gcccgacgagcacctgatt 6FAM-caggtcaacgagcttcacgcggatc-BHQ1 PCR Mastermix (MM) je Probe (µl) Thermocycler-Programm (MX3000) Wasser 9,75 50 C 2min; 95 C 10 min, PCR-Puffer (2 ) 12,50 45 x (95 C 25s, 63 C 60s) Primer flip-f (10 µm) 0,25 Primer flip-r (10 µm) 0,25 Bma-probe (10 µm) 0,25 Template DNA 2,00 FLI 331
333 Anhang 2 Komplementbindungsreaktion (KBR) Empfehlung zur Durchführung der KBR in der Mikro-Methode 1. Materialien und Reagenzien KBR-Malleus- Antigen, zugel. nach 17c TierSG (z. B. Fa. C.c.pro GmbH, Oberdorla, Zul.-Nr.BFAV-B349) Kontrollserum, positiv, zugel. nach 17c TierSG (z. B. Fa. C.c.pro GmbH, Oberdorla, Zul.-Nr.BFAV-B349) Die Verdünnung des o.g. zugelassenen KBR Antigens bezieht sich auf die Verwendung der KBR-Reagenzien der Firma Institut Virion/ Serion GmbH, Würzburg. Kontrollserum, negativ Komplement (Institut Virion/ Serion GmbH, Würzburg). Ampozeptor (Institut Virion/ Serion GmbH, Würzburg). Hammelblut (stabilisierte 1% ige Suspension, Institut Virion/ Serion GmbH, Würzburg). KBR-Puffer (Institut Virion/ Serion GmbH, Würzburg). Mikrotiterplatten Bei der Verwendung kommerzieller KBR Reagenzien ist die Gebrauchsanweisung des Herstellers zu beachten. 2. Durchführung 2.1. Probenvorbereitung Serumproben und Antigen auf Raumtemperatur erwärmen. Vor der Untersuchung sind alle zu untersuchenden Proben einschließlich Kontrollseren im Wasserbad in entsprechender Verdünnung wie folgt zu inaktivieren: Serumverdünnung Tierart Temp. ( C) Zeit (min) 1:5 Pferd :5 Maultier, Maulesel, Esel Verunreinigte und hämolytische Seren sind zur Untersuchung nicht geeignet. FLI 332
334 2.2. KBR-Ansatz In der Tabelle 3 werden die Arbeitsschritte für eine Probe und ein Antigen als Modell dargestellt. Tabelle 3a: KBR-Schritte Proben Tag 1 Arbeitsschritte Well 1 (SK) 2 1:5 3 1:10 4 1:20 : : 10 1: 1. KBR-Puffer (µl) : : : : 2. Serum (µl) : : : : 3. Titration des Serums von 3 nach 10 (verwerfen von 25 µl aus dem Wells 10) 4. Antigen (µl) : : : : 5. Komplement (µl) : : : : Bei der Durchführung des KBR-Ansatzes sind jeweils folgende Kontrollansätze mitzuführen: a. Kontrolle der antikomplementären Wirkung des Serums (Serumkontrolle SK), angesetzt in Well 1: Bewertung : 100 % Hämolyse b. Kontrollen des Antigens KBR-PUFFER: Antigen: Komplement: HS Tag 2: 25 µl 25 µl 25 µl 50 µl Bewertung : 100 % Hämolyse c. Kontrollen des Komplements (nach Herstellerangaben ggf. titrieren) KBR-PUFFER: 50 µl Komplement: 25 µl HS Tag 2: 50 µl Bewertung : 100 % Hämolyse d. Kontrolle des Hämolytischen Systems (HS) KBR-PUFFER: 75 µl HS Tag 2: 50 µl Bewertung : 0 % Hämolyse Abgedeckte Platte 18 bis 24h bei +5 C ± 3 C inkubieren. Tag 2: Platten auf Raumtemperatur erwärmen Herstellung des Hämolytisches System (HS) Verdünnung des Ambozeptors nach Herstellerangaben in KBR-Puffer und Mischen mit der Erythrozytensuspension im Verhältnis 1+1. Inkubation des HS für 30 Minuten bei 37 C im Wasserbad. Vortemperierung der KBR-Platten bei 37 C. FLI 333
335 Tabelle 3b: KBR-Schritte Proben Tag 2 6. HS (µl) : : : : 7. Inkubation bei +37 C ± 1 C im Brutschrank in einer feuchten Kammer. Hämolysekontrolle! Inkubation abbrechen, wenn die Komplementkontrollen mit 2 und 1 Einheiten eine komplette Hämolyse zeigen. 8. Zentrifugation 5 min bei 2000 Upm 3. Auswertung Bei der Ablesung wird unterschieden: 100 % Hämolysehemmung = 4 (++++) 75 % Hämolysehemmung = 3 (+++) 50 % Hämolysehemmung = 2 (++) 25 % Hämolysehemmung = 1 (+) keine Hämolysehemmung = negativ Titerbeurteilung: Gemäß O.I.E. Handbuch (2008) werden die Titer wie folgt beurteilt: Eine Serumprobe in der Verdünnung von 1:5 mit 100 % Hämolyse ist negativ, mit % Hämolyse ist verdächtig ohne Hämolyse ist positiv. Literatur ASHDOWN, L. R. An Improved Screening Technique For Isolation Of Pseudomonas Pseudomallei From Clinical Specimens. Pathology (1979), 11, Pp ELSCHNER MC, SCHOLZ HC, MARTEN P, RASSBACH A, DIETZSCH M, MELZER F, SCHMOOCK G, DE ASSIS SANTANA VL, DE SOUZA MM, WERNERY R, WERNERY U, NEUBAUER H (2011): Use of a Western blot technique for the serodiagnosis of glanders. BMC Vet Res 7,4. NAUREEN, A.; SAQIB, M.; MUHAMMAD, G.; HUSSAIN, M. H., AND ASI, M. N. Comparative evaluation of Rose Bengal plate agglutination test, mallein test, and some conventional serological tests for diagnosis of equine glanders. J Vet Diagn Invest Jul; 19(4): OIE Manual of Standards For Diagnostic Tests and Vaccines, OIE, online-version. SCHOLZ, H. C., M. JOSEPH, H. TOMASO, S. AL DAHOUK, A. WITTE, J. KINNE, R.M. HA- GEN, R. WERNERY, U. WERNERY UND H. NEUBAUER Detection of the reemerging agent Burkholderia mallei in a recent outbreak of glanders in the United Arabic Emirates by a newly developed flip-based PCR assay. Diag. Microbiol. Inf. Dis., 54, TOMASO, H., H.C. SCHOLZ, S. AL DAHOUK, M. EICKHOFF, T.M. TREU, R. WERNERY, U. WERNERY UND H. NEUBAUER Real-time identification of Burkholderia pseudomallei with a 5' nuclease real-time PCR assays using fluorescent hybridization probes. Clin. Chem., 52, XIE X., XU F., XU B., DUAN X. & GONG R. (1980). A New Selective Medium for Isolation of Glanders Bacilli. Collected papers of veterinary research. Control Institute of Veterinary Biologics, Ministry of Agriculture, Peking, China (People s Rep. of), 6, FLI 334
336 46. Salmonellose der Rinder Charakterisierung der Infektion Erreger Die Salmonellose ist eine durch bakterielle Erreger der Gattung Salmonella (S.) verursachte Infektionserkrankung. Sie tritt sowohl bei Tieren als auch beim Menschen auf und stellt weltweit eine der wichtigsten Zoonosen dar. Salmonellen gehören zur Familie der Enterobacteriaceae, der gramnegative, asporogene, peritrich begeißelte oder unbewegliche Arten angehören. Die Gattung Salmonella besteht aus der Spezies enterica und der Spezies bongori. Die Spezies Salmonella enterica wird in 6 Subspezies eingeteilt: S. enterica subsp. enterica, S. enterica subsp. salamae, S. enterica subsp. arizonae, S. enterica subsp. diarizonae, S. enterica subsp. houtenae und S. enterica subsp. indica. Nur für Serovaren, die zu S. enterica subsp. enterica gehören, wurde ein Name festgelegt, der auf den Ort der erstmaligen Isolierung zurückzuführen ist. Der Name der Serovar wird mit großem Anfangsbuchstaben und nicht kursiv geschrieben. Der vollständige Name lautet dann z. B. Salmonella enterica subsp. enterica serovar Typhimurium, als Kurzform wird Salmonella Typhimurium verwendet. Bei Serovaren anderer Subspezies wird nach der Subspezies die entsprechende Antigenformel angegeben. Die Antigenformeln aller Salmonella-Serovaren sind im Kauffmann-White-Schema aufgelistet, zum gegenwärtigen Zeitpunkt sind mehr als 2500 verschiedene Serovaren enthalten. Die größte Bedeutung für die Salmonellose des Rindes in Deutschland besitzen die Salmonella-Serovaren Typhimurium und Typhimurium variatio copenhagen, die an das Rind adaptierte Serovar Dublin, Salmonella Abony (frühere Nomenklatur Salmonella Abortus-bovis) und Salmonella Enteritidis. Zahlreiche andere Serovaren können auch Salmonellosen bei Rindern verursachen, insgesamt ist ihr Anteil jedoch wesentlich geringer Klinische Symptomatik Salmonellosen der Rinder sind perakut bis chronisch oder symptomlos verlaufende zyklische Infektionskrankheiten, die überwiegend bei Kolostral- und Tränkmilchkälbern, bei Jungrindern aber auch bei Kühen um den Zeitraum des Abkalbens auftreten können. Klinische Symptome sind Durchfall, der blutig sein kann, Lungen- bzw. Gelenkentzündungen sowie Aborte ab 7. Trächtigkeitsmonat. Anhaltende latente Infektionen mit symptomloser intestinaler Besiedelung durch den Erreger sind möglich. Die Inkubationszeit variiert in Abhängigkeit vom Alter der Tiere, der Infektionsdosis und der Salmonella-Serovar zwischen 2 bis 8 Tagen Differentialdiagnostik Auszuschließen sind Kolisepsis und Koliruhr der Kälber, Clostridium-perfringens- Enterotoxämien, Pasteurellose, Rotavirus-Infektion der Saugkälber, Brucellose bei Aborten sowie Futtermittelintoxikationen. In allen Fällen sichern erst der Erreger- FLI 335
337 nachweis und der Ausschluss der möglichen anderen Ursachen die Diagnose endgültig Diagnostische Indikation Klinischer, pathologisch-anatomischer oder epidemiologisch begründeter Verdacht Zuständige Untersuchungseinrichtung Staatliche Veterinäruntersuchungseinrichtungen NRL Salmonellose der Rinder am FLI Rechtsgrundlagen Verordnung zum Schutz gegen die Salmonellose der Rinder (Rinder- Salmonellose-Verordnung) in der Fassung der Bek. vom 14. November 1991 (BGBl. I S. 2118) Änderung der Rinder-Salmonellose-Verordnung nach Artikel 2 der Zweiten Verordnung zur Änderung tierseuchenrechtlicher Verordnungen (BGBl. I 2009, S ff. vom 23.Dezember 2009 Nr. 80) Untersuchungsmaterial Kotproben als Einzel- oder Sammelproben. Organproben von verendeten oder getöteten Tieren (Darminhalt, besonders Dickdarmabschnitte, Leber, Milz, Darmlymphknoten). Zur Abklärung von Eintragsquellen und insbesondere von Ausbreitungswegen sollten auch Umweltproben und Umgebungsproben aus dem Stallbereich (besonders geeignet sind dafür auch Sockentupferproben), Futtermittel, Kot oder Organe von anderen Tierarten (Nutztiere, Haustiere, Nagetiere, Wildvögel) untersucht werden. Zur Untersuchung sollte nur frisch entnommenes Material verwendet werden. Das Untersuchungsmaterial soll in einem sterilen und verschlossenen Probenbehälter transportiert werden. Bei der Entnahme sollen Kreuzkontaminationen vermieden werden. Der Probenbehälter muss so eindeutig beschriftet sein, dass die Herkunft und Identität der Proben jederzeit erkennbar ist. Die Transportdauer, d. h. die Zeit von der Gewinnung des Untersuchungsmaterials bis zum Eingang im mikrobiologischen Laboratorium, soll so kurz wie möglich sein und 48 Stunden nicht überschreiten. In Sonderfällen müssen sich Einsender und Laboratorien über den geeigneten Versand verständigen. Dem Untersuchungsmaterial soll ein schriftlicher, vom Einsender unterschriebener, Untersuchungsauftrag sowie Vorbericht beigefügt sein. Weitere Vorgaben zur Probenentnahme und zum Untersuchungsmaterial sind in den Ausführungshinweisen zur Verordnung zum Schutz gegen die Salmonellose der Rinder vom 1. Februar 1972 (B-21.2) enthalten (Nr. 5.1 bis 5.4 zu 3). FLI 336
338 46.3. Untersuchungsgang Mit der Änderung der Rinder-Salmonellose-Verordnung nach Artikel 2 der Zweiten Verordnung zur Änderung tierseuchenrechtlicher Verordnungen (BGBl. I 2009, S ff. vom 23. Dezember 2009 Nr. 80) wurde festgelegt, dass die bakteriologischen Untersuchungen von Probenmaterial aus Rinderbeständen den Anforderungen der ISO-Norm 6579 Anhang D entsprechen müssen. Dazu wurde die Rinder- Salmonellose Verordnung folgendermaßen geändert: In 1 Absatz 2 der Rinder-Salmonellose-Verordnung in der Fassung der Bekanntmachung vom 14. November 1991 (BGBl. I S. 2118) wird nach Satz 1 folgender Satz angefügt: Die bakteriologischen Untersuchungsverfahren nach Satz 1 Nummer 1 und 2 Buchstabe a müssen den Anforderungen der ISO-Norm 6579 Anhang D 1 entsprechen. 1 Die ISO Norm ist im BeuthVerlag GmbH, Berlin, erschienen. Sie ist beim Deutschen Patent- und Markenamt archivmäßig gesichert niedergelegt. Bemerkungen zur Methodik der bakteriologischen Untersuchung Die bakteriologische Untersuchung von Kotproben des Rindes auf Salmonellen wurde bisher auf Grundlage der Ausführungshinweise zur Rinder-Salmonellose- Verordnung vom 1. Februar 1972 durchgeführt. Ein wesentlicher Unterschied zwischen diesen Ausführungshinweisen und der Standard-Methode ISO 6579 Anhang D (Nachweis von Salmonella spp. in Tierkot und Umgebungsproben aus der Primärproduktion) besteht darin, dass bei der ISO-Methode eine Voranreicherung unter Verwendung von gepuffertem Peptonwasser (BPW) erfolgen muss und dass anstelle der beiden flüssigen Selektivanreicherungsmedien nur das modifizierte, halbfeste Rappaport-Vassiliadis-Medium (MSRV) Anwendung findet. Untersuchungsgang nach ISO 6579 Anhang D: Voranreicherung in gepuffertem Peptonwasser (18 ± 2 Stunden bei 37 ± 1 C) Selektive Anreicherung auf MSRV (zweimal 24 Stunden bei 41,5 ± 1 C) Ausstreichen auf XLD (nach ISO 6579 Anhang 2) und zweites Medium nach Wahl Bestätigung nach ISO Natriumhypochloritlösung: durch 1:5 Verdünnung einer 13%igen Stammlösung wird ein Gehalt an aktivem Chlor von 2,6% erreicht. Zum uneingeschränkten Wirksamkeit ist ein Gehalt von mindestens 2% aktiven Chlors notwendig. Daher ist es sehr wichtig, die Lösung mindestens alle 4 Wochen zu erneuern. FLI 337
339 Selektivanreicherung auf halbfestem Rappaport-Vassiliadis-Medium (MSRV): Das halbfeste Medium mit den Hemmzusätzen unterdrückt das Wachstum der Begleitflora und ermöglicht die Vermehrung und das Schwärmen der Salmonellen auf der Oberfläche der Platten. Von der Voranreicherungskultur in gepuffertem Peptonwasser werden 100 µl auf die MSRV-Platten pipettiert und zweimal 24 Stunden bei 41,5 ± 1 C inkubiert. Feste Selektivmedien: Zur Identifizierung der Salmonellen wird Material vom äußeren Rand der Schwärmzone (MSRV) auf festen Selektivmedien mit einer Impföse ausgestrichen. Dabei sollten auf einem Teil der Platten Einzelkolonien entstehen. Die Wahl des Agars hängt wesentlich vom Untersuchungsmaterial und daher von der zu erwartenden Begleitflora ab. Neben dem nach ISO 6579 Anhang D vorgegebenem Xylose-Lysin-Desoxycholat-Agar (XLD) stehen zahlreiche verschiedene Medien als zweites festes Selektivmedium zur Verfügung (XLT4-Agar, Desoxycholat-Citrat- Lactose-Saccharose-Agar, Rambach-Agar). Die Bebrütung erfolgt bei 37 C für 24 bis 48 Stunden. Differenzierung Salmonella verdächtiger Kulturen: Salmonella-verdächtige Reinkulturen werden serologisch und biochemisch (s. o.) mit kommerziellen Salmonella- Antiseren bzw. kommerziellen Testkits weiter differenziert. FLI 338
340 47. Schweinepest (KSP) Charakterisierung der Infektion Erreger Der Erreger der Klassischen Schweinepest (KSP) ist ein lipidumhülltes RNA-Virus des Genus Pestivirus der Familie Flaviviridae. Er ist verwandt mit den für die Virusdiarrhoe des Rindes (BVD) und die Border Disease des Schafes (BD) verantwortlichen Pestiviren. Diese Verwandtschaft ist für die KSP-Diagnostik insofern bedeutsam, als Kreuzreaktionen auftreten, die zu falsch-positiven Laborbefunden führen können. Das KSP-Virus ist in Exkreten infizierter Schweine, in Schlachtkörpern, frischem Schweinefleisch und bestimmten Schweinefleischerzeugnissen relativ stabil. Es lässt sich durch Detergentien, flüssige Lösemittel, Proteasen und gängige Desinfektionsmittel wirksam abtöten Klinische Symptomatik Die KSP ist eine seuchenhaft verlaufende Infektionskrankheit der Haus- und Wildschweine und kann - abhängig von Wirts- bzw. Erregereigenschaften sowie des Infektionszeitpunktes (prä- oder postnatal) - in der akuten, chronischen oder "late onset" Verlaufsform auftreten. Besonders die letzteren beiden Formen bereiten Schwierigkeiten bei der klinischen Diagnose und tragen so in besonderem Maße zur Verbreitung des Virus bei. Die meisten Schweine in einer Herde erkranken an der akuten Form der KSP. Je nach Alter des Tieres, seiner Konstitution und Kondition, kann die akute Infektion entweder transient oder letal verlaufen. Bei der akut-letalen Form sind die Symptome in der Regel ausgeprägter als bei der transienten Form, die mild oder sogar subklinisch verläuft. Die Mortalität ist bei Jungtieren wesentlich höher als bei adulten Schweinen. Die Inkubationszeit der KSP beträgt etwa eine Woche. Die frühen Symptome, besonders der akut-letal infizierten Schweine, bestehen in hohem Fieber, Appetitlosigkeit, Somnolenz, Konjunktivitis und Nasenausfluss (Abb. 1). Im weiteren Verlauf zeigen die kranken Tiere unsichere Bewegungen, Zittern und schließlich eine Hinterhandparese. Charakteristisch ist das hämorrhagische Syndrom: Cyanotische Verfärbungen des Abdomens, der Schnauze und der Ohren sowie der medialen Teile der Gliedmaßen, petechiale bishin zu landkartenähnliche Blutungen in äußerer Haut und Schleimhäuten. Labordiagnostisch sind eine Leukopenie und Thrombozytopenie feststellbar, die bei den akut erkrankten Schweinen bis zum Tode bestehen bleiben. Wenige Schweine, die nach der akuten Infektionsphase weder genesen noch sterben, entwickeln die chronische Form der KSP (Abb. 2). Dieser Krankheitsverlauf ist durch einen protrahierten Verlauf gekennzeichnet. Die klinischen Erscheinungen ähneln denen der akuten Infektion, treten jedoch schwächer in Erscheinung. Die betroffenen Tiere bleiben bis zu ihrem Tode über einen Zeitraum von mehreren Monaten virämisch. Es kommt abwechselnd zu Phasen klinischer Besserung mit nachlassendem Fieber gefolgt von erneuten Krankheitsschüben mit Symptomen wie Anorexie, Fieber, Durchfall, Alopezie und Dermatitis. Die Tiere zeigen deutliche Entwicklungsrückstände und kümmern. In einer betroffenen Herde FLI 339
341 sind sowohl die akut-letale, als auch die transiente Form der KSP zu beobachten. Chronische Formen sind nur selten zu beobachten, wenn eine Infektion in einer Herde lange unerkannt bleibt. FLI 340
342 Das KSP-Virus kann in tragenden Tieren, die nur transient (milde Verlaufsform) erkranken, die Plazentaschranke überwinden und die Feten infizieren (carrier sow syndrome). Abhängig vom Trächtigkeitsstadium kommt es zu embryonalem bzw. fetalem Tod, zu teratogenen Veränderungen unterschiedlichster Art, zur Geburt moribunder oder toter Ferkel, oder zur Geburt gesunder, persistent virämischer Ferkel (Abb. 3). Diese zuletzt genannten Ferkel können über einen Zeitraum von Wochen oder Monaten klinisch unauffällig bleiben, bis sie die Spätform ( late onset disease") der Schweinepest entwickeln. Als einziger klinischer Hinweis wäre ein Wachstumsrückstand (kümmern) gegenüber den Wurfgeschwistern zu nennen. Sie sind gegen das KSP-Virus immuntolerant, bilden keine homologen Antikörper und scheiden permanent KSP-Virus aus. Somit stellen sie eine dauernde Infektionsquelle dar und sorgen für die Verbreitung des Erregers innerhalb der Population. Nach mehreren Wochen oder Monaten verschlechtert sich der Gesundheitszustand solcher Tiere und sie sterben. Die längste Überlebenszeit für persistent infizierte Ferkel ist mit 11 Monaten angegeben worden. Das carrier sow syndrome mit der Folge eines late onset Verlaufes sind zwar seltene Ereignisse, spielen aber in der Epidemiologie der KSP eine Schlüsselrolle, die häufig unterschätzt wird. Abb. 3 Intrauterine Infektion Monate vor Geburt Monate nach Geburt Persistent-virämische Nachkommen Virämie...11 Ak. Aborte Totgeburten Frühsterblichkeit Leitlinien für die Erkennung KSP-verdächtiger Betriebe Die Entscheidung über die Ausweisung eines Betriebs als KSP-verdächtig wird auf der Grundlage folgender Feststellungen, Kriterien und Argumente getroffen: a) klinische Symptome und pathologische Veränderungen bei Schweinen, wobei im Wesentlichen folgende Befunde berücksichtigt werden: Fieber, einhergehend mit erhöhter Morbidität und Mortalität, Fieber, einhergehend mit hämorrhagischem Syndrom, FLI 341
343 Fieber, einhergehend mit neurologischen Symptomen Fieber mit unbekannter Ursache, wobei sich der Gesundheitszustand nach antibiotischer Behandlung nicht gebessert hat Aborte und zunehmende Fruchtbarkeitsstörungen in den letzten drei Monaten kongenitaler Tremor bei Ferkeln, chronisch kranke Tiere Jungtiere mit Wachstumsstörungen (Kümmern), petechiale und ecchymatöse Blutungen, vor allem in Lymphknoten, Nieren, Milz, Harnblase und am Kehlkopf, Infarkt oder Hämatome, vor allem in der Milz, diphteroide Ulcera ( button ulcera ), vor allem nahe der Ileozäkalklappe; b) epidemiologische Befunde, wobei im Wesentlichen die Fälle berücksichtigt werden, in denen: Schweine direkt oder indirekt mit einem Schweinehaltungsbetrieb in Berührung gekommen sind, der nachweislich KSPV-infiziert war, ein Betrieb Schweine geliefert hat, die sich anschließend als KSPV-infiziert herausgestellt haben, Sauen mit Sperma KSP-verdächtiger Eber künstlich besamt wurden, Schweine direkt oder indirekt mit Wildschweinen einer KSP-infizierten Population in Berührung gekommen sind, Schweine in einer Region im Freien gehalten werden, in der die Schwarzwildpopulation mit KSPV infiziert ist, Schweine mit Küchenabfällen gefüttert wurden und der Verdacht besteht, dass diese Abfälle keiner KSPV-abtötenden Behandlung unterzogen wurden, Schweine möglicherweise durch Personen, Fahrzeuge mit Betriebszugang usw. gefährdet wurden; c) serologische Befunde, wobei im Wesentlichen folgende Befunde berücksichtigt werden: serologische Reaktionen infolge einer latenten KSPV-Infektion oder Impfung, Kreuzreaktionen zwischen KSPV- und anderen Pestivirus-Antikörpern, Einzelreagenten Differentialdiagnostik Der Nachweis der Klassischen Schweinepest kann sich vor allem in Zuchtbeständen als schwierig erweisen, in denen die Seuche möglicherweise sehr mild verläuft und daher mit vielen anderen pathologischen Zuständen verwechselt werden kann. Fruchtbarkeitsstörungen und Aborte können sowohl durch Klassische Schweinepest als auch durch Parvovirus-Infektionen, CBPP, Leptospirose und Aujeszky-Krankheit hervorgerufen werden. KSP-bedingtes Abortmaterial lässt sich von abortierten Föten infolge anderer Krankheiten pathologisch nicht unterscheiden. Bei Verdacht auf Infektion des Reproduktionstraktes muss sofort auf Klassische Schweinepest untersucht werden, wenn der betroffene Betrieb (z. B. aufgrund seines Standorts in einem Gebiet mit Schweinepestvorkommen in der Schwarzwildpopulation) seuchengefährdet ist. Die Untersuchung auf Schweinepest muss jedoch in jedem Fall erfolgen, wenn gängige Infektionen des Reproduktionstraktes ausgeschlossen wurden. FLI 342
344 Abhängig vom Zeitpunkt der Infektion des Tieres (pränatal oder postnatal), vom Alter und von der Nutzungsrichtung sind die Folgen und Erscheinungen der KSP unterschiedlich. Diese Unterschiede drücken sich auch in dem differentialdiagnostisch zu berücksichtigenden Spektrum anderer Erkrankungen bei Schweinen aus: 1) Intrauterine Infektionen mit/ohne Missbildungen, Mumifikation, Totgeburt Aujeszkysche Krankheit Parvovirus-Infektion (SMEDI-Syndrom) Cytomegalievirus-Infektion PRRS 2) Zentralnervöse Erscheinungen Aujeszkysche Krankheit Teschen-Talfan-Virusinfektion Tollwut Listeriose 3) Hämorrhagisches Syndrom, Zyanose und/oder Nekrose Afrikanische Schweinepest Porzines Circovirus Typ 2-Infektion PRRS Rotlauf Eperythrozoon-Infektion Pasteurellose Dicumarol-Vergiftung Vitamin K-Mangel 4) Gastrointestinale Erscheinungen bei Ferkeln Transmissible Gastroenteritis Vomiting-and-Wasting-Disease Rotavirus- E. coli-infektion Salmonellosen 5) Bronchopneumonische Erscheinungen Aujeszkysche Krankheit Schweineinfluenza PRRS 6) Apoplektiforme Todesfälle (perakut) Afrikanische Schweinepest Vergiftungen Rotlauf Zuständige Untersuchungseinrichtungen Veterinär- und Lebensmitteluntersuchungsämter der Länder Virustypisierung durch das Friedrich-Loeffler-Institut (Nationales Referenzlabor für Klassische Schweinepest), Südufer 10, D Greifswald-Insel Riems FLI 343
345 Rechtsgrundlagen Verordnung zum Schutz gegen die Schweinepest und die Afrikanische Schweinepest (Schweinepest-Verordnung) Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung Richtlinie 2001/89/EG KSP-Diagnosehandbuch (2002/106/EG) Untersuchungsmaterial Bevor mit der Probennahme in einem seuchenverdächtigen Betrieb begonnen wird, ist ein Grundriss des Betriebs anzufertigen, auf dem die epidemiologischen Untereinheiten eingezeichnet sind. Wenn zu erwarten ist, dass eine Zweitbeprobung notwendig werden könnte, sind die betreffenden Schweine unverwechselbar in einer Weise zu kennzeichnen, dass sie leicht erneut beprobt werden können. Allen Proben müssen bei der Beförderung zum Labor die von der zuständigen Behörde vorgegebenen Formulare beiliegen, die Angaben zur Krankheitsgeschichte der beprobten Schweine sowie über die klinischen Symptome bzw. Sektionsbefunde enthalten. Es sind genaue Angaben über Alter, Kategorie und Herkunftsbetrieb der beprobten Tiere zu machen. Es wird empfohlen, den Standort jedes beprobten Schweins, zusammen mit seinem Einzelkennzeichen zu erfassen Untersuchungsmaterial für den Erregernachweis Der Erregernachweis (virologische Untersuchungen) wird im Falle kranker Tiere empfohlen. Ihr Wert ist in der Regel begrenzt, wenn sie zur Überwachung von Tieren ohne klinische Krankheitsanzeichen angewandt werden. Besteht das Ziel einer umfangreichen Stichprobenuntersuchung jedoch darin, den KSP-Erreger schon in der Inkubationszeit nachzuweisen, so sind Blutproben mit Gerinnungshemmer (z. B. EDTA-Blut) oder Tonsillen das geeignetste Probenmaterial. Zum Nachweis des KSP-Virus, KSPV-Antigens oder KSPV-Genoms bei toten oder schmerzlos getöteten Schweinen sind Proben von Tonsillen, Milz und Lymphknoten (z. B. Ln. retropharyngeum, Ln. parotideum, Ln. mandibulare oder Ln. mesentericum) am besten geeignet. Ferner wird empfohlen, Proben von Niere und Ileum zu entnehmen. Im Falle autolytischer Tierkörper sind ein Röhrenknochen oder das Sternum das geeignetste Probenmaterial. Blutproben sowohl mit als auch ohne Gerinnungshemmer sind in jedem Falle von Schweinen zu entnehmen, die Anzeichen von Fieber oder sonstige Krankheitsanzeichen zeigen Untersuchungsmaterial für den Antikörpernachweis Für den Antikörpernachweis werden Blutproben ohne Gerinnungshemmer (Serumproben) benötigt. In Ausnahmefällen können auch Blutproben mit Gerinnungshemmer (Plasmaproben) untersucht werden Beförderung der Proben Es wird empfohlen, sämtliches Probenmaterial in auslaufsicheren Behältnissen zu transportieren und zu lagern; nicht einzufrieren, sondern bei Kühlschranktemperatur FLI 344
346 zu kühlen; dem Labor so schnell wie möglich anzuliefern; in einem Paket zu befördern, in dem zur Kühlung des Probenmaterials Kühlelemente verwendet werden. Im Falle von Gewebe- oder Organproben wird empfohlen: separat in verschlossenen ordnungsgemäß etikettierten Kunststoffbeuteln zu befördern, die wiederum in größere, feste Behältnisse gepackt werden, die zum Schutz vor Beschädigung und zum Aufsaugen etwa ausfließenden Beutelinhalts mit ausreichend saugfähigem Material ausgekleidet sind; im Interesse des sicheren und schnellen Transports soweit möglich von Fachleuten auf direktem Wege zum Labor befördern zu lassen. Das Äußere der Verpackung muss mit der Anschrift des Empfängerlabors und deutlich sichtbar mit folgendem Vermerk gekennzeichnet sein: Diagnostisches Untersuchungsmaterial. Verderblich. Zerbrechlich. Darf nur im KSP-Diagnoselabor geöffnet werden. Das Empfängerlabor ist im Voraus über den Zeitpunkt und die Art der Probensendung zu informieren Untersuchungsgang Erregernachweis Für den Erregernachweis stehen zur Verfügung die zellkulturelle Virusisolierung zum Nachweis von KSP-Virus, die real-time Polymerase-Ketten-Reaktion (real-time RT-PCR) zum Nachweis von KSP-Virusgenom, der Immunfluoreszenztest (IFT), auch Fluoreszenzantikörpertest (FAT) bezeichnet, zum Nachweis von KSP-Virusantigen, der Antigen-ELISA zum Nachweis von KSP-Virusantigen (Methode, die nicht mehr empfohlen wird). Qualität und Effizienz der von den Untersuchungseinrichtungen angewandten Diagnosemethoden müssen im Rahmen der laborübergreifenden Vergleichtests (KSP- Ringtest), die das Referenzlabor jährlich durchführt, kontrolliert werden Zellkulturelle Virusisolierung Die zellkulturelle Virusisolierung wird zum qualitativen Nachweis von Pestiviren in Untersuchungsmaterial (Leukozyten, Serum, Vollblut, Organanreibungen) eingesetzt und gilt als der Goldstandard der direkten Nachweisverfahren. Das zu untersuchende Material wird auf empfängliche Zellkulturen verimpft. Im positiven Falle vermehrt sich das Pestivirus in der Zellkultur und wird durch eine Immunfärbung nachgewiesen. Die Virusisolierung, die hauptsächlich die Rolle eines Bestätigungstest darstellt, ist am besten zur Untersuchung von Proben kleiner Tiergruppen und weniger zur Überwachung großer Bestände geeignet. Die Virusisolierung ist arbeitsintensiv und zeitaufwendig (Ergebnisse liegen frühestens nach drei Tagen vor). Zwei weitere Zellkulturpassagen können erforderlich sein, um eine kleine Virusmenge in der Probe nachweisen zu können. Bis ein Endergebnis vorliegt, können durchaus 10 Tage vergehen. Autolytische Proben können einen zytotoxischen Effekt auf die Zellkultur haben und den Test entsprechend beeinträchtigen. Bei Primärausbrüchen ist die zellkulturelle Virusisolierung als Referenzmethode zur Bestätigung von Positivbefunden früherer Antigen-ELISA-, PCR- oder IFT-Tests obli- FLI 345
347 gatorisch. Alle KSPV-Isolate aus Primärausbrüchen bzw. Primärfällen in der Wildschweinpopulation müssen im nationalen Referenzlabor einer genetischen Typisierung unterzogen werden. In jedem Falle sind diese Virusisolate für die Virussammlung unverzüglich an das Referenzlabor weiterzuleiten. Ein Arbeitsprotokoll für die zellkulturelle Virusisolierung befindet sich im Anhang I Immunfluoreszenztest (IFT) / Fluoreszenzantikörpertest (FAT) Testprinzip ist der Nachweis von Virusantigen in dünnen Kryostatschnitten von Organproben KSP-verdächtiger Schweine. Das intrazelluläre Antigen wird entweder direkt oder indirekt mit Hilfe eines spezifischen KSP-Antikörpers nachgewiesen. Die im direkten IFT anzuwendenden polyklonalen KSP-Konjugate können mit Unzulänglichkeiten behaftet sein, wie Kreuzreaktionen mit anderen Pestiviren oder zusätzlichem Gehalt an markierten Antikörpern gegen andere Virusarten. Dies erschwert die Diagnosestellung oder kann zu Fehldiagnosen führen. Deshalb sollte nach Möglichkeit auf die Verwendung polyklonaler Konjugate verzichtet werden. Als die bessere Alternative bietet sich für die Routinediagnostik die Anwendung des indirekten IFT mit kommerziell verfügbaren und behördlich zugelassenen Anti-KSPV-monoklonalen Antikörpern an, zumal ein mit polyklonalem Konjugat erhobener Positivbefund ohnehin durch erneutes Anfärben mit einem spezifischen monoklonalen Antikörper zu bestätigen ist. Als Organproben eignen sich Tonsillen, Nieren, Milz, diverse Lymphknoten und Ileum. Bei Wildschweinen kann auch ein Knochenmarkabstrich verwendet werden, falls Organmaterial nicht erhältlich oder autolytisch ist. Der Test lässt sich innerhalb eines Tages durchführen. Da Organproben nur von toten Tieren entnommen werden können, ist der Test für Screeningzwecke nur begrenzt geeignet. Die Zuverlässigkeit der Testergebnisse kann durch unklare Immunreaktionen beeinträchtigt werden, insbesondere, wenn die Erfahrung des Untersuchers noch begrenzt ist oder das Ausgangsmaterial autolytisch war. Ein Arbeitsprotokoll für den IFT befindet sich im Anhang II Real-time Polymerase-Ketten-Reaktion (real-time RT-PCR) Die PCR dient dem Nachweis von Virusgenom in Blut- oder Organproben. Kleine Fragmente viraler RNA werden in DNA-Fragmente transkribiert, die sich durch die PCR zu nachweisbaren Mengen amplifizieren. Da sich mit diesen Tests nur eine Genomsequenz des Virus nachweisen lässt, kann die PCR auch einen Positivbefund ergeben, wenn kein lebensfähiger Infektionserreger mehr vorhanden ist (z. B. in autolytischen Geweben oder Proben von rekonvaleszenten Schweinen). Aufgrund der hohen Sensitivität dieses Verfahrens können mehrere Proben (z. B. 10) gepoolt werden. Die real-time RT-PCR eignet sich sehr gut zur Routineuntersuchung bei einem hohen Probenaufkommen (Massendiagnostik). Zum Erregernachweis in Probenmaterial von Wildschweinen könnte sie die Vorzugsmethode sein, wenn das Material autolytisch ist und die Virusisolierung wegen Zytotoxizität nicht mehr möglich ist. Die real-time RT-PCR lässt sich innerhalb eines Tages durchführen. Sie setzt eine geeignete Laborausrüstung, spezielle Räumlichkeiten und erfahrenes Laborpersonal voraus. Ein Vorteil dieser Methode liegt darin, dass infektiöse Viruspartikel nicht im Labor repliziert werden müssen. Der Test ist hochempfindlich, allerdings kann es auch zu Kontaminationen kommen, die zu falsch-positiven Ergebnissen führen. Strenge Qualitätskontrollen sind daher unerlässlich. Einige real-time RT-PCR- FLI 346
348 Protokolle sind pestivirusspezifisch und machen weitere Bestätigungstests, wie beispielsweise die Sequenzierung des PCR-Produkts, erforderlich. Für die real-time RT-PCR gibt es mehrere adäquate Arbeitsprotokolle, die im Referenzlabor erhältlich sind ELISA zum Antigennachweis KSP-Virusantigen lässt sich mit verschiedenen kommerziell erhältlichen ELISA-Kits bei klinisch kranken Tieren nachweisen. Es dürfen nur vom Referenzlabor geprüfte Chargen zugelassener Antigen-ELISA verwendet werden. Die Sensitivität aller derzeit im Handel erhältlichen Testkits liegt unterhalb der zellkulturellen Virusisolierung. Sie ist höher bei Ferkelblutproben als bei Blutproben adulter Schweine. Wegen der niedrigen Empfindlichkeit sollten nur Proben von verdächtigen Tieren mit klinischen Symptomen oder pathologischen Veränderungen untersucht werden. Der Test ist zur Untersuchung von Tieren ohne klinische oder pathomorphologische Veränderungen ungeeignet. Aufgrund der geringen Sensitivität wird der Antigen-ELISA zum Nachweis von KSP-Virusantigen nicht empfohlen Auswertung der Ergebnisse virologischer Untersuchungen Ein Positivbefund im Antigen- oder Genomtest (PCR, IFT, ELISA) setzt voraus, dass der betreffende Test mit KSP-Virusspezifischen Antikörpern oder spezifischen Primern durchgeführt wurde. War der angewandte Test nicht KSPV-, sondern lediglich pestivirusspezifisch, so muss er mit KSPV-spezifischen Reagenzien wiederholt werden. Bei Primärausbrüchen ist die zellkulturelle Virusisolierung als Referenzmethode obligatorisch. Die Virusisolierung ist auch im Falle positiver IFT-, ELISA- oder PCR- Befunde, die nicht mit klinischen Symptomen oder Läsionen assoziiert sind, sowie in anderen Zweifelsfällen erforderlich. Sekundärausbrüche können bestätigt werden, wenn bei den betreffenden Tieren zusätzlich zu einem epidemiologischen Zusammenhang mit einem bestätigten Seuchenherd oder Seuchenfall klinische Symptome oder Läsionen nachgewiesen wurden und für einen Antigen- oder Genomtest (PCR, IFT, ELISA) ein Positivbefund vorliegt. Ein Primärherd in der Wildschweinpopulation kann nach der Virusisolierung bestätigt werden oder wenn für mindestens zwei Antigen- oder Genomtests ein Positivbefund vorliegt. Jedoch kann die Feststellung von KSP-Virusantigen mittels IFT allein zu einer Bestätigung führen, wenn für KSP sprechende klinische Befunde und Läsionen vorliegen. Weitere KSP-Fälle bei Wildschweinen, bei denen ein epidemiologischer Zusammenhang mit zuvor bestätigten Fällen nachgewiesen wurde, können bestätigt werden, wenn für einen Antigen- oder Genomtest ein Positivbefund vorliegt Antikörpernachweis Bei rekonvaleszenten Schweinen lassen sich schützende neutralisierende Antikörper ab der zweiten Woche post infectionem noch mehrere Jahre nach der Infektion oder sogar lebenslang nachweisen. Antikörper werden sporadisch auch bei moribunden Tieren in der Endphase der Erkrankung festgestellt. Bei einigen chronisch KSPkranken Schweinen sind Antikörper möglicherweise für einige Tage am Ende des ersten Monats post infectionem nachweisbar. Die Halbwertszeit maternaler Antikör- FLI 347
349 per beträgt ungefähr zwei Wochen. Daher sind maternale Antikörper ab dem 3. Lebensmonat in der Regel nicht mehr nachweisbar. Das bedeutet, dass KSPV- Antikörper in über 3 Monate alten Ferkeln auf einen aktiven Immunschutz hinweisen. Der Nachweis von KSPV-Antikörpern in Serum-oder Plasmaproben dient der Untermauerung der KSP-Diagnose in seuchenverdächtigen Betrieben, der Bestimmung der Infektionsdauer bei bestätigten Ausbrüchen sowie der Seuchenüberwachung. Bei erst seit kurzem bestehenden Infektionen sind serologische Nachweisverfahren jedoch nur von begrenztem Wert. Eine geringe Anzahl seropositiver Schweine mit niedrigem Neutralisationstiter deutet auf eine junge Infektion hin (die erst seit zwei bis vier Wochen besteht). Viele Tiere mit hohem Neutralisationstiter legen den Schluss nahe, dass das Virus schon vor über einem Monat in den Betrieb eingeschleppt wurde. Der Standort seropositiver Schweine im Haltungsbetrieb kann ein wichtiger Anhaltspunkt für den Einschleppungsweg sein. Die Befunde der serologischen Untersuchungen müssen jedoch sorgfältig ausgewertet werden, wobei allen Ergebnissen der klinischen, virologischen und epidemiologischen Untersuchungen Rechnung zu tragen ist. In seltenen Fällen können Einzelreagenten zu falsch-positiven serologischen Reaktionen führen. Einzelreagenten können virusneutralisierende Antikörpertiter aufweisen, die vom Grenzfall (die Regel) bis zu stark positiven Befunden reichen. Bei Wiederholungsuntersuchungen können Einzelreagenten einen abnehmenden oder konstanten Titerwert zeigen. Im Allgemeinen manifestieren sich diese falsch-positiven Reaktionen nur bei wenigen, in der Regel älteren Tieren eines Bestands. Die Ursache für diese Reaktionen ist unbekannt. Der Antikörpernachweis kann entweder mit dem Neutralisationstest oder mit dem Antikörper-ELISA durchgeführt werden. Qualität und Effizienz der von den Untersuchungseinrichtungen angewandten serologischen Diagnosemethoden müssen im Rahmen der laborübergreifenden Vergleichtests (KSP-Ringtest), die das Referenzlabor durchführt, regelmäßig kontrolliert werden Neutralisationstest (NT) Der NT dient der Bestimmung der virusneutralisierenden Aktivität der Serumantikörper. Für Screeningzwecke werden die zu untersuchenden Seren zunächst 1:10 verdünnt. Ist eine vollständige Titration zur Bestimmung des Antikörpertiters erforderlich, müssen Serumverdünnungen beginnend mit 1:2 oder 1:5 angesetzt werden. Der NT ist die empfindlichste und zuverlässigste Methode zum Nachweis von KSPV- Antikörpern und wird daher für die serologische Untersuchung sowohl einzelner Tiere als auch ganzer Bestände empfohlen. Mit diesem Test können jedoch auch kreuzneutralisierende Antikörper festgestellt werden, die bei Infektionen mit ruminanten Pestiviren auftreten können. Der NT zum Nachweis von BVDV- und BDV-Antikörpern folgt denselben Prinzipien und wird zur serologischen Differentialdiagnose der KSP angewandt. Pestivirus-Stämme, die in Neutralisationstests verwendet werden, müssen der Empfehlung des Referenzlabors entsprechen. Ein Arbeitsprotokoll für den NT befindet sich im Anhang III. FLI 348
350 Antikörper-ELISA Für den Antikörpernachweis mittels ELISA dürfen nur vom Referenzlabor geprüfte Chargen zugelassener ELISA verwendet werden. Der ELISA gilt als weniger empfindlich als der NT und sollte daher nur zum Screening auf Herdenbasis eingesetzt werden. Nicht alle zugelassenen und im Handel erhältlichen ELISA können zwischen KSP-Virus und anderen Pestiviren unterscheiden. Daher müssen in Zweifelsfällen, positive serologische Befunde im NT abgeklärt werden. Der ELISA muss gewährleisten, dass alle KSP-Infektionen im Rekonvaleszenzstadium (nach Tag 21 post infectionem) erkannt werden, und es sollte möglichst nicht zu Interferenzen durch kreuzreagierende Antikörper gegen Wiederkäuer-Pestiviren kommen Auslegung serologischer Testergebnisse und Differentialdiagnose zur Abgrenzung von Wiederkäuer-Pestivirus-Infektionen (BVD und BD) a) Bei Nachweis eines KSPV-Neutralisationstiters von gleich oder höher als 10 ND 50 oder bei einem positiven ELISA-Befund muss eine differentialdiagnostische Abklärung erfolgen, wenn die KSP nicht schon mit anderen Nachweisverfahren (Erregernachweis) nachgewiesen wurde. Die Proben sind in einem zweiten Untersuchungsgang auf neutralisierenden Antikörper gegen das KSP- Virus und gegen Wiederkäuer-Pestiviren (vergleichende Endpunkt-Titrationen) erneut zu testen. b) Zeigen die vergleichenden Neutralisationstests Antikörper gegen Wiederkäuer-Pestiviren und keine oder weniger als das Dreifache (oder zwei Titerstufen) Antikörper gegen das KSP-Virus, so gilt der KSP-Verdacht als entkräftet, es sei denn, es existieren andere Gründe, die für KSP sprechen. Zeigen die vergleichenden Tests einen Virusneutralisationstiter von gleich oder höher als 10 ND 50 und ist dieser Titer gleich oder höher als die Titer gegen andere Pestiviren, kann die KSP bestätigt werden, vorausgesetzt, in dem betreffenden Betrieb liegen entsprechende epidemiologische Befunde vor. c) Wenn die epidemiologische Untersuchung keinen Seuchenbefund ergab oder wenn die serologischen Ergebnisse unschlüssig sind, müssen so schnell wie möglich weitere serologische und virologische Untersuchungen durchgeführt werden, um den KSP-Verdacht zu bestätigen oder zu entkräften. Kann der KSP-Verdacht mit weiteren Untersuchungen jedoch nicht entkräftet werden (unklare serologische Befunde, negativer Erregernachweis), so werden frühestens zwei Wochen nach den letzten Untersuchungen in dem betreffenden Betrieb weitere Blutproben für serologische Untersuchungen entnommen. d) Im Rahmen dieser weiteren Untersuchungen werden die bereits untersuchten Schweine, d. h. deren zuvor entnommene Proben, erneut einer vergleichenden serologischen Untersuchung unterzogen (Probenpaare), um eine etwaige Serokonversion in Bezug auf KSP oder Wiederkäuer-Pestiviren festzustellen. Lässt sich die KSP aufgrund dieser Untersuchungen nicht bestätigen, so gilt der Verdacht als entkräftet. FLI 349
351 Anhang Im Anhang befinden sich die Arbeitsprotokolle der im Referenzlabor durchgeführten Tests, die nicht kommerziell erhältlich sind. Es handelt sich um Protokollvorschläge, die entweder so in die Routinediagnostik übernommen werden können oder als Referenzmethode zur Validierung der eigenen Hausmethoden geeignet sind. Sollte mit den Hausmethoden unbefriedigende Ergebnisse in dem jährlich durchgeführten KSP-Ringtest erzielt werden, wird empfohlen, die hier aufgezeigten Arbeitsprotokolle zu übernehmen. Für Fragen und Hilfestellung bei der KSP-Diagnostik steht das Referenzlabor jederzeit zur Verfügung. Anhang I Zellkulturelle Virusisolierung Die zellkulturelle Virusisolierung wird zum qualitativen Nachweis von Pestiviren in Untersuchungsmaterial (Leukozyten, Serum, Vollblut, Organanreibungen) eingesetzt. Das zu untersuchende Material wird auf empfängliche Zellkulturen verimpft. Im positiven Falle vermehrt sich das Pestivirus in der Zellkultur und wird durch eine Immunfärbung nachgewiesen. Probenaufarbeitung Gewinnung von Leukozyten Die Leukozytenfraktion wird bevorzugt aus EDTA-Blutproben gewonnen. Dafür wird wie folgt verfahren: EDTA-Blutprobe (5 bis 10 ml) mit 1 ml Dextransulfatlösung versetzen und nach vorsichtigem Schwenken etwa 1 bis 2 Stunden bei Raumtemperatur (alternativ 30 Minuten bei 37 C) stehen lassen. In dieser Zeit setzen sich die Erythrozyten ab. Den leukozytenhaltigen milchig-trüben Überstand absaugen und für 10 Minuten bei 2000g zentrifugieren. Das Sediment wird nach zweimaligem Waschen in je 5 ml Ca-Mg-freier phosphatgepufferter Salzlösung (PBS-minus) in 2 ml Kulturmedium aufgenommen. (Jedem Waschschritt folgt ein Zentrifugationsschritt für 10 Minuten bei 2000g.) Die konzentrierte Leukozytensuspension dient als Inokulum für die weiteren Arbeitsschritte. Für den späteren Gebrauch kann das Material bei 70 C gelagert werden. Herstellung von Organhomogenisaten (Organanreibungen) Circa 1 g schwere Organteilchen (z. B. aus Milz, Lymphknoten, Tonsille, Niere etc.) werden mit der Schere fein zerkleinert und mit der neunfachen Menge Kulturmedium und dem Zehnfachen der üblichen Konzentration an Antibiotika in einem Mörser zusammen mit sterilem Seesand verrieben. Nach einstündiger Einwirkung des Antibiotikums bei Raumtemperatur wird die Organsuspension für 15 Minuten bei 2500 g zentrifugiert. Der Überstand dient als Inokulum für die weiteren Arbeitsschritte. Für den späteren Gebrauch kann das Material bei 70 C gelagert werden. FLI 350
352 Serumgewinnung Blutproben ohne gerinnungshemmenden Zusatz werden für 15 Minuten bei 1300g zentrifugiert. Das Serum dient als Inokulum für die weiteren Arbeitsschritte. Für den späteren Gebrauch kann das Serum bei 20 C gelagert werden. Inokulation der Zellkulturen Jeweils 0,1 bis 0,3 ml des zu untersuchenden Materials (Leukozytensuspension, Organanreibung, Serum) wird auf eine ein bis zwei Tage alte PK15-Zellkultur im Doppelansatz inokuliert (1. Passage). Die Zellen können in Makrotiterplatten, Kulturflaschen oder Kulturröhrchen gezüchtet werden. In jedem Test wird zusätzlich eine Zellkontrolle mitgeführt. Bei der Zellkontrolle wird statt Untersuchungsmaterial Kulturmedium eingesetzt. Vor der Inokulation der Zellkulturen wird das Kulturmedium verworfen. Nach der Inokulation bildet das Inokulum einen dünnen Film auf dem Zellrasen. Nach einer ein- bis zweistündigen Adsorptionszeit wird das Inokulum verworfen, der Zellrasen einmal mit Medium oder PBS-minus gewaschen und anschließend mit Kulturmedium versorgt. Die Zellkulturen werden mindestens 2 maximal 5 Tage bei 37 C inkubiert. Während dieser Zeit werden die Zellkulturen regelmäßig mikroskopiert um auftretende zytopathische oder zelltoxische Effekte zu beobachten. Die Makrotiterplatten können anschließend einer Immunfärbung unterzogen werden, die Kulturflaschen bzw. Kulturröhrchen werden bei -70 C eingefroren, um eine weitere Passage durchzuführen. Für die zweite Passage werden tiefgefrorene Kulturröhrchen zügig aufgetaut und für 5 Minuten bei 500g zentrifugiert. Je 0.2 ml des Überstandes werden in 2 Vertiefungen einer 48-Loch- Makrotiterplatte mit einen Tag alten Zellkulturen inokuliert (am Vortag die Platte vorbereiten!). Vor der Inokulation der Makrotiterplatte wird das Kulturmedium verworfen. Nach der Inokulation bildet das Inokulum einen dünnen Film auf dem Zellrasen. Nach einer ein- bis zweistündigen Adsorptionszeit wird das Inokulum verworfen, der Zellrasen einmal mit PBS-minus oder Zellkulturmedium gewaschen und anschließend mit Kulturmedium versorgt. Die Platten werden 2 bis 4 Tage im CO 2 -Schrank bei 37 C inkubiert. Immunreaktion Fixation Das Kulturmedium wird abgesaugt und der Zellrasen einmal mit 1/3 PBS-minus gewaschen. Flüssigkeitsreste müssen gründlich abgesaugt werden. Durch Inkubation für 2h in einem Trockenschrank bei 80 C wird der Zellrasen fixiert. Nach dem Abkühlen der Platten erfolgt die Immunfärbung. Wenn die zu untersuchenden Platten nicht sofort weiter bearbeitet werden können, besteht die Möglichkeit sie kurzfristig (<1 Woche) bei 4 C und längerfristig (>1 Woche) bei 20 C zu lagern. FLI 351
353 Immunfärbung Die Immunfärbung kann direkt mit einem geprüften Pestiviruskonjugat durchgeführt werden. Alternativ besteht die Möglichkeit, indirekt mit einem monoklonalen Antikörper, der an das KSP-Virus bindet und einem Anti-Maus-Peroxidase-Konjugat, das an den monoklonalen Antikörper bindet, zu arbeiten. Die fixierten Platten werden vor der Zugabe des Konjugates oder des monoklonalen Antikörpers mit 1/3 PBS-minus angefeuchtet und anschließend ausgeklopft. a) Direkte Methode Zugabe von 150 µl pro Vertiefung (48-Loch-Platte) eines KSP-Konjugates in der entsprechenden Gebrauchsverdünnung. Inkubation für 1 Stunde bei 37 C in einer feuchten Kammer. Die Gebrauchsverdünnung des Konjugates wird vom Hersteller mitgeteilt. b) Indirekte Methode Pro Vertiefung (48-Loch-Platte) 150 µl eines geeigneten monoklonalen Antikörpers, in der Gebrauchsverdünnung zugeben und 1 Stunde bei 37 C in einer feuchten Kammer inkubieren. Der Antikörper wird in Waschpuffer verdünnt. Anschließend 3x mit Waschpuffer waschen. Danach erfolgt die Zugabe von 150 µl eines vorab getesteten Anti-Maus-Peroxidase- Konjugates und die Inkubation für 1h bei 37 C. Das Konjugat wird in Waschpuffer verdünnt. Anschließend 3x mit Waschpuffer und danach 1x mit Aqua bidest waschen. Farbreaktion Nach der Immunreaktion erfolgt die eigentliche Färbung der Zellen mittels Chromogen/Substratlösung. Es werden 150 µl Chromogen/Substratlösung pro Vertiefung zugegeben und bei Raumtemperatur im Dunkeln für ca. 15 bis 25 Minuten inkubiert, danach entfernt und ca. 300 µl Aqua bidest zugegeben. Die Chromogen/Substratlösung muss immer frisch aus Stammlösungen hergestellt werden Auswertung Das Zytoplasma antigenhaltiger Zellen färbt sich braunrot an. Jede einzelne Kavität der Platte wird mittels Umkehrmikroskop ausgewertet. Dabei gilt eine Kavität bereits als infiziert, wenn das Zytoplasma nur einer Zelle spezifisch gefärbt ist FLI 352
354 Anhang II Immunfluoreszenztest (IFT) Methodische Empfehlungen Es wird empfohlen, in der Labordiagnostik der KSP nach Möglichkeit auf die Verwendung polyklonaler Konjugate zu verzichten und solange monoklonale Konjugate nicht auf dem Markt sind - den indirekten IFT mit monoklonalen Antikörper (mak) anzuwenden. Organproben Organproben (Tonsille, Milz, Lymphknoten, Niere, Ileum) werden in einer Größe von ca. 10 mm x 10 mm x 5 mm in flüssigem Stickstoff oder in auf ca. -70 C herabgekühltem n-heptan schockgefrostet. Die Lagerung der Organproben erfolgt bei ca. -70 C. Fixierung der Kryostatschnitte Etwa 5 µm dicke Kryostatschnitte werden luftgetrocknet (ca. 30 min). Die Fixierung erfolgt in auf ca. -20 C vorgekühltem Azeton für 15 bis 20 min bei ca. -20 C. Fixierte Kryostatschnitte können mehrere Monate bei ca. -20 C gelagert werden. Nachweis des KSP-Virusantigens mit dem indirekten IFT In einem Prüfansatz werden bearbeitet: 1. Schnitte von verdächtigen Organproben, 2. Schnitte von Organproben eines KSPV-freien Schweines ( = negative Kontrollen), 3. Schnitte von KSPV-positiven Organproben ( = positive Kontrollen). In jedem Prüfansatz kommen zur Anwendung: 1. Anti-KSPV-mAk, 2. irrelevanter mak. Protokoll Alle folgenden Schritte erfolgen bei Raumtemperatur. Waschen der fixierten Kryostatschnitte in PBS für 5 min Blockierung mit 5 % bovinem Serumalbumin (BSA) in PBS für 30 min Kurz waschen in PBS Inkubation mit mak in vom Hersteller empfohlener Arbeitsverdünnung in PBS für 60 min Waschen in PBS: 3 x 5 min Inkubation mit FITC-markiertem Sekundärantikörper (Anti-Maus-Ig-FITC- Konjugat) in empfohlener Arbeitsverdünnung für 60 min: Verdünnung in PBS und Zusatz des Kontrastfarbstoffes Evans blue (3 Teile Konjugat-Arbeitsverdünnung + 1 Teil 0,005 % Evans blue in PBS). Waschen in PBS: 3 x 5 min Waschen in Aqua dest. für mindestens 5 min FLI 353
355 Lufttrocknung bis zum feuchten Glanz Eindecken der noch leicht feuchten Schnitte mit PPBS-Glycerol-Gemisch (1 Teil PBS + 9 Teile Glycerol) oder DABCO-Fluoreszenzerhaltungs-Puffer Mikroskopische Beurteilung der Schnitte Für die mikroskopische Beurteilung der Schnitte ist ein aufrechtes Mikroskop mit Auflichtfluoreszenz erforderlich. Die Fluoreszenzeinrichtung sollte mit einer Quecksilberdampf-Kurzbogenlampe HBO 100 W ausgerüstet sein. Die Beurteilung der Schnitte erfolgt im exakten Vergleich mit den negativen und positiven Kontrollschnitten. KSP-Virusantigen-positive Zellen zeigen zytoplasmatische, weitgehend homogene, leuchtende hellgrüne Fluoreszenz. Die Zellkerne bleiben dunkel ausgespart. Virusantigen kann in verschiedenen Zellarten vorliegen, insbesondere in Zellen der lymphatischen Gewebe (lymphatische Keimzentren, diffuses lymphatisches Gewebe, außerdem im Kryptenepithel der Tonsillen, weiße und rote Milzpulpa), in Epithelzellen, in Zellen des roten Knochenmarkes. Je nach Intensität des Befalls und dem Stadium der Infektion findet man entweder nur einzelne, im Gewebsverband eingestreute oder zahlreiche bis sehr viele Zellen mit spezifischer Fluoreszenz. Im positiven Fall können alle untersuchten Organproben oder nur einzelne Proben befallen sein. Die Kontrastfärbung mit Evans blue führt zu einer allgemeinen rötlich-bräunlichen Färbung und überdeckt geringe unspezifische Fluoreszenzerscheinungen. Nichtzytoplasmatische Fluoreszenzen oder gelbgrün- und gelb-granuläre, zellgebundene Fluoreszenzerscheinungen sind als unspezifisch zu betrachten. Degenerierte Zellen und Zelltrümmer zeigen oft hellgrüne bis gelbgrüne unspezifische Fluoreszenz. FLI 354
356 Anhang III Neutralisationstest Der Neutralisationstest (NT) wird zum qualitativen und quantitativen Nachweis von neutralisierenden Antikörpern gegen Pestiviren (KSPV, BVDV, BDV) durchgeführt. Probenaufarbeitung Der Neutralisationstest wird routinemäßig mit Serum durchgeführt. In Ausnahmefällen, wenn kein Serum zur Verfügung steht oder wenn spezielle Fragestellungen zu beantworten sind, kann der Test auch mit Plasma, Fleischsaft oder Körperhöhlenexudaten durchgeführt werden. Serum wird aus Blutproben ohne gerinnungshemmenden Zusatz gewonnen. Dafür werden die Blutröhrchen für 15 Minuten bei 1300 g zentrifugiert. Das Serum, das sich oberhalb des Blutkuchens absetzt, wird abpipettiert und portioniert (1- bis 2-ml- Portionen). Wenn die zu untersuchende Serumprobe nicht sofort verarbeitet werden kann, wird sie kurzfristig (<1 Woche) bei 4 C und längerfristig (>1 Woche) bei -20 C gelagert. Plasma wird auf gleiche Weise aus Blutproben mit gerinnungshemmenden Zusätzen gewonnen und bearbeitet. Neutralisationsschritt Verdünnungsreihen Der Test wird in einer 96-Loch-Mikrotiterplatte unter Verwendung von Zellkulturmedium mit Antibiotikazusatz durchgeführt. Es wird eine Serumverdünnungsreihe in 2-er- Stufen (z. B. von 1:5 bis 1:640) mit je einem Volumen von 50 µl pro Kavität hergestellt. Pro Serumverdünnungsstufe werden zwei Kavitäten (Doppelansatz) nebeneinander beschickt. Die Verdünnung von 1:5 erhält man, indem man 80 µl Kulturmedium mit 20 µl Serumprobe in der ersten Vertiefungsreihe mischt. In alle anderen Kavitäten werden 50 µl Kulturmedium vorgelegt. Mit einer Multikanalpipette werden aus der ersten Verdünnungsstufe (1:5 Verdünnung) 50 µl aufgenommen, in die nächste Reihe gegeben, durchmischt, und die Verdünnungsreihe fortgesetzt (8 bis 12 Verdünnungsstufen). Die letzten 50 µl werden verworfen. Jede Kavität enthält jetzt 50 µl einer Serum-Medium-Verdünnung. Mindestens zwei positive Referenzseren (Seren mit bekanntem Titer) werden in gleicher Weise als Kontrollen mitgeführt (positive Serumkontrollen). Die Neutralisationstiter der Kontrollseren sollten bei einem Serum unter 100 ND 50 und bei dem anderen über100 ND 50 liegen Testvirus In jede Kavität werden danach 50 µl mit 100 KID 50 der Testvirussuspension gegeben. Die Testvirussuspension muss unmittelbar vor Gebrauch mit Kulturmedium auf 100 KID 50 /50 µl (2000 KID 50 /ml) eingestellt werden. Die benötigte Menge an Testvirus (ca. 5 ml pro Mikrotiterplatte) ist in einem Ansatz herzustellen. Der Verdünnungsfaktor um die Testvirussuspension auf 100 KID 50 /50 µl einzustellen wird rechnerisch ermittelt. Ein Rechenbeispiel ist im Anhang IV zu finden. Kontrollen FLI 355
357 Neben den schon erwähnten positiven Serumkontrollen werden eine Zellkontrolle, eine Viruskontrolle und eine Rücktitration des Testvirus mitgeführt. Als Zellkontrolle werden mindestens 6 Kavitäten mit 100 µl Kulturmedium beschickt. Sie enthalten kein Serum und kein Virus. Im weiteren Verlauf werden sie mit Zellen beschickt. In jedem Test wird außerdem eine Rücktitration des Testvirus zur Bestimmung der eingesetzten KID 50 durchgeführt. Mit der Rücktitration kontrolliert man den tatsächlichen Virusgehalt im Test. Hierbei wird die im Test eingesetzte Virusverdünnung in Log-2- Schritten beginnend bei 1:10 bis 1:1280 ausverdünnt. Die Verfahrensweise ist wie bei der Serumverdünnung. 180 µl Kulturmedium werden vorgelegt, 20 µl Testvirussuspension dazugegeben (1:10) und anschließend ausverdünnt. Pro Verdünnungsstufe werden vier Kavitäten nebeneinander mit 100 µl Virusverdünnung beschickt. Neutralisation Die Mikrotiterplatte inkubiert daraufhin für mindestens 1 bis maximal 2 Stunden bei 37 C in einer feuchten Umgebung in einem CO 2 -Schrank (5 % CO 2 ). Während dieser Zeit findet der Neutralisationsprozess statt. Nach der Inkubationszeit werden in jede Kavität 100 µl der entsprechenden Zellsuspension hinzugefügt. Die Zelldichte muss so eingestellt sein, dass nach 24 Stunden ein konfluenter Zellrasen entsteht. Die Mikrotiterplatte verbleibt für 72 bis 96 Stunden zur Inkubation bei 37 C in einer feuchten Umgebung im CO 2 -Schrank (5 % CO 2 ). Die weiteren Schritte der Immunreaktion (Fixation, Immunfärbung, Farbreaktion) erfolgen wie bei der zellkulturellen Virusisolierung beschrieben. Auswertung Das Zytoplasma antigenhaltiger Zellen färbt sich braunrot an. Jede einzelne Kavität der Mikrotiterplatte wird mittels Umkehrmikroskop ausgewertet. Dabei gilt eine Kavität bereits als infiziert, wenn das Zytoplasma nur einer Zelle spezifisch gefärbt ist. Falls in allen Verdünnungsstufen das Virus neutralisiert wurde und so der Neutralisationstiter nicht errechnet werden kann, wird von dem Ausgangsserum eine 1:100- Verdünnung hergestellt und der Neutralisationstest in 2-er-Verdünnungstufen von 1:100 bis 1:12800 wiederholt. Der Rücktitrationstiter des Testvirus sollte idealerweise 100 KID 50 betragen, mit einer Schwankungsbreite zwischen 40 und 660 KID 50. Der Titer der mitgeführten Kontrollseren sollte nicht mehr als eine Verdünnungsstufe ober- oder unterhalb des Erwartungswertes liegen. Die Zellkontrolle muss negativ sein. Der Neutralisationstiter wird als der Kehrwert der Serumverdünnung bestimmt, bei der in einer von zwei Vertiefungen (50 %) das Virus neutralisiert wurde. Der Titer wird als neutralisierende Dosis 50 (ND 50 ) angegeben. Ein Titer, der zwischen zwei Verdünnungsstufen liegt, wird als der Durchschnittswert zwischen diesen zwei Stufen angegeben. FLI 356
358 Anhang IV Geräte und Materialien Makrotiterplatten (24- oder 48-Loch-Platten) Mikrotiterplatten (96-Loch-Platten) Kulturröhrchen oder Kulturflaschen Mehrkanalpipetten, Pipetten, sterile Plastikspitzen Empfängliche Zelllinien vom Schwein für die zellkulturelle Virusisolierung (z. B. PK15 Zellen, Bezugsquelle Zellbank der BFAV) Zellkulturen für den Neutralisationstest, z. B.: PK15 Zellen für den KSP-NT; MDBK Zellen für den BVD-NT; SFT Zellen für den BD-NT (Bezugsquelle: Zellbank der BFAV) Zellkulturmedien (Bezugsquelle: kommerzielle Hersteller) Testviren für den Neutralisationstest (Bezugsquelle: Referenzlabor) Spezifische monoklonale Antikörper gegen Pestiviren (Bezugsquelle: kommerzielle Hersteller) Peroxidasemarkierte Anti-Maus-Antikörper (Bezugsquelle: kommerzielle Hersteller) Positive Kontrollseren (Bezugsquelle: Referenzlabor) Standardmäßige Laborausstattung für ein Viruslabor (Sterilwerkbank, Umkehrmikroskop, CO 2 -Schrank (37 C), Zentrifuge, Inkubator (80 C), Kühlschrank, Kühltruhe (-20 C, -70 C). Reagenzien Antibiotikalösung 1,25 g Penicillin 2g Streptomycin In 20 ml sterilem Aqua bidest lösen, portionieren und bei 20 C einfrieren 1 ml Konzentrat reicht für 1 L Medium Zehnfache Menge Konzentrat für Organanreibungen Waschlösung: PBS-minus/Tween (Phosphat-gepufferte Salzlösung ohne Calcium- und Magnesium-Ionen mit Tween) ph 7,0-7,2 nach Dulbecco u. Vogt (1954): 80,00 g NaCl 2,00 g KCl 14,24 g Na 2 HPO 4 x 2 H 2 O 2,00 g KH 2 PO 4 ad 10,0 L Aqua bidest. 0,1 ml Tween-20 pro 1000 ml PBS-minus 1/3PBS-minus 1 Teil PBS-minus Gebrauchslösung, 2 Teile Aqua bidest FLI 357
359 Dextransulfatlösung 7,5 g NaCl 15 g EDTA 300 mg Streptomycin 200 mg Penicillin ad 1000 ml Aqua bidest. In 100 ml dieser Lösung werden 5 g Dextransulfat (Mol.-Gew ) gelöst Chromogen/Substratlösung Angaben für 2 Mikrotiterplatten Angaben für 2 Mikrotiterplatten: 9,00 ml 0,05 mol/l Natriumazetatpuffer, ph 5,0 1 ml AEC-Lösung (3-Amino-9-Ethylcarbazol) 0,10 ml H 2 O 2 3%ig Herstellung der AEC-Lösung 6 mg AEC in 1,5 ml DMF (Dimethylformamid) langsam lösen, nicht schütteln (Menge reicht für 3 Mikrotiterplatten). Die AEC-Lösung kann in dunklen Flaschen bei Kühlschranktemperatur mehrere Monate gelagert werden. Achtung, AEC ist kanzerogen! (Laborhandschuhe tragen, nicht mit Metallspatel abwiegen!) Rechenbeispiel zur Berechnung des Verdünnungsfaktors für das Testvirus: Die im Neutralisationstest zum Einsatz kommende Virussuspension (Testvirus) soll einen Titer von 100 KID 50 /50 µl haben. Folglich muss das hochtitrigere Ausgangsvirus entsprechend verdünnt werden. Die Berechnung des Verdünnungsfaktors erfolgt nach der Formel: Titer log 10 KID 50 /0,1ml Ausgangsvirus minus * = log 10 Virusverdünnung; entlogarithmieren! Reziproker Wert = Virusverdünnung. Beispiel: Der Titer des Ausgangsvirus beträgt 10 6,3 KID 50 / ml. Das sind 10 5,3 KID 50 /0,1ml. Berechnung: 10 5,3-10 2,3 = 10 3 Entlogarithmierung 3,0 log 10 = 1000 Das Ausgangsvirus muss 1 : 1000 in Kulturmedium verdünnt werden. (* 10 2,3 = 200 KID 50 pro 0,1 ml) FLI 358
360 48. Stomatitis vesicularis Charakterisierung der Infektion Erreger Die Stomatitis vesicularis wird durch verschiedene Viren aus der Gruppe der Vesiculoviren der Familie Rhabdoviridae ausgelöst Klinische Symptomatik Es handelt sich um eine fieberhafte Allgemeinerkrankung der Pferde, Rinder und Schweine. Sie führt nach kurzer Inkubationszeit (ca. 1 Tag) zur Bildung von Bläschen (Aphthen) und Erosionen an kutanen Schleimhäuten und unbehaarten Teilen der Haut, insbesondere im Bereich des Maules und der Klauen, die nicht von denen bei der Maul- und Klauenseuche zu unterscheiden sind. Sie kommt nur auf dem amerikanischen Kontinent vor und verläuft meist gutartig, d. h. die Tiere genesen nach 3 bis 5 Tagen. Sie wird durch direkten Kontakt sowie Küchenabfälle und wahrscheinlich durch Insekten übertragen. Als Virusreservoire werden in den USA Wildtiere, Nager und Insekten vermutet. Es wurden Infektionen von Menschen mit grippeähnlichen Symptomen beschrieben Differentialdiagnostik Fieberhafte Allgemeinerkrankungen bei den empfänglichen Tieren, die mit der Bildung von Aphthen und Erosionen an kutanen Schleimhäuten und unbehaarten Teilen der Haut einhergehen, insbesondere Maul- und Klauenseuche und SVD Diagnostische Indikation Seuchenverdacht, Export-/Import-Untersuchungen Zuständige Untersuchungseinrichtung Friedrich-Loeffler-Institut, Insel Riems, Südufer 10, Greifswald, Tel Rechtsgrundlagen Verordnung über anzeigepflichtige Tierseuchen in der jeweils gültigen Fassung FLI 359
361 48.2. Untersuchungsmaterial Da die Diagnose außer beim Pferd stets als Differentialdiagnose zur Maul- und Klauenseuche gestellt werden muss, sind die für diese Krankheit genannten Proben zu ziehen. Beim Schwein sind ggf. zusätzlich die für die SVD relevanten Proben einzusenden. Der Nachweis von infektiösem VS-Virus (VSV) bzw. VSV-Antigen gelingt am sichersten in Aphthenlymphe sowie Aphthendeckenmaterial frischer Aphthen. Bei deren Fehlen können auch Probangproben oder Rachentupfer von Schweinen eingesandt werden. Außerdem sind Blutproben zur Untersuchung auf Antikörper einzusenden. Die Labordiagnose erfolgt wegen der Differentialdiagnose MKS stets am FLI, Insel Riems. Für die Einsendung gilt sinngemäß das für MKS beschriebene Verfahren Untersuchungsgang (NUR DURCH FLI DURCHZUFÜHREN) Erregernachweis Der Virusnachweis erfolgt in Zellkultur. VSV erzeugt einen CPE in VERO-Zellen, BHK-Zellen sowie IBRS2-Zellen. Der Antigen-ELISA (ELISA-Kit aus dem IAH, Pirbright) kann durchgeführt werden mit Aphthenflüssigkeit, Aphtendecken und Zellkulturüberständen. Er wird in Verdachtsfällen stets mit der Virusanzüchtung kombiniert Antikörpernachweis Der Antikörpernachweis wird mittels Neutralisationstest (NT) geführt und benötigt 3 Tage. FLI 360
362 49. Taura-Syndrom Charakterisierung der Infektion Erreger Das Taura-Syndrom (TS) wird durch das Taurasyndromvirus (TSV) verursacht Klinische Symptomatik Hauptwirte für das TSV sind Weiße (Litopenaeus vannamei) und Blaue (L. stylirostris) Pazifische Shrimps. Empfängliche sind alle postlarvalen Entwicklungsstadien (Mortalitäten bis über 90 %). Klinik akute Phase: Rötungen an Schwanzfächer und Pleopodien marginale Nekrosen der Uro- und Pleopodien Erweichung des Außenskeletts Konzentration der Tiere an Oberfläche und Rand der Teiche Klinik transiente Phase: multifokale, irreguläre braunschwarze Läsionen der Kutikula keine Klinik während der chronischen Phase Die Inkubationszeit beträgt 7 bis 10 Tage. Das Virus kann lebenslang persistieren Rechtsgrundlagen Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (ABl. EU Nr. L 328 S. 14) Fischseuchenverordnung und Verordnung zur Änderung der Verordnung über anzeigepflichtige Tierseuchen vom 24. November 2008 (BGBl. I S. 2315) Verdächtige Fälle sind zuerst mittels RT-PCR zu überprüfen. TS-Freiheit kann deklariert werden, wenn im Verlaufe von 2 Jahren kein positiver Befund mehr erhoben wurde. Bestätigung von Erstausbrüchen in Betrieben zugelassener Gebiete erfolgt durch eine der unten genannten Methoden zum Erregernachweis. FLI 361
363 49.2. Labordiagnostischer Nachweis Das Virus befällt vor allem epitheliales und lymphohämatopoietisches Gewebe sowie die Antennendrüsen. Der labordiagnostische Nachweis kann mit folgenden Methoden erfolgen: Mikroskopische Untersuchung Infektion juveniler spezifisch-pathogenfreier Tiere Erregernachweis: Immunhistochemie (IHC) RT-PCR (lymphoides Gewebe, Kieme, Hämolymphe) Genomsequenzierung Western Blot (Hämolymphe) In-situ-Hybridisierung (ISH) Weiterführende Informationen unter: OIE-Manual of Diagnostic Tests for Aquatic Animals: FLI 362
364 50. Tollwut Charakterisierung der Infektion Erreger Das Tollwutvirus gehört zur Familie der Rhabdoviridae, Gattung Lyssavirus und dort dem Genotyp 1(Tollwutvirus) an. Das Wirtsspektrum umfasst alle Säugetierarten und den Menschen. Als Hauptreservoire fungieren vor allem Wildtiere wie der Rotfuchs (Europa, Asien), der Polarfuchs (Europa, Asien, Nordamerika), das Stinktier (Nordamerika), der Waschbär (Nordamerika), der Mungo und der Schakal (Afrika), aber auch der Hund (Afrika, Asien). Als tollwutähnliche ('rabies related') Viren der Gattung Lyssavirus gelten die Genotypen 2 bis 6. Für das europäische Fledermausvirus werden die Genotypen EBL1 und EBL2 (European Bat Lyssavirus) unterschieden. Das Wirtsspektrum der European Bat Lyssaviren umfasst derzeit fast ausschließlich insektivore Fledermäuse (Europa). Spill-over Infektionen auf andere terrestrische Tierarten sind bislang sehr selten. Tollwutvirus-Isolate von drei Menschen und einem Steinmarder zeigten allerdings ein für EBL Viren typisches Muster bei der Charakterisierung mit monoklonalen Antikörpern sowie beim Vergleich Nucleoproteinspezifischer RNA-Sequenzen. Ein 1996 in australischen Flughunden isoliertes Virus (Pteropid Bat Virus) wurde als neuer Genotyp eingeordnet. Virus Serotyp Genotyp Wirtsspektrum Verbreitung Lyssavirus I I Wild- & Haustiere, hämatophage und insektenfressende Europa, Amerika, Asien, Afrika Fledermäuse (Nord-, Südamerika), Mensch Lagos Bat-Virus II II fruchtfleischfressende Afrika Fledermäuse Mokola-Virus III III Spitzmäuse, Katzen, Afrika Hunde, Mensch Duvenhage IV IV fruchtfleischfressende Afrika Fledermäuse EBL 1* V insektenfressende Europa Fledermäuse EBL 2* VI insektenfressende Europa Fledermäuse ABL** VII Insektenfressende Flughunde, Mensch Australien Legende: EBL = EBL = European Bat Lyssavirus, ABL = Australian Bat Lyssavirus FLI 363
365 Klinische Symptomatik Die Inkubationszeit variiert zwischen 3 Wochen bis mehreren Monaten. Bei der rasenden Wut zeigen sich folgende klinischen Symptome: Wesensveränderungen, Hypersensibilität, Aggressivität, Paralysen, Lähmungen, Speicheln, Unterkieferlähmung, Erstickungsanfälle, Festliegen. Bei der sogenannten stillen Wut gehen die Anfangssymptome schnell in Lähmungen über, ohne dass dabei Anzeichen von Hypersensibilität und Aggressivität auftreten. Die Tiere leiden unter Krämpfen und Lähmungen. Die Erkrankung führt immer zum Tod. Beim Menschen sind Aerophobie und Hydrophobie prognostisch. Bei Fledermäusen sind hauptsächlich Lähmungen und Orientierungslosigkeit beschrieben worden, aber auch aggressive Wut Differentialdiagnostik Es sind alle ZNS-Erkrankungen insbesondere Aujeszkysche Krankheit, Bornasche Krankheit, Toxoplasmose, Listeriose, Kochsalzvergiftung beim Schwein, Fuchsenzephalitis etc. einzubeziehen. Weitere möglichen Differentialdiagnosen finden sich in Beer, J. Infektionskrankheiten der Haustiere, 1987, Gustav Fischer Verlag Jena, pp Diagnostische Indikation Differentialdiagnostische Abklärung bei Tieren mit zentralnervösen Störungen bei klinischem oder epidemiologisch begründetem Verdacht Anforderungen aus der Humanmedizin, z. B. Tierbisse, Kontakte im In- und Ausland, Verbringen von Tieren in bestimmte Länder, Ein- und Ausfuhr, Begleitung von Surveillance- und Bekämpfungsprogrammen Zuständige Untersuchungseinrichtung Veterinäruntersuchungsämter der Bundesländer, Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit (nationales Referenzzentrum für Tollwut, WHO Collaborating Centre for Rabies Surveillance and Research) Rechtsgrundlagen Tollwutverordnung vom 11. April /258/EG: Entscheidung des Rates vom 20. März 2000 zur Bestimmung eines spezifischen Instituts, das für die Aufstellung der Kriterien für die Normung der serologischen Tests zur Kontrolle der Wirksamkeit der Tollwutimpfstoffe verantwortlich ist Amtsblatt Nr. L 079 vom 30/03/2000 S BERICHTIGUNG FÜR: 2000/258/EG: Entscheidung des Rates vom 20. März 2000 zur Bestimmung eines spezifischen Instituts, das für die Aufstellung der Kriterien für die Normung der serologischen Tests zur Kontrolle der Wirksamkeit der Tollwutimpfstoffe verantwortlich ist Amtsblatt Nr. L 231 vom 13/09/2000 S FLI 364
366 50.2. Untersuchungsmaterial Untersuchungsmaterial Erregernachweis Gehirnmaterial (Ammonshorn, Cerebellum, Pons oder Medulla oblongata); Speicheldrüsen (Parotis) sind nur in Ausnahmefällen zu empfehlen (Fehlen von Gehirnmaterial) und bieten keine ausreichende diagnostische Sicherheit; Menge: ca. 1cm 3 Versand: Tierkörper, bei Organmaterial in 50 % Glycerin (Anlage) o. tiefgefroren (Trockeneis), (detaillierte Angaben in Ausführungshinweisen zur Tollwut-Verordnung vom 22. April 2001). Ca. 1,0 ml Serum; zur Kontrolle von Impfmaßnahmen bei Wildtieren (orale Immunisierung des Fuchses) mindestens 0,5 ml Brusthöhlen- u. Bauchhöhlentranssudat (nicht älter als 3 Tage post mortem) Untersuchungsgang Direkter Erregernachweis Antigennachweis mittels direkter Immunfluoreszenztest (IFT) Herstellung der Präparate Es ist darauf zu achten, dass soweit möglich, jeweils stets ein Gewebestück vom Ammonshorn, Cerebellum sowie Pons oder Medulla oblongata von einem Tier auf einem Objektträger (OT) untersucht wird!! gut Weizenkorn-großes Gewebestück mittels Skalpellspitze oder Pinzette entnehmen und unter leichtem Druck auf fett- und fluoreszenzfreien OT unter mäßigem Druck mehrmals tupfen, so dass ein etwa Pfennig-großes Präparat entsteht (vorgefertigte OT benutzen) Präparate lufttrocknen. Fixieren durch Hitze (1- bis 2-mal leicht durch die offenen Flamme eines Bunsenbrenners ziehen) oder 30 min in -20 C Aceton. Direkte Immunfluoreszenz Färben mit kommerziell erhältlichem FITC-Antitollwut-Konjugat (Gebrauchsverdünnung lt. Hersteller, vorzugsweise hergestellt mit polyklonalen Antikörpern und mit Zusatz von Evans Blue, Konjugate auf der Basis monoklonaler Antikörper können bei atypischen Tollwutvirusvarianten, wie sie in Deutschland nachgewiesen wurden, zu falsch negativen Ergebnissen führen!!) Inkubation lt. Gebrauchsanweisung des Herstellers, OT 2x 5 min mit Tollwut(TW)-Puffer, ph 7,8, bzw. mit dem vom Hersteller empfohlenen Puffer waschen, spülen in Aqua dest., Präparat lufttrocknen, Eindecken der Präparate in isotonischen Phosphatpuffer (IP) -Glycerol (9:1) Fluoreszenzmikroskopie bei mindestens 300-facher Vergrößerung, mäanderförmige Durchmusterung aller drei Gewebeproben. FLI 365
367 Virusisolierung in der Zellkultur Die Virusisolierung in der Zellkultur sollte bei allen IFT-fraglichen Befunden sowie auch bei IFT-negativen Befunden mit humaner Exposition durchgeführt werden. Da die Virusisolierung in der Zellkultur eine gleiche bzw. höhere Sensitivität als der Mausinokulationstest aufweist, sollte dies die Methode der Wahl sein. Vorbereitung des Untersuchungsmaterials Herstellung einer 20%igen Gehirnsuspension in Anzuchtmedium, 30 min bei 4 C absetzen lassen, zentrifugieren bei UpM für 10 min, Überstand kurzfristig bei 4 C aufbewahren, längere Lagerung bei -70 C, nicht bei -20 C! Zellen (Na42/13) in einer Konzentration von 2 x 10 6 Zellen/ml in Dextran- Gebrauchslösung, 0,5 ml Zellsuspension mit 0,5 ml Überstand mischen. 30 Minuten bei 37 C und 5 % CO 2 inkubieren, dazwischen 2- bis 3-mal die Zellen vorsichtig aufwirbeln, Zellsuspension abzentrifugieren, Zellpellet in 10 ml Anzuchtmedium aufnehmen und 8 ml in Gewebekulturflasche (T25) und 2 ml in 6er bzw. 24er-well- Platte für IFT-Kontrolle aussäen, Inkubation 3-4 Tage bei 37 C und 5 % CO 2, IFT-Kontrolle. Mitführen einer Negativ- und Positivkontrolle. Positive Kontrolle: Zellkultur, beimpft mit positivem Untersuchungsmaterial mit bekanntem Virusgehalt in einer Konzentration, die das Auszählen der fluoreszierenden Zellen bzw. Zellgruppen erlaubt (Sensitivitätskontrolle). Immunfluoreszenztechnik Medium absaugen, zweimal mit TW-Puffer spülen, einmal mit 80%igem Aceton spülen, Fixierung in 80%igem Aceton für 30 min bei 4 o C, trocknen, Lage markieren, Färben mit kommerziell erhältlichem Konjugat, für 30 Minuten bei 37 C in feuchter Kammer, zweimal mit TW-Puffer spülen, einmal mit Aqua bidest. erneute Zugabe von Aqua bidest, 10 min bei Raumtemperatur stehen lassen, Fluoreszenzmikroskopie bei ca. 300-facher, im Zweifelsfall bei 400-facher Vergrößerung, Auswertung des gesamtem markierten Bereiches Mausinokulationstest Der Mausinokulationstest (MIT) sollte aus Gründen des Tierschutzes in jedem Fall durch die Virusisolierung in der Zellkultur abgelöst werden. Die Virusisolierung in der Zellkultur bietet bei zumindest gleicher Sensitivität entscheidende arbeitstechnische Vorteile. Vorbereitung des Untersuchungsmaterials Gehirne möglichst steril entnehmen, Herstellung einer 20%igen Gehirnsuspension unter Antibiotikazusatz, 30 min bei 4 C absetzen lassen, zentrifugieren bei UpM für 10 min, FLI 366
368 Überstand kurzfristig bei 4 C aufbewahren, längere Lagerung bei -70 C, nicht bei -20 C! Tiermaterial Saugmäuse (z. B. NMRI) 1 bis 3 Tage alt (hochtragende Muttertiere sollen bis 48 h nach Aufstallung werfen, Wurfgröße i.d.r. 6 bis 12 Saugmäuse pro Muttertier). Applikation bis max. 3 Tage p.p. 0,03 ml pro Saugmaus i.c. nach beschriebener Methodik applizieren, bei wertvollem Untersuchungsmaterial auf 2 gleichstarke Würfe verteilen, separate Boxen je Wurf Applikation mit Tuberkulinspritze mit 1/100 Teilstrichen bzw. Kanülen von 0,5 x 16 mm Nach dem Auftreten von Krankheitssymptomen schmerzloses Töten aller Saugmäuse (Achtung arbeits- und Infektionsschutz!) Spezifitätskontrolle Die Diagnose Tollwut kann beim MIT nicht allein durch die Beobachtung klinischer Symptome gestellt werden! Sie muss durch die Untersuchung der Mäuse in mindestens einem der folgenden Tests ergänzt werden: Antigennachweis mittels direkter Immunfluoreszenz Virusisolierung in der Zellkultur Virustypisierung Die Virustypisierung kann sowohl anhand von Gehirnabklatschpräparaten als auch nach Anzucht in der Zellkultur erfolgen ( bzw ). Die Virustypisierung sollte aufgrund der Bekämpfungsfortschritte bei der Tollwut durch die orale Immunisierung der Füchse vorzugsweise am FLI durchgeführt werden Indirekte Immunfluoreszenz Abklatsch, fixieren 30 min in -20 C oder 4 C Aceton Auftragen von monoklonalen Antikörpern (mak1, mak2, mak4) 60 min bei 37 C in feuchter Kammer inkubieren, zweimal 5 min mit Tollwut(TW)-Puffer waschen, spülen in Aqua dest., Färben mit kommerziell erhältlichem FITC-Anti-Maus-Konjugat (Gebrauchsverdünnung lt. Hersteller) 60 min bei 37 C in feuchter Kammer inkubieren, zweimal 5 min mit Tollwut(TW)-Puffer, ph 7,8, bzw. mit dem vom Hersteller empfohlenen Puffer waschen, spülen in Aqua dest., Präparat lufttrocknen, Eindecken der Präparate in isotonischen Phosphatpuffer (IP) -Glycerol (9:1) Fluoreszenzmikroskopie bei mindestens 300-facher Vergrößerung. FLI 367
369 Indirekter Erregernachweis Bei der Tollwut kann der indirekte (serologische) Erregernachweis allein nicht zur Diagnose Tollwut führen. Der Rapid Fluorescence Focus Inhibition Test (RFFIT) ist eine fluoreszenzserologische Methode zur Bestimmung von neutralisieren Antikörpern gegen Tollwut. Der Test wird im Zusammenhang mit der oralen Immunisierung der Füchse gegen Tollwut als eine Methode zur Überprüfung des Impferfolges im Rahmen von Impfkampagnen in Fuchspopulationen benutzt. Seren von Füchsen sollten zur Verwendung im RFFIT nicht älter als 3 Tage sein! Der Fluorescence Antibody Virus Neutralization Test (FAVN) ist für die postvakzinale Bestimmung von neutralisierenden Antikörpern im Rahmen prophylaktischer Impfungen von Hunden bzw. Katzen gegen Tollwut bei der Einfuhr in tollwutfreie Länder (z. B. Skandinavien) von der O.I.E. vorgeschlagen RFFIT Ausführung (Kurzfassung): Virusvermehrung aus Masterstockvirus (Laborstamm CVS 11) auf BHK 21 C13 oder BHK 21-BSR/ P5 88-Zellen in Zellkulturflaschen (Dichte Zellen/ml), Virusernte erfolgt, wenn das Virus etwa zu 100 % abgegeben wurde (IFT- Kontrolle), Überstand abgießen, ph-wert auf 7,6 bis 7,8 einstellen, Zentrifugation bei UpM für ca. 10 Minuten, Titration des Arbeitsvirus auf Mikrotiterplatten (Vierfachansatz), Bestimmung des Virustiters nach Kärber, Portionierung zu 0,5 ml, Lagerung bei -80 C (Masterstock). Einstellen der Virusgebrauchsverdünnung auf 40 infizierte Zellen nach vorheriger Bestimmung, Serum von Nativblutproben (keine EDTA-Plasmaproben); Inaktivierung in Serumverdünnung (1:10 in EM) für 30 Minuten bei 56 C im Wasserbad oder Heizblock, Zentrifugation bei 3000 UpM für 10 min, Test- und Referenzseren (kalibriertes Positiv- Negativserum) in log2-schritten in Mikrotiterplatte oder Röhrchen im Doppelansatz weiterverdünnen (50 µl Endvolumen), Zugabe eines äquivalenten Volumens (50 µl) der Virusgebrauchsverdünnung, Inkubation für 90 min bei 37 C und 5 % CO 2, Herstellen der Zellsuspension kurz vor Ablauf der Inkubationszeit (1x 10 6 Zellen/ml) in Anzuchtmedium (AZM), Zugabe von 100 µl Zellsuspension/well, kurz schütteln. nach vorheriger guter Durchmischung (Plattenschüttler, 5 sec) 10 µl des Virus- Serum-Zell-Gemisches der Mikrotiter- oder Verdünnungsplatte auf die äquivalenten Vertiefungen einer Terasakiplatte übertragen, nach Übertragung einer Verdünnungsreihe erneut schütteln, Virus- und Zellkontrolle mitführen, Platten für 24 Stunden bei 37 C und 5 % CO 2 in einer feuchten Kammer inkubieren. Terasakiplatte 1x vorsichtig mit TW-Puffer spülen, anschließend mit Aceton (80 %) 30 min bei 4 C fixieren, trocknen, FLI 368
370 Zugabe von 10 µl eines FITC-Antitollwut-Konjugates (Gebrauchsverdünnung lt. Hersteller), 30 bis 60 min in feuchter Kammer inkubieren, anschließend zweimal mit TW-Puffer und einmal mit Aqua dest spülen, fluoreszenzmikroskopische Ablesung des Tests, Bestimmung des nak-titers nach Kärber (Grenzwert > 1:60) oder Umrechnung in internationale Einheiten (Grenzwert > 0,5 IU/ml) FAVN Ausführung (detaillierte Beschreibung im O.I.E. Manual of Standards): Virusvermehrung aus Masterstockvirus (Laborstamm CVS 11) auf BHK 21 C13 oder BHK21-BSR/P5 88-Zellen in Zellkulturflaschen (Dichte Zellen/ml), Virusernte erfolgt, wenn das Virus etwa zu 100 % abgegeben wurde (IFT- Kontrolle), Überstand abgießen, ph-wert auf 7,6 bis 7,8 einstellen, Zentrifugation bei UpM für ca. 10 Minuten, Titration des Arbeitsvirus auf Mikrotiterplatten (Vierfachansatz), Bestimmung des Virustiters nach Kärber, Portionierung zu 0,5 ml, Lagerung bei -80 C (Masterstock). Einstellen der Virussuspension auf 100 KID 50 /0,05 ml, Serum von Nativblutproben (keine EDTA-Plasmaproben); Inaktivierung unverdünnt oder in Serumverdünnung (1:3 in Medium, PBS) für 30 Minuten bei 56 C im Wasserbad oder Heizblock, Zentrifugation bei 3000 UpM für 10 min, Test- und Referenzseren (WHO-Standardserum, O.I.E.-Hundeserum, kalibriertes Positiv- Negativserum) in log3-schritten in Mikrotiterplatte im Vierfachansatz weiterverdünnen (50 µl Endvolumen) Zugabe der Virusgebrauchsverdünnung (50 µl), Inkubation für 60 min bei 37 C und 5 % CO 2, Herstellen der Zellsuspension kurz vor Ablauf der Inkubationszeit (4x 10 5 Zellen/ml) in Anzuchtmedium, Zugabe von 50 µl Zellsuspension/well, kurz schütteln, auf einer Mikrotiterplatte Virus- (Virustitration), Zell-, Positiv- und Negativkontrollen sowie Standardreferenzseren im Vierfachansatz mitführen, Platten für 48 Stunden bei 37 C und 5 % CO 2 inkubieren, Mikrotiterplatte vorsichtig spülen, anschließend mit Aceton (80 %) 30 min bei Raumtemperatur fixieren, trocknen 1 h bei RT, Zugabe von 50 µl eines Tollwut-Konjugates (Gebrauchsverdünnung lt. Hersteller), 30 bis 60 min inkubieren, anschließend 2x mit TW-Puffer und 1x mit Aqua dest spülen, fluoreszenzmikroskopische Ablesung des Tests (alles oder nichts), Bestimmung des nak-titers nach Kärber, Umrechnung in internationale Einheiten (Grenzwert > 0,5 IU/ml). FLI 369
371 ELISA Anmerkungen: Die bislang kommerziell erhältlichen ELISA-Tests sind ausschließlich für die Anwendung in der Humanmedizin entwickelt worden. Zwar können mit auf Staphylokokkenprotein A basierenden ELISA-Testsystemen in begrenztem Maße auch andere Tierarten auf das Vorhandensein von Antikörpern gegen das Tollwutglycoprotein untersucht werden, bei bakterieller Kontamination kann es jedoch zu fehlerhaften Ergebnissen kommen. Für die postvakzinale Antikörperbestimmung (Hund, Katze,...) werden ELISA- Ergebnisse international nicht anerkannt. Für epidemiologische Fragestellungen bei Tieren (Begleituntersuchungen zur oralen Fuchsimpfung) stehen derzeit keine ELISA-Tests zur Verfügung. Die Benutzung kommerziell verfügbarer ELISA bedarf für derartige Zwecke vorab einer eingehenden Optimierung (Verwendung von Antispezies-Konjugaten) und Validierung des Testsystems. FLI 370
372 Anlagen Zelllinien: Virusisolierung: Na42/13 (Mausneuroblastomzellen) RFFIT & FAVN: BHK 21 C13 (Baby Hamster kidney) BHK 21-BSR/P5 88 Bezugsquelle: FLI Insel Riems, Zellbank für Zelllinien in der Veterinärmedizin, Dr. Riebe Medien: Medien Zelllinie BHK 21 C13 (BHK21-BSR/P5 88) Anzuchtmedium: 90 % Dulbecco Eagle MEM w/l-glut. 10 % Fetales Kälberserum (FKS) 1 % Antibiotika Antibiotika: Amphotericin B (250 µg/ml) Penicillin ( IE/l), Streptomycin (100 mg/l) oder Gentamycin (50 mg/ml) Erhaltungsmedium: 98 % Dulbecco Eagle MEM w/l-glut. 1 % FKS 1 % Antibiotika Medien Zelllinie Na 42/13: Anzuchtmedium: 90 % Eagle MEM mit Earle s Salts 10 % Fetales Kälberserum (FKS) 1 % Antibiotika Antibiotika: Penicillin ( IE/l), Streptomycin (100 mg/l) oder 50 mg/l Gentamycin Erhaltungsmedium: 98 % Eagle MEM mit Earle s Salts 1 % FKS 1 % Antibiotika FLI 371
373 Puffer, Lösungen, Reagenzien Dextran-Stammlösung: 0,50 g DEAE-Dextran in 100 ml PBS (Hanks) lösen, sterilfiltrieren, ca. 4 Wochen bei 4 C haltbar Dextran-Gebrauchslösung: 0,2 ml Dextr.-SL in 25 ml AZM Tollwut-Puffer: 1,72 g Na2HPO4 x 2 H 2 O + 0,50 g KH 2 PO 4 + 7,20 g NaCl ad ml Aqua bidest, ph 7,8 PBS (Hanks ): 9,86 g Hanks + 0,35g NaHCO 3 ad ml Aqua bidest, ph 7,2 Isotonischer Phosphatpuffer: 8,28g NaCl + 3,30g Na 2 HPO 4 x 12 H 2 0 ad ml Aqua bidest (IP) ph 7,8 IP-Glycerol: IP - Glycerol = 9 : 1 Anti-Tollwutkonjugate: mak1, 2, 4 Centocor fitc anti-rabies [Centocor, Inc.(monoklonal-mix)] Anti-Tollwut-Serum [Behring (polyklonal)] Anti-Tollwut [SIFIN (polyklonal)] Anti-Tollwut-FITC [Bioveta (polyklonal)] Diagnostic Pasteur über die BFAV zu beziehen FLI 372
374 51. Transmissible Spongiforme Enzephalopathie (Scrapie) Charakterisierung der Infektion Erreger Scrapie ist eine infektiöse neurodegenerative Erkrankung der Schafe und Ziegen. Sie wurde erstmals in England 1732 beschrieben und ist heute vermutlich weltweit verbreitet, lediglich Australien und Neuseeland gelten als Scrapie-frei. Ätiologisch wird sie der Gruppe der TSE/Prionenerkrankungen zugeordnet, die durch Ablagerungen des pathologischen Prion-Proteins im Zentralen Nervensystem erkrankter Tiere gekennzeichnet ist. Neben der klassischen Scrapie sind zudem atypische Scrapiefälle bekannt die vorwiegend Einzeltiere mit geringer genetischer Scrapie-Empfänglichkeit betrifft Klinische Symptomatik (Schafe, Ziegen) Klinische Symptome von Scrapie sind zu Beginn neurologische Veränderungen (verändertes Verhalten in der Herde, Angsterscheinungen, Hypermotorik), die im späteren Krankheitsverlauf zu Bewegungskoordinationsstörungen (Ataxie, stelziger Gang = Traberkrankheit) und Sensibilitätsstörungen (Pruritus, scrapie; engl. to scrapie= scheuern) führen. Das Scheuern aufgrund von Pruritus (Juckreiz) führt zu einem Verlust der Wolle und kann Hautabschürfungen verursachen. Ein feinschlägiger Tremor, Krampfanfälle und Blindheit können auftreten. In späteren Krankheitsstadien kommt es häufig zu einem Konditionsverlust. Der Krankheitsverlauf von Scrapie kann eine Woche bis mehrere Monate dauern. Die Scrapie-Erkrankung bei den kleinen Wiederkäuern entwickelt sich anfangs schleichend und unauffällig und kann bei oberflächlicher Betrachtung übersehen werden. Deshalb kann schon die kleinste Veränderung (s. o.) ein Hinweis auf eine sich entwickelnde Scrapie sein. Selbst im fortgeschrittenen Erkrankungsstadium sind oft nur einzelne Veränderungen und nur äußerst selten alle Symptome gleichzeitig bemerkbar Differentialdiagnosen Als Differentialdiagnosen kommen in Betracht: Bakterielle oder virale Infektionen des zentralen Nervensystems z. B. Listeriose, Bornasche Krankheit, Aujeszkysche Krankheit, Tollwut, Visna Raumfordernde Prozesse im Zentralen Nervensystem z. B. Tumore, Parasiten (Coenurus), Abszesse Stoffwechselstörungen z. B. CCN, Hypomagnesämie, Hypokalzämie, Kupfermangel, Hepatoenzephalopathie Hautkrankheiten z. B. Räude, Ektoparasiten FLI 373
375 TSE-Überwachung bei kleinen Wiederkäuern Die TSE-Überwachungsmaßnahmen umfassen die A B C Stichprobenartige amtliche Untersuchung bei über 18 Monate alten normalgeschlachteten kleinen Wiederkäuer mittels TSE-Schnelltest ( Active surveillance ) Stichprobenartige Schnelltest-Untersuchungen bei über 18 Monate alten verendeten oder aus besonderem Anlass geschlachteten kleinen Wiederkäuer sowie von Tieren, die im Falle der amtlichen Feststellung der TSE bei einem kleinen Wiederkäuer sowie zum Zwecke der Bekämpfung anderer Tierseuchen, mit Ausnahme von epidemisch verlaufenden Tierseuchen, getötet worden sind ( Active surveillance ) Abklärung klinischer Verdachtsfälle mittels OIE-Methoden ( Passive surveillance ) Ad A) und B) Zur Untersuchung kleiner Wiederkäuer dürfen nur solche Tests verwendet werden, die für die Untersuchung dieser Spezies zugelassen sind. ( Je nach Schnelltest müssen gemäß der Gebrauchsinformation hierbei nur eine Probe aus dem Obexbereich oder zusätzlich eine Probe aus dem Kleinhirn untersucht werden. Wird bei der TSE-Schnelltest-Untersuchung entsprechend den Vorgaben der zugelassenen Gebrauchsanleitung ein reaktives Ergebnis festgestellt, so wird die Probe direkt zum NRL für BSE und Scrapie am FLI zur abschließenden Abklärung versandt. Ad C) Die Abklärung eines ausgesprochenen klinischen Verdachtsfalles darf ausschließlich mittels OIE-Methoden durchgeführt werden, d. h. nur ein negatives Ergebnis mit diesen Methoden im NRL kann einen klinischen Verdacht ausräumen. Um die umfangreiche Asservation von Proben (siehe Untersuchungsmaterial) sicherzustellen sollte das FLI in solchen Fällen frühzeitig benachrichtigt werden, so dass eine Überweisung des Tieres von den betroffenen Veterinärämtern/ Landesuntersuchungsämtern durchgeführt werden kann. Alternativ ist auch eine Sektion vor Ort mit Unterstützung eines Mitarbeiters des FLI möglich. Sollten diese Maßnahmen nicht möglich sein, ist eine initiale Bewertung des klinischen Verdachtsfalles durch die Untersuchung mittels eines zugelassen TSE-Schnelltests in einer staatlichen Untersuchungsstelle durchführbar. Die Untersuchungsstelle hat das BMELV und das NRL am FLI bundeseinheitlich nach einem vorgegebenen Meldesystem (siehe Untersuchungsmaterial) über das Ergebnis der jeweiligen Untersuchungen zu informieren. Abschließende Falldefinition für TSE bei kleinen Wiederkäuern Ein TSE-Verdacht bei kleinen Wiederkäuern wird auf Grund klinischer Symptomatik oder eines in der Wiederholungsuntersuchung reaktiven Ergebnisses in einem der national und von der EU zugelassenen TSE-Schnelltests geäußert. FLI 374
376 Ein TSE-Fall ist nach Erhalt eines den Verdacht bestätigenden Befundes aus dem nationalen TSE-Referenzlabor am FLI festzustellen und in TSN einzustellen Zuständige Untersuchungseinrichtungen TSE-Untersuchungen bei kleinen Wiederkäuern werden ausschließlich durch die staatlichen Untersuchungsstellen durchgeführt. Bestätigungsuntersuchungen müssen durch das nationale Referenzlabor am FLI durchgeführt werden. Dies gilt für alle bei Tieren auftretenden TSE Erkrankungen (z. B. auch CWD, FSE) Rechtsgrundlagen Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2009 des OIE. EU: Anhang X der VO (EG) 999/2001 und alle Änderungen National: TSE Überwachungsverordnung Untersuchungsmaterial Probennahme Probennahme und Beprobung erfolgen entsprechend Anhang X, Kapitel C der VO (EG) 999/2001 sowie den Vorgaben des Internationalen Tierseuchenamtes (OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2008) Entnahme des Hirnstammes Der Gehirnstamm ist durch Amtstierärzte, amtliche Tierärzte und Fleischkontrolleure oder durch eingewiesene Probenehmer unter direkter Aufsicht des amtlichen Tierarztes zu entnehmen. Die Proben sollten so frisch wie möglich sein und unverzüglich nach dem Tod des Tieres entnommen werden, um die fortschreitende Autolyse des Gewebes zu verhindern. Zur Entnahme des Hirnmaterials ist folgende Methode bekannt: Entnahmelöffel (scharfer Löffel) Methode ist eine geeignete Technik zur Entnahme von Hirnproben. Die Entnahme hat mit einem Entnahmelöffel durch das Foramen magnum zu erfolgen. Dabei hat die Entnahme so zu erfolgen, dass neben dem Hirnstamm (Obexregion) auch eine Probe aus dem Kleinhirn gewonnen wird. Spezielle gebogene Entnahmelöffel sind kommerziell erhältlich. Die Gehirnproben sind unversehrt in das mit der Untersuchung befasste Labor zu senden. Dort werden die für den jeweils verwendeten Test notwendigen Proben genommen und der Probenrest bis zum Abschluss der Untersuchung bei +4 C gelagert Probennahme im Rahmen der Schnelltestuntersuchungen Unabhängig von ihrem Zustand ist im Rahmen der aktiven Überwachung prinzipiell jede Probe mittels Schnelltest zu untersuchen. FLI 375
377 Soweit es der Gewebezustand zulässt, ist dabei das Material aus der Obex-Region des Hirnstammes (Abb. 1 und 2) sowie, je nach angewandtem Testverfahren, zusätzlich aus dem Kleinhirn zu entnehmen. Dies erhöht die Wahrscheinlichkeit nicht nur frühe, präklinische Stadien sondern auch atypische Scrapie nachweisen zu können. Andere Hirnregionen und/oder das Rückenmark dürfen im Rahmen der Schnelltestuntersuchungen unter keinen Umständen verwendet werden. Ist die Obex-Region wegen fortgeschrittener Autolyse und Fäulnis des Gewebes nicht mehr auffindbar, muss in jedem Fall eine möglichst repräsentative Probe des Hirnstammes sowie des Kleinhirns entnommen werden. In solchen Fällen ist ein positives Ergebnis gültig. Ein negatives Ergebnis hingegen kann nur unter Vorbehalt verwendet werden. Vorgehensweise: Es sollte eine würfelförmige Gewebeprobe unilateral im Bereich des Obex sowie, je nach angewandten Testverfahren, aus dem Kleinhirn, unter Schonung der Gegenseite (Abb. 2), vorzugsweise mittels eines Skalpells entnommen werden; alternativ kann die Probe auch mittels spezieller Entnahmetechniken (Entnahmespritze o.ä.) gewonnen werden; näheres hierzu regeln die jeweils amtlich zugelassenen Gebrauchsanweisungen der TSE-Schnelltests. zusätzliche Kleinhirnprobe Probennahme für TSE-Schnelltest Abb. 1: Medianschnitt durch das Gehirn (nach Budras und Wünsche) FLI 376
378 Entnahmestelle für Histopathologie/Immunhistologie (Formalinprobe des Stammhirns) Obex; Lokalisation für Schnelltestung zusätzliche Kleinhirnprobe: als Nativmaterial und Formalinprobe Medulla oblongata Reste des Kleinhirns Mittelhirn Abb. 2: Stammhirn von dorsal nach Abtragung des Kleinhirns Probennahme nach einem reaktiven Schnelltestergebnis (TSE-Verdacht) Reaktive TSE-Schnelltest-Ergebnisse führen zur weitergehenden Abklärung durch das nationale Referenzlabor am INNT des FLI, Insel Riems. Einzelheiten zum Versand der Proben siehe Unterkapitel Einsendungen an das NRL müssen telefonisch vorangemeldet werden. Zur Ankündigung der Einsendung ist zudem das FAX-Formular gemäß Anhang zu verwenden. Zur Untersuchung sind alle Vorergebnisse (Filme, ELISA-Werte der Probe - einschließlich des jeweiligen Cut-offs), sowie alle zur Verfügung stehenden Proben (auch Gewebeblöcke für die Histologie) einschließlich der Reste der ersten Homogenate einzusenden. Weiterhin sollte eine vollständige, transversale Scheibe (ca. 5 mm) aus der Region direkt kranial des Obex sowie eine Scheibe aus dem Kleinhirn entnommen werden (Abb. 2). Diese dienen der späteren histopathologischen sowie immunhistologischen Untersuchung. Um einerseits die Diagnostik beeinträchtigende morphologische Verluste zu vermeiden und andererseits eine schnellstmögliche diagnostische Untersuchung zu gewährleisten, sollten diese Proben unabhängig vom Autolysegrad bereits im Schnelltestlabor in neutral gepuffertes Formalin (4 %) fixiert werden. Ein Einfrieren des für die histomorphologische Untersuchung gedachten Gewebes sollte unbedingt vermieden werden. FLI 377
Amerikanische Faulbrut
 Amtliche Methodensammlung Amerikanische Faulbrut (Erreger: Paenibacillus larvae) 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung des FLI Stand
Amtliche Methodensammlung Amerikanische Faulbrut (Erreger: Paenibacillus larvae) 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung des FLI Stand
Amtliche Methodensammlung für anzeigepflichtige Tierseuchen
 Amtliche Methodensammlung für anzeigepflichtige Tierseuchen Stand: März 2009 Inhaltsverzeichnis Einleitung... 3 Nationale Referenzlaboratorien... 4 1. Affenpocken... 11 2. Afrikanische Pferdepest... 12
Amtliche Methodensammlung für anzeigepflichtige Tierseuchen Stand: März 2009 Inhaltsverzeichnis Einleitung... 3 Nationale Referenzlaboratorien... 4 1. Affenpocken... 11 2. Afrikanische Pferdepest... 12
Inhalt. Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung... 6
 Inhalt Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung.... 6 Affenpocken.... 13 Afrikanische Pferdepest.... 14 Afrikanische Schweinepest.... 16 Amerikanische
Inhalt Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung.... 6 Affenpocken.... 13 Afrikanische Pferdepest.... 14 Afrikanische Schweinepest.... 16 Amerikanische
Informationen für Rinderhalter - Abschluss BHV1 Sanierung in 2015
 Informationen für Rinderhalter - Abschluss BHV1 Sanierung in 2015 BHV1-Schutzverordnung Baden-Württemberg - ergänzende Regelungen: Impfverbot ab 28. Februar 2015: Die Impfung von Rindern gegen die BHV1-Infektion
Informationen für Rinderhalter - Abschluss BHV1 Sanierung in 2015 BHV1-Schutzverordnung Baden-Württemberg - ergänzende Regelungen: Impfverbot ab 28. Februar 2015: Die Impfung von Rindern gegen die BHV1-Infektion
Inhalt. Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung... 6
 Inhalt Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung.... 6 Affenpocken.... 13 Afrikanische Pferdepest.... 14 Afrikanische Schweinepest.... 16 Amerikanische
Inhalt Tierseuchenbekämpfung wozu?... 4 Allgemeine Erläuterungen zu den Grundlagen der Tierseuchenbekämpfung.... 6 Affenpocken.... 13 Afrikanische Pferdepest.... 14 Afrikanische Schweinepest.... 16 Amerikanische
Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27.
 Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27. Februar 2004 Anlagen 1. Einleitung Das PRRS-Virus wurde Anfang der 90-iger Jahre
Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27. Februar 2004 Anlagen 1. Einleitung Das PRRS-Virus wurde Anfang der 90-iger Jahre
L 25/64 Amtsblatt der Europäischen Union 28.1.2005. (Nicht veröffentlichungsbedürftige Rechtsakte) KOMMISSION
 L 25/64 Amtsblatt der Europäischen Union 28.1.2005 II (Nicht veröffentlichungsbedürftige Rechtsakte) KOMMISSION ENTSCHEIDUNG DER KOMMISSION vom 20. Januar 2005 zur Änderung der Entscheidung 2003/881/EG
L 25/64 Amtsblatt der Europäischen Union 28.1.2005 II (Nicht veröffentlichungsbedürftige Rechtsakte) KOMMISSION ENTSCHEIDUNG DER KOMMISSION vom 20. Januar 2005 zur Änderung der Entscheidung 2003/881/EG
Erfahrungsbericht zur Eignung verschiedener ELISA Kits zum Nachweis von Antikörpern gegen Aviäre Influena für das Routinelabor
 Erfahrungsbericht zur Eignung verschiedener ELISA Kits zum Nachweis von Antikörpern gegen Aviäre Influena für das Routinelabor Dr. Hans-C. Philipp Lohmann Tierzucht GmbH Veterinär-Labor Abschnede 64 27472
Erfahrungsbericht zur Eignung verschiedener ELISA Kits zum Nachweis von Antikörpern gegen Aviäre Influena für das Routinelabor Dr. Hans-C. Philipp Lohmann Tierzucht GmbH Veterinär-Labor Abschnede 64 27472
DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION
 L 247/22 Amtsblatt der Europäischen Union 24.9.2011 DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION vom 20. September 2011 zur Änderung von Anhang D der Richtlinie 88/407/EWG des Rates hinsichtlich des Handels innerhalb
L 247/22 Amtsblatt der Europäischen Union 24.9.2011 DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION vom 20. September 2011 zur Änderung von Anhang D der Richtlinie 88/407/EWG des Rates hinsichtlich des Handels innerhalb
Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter. Dr. Janin Stratmann-Selke
 Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter Dr. Janin Stratmann-Selke Salmonellen und Campylobacter als Erreger von Lebensmittelinfektionen
Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter Dr. Janin Stratmann-Selke Salmonellen und Campylobacter als Erreger von Lebensmittelinfektionen
Verordnung über meldepflichtige Tierkrankheiten
 Ein Service des Bundesministeriums der Justiz in Zusammenarbeit mit der juris GmbH - www.juris.de Verordnung über meldepflichtige Tierkrankheiten TKrMeldpflV 1983 Ausfertigungsdatum: 09.08.1983 Vollzitat:
Ein Service des Bundesministeriums der Justiz in Zusammenarbeit mit der juris GmbH - www.juris.de Verordnung über meldepflichtige Tierkrankheiten TKrMeldpflV 1983 Ausfertigungsdatum: 09.08.1983 Vollzitat:
Monitoring / Früherkennung als Baustein in der Gefahrenabwehr am Beispiel der Schweinepest
 Monitoring / Früherkennung als Baustein in der Gefahrenabwehr am Beispiel der Schweinepest Schweinepest-Monitoring zur Früherkennung als Mittel der Gefahrenabwehr Bild: Alexandra Meindl-Böhmer LAVES Oldenburg
Monitoring / Früherkennung als Baustein in der Gefahrenabwehr am Beispiel der Schweinepest Schweinepest-Monitoring zur Früherkennung als Mittel der Gefahrenabwehr Bild: Alexandra Meindl-Böhmer LAVES Oldenburg
Trichomonadenseuche des Rindes
 Amtliche Methodensammlung Trichomonadenseuche des Rindes 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung FLI Stand 26.09.2017 1. Charakterisierung
Amtliche Methodensammlung Trichomonadenseuche des Rindes 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung FLI Stand 26.09.2017 1. Charakterisierung
24-STUNDEN-SAMMELURIN
 Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
(Text von Bedeutung für den EWR)
 L 324/38 DURCHFÜHRUNGSBESCHLUSS (EU) 2015/2301 R KOMMISSION vom 8. Dezember 2015 zur Änderung der Entscheidung 93/195/EWG hinsichtlich der tierseuchenrechtlichen Bedingungen und der Beurkundung für die
L 324/38 DURCHFÜHRUNGSBESCHLUSS (EU) 2015/2301 R KOMMISSION vom 8. Dezember 2015 zur Änderung der Entscheidung 93/195/EWG hinsichtlich der tierseuchenrechtlichen Bedingungen und der Beurkundung für die
Afrikanische Schweinepest (ASP)
 Afrikanische Schweinepest (ASP) Informationen Informationen des FLI des FLI Stand Stand 28.06.2013 28.06.2013 1 Erreger Verbreitung Der Erreger der Afrikanischen Schweinepest (ASP) ist ein großes, komplexes
Afrikanische Schweinepest (ASP) Informationen Informationen des FLI des FLI Stand Stand 28.06.2013 28.06.2013 1 Erreger Verbreitung Der Erreger der Afrikanischen Schweinepest (ASP) ist ein großes, komplexes
10.Wie viel seines Einkommen gibt der Deutsche für Lebensmittel aus? (Globus-
 rnährungszentrum südlicher oberrhein 1 Unterrichtsablauf für Gymnasien Thema: BSE - ein kalkulierbares Risiko? Zeit: 2 bis 3 Unterrichtseinheiten Unterrichtsablauf: 1. Folie Ernährungsrisiken: Wo ordnen
rnährungszentrum südlicher oberrhein 1 Unterrichtsablauf für Gymnasien Thema: BSE - ein kalkulierbares Risiko? Zeit: 2 bis 3 Unterrichtseinheiten Unterrichtsablauf: 1. Folie Ernährungsrisiken: Wo ordnen
Eidgenössisches Departement des Innern EDI. Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV Tiergesundheit
 sstatistik 2017 Die Meldepflicht für Seuchen und seuchenverdächtige Erscheinungen ist im Tierseuchengesetz Artikel 11 festgelegt (TSG, SR 916.40) und in der Tierseuchenverordnung Artikel 61 präzisiert
sstatistik 2017 Die Meldepflicht für Seuchen und seuchenverdächtige Erscheinungen ist im Tierseuchengesetz Artikel 11 festgelegt (TSG, SR 916.40) und in der Tierseuchenverordnung Artikel 61 präzisiert
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Fragen und Antworten
 Fragen und Antworten im Umgang mit dem elektronischen Abfallnachweisverfahren eanv in Bezug auf die ZKS-Abfall -Allgemeine Fragen- www.zks-abfall.de Stand: 19.05.2010 Einleitung Auf den folgenden Seiten
Fragen und Antworten im Umgang mit dem elektronischen Abfallnachweisverfahren eanv in Bezug auf die ZKS-Abfall -Allgemeine Fragen- www.zks-abfall.de Stand: 19.05.2010 Einleitung Auf den folgenden Seiten
Gene Control. Probenentnahme für DNA-Untersuchungen. Ein Unternehmen bayerischer Tierzuchteinrichtungen. Hinweise. Anleitung zur
 Hinweise Probenentnahme für DNA-Untersuchungen zur Haarwurzelentnahme Seite 2 Blutentnahme Seite 3 Gewebeentnahme Seite 4 Probenversand Seite 5 1 QMHAN19.03_Probenahme GeneControl GmbH Senator-Gerauer-Straße
Hinweise Probenentnahme für DNA-Untersuchungen zur Haarwurzelentnahme Seite 2 Blutentnahme Seite 3 Gewebeentnahme Seite 4 Probenversand Seite 5 1 QMHAN19.03_Probenahme GeneControl GmbH Senator-Gerauer-Straße
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Hygiene und Infektionsvorbeugung
 Hygiene und Infektionsvorbeugung Isolierung Beter voor elkaar 2 Einleitung Diese Broschüre ist für Patienten gedacht, die isoliert gepflegt werden und für deren Angehörige/sonstige Personen, die diese
Hygiene und Infektionsvorbeugung Isolierung Beter voor elkaar 2 Einleitung Diese Broschüre ist für Patienten gedacht, die isoliert gepflegt werden und für deren Angehörige/sonstige Personen, die diese
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
RSV. RSV kennen. Das Virus, das Eltern kennen sollten. Informationen. Kinder schützen
 RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 05.07.2005 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 13. Februar 2004 (BGBl. I S. 216)
05.07.2005 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 13. Februar 2004 (BGBl. I S. 216)
PCD Europe, Krefeld, Jan 2007. Auswertung von Haemoccult
 Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
10.000 10.000. an Masern erkrankt. an Mumps erkrankt. mit Röteln infiziert
 Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
AVN Nr. 1/Jänner 2014 vom 25. Februar 2014
 3. Kundmachung zu Erhebungen über das Vorkommen von Influenza-Viren in Hausgeflügel- und Wildvogelbeständen in Österreich im Jahr 2014 gemäß 3 der Geflügelpestverordnung, BGBl. II Nr. 209/2007 GZ. 74.600/0012-II/B/11/2014
3. Kundmachung zu Erhebungen über das Vorkommen von Influenza-Viren in Hausgeflügel- und Wildvogelbeständen in Österreich im Jahr 2014 gemäß 3 der Geflügelpestverordnung, BGBl. II Nr. 209/2007 GZ. 74.600/0012-II/B/11/2014
Sie haben das Recht, binnen vierzehn Tagen ohne Angabe von Gründen diesen Vertrag zu widerrufen.
 Widerrufsbelehrung Nutzt der Kunde die Leistungen als Verbraucher und hat seinen Auftrag unter Nutzung von sog. Fernkommunikationsmitteln (z. B. Telefon, Telefax, E-Mail, Online-Web-Formular) übermittelt,
Widerrufsbelehrung Nutzt der Kunde die Leistungen als Verbraucher und hat seinen Auftrag unter Nutzung von sog. Fernkommunikationsmitteln (z. B. Telefon, Telefax, E-Mail, Online-Web-Formular) übermittelt,
3. EIGENE UNTERSUCHUNGEN
 3.2. Ergebnisse 3.2.1. Probenentnahme Von 100 Rotfüchsen waren 78 Tiere mit Schildzecken und 41 mit Flöhen befallen. Bei 15 Füchsen konnte weder ein Zecken- noch ein Flohbefall festgestellt werden. Beim
3.2. Ergebnisse 3.2.1. Probenentnahme Von 100 Rotfüchsen waren 78 Tiere mit Schildzecken und 41 mit Flöhen befallen. Bei 15 Füchsen konnte weder ein Zecken- noch ein Flohbefall festgestellt werden. Beim
Eidgenössisches Departement des Innern EDI. Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV Tiergesundheit
 sstatistik 2018 Die Meldepflicht für Seuchen und seuchenverdächtige Erscheinungen ist im Tierseuchengesetz Artikel 11 festgelegt (TSG, SR 916.40) und in der Tierseuchenverordnung Artikel 61 präzisiert
sstatistik 2018 Die Meldepflicht für Seuchen und seuchenverdächtige Erscheinungen ist im Tierseuchengesetz Artikel 11 festgelegt (TSG, SR 916.40) und in der Tierseuchenverordnung Artikel 61 präzisiert
Fallstricke in der HIV-Diagnostik. Elisabeth Puchhammer-Stöckl Department für Virologie Medizinische Universität Wien
 Fallstricke in der HIV-Diagnostik Elisabeth Puchhammer-Stöckl Department für Virologie Medizinische Universität Wien HIV-Infektion: Diagnostik- Zeitverlauf Nach Pilcher et al, 2004 HIV-Infektion: Diagnostik-
Fallstricke in der HIV-Diagnostik Elisabeth Puchhammer-Stöckl Department für Virologie Medizinische Universität Wien HIV-Infektion: Diagnostik- Zeitverlauf Nach Pilcher et al, 2004 HIV-Infektion: Diagnostik-
Screening Das Programm. zur Früherkennung von Brustkrebs
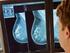 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß
 Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Carnobakterien im Wein- Methoden zur Identifizierung von einem Hefen- und Bakterienisolates an GH140 in der Weinbereitung
 Carnobakterien im Wein- Methoden zur Identifizierung von einem Hefen- und Bakterienisolates an GH140 in der Weinbereitung In Zusammenarbeit mit Katharina Mumm, Alexander Prange Gewinnung des Hefe - Bakterienisolates
Carnobakterien im Wein- Methoden zur Identifizierung von einem Hefen- und Bakterienisolates an GH140 in der Weinbereitung In Zusammenarbeit mit Katharina Mumm, Alexander Prange Gewinnung des Hefe - Bakterienisolates
Ihre Interessentendatensätze bei inobroker. 1. Interessentendatensätze
 Ihre Interessentendatensätze bei inobroker Wenn Sie oder Ihre Kunden die Prozesse von inobroker nutzen, werden Interessentendatensätze erzeugt. Diese können Sie direkt über inobroker bearbeiten oder mit
Ihre Interessentendatensätze bei inobroker Wenn Sie oder Ihre Kunden die Prozesse von inobroker nutzen, werden Interessentendatensätze erzeugt. Diese können Sie direkt über inobroker bearbeiten oder mit
6 Schulungsmodul: Probenahme im Betrieb
 6 Schulungsmodul: Probenahme im Betrieb WIEDNER Wie schon im Kapitel VI erwähnt, ist die Probenahme in Betrieben, die Produkte nach dem Lebensmittel- und Futtermittelgesetzbuch herstellen oder in den Verkehr
6 Schulungsmodul: Probenahme im Betrieb WIEDNER Wie schon im Kapitel VI erwähnt, ist die Probenahme in Betrieben, die Produkte nach dem Lebensmittel- und Futtermittelgesetzbuch herstellen oder in den Verkehr
Krankheiten gibt es überall
 Praxisstempel Krankheiten gibt es überall Ein Impfratgeber für Katzenbesitzer 035946-D. Oktober 2014 (50.000) 113 Die Wissenschaft für gesündere Tiere Intervet Deutschland GmbH ein Unternehmen der MSD
Praxisstempel Krankheiten gibt es überall Ein Impfratgeber für Katzenbesitzer 035946-D. Oktober 2014 (50.000) 113 Die Wissenschaft für gesündere Tiere Intervet Deutschland GmbH ein Unternehmen der MSD
Hilfedatei der Oden$-Börse Stand Juni 2014
 Hilfedatei der Oden$-Börse Stand Juni 2014 Inhalt 1. Einleitung... 2 2. Die Anmeldung... 2 2.1 Die Erstregistrierung... 3 2.2 Die Mitgliedsnummer anfordern... 4 3. Die Funktionen für Nutzer... 5 3.1 Arbeiten
Hilfedatei der Oden$-Börse Stand Juni 2014 Inhalt 1. Einleitung... 2 2. Die Anmeldung... 2 2.1 Die Erstregistrierung... 3 2.2 Die Mitgliedsnummer anfordern... 4 3. Die Funktionen für Nutzer... 5 3.1 Arbeiten
Die Beschreibung bezieht sich auf die Version Dreamweaver 4.0. In der Version MX ist die Sitedefinition leicht geändert worden.
 In einer Website haben Seiten oft das gleiche Layout. Speziell beim Einsatz von Tabellen, in denen die Navigation auf der linken oder rechten Seite, oben oder unten eingesetzt wird. Diese Anteile der Website
In einer Website haben Seiten oft das gleiche Layout. Speziell beim Einsatz von Tabellen, in denen die Navigation auf der linken oder rechten Seite, oben oder unten eingesetzt wird. Diese Anteile der Website
Die Notare. Reform des Zugewinnausgleichsrechts
 Die Notare informieren Reform des Zugewinnausgleichsrechts Dr. Martin Kretzer & Dr. Matthias Raffel Großer Markt 28 66740 Saarlouis Telefon 06831/ 94 98 06 und 42042 Telefax 06831/ 4 31 80 2 Info-Brief
Die Notare informieren Reform des Zugewinnausgleichsrechts Dr. Martin Kretzer & Dr. Matthias Raffel Großer Markt 28 66740 Saarlouis Telefon 06831/ 94 98 06 und 42042 Telefax 06831/ 4 31 80 2 Info-Brief
Spielmaterial und Spielaufbau
 Ein Spiel für 2-5 Spieler, ab 8 Jahren, mit ca. 30 Minuten Spieldauer. Spielmaterial und Spielaufbau 1 Spielplan, 15 Bauern aus Holz (je 3 in den Farben blau, gelb, grün, rot, schwarz), 5 Bauernhöfe, 25
Ein Spiel für 2-5 Spieler, ab 8 Jahren, mit ca. 30 Minuten Spieldauer. Spielmaterial und Spielaufbau 1 Spielplan, 15 Bauern aus Holz (je 3 in den Farben blau, gelb, grün, rot, schwarz), 5 Bauernhöfe, 25
AZK 1- Freistil. Der Dialog "Arbeitszeitkonten" Grundsätzliches zum Dialog "Arbeitszeitkonten"
 AZK 1- Freistil Nur bei Bedarf werden dafür gekennzeichnete Lohnbestandteile (Stundenzahl und Stundensatz) zwischen dem aktuellen Bruttolohnjournal und dem AZK ausgetauscht. Das Ansparen und das Auszahlen
AZK 1- Freistil Nur bei Bedarf werden dafür gekennzeichnete Lohnbestandteile (Stundenzahl und Stundensatz) zwischen dem aktuellen Bruttolohnjournal und dem AZK ausgetauscht. Das Ansparen und das Auszahlen
Abschnitt 1 Anwendungsbereich und Allgemeine Anforderungen an die Konformitätsbewertung 1 Anwendungsbereich
 13.06.2007 Verordnung über Medizinprodukte - (Medizinprodukte-Verordnung - MPV)* vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 16. Februar 2007 (BGBl. I S.
13.06.2007 Verordnung über Medizinprodukte - (Medizinprodukte-Verordnung - MPV)* vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 16. Februar 2007 (BGBl. I S.
Die Post hat eine Umfrage gemacht
 Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Leichte-Sprache-Bilder
 Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
Erklärung zum Internet-Bestellschein
 Erklärung zum Internet-Bestellschein Herzlich Willkommen bei Modellbahnbau Reinhardt. Auf den nächsten Seiten wird Ihnen mit hilfreichen Bildern erklärt, wie Sie den Internet-Bestellschein ausfüllen und
Erklärung zum Internet-Bestellschein Herzlich Willkommen bei Modellbahnbau Reinhardt. Auf den nächsten Seiten wird Ihnen mit hilfreichen Bildern erklärt, wie Sie den Internet-Bestellschein ausfüllen und
TECHNISCHE INFORMATION LESSOR LOHN/GEHALT BEITRAGSNACHWEIS-AUSGLEICH BUCH.-BLATT MICROSOFT DYNAMICS NAV
 MICROSOFT DYNAMICS NAV Inhaltsverzeichnis TECHNISCHE INFORMATION: Einleitung... 3 LESSOR LOHN/GEHALT Beschreibung... 3 Prüfung der Ausgleichszeilen... 9 Zurücksetzen der Ausgleichsroutine... 12 Vorgehensweise
MICROSOFT DYNAMICS NAV Inhaltsverzeichnis TECHNISCHE INFORMATION: Einleitung... 3 LESSOR LOHN/GEHALT Beschreibung... 3 Prüfung der Ausgleichszeilen... 9 Zurücksetzen der Ausgleichsroutine... 12 Vorgehensweise
Version 1.0.0. NotarNet Bürokommunikation. Bedienungsanleitung für den ZCS-Import-Assistenten für Outlook
 Version 1.0.0 NotarNet Bürokommunikation Bedienungsanleitung für den ZCS-Import-Assistenten für Outlook Seite 1 Vorgehensweise bei der Einrichtung... 2 2 Vorbereitung... 2 3 Ablauf des Imports... 3 4 Allgemeine
Version 1.0.0 NotarNet Bürokommunikation Bedienungsanleitung für den ZCS-Import-Assistenten für Outlook Seite 1 Vorgehensweise bei der Einrichtung... 2 2 Vorbereitung... 2 3 Ablauf des Imports... 3 4 Allgemeine
Vor- und Nachteile der Kastration
 Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Liechtensteinisches Landesgesetzblatt
 Liechtensteinisches Landesgesetzblatt 952.11 Jahrgang 2015 Nr. 250 ausgegeben am 25. September 2015 Verordnung vom 22. September 2015 über die Abänderung der Sorgfaltspflichtverordnung Aufgrund von Art.
Liechtensteinisches Landesgesetzblatt 952.11 Jahrgang 2015 Nr. 250 ausgegeben am 25. September 2015 Verordnung vom 22. September 2015 über die Abänderung der Sorgfaltspflichtverordnung Aufgrund von Art.
Häufig wiederkehrende Fragen zur mündlichen Ergänzungsprüfung im Einzelnen:
 Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Tiergesundheit bei Ausstellungen aus Sicht des öffentlichen Veterinärdienstes
 Eidgenössisches Departement des Innern EDI Bundesamt für Veterinärwesen BVET Tiergesundheit bei Ausstellungen aus Sicht des öffentlichen Veterinärdienstes Lukas Perler Leiter Tiergesundheit BVET Herbsttagung
Eidgenössisches Departement des Innern EDI Bundesamt für Veterinärwesen BVET Tiergesundheit bei Ausstellungen aus Sicht des öffentlichen Veterinärdienstes Lukas Perler Leiter Tiergesundheit BVET Herbsttagung
Gemeinsam können die Länder der EU mehr erreichen
 Gemeinsam können die Länder der EU mehr erreichen Die EU und die einzelnen Mitglieds-Staaten bezahlen viel für die Unterstützung von ärmeren Ländern. Sie bezahlen mehr als die Hälfte des Geldes, das alle
Gemeinsam können die Länder der EU mehr erreichen Die EU und die einzelnen Mitglieds-Staaten bezahlen viel für die Unterstützung von ärmeren Ländern. Sie bezahlen mehr als die Hälfte des Geldes, das alle
AUF LETZTER SEITE DIESER ANLEITUNG!!!
 BELEG DATENABGLEICH: Der Beleg-Datenabgleich wird innerhalb des geöffneten Steuerfalls über ELSTER-Belegdaten abgleichen gestartet. Es werden Ihnen alle verfügbaren Belege zum Steuerfall im ersten Bildschirm
BELEG DATENABGLEICH: Der Beleg-Datenabgleich wird innerhalb des geöffneten Steuerfalls über ELSTER-Belegdaten abgleichen gestartet. Es werden Ihnen alle verfügbaren Belege zum Steuerfall im ersten Bildschirm
Influenza des Schweines
 Influenza des Schweines Historie: - erstmals beobachtet 1918 in USA, China, Ungarn - zeitgleich mit der Pandemie beim Menschen (> 20 Mill. Tote) - Virus-Subtyp H1N1 - Übertragung sehr wahrscheinlich vom
Influenza des Schweines Historie: - erstmals beobachtet 1918 in USA, China, Ungarn - zeitgleich mit der Pandemie beim Menschen (> 20 Mill. Tote) - Virus-Subtyp H1N1 - Übertragung sehr wahrscheinlich vom
Tierseuchenbekämpfung wozu?
 Inhalt Tierseuchenbekämpfung wozu?.......................... 4 Allgemeine Erläuterungen zum Tierseuchenrecht............... 6 Meldepflicht.......................................... 7 Ansteckende Metritis
Inhalt Tierseuchenbekämpfung wozu?.......................... 4 Allgemeine Erläuterungen zum Tierseuchenrecht............... 6 Meldepflicht.......................................... 7 Ansteckende Metritis
sm@rt-tan plus Flickerfeld bewegt sich nicht
 Technischer Hintergrund Um die Verwendung des Verfahrens Sm@rt-TAN plus des neuen sicheren TAN- Verfahrens so komfortabel wie möglich zu gestalten, wurde eine Möglichkeit geschaffen, die Angaben einer
Technischer Hintergrund Um die Verwendung des Verfahrens Sm@rt-TAN plus des neuen sicheren TAN- Verfahrens so komfortabel wie möglich zu gestalten, wurde eine Möglichkeit geschaffen, die Angaben einer
089413/EU XXIV. GP. Eingelangt am 31/07/12 RAT DER EUROPÄISCHEN UNION. Brüssel, den 27. Juli 2012 (31.07) (OR. en) 12985/12 AGRILEG 120 CODEC 1993
 089413/EU XXIV. GP Eingelangt am 31/07/12 RAT DER EUROPÄISCHEN UNION Brüssel, den 27. Juli 2012 (31.07) (OR. en) 12985/12 AGRILEG 120 CODEC 1993 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission 26.
089413/EU XXIV. GP Eingelangt am 31/07/12 RAT DER EUROPÄISCHEN UNION Brüssel, den 27. Juli 2012 (31.07) (OR. en) 12985/12 AGRILEG 120 CODEC 1993 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission 26.
Vergleich von diagnostischen Methoden zum Nachweis der Koi-Herpesvirus
 Vergleich von diagnostischen Methoden zum Nachweis der Koi-Herpesvirus Herpesvirus-Infektion (KHV-I) Fischgesundheitsdienst Dr. Kerstin Böttcher, Dr. Grit Bräuer Vergleich von diagnostischen Methoden zum
Vergleich von diagnostischen Methoden zum Nachweis der Koi-Herpesvirus Herpesvirus-Infektion (KHV-I) Fischgesundheitsdienst Dr. Kerstin Böttcher, Dr. Grit Bräuer Vergleich von diagnostischen Methoden zum
malistor Phone ist für Kunden mit gültigem Servicevertrag kostenlos.
 malistor Phone malistor Phone ist die ideale Ergänzung zu Ihrer Malersoftware malistor. Mit malistor Phone haben Sie Ihre Adressen und Dokumente (Angebote, Aufträge, Rechnungen) aus malistor immer dabei.
malistor Phone malistor Phone ist die ideale Ergänzung zu Ihrer Malersoftware malistor. Mit malistor Phone haben Sie Ihre Adressen und Dokumente (Angebote, Aufträge, Rechnungen) aus malistor immer dabei.
Bedienungsanleitung. Matthias Haasler. Version 0.4. für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof
 Bedienungsanleitung für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof Matthias Haasler Version 0.4 Webadministrator, email: webadmin@rundkirche.de Inhaltsverzeichnis 1 Einführung
Bedienungsanleitung für die Arbeit mit der Gemeinde-Homepage der Paulus-Kirchengemeinde Tempelhof Matthias Haasler Version 0.4 Webadministrator, email: webadmin@rundkirche.de Inhaltsverzeichnis 1 Einführung
Dow Jones am 13.06.08 im 1-min Chat
 Dow Jones am 13.06.08 im 1-min Chat Dieser Ausschnitt ist eine Formation: Wechselstäbe am unteren Bollinger Band mit Punkt d über dem 20-er GD nach 3 tieferen Hoch s. Wenn ich einen Ausbruch aus Wechselstäben
Dow Jones am 13.06.08 im 1-min Chat Dieser Ausschnitt ist eine Formation: Wechselstäbe am unteren Bollinger Band mit Punkt d über dem 20-er GD nach 3 tieferen Hoch s. Wenn ich einen Ausbruch aus Wechselstäben
Richtlinie. des Gemeinsamen Bundesausschusses. zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie )
 Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Das große ElterngeldPlus 1x1. Alles über das ElterngeldPlus. Wer kann ElterngeldPlus beantragen? ElterngeldPlus verstehen ein paar einleitende Fakten
 Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Enterovirus/Parechovirus Infektionen. Daniela Huzly Institut für Virologie Freiburg
 Enterovirus/Parechovirus Infektionen Daniela Huzly Institut für Virologie Freiburg Virologie Beide gehören zur Familie der PICORNAVIRIDAE Enteroviren werden traditionell unterteilt in: Poliovirus 1 3 Echoviren
Enterovirus/Parechovirus Infektionen Daniela Huzly Institut für Virologie Freiburg Virologie Beide gehören zur Familie der PICORNAVIRIDAE Enteroviren werden traditionell unterteilt in: Poliovirus 1 3 Echoviren
Keime sicher beherrschen. Fleischzubereitung
 Keime sicher beherrschen. Hygienetipps für die Fleischzubereitung HygienemaSSnahmen bei der Zubereitung von Fleisch Verbraucher müssen genauso auf Hygiene achten wie Hersteller und Handel Rohe Lebensmittel
Keime sicher beherrschen. Hygienetipps für die Fleischzubereitung HygienemaSSnahmen bei der Zubereitung von Fleisch Verbraucher müssen genauso auf Hygiene achten wie Hersteller und Handel Rohe Lebensmittel
Screening-Umsetzung: Screening als Versicherung CONSTANZE WENDT
 Screening-Umsetzung: Screening als Versicherung CONSTANZE WENDT Warum screenen wir nicht Die Empfehlungen sind nicht eindeutig Wir müssen viele Abstrichorte inkl. Rektalabstriche berücksichtigen Es besteht
Screening-Umsetzung: Screening als Versicherung CONSTANZE WENDT Warum screenen wir nicht Die Empfehlungen sind nicht eindeutig Wir müssen viele Abstrichorte inkl. Rektalabstriche berücksichtigen Es besteht
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
33 - Leistungsvoraussetzungen
 Hinweis: Ältere Fassungen Gemeinsamer Rundschreiben sind im CareHelix-PV nachzulesen. 33 - Leistungsvoraussetzungen (1) Versicherte erhalten die Leistungen der Pflegeversicherung auf Antrag. Die Leistungen
Hinweis: Ältere Fassungen Gemeinsamer Rundschreiben sind im CareHelix-PV nachzulesen. 33 - Leistungsvoraussetzungen (1) Versicherte erhalten die Leistungen der Pflegeversicherung auf Antrag. Die Leistungen
Wir, gewählter Oberster Souverän von Gottes Gnaden, Treuhänder des
 Wir, gewählter Oberster Souverän von Gottes Gnaden, Treuhänder des Reiches bestimmen und ordnen was folgt: Gesetz über die Staatsangehörigkeit des Königreiches Deutschland (Staatsangehörigkeitsgesetz)
Wir, gewählter Oberster Souverän von Gottes Gnaden, Treuhänder des Reiches bestimmen und ordnen was folgt: Gesetz über die Staatsangehörigkeit des Königreiches Deutschland (Staatsangehörigkeitsgesetz)
How to do? Projekte - Zeiterfassung
 How to do? Projekte - Zeiterfassung Stand: Version 4.0.1, 18.03.2009 1. EINLEITUNG...3 2. PROJEKTE UND STAMMDATEN...4 2.1 Projekte... 4 2.2 Projektmitarbeiter... 5 2.3 Tätigkeiten... 6 2.4 Unterprojekte...
How to do? Projekte - Zeiterfassung Stand: Version 4.0.1, 18.03.2009 1. EINLEITUNG...3 2. PROJEKTE UND STAMMDATEN...4 2.1 Projekte... 4 2.2 Projektmitarbeiter... 5 2.3 Tätigkeiten... 6 2.4 Unterprojekte...
Die Diagnostik der Koi-Herpesvirus-Infektion
 Die Diagnostik der Koi-Herpesvirus-Infektion Sven M. Bergmann und Dieter Fichtner Institut für Infektionsmedizin Nationales Referenzlabor für Fischkrankheiten Verbreitung der Infektion mit dem KHV Klinisches
Die Diagnostik der Koi-Herpesvirus-Infektion Sven M. Bergmann und Dieter Fichtner Institut für Infektionsmedizin Nationales Referenzlabor für Fischkrankheiten Verbreitung der Infektion mit dem KHV Klinisches
Dokumentation zur Versendung der Statistik Daten
 Dokumentation zur Versendung der Statistik Daten Achtung: gem. 57a KFG 1967 (i.d.f. der 28. Novelle) ist es seit dem 01. August 2007 verpflichtend, die Statistikdaten zur statistischen Auswertung Quartalsmäßig
Dokumentation zur Versendung der Statistik Daten Achtung: gem. 57a KFG 1967 (i.d.f. der 28. Novelle) ist es seit dem 01. August 2007 verpflichtend, die Statistikdaten zur statistischen Auswertung Quartalsmäßig
LAS PROGRAMM- ANPASSUNGEN
 LAS PROGRAMM- ANPASSUNGEN Auf Basis der Änderungen des Reisekostenrechts zum 01.01.2014 Zum 1. Januar 2014 treten Änderungen zum steuerlichen Reisekostenrecht in Kraft, die im BMF Schreiben zur Reform
LAS PROGRAMM- ANPASSUNGEN Auf Basis der Änderungen des Reisekostenrechts zum 01.01.2014 Zum 1. Januar 2014 treten Änderungen zum steuerlichen Reisekostenrecht in Kraft, die im BMF Schreiben zur Reform
Anmeldung, Registrierung und Elternkontrolle des MEEP!-Tablet-PC
 Anmeldung, Registrierung und Elternkontrolle des MEEP!-Tablet-PC Starten Sie in den Browsern Chrome oder Safari die Seite: www.mymeep.de Erstellen Sie Ihren persönlichen Account unter Eltern Login neu,
Anmeldung, Registrierung und Elternkontrolle des MEEP!-Tablet-PC Starten Sie in den Browsern Chrome oder Safari die Seite: www.mymeep.de Erstellen Sie Ihren persönlichen Account unter Eltern Login neu,
Unternehmensname Straße PLZ/Ort Branche Mitarbeiterzahl in Deutschland Projektverantwortlicher Funktion/Bereich E-Mail* Telefon
 Hinweis: Bei Begriffen, für die es sowohl eine weibliche als auch eine männliche Form gibt, wird in diesem Dokument aus Gründen der besseren Lesbarkeit auf eine Unterscheidung verzichtet. Entsprechende
Hinweis: Bei Begriffen, für die es sowohl eine weibliche als auch eine männliche Form gibt, wird in diesem Dokument aus Gründen der besseren Lesbarkeit auf eine Unterscheidung verzichtet. Entsprechende
Konfiguration eines DNS-Servers
 DNS-Server Grundlagen des Themas DNS sind im Kapitel Protokolle und Dienste in meinem Buch (LINUX erschienen im bhv-verlag) beschrieben. Als Beispiel dient ein Intranet mit mehreren Webservern auf verschiedenen
DNS-Server Grundlagen des Themas DNS sind im Kapitel Protokolle und Dienste in meinem Buch (LINUX erschienen im bhv-verlag) beschrieben. Als Beispiel dient ein Intranet mit mehreren Webservern auf verschiedenen
Entwicklung und Validierung von multiplex real-time RT-PCR assays in der Virusdiagnostik
 Entwicklung und Validierung von multiplex real-time RT-PCR assays in der Virusdiagnostik Bernd Hoffmann, Klaus R. Depner, Horst Schirrmeier & Martin Beer Friedrich-Loeffler-Institut Greifswald-Insel Riems
Entwicklung und Validierung von multiplex real-time RT-PCR assays in der Virusdiagnostik Bernd Hoffmann, Klaus R. Depner, Horst Schirrmeier & Martin Beer Friedrich-Loeffler-Institut Greifswald-Insel Riems
Was ist clevere Altersvorsorge?
 Was ist clevere Altersvorsorge? Um eine gute Altersvorsorge zu erreichen, ist es clever einen unabhängigen Berater auszuwählen Angestellte bzw. Berater von Banken, Versicherungen, Fondsgesellschaften und
Was ist clevere Altersvorsorge? Um eine gute Altersvorsorge zu erreichen, ist es clever einen unabhängigen Berater auszuwählen Angestellte bzw. Berater von Banken, Versicherungen, Fondsgesellschaften und
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005
 trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005 2 Inhalt 1. Anleitung zum Einbinden eines über RS232 zu steuernden Devices...3 1.2 Konfiguration
trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005 2 Inhalt 1. Anleitung zum Einbinden eines über RS232 zu steuernden Devices...3 1.2 Konfiguration
CGM JESAJANET Zuweiserportal 3.1.0 Einrichtung des Konfigurationsassistenten und der Benachrichtigungen
 CGM JESAJANET Zuweiserportal 3.1.0 Einrichtung des Konfigurationsassistenten und der Benachrichtigungen CGM JESAJANET Zuweiserportal 3.1 - Einrichtung Konfigurationsassistent und der Benachrichtigungen
CGM JESAJANET Zuweiserportal 3.1.0 Einrichtung des Konfigurationsassistenten und der Benachrichtigungen CGM JESAJANET Zuweiserportal 3.1 - Einrichtung Konfigurationsassistent und der Benachrichtigungen
... damit Ihr Kind gesund groß wird. Informationen zum Früherkennungs- und Vorsorgeprogramm
 ... damit Ihr Kind gesund groß wird Informationen zum Früherkennungs- und Vorsorgeprogramm ...damit Ihr Kind gesund groß wird 2 Liebe Mutter, Lieber Vater Kinder zu haben ist sehr schön. Bis Ihr Kind groß
... damit Ihr Kind gesund groß wird Informationen zum Früherkennungs- und Vorsorgeprogramm ...damit Ihr Kind gesund groß wird 2 Liebe Mutter, Lieber Vater Kinder zu haben ist sehr schön. Bis Ihr Kind groß
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN. Vorschlag für GEMEINSAME REGELUNG
 KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 15.4.2004 SEK(2004) 411 endgültig Vorschlag für GEMEINSAME REGELUNG zur Festlegung der Modalitäten für die Überweisung eines Teils der Dienstbezüge
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 15.4.2004 SEK(2004) 411 endgültig Vorschlag für GEMEINSAME REGELUNG zur Festlegung der Modalitäten für die Überweisung eines Teils der Dienstbezüge
Einleitende Bemerkungen
 Einleitende Bemerkungen EU-FORMBLATT LENKFREIE TAGE / KONTROLLGERÄT MANUELLER NACHTRAG ENTSCHEIDUNGSHILFE FÜR FAHRPERSONAL VON VERORDNUNGS-FAHRZEUGEN 1 BEI TÄTIGKEITEN IM INNERSTAATLICHEN VERKEHR Zur Frage,
Einleitende Bemerkungen EU-FORMBLATT LENKFREIE TAGE / KONTROLLGERÄT MANUELLER NACHTRAG ENTSCHEIDUNGSHILFE FÜR FAHRPERSONAL VON VERORDNUNGS-FAHRZEUGEN 1 BEI TÄTIGKEITEN IM INNERSTAATLICHEN VERKEHR Zur Frage,
Die neue Aufgabe von der Monitoring-Stelle. Das ist die Monitoring-Stelle:
 Die neue Aufgabe von der Monitoring-Stelle Das ist die Monitoring-Stelle: Am Deutschen Institut für Menschen-Rechte in Berlin gibt es ein besonderes Büro. Dieses Büro heißt Monitoring-Stelle. Mo-ni-to-ring
Die neue Aufgabe von der Monitoring-Stelle Das ist die Monitoring-Stelle: Am Deutschen Institut für Menschen-Rechte in Berlin gibt es ein besonderes Büro. Dieses Büro heißt Monitoring-Stelle. Mo-ni-to-ring
Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft:
 Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft: Hinweis: Die im Folgenden dargestellten Fallkonstellationen beziehen sich auf
Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft: Hinweis: Die im Folgenden dargestellten Fallkonstellationen beziehen sich auf
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Anleitung zur Online-Schulung
 Anleitung zur Online-Schulung Webbasierte 7-Stunden-Schulung für Personen mit Zugang zu identifizierbarer Luftfracht oder Luftpost (gemäß Kapitel 11.2.3.9 der Verordnung (EU) Nr. 185/2010). Vorgehensweise:
Anleitung zur Online-Schulung Webbasierte 7-Stunden-Schulung für Personen mit Zugang zu identifizierbarer Luftfracht oder Luftpost (gemäß Kapitel 11.2.3.9 der Verordnung (EU) Nr. 185/2010). Vorgehensweise:
Q-Fieber in der Schweiz: Seroprävalenz beim Kleinwiederkäuer und Risikoabschätzung für den Menschen
 Q-Fieber in der Schweiz: Seroprävalenz beim Kleinwiederkäuer und Risikoabschätzung für den Menschen Untertitel, Autoren etc. J. Hunninghaus, I. Magkouras, M.M. Wittenbrink, G. Schüpbach Jahreskonferenz
Q-Fieber in der Schweiz: Seroprävalenz beim Kleinwiederkäuer und Risikoabschätzung für den Menschen Untertitel, Autoren etc. J. Hunninghaus, I. Magkouras, M.M. Wittenbrink, G. Schüpbach Jahreskonferenz
Allgemeine Geschäftsbedingungen. 1. Geltungsbereich
 Allgemeine Geschäftsbedingungen 1. Geltungsbereich Clavital GmbH erbringt alle Leistungen, die der Kunde im Internet bei www.mydiagnosis.ch bestellt, ausschließlich auf der Basis dieser Allgemeinen Geschäftsbedingungen.
Allgemeine Geschäftsbedingungen 1. Geltungsbereich Clavital GmbH erbringt alle Leistungen, die der Kunde im Internet bei www.mydiagnosis.ch bestellt, ausschließlich auf der Basis dieser Allgemeinen Geschäftsbedingungen.
Anleitungen zum KMG-Email-Konto
 In dieser Anleitung erfahren Sie, wie Sie mit einem Browser (Firefox etc.) auf das Email-Konto zugreifen; Ihr Kennwort ändern; eine Weiterleitung zu einer privaten Email-Adresse einrichten; Ihr Email-Konto
In dieser Anleitung erfahren Sie, wie Sie mit einem Browser (Firefox etc.) auf das Email-Konto zugreifen; Ihr Kennwort ändern; eine Weiterleitung zu einer privaten Email-Adresse einrichten; Ihr Email-Konto
Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007
 26.02.2007 Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007 Auf Grund des 37 Abs. 1, 9, 10 und 11 Satz 1 des Medizinproduktegesetzes in der Fassung der Bekanntmachung
26.02.2007 Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007 Auf Grund des 37 Abs. 1, 9, 10 und 11 Satz 1 des Medizinproduktegesetzes in der Fassung der Bekanntmachung
40-Tage-Wunder- Kurs. Umarme, was Du nicht ändern kannst.
 40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
