Hämovigilanz von Blutkomponenten
|
|
|
- Jörg Wagner
- vor 5 Jahren
- Abrufe
Transkript
1 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz : Springer-Verlag 1999 Annette Graul Brigitte Keller-Stanislawski Paul-Ehrlich-Institut, Langen Hämovigilanz von Blutkomponenten Meldungen an das Paul-Ehrlich-Institut vom bis zum Zusammenfassung Zelluläre Blutprodukte sind in Deutschland zulassungspflichtige Arzneimittel. Das Meldeverfahren und die Analyse und Bewertung der Verdachtsfälle aus den Daten der Spontanerfassung werden vorgestellt. In der Zeit vom bis wurden insgesamt 1488 UAW-Verdachtsfälle im Zusammenhang mit zellulären Blutprodukten und Frischplasma gemeldet Berichte (85,34%) betrafen Verdachtsfälle von Virusübertragungen, 187 (12,56%) immunologische Transfusionsreaktionen und 31 (2,06%) bakterielle Infektionen. Bei den Verdachtsfällen der viralen Infektionsübertragungen wurde in jedem Fall gemäß den Empfehlungen des Arbeitskreises Blut ein,,look-back-verfahren durchgeführt. Von den 1270 Berichten konnte in 864 Fällen (68%) aufgrund der Spendernachuntersuchung die Kausalität zu dem verabreichten Blutprodukt ausgeschlossen werden. In 118 Fällen (9,3%) wurde ein nachträglich infektiöser Spender gefunden. Es handelte sich um 21 HIV-, 81 HCV- und 16 HBV-Infektionen. Die Meldungen wurden nach Therapiejahr aufgeschlüsselt, so daß eine Unterscheidung der Fälle vor und nach Einführung des Spenderscreenings durchgeführt werden konnte. 51 Übertragungen stammen aus der Zeit, als die Spender noch nicht auf virologische Antikörper untersucht wurden. Insgesamt 67 Infektionen (3 HIV, 48 HCV und 16 HBV) sind auf das diagnostische Fenster der einzelnen Infektionen zurückzuführen. Bei Transfusionsreaktionen muß in Deutschland verglichen mit Frankreich und Großbritannien von einem Underreporting ausgegangen werden. Die aufgetretenen Infektionen, die auf zelluläre Blutprodukte zurückgeführt werden konnten, spiegeln in ihrer Häufigkeit das in der wissenschaftlichen Literatur beschriebene Restrisiko. Gesetzliche Meldeverpflichtungen Zelluläre Blutprodukte und Frischplasma zu Therapiezwecken sind in Deutschland zulassungspflichtige Arzneimittel. Daher gelten auch für die labilen Blutprodukt die Vorschriften des Arzneimittelgesetzes (AMG). Alle Verdachtsfälle schwerwiegender unerwünschter Arzneimittelwirkungen (Übersicht 1) und Wechselwirkungen mit anderen Mitteln (UAW) sind nach 29 AMG innerhalb von 15 Tagen nach Bekanntwerden durch den pharmazeutischen Unternehmer (PU) dem Paul-Ehrlich-Institut (PEI) anzuzeigen (Abb. 1). Verdachtsfälle nicht-schwerwiegender UAW sind in periodischen Zeitabständen, zunächst halbjährlich in den ersten beiden Jahren nach der Zulassung und jährlich in den folgenden drei Jahren, vorzulegen. Da- nach hat der Zulassungsinhaber nichtschwerwiegende Verdachtsfälle in Abständen von fünf Jahren mitzuteilen. Für Arzneimittel, die gemäß den Übergangsbestimmungen des AMG als zugelassen gelten (sogenannte fiktiv zugelassene Arzneimittel), gilt das Datum der Nachzulassung als Fristenbeginn für die fünfjährige Berichtspflicht. Da die Dunkelziffer hinsichtlich der Meldungen von Verdachtsfällen unerwünschter Arzneimittelwirkungen im Rahmen der Spontanerfassung bekanntermaßen hoch selbst lebensbedrohliche unerwünschte Arzneimittelwirkungen werden im Mittel nur von jedem fünften Arzt gemeldet stellt die Zusammenstellung der dem PEI gemeldeten Verdachtsfälle aus den Jahren (Stand ) nur einen Ausschnitt der realen Häufigkeiten von UAW dar (Abb. 2). Seit sind die Ärzte nach dem Transfusionsgesetz gesetzlich verpflichtet,verdachtsfälle schwerwiegender unerwünschter Arzneimittelwirkungen der Bundesoberbehörde unverzüglich direkt zu melden, so daß zu erwarten ist, daß die Grauzone der aufgetretenen und nicht Dr. Annette Graul Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51 59, D Langen Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz
2 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz : Springer-Verlag 1999 A. Graul B. Keller-Stanislawski Haemovigilance of blood components Reports to the Paul-Ehrlich-Institut from until Summary In Germany cellular blood products are a licensed medicinal product. In the following we would like to present the reporting procedure, analysis and evaluation of suspected cases from spontaneously recorded data. During the time period from until a total of 1488 suspected adverse events were reported in connection with cellular blood products and fresh plasma. In 1270 (85.34%) of these case reports viral transmissions were implicated, in 187 (12.56%) immunological transfusion reactions and in 31 (2.06%) bacterial infections.the case reports concerning viral transmission were further evaluated in a look-back-procedure according to the guidelines of the Arbeitskreis Blut, a working party on acute issues arising in the transfusion medicine area. In 864 (68%) of the 1270 cases the causality of the blood product could be excluded by re-testing the donor. In 118 cases (9.3%) infectious donors were subsequently identified; 21 were HIV-, 81 HCV- and 16 HBV transmissions.the reports were decoded according to year of treatment to differentiate those cases that occurred before the introduction of mandatory donor screening from those that occurred afterwards. 51 transmissions arose from the time prior to screening for viral antibodies. A total of 67 cases (3 HIV, 48 HCV, 16 HBV) can be traced back to the diagnostic window of each infection. In Germany transfusion reactions are most likely to be underreported compared to France or theunited Kingdom.The frequency of infections that arose from cellular blood products is comparable to the remaining risk described in scientific literature. Übersicht 1 Definitionen der Richtlinie 319/75 EWG Nebenwirkung bedeutet eine Reaktion, die schädlich und unbeabsichtigt ist und bei Dosierungen auftritt, wie sie normalerweise beim Menschen zur Prophylaxe, Diagnose oder Therapie von Krankheiten oder für die Änderungen einer physiologischen Funktion verwendet werden. Eine schwerwiegende Nebenwirkung bedeutet eine Nebenwirkung, die tödlich oder lebensbedrohlich ist, zu Arbeitsunfähigkeit oder einer Behinderung führt oder eine stationäre Behandlung oder Verlängerung einer stationären Behandlung zur Folge hat. gemeldeten Verdachtsfälle zukünftig abnehmen wird. Für zelluläre Blutprodukte sind noch keine Verfahren entwickelt, transfusionsmedizinisch relevante Viren wie Hepatitis-Viren und HIV wirksam abzutrennen oder zu eliminieren, ohne die Zellen selber zu schädigen. Daher ist eine sorgfältige Spenderauswahl und -untersuchung notwendig, um die Sicherheit dieser Arzneimittel zu gewährleisten. Grundlagen bilden weltweit die Empfehlungen der Weltgesundheitsorganisation,,Anforderung an die Entnahme, Verarbeitung und Qualitätskontrolle von Blut, Blutbestandteilen und Plasmabestandteilen (Anlage 2 der World Health Organization Technical Report Series, No 840,1994), europaweit die Empfehlungen des Rates vom über die Eignung von Blutund Plasmaspendern und das Screening von Blutspenden in der Europäischen Gemeinschaft (98/463/EG) und national die Richtlinien zur Blutgruppenbestimmung und Transfusion (Hämotherapie), des wissenschaftlichen Beirates der Bundesärztekammer Danach sind neben der Spenderbefragung, ärztlichen Anamnese, Spenderuntersuchung und dem Recht des Spenders auf Selbstausschluß die Untersuchungen auf Antikörper gegen HIV und HCV und auf HBs- Antigen die derzeit vorgeschriebenen Maßnahmen, das Risiko der Virusübertragung durch zelluläre Blutprodukte auf ein Mindestmaß zu beschränken. Für Frischplasma, das im Gegensatz zu den zellulären Blutprodukten eingefroren werden kann, ist darüber hinaus Abb. 1 Meldewege in Deutschland 144 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2 99
3 Abb. 2 Meldungen von UAW-Verdachtsfällen an das Paul-Ehrlich-Institut nach Blutkomponenten (EK, TK, Plasma,,,Blut ) in der Zeit vom bis eine Quarantänelagerung von sechs Monaten vorgeschrieben, so daß hierdurch die Lücke des nicht Erkennens einer Infektion im diagnostischen Fenster insbesondere für HIV und HCV weitgehendst geschlossen werden konnte. So sind dem Paul-Ehrlich-Institut nach Einführung der Quarantänelagerung keine Virusübertragungen durch nicht virusinaktiviertes Frischplasma bekannt geworden. Der Verdachtsfall einer UAW in Form einer Virusinfektion des Empfängers wird durch den PU bezüglich der möglichen Kausalität zu dem verabreichten Blutprodukt nach den Mitteilungen des Arbeitskreises Blut beim Robert Koch-Institut vom (Bundesanzeiger 12/95) geprüft durch die Rückverfolgung des Spenders der Konserve (vom Empfänger ausgehendes Look-back-Verfahren). Der Spender muß mindestens vier Monate nach der involvierten Spende keine Infektionsmarker zeigen. Das PEI überprüft die Rechtmäßigkeit des durchgeführten Look-back-Verfahrens. Die Bewertung des Kausalzusammenhangs erfolgt im Paul-Ehrlich-Institut nach den Kriterien der WHO, die für Blutprodukte durch das PEI modifiziert wurden (Übersicht 2). Danach ist der Kausalzusammenhang als wahrscheinlich zu bewerten, wenn der Spender nach der involvierten Spende bezüglich der beim Empfänger aufgetretenen Infektion serokonvertiert ist. Als möglich wird der Kausalzusammenhang bewertet, wenn sich der Spender einer Nachuntersuchung unterzieht. Ist keine Konservennummer angegeben, wird der Kausalzusammenhang als nicht zu beurteilen bewertet. Unwahrscheinlich ist der Kausalzusammenhang, wenn der Spender vier Monate nach der Spende keine Serokonversion zeigt. In den Jahren (Stand ) sind dem PEI insgesamt 1488 Verdachtsfälle unerwünschter Arzneimittelwirkungen zugegangen, wobei es sich bei 1270 Verdachtsfällen um virale Infektionen handelt. Die Kausalitätsbewertung der wichtigsten Infektionen ist in Tabelle 1 dargestellt. Unerwünschte Wirkungen durch die Transfusion von Blutkomponenten Virale Infektionen Ein Restrisiko bei der Übertragung von Blutkomponenten besteht insbesondere für die Infektionen, die mit einer Virämie langfristig persistieren, ohne daß klinische Symptome beim Spender auftreten und die aufgrund der Zeitspanne zwischen Virämie und dem Auftreten von Antikörpern (diagnostisches Fenster) nicht durch Antikörpertestung des Spenders erkannt werden. Humanes Immundefizienzvirus (HIV) Die Infektion mit HIV wird durch den Antikörpertest bei der Blutspende festgestellt. Das diagnostische Fenster konnte auf Grund der Weiterentwicklung der Antikörpertests der 3. Generation in den letzten Jahren immer mehr verkürzt werden. So wurde es bei Tests der 1. Generation noch mit durchschnittlich 45 Tagen angegeben [1] und wird heute mit sechs bis 38 Tagen, im Mittel 22 Tagen errechnet [2]. Das Restrisiko einer HIV-Infektion durch nicht inaktivierbare Blutprodukte wurde von Schreiber et al. mit 1 : bis 1 : ,im Mittel mit 1 : Transfusionen angegeben[3]. In einer Multicenter-Studie des Berufsverbandes deutscher Transfusionsmediziner wurden die Ergebnisse von 94% der Blutspenden des Jahres 1996 gesammelt und die Übertragungsrisiken auf der Grundlage der gemessenen Serokonversionen, der publizierten Fensterperioden und der durchschnittlichen Intervalle zwischen den Spenden abgeschätzt. Danach wurde für HIV ein Restrisiko von 1 : berechnet [4]. Dem PEI sind in der Zeit vom bis zum insgesamt 151 Verdachtsfälle von HIV-Infektionen berichtet worden. Von diesen mußten 21 Fälle (13,9%) durch ein positives Lookback-Verfahren auf einen nachträglich als infiziert erkannten Spender zurückgeführt werden. In drei der 151 gemeldeten Fälle (1,98%) erfolgte die Therapie nach Einführung des Spenderscreenings, so daß die drei mit einem wahrscheinlichen Kausalzusammenhang bewerteten Infektionsübertragungen auf die Nichterkennung der infektiösen Spender im diagnostischen Fenster zurückzuführen sind. Hepatitis-B-Virus Zur Feststellung der möglichen Infektion beim Spender wird der Spender nicht auf Antikörper, sondern auf HBs-Antigen untersucht. Grund hierfür ist, daß die Antikörper in der Regel jahrelang erhalten bleiben, auch wenn eine Virämie nicht mehr besteht. Daher darf ein Spender nach derzeit geltenden nationalen Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz
4 Übersicht 2: Kausalitätsbewertung von UAW-Verdachtsfällen nach WHO-Kriterien, modifiziert durch das PEI für Blutkomponenten 1. Gesichert (certain): Ein klinisches Ereignis, einschließlich Veränderungen von Laborparametern, gilt als gesicherte UAW, wenn ein plausibler zeitlicher Rahmen vorliegt und keine anderen Ursachen in Frage kommen. Desweiteren muß die Reaktion bekannt und pathophysiologisch erklärbar sein, wobei ein positiver Reeypositionsversuch nicht zwangsläufig gefordert wird, in der Regel aber vorhanden sein sollte. Homogener Gen-Sequenzvergleich. 2. Wahrscheinlich (probably/likely): Ein klinisches Ereignis, einschließlich Veränderungen von Laborparametern, gilt als wahrscheinliche UAW, wenn ein plausibler zeitlicher Rahmen vorliegt und wahrscheinlich nicht durch andere Ursachen ausgelöst ist. Die Reaktion sollte bekannt und pathophysiologisch erklärbar sein, wobei ein positiver Reexpositionsversuch nicht gefordert wird. Positives Look-back-Verfahren, PCR-Testung der Charge und des Plasmapools positiv. 3. Möglich (possible): Ein klinisches Ereignis, einschließlich Veränderungen von Laborparametern, gilt als mögliche UAW, wenn ein plausibler zeitlicher Rahmen vorliegt, aber auch ander Ursachen, wie koinzidierende Erkrankungen oder Medikamente in Frage kommen. Nicht zu ermittelnder Spender, Charge nicht zu untersuchen, aber Inaktivierungsverfahren insuffizient. 4. Unwahrscheinlich (unlikely): Ein klinisches Ereignis, einschließlich Veränderungen von Laborparametern, gilt als unwahrscheinliche UAW, wenn eine zweifelhafte zeitliche Korrelation besteht und insgesamt mehr Aspekte gegen einen Kausalzusammenhang sprechen. Negatives Look-back-Verfahren. Negative PCR-Testung der Charge und des Plasmapools, effektive Virusinaktivierung. 5. Unvollständig (conditional/unclassified): Die Datenlage ist zur Beurteilung insuffizient, weitere Daten sind angekündigt oder angefordert. 6. Nicht zu beurteilen (unassessible/unclassificable): Die Datenlage ist zur Beurteilung insuffizient, keine weiteren Daten sind zu erwarten. Die Chargennummer des Blutproduktes ist nicht zu ermitteln.virusinaktivierungsverfahren fraglich. Regelungen wieder zur Spende zugelassen werden, wenn seine Hepatitis-B-Infektion fünf Jahre zurückliegt. HBs-Ag und Anti-Hbc sind etwa zur gleichen Zeit (Anti-HBc einige Tage später als HBsAg) im Blut des Spenders nachweisbar. Die Virämie und somit die Infektiosität des Spenders kann jedoch ein bis sechs Wochen vor Feststellung durch das HBs-Ag vorhanden sein [5].Von Mimms et al wird die Fensterphase mit 37 bis 87 Tagen, im Mittel mit 59 Tagen angegeben [6]. Das HBs-Ag ist nach spätestens sechs Monaten (im Mittel 70 Tagen) nicht mehr nachweisbar. Einige Tage bis Wochen nach Verschwinden des HBs-Ag ist der Antikörper Anti-HBs erstmals nachweisbar und stellt für den Spender in der Regel eine lebenslange Immunität dar. Inwieweit das Anti-HBs schützende Wirkung hat, ist noch nicht abschließend geklärt. In 5 10% der Erkrankungen bei Erwachsenen ist das HBs-Ag länger als sechs Monate nachweisbar, was eine Chronifizierung bedeutet. Etwa bei 10% der Erkrankten ist das HBs-Ag wegen eines niedrigen Titers überhaupt nicht nachweisbar. Von Schreiber et al wird das Restrisiko mit 1 : bis 1 : , im Mittel mit 1 : Transfusionen angegeben [3]. Hier wurde das aufgrund der Fensterperiode geschätzte Risiko mit einem Faktor von 2,38 multipliziert unter der Annahme, daß nur 42% der Infektionen durch das HBs-Ag entdeckt werden können. Der Berufsverband der Deutschen Transfusionsmediziner [4] errechnete ein Restrisiko von 1 : , wobei von einer Fensterphase von 56 Tagen ausgegangen wurde. Er hat hierbei ausdrücklich den Faktor von 2,38 nicht einkalkuliert. Unter Berücksichtigung dieses Faktors würde das Restrisiko somit 1 : Transfusionen betragen. In der Zeit vom bis zum sind dem PEI insgesamt 442 Verdachtsfälle einer HBV-Infektion berichtet worden. In 16 Fällen (3,61%) wurde der Spender nachträglich Anti-HBc positiv getestet.alle Spender waren zum Zeitpunkt der Spende HBs-Ag negativ getestet. Hepatitis-C-Virus (HCV) Die Diagnose der HCV-Infektion ist durch den Nachweis von Anti-HCV in der späten akuten Phase der Infektion und in der persistierenden Phase möglich. Die Antikörper haben zwar eine schützende Wirkung, jedoch entzieht sich das Virus durch Mutation der Neutralisation. Antikörper gegen HCV sind mit den gegenwärtigen Tests erst zwei bis fünf Monate nach Infektion nachweisbar.von Bush et al wird das diagnostische Fenster mit 54 bis 192 Tagen, im Mittel 82 Tagen angegeben [7]. Danach wird nach Schreiber et al das Restrisiko der Übertragung einer HCV durch zelluläre Blutprodukte auf 1 : bis 1 : , im Mittel 1 : Transfusionen errechnet [3]. Diese Angaben entsprechen dem vom Berufsverband Deutscher Transfusionsmediziner für Deutschland 1996 errechneten Restrisiko von 1 : [4]. Durch Einführung der NAT PCR-Testung kann dieses Risiko noch erheblich reduziert werden, da HC-Viren sich sehr früh nach der Infektion in hohem Maße anreichern. Schreiber et al. haben durch die RNA-PCR Testung eine Reduktion des Risikos um 72% errechnet [3]. Dem PEI sind in der Zeit zwischen 1995 und dem insgesamt 670 Verdachtsfälle von HCV-Übertragungen 146 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2 99
5 Tabelle 1 Ausgang von Look-back-Verfahren bei Verdachtsmeldungen von Virusübertragungen nach zellulären Blutprodukten und Frischplasma ( ) Virusübertragungen HBV HCV HIV gesamt Kausalzusammenhang wahrscheinlich 16 3,6% 81 12,1% 21 13,9% vor Einführung des 0 0% 33 4,9% 18 11,9% Spenderscreenings nach Einführung des 16 3,6% 48 7,2% 3 2,0% Spenderscreenings unwahrscheinlich ,9% ,3% 93 61,6% möglich/nicht 86 19,5% ,6% 37 24,5% zu beurteilen noch nicht 56 12,7% 54 8,1% 4 2,6% abgeschlossen gemeldet worden. In 81 Fällen (12,08%) wurde der Spender nachträglich als Anti-HCV positiv getestet. In 33 Fällen lag die Spende vor Einführung der Anti- HCV-Testung. In 48 der 670 berichteten Übertragungen (7,16%) erfolgte die Infektion wahrscheinlich auf Grund des diagnostischen Fensters. Weitere transfusionsmedizinisch relevante Viren sind Hepatitis A, Humanes Parvovirus B19, Cytomegalie-Virus, das Epstein-Barr-Virus, Humane Herpes-Viren 6 8, Humanes T-Zell-Leukämie-Virus Typ I und II, Hepatitis-D-Virus, Hepatitis-G-Virus, Hepatitis-E-Virus. Im folgenden werden nur noch die Infektionen beschrieben, zu denen dem Paul-Ehrlich-Institut Verdachtsfälle von Übertragungen durch zelluläre Blutprodukte berichtet wurden. HGV-Infektionen Das Virus wurde 1995 identifiziert und zeigt eine enge Verwandtschaft zu dem Hepatitis-C-Virus [8]. Die klinische Relevanz dieses Virus ist noch nicht bekannt. 1 2% der Bevölkerung und der Blutspender trägt dieses Virus, ohne die Zeichen einer Erkrankung zu zeigen [9]. Dem PEI sind in den Jahren drei Verdachtsfälle einer HGV-Infektion bekannt geworden. In keinem Fall konnten beim Spender Antikörper gegen HGV nachgewiesen werden. In einem Fall starb ein achtjähriges Kind im Leberausfallkoma nach Tonsillektomie. In der Obduktion war die Hepatitisserologie bis auf Antikörper gegen HGV unauffällig. Im zweiten Fall fiel der Empfänger bei negativer Hepatitisserologie durch einen Ikterus auf.auch er hatte allein Antikörper gegen HGV. HAV-Infektionen Die Übertragung einer Hepatitis A durch zelluläre Blutprodukte wurde zwar schon beschrieben [10], ist aber ein seltenes Ereignis, da die Inkubationszeit mit nur einigen Tagen kurz ist und Antikörper neutralisierende Wirkung haben. Von 1995 bis 1998 wurden dem PEI elf Verdachtsfälle einer HAV-Infektion gemeldet. Bei allen Spendern konnten keine HAV-Antikörper nachgewiesen werden, so daß der Kausalzusammenhang als unwahrscheinlich zu bewerten ist. Humanes Parvovirus-B19-Infektionen Das Vorhandensein dieses Virus in der Blutspende ist insbesondere für Schwangere und immungeschwächte Empfänger von Blutprodukten von Bedeutung % der Erwachsenen haben Antikörper und sind immun [11]. Da erst ab etwa dem 12. Tag nach Infektion Antikörper nachweisbar sind, wird disku- tiert, ob bei der Übertragung von zellulären Blutprodukten an gefährdete Personen nur die NAT-PCR-Testung der Spender sinnvoll ist. Der Anteil virämischer Blutspenden wird mit 1 : 2400 bis 1 : angegeben [12]. Dem PEI sind insgesamt fünf Verdachtsfälle von Parvovirus-B19-Infektionen berichtet worden. In allen Fällen konnte auch hier der Kausalzusammenhang zu den applizierten Blutprodukten als unwahrscheinlich bewertet werden, da bei den Spendern keine Antikörper gefunden wurden. CMV-Infektionen Auch die Cytomegalieinfektion stellt hauptsächlich ein Risiko für Schwangere und Immungeschwächte ein Risiko dar. Beim Immunkompententen verläuft die Primärinfektion meist unbemerkt. Cytomegalie-Viren persistieren lebenslang in Leukozyten. Dennoch ist Antikörper-positives Spenderblut nicht in allen Fällen infektiös. Die Durchseuchung in der Gesamtbevölkerung wird mit % angegeben [13]. Das Risiko einer CMV-Infektion durch nicht getestetes Spenderblut wird unter 2,7% angegeben [14]. Dem PEI sind drei Verdachtsfälle einer CMV-Infektion im Zusammenhang mit zellulären Blutprodukten berichtet worden. In zwei Fällen hatten die Spender keine Antikörper gegen CMV, so daß die Übertragung durch die Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz
6 Tabelle 2 Verdachtsfälle von Immunologischen Transfusionsübertragungen an das PEI in der Zeit vom bis bis n = Hämolytische Transfusionsreaktion Allergische Reaktion Purpura TRALI Bakterielle Infektion GvHD Febrile Reaktion Fehlgebrauch Sonstige Blutprodukte unwahrscheinlich ist. In einem Fall hat ein nachträglich positiv getestetes Quarantäne-gelagertes Frischplasma wahrscheinlich zur Infektion eines Säuglings mit Fallot scher Tetralogie geführt. Das Kind starb einen Monat später. Da jedoch die Histologie sämtlicher Organe keine Zeichen einer CMV-Infektion zeigte, hat die Cytomegalieinfektion für den Verlauf quoad vitam wahrscheinlich eine untergeordnete Rolle gespielt. Bakterielle Infektionen Transfusionsassoziierte bakterielle Infektionen können zu lebensbedrohlichen septischen Krankheitsbildern bis hin zum Multiorganversagen führen. Durch Bakterien ausgelöste tödliche Transfusionszwischenfälle werden in der Literatur mit 1 : 6 Millionen transfundierte Einheiten angegeben [15]. Die häufigste Ursache für bakterielle Infektionen ist nicht die unerkannte Infektiosität des Spenders, sondern die Kontamination der Konserve. Dem PEI sind insgesamt 31 Verdachtsfälle von bakterielle Infektionen gemeldet worden. In drei Fällen mußten sie auf nicht erkannte Infektionen des Spenders zurückgeführt werden. Es handelt sich um Yersinia enterocolitica-, E. coli- und Malaria-Infektionen. Die Empfänger konnten erfolgreich therapiert werden. In 18 Fällen mußte eine Kontamination der Konserve festgestellt werden, die jedoch nur im Restblut und nicht in den Rückstellproben nachweisbar waren. Vier dieser Infektionen (Yersinia, Staph.aureus, Proteus vulgaris und Enterobacter cloacae) endeten tödlich. Immunologische Transfusionsreaktionen (Tabelle 2) Febrile (>1 C), nichthämolytische Reaktion (durch Zytokinproduktion von Spenderleukozyten (TNFα, IL-1 etc.) treten in 1 4% der Transfusionen auf. Die Therapie besteht in einem Transfusionsstop und in der symptomatischer Gabe von Antipyretika und Ausschluß von akuter Hämolyse oder transfusionsassoziierter Sepsis. Dem PEI sind /187 Verdachtsfälle (6,39%) berichtet worden. Hämolytische Transfusionsreaktionen Sofortreaktionen mit Frösteln, Fieber, Schweißausbruch, Kopfschmerzen, Tachykardie, Blutdruckabfall, Brust- Bauch- und Flankenschmerz bis hin zum Vollbild des Schocks mit DIC und Nierenversagen wird in einer älteren Arbeit mit 0,014% angegeben [16], allerdings dürften die Zahlen variieren, da es sich zumeist um eine Fehltransfusion handelt. Die häufigste Ursache ist die ABO-Inkompatibilität infolge von Verwechslungen. Weniger häufig sind andere, bereits vor der Transfusion vorhandene Alloantikörper. Die Reaktion tritt während der Transfusion bzw. kurz danach auf. Die Therapie: Sofortige Beendigung der Transfusion und Schockprophylaxe. Verzögerte hämolytische Reaktionen treten im Laufe von Tagen nach der Transfusion auf [17]. Symptome sind zumeist leicht mit Fieber, Hb-Abfall, Ikterus. Schwerere Reaktionen mit akutem Nierenversagen oder ein tödlicher Ausgang sind Raritäten.Auslösend sind erythrozytäre Alloantikörper z.b. Kell, Rh, Kidd, Duffy, die zum Zeitpunkt der Transfusion nur in einer geringen Konzentration vorlagen (nicht meßbar, negative Kreuzprobe), sind also unvermeidbar. In den meisten Fällen ist eine Therapie nicht erforderlich (bei schweren Reaktionen Therapie wie bei der hämolytischen Sofortreaktion). Dem PEI sind insgesamt 51/187 hämolytische Transfusionsreaktionen (27,27%) gemeldet worden. Graft-versus-host-Krankheit (sehr selten) wird bei Immunsupprimierten und Blutsverwandten nach Übertragung von proliferationsfähigen Lymphozyten beobachtet. Es kommt zu einer massiven Produktion von Zytokinen. Symptome sind Exanthem, Fieber, Diarrhö, Hepatitis und Markdepression mit hoher Letalität. GVHD läßt sich durch Bestrahlung der Blutprodukte mit 30 Gy verhindern. Sie sind insgesamt sehr selten. Dem PEI wurde bisher ein Fall gemeldet. Allergische Reaktionen Urtikarielle Hautreaktion und milde allergische Reaktionen kommen bei bis zu 1 3% der Transfusionen vor. Gerenalsierungen werden selten beobachtet. Posttransfusionspurpura sieben bis zehn Tage nach der Transfusion durch plättchenspezifische Alloantikörper mit isolierter Thrombozytopenie, Petechien und Blutungsneigung werden 148 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2 99
7 selten beobachtet. Berichte über urtikarielle Hautreaktionen und Posttransfusionspurpura sind dem PEI bisher nicht mitgeteilt worden. Anaphylaktische Reaktionen sind äußerst selten. Ursächlich sind zumeist Antikörper gegen IgA und Plasmaproteine.Anaphylaktische Reaktionen wurden fast ausschließlich bei Patienten mit angeborenem IgA-Mangel und einer Immunisierung gegen IgA beobachtet. Dem PEI wurden /187 anaphylaktische Reaktionen gemeldet (41,7%). Die meisten dieser Reaktionen traten allerdings im Zusammenhang mit virusinaktiviertem Frischplasma auf. Transfusionsassoziierte Lungeninsuffizienz (TRALI) wird äußerst selten beobachtet [18]. Die klinischen Symptome des TRALI sind dem Respiratory Distress Syndrome (ARDS) zu vergleichen. Sie tritt fast ausschließlich nach Plasma auf, das granulozytenspezifische Alloantikörper enthält. In den meisten Fällen kommen die Antikörper vom Spender und reagieren mit den Granulozyten des Empfängers, seltener findet sich eine Reaktion von Antikörpern des Empfängers mit Granulozyten des Spenders.Als Pathomechanismus wird diskutiert: die Transmigration aktivierter Granulozyten (antikörperbeladene Granulozyten) in der Lunge, Kapillarschädigung und Generalisierung durch Freisetzung von Proteasen, Zytokinen und/oder Superoxide, Kapillarwandschädigung und Hyperpermeabilität, die zu einer respiratorischen Insuffizienz führen. Therapie besteht in Transfusionsstop, gegebenenfalls Beatmung und Katecholaminen. Die Mortalität beträgt wenige Prozent und ist somit sehr viel geringer als beim ARDS, dennoch ist die transfusionsassoziierte Lungeninsuffizienz nach US-amerikanischen Statistiken für 15% der transfusionsassoziierten Todesfälle verantwortlich [17]. Patienten mit Granulozytenantikörpern sollten möglichst leukozytenarme Präparate erhalten. Spender, deren Präparate ein TRALI ausgelöst haben und leukozytäre Antikörper aufweisen, sind zu sperren. Dem PEI sind insgesamt 15 Verdachtsfälle einer TRALI gemeldet worden (8,02%). Fazit für die Praxis Das Look-back-Verfahren, wie es vom Arbeitskreis Blut empfohlen wird, stellt ein bewährtes Verfahren mit einer hohen Compliance dar. Im Bereich der immunvermittelten unerwünschten Transfusionsreaktionen und der bakteriologisch parasitären Infektionen ist auf Grund von Daten aus der Literatur und einem Vergleich von Meldungen aus Großbritannien und Frankreich von einer hohen Dunkelziffer auszugehen. Konzepte zur Verbesserung der Meldepraxis sollten zwischen den Beteiligten,Vertretern der behandelnden Ärzte, pharmazeutischen Unternehmern und der Behörde entwickelt werden. Literatur 1. Petersen et al (1994) Duration of time from onset of human immunodeficiency virus type 1 infectiousness to developement of detectable antibody. The HIV sero conversion Study Group. Transfusion 34 (Suppl.):71S 2. Busch MP et al (1995) Time course of detection of viral and serologic markers preceding human immunodeficiency virus type 1 seroconversion: implications for screening of blood and tissue donors. Transfusion 35: Schreiber GB et al (1996) The risk of transfusion-transmitted viral infections. N Engl J Med 334: Glück D et al (1998) Seroconversion of HIV, HCV and HBV in blood donors in 1996 risk of virus transmission by blood products in Germany. Infusionstherapie und Transfusionsmedizin 25: Hofnagle JH (1990) Posttransfusion hepatitis B. Transfusion 30, 5: Mimms et al(1993) Effect of concurrent acute infection with hepatitis C virus on acute hepatitis B virus infection. BMJ 307: Busch MB et al (1995) Declining value of alanineaminotransferase in screening of blood donors to prevent posttransfusion hepatitis B and C virus infection. Transfusion 35: Simons JN et al (1995) Isolation of novel virus-like sequences associated with human hepatitis. Nat Med 1: Alter HJ (1996) The cloning and clinical implications of HGV and HGBV-C. N Engl J Med 334: Shehertz RJ et al (1984) Transmission of hepatitis A by transfusion of blood products. Arch Intern Med 144: Scharz TF et al (1987) Häufigkeit der Parvovirus B 19 Infektionen. Seroepidemiologische Untersuchungen. DMW 112: Caspari G et al (1996) Durch Blut übertragene Infektionskrankheiten. In: Mueller-Eckardt (Hrsg) Transfusionsmedizin, 2.Auflage 1996.Springer, Berlin Heidelberg New York, Kapitel Krech U (1973) Complement-fixing antibodies against CMV in different parts of the world. Bull WHO 49: Preiksaitis JK et al (1988) The risk of cytomegalovirus infection in seronegative transfusion recipients not receiving exogenous immunosuppression. J Infect Dis 157: Wagner SJ et al (1994) Transfusion- associated bacterial sepsis. Clin Microbiol Rev 7: Taswell HF et al (1981) Hemolytic transfusion reactions. In: Bell CA (ed) Sem Immunemediated cell destruction. Amm Assoc Blood Banks, pp Roelcke D (1996) Nichtinfektiöse unerwünschte Wirkungen. In: Mueller-Eckhardt (Hrsg) Transfusionsmedizin.Springer, Berlin Heidelberg New York, S SHOT office (1998) Serious hazards of transfusion. Annual Report Manchester Blood Center Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Impfstoffsicherheit in Deutschland
 Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Mit dem Meldebogen (1b) sollen solche Ereignisse erfasst werden, bei denen eines oder mehrere der folgenden Kriterien erfüllt sind:
 Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Ergänzende Empfehlungen zur Testung von Blut- und Plasmaspenden und zum Rückverfolgungsverfahren
 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe 2 Testung auf Antikörper gegen Hepatitis B-Core-Antigen (anti-hbc) im Blutspendewesen
 An alle pharmazeutischen Einrichtungen, die Blut oder Blutkomponente gewinnen oder herstellen S1-23 600 06103 / 77-1023 06103 / 77-1263 30.03.2006 Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe
An alle pharmazeutischen Einrichtungen, die Blut oder Blutkomponente gewinnen oder herstellen S1-23 600 06103 / 77-1023 06103 / 77-1263 30.03.2006 Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe
Gesetzliche Grundlagen und Meldepflicht
 Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
hier: Abwehr von Arzneimittelrisiken Testung auf Antikörper gegen Hepatitis-B-Core-Antigen (anti-hbc) im Blutspendewesen
 Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion
 Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller
 Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Akute hämolytische TR. Schmerzen in der Nierengegend Hypotonie Übelkeit, Erbrechen RR-Abfall Blutiger Urin (auch bei Schock) Nierenversagen Schock
 Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse
 Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
Haemovigilance. Swisstransfusion, Fribourg M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic
 Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung
 www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit
 Querschnittsbereich 4 (QB4) Vorlesungsteil Transfusionsmedizin und Immunhämatologie Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit Prof. Dr. med. Christian Seidl Prof.
Querschnittsbereich 4 (QB4) Vorlesungsteil Transfusionsmedizin und Immunhämatologie Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit Prof. Dr. med. Christian Seidl Prof.
Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV
 PD Dr. med. Thomas Zeiler, Dr. med. Angelika Reil Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV Erfahrungen, Ergebnisse und Informationen
PD Dr. med. Thomas Zeiler, Dr. med. Angelika Reil Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV Erfahrungen, Ergebnisse und Informationen
Risiken der Transfusion von Blut und Blutprodukten
 Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Screening zur Prävention von transfusionsübertragenen viralen Infektionen
 Screening zur Prävention von transfusionsübertragenen viralen Infektionen Christoph Niederhauser CNI/2010 Hämovigilanztagung Bern 2010 1 Topics Sicherheit von Blutprodukten bezüglich Infektionserregern
Screening zur Prävention von transfusionsübertragenen viralen Infektionen Christoph Niederhauser CNI/2010 Hämovigilanztagung Bern 2010 1 Topics Sicherheit von Blutprodukten bezüglich Infektionserregern
Bedeutung von Nebenwirkungen
 Bedeutung von Nebenwirkungen NW erhöhen Morbidität und Mortalität von Patienten erheblich: Etwa 3-6% aller stationären Aufnahmen sind durch UAW bedingt [Pirmohamed M et al., BMJ 2004; Lazarou J et al.,
Bedeutung von Nebenwirkungen NW erhöhen Morbidität und Mortalität von Patienten erheblich: Etwa 3-6% aller stationären Aufnahmen sind durch UAW bedingt [Pirmohamed M et al., BMJ 2004; Lazarou J et al.,
Applikation. gegeben von / bis. Anlage 1
 BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
Übersicht TRALI heute
 Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung
 Impfstoff-Egoismus mit Folgen Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung Gießen (20. Januar 2011) - Ein internationales Forscherteam, darunter die Virusforscher Ulrike Wend und Wolfram
Impfstoff-Egoismus mit Folgen Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung Gießen (20. Januar 2011) - Ein internationales Forscherteam, darunter die Virusforscher Ulrike Wend und Wolfram
Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen
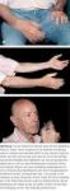 Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Time-to-onset bei Transfusionsreaktionen
 Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Transfusionsmedizin. Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich
 Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK
 Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK Seite 1 Übersicht Blutspendewesen und Rotes Kreuz Gesetz
Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK Seite 1 Übersicht Blutspendewesen und Rotes Kreuz Gesetz
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern
 Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin
 UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
L 256/32 Amtsblatt der Europäischen Union
 L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
Immunhämatologische Resultate in der Hausarztpraxis
 Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
CMV in Plasma. Dr. Marijke Weber-Schehl
 CMV in Plasma Dr. Marijke Weber-Schehl Inhalt Nachweis von HCMV in Plasma Ergebnisse Spenderscreening CMV und Plasmaprodukte Weber-Schehl 2 Weber-Schehl 3 Strategie Vermeidung von CMV-Infektionen durch
CMV in Plasma Dr. Marijke Weber-Schehl Inhalt Nachweis von HCMV in Plasma Ergebnisse Spenderscreening CMV und Plasmaprodukte Weber-Schehl 2 Weber-Schehl 3 Strategie Vermeidung von CMV-Infektionen durch
Einführung Risiko- minimierender Maßnahmen zur Prävention einer Hepatitis E Virus- Übertragung durch nicht pathogen-inaktivierte Blutkomponenten
 Paul-Ehrlich-Institut Postfach 63207 Langen Prof. Dr. med. Markus Funk Fachgebietsleiter Pharmakovigilanz II An alle Inhaber einer Zulassung von zellulären Blutzubereitungen und therapeutischem Frischplasma
Paul-Ehrlich-Institut Postfach 63207 Langen Prof. Dr. med. Markus Funk Fachgebietsleiter Pharmakovigilanz II An alle Inhaber einer Zulassung von zellulären Blutzubereitungen und therapeutischem Frischplasma
Infektiöse und nicht-infektiöse Transfusionsrisiken HÄMATOLOGIE HEUTE Berlin, 27. April 2012
 Infektiöse und nicht-infektiöse Transfusionsrisiken HÄMATOLOGIE HEUTE Berlin, 27. April 2012 Dr. med. Beate Mayer Spezielles Immunhämatologisches Labor Institut für Transfusionsmedizin U N I V E R S I
Infektiöse und nicht-infektiöse Transfusionsrisiken HÄMATOLOGIE HEUTE Berlin, 27. April 2012 Dr. med. Beate Mayer Spezielles Immunhämatologisches Labor Institut für Transfusionsmedizin U N I V E R S I
Was macht die Leber krank? Viren und mehr
 Was macht die Leber krank? Viren und mehr Dr. Ruth Zimmermann MPH Abt. für Infektionsepidemiologie Robert Koch Institute Arzt-Patienten-Seminar 10 Jahre Deutsche Leberstiftung Berlin, 01.12.2016 1 Meldungen
Was macht die Leber krank? Viren und mehr Dr. Ruth Zimmermann MPH Abt. für Infektionsepidemiologie Robert Koch Institute Arzt-Patienten-Seminar 10 Jahre Deutsche Leberstiftung Berlin, 01.12.2016 1 Meldungen
Infektion mit dem Zytomegalievirus (CMV) in der Schwangerschaft. CMV-Serologie: IgM, IgG und Avidität? Christoph Koidl April 2013
 Infektion mit dem Zytomegalievirus (CMV) in der Schwangerschaft CMV-Serologie: IgM, IgG und Avidität? Christoph Koidl April 2013 Einleitung-Systematik - Familie: Herpesviridae - Subfamilie: Betaherpesvirinae
Infektion mit dem Zytomegalievirus (CMV) in der Schwangerschaft CMV-Serologie: IgM, IgG und Avidität? Christoph Koidl April 2013 Einleitung-Systematik - Familie: Herpesviridae - Subfamilie: Betaherpesvirinae
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien
 Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit und Soziale Sicherung
 Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit und Soziale Sicherung Bei der 58. Sitzung des Arbeitskreises Blut am 17.03.2005 wurde folgendes Votum (V 31) verabschiedet: Erhöhung
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit und Soziale Sicherung Bei der 58. Sitzung des Arbeitskreises Blut am 17.03.2005 wurde folgendes Votum (V 31) verabschiedet: Erhöhung
Die CMV-Infektion bei Blutspendern und Patienten
 Die CMV-Infektion bei Blutspendern und Patienten Holger Hennig PEI - KOLT 11.05.2011 Das Humane Cytomegalovirus (HCMV) CMV CMV ist ein Herpesvirus DNA im Viruspartikel linear, in der Wirtszelle zirkulär,
Die CMV-Infektion bei Blutspendern und Patienten Holger Hennig PEI - KOLT 11.05.2011 Das Humane Cytomegalovirus (HCMV) CMV CMV ist ein Herpesvirus DNA im Viruspartikel linear, in der Wirtszelle zirkulär,
West-Nil-Virus und Hepatitis E-Virus: durch Bluttransfusion übertragbare Viren
 West-Nil-Virus und Hepatitis E-Virus: durch Bluttransfusion übertragbare Viren 100 nm HEV, Abb.: Center of Disease Control and Prevention WNV, Abb.: Dr. H. Gelderblohm, RKI Institut für Transfusionsmedizin
West-Nil-Virus und Hepatitis E-Virus: durch Bluttransfusion übertragbare Viren 100 nm HEV, Abb.: Center of Disease Control and Prevention WNV, Abb.: Dr. H. Gelderblohm, RKI Institut für Transfusionsmedizin
Rückblick und aktuelle Daten Haemovigilance
 Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Durchflusszytometrische Detektion antigranulozytärer Antikörper
 Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
Interdisziplinäre Beratung und Management von NSV das Frankfurter NSV-Konzept. Sabine Wicker Universitätsklinikum Frankfurt
 Interdisziplinäre Beratung und Management von NSV das Frankfurter NSV-Konzept Sabine Wicker Universitätsklinikum Frankfurt Was kommt jetzt? Fallbericht Blutübertragbare Infektionen Frankfurter NSV-Konzept
Interdisziplinäre Beratung und Management von NSV das Frankfurter NSV-Konzept Sabine Wicker Universitätsklinikum Frankfurt Was kommt jetzt? Fallbericht Blutübertragbare Infektionen Frankfurter NSV-Konzept
1.WielangehättedieBeschaffungdernötigenUnterlagenzurBeantwortung
 Deutscher Bundestag Drucksache 17/11934 17. Wahlperiode 18. 12. 2012 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Dr. Martina Bunge, Diana Golze, Matthias W. Birkwald, weiterer Abgeordneter
Deutscher Bundestag Drucksache 17/11934 17. Wahlperiode 18. 12. 2012 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Dr. Martina Bunge, Diana Golze, Matthias W. Birkwald, weiterer Abgeordneter
SOPS Tranfusionskette SOP-6 Version Nr.: 1 vom Dok. Nr.: 6-SEROLOG DOC Seite 1 von 5
 Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
DRK-Blutspendedienst West Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren?
 Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Die Epidemiologie von HIV in der
 Induction of HIV-1 broadly neutralizing antibodies: The role of host Schweiz and viral determinants Die Epidemiologie von HIV in der Roger D. Kouyos Klinik für Infektionskrankheiten und Spitalhygiene roger.kouyos@usz.ch
Induction of HIV-1 broadly neutralizing antibodies: The role of host Schweiz and viral determinants Die Epidemiologie von HIV in der Roger D. Kouyos Klinik für Infektionskrankheiten und Spitalhygiene roger.kouyos@usz.ch
Hämovigilanzbericht Institut Inspektionen, Medizinprodukte & Hämovigilanz. pharmmed
 Hämovigilanzbericht 8 Bundesamt für Sicherheit im Gesundheitswesen /AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz pharmmed Inhaltsverzeichnis Hämovigilanz 3 Formulare der Hämovigilanz
Hämovigilanzbericht 8 Bundesamt für Sicherheit im Gesundheitswesen /AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz pharmmed Inhaltsverzeichnis Hämovigilanz 3 Formulare der Hämovigilanz
Konformitätsbewertung E 14
 Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9.8 E 14 Richtlinie 98/79/EG über In-vitro-Diagnostika Überprüfung der hergestellten Produkte nach Anhang II Liste A Für die Überprüfung der
Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9.8 E 14 Richtlinie 98/79/EG über In-vitro-Diagnostika Überprüfung der hergestellten Produkte nach Anhang II Liste A Für die Überprüfung der
HIV-Postexpositionsprophylaxe beim Krankenhauspersonal
 HIV-Postexpositionsprophylaxe beim Krankenhauspersonal Stefanie Döbele 16. Symposium Infektionsmedizin in Tübingen 10. März 2018 Übertragungsmöglichkeiten im Gesundheitsbereich Relevant: Blut, blutige
HIV-Postexpositionsprophylaxe beim Krankenhauspersonal Stefanie Döbele 16. Symposium Infektionsmedizin in Tübingen 10. März 2018 Übertragungsmöglichkeiten im Gesundheitsbereich Relevant: Blut, blutige
Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version-
 Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version- Symposium für Praxis- und Pflegekräfte, Hannover-Meeting, 22.Januar 2011 Dr. J. Martens
Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version- Symposium für Praxis- und Pflegekräfte, Hannover-Meeting, 22.Januar 2011 Dr. J. Martens
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18
 VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
Erythrozytensubstitution M.Neuss Quelle: UptoDate 14.1 (4.2006)
 Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Therapie mit Thrombozytenkonzentraten
 Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Transfusionsmedizin Sommersemester Stunde
 Transfusionsmedizin Sommersemester 2005 1.Stunde H. Schrezenmeier Institut für Klinische Transfusionsmedizin und Immungenetik Ulm Abteilung Transfusionsmedizin Ulm Transfusionsmedizin Sommersemester 2005
Transfusionsmedizin Sommersemester 2005 1.Stunde H. Schrezenmeier Institut für Klinische Transfusionsmedizin und Immungenetik Ulm Abteilung Transfusionsmedizin Ulm Transfusionsmedizin Sommersemester 2005
Informationsbroschüre Risiko Hepatitis C
 Dres. med. Fenner & Kollegen Gemeinschaftspraxis für Labormedizin und Humangenetik Informationsbroschüre Risiko Hepatitis C Das Hepatitis-C-Virus ein Silent Killer Dr. med. Claus Fenner FA Laboratoriumsmedizin,
Dres. med. Fenner & Kollegen Gemeinschaftspraxis für Labormedizin und Humangenetik Informationsbroschüre Risiko Hepatitis C Das Hepatitis-C-Virus ein Silent Killer Dr. med. Claus Fenner FA Laboratoriumsmedizin,
Grundlagen für die Vorbereitung auf die Klausur. Immunreaktionen gegen Erythrozyten, Granzulozyten
 Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Verfahren zur Rückverfolgung (Look Back) (gemäß 19 Transfusionsgesetz)
 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 40. Sitzung des Arbeitskreises Blut am 8. November 2000 wurde folgendes Votum (V 24) verabschiedet: Verfahren zur Rückverfolgung
Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 40. Sitzung des Arbeitskreises Blut am 8. November 2000 wurde folgendes Votum (V 24) verabschiedet: Verfahren zur Rückverfolgung
Transfusionsmedizin Grundlagen und praktisches Vorgehen
 Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
Schutz der Patienten vor der schweren Viruserkrankung PML
 Natalizumab bei Multipler Sklerose Schutz der Patienten vor der schweren Viruserkrankung PML Berlin (29. Juni 2012) Das Medikament Natalizumab gilt seit seiner Einführung in Europa vor etwa sechs Jahren
Natalizumab bei Multipler Sklerose Schutz der Patienten vor der schweren Viruserkrankung PML Berlin (29. Juni 2012) Das Medikament Natalizumab gilt seit seiner Einführung in Europa vor etwa sechs Jahren
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004
 PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Infektiöse und nicht-infektiöse Transfusionskomplikationen
 Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Vor Infektionen schützen
 Vor Infektionen schützen Basiswissen zum Impfen Vorlesung WS 2011/2012 Prof. Theo Dingermann, Frankfurt Impfung Immunisierung = prophylaktische Maßnahme. Impfung Immunisierung = prophylaktische Maßnahme.
Vor Infektionen schützen Basiswissen zum Impfen Vorlesung WS 2011/2012 Prof. Theo Dingermann, Frankfurt Impfung Immunisierung = prophylaktische Maßnahme. Impfung Immunisierung = prophylaktische Maßnahme.
Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten
 Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten im Universitätsklinikum Frankfurt am Main Anforderung von Blutkomponenten (1)! Verschreibungspflicht! (Arztunterschrift, patientenbezogen)!
Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten im Universitätsklinikum Frankfurt am Main Anforderung von Blutkomponenten (1)! Verschreibungspflicht! (Arztunterschrift, patientenbezogen)!
Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung
 Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung Inge von Zabern AG Seltene Blutgruppen DGTI 2009 Institut
Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung Inge von Zabern AG Seltene Blutgruppen DGTI 2009 Institut
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut
 www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
5. Fortbildungsveranstaltung für Klinische Hämotherapie
 CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN
 STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
Rückblick oder Prognosen welche Daten benötigen wir
 Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS //
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung,
 Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung, 21.04.2015 Betroffene Arzneimittel und Indikationen Ambroxol ist aktiver Metabolit von Bromhexin
Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung, 21.04.2015 Betroffene Arzneimittel und Indikationen Ambroxol ist aktiver Metabolit von Bromhexin
27 Jahre Octaplas. Ein biochemisch/medizinisches Resümee eines S/D virus inaktivierten, pharmazeutisch hergestellten Plasmas
 27 Jahre Octaplas Ein biochemisch/medizinisches Resümee eines S/D virus inaktivierten, pharmazeutisch hergestellten Plasmas Andrea Neisser-Svae, PhD Head of Business Unit Intensive Care & Emergency Medicine
27 Jahre Octaplas Ein biochemisch/medizinisches Resümee eines S/D virus inaktivierten, pharmazeutisch hergestellten Plasmas Andrea Neisser-Svae, PhD Head of Business Unit Intensive Care & Emergency Medicine
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV
 Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
3.18 Morbus Hodgkin. Kernaussagen. Inzidenz und Mortalität: Nach der Jahrtausendwende
 132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
TSS versus TRALI. Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden
 TSS versus TRALI Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden Hans Pargger, Operative Intensivbehandlung Universitätsspital Basel 2014 TSS T S S Toxic Shock Syndrome TRALI T
TSS versus TRALI Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden Hans Pargger, Operative Intensivbehandlung Universitätsspital Basel 2014 TSS T S S Toxic Shock Syndrome TRALI T
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer
 Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums
 Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung
 www.pei.de Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung V 35 Anhang B1 Hepatitis B Virus (HBV) Untersuchungs-Schema zum Rückverfolgungsverfahren HBsAg Anti-HBc 1
www.pei.de Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung V 35 Anhang B1 Hepatitis B Virus (HBV) Untersuchungs-Schema zum Rückverfolgungsverfahren HBsAg Anti-HBc 1
Infektionsgefährdung und Akzeptanz von Arbeitsschutzmaßnahmen bei Beschäftigten im Gesundheitswesen. Sabine Wicker 23. April 2013
 Infektionsgefährdung und Akzeptanz von Arbeitsschutzmaßnahmen bei Beschäftigten im Gesundheitswesen Sabine Wicker 23. April 2013 Was kommt jetzt? Zahlen zum Berufskrankheitengeschehen Daten zur Epidemiologie
Infektionsgefährdung und Akzeptanz von Arbeitsschutzmaßnahmen bei Beschäftigten im Gesundheitswesen Sabine Wicker 23. April 2013 Was kommt jetzt? Zahlen zum Berufskrankheitengeschehen Daten zur Epidemiologie
Blutübertragbare Erkrankungen Hepatitiden, HIV
 Blutübertragbare Erkrankungen Hepatitiden, HIV Barbara Klesse, Hygieneberaterin Hygieneforum, Juni 2005 Hepatitiden (HAV, HBV, HCV ) Infektionen der Leber mit Viren Andere Ursachen: Alkohol, Medikamente,
Blutübertragbare Erkrankungen Hepatitiden, HIV Barbara Klesse, Hygieneberaterin Hygieneforum, Juni 2005 Hepatitiden (HAV, HBV, HCV ) Infektionen der Leber mit Viren Andere Ursachen: Alkohol, Medikamente,
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 14/18
 VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 4/8 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 4/8 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
DDT Notfälle Transfusionszwischenfall 16.10.2009. Dr. J. Martens Institut für Transfusionsmedizin
 DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
Middle East Respiratory Syndrome - MERS-Coronavirus
 Middle East Respiratory Syndrome - MERS-Coronavirus Stephan Aberle Department für Virologie, Medizinische Universität Wien Nationale Referenzzentrale für Influenza und respiratorische Virusinfektionen
Middle East Respiratory Syndrome - MERS-Coronavirus Stephan Aberle Department für Virologie, Medizinische Universität Wien Nationale Referenzzentrale für Influenza und respiratorische Virusinfektionen
Hepatitis B-Impfung B Adoleszenten
 Hepatitis B-Impfung B von Adoleszenten Soll ich meine jugendlichen Kinder impfen lassen? Was nützt es? Wieviel schadet es? Thomas Bregenzer Kantonsspital Aarau Was nützt es? Wie viel schadet es? Impfen
Hepatitis B-Impfung B von Adoleszenten Soll ich meine jugendlichen Kinder impfen lassen? Was nützt es? Wieviel schadet es? Thomas Bregenzer Kantonsspital Aarau Was nützt es? Wie viel schadet es? Impfen
1 / 6. Erythrozytenkonzentrat in Additivlösung aus Vollblutentnahme
 1 / 6 Erythrozytenkonzentrat in Additivlösung aus Vollblutentnahme Identifizierung des Arzneimittels a) Bezeichnung Erythrozytenkonzentrat SAGM Th-J b) Stoffgruppe zelluläre Blutzubereitung Anwendungsgebiete
1 / 6 Erythrozytenkonzentrat in Additivlösung aus Vollblutentnahme Identifizierung des Arzneimittels a) Bezeichnung Erythrozytenkonzentrat SAGM Th-J b) Stoffgruppe zelluläre Blutzubereitung Anwendungsgebiete
Gefiltertes Erythrozytenkonzentrat (PF)
 1/5 Gebrauchsinformation und Fachinformation Gefiltertes Erythrozytenkonzentrat (PF) 1. Identifizierung des Arzneimittels a) Bezeichnung Gefiltertes Erythrozytenkonzentrat (PF) b) Stoffgruppe zelluläre
1/5 Gebrauchsinformation und Fachinformation Gefiltertes Erythrozytenkonzentrat (PF) 1. Identifizierung des Arzneimittels a) Bezeichnung Gefiltertes Erythrozytenkonzentrat (PF) b) Stoffgruppe zelluläre
medexter clinical decision support
 medexter Daten, Wissen und Transparenz in der klinischen Entscheidungsunterstützung Klaus-Peter Adlassnig Medexter Healthcare Borschkegasse 7/5, A-1090 Vienna www.medexter.com and Section for Artificial
medexter Daten, Wissen und Transparenz in der klinischen Entscheidungsunterstützung Klaus-Peter Adlassnig Medexter Healthcare Borschkegasse 7/5, A-1090 Vienna www.medexter.com and Section for Artificial
Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel)
 Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel) Wichtige Sicherheitsinformationen zur Minimierung des Risikos von KYMRIAH Der Wirkstoff von KYMRIAH heißt Tisagenlecleucel. Diese Bezeichnung
Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel) Wichtige Sicherheitsinformationen zur Minimierung des Risikos von KYMRIAH Der Wirkstoff von KYMRIAH heißt Tisagenlecleucel. Diese Bezeichnung
Erythrozytentransfusion, kritische Indikationsstellung
 Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
1/5. 1. Identifizierung des Arzneimittels a) Bezeichnung Erythrozytapheresekonzentrat / bestrahlt DRK-Blutspendedienst
 1/5 DRK-Blutspendedienst Baden-Württemberg - Hessen ggmbh Friedrich-Ebert-Str. 107, 68167 Mannheim, Telefon (0621) 37060 Gebrauchsinformation und Fachinformation - aufmerksam lesen! Die Angaben dieser
1/5 DRK-Blutspendedienst Baden-Württemberg - Hessen ggmbh Friedrich-Ebert-Str. 107, 68167 Mannheim, Telefon (0621) 37060 Gebrauchsinformation und Fachinformation - aufmerksam lesen! Die Angaben dieser
Enterovirus/Parechovirus Infektionen. Daniela Huzly Institut für Virologie Freiburg
 Enterovirus/Parechovirus Infektionen Daniela Huzly Institut für Virologie Freiburg Virologie Beide gehören zur Familie der PICORNAVIRIDAE Enteroviren werden traditionell unterteilt in: Poliovirus 1 3 Echoviren
Enterovirus/Parechovirus Infektionen Daniela Huzly Institut für Virologie Freiburg Virologie Beide gehören zur Familie der PICORNAVIRIDAE Enteroviren werden traditionell unterteilt in: Poliovirus 1 3 Echoviren
Institut für Nieren- und Hochdruckkrankheiten Rostock
 HEPATITIS. Aspekte Ann Michelsen, R.E.Winkler, M.Tieß, W.Ramlow, Gabriele Weber, Doris Hofmann, Jana-Maria Schneidewind, H.Prophet Dialyse-Gemeinschaft Nord e.v.- Institut für Nieren- und Hochdruckkrankheiten
HEPATITIS. Aspekte Ann Michelsen, R.E.Winkler, M.Tieß, W.Ramlow, Gabriele Weber, Doris Hofmann, Jana-Maria Schneidewind, H.Prophet Dialyse-Gemeinschaft Nord e.v.- Institut für Nieren- und Hochdruckkrankheiten
