Mit dem Meldebogen (1b) sollen solche Ereignisse erfasst werden, bei denen eines oder mehrere der folgenden Kriterien erfüllt sind:
|
|
|
- Karoline Wagner
- vor 6 Jahren
- Abrufe
Transkript
1 Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am Das Paul-Ehrlich-Institut nutzt die Neufassung des AMG, um im Folgenden die Meldeverpflichtungen für schwerwiegende Zwischenfälle und unerwünschte Reaktionen bei der Blut- und Gewebezubereitung zu veranschaulichen. Definition des schwerwiegenden Zwischenfalls Nach 63i Abs. 6 AMG ist ein schwerwiegender Zwischenfall: jedes unerwünschte Ereignis im Zusammenhang mit der Gewinnung, Untersuchung, Aufbereitung, Be- oder Verarbeitung, Konservierung, Aufbewahrung oder Abgabe von Geweben oder Blutzubereitungen, das die Übertragung einer ansteckenden Krankheit, den Tod oder einen lebensbedrohenden Zustand, eine Behinderung oder einen Fähigkeitsverlust von Patienten zur Folge haben könnte oder einen Krankenhausaufenthalt erforderlich machen oder verlängern könnte oder zu einer Erkrankung führen oder diese verlängern könnte. Umsetzung der beschriebenen Meldepflicht Der Verdacht eines schwerwiegenden Ereignisses (Zwischenfall) im Zusammenhang mit der Herstellung oder der Anwendung von Blutprodukten bezieht sich in erster Line auf die Einrichtungen, in denen Blutprodukte hergestellt, transportiert oder gelagert werden. Treten Zwischenfälle bei der Abgabe oder Anwendung des Produktes auf, können die Einrichtungen und/oder der behandelnde Arzt betroffen sein. Mit dem Meldebogen (1b) sollen solche Ereignisse erfasst werden, bei denen eines oder mehrere der folgenden Kriterien erfüllt sind: a) Auslieferung von fehlerhaften Produkten b) Ereignisse, die wiederholt in einer Einrichtung auftreten und somit auf einen fehlerhaften Arbeitsprozess zurückgeführt werden können c) Ereignisse, die als kritisch zu bewerten sind, auch wenn es nicht zur Auslieferung der Blutprodukte gekommen ist. d) Fehltransfusionen ohne schwerwiegende Reaktion des Empfängers Ein Beispiel für einen meldepflichtigen Zwischenfall wie unter Punkt a) beschrieben, ist die Fehletikettierung eines ausgelieferten Blutbeutels oder die Auslieferung eines defekten Blutbeutels (z.b. wegen eines Materialfehlers). Schäden aufgrund einer unsachgemäßen Handhabung durch den Anwender unterliegen nicht der Meldepflicht. Ein Beispiel für einen meldepflichtigen Zwischenfall wie unter Punkt b) beschrieben, ist das wiederholte Auftreten von inkompletten Schweißnähten oder Fehletikettierungen, auch wenn es nicht zur Auslieferung der hergestellten Blutprodukte gekommen ist.
2 Ein unter Punkt c) genanntes kritisches Ereignis wäre z.b. eine außergewöhnliche Kontamination die während der Herstellung festgestellt wird, ohne dass es zur Auslieferung der hergestellten Blutprodukte gekommen ist. Zu d) Mit der 16. AMG Novelle sind nun auch Fehltransfusionen meldepflichtige Ereignisse. Sofern es nicht zu einer schwerwiegenden Reaktion des Empfängers kommt, sind diese Ereignisse als schwerwiegender Zwischenfall zu melden. Tritt eine Reaktion beim Empfänger auf, ist diese Reaktion unabhängig vom Schweregrad als schwerwiegende unerwünschte Reaktion melden. Nicht als Zwischenfall gemeldet werden sollen alle anderen Ereignisse, die im Rahmen der Qualitätssicherung bereits erfasst wurden, deren negative Auswirkungen durch die Erfassung des fehlerhaften Prozesses korrigiert werden konnten bzw. bei denen eine Auslieferung des Blutproduktes verhindert wurde. Definition der schwerwiegenden unerwünschten Reaktionen Nach 63i Abs. 7 AMG ist eine schwerwiegende unerwünschte Reaktion: eine unbeabsichtigte Reaktion einschließlich einer übertragbaren Krankheit beim Spender oder Empfänger, die tödlich oder lebensbedrohlich verläuft oder eine Behinderung oder einen Fähigkeitsverlust zur Folge hat oder einen Krankenhausaufenthalt erforderlich macht oder verlängert oder zu einer Erkrankung führt oder diese verlängert und im Zusammenhang mit der Gewinnung oder Transfusion von Blut und Blutbestandteilen steht. Bei den Definitionen der Transfusionsreaktionen gibt es eine weitgehende Übereinstimmung zwischen den Empfehlungen des PEI und den Empfehlungen des European Haemovigilance Network. Im Folgenden werden die aktuellen Kriterien für die einzelnen Transfusionsreaktionen aufgelistet und den entsprechenden Meldebögen des PEI zugeordnet. Der initiale Verdacht auf eine Transfusionsreaktion ist auf dem Basismeldebogen (1a) zu dokumentieren. Für die Dokumentation der weiteren Abklärung sollen die Folgemeldebögen (2a, 2b, 2c) verwendet werden. Der Verdacht einer hämolytischen Transfusionsreaktion (HTR) liegt vor, wenn eines oder mehrere der folgenden Kriterien erfüllt sind (Meldebogen 2a): - Fieber mit anderen Symptome (Atemnot, Hypotension, Tachykardie, Schmerzen in der Nierengegend) - Inadäquater Anstieg des Hämoglobinwertes nach Transfusion - Abfall des Hämoglobinwertes > 2g/dl innerhalb von 24 Std. - Anstieg des LDH > 50% in 24 Std. - Anstieg des Bilirubinwertes, Hämoglobinämie, Abfall des Haptoglobins in zeitlichem Zusammenhang mit der Transfusion - Makrohämaturie Eine Hämolytische Transfusionsreaktion (HTR) wird bestätigt durch: - Positiver Antiglobulintest 2
3 - Positive Kreuzprobe Es wird klinisch zwischen zwei Subtypen unterschieden: Akute HTR: Symptome innerhalb von 24 Std. Verzögerte HTR: Symptome zwischen 1-28 Tagen Der Verdachtsfall einer hämolytischen Transfusionsreaktion ist immer als schwerwiegend einzustufen, da beim Auftreten eines der Symptome eine engmaschige Überwachung und ggf. therapeutische Maßnahmen erforderlich sind. Der Verdacht einer allergischen Transfusionsreaktion (ATR) ist gegeben, beim Auftreten der folgenden Symptome innerhalb von 24 Stunden nach Transfusion (siehe auch Meldebogen 2a): - Hautausschlag - Allergische Atemnot - Angioödem - Juckreiz - Nesselsucht - Abfall des systolischen Blutdruckes < 30 mm Hg Eine schwere allergische bzw. anaphylaktoide Reaktion ist definiert durch das Auftreten eines oder mehrerer der folgenden Symptome innerhalb von 24 Std. nach Transfusion: - Abfall des systolischen Blutdruckes > 30 mm Hg - Anstieg der Herzfrequenz > 30/ min (Definition der Tachykardie) - Dyspnoe - Larynxödem - Bronchospasmus/ Zyanose - Schock/ Kreislaufstillstand Der Verdacht einer transfusionsbedingten bakteriellen Infektion (TTBI) liegt vor, wenn eines oder mehrere der folgenden Kriterien erfüllt sind (Meldebogen 2a): Auftreten folgender Symptome innerhalb von 24 Std. nach Transfusion - Fieber > 39 C oder ein Anstieg um 2 C - Schüttelfrost - Tachykardie Der Verdacht der transfusionsbedingten bakteriellen Infektion wird erhärtet durch den Nachweis des Bakteriums im transfundierten Blutprodukt oder beim Empfänger. Der Verdacht der transfusionsbedingten bakteriellen Infektion wird bestätigt durch den Nachweis desselben Bakterienstammes im Empfängerblut und transfundierten Blutprodukt. 3
4 Der Verdachtsfall einer transfusionsbedingten bakteriellen Infektion ist immer als schwerwiegend einzustufen und damit meldepflichtig. Der Verdacht einer transfusionsbedingten viralen Infektion (TTVI) ist gegeben, wenn beim Empfänger eine Infektion nachgewiesen ist und weitere Anhaltspunkte vorliegen (z. B. bekannte negative Serologie beim Empfänger vor Transfusion, klinische Symptome im zeitlichen Zusammenhang zur Transfusion, etc.). Verdachtsfälle von viralen Infektionsübertragungen sind immer als schwerwiegend einzustufen und damit meldepflichtig. Zur Abklärung des möglichen Kausalzusammenhangs ist das vom Empfänger ausgehende Rückverfolgungsverfahrens durchzuführen (entsprechend den Voten 34, 35 und 42 des Arbeitskreises Blut). Die Ergebnisse sind auf dem Meldebogen 2b zu dokumentieren. Eine transfusionsassoziierte akute Lungeninsuffizienz (TRALI) wird bestätigt, wenn die folgenden klinischen Kriterien erfüllt sind (Meldebogen 2c): - Akute Atemnot (Symptomatik innerhalb von 6 h nach Transfusionsbeginn) - Neu aufgetretenes beidseitiges Lungenödem, radiologisches gesichert - Ausschluss einer Hypervolämie (kardial, renal, iatrogen) Eine immunogene transfusionsassoziierte akute Lungeninsuffizienz ist wahrscheinlich, wenn bei dem Spender oder einem der Spender humane leukozytäre Antikörper (HLA-AK) oder humane neutrophile Antikörper (HNA-AK) nachgewiesen wurden. Eine immunogene transfusionsassoziierte akute Lungeninsuffizienz ist bestätigt, wenn bei einem der Spender humane leukozytäre Antikörper nachgewiesen wurden und bei dem Empfänger ein korrespondierendes Antigen vorliegt bzw. wenn bei einem der Spender ein humaner neutrophiler Antikörper nachgewiesen wurden. Der Verdachtsfall einer transfusionsassoziierten akuten Lungeninsuffizienz ist immer als schwerwiegend einzustufen und damit zu melden. Zur Abklärung des möglichen Kausalzusammenhangs ist ein vom Empfänger ausgehendes Lookback- Verfahren entsprechend dem Meldebogen 2c durchzuführen. Hierbei sollten alle weiblichen Spender auf leukozytäre Antikörper untersucht werden, deren Blutprodukte in einem Zeitraum von 6 Stunden vor dem Einsetzen der TRALI- Symptomatik transfundiert wurden. Männliche Spender sollten dann auf leukozytäre Antikörper untersucht werden, wenn bei ihnen eine positive Transfusionsanamnese vorliegt bzw. der hochgradige Verdacht auf eine stattgefundene Transfusion besteht. Die Untersuchungen auf HLA- Klasse I / II- und HNA- Antikörper sollten entsprechend den Empfehlungen der ISBT Working Party [Goldmann M, et al. Transfus Med Rev. 2005; 19: 2 31] durchgeführt und die Ergebnisse der Untersuchungen wie vorgegeben dokumentiert werden. Spender mit HNA- Antikörper müssen von der weiteren Spende für labile Blutkomponenten ausgeschlossen werden. Spender mit HLA- Klasse I / II Antikörper sollten von der Spende für 4
5 therapeutisches Frischplasma ausgeschlossen werden. Das Plasma aller positiv getesteten Spender kann zur Herstellung von Fraktionierungsprodukten abgegeben werden. Eine febrile nicht hämolytische Transfusionsreaktion (FNHTR) ist wahrscheinlich, wenn eines oder mehrere der folgenden Symptome innerhalb von 4 Std. nach Transfusion auftreten: - Fieber >38 C oder ein Anstieg um 1 C - Frösteln - Kältegefühl - Schüttelfrost - Ausschluss einer anderen Ursache, wie HTR oder TTBI In den meisten Fällen sind Verdachtsfälle von febrilen Transfusionsreaktionen nicht als schwerwiegend einzustufen. Einleitung eines vom Spender ausgehenden Rückverfolgsverfahrens (Look-Back- Verfahren) Nach 63i Abs. 2 AMG sind.. Reaktionen auf ihre Ursache und Auswirkung zu untersuchen und zu bewerten und die Ergebnisse der zuständigen Bundesoberbehörde unverzüglich mitzuteilen, ebenso die Maßnahmen zur Rückverfolgung und zum Schutz der Spender und Empfänger. Vorbemerkung zu den Meldebögen Eine übertragbare Erkrankung beim Spender ist eine schwerwiegende unerwünschte Reaktion im Sinne von 63i (7) AMG. Sie ist daher nach 63i (2) AMG unverzüglich spätestens aber innerhalb von 15 Tagen der Bundesoberbehörde zu melden. Dies gilt in erster Linie für Mehrfachspender. Die Meldung nach 19 TFG an die zuständige Landesbehörde und die epidemiologische Meldung nach 22 TFG an das RKI bleiben davon unberührt. Rückverfolgsverfahren Die Rückverfolgung ist entsprechend den Voten 34, 35 und 42 des Arbeitskreises Blut für HBV, HCV, HIV durchzuführen: - Nach Votum 34 wird das Rückverfolgungsverfahren eingeleitet, wenn sich aus Untersuchungen nach 2.2 bei einem Mehrfachspender der begründete Verdacht nach 2.4 einer Infektion ergibt und vorausgehende Spenden ermittelt wurden. Solange die Infektion des Spenders durch weitere Untersuchungen nicht bestätigt ist, ist eine Meldung nicht erforderlich. - Die Einleitung eines Rückverfolgungsverfahrens kann sich entsprechend dem Votum 34 auch ergeben, wenn nachträglich Zweifel an der Validität eines verwendeten Testsystems aufkommen oder sich der begründete Verdacht einer Infektion infolge anamnestischer Angaben, von Symptomen oder einer Erkrankung ergibt. 5
6 Die Meldung für Mehrfachspender umfasst: Meldebogen 3a: Einleitung des Rückverfolgungsverfahrens Meldebogen 3b: Abschluss des Rückverfolgungsverfahrens Ergibt sich im Laufe eines Rückverfolgungsverfahrens nach V /6.5/6.13 bei der Untersuchung von Nachuntersuchungsproben, von weiteren verfügbaren Proben aus Blutentnahmen des Spenders oder eines Empfängers der begründete Verdacht auf Infektiosität bei früheren Spenden, wird der Rückverfolgungszeitraum erweitert (erweitertes Rückverfolgungsverfahren). Handelt es sich um einen Erstspender ist optional eine Anzeige auf dem Meldebogen 3a mit entsprechender Dokumentation erforderlich. Entscheidet die verantwortliche Person die Einleitung eines vom Spender ausgehenden Rückverfolgungsverfahrens wegen eines anderen Erregers (z. B. Prionen, Plasmodium, etc.), der zu schwerwiegenden Krankheitsverläufen führen könnte, so soll dies auf den Meldebögen entsprechend dokumentiert werden. Insbesondere der Verdacht auf die neue Variante der Creutzfeldt-Jakob- Krankheit bei Blut- und Plasma-Spender sollte unverzüglich dem PEI (siehe Meldebogen 1a und 3a) und dem RKI gemeldet werden, damit die Abklärung in den nationalen Referenzzentren beschleunigt werden kann. Solange der Verdachtsfall auf vcjd nicht abgeklärt wurde, dürfen Blutprodukte dieses Spenders nicht freigegeben bzw. ausgeliefert werden. Mit der Bestätigung des Verdachtsfalls auf vcjd muss ein sofortiger Rückruf aller ausgelieferten Produkte erfolgen, einschließlich aller betroffenen Arzneimittel, die im Rahmen eines Fraktionierungsverfahrens hergestellt wurden (siehe und Votum 33 des Arbeitskreises Blut). Adresse: pharmakovigilance2@pei.de Tel.: Fax.: Paul-Ehrlich-Institut, Abteilung S: Arzneimittelsicherheit, Referat S2: Pharmakovigilanz II Paul-Ehrlich-Strasse 51-59, Langen, Germany Ansprechpartner im Paul-Ehrlich-Institut: Dr. A. Lohmann pharmakovigilanz2@pei.de Telefon:
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller
 Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
hier: Abwehr von Arzneimittelrisiken Testung auf Antikörper gegen Hepatitis-B-Core-Antigen (anti-hbc) im Blutspendewesen
 Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Akute hämolytische TR. Schmerzen in der Nierengegend Hypotonie Übelkeit, Erbrechen RR-Abfall Blutiger Urin (auch bei Schock) Nierenversagen Schock
 Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Gesetzliche Grundlagen und Meldepflicht
 Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS //
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
Applikation. gegeben von / bis. Anlage 1
 BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN
 STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit
 Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 61. Sitzung des Arbeitskreises Blut am 11.01.2006 wurde folgendes Votum (V33) verabschiedet: Vorgehensweise bei Variante
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 61. Sitzung des Arbeitskreises Blut am 11.01.2006 wurde folgendes Votum (V33) verabschiedet: Vorgehensweise bei Variante
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2010 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2010 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen
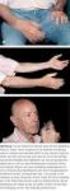 Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
AW-Merkblatt Klassierung und Abklärung von Transfusionsreaktionen
 Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Die Transfusion von Blutpräparaten
 Die Transfusion von Blutpräparaten Ein Leitfaden für die Kitteltasche DRK-Blutspendedienst Baden-Württemberg - Hessen gemeinnützige GmbH Institut für Transfusionsmedizin und Immunhämatologie Sandhofstraße
Die Transfusion von Blutpräparaten Ein Leitfaden für die Kitteltasche DRK-Blutspendedienst Baden-Württemberg - Hessen gemeinnützige GmbH Institut für Transfusionsmedizin und Immunhämatologie Sandhofstraße
Impfstoffsicherheit in Deutschland
 Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Transfusionsmedizin. Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich
 Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung
 www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
Klassierung und Abklärung von Transfusionsreaktionen
 Haemovigilance Workshop, 19. Mai 2014 Klassierung und Abklärung von Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Haemovigilance Workshop, 19. Mai 2014 Klassierung und Abklärung von Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Originalien und Übersichten. Wesentliche Voraussetzungen für ein funktionierendes Hämovigilanzsystem sind die genaue Dokumentation der unerwünschten
 Originalien und Übersichten Bundesgesundheitsbl 2010 53:347 356 DOI 10.1007/s00103-010-1037-8 Online publiziert: 7. März 2010 Springer-Verlag 2010 M.B. Funk S. Günay A. Lohmann O. Henseler B. Keller-Stanislawski
Originalien und Übersichten Bundesgesundheitsbl 2010 53:347 356 DOI 10.1007/s00103-010-1037-8 Online publiziert: 7. März 2010 Springer-Verlag 2010 M.B. Funk S. Günay A. Lohmann O. Henseler B. Keller-Stanislawski
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut
 www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
Verfahren zur Rückverfolgung (Look Back) (gemäß 19 Transfusionsgesetz)
 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 40. Sitzung des Arbeitskreises Blut am 8. November 2000 wurde folgendes Votum (V 24) verabschiedet: Verfahren zur Rückverfolgung
Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 40. Sitzung des Arbeitskreises Blut am 8. November 2000 wurde folgendes Votum (V 24) verabschiedet: Verfahren zur Rückverfolgung
Daten Haemovigilance
 Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern
 Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Bewertung des kausalen Zusammenhangs eines Verdachts einer HIV-Übertragung beim Empfänger durch Blut und Blutkomponenten
 Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG
 Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG 12:00 Uhr Begrüßung, M. Heiden, PEI 12:10 Uhr Einführung gesetzliche Neuregelung, H.M. Huber, PEI 12:50 Uhr
Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG 12:00 Uhr Begrüßung, M. Heiden, PEI 12:10 Uhr Einführung gesetzliche Neuregelung, H.M. Huber, PEI 12:50 Uhr
5. Fortbildungsveranstaltung für Klinische Hämotherapie
 CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion
 Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Therapie mit Thrombozytenkonzentraten
 Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
DDT Notfälle Transfusionszwischenfall 16.10.2009. Dr. J. Martens Institut für Transfusionsmedizin
 DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
WICHTIGE INFORMATIONEN FÜR PATIENTEN
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
Transfusionspraxis. Perioperatives Management. von Gabriele Walther-Wenke, Günter Singbartl. 1. Auflage. Springer-Verlag Berlin Heidelberg 2003
 Transfusionspraxis Perioperatives Management von Gabriele Walther-Wenke, Günter Singbartl 1. Auflage Springer-Verlag Berlin Heidelberg 2003 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 540 00631
Transfusionspraxis Perioperatives Management von Gabriele Walther-Wenke, Günter Singbartl 1. Auflage Springer-Verlag Berlin Heidelberg 2003 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 540 00631
Infektiöse und nicht-infektiöse Transfusionskomplikationen
 Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Unverzichtbar für ein effizientes Beobachtungs- und Meldesystem sind:
 Medizintechnologie.de Vigilanzsystem Probleme mit Medizinprodukten treten häufig erst auf, nachdem die Produkte bereits langfristig im Einsatz sind oder von einer größeren Population von Anwendern oder
Medizintechnologie.de Vigilanzsystem Probleme mit Medizinprodukten treten häufig erst auf, nachdem die Produkte bereits langfristig im Einsatz sind oder von einer größeren Population von Anwendern oder
Am Robert Koch Institut erfasste Daten zur konnatalen Toxoplasmose
 Am Robert Koch Institut erfasste Daten zur konnatalen Toxoplasmose Dr. Katharina Alpers Robert Koch Institut, Berlin Grundlage für Überwachung von Infektionskrankheiten BRD: 1961-2000 Bundes-Seuchengesetz
Am Robert Koch Institut erfasste Daten zur konnatalen Toxoplasmose Dr. Katharina Alpers Robert Koch Institut, Berlin Grundlage für Überwachung von Infektionskrankheiten BRD: 1961-2000 Bundes-Seuchengesetz
Übersicht TRALI heute
 Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
Paul-Ehrlich-Institut Bundesamt für Sera und Impfstoffe
 Hintergrundinformationen zur Leukozytendepletion 1. Bisheriger Ablauf des Verfahrens Die Technik der Leukozytendepletion wurde in den letzten Jahren als eine Methode zur Verbesserung der Qualität von Transfusionen
Hintergrundinformationen zur Leukozytendepletion 1. Bisheriger Ablauf des Verfahrens Die Technik der Leukozytendepletion wurde in den letzten Jahren als eine Methode zur Verbesserung der Qualität von Transfusionen
Stationäre Krankenhausbehandlung. multiresistenten Tuberkulose
 Stationäre Krankenhausbehandlung von Tuberkulosepatienten und Management der multiresistenten Tuberkulose Arbeitskreis Tuberkulose im Fachausschuss Infektionsschutz des BVÖGD Martin Priwitzer Gesundheitsamt
Stationäre Krankenhausbehandlung von Tuberkulosepatienten und Management der multiresistenten Tuberkulose Arbeitskreis Tuberkulose im Fachausschuss Infektionsschutz des BVÖGD Martin Priwitzer Gesundheitsamt
Ergänzende Empfehlungen zur Testung von Blut- und Plasmaspenden und zum Rückverfolgungsverfahren
 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Rechtliche Grundlagen für die Anwendung von Blutprodukten
 Weiterbildungsseminar Bielefeld 2013 Rechtliche Grundlagen für die Anwendung von Blutprodukten Gabriele Walther-Wenke Zentrum für Transfusionsmedizin Münster DRK Blutspendedienst West Das Bundesgesundheitsamt
Weiterbildungsseminar Bielefeld 2013 Rechtliche Grundlagen für die Anwendung von Blutprodukten Gabriele Walther-Wenke Zentrum für Transfusionsmedizin Münster DRK Blutspendedienst West Das Bundesgesundheitsamt
Erfahrungen mit dem Anti-HBc-Stufenplan 2006
 Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
Haemovigilance Jahresbericht 2008
 Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Verfahren zur Rückverfolgung (Look Back) (gemäß 19 Transfusionsgesetz)
 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 62. Sitzung des Arbeitskreises Blut am 14.06.2006 wurde folgendes Votum (V 34) verabschiedet: Verfahren zur Rückverfolgung
Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 62. Sitzung des Arbeitskreises Blut am 14.06.2006 wurde folgendes Votum (V 34) verabschiedet: Verfahren zur Rückverfolgung
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums
 Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Dokumenten-Nr.: Bewertung von Abweichungen, Fehlern und Mängeln 2/5
 Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
DRK-Blutspendedienst West Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren?
 Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
Erythrozytensubstitution M.Neuss Quelle: UptoDate 14.1 (4.2006)
 Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Rückblick oder Prognosen welche Daten benötigen wir
 Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin
 UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
Qualitätssicherung bei Transfusionen und Hämotherapie
 ÄRZTEKAMMER Stand: 02.06.2016 Qualitätssicherung bei Transfusionen und Hämotherapie Hinweise zur Anwendung der Richtlinien Hämotherapie Mit der am 5. November 2005 erfolgten vollständigen Novellierung
ÄRZTEKAMMER Stand: 02.06.2016 Qualitätssicherung bei Transfusionen und Hämotherapie Hinweise zur Anwendung der Richtlinien Hämotherapie Mit der am 5. November 2005 erfolgten vollständigen Novellierung
SOPS Tranfusionskette SOP-6 Version Nr.: 1 vom Dok. Nr.: 6-SEROLOG DOC Seite 1 von 5
 Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Im Vordergrund steht die Bewertung der Herstellungsverfahren. Erfüllt das Produkt seine Funktion und ist es nicht schädlich für den Patienten?
 Institut für Klinische Transfusionsmedizin und Hämotherapie Direktor: Prof. Dr. M. Böck Vereinfachtes Genehmigungsverfahren nach 21a AMG für Stammzellzubereitungen Endproduktspezifikation Informationsveranstaltung
Institut für Klinische Transfusionsmedizin und Hämotherapie Direktor: Prof. Dr. M. Böck Vereinfachtes Genehmigungsverfahren nach 21a AMG für Stammzellzubereitungen Endproduktspezifikation Informationsveranstaltung
Immunhämatologische Resultate in der Hausarztpraxis
 Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Hämovigilanz Bericht 2002/2003
 Seite 1 Einleitung Am 1.1.2002 trat das neue Heilmittelgesetz in Kraft. Damit wurde die Swissmedic für die Hämovigilanz zuständig und begann ein nationales Hämovigilanz-System aufzubauen. Aufgaben und
Seite 1 Einleitung Am 1.1.2002 trat das neue Heilmittelgesetz in Kraft. Damit wurde die Swissmedic für die Hämovigilanz zuständig und begann ein nationales Hämovigilanz-System aufzubauen. Aufgaben und
Grundlagen für die Vorbereitung auf die Klausur. Immunreaktionen gegen Erythrozyten, Granzulozyten
 Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Risiken der Transfusion von Blut und Blutprodukten
 Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Blutgruppenserologie und Immunhämatologie
 Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Organisation der klinischen und ambulanten Hämotherapie in Deutschland
 Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Durchflusszytometrische Detektion antigranulozytärer Antikörper
 Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
INFEKT-INFO. Ausgabe September Hygiene Institut Hamburg Im Dienste der Gesundheit
 FREIE UND HANSESTADT HAMBURG Zentrum für Impfmedizin und Infektionsepidemiologie des Hygiene Institutes Hygiene Institut Hamburg Im Dienste der Gesundheit INFEKT-INFO Herausgeber: Infektionsepidemiologie
FREIE UND HANSESTADT HAMBURG Zentrum für Impfmedizin und Infektionsepidemiologie des Hygiene Institutes Hygiene Institut Hamburg Im Dienste der Gesundheit INFEKT-INFO Herausgeber: Infektionsepidemiologie
N Vectibix ist kontraindiziert bei Patienten mit einer Vorgeschichte schwerer oder lebensbedrohlicher Überempfindlichkeitsreaktionen gegen Vectibix.
 AMGE GmbH Postfach 50 0110 80971 München München, 19 April 2010 Vectibix (Panitumumab) Wichtige sicherheitsrelevante Informationen für Angehörige der medizinischen Heilberufe bezüglich schwerwiegender
AMGE GmbH Postfach 50 0110 80971 München München, 19 April 2010 Vectibix (Panitumumab) Wichtige sicherheitsrelevante Informationen für Angehörige der medizinischen Heilberufe bezüglich schwerwiegender
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab)
 Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen
 BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
Interaktive Fallbesprechung
 Interaktive Fallbesprechung Haemovigilance Workshop 13.Februar 2012 M. Jutzi, M.Rüesch Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000
Interaktive Fallbesprechung Haemovigilance Workshop 13.Februar 2012 M. Jutzi, M.Rüesch Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000
An die Pandemie-Beauftragten der Kassenärztlichen Vereinigungen der Bundesrepublik Deutschland
 An die Vorstände der Kassenärztlichen Vereinigungen der Bundesrepublik Deutschland An die Pandemie-Beauftragten der Kassenärztlichen Vereinigungen der Bundesrepublik Deutschland Dezernat 1 Innovation und
An die Vorstände der Kassenärztlichen Vereinigungen der Bundesrepublik Deutschland An die Pandemie-Beauftragten der Kassenärztlichen Vereinigungen der Bundesrepublik Deutschland Dezernat 1 Innovation und
Rechtliche Grundlagen für die Herstellung von Blutprodukten
 Rechtliche Grundlagen für die Herstellung von Blutprodukten Weiterbildungsseminar des BDT und der DGTI Bielefeld, April 2013 Ruth Offergeld Robert Koch-Institut, Berlin Blutspendeeinrichtungen als Pharmazeutische
Rechtliche Grundlagen für die Herstellung von Blutprodukten Weiterbildungsseminar des BDT und der DGTI Bielefeld, April 2013 Ruth Offergeld Robert Koch-Institut, Berlin Blutspendeeinrichtungen als Pharmazeutische
XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v. 20.-21. November 2015 in Berlin
 XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v. 20.-21. November 2015 in Berlin Dr. iur. Bita Bakhschai Rechtsanwältin Fachanwältin für Medizinrecht Wirtschaftsjuristin (Univ. Bayreuth) Rechtsanwälte
XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v. 20.-21. November 2015 in Berlin Dr. iur. Bita Bakhschai Rechtsanwältin Fachanwältin für Medizinrecht Wirtschaftsjuristin (Univ. Bayreuth) Rechtsanwälte
Vergleich Richtlinie Hämotherapie 2010 und 2017
 2010 (alt) 2017 (neu) Abschnitt Inhalt Abschnitt Inhalt 1.4 Qualitätsmanagement (QM)/Qualitätssicherung 6 Qualitätsmanagement und Qualitätssicherung 1.4.1 Sowohl Einrichtungen, in denen Blut und Blutbestandteile
2010 (alt) 2017 (neu) Abschnitt Inhalt Abschnitt Inhalt 1.4 Qualitätsmanagement (QM)/Qualitätssicherung 6 Qualitätsmanagement und Qualitätssicherung 1.4.1 Sowohl Einrichtungen, in denen Blut und Blutbestandteile
Inhalt: Themenkomplex III:
 26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN. Hämovigilanz. Hämovigilanz. Jahresbericht. Jahresbericht
 ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Hämovigilanz Jahresbericht Jahresbericht 2003 2003 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Hämovigilanz Jahresbericht Jahresbericht 2003 2003 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
SOP allergische Reaktion Erwachsene
 1. Ziel und Zweck Diese SOP soll bei allen Patienten, die sich im zuständigen Rettungsdienstbereich mit der Symptomatik einer schweren allergischen/anaphylaktischen Reaktion an den Rettungsdienst wenden,
1. Ziel und Zweck Diese SOP soll bei allen Patienten, die sich im zuständigen Rettungsdienstbereich mit der Symptomatik einer schweren allergischen/anaphylaktischen Reaktion an den Rettungsdienst wenden,
Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen
 23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
AMK-AMG-Herstell-Anz Seite 1 von 6
 AMK-AMG-Herstell-Anz-2010-01-25 Seite 1 von 6 Information der Arzneimittelkommission der deutschen Heilpraktiker bezüglich der arzneimittelrechtlichen Änderungen zur Anzeigepflicht der Herstellung von
AMK-AMG-Herstell-Anz-2010-01-25 Seite 1 von 6 Information der Arzneimittelkommission der deutschen Heilpraktiker bezüglich der arzneimittelrechtlichen Änderungen zur Anzeigepflicht der Herstellung von
U N I V E R S I T Ä T S M E D I Z I N B E R L I N
 U N I V E R S I T Ä T S M E D I Z I N B E R L I N Medikamentös induzierte Immunhämolyse Prof. Dr. A. Salama Charité Universitätsmedizin Berlin Institut für Transfusionsmedizin Campus Virchow-Klinikum Augustenburger
U N I V E R S I T Ä T S M E D I Z I N B E R L I N Medikamentös induzierte Immunhämolyse Prof. Dr. A. Salama Charité Universitätsmedizin Berlin Institut für Transfusionsmedizin Campus Virchow-Klinikum Augustenburger
Bewertung von Abweichungen, Fehlern und Mängeln
 Seite 2 von 8 1 Zweck Ziel der Verfahrensanweisung ist es, Kriterien für die Bewertung von Abweichungen festzulegen, die im Zusammenhang mit GMP-Inspektionen festgestellt werden. Diese VAW regelt ferner
Seite 2 von 8 1 Zweck Ziel der Verfahrensanweisung ist es, Kriterien für die Bewertung von Abweichungen festzulegen, die im Zusammenhang mit GMP-Inspektionen festgestellt werden. Diese VAW regelt ferner
Sexuell übertragbare Infektionen MUSTER. Sexuell übertragbare. Was muss ich wissen?
 Sexuell übertragbare Infektionen Sexuell übertragbare Infektionen Was muss ich wissen? Was sind STDs? Sexuell übertragbare Infektionen (STD sexually transmitted diseases) werden durch verschiedene Erreger
Sexuell übertragbare Infektionen Sexuell übertragbare Infektionen Was muss ich wissen? Was sind STDs? Sexuell übertragbare Infektionen (STD sexually transmitted diseases) werden durch verschiedene Erreger
Satzung für den Kindergarten Arzbach der Gemeinde Wackersberg (Kindergartensatzung) vom
 Satzung für den Kindergarten Arzbach der Gemeinde Wackersberg (Kindergartensatzung) vom 15.10.2002 Auf Grund von Art. 23 und Art. 24 Abs.1 Nr.1 der Gemeindeordnung erläßt die Gemeinde Wackersberg folgende
Satzung für den Kindergarten Arzbach der Gemeinde Wackersberg (Kindergartensatzung) vom 15.10.2002 Auf Grund von Art. 23 und Art. 24 Abs.1 Nr.1 der Gemeindeordnung erläßt die Gemeinde Wackersberg folgende
Transfusionsmedizin Sommersemester Stunde
 Transfusionsmedizin Sommersemester 2005 1.Stunde H. Schrezenmeier Institut für Klinische Transfusionsmedizin und Immungenetik Ulm Abteilung Transfusionsmedizin Ulm Transfusionsmedizin Sommersemester 2005
Transfusionsmedizin Sommersemester 2005 1.Stunde H. Schrezenmeier Institut für Klinische Transfusionsmedizin und Immungenetik Ulm Abteilung Transfusionsmedizin Ulm Transfusionsmedizin Sommersemester 2005
Dringende Sicherheitsinformation
 Medtronic GmbH 40670 Meerbusch Earl-Bakken-Platz 1 40639 Meerbusch Postfach 1444 Telefon 02159/8149-0 Telefax 02159/8149-100 E-Mail: deutschland@medtronic.com Internet: www.medtronic.de Medtronic GmbH
Medtronic GmbH 40670 Meerbusch Earl-Bakken-Platz 1 40639 Meerbusch Postfach 1444 Telefon 02159/8149-0 Telefax 02159/8149-100 E-Mail: deutschland@medtronic.com Internet: www.medtronic.de Medtronic GmbH
Wichtige Informationen zur Minimierung des Risikos in der Nachsorge. eine Aufklärungsbroschüre für Eltern/Betreuer
 Nur zur Abgabe durch den behandelnden Arzt an Eltern/Betreuer von Patienten, denen Strimvelis verordnet wurde Wichtige Informationen zur Minimierung des Risikos in der Nachsorge bei Kindern, die eine Gentherapie
Nur zur Abgabe durch den behandelnden Arzt an Eltern/Betreuer von Patienten, denen Strimvelis verordnet wurde Wichtige Informationen zur Minimierung des Risikos in der Nachsorge bei Kindern, die eine Gentherapie
Qualitätssicherung bei Transfusionen und Hämotherapie
 ÄRZTEKAMMER Stand: 20.11.08 Qualitätssicherung bei Transfusionen und Hämotherapie Hinweise zur Anwendung der Richtlinie Hämotherapie Mit der am 5. November 2005 erfolgten vollständigen Novellierung der
ÄRZTEKAMMER Stand: 20.11.08 Qualitätssicherung bei Transfusionen und Hämotherapie Hinweise zur Anwendung der Richtlinie Hämotherapie Mit der am 5. November 2005 erfolgten vollständigen Novellierung der
Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK
 Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK Seite 1 Übersicht Blutspendewesen und Rotes Kreuz Gesetz
Infektmarker im schweizerischen Blutspendedienst Dr. phil. nat. Caroline Tinguely, Labor Infektmarker IRB SRK AG / nationales Referenzlabor B-CH SRK Seite 1 Übersicht Blutspendewesen und Rotes Kreuz Gesetz
Referenz- und Kreuzprobenlabor Immunhämatologie
 Referenz- und Kreuzprobenlabor Immunhämatologie Blutgruppe Methode: Material: Indikation: Transport: Hämagglutinationtest (Antigenaustestung, Isoagglutinine und Antikörpersuchtest) 10 ml Nativ-Blut (ohne
Referenz- und Kreuzprobenlabor Immunhämatologie Blutgruppe Methode: Material: Indikation: Transport: Hämagglutinationtest (Antigenaustestung, Isoagglutinine und Antikörpersuchtest) 10 ml Nativ-Blut (ohne
INFEKT-INFO. Ausgabe 2/ Januar Hygiene Institut Hamburg Im Dienste der Gesundheit
 FREIE UND HANSESTADT HAMBURG Zentrum für Impfmedizin und sepidemiologie des Hygiene Institutes Hygiene Institut Hamburg Im Dienste der Gesundheit INFEKT-INFO Herausgeber: sepidemiologie des Hygiene Institutes!
FREIE UND HANSESTADT HAMBURG Zentrum für Impfmedizin und sepidemiologie des Hygiene Institutes Hygiene Institut Hamburg Im Dienste der Gesundheit INFEKT-INFO Herausgeber: sepidemiologie des Hygiene Institutes!
Auftrag für GMP- Dienstleistung
 An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
Gebrauchsinformation und Fachinformation
 Gebrauchsinformation und Fachinformation Bestrahltes Erythrozytenkonzentrat in Additivlösung aus Vollblutentnahme 1. Identifizierung des Arzneimittels a) Bezeichnung Erythrozytenkonzentrat PAGGS/SB bestrahlt
Gebrauchsinformation und Fachinformation Bestrahltes Erythrozytenkonzentrat in Additivlösung aus Vollblutentnahme 1. Identifizierung des Arzneimittels a) Bezeichnung Erythrozytenkonzentrat PAGGS/SB bestrahlt
Zusammenfassung der RKI Empfehlung E 4 a / Juli 2002
 Empfehlungen zur Minimierung des Risikos einer iatrogenen Übertragung von vcjk durch potentiell kontaminierte Medizinprodukte, insbesondere chirurgische Instrumente Zusammenfassung der RKI Empfehlung E
Empfehlungen zur Minimierung des Risikos einer iatrogenen Übertragung von vcjk durch potentiell kontaminierte Medizinprodukte, insbesondere chirurgische Instrumente Zusammenfassung der RKI Empfehlung E
Das BASG / AGES PharmMed
 CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
