Temperaturgleit Teil 1: Grundlagen und praktische Regeln im Umgang mit zeotropen Kältemittelgemischen
|
|
|
- Jonas Diefenbach
- vor 5 Jahren
- Abrufe
Transkript
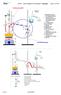
1 Konzentrationsverschiebung zeotrope Kältemittelgemische Leckagen Eigenschaften von Kältemitteln In der aktuellen Zeit besteht immer noch ein Vorbehalt gegenüber zeotropen Kältemittelgemischen die über einen verfügen; Grund hierfür ist die assoziierte Konzentrationsverschiebung die durch Leckagen und den inkorrekten Umgang mit dem Kältemittel auftretenkann. Um dieser Unsicherheit entgegenzuwirken sind im Folgenden die physikalisch-chemischen Prinzipien der unterschiedlichen Verdampfungsprozesse von azeotropen und zeotropen Kältemittel anschaulich erklärt. Weiterhin wird diskutiert worauf beim praktischen Umgang mit zeotropen Kältemitteln geachtet werden muss und welche sicherheitsrelevanten Aspekte wirklich von Bedeutung sind. Principles and practical rules for handling zeotropic refrigerant mixtures temperature glide concentration shift zeotropic refrigerant mixtures leaks refrigerant properties Reservations still subsist today regarding zeotropic refrigerant mixtures which have a certain temperature glide. The reason for this is generally the associated concentration shift which can occur due to leaks and improper handling of the refrigerant. Aiming to dispel this uncertainty, the physico-chemical principles underlying the various evaporation processes of azeotropic and zeotropic refrigerants are described below. Factors which must be borne in mind when handling zeotropic refrigerants and those safety aspects which are really of practical significance are also discussed. Autor Dr. Nicolas Dietl Technisches Marketing Opteon Kältemittel, Chemours (Deutschland) GmbH Teil 1: Grundlagen und praktische Regeln im Umgang mit zeotropen Kältemittelgemischen Einleitung Seit ihrer Einführung in den Markt herrscht im Bereich der zeotropen Kältemittelgemische eine allgemeine Unsicherheit im Umgang mit ihrem oft stärker ausgeprägtem und der daraus resultierenden Angst vor Leckage-bedingten Konzentrationsverschiebungen und Leistungsverminderungen in Kälte- und Klimaanlagen. Getrieben von politischen Entscheidungen über Kältemittel mit möglichst niedrigem Treibhauspotenzial (GWP: Global Warming Potential), sind diese Gemische aber der Schlüssel für eine langfristige Lösung der kältetechnischen Herausforderungen unserer Zeit, nämlich den wirtschaftlichen, umweltfreundlichen und effizienten Einsatz unserer Ressourcen. Diese Thematik greift dieser Artikel auf, um der teilweise vorhandenen Unsicherheit in der Branche entgegenzuwirken und eine solide Basis im Umgang mit (zeotropen) Kältemittelgemischen zu geben. Hierbei wird möglichst anschaulich ohne die mathematischen Herleitungen zu vertiefen auf die thermodynamisch relevanten Eigenschaften und den praktischen Umgang mit diesen Gemischen eingegangen und auf die daraus resultierenden Sicherheitsprobleme hingewiesen. Zeotrope Kältemittelgemische und ihre Eigenschaften Kältemittelgemische werden oft in zwei Klassen unterteilt: die azeotropen und die zeotropen (Letztere werden oft auch als nicht-azeotrope Kältemittel bezeichnet). Azeotrope Gemische sind laut Definition nicht mehr durch Destillation zu trennen (daher auch der Wortursprung aus dem Griechischen: a = nicht, zeo = siedend und tropos = Änderung ), das heißt, sie haben zu jedem Zeitpunkt die gleiche Zusammensetzung in der Gas- und der Flüssigphase (Abb. 1, links). Dadurch ähneln sie in ihren kältetechnisch relevanten Eigenschaften stark den Einkomponenten-Kältemitteln. An dieser Stelle soll jedoch erwähnt sein, dass Azeotropie nur bei einer genauen Zusammensetzung vorliegt und von den äußeren Parametern wie Druck und Temperatur abhängt. Mit anderen Worten: Nur weil ein Kältemittel bei der Befüllung einer Anlage azeotrop vorliegt, heißt das nicht automatisch, dass auch während des gesamten Kältekreislaufes diese Eigenschaft beibehalten wird; vielmehr kann es auch hier an bestimmten Stellen im Kältemittelkreislauf zu zeotropem Verhalten kommen. Ein Beispiel hierfür wäre R-507A, welches nur bei -40 C tatsächlich azeotrop vorliegt; unter abweichenden Bedingungen liegt auch bei diesen Kältemitteln ein wenn auch sehr schwach ausgeprägter vor. Zeotropes Verhalten zeichnet sich im Gegensatz zu azetropem dadurch aus, dass die gemischten Komponenten sich durch (fraktionierte) Destillation trennen lassen können. In so einer Mischung liegen in der Regel zwei Stoffe mit unterschiedlichen Siedepunkten vor, von denen die flüchtigere Verbindung leichter verdampft und sich in der Gasphase anreichert. Dies führt bei einem Phasenübergang (Sieden oder Kondensieren) zu einer unterschiedlichen Konzentration der beiden Komponenten in Gas und Flüssigkeit (Abb. 1, rechts). Wie genau sich die Konzentration in der jeweiligen Phase zusammensetzt, lässt sich am besten schematisch an Hand eines Phasendiagramms (flüssiggasförmig) der entsprechenden Mischung darstellen. In Abbildung 2 ist ein solches Diagramm für eine Mischung mit azeotropem Punkt (a) und eine rein zeotrope Mischung (b) dargestellt (bei konstantem Druck). Die x-achse stellt dabei die Zusammensetzung des Kältemittels (also die relative Verteilung der jeweiligen Einzelkomponente A und B bzw. Konzentration oder auch Molenbruch genannt) dar, während die y-achse die Temperatur widerspiegelt; der Schnittpunkt an den jeweiligen y-achsen entspricht demnach den Siedepunkten der Reinstoffe A und B 1. Der flüssige und der 31
2 1 Vereinfachte Gegenüberstellung von azeotropem Verhalten (links) und zeotropem Verhalten (rechts) beim Verdampfen einer Mischung aus zwei Reinstoffen. Im Falle des zeotropen Verhaltens ist die gelbe Komponente leichter flüchtig (hat also den tieferen Siedepunkt) und ist zu Beginn der Verdampfung stärker in der Gasphase angereichert. gasförmige Bereich im Diagramm sind von einem Zweiphasengebiet (blaue Fläche) getrennt, in dem über einen gewissen Temperaturgradienten sowohl Flüssigkeit als auch Gas im jeweiligen System vorliegen. Die entsprechenden Grenzlinien nennt man Siedekurve (zur Flüssigphase) und Kondensations-/Taukurve (zur Dampfphase). Zieht man also für eine bestimmte Zusammensetzung (im Beispiel 70 % A und 30 % B) auf der x-achse eine vertikale Linie nach oben (orangene Linie; Abb. 2, Abschnitt a), so ergibt die Differenz zwischen den Schnittpunkten mit der Kondensationsund Siedekurve den für das entsprechende Kältemittelgemisch. Wie sich die einzelnen Phasen im Gleichgewicht zusammensetzen, kann an dem Beispiel der zeotropen Mischung (Abb. 2, Abschnitt b) gezeigt werden: Liegt die entsprechende Mischung (z. B. eine 50/50-Mischung aus den Einzelstoffen A und B) bei einer beliebigen Temperatur T1 im Zweiphasengebiet (roter Kreis, Abb. 2), so haben Gas- und Flüssigphase unterschiedliche Konzentrationen der Einzelkomponenten. Der Schnittpunkt der Isotherme mit der Siedekurve entspricht (auf der x-achse) der Zusammensetzung der flüssigen Phase, während der Schnittpunkt der Isotherme mit der Kondensationskurve der Zusammensetzung der Gasphase entspricht. Diese Abweichung ist aber durch die Breite des Zweiphasengebietes klar begrenzt und es kann nicht zu einer vollständigen Trennung der Komponenten kommen. Mit anderen Worten: Wird also bei der Verdampfung einer Flüssigkeit das 2-Phasengebiet vertikal durchlaufen, kann für jeden Punkt die Zusammensetzung der jeweiligen Phasen durch die entsprechenden Schnittpunkte der Isothermen mit der Siede- und Kondensationskurve definiert werden. Beim Austritt aus dem Zweiphasengebiet hat das Gas dann wieder die ursprüngliche Zusammensetzung der Flüssigkeit. Demzufolge ist die Abweichung am größten entweder direkt am Siedepunkt für die Gasphase bzw. direkt am Taupunkt für die Flüssigphase. Wie exakt diese Werte ausfallen können, kann am Beispiel von R-407C oder R-410A veranschaulicht werden. Bei Ersterem handelt es sich um eine Mischung aus drei Komponenten: Difluormethan R-32 (23 m.-%), Pentafluorethan R-125 (25 m.-%) und 1,1,1,2-Tetrafluorethan R-134a (52 m.-%), welches einen der am stärksten ausgeprägten s aller kommerziell-verfügbaren Kältemittel besitzt. 410A besteht nur aus den zwei Komponenten Difluormethan R-32 (50 m.-%) und Pentafluorethan R-125 (50 m.-%) und weist im Vergleich zu 407C und anderen Gemischen einen nahezu vernachlässigbaren auf. Beide werden hauptsächlich im Klima- und Wärmepumpenbereich eingesetzt. Wählt man den Druck nun beispielsweise so, dass der Siedepunkt 10 C ist, so resultiert das in einem von 5,9 K für R-407C bzw. 0,1 K für R-410A [1]. Gleichzeitig entspricht dies dann einer maximalen Konzentrationsverschiebung (also direkt am Siedepunkt) von 1 Als anschauliches Beispiel könnte man hier die Mischung von A = R-124 und B = R-22 betrachten. Demzufolge entspräche der Wert auf der linken y-achse dem Siedepunkt von R-124 (-12 C) und der Wert auf der rechten y- Achse dem Siedepunkt von R-22 (-40,9 C). 14 % für R-407C bzw. 2,7 % für R-410A [1]. Die realen Werte sind also deutlich kleiner, als in der schematischen Darstellung in Abb. 2. Folgende wichtige Erkenntnisse kann man aus dieser einfachen Betrachtungsweise ziehen: 1. Die Konzentrationsverschiebung in Dampf und Flüssigkeit kann nur in einem begrenzten Rahmen stattfinden, das heißt, es kann niemals nur eine Komponente verdampfen oder kondensieren. Vielmehr liegen in beiden Phasen auch immer beide (bzw. alle beteiligten) Komponenten vor. 2. Die Abweichung von der ursprünglichen Konzentration hat ihr Maximum für die Gasphase direkt am Siedepunkt und für die flüssige Phase direkt am Taupunkt; größere Konzentrationsabweichungen in einem geschlossenem System sind de facto nicht möglich. Die daraus resultierende Konsequenzen im praktischen Umgang werden in einem späteren Abschnitt behandelt. Was dieses zeotrope Verhalten beim Phasenübergang nun für den Kältemittelkreislauf bedeutet, lässt sich im Mollier (Druck-Enthalpie) -Diagramm in Abbildung 3 ganz gut erkennen. Der offensichtlichste und entscheidende Unterschied im Vergleich zu azeotropen oder Einkomponenten-Kältemitteln liegt hier im Erscheinungsbild der Isothermen. Diese verlaufen nicht mehr parallel zur x-achse (Enthalpie) oder den Isobaren, sondern fallen im Bereich des Zweiphasengebietes leicht ab. Diese Abweichung ist das Resultat aus dem eben beschriebenen, veränderten Siede-/Kondensationsverhalten zeotroper Mischungen. Startet man ausgehend von Abbildung 3 mit der Expansion des Kältemittels in den Niederdruckbereich (1), hat zu Beginn des Verdampfungsprozesses die Temperatur des Kältemittels den Wert T1. Im Verlaufe des Siedeprozesses (2) kommt es jedoch zu einem Gleit und die Temperatur des Kältemittels steigt bis zum Verlassen des Verdampfers auf den Wert T2. Als Verdampfungstemperatur wird der Mittelwert von T1 und T2 angegeben. Der umgekehrte Sachverhalt gilt nun für die andere Hälfte des Kreislaufs. Nach dem Kompressor (3) wird das Gemisch im Hochdruckbereich bis auf den Wert von T4 erhitzt, bevor es in den Kondensator gelangt und sich via auf den Wert T3 abkühlt und vollständig verflüssigt (4). So lange dieser Kreislauf Leckage-frei abläuft, ergeben sich für den praktischen Umgang 32
3 erst einmal keine besonderen Umstände. Es müssen jedoch einige prinzipielle Punkte bei der Auslegung der Komponenten berücksichtigt werden: 1. Beim Einregeln einer Kälteanlage ist es wichtig, die richtigen Werte der Dampfdruckkurve zu verwenden. Für die Überhitzung nach dem Verdampfer muss der Temperaturwert des gesättigten Dampfes an genau diesem Punkt gemessen werden. Er entspricht in Abbildung 3 dem Taupunkt B. Würde man den Kontrollwert an einer früheren Stelle des Verdampfers messen, so ergäbe sich fälschlicherweise eine größere Differenz zur Überhitzung und die eigentlich logische Reduzierung der Überhitzungstemperatur könnte zu Verdichterschäden durch unvollständig verdampftes bzw. flüssiges Kältemittel führen (Flüssigkeitsschläge). Konsequenterweise muss auch für die Unterkühlung nach dem Verflüssiger der Wert für die gesättigte Flüssigkeit am korrekten Punkt (Abbildung 3; Siedepunkt A) gemessen werden, um Fehlfunktionen zu verhindern. 2. Im Bereich der Tieftemperaturanwendung muss die variierende Frostbildung am Verdampfer berücksichtigt werden. Während bei einem Kältemittel ohne die Frostschicht relativ gleichmäßig ausfallen wird, kommt es bei einem Kältemittel mit Gleit zu einer stärkeren Ausbildung der Eisbildung zu Beginn des Verdampfers. 3. Ein kann auch von Vorteil sein und eine höhere Energieeffizienz ergeben. Voraussetzung dafür sind entsprechend ausgelegte Wärmeübertrager (z. B. Kreuzgegenstrom). 4. Für manche spezielle Anwendungen sollte die Verwendung von Kältemittel mit sorgfältig geprüft werden. Ein Beispiel wären Anlagen mit überflutetem Verdampfer, da sich hier die stark ausgeprägte Konzentrationsverschiebung im Verdampfer direkt auf den zirkulierenden Massenstrom auswirkt und die angesaugte Kältemittelzusammensetzung von der Originalzusammensetzung abweicht. Weitaus interessanter ist nun der Fall, dass der Kältemittelkreislauf undicht ist und es durch Defekte in der Anlage oder den wartungstechnischen Wechsel zum Austritt des Kältemittels kommt. Mit diesen Szenarien und den daraus resultierenden Konsequenzen beschäftigt sich das nächste Kapitel und geht genauer auf die praktischen Regeln im Umgang mit zeotropen Kältemitteln ein. Zeotrope Kältemittel und das Problem der Konzentrationsverschiebung Die falsche Handhabung zeotroper Kältemittelgemische kann die Leistung einer Anlage negativ beeinflussen. Dies geschieht in der Regel, indem durch Leckage-bedingtes Austreten des Kältemittels oder dessen inkorrekte Befüllung sich die Konzentration der jeweiligen Einzelkomponenten im System im Vergleich zur ursprünglichen Formulierung verändert: Man spricht dann von einer sogenannten Konzentrationsverschiebung. Deshalb ist es wichtig, ein paar Grundregeln beim Umgang mit diesen Kältemitteln zu berücksichtigen, um von Beginn an einen effizienten Betrieb der Anlage zu gewährleisten. Bedingt durch den Dampfdruck des Kältemittels und das geschlossene System sind in einem nur teilweise gefüllten Gebinde/Behälter immer zwei Phasen vorhanden. Es liegt also neben der flüssigen auch stets eine gasförmige Phase vor. Wie zuvor erläutert, hat bei zeotropen Gemischen diese Dampfphase aber durch die unterschiedlichen Dampfdrücke der Einzelstoffe eine abweichende Zusammensetzung zum ursprünglichen Kältemittel und sollte daher nicht zum Befüllen der Kälteanlage verwendet werden. Gleichzeitig ist die Dichte der Gasphase aber so gering, dass sie die Zusammensetzung der flüssigen Phase nicht signifikant verfälscht 2. Demzufolge sollte die Anlage ausschließlich mit der Flüssigkeit befüllt werden, um die korrekte Zusammensetzung im Kältekreislauf zu garantieren. Sobald der Gasraum im Gebinde zu stark zunimmt, ist diese Annahme jedoch nicht mehr gültig; bei der Befüllung von Kleingeräten gilt als Faustregel deshalb, dass etwa ein Zehntel des Kältemittels im Gebinde verbleiben sollte, da bei weiterer Entnahme von Kältemittel auch die korrekte Zusammensetzung der flüssigen Phase nicht mehr gewährleistet ist. Diese Punkte werden jedoch hinfällig, wenn der Behälter komplett dem Kältekreislauf zugegeben wird, da in diesem Fall Konzentrationsschwankungen im Dampf oder in der Flüssigkeit 2 Beispielsweise macht in einem Container der je zur Hälfte (Volumen) mit Flüssigkeit und Gas gefüllt ist, die flüssige Phase immer noch je nach Kältemittel um die 95 % der Gesamtfüllung (Masse) aus. 2 Schematisches Phasendiagramm für eine vollständig zeotrope Mischung (A) und eine Mischung mit azeotropem Punkt (B) bei konstantem Druck 33
4 3 Schematisches Mollier (p-h-) Diagramm für eine zeotrope Mischung mit durch die vollständige Befüllung wieder ausgeglichen werden. Etwas komplizierter ist die Betrachtung des Falls, der durch das Auftreten einer Leckage entsteht; hier kann gerade bei längerfristigem Gasaustritt eine relevante Konzentrationsverschiebung im System auftreten. Man muss aber zwischen den verschiedenen möglichen Szenarien einer auftretenden Leckage unterscheiden, da nur die wenigsten auch eine relevante Konzentrationsverschiebung verursachen können. Eine Konzentrationsverschiebung kann nur dann auftreten, wenn erstens ein Zweiphasengemisch vorliegt, und zweitens nur eine der beiden Phasen aus dem System austritt bzw. eine Phase deutlich vermehrt als die andere. Als Beispiel hierfür können die Wärmetauscher oder Sammler genannt werden. Im Bereich des Kompressors liegt dagegen beispielsweise nur ein Gas vor und eine Leckage hätte keinerlei Auswirkungen auf die Zusammensetzung des verbleibenden Kältemittels. Auch im Abschnitt vor dem Expansionsventil würde durch das Vorliegen der reinen flüssigen Phase eine Leckage keine Veränderung der Zusammensetzung bewirken. Für die verbleibenden Elemente hat sich nun gezeigt, dass bei stationären Anwendungen Wärmetauscher in der Regel mit Helium sorgfältig geprüft werden und entsprechend dicht sind. Eine Leckage ist an dieser Stelle also tendenziell unwahrscheinlich. Als kritischere Bereiche verbleiben das Expansionsventil und der folgende Abschnitt bis zum Verdampfer. Hier ist das Auftreten einer Konzentrationsverschiebung bei einer Leckage am wahrscheinlichsten. Nichtsdestotrotz haben erweiterte Untersuchungen gezeigt, dass Leckagen im laufenden Betrieb weniger gravierende Auswirkungen haben als generell angenommen [1, 2]. Tatsächlich liegen in einem laufenden Kältekreislauf durch die starken Druck- und Temperaturschwankungen turbulente Strömungsverhältnisse vor. Dies hat zur Folge, dass bei einer Leckage am Expansionsventil oder in einem der Wärmetauscher nie nur die eine Phase austritt, sondern immer sowohl Dampf als auch Flüssigkeit 3. So kann in den meisten Fällen nach der Reparatur der Leckage das ausgetretene Kältemittel einfach mit frischem ersetzt werden, statt das komplette Kältemittel im System auszutauschen. Anders verhält sich die Situation aber bei einer ruhenden Kälte-oder Klimaanlage. Hier liegen keine Turbulenzen mehr vor und eine Leckage führt in der Regel dazu, dass vermehrt nur eine der Phasenkomponenten austritt und nun doch eine Verschiebung der Gemisch-Zusammensetzung auftritt. Wie drastisch so eine Leckage und die damit einhergehende Konzentrationsverschiebung ausfallen kann, hängt wie schon gesagt stark von der Menge an ausgetretenem Kältemittel ab. Um ein Gefühl für diese Mengen zu vermitteln, sind im Folgenden wieder einige Beispielrechnungen für 3 Durch den Expansionseffekt wird natürlich auch Flüssigkeit bei einer kleinen Leckage als Dampf austreten. Dieser hat jedoch die Zusammensetzung der ursprünglich flüssigen Phase im System und wird daher im Folgendem weiter als Flüssigkeit bezeichnet. das bereits weiter oben erwähnte Kältemittel R-407C dargestellt, das mit seinem stärker ausgeprägten Gleit als eines der extremsten Beispiele angesehen werden kann. Die maximal erlaubte Abweichung der einzelnen Komponenten um der Spezifikation von R-407C noch zu entsprechen beträgt ±2 Prozent. Wie viel Kältemittel muss also austreten, damit das in der Anlage verbleibende Mittel von diesen festgelegten Spezifikationen abweicht und demnach nicht mehr als R-407C bezeichnet werden dürfte bzw. nicht mehr die thermodynamischen Anforderungen erfüllt? Als Beispiel wird hier einmal der Wert für folgendes Szenario angeben. Rechnungen wurden mit REFLEAK Version 4.0 durchgeführt, unter Verwendung der LJ4 Lemmon & Jacobsen Modells [3]. Aus einem kleinen Leck (langsamer Austritt, isothermer Prozess) tritt ausschließlich die Dampfphase aus der Kälteanlage aus. Dabei soll die Temperatur 0 C und das Anfangsvolumen der Dampfphase im geschlossenen System 20 % betragen. Wie in dem Kurvenverlauf in Abbildung 4 zu erkennen, treten mit dem Kältemitteldampf verstärkt die leichter flüchtigen Komponenten R-125 und R-32 aus und als Konsequenz kommt es sowohl in der flüssigen als auch in der Gasphase im System zur Anreicherung von R-134a. Da die Steigungen der entsprechenden Kurven von R-134a (blaue Linien) größer sind als die von R-32 (rote Linien) und R-125 (grüne Linien), ergibt sich daraus, dass diese Komponente als erstes den Toleranzwert von 2 % überschreiten wird. Tatsächlich ergibt sich aus der Analyse der Datenpunkte, dass etwa ein Zehntel des Kältemitteldampfes austreten muss, bevor der verbleibende Anteil an R-134a im System die 2-%-Grenze von 54 % überschreitet und nicht mehr die Spezifikationen von R-407C erfüllt. Bis zu diesem Zeitpunkt und auch darüber hinaus ist eine Beeinträchtigung der Kälteleistung praktisch nicht messbar und das ausgetretene Kältemittel kann durch einfaches Nachfüllen der Originalmischung ersetzt werden. Hierbei handelt es sich aber um das sogenannte Worstcase -Szenario, denn tritt hingegen Flüssigkeit unter diesen Bedingungen aus, entspricht sogar bei über 90 % ausgetretenem Kältemittel die Spezifikation der verbleibenden Flüssigkeit im System immer noch der von R-407C. Vielmehr kann so eine reine Gasleckage wie oben beschrieben nur bei ruhenden Anlagen auftreten. Bei laufendem Betrieb werden 34
5 immer beide Phasen austreten und somit der tatsächliche Wert deutlich höher als die berechneten 10 % liegen. Bei Kältemitteln mit geringerem von etwa 4-5 Kelvin, wie etwa R- 407A oder das neue HFO-Kältemittel Opteon XP40 (R449A), können bei dem oben beschriebenen Worst-case -Szenario sogar mehr Kältemittel als Dampf austreten, ohne dass dadurch eine relevante Änderung der Zusammensetzung bzw. eine praktisch-messbare Verminderung der Kälteleistung auftritt. Es kann also im alltäglichen Betrieb in der Regel einfach aufgefüllt werden, ohne die Sicherheit und Effizienz der Kälteanlage zu kompromittieren. Zusammenfassend kann man festhalten, dass sehr hohe Leckagemengen und ganz bestimmte Vorrausetzungen nötig sind, um eine leistungs- und sicherheitsrelevante Konzentrationsverschiebung zu verursachen. Das Risiko für das Auftreten einer solchen Leckage kann jedoch in Anbetracht der immer moderneren Kälte-, Klima- und Wärmepumpenanlagen und bei ordnungsgemäßer Wartung der Anlage und Einhaltung der neusten EU-Richtlinien zur Leckage-Prüfung auf ein absolutes Minimum reduziert werden. Weitere sicherheitsrelevante Aspekte Durch die höheren Ansprüche an Kältemittel bei der Reduzierung des CO 2 -Ausstoßes und der jüngst ausgearbeiteten F-Gase-Verordnung (EU) 517/2014[4] bei bestenfalls gleichbleibender Effizienz werden in naher Zukunft immer mehr Kältemittel auf den Markt kommen, die der ASHRAE-Klassifizierung A2L entsprechen: Beispiele sind das bereits häufig in Mischung eingesetzte Kältemittel R-32 oder die Klasse der neuen HFOs (engl.: Hydrofluoroolefins) wie etwa R-1234yf oder R-1234ze. Diese Kältemittel sind zwar weiterhin ungiftig (Klasse A), sind jedoch nicht als unbrennbar (Klasse 1) eingestuft, sondern als schwer entflammbar (2L). Diese Entflammbarkeit ist jedoch so schwach ausgeprägt, dass entsprechende Kältemittel trotzdem für zahlreiche Anwendungen validiert sind und in Zukunft sicher eingesetzt werden können. Einige Unsicherheit besteht aber bei neuen Kältemittelgemischen (mit ), die eine solche A2L-klassifzierte Substanz beinhalten, selber jedoch als A1 eingestuft sind. Hier steht oft die Befürchtung im Raum, dass durch eine eventuelle Leckage und die damit mögli- 4 Berechneter Konzentrationsverlauf der Einzelkomponenten in der flüssigen (fl) und der Gasphase (g) bei einer Gasleckage in einer mit R-407C betriebenen Kältemittelanlage cherweise auftretende Konzentrationsverschiebung, die Zusammensetzung sich so stark verändern könnte, dass aus einem nicht-brennbaren (A1) auf einmal ein schwer entflammbares Gemisch (A2L) werden kann und dieses für die entsprechende Anlage plötzlich ein höheres Sicherheitsrisiko darstellen würde. Diese Ängste sind jedoch unbegründet! Bei der Prüfung und Klassifizierung durch die ASHRAE-Kommission werden auch solche Extremfälle überprüft und in der Sicherheitsbewertung berücksichtigt. Demzufolge kann sich ein als A1 gekennzeichnetes Kältemittel auch durch eine extreme Konzentrationsverschiebung nicht zu einem A2L Kältemittel umwandeln. Tatsächlich ist die leichter zu entzündende Komponente meist auch die leichter flüchtige Komponente, das heißt, in der Regel nimmt die Entflammbarkeit bei einer Leckage-induzierten Konzentrationsverschiebung tendenziell eher ab. Fazit Die Eigenschaften von zeotropen Kältemittelgemischen und die resultierenden Konsequenzen für den praktischen Umgang in der Kältetechnik sind mittlerweile gut verstanden. Daher ist der teilweise noch bestehende Vorbehalt gegenüber Kältemittelgemischen mit einem in den meisten Anwendungsfällen absolut unbegründet. Unter der Berücksichtigung einiger einfacher Richtlinien im Umgang mit diesen Mitteln stehen diese ihren azeotropen Äquivalenten in Sachen Sicherheit, Effizienz und Nachhaltigkeit in nichts nach. Dazu gehören ein paar zu berücksichtigende Punkte bei der Auslegung des Kältemittelkreislaufes, die korrekte Befüllung und die ordnungsgemäße Wartung der Anlage. Außerdem wird die Gefahr durch eine Leckage-bedingte Konzentrationsverschiebung immer noch überschätzt, denn es sind extreme Umstände bzw. fahrlässiges Verhalten notwendig, damit ein messbarer Effekt auftritt. In Anbetracht der zahlreichen Herausforderungen für die Kältetechnikbranche bieten diese Kältemittel vielmehr eine sinnvolle und notwendige Alternative, um die ambitionierten Ziele der Gesetzgeber im Bereich der Energie- und Umweltschonung zu realisieren. Im zweiten Teil, welcher in der November-Ausgabe erscheint, wird Michael Freiherr die Auswirkungen des s auf Verflüssiger und Verdampfer näher beleuchten und einen praxisgerechten Lösungsansatz für die korrekte Auslegung von Wärmeübertragern vorstellen. Literatur [1] Morley, J. R. : Refrigerant Blends for Air Conditioning: Causes and effects of Composition Shifts and Temperature Glide. DuPont Research Paper, 2004 [2] Lavelle, J.: Refrigerant Blends: Part one Part three, RSES (Refrigeration Service Engineers Society) Journal 2006 (Jan Mar) [3] Didion, D., Kim, M., Domanski, P. A.: NIST Standard Reference Database 73 REFLEAK: NIST Leak/Recharge Simulation Model for Refrigerant Mixtures, Version 4.0, National Institute of Standards and Technology, Standard Reference Data Program. Gaithersburg, 2012 [4] Verordnung (EU) Nr. 517/2014 des Europäischen Parlaments und des Rates, vom 16. April 2014 über fluorierte Treibhausgase und zur Aufhebung der Verordnung (EG) Nr. 842/2006 (Stand ) 35
Das h-log-p (lg p-h)-diagramm
 Das h-log-p (lg p-h)-diagramm Das h-log-p-diagramm ist in der Kältetechnik das wichtigste Arbeitsinstrument neben den Dampftafeln für den gesättigten-, Naßdampf- und überhitzten Bereich. Im Gegensatz zu
Das h-log-p (lg p-h)-diagramm Das h-log-p-diagramm ist in der Kältetechnik das wichtigste Arbeitsinstrument neben den Dampftafeln für den gesättigten-, Naßdampf- und überhitzten Bereich. Im Gegensatz zu
Kältemittel mit Temperaturgleit und Auswirkungen auf die Leistungsangaben
 Kältemittel mit Temperaturgleit und Auswirkungen auf die Leistungsangaben Umfang und Zweck Einhergehend mit der EU-Verordnung 517/2014 (F-Gase-Verordnung) wird es sich bei künftigen synthetischen Kältemitteln
Kältemittel mit Temperaturgleit und Auswirkungen auf die Leistungsangaben Umfang und Zweck Einhergehend mit der EU-Verordnung 517/2014 (F-Gase-Verordnung) wird es sich bei künftigen synthetischen Kältemitteln
( ) 3 Definitionen. 3.1 Leistung Die Leistung eines Ventils wird durch die Kälteleistung (Q o ) definiert:
 Dimensionierung von thermostatischen Expansionsventilen 1 Zweck... 1 2 Anwendungsbereich... 1 3 Definitionen... 1 3.1 Leistung... 1 3.2 Überhitzung... 3 4 Nennbedingungen bei nicht zeotropen Kältemitteln....
Dimensionierung von thermostatischen Expansionsventilen 1 Zweck... 1 2 Anwendungsbereich... 1 3 Definitionen... 1 3.1 Leistung... 1 3.2 Überhitzung... 3 4 Nennbedingungen bei nicht zeotropen Kältemitteln....
Handbuch zur Kältemittelumstellung.
 Handbuch zur Kältemittelumstellung. Umstellung von R 404A und R 134a auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der
Handbuch zur Kältemittelumstellung. Umstellung von R 404A und R 134a auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Handbuch zur Kältemittelumstellung.
 Handbuch zur Kältemittelumstellung. Umstellung von R 404A und R 134a auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der
Handbuch zur Kältemittelumstellung. Umstellung von R 404A und R 134a auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6
 LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
Handbuch zur Kältemittelumstellung. von R 404A auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen,
 Systementwicklung Handbuch zur Kältemittelumstellung von R 404A auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der Anwendung.
Systementwicklung Handbuch zur Kältemittelumstellung von R 404A auf alternative Kältemittel. Detaillierte Vergleiche zu Kälteleistungen, Verdampfung und Verflüssigung sowie hilfreiche Tipps in der Anwendung.
Versuch 6: Rektifikation
 Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Taschenbuch Kälte Wärme Klima 2016
 Taschenbuch Kälte Wärme Klima 2016 Bearbeitet von Sylvia Schädlich Neuerscheinung 2015. Taschenbuch. 282 S. Paperback ISBN 978 3 8007 3655 3 Format (B x L): 10,2 x 14,3 cm Gewicht: 178 g Weitere Fachgebiete
Taschenbuch Kälte Wärme Klima 2016 Bearbeitet von Sylvia Schädlich Neuerscheinung 2015. Taschenbuch. 282 S. Paperback ISBN 978 3 8007 3655 3 Format (B x L): 10,2 x 14,3 cm Gewicht: 178 g Weitere Fachgebiete
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Erstellt Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 39, Seite 1 von 2. In Zusammenarbeit
 Erstellt 18.04.2016 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 39, 20.04.2016 Seite 1 von 2 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über : Für
Erstellt 18.04.2016 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 39, 20.04.2016 Seite 1 von 2 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über : Für
COLD. Basic Training Course III. March ESSE - Wilhelm Nießen
 COLD Basic Training Course III 1 COLD Temperatur- und Druckmessungen zur Fehlerdiagnose 2 Kältekreislauf Verdampfer Temperatur Verflüssiger Temperatur Unterkühlung Heißgas Temperatur Sauggas Temperatur
COLD Basic Training Course III 1 COLD Temperatur- und Druckmessungen zur Fehlerdiagnose 2 Kältekreislauf Verdampfer Temperatur Verflüssiger Temperatur Unterkühlung Heißgas Temperatur Sauggas Temperatur
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Azeotrope. Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch
 Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Auslegung von Verdampfern und Verflüssigern für Kältemittel-Gemische mit hohem Temperatur-Gleit
 www.guentner.de Auslegung von Verdampfern und Verflüssigern für Kältemittel-Gemische mit hohem Temperatur-Gleit Autor Michael Freiherr Leiter Produktmanagement Zusammenfassung Das Temperatur-Gleit zeotroper
www.guentner.de Auslegung von Verdampfern und Verflüssigern für Kältemittel-Gemische mit hohem Temperatur-Gleit Autor Michael Freiherr Leiter Produktmanagement Zusammenfassung Das Temperatur-Gleit zeotroper
Die nächste Generation der Kältemittel Welche Optionen hat Europa? Otto Oberhumer Konsulent
 Die nächste Generation der Kältemittel Welche Optionen hat Europa? Otto Oberhumer Konsulent Agenda Warum sind die F-Gase ein politisches Schwergewicht? Warum verwenden wir F-Gase wie R410A, R404A, R134a,
Die nächste Generation der Kältemittel Welche Optionen hat Europa? Otto Oberhumer Konsulent Agenda Warum sind die F-Gase ein politisches Schwergewicht? Warum verwenden wir F-Gase wie R410A, R404A, R134a,
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Infos für Praktiker 1. Zeotrope Kältemittelgemische. Der sichere Einsatz in Ihrer Anlage.
 Infos für Praktiker 1 Zeotrope Kältemittelgemische. Der sichere Einsatz in Ihrer Anlage. Kältemittelgemische eine umweltfreundliche Alternative. Azeotrope und zeotrope Kältemittelgemische Die Auswahl des
Infos für Praktiker 1 Zeotrope Kältemittelgemische. Der sichere Einsatz in Ihrer Anlage. Kältemittelgemische eine umweltfreundliche Alternative. Azeotrope und zeotrope Kältemittelgemische Die Auswahl des
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
!"#$%& ' ()*+),)-./00 0-,) /& 11 ) 00./ (+,40 * 13 4./00-,) 0,) -&" /00)-13 00& ;+)0 ',) ,)) -+51 /( &
 Janua 8!"#$%& ' ()*+),)-./00 0-,) /& 11 ) 00./00 ''2& 13 4(+,40 * 13 4./00-,) 0,) -&" 5100 46-7- 844./00)-13 00& *./00)00)40019 :(4''2 00+& ;+)0 ',) 4 0 11 9,)) -+51 /( & * 4 11./00 ) ),) ( & * -./00+43-+2/)6)&
Janua 8!"#$%& ' ()*+),)-./00 0-,) /& 11 ) 00./00 ''2& 13 4(+,40 * 13 4./00-,) 0,) -&" 5100 46-7- 844./00)-13 00& *./00)00)40019 :(4''2 00+& ;+)0 ',) 4 0 11 9,)) -+51 /( & * 4 11./00 ) ),) ( & * -./00+43-+2/)6)&
Modell-Bibliothek Thermo-Fluidtechnik
 Modell-Bibliothek Thermo-Fluidtechnik Thermo-fluidtechnische Systeme und Komponenten können mit Hilfe der Bibliothek Thermo-Fluidtechnik sehr schnell und effektiv untersucht werden. Die Bibliothekselemente
Modell-Bibliothek Thermo-Fluidtechnik Thermo-fluidtechnische Systeme und Komponenten können mit Hilfe der Bibliothek Thermo-Fluidtechnik sehr schnell und effektiv untersucht werden. Die Bibliothekselemente
Erstellt Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 37b, Seite 1 von 3.
 Erstellt 17.05.2015 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 37b, 16.12.2016 Seite 1 von 3 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über :
Erstellt 17.05.2015 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 37b, 16.12.2016 Seite 1 von 3 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über :
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11
 Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12
 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
Siedediagramm binärer Gemische und Rektifikation
 Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Stand bei der Umsetzung der F-Gase VO. Mit Opteon Kältemitteln in die Zukunft!
 Stand bei der Umsetzung der F-Gase VO Mit Opteon Kältemitteln in die Zukunft! Chemours Unser Geschäft Fluorprodukte (u.a. Kältemittel) Weltmarktführer bei Titandioxid-Technologien, Fluorprodukten und anderen
Stand bei der Umsetzung der F-Gase VO Mit Opteon Kältemitteln in die Zukunft! Chemours Unser Geschäft Fluorprodukte (u.a. Kältemittel) Weltmarktführer bei Titandioxid-Technologien, Fluorprodukten und anderen
FAQ s F-Gase ALLGEMEIN
 Am 1. Januar 2015 ist die Verordnung (EU) Nr. 517/2014, auch bekannt als F-Gas-Verordnung, europaweit in Kraft getreten. Unsere Klimakammern nutzen Gase, welche dieser Verordnung unterliegen. Dieses FAQ-Papier
Am 1. Januar 2015 ist die Verordnung (EU) Nr. 517/2014, auch bekannt als F-Gas-Verordnung, europaweit in Kraft getreten. Unsere Klimakammern nutzen Gase, welche dieser Verordnung unterliegen. Dieses FAQ-Papier
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
Die neue F-Gase Verordnung tritt ab dem 01. Januar 2015 in Kraft
 Die neue F-Gase Verordnung tritt ab dem 01. Januar 2015 in Kraft Die EG-VO 517-2014 über teilfluorierte Treibhausgase hebt die Verordnung Nr. 842/2006 auf. Im Folgenden erfahren Sie, welche praktischen
Die neue F-Gase Verordnung tritt ab dem 01. Januar 2015 in Kraft Die EG-VO 517-2014 über teilfluorierte Treibhausgase hebt die Verordnung Nr. 842/2006 auf. Im Folgenden erfahren Sie, welche praktischen
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12
 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
Erstellt Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 36c, Seite 1 von 6.
 Erstellt 07.12.2014 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 36c, 03.12.2016 Seite 1 von 6 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über :
Erstellt 07.12.2014 Information für den Kälte -, Klima - und Wärmepumpenbauer, Nr. 36c, 03.12.2016 Seite 1 von 6 Berufsgruppe Kälte und Klimatechnik In Zusammenarbeit dürfen wir Sie informieren über :
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Phasengleichgewicht. 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. A fl. A g
 Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Der Umwelt zuliebe mit Schiessl umstellen!
 Der Umwelt zuliebe mit Schiessl umstellen! Einsatz von alternativen Kältemitteln zur Umstellung oder Neukonzeption von Kälteanlagen Der in der aktuellen F-Gase Verordnung eingebettete Phase Down für die
Der Umwelt zuliebe mit Schiessl umstellen! Einsatz von alternativen Kältemitteln zur Umstellung oder Neukonzeption von Kälteanlagen Der in der aktuellen F-Gase Verordnung eingebettete Phase Down für die
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan)
 Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
Kühlung: Verdampfer-Kühlschrank: Das Arbeitsgas muss sich bei der gewünschten Temperatur verflüssigen lassen. (Frigen, NH 3, SO 2, Propan) Ein Kompressor komprimiert das Gas. Bei Abkühlung auf Raumtemperatur
Protokoll Dampfdruck. Punkte: /10
 Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System
 Was Sie im letzten Lehrabschnitt gelernt haben 1 Einordnen von thermodynamischen Prozessen Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System Aussage und mathematische Formulierung
Was Sie im letzten Lehrabschnitt gelernt haben 1 Einordnen von thermodynamischen Prozessen Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System Aussage und mathematische Formulierung
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
2. GRUNDLAGEN. 2.1 Kontinuierliche Thermodynamik
 2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
Betriebsoptimierung von Kältemaschinen
 Betriebsoptimierung von Kältemaschinen 1 Einsatz von Kältemittel 2 Einsatz von Kältemittel 3 Funktionsweise einer Wärmepumpe / Kältemaschine 4 Grundzüge des h, log p Diagramm 5 1-2 Isentrope Verdichtung
Betriebsoptimierung von Kältemaschinen 1 Einsatz von Kältemittel 2 Einsatz von Kältemittel 3 Funktionsweise einer Wärmepumpe / Kältemaschine 4 Grundzüge des h, log p Diagramm 5 1-2 Isentrope Verdichtung
LCY (ohne Wärmetauscher) /LCYE (mit Wärmetauscher) / LCY-ST (Edelstahl ohne Wärmetauscher)
 Refrigeration & limate omponents Solutions 33.1 TY-DE 33.1-5 / 02-2018 Y (ohne Wärmetauscher) /YE (mit Wärmetauscher) / Y-ST (Edelstahl ohne Wärmetauscher) n Anwendungen Verhindern den saugseitigen Rückfluss
Refrigeration & limate omponents Solutions 33.1 TY-DE 33.1-5 / 02-2018 Y (ohne Wärmetauscher) /YE (mit Wärmetauscher) / Y-ST (Edelstahl ohne Wärmetauscher) n Anwendungen Verhindern den saugseitigen Rückfluss
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
by STS Sensors on June 15, 2016
 Miniaturisierung, Leistungssteigerung, Verbrauchsreduktion: Mobile Klimatechnik mit Kohlendioxid by STS Sensors on June 15, 2016 Kohlendioxid ist schon seit über 150 Jahren als Kältemittel bekannt. Dass
Miniaturisierung, Leistungssteigerung, Verbrauchsreduktion: Mobile Klimatechnik mit Kohlendioxid by STS Sensors on June 15, 2016 Kohlendioxid ist schon seit über 150 Jahren als Kältemittel bekannt. Dass
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Endersch, Jonas 09./
 Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 1. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Vergleich von Flüssigkeitskühlsätzen mit Schraubenverdichtern für Klimaanlagen mit Ammoniak und R134a
 Vergleich von Flüssigkeitskühlsätzen mit Schraubenverdichtern für Klimaanlagen mit und R134a Für die Klimakälte sind Flüssigkeitskühlsätze mit indirekter Kühlung Standard. Der Kälteträger ist im Allgemeinen
Vergleich von Flüssigkeitskühlsätzen mit Schraubenverdichtern für Klimaanlagen mit und R134a Für die Klimakälte sind Flüssigkeitskühlsätze mit indirekter Kühlung Standard. Der Kälteträger ist im Allgemeinen
Überarbeitung der europäischen F-Gas- Regelungen auf Deutschland aus?
 Öko-Recherche Büro für Umweltforschung und -beratung GmbH Überarbeitung der europäischen F-Gas- Verordnung: Wie wirken sich die neuen Regelungen auf Deutschland aus? Barbara Gschrey, Winfried Schwarz 22.11.2013
Öko-Recherche Büro für Umweltforschung und -beratung GmbH Überarbeitung der europäischen F-Gas- Verordnung: Wie wirken sich die neuen Regelungen auf Deutschland aus? Barbara Gschrey, Winfried Schwarz 22.11.2013
Thermodynamik 1 Klausur 02. August 2010
 Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Der Umgang mit R410A MITSUBISHI ELECTRIC R32 R125 R410A AIRCONDITIO NING
 Der Umgang mit... R32 R125 R410A...R410A MITSUBISHI ELECTRIC AIRCONDITIO NING R410A Inhalt Was ist R410A?......................................... 3 Begriffe..............................................
Der Umgang mit... R32 R125 R410A...R410A MITSUBISHI ELECTRIC AIRCONDITIO NING R410A Inhalt Was ist R410A?......................................... 3 Begriffe..............................................
DIE FILES DÜRFEN NUR FÜR DEN EIGENEN GEBRAUCH BENUTZT WERDEN. DAS COPYRIGHT LIEGT BEIM JEWEILIGEN AUTOR.
 Weitere Files findest du auf www.semestra.ch/files DIE FILES DÜRFEN NUR FÜR DEN EIGENEN GEBRAUCH BENUTZT WERDEN. DAS COPYRIGHT LIEGT BEIM JEWEILIGEN AUTOR. Physiklabor 2 Michel Kaltenrieder 9. Februar
Weitere Files findest du auf www.semestra.ch/files DIE FILES DÜRFEN NUR FÜR DEN EIGENEN GEBRAUCH BENUTZT WERDEN. DAS COPYRIGHT LIEGT BEIM JEWEILIGEN AUTOR. Physiklabor 2 Michel Kaltenrieder 9. Februar
Ricardo Fiorenzano de Albuquerque (Autor) Untersuchung von Ejektor-Kälteanlagen beim Einsatz in tropischen Gebieten
 Ricardo Fiorenzano de Albuquerque (Autor) Untersuchung von Ejektor-Kälteanlagen beim Einsatz in tropischen Gebieten https://cuvillier.de/de/shop/publications/389 Copyright: Cuvillier Verlag, Inhaberin
Ricardo Fiorenzano de Albuquerque (Autor) Untersuchung von Ejektor-Kälteanlagen beim Einsatz in tropischen Gebieten https://cuvillier.de/de/shop/publications/389 Copyright: Cuvillier Verlag, Inhaberin
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
R723 ein Azeotrop auf der Basis von Ammoniak
 R723 ein Azeotrop auf der Basis von Ammoniak Neben dem Kältemittel ist das Kältemaschinenöl ein wichtiger Betriebsstoff einer Kälteanlage. Bei einem geschlossenen Kreislauf muss das Öl wieder zum Verdichter
R723 ein Azeotrop auf der Basis von Ammoniak Neben dem Kältemittel ist das Kältemaschinenöl ein wichtiger Betriebsstoff einer Kälteanlage. Bei einem geschlossenen Kreislauf muss das Öl wieder zum Verdichter
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan
 Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Positively Innovative F-Gas Verordnung und Kältemittelalternativen
 Positively Innovative 26.01.2016 F-Gas Verordnung und Kältemittelalternativen Agenda Agenda Daikin at a Glance Vorgaben F-Gas Verordnung Herausforderung Zukünftige Kältemittel und ihre Anwendung Daikin
Positively Innovative 26.01.2016 F-Gas Verordnung und Kältemittelalternativen Agenda Agenda Daikin at a Glance Vorgaben F-Gas Verordnung Herausforderung Zukünftige Kältemittel und ihre Anwendung Daikin
Planen Sie jetzt für einen reibungslosen und profitablen Übergang Der Countdown für R32 hat begonnen.
 MAKING MODERN LIVING POSSIBLE Planen Sie jetzt für einen reibungslosen und profitablen Übergang Der Countdown für R32 hat begonnen. 2013 R32 Einführung Machen Sie sich bereit für das neue Kältemittel mit
MAKING MODERN LIVING POSSIBLE Planen Sie jetzt für einen reibungslosen und profitablen Übergang Der Countdown für R32 hat begonnen. 2013 R32 Einführung Machen Sie sich bereit für das neue Kältemittel mit
CE-Kennzeichnung von Ausrüstungsteilen mit Sicherungsfunktion und druckhaltenden Ausrüstungsteilen
 Positionspapier Druckgeräterichtlinie 2014/68/EU CE-Kennzeichnung von Ausrüstungsteilen mit Sicherungsfunktion und druckhaltenden Ausrüstungsteilen Stand: 30.05.2017 Verband Deutscher Maschinenund Anlagenbau
Positionspapier Druckgeräterichtlinie 2014/68/EU CE-Kennzeichnung von Ausrüstungsteilen mit Sicherungsfunktion und druckhaltenden Ausrüstungsteilen Stand: 30.05.2017 Verband Deutscher Maschinenund Anlagenbau
Umweltverträgliche organische Arbeitsmedien Experimenteller Vergleich von R1233zd-E als Ersatz für R245fa
 Lehrstuhl für Energiesysteme Fakultät für Maschinenwesen Technische Universität München Umweltverträgliche organische Arbeitsmedien Experimenteller Vergleich von R1233zd-E als Ersatz für R245fa Sebastian
Lehrstuhl für Energiesysteme Fakultät für Maschinenwesen Technische Universität München Umweltverträgliche organische Arbeitsmedien Experimenteller Vergleich von R1233zd-E als Ersatz für R245fa Sebastian
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Kolligative Eigenschaften
 Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Thermodynamik 2 Klausur 14. September 2011
 Thermodynamik 2 Klausur 14. September 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Thermodynamik 2 Klausur 14. September 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Auslegung von Verdampfern und Verflüssigern
 Auslegung von Verdampfern und Verflüssigern Kältemittel mit hohem Temperatur-Gleit Dipl.-Ing. Michael Freiherr, Leitung Projektmanagement 1 EINLEITUNG Die novellierte F-Gase-Verordnung (EU 517/2014) ist
Auslegung von Verdampfern und Verflüssigern Kältemittel mit hohem Temperatur-Gleit Dipl.-Ing. Michael Freiherr, Leitung Projektmanagement 1 EINLEITUNG Die novellierte F-Gase-Verordnung (EU 517/2014) ist
KÄLTEVERSORGUNG. Ein Unternehmen von Bayer und LANXESS
 KÄLTEVERSORGUNG Ein Unternehmen von Bayer und LANXESS KÄLTEVERSORGUNG - Einführung EINFÜHRUNG In vielen Produktionsbereichen der chemischen Industrie ist die richtige Betriebstemperatur eine Grundvoraussetzung
KÄLTEVERSORGUNG Ein Unternehmen von Bayer und LANXESS KÄLTEVERSORGUNG - Einführung EINFÜHRUNG In vielen Produktionsbereichen der chemischen Industrie ist die richtige Betriebstemperatur eine Grundvoraussetzung
Physik III im Studiengang Elektrotechnik
 hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Van der Waals-Theorie und Zustandsgleichung
 Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Röhrenwärmeübertrager Typ HE
 MAKING MODERN LIVING POSSIBLE Datenblatt Röhrenwärmeübertrager Typ HE Der Röhrenwärmeübertrager vom Typ HE, wird primär für die Wärmeübertragung zwischen Flüssigkeitsleitung und Saugleitung in einer Kälteanlage
MAKING MODERN LIVING POSSIBLE Datenblatt Röhrenwärmeübertrager Typ HE Der Röhrenwärmeübertrager vom Typ HE, wird primär für die Wärmeübertragung zwischen Flüssigkeitsleitung und Saugleitung in einer Kälteanlage
Kälteanlagenbranche im Umbruch
 Kälteanlagenbranche im Umbruch Umstellung oder Nachfüllung von R 404A Anlagen Nicht nur eine Gewissensfrage?! Kälteanlagenbranche im Umbruch - Planungs- und Berechnungssoftware - Diagnose, Monitoringund
Kälteanlagenbranche im Umbruch Umstellung oder Nachfüllung von R 404A Anlagen Nicht nur eine Gewissensfrage?! Kälteanlagenbranche im Umbruch - Planungs- und Berechnungssoftware - Diagnose, Monitoringund
3.4 Änderung des Aggregatzustandes
 34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
Der Temperatur-Glide von Kältemitteln und. die rechte Grenzkurve Nassdampfgebiet die linke Grenzkurve Siedepunkt. Mitteltemperatur
 Falsche Schlussfolgerung, der Temperatur ist kein Druckabfall zugeorndet. Erstellt 12.05.2016 Information für den Kälte-, Klima- und Wärmepumpenbauer, Nr. 40, 16.05.2016 Seite 1 von 2 Berufsgruppe Kälte
Falsche Schlussfolgerung, der Temperatur ist kein Druckabfall zugeorndet. Erstellt 12.05.2016 Information für den Kälte-, Klima- und Wärmepumpenbauer, Nr. 40, 16.05.2016 Seite 1 von 2 Berufsgruppe Kälte
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
R723 ein Azeotrop auf der Basis von Ammoniak
 R723 ein Azeotrop auf der Basis von Ammoniak Neben dem Kältemittel ist das Kältemaschinenöl ein wichtiger Betriebsstoff einer Kälteanlage. Bei einem geschlossenen Kreislauf muss das Öl wieder zum Verdichter
R723 ein Azeotrop auf der Basis von Ammoniak Neben dem Kältemittel ist das Kältemaschinenöl ein wichtiger Betriebsstoff einer Kälteanlage. Bei einem geschlossenen Kreislauf muss das Öl wieder zum Verdichter
Partikel-Dampf-Gemische am Arbeitsplatz - Grundlagen zur Messung -
 Partikel-Dampf-Gemische am Arbeitsplatz - Grundlagen zur Messung - 3. Symposium Gefahrstoffe am Arbeitsplatz, Dr. Dietmar Breuer, IFA Dortmund, 25. 09. 2012 Die einfache Welt der Dampf oder Aerosolprobenahme
Partikel-Dampf-Gemische am Arbeitsplatz - Grundlagen zur Messung - 3. Symposium Gefahrstoffe am Arbeitsplatz, Dr. Dietmar Breuer, IFA Dortmund, 25. 09. 2012 Die einfache Welt der Dampf oder Aerosolprobenahme
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
8. Mehrkomponentensysteme. 8.1 Partielle molare Größen. Experiment 1 unter Umgebungsdruck p:
 8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
1. Aufgaben der Klimaanlage
 Praxiswissen Pkw-Klimaanlagen 1 1. Aufgaben der Klimaanlage In erster Linie kommt der Klimaanlage die Aufgabe zu, die Temperatur im Fahrzeug - innenraum bei entsprechend hohen Außentemperaturen auf ein
Praxiswissen Pkw-Klimaanlagen 1 1. Aufgaben der Klimaanlage In erster Linie kommt der Klimaanlage die Aufgabe zu, die Temperatur im Fahrzeug - innenraum bei entsprechend hohen Außentemperaturen auf ein
Van der Waalsgeleichung
 HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, bernhard.nietrost@htl-steyr.ac.at Van der Waalsgeleichung Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, bernhard.nietrost@htl-steyr.ac.at Van der Waalsgeleichung Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
Bleiben Sie im Geschäft: Machen Sie Schluss mit R-404A / R-507A!
 R-507A R-404A Bleiben Sie im Geschäft: Machen Sie Schluss mit R-404A / R-507A! WARUM MÜSSEN SIE DRINGEND HANDELN? Der enorme HFKW Phase-Down Schritt in 2018 und die Begrenzung des GWP Wertes auf maximal
R-507A R-404A Bleiben Sie im Geschäft: Machen Sie Schluss mit R-404A / R-507A! WARUM MÜSSEN SIE DRINGEND HANDELN? Der enorme HFKW Phase-Down Schritt in 2018 und die Begrenzung des GWP Wertes auf maximal
Liste der Formelzeichen. A. Thermodynamik der Gemische 1
 Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Röhrenwärmeübertrager Typ HE
 Datenblatt Röhrenwärmeübertrager Typ HE Der Röhrenwärmeübertrager vom Typ HE, wird primär für die Wärmeübertragung zwischen Flüssigkeitsleitung und Saugleitung in einer Kälteanlage eingesetzt. Der Grund
Datenblatt Röhrenwärmeübertrager Typ HE Der Röhrenwärmeübertrager vom Typ HE, wird primär für die Wärmeübertragung zwischen Flüssigkeitsleitung und Saugleitung in einer Kälteanlage eingesetzt. Der Grund
Vergleich des zu erwartenden Energiebedarf einer TK Kälteanlagen mit R 404A im Istzustand und nach energetischer Sanierung
 Vergleich des zu erwartenden Energiebedarf einer TK Kälteanlagen mit R 404A im Istzustand und nach energetischer Sanierung Messungen an der Anlage mit CoolTool Diagnostics Eine TK Verbundkälteanlage mit
Vergleich des zu erwartenden Energiebedarf einer TK Kälteanlagen mit R 404A im Istzustand und nach energetischer Sanierung Messungen an der Anlage mit CoolTool Diagnostics Eine TK Verbundkälteanlage mit
E Homogene / inhomogene Mischungen und Entmischungsdiagramme
 E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
Phasendiagramm. Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; Verfasser: Philippe Knüsel
 Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
Thermodynamik 1 Klausur 12. August 2013
 Thermodynamik 1 Klausur 12. August 2013 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 1 Klausur 12. August 2013 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
