Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
|
|
|
- Sabine Neumann
- vor 5 Jahren
- Abrufe
Transkript
1 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der Druck und die Zusammensetzung der beiden Phasen mit bekanntem Siedediagramm bestimmt. Lässt sich daraus die Zusammensetzung des Eingangsstroms eindeutig rekonstruieren? Begründen Sie. P Aus diesen Informationen lässt sich der Eingangsstrom nicht eindeutig rekonstruieren. Hierzu ist entweder noch die Angabe der Phasenanteile Hebel oder der Siedetemeratur des Eingangsstroms notwendig. b Gegeben ist das Phasendiagramm einer binären Mischung mit der überkritischen Komonente A. Beschreiben Sie die Kondensation entlang der Isobaren von Punkt 1 bis Punkt 5. Gehen Sie dabei auf due Stoffmengenanteile der beiden Phasen ein. In welchem Aggregatzustand befindet sich die Mischung im Punkt 5? Wie wird diese Art der Kondensation auch genant? 5 P Kühlt man die Gasmischung Punkt 1 isobar ab, so bildet sich beim Überschreiten der Kondensationslinie Flüssigkeit, deren Menge bei weiterer Abkühlung anteilmäßig zunimmt Punkt um schließlich ein Maximum Punkt 3 zu erreichen. Bei weiterer Abkühlung sinkt der Anteil der Flüssighase wieder Punkt 4 um beim erneuten Überschreiten der Kondensationslinie wieder gasförmig Punkt 5 vorzuliegen. Dieser Vorgang wird als retrograde Kondensation bezeichnet. c Die binäre Mischung Ethanol A-Toluol B bildet bei dem betrachteten Systemdruck ein Leichtsiederazeotro aus. Skizzieren Sie den Prozessweg für die abgebildete fraktionelle Destillation, bestehend aus einem Verdamfer und n = Kondensatoren in das beigefügte T, x- Diagramm ein. Berechnen Sie die fehlenden Werte. Welcher Wert ergibt sich für die Gas- bzw. Flüssighasenzusammensetzung, wenn n gegen Unendlich geht? 8 P Die Zusammensetzung am Ausgang der 1. Verdamfereinheit 0 kann aus dem beigefügten T, x-diagramm abgelesen werden zu x A = 0.03, x A = x B x B Die zugehörigen Stoffmengenanteile werden aus dem Konoden- bzw. Hebelgesetz bestimmt n = 4.65 n 0.4 n = n Da die Gesamtstoffmenge n + n = 1 mol bekannt sind, ergibt sich für die Stoffmenge der jeweiligen Phasen n = 1 n = mol n = mol Über die, bereits bestimmte, Gashasenzusammensetzung ergeben sich die Stoffmengen der beiden Komonenten in der Gashase n A = 0.0 mol n B 1
2 Die Zusammensetzung der einzelnen Phasen nach der 1. Kondensatorenstufe 1 wird wieder aus dem T, x- Diagramm bestimmt x A = 0.5, x A = x B Aus dem Hebelgesetz ergibt sich auch hier für die Phasenanteile x B n = 8.8 n 0.3 n = 9.33 n Die Gesamtstoffmenge in. Kondensator wurde bereits im vorherigen Schritt zu n + n = mol berechnet n = mol n = n = Aus der Gashasenzusammensetzung ergibt sich somit für die Stoffmengenanteile der beiden Komonenen in der Gashase n A = mol n B Man erkennt dass sich die Gashase mit der Komonente A anreichert. Die gesuchte Temeratur der. Kondensatorenstufe ergibt sich aus dem Diagramm zu T = K. Für die Zusammensetzung der Gasund Flüssighase im azeotroen Punkt ergibt sich schließlich x A = x A = x B Reale Fluide 4 P x B d Über das Korresondenzrinzi kann man das Realverhalten verschiedener Stoffe im dimensionslosen Koordinatensystem darstellen. Geben Sie die gesuchten Zahlenwerte an. In welchem Punkt befindet sich das globale Minimum der Kurvenscharen? Begründen Sie. Zeichnen Sie die Boyle-Isotherme qualitativ in das Schaubild ein. P
3 e Zeichnen Sie den qualitativen Verlauf einer Isothermen gemäß einer kubischen Zustandsgleichung mit T < T c in das, v-diagramm ein. Gehen Sie davon aus, dass drei reelle Lösungen für den Damfdruck existieren, zeichnen Sie diese in das Diagramm ein. Wie ist dadurch der thermodynamisch instabile Bereich gekennzeichnet? P Die beiden Flächen A 1 und A sind gleich groß Maxwell-Bedingung. Der instabile Bereich liegt zischen den Punkten 1 und. Von den drei Lösungen liegt v 1, im instabilen Bereich und somit sind die beiden hysikalisch sinnvollen Lösungen festgelegt. Das molare Volumen der Gashase ergibt sich zu v 1,1 und das der Flüssihase zu v 1,3 Henrysche und Raoultsche Gesetz 9 P Für die folgenden Betrachtungen verhalten sich sowohl die Gas-wie auch die Flüssighase vollständig ideal. f Im Folgenden soll die Löslichkeit von Kohlenstoffmonoxid in Wasser betrachtet werden. Berechnen Sie die Stoffmengen der beiden Komonenten in der Gas- und Flüssighase, sowie die jeweilige Zusammensetzung. Bewerten Sie zudem, ob in diesem Beisiel die Annahmen der idealen Gas- oder Flüssighase sinnvoll sind. 5 P Der Molenbruch der jeweiligen Komonente kann entweder über die angegebenen Partialdrück oder alternativ über die angegebenen molaren Partialdichten berechnet werden CO ρ CO x CO = = CO + HO ρ CO + ρ HO x H O = mol/mol. = mol/mol, Um den Molenbruch des Kohlenstoffdioxid in der Flüssighase zu berechnen, soll das Henrysche Gesetz verwendet werden x CO= x CO H CO,HO = , 351 = 1, mol/mol. Der Molenbruch des Wasser in der Flüssigkeit ergibt sich einfach aus der Molenbruch-Schließbedingung x H O= =
4 Die Stoffmenge des Kohlenstoffmonoxid ergibt sich aus der Definition des Molenbruchs n CO x CO = n CO + n H O n CO = x CO n H O 1 x CO = mol. g Das vereinfachte Raoultsche Gesetz beschreibt den Gesamtdruck eines binären Damf-Flüssig Gleichgewichts der Komonenten A und B über die Geradengleichung Ges. x A = m x A + c. Wie lassen sich m und c bei Kenntnis der Reinstoffdamfdrücke berechnen? 3 P Ges. x A = 0 A 0 B x A + 0 B Mit dem Partialdruck der i-ten Komonente im Gas i und dem Damfdruck der i-ten Reinstoffkomonente 0 i. h Das Henrysche Gesetz kann in das Raoultsche Gesetz umgeschrieben werden. Welchen Wert muss die Henry-Konstante H i,lm T annehmen? 1 P 0 i x i = x i H i,lm T x i = x i H i,lm T! = 0 i T 4
5 Rechenteil : Aufgabe Im Folgenden soll die Gashasenzusammensetzung der biären Mischung Ethanol A und Wasser B im Damf-Flüssigkeitsgleichgewicht bei T =3.5 C berechnet werden. Aufgrund des hohen Systemdrucks von 50 bar kann die Gashase nicht als ideal betrachtet werden. Zur Bestimmung der Gashasenzusammensetzung wird folgender Lösungsansatz vorgeschlagen. Der Fugazitätskoeffizient der i-ten Gaskomonente kann über eine Virialgleichung bestimmt werden. Entwickelt man bis zum.virialkoeffizienten, so ergibt sich folgender Zusammensetzung: RT lnϕ i = B mix + j=1 x j B ij a Berechnen Sie aus den angegebenen Stoffdaten das chemische Potential des Ethanols in der Flüssighase. P µ EthT,, x = µ rein.liq. Eth. T, + RT ln x i γ i µ EthT,, x = 4755 J mol µ EthT,, x = J mol. J mol K K ln b Formulieren Sie das chemische Potential des Ethanols in der Gashase als Funktion und verwenden Sie dabei die angegebene Näherung des Fugazitätskoeffizienten. P Eth.T,, x x = µ 0 Eth. Eth.T, + RT ln ϕ Eth.. 0 c Die Phasengleichgewichtsbedingung führt, unter der Näherung lnx i x i x i /, auf eine quadratische Gleichung der Form ax A + bx A + c = 0. Bestimmen Sie die Koeffizienten a, b, c und damit dann die gesuchte Gashasenzusammensetzung. 10 P Eth.T,, x = µ 0 Eth.T, 0 + RT ln + RT lnx Eth. + RT lnϕ Eth. T,, x 0 Eth.T,, x [ = µ 0 Eth.T, 0 + RT ln + lnx Eth. + x Eth.B 11 + x Was.B 1 B Mix.] 0 B Mix. = x Eth.B 11 + x Eth.x Was.B 1 + x Was.B x Was. = 1 x Eth. RT lnx Eth. RT x Eth. + x Eth. Eth.T,, x = µ Eth.T,, x 5
6 B 11 + B 1 B RT B 1 B x Eth. + x Eth. B 11 B 1 + B RT + RT ln + µ 0 Eth.T, 0 µ Eth.T,, x = 0 0 a x Eth. + b x Eth. + c = 0, a = B 11 B 1 + B + RT b = B 11 B 1 + B RT c = B 1 B + RT ln 0 = J mol = J mol + µ 0 Eth.T, 0 µ Eth.T,, x = J mol. x Eth.,1 = = x Eth., = x Was. =
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N
 -IV A.1- IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N 1 Einleitung Während heterogene Stoffgemische sich häufig durch mechanische Trennverfahren in ihre homogenen Phasen
-IV A.1- IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N 1 Einleitung Während heterogene Stoffgemische sich häufig durch mechanische Trennverfahren in ihre homogenen Phasen
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasengleichgewicht (Destillation)
 Phasengleichgewicht (Destillation) Labor für Thermische Verfahrenstechnik bearbeitet von Prof. Dr.-Ing. habil. R. Geike 1. Grundlagen für das Phasengleichgewicht Damf - Flüssigkeit Die unterschiedliche
Phasengleichgewicht (Destillation) Labor für Thermische Verfahrenstechnik bearbeitet von Prof. Dr.-Ing. habil. R. Geike 1. Grundlagen für das Phasengleichgewicht Damf - Flüssigkeit Die unterschiedliche
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Institut für Technische Chemie Technische Universität Clausthal. Technisch-chemisches Praktikum TCB. Versuch: Rektifikation
 Institut für Technische Chemie Technische Universität Clausthal Technisch-chemisches Praktikum TCB Versuch: Rektifikation Einleitung In einer Vielzahl von chemischen Produktionsanlagen besteht die Notwendigkeit,
Institut für Technische Chemie Technische Universität Clausthal Technisch-chemisches Praktikum TCB Versuch: Rektifikation Einleitung In einer Vielzahl von chemischen Produktionsanlagen besteht die Notwendigkeit,
Inhalt 1 Grundlagen der Thermodynamik
 Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik
 Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Zur Erinnerung. p isotherm. Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: Kreisprozesse:
 Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Karl Stephan Franz Mayinger. Thermodynamik. Grundlagen und technische Anwendungen. Zwölfte, neubearbeitete und erweiterte Auflage
 Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Musterlösung zur Abschlussklausur PC I Übungen (27. Juni 2018)
 1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
212 - Siedepunktserhöhung
 1 - Siedeunktserhöhung 1. Aufgabe Es ist für verschiedene in Wasser lösliche Stoffe die Siedeunktserhöhung ihrer Lösung zu messen und daraus die molare Masse zu bestimmen.. Grundlagen Stichworte: Damfdruck,
1 - Siedeunktserhöhung 1. Aufgabe Es ist für verschiedene in Wasser lösliche Stoffe die Siedeunktserhöhung ihrer Lösung zu messen und daraus die molare Masse zu bestimmen.. Grundlagen Stichworte: Damfdruck,
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 2. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Thermodynamik II. G 0 Ed = G 0 A + G 0 B = n A,st g 0. = n A,st
 Thermodynamik II Lösung ufgabe 89 sgleichgewicht a us der efinition der Freien Enthalie H T S ergibt sich bei Referenzdruck Index aus den molaren ildungsenthalien und den absoluten Entroien die Freie Enthalie
Thermodynamik II Lösung ufgabe 89 sgleichgewicht a us der efinition der Freien Enthalie H T S ergibt sich bei Referenzdruck Index aus den molaren ildungsenthalien und den absoluten Entroien die Freie Enthalie
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11
 Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Lösungsvorschlag zu Übung 11
 PCI Thermodynamik G. Jeschke FS 2015 Lösungsvorschlag zu Übung 11 (Version vom 28.04.2015) Aufgabe 1 Alle Reaktionsgleichgewichte stellen sich bei 1000 K ein, damit sind alle Komponenten stets gasförmig.
PCI Thermodynamik G. Jeschke FS 2015 Lösungsvorschlag zu Übung 11 (Version vom 28.04.2015) Aufgabe 1 Alle Reaktionsgleichgewichte stellen sich bei 1000 K ein, damit sind alle Komponenten stets gasförmig.
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Die Eigenschaften einfacher
 Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Liste der Formelzeichen. A. Thermodynamik der Gemische 1
 Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
T 1 T T Zustandsverhalten einfacher Systeme (Starthilfe S ) - Prozess und Zustandsänderung. Prozess (Q 12
 . Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
. Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Band 2: Mehrstoffsysteme und chemische Reaktionen. Grundlagen und technische Anwendungen
 Karl Stephan Franz Mayinger n 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. or Band 2: Mehrstoffsysteme und chemische
Karl Stephan Franz Mayinger n 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. or Band 2: Mehrstoffsysteme und chemische
Physikalische Chemie II
 Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
Repetitorium Physikalische Chemie für Lehramt
 Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
Protokoll zum Versuch 4.2
 Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Phsikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt zur Vrlesung Phsikalische Chemie II WS 8/9 Prf. E. Bartsch.1 Bei 73 K werden 5 g (.59 ml) Hean, C 6 H 14, und
Institut für Phsikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt zur Vrlesung Phsikalische Chemie II WS 8/9 Prf. E. Bartsch.1 Bei 73 K werden 5 g (.59 ml) Hean, C 6 H 14, und
Van der Waals-Theorie und Zustandsgleichung
 Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
4 Phasendiagramme. Für den kritischen Punkt von Kohlendioxid werden 304,14 K und 7,375 MPa angegeben, für den Tripelpunkt 216,58 K und 518 kpa.
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 4 Phasendiagramme 1 Skizzieren
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 4 Phasendiagramme 1 Skizzieren
Adsorption an Festkörpern
 Adsortion an Festkörern Anreicherung eines Stoffes findet im wesentlichen nur an der Festköreroberfläche statt. Die Lage der Grenzfläche ist damit sehr genau bestimmt. Nicht nur die Größe der für die Adsortion
Adsortion an Festkörern Anreicherung eines Stoffes findet im wesentlichen nur an der Festköreroberfläche statt. Die Lage der Grenzfläche ist damit sehr genau bestimmt. Nicht nur die Größe der für die Adsortion
Destillation und Rektifikation: Vorlesung am : Zusammenfassung des zweiten Teils. Siedediagramm
 Destillation und Rektifikation: Vorlesung am 27.1.211: Zusammenfassung des zweiten eils llgemeine Bemerkung zu den Berechnungen und bleitungen der Formeln: Die Vorgänge werden in der Regel für ideale Zustände
Destillation und Rektifikation: Vorlesung am 27.1.211: Zusammenfassung des zweiten eils llgemeine Bemerkung zu den Berechnungen und bleitungen der Formeln: Die Vorgänge werden in der Regel für ideale Zustände
-aus theoretischen Ansätzen - Approximationen
 2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
Chemische Thermodynamik. Arbeitsbuch 4. 4., überarbeitete Auflage. Autoren. Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
 Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
wegen adiabater Kompression, d.h. kein Wärmeaustausch mit der Umgebung, gilt:
 Ü 7. Adiabate Komression on Luft Luft wird in einem adiabaten Zylinder on. bar, T 5 C solange erdichtet bis eine Endtemeratur on T 00 C erreicht wird. Gesucht sind die zur Verdichtung erforderliche Arbeit
Ü 7. Adiabate Komression on Luft Luft wird in einem adiabaten Zylinder on. bar, T 5 C solange erdichtet bis eine Endtemeratur on T 00 C erreicht wird. Gesucht sind die zur Verdichtung erforderliche Arbeit
Praktikum Physikalische Chemie II (C-3) Versuch Nr. 11
 Praktikum Physikalische Chemie II (C-3) Versuch Nr. 11 Bestimmung der Phasengleichgewichtskurve eines binären Systems Grundlagen Im Allgemeinen besitzt der Dampf über einer binären flüssigen Mischung eine
Praktikum Physikalische Chemie II (C-3) Versuch Nr. 11 Bestimmung der Phasengleichgewichtskurve eines binären Systems Grundlagen Im Allgemeinen besitzt der Dampf über einer binären flüssigen Mischung eine
3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen
 Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Klausurlösungen Thermodynamik II Sommersemester 2014 Fragenteil
 Klausurlösungen Thermodynamik II Sommersemester 2014 Fragenteil Lösung zum Fragenteil Regeln Nur eine eindeutige Markierung wird bewertet, z. B.: Für eine Korrektur kann die zweite Spalte mögl. Korrektur
Klausurlösungen Thermodynamik II Sommersemester 2014 Fragenteil Lösung zum Fragenteil Regeln Nur eine eindeutige Markierung wird bewertet, z. B.: Für eine Korrektur kann die zweite Spalte mögl. Korrektur
Physikalische Chemie I
 Physikalische Chemie I 2017 Physikalische Chemie I Dozenten: Vorlesung Prof. Dr. Cornelia Palivan (Tel: 0612673839 Cornelia.Palivan@unibas.ch) Prof. Dr. Wolfgang Meier (Tel: 0612673802 Wolfgang.Meier@unibas.ch)
Physikalische Chemie I 2017 Physikalische Chemie I Dozenten: Vorlesung Prof. Dr. Cornelia Palivan (Tel: 0612673839 Cornelia.Palivan@unibas.ch) Prof. Dr. Wolfgang Meier (Tel: 0612673802 Wolfgang.Meier@unibas.ch)
GPH2 Thermodynamik. 27. September Dieser Entwurf ist weder vollständig oder fehlerfrei noch ein offizielles Script zur Vorlesung.
 GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung PhysChem Verlag Erlangen U. Nickel VII Inhaltsverzeichnis 1 GRUNDLAGEN DER THERMODYNAMIK 1 1.1 Einführung 1 1.2 Materie 2 1.3 Energie
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung PhysChem Verlag Erlangen U. Nickel VII Inhaltsverzeichnis 1 GRUNDLAGEN DER THERMODYNAMIK 1 1.1 Einführung 1 1.2 Materie 2 1.3 Energie
Aufgaben Kreisprozesse. 1. Ein ideales Gas durchläuft den im V(T)- Diagramm dargestellten Kreisprozess. Es ist bekannt:
 Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
NAME, Vorname Matr.-Nr. Studiengang. Prüfung am im Fach Technische Thermodynamik I
 NAME, Vorname Matr.-Nr. Studiengang Prof. Dr.-Ing. Gerhard Schmitz Prüfung am 26. 02. 2019 im Fach Technische Thermodynamik I Fragenteil ohne Hilfsmittel erreichbare Punktzahl: 30 Dauer: 25 Minuten Regeln
NAME, Vorname Matr.-Nr. Studiengang Prof. Dr.-Ing. Gerhard Schmitz Prüfung am 26. 02. 2019 im Fach Technische Thermodynamik I Fragenteil ohne Hilfsmittel erreichbare Punktzahl: 30 Dauer: 25 Minuten Regeln
PC I Thermodynamik G. Jeschke FS Lösung zur Übung 12
 PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
Übung 4. SS 2013 Übung - Einführung in die Verbrennung - Methling, Özuylasi 1
 Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Übung 3. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) Verständnis des thermodynamischen Gleichgewichts
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
1. Thermodynamische Potentiale, Maxwellgleichungen
 69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
Beispiel 13: Gasvolumetrie
 Aufgabenstellung Beisiel 1: Gasvolumetrie Eine abgewogene Menge eines festen carbonathaltigen Stoffes wird mit einem Überschuss starker Säure versetzt. Die Menge an gebildetem gasförmigem Kohlenstoffdioxid
Aufgabenstellung Beisiel 1: Gasvolumetrie Eine abgewogene Menge eines festen carbonathaltigen Stoffes wird mit einem Überschuss starker Säure versetzt. Die Menge an gebildetem gasförmigem Kohlenstoffdioxid
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
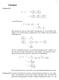 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Aufgabe 1: Theorie Punkte
 Aufgabe 1: Theorie.......................................... 30 Punkte (a) (2 Punkte) In einen Mischer treten drei Ströme ein. Diese haben die Massenströme ṁ 1 = 1 kg/s, ṁ 2 = 2 kg/s und ṁ 3 = 2 kg/s.
Aufgabe 1: Theorie.......................................... 30 Punkte (a) (2 Punkte) In einen Mischer treten drei Ströme ein. Diese haben die Massenströme ṁ 1 = 1 kg/s, ṁ 2 = 2 kg/s und ṁ 3 = 2 kg/s.
3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen
 Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Thermodynamik 2 Klausur 11. März 2011
 Thermodynamik 2 Klausur 11. März 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 4 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 2 Klausur 11. März 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 4 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik
 Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
Versuch Beschreiben Sie die Vorgänge, die in der Nähe des kritischen Punktes zu beobachten sind.
 1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
2. GRUNDLAGEN. 2.1 Kontinuierliche Thermodynamik
 2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
Modelle zur Beschreibung von Gasen und deren Eigenschaften
 Prof. Dr. Norbert Hampp 1/7 1. Das Ideale Gas Modelle zur Beschreibung von Gasen und deren Eigenschaften Modelle = vereinfachende mathematische Darstellungen der Realität Für Gase wollen wir drei Modelle
Prof. Dr. Norbert Hampp 1/7 1. Das Ideale Gas Modelle zur Beschreibung von Gasen und deren Eigenschaften Modelle = vereinfachende mathematische Darstellungen der Realität Für Gase wollen wir drei Modelle
Versuch 10. Rektifikation und Rektifizierkolonne
 Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum
 Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13. Klausur PC 1
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13 Klausur PC 1 Wintersemester 2009/10-20.10.2009 Hörsaal H2 15:15 bis 16:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift:
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13 Klausur PC 1 Wintersemester 2009/10-20.10.2009 Hörsaal H2 15:15 bis 16:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift:
Spezialfälle. BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz. bei V, n = konstant: p = const.
 Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken.
 8.4 Phasenübergänge und Phasengleichgewichte 8.4.1 Phasenübergang bei reinem Stoff Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken. Die Erfahrung
8.4 Phasenübergänge und Phasengleichgewichte 8.4.1 Phasenübergang bei reinem Stoff Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken. Die Erfahrung
Gegenstand der letzten Vorlesung
 Thermodynamik - Wiederholung Gegenstand der letzten Vorlesung Carnotscher Kreisprozess: Die idealisierte Wärmekraftmaschine Wirkungsgrad η Entropie S = k B lnw (statistische Definition) Freie Gibbs-Enthalpie
Thermodynamik - Wiederholung Gegenstand der letzten Vorlesung Carnotscher Kreisprozess: Die idealisierte Wärmekraftmaschine Wirkungsgrad η Entropie S = k B lnw (statistische Definition) Freie Gibbs-Enthalpie
NAME, Vorname Matr.-Nr. Studiengang. Prüfung am im Fach Thermodynamik II
 NAME, Vorname Matr.-Nr. Studiengang ÈÖÓ º Öº¹ÁÒ º º Ë Ñ ØÞ Prüfung am 12. 08. 2014 im Fach Thermodynamik II Fragenteil ohne Hilfsmittel erreichbare Punktzahl: 20 Dauer: 15 Minuten Regeln Nur eine eindeutige
NAME, Vorname Matr.-Nr. Studiengang ÈÖÓ º Öº¹ÁÒ º º Ë Ñ ØÞ Prüfung am 12. 08. 2014 im Fach Thermodynamik II Fragenteil ohne Hilfsmittel erreichbare Punktzahl: 20 Dauer: 15 Minuten Regeln Nur eine eindeutige
8. Mehrkomponentensysteme. 8.1 Partielle molare Größen. Experiment 1 unter Umgebungsdruck p:
 8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
3. Phasendiagramme. Für den kritischen Punkt von Kohlendioxid werden 304,14 K und 7,375 MPa angegeben, für den Tripelpunkt 216,58 K und 518 kpa.
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 3. Phasendiagramme 1 Skizzieren
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 3. Phasendiagramme 1 Skizzieren
Gruppe 46 Christine Albrecht. Protokoll. Versuch T2: Dampfdruck von Flüssigkeiten
 .10.007 Grue 46 Christine Albrecht Betreuer: Dr. Gaonik Jörg Kluge Protokoll ersuch : Damfdruck von Flüssigkeiten Aufgabe: Es war der Damfdruck einer Flüssigkeit bei verschiedenen emeraturen zu bestimmen.
.10.007 Grue 46 Christine Albrecht Betreuer: Dr. Gaonik Jörg Kluge Protokoll ersuch : Damfdruck von Flüssigkeiten Aufgabe: Es war der Damfdruck einer Flüssigkeit bei verschiedenen emeraturen zu bestimmen.
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht
 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Musterlösung Übung 9
 Musterlösung Übung 9 Aufgabe 1: Chlorierung von Phosphotrichlorid a) Von 1 mol ursprünglichem PCl 3 und Cl 2 wären 0.515 mol zu PCl 5 reagiert und 0.485 mol verblieben. Mit x i = n i ergeben sich die Molenbrüche
Musterlösung Übung 9 Aufgabe 1: Chlorierung von Phosphotrichlorid a) Von 1 mol ursprünglichem PCl 3 und Cl 2 wären 0.515 mol zu PCl 5 reagiert und 0.485 mol verblieben. Mit x i = n i ergeben sich die Molenbrüche
Thermodynamik 1 Klausur 08. September 2016
 Thermodynamik 1 Klausur 08. September 2016 Bearbeitungszeit: 150 Minuten Umfang der Aufgabenstellung: 7 nummerierte Seiten Alle Unterlagen zur Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Thermodynamik 1 Klausur 08. September 2016 Bearbeitungszeit: 150 Minuten Umfang der Aufgabenstellung: 7 nummerierte Seiten Alle Unterlagen zur Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
- Chemisches Potential der idealen Gasphase: Phasengleichgewichte nichtidealer Gemische
 Inhalt von Abschnitt 3.3 3.3-0 3.3 Phasenübergänge und Phasengleichgewichte 3.3.1 Phasenübergang bei reinem Stoff 3.3.2 Phasengleichgewichte reiner Stoffe 3.3.3 Phasengleichgewichte von Stoffgemischen
Inhalt von Abschnitt 3.3 3.3-0 3.3 Phasenübergänge und Phasengleichgewichte 3.3.1 Phasenübergang bei reinem Stoff 3.3.2 Phasengleichgewichte reiner Stoffe 3.3.3 Phasengleichgewichte von Stoffgemischen
Schwerpunktfach Physik und Anwendungen der Mathematik
 KANTONSSCHULE REUSSBÜHL MATURITÄTSPRÜFUNG 003 (Bv, Bh) Schwerpunktfach Physik und Anwendungen der Mathematik Bemerkungen: Zeit: 3 Stunden Jede vollständig gelöste Aufgabe wird mit 10 Punkten bewertet.
KANTONSSCHULE REUSSBÜHL MATURITÄTSPRÜFUNG 003 (Bv, Bh) Schwerpunktfach Physik und Anwendungen der Mathematik Bemerkungen: Zeit: 3 Stunden Jede vollständig gelöste Aufgabe wird mit 10 Punkten bewertet.
