4 Phasendiagramme. Für den kritischen Punkt von Kohlendioxid werden 304,14 K und 7,375 MPa angegeben, für den Tripelpunkt 216,58 K und 518 kpa.
|
|
|
- Uwe Fiedler
- vor 7 Jahren
- Abrufe
Transkript
1 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 4 Phasendiagramme 1 Skizzieren Sie das Phasendiagramm von Wasser! a) Tragen Sie Tripelpunkt, Siedepunkt, und kritischen Punkt ein! 26. April 2016 Die ebullioskopischen bzw. kryoskopischen Konstanten betragen 0,513 bzw. 1,86 K*kg*mol -1. Zeichnen Sie die Dampfdruckkurve einer Lösung von 10,6 g Saccharose (C 12H 22O 11) in 100 ml Wasser qualitativ in die Abbildung ein, und bezeichnen Sie die berechenbaren Größen! 2 Für den kritischen Punkt von Kohlendioxid werden 304,14 K und 7,375 MPa angegeben, für den Tripelpunkt 216,58 K und 518 kpa. a) Skizzieren Sie das Phasendiagramm und beschriften Sie es möglichst vollständig! In welchem Aggregatzustand und bei welcher (geschätzten) Temperatur befindet sich kondensiertes CO2, das bei einem Bar Druck aufbewahrt wird? Berechnen Sie die Parameter a, b für die vanderwaals-gleichung und stellen Sie diese auf. Wie groß ist das Volumen am kritischen Punkt nach dieser vanderwaals-gleichung und nach dem idealen Gasgesetz? Schlittschuhe gleiten auf Eis, weil sich zwischen den Kufen und dem Eis eine dünne Wasserschicht 3 bildet. Das Eis schmilzt, weil durch den Druck der Schmelzpunkt erniedrigt wird, und weil die naturgemäß geringe- Reibung Wärme freisetzt. Die Länge der Kufen betrage etwa 20 cm, die Breite 2 mm (mit Hohlschliff). Berechnen Sie die a) Auflagefläche A und den Druck der Kufen auf das Eis, wenn die Masse des Läufers insgesamt etwa 55 kg beträgt! Es wird jeweils beim Laufen nur ein Schlittschuh auf den Boden gesetzt. Berechnen Sie den Unterschied der Molvolumina von Eis (ρ=0,916 g/cm³) und Wasser. Die Schmelzenthalpie von Eis ist 6,01 kj/mol. Berechnen Sie daraus die Schmelzentropie! Unter welcher Bedingung darf man hier die Gibbs-Helmholtz-Gleichung verwenden? Berechnen Sie nach der Clapeyron-Gleichung den Schmelzpunkt des Eises unter den Kufen. Worin unterscheidet sich das Phasendiagramm von Wasser qualitativ von denen der meisten anderen e) Stoffe? Der Läufer erfährt eine Reibungskraft von F=2 N. Wie viel Reibungsenergie setzt er je zurückgelegtem f) Meter frei, und wie viele Mol Eis kann man damit schmelzen? g) Wie viele cm³ Wasser sind das? h) Wie groß ist die Dicke d der Wasserschicht unter den Kufen des Läufers also in µm? Berechnen Sie damit die Geschwindigkeit v des Schlittschuhläufers in km/h aus der Reibungskraft F und i) der Viskosität η= Pa s des Wassers nach F A v d 1
2 Wasser-Ethanol-Phasendiagramm (nicht ideal) Phasendiagramm von Ethanol in Wasser bei 760 Torr T / C Massenanteil Ethanol in % Berechnet nach R. Rieder, R. Thompson, Ind. Eng. Chem. 41 (1949) a) (I) Eine Ethanol-Wassermischung von anfänglich 50 g wird in einem geschlossenen System teilweise verdampft, so daß noch 15 g Flüssigkeit mit dem Dampf im Gleichgewicht stehen. Die Temperatur beträgt nach der Einstellung dieses Gleichgewichtes genau 90 C. Zeichnen Sie dieses Gleichgewicht in das Diagramm ein, und entnehmen Sie die Gewichtsanteile des Alkohols in der flüssigen und in der dampfförmigen Phase aus dem Diagramm! Berechnen Sie aus diesen Gewichtsanteilen sowie den Gewichten der flüssigen und gasförmigen Phasen die Gewichte des Alkohols in der flüssigen und in der gasförmigen Phase! Berechnen Sie das Gesamtgewicht des Alkohols im System und seinen Gewichtsanteil in der ung vor dem Verdampfen! Zeichnen Sie die Verdampfung dieses anfänglich vorliegenden Gemischs in das Diagramm ein und ermitteln Sie den zugehörigen Siedepunkt! 5 Phasendiagramm von Wasser und Ethanol (II) a) Ergänzen Sie die Beschriftung des Phasendiagramms von Wasser und Ethanol! e) Verwenden Sie die Gibbsche Phasenregel für eine Grenzlinie und ein Gebiet in diesem Phasendiagramm! Rechnen Sie die Zusammensetzung von Wein (12 Vol% Alkohol in Wasser) und Weinbrand (35 Vol%) in Gewichts % (µwein und µbrand ) um! Wie viel Gewichts% Alkohol (µwasser) hat die wasserreiche Phase, wenn die Temperatur so hoch ist, dass die alkoholreiche Phase bei der Weindestillation genau Weinbrand ergibt (aus dem Diagramm abzulesen)? Zeichnen Sie die Destillation von Wein (12 Volumen %) zu Weinbrand (35Volumen % Alkohol in Wasser) in das Diagramm ein! 2
3 Berechnen Sie nach dem Hebelgesetz : f) (µbrand - µwein)/ (µwein - µwasser) = mwasser/ mbrand das Verhältnis der Massen von Weinbrand (mbran und wasserreicher Phase (mwasser) g) Wie viel Weinbrand kann man aus einer Flasche Wein (740g) erhalten? 6 (I) Wasser und Ethanol bilden ein azeotropes Gemisch bei 78,2 C mit 90,4 mol% Alkohol. a) Skizzieren Sie das Zweistoff-Phasendiagramm und beschriften Sie es möglichst vollständig! Aktivitätskoeffizient gezeichnet nach Rieder Thompson, Ind Eng Chem 1949 p / Torr Molenbruch Ethanol in % Entnehmen Sie den Abbildungen die Sättigungsdampfdrucke von Ethanol (schwarz) und Wasser (blau) und die Aktivitätskoeffizienten am azeotropen Punkt! Berechnen Sie nach diesen Daten den Molenbruch von Ethanol in der Gasphase und vergleichen Sie diesen mit dem Wert in der flüssigen Phase! 7 Die Abbildungen in Aufgabe 6 zeigen den Dampfdruck von Ethanol und Wasser und die Aktivitätskoeffizienten. Molenbruch Ethanol in der Flüssigkeit Aktivitätskoeffizient von Ethanol Aktivitätskoeffizient von Wasser Partialdruck Ethanol in der Gasphase Molenbruch Wasser in der Flüssigkeit Partialdruck Wasser in der Gasphase Molenbruch Ethanol in der Gasphase Gesamtdruck 0 30% 90% 100% a b Bestimmen Sie für T=80 C und Molenbrüche von 30% und 90% Ethanol in der Flüssigkeit jeweils die Partialdrucke von Ethanol und Wasser in der Gasphase über der Lösung unter Verwendung der jeweiligen Aktivitätskoeffizeinten den Molenbruch von Ethanol in der Gasphase. Tragen Sie in ein Diagramm für Druck über Molenbruch die Molenbrüche von Ethanol in der flüssigen und in der Gasphase und die Dampfdrucke der reinen Phasen ein und zeichnen Sie ein Zweikomponenten-Phasendiagramm für die Gleichgewichte zwischen Ethanol-Wasser-ungen in 3
4 c d 8 a) der flüssigen und in der Gasphase bei 80 C. Kennzeichnen Sie in dem Diagramm die flüssige und die Gasphase, sowie das Zweiphasengebiet! Woran erkennt man einen azeotropen Punkt? Benzol Toluol (ideal) Benzol und Toluol stellen ein ideales Gemisch dar. Die Siedepunkte von reinem Benzol und Toluol sind 80,1 C und 111 C bei Atmosphärendruck. Berechnen Sie die Dampfdrucke von Benzol und Toluol in Torr bei 95 C nach der empirischen Antoineschen Formel lg p 1 Torr B A C T mit den Werten A B C Benzol 6, ,76 C 219,161 C Toluol 6, ,8 C 219,482 C Berechnen Sie die Zusammensetzung der Gasphase im Gleichgewicht über einer ung von 35% Benzol in 65% Toluol bei 95 C! Wie hoch ist der Druck für dieses Gleichgewicht? Die Abbildung zeigt die flüssig/gasförmig-phasengleichgewichte von Benzol und Toluol bei 90 und 100 C. Entnehmen Sie daraus die Geichgewichtskonzentrationen für flüssige und gasförmige Phase bei diesen Temperaturen. 90 C 100 C Skizzieren Sie das Siedediagramm bei Atmosphärendruck (T über xtoluol) unter Verwendung von und von den Siedepunkten. 4
5 9 Entmsichung im Zweikomponenten-Phasendiagramm Für eine Lösung eines Phenols (Molenbruch x) in Wasser werden die ungsenthalpie und die ungsentropie durch die Formeln H H S 25,4 kj / mol x (0,47 x) x 0,47 0 R x 0,47 x ln x (1 x) ln(1 x) grob angenähert. Die ungslücke kann dann mit Hilfe der Gibbs-Helmholtz-Gleichung bestimmt werden. a) Berechnen Sie ΔH und ΔS für die vorgegebenen Molenbrüche. Rechnen Sie die Molenbrüche in Massenanteile µ um. Berechnen Sie die Temperatur, bei der gerade Entmischung eintritt, für diese Molenbrüche (ΔG=0). x Phenol 0,04 0,1 0,16 0,22 µ Phenol ΔH / kj/mol ΔS / J/(mol K) T / K Θ/ C e) f) Tragen Sie die so bestimmten Temperaturen in das unten gegebene Phenol-Wasser- Phasendiagramm über den dazu berechneten Massenanteilen ein. Wie würde sich die ungslücke in der Abbildung verändern, wenn die ungsenthalpie nicht positiv, sondern negativ wäre (qualitativ, keine Rechnung)? 10 Für eine Lösung von Hexan (Molenbruch x) in Anilin werden die ungsenthalpie und die ungsentropie durch die Formeln H S 8,0 kj / mol x (1 x) R x ln x (1 x) ln(1 x) grob angenähert. Die ungslücke kann dann mit Hilfe der Gibbs-Helmholtz-Gleichung bestimmt werden. a) Berechnen Sie ΔH und ΔS für die vorgegebenen Molenbrüche. Rechnen Sie die Molenbrüche in Massenanteile µ um. Berechnen Sie die Temperatur, bei der gerade Entmischung eintritt, für diese Molenbrüche (ΔG=0). X Hexan 0,14 0,35 0,6 0,83 µ Hexan 5
6 ΔH / kj/mol ΔS / J/(mol K) T / K Θ/ C Tragen Sie die so bestimmten Temperaturen in das unten gegebene Anilin-Hexan-Phasendiagramm über den dazu berechneten Massenanteilen ein. Θ / C Wie würde sich die ungslücke in der Abbildung verändern, wenn die ungsenthalpie nicht positiv, sondern negativ wäre (qualitativ, keine Rechnung)? 6
7 Dreikomponentenphasendiagramme Die Abbildung zeigt das Dreikomponentenphasendiagramm von Wasser, Essigsäure und Chloroform. Aufgetragen sind Molenbrüche. Der schraffierte Bereich stellt eine ungslücke dar. CH 3 COOH 11 CHCl 3 H 2 O a) Sie stellen eine Lösung von 40 g CH3COOH in 10 ml H2O her. Berechnen Sie die gesamte Stoffmenge dieser Lösung und die Molenbrüche und zeichnen Sie die Lösung in das Diagramm ein! Sie tropfen zu dieser ung langsam Chloroform zu. Zeichnen Sie die Gerade in das Diagramm ein, auf der alle resultierenden ternären ungen liegen müssen! Bestimmen Sie die Molenbrüche von Chloroform, bei denen Übergänge zur Entmischung bzw. wieder zur vollständigen ung eintreten! Bestimmen Sie die Stoffmengen von Chloroform, die diesen Molenbrüchen entsprechen! e) Bestimmen Sie das Molvolumen von Chloroform in ml (Dichte 1,48 g cm -3 )! f) Bestimmen Sie die Volumina von Chloroform in ml, die diesen Stoffmengen entsprechen! 7
8 12 Die Abbildung zeigt das Dreikomponentenphasendiagramm von Wasser, Ethanol und Anisöl (Anethol), das für Anislikör ( Ouzo, Pastis ) grundlegend ist. Aufgetragen sind Massenanteile. Aufgabe methanol/mh2o manisöl/mgesamt methanol/mgesamt mh2o/mgesamt a) / ,2 0,8 40/ ,4 0,6 70/30 0,1 80/20 0,65 a) e) Anislikör enthält je Liter etwa 548 ml Wasser, 450 ml Ethanol und den Rest Anisöl (Dichte 0,99 g/l). Berechnen Sie die Massenanteile und zeichnen Sie diese Zusammensetzung in das Dreieck ein! Sie geben zu einem Glas mit 40 cm³ dieses Anislikörs 60 cm³ Wasser zu. Berechnen Sie die Massenanteile dieser Zusammensetzung und zeichnen Sie den Punkt ein! In [N. Sitnikova, R. Sprik, G.Wegdam, Langmuir, 2005, 21, 7083] finden Sie Angaben für die Grenze der ungslücke in der Tabelle. Es sind das Verhältnis von Ethanol- zu Wassermasse und der maximal lösliche Massenanteil des Anisöls gegeben. Berechnen Sie die fehlenden Massenanteile von H2O und Ethanol an der gesamten Lösung und zeichnen Sie die Punkte ein! Verbinden Sie diese frei Hand mit einer Linie! Stellen Sie fest, welche Ethanol- und Wasser-Anteile aus der Tabelle, Teil, jeweils ungefähr den beiden ungen aus a) und entsprechen! Vergleichen Sie dann anhand der Daten in der Tabelle die in a), berechneten Massenanteile des Anisöls mit den zugehörigen barkeitsgrenzen aus und schätzen Sie ab, ob bei den Zusammensetzungen in a) (reiner Likör) und (Likör mit Wasser) jeweils noch barkeit vorliegt oder schon Entmischung (Trübung) zu erwarten ist. 8
3. Phasendiagramme. Für den kritischen Punkt von Kohlendioxid werden 304,14 K und 7,375 MPa angegeben, für den Tripelpunkt 216,58 K und 518 kpa.
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 3. Phasendiagramme 1 Skizzieren
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel 3. Phasendiagramme 1 Skizzieren
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6
 LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Lösung. Nachholklausur zur Vorlesung Physikalische Chemie I - Sommersemester 2002
 Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H 2 O von
 Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
3.4 Änderung des Aggregatzustandes
 34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
LMPG 1 ÜB5 Grundlagen der Dest. Kombinierte Übungen Seite 1 von 10 LÖSUNGEN
 LMG 1 ÜB5 Grundlagen der Dest. Kombinierte Übungen Seite 1 von 10 Substanz A B C tmin tma Formel Name C C H2O Wasser 8.19621 1730.63 233.426 1 100 H3N Ammoniak 7.4854 926.133 240.17 94 12 Antoine- H4N2
LMG 1 ÜB5 Grundlagen der Dest. Kombinierte Übungen Seite 1 von 10 Substanz A B C tmin tma Formel Name C C H2O Wasser 8.19621 1730.63 233.426 1 100 H3N Ammoniak 7.4854 926.133 240.17 94 12 Antoine- H4N2
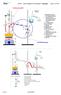
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12
 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12
 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11
 Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Spezialfälle. BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz. bei V, n = konstant: p = const.
 Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Kolligative Eigenschaften
 Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke
 Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke Themenbereiche Gibbssches Phasengesetz, Phasendiagramme, Mischbarkeit im flüssigen und festen Zustand, thermodynamische Stabilitätsbedingungen.
Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke Themenbereiche Gibbssches Phasengesetz, Phasendiagramme, Mischbarkeit im flüssigen und festen Zustand, thermodynamische Stabilitätsbedingungen.
Allgemeine Chemie. SS 2014 Thomas Loerting. Thomas Loerting Allgemeine Chemie
 Allgemeine Chemie SS 2014 Thomas Loerting 1 Inhalt 1 Der Aufbau der Materie (Teil 1) 2 Die chemische Bindung (Teil 2) 3 Die chemische Reaktion (Teil 3) 2 Definitionen von den an einer chemischen Reaktion
Allgemeine Chemie SS 2014 Thomas Loerting 1 Inhalt 1 Der Aufbau der Materie (Teil 1) 2 Die chemische Bindung (Teil 2) 3 Die chemische Reaktion (Teil 3) 2 Definitionen von den an einer chemischen Reaktion
11. Der Phasenübergang
 11. Der Phasenübergang - Phasendiagramme, Kritischer Punkt und ripelpunkt - Gibbssche Phasenregel - Phasenübergänge 1. und 2. Ordnung - Das Phasengleichgewicht - Clausius-Clapeyron-Gleichung - Pictet-routon-Regel,
11. Der Phasenübergang - Phasendiagramme, Kritischer Punkt und ripelpunkt - Gibbssche Phasenregel - Phasenübergänge 1. und 2. Ordnung - Das Phasengleichgewicht - Clausius-Clapeyron-Gleichung - Pictet-routon-Regel,
Klausur Physikalische Chemie für TUHH (Chemie III)
 07.03.2012 14.00 Uhr 17.00 Uhr Moritz / Pauer Klausur Physikalische Chemie für TUHH (Chemie III) Die folgende Tabelle dient Korrekturzwecken und darf vom Studenten nicht ausgefüllt werden. 1 2 3 4 5 6
07.03.2012 14.00 Uhr 17.00 Uhr Moritz / Pauer Klausur Physikalische Chemie für TUHH (Chemie III) Die folgende Tabelle dient Korrekturzwecken und darf vom Studenten nicht ausgefüllt werden. 1 2 3 4 5 6
Phasengleichgewicht und Phasenübergänge. Gasförmig
 Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Endersch, Jonas 09./
 Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum
 Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Gefrierpunktserniedrigung
 Gefrierpunktserniedrigung Zur Darstellung der möglichen Phasen einer Substanz wird deren Verhalten bei verschiedenen Drücken und Temperaturen gemessen und in ein Druck-Temperatur- Diagramm eingetragen.
Gefrierpunktserniedrigung Zur Darstellung der möglichen Phasen einer Substanz wird deren Verhalten bei verschiedenen Drücken und Temperaturen gemessen und in ein Druck-Temperatur- Diagramm eingetragen.
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Verflüssigung von Gasen / Joule-Thomson-Effekt
 Sieden und Kondensation: T p T p S S 0 1 RTSp0 1 ln p p0 Dampfdrucktopf, Autoklave zur Sterilisation absolute Luftfeuchtigkeit relative Luftfeuchtigkeit a ( g/m 3 ) a pw rel S ps rel 1 Taupunkt erflüssigung
Sieden und Kondensation: T p T p S S 0 1 RTSp0 1 ln p p0 Dampfdrucktopf, Autoklave zur Sterilisation absolute Luftfeuchtigkeit relative Luftfeuchtigkeit a ( g/m 3 ) a pw rel S ps rel 1 Taupunkt erflüssigung
Übungsaufgaben Physikalische Chemie
 Übungsaufgaben Physikalische Chemie A1. Welchen Druck übt gasförmiger Stickstoff mit einer Masse von 2,045 g bei 21 C in einem Gefäß mit einem Volumen von 2,00 l aus? A2. In Haushaltgeräten zur Erzeugung
Übungsaufgaben Physikalische Chemie A1. Welchen Druck übt gasförmiger Stickstoff mit einer Masse von 2,045 g bei 21 C in einem Gefäß mit einem Volumen von 2,00 l aus? A2. In Haushaltgeräten zur Erzeugung
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
AC2 ÜB THERMODYNAMIK 2, GLEICHGEWICHTSKONSTANTE Seite 1 von J / mol J K. molk
 Lösung Aufgabe 1: Kc = [HO + ]. [OH - ] a) AC2 ÜB THERMODYNAMIK 2, GLEICHGEWICHTSKONSTANTE Seite 1 von 12 1 H 2 O(l) + + 0 1 H + (aq) + 1 OH - (aq) + 0 f H m -285.8 0 0-229.99 0 [Kj/mol] S m 69.91 0 0-10.75
Lösung Aufgabe 1: Kc = [HO + ]. [OH - ] a) AC2 ÜB THERMODYNAMIK 2, GLEICHGEWICHTSKONSTANTE Seite 1 von 12 1 H 2 O(l) + + 0 1 H + (aq) + 1 OH - (aq) + 0 f H m -285.8 0 0-229.99 0 [Kj/mol] S m 69.91 0 0-10.75
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
14 Destillation Grundlagen Destillation
 72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
S05-Mischungslücke_Bsc Erstelldatum :15:00
 S05-ischungslücke_Bsc Erstelldatum 21.03.2014 11:15:00 Übungen in physikalischer Chemie für Studierende der Biochemie Versuch Nr.: S05 Version 2014 Kurzbezeichnung: ischungslücke ischungslücke in der flüssigen
S05-ischungslücke_Bsc Erstelldatum 21.03.2014 11:15:00 Übungen in physikalischer Chemie für Studierende der Biochemie Versuch Nr.: S05 Version 2014 Kurzbezeichnung: ischungslücke ischungslücke in der flüssigen
Protokoll zum Versuch 4.2
 Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Lösungsvorschlag zu Übung 11
 PCI Thermodynamik G. Jeschke FS 2015 Lösungsvorschlag zu Übung 11 (Version vom 28.04.2015) Aufgabe 1 Alle Reaktionsgleichgewichte stellen sich bei 1000 K ein, damit sind alle Komponenten stets gasförmig.
PCI Thermodynamik G. Jeschke FS 2015 Lösungsvorschlag zu Übung 11 (Version vom 28.04.2015) Aufgabe 1 Alle Reaktionsgleichgewichte stellen sich bei 1000 K ein, damit sind alle Komponenten stets gasförmig.
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
PC I Thermodynamik G. Jeschke FS Lösung zur Übung 12
 PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
8. Reines Ethanol besitzt eine Dichte von ρ = 0,79 g/cm³. Welches Volumen V Ethanol ist erforderlich, um eine Masse von m = 158g Ethanol zu erhalten?
 Staatliche Schule für technische Assistenten in der Medizin Klinikum der Johann Wolfgang Goethe-Universität Frankfurt am Main Testklausur Physik 1. 10 2 10 3 =... 2. 4 10 3 2 10 3=... 3. 10 4 m= cm 4.
Staatliche Schule für technische Assistenten in der Medizin Klinikum der Johann Wolfgang Goethe-Universität Frankfurt am Main Testklausur Physik 1. 10 2 10 3 =... 2. 4 10 3 2 10 3=... 3. 10 4 m= cm 4.
Taschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister
 aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
Siedediagramm binärer Gemische und Rektifikation
 Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Beispielaufgaben IChO 2. Runde 2019 Grundlagen der Thermodynamik, Lösungen. = -0,900 kj/k (21,84 22,15) K / 13,16 g = 0,279 kj / 13,16 g
 Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
BM Chemie Test 2 Schuljahr 17/18
 1. Vervollständigen Sie folgende Tabelle. () Chemische Formel Molare Masse [g/mol] Masse [g] Stoffmenge n [mol] C 6 12 O 6 180.155 10 0.055 CaCl 2. 2 2 O 17.01 18. 0.125 K 2 Cr 2 O 7 29.181 67.7 1.25 2.
1. Vervollständigen Sie folgende Tabelle. () Chemische Formel Molare Masse [g/mol] Masse [g] Stoffmenge n [mol] C 6 12 O 6 180.155 10 0.055 CaCl 2. 2 2 O 17.01 18. 0.125 K 2 Cr 2 O 7 29.181 67.7 1.25 2.
Tutorium Physik 2. Fluide
 1 Tutorium Physik 2. Fluide SS 16 2.Semester BSc. Oec. und BSc. CH 2 Themen 7. Fluide 8. Rotation 9. Schwingungen 10. Elektrizität 11. Optik 12. Radioaktivität 3 7. FLUIDE 7.1 Modellvorstellung Fluide:
1 Tutorium Physik 2. Fluide SS 16 2.Semester BSc. Oec. und BSc. CH 2 Themen 7. Fluide 8. Rotation 9. Schwingungen 10. Elektrizität 11. Optik 12. Radioaktivität 3 7. FLUIDE 7.1 Modellvorstellung Fluide:
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Materie ist die Gesamtheit aller Stoffe: Energie bei chemischen Reaktionen:
 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt eine Masse m (Einheit: kg) Dichte = Masse / Volumen
Aufgaben zur Wärmelehre
 Aufgaben zur Wärmelehre 1. Ein falsch kalibriertes Quecksilberthermometer zeigt -5 C eingetaucht im schmelzenden Eis und 103 C im kochenden Wasser. Welche ist die richtige Temperatur, wenn das Thermometer
Aufgaben zur Wärmelehre 1. Ein falsch kalibriertes Quecksilberthermometer zeigt -5 C eingetaucht im schmelzenden Eis und 103 C im kochenden Wasser. Welche ist die richtige Temperatur, wenn das Thermometer
IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N
 -IV A.1- IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N 1 Einleitung Während heterogene Stoffgemische sich häufig durch mechanische Trennverfahren in ihre homogenen Phasen
-IV A.1- IV T H E R M I S C H E V E R F A H R E N S T E C H N I K A G R U N D L A G E N 1 Einleitung Während heterogene Stoffgemische sich häufig durch mechanische Trennverfahren in ihre homogenen Phasen
Repetitorium Physikalische Chemie für Lehramt
 Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Physikalische Chemie II
 Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 1. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Versuch Beschreiben Sie die Vorgänge, die in der Nähe des kritischen Punktes zu beobachten sind.
 1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
Versuch 10. Rektifikation und Rektifizierkolonne
 Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Technische Thermodynamik
 Gernot Wilhelms Übungsaufgaben Technische Thermodynamik 6., überarbeitete und erweiterte Auflage 1.3 Thermische Zustandsgrößen 13 1 1.3.2 Druck Beispiel 1.2 In einer Druckkammer unter Wasser herrscht ein
Gernot Wilhelms Übungsaufgaben Technische Thermodynamik 6., überarbeitete und erweiterte Auflage 1.3 Thermische Zustandsgrößen 13 1 1.3.2 Druck Beispiel 1.2 In einer Druckkammer unter Wasser herrscht ein
Auswertung. B06: Wasserdampf
 Auswertung zum Versuch B06: Wasserdampf Jule Heier Partner: Alexander FufaeV Gruppe 254 Versuchsteil A: Dampfdruck von Wasser Messung T in C p in mbar 22,2 28 30,5 44 35,9 59 41 77 45,3 98 48,4 113 51,6
Auswertung zum Versuch B06: Wasserdampf Jule Heier Partner: Alexander FufaeV Gruppe 254 Versuchsteil A: Dampfdruck von Wasser Messung T in C p in mbar 22,2 28 30,5 44 35,9 59 41 77 45,3 98 48,4 113 51,6
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Versuch Nr. 7. = q + p dv
 Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung
 1 Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung 1. Theorie und Aufgabenstellung Theorie und Methode Lösungen bestehen aus einem Lösungsmittel und dem darin gelösten Stoff. Das Lösemittel
1 Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung 1. Theorie und Aufgabenstellung Theorie und Methode Lösungen bestehen aus einem Lösungsmittel und dem darin gelösten Stoff. Das Lösemittel
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Mögliche Punktzahl: 100 Gesamtnote aus Teil 1 und 2: Erreichte Punktzahl: Prozent:
 Fakultät für Bauingenieurwesen und Umweltwissenschaften Institut für Werkstoffe des Bauwesens Univ.-Prof. Dr.-Ing. K.-Ch. Thienel Bachelorprüfung Prüfungsfach: Geologie, Werkstoffe und Bauchemie Teil 1:
Fakultät für Bauingenieurwesen und Umweltwissenschaften Institut für Werkstoffe des Bauwesens Univ.-Prof. Dr.-Ing. K.-Ch. Thienel Bachelorprüfung Prüfungsfach: Geologie, Werkstoffe und Bauchemie Teil 1:
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
2.1 Bestimmung einiger Isothermen von Schwefelhexafluorid SF 6
 Atom- und Kernphysi-Versuch 31 AKP-31-1 Zustandsgrößen realer Gase 1 Vorbereitung Koexistenz von Flüssigeiten und Dampf, Dampfdruc, Verdampfungswärme, Koexistenz von Festörper und Flüssigeit, Koexistenz
Atom- und Kernphysi-Versuch 31 AKP-31-1 Zustandsgrößen realer Gase 1 Vorbereitung Koexistenz von Flüssigeiten und Dampf, Dampfdruc, Verdampfungswärme, Koexistenz von Festörper und Flüssigeit, Koexistenz
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Thermodynamik 1 Klausur 02. August 2010
 Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Chemie. für Ingenieure. Guido Kickelbick. 2., aktualisierte Auflage
 Chemie für Ingenieure 2., aktualisierte Auflage Guido Kickelbick 4 Aggregatzustände 4.5 Aggregatzustandsänderungen Die drei Aggregatzustände können, wie wir gesehen haben, ineinander überführt werden.
Chemie für Ingenieure 2., aktualisierte Auflage Guido Kickelbick 4 Aggregatzustände 4.5 Aggregatzustandsänderungen Die drei Aggregatzustände können, wie wir gesehen haben, ineinander überführt werden.
PC-Übung Nr.3 vom
 PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
Thermodynamik 2 Klausur 11. März 2011
 Thermodynamik 2 Klausur 11. März 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 4 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 2 Klausur 11. März 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 4 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Regeln. Lösung zum Fragenteil. Fragen mit Ankreuzmöglichkeit:
 Klausurlösungen T. Thermodynamik II Sommersemester 2018 Fragenteil Lösung zum Fragenteil Regeln Fragen mit Ankreuzmöglichkeit: Nur eine eindeutige Markierung wird bewertet, z. B.: Für eine Korrektur kann
Klausurlösungen T. Thermodynamik II Sommersemester 2018 Fragenteil Lösung zum Fragenteil Regeln Fragen mit Ankreuzmöglichkeit: Nur eine eindeutige Markierung wird bewertet, z. B.: Für eine Korrektur kann
Hydrostatik. Von Wasser und Luft und anderem 1. OG. Stiftsschule Engelberg, Schuljahr 2016/2017
 Hydrostatik Von Wasser und Luft und anderem 1. OG Stiftsschule Engelberg, Schuljahr 2016/2017 1 Die Dichte Ziele dieses Kapitels Du weisst, was die Dichte ist und wie man sie messen kann. Du kannst Berechnungen
Hydrostatik Von Wasser und Luft und anderem 1. OG Stiftsschule Engelberg, Schuljahr 2016/2017 1 Die Dichte Ziele dieses Kapitels Du weisst, was die Dichte ist und wie man sie messen kann. Du kannst Berechnungen
Azeotrope. Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch
 Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Azeotrope B A Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahl- reiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, a wenn die Wechselwirkungen
Phasenumwandlungsenthalpie
 Universität Potsdam Institut für Physik und Astronomie Grundpraktikum 7 Phasenumwandlungsenthalpie Die Enthalpieänderung beim Übergang eines Systems in einen anderen Aggregatzustand kann unter der Voraussetzung,
Universität Potsdam Institut für Physik und Astronomie Grundpraktikum 7 Phasenumwandlungsenthalpie Die Enthalpieänderung beim Übergang eines Systems in einen anderen Aggregatzustand kann unter der Voraussetzung,
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13. Klausur PC 1
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13 Klausur PC 1 Wintersemester 2009/10-20.10.2009 Hörsaal H2 15:15 bis 16:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift:
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) WS09/10 - Blatt 1 von 13 Klausur PC 1 Wintersemester 2009/10-20.10.2009 Hörsaal H2 15:15 bis 16:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift:
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Gefrierpunktserniedrigung
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Hydromechanik-Tutorium vom
 Hydromechanik-Tutorium vom 12.01. 2015 Aufgabe 1: Eine Wetterstation in Florida misst vor dem Sonnenuntergang einen Luftdruck von 1011 hpa, eine Temperatur von 30 C und eine relative Luftfeuchtigkeit von
Hydromechanik-Tutorium vom 12.01. 2015 Aufgabe 1: Eine Wetterstation in Florida misst vor dem Sonnenuntergang einen Luftdruck von 1011 hpa, eine Temperatur von 30 C und eine relative Luftfeuchtigkeit von
A Sie ist weniger als 1 kg/dm 3. B E F D A G C. Zusammengesetzte Grössen 15
 1. Richtig oder falsch? A Stoffe mit einer Dichte unter 1 kg/dm 3 schwimmen in Wasser. Richtig B Die Dichte von kleinen Körpern ist immer kleiner als die Dichte von grossen Körpern. Falsch C Schwere Körper
1. Richtig oder falsch? A Stoffe mit einer Dichte unter 1 kg/dm 3 schwimmen in Wasser. Richtig B Die Dichte von kleinen Körpern ist immer kleiner als die Dichte von grossen Körpern. Falsch C Schwere Körper
