// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
|
|
|
- Tomas Fertig
- vor 5 Jahren
- Abrufe
Transkript
1 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2009 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
2 // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen) Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Paul-Ehrlich-Straße Langen Redaktion PD Dr. Markus Funk, Pharmakovigilanz II, PEI Tel.: +49 (0)6103/ Dr. Corinna Volz-Zang, Pressestelle PEI Tel.: +49 (0)6103/ Lektorat und Layout Kirsten Külker, Heidelberg Der Hämovigilanzbericht erscheint einmal jährlich. Die PDF-Version kann auf der Homepage des Paul-Ehrlich-Instituts ( abgerufen oder unter abonniert werden. // Vorwort // Liebe Leserinnen und Leser, mit der vorliegenden Publikation startet das Paul-Ehrlich-Institut eine neue Veröffentlichungsreihe, um mehr Transparenz im Hinblick auf Meldungen und Maßnahmen zu Blutprodukten und ihrer Anwendung zu schaffen. In dem einmal jährlich erscheinenden Hämovigilanz-Bericht werden die Meldungen schwerwiegender Transfusionsreaktionen eines Jahres dokumentiert und den Meldungen aus den Vorjahren gegenübergestellt. Auf der Grundlage der gemeldeten Ereignisse und ihrer Bewertung hat das Paul-Ehrlich-Institut in den vergangenen Jahren gemeinsam mit den Blutspendeeinrichtungen eine Vielzahl von Maßnahmen zur Risikovorsorge getroffen und dadurch die Sicherheit von Blutkomponenten weiter erhöhen können. Der aktuelle Bericht zeigt erneut, dass heute Übertragungen von Viren wie HIV sowie Hepatitis-B- und -C-Viren durch Blutkomponenten extrem seltene Ereignisse sind. Auch die vom Paul-Ehrlich-Institut im Mai 2009 verfügte Maßnahme zur Senkung des Risikos einer transfusionsassoziierten akuten Lungeninsuffizienz (TRALI), einer zwar seltenen, aber lebensbedrohlichen Komplikation, war erfolgreich. Schon jetzt zeichnet sich ab, dass dies zur Senkung der Morbidität und Mortalität geführt hat. Mit der jährlichen Veröffentlichung des Hämovigilanz-Berichts möchte das Paul-Ehrlich-Institut den aktuellen Sicherheitsstandard dokumentieren und deutlich machen, dass durch gezielte Maßnahmen, die sich an neuen wissenschaftlichen Erkenntnissen orientieren, bestehende Risiken weiter reduziert werden können. ISSN (Print) ISSN (Internet) Prof. Dr. Klaus Cichutek Präsident des Paul-Ehrlich-Instituts Das Paul-Ehrlich-Institut ist eine Einrichtung im Geschäftsbereich des Bundesministeriums für Gesundheit. An dem Hämovigilanz-Bericht haben außerdem mitgearbeitet: Dr. Serife Günay 1, Dr. Annette Lohmann 1, Herr Jochen Halbauer 1, Frau Cornelia Witzenhausen 1, Herr Olaf Henseler 2, Dr. Margarethe Heiden 2 und Dr. Brigitte Keller-Stanislawski 1 1 Abteilung S: Sicherheit von Arzneimitteln und Medizinprodukten 2 Abteilung 7: Hämatologie/Transfusionsmedizin 2
3 // Inhaltsverzeichnis // 1. Einleitung 4 2. Abkürzungen 4 3. Methoden Einteilung der Transfusionsreaktionen Maßnahmen zur Verbesserung des Sicherheitsstandards 5 4. Ergebnisse Schwerwiegende Transfusionsreaktionen gemäß IHN-Kriterien Akute (allergische) Transfusionsreaktionen (ATR) Transfusionsassoziierte akute Lungeninsuffizienz (TRALI) Hämolytische Transfusionsreaktion (HTR) Transfusionsbedingte bakterielle Infektionen (TBBI) Transfusionsbedingte virale Infektionen (HBV, HCV, HIV) Transfusionsassoziierte Volumenüberladung (TACO) Hämolytische Reaktionen aufgrund von Fehltransfusionen Zusammenfassung/Schlussfolgerungen Literatur Abbildungen und Tabellen 17 Abbildung 1 Kumulative Anzahl der Transfusionsreaktionen ( ) 17 Abbildung 2 Vergleich der Transfusionsreaktionen ( ) 18 Abbildung 3 Transfusionsbedingte virale Infektionen (nach Votum 34) 18 Tabelle 1 Schwerwiegende Transfusionsreaktionen ( ) 19 Tabelle 2 Akute Transfusionsreaktionen (ATR), assoziierte Todesfälle 19 Tabelle 3 TRALI-Ereignisse, assoziierte Todesfälle und Meldehäufigkeiten 20 Tabelle 4 Hämolytische TR (HTR), assoziierte Todesfälle und Meldehäufigkeiten 20 Tabelle 5 Bakterielle Infektionen (TBBI), assoziierte Todesfälle und Meldehäufigkeiten 21 Tabelle 6 Ergebnisse der mikrobiologischen Untersuchungen 21 Tabelle 7 Virale Infektionen (HBV, HCV, HIV) und Meldehäufigkeiten 22 Tabelle 8 AB0-Inkompatibilität, assoziierte Todesfälle und Meldehäufigkeiten 22 Tabelle 9 Herstellung und errechneter Verbrauch von Blutkomponenten ( ) 23 3
4 // 1. Einleitung // Der Hämovigilanz-Bericht 2009 des Paul-Ehrlich-Institutes wurde auf der Grundlage des Hämovigilanz-Berichtes erstellt. Mit Hilfe der errechneten Meldehäufigkeit konnten die Daten über die bestätigten schwerwiegenden Transfusionsreaktionen verglichen und Transfusionsrisiken in Bezug zu risikominimierenden Maßnahmen gesetzt werden. Bezüglich der Meldehäufigkeit konnten somit langfristige Trends erkannt und der Nutzen umgesetzter Maßnahmen bewertet werden. Dies zeigt sich zum Beispiel bei der Entwicklung der Meldehäufigkeit für virale Transmissionen und TRALI-Reaktionen. Für den Zeitraum 2009 wurden die gemeldeten akuten (allergischen) Transfusionsreaktionen mit Hilfe eines etablierten Klassifizierungssystems in vier Schweregrade eingeteilt und gegen andere Transfusionsreaktionen abgegrenzt. Die zunehmende Zahl der Meldungen von allergischen Transfusionsreaktionen kann dadurch besser mit den Daten anderer Hämovigilanzsysteme verglichen werden [1, 2]. Im aktuellen Bericht werden zusätzlich erstmals die transfusionsassoziierte Volumenüberladung (TACO) und die AB0- Inkompatibilität im Rahmen des nicht bestimmungsgemäßen Gebrauchs erfasst. Dadurch soll ebenfalls ein Vergleich mit aktuellen Literaturdaten ermöglicht werden [3 6]. In Deutschland werden derzeit in erster Linie die produktspezifischen unerwünschten Reaktionen und Ereignisse dokumentiert, die bei der Spende, der Herstellung und der Anwendung von Blutprodukten im Rahmen des bestimmungsgemäßen Verbrauchs auftreten [7, 8]. Dadurch sollen schwerwiegende Transfusionsreaktionen beziehungsweise die Häufigkeit der Komplikationen erfasst und gegebenenfalls geeignete Maßnahmen zur Risikovorsorge beziehungsweise Risikoabwehr eingeleitet werden [9, 10]. In Zukunft werden die Spenderreaktionen, der nicht bestimmungemäße Gebrauch sowie die Zwischenfälle im Rahmen des Herstellung und Lagerung von Blutkomponenten stärkere Beachtung in den Gremien der Europäischen Kommission finden. Entsprechend der europäischen Richtlinie (2005/61/EG) und der nationalen Gesetzgebung [11] müssen in Zukunft die Daten zu schwerwiegenden Zwischenfällen (adverse events) und Spenderreaktionen genauer dokumentiert werden, um einen Vergleich mit den Daten anderer Mitgliedstaaten zu ermöglichen. Für den Zeitraum 2009 wurden diese Daten jedoch noch nicht berücksichtigt. Im Vordergrund steht derzeit die Auswertung der gemeldeten Transfusionsreaktionen bei den Empfängern. Transfusionsmediziner und transfundierende Ärzte sollen auf diese Weise über die Häufigkeit und den Schweregrad der gemeldeten Transfusionsreaktionen und den Nutzen von risikoreduzierenden Maßnahmen informiert werden. // 2. Abkürzungen // AML AK Blut AMG Anti-HBc ATR akute myeloische Leukämie Arbeitskreis Blut Arzneimittelgesetz Antikörper gegen Hepatitis B-core Antigen akute Transfusionsreaktionen IHN LDH NAT PEI STR International Haemovigilance Network Laktatdehydrogenase Nukleinsäure-Amplifikationstest-Technologie Paul-Ehrlich-Institut schwerwiegende Transfusionsreaktion BNP CML EK GFP HLA HNA HTR brain natriuretic peptide chronische myeloische Leukämie Erythrozytenkonzentrat gefrorenes Frischplasma Human Leucocyte Antigen Human Neutrophil Antigen hämolytische Transfusionsreaktion TACO TBBI TTVI TFG TK TRALI Transfusion-Associated Circulatory Overload/ transfusionsbedingte Volumenüberladung transfusionsbedingte bakterielle Infektion transfusionsbedingte virale Infektion Transfusionsgesetz Thrombozytenkonzentrat transfusionsassoziierte akute Lungeninsuffizienz 4
5 // 3. Methoden // Alle Meldungen einer schwerwiegenden Transfusionsreaktion, die das PEI aufgrund 16 Abs. 2 TFG bzw. 63c AMG erhält, werden in die Datenbank des PEI eingegeben. Der meldende Arzt dokumentiert mit den Meldeformularen empfängerspezifische Daten, wie verabreichte Blutkomponente, Geburtsdatum und Geschlecht des Patienten, Grunderkrankung, relevante Begleitererkrankungen und Verlauf der Transfusionsreaktion. Die involvierten Blutspendeeinrichtungen ergänzen die Angaben durch spezifische Daten zu den Spendern, durchgeführte Laboruntersuchungen und Rückverfolgungsverfahren. Gemeldete Reaktionen wurden als Transfusionsreaktionen gemäß den Kriterien des International Haemovigilance Network (IHN) eingestuft. Beinahe-Ereignisse und Fehltransfusionen konnten auf freiwilliger Basis gemeldet werden. Gemäß 16 Abs.1 des Transfusionsgesetzes muss eine AB0-Inkompatibilität aufgrund eines nicht bestimmungsgemäßen Gebrauchs (Fehltransfusion) dem Transfusionsbeauftragten der Klinik gemeldet werden. Maßnahmen zur Vermeidung von Fehltransfusionen sollen daher innerhalb der Klinik umgesetzt werden. 3.1 Einteilung der Transfusionsreaktionen Als Definitionen der schwerwiegenden Transfusionsreaktionen wurden weitgehend die Empfehlungen des IHN übernommen [12]. Die Einteilung und Bewertung der Transfusionsreaktionen erfolgte anhand der Kriterien in Kasten 1: Definition der schwerwiegenden Transfusionsreaktionen (nach IHN-Kriterien), siehe Seite 8. Für die Bewertung des Nutzens von sicherheitsrelevanten Maßnahmen wurde in erster Linie die Meldehäufigkeit schwerwiegender Transfusionsreaktionen ausgewertet. Die 2009 gemeldeten Fälle einer akuten (allergischen) Transfusionsreaktion wurden mit Hilfe der Klassifikation der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) [13] weiter unterteilt. Entsprechend dieser Einteilung wurde zwischen allergischen Transfusionsreaktionen Grad I und II und schwerwiegenden allergischen bzw. anaphylaktoiden Transfusionsreaktionen Grad III und IV unterschieden. Zur Sicherung der Verdachtsdiagnose TRALI wird ein standardisierter Fragebogen (siehe ww.pei.de Hämovigilanz Meldeformulare H2c) verwendet, um so die definierten TRALI-Kriterien, entsprechend den Vorgaben des IHN, erfassen zu können. Die transfusionsbedingte Volumenüberladung (TACO) wurde in diesem Bericht erstmalig für das Jahr 2009 dargestellt. Eine weiterführende Bewertung der Zahlen ist jedoch erst mit Vergleichszahlen aus einer zweiten Meldeperiode sinnvoll. Die Menge der von deutschen Blutspendeeinrichtungen hergestellten Blutkomponenten wie auch der Verfall bei Herstellern und Anwendern wird seit 1998 gemäß 21 TFG an das PEI gemeldet [14]. Der tatsächliche jährliche Verbrauch der einzelnen Blutkomponenten lässt sich näherungsweise berechnen und wird im Bericht des PEI über die Meldungen nach 21 TFG regelmäßig veröffentlicht (Tabelle 9). In den Tabellen 2 7 wurde die Meldehäufigkeit der Transfusionsreaktionen pro Blutkomponente jeweils für einen Zeitraum von vier Jahren ermittelt und insgesamt drei Vierjahreszeiträume wurden miteinander verglichen. 5
6 METHODEN Kasten 1: Definition der schwerwiegenden Transfusionsreaktionen (nach IHN-Kriterien) Akute Transfusionsreaktion (ATR): Hautausschlag, Juckreiz, Exanthem, allergische Atemnot, Angioödem, Larynxödem, Abfall des systolischen Blutdruckes >30 mm Hg, Anstieg der Herzfrequenz >30/min (Definition der Tachykardie), Bronchospasmus/Zyanose, Schock/Kreislaufstillstand, Auftreten der Symptome innerhalb von 24 Stunden nach Transfusion, Ausschluss anderer Ursachen. Transfusionsassoziierte akute Lungeninsuffizienz (TRALI): Akute Atemnot (Symptomatik innerhalb von sechs Stunden nach Transfusionsbeginn), Dyspnoe, Hypoxämie, neu aufgetretenes beidseitiges Lungenödem (radiologisch gesichert), Ausschluss einer Hypervolämie (kardial, renal, iatrogen). Transfusionsassoziierte Volumenüberladung (TACO): Akute Atemnot, Tachykardie, erhöhter Blutdruck, Zeichen eines kardiogenen Lungenödems in der Röntgen-Thorax-Aufnahme, positive Flüssigkeitsbilanzierung und /oder vorbestehende Beeinträchtigung der Herzfunktion, BNP-Erhöhung. Hämolytische Transfusionsreaktion (HTR): Fieber mit anderen Symptomen (Atemnot, Hypotension, Tachykardie, Schmerzen in der Nierengegend), Makrohämaturie, inadäquater Anstieg des Hämoglobinwertes nach Transfusion, Abfall des Hämoglobinwertes >2g/dl innerhalb von 24 Stunden, Anstieg des Laktatdehydrogenase- Wertes (LDH-Wert) >50% in 24 Stunden, Anstieg des Bilirubinwertes, Hämoglobinämie, Abfall des Haptoglobins in zeitlichem Zusammenhang mit der Transfusion. Die Reaktion wird bestätigt durch einen positiven Antiglobulintest bzw. eine positive Kreuzprobe. Die akute HTR manifestiert sich innerhalb von 24 Stunden, die verzögerte HTR in einem Zeitraum >24 Stunden bis 28 Tagen. Transfusionsbedingte bakterielle Infektion (TBBI): Auftreten von Fieber >39 C oder ein Anstieg um 2 C innerhalb von vier Stunden, begleitet von Schüttelfrost und Tachykardie. Der Verdacht der transfusionsbedingten bakteriellen Infektion wird erhärtet durch den Nachweis des Bakteriums im n Blutprodukt oder beim Empfänger und bestätigt durch den Nachweis desselben Bakterienstammes im Empfängerblut und der n Blutkomponente. Transfusionsbedingte virale Infektion (TTVI: HBV, HCV, HIV): Der Verdacht ist gegeben bei einer Serokonversion des Empfängers nach einer Transfusion. Zur Abklärung des Kausalzusammenhangs muss das vom Empfänger ausgehende Rückverfolgungsverfahren (entsprechend dem Votum 34/35 des AK Blut) durchgeführt werden. Nicht bestimmungsgemäßer Gebrauch: Ein Beispiel hierfür ist die Gabe von AB0-inkompatiblen Blutkomponenten (Fehltransfusion). 6
7 3.2 Maßnahmen zur Verbesserung des Sicherheitsstandards Zwischen 1997 und 2009 wurde die Umsetzung der folgenden Maßnahmen zur Verbesserung der Qualität und Sicherheit von Blutkomponenten durch das PEI vorgeschrieben bzw. durch den AK Blut empfohlen. Zeitpunkt der Bekanntgabe Vorgeschriebene bzw. empfohlene Maßnahmen Ab April 1999 Einführung des HCV-Screenings für Spender von Erythrozytenund Thrombozytenkonzentraten mit einer NAT-Pool-Testung (Nachweisgrenze der HCV-RNA-Konzentration von 5000 IU/ml, bezogen auf die Einzelspende). Ab Oktober 1999 HCV-Screening von GFP-Spendern mit einer NAT-Pool-Testung (Nachweisgrenze der HCV-RNA-Konzentration von 5000 IU/ml). Ab August 2000 Einführung der Leukozytendepletion bei der Herstellung von Erythrozyten- und Thrombozytenkonzentraten (Restleukozytengehalt von <1 pro Einheit). Ab Februar 2001 Ausschluss von Blutspendern, die in Ländern gelebt haben, in denen ein Anstieg der neuen Variante der Creutzfeldt-Jakob-Krankheit (vcjk) registriert wurde Ab Juni 2003 Einführung eines Pre-donation sampling bei der Herstellung von Thrombozytenkonzentraten zur Reduktion der mikrobiellen Kontamination (freiwillige Maßnahme der Blutspendeeinrichtungen entsprechend dem Votum 27 des AK Blut). Ab Mai 2004 Einführung des HIV-Spender-Screenings für zelluläre Blutkomponenten und gefrorenes Frischplasma mit einer NAT-Pool-Testung (Nachweisgrenze der HIV-RNA-Konzentration von IU/ml) Ab Oktober 2006 Einführung des Spender-Screenings für zelluläre Blutkomponenten und gefrorenes Frischplasma mit der Hepatitis-B-core- Antikörper-Einzeluntersuchung (anti-hbc-test). Seit Juni 2008 Festlegung der Haltbarkeitsfrist von Thrombozytenkonzentraten auf 4 x 24 Stunden plus dem Herstellungstag mit dem Ziel, lebensbedrohliche septische Transfusionsreaktionen durch bakterielle Kontamination zu reduzieren (Votum 38 des AK Blut) Ab September 2009 Einführung des Spender-Screenings zur Reduktion des TRALI-Risikos, weibliche Spender können nur dann für die Herstellung von Plasma zugelassen werden, wenn diese eine negative Schwangerschaftsanamnese aufweisen bzw. wenn das Testergebnis auf leukozytäre Antikörper negativ ist. Die Bestimmung der leukozytären Antikörper erfolgt entsprechend den in der Literatur beschriebenen Verfahren [15, 16]. 7
8 // 4. Ergebnisse // 4.1 Schwerwiegende Transfusionsreaktionen gemäß IHN-Kriterien ( ) Im Jahr 2009 wurden dem PEI insgesamt 492 Transfusionsreaktionen gemeldet (siehe Tabelle 1, S. 19). Für den Zeitraum ergibt sich somit eine Gesamtzahl von gemeldeten Verdachtsfällen. Die Anzahl der Meldungen variierte während dieses Zeitraums zwischen 298 und 525 Fällen pro Jahr (Mittelwert: 412 Fälle). Die Mehrzahl der Meldungen im Jahr 2009 bezog sich auf akute Transfusionsreaktionen (54%), auf TALI- Reaktionen (15%) und mögliche transfusionsbedingte virale Infektionen (15%). 303 aller gemeldeten Reaktionen (61%) entsprachen den IHN-Kriterien. 113 (23%) wurden als schwerwiegende Transfusionsreaktionen eingestuft und in diesem Bericht dargestellt. Insgesamt konnten 61 schwerwiegende allergische Transfusionsreaktionen, 20 Fälle von transfusionsbedingter Volumenüberladung, 13 TRALI-Reaktionen, acht transfusionsbedingte bakterielle Infektionen, sieben hämolytische Reaktionen und acht Fehltransfusionen (siehe Tabelle 8, S. 22) bestätigt werden gab es keinen bestätigten Fall einer HBV-, HCV- oder HIV-Übertragung sowie keinen Fall einer Posttransfusionellen Purpura oder einer transfusionsassoziierten GvHD. Bei der Zusammenfassung aller schwerwiegenden Transfusionsreaktionen für den Zeitraum 1997 bis 2009 (siehe Tabelle 1, S. 19, Abbildung 1, S. 17) entfällt der Großteil der schwerwiegenden Transfusionsreaktionen ebenfalls auf allergische Transfusionsreaktionen (317), gefolgt von TRALI-Reaktionen (197), hämolytischen Reaktionen (139), transfusionsbedingten bakteriellen Infektionen (79) und AB0-Inkompatibilität (58). Die transfusionsbedingte virale Infektion lag mit insgesamt 47 Übertragungsfällen im unteren Bereich der Häufigkeitsskala. Während es in den letzten Jahren zu einer Zunahme der schwerwiegenden allergischen Transfusionsreaktionen kam, nahm die Zahl der TRALI-Reaktionen ab. Die Zahl der hämolytischen Reaktionen und transfusionsbedingten bakteriellen Infektionen blieb konstant (siehe Abbildung 2, S. 19) wurden fünf tödliche Verläufe einer Transfusionsreaktion dokumentiert, jeweils ein Todesfall nach TRALI-Reaktion, nach bakterieller Infektion und Volumenüberlastung sowie zwei Fälle nach einer schwerwiegenden allergischen Transfusionsreaktion. Im Zeitraum von 13 Jahren ( ) konnten 66 transfusionsbedingte Todesfälle bestätigt werden. Als häufigste Todesursache wurden TRALI-Reaktionen (20 Fälle) und schwerwiegende allergische Reaktionen (17 Fälle) dokumentiert, gefolgt von transfusionsbedingten bakteriellen Infektionen (zehn Fälle) und hämolytischen Transfusionsreaktionen (neun Fälle). Zudem wurden sechs Todesfälle nach AB0-Inkompatibilität, zwei nach transfusionsbedingten viralen Infektionen und je ein Todesfall nach einer GvHD und nach TACO gemeldet. 4.2 Akute (allergische) Transfusionsreaktionen (ATR) IHN-Kriterien für weniger schwerwiegende Verläufe: Hautreaktionen, Blutdruckabfall >30 mm Hg, leichte Dyspnoe. IHN-Kriterien für schwerwiegende Verläufe: Blutdruckabfall >30 mm Hg, ausgeprägte Dyspnoe, Schock- Symptomatik, Einsatz intensivmedizinischer Maßnahmen. Zur besseren Unterscheidung wurden die 2009 gemeldeten Fälle weiter unterteilt in allergische Transfusionsreaktionen Grad I und II und schwerwiegende allergische/anaphylaktoide Transfusionsreaktionen Grad III und IV. Als Grundlage dienen die AWMF-Leitlinien [13] (Einteilung entsprechend der schwersten aufgetretenen Symptomatik). 8
9 Kasten 3 : Klassifizierung allergischer Transfusionsreaktionen nach AWMF Grad Haut Abdomen Respirationstrakt Herz-Kreislauf I II Juckreiz Flush Urtikaria Angioödem Nausea Krämpfe Rhinorrhö Heiserkeit Dyspnoe Arrythmie Tachykardie (Anstieg >20/min) Hypotonie (Abfall >20mm Hg sys.) Larynxödem III Erbrechen Defäkation Bronchospasmus Zyanose Schock Kreislaufstillstand IV Atemstillstand Fallbeschreibungen schwerer allergischer Reaktionen mit tödlichem Ausgang aus dem Jahr 2009 Respiratorische Insuffizienz: Eine 51-jährige Patientin mit Leberzirrhose reagierte unmittelbar nach der Gabe von zwei TK mit Fieber, Unwohlsein, Erbrechen, Tachykardie, Dyspnoe, Tachypnoe und Übelkeit. Nach vorübergehender Stabilisierung verstarb die Patientin am nächsten Tag in respiratorischer Insuffizienz. Immunhämatologische Untersuchung: keine Hinweise auf eine durch Leukozytenantikörper ausgelöste TRALI-Reaktion. Bakteriologische Untersuchungsergebnisse und Infektionsparameter waren unauffällig. Darstellung der Fälle akuter Transfusionsreaktionen (siehe auch Tabelle 2, Seite 19) Zeitraum Anzahl der Meldungen IHN-Kriterien erfüllt Anzahl der weniger schweren Verläufe 787 Grad-I-Fälle Grad-II-Fälle Anzahl der schweren ART 256 Grad-III- und -IV-Fälle schwere ATR nach EK-Gabe 156 Grad-I- und -II-Fälle nach EK-Gabe Grad-III- und -IV-Fälle nach EK-Gabe schwere ART nach TK-Gabe 38 Grad-I- und -II-Fälle nach TK-Gabe Grad-III- und -IV-Fälle nach TK-Gabe schwere ART nach GFP-Gabe 29 Grad-I- und -II-Fälle nach GFP-Gabe Grad-III- und -IV-Fälle nach GFP-Gabe schwere ART nach Kombination 33 Grad-I- und -II-Fälle nach Kombination Grad-III- und -IV-Fälle nach Kombination tödliche Verläufe nach ATR Meldehäufigkeit nach EK-Gabe Einheiten Meldehäufigkeit nach TK-Gabe Einheiten Maßnahmen zur ART-Reduktion 6,2 6,17 13,2 31,6 bisher keine spezifischen Maßnahmen 9
10 ERGEBNISSE Fallbeschreibung einer schweren allergischen (anaphylaktoiden) Transfusionsreaktion: Ein 73-jähriger Patient mit Blasentamponade bei Blasentumor erlitt während der Transfusion von zwei EKs einen anaphylaktischen Schock mit erfolgloser Reanimation. Eine Ursache für ein immunologisches, bakterielles oder serologisches Geschehen wurde nicht gefunden. 4.3 Transfusionsassoziierte akute Lungeninsuffizienz (TRALI) IHN-Kriterien: Akute Atemnot (Symptomatik innerhalb von sechs Stunden nach Transfusionsbeginn), Dyspnoe, neu aufgetretenes beidseitiges Lungenödem (radiologisch gesichert), Ausschluss einer Hypervolämie (kardial, renal, iatrogen). Fallbeschreibung transfusionsassoziierter akuter Lungeninsuffizienz (TRALI) mit tödlichem Ausgang aus dem Jahr 2009 Eine 66-jährige weibliche Patientin mit Rectum-CA erhielt aufgrund einer postoperativen Nachblutung einer Ileostomaanlage bei Thrombopenie zwei Apherese-TK und reagierte eine Stunde nach Transfusionsbeginn mit Dyspnoe, Blutdruckabfall, Lungenödem und Leukozytenabfall. Im Röntgen-Thorax waren Darstellung der TRALI-Fälle (siehe auch Tabelle 3, S. 20, und Literatur [17]) Zeitraum 1997 bis bis 2009 Anzahl der Meldungen IHN-Kriterien erfüllt Anzahl der nicht immunogenen TRALI-Fälle keine/unvollständige Untersuchung auf leukozytäre Antikörper (Ak) Anzahl der immunogenen TRALI-Fälle Anzahl der Fälle mit Ak-positiven GFP-Spendern Anzahl der Fälle mit Ak-positiven EK-Spendern Anzahl der Fälle mit Ak-positiven TK-Spendern Anzahl der Fälle mit Ak-positiven weiblichen Spendern Anzahl der Fälle mit Ak-positiven männlichen Spendern tödliche Verläufe nach nicht immunogenem TRALI tödliche Verläufe nach immunogenem TRALI TRALI-assoziierte Todesfälle nach GFP-Gabe TRALI-assoziierte Todesfälle nach EK-Gabe TRALI-assoziierte Todesfälle nach TK-Gabe Meldehäufigkeit nach GFP-Gabe Einheiten 11,18 4,56 Ein positiver Effekt der Maßnahme zur TRALI-Reduktion (09/2009) ist erkennbar 10
11 bilaterale Infiltrate nachweisbar, die zuvor nicht vorhanden waren. Andere Risikofaktoren für ein Lungenödem waren nicht vorhanden, eine kardiale Ursache wurde über eine transösophageale Echokardiografie (TEE) mehrfach ausgeschlossen. Aufgrund eines massiven serösen Exsudats und einer zunehmenden respiratorischen Insuffizenz wurde die Patientin intubationspflichtig. Am Folgetag verstarb die Patientin. Im Obduktionsbericht wurde ein massives Lungenödem als alleinige Todesursache bestätigt. Die immunhämatologische Untersuchung ergab einen HNA-3a-Antikörper bei einer Spenderin mit positiver Schwangerschaftsanamnese. Das korrespondierende Antigen konnte bei der Empfängerin nachgewiesen werden. 4.4 Hämolytische Transfusionsreaktion (HTR) IHN-Kriterien: Fieber mit anderen Symptomen (Atemnot, Hypotension, Tachykardie, Schmerzen in der Nierengegend), Makrohämaturie, Abfall des Hämoglobinwertes >2g/dl innerhalb von 24 Stunden, Anstieg des LDH >50% in 24 Stunden, Anstieg des Bilirubinwertes, positiver Antiglobulintest, positive Kreuzprobe. Darstellung der Fälle hämolytischer Transfusionsreaktionen (siehe auch Tabelle 4, S. 20) Zeitraum Anzahl der Meldungen IHN-Kriterien erfüllt akute HTR verzögerte HTR verzögerte HTR, irreguläre erythrozytäre Ak HTR nach EK-Gabe HTR nach TK-Gabe HTR nach kombinierter Gabe tödliche Verläufe nach HTR HTR-assoziierte Todesfälle nach EK-Gabe HTR-Meldehäufigkeit nach EK-Gabe ( Einheiten) 2,41 1,32 Fallbeschreibungen einer hämolytischen Transfusionsreaktion Eine 72-jährige Patientin erhielt aufgrund einer gastrointestinalen Blutung im Rahmen einer Peritonitis zwei Erythrozyten-Konzentrate. Innerhalb von 24 Stunden entwickelten sich Juckreiz, Fieber, Dyspnoe, Blutdruckabfall und schließlich eine beatmungspflichtige respiratorische Insuffizienz. Die immunhämatologische Untersuchung ergab einen positiven Coombstest und den Nachweis eines erythrozytären Antikörpers anti- Yt(a), sodass die Diagnose einer hämolytischen Transfusionsreaktion bestätigt werden konnte. 4.5 Transfusionsbedingte bakterielle Infektionen (TBBI) IHN-Kriterien: Fieber >39 C oder ein Anstieg um 2 C innerhalb von vier Stunden, Schüttelfrost, Tachykardie, Nachweis des gleichen Bakterienstammes im Empfängerblut und der n Blutkomponente. 11
12 ERGEBNISSE Darstellung der Fälle transfusionsbedingter bakterieller Infektionen (siehe auch Tabellen 5 und 6, S. 21) Zeitraum Anzahl der Meldungen IHN-Kriterien erfüllt TBBI nach TK-Gabe TBBI nach EK-Gabe TBBI nach GFP-Gabe tödliche Verläufe nach TBBI TBBI-assoziierte Todesfälle nach TK-Gabe 5 1 6* TBBI-assoziierte Todesfälle nach EK-Gabe Fälle mit Empfängern mit relevanter Immunsuppression** TBBI-Meldehäufigkeit nach TK-Gabe ( Einheiten) 9,57 4,51 * Alle sechs Thrombozytenkonzentrate hatten zum Zeitpunkt der Transfusion das Ende der Haltbarkeitsdauer erreicht (vierter bzw. fünfter Tag nach Herstellung). ** Tödliche Verläufe traten bei Patienten mit einer malignen Grunderkrankung (CML, AML, aplastische Anämie etc.) auf. Fallbeschreibungen aus dem Jahr 2009 Nach der Gabe von zwei EKs und zwei TKs reagierte eine 69-jährige Polycythaemia-vera-Patientin mit Schüttelfrost, Temperaturanstieg, Tachykardie, Hämoglobinurie und Ikterus. In der Blutuntersuchung wurden ein LDH-Anstieg, ein Haptoglobinabfall sowie Zeichen einer Gerinnungsstörung festgestellt. Nach Verlegung auf die Intensivstation kam es zu einer raschen Progredienz mit Schockgeschehen und Exitus. Nach achtstündiger Bebrütung konnte Streptokokkus agalactiae nachgewiesen werden. Der gleiche Erreger war auch in Resten des Buffy Coats und bei der Patientin nachweisbar, die sich zum Zeitpunkt der Transfusion vermutlich in einer Blastenkrise befand. Das gepoolte TK wurde am vierten Tag nach der Herstellung verabreicht. 4.6 Transfusionsbedingte virale Infektionen (HBV, HCV, HIV) Die Kriterien entsprechend dem Votum 34 des AK Blut. Nach der Einführung des NAT-Spender-Screenings für alle Blutkomponenten wurden ein Fall einer HCVsowie ein Fall einer HIV-Übertragung registriert (Tabelle 7, S. 22, Abbildung 3, S. 18). In beiden Fällen erfolgte die Übertragung durch EK-Spender, die im Rahmen der NAT-Untersuchung des gepoolten Plasmas negativ getestet wurden [18]. Demgegenüber lag die Häufigkeit von HBV-Transmissionen zwischen 1997 und 2006 im Mittel bei zwei Fällen pro Jahr. Nach der Einführung des Spender-Screenings mit der Anti-HBc-Einzeltestung wurden 2007 und 2008 jeweils ein Fall und im Jahr 2009 kein Fall einer transfusionsbedingten HBV-Infektion bestätigt. 12
13 Darstellung der Fälle transfusionsbedingter viraler Infektionen (siehe auch Tabelle 7, S. 22, und Abbildung 3, S. 18) Zeitraum Anzahl der Meldungen gesamt Anzahl der Meldungen zu HBV Anzahl der Meldungen zu HCV Anzahl der Meldungen zu HIV Gesamtzahl der Fälle mit wahrscheinlicher bzw. gesicherter viraler Transmission (Votum 34 D) HBV 22 0 HCV 20 0 HIV 5 0 Transmission nach EK-Gabe 29 0 Transmission nach TK-Gabe 6 0 Transmission nach GFP-Gabe 12 0 tödliche Verläufe nach HBV-Transmission 2 0 Meldehäufigkeit nach EK-Gabe ( Einheiten) 0, Transfusionsassoziierte Volumenüberladung (TACO) IHN-Kriterien: Akute Atemnot, Tachykardie, erhöhter Blutdruck, charakteristische Zeichen eines kardiogenen Lungenödems in der Röntgen-Thorax-Aufnahme, positive Flüssigkeitsbilanz und/oder bekannte Beeinträchtigung der Herzfunktion innerhalb von zwölf Stunden nach Transfusionsende, Nachweis einer BNP-Erhöhung. Zeitraum 2009 gesamt 21 bestätigt 20 EK 11 TK 1 GFP 1 Kombination 7 tödliche Verläufe 1 Darstellung der Fälle mit transfusionsassoziierter Volumenüberladung 13
14 ERGEBNISSE Fallbeschreibung transfusionsassoziierter Volumenüberladung (TACO) mit tödlichem Ausgang aus dem Jahr 2009 Ein 52-jähriger Patient mit einem Prostata-CA, bei Zustand nach Blasenruptur, erhielt aufgrund der Blutungsneigung und Thrombozytopenie ein EK und zwei TKs. Zwei Stunden nach dem Transfusionsende entwickelte sich eine ausgeprägte Dyspnoe und ein zunehmendes Lungenödem. Nach Beatmung und Gabe von Diuretika bei eingeschränkter Nierenfunktion waren respiratorische Symptomatik und Lungenödem rückläufig. Die immunhämatologischen und bakteriologischen Untersuchungen waren unauffällig. EKG und Herzechokardiografie ergaben keine kardiale Verschlechterung. Entsprechend dem klinischen Verlauf und den erhobenen (Labor-)Befunden wurde die Ausschlussdiagnose TACO gestellt. 4.8 Hämolytische Reaktionen auf Grund von Fehltransfusionen (siehe auch Tabelle 8, S. 22) Im Jahr 2009 wurden dem PEI neun Fälle von Fehltransfusionen gemeldet, die zu hämolytischen Transfusionsreaktionen führten. Da für einen nicht bestimmungsgemäßen Gebrauch keine Meldeverpflichtung an das PEI besteht, sind die Fälle nur sehr eingeschränkt dokumentiert. Die eigentlichen Transfusionsreaktionen verliefen demnach ohne schwere Folgeschäden. In zwei Fällen sind die Patienten allerdings auf Grund ihrer Grunderkrankungen (in einem Fall septischer Schock bei akuter Leukämie, im zweiten Fall ein Patient mit Rippenfrakturen und unstillbaren Blutungen bei Marcumarisierung wegen künstlicher Herzklappe) verstorben. 14
15 // 5. Zusammenfassung/Schlussfolgerungen // Bezogen auf alle Meldungen Aufgrund der Hämovigilanzdaten lässt sich nur die Meldehäufigkeit, nicht die Inzidenz von schwerwiegenden Transfusionsreaktionen ermitteln. Die Meldehäufigkeit wird beeinflusst durch die Sensibilisierung für spezifische Transfusionskomplikationen und die gesetzliche Meldeverpflichtung. Bezogen auf den Zeitraum 2009 Die häufigsten Komplikation nach TK-Gabe waren: 31,6 ATR- und 6,77 TRALI-Ereignisse Einheiten Die häufigsten Komplikation nach EK-Gabe waren: 6,2 ATR- und 1,3 HTR-Ereignisse Einheiten Die häufigsten Komplikationen nach GFP-Gabe waren: 13,7 ATR-Ereignisse Einheiten Bezogen auf den Zeitraum Die am häufigsten gemeldeten Verdachtsdiagnosen waren: TTVI > ATR > TRALI > HTR > TBBI Die am häufigsten transfusionsbedingten Todesfälle waren: TRALI, ATR > TBBI und HTR Bezogen auf die akuten Transfusionsreaktionen Es findet sich eine deutliche Zunahme der ATR nach TK- und EK-Gabe, die auch von anderen Hämovigilanz-Systemen beobachtet wird [1, 2]. Die Gründe sind nicht bekannt, vermutet wird eine verbesserte Meldecompliance und generell eine erhöhte Allergieneigung. Bezogen auf die transfusionsassoziierte akute Lungeninsuffizienz Mit der Umsetzung der Maßnahmen zur Reduktion des immunogenen TRALI spätestens zum September 2009 kam es zu einem Rückgang der gemeldeten TRALI-Reaktionen wie auch der assoziierten Todesfälle. Der überwiegende Anteil der antikörpervermittelten TRALI-Reaktionen erfolgt nach der Gabe von therapeutischem Frischplasma. Dieses Plasma stammte fast ausschließlich von Spenderinnen mit positiver Schwangerschaftsanamnese. Der Nutzen des Ausschlusses von Spenderinnen mit Schwangerschaftsanamnese, die nicht negativ auf leukozytäre Antikörper getestet wurden [19] kann noch nicht endgültig beurteilt werden, mit der Auswertung der Meldungen aus dem Jahr 2010 kann der Effekt besser dargestellt werden. Der Todesfall nach TK-Gabe war der Anlass für das Stufenplanverfahren Stufe I Wissenschaftlicher Informationsaustausch zum Risiko einer transfusionsassoziierten akuten Lungeninsuffizienz (TRALI) als Nebenwirkung von Blutzubereitungen (12/2010). 15
16 ZUSAMMENFASSUNG/ SCHLUSSFOLGERUNGEN Bezogen auf die hämolytischen Transfusionsreaktionen Die an das PEI gemeldeten Reaktionen waren zum Großteil akute hämolytische Transfusionsreaktionen (<24 Stunden nach Transfusion). Es muss angenommen werden, dass ein Teil der verzögerten HTR nicht an das PEI gemeldet wurde. Die Meldehäufigkeit ist in den letzten Jahren konstant geblieben, eine risikoreduzierende Maßnahme ist zurzeit nicht umsetzbar [20]. Bezogen auf die transfusionsbedingten bakteriellen Infektionen Die Meldehäufigkeit von bakteriellen Infektionen nach TK-Gabe blieb während des Zeitraums von zwölf Jahren ( ) konstant bei ca. zehn Fällen pro 10 6 Einheiten. Tödliche Verläufe wurden in den meisten Fällen durch Erreger mit hoher Humanpathogenität ausgelöst. Tödliche Verläufe nach TK-Gabe ereigneten sich in fast allen Fällen mit Konzentraten, die zum Zeitpunkt der Transfusion das Ende der Haltbarkeit erreicht hatten. Das Votum 38 des AK Blut empfiehlt daher seit 2008 eine Beschränkung der Haltbarkeit von TKs auf 4 x 24 Stunden plus Herstellungstag. Nach der Beschränkung der Haltbarkeit liegt die Melderate von bakteriellen Infektionen nach TK-Gabe für das Jahr 2009 bei 4,5 Fällen pro 10 6 Einheiten. Praktisch anwendbare Screening-Tests, die eine bakterielle Kontamination mit hoher Sensitivität und zeitnah zur Abgabe nachweisen können, werden zurzeit erprobt. Der Nutzen der Pathogeninaktivierung muss im Rahmen von vergleichenden Studien weiter untersucht werden. Bezogen auf die transfusionsbedingten viralen Infektionen Mit der Einführung des serologischen Einzelspender-Screenings bis zum Ende der 90er Jahre konnte die virale Transmission weitgehend verhindert werden. Mit der NAT-Pool-Testung (1999 und 2003) konnte die HIV- und HCV-Transmission fast vollständig verhindert werden. Eine vollständige Erfassung aller infizierten Spender kann aufgrund der diagnostischen Fensterphase und der Variabilität des HI-Virus nicht erreicht werden. Mit dem HBsAg-Einzelspender-Screening konnte die Melderate für eine HBV-Übertragung auf ein bis drei Fälle pro Jahr reduziert werden. Mit der Einführung der Anti-HBc-Einzeltestung (2006) konnten Spender mit einer persistierenden HBV-Infektion erfasst werden, bei denen das HBsAG nicht nachweisbar ist waren keine Übertragungen von HBV, HCV und HIV nachweisbar. Mit der Einführung der HCV-NAT-Pool-Testung wurden im Zeitraum 1999 bis 2009 ca. 40 Millionen Spenden untersucht, 92 mit positivem NAT- und negativem ELISA-Testergebnis. Mit der Einführung des HIV-NAT-Pool-Testung wurden im Zeitraum 2004 bis 2007 ca. 17 Millionen Spenden untersucht, elf mit positivem NAT- und negativem ELISA-Testergebnis [18]. 16
17 // 6. Literatur // 1. SHOT reports Annual Hemovigilance Reports. dic.ch/haemo.asp 3. Li G, Rachmale S, Kojicic M, Shahjehan K, Malinchoc M, Kor DJ, Gajic O: Incidence and transfusion risk factors for transfusion-associated circulatory overload among medical intensive care unit patients. Transfusion. 2011;51(2): Ozier Y, Renaudier P, Caldani C, Aguilon P, Canivet N: Post-transfusion pulmonary oedema: the French hemovigilance network classification method. Transfus Clin Biol. 2010;17(5-6): Pagliaro P, Turdo R, Capuzzo E: Patients positive identification systems. Blood Transf. 2009;7 (4): Tondon R, Pandey P, Mickey KB, Chaudhary R: Errors reported in cross match laboratory: a prospective data analysis. Transfus Apher Sci. 2010;43(3): Graul A, Heiden M, Gräf K, Keller-Stanislawski B: Hämovigilanz in Deutschland Berichte an das Paul-Ehrlich-Insitut über Verdachtsfälle von Transfusionsreaktionen im Beobachtungszeitraum 1995 bis Transfus Med Hemother. 2003;30: Graul A, Keller-Stanislawski B: Hämovigilanz von Blutkomponenten. Meldung an das Paul-Ehrlich-Institut vom bis zum Bundesgesundheitsbl. Gesundheitsforsch Gesundheitsschutz. 1999;42: Keller-Stanislawski B, Lohmann A, Günay S, Heiden M, Funk MB: The German Haemovigilance System reports of serious adverse transfusion reactions between 1997 and Transfusion Medicine. 2009;19(6): Funk MB, Günay S, Lohmann A, Henseler O, Keller-Stanislawski B: Bewertung der Maßnahmen zur Reduktion schwerwiegender Transfusionsreaktionen (Hämovigilanzdaten von 1997 bis 2008). Bundesgesundheitsblatt. 2010;53(4): Arzneimittel-Gesetz AMG in der Neufassung 2006; BGBl. I S. 3367, International Haemovigilance Network (IHN): Definition of adverse transfusion events. www. ihn-org.net Gesetz zur Regelung des Transfusionswesens TFG 1998; BGBI. I S ISBT Working Party on Granulocyte Immunobiology, Bierling P, Bux J, Curtis B, Flesch B, Fung L, Lucas G, Macek M, Muniz-Diaz E, Porcelijn L, Reil A, Sachs U, Schuller R, Tsuno N, Uhrynowska M, Urbaniak S, Valentin N, Wikman A, Zupanska B: Recommendations of the ISBT Working Party on Granulocyte Immunobiology for leucocyte antibody screening in the investigation and prevention of antibody-mediated transfusion-related acute lung injury. Vox Sanguinis. 2009;96: Bux J: Transfusion-related acute lung injury (TRA- LI): a serious adverse event of blood transfusion. Vox Sanguinis. 2005;89(1): Keller-Stanislawski B, Reil A, Günay S, Funk MB: Frequency and severity of transfusion related acute lung injury (TRALI) German haemovigilance data ( ). Vox Sanguinis. 2010;98(1): Nübling CM, Heiden M, Chudy M, Kress J, Seitz R, Keller-Stanislawski B, Funk MB: Experience of mandatory NAT screening across all blood organisations in Germany: NAT yield versus breakthrough transmissions. Transfusion. 2009;49: Bundesanzeiger Nr. 84 vom , S TJ2009Nr00084x // 7. Abbildungen und Tabellen // PTP 10 (1,2 %) TA-GVHD (0,2 %) TACO 20 (2,3 %) sonstige (0,2 %) TTVI 47 (5,4 %) AB0-Inkompatibilität 58 (6,7 %) ATR 317 (36,4 %) TBBI 79 (9,1 %) HTR 139 (16 %) Abbildung 1: Kumulative Anzahl der Transfusionsreaktionen (entsprechend den IHN- Kriterien) für den Zeitraum TRALI 197 (22,6 %) 17
18 ABBILDUNGEN UND TABELLEN Anzahl bestätigter Transfusionsaktionen ATR TRALI HTR TBBI AB0-Ink. TTVI TACO Art der Transfusionsaktionen Abbildung 2: Vergleich der bestätigten Transfusionsreaktionen (entsprechend den IHN-Kriterien) für den Zeitraum HCV HBV HIV HCV-NAT-Testung HIV-NAT-Testung Anti-HBc-Testung Abbildung 3: Transfusionsbedingte virale Infektionen (entsprechend dem Votum 34) nach Gabe von Blutkomponenten für den Zeitraum und dem Zeitpunkt der Einführung eines erweiterten Spender-Screenings 18
19 Tabelle 1: Gemeldete Transfusionsreaktionen, schwerwiegende Transfusionsreaktionen (STR) nach IHN-Kriterien sowie transfusionsbedingte Todesfälle ( ) bis 2009 schwerwiegende Transfusionsreaktionen (STR) akute (allergische) Transfusionsreaktion (ATR) transfusionsass. akute Lungeninsuffizienz (TRALI) hämolytische Transfusionsreaktion (HTR) transfusionsbedingte bakterielle Infektion (TBBI) gemeldete STR Verdachtsfälle STR nach IHN- Kriterien Gesamtzahl (Anteil) STR mit tödlichem Verlauf Gesamtzahl (Anteil) (33,8%) 61 (54%) 317 (36%) 15 2* (24,3%) 13 (11%) 197 (23%) (17,4%) 7 (6%) 139 (16%) (10,1%) 2 (2%) 79 (9%) AB0-Inkompatibilität (6,6%) 8 (7%) 58 (7%) transfusionsbedingte virale Infektion (TTVI) Posttransfusionelle Purpura (PTP) transfusionsassoziierte GVHD (TA-GVHD) (6,2%) 0 47 (5%) (1,3%) 0 10 (1%) (0,3%) TACO (18%) 20 (2%) sonstige (25) gesamt (8,1%)** 5 (4%)** 66 (8%)** * Es handelt sich bei diesen Fällen um Patienten mit schweren Grunderkrankungen. Ein Zusammenhang zwischen der Transfusionsreaktion und dem tödlichen Verlauf ist wahrscheinlich. ** bezogen auf 758, auf 113 bzw. auf 871 (jeweils 100%) bestätigte schwerwiegende Transfusionsreaktionen Tabelle 2: Schwerwiegende akute (allergische) Transfusionsreaktionen (ATR Grad III und IV), assoziierte Todesfälle und Meldehäufigkeiten bezogen auf die n Blutkomponenten * schwere allergische Reaktionen nach Gabe von EK TK GFP gesamt tödliche Verläufe nach Gabe von EK TK GFP Kombination Kombination gesamt ** 20 Meldehäufigkeit schwerer allergischer Reaktionen für den Zeitraum ATR ATR ATR transfund. ATR EK 15,837 (13) 0,82 16,340 (35) 2,14 17,417 (108) 6,20 4,535 (28) 6,17 TK 1,294 (4) 3,09 1,311 (12) 9,15 1,671 (22) 13,17 0,443 (14) 31,6 GFP 6,346 (3) 0,47 4,781 (12) 2,51 4,474 (13) 2,91 1,096 (15) 13,69 Die hellblau unterlegte Spalte markiert die Einführung der Einteilung der akuten Transfusionsreaktionen in allergische und anaphylaktische Transfusionsreaktionen. * Einführung der Leukozytendepletion ** Es handelt sich bei diesen Fällen um Patienten mit schweren Grunderkrankungen. Ein Zusammenhang der Transfusionsreaktion zum tödlichen Verlauf ist nicht auszuschließen. *** errechneter Verbrauch 19
20 ABBILDUNGEN UND TABELLEN Tabelle 3: Meldehäufigkeiten der immunogenen und nicht immunogenen TRALI-Ereignisse und assoziierten Todesfälle und bezogen auf die n Blutkomponenten TRALI-Ereignisse nach IHN-Kriterien, Spenderuntersuchung auf HLA-/HNA-Antikörper negativ positiv nicht durchgeführt gesamt TRALI-Ereignisse, Untersuchung auf HLA-/HNA-Antikörper positiv bei EK-Spendern TK-Spendern GFP-Spendern gesamt TRALI-Ereignisse mit tödlichen Verläufen, Untersuchung auf HLA-/HNA-Antikörper positiv bei EK-Spendern TK-Spendern GFP-Spendern gesamt Meldehäufigkeit immunogener TRALI-Ereignisse für transfund TRALI TRALI TRALI transfund. TRALI EK 15,837 (6) 0,38 16,340 (5) 0,31 17,417 (8) 0,46 4,535 (4) 0,88 TK 1,294 (1) 0,77 1,311 (3) 2,28 1,671 (3) 1,80 0,443 (3) 6,77 GFP 6,346 (9) 1,42 4,781 (25) 5,23 4,474 (50) 11,8 1,096 (5) 4,56 Die erste hellblau unterlegte Spalte markiert die Einführung der Leukozytendepletion (2000). Die zweite hellblau unterlegte Spalte markiert den Beginn der intensivierten Überwachung durch das PEI. Die dritte hellblau unterlegte Spalte markiert die Einführung des TRALI-Stufenplans für Plasmen (09/2009). * errechneter Verbrauch 20 Tabelle 4: Hämolytische Transfusionsreaktionen (HTR), assoziierte Todesfälle und Meldehäufigkeiten bezogen auf die n Blutkomponenten hämolytische Transfusionsreaktionen nach Gabe von EK TK Kombination gesamt akute und verzögerte hämolytische Transfusionsreaktionen und HTR mit Nachweis von AK akute HTR verzögerte HTR irreg. Erythr.-Ak gesamt hämolytische Transfusionsreaktionen mit tödlichen Verläufen nach Gabe von EK Kombination gesamt Meldehäufigkeit hämolytischer Transfusionsreaktionen für transfund HTR HTR HTR transfund. HTR EK 15,837 (42) 2,65 16,340 (25) 1,53 17,417 (42) 2,41 4,535 (6) 1,32 TK 1,294 (0) 0,00 1,311 (4) 3,05 1,671 (3) 1,80 0,443 (0) 0,00 * errechneter Verbrauch
21 Tabelle 5: Transfusionsbedingte bakterielle Infektionen (TBBI), assoziierte Todesfälle und Meldehäufigkeiten bezogen auf die n Blutkomponenten * bakterielle Infektionen nach Gabe von EK TK GFP gesamt bakterielle Infektionen mit tödlichen Verläufen nach Gabe von EK TK GFP gesamt Meldehäufigkeit transfusionsbedingter bakterieller Infektionen für TTBI TTBI TTBI transfund. TTBI EK 1,294 (10) 0,63 16,340 (11) 0,67 17,417 (13) 0,75 4,535 (0) 0,00 TK 6,346 (12) 9,27 1,311 (14) 10,68 1,671 (16) 9,57 0,443 (2) 4,51 GFP 15,837 (4) 0,63 4,781 (0) 0,00 4,474 (1) 0,22 1,096 (0) 0,00 Die hellblau unterlegte Spalte links markiert die Einführung des Pre-donation sampling (2002). Die beiden hellblau unterlegten Kästchen rechts markieren die AK-Blut-Empfehlung für eine auf vier Tage verkürzte TK-Haltbarkeit (2008). * errechneter Verbrauch Tabelle 6: Ergebnisse der mikrobiologischen Untersuchungen bei bestätigten Fällen von transfusionsbedingten bakteriellen Infektionen ( ) Mikroorganismus Anzahl der Blutkomponenten Erregernachweis bei Empfänger/ Blutprodukt Krankheitsverlauf der Empfänger Todesfälle nach Gabe von Gattung/Spezies EK TK FFP total nicht tödlich tödlich EK TK Erreger mit niedriger (Human-)Pathogenität Staphylococcus capitis, epidermidis, hominis, saprophyticus und spp. Micrococcus luteus, Corynebacterium spp. Propionibacterium acnes Erreger mit mittlerer/hoher Pathogenität Staphylococcus aureus Streptococcus pyogenes und agalactiae Bacillus cereus, Escherichia coli Enterobacter erogenes, amnigenus Klebsiella oxytoca, pneumonia Pantoea agglomerans, Serratia marcescens, Yersinia enterocolitica, Enterococcus spp. Acinetobacter Iwoffii, Pseudomonas aeruginosa Stenotrophomonas maltophilia gesamt * * Transfusion der Thrombozytenkonzentrate am vierten bzw. fünften Tag nach Herstellung 21
22 // ABBILDUNGEN UND TABELLEN // Tabelle 7: Transfusionsbedingte virale Infektionen (HBV, HIV, HCV) und Meldehäufigkeiten bezogen auf die n Blutkomponenten * HCV-Infektionen nach Gabe von EK TK GFP gesamt HIV-Infektionen nach Gabe von EK TK GFP gesamt HBV-Infektionen nach Gabe von EK TK GFP gesamt Meldehäufigkeit transfusionsbedingter viraler Infektionen für TTVI TTVI TTVI transfund. TTVI EK 15,837 (16) 1,01 16,340 (5) 0,31 17,417 (8) 0,46 4,535 (0) 0,00 TK 1,294 (4) 3,10 1,311 (2) 1,53 1,671 0,00 0,443 (0) 0,00 GFP 6,346 (9) 1,42 4,781 (3) 0,63 4,474 0,00 1,096 (0) 0,00 Die erste hellblau unterlegte Spalte markiert die Einführung der HCV-NAT-Pool-Testung. Die zweite hellblau unterlegte Spalte markiert die Einführung der HIV- NAT-Pool-Testung. Die dritte hellblau unterlegte Spalte markiert die Einführung der Anti-HBc-Einzeltestung. * errechneter Verbrauch Tabelle 8: Gemeldete AB0-Inkompatibilität aufgrund eines nicht bestimmungsgemäßen Verbrauchs und Meldehäufigkeiten bezogen auf die n Blutkomponenten AB0-Inkompatibilität * EK AB0-Inkompatibilität mit tödlichem Verlauf EK Meldehäufigkeit AB0-Inkompatibilität für den Zeitraum AB0-Ink. AB0-Ink. AB0-Ink. transfund. AB0-Ink. EK 15,837 (18) 1,14 16,340 (10) 0,61 17,417 (22) 1,26 4,535 (8) 1,76 * errechneter Verbrauch 22
23 Tabelle 9: Herstellung und errechneter Verbrauch von Blutkomponenten von 1999 bis 2009 Meldung an das PEI nach TFG 21 EK TK GFP EK, TK, GFP Jahr Herstellung Einheiten Verbrauch* Einheiten Herstellung Einheiten Verbrauch* Einheiten Herstellung Einheiten Verbrauch* Einheiten Verbrauch* Einheiten ,28 3,99 0,41 0,32 1,81 1,74 6, ,26 3,93 0,42 0,33 1,53 1,43 5, ,32 4,03 0,39 0,32 1,45 1,38 5, ,45 4,12 0,38 0,33 1,28 1,23 5, ,24 3,93 0,37 0,30 1,11 1,05 5, ,54 4,26 0,41 0,36 1,18 1,11 5, ,56 4,29 0,43 0,38 1,09 1,03 5, ,52 4,29 0,45 0,41 1,10 1,05 5, ,57 4,35 0,48 0,43 1,27 1,22 6, ,71 4,49 0,51 0,45 1,23 1,17 6, ,74 4,54 0,52 0,44 1,14 1,10 6,08 * Berechnung erfolgte aufgrund der Angaben zum Verfall beim Hersteller und Anwender 23
Mit dem Meldebogen (1b) sollen solche Ereignisse erfasst werden, bei denen eines oder mehrere der folgenden Kriterien erfüllt sind:
 Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2013/14 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS //
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2010 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2010 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Originalien und Übersichten. Wesentliche Voraussetzungen für ein funktionierendes Hämovigilanzsystem sind die genaue Dokumentation der unerwünschten
 Originalien und Übersichten Bundesgesundheitsbl 2010 53:347 356 DOI 10.1007/s00103-010-1037-8 Online publiziert: 7. März 2010 Springer-Verlag 2010 M.B. Funk S. Günay A. Lohmann O. Henseler B. Keller-Stanislawski
Originalien und Übersichten Bundesgesundheitsbl 2010 53:347 356 DOI 10.1007/s00103-010-1037-8 Online publiziert: 7. März 2010 Springer-Verlag 2010 M.B. Funk S. Günay A. Lohmann O. Henseler B. Keller-Stanislawski
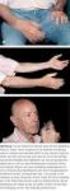
Akute hämolytische TR. Schmerzen in der Nierengegend Hypotonie Übelkeit, Erbrechen RR-Abfall Blutiger Urin (auch bei Schock) Nierenversagen Schock
 Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
// HÄMOVIGILANZBERICHT DES PAUL-EHRLICH-INSTITUTS // 2016/2017
 // HÄMOVIGILANZBERICHT DES PAUL-EHRLICH-INSTITUTS // 2016/2017 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut
// HÄMOVIGILANZBERICHT DES PAUL-EHRLICH-INSTITUTS // 2016/2017 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut
Übersicht TRALI heute
 Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
Übersicht TRALI heute Transfusion-related Acute Lung Injury 3. Haemovigilance Tagung Bern, 26.08.2010 Stefano Fontana Blutspendedienst Bern Was ist TRALI? TRALI IST EINE KLINISCHE DIAGNOSE! Akute Atemnot
hier: Abwehr von Arzneimittelrisiken Testung auf Antikörper gegen Hepatitis-B-Core-Antigen (anti-hbc) im Blutspendewesen
 Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen
 Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Therapie mit Thrombozytenkonzentraten
 Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Therapie mit Thrombozytenkonzentraten Priv. Doz. Dr. med. Michael Müller-Steinhardt Institut für Transfusionsmedizin und Immunologie DRK Blutspendedienst Baden-Württemberg - Hessen Medizinische Fakultät
Time-to-onset bei Transfusionsreaktionen
 Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Klassierung und Abklärung von Transfusionsreaktionen
 Haemovigilance Workshop, 19. Mai 2014 Klassierung und Abklärung von Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Haemovigilance Workshop, 19. Mai 2014 Klassierung und Abklärung von Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Ergänzende Empfehlungen zur Testung von Blut- und Plasmaspenden und zum Rückverfolgungsverfahren
 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN
 STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
Haemovigilance. Swisstransfusion, Fribourg M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic
 Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Applikation. gegeben von / bis. Anlage 1
 BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
Gesetzliche Grundlagen und Meldepflicht
 Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Hämovigilanzbericht Institut Inspektionen, Medizinprodukte & Hämovigilanz. pharmmed
 Hämovigilanzbericht 8 Bundesamt für Sicherheit im Gesundheitswesen /AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz pharmmed Inhaltsverzeichnis Hämovigilanz 3 Formulare der Hämovigilanz
Hämovigilanzbericht 8 Bundesamt für Sicherheit im Gesundheitswesen /AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz pharmmed Inhaltsverzeichnis Hämovigilanz 3 Formulare der Hämovigilanz
AW-Merkblatt Klassierung und Abklärung von Transfusionsreaktionen
 Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller
 Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion
 Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe 2 Testung auf Antikörper gegen Hepatitis B-Core-Antigen (anti-hbc) im Blutspendewesen
 An alle pharmazeutischen Einrichtungen, die Blut oder Blutkomponente gewinnen oder herstellen S1-23 600 06103 / 77-1023 06103 / 77-1263 30.03.2006 Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe
An alle pharmazeutischen Einrichtungen, die Blut oder Blutkomponente gewinnen oder herstellen S1-23 600 06103 / 77-1023 06103 / 77-1263 30.03.2006 Abwehr von Arzneimittelrisiken Stufenplanverfahren Stufe
Rückblick und aktuelle Daten Haemovigilance
 Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer
 Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung
 www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
Transfusionszwischenfälle
 Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Querschnittsbereich 4 Immunologie / Infektiologie Transfusionszwischenfälle Univ.-Prof. Dr. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin Universität und Universitätsklinikum
Einführung Risiko- minimierender Maßnahmen zur Prävention einer Hepatitis E Virus- Übertragung durch nicht pathogen-inaktivierte Blutkomponenten
 Paul-Ehrlich-Institut Postfach 63207 Langen Prof. Dr. med. Markus Funk Fachgebietsleiter Pharmakovigilanz II An alle Inhaber einer Zulassung von zellulären Blutzubereitungen und therapeutischem Frischplasma
Paul-Ehrlich-Institut Postfach 63207 Langen Prof. Dr. med. Markus Funk Fachgebietsleiter Pharmakovigilanz II An alle Inhaber einer Zulassung von zellulären Blutzubereitungen und therapeutischem Frischplasma
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern
 Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Epidemiologie - Aktuelle Daten zu Infektionen bei Blut- und Plasmaspendern XV. Fortbildungsveranstaltung der ARGE Plasmapherese e.v., 20.-21.11.2015, Berlin Dr. Ruth Offergeld, Robert Koch-Institut, Berlin
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse
 Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
Infektiöse und nicht-infektiöse Transfusionskomplikationen
 Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin
 UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
Immunhämatologische Resultate in der Hausarztpraxis
 Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
Immunhämatologische Resultate in der Hausarztpraxis Interpretation, Konsequenzen Dr. med. T. Braschler, OAmbF Hämatologie 08.03.2018 Inhalt Der Immunhämatologische Befund Type and Screen Untersuchung Bedeutung
Laborhandbuch Hämovigilanz
 Laborhandbuch Hämovigilanz Allgemein Seit dem 1.1.2002 besteht die Meldepflicht für unerwünschte Reaktionen bei der Transfusion von labilen Blutprodukten (Hämovigilanz). Meldepflichtig sind nicht nur schwerwiegende,
Laborhandbuch Hämovigilanz Allgemein Seit dem 1.1.2002 besteht die Meldepflicht für unerwünschte Reaktionen bei der Transfusion von labilen Blutprodukten (Hämovigilanz). Meldepflichtig sind nicht nur schwerwiegende,
Die Transfusion von Blutpräparaten
 Die Transfusion von Blutpräparaten Ein Leitfaden für die Kitteltasche DRK-Blutspendedienst Baden-Württemberg - Hessen gemeinnützige GmbH Institut für Transfusionsmedizin und Immunhämatologie Sandhofstraße
Die Transfusion von Blutpräparaten Ein Leitfaden für die Kitteltasche DRK-Blutspendedienst Baden-Württemberg - Hessen gemeinnützige GmbH Institut für Transfusionsmedizin und Immunhämatologie Sandhofstraße
Daten Haemovigilance
 Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Erfahrungen mit dem Anti-HBc-Stufenplan 2006
 Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
TSS versus TRALI. Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden
 TSS versus TRALI Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden Hans Pargger, Operative Intensivbehandlung Universitätsspital Basel 2014 TSS T S S Toxic Shock Syndrome TRALI T
TSS versus TRALI Anästhesiologie, Universitätsspital Basel Herbstsymposium Der rote Faden Hans Pargger, Operative Intensivbehandlung Universitätsspital Basel 2014 TSS T S S Toxic Shock Syndrome TRALI T
Stufenplanverfahren (Bescheide) des Paul-Ehrlich-Instituts zu Zika-Virus, West-Nil-Virus, Chikungunya-Virus und Prionen; Plasmodien.
 Paul-Ehrlich-Institut Postfach 63207 Langen Der Präsident An alle pharmazeutischen Unternehmer von Blutkomponenten, Stammzellen und gefrorenem Frischplasma Ansprechpartner/in: Prof. Dr. M. Funk Telefon:
Paul-Ehrlich-Institut Postfach 63207 Langen Der Präsident An alle pharmazeutischen Unternehmer von Blutkomponenten, Stammzellen und gefrorenem Frischplasma Ansprechpartner/in: Prof. Dr. M. Funk Telefon:
Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit
 Querschnittsbereich 4 (QB4) Vorlesungsteil Transfusionsmedizin und Immunhämatologie Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit Prof. Dr. med. Christian Seidl Prof.
Querschnittsbereich 4 (QB4) Vorlesungsteil Transfusionsmedizin und Immunhämatologie Vorlesung 3 Hämotherapie: Indikation und Strategie: Anämie und kritischer Hämatokrit Prof. Dr. med. Christian Seidl Prof.
Risiken der Transfusion von Blut und Blutprodukten
 Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen
 Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen Dietrich G., Biscoping J. PD Dr. Gerald Dietrich Chefarzt der Anästhesie-Abteilung Kreiskrankenhaus Simonsöder Allee 20 84307
Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen Dietrich G., Biscoping J. PD Dr. Gerald Dietrich Chefarzt der Anästhesie-Abteilung Kreiskrankenhaus Simonsöder Allee 20 84307
Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut
 www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
Transfusionsmedizin. Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich
 Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
CMV in Plasma. Dr. Marijke Weber-Schehl
 CMV in Plasma Dr. Marijke Weber-Schehl Inhalt Nachweis von HCMV in Plasma Ergebnisse Spenderscreening CMV und Plasmaprodukte Weber-Schehl 2 Weber-Schehl 3 Strategie Vermeidung von CMV-Infektionen durch
CMV in Plasma Dr. Marijke Weber-Schehl Inhalt Nachweis von HCMV in Plasma Ergebnisse Spenderscreening CMV und Plasmaprodukte Weber-Schehl 2 Weber-Schehl 3 Strategie Vermeidung von CMV-Infektionen durch
Spenderauswahl, Testung, Pathogeninaktivierung was hat sich bewährt?
 www.pei.de Spenderauswahl, Testung, Pathogeninaktivierung was hat sich bewährt? KOLT 2015 M. Heiden Paul-Ehrlich-Institut Drei Säulen der Blutsicherheit 1. Spenderauswahl a. Spenderschutzkriterien b. Empfängerschutzkriterien
www.pei.de Spenderauswahl, Testung, Pathogeninaktivierung was hat sich bewährt? KOLT 2015 M. Heiden Paul-Ehrlich-Institut Drei Säulen der Blutsicherheit 1. Spenderauswahl a. Spenderschutzkriterien b. Empfängerschutzkriterien
Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version-
 Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version- Symposium für Praxis- und Pflegekräfte, Hannover-Meeting, 22.Januar 2011 Dr. J. Martens
Transfusionen bei (Krebs)patienten Ein kurzer Überblick über Regelwerke, Durchführung und Risiken -Internet Version- Symposium für Praxis- und Pflegekräfte, Hannover-Meeting, 22.Januar 2011 Dr. J. Martens
DDT Notfälle Transfusionszwischenfall 16.10.2009. Dr. J. Martens Institut für Transfusionsmedizin
 DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
DDT Notfälle Transfusionszwischenfall 16.10.2009 Dr. J. Martens Institut für Transfusionsmedizin Welcher Notfall? Notfalltransfusion Notfall durch Transfusion Notfalltransfusion Zwei Patientengruppen:
Der akute Notfall in der Arbeitsmedizin
 Der akute Notfall in der Arbeitsmedizin Silke Kretzschmar Fachärztin für Arbeitsmedizin Gera 1 Notfälle in der Prävention? 2 Akute Notfälle in der arbeitsmedizinischen Praxis Kollaps/ Kreislaufstillstand
Der akute Notfall in der Arbeitsmedizin Silke Kretzschmar Fachärztin für Arbeitsmedizin Gera 1 Notfälle in der Prävention? 2 Akute Notfälle in der arbeitsmedizinischen Praxis Kollaps/ Kreislaufstillstand
Erythrozytentransfusion, kritische Indikationsstellung
 Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
Zwischenbericht zur ESPED Studie. Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern
 Zwischenbericht zur ESPED Studie Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern Einleitung: Bei Routineabstrichen werden gelegentlich multiresistente bakterielle Infektionserreger
Zwischenbericht zur ESPED Studie Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern Einleitung: Bei Routineabstrichen werden gelegentlich multiresistente bakterielle Infektionserreger
Bakterielle Kontamination in humanen Stammzell-Präparaten Einfluss von Stammzellquellen und Hygienevorgaben. W. Schwarz Paul-Ehrlich-Institut Langen
 Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel www.pei.de Bakterielle Kontamination in humanen Stammzell-Präparaten Einfluss von W. Schwarz Paul-Ehrlich-Institut Langen Methoden bzw. Matrix-Validierung
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel www.pei.de Bakterielle Kontamination in humanen Stammzell-Präparaten Einfluss von W. Schwarz Paul-Ehrlich-Institut Langen Methoden bzw. Matrix-Validierung
Organisation der klinischen und ambulanten Hämotherapie in Deutschland
 Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009
 Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009 Prim. i.r. Univ.-Prof. Dr. Barbara Blauhut Hersteller Statistik:
Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009 Prim. i.r. Univ.-Prof. Dr. Barbara Blauhut Hersteller Statistik:
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums
 Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Transfusionsmedizin Grundlagen und praktisches Vorgehen
 Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004
 PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
TRALI - Was lange währt, wird endlich gut Eine Erfolgsgeschichte in der Transfusionsmedizin
 TRALI - Was lange währt, wird endlich gut Eine Erfolgsgeschichte in der Transfusionsmedizin 19 Aus Berichten des britischen Hämovigilanzsystems SHOT (Serious Hazards of Transfusion), die gemeldete Transfusionsreaktionen
TRALI - Was lange währt, wird endlich gut Eine Erfolgsgeschichte in der Transfusionsmedizin 19 Aus Berichten des britischen Hämovigilanzsystems SHOT (Serious Hazards of Transfusion), die gemeldete Transfusionsreaktionen
DRK-Blutspendedienst West Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren?
 Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Verbringen hämatopoetischer Stammzellen nach Deutschland
 Verbringen hämatopoetischer Stammzellen nach Deutschland START - PEI 2016 Markus Wiesneth IKT Ulm IKT Ulm Universitätsklinikum Ulm Verbringen hämatopoetischer Stammzellen Regulatorische Anforderungen sind
Verbringen hämatopoetischer Stammzellen nach Deutschland START - PEI 2016 Markus Wiesneth IKT Ulm IKT Ulm Universitätsklinikum Ulm Verbringen hämatopoetischer Stammzellen Regulatorische Anforderungen sind
Blutgruppenkompatibilitäten im AB0-System
 Blutgruppenkompatibilitäten im AB0-System Patient EK GFP Pool-TK* A A oder 0 B B oder 0 AB AB, (A, B, 0) 0 0 A, AB B, AB AB 0, A, B, AB A, (AB, 0**, B**) B, (AB, 0**, A**) AB, (A**, B**, 0**) 0, (A, B,
Blutgruppenkompatibilitäten im AB0-System Patient EK GFP Pool-TK* A A oder 0 B B oder 0 AB AB, (A, B, 0) 0 0 A, AB B, AB AB 0, A, B, AB A, (AB, 0**, B**) B, (AB, 0**, A**) AB, (A**, B**, 0**) 0, (A, B,
Qualitätsbericht Hämotherapie. Dokumentationsbogen (Berichtsjahr 2018)
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Rückblick oder Prognosen welche Daten benötigen wir
 Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
Rückblick oder Prognosen welche Daten benötigen wir www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276
Haemovigilance Jahresbericht 2008
 Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung
 www.pei.de Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung V 35 Anhang B1 Hepatitis B Virus (HBV) Untersuchungs-Schema zum Rückverfolgungsverfahren HBsAg Anti-HBc 1
www.pei.de Vorschläge zur Änderung der Anhänge B1 und B2 des AK Blut Votums zur Rückverfolgung V 35 Anhang B1 Hepatitis B Virus (HBV) Untersuchungs-Schema zum Rückverfolgungsverfahren HBsAg Anti-HBc 1
Ambulant erworbene Pneumonie (Modul PNEU)
 Externe Qualitätssicherung in der stationären Versorgung Ambulant erworbene Pneumonie (Modul PNEU) Jahresauswertung 2014 BASISAUSWERTUNG 0 Geschäftsstelle Qualitätssicherung Hessen Hessen gesamt Frankfurter
Externe Qualitätssicherung in der stationären Versorgung Ambulant erworbene Pneumonie (Modul PNEU) Jahresauswertung 2014 BASISAUSWERTUNG 0 Geschäftsstelle Qualitätssicherung Hessen Hessen gesamt Frankfurter
Bewertung des kausalen Zusammenhangs eines Verdachts einer HIV-Übertragung beim Empfänger durch Blut und Blutkomponenten
 Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV
 PD Dr. med. Thomas Zeiler, Dr. med. Angelika Reil Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV Erfahrungen, Ergebnisse und Informationen
PD Dr. med. Thomas Zeiler, Dr. med. Angelika Reil Patientenbezogenes Rückverfolgungsverfahren bei Verdacht auf transfusionsbedingte Übertragung von HIV, HCV oder HBV Erfahrungen, Ergebnisse und Informationen
Bakterienscreening von Thrombozytenkonzentraten: alte und neue Strategien
 3. Sektionssitzung "Sicherheit von Blutprodukten" Bad Oeynhausen, 21./22.03.2013 Bakterienscreening von Thrombozytenkonzentraten: alte und neue Strategien PD Dr. J. Dreier Institut für Laboratoriums und
3. Sektionssitzung "Sicherheit von Blutprodukten" Bad Oeynhausen, 21./22.03.2013 Bakterienscreening von Thrombozytenkonzentraten: alte und neue Strategien PD Dr. J. Dreier Institut für Laboratoriums und
Erythrozytensubstitution M.Neuss Quelle: UptoDate 14.1 (4.2006)
 Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung
 Impfstoff-Egoismus mit Folgen Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung Gießen (20. Januar 2011) - Ein internationales Forscherteam, darunter die Virusforscher Ulrike Wend und Wolfram
Impfstoff-Egoismus mit Folgen Neue Studie über unerwartete Auswirkung der Hepatitis-B-Impfung Gießen (20. Januar 2011) - Ein internationales Forscherteam, darunter die Virusforscher Ulrike Wend und Wolfram
Qualitätsbericht Hämotherapie 2 0 Berichtsjahr
 Berichtshr Qualitätsbericht gemäß der aktuellen Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie-Richtlinie) Kapitel 7 Anhang. Für alle medizinischen
Berichtshr Qualitätsbericht gemäß der aktuellen Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie-Richtlinie) Kapitel 7 Anhang. Für alle medizinischen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
15 Jahre Transfusionsgesetz eine Erfolgsgeschichte
 Recht 49 Deutsches Transfusionsgesetz 15 Jahre Transfusionsgesetz eine Erfolgsgeschichte Das deutsche Transfusionsgesetz (TFG) von 1998 [1] geht auf die weltweite Medizinkatastrophe der Übertragung des
Recht 49 Deutsches Transfusionsgesetz 15 Jahre Transfusionsgesetz eine Erfolgsgeschichte Das deutsche Transfusionsgesetz (TFG) von 1998 [1] geht auf die weltweite Medizinkatastrophe der Übertragung des
Screening zur Prävention von transfusionsübertragenen viralen Infektionen
 Screening zur Prävention von transfusionsübertragenen viralen Infektionen Christoph Niederhauser CNI/2010 Hämovigilanztagung Bern 2010 1 Topics Sicherheit von Blutprodukten bezüglich Infektionserregern
Screening zur Prävention von transfusionsübertragenen viralen Infektionen Christoph Niederhauser CNI/2010 Hämovigilanztagung Bern 2010 1 Topics Sicherheit von Blutprodukten bezüglich Infektionserregern
Massentransfusion (MT)
 Massentransfusion (MT) Fallbeispiel aus dem Jahr 1994, 15-jähriger Patient, Blutgruppe 0-neg. Mathies Andreas 2 Mathies Andreas 3 Diagnosen Ruptur des linken Leberlappens, Verschluss beider Nierenarterien,
Massentransfusion (MT) Fallbeispiel aus dem Jahr 1994, 15-jähriger Patient, Blutgruppe 0-neg. Mathies Andreas 2 Mathies Andreas 3 Diagnosen Ruptur des linken Leberlappens, Verschluss beider Nierenarterien,
Sepsis/Endokarditis im Alter. Bad Honnef Symposium der PEG April 2011
 Sepsis/Endokarditis im Alter Bad Honnef Symposium der PEG April 2011 Sepsis/Endokarditis im Alter Sind sie häufiger im Alter als es dem Anteil der Bevölkerung entspricht? Welche Risikofaktoren gibt es
Sepsis/Endokarditis im Alter Bad Honnef Symposium der PEG April 2011 Sepsis/Endokarditis im Alter Sind sie häufiger im Alter als es dem Anteil der Bevölkerung entspricht? Welche Risikofaktoren gibt es
L 256/32 Amtsblatt der Europäischen Union
 L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
Impfstoffsicherheit in Deutschland
 Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Durchflusszytometrische Detektion antigranulozytärer Antikörper
 Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
Durchflusszytometrische Detektion antigranulozytärer Antikörper Matthias Heinzl Univ.-Klinik für Blutgruppenserologie und Transfusionsmedizin der Medizinischen Universität Wien Ao.Univ.-Prof. Dr. Günther
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit
 Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 66. Sitzung des Arbeitskreises Blut am 09. Juni 2008 wurde folgende Ergänzung zum Votum 38 (V 38) verabschiedet: Reduktion
Mitteilung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 66. Sitzung des Arbeitskreises Blut am 09. Juni 2008 wurde folgende Ergänzung zum Votum 38 (V 38) verabschiedet: Reduktion
Evaluierung der derzeit angeordneten Spendertestungen auf virale Marker
 www.pei.de Evaluierung der derzeit angeordneten Spendertestungen auf virale Marker 4. Sitzung der DGTI Sektion Sicherheit von Blutprodukten 27.-28.03.2014 Lübeck - Travemünde Michael Chudy Molekulare Virologie
www.pei.de Evaluierung der derzeit angeordneten Spendertestungen auf virale Marker 4. Sitzung der DGTI Sektion Sicherheit von Blutprodukten 27.-28.03.2014 Lübeck - Travemünde Michael Chudy Molekulare Virologie
Hämovigilanz- Bericht 2002/2003
 16 NEWS Aufgaben und Ziele der Hämovigilanz Sammlung von Informationen über unerwünschte Folgen oder Ausbleiben der erwarteten Wirkung im Zusammenhang mit der Verabreichung von Blutkomponenten oder deren
16 NEWS Aufgaben und Ziele der Hämovigilanz Sammlung von Informationen über unerwünschte Folgen oder Ausbleiben der erwarteten Wirkung im Zusammenhang mit der Verabreichung von Blutkomponenten oder deren
Diagnostische Verfahren
 6. Diagnostische s Jede Registrierung oder Auswertung einer Information mit dem Ziel der Erkennung einer Erung oder eines speziellen Zustandes wird diagnostischer genannt. Beispiele Reaktion auf Ansprechen
6. Diagnostische s Jede Registrierung oder Auswertung einer Information mit dem Ziel der Erkennung einer Erung oder eines speziellen Zustandes wird diagnostischer genannt. Beispiele Reaktion auf Ansprechen
Transfusion von Thrombozyten- Konzentraten
 Transfusion von Thrombozyten- Konzentraten Prof. Dr. med. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin SPIG 2012, LeiLi BÄK TK-Transfusion Herstellung von TK aus Apherese-
Transfusion von Thrombozyten- Konzentraten Prof. Dr. med. Hermann Eichler Institut für Klinische Hämostaseologie und Transfusionsmedizin SPIG 2012, LeiLi BÄK TK-Transfusion Herstellung von TK aus Apherese-
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18
 VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
VIRUSEPIDEMIOLOGISCHE INFORMATION NR. 02/18 Für den Inhalt verantwortlich: Prof. Dr. J. Aberle, Prof. Dr. St. Aberle, Prof. Dr. H. Holzmann, Prof. Dr. Th. Popow-Kraupp, Prof. Dr. E. Puchhammer Redaktion:
5. Diskussion 81. Auskultationsbefund Ultraschallbefund Screning-EKG-Befund PC-EKG-Befund
 5. Diskussion 81 5.4. Ergebnisse 5.4.1. Ergebnisse der Gruppe A Die in der Gruppe A durchgeführte Studie hatte zum Ziel, durch eine verlängerte EKG- Überwachung von vier bis sechs Stunden bereits festgestellte
5. Diskussion 81 5.4. Ergebnisse 5.4.1. Ergebnisse der Gruppe A Die in der Gruppe A durchgeführte Studie hatte zum Ziel, durch eine verlängerte EKG- Überwachung von vier bis sechs Stunden bereits festgestellte
Qualitätsbericht Hämotherapie
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Blutgruppenserologie und Immunhämatologie
 Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Decitabin Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT B6
 Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
fehlendenhauptsächlichausmenschlichemblutgewonnenengerinnungsfaktorenmöglich.dieseblutproduktewerdendurchblutpools,alsodurch
 Deutscher Bundestag Drucksache 17/10910 17. Wahlperiode 02. 10. 2012 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Dr. Martina Bunge, Diana Golze, Matthias W. Birkwald, weiterer Abgeordneter
Deutscher Bundestag Drucksache 17/10910 17. Wahlperiode 02. 10. 2012 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Dr. Martina Bunge, Diana Golze, Matthias W. Birkwald, weiterer Abgeordneter
Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten
 Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten im Universitätsklinikum Frankfurt am Main Anforderung von Blutkomponenten (1)! Verschreibungspflicht! (Arztunterschrift, patientenbezogen)!
Dienstanweisung für die klinische Anwendung von Blut und Blutprodukten im Universitätsklinikum Frankfurt am Main Anforderung von Blutkomponenten (1)! Verschreibungspflicht! (Arztunterschrift, patientenbezogen)!
