Vorlesung Allgemeine Chemie Teil 3: Grundlagen der Organischen Chemie
|
|
|
- Carl Geisler
- vor 7 Jahren
- Abrufe
Transkript
1 Vorlesung Allgemeine hemie Teil 3: Grundlagen der rganischen hemie Einführung Was ist rganische hemie Kohlenstoff und Wasserstoff machen bevorzugt kovalente (nicht ionische) Bindungen Kohlenstoff macht stabile Bindungen zu anderen Kohlenstoffatomen Daraus resultiert die Stoffklasse der Kohlenwasserstoffe (kurz KW, Verbindungen aus Kohlenstoff und Wasserstoff) Einteilung in Gesättigte KW Kettenförmig (offenkettig), Summenformel n 2n+2 Unverzweigt Verzweigt Ringförmig (zyklisch), enthalten weniger Wasserstoff Ungesättigte KW (enthalten weniger Wasserstoff Kettenförmig (offenkettig) Unverzweigt, verzweigt Ringförmig (zyklisch) Spezielle Klasse: aromatische KW (ringförmig) aromatisch:
2 Wie wurde nachgewiesen, dass organische Verbindungen hauptsächlich aus Kohlenstoff und Wasserstoff bestehen? rganische Verbindungen wurden durch Erhitzen in einem abgeschlossenen System unter reinem Sauerstoff verbrannt. Als Verbrennungsprodukte wurde 2 und 2 nachgewiesen Außer Kohlenstoff und Wasserstoff kommen noch andere Elemente in organischen Verbindungen vor: häufig: N, F weniger häufig: P, S N 2 F selten: F, l, Br, I, Se,... F S N 2 N N P Daraus resultiert eine fast unendliche Vielfalt organischer Verbindungen: Über 20 Millionen kohlenstoffhaltige Verbindungen bekannt und beschrieben Über 50 Millionen Peptid- / DNA Sequenzen bekannt Jährlich über eine Million neue Verbindungen Unbegrenzte weitere Zahl von Verbindungen möglich Die Bedeutung der rganischen hemie: Trotz dramatisch angestiegener Weltbevölkerung wurde die Ernährungssituation verbessert (Dünger, Pflanzenschutz, etc.) Steigende Lebenserwartung durch Bekämpfung von Seuchen und Krankheiten Vielzahl neuer Materialien für Technik Alle biologischen Prozesse basieren auf der Basis der rganischen hemie Der Bau von organischen Molekülen Um die Eigenschaften und Reaktionen von organischen Molekülen zu verstehen, muss man ihre Bindungsverhältnisse und ihren räumlichen Bau kennen und verstehen. Zahl von Bindungen (Bindigkeiten): Die Zahl von Bindungen, die eine Atomsorte eingeht, ergibt sich aus der Zahl ihrer Außenelektronen und damit aus ihrer Stellung im Periodensystem. In neutralen Molekülen ist Wasserstoff immer einbindig Kohlenstoff immer vierbindig (Ausnahmen sind reaktive Zwischenstufen) Stickstoff immer dreibindig (mit 1 freien Elektronenpaar) Sauerstoff immer zweibindig (mit 2 freien Elektronenpaaren) alogene wie F, l, Br immer einbindig (mit 3 freien Elektronenpaaren)
3 Der räumliche Bau von Kohlenstoffverbindungen ergibt sich aus den Bindungsverhältnissen bzw. der ybridisierung am Kohlenstoff. Folgende Fälle am Kohlenstoff sind möglich: Einfachbindungen Doppelbind. Dreifachbind. ybridisierung Anordnung sp 3 tetraedrisch sp 2 trigonal planar sp linear sp linear Beispiele: sp 3 sp 2 sp sp Ganz wichtig für die Elemente der 2. Periode (, N,, etc.) ist die ktettregel: Die Zahl der Außenelektronen (Bindungen und freie Elektronenpaare) soll 8 betragen; 4 Einfachbindungen am Kohlenstoff (jeweils 2 Elektronen) ergeben 8 Außenelektronen ebenso 3 Einfachbindungen und ein freies Elektronenpaar am Stickstoff oder 2 Einfachbindungen und 2 freie Elektronenpaare am Sauerstoff: o N 107 o o.. F.. Mehr als 8 Außenelektronen sind bei diesen Elementen nicht möglich, also kann Kohlenstoff nie mehr als 4 Bindungen eingehen! Der räumliche Bau der organischen Verbindung 2 l 2 sieht also folgendermaßen aus: l l Eine ebene Darstellung (rechts) dieses Moleküls würde die Wirklichkeit nicht richtig beschreiben l l l l Kohlenstoff ist tetraedrisch von den 4 Substituenten umgeben und nicht planar!
4 Formeln Summenformeln wie 2 6 genügen nicht zur eindeutigen Beschreibung organischer Moleküle, da es hier zwei verschiedene Möglichkeiten der Anordnung der Atome gibt: oder Die Formeln organische Moleküle müssen also genauer gezeichnet werden. Man benutzt dazu Strukturformeln bzw. Valenzstrichformeln: oder Man sollte sich dabei aber immer bewusst sein, dass diese Moleküle nicht eben sind, sondern Kohlenstoff mit 4 Einfachbindungen immer tetradrisch umgeben ist. Etwas einfacher ist die folgende linearisierte Schreibweise, die häufig angewandt wird und die Verknüpfung der Atome korrekt (bis auf die Winkel) und eindeutig angibt oder Noch schneller zu schreiben ist die folgende Kurzschreibweise oder Stereostenographie oder bei der jedes Ende eines geraden Striches ein Kohlenstoffatom mit der für Vierbindigkeit erforderlichen Zahl von Wasserstoffatomen bedeutet. Sie hat den Vorteil, die gewinkelte Verknüpfung der Atome der Atome zu zeigen, sie ist aber für unerfahrene Benutzer gefährlich, da häufig die korrekte Zahl von Kohlenstoff- und Wasserstoffatomen nicht erkannt wird. Bei zyklischen Verbindungen wird diese Stereostenographie häufig angewandt und zeigt auch klar die Zahl der -Atome; die nebenstehende Verbindung hat also die Summenformel 5 10
5 Gesättigte Kohlenwasserstoffe: Alkane Sie haben die Summenformel 2 2n+2 Die Vertreter der unverzweigten Alkane von n=1 bis n=7 sind in in der folgenden Tabelle aufgelistet Die Namen von Methan bis Butan sind Trivialnamen, ab Pentan leiten sie sich von griechischen Zahlwörtern ab; allen gemeinsam ist die Endung an. Bis zum Butan sind diese Verbindungen gasförmig, ab Pentan flüssig.
6 Methan ist der einfachste Vertreter der Alkane. Methan ist auptbestandteil von Erdgas (50 80 %) Das nebenstehende Bild zeigt die 4 sp 3 -ybridorbitale des Kohlenstoffatoms und die rbitalüberlappung mit den kugelförmigen s-rbitalen der 4 Wasserstoffatome, die zu 4 Sigma-Bindungen führen. Die Kohlenstoff-Kohlenstoff-Einfachbindung (Sigmabindung) im Ethan und den längerkettigen Alkanen wird durch Überlappung von sp 3 -ybridorbitalen gemacht Propan und Butan finden Verwendung u.a. als Druckgase zum Kochen und eizen, ab Pentan werden Alkane auch als Lösungsmittel eingesetzt. Alkane ab 6 Kohlenstoffatomen sind die wichtigsten Bestandteile von Benzin, längerkettige Alkane von Dieselöl, leichtem und schweren eizöl, etc. Wie oben schon kurz beschrieben können nicht nur unverzweigte Kohlenstoffketten auftreten, sondern auch verzweigte. Moleküle mit der gleichen Summenformel, aber unterschiedlicher Verknüpung der Atome nennt man Isomere, genauer Strukturisomere oder Konstitutionsisomere.
7 Für 6 14 sehen die Konstitutionsisomeren so aus: Die Zahl der möglichen Konstitutionsisomeren steigt mit der Zahl der -Atome stark an: für -6: 5-10: 75-20: : n-exan 2-Methylpentan 3-Methylpentan Je nach der Zahl von Alkylgruppen an einem Kohlenstoffatom werden die folgenden Bezeichnungen für den Substituionsgrad verwendet: 2,2-Dimethylbutan 2,3-Dimethylbutan p s p q t p p p p: primär mit 1 -Atom verknüpft s: sekundär mit 2 -Atomen verknüpft t: tertiär mit 3 -Atomen verknüpft q: quartär mit 4 -Atomen verknüpft Nomenklatur von verzweigten Alkanen: Man sucht die längste Kohlenstoffkette Mögl. niedrige 1. Ziffer für Substituenten, die die Endung yl bekommen Substituenten alphabetisch vor längste Kette Multiplikationsvorsilben di, tri, tetra,... Für jeden Substituent 1 Ziffer (-2,2,4-tri...) Bindestriche zwischen Zahlen-Text, 1. Buchstabe groß Die rechts stehende Verbindung heißt also: 5-Ethyl-2,6,6-trimethyloctan Bei Kohlenwasserstoffen mit --Einfachbindung ist diese nicht starr, sondern es ist leicht Drehung der Gruppen um diese Einfachbindung möglich. Dabei nehmen die Kohlenwasserstoffe unterschiedliche Konformationen an. Die folgende Abb. zeigt das für Ethan: verdeckte Konformation die -Atome stehen in die die gleiche Richtung gestaffelte Konformation die -Atome stehen gestaffelt bzw. auf Lücke
8 Die gestaffelte Konformation ist energetisch etwas günstiger, jedoch drehen sich bei Raumtemperatur die beiden Methylgruppen ständig gegeneinander. ycloalkane Wie schon kurz beschrieben gibt es nicht nur offenkettige, sondern auch ringförmige Alkane; sie heißen ycloalkane. Die Summenformel ist n 2n, wenn sie einen Ring besitzen. Die Namen werden so gemacht, dass man das Wort yclo vor den Namen des Alkans setzt: yclopropan yclobutan yclopentan yclohexan Beim yclopropan und yclobutan sind die gezeichneten --Bindungswinkel mit 60 und 90 Grad viel kleiner als der Tetraederwinkel (109,5 Grad), so dass deswegen und wegen verdeckt stehender -Atome deutliche Ringspannung auftritt; diese kleinen Ringe sind nicht allzu stabil, existieren aber. Der Sechsring ist spannungsfrei, weil er nicht eben ist, sondern eine sessel-
9 ähnliche Konformation einnimmt, die Sesselkonformation. Die beiden gezeigten Konformationen wandeln sich bei Raumtemperatur rasch ineinander um, es besteht ein Gleichgewicht zwischen ihnen. Vorkommen von Alkanen Methan kommt im Erdgas vor, wird aber auch ständig bei der anaeroben Zersetzung organischen Materials gebildet und in die Atmosphäre freigesetzt: Neuerdings wurde bekannt, dass auch lebende Pflanzen Methan in nicht unerheblicher Menge produzieren. Lagerstätten von Methan in Form von Methanhydrat (unter Druck ein farbloser Feststoff) finden sich auf dem Meeresboden an tiefen Stellen des zeans.
10 Das folgende Schema zeigt, wie Rohöl durch Destillation in verschiedene Fraktionen aufgetrennt wird und die hochsiedenden Bestandteile des Erdöls durch racken (Zerstückeln) in kleinere und damit nützlichere Kohlenwasserstoffe überführt werden: Raffinerie Reaktionen von Alkanen bzw. ycloalkanen Am wichtigsten für die Menschen ist derzeit noch die Energiegewinnung aus Erdöl und Erdgas durch Verbrennen der Kohlenwasserstoffe, wobei viel Energie frei wird: Freie Reaktionsenthalpie: kjmol -1 Bei Reaktionsgleichungen muss darauf geachtet werden, dass die Zahl der Atome jedes Elements für Edukte und Produkte gleich ist, dass also die Stöchiometrie stimmt. Unvollständige Verbrennungsprozesse treten u.a. beim Betrieb von Motoren auf Unvollständige Verbrennung in tto-motoren: 4 + 3/ Unvollständige Verbrennung in Diesel-Motoren: wobei giftiges Kohlenmonoxid bzw. Ruß entstehen.
11 Die wichtigste andere Reaktion von Alkanen außer der Verbrennung mit Luft (Sauerstoff) ist die Reaktion von Alkanen mit hlor oder Brom unter Lichteinfluss oder in starker itze. Dabei tritt Substitution (Ersatz) von Wasserstoff gegen alogen auf, wie bei der folgenden Reaktion von Methan mit hlorgas gezeigt: l + l 2 + l Diese Reaktion nennt man radikalische Substitution, da sie nur unter Bildung und Reaktionen von Radikalen ablaufen kann. Radikale sind Atome oder reaktive Moleküle mit einzelnen, ungepaarten Elektronen. ier eine Beschreibung der Teilschritte der Reaktion (Mechanismus) Licht Start: l-l l-l 2 l (2 hlorradikale) 2 l. Kettenreaktion: + l.. + l. + l 2 l + l. Während der Kettenreaktion wird in jedem Teilschritt aus einem Radikal wieder ein neues Radikal gebildet. Es ist aber andauernde Belichtung nötig, da bei Kettenabbruchreaktionen Radikale miteinander kombinieren und so der Kettenreaktion entzogen werden, z.b.. + l. l Durch diese radikalische Substitution an Alkanen entstehen hloralkane (mit Brom Bromalkane), die wichtige Bausteine für viele Synthesen sind. Auch mehrere alogenatome lassen sich in ein Molekül einführen wie bei l l l l l Dichlormethan Trichlormethan (hloroform)
12 Solche mehrfachchlorierten Verbindungen sind wichtige Lösungsmittel allerdings sind sie auch gesundheitsschädlich. Wenn Alkane, die nicht nur primäre, sondern auch sekundäre oder tertiäre -Atome besitzen, einer radikalischen Substitution unterzogen werden, so stellt man fest, dass die Reaktion am häufigsten an tertiären -Atomen auftritt, gefolgt von sekundären und erst dann von primären -Atomen. Diese Selektivität für bestimmte Positionen ist besonders stark ausgeprägt bei der radikalischen Bromierung, weniger stark bei der hlorierung. Das auptprodukt der Reaktion von Propan mit Brom ist 2-Brompropan Br + Br Br und nicht 1-Brompropan, was nur als untergeordnetes Nebenprodukt (wenige Prozent) entsteht. Ungesättigte Kohlenwasserstoffe Alkene mit einer oder mehreren Doppelbindungen Der einfachste Vertreter ist Ethylen (Ethen) Die Kohlenstoffatome an der Doppelbindung sind im Unterschied zu den Alkanen nicht sp3-, sondern sp2-hybridisiert und damit trigonal-planar von den drei Substituenten umgeben. Die für die ybridisierung nicht benötigten p-rbitale überlappen zur π-bindung; die -- Doppelbindung besteht also aus der σ-bindung mit einer zusätzlichen π-bindung. Die --- und ---Bindungswinkel betragen jeweils 120 Grad, die π-elektronen stehen senkrecht auf dem sonst planaren Molekül.
13 Molekülmodelle von Ethylen sehen folgendermaßen aus: Links ist ein Kugel-Stab-Modell gezeigt, rechts ein raumfüllendes Modell von Ethylen. Nomenklatur von Alkenen An den gleichen Grundnamen wie bei den Alkanen wird nun die Endung en angehängt. ier zwei Beispiele: 2-Penten 4-Ethyl-6,7-dimethyl-2-octen Die längste Kette muss die meisten (bei mehr als 1) Doppelbindungen enthalten und so durchnummeriert werden, dass die Doppelbindung(en) möglichst niedrige Ziffern bekommen. Bei Alkenen gibt es eventuell Isomere, die sich im räumlichen Bau dadurch unterscheiden, dass Substituenten auf der gleichen Seite der Doppelbindung stehen (cis) oder auf verschiedenen Seiten (trans) Das oben gezeichnete 2-Penten l l l ist also ein trans-2-penten. l Die Stellung der Substituenten An der Doppelbindung soll beim Namen immer angegeben cis-1,2-dichlorethen trans-1,2-dichlorethen werden, wenn es cis/trans-isomere gibt. Man nennt diese Isomerie Konfigurationsisomerie, die Isomeren dann Konfigurationsisomere. Die gleiche Art von cis/trans-isomerie gibt es auch bei ringförmigen Alkanen, also z.b. cis-1,2-yclobutan und trans-1,2-yclobutan ; auch das sind Konfigurationsisomere. Alkene wie Ethen, Propen und Buten entstehen vor allem beim racken von Erdölprodukten und sind wichtige Rohstoffe für Synthesen. erstellung von Alkenen Alkene kann man u.a. aus gesättigten Kohlenwasserstoffen mit einer funktionellen Gruppe X herstellen, indem man diese funktionelle Gruppe mit einem Wasserstoffatom (bzw. Proton) am Nachbarkohlenstoffatom als X abspaltet.
14 Die folgenden Beispiele zeigen, wie man aus Alkoholen (X=) Alkene herstellen kann: S o + 2 Ethanol Ethylen Wasser oder S 4 50 o tert-butanol Isobuten Wasser Dieses Abspalten von und unter Bildung einer Doppelbindung nennt man Eliminierung. Da verzweigte Alkene wie Isobuten stabiler sind als unverzweigte zw. Ethylen, geht hier die Eliminierung von Wasser schon bei 50 o. Reaktionen von Alkenen Alkene sind wegen ihrer Doppelbindung viel reaktiver als Alkane. Da die Doppelbindung elektronenreich ist (π-bindung), reagieren Alkene häufig zunächst mit Elektrophilen. Das sind (partiell) positiv geladene Teilchen, die Elektronenüberschuss suchen, im untenstehenden Beispiel also +. An die sich dabei bildenden reaktiven Zwischenstufen (meistens positiv geladen) lagert sich dann ein negatives Teilchen, genannt Nukleophil (unten l - ) an, so dass ein neutrales Additionsprodukt entsteht. R R elektrophiler Angriff + l - nukleophiler Angriff l R + Diese Reaktion nennt man Addition (genauer elektrophile Addition), da zwei Teilchen (hier und l) an die Doppelbindung addiert werden. Sie stellt die Umkehr der Eliminierung dar. Außer dem oben gezeichneten Produkt der Addition von -l an eine endständige Doppelbindung könnte auch ein isomeres Produkt, nämlich das nebenstehende entstehen. R l Die Regel von Markovnikov besagt aber, dass als auptprodukt immer dasjenige entsteht, bei dem an das -Atom geht, das bereits die meisten -Atome trägt.
15 Bei Addition von -X (X=l, Br,, etc.) ist die Reaktion also regiospezifisch, das bedeutet, dass bei unsymmetrischen Alkenen dessen Struktur festlegt, wie herum -X an die Doppelbindung addiert wird. Bei der Addition von -l entsteht also ein hloralkan. Die folgenden Beispiele zeigen die Addition von Wasser (Umkehr der Synthese von Alkenen aus Alkoholen) + - bzw. von Methanol an Alkene, wobei ein Methylether (Stoffklasse: Ether) entsteht Die letzte Addition ist technisch von großer Bedeutung, da dieser Ether (Methyl-tertbutylether, abgekürzt MTBE) dem Benzin als Antiklopfmittel beigemischt wird. Beide Reaktionen verlaufen wieder regiospezifisch und folgen der Regel von Markovnikov. Neben -X können auch Moleküle wie Br 2 oder l 2 an die --Doppelbindung addiert werden. Auch dabei handelt es sich um eine elektrophile Addition, da das alogenmolekül zunächst polarisiert wird und das partiell positive Atom zunächst an die Doppelbindung angelagert wird, gefolgt vom (partiell) negativ geladenen alogenatom. R + Br-Br Addition Br R Br So entstehen mit Brom Dibromalkane, an denen die beiden Bromatome an benachbarten - Atomen sitzen. Außer für solche Additionsreaktionen werden Alkene in großer Menge für Polymerisationen (Polyadditionen) eingesetzt. Polyethylen (PE) wird durch Polymerisation von Ethylen gewonnen: X n n 2 + Y
16 X soll den Katalysator bzw. Starter der Polymerisation darstellen, Y für den Atomausgleich sorgen. (Vereinfachte Darstellung!) Bei der Polymerisation werden lange Ketten aus 2 -Gruppen gebildet. Jährlich werden etwa 60 Millionen Tonnen PE hergestellt. Aus Propen (oder Propylen) 2 =- 3 wird Polypropylen (PP) hergestellt, aus Vinylchlorid l-= 2 Polyvinylchlorid (PV): n 2 l l l l l n 2 Polypropylen (PP) Polyvinylchlorid (PV) Kautschuk wird durch Polymerisation von Isopren hergestellt, Polyester wie PET (Polyethylenterephthalat) durch Polymerisation von Ethylenglykol und Terephthalsäure. Polymere wie Perlon und Nylon sind langkettige Polyamide Zur gleichen Stoffklasse gehören die natürlichen Polypeptide (Eiweißmoleküle), die durch Verknüpfung von alpha-aminosäuren gebildet werden. Alkine mit einer oder mehreren Dreifachbindungen Der einfachste Vertreter der Alkine ist Ethin (auch Acetylen genannt) Die Dreifachbindung kommt durch Überlappung von 2 aufeinander senkrecht stehenden p- rbitalen (z.b. py und pz) zustande Die Kohlenstoffatome sind dabei sp-hybridisiert, alle 4 Atome von Acetylen sind linear angeordnet, die Elektronen der Dreifachbindung symmetrisch um die --Bindung herum angeordnet.
17 Nomenklatur von Alkinen: An den Namen der längsten Kette (wie bei Alkanen) wird statt an bzw. en die Ending in angehängt, also Ethin, Propin, etc. Ab einer Kettenlänge von 4 -Atomen muss man die Position der Dreifachbindung angeben, wobei diese Ziffer wieder so klein wie möglich sein soll: diese Verbindung heißt also 2-Pentin erstellung von Acetylen Das einfachste Alkin, nämlich Acetylen, wurde früher aus alciumcarbid hergestellt, und diese Synthese spielt auch heute noch eine gewisse Rolle: a a() 2 Dieses Verfahren wurde auch in den Grubenlampen zur Beleuchtung (Verbrennen von Acetylen) eingesetzt. Im alciumcarbid, das aus a 2+ -Kationen und 2- -Anionen besteht, zeigt sich die erhöhte Acidität der --Bindung in Alkinen gegenüber Alkenen und Alkanen: Acetylen Ethylen Ethan Wasser ybridisierung sp sp 2 sp 3 sp 3 pk s ,7 Der Grund dieser stark erhöhten Acidität liegt in der ybridisierung der rbitale am Kohlenstoff. Reaktionen von Alkinen Analog wie bei Alkenen können auch an die Dreifachbindung von Alkinen elektrophile Partner wie -X oder X 2 addiert werden. l Acetylen + l l Vinylchlorid Dieses Beispiel zeigt die Synthese des technisch wichtigen Vinylchlorids (für PV). An das Vinylchlorid könnte noch einmal l addiert werden, so dass man durch zweimalige Addition an Alkine gesättigte Produkte (mit --Einfachbindung) erhalten kann. Der erste Schritt der Addition an Dreifachbindungen geht allerdings langsamer als die Addition an Doppelbindungen und auch der 2. Schritt ist durch elektronenziehende Substituenten (hlor o.ä.) häufig erschwert.
18 Aromatische Kohlenwasserstoffe Diese besondere Klasse von ringförmigen, ungesättigten Kohlenwasserstoffen zeichnet sich durch besonders hohe Stabilität aus. Additionen an die vorhandenen =-Doppelbindungen erfolgen in der Regel nicht. Die Bezeichnung aromatisch leitet sich vom Geruch vieler Vertreter dieser Klasse ab. Allerdings sind aromatische Kohlenwasserstoffe häufig auch gesundheitsschädlich oder sogar krebserregend. Der einfachste und typische Vertreter dieser Klasse ist das Benzol 6 6 (in Anlehnung an die Bezeichnung von Alkenen manchmal auch Benzen genannt). Benzol wird durch die beiden obenstehenden Formeln gleich gut beschrieben, d.h. alle - Bindungen haben die selbe Bindungslänge von 139 pm und liegen damit zwischen Einfachund Doppelbindung. Die Bindungsverhältnisse im Benzol werden durch die folgenden Abbildungen beschrieben Die 6 Kohlenstoffatome sind sp 2 -hybridisiert und bilden mit diesen sp 2 -ybridorbitalen die Einfachbindungen zu den anderen -Atomen und zu den -Atomen aus. Senkrecht auf diesem gleichseitigen Sechseck stehen die restlichen p-rbitale (im Bild rot); die Überlappung dieser p-rbitale führt zu den zusätzlichen π-bindungen formal sind das 3 Doppelbindungen, die aber nicht lokalisiert, sondern gleichmäßig verteilt sind (Ring im rechten Bild von Benzol). Benzol kommt im Erdöl vor und ist deshalb auch im Benzin vertreten. Aromatische Kohlenwasserstoffe erhöhen die Klopffestigkeit von Benzin, sind allerdings wegen der Möglichkeit, Krebs zu erzeugen, bedenklich. Kleine Mengen von Benzol werden auch beim Rauchen freigesetzt.
19 Reaktionen von Benzol Aromatische Kohlenwasserstoffe wie Benzol sind wegen ihrer hohen Stabilität recht reaktionsträge. Eine Addition von eletrophilen Partnern an die (partiellen) Doppelbindungen findet normalerweise nicht statt, da das Produkt nicht mehr aromatisch und damit weniger stabil wäre. Allerdings kann mit ilfe von geeigneten elektrophilen Teilchen eine Substitution von Wasserstoff gegen das Elektrophil (elektrophile aromatische Substitution, S E arom ) erreicht werden. Br-Br + FeBr 3 Br + FeBr Br Br + FeBr Br + FeBr 3 Brom alleine reagiert also nicht mit Benzol, aber mit ilfe des Katalysators FeBr 3 entsteht ein elektrophiles Br + -Kation, das ein + am Benzol ersetzt (substituiert); das Produkt ist Brombenzol. Substituierte Kohlenwasserstoffe alogenverbindungen Bei den oben geschilderten Reaktionen von gesättigten oder ungesättigten Kohlenwasserstoffen sind mehrmals halogen-substituierte Kohlenwasserstoffe aufgetreten, die die Klasse der organischen alogenverbindungen darstellen. Zusätzlich zu den bereits gezeigten Vertretern sind hier weitere wichtige alogenverbindungen aufgeführt: alogenverbindungen 3 Br: Methylbromid. giftig, gasförmig, von Kammerjägern verwendet 2 l 2 : Dichlormethan, gebräuchliches Lösungsmittel l 3 : l 4 : hloroform, früher Narkosemittel Tetrachlormethan, Lösungsmittel, giftig l 2 =l 2 : Tetra (Per), Lösungsmittel, Textilreinigung PB: Polychlorbiphenyle
20 l n l n Die Polychlorbiphenyle sind als Umweltgifte bekannt, die früher in Transformatoren und ydraulikanlagen und als Weichmacher von Kunststffen verwendet wurden. Inzwischen ist ihre Verwendung verboten Eigenschaften und Reaktionen von alogenverbindungen In den organischen alogenverbindungen ist mit hlor oder Brom (selten Fluor oder Iod) ein Element enthalten, das eine deutlich höhere Elektronegativität besitzt als Kohlenstoff. Daher ist die -al-bindung polarisiert, die Bindungselektronen werden vom alogen stärker angezogen, so dass die -al-bindung unter Umständen sogar vollständig ionisch geöffnet werden kann. Die Reaktion von tert-butylchlorid mit Wasser (auch ydrolyse genannt) zeigt so ein Beispiel 3 3 l 3 in Wasser l Das alogenatom in organischen alogenverbindungen kann also substituiert werden durch andere Gruppen, im obigen Fall die -Gruppe; dabei entsteht ein Alkohol. Dieser Reaktionstyp heißt nukleophile Substitution (S N ), da ein Nukleophil (hier der Sauerstoff von Wasser) ein anderes Nukleophil (hier hlor) substituiert. Bei tertiären alogenverbindungen (wie im obigen Beispiel) verläuft die Reaktion stufenweise, wobei zunächst das Nukleophil abgespalten wird (es heißt dann auch Nukleofug) und ein positiv geladenes arbenium-ion als instabile Zwischenstufe gebildet wird. Dieses tertiäre arbenium-ion ist zwar durch die 3 Methylgruppen viel besser stabilisiert als ein primäres arbenium-ion, trotzdem reagiert es sehr rasch weiter mit vorhandenen Nukleophilen, in diesem Fall mit Wasser. Um die positive Ladung loszuwerden, spaltet der Sauerstoff anschließend ein Proton ab. Dieser stufenweise Reaktionstyp heißt monomolekulare nukleophile Substitution, abgekürzt S N 1. Bei primären alogenverbindungen läuft die Reaktion dagegen nach einem S N 2- Mechanismus ab, wobei die Öffnung der -al-bindung und die Neuknüpfung der -- Bindung einigermaßen gleichzeitig (konzertiert) verlaufen:
21 l l 2 2 Alkohole Alkohole enthalten eine (oder mehrere) -Gruppe(n) als Substituent am Kohlenwasserstoffrest. ier sind einige wichtige Vertreter dieser Verbindungsklasse aufgeführt: Methanol Ethanol 1-Propanol Isopropylalkohol 1-Butanol Ethylenglykol Die Namengebung erfolgt so, dass an den Namen des gesättigten Kohlenwasserstoffs die Endung ol angehängt wird. Bei mehr als 2 -Atomen muss noch die Position der - Gruppe mit einer vorgestellten Ziffer angegeben werden (Isopropanol heißt also auch 2-Propanol, Ethylenglykol auch 1,2-Ethandiol). Alkohole haben wegen der intramolekularen Anziehungskräfte (Wasserstoffbrückenbindungen, siehe Abbildung) einen viel höheren Siedepunkt als die gleich großen Alkane: Propan MW 44, Sdp. -42 o Ethanol MW 46, Sdp. +78 o
22 -Gruppen enthalten auch die folgenden Stoffklassen: Zucker, Steroide, Wachsalkohole, Riechstoffe, etc. Ether Ether haben die allgemeine Formel R--R Die beiden Alkylgruppen können gleich sein wie beim bekanntesten Vertreter Diethylether: oder auch unterschiedlich wie bei Methyl-tert-butyl-ether (MTBE), der als Antiklopfmittel dem Benzin zugesetzt wird und deshalb in großen Mengen synthetisiert wird. Neuerdings wird statt MTBE auch ETBE (Ethyl-tert-butyl-ether) synthetisiert und dem Benzin zugesetzt Da Ether wenig reaktiv sind, werden sie häufig auch als Lösungsmittel für chemische Reaktionen eingesetzt. Amine Amine haben die allgemeine Formel R-N 2 Man unterscheidet je nach Zahl von Alkylgruppen am Stickstoff zwischen primären, sekundären und tertiären Aminen. N N N Ethylamin primäres Amin Dipropylamin sekundäres Amin Triethylamin tertiäres Amin Amine haben basiche Eigenschaften, da am Stickstoff noch ein freies Elektronenpaar zur Anlagerung eines Protons zur Verfügung steht. Alkylamine sind sogar stärkere Basen als der Grundkörper Ammoniak, N 3. Alkylamine haben einen typischen Fischgeruch, sie entstehen bei der Zersetzung bestimmter Aminosäuren. Werden die basischen Amine durch Säuren (wie Zitronensäure im Saft von Zitronen) protoniert, so verschwindet dieser Geruch. Die Substituenten am Stickstoff können auch ringförmig miteinander verbunden sein; man erhält dann Stickstff-eterocyclen wie Pyrrolidin (links) oder Pyridin (rechts) 2 2 N 2 2 N
23 Aldehyde und Ketone Die Gruppe, bei der Kohlenstoff außer einem (oder zwei) Kohlenwasserstoffrest(en) noch einen doppelt gebundenen Sauerstoff trägt, nennt man arbonylgruppe. Jenachdem ob nur ein KW-Rest und ein -Atom oder zwei KW-Reste an der arbonylgruppe sitzen erhält man Aldehyde oder Ketone. R Áldehyde R1 R2 Ketone Nomenklatur von Aldehyden: An den Namen des gesättigten Kohlenwasserstoffs wird die Endung al angehängt, z.b. Butanal, exanal Einfache Vertreter haben Trivialnamen wie Formaldehyd (R =, Verwendung als Desinfektion und für Kunstharze) oder Acetaldehyd (R = 3 ) höhere Aldehyde finden auch Verwendung als Riechstoffe Nomenklatur von Ketonen: An den Namen des gesättigten Kohlenwasserstoffs wird die Endung on angehängt, z.b. 2-Butanon, 3-Pentanon Einfache Vertreter haben Trivialnamen wie Aceton (R1 = R2 = 3, Verwendung u..a. als Lösungsmittel) arbonsäuren und Ester arbonsäuren haben die funktionelle Gruppe Einfache Vertreter sind die Ameisensäure (R = ) und die Essigsäure (R = 3 ) R Die Trivialnamen der arbonsäuren weisen häufig auf das natürlich Vorkommen hin, auch bei Buttersäure, Ölsäure, Zitronensäure, Weinsäure, etc. Nach der systematischen Nomenklatur wird an den Namen des gesättigten Kohlenwasserstoffs mit der gleichen Zahl von -Atomen die Endung säure angehängt; Essigsäure kann man also auch Ethansäure nennen, etc. Fettsäuren heißen längerkettige arbonsäuren, weil sie als Triglyceride (d.h. Glycerin mit 3 Fettsäuren verestert) in Fetten vorkommen. Öle enthalten Ester ungesättigter Fettsäuren, die eine oder mehrere Doppelbindungen aufweisen. Bei den lebensnotwendigen (essentiellen) mega-3-fettsäuren geht eine Doppelbindung vom drittletzten -Atom der Kette aus. arbonsäuren sind schwache Säuren, spalten also das Proton der -Gruppe relativ leicht ab. Der p K a-wert von Essigsäure beträgt 4.75.
24 Ester haben die funktionelle Gruppe Sie sind Derivate aus arbonsäuren (R) und Alkoholen (R ) Säure + Alkohol Ester + Wasser Wie bereits erwähnt sind Fette und Öle Ester von Fettsäuren mit dem dreiwertigen Alkohol Glycerin, siehe rechts Wachse sind Ester von Fettsäuren mit langkettigen (Mono)alkoholen R R 2 2 R1 R2 R3 Aus kleineren Molekülen aufgebaute Ester riechen häufig angenehm fruchtig und sind natürlich vorkommende Aromastoffe. Der Ethylester der Essigsäure (Essigester) ist ein wichtiges Lösungsmittel (Klebstoffe etc.) Aminosäuren Aminosäuren sind die Bausteine aller Proteine (Eiweißmoleküle); dafür werden aber nur α-aminosäuren verwendet, die die Aminogruppe an dem der arbonsäuregruppe R benachbarten -Atom tragen. + N Freie Aminosäuren liegen in Form von Zwitterionen 3 vor siehe Abbildung da sie innerhalb des Moleküls eine Säurefunktion und die basische Aminogruppe tragen. Diese geladene Form macht Aminosäuren auch recht gut wasserlöslich. a - Die einfachste α-aminosäure ist Glycin (R = ), das nächsthöhere omologe Alanin (R = 3 ). In Proteinen sind bisher 23 natürliche α-aminosäuren bekannt, die alle in der L- Konfiguration (räumlicher Bau am stereogenen Zentrum) vorkommen. Ketten aus 2-10 AS nennt man ligopeptide, aus AS Polypeptide.
25 Zucker (Kohlenhydrate) Zucker enthalten mehrere -Gruppen, zusätzlich aber auch eine arbonylgruppe (Aldehyd oder Keton). Wegen dieser sehr polaren funktionellen Gruppen sind sie gut wasserlöslich. Der wichtigste Zucker ist die Glucose, auch Traubenzucker oder Dextrose genannt. Die Formel links zeigt die offenkettige Form der Glucose, die jedoch hauptsächlich in der rechts gezeigten zyklischen Form als Sechsring mit einem Sauerstoff im Ring vorliegt. 2 Glucose ist ein Monosaccharid (Einfachzucker) und ist der wichtigste Energielieferant des rganismus. Glucose ist Baustein in Disacchariden wie Rohrzucker und Milchzucker. Auch Stärke und ellulose sind aus Glucose aufgebaut, also Polymere von Glucose. Die Bezeichnung Kohlenhydrate kommt daher, dass man die Summenformeln von Zuckern und Polymeren davon auch schreiben kann als n ( 2 ) n, d.h. als ydrate von Kohlenstoff. Entsprechend zersetzt sich Zucker beim Erhitzen in Kohlenstoff und Wasser.
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
EINFÜHRUNG IN DIE ORGANISCHE CHEMIE
 rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Grundwissen Chemie Mittelstufe (10 MNG)
 Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Organische Chemie. Kohlenstoff. Kohlenstoffkreislauf. Erdölverarbeitung. Kohlenwasserstoffe
 rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
GRUNDWISSEN CHEMIE 10. KLASSE
 Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Organische Chemie für Mediziner WS 2016/2017. Übungsblatt 3: Ausgewählte Substanzklassen
 1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Grundwissen 10. Klasse NTG 1
 Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
IUPAC-Nomenklaturregeln als Grundlage für Q11 Chemie
 Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Organische Chemie. 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8. Lehrstuhl für Organische Chemie
 Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.02.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 2 H 4 O 2 ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.02.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 2 H 4 O 2 ein, die die folgenden Eigenschaften
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
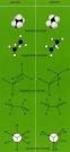 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
CH CH 2 H 2 C H 2 C CH 2 CH CH CH 2 CH 2 C H H 2 C CH 2 C 2 CH 2 H CH 2 CH 2
 Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. CnH2n-2
 Ri 51 1.3. Alkine Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. Allgemeine Summenformel der Monoalkine: CnH2n-2 Alkine sind gestreckte MolekÄle.
Ri 51 1.3. Alkine Alkine sind aliphatische, ungesättigte Kohlenwasserstoffe die eine oder mehrere Dreifachbindungen aufweisen. Allgemeine Summenformel der Monoalkine: CnH2n-2 Alkine sind gestreckte MolekÄle.
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 4
 Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
1 Stoffklasse Alkane : C n H 2n+2 Namensendung an
 rganische hemie LÖSUNGEN Seite 1 von 11 1 Stoffklasse Alkane : n 2n+2 Namensendung an Zahl der -Atome Name Molekülformel Lewisformel Keilstrichformel Skelettformel 1 Methan 4 Sinnlos 2 Ethan 2 6 3 Propan
rganische hemie LÖSUNGEN Seite 1 von 11 1 Stoffklasse Alkane : n 2n+2 Namensendung an Zahl der -Atome Name Molekülformel Lewisformel Keilstrichformel Skelettformel 1 Methan 4 Sinnlos 2 Ethan 2 6 3 Propan
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Zeichnen von Valenzstrichformeln
 Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
4.1. Gesättigte Kohlenwasserstoffe (Alkane)
 4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Klausur zur Vorlesung Allgemeine Chemie II (Organische Chemie) für Studierende der Agrarwissenschaften und der Ökotrophologie. Wintersemester 2002/03
 Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O ein, die die folgenden Eigenschaften besitzt: - Die Verbindung bildet mit einem primären Amin ein Imin.
Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O ein, die die folgenden Eigenschaften besitzt: - Die Verbindung bildet mit einem primären Amin ein Imin.
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
