Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
|
|
|
- Helmut Rosenberg
- vor 7 Jahren
- Abrufe
Transkript
1 1
2 2 nhalt...1 nhalt... 2 Wdh. Klasse 10: Die Atombindung bei Wasserstoff & Kohlenstoff...4 Kohlenstoff als Bindungspartner... 5 Die homologe Reihe der Alkane... 6 Die Namen der homologen Reihe von Alkanen > Was macht die Alkane so besonders?...7 Eigenschaften der Alkane - Schmelz und Siedepunkte...8 Alkangemische... 9 a) Paraffin... 9 Kohlenstoffketten können verzweigt vorliegen: somerie...10 Butan und sein somer: Stoffvielfalt durch somerie Oktanisomere im Vergleich ihrer Schmelz- und Siedepunkte...12 eptanisomere Konformations-somerie am Beispiel des Ethans...14 Zwei Möglichkeiten der Darstellung:...14 Übung zur somerie Weitere somerieformen Konstitutionsisomere Stereoisomere Übungen zur cis/ Tranz somerie (E/z)...18 Aufgabe: Bestimme die Anzahl an Pentenisomeren...20 Vorkommen und wichtige Beispiele der Alkane Methan: Propan: Butan und sein somer: Pentan und seine somere:...22 ycloalkane Stabilität der cyclischen Alkane...24 yclohexan und seinem Bau...25 Der yclohexanring ist nicht planar gebaut...25 Kohlenwasserstoffe mit Mehrfachbindungen: Alkene und Alkine...26 Bananen - unreif geerntet und unreif verschifft, mit Ethen dann zum Reifen gebracht...27 Eigenschaften und Verwendung wichtiger Alkane, Alkene, Alkine...28 Mindmap: Alkene Mindmap: Alkine ycloalkene Die Genfer Nomenklatur von organischen Verbindungen (UPA) - Teil Übungen zur Nomenklatur organischer Verbindungen (Domino)...33 Übersicht der funktionelle Gruppen...34 Funktionellen Gruppen: Übersicht über wichtige Stoffklassen der organischen hemie...35 Weitere funktionelle Gruppen in der Übersicht...36 Übersicht über wichtige funktionelle Gruppen und bekannte Vertreter...37 Funktionelle Gruppen ändern massiv die Stoffeigenschaften...41 Die Genfer Nomenklatur von organischen Verbindungen (UPA) - Teil a) Nomenklatur mit Alkohol-Substituenten...42 b) Nomenklatur mit alogen-substituenten...43 c) Nomenklatur mit Ether & Ester Substituenten...43 Bindungswinkel und Drehbarkeit a) Bindungswinkel der Alkane b) Bindungswinkel der Alkene c) Bindungswinkel der Alkine Verschiedene graphische Darstellungsmöglichkeiten von organischen Verbindungen...46 Übung: m Benzin enthaltene Alkane und Alkine...47 racken von langkettigen Kohlenwasserstoffen...48
3 3 Beispiel: racken von exadecan Wiederholungsaufgaben zur Kohlenstoffverbindungen sowie zu organischen hemie...49
4 4 Wdh. Klasse 10: Die Atombindung bei Wasserstoff & Kohlenstoff 4 2 e- werden jeweils durch ein Strich dargestellt Also, nicht verwechseln: onen gibt es nur in Kristallen oder gelöst in Wasser! Bei Kohlenwasserstoffen hingegen liegt beides nicht vor. Die Bindung zwischen den Atomen ist immer eine Atombindung. Dazu überlappen die äußeren Elektronenhüllen und bilden einen gemeinsamen Bereich (dieser wird auch Molekülorbital genannt1). Damit gehört das Valenzelektronen-Paar beiden Atomen in gleicher Weise und sie erhalten Edelgaskonfiguration. Lewis, 1916: Atome sind in Molekülen durch gemeinsame Elektronen verbunden (=Atombindung bzw. Elektronenpaar Bindung). Vom Kohlenstoffatom gehen in der Regel 4 Elektronenpaarbindungen ab (oder es liegen Doppel- oder Dreifachbindungen vor, dann sind es entsprechend weniger, aber der Kohlenstoff wird weiterhin als vierbindig bezeichnet!). Meistens ist Kohlenstoff dabei mit Kohlenstoff oder mit Wasserstoff verknüpft (aber auch Sauerstoff, Schwefel und Stickstoff (u.a.) sind möglich). Je länger dabei eine Kohlenstoffkette ist, desto fester und dickflüssiger wird eine Substanz. Tipp: Bei Problemen mit dem Erstellen von Atombindungen lies nochmals das Arbeitsblatt Regeln zum Erstellen von Valenzstrichformeln im Kapitel Atombindung. 1 Fachlich nicht einwandfrei, da MO der ganze Bereich ist!
5 5 Kohlenstoff als Bindungspartner Kohlenstoff steht ist ein Element der 4. auptgruppe, d.h. es hat vier Außenelektronen. Es fehlen also 4 Valenzelektronen zum Erreichen der Edelgaskonfiguration. Das Ausbilden von 4 Atombindungen bietet sich an, um diesen Zustand zu erreichen. Dabei bilden die Außenelektronen des Kohlenstoffatoms mit den Außenelektronen der Reaktionspartner gemeinsame Bindungselektronenpaare. Am stabilsten sind dabei Kohlenstoff-Kohlenstoff-Bindungen. Es entstehen Atombindungen. Sie ist bei allen organischen Verbindungen zu finden. Die entstehenden Kohlenstoffverbindungen können kettenförmig sein, verzweigt oder zyklisch (=ringförmig). Es entstehen Atombindungen. Sie ist bei allen organischen Verbindungen zu finden. Die entstehenden Kohlenstoffverbindungen können kettenförmig sein, verzweigt oder zyklisch (=ringförmig): Beim Verbrennen organischer Substanzen wird viel Energie freigesetzt. Diese stammt aus den Bindungen und wird von den Menschen bei der Verbrennung fossiler Brennstoffe (Erdöl, Erdgas), olz und Kohle genutzt. Auch die Verbrennung von Kunststoffen in Müllverbrennungsanlagen setzt diese Energie frei. Kein Wunder, denn auch Kunststoffe sind Kohlenwasserstoffverbindungen. Kettenförmige Kohlenwasserstoffe (ohne Mehrfachbindungen) nennt man Alkane. Ringförmige entsprechend ycloalkane. Ketteförmige Kohlenwasserstoffe mit Doppelbindungen, werden Alkene, Kohlenwasserstoffe mit Dreifachbindungen werden Alkine genannt. Die einfache Verknüpfung von Kohlenstoff mit anderen Nichtmetallen über Atombindungen ermöglicht eine schier unendliche Anzahl an möglichen Kombinationen. Mehr als 5 Millionen sollen in der Natur zu finden sein! m Labor entstehen täglich neue. Obwohl in der anorganischen hemie viel mehr Elemente reagieren, sind bisher nur ca Verbindungen bekannt. m Vergleich dazu schätzt man die Anzahl an organischen Verbindungen auf ca. 10 Millionen. Organische Moleküle enthalten Kohlenstoff und Wasserstoff sowie zum Teil Sauerstoff und einige andere Elemente (z.b. Stickstoff, Schwefel, Phosphor). Ausnahmen: Kohlenstoffverbindungen, die als anorganisch gelten Oxide des Kohlenstoffs (z.b. O, O2) Kohlensäure (2O3) Salze der Kohlensäure (z.b. Kalk ao3)
6 6 Die homologe Reihe der Alkane Als homologe Reihen bezeichnet man Reihen von Verbindungen, deren Glieder sich nur durch eine 2-Gruppe voneinander unterscheiden, die aber ansonsten gleich gebaut sind. Alkane enthalten nur --Einfachbindungen sowie --Bindungen. Da die maximal mögliche Anzahl von Wasserstoff-Atomen gebunden ist, spricht man deshalb auch von gesättigten Kohlenwasserstoffen. Verbindung (Strukturformel) Name Summenformel somere Sdp. Dichte Methan (gasförmig) ,4 Ethan (gasförmig) 2 6 Propan (gasförmig) 3 8 Butan (gasförmig) 410 Pentan (flüssig) ,1 0,63 g/cm³ exan (flüssig) ,7 0,66 g/cm³ eptan (flüssig) ,4 Oktan (flüssig) 818 Nonan (flüssig) 920 Dekan (dickflüssig) ,47 g/cm³ (bei Verflüssigung) 1-88,6 0,57 g/cm³ (bei Verflüssigung) 2-0,5 0,60 g/cm³ (bei Verflüssigung) 0,68 g/cm³ ,6 0,72 g/cm³ ,8 0,73 g/cm³ 0,59 g/cm³ (bei Verflüssigung) - 42, ,3 0,74 g/cm³
7 7 Die Namen der homologen Reihe von Alkanen > Decan Undecan Dodecan Tridecan Tetradecan Pentadecan exadecan eptadecan Octadecan Nonadecan Eikosan Zusatzinformationen: Was macht die Alkane so besonders? Die von Methan abgeleiteten Verbindungen werden als Alkane bezeichnet. Alkane kommen als unverzweigte Ketten, verzweigte Alkane oder als cyclischen Alkane vor. Alkane mit der gleichen Summenformel, aber verschiedener Strukturformel nennt man somere (so gibt es zwei 410 Moleküle, drei 512 Moleküle und 4,111,846,763 mögliche 3062 somere ;-) ). n Alkanen bilden Kohlenstoffe vier Einfachbindungen aus, Wasserstoffe bilden immer nur eine! Die Alkane 1 bis 4 sind bei Raumtemperatur gasförmig. Ab 1430 sind Alkane bei Raumtemperatur Feststoffe. Bei Raumtemperatur flüssige Alkane sind wasserklare Flüssigkeiten mit stark aromatischem Geruch, der an Benzin erinnert. Je länger die Kohlenstoffkette wird, desto dickflüssiger, öliger werden sie. Der Geruch lässt entsprechend nach. Alkane könne auch in Ringen auftreten. Man nennt sie dann ycloalkane. Alkane werden auch wegen der Abwesenheit von Doppelbindungen als gesättigt bezeichnet. Rein kettenförmige Alkane werden auch als n-alkane (z.b. n-eptan) bezeichnet. Verzweigte Alkane werden als iso-alkane bezeichnet. Je länger die Kohlenstoffkette (also mit zunehmender Molekülmasse), desto höher liegen Schmelzund Siedepunkte des Alkans. Ursache sind steigenden van der Waals-Kräfte aufgrund zunehmender Kettenlänge. Allgemeine Summenformel der kettförmigen Alkane: n 2n+2 Allgemeine Formel der zyklischen Alkane: n 2n Lange unverzweigte Alkane bilden lineare Zick-Zack-Ketten aus.
8 8 Eigenschaften der Alkane - Schmelz und Siedepunkte Kettenlänge Name SMP [ ] Sdp [ ] Kettenlänge Name Methan Ethan Propan Butan Pentan exan eptan Okatan Nonan Dekan Undekan Dodekan Tridekan Tetradekan Pentadekan ,5 9, , exadekan eptadekan Oktadekan Nonadekan Eicosan enikosan Dokosan Trikosan Tetrakosan Pentakosan exakosan eptakosan Octakosan Nonakosan Triakontan SMP [ ] Sdp [ ] ,7 40, ,4 59,5 64,5 63,7 65,
9 9 Alkangemische a) Paraffin Ein Gemisch langkettiger (18-45) Alkane wird als Paraffin bezeichnet. Eine allgemeine Summenformel kann somit nicht angegeben werden. Die molare Masse damit zwischen g/ mol. Es ist weiß mit einer leichten Transparenz. Es entsteht z.b. als Produkt der Erdöldestillation. Paraffin ist geruchlos. artparaffin schmilzt zwischen 50 und 60, Weichparaffin bei etwa 45. Verwendung: - als Kerzenwachs - Mikrowachs - eresin - Lackpoliturzusatz - Petroleumersatz (Brennstoff für Öllampen) - Vaseline - Ausgangsstoff bei der erstellung von Kaugummi uvm. b) Benzin Benzin ist eine Mischung aus verschiedenen leichten Kohlenwasserstoffen. Es befinden sich neben Alkanen auch ycloalkane, Alkene (mit Doppelbindungen) und Alkine (mit Dreifachbindungen) im Gemisch. Benzin wird durch fraktionierte Destillation aus Erdöl oder auch im geringen Maße durch Kohleverflüssigung gewonnen. Zusatzinformationen
10 10 Kohlenstoffketten können verzweigt vorliegen: somerie n ampinggaskartuschen findet man in der Regel das Gas Butan. Da es einen Siedepunkt von ca. 0,5 hat, lässt es sich unter etwas Druck leicht verflüssigen. Das komprimierte Gas wird dadurch flüssig. Untersucht man das enthaltene Gas genau, so findet man meist zwei verschiedene Gase, welche allerdings eine identische Anzahl an Kohlenstoff und Wasserstoffatomen haben. Butan und sein somer: n-butan Smp.: -138 Sdp.: -0,5 iso - Butan Smp.: -160 Sdp.: -12. Von Butan existieren zwei Formen, diese werden somere genannt. Beide sind gasförmige, farblose, gesättigte Kohlenwasserstoffe. Sie unterschieden sich jedoch hinsichtlich ihrer Eigenschaften. Vor allem Schmelz- und Siedepunkte sowie die Dichte unterscheiden sich deutlich. n anderen Eigenschaften sind sie sich ähnlicher. Die Ursache für die höheren Schmelz- und Siedepunkte des n-butans liegen in der besser Ausbildung von Van der Waals-Kräften. Diese bilden sich im allgemeinen bei kettenförmigen Molekülen immer besser aus. Dadurch halten die Ketten besser zusammen und man benötigt mehr Energie (in diesem Fall Temperatur) um die Moleküle so stark ins schwingen zu versetzen, dass sie den Aggregatzustand ändern. Moleküle mit verzweigten Ketten haben immer geringere Siedepunkte als unverzweigte, weil die Van der Waals-Kräfte sich zwischen Ketten besser ausbilden als bei ungleichmäßig geformten Molekülen. Definition: Substanzen, die trotz gleicher Summenformel eine andere Strukturformel (und somit verschiedene Eigenschaften) haben, nennt man somere (isos gr. = gleich, meros gr. = Teil). Auggabe: 1. Zeichne alle somere von Pentan, exan, eptan usw. ;-) Die somerenzahl wächst sehr rasch mit steigender Kohlenstoffzahl somere somere somere somere somere ,111,846,763 somere Die Zahl der tatsächlich existierenden somere ist kleiner, als die Zahl der theoretisch möglichen!
11 11 Stoffvielfalt durch somerie Butan 2 somere Pentan 3 somere exan 5 somere Smp: -138,3 Sdp: -0, Smp: -159,4 Sdp: -11, Smp: Sdp: -20 9,5 --
12 12 Oktanisomere im Vergleich ihrer Schmelz- und Siedepunkte Octan 17 somere Smp: -56,8 Sdp: 125,7 Smp: -109,2 Sdp: 117,6 Smp: -121,2 Sdp: 106, Smp: -100,7 Sdp: 106,3 Zusatzinformationen
13 13 eptanisomere
14 14 Konformations-somerie am Beispiel des Ethans 3 3 sp3-hybridisiert freie Drehbarkeit Konformationen: mögliche räumliche Anordnungen der Atome im Molekül, die durch die freie Drehbarkeit um die -Bindung entstehen. Konformatisisomere: Moleküle, die unterschiedliche Konformationen einnehmen. Zwei Möglichkeiten der Darstellung: ekliptische (verdeckte) Konformation gestaffelte Konformation Sägebock -Projektion Newman -Projektion 13 kj / mol WW der -Atome
15 15 Übung zur somerie
16 16 Weitere somerieformen Man unterscheidet zwischen zwei Arten von somerie : Struktur- (bzw. Konstitutionsisomerie) und Stereoisomerie: 1. Strukturisomere: Verbindungen mit gleicher Summenformel, aber verschiedenen Strukturformeln. (Unterscheidung in der Reihenfolge der aneinander gebundenen Atome.) Bsp.: O O O 2. Stereoisomere: Verbindungen, deren Strukturformel (=Konstitution) und Summenformel im Grunde gleich ist, die sich aber in der räumlichen Anordnung unterscheiden. (Zum Verständnis muss man dazu wissen, dass Mehrfachbindungen nicht frei drehbar sind!) cis-/trans-somere Moleküle, bei denen die Stellung der Substituenten an der Doppelbindung bzw. Dreifachbindung vertauscht ist. Sie haben in der Regel unterschiedliche chemische Eigenschaften. Enantiomere (=Stereoisomere) Moleküle, die sich wie Bild und Spiegelbild verhalten. Sie können nicht zur Deckung gebracht werden können und haben i.d.r. identische chemische Eigenschaften. Diastereomere Moleküle, welche Stereoisomere mit hiralitätszentrum, aber keine Enantiomere sind. Sie haben i.d.r. unterschiedliche chemische Eigenschaften) Bsp.: 48 Bsp.: BrlF Bsp.: Weinsäure * * F l Br l F Br Die gestrichelten Bindungen zeigen nach hinten, die fetten, nach vorn! D-Weinsäure L-Weinsäure Konformationsisomere: Moleküle mit einer unterschiedlichen räumlichen Anordnung, die durch Rotation um Einfachbindungen entstehen. Bsp.: 1,2-Dichlorethan Zusatzinformationen: Quelle Weinsäuregrafiken: public domain: - thank you
17 17 Konstitutionsisomere Gerüstisomere funktionelle somere Stellungssomere n-butan 2-Methylpropan 3 3 O 2 3 O 3 2 O 3 1-Propanol Dimethylether O 2-Propanol Ethanol Stereoisomere Konfigurationsisomere cis-trans- Konformere Enantiomere somere OO O OO 2O l l l l O 2O L-Glycerinsäure DGlycerinsäure l cis- l trans- 1,2-Dichlorethen l l 1,2-Dichlorethan Diastereomere OO OO O O O O 3 3 D-Threose L-Threose
18 18 Übungen zur cis/ Tranz somerie (E/Z) is- bzw. (Z)-Anordnung bedeutet, dass beide Substituenten auf der gleichen Seite (zusammen) der Doppelbindung verbunden sind. Trans- bzw. (E)-Anordnung bedeutet, dass beide Substituenten auf entgegengesetzten Seiten (entgegen) der Doppelbindung zu finden sind. Sind drei oder mehr Subsituenten vorhanden, werden zur Benennung die mit der höchsten Ordnungszahl verwendet (also Brom käme dann vor hlor!).
19 19 Lösungen:
20 20 Aufgabe: Bestimme die Anzahl an Pentenisomeren Beispiele für Pentenisomere mit einer Doppelbindung: 1-Penten trans-2-penten cis-2-penten 2-Methyl-1-buten 2-Methyl-2-buten 2-Methyl-3-buten Es sind auch Pentene mit mehreren Doppelbindungen möglich, so dass die Anzahl der möglichen somere mindestens 8 beträgt! Zum Vergleich: Es gibt nur vier Pentanisomere!
21 21 Vorkommen und wichtige Beispiele der Alkane 1. Methan: Vorkommen: auptbestandteil von Erdgas. Auch in aus Steinkohle gebildetem Stadtgas enthalten. Dazu findet eine trockene Destillation von Steinkohle unter Luftausschluss bei 1200 statt. Der Rest wird als Koks bezeichnet) Methan entsteht in der Natur bei: - Fäulnisprozessen (z.b. im Komposthaufen, in Sümpfen und im Klärschlamm der Kläranlage - der ellulosegärung der Wiederkäuer. - unterirdisch in Steinkohlegruben als Grubengas (Gefahr, da die schlagenden Wetter (MethanLuft-Explosionen) die durch einen Funken entstehen können. Es entsteht bei Vedauungsvorgängen von Wiederkäuern sowie beim Reisanbau (Anteil des Reisanbaus an der weltweiten Methanproduktion ca. 17 %!) Eigenschaften und Verwendung: Farb- und geruchloses Gas (Wieso heißt es eigentlich in Krimis immer: Es riecht nach Gas?) Methan ist in Wasser unlöslich. brennbar: O2 O O = -888 kj/mol Es stellt sich natürlich die Frage, warum hier eine so hohe Energieausbeute vorliegt? Es bildet sich 2O und O2, die beide sehr stabile und energiearme Stoffe sind. geringere Dichte als Luft. explosives Luft/Methan-Gemisch. (Explosionsgrenze 10% - 90% 4) wichtigen Rohstoff der chemischen ndustrie. So wird beispielsweise Wasserstoff durch thermische Spaltung oder durch Reaktionen mit Wasserdampf (an Nickel-Katalysatoren) gewonnen, durch itzespaltung gewinnt man Acetylen (=Ethin) 22: 4 + E + 22 (bei 1200 ) 4 + 2O O + 32 (bei , an einem Nickelkatalysator) Zusatzinformationen: 2. Propan: Tritt als Begleiter des Erdöls, im Erdgas und in rackgasen auf. Wird als Stadtgas zum Beheizen von äusern verwendet. Treibgas in Spraydosen. Zusatzinformationen:
22 22 3. Butan und sein somer: n-butan und sobutan sind Flüssiggase, die bei der Erdöldestillation anfallen. Sie kommen im Erdöl und Erdgas vor. in Wasser ist Butan so gut wie unlöslich (nur 150 ml/l). Beide somere verhalten sich chemisch ähnlich (beide sind brennbar und werden von den alogenen hlor und Brom unter Lichteinfluss angegriffen. n-butan wird seit dem FKW-Verbot als Treibgas in Spraydosen verwendet. Beide somere werden in Feuerzeugen, oft im Gemisch mit Propan, eingesetzt. Butan wird (trotz der Brennbarkeit) im Kühlschrank als Kältemittel eingesetzt manche Solarkollektoren verwenden sobutan als Wärme(über)träger. Zusatzinformationen: 4. Pentan und seine somere: Es gibt drei somere des Pentans. Der Flammpunkt von n-pentan liegt bei -49, die Zündtemperatur bei 309. Löslichkeit: 0.36 g/l (16 ) in Wasser. Pentan wird heutzutage als FKW-freies Kältemittel in Kühlschränken und Klimaanlagen verwendet. Zusatzinformationen:
23 23 ycloalkane Du kennst jetzt die kettenförmigen Alkane, man nennt sie auch aliphatische Alkane. hre Kette kann verzweigt oder unverzweigt sein. Wenn Kohlenstoffatome sich in einem Ring anordnen, nennt man diese auch ycloalkane. Die Eigenschaften der ycloalkane sind mehr oder weniger die typischen physikalischen und chemischen Eigenschaften der Alkane. n der Natur spielen zyklische Ringsysteme als Bestandteile vieler pflanzlicher und tierischer Stoffe eine große Rolle. Allerdings liegen dort oft ycloalkane mit mehreren Mehrfachbindungen vor. Diese haben dann deutlich andere Eigenschaften als die Alkane. yclopropan ist ein brennbares Gas mit einem Sdp. von -33, es ist reaktionsfreudig, da die Bindungswinkel zwischen den einzelnen Kohlenstoffatomen stark vom üblichen Tetraederwinkel abweichen und somit die Ringe unter einer gewissen inneren Spannung stehen. Durch eine Reaktion kann der Ring aufgebrochen werden, was viel Energie freisetzt. yclobutan ist ebenfalls ein brennbares Gas. Sein Sdp. liegt bei 12,5. Es ist aus den gleichen ebenfalls reaktionsfreudig yclopentan ist eine farblose Flüssigkeit, die leicht entzündbar ist. Der Sdp. liegt bei 49 yclohexan ist ebenfalls eine farblose Flüssigkeit. Sein Sdp. liegt bei 81. Es ist nicht so reaktionsfreudig, da hier ein sehr entspannter Tetraederwinkel vorliegt. Obwohl der Ring planar gezeichnet ist, so ist er es nicht! Zusatzinformationen:
24 24 Stabilität der cyclischen Alkane Allgemeine Formel der cyclischen Alkane: n2n Name Summenformel Sdp. Ringspannung yclopropan yclobutan yclopentan yclohexan Strukturformel Wie man sieht, stehen die ersten Ringe der Reihe unter enormer Ringspannung. m yclohexan liegt ein perfekter tetraedischer Winkel von 109 vor, so dass der Ring nicht unter Spannung steht! Stabilität der homologe Reihe der ycloalkane: sehr instabil yclopropan 36 yclobutan 48 yclopentan 510 yclohexan 612 instabil ycloheptan 714 stabil yclooctan 816 stabil Je stärker die Bindungswinkel der ycloalkane vom Tetraederwinkel 109 abweichen, desto instabiler ist das Molekül (aufgrund der hohen Winkelspannung).
25 25 yclohexan und seinem Bau farblose Flüssigkeit Sdp.: 81 o (n-exan 69 o) zeigt typische Alkaneigenschaften zeigt typische Alkanreaktionen (z.b. radikalische Substitution SR - allerdings entsteht dabei nur ein Monosubstitutionsprodukt!). Der yclohexanring ist nicht planar gebaut. Sesselform Newmanprojektion: Wannenform
26 26 Kohlenwasserstoffe mit Mehrfachbindungen: Alkene und Alkine Ethen (Trivialname Ethylen) ist ein farbloses, süßlich riechendes Gas. Es ist das einfachste Alken und enthält eine Doppelbindung. Man spricht auch von einem ungesättigten Kohlenwasserstoff. 120 \ / = / \ Wenn man den räumlichen Bau anschaut, sieht man schnell, dass es ein planares Molekül ist, welches einen Bindungswinkel von 120 hat. Ethen wird als Pflanzenhormon verwendet. So werden z.b. noch grüne Bananen gepflückt, transportiert und dann kurz vor Verkauf mit Ethen begast, welches sie zum reifen bringt. Auch reife Früchte wie Bananen geben Ethen ab, so dass unreifes Obst, wie Tomaten, in Gegenwart von Bananen weiter reifen. Des weiteren ist es Ausgangsstoff für sehr viele chemische Synthesen und zur Kunststoffherstellung (PE Polyethylen, Polystyrol (=Styropor) sowie Polyester u.a.). Auch der Alkohol Ethanol kann daraus hergestellt werden. Vorsicht: Ethen ist hochentzündlich. Bei einem Luftvolumenanteil von 3-36% bildet es explosive Gemische. n hoher Konzentration wirkt es auch als Betäubungsmittel. Alkene enthalten Zweifachbindungen. Sie gehören zu den ungesättigten Kohlenwasserstoffen. hre Namen enden auf -en. Ethin (Trivialname Acetylen) ist ebenfalls ein farbloses, leicht süßlich riechendes Gas. Beide Kohlenstoffatome sind über eine Dreifachbindung miteinander verbunden. Es ist der einfachste Vertreter aus der homologen Reihe der Alkine: Der räumlichen Bau ist planar (kettenförmig). Der Bindungswinkel beträgt 180. Es brennt mit stark rußender Flamme. m richtigen Gemisch mit Sauerstoff werden dabei Temperaturen von bis zu 3100 erreicht. Aus diesem Grunde wird es als Schweißgas verwendet. Ethin-Luftgemische zwischen 2-82% Luftvolumenanteil sind hochexplosiv. Unter hohem Druck zerfällt es, so dass es in Schweißflaschen nur mit geringem Druck gelagert werden kann. Die Löslichkeit in Wasser beträgt Normalbedingungen nur 1,23 g/l, wohingegen die Löslichkeit in Alkohol und Aceton sehr gut ist. Außer zum Schweißen ist dieses Gas besonders gut für chemische Synthesen als Ausgangsstoff geeignet. Außer Kunststoffen wie Polyvinylchlorid2 (PV) werden auch viele organische Säuren wie Essigsäure daraus hergestellt. Alkine enthalten Dreifachbindungen. Sie gehören zu den ungesättigten Kohlenwasserstoffen. hre Namen enden auf -in. Zusatzinformationen Vinyl: R-=2
27 27 Bananen - unreif geerntet und unreif verschifft, mit Ethen dann zum Reifen gebracht
28 28 Eigenschaften und Verwendung wichtiger Alkane, Alkene, Alkine Verbindung Eigenschaften Verwendung Ethan - farbloses Gas - Siedepunkt: Schmelzpunkt: Erdgas Ethen - farbloses Gas - Siedepunkt: Schmelzpunkt: Erdgas - Betäubungsmittel Ethin - farbloses Gas - sublimationspunkt:-83 - Gift - Aufbau von Aktivkohle Propan - Gas (farblos, geruchlos) - Siedepunkt: Schmelzpunkt: Erdgas - eißluftballongas Propen - farbloses Gas - Siedepunkt: Schmelzpunkt: Gas in Brennschneidern Propin - farbloses Gas - Siedepunkt: Schmelzpunkt: -23 Butan - farbloses Flüssiggas - Siedepunkt: -0,5 - Schmelzpunkt: hoch entzündlich - Treibgas - Kältemittel - Missbrauch als Droge Buten - farbloses Gas - Siedepunkt: -6 - Schmelzpunkt: erstellung von Synthesen Butin - farbloses Gas - Siedepunkt: Schmelzpunkt: Kunststoffbildung
29 29 Mindmap: Alkene
30 30 Mindmap: Alkine
31 31 ycloalkene ycloalkene haben zum Teil die Eigenschaft, einen sehr aromatischen (benzinartigen) Geruch zu haben. Diese Stoffe lernst Du später genauer kennen. Sie werden Aromaten genannt. Der bekannteste Vertreter der ycloalkene und auch der Aromaten ist das yclohex-1,3,5-trien. Es wird der Einfachheit halber oft mit seinem Trivialnamen Benzol bezeichnet. Eine Besonderheit des Benzols ist, dass die Doppelbindungen abwechselnd (=konjugiert) angeordnet sind. Diese besondere Anordnung ermöglicht, dass sie die Doppelbindungselektronen (π-elektronen) frei bewegen können. Sie sind also nicht fest den Kohlenstoffatomen zugeordnet. Man sagt auch, die πelektronen sind delokalisiert. Das dahinter liegende Phänomen wird Mesomerie genannt. Für weitere nformationen siehe Kapitel Aromaten
32 32 Die Genfer Nomenklatur von organischen Verbindungen (UPA) - Teil 1 1. Es wird die längste Kohlenstoffkette gesucht und die Kohlenstoffatome werden entsprechend nummeriert. Dabei spielt es keine Rolle, ob von Links oder rechts gelesen wird! 2. Bei Doppelbindungen wird die Endsilbe -an durch die Silbe -en ersetzt. Die Endung -in wird für Dreifachbindungen verwendet. Die Kette wird dann so nummeriert, dass die Doppel- (bzw. Dreifach-) Bindung die niedrigste Ziffer erhält. Die Lage der Mehrfachbindungen im Molekül wird durch die Nummer des Kohlenstoffatoms bezeichnet, das in der Mehrfachbindung die kleinere Nummer trägt. Sie wird vor (oder früher auch nach) dem Namen des Alkens stehen. Treten mehre Mehrfachbindungen auf, wird ein di, tri... vor die Endsilbe eingesetzt. Propen 1 = 2-3 ept-1,5-dien 1 = = Seitengruppen werden mit den Namen der entsprechenden Alkane (Alkene/ Alkine) und der Endung -yl gekennzeichnet. hre Anzahl wird, (wenn von 1 abweichend) durch die Silben Di-, Tri-, Tetra-, Penta- gekennzeichnet: Vor die Bezeichnung des Restes kommt die Nummer der Stelle der Verzweigung. Treten z.b. zwei Methyl-Reste auf, so kommt noch die Silbe di hinzu. Die Seitengruppen werden in alphabetischer Reihenfolge genannt (also -ethyl vor -methyl). Tipp: zwischen Zahl und Buchstabe immer einen Bindestrich setzten, zwischen Zahlen ímmer ein Komma! = Ethyl-4-methyl-heptan 3, 3-Dimethyl-hept-1-en 4. Mehrere Doppelbindungen werden durch die Endsilbe -dien gekennzeichnet. Verbindungen mit Doppel- und Dreifachbindungen werden durch die Endungen -enin gekennzeichnet. Sind viele Mehrfachbindungen (oder funktionelle Gruppen) vorhanden, kann die Zahl auch direkt vor das -en oder -in gestellt werden: z.b. 1-Buten = But-1-en. 1 = = Ethyl-4-methyl-hept-1,5-dien 1 = Ethyl-2,5-dimethyl-hept-1-en-6-in 5. Wichtig: Die Nummerierung der Kohlenstoffkette (siehe 1.) ist so durchzuführen, dass nicht nur Mehrfachbindungen, sondern auch Seitenketten eine möglichst niedrige Nummer erhalten. 6. Seitenketten mit Einfachbindungen enden auf -yl (Methyl, Ethyl usw.), Seitenketen mit Doppelbindungen enden auf -enyl (Ethenyl, Propenyl usw.).
33 33 Übungen zur Nomenklatur organischer Verbindungen (Domino)
34 34 Übersicht der funktionelle Gruppen Die Vielfalt der organischer hemie kommt durch beliebige Verknüpfungsmöglichkeiten der Kohlenstoffketten und durch Anbindung von Liganden bzw. funktionellen Gruppen zustande. Funktionelle Gruppe bestimmen maßgeblich die chemischen Eigenschaften und die Reaktivität des gesamten Moleküls. hemische Reaktionen laufen in der Regel auch immer zuerst an funktionellen Gruppen (bzw. Mehrfachbindungen) ab.
35 35 Funktionellen Gruppen: Übersicht über wichtige Stoffklassen der organischen hemie Als Funktionelle Gruppen bezeichnet man besondere Atome, die anstelle eines Wasserstoffes an eine Kohlenwasserstoffkette angehängt ist. Die funktionellen Gruppen sind entscheidend für die chemischen Eigenschaften und das chemische Verhalten dieser Verbindung. So kann ein einzelnes hloratom die Eigenschaften einer Kohlenstoffkette aus 10 Kohlenstoffatomen komplett verändern. Oft werden auch spezielle Bindungsarten (Doppel-, Dreifachbindung sowie Ringschlüsse) zu den funktionellen Gruppen zugeordnet. Name Merkmal bzw. funktionelle Gruppe Endung (Suffix) Name vorangestellt (Präfix) -an Alkan = Alkin -en -in FluorhlorBromod- alogenalkan R al Alkanol/ Alkohol -ol Keton Alkanal/ Aldehyd O // R \ O // R \ O Ester O // R \ O 2 R -on -al Formyl- -säure arboxy- -oat R 2 O 2 R Bromethan: Br Ethanol: O Propanon: O Ethanal: O // \ Ethansäure: O // \ O Ethylpropanoat (früher Essigsäurepropylester): O // \ O s.u. Ether ydroxy- R O O R R arbonsäure Ethen: = Ethin: Alken Beispiel (Achtung: freie Elektronenpaare fehlen!) Ethan: Ethoxy-propan (bzw. früher Ethylpropylether): O
36 Zucker 36 -ose Benzolring 65 Phenyl- Thiol R-S Ammine R-N2 Amino- Nitroverbindung R-NO2 Nitro- -thiol Mercapto- Beachte: R (bzw. R ) kennzeichnen beliebige Kohlenwasserstoffketten als Rest Weitere funktionelle Gruppen in der Übersicht Funktionellen Gruppen Aromatische Ringe aromatischer Ring mit -O R- N R-O R-O R-OO R-OO-R R-al (F, l, Br, oder ) Ringschluss R-N=N-R R-N=O R-N2 R-NO2 R-O- N R-O R-O-O-R R-O-R R-O-SO2-O-R R-S- R-SO2-R R-SO3 R-S-R R-S-S-R Name Aromaten Phenole Nitrile Ketone Aldehyde arbonsäuren Ester alogenkohlenwasserstoffe ycloalkane Azoverbindungen Nitrosoverbindungen Amin Nitroverbindungen yanat Alkohole Peroxide Ether Sulfate Thiole (bzw. Mercaptane) Sulfone Sulfonsäure Thioether Disulfide
37 37 Übersicht über wichtige funktionelle Gruppen und bekannte Vertreter (Achtung: freie Elektronenpaare fehlen!) Name/ funktionelle Gruppe Alkohole [-ol] R--O- Beispiele Methanol O Verwendung und Besonderheiten Früher bekannt als Methylalkohol oder olzgeist. ochgiftige, farblose, leicht brennbare Flüssigkeit. Sie wird schon durch autkontakt in den Körper aufgenommen. Schon kleinste Mengen führen zu Nervenschäden und Erblindung. Mengen ab ca. 5ml sind tödlich. Ein Erkennungsmerkmal ist die Verbrennung mit leicht bläulicher Flamme. Ein weiterer Nachweis (und eine Unterscheidung zu Ethanol ist die Verbrennung mit Borax. Dabei entsteht Trimethylborat, das mit grüner Flamme verbrennt. Es findet Verwendung als Lösungs- und Reinigungsmittel, als Treibstoff und Benzinersatz. Zusatzinformationen: Ethanol O Der bekannteste Alkohol wurde früher auch Ethylalkohol oder Weingeist genannt. Er ist ein sehr wichtiges Lösungsmittel, Bestandteil von Reinigungsmitteln und Ausgangsstoff für viele chemische Synthesen. Als Genussmittel wird in den meisten Ländern Alkoholsteuer darauf erhoben. Damit er trotzdem für andere Zwecke, wie z.b. zum Reinigen von Fenstern, zur Verfügung steht, wird er als Spiritus mit einem Vergällungsstoff in den andel gebracht. Dieser ist ungenießbar (außer für arl) Ethanol ist giftig. Zwar kann die Leber und die darin gespeicherten Enzyme (z.b. Alkoholdehydrogenase) das Blut wieder entgifteten, aber schon ein Glas Wein/ Bier lässt Menschen (je nach Gewicht) die typischen Vergiftungserscheinungen spüren (Schwindel, Übelkeit, Orientierungsstörung, gesteigerte Aggressivität usw.). Die tödliche Dosis liegt etwa bei 3,0 bis 4,0 Promille. Zusatzinformationen: Glycerin O O O Glycerin (bzw. Glycerol) ist der Trivialname von Propantriol. Dieser dreiwertige Alkohol ist eine wichtige Ausgangssubstanz für remes und andere Kosmetika. Es wirkt als Frostschutzmittel in Scheibenwischanlagen und kann bei der Kunststoffproduktion als Weichmacher verwendet werden. Man findet es auch in Zahnpasta und vielen natürlichen Lipiden (Fetten). Zusatzinformationen:
38 Name/ funktionelle Gruppe Aldehyde [-al] R -=O Beispiele Methanal (=Formaldehyd) O 38 Verwendung und Besonderheiten Formaldehyd ist ein farbloses, stechend riechendes Gas, welches schwerer als Luft ist. n geringen Mengen riecht es etwas süßlich. Es ist ein gutes Reduktionsmittel und noch in Konzentrationen von 0,05-1 ml/m³ wahrnehmbar. Bei autkontakt oder beim Einatmen kommt es zu Verätzungen. Als tödliche Menge reichen schon ca. 10ml Lösung. n geringeren Mengen ist es immer noch krebserregend und kann außerdem Allergien, aut-, Atemwegs- oder Augenreizungen verursachen. Es wird zur erstellung von Kunststoffen, Düngemitteln, Farbstoffen, Konservierungsstoff in der Kosmetikindustrie, Desinfektionsmitteln usw. verwendet. Früher würde es gepresstem olz beigefügt, um dieses vor Schimmel und nsektenbefall zu schützen. Alte Möbel aus gepresstem olz können auch noch Jahrzehnte später Formaldehyd ausdünsten. Zusatzinformationen: Ethanal (=Acetaldehyd) O // \ Ethanal ist eine farblose, sehr leicht flüchtige und daher leicht entzündliche Flüssigkeit mit betäubendem, stechendem Geruch, die mit Wasser in jedem Verhältnis mischbar ist. Beim Abbau von Alkohol in der Leber entsteht Ethanal als Zwischenprodukt. größere Mengen davon sind u.a. (neben Magnesiummangel im Blut) für den Kater am nächsten Morgen mitverantwortlich. Es entsteht ebenso (neben über 1000 anderen Verbindungen) bei der Verbrennung von Tabak. Es ist Bestandteil von Kunststoffen (Synthesekautschuk) Farben und wird zur erstellung von Parfümen verwendet. Auch in der Gummi-, Papier- und Lederindustrie wird es eingesetzt. Manchmal wird es auch als Konservierungsstoff von Früchten und Fisch verwendet. Zusatzinformationen: Ketone [-on] R - - R O Aceton O Aceton ist eine dünnflüssige, farblose Flüssigkeit mit typischem Geruch. Sie ist sehr leicht flüchtig und leicht entzündlich und bildet mit Luft ein explosives Gemisch. Mit Wasser ist sie in jedem Verhältnis mischbar und wird deshalb auch oft als Lösungsmittel verwendet (besonders für arze, Fette, Öle, Klebstoffe, Lacke und Farben). Früher wurde es häufig als Nagellackentferner eingesetzt Zusatzinformationen:
39 Name/ funktionelle Gruppe arbonsäure [-säure] R -=O O Beispiele Ameisensäure O // \ O 39 Verwendung und Besonderheiten Ameisensäure ist eine farblose, ätzende, stark riechende und in Wasser lösliche Flüssigkeit, die in der Natur vielfach von Lebewesen zu Verteidigungszwecken genutzt wird. Ameisensäure ist ein starkes Reduktionsmittel. Mit Wasser ist sie in jedem Verhältnis mischbar. Als Konservierungsstoff für die Lebensmittelindustrie trägt es die Nummer E 236. hr Säurerest heißt Formiat Ethansäure (=Essigsäure) O // \ O Zusatzinformationen: Reine Essigsäure ist eine stark riechende Flüssigkeit, die schon bei 16,5 erstarrt. Sie wird dann auch als Eisessig bezeichnet. Sie hat eine recht hohe ätzende Wirkung und greift unter anderem Kalk und Metalle an. Sie ist in jedem Verhältnis mit Wasser mischbar. Wässrige Lösungen der Essigsäure werden auch Essig genannt. Der Essig im andel enthält zwischen 5-15% Essigsäure. Als Konservierungsstoff für die Lebensmittelindustrie trägt es die Nummer E 260. Die Salze der Essigsäure werden als Acetate bezeichnet. Weitere Säuren: Zusatzinformationen: An arbonsäuren gibt es eine zu große Vielfalt, um alle wichtigen Vertreter hier aufzulisten. Aus diesem Grunde folgt nur eine Kurzübersicht. Kurzkettige arbonsäuren sind stark polar. Langkettige arbonsäuren haben ein polares und ein unpolares Ende der Kohlenwasserstoffkette. Die mit Mehrfachbindungen werden ungesättigten Fettsäuren genannt. Ohne Doppelbindungen als gesättigte Fettsäuren). Komplexe arbonsäuren, wie sie oft auch in der Natur in Pflanzen oder beim Stoffwechseln von Tieren auftreten können auch 2 Säuregruppen bzw. auch ydroxidgruppen enthalten. Sie bilden sie untereinander Wasserstoffbrückenbindungen aus und haben u.a. deshalb hohe Siedepunkte. Bei langkettigen arbonsäuren haben auch die Van-der-Waals-Kräfte größen Einfluss auf die hohen Schmelz- und Siedepunkte Propionsäure 3-2-OO Milchsäure 3--OO O Buttersäure OO Weinsäure OO-O-O-OO Zusatzinformationen: Konservierungsmittel, kaum noch verwendet (E 280), Säurerest: Propionate Bestandteil des Säureschutzmantels der aut. Entsteht beim sauer werden von Milch, Kochsalzersatz in der Diätnahrung (E 270), Säurerest: Lactate Einsatz bei der Kunststoffherstellung, Säurerest: Butyrate Bestandteil in Weintrauben, Säuerungsmittel in der Lebensmittelindustrie (E 334), Säurerest: Tartrate
40 itronensäure 6 8 O 7 2 O Benzoesäure 65OO Stearinsäure 1836O2 Ether [-ether] R \ O R Ester [-ester] O R - \ O - - R Diethylether (oft auch einfach nur Ether genannt) Essigsäureethylester (=Ethylacetat) O // \ O 40 Konservierungsstoff und Säuerungsmittel (E 330), Säurerest: itrate Lebensmittel-Konservierung (E 210), Säurerest: Benzoate Seifen- und Kerzenwachsherstellung, Säurerest: Stearate Diethylether richt leicht süßlich und wird vom Geruch oft mit dem Geruch von Zahnarztprxen in Verbindung gebracht. Es ist eine klare, farblose Flüssigkeit, welche bei Raumtemperatur sehr schnell verdunstet. Beim Einatmen hat gasförmiger Dieethylether eine betäubende Wirkung, so dass er ab 1846 von Ärzten als Narkotikum (4-5-Vol% Diethylether in der Atmeluft, mindestens 15g) Die Wirkung ist dabei eine Lähmung des ZNS, so dass es zu Bewusstseinsverlust und Schmerzempfindlichkeit kommt. n der bevölkung hieß der Stoff von da an auch vereinfacht Ether. Der Vorteil dieses Betäubungsmittels ist, dass er Atmung und Blutkreislauf nur kaum beeinträchtigt, so dass die Patienten zwar mit Kopfschmerzen, aber sonst gesund aus der Narkose erwachten. Die Gefahr lag darin, dass Dieethyletherdämpfe mit Luft ein explosives Gemisch bilden. Diethylether ist recht apolar, so dass er ein gutes Lösungsmittel für lipophile Stoffe und ein schlechtes für Wasser und hydrophile Stoffe darstellt. Diethylether entzündet sich bereits als Gemisch mit Luft bei 180 von selbst! Beim Stehenlassen bilden sich in Vorratsflschen Peroxidverbindungen (R-O-O-R). Diese sind ebenfalls gefährlich und steigern die Explosivität. Ester sind meiste klare farblose Flüssigkeiten. So auch der Essigsäureethylester. Er ist teilweise in Nagellackentferner enthalten und ist auch in vielen Klebstoffen als Lösungsmittel enthalten. Wenn man davon viel einatmet, reizt das die Atemwege, wirkt narkotisierend/ betäubend und kann auch beim regelmäßigen Schnüffeln abhängig machen. Essigsäureethylester löst sich etwas in Wasser und löst sich vor allem in Ölen und Fetten (lipophile Stofffe). Man findet es neben der Verwendung als Lösungsmittel in geringen Konzentrationen auch als künslichen Fruchtaromastoff in Lebensmitteln sowie bei der Kunststoffherstellung (Kunstharze, ellophan, elluloid)
41 41 Funktionelle Gruppen ändern massiv die Stoffeigenschaften Sind andere Atome als oder in funktionellen Gruppen beteiligt, führen diese in der Regel zu polaren Atombindungen und somit oft zu Dipolen. Dies hat wiederum Einfluss auf Siede- und Schmelzpunkte sowie die Löslichkeit in polaren Lösungsmitteln. Es gilt: Je stärker der Dipol, desto eher löst sich der Stoff auch in Wasser. Funktionelle Gruppen reagieren leichter als Kohlenstoffatome der auptkette. ier finden also oft die Angriffe von Reaktionspartnern statt. Auch Mehrfachbindungen zwischen zwei Kohlenstoffenen der auptkette gelten als funktionelle Gruppe (funktionelle Gruppen ohne eteroatome). Sie werden oft bei Reaktionen aufgespalten! Moleküle mit Mehrfachbindungen sind deutlich reaktiver als reine Alkane! Zusatzinformationen:
42 42 Die Genfer Nomenklatur von organischen Verbindungen (UPA) - Teil 2 Man unterscheidet zwischen Seitenketten (Methyl-, Ethyl-, Propyl usw.) oder besonderen Substituenten, diese nennt man funktionelle Gruppen. Substituenten ersetzten Wasserstoff und werden auch als eteroatome bezeichnet, da sie nicht oder sind: a) Nomenklatur mit Alkohol-Substituenten 1. Bei Alkoholen wird das ydroxid als Alkanderivate behandelt. Dem Namen des Alkans wird die Endung -ol angehängt. Den Platz der ydroxidgruppe erhält wie üblich eine möglichst geringe Nummer. Wichtig: Die Namen und Ziffern der Alkylsubstituenten werden denen der Alkanolsubstituenten vorangestellt: O O- O- Pentan-1-ol (bzw. 1-Pentanol) 2 Methyl-hexan-6-ol yclohexanol 2. ydroxidgruppen, alogengruppen sowie Alkylgruppen können entsprechend ihrer Stellung die auptkette als primäre, sekundäre oder tertiäre kennzeichnen. Entscheidend ist dabei immer, wie viele weitere Kohlenstoffe an dem zu finden sind, welches die ydroxigruppe bindet. 3 2 O O O Entsprechend der Anzahl der O-Gruppen unterscheidet man einwertige, zweiwertige, dreiwertige (usw.) also mehrwertige Alkohole O O 2 2 O O O 2 2 zweiwertiger Alkohol (Glycol) dreiwertiger Alkohol (Glycerin) 4. Liegen die ydroxygruppen am Benzol (66) vor, so spricht man von Phenolen. Kommen zusätzlich Alkylgruppen vor, so werden sie im Namen wieder vorangestellt. O 5. Bei der Benennung von Verbindungen mit Alkoholsubstituenten und Mehrfachbindungen, werden zuerst die Alkoholsubstituenten genannt. 6. Die Doppelbindung hat bei der Nomenklatur Vorfahrt vor alogenen und Alkanseitenketten!
43 43 b) Nomenklatur mit alogen-substituenten 7. Die Nomenklatur entspricht den Regeln der üblichen Nomenklatur der Alkane (d.h. zuerst längste Kette suchen, alphabetisches Sortieren der Reste usw...) 8. Der Name des alogens (Fluor, hlor, Brom, od) wird vor den Namen (evtl. mit di, tri, tetra usw...) vorangestellt. Die Nummer wird entsprechend den Regeln zur Bestimmung von Verzweigungen bei Alkanen angegeben. Also z.b. 2 hlor-propan 9. Die Doppelbindung hat bei der Nomenklatur Vorfahrt vor alogenen und Alkanseitenketten! Bei alogensubstituenten und Verzweigungen (z. B. Ethyl- und hlor-verzweigungen in einem Molekül) wird das alogen also als funktionelle Gruppe als zweites genannt! 10. Nun gilt es noch zu entscheiden, welche Funktionelle Gruppe als Endung verwendet wird: at man neben den Alkylresten auch funktionelle Gruppen, wie alogene, Sauerstoff, Stickstoff oder auch Mehrfachbindungen, so wird die ranghöchste Gruppe dabei als Endung verwendet und alle anderen alphabetisch geordnet, als Vorsilben genannt. c) Nomenklatur mit Ether & Ester Substituenten 11. Grundsätzlich gibt es hier eine neue und eine ältere (aber noch häufig verwendete Methode. Da Ester durch die Reaktion von Alkohol mit Säuren entstehen, bilden sich die Namen entsprechend: Rest des Alkohols + Rest der Säure + oat (früher: Säurename + Restname + Ether) 12. Auch hier gibt es zwei entsprechende Methoden. eute werden Ether als Alkoxyalkane bezeichnet. Dabei wird der längere Alkyl-Rest als Stamm und der kürzere Rest als Alkoxy-Substituent benannt. (früher: Name aus den beiden Alkyl-Resten + -ether) Zusatzinformationen:
44 44 Bindungswinkel und Drehbarkeit a) Bindungswinkel der Alkane Erinnere Dich an das Kapitel Atombindung. Nach der Elektronenpaarabstoßungstheorie stoßen sich Elektronen voneinander ab. Deshalb haben auch Bindungselektronenpaare immer einen größtmöglichen Abstand voneinander. Ein Atom mit vier Bindungen (also genauso wie der Kohlenstoff in Methan, Ethan usw.) liegt also nicht so vor, wie wir es oft zeichen: 4: 109,5 Einfache Darstellung, welche oft ausreicht - aber Maximale Abstoßung liegt bei einem Winkel von nicht exakt ist! 109,5 vor. Die räumliche Gestalt, welche entsteht, Der Bindungswinkel ist tatsächlich aber nicht 90. wenn man die 's verbindet, nennt man Tetraeder. Ein größerer Winkel ist möglich! Dies ist die räumliche Anordnung, wie sie bei sehr vielen Molekülen, welche 4 Bindungspartner haben vorliegt, ermöglicht den größtmöglichen Abstand zwischen den Bindungspartnern. intergrund ist die Abstoßung der Elektronenwolken untereinander (und im Übrigen auch die der Atomkerne). Elektronen und Atome versuchen jeweils einen möglichst großen Abstand voneinander zu bekommen. Die Einfachbindung ist frei drehbar! b) Bindungswinkel der Alkene in Alkenen liegen am Doppelbindungs- nur 3 Bindungen vor (die Doppelbindung zählt nur einmal, da sie ja nur ENE Doppelbindung ist!). Der Bidnungswinkel beträgt \ / = / \ Die Doppelbindung ist nicht frei drehbar!
45 45 c) Bindungswinkel der Alkine Ein mit Dreifachbindung hat nur 2 Bindungen. Somit ist der maximale Abstand erreicht, wenn ein Bindungswinkel von 180 vorliegt! Die Dreifachbindung ist nicht drehbar!
46 46 Verschiedene graphische Darstellungsmöglichkeiten von organischen Verbindungen Organische Verbindungen sind im Aufbau komplex. Durch ihre dreidimensionalen Aufbau ist es schwierig, sie zweidimensional auf Papier darzustellen. ier eine Übersicht über verschiedene Darstellungsweisen: a) Summenformel: Die Summenformel beschreibt einfach die Summe der beteiligten Atome. Sie sagt nichts über den tatsächlichen Aufbau aus Ethan b) Konstitutionsformel/ Strukturformel Die Konstitutionsformel zeigt den einfachen, zweidimensionalen Aufbau der Verknüpfungen von Kohlenwasserstoffen. c) Strukturformel mit dreidimensionaler Darstellung n der Regel entspricht sie der Konstitutionsformel. Sie kann (bei einfachen Molekülen) auch dreidimensional gezeichnet sein (gestrichelte Linien ragen nach hinten, dicke Dreieckslinien ragen nach vorn - aus der Ebene hinaus). d) albstrukturformel (Kettenschreibweise) Propan: so-butan: 3-(3)-3 e) Skelettformel Bei dieser Schreibweise werden Wasserstoffe nicht gezeichnet, Kohlenstoffe, werden durch die Winkel angegeben. Bsp. 3-Methylhexan Weiter Möglichkeiten der dreidimensionalen Abbildung: Newmann-Projektion: Fischer-Projektion: aworth-formel:
47 47 Übung: m Benzin enthaltene Alkane und Alkine Benzin ist ein Gemisch. Es enthält mehrere verschiedene Alkane, ykloalkane, Alkene und ycloalkene. ier ein Ausschnitt eines typischen Benzins: Aufgaben: 1. Ordne die folgenden Namen den einzelnen Verbindungen zu: 1,3 Diethyl-cyclo-pentan, 2,4,5 Trimethyl-heptan, 1,2 Dimethyl-cyclohexan, 3,4, Dimethyl-octan, 3 sopropyl-hexan, Oktan, Benzol (=ex-1,3,5-trien), eptan, 2,2,4 Trimethyl-heptan, 1,3,5 Trimethylbenzol, 3 Methyl-pentan, sopropyl-4-propyl-benzol, 4 Ethyl-3 methyl-heptan, 3,4 Dimethyl-heptan, (1-Methyl-propyl)-cyclopentan, sobutyl-benzol. 2. Stelle eine ypothese für die unterschiedliche Zusammensetzung des Gemisches Benzin auf. 3. Erkündige Dich über die Oktanzahl. Ein Tipp dazu: n-heptan hat die Oktanzahl 0, iso-oktan die Oktanzahl 100.
48 48 racken von langkettigen Kohlenwasserstoffen Die wichtigsten Rohstoffe, welche aus Erdöl gewonnen werden sind v.a. Treibstoffe wie Benzin und Diesel sowie kurzkettige (2-4) Kohlenwasserstoffe zur Kunststoffproduktion. Da die Zusammensetzung von Erdöl unterschiedlich ist und der prozentuale Anteil an Benzin, Diesel und kurzkettigen Kohlenwasserstoffen in Erdöl (natürlich) nicht ausreicht, die menschliche Nachfrage zu decken, benötigt man ein Verfahren, um aus den kaum nutzbaren langkettigen Kohlenwasserstoffketten dringend benötigt kurzkettige, herzustellen. Ein Verfahren dazu ist das so genannte racken. m Grunde wird eine lange Kohlenwasserstoffkette dabei durch Erhitzen auf ca. 800 (oder durch einen Katalysator bei ca. 450 ) in mehrere Kürzere zerschnitten. Dies funktioniert deshalb so einfach, da die Kohlenstoffatome bei solche hohen Temperaturen derart stark schwingen, so dass die Ketten reißen. Zu beachten ist, dass an den Bruchstellen von langkettigen Alkanen jeweils 2- Glieder vorliegen. Daraus folgt, dass die neuen Kettenenden der entstehenden Bruchstücke allerdings nicht immer 3-Enden haben können! (da ja Wasserstoffatome fehlen)3. Als Konsequenz entstehen beim racken immer auch Alkene. Durch anschließende Reaktion mit Wasserstoff, können daraus aber Alkane gebildet werden. Beispiel: racken von exadecan \ / = / \ \ = / \ = / Zusatzinformationen: 3 bei komplexen Verfahren können zusätzliche Wasserstoffe natürlich später an die Doppelbindungen addiert werden
49 49 Wiederholungsaufgaben zur Kohlenstoffverbindungen sowie zu organischen hemie 1. Vergleiche Diamant und Graphit hinsichtlich ihrer Eigenschaften und dem Aufbau. 2. Was versteht man unter der hemie des Kohlenstoffs. Auf wen geht die Auftrennung der hemie in organische und anorganische hemie zurück? 3. Beschreibe die Verbrennung organischer Substanzen am Beispiel der Verbrennung von Benzin (zur Vereinfachung Octan). Stelle eine Reaktionsgleichung auf und formuliere einen Merksatz, der dies für alle organischen Substanzen zusammenfasst. 4. Stelle die RG für die Verbrennung von Methan, Ethan und Propan auf 5. Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.b. Benzin oder Alkohol) aus? 6. Welche Konsequenzen ergeben sich aus der Reaktionsgleichung in 3. und 4. für unsere Umwelt? 7. Was versteht man unter einer Atombindung? Zeichne die Atombindung zwei Sauerstoffatome. 8. Zeichne die folgenden Verbindungen als Valenzstrichformel: 2, O2, N2, l2, l, O, 2O, 4, O2 9. Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel. 10. Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane? 11. a) Welche Summenformel haben yclo-alkane b) Alkene mit zwei Doppelbindungen)? 12. Erkläre den Begriff somer. Zeichne dann alle somere von exan. 13. Wie erklärst Du Dir die Vielfalt der organischen Verbindungen? 14. Nenne 10 Stoffe in denen Kohlenstoff enthalten ist 15. Wie kann man Kohlenstoff chemisch nachweisen? Beschreibe ein Experiment mit Aufbau. 16. Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.b. Benzin oder Alkohol) aus? 17. Kohlenstoff steht in der 4. G. Wie viel Atombindungen kann ein Element der 4. G nur haben? 18. Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel 411O an! 19. Stelle die Valenzstrichformeln der folgenden Verbindungen auf: a) alle Dir bekannten Säuren b) Methan, eptan, 26, 614, 410, 920, 24, 612, Wiederhole die Regeln der Genfer Nomenklatur. 21. Zeichne: 2,2 Dimethyl-propan; 2,3,4 Trimethyl-penten; 4,4 Dimethyl-heptan 22. Unter welchen Bedingungen konnten sich Erdgas und Erdöl bilden. Beschreibe den Vorgang. 23. Norddeutsches Erdgas enthält auch Schwefelwasserstoff. Welche Gefahren würden auftreten, wenn dieser Bestandteil nicht vor der Verbrennung heraus gewaschen würde? Begründe mit einer Reaktionsgleichung! 24. Woran liegt es, dass die Zusammensetzung des Erdöls aus verschiedenen Ländern unterschiedlich ist? 25. Erkläre den Begriff somer und stelle alle somere von exan auf 26. Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel 49O an! 27. Zeichne die folgenden Strukturformeln und benenne die Substanzen: a) 3-l2 b) 25O c) 3-3O d) 23Br e) 37l f) 66 g) 38 h) 35l i) 34OO j) 33O k) Ethanol l) (3)33 m) 2=(3)2F n) 3-2-Br o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhex-3-en q) 4,4, Dimethyl eptan r) 2,3,4 Trimethyl Penten s) t) 3-=-=-3 u) 2,2 Dimethyl Propan 28. Begründe, warum es in der organischen hemie eine theoretisch unendliche Anzahl an Verbindungen gibt. 29. Warum ist Kohlenstoff immer vierbindig und warum darf Wasserstoff nur eine Bindung haben? Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus? 30. Nenne 10 Stoffe in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man alogene in Kohlenwasserstoffen nachweisen?) 31. Vervollständige die Tabelle: Stoffklasse Alkan Alken Alkin alogenalkane Alkohol arbonsäure funktionelle Gruppe Endung Beispiel -
Kapitel 6: Organische Verbindungen mit funktionellen Gruppen
 Kapitel 6: rganische Verbindungen mit funktionellen Gruppen 2 nhalt Kapitel 6: rganische Verbindungen mit funktionellen Gruppen... 1 nhalt... 2 Übersicht über wichtige Stoffklassen der organischen Chemie...
Kapitel 6: rganische Verbindungen mit funktionellen Gruppen 2 nhalt Kapitel 6: rganische Verbindungen mit funktionellen Gruppen... 1 nhalt... 2 Übersicht über wichtige Stoffklassen der organischen Chemie...
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Organische Chemie - 4 - Kohlenstoff als Bindungspartner. Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
GRUNDWISSEN CHEMIE 10. KLASSE
 Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
Grundwissen 10. Klasse NTG 1
 Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe
 Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Alkohole Brüder des Wassers
 6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
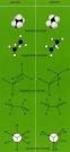 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Die Alkane. Anna Heynkes. 22.6.2005, Aachen. 1 Was sind Alkane 1. 2 Verwendung der Alkane 1. 3 Einige Eigenschaften der Alkane 2
 Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Zur Benennung organischer Moleküle
 Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Chemie in der Einführungsphase am CFG
 Einteilung organischer Verbindungen in Stoffklassen Übersicht 1. Was ist Organische Chemie? 2. Kohlenstoffwasserstoffe/Alkane 3. Alkohole 4. Vom Alkohol zum Aromastoff - Um 1806: BERZELIUS (1779 1848):
Einteilung organischer Verbindungen in Stoffklassen Übersicht 1. Was ist Organische Chemie? 2. Kohlenstoffwasserstoffe/Alkane 3. Alkohole 4. Vom Alkohol zum Aromastoff - Um 1806: BERZELIUS (1779 1848):
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
ORGANISCHE CHEMIE. Prof. Dipl.-Ing. Manfred SUSSITZ. Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt
 ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
Auswahlverfahren Medizin Prüfungsgebiet Chemie. 5.Termin Organische Chemie
 Auswahlverfahren Medizin Prüfungsgebiet Chemie 5.Termin Organische Chemie Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 1 Merkmale organischer Verbindungen Verbindungen des Kohlenstoffs Ausnahmen:
Auswahlverfahren Medizin Prüfungsgebiet Chemie 5.Termin Organische Chemie Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 1 Merkmale organischer Verbindungen Verbindungen des Kohlenstoffs Ausnahmen:
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur
 Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
10.1. Was versteht man unter einem Orbital? 10.2
 10.1 Was versteht man unter einem Orbital? Ein Orbital ist ein dreidimensionaler Aufenthaltsraum für maximal 2 Elektronen, in dem diese sich mit 99% Wahrscheinlichkeit aufhalten. Je nach Energiestufe ist
10.1 Was versteht man unter einem Orbital? Ein Orbital ist ein dreidimensionaler Aufenthaltsraum für maximal 2 Elektronen, in dem diese sich mit 99% Wahrscheinlichkeit aufhalten. Je nach Energiestufe ist
Clara Schumann -Gymnasium Grundlagen der organischen Chemie
 1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Grundwissen der 10.Klasse NTG
 Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2
 A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Zahl der C-Atome Allgemeine Summenformel C n H 2n+ ₂
 1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
Chemiegrundwissen. 1. Atombau Bohrsches Atommodell Elemente, PSE, Hauptgruppen Elektronegativität
 hemiegrundwissen 1. Atombau Bohrsches Atommodell Elemente, PSE, auptgruppen Elektronegativität 2. Element, Verbindung Gemisch Unterschied Reinstoff, Gemisch Salze Ionen aus Metall-Nichtmetall Salze in
hemiegrundwissen 1. Atombau Bohrsches Atommodell Elemente, PSE, auptgruppen Elektronegativität 2. Element, Verbindung Gemisch Unterschied Reinstoff, Gemisch Salze Ionen aus Metall-Nichtmetall Salze in
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Stationenlernen Chemie im Paket. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Funktionelle Gruppen Alkohol
 Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Organische Chemie. Maximilian Ernestus
 rganische hemie Maximilian Ernestus Inhaltsverzeichnis 1 rganische hemie 2 1.1 Wichtige Eigenschaften von Kohlenstoff..................... 2 1.2 Alkane....................................... 3 1.2.1 Isomere..................................
rganische hemie Maximilian Ernestus Inhaltsverzeichnis 1 rganische hemie 2 1.1 Wichtige Eigenschaften von Kohlenstoff..................... 2 1.2 Alkane....................................... 3 1.2.1 Isomere..................................
Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel!
 Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel! Prof. Dr. Ivo C. Ivanov Einführung (interaktive Vorlesung) Die genaue Benennung organischer Verbindungen nach
Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel! Prof. Dr. Ivo C. Ivanov Einführung (interaktive Vorlesung) Die genaue Benennung organischer Verbindungen nach
Kapitel 02: Erdgas und Erdöl
 Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Alkane als Kraftstoffe
 Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Fossile Rohstoffe. Erdöl
 Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Christian-Ernst-Gymnasium
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 10 - MuG erstellt von der Fachschaft Chemie C 10.1 Molekülstruktur und Stoffeigenschaften Atombindung Die chemische Bindung,
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 10 - MuG erstellt von der Fachschaft Chemie C 10.1 Molekülstruktur und Stoffeigenschaften Atombindung Die chemische Bindung,
Grundwissen Chemie. 8. Jahrgangsstufe, Gruppe I
 Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
IUPAC Nomenklatur. Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten. Feld 2: Stammname der Verbindung
 Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Chemiefragen 10.Klasse:
 Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 10.Klasse: A) Organische Verbindungen Kohlenwasserstoffe B) Erdöl
Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 10.Klasse: A) Organische Verbindungen Kohlenwasserstoffe B) Erdöl
Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen. Atombindung, Nichtmetalle, Valenzelektronen, Bindende und
 Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen Atombindung, Nichtmetalle, Valenzelektronen, Bindende und 1.1 Verkürzte Schreibweisen 2 Freie Elektronenpaare,
Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen Atombindung, Nichtmetalle, Valenzelektronen, Bindende und 1.1 Verkürzte Schreibweisen 2 Freie Elektronenpaare,
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Grundwissen Chemie Klasse
 Grundwissen Chemie 8. 10. Klasse Grundwissen Chemie 8I Chemie Reinstoff und Gemisch Atome und Moleküle Chemische Reaktionen Analyse und Synthese Katalysatoren Luft Sauerstoff und Wasserstoff Redoxreaktionen
Grundwissen Chemie 8. 10. Klasse Grundwissen Chemie 8I Chemie Reinstoff und Gemisch Atome und Moleküle Chemische Reaktionen Analyse und Synthese Katalysatoren Luft Sauerstoff und Wasserstoff Redoxreaktionen
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
Alkansäuren. Nomenklatur & Vorkommen in der Natur
 Alkansäuren Nomenklatur & Vorkommen in der Natur Übersicht Allgemeines Nomenklatur Eigenschaften & Merkmale der Alkansäuren Bekannte Alkansäuren und ihre Salze und die Vorkommen in der Natur Allgemeines
Alkansäuren Nomenklatur & Vorkommen in der Natur Übersicht Allgemeines Nomenklatur Eigenschaften & Merkmale der Alkansäuren Bekannte Alkansäuren und ihre Salze und die Vorkommen in der Natur Allgemeines
Name Stoffklasse funktionelle Gruppe Schmelzpunkt Siedepunkt Aggregatzustand. Löslichkeit in Wasser
 1 Ether als Isomere der Alkohole Summenformel: 2 6 O O O Ethanol Alkohole ydroxylgruppe 114 78 flüssig in beliebigem Verhältnis mischbar Name Stoffklasse funktionelle Gruppe Schmelzpunkt Siedepunkt Aggregatzustand
1 Ether als Isomere der Alkohole Summenformel: 2 6 O O O Ethanol Alkohole ydroxylgruppe 114 78 flüssig in beliebigem Verhältnis mischbar Name Stoffklasse funktionelle Gruppe Schmelzpunkt Siedepunkt Aggregatzustand
Kohlenwasserstoffe. Homologe Reihe. Alkane. Alkene. HGA-Grundwissen Chemie-10. Klasse NTG
 GA-Grundwissen Chemie-10. Klasse NTG Kohlenwasserstoffe Sind eine Stoffgruppe von chemischen Verbindungen, die nur aus C- und - Atomen bestehen. Aufgrund des unpolaren Molekülbaus sind sie lipophil und
GA-Grundwissen Chemie-10. Klasse NTG Kohlenwasserstoffe Sind eine Stoffgruppe von chemischen Verbindungen, die nur aus C- und - Atomen bestehen. Aufgrund des unpolaren Molekülbaus sind sie lipophil und
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Systematische Nomenklatur
 Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Curriculum Chemie Klasse 10 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 10 Albert-Einstein-Gymnasium Ulm Klasse 10 Themen Kohlenwasserstoffe Alkane - Vorkommen, Eigenschaften und Molekülstruktur - Isomerie und Nomenklatur Kohlenwasserstoffe - Energieträger
Curriculum Chemie Klasse 10 Albert-Einstein-Gymnasium Ulm Klasse 10 Themen Kohlenwasserstoffe Alkane - Vorkommen, Eigenschaften und Molekülstruktur - Isomerie und Nomenklatur Kohlenwasserstoffe - Energieträger
Organische Chemie. IBPM 2005 Prof. Setzer 1. U I S B U R G E S S E N Campus Essen. IBPMInstitut für Bauphysik und Materialwissenschaft IBPM
 Institut für Organische Chemie 2005 Prof. Setzer 1 Anwendungsbeispiele Institut für Wiba-Net:Lehrpfad Kunststoffe 2005 Prof. Setzer 2 Anwendungsbeispiele Institut für Wiba-Net:Lehrpfad Kunststoffe 2005
Institut für Organische Chemie 2005 Prof. Setzer 1 Anwendungsbeispiele Institut für Wiba-Net:Lehrpfad Kunststoffe 2005 Prof. Setzer 2 Anwendungsbeispiele Institut für Wiba-Net:Lehrpfad Kunststoffe 2005
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Chemieschulaufgabe. Def. Chemische Bindung: Anziehungskräfte zwischen ungleichsinnig geladenen Teilchen.
 www.schlurcher.de.vu 1 Edited by Schlurcher Kohlenwasserstoffe Chemieschulaufgabe Struktur und Reaktivität der Kohlenwasserstoffe Def. Organische Chemie: Sie umfasst alle Verbindungen des Kohlenstoffs
www.schlurcher.de.vu 1 Edited by Schlurcher Kohlenwasserstoffe Chemieschulaufgabe Struktur und Reaktivität der Kohlenwasserstoffe Def. Organische Chemie: Sie umfasst alle Verbindungen des Kohlenstoffs
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
2. Alkane. Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
Grundwissenkarten Hans-Carossa- Gymnasium
 Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Benennung (Nomenklatur) von Alkanen. zusammengestellt von W. Habelitz-Tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S.
 Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
