UND IHRE KONFIGURATION.(1) Von Yuichi NAKATSUKA and Hirosi IINUMA. Eingegagen am 5. November Ausgegeben am 28. Februar 1936.
|
|
|
- Käthe Brauer
- vor 6 Jahren
- Abrufe
Transkript
1 48 UBER H. Iinuma. DIDIMETHYLGLYOXIM-DIAMMIN-KOBALT UND IHRE KONFIGURATION.(1) [ Vol. ]], No. 2 (III)-SALZE Von Yuichi NAKATSUKA Hirosi IINUMA. Eingegagen am 5. November Ausgegeben am 28. Februar Feigl Rubinstein(2) erhielten grune Kristalle von der Formel [Co (DH2) 2Cl2] (3) aus einer alkoholischen oder acetonischen Losung von Kobaltchlorid Dimethylglyoxim. Wenn man aber eine vollig wasserfreie acetonische Losung von frisch entwassertem Kobaltchlorid Dimethylglyoxim eindunsten lasst, so kristallisiert dagegen nach Thilo Heilborn(4) ein rotes mit dem Feiglschen grnnen Salz isomeres echtes Chlorid [Co (DH2) 2] Cl2 aus. Thilo Heilborn(4) haben uberdies festgestellt, dass im Feiglschen Salz zwei Chloratome trans-stellungen besetzen, also zwei Dimethylglyoxime plan konfiguriert sein miissen. Ausgehend von diesen beiden Salzen, haben wir in der vorliegenden Arbeit (1) einige neue Kobalt (III) -komplexsalze von der allgemeinen Formel [CoA2(DH)2]X(5) dargestellt, (2) die Konfiguration der (1) Gekiirzte Ubersetzung der schon in Japanisch veroffentlichten Arbeit, J. Chem. Soc. Japan, 55 (1934), 630. (2) Ann., 433 (1923), 183. Vgl. dazu Hieber u. Leutert, Ber., 60 (1927), 2296; Thilo u. Heilborn, Ber., 64 (1931), (3) DH2 = Dimethylglyoxim, DH = einwertiger Dimethylglyoximrest. (4) a.a.o. (5) A = NH3 bzw. einwertiges Amin; X = einwertiger Saurerest.
2 1936] Uber Didimethylglyoxim-diammin-kobalt (III)-salze ihre Konfiguration. 49 schon beschriebenen auch der von uns zum ersten Mal erhaltenen Salze dieser Reihe daraufhin bewiesen, dass zwei Dimethylglyoximreste immer sehr fest plan koordiniert sind, wie dies bei den zwei Dimethylglyoximen im Feiglschen Salz des zweiwertigen Kobalts der Fall ist. FrUhere Untersuchungen Uber die Salze der Reihe wurden fast alle von Tschugaeff (6) durchgefiihrt. Er erhielt [Co (NH3) 2(DH) 2] Cl aus [Co(NH3)6]Cl3 DimethylgIyoxim. Die eren Salze wurden im wesentlichen direkt aus den Bestteilen dargestellt, also z.b. [Copy2.(DH) 2] Cl durch Oxydation mittels Luftsauerstoffes einer Mischung alkoholhaltiger Losungen von Kobaltchlorid, Dimethylglyoxim Pyridin. Beato Brugger(7) erhielten 1929 Komplexsalze der Reihe (A = Anilin bzw. o- p-toluidin) direkt aus der alkoholischen Losung der Bestteile, aber sie benutzten die Salze als Nachweisreagenzien von Polysulfid bestimmten die Zusammensetzung selbst nicht. Wir haben uns der oben erwahnten Methode von' Beato Brugger bedient, d.h. eine gemischte alkoholische Losung von Kobaltchlorid DimethylgIyoxim wurde nach Zusatz von Amin mit Luft oxydiert. Auf these Weise haben wir zuerst das Chlorid, dann durch doppelte Umsetzung das Bromid, Jodid, Rhodanid, Nitrat, saure Sulfat neutrale Sulfat dargestellt. Als Amine wurden Ammoniak, Anilin, o- p-toluidin, m-xylidin, undα-β-naphthylamin gebraucht. Das von uns so erhaltene Salz [Co (NH3) 2(DH) 2] Cl war dasselbe wie das von Tschugaeff aus [Co (NH3) 6] Cl3 gewonnene. Wie im experimentellen Teil beschrieben wird, koordinieren alle these Amine ausserordentlich leicht am Zentralkobaltatom. Wenn nun ein Molekiil o-phenylendiamin als zweizahliger Lig anstelle von zwei A treten wurde, musste es sich natiirlich in cis-stellung binden, vorausgesetzt dass zwei Dimethylglyoximreste nicht plan konfiguriert sind. Ein solches Salz konnte aber nie erhalten werden, sondern immer trat ophenylendiamin als einzahliger Lig an das Kobaltatom wie in dem Salz [Coph2 (DH) 2] Cl(8). Daraus folgt, dass die zwei Dimethylglyoximreste in einer Ebene liegen infolgedessen zwei A in den Salzen [CoA_ (DH) 2] X trans-stellungen besetzen mnssen. Wir haben noch ein Salz von der Zusammensetzung Co (DH) 2Cl,ph erhalten. Dieses Salz enthalt aber kein ionogenes Chlor, was sich durch (6),,Gmelins (7) (8) Z. anorg. Chem., 46 (1905), 144; Ber., 39 (1906), Vgl. dazu noch Hbuch der anorganischen Chemie`, 58.B, S.276f. Anales Soc. Espanola Fisica Quim., 27 (1929), 822. ph = o-phenylendiamin.
3 50 H. Iinuma. [Vol. 11, No. 2, Schaumen beim Eintragen in konzentrierte Schwefelsaure erkennen lassen wiirde. Aus diesem Grunde hat das Salz die Formel [Coph (DH) 2Cl] nicht [Coph (DH) 2] Cl. Auch hier reagiert o-phenylendiamin als einzahliger Lig. Auch wenn man von dem Thiloschen roten Salz [Co (DH2) 2] Cl.2 ausgeht, kann man keine eren Salze der aligemeinen Formel [CoA2(DH) 2] Cl erhalten. Wenn man also z.b. nach Einleitung von trockenem Ammoniak in eine acetonische Losung von [Co (DH2) 2] Cl2 mit getrockneter Luft oxydiert, oder anstatt des Ammoniaks Anilin gebraucht, erhalt man immer dieselben Salze wie oben. Falls man o-phenylendiamin als Amin verwendet, scheiden sich zuerst gelbe Nadeln aus. Diese Kristalle verschwinden allmahlich mit dem Luftzutritt, es gelingt nicht, aus der Losung ein kristallinisches Komplexsalz zu erhalten. Diese gelben Nadeln haben die Formel [Coph (DH2) 2 (OH2) ] Cl2,CH3 CO CH3, worin Kobalt also zweiwertig ist. Denn dasselbe Salz wird ebenso erhalten, wenn man in einer Stickstoffatmosphare arbeitet. Auch ist das. Salz durch Sauren sehr leicht zersetzbar, wahrend Kobalt (III) -dimethylglyoxim-komplexsalze im allgemeinen bestig gegen Sauren sind. Das Salz verliert kein Gewicht im Vakuum fiber konzentrierter deutlich sauer in wassriger massen gedeutet werden : Schwefelsaure Losung. oder bei Diese Reaktion 110 kann reagiert folgender- [Coph(DH2)2(OH2)]Cl2 [Coph(DH2)2(OH)]Cl + HCl. Aus dem oben beschriebenen kann man schliessen, dass in alien bisher erhaltenen von uns neu dargestellten Kobalt (III) -komplexsalzen von der allgemeinen Formel [CoA2 (DH) 2] X zwei Dimethylglyoximreste sehr fest plan konfigurieren, daher zwei A trans-stellungen besetzen. Experimenteller Teil. Allgemeine Darstellungsmethoden der Sake [CoA2(DH)2]X. Zur Darstellung des Chlorids Post man I g. kristallisiertes Kobaltchlorid in 15 c.c. warmem Alkohol, der 1 g. Dimethylglyoxim gelost enthalt. Nach dem Erkalten tragt man etwa 4 Mole Amin auf 1 Mol Kobaltchlorid ein -oxydiert das Gemisch 5 Minuten lang durch einen starken Luftstrom oder Iasst 30 Minuten unter haufigem Umriihren an der Luft stehen. Das Chlorid, das sich sehr leicht ausscheidet, wird nach dem Abfiltrieren aus warmem Wasser umkristallisiert. Fiigt man dabei etwas Natriumchlorid hinzu, so wird das Salz mit besserer Ausbeute erhalten. Das Bromid, Jodid, Rhodanid bzw. Nitrat kristallisiert mit guter Ausbeute aus einer warmen konzentrierten Losung.des Chlorids beim Zusatz eines Oberschusses an Kaliumbromid, Kaliumjodid, Kaliumrhodanid bzw. Natriumnitrat.
4 1936] fiber DidimethyIglyoxim-diammin-kobalt (III)-salze ihre Konfiguration. 51 Auf these Weise kann man jedoch das Sulfat wegen seiner grossen Loslichkeit nicht rein erhalten. Wenn man eine alkoholische oder acetonische Losung von Dimethylglyoxim Amin, in welcher gepulvertes kristallisiertes Kobaltsulfat suspendiert ist, mit Luft oxydiert, erhalt man unreines Sulfat. Um daraus das Sulfat rein darzustellen, ist es empfehlenswert, iiber das saure Sulfat zu gehen. Wenn man also zu einer konzentrierten Losung des unreinen Sulfates halbkonzentrierte Schwefelsaure im Uberschuss fugt, so kristallisiert reines saures Sulfat in guter Ausbeute aus. Dasselbe saure Sulfat erhalt man auch, wenn man eine konzentrierte warme Losung des Chlorids oder das in wenig Wasser suspendierte Chlorid mit Schwefelsaure reagieren lasst. Fiigt man zu dem in moglichst wenig Wasser eingetragenen sauren Sulfat die berechnete Menge oder einen geringen f)berschuss an Natriumkarbonatlosung lasst das Gemisch erkalten oder versetzt es mit etwas Natriumsulfat, so scheidet sich das neutrale Sulfat rein aus. DidimethyIglyoxim-diammin-kobalt (III)-sale. Die Darstellungsmethode ist die gleiche wie die oben angegebene allgemeine Vorschrift, wobei Ammoniak als konzentrierte Losung gebraucht wird. Dabei scheiden sich gelbe Nadeln aus. Aus Wasser umkristallisiert, erhalt man sie rein als viereckige Tafeln. Gut loslich in Wasser, in Alkohol etwas loslich. Co, 13.12; H2O, Ber. fur No (NH3)2(DH)2]Cl,5H2O: Co, 13.15; H2o, 20.04%.) Gelbe Tafeln, schlecht loslich in Wasser Alkohol. Co, Ber. fiir [Co(NH3)2(DH)2]Br: Co, 14.64%.) Gelbe Nadeln, schwer loslich in Wasser, Alkohol Aceton. Co, Ber. fir [Co(NH3)2(DH)2]I: Co, 13.12%.) Gelbe Schuppen, schwer loslich wie das Co, 14.81; H20, Ber. fiir [Co(NH3)2(DH)2]SCN,H2O: Co, 14.80; H2O, 4.66%.) Gelbe Nadeln, ziemlich gut loslich in Wasser, schwer in Alkohol. Co, Ber. fur [Co(NH3)2(DH)2]NO3: Co, 15.33%.) DidimethyIglyoxim-dianilin-kobalt (III)-saize. Zuerst als Nadeln erhaltlich; aus Wasser umkristallisiert gelbbraune Prismen, ziemlich gut loslich in Wasser, Alkohol, Aceton. Co, 10.18; H2O, Ber. fur [Co(C6H7N)2(DH)2]Cl,4H2O: Co, 10.12; H2O, 12.35%.) Nadeln, nicht gut loslich in Wasser Alkohol. Co, 10.70; N, Ber. Par [Co(C6H7N)2(DH)2Br: Co, 10.63; N, 15.13%.) Braune Nadeln, wenig loslich in Wasser Alkohol. Co, 9.76; N, Ber. Air [Co(CBH7N)2(DH)2]I: Co, 9.81; N, 13.95%.) Tafeln, schwer loslich in Wasser. Co, 10.45; N, 17.79; H2O, Ber. fiir [Co(C6H7N)2(DH)2]SCN,H2O: Co, 10.70; N, 17.78; H2O, 3.27%.) Nadeln, nicht gut loslich in Wasser Alkohol. Co, 11.08; H2O, Ber. fiir [Co(CBH7N)2(DH)2]NO3,2H20: Co, 10.97; H2O, 6.29%.) Graubraune Tafeln, ziemlich gut loslich in Wasser, wenig in Alkohol Aceton. Co, 9.69; SO,, 15.98; N, 13.83; H2O, Ber. fir [Co(C6H7N)2(DH)2]2SO,,H2SO4,31/2 H2O: Co, 9.79; SO,, 15.88; N, 13.90; H2O, 5.30%.) Neutrales Sulfat. Gelbe Saulen, sehr gut loslich in Wasser, auch gut in Alkohol. Co, 10.09; N, 14.60; H2O, Ber. Air [Co(CBH7N)2(DH)2]2SO4,7H2O: Co, 10.05; N, 14.34; H2O, 10.73%.)
5 52 H. Iinuma. [Vol. 11, No. 2, Didimethylglyoxim.di-o-toluidin-kobalt(III)-salze. Sechseckige Prismen, ziemlich gut loslich in Wasser Alkohol. Co, 9.69; H2O, Ber. Par [Co(C,H9N)2(DH)2]Cl,4H2O: Co, 9.67;H2O, 11.80%.) Saulen, wenig loslich in Wasser. Co, 9.76; H2O, Ber. fur [Co(C,HsN)2(DH)2]Br, H2O: Co, 9.82;H2O, 2.99%.) Nadeln, schwer loslich in Wasser. Co, 9.36; N, Ber. fur [Co(C,H9N)2(DH)2]I: Co, 9.38; N, 13.32%.) Nadeln, schwer loslich in Wasser. Co, 10.37; N, 16.87; MO, Ber. fur [Co(C7H9N)2(DH)2]SCN,H2O: Co, 10.19; N, 16.90; H2O, 3.11%.) Braune Saulen, nicht gut loslich in Wasser Alkohol. Co, 10.52; N, Ber. fur [Co(C7H9N)2(DH)2]NO3: Co, 10.44; N, 17.35%.) Braune Prismen, gut loslich in Wasser. Co, 9.40; SO4, 15.97; N, 13.77; H2O, Ber. fur [Co(C,H9N)2(DH)2]2SO4,H2SO4,2H2O: Co, 9.56; SO4, 15.35; N, 13.61; H2O, 2.92%.) Neutrales Sulfat. Gelbe Nadeln, sehr gut loslich in Wasser. Co, 9.02; N, 12.87; H2O, Ber. Mr [Co(C,H9N)2(DH)2]2SO4,12H2O: Co, 8.96; N, 12.73; H2O, 16.37%.) Didimethylglyoxim-di-p-toluidin.kobalt(III)-salze. Braune Saulen, ziemlich gut loslich in Wasser, wenig in Alkohol Aceton. Co, 10.68; H2O, Ber. fur [Co(C,H,N)2(DH)2]Cl,H2O: CO, 10.59; H4O, 3.24%.) Co, Ber. fur [Co(C7H9N) 2(DH)2]Br: Co, 10.12%.) Co, 9.46; N, Ber. Mr [Co(C7H4N)2(DH)2]I: Co, 9.37; N, 13.47%.) Co, 10.63; N, Ber. fiir [CO(C7H9N)2(DH)2]SCN: Co, 10.51; N, 17.45%.) Braune rautenformige Tafeln, ziemlich gut loslich in Wasser. Co, Ber. fur [Co(C7H8N)2(DH)2]NO3: Co, 10.44%.) Rotbraune sechseckige Prismen, gut loslich in Wasser. Co, 8.74; SO4, 17.91; N, 12.01; H2O, Bet. Air [Co(C,H,N)2(DH)2]2SO4, 1 1/2 H2SO4,7H20: Co, 8.59; SO4, 17.46; N, 12.22; H2O, o.) Neutrales Sulfat. Rotbraune Saulen, sehr gut loslich in Wasser. Co, 9.18; H20, Ber. fur [Co(C7H9N)2(DH)2]2SO4,10H2O: Co, 9.20; H2O, 14.04%.) Freie Base. Aus der Losung des Chlorids oder Sulfats der Reihe mit i1berschussigem Alkali als gelbbraune flache Saulen erhaltlich, schwer loslich in Wasser, wenig in Aceton, gut in Alkohol. Co, 10.70; H2O, Ber. fiir [Co(C7H8N)2(DH)2]OH,2H2O: Co, 10.61; H2O, 6.48%.) Didimethylglyoxim-di-m-xylidin-kobalt (III)-salze. Braune Saulen, ziemlich gut loslich in Wasser, Alkohol, Aceton. Co, 9.70; H2O, Ber. fur [Co(C8H11N)2(DH)2]Cl,2H2O: Co, 9.80; H9O, 5.98%.) Co, 9.59; N, Ber. Air (Co(C8H11N)2(DH)2]Br: Co, 9.66; N, 13.74%.) Saulen. Co, 8.80; H2O, Ber. fur [Co(C8H11N)2(DH)2]I,H2O: Co, 8.73; H2O, 2.66%.) Co, 9.84; N, Ber. fur [Co(C8H11N)2(DH)2]SCN: Co, 10.00; N, 16.63%.)
6 1936] Uber Didimethylglyoxim-diammin-kobalt (III)-saize ihre Konfiguration. Braune Prismen. Co, 9.85; H2O, [Co(C8H11N) (DH)2]NO3,H2O: Co, 9.66; H2O, 2.95%.) Sulfat. Entgegen der allgemeinen Vorschrift kann man dieses Salz dem unreinen Sulfat durch Umkristallisieren aus Alkohol Wasser Gelbe Tafeln, sehr gut loslich in Wasser. Co, 9.12; N, 12.98; H2O, fur [Co(C8H11N)2(DH)2]2SO4,71/2H2O: Co, 9.13; N, 12.97; H2O, 10.43%.) Ber. 53 fiir direkt aus darstellen Ber. Didimethylglyoxim-di-anaphthylamin-kobalt(III)-saize. Rotbraune Nadeln, ziemlich gut loslich in warmem Wasser. Co, 9.07; H20, Ber. fur [Co(CmH9N)2(DH).]Cl,2H2O: Co, 9.13; H2O, 5.60%.) Rotbraune Nadelchen. Co, 8.48; H2O, Ber. fur [.Co(C10H9N)2(DH)2]Br,2H2O: Co, 8.53; H2O, 5.21%.) Rotbraunes Pulver. Co, 8.22; H2O, Ber. fur [CoMAN) 2(DH)2]I,1/2H2O: Co, 8.30; H2O, 1.27%.) s Pulver, schwer Ioslich in Wasser. Co, 9.41; N, Ber. fur [Co(C ohon)2(dh)2]scn: Co, 9.32; N, 15.49%.) Rotbraune Saulen, wenig loslich in Wasser Alkohol, praktisch unloslich in iiberschiissiges Nitrat enthaltendem Wasser. Co, 8.90; H2O, Ber. fiir [Co(C10H9N)2(DH)2]NO3,11/2H2O: Co, 8.88; H2O, 4.07%.) Rotbraune Co, 8.52; SO4, 14.40; N, Ber. fur [Co(C10H9N)2(DH)2]2SO4,H2SO4: Co, 8.77; SO4, 14.27; N, 12.50%.) Neutrales Sulfat. Rotbraunes Pulver. Co, 8.32; N, 11.93; H2O, Ber. fur [Co(C10H9N)2(DH)2]2SO4,9H2O: Co, 8.38; N, 11.94; H2O, 11.51%.) D:dimethylglyoxim-di-(i-naphthylamin-kobalt(III)-salze. Gelbe Co. 9.33; H2O, Ber. fur [Co(C10H9N)2(DH)2]Cl,H2O: Co, 9.39; H2O, 2.86%.) Co, 8.40; H2O, Ber. fur [Co(C10H9N)2(DH)2]Br,3H2O: Co, 8:32; H4O, 7.62%.) Braunes Pulver. Co, 8.38; H2O, Ber. fur [Co(C10H9N)2(DH)2] I,1/2H2O: Co, 8.30; H20, 1.27%.). Braune Prismen. Co, 9.20; H2O, Ber. fur [Co(C10H9N)2(DH)2]SCN,1/2H2O: Co, 9.19; H2O, 1.40%.) Nadelchen, ziemlich gut loslich in Wasser. CO, 8.40; H2O Ber. fur [Co(C10H9N)2(DH)2]NO3,4H2O: Co, 8.32; H2O, 10.15%.) Co, 8.60; SO4, 13.68; N, 11.97; H2O, Ber. fiir [Co(C10H9N)2(DH)2]2SO4,H-SO4,21/2H2O: Co, 8.50; SO4, 13.80; N, 12.09; H2O, 3.24%.) Neutrales Sulfat. Man fallt eine warme Losung, die auf 10 c.c. Wasser 1 g. des sauren Sulfates enthalt, tropfenweise mit etwas weniger der berechneten Menge Natriumkarbonatlosung. Nach dem Erkalten kristallisiert das Salz in gelben Saulen aus. Sehr gut loslich in Wasser. Co, 8.67; H2O; Ber. fur [Co(C10H9N)2(DH)2]2SO4,7H2O: Co, 8.60; H2O, 9.18%.) Freie Base. Erhaltlich wie die entsprechende p-toluidinverbindung als schwer losliche gelbe Schuppen. Co, 9.55; N, 13.69; H2O, Ber. fur [Co(C10H9N)2(DH)2]OH,2H2O: Co, 9.40; N, 13.36; H2O, 5.73%.) Didimethylglyoxim-di-o-phenylendiamin-kobalt(III)-chlorid. Losung, die auf 30 c.c. Alkohol 1 g. kristallisiertes Kobaltchlorid Man tragt in eine 1 g. Dimethylgly-
7 54 H. Iinuma. [Vol. 11, No. 2, oxim enthalt, 1 g. o-phenylendiamin ein, oxydiert das Gemisch mit Luft. Das ausgeschiedene Salz wird aus Wasser umkristallisiert. Es bildet in Wasser sehr gut losliche, schwarzbraune Kristalle. In konzentrierte Schwefelsaure eingeworfen, schaumt es heftig als Kennzeichen eines echten Chlorides. ( Gef.: Co, 9.74; N, 18.63; H2O, Ber. fur [Coph2(DH)2]Cl,4H2O: Co, 9.63; N, 18.30; H2O, 11.76%.) Chloro-didimethylglyoxim-o-phenylendiamin-kobalt (III). Nach Zusatz von 0.4 g. o-phenylendiamin 2 c.c. norm. Atznatron zu 20 c.c. Alkohol, der 1 g. kristallisiertes KobaItchlorid 1 g. Dimethylglyoxim gelost enthalt, leitet man in die Losung sehr lange Luft ein. Die erhaltene Kristalle werden mit etwas Wasser gewaschen aus Methanol umkristallisiert. Rotbraune Tafeln, schwer loslich in Wasser, ziemlich gut in Alkohol. Reaktion mit konzentrierter Schwefelsaure zeigt, dass das Salz kein ionogenes Chlor enthalt. Bei der trockenen Destillation gibt das Destillat die Jodoformreaktion. Co, 12.23; Cl, 7.82; C2H5OH,9.53. Ber. fur [Coph(DH)2Cl], C2H5OH:Co, 12.22; Cl, 7.42; C2H5OH,9.61%.) Didimethylglyoxim-aquo-o-phenylendiamin-kobalt(II)-chlorid. Man lost 0.5 g. frisch entwassertes Kobaltchlorid 1.2 g. Dimethylglyoxim in 20 c.c. vollig wasserfreiem Aceton, fi gt dazu 0.4 g. in wenig wasserfreiem Aceton gelostes o-phenylendiamin. Reibt man einige Zeit die Gefassw, so scheiden sich gelbe Nadeln mit guter Ausbeute aus, die in Methanol gelost unter Zusatz von Ather gefallt werden konnen. Sehr gut loslich in Alkohol, schwer loslich in Wasser, jedoch mit deutlich saurer Reaktion. Durch Sauren sofort zersetzbar; reagiert mit konzentrierter Schwefelsaure als echtes Mittels der Jodoformreaktion ist Aceton nachweisbar. Co, 10.73; Cl, 12.82; N, Ber. fur [Coph(DH2)2(OH2)]Cl2, CH3-CO.CH3:Co, 10.80; Cl, 13.00; N, 15.36%.) Zusammenfassung. Komplexsalze der allgemeinen Formel [CoA2 (DH) 2] X, in denen A Ammoniak, Anilin, o- p-toluidin, m-xylidin, bzw. a- f-naphthylamin, X Cl, Br, J, SCN, NO3 bzw. 1/2SO4 ist, wurden dargestellt. Gleichzeitig wurden einige verwte Verbindungen dargestellt. Es wurde gezeigt, dass, wenn o-phenylendiamin als A gebraucht wird, dieses zweiwertige Amin nie als zweizahliger Lig reagiert, sondern immer einzahlig ist, woraus wir schlossen, dass zwei Dimethylglyoximreste in den Komplexsalzen sehr fest plan konfigurieren mi ssen. Herrn herzlichem S. Murayama sind wir fur seine Hilfe bei dieser Dank verpflichtet. Chemisches Laboratorium der Universitdt zu Taihoku. Arbeit zu
Trisacetylacetonatoferrat(III) Fe(acac) 3
 Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
7. Studieneinheit. Siebte Studieneinheit
 86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
33. Synthese der r-substituierten Pyridinderivaten.
 No. 3.1 141 33. Synthese der r-substituierten Pyridinderivaten. Eiji OCHIAI, Takanobu ITAI and Kinzaburo YosHINO. Pharmazeutische Institut, Kaiserlichen Universitat, Tokyo. (Comm. by Y. ASAHINA, M.I.A.,
No. 3.1 141 33. Synthese der r-substituierten Pyridinderivaten. Eiji OCHIAI, Takanobu ITAI and Kinzaburo YosHINO. Pharmazeutische Institut, Kaiserlichen Universitat, Tokyo. (Comm. by Y. ASAHINA, M.I.A.,
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
BASEN KOORDINIEREN.(1) Von Yuichi NAKATSUKA. Eingegangen am 1. Juli Ausgegeben am 28. Oktober 1936.
 UBER KOBALTIAMMINE, DIE QUARTARE BASEN KOORDINIEREN.(1) AMMONIUM- Von Yuichi NAKATSUKA. Eingegangen am 1. Juli 1936. Ausgegeben am 28. Oktober 1936. Wahrend meines Studium uber Aquokobaltiammine babe ich
UBER KOBALTIAMMINE, DIE QUARTARE BASEN KOORDINIEREN.(1) AMMONIUM- Von Yuichi NAKATSUKA. Eingegangen am 1. Juli 1936. Ausgegeben am 28. Oktober 1936. Wahrend meines Studium uber Aquokobaltiammine babe ich
3. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 3. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 3. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Zusammenfassung: Säure Base Konzept
 Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
5 Chemisch-experimenteller Teil
 5 Chemisch-experimenteller Teil 113 5 Chemisch-experimenteller Teil 5.1 Allgemeine Angaben Schmelzpunkt-Bestimmung Lindström-Gerät (unkorrigiert) Elementaranalysen Elementar Vario EL IR-Spektren Perkin-Elmer
5 Chemisch-experimenteller Teil 113 5 Chemisch-experimenteller Teil 5.1 Allgemeine Angaben Schmelzpunkt-Bestimmung Lindström-Gerät (unkorrigiert) Elementaranalysen Elementar Vario EL IR-Spektren Perkin-Elmer
Tris(acetylacetonato)cobalt(III)
 Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Dissoziation, ph-wert und Puffer
 Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Analytische Chemie. B. Sc. Chemieingenieurwesen. 15. März 2017, Uhr. Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
3011 Synthese von erythro-9,10-dihydroxystearinsäure aus Ölsäure
 311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Carbonat, Hydrogencarbonat
 Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Qualitative anorganische Analyse
 Qualitative anorganische Analyse Grundprinzip: nicht Stoffe (chemische Verbindungen) werden nachgewiesen, sondern die Ionen, aus denen sie aufgebaut sind Ergebnisform: (auf einem A4 oder A5 Blatt mit Namen,
Qualitative anorganische Analyse Grundprinzip: nicht Stoffe (chemische Verbindungen) werden nachgewiesen, sondern die Ionen, aus denen sie aufgebaut sind Ergebnisform: (auf einem A4 oder A5 Blatt mit Namen,
3.Präparat / Versuch 8.3
 .Präparat ersuch 8. Herstellung von Nitropentainkobalt(III)-chlorid ([NH ) 5 NO ]Cl ) 1. Herstellungsvorschrift: (Quelle 1, ) Es sollen g Nitropentainkobalt(III)-chlorid hergestellt werden. a) Herstellung
.Präparat ersuch 8. Herstellung von Nitropentainkobalt(III)-chlorid ([NH ) 5 NO ]Cl ) 1. Herstellungsvorschrift: (Quelle 1, ) Es sollen g Nitropentainkobalt(III)-chlorid hergestellt werden. a) Herstellung
Laborprotokoll Qualitative Analyse Ralph Koitz, Einzelsalz
 1. Einzelsalz Aufgabenstellung: Nasschemische qualitative Analyse eines anorganischen Einzelsalzes. o Farblose, grobkörnige Kristalle o Flammenfärbung: leicht orange, nicht charakteristisch da vermutlich
1. Einzelsalz Aufgabenstellung: Nasschemische qualitative Analyse eines anorganischen Einzelsalzes. o Farblose, grobkörnige Kristalle o Flammenfärbung: leicht orange, nicht charakteristisch da vermutlich
REDOX-REAKTIONEN Donator-Akzeptor-Konzept! So geht s: schrittweises Aufstellen von Redoxgleichungen Chemie heute
 REDOXREAKTIONEN In den letzten Wochen haben wir uns mit SäureBaseReaktionen und Redoxreaktionen beschäftigt. Viele Phänomene in uns und um uns herum sind solche Redoxreaktionen. Nun müssen wir unseren
REDOXREAKTIONEN In den letzten Wochen haben wir uns mit SäureBaseReaktionen und Redoxreaktionen beschäftigt. Viele Phänomene in uns und um uns herum sind solche Redoxreaktionen. Nun müssen wir unseren
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
1.5 Säuren und Basen und der ph-wert
 Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Chemie: Nachweisreaktionen
 Chemie: Nachweisreaktionen 1. Nachweis von Elementen und Verbindungen a) Nachweis von Wasserstoff Wasserstoff H2 Nachweis: Knallgasprobe Durchführung: verschlossenes Reagenzglas wird waagerecht mit der
Chemie: Nachweisreaktionen 1. Nachweis von Elementen und Verbindungen a) Nachweis von Wasserstoff Wasserstoff H2 Nachweis: Knallgasprobe Durchführung: verschlossenes Reagenzglas wird waagerecht mit der
Kapiteltest 1.1. Kapiteltest 1.2
 Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Organische Chemie Bausatz mit 109 Atomen Best.- Nr. MT00206
 Organische Chemie Bausatz mit 109 Atomen Best.- Nr. MT00206 1. Beschreibung Der Bausatz gestattet die Darstellung von Basismolekülen der modernen Chemie sowohl in einer Kompaktform als auch in einer Form,
Organische Chemie Bausatz mit 109 Atomen Best.- Nr. MT00206 1. Beschreibung Der Bausatz gestattet die Darstellung von Basismolekülen der modernen Chemie sowohl in einer Kompaktform als auch in einer Form,
4. Isomerie von Komplexverbindungen
 4. Isomerie von Komplexverbindungen 4. Isomerie bei Koordinationsverbindungen Grundsätzlich unterscheidet man Konstitutionsisomerie Strukturisomerie) und Stereoisomerie (Konfigutationsisomerie). Konstitutionsisomerie:
4. Isomerie von Komplexverbindungen 4. Isomerie bei Koordinationsverbindungen Grundsätzlich unterscheidet man Konstitutionsisomerie Strukturisomerie) und Stereoisomerie (Konfigutationsisomerie). Konstitutionsisomerie:
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6
 Prof. A. Togni, D-CHAB, HCI H 239 Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6 Säure-Base-Gleichgewichte E 1. Sie möchten 200 ml einer Pufferlösung mit ph = 5.00 mit dem Säure-Base-Paar Essigsäure
Prof. A. Togni, D-CHAB, HCI H 239 Allgemeine Chemie I (AC) HS 2011 Übungen Serie 6 Säure-Base-Gleichgewichte E 1. Sie möchten 200 ml einer Pufferlösung mit ph = 5.00 mit dem Säure-Base-Paar Essigsäure
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler
 Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1
 Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
1017 Azokupplung von Benzoldiazoniumchlorid mit 2-Naphthol zu 1-Phenylazo-2-naphthol
 OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
Ein Puffer ist eine Mischung aus einer schwachen Säure/Base und ihrer Korrespondierenden Base/Säure.
 2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Salpetersäure. Herstellung und Bedeutung. von
 Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Analytische Chemie. B. Sc. Chemieingenieurwesen. 19. März Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Übung 9. Allgemeine Chemie I Herbstsemester Vergleichen Sie die Abbildung 30.1 (MM., p. 515).
 Übung 9 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Vergleichen Sie die Abbildung 30.1 (MM., p. 515). 2. Aufgabe Der Chelateffekt beruht darauf, dass ein mehrzähniger Ligand (einer, der simultan
Übung 9 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Vergleichen Sie die Abbildung 30.1 (MM., p. 515). 2. Aufgabe Der Chelateffekt beruht darauf, dass ein mehrzähniger Ligand (einer, der simultan
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Säuren, Basen, Salze
 Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Diisothiocyanatotetrapyridinmangan(II) [Mn(SCN) 2 (py) 4 ]
![Diisothiocyanatotetrapyridinmangan(II) [Mn(SCN) 2 (py) 4 ] Diisothiocyanatotetrapyridinmangan(II) [Mn(SCN) 2 (py) 4 ]](/thumbs/62/47687170.jpg) Diisothiocyanatotetrapyridinmangan(II) [Mn(SCN) (py) ] Zürich, 3. Dezember 00 Katrin Niedermann OACP 1 SYNTHESE 1.1 Methode Mangan(II)sulfat-monohydrat reagiert mit Ammoniumthioccyanat in Pyridin zu Diisothioxyanatotetrapyridinmangan(II).
Diisothiocyanatotetrapyridinmangan(II) [Mn(SCN) (py) ] Zürich, 3. Dezember 00 Katrin Niedermann OACP 1 SYNTHESE 1.1 Methode Mangan(II)sulfat-monohydrat reagiert mit Ammoniumthioccyanat in Pyridin zu Diisothioxyanatotetrapyridinmangan(II).
Elektrolyte. (aus: Goldenberg, SOL)
 Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
Kaliumdioxalatocuprat(II)- dihydrat
 Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
6. Woche. Reaktionen und Nachweis der Anionen. Klasse I
 6. Woche Reaktionen und achweis der Anionen Klasse I Klassenreaktion: Die Anionen der I. Anionenklasse zeigen nach Zugabe verdünnter Salzsäure eine gut wahrnehmbare Veränderung (Gasentwicklung oder iederschlag
6. Woche Reaktionen und achweis der Anionen Klasse I Klassenreaktion: Die Anionen der I. Anionenklasse zeigen nach Zugabe verdünnter Salzsäure eine gut wahrnehmbare Veränderung (Gasentwicklung oder iederschlag
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7
 AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
Formeln & Namen. Will man ein Kapitel nicht bearbeiten, kann man dessen Aufgabenzahl auf '0' setzen.
 Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Übersicht. Wasserstoff-Verbindungen
 Allgemeine Chemie - Teil Anorganische Chemie II: 5. Hauptgruppe Übersicht A. Die Stellung der Elemente der 5. Hauptgruppe im Periodensystem. Stickstoff 2.1. Stickstoff-Wasserstoff Wasserstoff-Verbindungen.1.1.
Allgemeine Chemie - Teil Anorganische Chemie II: 5. Hauptgruppe Übersicht A. Die Stellung der Elemente der 5. Hauptgruppe im Periodensystem. Stickstoff 2.1. Stickstoff-Wasserstoff Wasserstoff-Verbindungen.1.1.
Aluminiumoxid & Aluminate. von Anne Gerten & Sabrina Huesmann
 Aluminiumoxid & Aluminate von Anne Gerten & Sabrina Huesmann Inhalte Aluminiumoxid Eigenschaften Die Gewinnung α-al 2 O 3 γ-al 2 O 3 Aluminate Allgemein Natriumaluminat Calciumaluminat Quellen Aluminiumoxid
Aluminiumoxid & Aluminate von Anne Gerten & Sabrina Huesmann Inhalte Aluminiumoxid Eigenschaften Die Gewinnung α-al 2 O 3 γ-al 2 O 3 Aluminate Allgemein Natriumaluminat Calciumaluminat Quellen Aluminiumoxid
4 LÖSLICHKEITSPRODUKT
 Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
lnt.ci.3: C 09 B 45/14 D 06 P 3/32, D 06 P 3/30 ( ) Erfinder: Püntener, Alois, Dr. Pulverweg 13 CH-4310 Rheinfelden(CH)
 European Patent Office Office europeen des brevets Veröffentlichungsnummer: 0 061 999 A1 EUROPAISCHE PATENTANMELDUNG @ Anmeldenummer: 82810123.8 @ Anmeldetag: 17.03.82 lnt.ci.3: C 09 B 45/14 D 06 P 3/32,
European Patent Office Office europeen des brevets Veröffentlichungsnummer: 0 061 999 A1 EUROPAISCHE PATENTANMELDUNG @ Anmeldenummer: 82810123.8 @ Anmeldetag: 17.03.82 lnt.ci.3: C 09 B 45/14 D 06 P 3/32,
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Darstellung von Silber(I)tetrafluoroborat(III) Ag[BF 4 ]
![Darstellung von Silber(I)tetrafluoroborat(III) Ag[BF 4 ] Darstellung von Silber(I)tetrafluoroborat(III) Ag[BF 4 ]](/thumbs/67/57250696.jpg) Darstellung von Silber(I)tetrafluoroborat(III) Ag[BF 4 ] Andreas J. Wagner, Philipp von den Hoff 26. Juli 2004 1 Theorie Das Tetrafluoroborat-Anion [BF 4 ] gehört zu der Familie der sog. nichtkoordinierenden
Darstellung von Silber(I)tetrafluoroborat(III) Ag[BF 4 ] Andreas J. Wagner, Philipp von den Hoff 26. Juli 2004 1 Theorie Das Tetrafluoroborat-Anion [BF 4 ] gehört zu der Familie der sog. nichtkoordinierenden
Extraktionen von Naturstoffen in Bildern: Eugenol und Eugenolacetat
 Extraktionen von Naturstoffen in Bildern: Eugenol und Eugenolacetat Hier wird die Extraktion von Eugenol und Eugenolacetat aus Gewürznelken dokumentiert. Genaue Extraktionsvorschrift: siehe Lambdasyn.
Extraktionen von Naturstoffen in Bildern: Eugenol und Eugenolacetat Hier wird die Extraktion von Eugenol und Eugenolacetat aus Gewürznelken dokumentiert. Genaue Extraktionsvorschrift: siehe Lambdasyn.
Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I
 Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
Einführungskurs 3. Seminar
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG Einführungskurs 3. Seminar Prof. Dr. Christoph Janiak Literatur: Riedel, Anorganische Chemie Inhalt Reaktionstypen Gleichgewicht bei Säure/Base-Reaktionen ph-berechnungen
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG Einführungskurs 3. Seminar Prof. Dr. Christoph Janiak Literatur: Riedel, Anorganische Chemie Inhalt Reaktionstypen Gleichgewicht bei Säure/Base-Reaktionen ph-berechnungen
Säuren und Basen. 18 UE Präsenz - Selbststudium 1,3 ECTS
 Säuren und Basen 18 UE Präsenz - Selbststudium 1,3 ECTS Überblick 1. Schülervorstellungen Phänomenologische Begriffsbestimmung 2. Verschiedene Definitionen der Begriffe 3. Stärke von Säuren und Basen 4.
Säuren und Basen 18 UE Präsenz - Selbststudium 1,3 ECTS Überblick 1. Schülervorstellungen Phänomenologische Begriffsbestimmung 2. Verschiedene Definitionen der Begriffe 3. Stärke von Säuren und Basen 4.
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Eine chemische Untersuchung der Harzmäntel von Sarcocaulon rigidum Schinz.
 Eine chemische Untersuchung der Harzmäntel von Sarcocaulon rigidum Schinz. Von P. KARRER und KURT SCHWARZ. Die Stengel der in Südafrika einheimischen Sarcocaulon-Arten sind von eigentümlichen dichten Harzmänteln
Eine chemische Untersuchung der Harzmäntel von Sarcocaulon rigidum Schinz. Von P. KARRER und KURT SCHWARZ. Die Stengel der in Südafrika einheimischen Sarcocaulon-Arten sind von eigentümlichen dichten Harzmänteln
Analytische Chemie. B. Sc. Chemieingenieurwesen. 01. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 01. Februar 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 01. Februar 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Analytische Chemie. B. Sc. Chemieingenieurwesen. 05. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Definiere den Begriff Orbital. Erkläre den ph-wert! Erkläre die Autoprotolyse des Wassers mit Hilfe der Reaktionsgleichung.
 Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Erkläre den pwert! Der
Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Erkläre den pwert! Der
SS 2010. Thomas Schrader. der Universität Duisburg-Essen. (Teil 7: Säuren und Basen, Elektrolyte)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Analytische Chemie. B. Sc. Chemieingenieurwesen. 9. September 2015, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Verlauf der Chinaldinsynthese bei den Tetralylaminen
 druckt mit Unterstützung Akademie d. Wissenschaften aus dem Wien; Jerome download und unter www.biologiezentrum.at Margaret Stonborough-Fonds. Verlauf der Chinaldinsynthese bei den Tetralylaminen Das 7,
druckt mit Unterstützung Akademie d. Wissenschaften aus dem Wien; Jerome download und unter www.biologiezentrum.at Margaret Stonborough-Fonds. Verlauf der Chinaldinsynthese bei den Tetralylaminen Das 7,
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
Darstellung von Kaliumtetrachloroiodat(III) K[ICl 4 ]
![Darstellung von Kaliumtetrachloroiodat(III) K[ICl 4 ] Darstellung von Kaliumtetrachloroiodat(III) K[ICl 4 ]](/thumbs/25/6722537.jpg) Darstellung von Kaliumtetrachloroiodat(III) K[ICl 4 ] Andreas J. Wagner 29. Juli 2004 1 Theorie Die Elemente der 17.Gruppe, die Halogene, treten in organischen und vielen anorganischen Verbindungen fast
Darstellung von Kaliumtetrachloroiodat(III) K[ICl 4 ] Andreas J. Wagner 29. Juli 2004 1 Theorie Die Elemente der 17.Gruppe, die Halogene, treten in organischen und vielen anorganischen Verbindungen fast
1.3 Chemische Reaktionen des Wassers - Bildung von Säuren und Basen
 1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
Zentralprüfung SwissChO 2016
 PROBLEM 1 - VERSCHIEDENE FRAGEN 9.5 PUNKTE a 6 N A = 3.61 10 4 mol 1 Punkt b Aufgrund der Verdünnung hat man 0.05M Br Ionen, 0.05M I Ionen und 0.1M Br + Ionen. 1/ Punkt wenn Br und I richtig, 1/ Punkt
PROBLEM 1 - VERSCHIEDENE FRAGEN 9.5 PUNKTE a 6 N A = 3.61 10 4 mol 1 Punkt b Aufgrund der Verdünnung hat man 0.05M Br Ionen, 0.05M I Ionen und 0.1M Br + Ionen. 1/ Punkt wenn Br und I richtig, 1/ Punkt
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid
 1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid Theorie Nucleophile Substitution 1. Ordnung am gesättigten Kohlenstoffatom. Darstellung tertiärer Alkylhalogenide durch Umsetzung
1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid Theorie Nucleophile Substitution 1. Ordnung am gesättigten Kohlenstoffatom. Darstellung tertiärer Alkylhalogenide durch Umsetzung
Dichlorobis(triphenylphosphin)nickel(II)
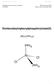 Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Zuusammenfassung Klasssenarbeit Chemie
 Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Chemie für Biologen, Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema ) iii) Carbonsäure iv) Dicarbonsäure
 Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Grundwissen Chemie Mittelstufe (9 MNG)
 Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
im Oberamt Waiblingen.
 4. Analyse der Mineralquelle oberhalb Beiiistein im Oberamt Waiblingen. Von F. R. Furch in Stuttgart. Diese Analyse unternahm ich im März des vorigen Jahres und führte sie im Laboratorium der königl. polytechnischen
4. Analyse der Mineralquelle oberhalb Beiiistein im Oberamt Waiblingen. Von F. R. Furch in Stuttgart. Diese Analyse unternahm ich im März des vorigen Jahres und führte sie im Laboratorium der königl. polytechnischen
Name: Matrikelnummer: Geburtsdatum: Hilfsmittel: Formelsammlung (beigefügt), Periodensystem (beigefügt), Taschenrechner
 Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
