Information zur Anfrage einer neuen Untersuchungs- und Behandlungsmethode entsprechend der Vorgabe des InEK
|
|
|
- Ursula Straub
- vor 6 Jahren
- Abrufe
Transkript
1 Hinweis: Stellen Sie NUB-Anfragen für 2017 über das InEK-Datenportal: Auf der Homepage des InEK finden Sie sämtliche Hintergrundinformation zu dem Verfahren der NUB-Anfragen: Information zur Anfrage einer neuen Untersuchungs- und Behandlungsmethode entsprechend der Vorgabe des InEK Wichtiger Hinweis: Bitte beachten Sie, dass der Wirkstoff Ustekinumab zum heutigen Zeitpunkt (Stand: ) nur für die Behandlung der Plaque-Psoriasis und der aktiven Psoriasis Arthritis zugelassen ist. Die EMA hat die Zulassung für die Indikation Morbus Crohn in 09/2016 empfohlen, die Zulassung wird für Oktober/November 2016 erwartet. Nachfolgend finden Sie Informationen, die Sie bei der Erstellung eines NUB-Antrages für Ustekinumab unterstützen können. Die in diesem Dokument enthaltenen Informationen zur Indikation Morbus Crohn stehen unter dem Vorbehalt der Erteilung der Zulassung durch die EMA und spiegeln den derzeitigen Stand der Erkenntnisse wider. Sie stehen erst nach Zulassung in Europa verbindlich fest. Formblatt NUB 1/4 1. Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung, max. 200 Zeichen) [Pflichtfeld] Geben Sie bitte eine prägnante Kurzbezeichnung mit einer Länge von maximal 200 Zeichen der angefragten Methode an. Wenn es sich um ein Medikament handelt, geben Sie bitte den Wirkstoffnamen an. Wirkstoff Ustekinumab (Arzneimittel: Stelara ) 2. Alternative Bezeichnung(en) der Methode Unter welcher anderen Bezeichnung (oder ggf. welchem Namen, z.b. auch Handelsname) ist die Methode noch bekannt? Systemische Therapie der Plaque-Psoriasis und der aktiven Psoriasis Arthritis Behandlung erwachsener Patienten mit mittelschwerem bis hochgradig aktivem Morbus Crohn 3. Beschreibung der neuen Methode [Pflichtfeld] Seite 1 von 19
2 Beschreiben Sie die neue Untersuchungs- und Behandlungsmethode konkret. Machen Sie dabei bitte insbesondere plausible Angaben zu Funktions-/Anwendungsweise, Technik, Materialien/Mengen, Wirkmechanismus, Wirkstoff, Dosierungen, Häufigkeit und Dauer der Anwendung etc. (soweit möglich und sinnvoll). Erstellen Sie Ihre Beschreibung der neuen Methode/Leistung bitte so, dass Ihre Erläuterungen vom Leser Ihrer Anfrage auch nachvollzogen werden können. Anwendungsgebiete Ustekinumab ist - für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque- Psoriasis indiziert, bei denen andere systemische Therapien einschließlich Ciclosporin, Methotrexat und PUVA nicht angesprochen haben, kontraindiziert sind oder nicht vertragen wurden. - für die Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei Kindern und Jugendlichen ab 12 Jahren indiziert, die unzureichend auf andere systemische Therapien oder Phototherapien angesprochen oder sie nicht vertragen haben. - allein oder in Kombination mit Methotrexat für die Behandlung der aktiven psoriatischen Arthritis bei erwachsenen Patienten indiziert, wenn das Ansprechen auf eine vorherige nicht-biologische krankheitsmodifizierende antirheumatische (DMARD) Therapie unzureichend gewesen ist. Ab Zulassung für die Indikation Morbus Crohn zudem: - für die Behandlung erwachsener Patienten mit mittelschwerem bis hochgradig aktivem Morbus Crohn indiziert, die entweder auf konventionelle Therapie oder einen der Tumor- Nekrose-Faktor (TNF)-alpha-Antagonisten unzureichend angesprochen haben, nicht mehr ansprechen oder eine Unverträglichkeit gegen eine entsprechende Behandlung aufweisen. Dosierung und Anwendung Plaque-Psoriasis und der aktiven Psoriasis Arthritis Nach einer initialen Injektion zu Therapiebeginn, erfolgt die nächste Injektion 4 Wochen später und dann alle 12 Wochen. Die Standarddosierung pro Injektion bei erwachsenen Patienten, sowie bei Kindern und Jugendlichen ab 12 Jahren beträgt 45 mg bei einem Körpergewicht 100kg. Bei Patienten mit einem Körpergewicht > 100 kg beträgt die empfohlene Dosierung 90 mg. Die Dosierung bei Kindern und Jugendlichen mit einem Gewicht < 60 kg erfolgt gewichtsadaptiert. Pro kg Körpergewicht werden hierbei 0,75mg Ustekinumab appliziert. Ustekinumab ist als Injektionslösung in einer Fertigspritze mit einer Wirkstoffmenge von 45 mg oder 90 mg verfügbar. Zur gewichtsadaptierten Dosierung bei Kindern und Jugendlichen steht eine Durchstechflasche mit 45 mg Ustekinumab zur Vefügung. Die Lösung ist jeweils subkutan zu injizieren. Ab Zulassung für die Indikation Morbus Crohn Seite 2 von 19
3 Morbus Crohn Die initiale intravenöse Gabe basiert auf dem Körpergewicht des Patienten und entspricht bei 55kg einer Gabe von 260 mg Ustekinumab. Zwischen 55kg bis 85kg beträgt die Initialdosis Ustekinumab 390 mg und ab > 85kg beträgt eine Dosis Ustekinumab 520 mg. Die weiteren Gaben werden im Abstand von 8 Wochen und anschließend alle 12 Wochen subkutan verabreicht. Wirkmechanismus Ustekinumab ist ein rein humaner monoklonaler IgG1κ-Antikörper, der mit hoher Affinität und Spezifität an die gemeinsame p40-protein- Untereinheit der humanen Zytokine Interleukin (IL)-12 und IL-23 bindet. Ustekinumab hemmt die Bioaktivität von humanem IL-12 und IL-23, indem es p40 daran hindert, an das IL-12Rβ1-Rezeptorprotein, das auf der Oberfläche von Immunzellen exprimiert wird, zu binden. Beide Zytokine wirken an den Immunfunktionen mit: IL-12 stimuliert natürliche Killerzellen (NK) und vermittelt die Differenzierung von CD4+ T-Zellen zum Phänotyp T-Helferzelle 1 (Th1),IL-23 induziert den T-Helfer-17-Pfad und eine anomale IL-12- und IL-23-Regulierung wurde mit immunvermittelten Krankheiten wie Psoriasis, psoriatischer Arthritits und Morbus Crohn assoziiert. Durch Bindung der IL-12 und IL-23 gemeinsamen p40-untereinheit kann Ustekinumab seine klinischen Effekte sowohl bei Plaque-Psoriasis, bei aktiver psoriatischer Arthritis und Morbus Crohn durch Unterbrechung der Th1- und Th17- Zytokinpfade ausüben, die beide eine zentrale Rolle in der Pathologie dieser Krankheiten spielen. Klassifizierung ATC-Code: L04AC05 Pharmakotherapeutische Gruppe: Interleukin-Rezeptor-Inhibitoren. Sicherheit und Wirksamkeit Plaque-Psoriasis Die Wirksamkeit und Sicherheit von Ustekinumab in der Therapie der Plaque-Psoriasis konnte bei 1996 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis und mit Eignung für eine Phototherapie oder eine systemische Therapie in zwei randomisierten, doppel-blinden, placebo-kontrollierten Phase III - Studien 1,2 gezeigt werden (PHOENIX 1, PHOENIX 2). 1 Leonardi et al., Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76- week results from a randomized, double-blind, placebo-controlled trial (PHOENIX1), The Lancet, Vol 371, 17.Mai 2008, S.1665 ff. Seite 3 von 19
4 Zudem wurde eine randomisierte, Studienarztverblindete, aktiv kontrollierte direkte Vergleichsstudie 3 gegen Etanercept mit 903 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis durchgeführt (ACCEPT). Bei den Patienten lag ein inadäquates Ansprechen, Unverträglichkeit oder eine Kontraindikation gegen Ciclosporin, MTX oder PUVA vor. Mittlerweile liegen publizierte Wirksamkeits 4 - und Verträglichkeitsdaten 5,6,7,8 aus den Zulassungsstudien über eine Nachbeobachtungszeit von drei bis fünf Jahren vor. Plaque-Psoriasis bei Kindern und Jugendlichen Die Wirksamkeit von Ustekinumab wurde in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Phase-III Studie mit 110 pädiatrischen Patienten im Alter von 12 bis 17 Jahren mit mittelschwerer bis schwerer Plaque-Psoriasis untersucht (CADMUS) 9. Es konnte gezeigt werden, dass Ustekinumab die Anzeichen und Symptome sowie die gesundheitsbezogene Lebensqualität bei Kindern und Jugendlichen ab 12 Jahren verbessert. Aktive Psoriasis-Arthritis Sicherheit und Wirksamkeit von Ustekinumab wurden in zwei randomisierten, placebokontrollierten doppelblinden Studien 10, 11 an 927 Patienten mit aktiver PsA ( 5 geschwollene Gelenke und 5 druckschmerzhafte Gelenke) trotz Therapie mit 2 Papp et al., Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52- week results from a randomized, double-blind, placebo-controlled trial (PHOENIX 2), The Lancet, Vol 371, 17.Mai 2008, S.1675 ff. 3 Griffiths CE, Strober BE, van de Kerkhof P, Ho V, Fidelus-Gort R, Yeilding N et al. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med 2010; 362(2): Kimball et al., Long-term efficacy of ustekinumab in patients with moderate-to-severe psoriasis: results from the PHOENIX 1 trial through up to 3 years. BJD 2012; 166, pp Lebwohl et al., Long-term safety experience of ustekinumab in patients with moderate-to-severe psoriasis (Part I of II): Results from analyses of general safety parameters from pooled Phase 2 and 3 clinical trials. JAAD 2011; doi: /j.jaad Gordon et al., Long-term safety experience of ustekinumab in patients with moderate to severe psoriasis (Part II of II): Results from analyses of infections and malignancy from pooled phase II and III clinical trials. JAAD 2012; doi: /j.jaad Reich et al., An update on the long-term safety experience of ustekinumab: results from the psoriasis clinical development program with up to four years of follow-up. JDD 2012; 11(3): Papp et al., Long-term safety of ustekinumab in patients with moderate-to-severe psoriasis: final results from 5 years of follow-up. British Journal of Dermatology (2013) 168, pp Landells et al., Ustekinumab in adolescent patients age 12 to 17 years with moderate-to-severe plaque psoriasis: results of the randomized phase 3 CADMUS study. J Am Acad Dermatol. doi: /j.jaad (Epub ahead of print). 10 McInnes et al., Efficacy and safety of ustekinumab in patients with actice psoriatric arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. The Lancet, Vol. 382 No pp ; , 11 Ritchlin et al., Efficacy and safety of the anti-il-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicenter, double-blind, placebo-controlled, randomized PSUMMIT 2 trial , doi: /annrheumdis Seite 4 von 19
5 nichtsteroidalen Antirheumatika (NSAR) oder krankheitsmodifizierenden Antirheumatika (DMARDs) untersucht. Es wurde gezeigt, dass Ustekinumab die Anzeichen und Symptome, die körperliche Funktion und die Lebensqualität in Bezug auf die Gesundheit bei erwachsenen Patienten mit aktiver PsA verbessert 12,13. Bei Patienten mit den Begleitmanifestationen einer aktiven Psoriasis Arthritis Enthesitis und/oder Daktylitis bei Aufnahme wurde in der Studie PSUMMIT1 in der Ustekinumab- Gruppe in Woche 24 im Vergleich zu Placebo eine signifikante Verbesserung der Enthesitis- und Daktylitis-Scores beobachtet. 14 Ab Zulassung für die Indikation Morbus Crohn: Morbus Crohn Das Phase 3 Entwicklungsprogramm für Ustekinumab in der Indikation Morbus Crohn besteht aus 3 großen randomisierten, placebokontrollierten, doppel-blinden sowie multizentrischen Studien: UNITI-1, UNITI-2 und IM-UNITI. Die UNITI-1 und UNITI-2 Studien untersuchen jeweils die Induktionsbehandlung mit Ustekinumab. Diese erfolgt beim Morbus Crohn als intravenöse Einmalgabe. An die Induktionsbehandlung schließt sich die Erhaltungstherapie an (IM-UNITI), die im Gegensatz zur Induktion subkutan appliziert wird. Die UNITI-1 15 Studie untersucht die Sicherheit und Wirksamkeit von Ustekinumab in Patienten mit mittelschwerem und schwerem Morbus Crohn, die bereits Versager einer TNF-Inhibitor Therapie sind oder dieser gegenüber intolerant sind. Prim. Endpunkt ist das klinische Ansprechen in Woche 6, definiert als eine Reduktion des Baseline-CDAI Scores 100 Punkte. Außerdem wurden die Patienten in zwei unterschiedliche Dosisgruppen (6 mg/kg Körpergewicht i.v. versus 130 mg i.v.) randomisiert. Den primären Endpunkt (Reduktion CDAI Score 100 in Woche 6) erreichten 33,7% (p=0,003; ~6 mg/kg) bzw. 34,3% (p=0,002; 130mg) der Patienten in den Ustekinumab Gruppen im Gegensatz zu 21,5% der Patienten in der Placebo-Gruppe. Eine klinische Remission (CDAI < 150) in Woche 8 erreichten unter Ustekinumab 20,9% (p<0,001; ~6 mg/kg) bzw. 15,9% (p=0,003; 130 mg), im Placebo-Arm 7,3% der Patienten. 12 McInnes et al., Efficacy and safety of ustekinumab in patients with actice psoriatric arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. The Lancet, Vol. 382 No pp ; , 13 Ritchlin et al., Efficacy and safety of the anti-il-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicenter, double-blind, placebo-controlled, randomized PSUMMIT 2 trial , doi: /annrheumdis McInnes et al., Efficacy and safety of ustekinumab in patients with actice psoriatric arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. The Lancet, Vol. 382 No pp ; , 15 UNITI-1: ECCO, 2016, Rutgeerts P et al, A Multicenter, Double-blind, Placebo-controlled Phase 3 Study of Ustekinumab, a Human IL-12/23p40 Monoclonal Antibody, in Moderate-severe Crohn s Disease Refractory to Anti-TNFα: UNITI-1 ( ) Seite 5 von 19
6 Die UNITI-2 16 Studie untersucht die Sicherheit und Wirksamkeit von Ustekinumab in Patienten mit moderatem bis hochgradig aktivem Morbus Crohn und einem vorhergehenden Versagen einer konventionellen Therapie untersucht, die nicht-refraktär gegenüber TNFa-Inhibitoren waren. Der primäre Endpunkt ist auch hier das klinische Ansprechen in Woche 6, definiert als eine Reduktion des Baseline-CDAI Scores 100 Punkte. Auch hier wurden die Patienten in zwei unterschiedliche Dosisgruppen (6 mg/kg Körpergewicht i.v. versus 130 mg i.v.) randomisiert. In dieser weniger vorbehandelten Population erreichten 55,5% (~6mg/kg) bzw. 51,7% (130 mg) der mit Ustekinumab behandelten Patienten ein klinisches Ansprechen in Woche 6 im Gegensatz zu 28,7% der Patienten in der Placebo-Gruppe (p<0,001). Eine klinische Remission (CDAI <150) in Woche 8 erreichten 40,2% (~6 mg/kg) bzw. 30,6% (130 mg) der Ustekinumab- Patienten sowie 19,6% der Placebo-Gruppe (p 0.009). Patienten, die innerhalb der UNITI-1 oder UNITI-2 Studie eine klinisches Ansprechen (Reduktion des Baseline-CDAI Scores 100 Punkte) in Woche 8 erreichten, konnten anschließend in die IM-UNITI 17 Studie eingeschlossen werden, die die Sicherheit und Wirksamkeit von Ustekinumab in der Erhaltungstherapie von Morbus Crohn Patienten untersucht. Außerdem werden hier zwei unterschiedliche Dosierungsintervalle (alle 8 Wochen s.c. versus alle 12 Wochen s.c.) randomisiert miteinander verglichen. Den primären Endpunkt einer klinischen Remission in Woche 44 (+8 Wochen Induktionsbehandlung = 1 Jahr nach Therapiebeginn) erreichten 53,1% (p=0,005) der Patienten, die 90 mg Ustekinumab alle 8 Wochen erhielten sowie 48,8% (p=0,040) der Patienten, die 90 mg Ustekinumab alle 12 Wochen erhielten im Gegensatz zu 35,9% der Patienten in der Placebo-Gruppe. Ein klinisches Ansprechen (Reduktion CDAI Score 100) in Woche 44 erreichten 59,4% (p=0,018; ~6 mg/kg) bzw. 58,1% (p=0,033; 130 mg) der Ustekinumab-Patienten sowie 44,3% der Patienten in der Placebo-Gruppe (p=0,033). 4. Mit welchem OPS wird die Methode verschlüsselt? Geben Sie bitte an, mit welchem OPS-Kode/welchen OPS-Kodes die Methode im Jahr 2016 verschlüsselt wird. Benutzen Sie bitte für jeden Kode eine neue Zeile. Falls kein Kode existiert, bleibt das Feld frei. OPS-Code Ustekinumab: j 16 UNITI-2: UEGW, 2015, Sandborn WJ et al, A MULTICENTER, DOUBLE-BLIND, PLACEBO-CONTROLLED PH3 STUDY OF USTEKINUMAB, A HUMAN MONOCLONAL ANTIBODY TO IL-12/23P40, IN PATIENTS WITH MODERATELY-SEVERELY ACTIVE CROHN S DISEASE WHO ARE NAÏVE OR NOT REFRACTORY TO ANTI-TNFΑ: UNITI-2 ( ) 17 IM-UNITI: DDW, 2016, Sandborn WJ et al (Presentation 768), A Phase 3, Randomized, Multicenter, Double-blind, Placebo-controlled, Study of Ustekinumab Maintenance Therapy in Moderate-Severe Crohn s Disease Patients: Results from IM-UNITI ( ) Seite 6 von 19
7 Seite 7 von 19
8 Formblatt NUB 2/4 2.1 Bei welchen Patienten wird die Methode angewandt (Indikation)? [Pflichtfeld] Beschreiben Sie bitte die Patientengruppe, die mit der neuen Methode behandelt wird. Wenn Ihnen bekannt ist, dass die Indikation typischerweise mit einer bestimmten DRG bzw. mehreren bestimmten DRGs verbunden ist, dann geben Sie diese bitte hier an. Plaque-Psoriasis Ustekinumab wird zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei erwachsenen Patienten eingesetzt, die auf andere systemische Therapien, inklusive Ciclosporin, Methotrexat und PUVA nicht angesprochen oder diese nicht vertragen haben, oder bei denen diese Therapien kontraindiziert sind. Seit 2015 ist Ustekinumab auch für die Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei Kindern und Jugendlichen ab 12 Jahren indiziert, die unzureichend auf andere systemische Therapien oder Phototherapien angesprochen oder sie nicht vertragen haben. Die Behandlung einer mittelschweren bis schweren Plaque Psoriasis ist in Abhängigkeit vom Alter der Patienten hauptsächlich in folgenden DRGs abgebildet (G-DRG Version 2016): HD: ICD L40.0 (Psoriasis vulgaris) DRG J61B Schwere Erkrankungen der Haut, mehr als ein Belegungstag, Alter > 17 Jahre, ohne äußerst schwere CC, ohne hochkomplexe Diagnose DRG J61C Schwere Erkrankungen der Haut, mehr als ein Belegungstag, Alter 18 Jahre, ohne hochkomplexe Diagnose oder mäßig schwere Hauterkrankungen, mehr als ein Belegungstag Aktive Psoriasis Arthritis Ustekinumab wird zudem allein oder in Kombination mit Methotrexat für die Behandlung der aktiven psoriatischen Arthritis bei Erwachsenen angewendet, wenn das Ansprechen auf eine vorherige Therapie mit nichtbiologischen krankheitsmodifizierenden Antirheumatika (DMARDs) unzureichend gewesen ist. Die Behandlung der Psoriasis Arthritis ist typischerweise in folgender DRG abgebildet (G-DRG Version 2016): HD: ICD L40.5 (Psoriasis Arthropathie) DRG I66B Andere Erkrankungen des Bindegewebes, mehr als ein Belegungstag, ohne äußerst schwere CC, ohne komplizierende Konstellation, ohne intensivmedizinische Komplexbehandlung > 196 / 184 / 184 Aufwandspunkte Seite 8 von 19
9 DRG I97Z Rheumatologische Komplexbehandlung bei Krankheiten und Störungen an Muskel-Skelett-System und Bindegewebe Ab Zulassung für die Indikation Morbus Crohn Morbus Crohn Die Behandlung eines mittelschweren bis hochgradig aktivem Morbus Crohn ist hauptsächlich in folgender DRG abgebildet (G-DRG Version 2016): HD: K50.- (Morbus Crohn) DRG G64A Entzündliche Darmerkrankung oder andere schwere Erkrankungen der Verdauungsorgane, mit äußerst schweren CC DRG G64B Entzündliche Darmerkrankung oder andere schwere Erkrankungen der Verdauungsorgane, ohne äußerst schwere CC 2.2 Welche bestehende Methode wird durch die neue Methode abgelöst oder ergänzt? [Pflichtfeld] Geben Sie hier bitte an, welche bestehende Methode durch die neue abgelöst oder ergänzt wird. Beschreiben Sie bitte kurz, wie Patienten vor Einführung der neuen Methode bei der entsprechenden Indikation behandelt wurden. Ustekinumab ergänzt die systemische Behandlung der mittelschweren bis schweren Plaque-Psoriasis und der aktiven Psoriasis Arthritis. Der Einsatz von Ustekinumab ersetzt sodann eine andere systemische Therapie. Durch die Indikationserweiterung zur Behandlung erwachsener Patienten mit mittelschwerem bis hochgradig aktivem Morbus Crohn, die entweder auf konventionelle Therapie oder einen der Tumor-Nekrose-Faktor (TNF)-alpha-Antagonisten unzureichend angesprochen haben, nicht mehr ansprechen oder eine Unverträglichkeit gegen eine entsprechende Behandlung aufweisen, stellt Ustekinumab eine weitere Therapieoption dar und ersetzt eine andere Therapie. 2.3 Ist die Methode vollständig oder in Teilen neu und warum handelt es sich um eine neue Untersuchungs- und Behandlungsmethode? [Pflichtfeld] Erläutern Sie bitte, warum die angefragte Methode aus Ihrer Sicht eine Neuerung darstellt. Wie unterscheidet sie sich von etablierten Verfahren? Gehen Sie bitte insbesondere auf den innovativen Charakter der neuen Methode ein. Bitte beschreiben Sie dabei möglichst genau die Neuerung(en) zu einer ggf. früher oder gegenwärtig eingesetzten Methode. Dies könnte bei Medikamenten z.b. der Wirkstoff, die Galenik oder Applikationsmethode sein, bei Verfahren z.b. ein Medikalprodukt (neuartiger Katheter), eine computergestützte Planung oder ein neuartiges kombiniertes Behandlungskonzept. Ustekinumab ist ein Wirkstoff zur Behandlung der mittelschweren bis schweren Plaque- Psoriasis und der aktiven Psoriasis Arthritis. Seite 9 von 19
10 Ustekinumab ist der einzige zugelassene Wirkstoff, welcher an freies Interleukin IL-12 und IL-23 bindet und deren Bindung an den Zielrezeptor auf naiven T-Zellen verhindert. Im Vergleich zu existierenden Biologika (TNF-α Inhibitoren) in den oben genannten Indikationen wird Ustekinumab in der Erhaltungstherapie im Gegensatz zu wöchentlichen oder zweiwöchentlichen Gaben in einem großen Intervall (alle zwölf Wochen) appliziert. Im Jahr 2015 erfolgte die Ausweitung des Indikationsbereiches auf die Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei Kindern und Jugendlichen ab einem Alter von 12 Jahren. Die aktuell erwartete Zulassungserweiterung für erwachsene Patienten mit mittelschwerem bis hochgradig aktivem Morbus Crohn indiziert das umfangreiche Behandlungskonzept des genannten Wirkstoffes und bietet in Zukunft voraussichtlich einer größeren Anzahl an Patienten eine entsprechende Therapieoption. 2.4 Welche Auswirkung hat die Methode auf die Verweildauer im Krankenhaus? Beschreiben Sie bitte die verweildauersteigernde oder -senkende Wirkung der neuen Methode, wenn möglich in Tagen pro Krankenhausaufenthalt (im Durchschnitt). Begründen Sie kurz, wodurch die Verweildaueränderung bewirkt wird. Hat die Methode nach Ihrer Kenntnis keine verweildauerändernde Wirkung, geben Sie bitte keine an. Die Therapie mit Ustekinumab hat voraussichtlich keine Auswirkung auf die stationäre Verweildauer, da die Therapie eine andere systemische Therapie ersetzt statt zusätzlich erforderlich zu sein. Seite 10 von 19
11 Formblatt NUB 3/4 3.1 Wann wurde diese Methode in Deutschland eingeführt? Wenn Ihnen der Einführungszeitpunkt der Methode in Deutschland bekannt ist, geben Sie ihn bitte hier an - ggf. als Schätzung. Wenn möglich, ergänzen Sie bitte, wann die Methode erstmals experimentell eingesetzt wurde und ab wann sie in der klinischen Praxis gebräuchlich ist. Wenn Sie keine Angaben machen können, lassen Sie das Feld bitte leer. Die Meldung von Ustekinumab in der Lauer-Taxe (Inverkehrbringen) erfolgte am 15. Februar Bei Medikamenten: Wann wurde dieses Medikament zugelassen? Geben Sie bitte den Zeitpunkt für die Zulassung des Medikamentes an, soweit Ihnen dieser bekannt ist. Wenn Sie Kenntnis über ein laufendes Zulassungsverfahren haben, geben Sie bitte an, bei welcher Behörde derzeit ein Zulassungsverfahren läuft und zu welchem Zeitpunkt eine Zulassung erwartet wird. Wenn Sie keine Kenntnis über diese Angaben haben, bleibt das Feld leer. Die EMA (European Medicines Agency) erteilte die Zulassung für Ustekinumab in der Plaque-Psoriasis am 16. Januar Die Zulassung für Ustekinumab in der aktiven Psoriasis Arthritis wurde am 19. September 2013 erteilt. Am 22. Juni 2015 hat die Europäische Kommission Ustekinumab auch für die Behandlung von mittelschwerer bis schwerer Plaque-Psoriasis bei jugendlichen Patienten ab einem Alter von 12 Jahren zugelassen. Die europäische Zulassung für die Indikation Morbus Crohn wird nach derzeitigem Kenntnisstand für November/Dezember 2016 erwartet. Seite 11 von 19
12 3.3 Wann wurde bzw. wird die Methode in Ihrem Krankenhaus eingeführt? [Pflichtfeld] Geben Sie bitte den Zeitpunkt der ersten Anwendung der Methode in Ihrem Krankenhaus an. Wenn Sie die Anfrage stellvertretend für mehrere Krankenhäuser Ihres Krankenhausverbundes stellen (vgl. Stammformblatt), geben Sie den Einführungszeitpunkt bitte für alle Krankenhäuser getrennt an (Angabe der IK-Nummer), wenn die Einführung nicht zu einem einheitlichen Zeitpunkt stattfand bzw. geplant ist. Verwenden Sie bitte für jede IK-Nummer eine eigene Zeile von Klinik individuell zu beantworten In wie vielen Kliniken wird diese Methode zurzeit eingesetzt (Schätzung)? Zur Unterstützung der Bearbeitung ist die Angabe hilfreich, in wie vielen Krankenhäusern diese Methode zum Zeitpunkt der Anfrage eingesetzt wird. Diese Angabe (Schätzung) ist nur dann vorzunehmen, wenn Sie eine ungefähre Kenntnis über den gegenwärtigen Umfang des Einsatzes der angefragten Methode in Deutschland haben; ansonsten bleibt das Feld leer. Es ist von mindestens 171 Kliniken auszugehen, die für das Jahr 2016 einen NUB- Antrag gestellt haben, den das InEK mit dem Status 1 eingestuft hat. 18 Die tatsächliche Anzahl der Kliniken, die Ustekinumab außerhalb dieses Verfahrens einsetzen, ist nicht referenzierbar. Beantragende Kliniken in der Vergangenheit, jeweils Bewertung mit Status 1: Im Jahr 2011: 30 Krankenhäuser/Kliniken Im Jahr 2012: 35 Krankenhäuser/Kliniken Im Jahr 2013: 91 Krankenhäuser/Kliniken Im Jahr 2014: 167 Krankenhäuser/Kliniken Im Jahr 2015: 140 Krankenhäuser/Kliniken Im Jahr 2016: 171 Krankenhäuser/Kliniken 18 InEK, Aufstellung der Informationen nach 6 Abs. 2 KHEntgG, System_2016/Neue_Untersuchungs_und_Behandlungsmethoden_NUB/Aufstellung_der_Informationen_nach_6_Abs._2_ KHEntgG_fuer_2016 Seite 12 von 19
13 3.5 Wie viele Patienten wurden in Ihrem Krankenhaus in 2015 oder in 2016 mit dieser Methode behandelt? [Pflichtfeld] Nennen Sie bitte die Anzahl der Patienten, an denen die angefragte Methode in Ihrem Krankenhaus im Jahr 2015 oder im Jahr 2016 angewandt wurde. Haben Sie keine genauen Zahlen, schätzen Sie die Anzahl der behandelten Patienten bitte möglichst genau. Haben Sie die neue Methode weder 2015 noch 2016 eingesetzt, geben Sie bitte keine an. Stellen Sie die Anfrage stellvertretend für mehrere Krankenhäuser Ihres Krankenhausverbundes (vgl. Stammformblatt), nennen Sie bitte die Anzahl der Patienten je Krankenhaus (Angabe der IK-Nummer). Verwenden Sie bitte für jede Angabe eine neue Zeile. In 2015: 1. - von Klinik individuell zu beantworten In 2016: 1. - von Klinik individuell zu beantworten Seite 13 von 19
14 3.6 Wie viele Patienten planen Sie im Jahr 2017 mit dieser Methode zu behandeln? [Pflichtfeld] Nennen Sie bitte die Anzahl der Patienten, an denen die angefragte Methode im Jahr 2017 in Ihrem Krankenhaus angewandt werden soll (Schätzung). Stellen Sie die Anfrage stellvertretend für mehrere Krankenhäuser Ihres Krankenhausverbundes (vgl. Stammformblatt), nennen Sie die (geschätzte) Anzahl der Patienten bitte je Krankenhaus (Angabe der IK-Nummer). Verwenden Sie bitte für jede IK-Nummer eine eigene Zeile von Klinik individuell zu beantworten Seite 14 von 19
15 Formblatt NUB 4/4 4.1 Entstehen durch die neue Methode Mehrkosten gegenüber dem bisher üblichen Verfahren? Wenn ja, wodurch? In welcher Höhe (möglichst aufgetrennt nach Personal- und Sachkosten)? [Pflichtfeld] Geben Sie bitte möglichst genau an, welche Mehrkosten durch die neue Methode verglichen mit der(n) bisher üblichen Methode(n) entstehen. Trennen Sie Ihre Angaben soweit möglich in Personal- und Sachkosten. Machen Sie Ihre Kostenangaben bitte als Durchschnittswert in Euro pro Anwendung. Sofern Ihnen die Mehrkosten nicht bekannt sind, umschreiben Sie bitte möglichst genau den zusätzlichen Aufwand, der durch Anwendung der neuen Methode entsteht. Der zusätzliche Aufwand kann beispielsweise durch verlängerte OP-Zeiten, eine höhere Qualifikation des einzusetzenden Personals, zusätzliches Personal, die Dosierung des Medikaments, die Verabreichung zusätzlicher Medikamente zur Stützung des Behandlungserfolges der neuen Methode, Implantatkosten o.ä. entstehen. Es entstehen keine Mehrkosten durch den Einsatz von Ustekinumab. Die Anwendung ersetzt andere systemische Therapien auf vergleichbarem Preisniveau. Ustekinumab (Stelara ) ist als Fertigspritze mit 45 mg (PZN ) und 90 mg (PZN ), sowie als Durchstechflasche mit 45 mg in der Packungsgröße N1 (jeweils 1 Stk.) verfügbar 19. Der Abgabepreis des pharmazeutischen Unternehmers (ApU) Janssen-Cilag GmbH beträgt für eine Fertigspritze mit 45 mg oder mit 90 mg Ustekinumab oder für eine Durchstechflasche mit 45 mg inkl. MwSt ,50 je Anwendung. Die Dosierung ist in der Therapie von erwachsenen Patienten mit Plaque-Psoriasis und mit aktiver Psoriasis Arthritis identisch. Die Standarddosierung pro Injektion bei erwachsenen Patienten beträgt 45 mg bei einem Körpergewicht 100kg. Bei Patienten mit einem Körpergewicht > 100 kg beträgt die Dosis 90 mg in der Behandlung der Plaque-Psoriasis. In der Behandlung der aktiven Psoriasis Arthritis können bei diesen Patienten alternativ zu 45 mg auch 90 mg verabreicht werden. Die empfohlene Dosierung bei Kindern und Jugendlichen mit Psoriasis variiert in Abhängigkeit vom Patientengewicht. Bei einem Gewicht zwischen 60 und 100kg beträgt die empfohlene Dosis 45 mg, bei einem Gewicht > 100 kg entsprechend 90 mg. Bei Kindern und Jugendlichen mit einem Gewicht < 60 kg werden 0,75 mg Ustekinumab pro kg Körpergewicht kalkuliert. Hierbei wird in Abhängigkeit des Patientengewichtes jeweils eine Durchstechflasche genutzt, aus der die passende Dosis aufgezogen wird. Nicht verwendete Arzneimittelreste, die in der Durchstechflasche verblieben sind, dürfen nicht weiter verwendet werden. Daher entstehen unabhängig von der tatsächlich applizierten Dosis auch bei Kindern und Jugendlichen mit einem geringeren Körpergewicht ebenfalls Kosten in Höhe von 4.819,50. Für die Induktions-Behandlung des mittelschweren und hochgradig aktivem Morbus Crohns wird eine neue Durchstechflache (PZN: ) mit 130mg eingeführt. Der 19 Stand der Information: Lauer-Taxe, Seite 15 von 19
16 Preis steht zum aktuellen Zeitpunkt noch nicht fest, da die Zulassung noch nicht erfolgt ist. Diese wird für November/Dezember 2016 erwartet. Der Preis wird sich an den gesetzlichen Vorgaben zum Preismoratorium bzw. erweiterten Preismoratorium zu orientieren haben. Die krankheitsbedingte gewichtsabhängige Induktionsgabe sowie die sich daran anschließende Erhaltungstherapie mit den derzeit bereits im Markt verfügbaren Darreichungsformen und Packungsgrößen sind in den Sachkosten der DRG-Entgelte nicht enthalten. Wie bereits unter 1.3 dieses Antrages dargestellt, werden bei der gewichtsabhängigen Induktionsgabe zwei, drei oder vier Durchstechflaschen auf einmal intravenös verabreicht. Die hierdurch entstehenden Kosten entsprechen dem Vielfachen der Kosten einer Durchstechflasche. Die Erhaltungstherapie erfolgt mittels der 90mg Fertigspritze, die je nach Ansprechen und Krankheitsschwere alle acht oder 12 Wochen verabreicht wird. Artikelbezeichnung Packungsgröße PZN ApU ApU inkl. MwSt. STELARA 45 mg N1, 1 Durchstechflasche , ,50 STELARA 45 mg N1, 1 Fertigspritze , ,50 STELARA 90 mg N1, 1 Fertigspritze , ,50 STELARA 130 mg N1, 1 Durchstechflasche n.n.b. n.n.b. 4.2 Welche DRG(s) ist / sind am häufigsten von dieser Methode betroffen? Soweit Sie davon Kenntnis haben, geben Sie hier bitte die am häufigsten von der angefragten Methode betroffene(n) DRG(s) an. Geben Sie bitte an, mit Hilfe welchen G-DRG-Fallpauschalen-Kataloges (z.b. Version 2016) Sie Ihre Angaben machen. Benutzen Sie bitte pro DRG eine neue Zeile. G-DRG Version 2016: Plaque-Psoriasis DRG J61B Schwere Erkrankungen der Haut, mehr als ein Belegungstag, Alter > 17 Jahre, ohne äußerst schwere CC, ohne hochkomplexe Diagnose DRG J61C Schwere Erkrankungen der Haut, mehr als ein Belegungstag, Alter 18 Jahre, ohne hochkomplexe Diagnose oder mäßig schwere Hauterkrankungen, mehr als ein Belegungstag Seite 16 von 19
17 Aktive Psoriasis Arthritis DRG I66B Andere Erkrankungen des Bindegewebes, mehr als ein Belegungstag, ohne äußerst schwere CC, ohne komplizierende Konstellation, ohne intensivmedizinische Komplexbehandlung > 196 / 184 / 184 Aufwandspunkte DRG I97Z Rheumatologische Komplexbehandlung bei Krankheiten und Störungen an Muskel-Skelett-System und Bindegewebe Morbus Crohn DRG G64A Entzündliche Darmerkrankung oder andere schwere Erkrankungen der Verdauungsorgane, mit äußerst schweren CC DRG G64B Entzündliche Darmerkrankung oder andere schwere Erkrankungen der Verdauungsorgane, ohne äußerst schwere CC 4.3 Warum ist diese Methode aus Ihrer Sicht derzeit im G-DRG-System nicht sachgerecht abgebildet? [Pflichtfeld] Erläutern Sie bitte, warum die Methode aus Ihrer Sicht nicht sachgerecht im G-DRG-System abgebildet ist. Hierbei sollte auch der Aspekt der Sachgerechtigkeit der Vergütung aus Ihrer Sicht betrachtet werden. Von Interesse ist, warum die durch die DRG-Fallpauschale bzw. durch die Zusatzentgelte bestimmte Vergütung in Bezug auf die entstehenden Kosten der NUB-Leistung nicht sachgerecht ist. Sie können Ihre Angaben auf das G-DRG-System 2015 und/oder 2016 beziehen. Wenn sich Ihre Angaben auf beide G-DRG-Systeme beziehen, beschreiben Sie bitte ggf. bestehende Unterschiede in der fehlenden Sachgerechtigkeit. Bitte vermerken Sie unbedingt, auf welches G-DRG-System (z.b. Version 2016) sich Ihre Ausführungen beziehen. Ustekinumab ist seit dem 16. Januar 2009 für die Behandlung der Plaque-Psoriasis und seit dem für die Behandlung der aktiven Psoriasis Arthritis zugelassen. Seitdem wurden jeweils NUB-Anträge für den Einsatz von Ustekinumab gestellt und mit dem Status 1 beschieden. Entgegen des tatsächlichen Einsatzes von Ustekinumb in der stationären Versorgung von Psoriasispatienten und PsA-Patienten ist die systemische Therapie in der jeweiligen DRG oder einem Zusatzentgelt aktuell noch nicht berücksichtigt worden. Durch die nun erfolgte Indikationserweiterung für die Behandlung von Jugendlichen in der Plaque-Psoriasis und durch die anstehende Zulassung zur Behandlung des Morbus Crohn kommen weitere potentielle stationäre Behandlungsfälle hinzu. Eine Berücksichtigung der Arzneimittelkosten von Ustekinumab ist daher dringend notwendig, da diese die Erlöse in den hauptsächlich angesteuerten DRGs J61B, J61C, I66B, I97Z bzw. G64A und G64B nach den Vorgaben des DRG-Abrechnungssystems 2016 deutlich übersteigen: Seite 17 von 19
18 Ustekinumab in der Plaque-Psoriasis: Die Diagnose der Plaque-Psoriasis (L.40.0) ist mit einem Anteil von ca. 57,17% in der DRG J61B abgebildet. Die DRG wird im Jahr 2016 mit einem Relativgewicht von 1,065 bewertet 20. Bei einem Bundesbasisfallwert von 3.311,98 21 wird die DRG mit einem Betrag von insgesamt 3.527,26 vergütet. Davon entfallen lediglich 8,71 auf die Sachkosten für Arzneimittel 22. Eine einmalige Applikation Ustekinumab erfolgt innerhalb eines stationären Aufenthaltes gemäß DRG J61B, ausgehend von den festgelegten Verweildauergrenzen (3 bis 18 Tage). Die Kosten einer Ustekinumab-Gabe (in der Erhaltungstherapie alle zwölf Wochen) betragen 4.819,50 inkl. MwSt. (siehe 4.1 dieses Antrages). Die anteilig in der DRG abgebildeten Arzneimittelkosten von 8,71 decken diese Kosten nicht. Auch der durchschnittliche Gesamterlös aus der gesamten DRG in Höhe von 3.527,26 deckt die Kosten der Ustekinumab-Gabe nicht. In der DRG J61C (für Patienten unter 18 Jahren) beläuft sich der DRG-Erlös bei einem Relativgewicht von 0,690 im Jahr 2016 auf 2.285, Die hier veranschlagten Kosten für Arzneimittel betragen 28, Auch hier übersteigen die Kosten für die einmalige Gabe von Ustekinumab die anteiligen Arzneimittelkosten in der DRG J61C um ein Vielfaches. Auch der durchschnittliche Gesamterlös aus der gesamten DRG in Höhe von 2.285,27 deckt die Kosten der Ustekinumab-Gabe nicht. Ustekinumab in der aktiven Psoriasis Arthritis: Die Diagnose der Psoriasis Arthritis (L.40.5) ist mit einer Anzahl von 3417 Patienten hauptsächlich in der DRG I66B abgebildet. Die DRG wird mit einem Relativgewicht von 0,785 bewertet 25. Bei einem Bundesbasisfallwert von 3.311,98 26 wird die DRG mit einem Betrag von insgesamt 2.599,90 vergütet. Davon entfallen 23,21 auf die Sachkosten für Arzneimittel 27. Eine einmalige Applikation Ustekinumab erfolgt innerhalb eines stationären Aufenthaltes gemäß DRG I66B, ausgehend von den festgelegten Verweildauergrenzen (2 bis 15 Tage). Die Kosten einer Ustekinumab-Gabe betragen 4.819,50 inkl. MwSt. (siehe 4.1 dieses Antrages). Die anteilig in der DRG abgebildeten Arzneimittelkosten von 23,21 decken diese Kosten nicht. Auch der durchschnittliche Gesamterlös aus der gesamten DRG in Höhe von 2.599,90 deckt die Kosten der Ustekinumab-Gabe nicht. 20 DRG J61B, DRG-Katalog 2016, InEK. 21 Bundesbasisfallwert 2016 gemäß Vereinbarung der DKG und dem GKV-Spitzenverband vom (gemäß 10 Abs. 9 KHEntgG). 22 DRG J61B, DRG-Report Browser 2016, InEK. 23 DRG J61C, DRG-Katalog 2016, InEK. 24 DRG J61C, DRG-Report Browser 2016, InEK. 25 DRG I66B, DRG-Katalog 2016, InEK. 26 Bundesbasisfallwert 2016, gemäß Vereinbarung der DKG und dem GKV-Spitzenverband vom (gemäß 10 Abs. 9 KHEntgG). 27 DRG I66B, DRG-Report Browser 2016, InEK. Seite 18 von 19
19 In der DRG I97Z beläuft sich der DRG-Erlös bei einem Relativgewicht von 1,418 im Jahr 2016 auf 4.696, Die hier veranschlagten Sachkosten für Arzneimittel betragen 19, Auch hier übersteigen die Kosten für die einmalige Gabe von Ustekinumab die anteiligen Arzneimittelkosten in der DRG I97Z um ein Vielfaches. Auch der durchschnittliche Gesamterlös aus der gesamten DRG in Höhe von 4.696,39 deckt die Kosten der Ustekinumab-Gabe nicht. Ustekinumab bei mittelschwerem bis hochgradig aktivem Morbus Crohn: Die Diagnose des Morbus Crohn (K50.*) wird hauptsächlich in der DRG G64B abgebildet. Die DRG wird mit einem Relativgewicht von 0,653 bewertet 30. Bei einem Bundesbasisfallwert von 3.311,98 31 wird die DRG mit einem Betrag von insgesamt 2.162,72 vergütet. Davon entfallen 20,40 auf die Sachkosten für Arzneimittel 32. Eine einmalige Applikation Ustekinumab erfolgt innerhalb eines stationären Aufenthaltes gemäß DRG G64B, ausgehend von den festgelegten Verweildauergrenzen (2 bis 11 Tage). Die genauen Kosten einer gewichtsabhängigen Induktionsgabe Ustekinumab können zum aktuellen Zeitpunkt noch nicht genau beziffert werden (siehe 4.1 dieses Antrages). Die anteilig in der DRG abgebildeten Arzneimittelkosten von 20,40 decken diese Kosten sicherlich nicht. Auch der durchschnittliche Gesamterlös aus der gesamten DRG in Höhe von 2.162,72 deckt die Kosten der Ustekinumab-Gabe nicht ab. 4.4 Wurde für diese Methode bereits eine Anfrage gemäß 6 Abs. 2 KHEntgG beim InEK gestellt? Wenn Sie für die angefragte Methode bereits in den vergangenen Jahren eine Anfrage gemäß 6 Abs. 2 KHEntgG gestellt haben, kreuzen Sie bitte Von Ihrem Krankenhaus an. Wenn Ihnen bekannt ist, dass ein anderes Krankenhaus für die von Ihnen aktuell angefragte Methode bereits eine Anfrage gemäß 6 Abs. 2 KHEntgG gestellt hat, kreuzen Sie bitte Von einem anderen Krankenhaus an. Ansonsten kreuzen Sie bitte nichts an. Von Ihrem Krankenhaus: - von Klinik individuell anzukreuzen - Von einem anderen Krankenhaus (falls Ihnen bekannt): -ja- 28 DRG I97Z, DRG-Katalog 2016, InEK. 29 DRG I97Z, DRG-Report Browser 2016, InEK. 30 DRG G64B, DRG-Katalog 2016, InEK. 31 Bundesbasisfallwert 2016, gemäß Vereinbarung der DKG und dem GKV-Spitzenverband vom (gemäß 10 Abs. 9 KHEntgG). 32 DRG G64B, DRG-Report Browser 2016, InEK. Seite 19 von 19
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Institut für das Entgeltsystem im Krankenhaus GmbH. Wichtige Information zur Nutzung des NUB-Tools
 Wichtige Information zur Nutzung des NUB-Tools Neue Untersuchungs- und Behandlungsmethoden (NUB) gemäß 6 Absatz 2 KHEntgG Das NUB-Tool enthält fünf verschiedene Formblätter: 1. Stammformblatt 2. NUB 1/4
Wichtige Information zur Nutzung des NUB-Tools Neue Untersuchungs- und Behandlungsmethoden (NUB) gemäß 6 Absatz 2 KHEntgG Das NUB-Tool enthält fünf verschiedene Formblätter: 1. Stammformblatt 2. NUB 1/4
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
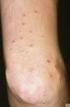 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
DAUER DER STUDIE: Läuft seit Nov mindestens bis 2017.
 KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
Behandlungsstrategien bei Psoriasis
 Behandlungsstrategien bei Psoriasis Nikhil Yawalkar Universitätsklinik für Dermatologie Inselspital, Bern Psoriasis Mild (70-75%) Mittelschwer bis schwer (25-30%) PASI BSA DLQI > 10 % Mrowietz et al. Arch
Behandlungsstrategien bei Psoriasis Nikhil Yawalkar Universitätsklinik für Dermatologie Inselspital, Bern Psoriasis Mild (70-75%) Mittelschwer bis schwer (25-30%) PASI BSA DLQI > 10 % Mrowietz et al. Arch
TNF a -Therapiestrategien bei Morbus Crohn und Colitis ulcerosa aktuelle Daten zum ECCO-Kongress
 TNF a -Therapiestrategien bei Morbus Crohn und Colitis ulcerosa aktuelle Daten zum ECCO-Kongress München (14. April 2011) Eine Kombinationstherapie aus Infliximab (REMICADE ) und Azathioprin (AZA) verhilft
TNF a -Therapiestrategien bei Morbus Crohn und Colitis ulcerosa aktuelle Daten zum ECCO-Kongress München (14. April 2011) Eine Kombinationstherapie aus Infliximab (REMICADE ) und Azathioprin (AZA) verhilft
Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml, Cosentyx/ -SensoReady 1/ 2 Auto-Injektor 150mg/1 ml
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 07.07.2016 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Stammformblatt NUB -immer ausfüllen-
 Stammformblatt NUB -immer ausfüllen- Die Anfrage wird durch folgendes Krankenhaus gestellt IK-Nummer (Institutskennzeichen) 123456789 Name des Krankenhauses KH Musterstadt Dieses wird als Ansprechpartner
Stammformblatt NUB -immer ausfüllen- Die Anfrage wird durch folgendes Krankenhaus gestellt IK-Nummer (Institutskennzeichen) 123456789 Name des Krankenhauses KH Musterstadt Dieses wird als Ansprechpartner
Ärztliche Fortbildung
 RHEUMATAG TIROL 25. FEBRUAR 2015 Universitätsklinik für Innere Medizin VI Innsbruck LANDHAUS 1, INNSBRUCK ZUGANG ÜBER DIE MERANER STRASSE 4, 6020 INNSBRUCK Ärztliche Fortbildung PROGRAMM Neu bei Psoriasis-Arthritis
RHEUMATAG TIROL 25. FEBRUAR 2015 Universitätsklinik für Innere Medizin VI Innsbruck LANDHAUS 1, INNSBRUCK ZUGANG ÜBER DIE MERANER STRASSE 4, 6020 INNSBRUCK Ärztliche Fortbildung PROGRAMM Neu bei Psoriasis-Arthritis
Johanniskraut Metaanalyse 2005
 Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
date Adjuvant Pegylated- Interferonalpha2b
 Organ/Bereich Krankheit Stadium Kurztitel Studie/ClinicalTrials.gov Identifier: Stand per: 11.05.2016 Hauttumore Melanom ulzeriertes primäres kutanes Melanom T(2-4)b N0 M0) Hauttumore Melanom nicht vorbehandeltes,
Organ/Bereich Krankheit Stadium Kurztitel Studie/ClinicalTrials.gov Identifier: Stand per: 11.05.2016 Hauttumore Melanom ulzeriertes primäres kutanes Melanom T(2-4)b N0 M0) Hauttumore Melanom nicht vorbehandeltes,
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
O f f e n e S t u d i e n - August 2013 -
 Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Subkutan oder intravenös? Besonderheiten bei der sub- kutanen Injektion von Herceptin
 Universität St. Gallen 5./6. September 2013 Subkutan oder intravenös? Besonderheiten bei der sub- kutanen Injektion von Herceptin Anja Kröner, MScN, HöFa I Onkologie, RN Pflegeexpertin Hämatologie und
Universität St. Gallen 5./6. September 2013 Subkutan oder intravenös? Besonderheiten bei der sub- kutanen Injektion von Herceptin Anja Kröner, MScN, HöFa I Onkologie, RN Pflegeexpertin Hämatologie und
Diagnostik und Behandlung des Morbus Crohn nach SONIC. PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster
 Diagnostik und Behandlung des Morbus Crohn nach SONIC PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster Klinische Wirkung von anti-tnf Der erste Fall 12 jährige Patientin
Diagnostik und Behandlung des Morbus Crohn nach SONIC PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster Klinische Wirkung von anti-tnf Der erste Fall 12 jährige Patientin
G-DRGs 2006 Klassifikation und Bewertung
 Thema: G-DRGs 2006 G-DRGs 2006 Klassifikation und Bewertung DRG und Onkologie - So geht es 2006! Berlin, den 3. Februar 2006 Dr. Frank Heimig, Geschäftsführer InEK ggmbh 1 Onkologie Ausgangssituation /
Thema: G-DRGs 2006 G-DRGs 2006 Klassifikation und Bewertung DRG und Onkologie - So geht es 2006! Berlin, den 3. Februar 2006 Dr. Frank Heimig, Geschäftsführer InEK ggmbh 1 Onkologie Ausgangssituation /
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM
 KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab
 Neues und Wissenswertes aus der Onkologie Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab München (26. Juli 2012) - Deutliche Fortschritte in der Tumortherapie haben in den letzten
Neues und Wissenswertes aus der Onkologie Optimierung der Therapie des kolorektalen Karzinoms durch Panitumumab München (26. Juli 2012) - Deutliche Fortschritte in der Tumortherapie haben in den letzten
Erhaltungstherapie mit Rituximab beim follikulären Lymphom
 Prof. Dr. med. Wolfgang Hiddemann: Non-Hodgkin-Lymphom - Erhaltungstherapie mit Rituximab beim fol Non-Hodgkin-Lymphom Erhaltungstherapie mit Rituximab beim follikulären Lymphom Prof. Dr. med. Wolfgang
Prof. Dr. med. Wolfgang Hiddemann: Non-Hodgkin-Lymphom - Erhaltungstherapie mit Rituximab beim fol Non-Hodgkin-Lymphom Erhaltungstherapie mit Rituximab beim follikulären Lymphom Prof. Dr. med. Wolfgang
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Formular für Vorschläge zur ICD-10 und zum OPS
 Formular für Vorschläge zur ICD-10 und zum OPS Bitte füllen Sie diesen Fragebogen in einem Textbearbeitungsprogramm aus und schicken Sie ihn als e-mail-anhang ans DIMDI an folgende e-mail-adresse Vorschlagsverfahren@dimdi.de
Formular für Vorschläge zur ICD-10 und zum OPS Bitte füllen Sie diesen Fragebogen in einem Textbearbeitungsprogramm aus und schicken Sie ihn als e-mail-anhang ans DIMDI an folgende e-mail-adresse Vorschlagsverfahren@dimdi.de
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Journal: Journal of Clinical Oncology Publikationsjahr: 2012 Autoren: Paulo M. Hoff, Andreas Hochhaus, Bernhard C. Pestalozzi et al.
 Cediranib Plus FOLFOX/CAPOX Versus Placebo Plus FOLFOX/CAPOX in Patients With Previously Untreated Metastatic Colorectal Cancer: A Randomized, Double Blind, Phase III Study (HORIZON II) Journal: Journal
Cediranib Plus FOLFOX/CAPOX Versus Placebo Plus FOLFOX/CAPOX in Patients With Previously Untreated Metastatic Colorectal Cancer: A Randomized, Double Blind, Phase III Study (HORIZON II) Journal: Journal
Neueste Studienergebnisse in der Therapie der PAH
 Dualer Endothelin-Rezeptor-Antagonismus: Neueste Studienergebnisse in der Therapie der PAH Von Prof. Ralf Ewert, Greifswald Lübeck (10. April 2008) - Das Wissen um die Pathophysiologie der Pulmonalen Arteriellen
Dualer Endothelin-Rezeptor-Antagonismus: Neueste Studienergebnisse in der Therapie der PAH Von Prof. Ralf Ewert, Greifswald Lübeck (10. April 2008) - Das Wissen um die Pathophysiologie der Pulmonalen Arteriellen
Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL
 Neue Maßstäbe in der Lymphomtherapie Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL Mannheim (2. Oktober 2009) - Der monoklonale Antikörper Rituximab
Neue Maßstäbe in der Lymphomtherapie Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL Mannheim (2. Oktober 2009) - Der monoklonale Antikörper Rituximab
Nutzenbewertung. von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V. Wirkstoff: Nepafenac. nach 2 Abs. 2 VerfO des G-BA
 Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Nepafenac nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 1. Oktober 2013 1 Nepafenac Zugelassenes Anwendungsgebiet
Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Wirkstoff: Nepafenac nach 2 Abs. 2 VerfO des G-BA Datum der Veröffentlichung: 1. Oktober 2013 1 Nepafenac Zugelassenes Anwendungsgebiet
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab
 Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab 5 Jahren und Jugendlichen Voraussetzungen für Selbstmedikation
Antrag auf Aufhebung der Verschreibungspflicht ( 48 und 53 AMG) Racecadotril 30 mg Granulat zur sympt. Behandlung der akuten Diarrhoe bei Kindern ab 5 Jahren und Jugendlichen Voraussetzungen für Selbstmedikation
Auf der 84. Jahrestagung der Deutschen Gesellschaft für Neurologie (DGN), die noch bis zum 1. Oktober in
 Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
Restless-Legs-Syndrom: Ein besseres Leben ist möglich Die Qual der ruhelosen Beine ist eine kaum bekannte Volkskrankheit Wiesbaden (29. September 2011) Bis zu zehn Prozent der Bevölkerung sind von einem
Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich
 Aktuelle Pressemitteilung Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich (Neuss, 4. Dezember 2007) Neueste beim Internationalen Myelomworkshop auf
Aktuelle Pressemitteilung Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich (Neuss, 4. Dezember 2007) Neueste beim Internationalen Myelomworkshop auf
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Innovatives Moleküldesign und schnelle Wirksamkeit
 Hintergrundtext Anti-TNF Certolizumab Pegol zur Behandlung von RA Innovatives Moleküldesign und schnelle Wirksamkeit Die Behandlungsmöglichkeiten bei Rheumatoider Arthritis (RA) entwickeln sich stetig
Hintergrundtext Anti-TNF Certolizumab Pegol zur Behandlung von RA Innovatives Moleküldesign und schnelle Wirksamkeit Die Behandlungsmöglichkeiten bei Rheumatoider Arthritis (RA) entwickeln sich stetig
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Was gibt es Neues in der Therapie? YAEL Arzt-Patientenseminar, Hamburg Christoph Schramm I. Medizinische Klinik und Poliklinik, UKE
 Was gibt es Neues in der Therapie? YAEL Arzt-Patientenseminar, Hamburg 2011 Christoph Schramm I. Medizinische Klinik und Poliklinik, UKE Autoimmune Lebererkrankungen Autoimmune Lebererkrankungen Autoimmune
Was gibt es Neues in der Therapie? YAEL Arzt-Patientenseminar, Hamburg 2011 Christoph Schramm I. Medizinische Klinik und Poliklinik, UKE Autoimmune Lebererkrankungen Autoimmune Lebererkrankungen Autoimmune
Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis
 Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2003
 Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2003 Die folgenden Hinweise sollen die Abrechnung und Handhabung des DRG- Systemzuschlags verdeutlichen. Teil
Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2003 Die folgenden Hinweise sollen die Abrechnung und Handhabung des DRG- Systemzuschlags verdeutlichen. Teil
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
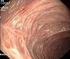 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Humanisierter Antikörper gegen Colitis ulcerosa und Morbus Crohn
 Auflage: 66437 Gewicht: Artikel Fachzeitschrift/-magazin 1. Juli 2015 Zurück zum Inhaltsverzeichnis TAKEDA TRIBUNE TITELSEITE Humanisierter Antikörper gegen Colitis ulcerosa und Morbus Crohn Neuer, darmselektiver
Auflage: 66437 Gewicht: Artikel Fachzeitschrift/-magazin 1. Juli 2015 Zurück zum Inhaltsverzeichnis TAKEDA TRIBUNE TITELSEITE Humanisierter Antikörper gegen Colitis ulcerosa und Morbus Crohn Neuer, darmselektiver
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Placeboforschung. Beschreibung der Studie. Berücksichtigt wurden nur die Placebo-Daten aus vielen Placebokontrollierten
 Science in School Issue 21: Winter 2011 1 Placeboforschung Übersetzt von Veronika Ebert, Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien Im Anschluss finden Sie einige Details aus
Science in School Issue 21: Winter 2011 1 Placeboforschung Übersetzt von Veronika Ebert, Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien Im Anschluss finden Sie einige Details aus
Behandlung mit Biologika (Biologicals), Stand 01/2011
 Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
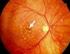 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Bei Depressionen. schnell wirksam, stark 2
 Bei Depressionen schnell wirksam, stark 2 Cipralex - der RI der zweiten Generation 1 Wie wichtig ist Ihnen der bleibende Erfolg? Effektivität mit guter Verträglichkeit kombiniert 3 Und wie wichtig ist
Bei Depressionen schnell wirksam, stark 2 Cipralex - der RI der zweiten Generation 1 Wie wichtig ist Ihnen der bleibende Erfolg? Effektivität mit guter Verträglichkeit kombiniert 3 Und wie wichtig ist
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Psoriasis-Arthritis: Differentialdiagnose
 Psoriasis-Arthritis: Differentialdiagnose Angewandte Immunologie Torsten Witte Klinik für Immunologie Abt. Psoriasis-Arthritis ca. 20% der Psoriasis-Patienten Frauen : Männer = 1:1 Manifestationsalter
Psoriasis-Arthritis: Differentialdiagnose Angewandte Immunologie Torsten Witte Klinik für Immunologie Abt. Psoriasis-Arthritis ca. 20% der Psoriasis-Patienten Frauen : Männer = 1:1 Manifestationsalter
Herzlich Willkommen zum
 Herzlich Willkommen zum 1 Chronisch entzündliche Darmerkrankungen Medikamentöse Therapie Dr. M. Geppert SHG MC-CU 17.05.2013 Die chronisch entzündlichen Darmerkrankungen (CED) sind: Morbus Crohn Colitis
Herzlich Willkommen zum 1 Chronisch entzündliche Darmerkrankungen Medikamentöse Therapie Dr. M. Geppert SHG MC-CU 17.05.2013 Die chronisch entzündlichen Darmerkrankungen (CED) sind: Morbus Crohn Colitis
Neue Hochdosis-Kombination von Blopress
 Deutsche Zulassung für neue Hochdosis-Kombination von Blopress zur Behandlung von Bluthochdruc Deutsche Zulassung Neue Hochdosis-Kombination von Blopress zur Behandlung von Bluthochdruck Frankfurt am Main
Deutsche Zulassung für neue Hochdosis-Kombination von Blopress zur Behandlung von Bluthochdruc Deutsche Zulassung Neue Hochdosis-Kombination von Blopress zur Behandlung von Bluthochdruck Frankfurt am Main
Visite 2 Monat 3 Arztbogen ID:
 1. Zwischenanamnese Datum: Haben sich seit der letzten Vorstellung des Patienten Änderungen im klinischen Typ der Psoriasis ergeben? nein ja Wenn ja, aktueller klinischer Typ? Nagelbeteiligung ja nein
1. Zwischenanamnese Datum: Haben sich seit der letzten Vorstellung des Patienten Änderungen im klinischen Typ der Psoriasis ergeben? nein ja Wenn ja, aktueller klinischer Typ? Nagelbeteiligung ja nein
REFERAT BILANZMEDIENKONFERENZ Es gilt das gesprochene Wort. Meine Damen und Herren
 REFERAT BILANZMEDIENKONFERENZ 26 Datum 11. April 26 Kontakt Dr. Barbara von Eisenhart Rothe, Verantwortliche Medizinische Sicherheit, Vifor (International) AG Thema Klinisches Entwicklungsprogramm Ferinject
REFERAT BILANZMEDIENKONFERENZ 26 Datum 11. April 26 Kontakt Dr. Barbara von Eisenhart Rothe, Verantwortliche Medizinische Sicherheit, Vifor (International) AG Thema Klinisches Entwicklungsprogramm Ferinject
Chancen und Risiken der digitalen Gesundheitsversorgung: Diagnose vor Therapie und Abwägung vor Versand
 Chancen und Risiken der digitalen Gesundheitsversorgung: Diagnose vor Therapie und Abwägung vor Versand Prof. Dr. Franz Porzsolt Versorgungsforschung an der Klinik für Allgemein-und Viszeralchirurgie,
Chancen und Risiken der digitalen Gesundheitsversorgung: Diagnose vor Therapie und Abwägung vor Versand Prof. Dr. Franz Porzsolt Versorgungsforschung an der Klinik für Allgemein-und Viszeralchirurgie,
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Celgene GmbH Joseph-Wild-Straße München. Telefon: (089) PRESSEMITTEILUNG
 Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Zweiter AMNOG-Prozess für Orphan Drug IMNOVID (Pomalidomid) innerhalb der gesetzlichen
ESC München Schrittmacher, ICD, kardiale Resynchronisation ( CRT ) Dr. Dorothee Meyer zu Vilsendorf
 ESC München 2008 Schrittmacher, ICD, kardiale Resynchronisation ( CRT ) Dr. Dorothee Meyer zu Vilsendorf Klinik für Kardiologie und Internistische Intensivmedizin, Städtische Kliniken Bielefeld ESC München
ESC München 2008 Schrittmacher, ICD, kardiale Resynchronisation ( CRT ) Dr. Dorothee Meyer zu Vilsendorf Klinik für Kardiologie und Internistische Intensivmedizin, Städtische Kliniken Bielefeld ESC München
Projekte: Gutartige, boesartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
 Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung eines VEGF-Rezeptor Hemmers Andere Erstellung einer Stellungnahme für den G-BA zur Nutzenbewertung Erstellung eines Dossiers für eine Nutzenbewertung
Chronisch entzündliche Darmerkrankungen. Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs
 Chronisch entzündliche Darmerkrankungen Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs Häufigkeit: Morbus Crohn In den letzten Jahren haben die Inzidenz und die Prävalenz (verbesserte Lebenserwartung) stetig
Chronisch entzündliche Darmerkrankungen Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs Häufigkeit: Morbus Crohn In den letzten Jahren haben die Inzidenz und die Prävalenz (verbesserte Lebenserwartung) stetig
Femara schützt wirksam vor Brustkrebsrezidiven, auch wenn die Behandlung erst Jahre nach Abschluss einer Tamoxifen-Therapie einsetzt
 Femara schützt wirksam vor Brustkrebsrezidiven, auch wenn die Behandlung erst Jahre nach Abschluss einer Tamoxifen-Therapie einsetzt - Analyse der entblindeten MA-17-Studiendaten zeigt Vorteile einer Behandlungsauf
Femara schützt wirksam vor Brustkrebsrezidiven, auch wenn die Behandlung erst Jahre nach Abschluss einer Tamoxifen-Therapie einsetzt - Analyse der entblindeten MA-17-Studiendaten zeigt Vorteile einer Behandlungsauf
Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns
 AMB 2000, 34, 92 Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns In einer Untersuchung von G. Cotter et al. aus Israel (1) wurden 100 Patienten (Durchschnittsalter 68 Jahre) mit seit weniger
AMB 2000, 34, 92 Zu Therapie und Prophylaxe des paroxysmalen Vorhofflimmerns In einer Untersuchung von G. Cotter et al. aus Israel (1) wurden 100 Patienten (Durchschnittsalter 68 Jahre) mit seit weniger
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Die Mistel bringt Lebensqualität in die Onkologie
 Die Mistel bringt Lebensqualität in die Onkologie Dr. Harald Matthes Stuttgart (2. Dezember 2009) - Die Mistel wurde von R. Steiner, dem Begründer der anthroposophischen Medizin, Anfang des letzten Jahrhunderts
Die Mistel bringt Lebensqualität in die Onkologie Dr. Harald Matthes Stuttgart (2. Dezember 2009) - Die Mistel wurde von R. Steiner, dem Begründer der anthroposophischen Medizin, Anfang des letzten Jahrhunderts
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Umfassende Schmerztherapie am Krankenhaus: Abbildung im DRG-System
 Umfassende Schmerztherapie am Krankenhaus: Abbildung im DRG-System Deutscher Schmerzkongress Jahrestagung DGSS / DMKG / DVS / DSG Berlin, den 11. Oktober 2008 Christian Jacobs, Leiter DRG-Entwicklung,
Umfassende Schmerztherapie am Krankenhaus: Abbildung im DRG-System Deutscher Schmerzkongress Jahrestagung DGSS / DMKG / DVS / DSG Berlin, den 11. Oktober 2008 Christian Jacobs, Leiter DRG-Entwicklung,
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
TGN1412: Worst case. Prof. Dr. Albert Duschl
 TGN1412: Worst case Prof. Dr. Albert Duschl Progress Monoklonale Ab gibt es seit 1975, der erste mab erreichte die Klinik bereits 1986 (Muromonab, anti- CD3, gegen Transplantat- Abstossung). Haupt-Anwendungsgebiete
TGN1412: Worst case Prof. Dr. Albert Duschl Progress Monoklonale Ab gibt es seit 1975, der erste mab erreichte die Klinik bereits 1986 (Muromonab, anti- CD3, gegen Transplantat- Abstossung). Haupt-Anwendungsgebiete
Information zur Abbildung der Radioiodtherapie und anderer Therapien mit Radionukliden im G-DRG-System 2006
 Information zur Abbildung der Radioiodtherapie und anderer Therapien mit Radionukliden im G-DRG-System 2006 Nachdem die nuklearmedizinische Therapie in der Version 2005 des G-DRG-Systems völlig neu abgebildet
Information zur Abbildung der Radioiodtherapie und anderer Therapien mit Radionukliden im G-DRG-System 2006 Nachdem die nuklearmedizinische Therapie in der Version 2005 des G-DRG-Systems völlig neu abgebildet
Liste der aktuell laufenden klinische Studien (Studie) und Nicht-interventionelle Studien (NIS)
 klinische n () und Nicht-interventionelle n () GMALL Registerstudie ALL (Akute lymphatische Leukämie ) ALL - diagnostizierte Patienten werden nach GMALL- Therapieempfehlungen behandelt und in das GMALL-Register
klinische n () und Nicht-interventionelle n () GMALL Registerstudie ALL (Akute lymphatische Leukämie ) ALL - diagnostizierte Patienten werden nach GMALL- Therapieempfehlungen behandelt und in das GMALL-Register
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Apremilast (Otezla ) Celgene GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 13.02.2015
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Apremilast (Otezla ) Celgene GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 13.02.2015
Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen
 Monotherapie bipolar affektiver Störung Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen Bonn (8. März 2010) Mit der Zulassung von Seroquel Prolong (Quetiapin) zur Phasenprophylaxe
Monotherapie bipolar affektiver Störung Seroquel Prolong ermöglicht kontinuierliche Therapie über alle Phasen Bonn (8. März 2010) Mit der Zulassung von Seroquel Prolong (Quetiapin) zur Phasenprophylaxe
Prevenar 13 für Erwachsene von 18 bis 49 Jahren
 Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus Update TKI-STOP
 Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Post St. Gallen Chemo- und Immuntherapie
 Post St. Gallen 2009 Chemo- und Immuntherapie Rupert Bartsch Universitätsklinik für Innere Medizin 1 Klinische Abteilung für Onkologie 1 Neue Daten von HERA und FinHER Empfehlungen des Panels zu Adjuvanten
Post St. Gallen 2009 Chemo- und Immuntherapie Rupert Bartsch Universitätsklinik für Innere Medizin 1 Klinische Abteilung für Onkologie 1 Neue Daten von HERA und FinHER Empfehlungen des Panels zu Adjuvanten
Personalisierte Medizin
 Personalisierte Medizin Möglichkeiten und Grenzen Prof. Dr. Friedemann Horn Universität Leipzig, Institut für Klinische Immunologie, Molekulare Immunologie Fraunhofer Institut für Zelltherapie und Immunologie
Personalisierte Medizin Möglichkeiten und Grenzen Prof. Dr. Friedemann Horn Universität Leipzig, Institut für Klinische Immunologie, Molekulare Immunologie Fraunhofer Institut für Zelltherapie und Immunologie
Tragende Gründe. Vom 28. Mai Inhaltsverzeichnis. 1. Rechtsgrundlagen. 2. Eckpunkte der Entscheidung. 3. Beratungsverlauf
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über einen Antrag zur Verordnungsfähigkeit der zulassungsüberschreitenden Anwendung eines Arzneimittels zu Lasten der gesetzlichen Krankenkassen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über einen Antrag zur Verordnungsfähigkeit der zulassungsüberschreitenden Anwendung eines Arzneimittels zu Lasten der gesetzlichen Krankenkassen
Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland
 Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Bevacizumab kann demnach bei selektionierten Patienten im
 Fortgeschrittenes NSCLC Neue S3-Leitlinie empfiehlt Bevacizumab Grenzach-Wyhlen (7. April 2010) - Die kürzlich veröffentlichte S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms
Fortgeschrittenes NSCLC Neue S3-Leitlinie empfiehlt Bevacizumab Grenzach-Wyhlen (7. April 2010) - Die kürzlich veröffentlichte S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms
Omalizumab Stolpersteine in der Therapie. Stephanie Korn III. Medizinische Klinik Universitätsmedizin Mainz
 Omalizumab Stolpersteine in der Therapie Stephanie Korn III. Medizinische Klinik Universitätsmedizin Mainz Stolpersteine 1. Alter Alter 484 Asthma-Patienten 174 Pat. 50 Jahre (40.7% männlich) 297 Pat.
Omalizumab Stolpersteine in der Therapie Stephanie Korn III. Medizinische Klinik Universitätsmedizin Mainz Stolpersteine 1. Alter Alter 484 Asthma-Patienten 174 Pat. 50 Jahre (40.7% männlich) 297 Pat.
Vom unklaren Symptomkomplex zur ganzheitlichen Diagnose
 Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Neues in der Diagnose der Tuberkulose
 Neues in der Diagnose der Tuberkulose Klinische Diagnose Dr. med. Alexander Turk Zürcher Höhenklinik Wald alexander.turk@zhw.ch Tuberkulose in Homo erectus vor 500 000 Jahren? AMERICAN JOURNAL OF PHYSICAL
Neues in der Diagnose der Tuberkulose Klinische Diagnose Dr. med. Alexander Turk Zürcher Höhenklinik Wald alexander.turk@zhw.ch Tuberkulose in Homo erectus vor 500 000 Jahren? AMERICAN JOURNAL OF PHYSICAL
KLINISCHE PRÜFUNG EINE EINFÜHRUNG. ATA Conference 2003 - Elke Vogt-Arendt
 KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
Psoriasis Arthritis - Krankheitsbild und Therapiemöglichkeiten
 Psoriasis Arthritis - Krankheitsbild und Therapiemöglichkeiten Dr. med. univ. Helga Merwald-Fraenk Psoriasis Arthritis (PsA) Die PsA ist eine mit der Schuppenflechte assoziierte klinisch heterogene entzündliche
Psoriasis Arthritis - Krankheitsbild und Therapiemöglichkeiten Dr. med. univ. Helga Merwald-Fraenk Psoriasis Arthritis (PsA) Die PsA ist eine mit der Schuppenflechte assoziierte klinisch heterogene entzündliche
Röntgentherapie zur Schmerzlinderung bei Erkrankungen der Gelenke
 Röntgentherapie zur Schmerzlinderung bei Erkrankungen der Gelenke Was wird bestrahlt: - Calcaneodynie - Epicondylitis - Omarthrose - Periarthropathia humeroscapularis - Gonarthrose - Bursitis trochanterica
Röntgentherapie zur Schmerzlinderung bei Erkrankungen der Gelenke Was wird bestrahlt: - Calcaneodynie - Epicondylitis - Omarthrose - Periarthropathia humeroscapularis - Gonarthrose - Bursitis trochanterica
96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
 Pressemitteilung EULAR 2014: Aktuelle Daten zum PEGylierten anti-tnf bei axspa und PsA 96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
Pressemitteilung EULAR 2014: Aktuelle Daten zum PEGylierten anti-tnf bei axspa und PsA 96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
Von Prof. Dr. Maurice Stephan Michel, Universitätsklinikum, Mannheim
 Das logische Prinzip GnRH Blocker" Von Prof. Dr. Maurice Stephan Michel, Universitätsklinikum, Mannheim Stuttgart (25. September 2008) - Die chirurgische Kastration bewirkt bereits innerhalb weniger Stunden
Das logische Prinzip GnRH Blocker" Von Prof. Dr. Maurice Stephan Michel, Universitätsklinikum, Mannheim Stuttgart (25. September 2008) - Die chirurgische Kastration bewirkt bereits innerhalb weniger Stunden
Osteoporose, Spondylarthropathien
 KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Osteoporose, Spondylarthropathien Dr. med. Nadine Schneider Teriparatid oder Alendronat bei Glukokortikoidinduzierter Osteoporose? (Saag et al. NEJM 2007; 357:2028-39)
KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Osteoporose, Spondylarthropathien Dr. med. Nadine Schneider Teriparatid oder Alendronat bei Glukokortikoidinduzierter Osteoporose? (Saag et al. NEJM 2007; 357:2028-39)
Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2015
 Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2015 Die folgenden Hinweise sollen die Abrechnung und Handhabung des DRG- Systemzuschlags im Jahr 2015 verdeutlichen.
Hinweise der Selbstverwaltungspartner zur Abrechnung und Handhabung des DRG-Systemzuschlags 2015 Die folgenden Hinweise sollen die Abrechnung und Handhabung des DRG- Systemzuschlags im Jahr 2015 verdeutlichen.
