Estradiol Linoladiol Estradiol - Emulsion. Estradiol Montadiol 0,01 % Creme. Estradiol Linoladiol N 10mg/100g (0.01%)
|
|
|
- Mina Solberg
- vor 8 Jahren
- Abrufe
Transkript
1 Anhang I Verzeichnis der Bezeichnungen, Darreichungsformen, Stärken, Arten der Anwendung der Arzneimittel, der Inhaber der Genehmigung für das Inverkehrbringen in den Mitgliedstaaten 1
2 Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung Mitgliedstaat EU/EWR Inhaber der Genehmigung für das Inverkehrbringen INN Name Stärke Darreichungsform Art der Anwendung Österreich Österreich Pharmazeutische Fabrik Montavit GesmbH Salzbergstraße Absam Austria Pharmazeutische Fabrik Montavit GesmbH Salzbergstraße Absam Austria Estradiol Linoladiol Estradiol - Emulsion Estradiol Montadiol 0,01 % Creme 10mg/100g (0.01%) 10mg/100g (0.01%) Vaginalemulsion Creme Anwendung auf der Haut, vaginale Anwendung Anwendung auf der Haut, vaginale Anwendung Bulgarien Tschechische Republik Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Estradiol Linoladiol N 10mg/100g (0.01%) Estradiol Linoladiol N 10.33mg/100g (10mg/100g; 0.01%) Creme Creme Anwendung auf der Haut, vaginale Anwendung Anwendung auf der Haut, vaginale Anwendung Estland Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Estradiol Linoladiol N 10mg/100g (0.01%) Creme Anwendung auf der Haut, vaginale Anwendung 2
3 Mitgliedstaat EU/EWR Inhaber der Genehmigung für das Inverkehrbringen INN Name Stärke Darreichungsform Art der Anwendung Deutschland Ungarn Lettland Litauen Slowakei Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Estradiol Linoladiol N 10mg/100g (0.01%) Creme topischen Anwendung Estradiol Linoladiol 0.1 mg/g 0.1mg/g Creme Anwendung auf gél der Haut, vaginale Anwendung Estradiol Linoladiol N 0,1 10mg/100g Vaginalcreme vaginale mg/g vaginal cream (0.01%) Anwendung, topischen Anwendung Estradiol Linoladiol N 10mg/100g Creme Anwendung auf (0.01%) der Haut, vaginale Anwendung Estradiol Linoladiol N 10mg/100g Creme Anwendung auf (0.01%) der Haut 3
4 Arzneimittel mit 0,005 Gew.-% Estradiol/0,4 Gew.-% Prednisolon zur topischen Anwendung Mitgliedstaat EU/EWR Inhaber der Genehmigung für das Inverkehrbringen INN Name Stärke Darreichungsform Art der Anwendung Estland Deutschland Lettland Litauen Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Dr. August Wolff GmbH&Co. KG Arzneimittel Sudbrackstrasse Bielefeld Germany Estradiol Prednisolon Estradiol Prednisolon Estradiol Prednisolon Estradiol Prednisolon Linoladiol HN Linoladiol HN Linoladiol-HN 0,05 mg/4 mg/g cream Linoladiol HN 0.05mg/g 4mg/g 0.005g/100g (0.005%) 0.05mg/g 4 mg/g 0.05mg/g 4 mg/g Creme Creme Creme Creme Anwendung auf der Haut topischen Anwendung Anwendung auf der Haut Anwendung auf der Haut 4
5 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 5
6 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Arzneimitteln mit hoher Konzentration von Estradiol zur topischen Anwendung Deutschland (BfArM) forderte im Mai 2012 die Bewertung des allgemeinen Nutzen-Risiko-Verhältnisses von Arzneimitteln mit hoher Konzentration von Estradiol (E2) an, die für die topische Anwendung zur Behandlung von Scheidenatrophie (intravaginal oder auf der Haut von Vulva und Vagina) indiziert sind. Deutschland hatte Bedenken dahingehend, dass diese Estradiol enthaltende Präparate, die nur für die lokale Anwendung indiziert sind, nach der Applikation eine hohe Konzentration im Blut ergeben, was nur bei Präparaten vorkommt, die für die systemische Anwendung zugelassen sind. In diesem Verfahren wurden zwei Gruppen von Präparaten beurteilt, die von Linoladiol N (Creme, 0,01 Gew.-% Estradiol) und Linoladiol HN (Creme, 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon) repräsentiert wurden. Linoladiol N und Linoladiol HN sind über nationale Verfahren in verschiedenen Mitgliedstaaten zugelassen. Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung (Linoladiol N) Der CHMP berücksichtigte alle vorliegenden Daten zu Pharmakokinetik (PK), Dosisfindung, Wirksamkeit und Sicherheit, einschließlich der endometrialen Sicherheit, von Präparaten für die intravaginale Applikation und/oder die Applikation auf die Haut der Vulva, die Estradiol enthalten, sowie die hinreichend bekannten Risiken einer systemischen Hormonersatztherapie (HRT) in den zugelassenen Anwendungsgebieten. Die Hauptstudien zur Stützung der intravaginalen Applikation sind die Studien SCO 5109 und SCO In der explorativen, monozentrischen, einphasigen Studie SCO 5109 wurde die Bioverfügbarkeit von Estradiol aus Linoladiol N bei 16 gesunden postmenopausalen Frauen im Alter zwischen 45 und 70 Jahren bestimmt. Die primäre Zielsetzung der Studie war die Abschätzung des Grads der Estradiol- Exposition nach Applikation der Prüfformulierung Linoladiol N. Die primären Variablen waren AUC δ0-36 und C δmax von Estradiol, d. h. der Grad der Exposition wurde als Fläche unter der Baseline-adjustierten Estradiolkonzentrationskurve und der Baseline-adjustierten maximalen Plasmakonzentration von Estradiol geschätzt. Der mittlere Wert von AUC 0-36 (1285,2 pg/ml h) und C max (103,5 pg/ml) weist auf eine systemische Exposition gegenüber dem Estradiol aus der intravaginalen Creme hin. Die Bestimmung der Estradiol- Serumkonzentrationen ergab die folgenden Hauptergebnisse: Baseline-adjustierte AUC δ0-36 von 900,8 pg/ml h, Baseline-adjustierte C δmax von 92,2 pg/ml. Die angepasste mittlere C δmax (92,2 pg/ml) entsprach 89 % der gesamten C max. Die Spitzenkonzentration von Estradiol war 6 Stunden nach der Applikation (Median) erreicht. Sechsunddreißig Stunden nach der Applikation waren die Estradiolkonzentrationen bei den meisten Probandinnen wieder auf die Anfangswerte (Baseline) vor Dosisgabe zurückgegangen. Der mittlere Baseline-Wert der Estradiol-Serumkonzentration betrug 11,3 pg/ml. Nach 36 Std., d. h. zum Zeitpunkt der letzten Entnahme von Blutproben, betrug die mittlere Estradiol-Serumkonzentration 10,7 pg/ml. Studie SCO 5174, eine randomisierte, doppelblinde, placebokontrollierte Parallelgruppenstudie nach der Zulassung, untersuchte die Wirksamkeit und Sicherheit von Linoladiol N bei der Behandlung von 48 postmenopausalen Frauen mit Scheidenatrophie. Der primäre Prüfparameter war der Vaginal Maturation Index (VMI). Zu den sekundären Prüfparametern zählten Scheidenatrophie-Symptome und der ph-wert in der Scheide. In Bezug auf den VMI war Linoladiol N gegenüber dem Placebo statistisch 6
7 signifikant überlegen (mittlerer VMI der mit Linoladiol N behandelten Gruppe: Ausgangswert 24,47 %, Wert an Tag 31 64,23 %; Placebogruppe: Ausgangswert 32,01 %, Wert an Tag 31 37,17 %). In dieser Studie betrugen die mittleren Estradiol-Serumkonzentrationen zu Beginn und an Tag 31 (d. h. etwa 36 Stunden nach Applikation des Studienmedikaments an Tag 29) 6,4 pg/ml bzw. 15,1 pg/ml bei den Anwenderinnen von Linoladiol N und 4,4 pg/ml bzw. 6,2 pg/ml in der Placebogruppe. Es wurden keine Studien zur kutanen Anwendung von Linoladiol N im äußeren Genitalbereich vorgelegt. Nach Ansicht des CHMP zeigen die pharmakokinetischen Daten, dass Estradiol nach vaginaler Applikation von Linoladiol N resorbiert wird. Da die Estradiolkonzentrationen die im Bereich von 10 bis 20 pg/ml liegenden postmenopausalen Konzentrationen überschreiten, sind systemische Auswirkungen zu erwarten. 1 Die systemischen Estradiolkonzentrationen in diesen beiden Studien warfen Bedenken auf. Auf der Grundlage der Studie SCO 5109 wurde der Schluss gezogen, dass zweimal wöchentlich ähnliche Estradiol-Serumkonzentrationen wie bei einer systemischen Hormonersatztherapie (HRT) gemessen werden. In der Studie SCO 5174 wurde darüber hinaus festgestellt, dass die Estradiol- Serumkonzentrationen etwa 36 Std. nach Applikation von Linoladiol N nicht auf den Ausgangswert zurückgegangen waren. Es wurde ein Vergleich der pharmakokinetischen Daten mit denen anderer lokal applizierter Arzneimittel durchgeführt. Der CHMP stellte fest, dass die für Linoladiol N empfohlene Erhaltungsdosis etwa 8 Mal höher als die Erhaltungsdosis bei Vaginaltabletten mit 25 µg Estradiol und einem Estradiol- Scheidenring und 20 Mal höher als die Erhaltungsdosis bei Vaginaltabletten mit 10 µg Estradiol ist. Der CHMP pflichtete dem Zulassungsinhaber bei, dass nicht nur die Dosis, sondern auch Resorption und systemische Konzentrationen von topisch appliziertem Estradiol von Interesse sind. Es wurde eine historische Analyse pharmakokinetischer Daten zu Estradiol nach vaginaler Applikation aus mehreren veröffentlichten Studien durchgeführt. Von den drei genannten Vergleichspräparaten (Vaginaltabletten mit 10 und 25 µg und Scheidenring) führen Vaginaltabletten mit 25 µg Estradiol zu der höchsten systemischen Estradiol-Exposition und wurden daher für den Vergleich mit Linoladiol N herangezogen. Den Studien von Notelovitz (2002) und Nilsson und Heimer (1992) zufolge betrug die C max ohne Baseline-Adjustierung nach einer Einzeldosis der Vaginaltabletten mit 25 µg Estradiol 206 pmol/l, während die C Durchschnitt ohne Baseline-Adjustierung in den ersten 24 Std. 86 pmol/l betrug. Zum Vergleich: Nach einer Einzeldosis von Linoladiol N betrug die C max ohne Baseline-Adjustierung 393 pmol/l und die C Durchschnitt ohne Baseline-Adjustierung in den ersten 24 Std. 178 pmol/l (Lauritzen, 1992; Göres, 1995 und Mazur, 2003). Bei Berücksichtigung der Baseline-adjustierten Werte betrugen die C max und die C Durchschnitt in dem 24- Stunden-Zeitraum nach der Applikation von Vaginaltabletten mit 25 µg Estradiol 175 pmol/l bzw. 55 pmol/l und nach Applikation von Linoladiol N 331 pmol/l bzw. 120 pmol/l. Obwohl historische Vergleiche mit anderen lokal applizierten Arzneimitteln Beschränkungen unterliegen, kann der Schluss gezogen werden, dass die Estradiol-Exposition nach Applikation von Linoladiol N erheblich höher ist als nach Applikation von anderen, schwächer dosierten Estradiol-Präparaten für die topische intravaginale Therapie. Die wöchentliche Exposition ist bei Linoladiol N höher als bei anderen Präparaten, was Sicherheitsbedenken aufwirft, insbesondere in Bezug auf die Möglichkeit einer systemischen Langzeitexposition in der täglichen klinischen Praxis. Die Pharmakokinetik des Dosierungsschemas von Linoladiol N bei Applikation auf die Haut der Vulva wurde nicht untersucht. 1 Clinical Gynaecologic Endocrinology and Infertility, 8e, Marc A Fritzand, Leon Speroff (Chapter 17: menopause and the peri-menopausal transition) 7
8 Daher gelangte der CHMP zu dem Schluss, dass das Anwendungsgebiet nur auf die vaginale Behandlung (d. h. nicht auf die Haut der Vulva) nach einem Behandlungsversagen mit schwächer dosiertem Östrogen und die Behandlungsdauer auf vier Wochen beschränkt werden sollten. Der Abschnitt zur Dosierung sollte diesbezüglich klare Angaben enthalten. Nach Ansicht des CHMP sind die verfügbaren Daten zur Sicherheit von Linoladiol begrenzt und liegt keine prospektive Beurteilung der Sicherheit und insbesondere der endometrialen Sicherheit vor. Was die Pharmakovigilanzdaten anbelangt, so wurden insgesamt 11 Fälle gemeldet, darunter Spontanmeldungen und Literaturfälle. Aufgrund der geringen Zahl an gemeldeten Fällen zu Linoladiol N und der Beeinflussung durch gemeldete Fälle mit endometrialen Ereignissen können jedoch auf der Grundlage der Daten nach der Markteinführung keine Schlussfolgerungen bezüglich der endometrialen Sicherheit gezogen werden. Über die Bedenken hinsichtlich der endometrialen Sicherheit hinaus sind systemische, Östrogen enthaltende Präparate für die HRT mit bekannten Risiken für Mammakarzinom, Ovarialkarzinom, venöse Thromboembolie und ischämischen Schlaganfall verbunden. Nach Ansicht des CHMP müssen daher in Anbetracht der potenziellen Risiken in Verbindung mit jeder HRT-Behandlung in den jeweiligen Abschnitten der Produktinformation entsprechende Angaben zur Überwachung und angemessene Warnhinweise, z. B. zu endometrialer Hyperplasie und Endometrialkarzinom, Mammakarzinom und Ovarialkarzinom, enthalten sein. Überdies wird die Beschränkung der Anwendung dieser Präparate auf 4 Wochen durch die derzeit vorliegenden klinischen Daten gerechtfertigt. Wegen der unspezifischen bislang erfolgten Sicherheitsmeldungen und der bekanntermaßen mangelnden Sensitivität von Spontanmeldungen sind jedoch nur die gut bekannten Risiken einer systemischen HRT zu erwarten. Die Einschränkung der Indikation auf die intravaginale Anwendung (und nicht auf die Haut der Vulva) nach einem Behandlungsversagen mit schwächer dosiertem Östrogen und die Begrenzung der Behandlungsdauer spiegeln die vorliegenden wissenschaftlichen und klinischen Daten und den aktuellen klinischen Wissensstand zur Anwendung von topisch applizierten, Estradiol enthaltenden Präparaten und von Linoladiol N in besserem Maß wider. Arzneimittel mit 0,005 Gew.-% Estradiol/0,4 Gew.-% Prednisolon zur topischen Anwendung (Linoladiol HN) Der CHMP prüfte auch die vorliegenden Daten für Linoladiol HN, die sich hauptsächlich auf Daten nach der Markteinführung beschränkten. Es wurden keine klinischen Studien zur PK/Resorption von Estradiol und Prednisolon oder zur Dosisfindung und Wirksamkeit von Linoladiol HN in den zugelassenen therapeutischen Anwendungsgebieten vorgelegt. Linoladiol HN enthält sowohl Estradiol als auch Prednisolon, und es ist von einer entzündungshemmenden Wirkung des Prednisolons auf entzündete Haut auszugehen. Aufgrund des Gehalts des Kortikosteroids Prednisolon wird die Anwendung von Linoladiol HN nur für eine Kurzzeittherapie (bis zu vier Wochen) empfohlen. Der CHMP berücksichtigte, dass Linoladiol HN weiterhin bei der anfänglichen äußeren Kurzzeitbehandlung akuter, leichter, entzündlicher, brennender und juckender Hauterkrankungen des äußeren Genitalbereichs der Frau angewendet werden könne, bei denen schwach wirksame Kortikosteroide und schwach dosiertes Estradiol indiziert sind. Darüber hinaus sollten klare Angaben zu dem zu behandelnden Patientenkollektiv (postmenopausale Frauen) hinzugefügt werden. Darüber hinaus sollte die maximale Behandlungsdauer nach Auffassung des CHMP weiterhin auf vier Wochen beschränkt bleiben, und der Abschnitt zur Dosierung sollte klare Angaben darüber enthalten, dass eine Behandlung über vier Wochen hinaus nicht empfohlen wird. Was die Anwendung von Linoladiol HN zur Behandlung von Lichen sclerosus genitalis anbelangt, stellte der CHMP fest, dass Estradiol nach derzeitigem klinischen Wissen über die Behandlung dieser 8
9 Erkrankung keine Behandlungsoption darstellt. Der CHMP empfahl daher, diese Indikation aus der Produktinformation zu entfernen. Obwohl Linoladiol HN eine niedrigere Östrogenkonzentration (halb soviel) als Linoladiol N enthält, vertrat der CHMP darüber hinaus die Auffassung, dass die Produktinformation trotzdem angemessene Warnhinweise zu den Risiken einer Hormonersatztherapie enthalten sollte. Es wird eine klinische Überwachung erwartet, und es sollte mit Vorsicht vorgegangen werden, z. B. bei Patientinnen mit malignen östrogenabhängigen Tumoren oder Gebärmuttertumoren. Es ist auf mögliche systemische Nebenwirkungen und Hautatrophie zu achten. Von einer längeren Anwendung wird abgeraten, und als unerwünschte Wirkungen wurden Hautreizung, Überempfindlichkeit und Schmierblutung angegeben. Ferner enthielt die Produktinformation dem aktuellen wissenschaftlichen Kenntnisstand entsprechende Angaben zum Wesen des Wirkstoffes Estradiol als stärkstes Östrogen und die potenziellen Auswirkungen auf die Haut und die Erbinformation. Allgemeines Nutzen-Risiko-Verhältnis Der Ausschuss gelangte zu dem Schluss dass das Nutzen-Risiko-Verhältnis von Arzneimitteln mit 0,01 Gew.-% Estradiol für die kurzzeitige äußere Behandlung von Scheidenatrophie bei postmenopausalen Patientinnen nach Scheitern mindestens einer topischen Östrogenbehandlung nach wie vor positiv ist, vorbehaltlich der vereinbarten Einschränkungen, Warnhinweise und Änderungen der Produktinformation. Der Ausschuss gelangte zu dem Schluss, dass das Nutzen-Risiko-Verhältnis von Arzneimitteln mit 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon für die topische Anwendung zur anfänglichen äußeren Kurzzeitbehandlung akuter, leichter, entzündlicher, brennender und juckender Hauterkrankungen des äußeren Genitalbereichs bei postmenopausalen Patientinnen, bei denen schwach wirksame Kortikosteroide und schwach dosiertes Estradiol indiziert sind, weiterhin positiv ist, vorbehaltlich der Einschränkungen, Warnhinweise und vereinbarten Änderungen der Produktinformation. Überprüfungsverfahren Nach der Annahme des Gutachtens und der Empfehlungen des CHMP bei der CHMP-Sitzung im Dezember 2013 beantragte ein Zulassungsinhaber eine erneute Überprüfung nur des Arzneimittels Linoladiol N. Der Zulassungsinhaber erklärte sich einverstanden, angesichts der Bedenken in Bezug auf die Daten zur Langzeitexposition und der fehlenden Studiendaten zur Frage der Behandlung der Haut der Vulva, die Höchstdauer der Behandlung auf vier Wochen zu begrenzen und die Art der Anwendung auf die intravaginale Applikation zu beschränken. In seiner Begründung für die erneute Überprüfung nannte der Zulassungsinhaber zwei Hauptpunkte unterschiedlicher wissenschaftlicher Auffassung gegenüber dem Gutachten des CHMP. Der Zulassungsinhaber widersprach in erster Linie der empfohlenen Einschränkung der Indikation Behandlung von Scheidenatrophie aufgrund von Östrogenmangel bei postmenopausalen Frauen nach Scheitern mindestens einer niedriger dosierten topischen Östrogenbehandlung für Linoladiol N. Der Zulassungsinhaber bevorzugte die ursprüngliche Indikation Behandlung von Scheidenatrophie aufgrund von Östrogenmangel bei postmenopausalen Frauen. Zweitens stimmte der Zulassungsinhaber der Beurteilung des Gesamtprofils des Präparats Linoladiol N seitens des CHMP nicht zu. Er argumentierte, dass das pharmakokinetische Profil, die systemische Exposition und die potenziellen Risiken nicht in Bezug auf eine systemische HRT beurteilt werden 9
10 sollten und dass die topische Anwendung von Linoladiol N nicht mit einer systemischen HRT- Behandlung verglichen werden kann. Somit widersprach er einigen der vom CHMP zur Aufnahme in die Produktinformation vorgeschlagenen Änderungen. Nachstehend sind die Schlussfolgerungen des CHMP zu diesen Punkten, die in der Begründung des Zulassungsinhabers genannt sind, aufgeführt. Der CHMP nahm eine erneute Beurteilung der vorliegenden Wirksamkeitsdaten in der betreffenden Indikation vor. Insbesondere prüfte der CHMP noch einmal die verfügbaren pharmakokinetischen Daten sowie den Vergleich mit bestehenden Behandlungen unter Berücksichtigung der internationalen Leitlinien. In den klinischen Leitlinien 2,3 wird die Anwendung topischer Östrogene nach mangelndem/unzureichendem Ansprechen auf nicht-hormonelle vaginale Gleitmittel/Befeuchtungsmittel und andere nicht-hormonelle Interventionen vorgeschlagen. Arzneimittel mit hochdosiertem Estradiol wie Linoladiol N werden in diesen Empfehlungen nicht gesondert berücksichtigt. Die Verfasser stellen fest, dass bei postmenopausalen Frauen, die Vaginalsymptome als einzige Beschwerden angeben, diese Symptome sicher und wirksam mit einer niedrig dosierten Östrogentherapie behandelt werden können, was die Risiken in Verbindung mit einer systemischen Langzeithormontherapie reduziert. Was die PK-Daten anbelangt, sind die systemischen Konzentrationen von Estradiol aufgrund gut bekannter Sicherheitsbedenken von Interesse. Bei dem Befassungsverfahren wurde ein Vergleich der für Linoladiol N verfügbaren pharmakokinetischen Daten mit denen anderer lokal applizierter Arzneimittel durchgeführt. Bei diesem Vergleich wurden drei andere intravaginal applizierte Arzneimittel berücksichtigt: Vaginaltabletten mit 10 µg und 25 µg und ein Vaginalring mit 2 mg. Ausgehend von dem vorgelegten Vergleich der C max - und C Durchschnitt -Werte für Linoladiol N scheint es, dass die systemische Exposition gegenüber Estradiol im Fließgleichgewicht (zweimal wöchentlich) etwa 2,5 bis 3 Mal höher ist als bei den 10-µg-Tabletten und bei Linoladiol N Creme etwa 25 % höher ist als bei den 25-µg- Tabletten. Ungeachtet etwaiger Einschränkungen aufgrund historischer Vergleiche lässt sich der Schluss ziehen, dass die bei Anwendung von Linoladiol N festgestellte systemische Estradiol-Exposition höher ist als die bei anderen Estradiolpräparaten zur topischen Anwendung in der Scheide. Die bei zweimal wöchentlicher Applikation dieses Präparats gemessenen systemischen Werte sind vergleichbar mit denen von Produkten im mittleren Estradiol-Dosierungsbereich. Ob das Risiko bei zweimal wöchentlicher Applikation (mit zweimal wöchentlicher hoher systemischer Östrogen-Exposition) niedriger ist als bei täglicher Applikation, ist derzeit nicht bekannt, stellt aber einen wichtigen Punkt für Bedenken dar. Die vorliegenden pharmakokinetischen Daten zeigen, dass Estradiol nach intravaginaler Applikation von Linoladiol N systemisch resorbiert wird. Aus den PK-Daten der Studie SCO 5174 geht ferner hervor, dass die Spitzenwerte der Estradiolkonzentrationen 6 Stunden nach der Applikation (C max 92,2 pg/ml) die empfohlenen postmenopausalen Werte deutlich überschreitet und auch 36 Stunden nach der Applikation der Ausgangswert noch nicht wieder erreicht ist (wahrscheinliche Talspiegel). Es wurden auch geringere Konzentrationen von FSH und LH beobachtet, die ferner auf eine signifikante systemische Exposition hindeuten. Da die bei Anwendung von Linoladiol N beobachtete systemische Exposition viel höher ist als bei anderen, für die intravaginale Anwendung erhältlichen, Estradiol enthaltenden Präparaten, wird die Beschränkung der Behandlungsdauer auf vier Wochen angesichts der bestehenden Sicherheitsbedenken und der diesbezüglichen Unsicherheiten hinsichtlich der systemischen Estradiol- 2 Rees et al. EMAS clinical guide: Low-dose vaginal estrogens for postmenopausal vaginal atrophy. Maturitas. 2012; 73: Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause, (9):
11 Exposition bei diesem Präparat in der Zielgruppe der postmenopausalen Frauen als eine angemessene Maßnahme zur Risikominimierung erachtet. Eine systemische Exposition ist bei einer topischen Therapie weder notwendig noch ratsam und gibt Anlass zu bei einer systemischen HRT bekannten Sicherheitsbedenken. Mit Blick auf die Sicherheit ist dieses Präparat daher aufgrund der höheren Dosis und der erheblichen systemischen Estradiol- Exposition eher mit systemischen HRT-Präparaten vergleichbar. Da es sich bei der Scheidenatrophie bei postmenopausalen Frauen aufgrund des Östrogenmangels um eine chronische Erkrankung handelt, ist von einem erneuten Auftreten der Anzeichen und Symptome auszugehen, wenn eine topische Östrogentherapie wieder abgesetzt wird. Ein Anstieg des östrogenbedingten Risikos bei wiederholter Anwendung dieses Präparats ist nicht auszuschließen. Aus diesem Grund empfahl der CHMP, die Anwendung dieser Arzneimittel auf nur 4 Wochen zu begrenzen (keine Anwendungswiederholung), und empfahl ferner, bei erneutem Auftreten von Symptomen einer Scheidenatrophie entweder nicht hormonelle oder topische Arzneimittel mit schwächer dosiertem Estradiol in Betracht zu ziehen. Der Ausschuss akzeptierte das Argument des Zulassungsinhabers, dass obwohl die aktuellen klinischen Leitlinien zwischen systemischen und topischen Östrogenbehandlungen unterscheiden und topische Behandlungen für diese Erkrankung eindeutig empfohlen werden, sie keine Empfehlung für ein Ranking der verschiedenen topischen Behandlungen aussprechen. Eine Zweitlinienindikation, wie im ursprünglichen CHMP-Gutachten vorgeschlagen,, d. h. die Anwendung von Linoladiol Nnach Scheitern einer niedrig dosierten topischen Estradiolbehandlung, ist zwar beabsichtigt, in den internationalen Leitlinien jedoch nicht explizit genannt. Der Ausschuss stimmte daher gemäß der Argumentation des Zulassungsinhabers zu, dass die Indikation Behandlung von Scheidenatrophie aufgrund von Östrogenmangel bei postmenopausalen Frauen lauten sollte, vorbehaltlich einer Beschränkung der Anwendungsdauer dieser Arzneimittel auf lediglich 4 Wochen (ohne Anwendungswiederholung), wie vorstehend erwähnt. Zur Durchsetzung dieser kurzen Anwendungsdauer verlangte der CHMP die Rücknahme der Packungsgrößen zu 100 g in allen EU-Mitgliedstaaten, in denen die Präparate zugelassen sind, da diese große Packungsgröße der Creme in Anbetracht der neuen Empfehlungen zur Anwendungsdauer als überflüssig erachtet wird. Zur weiteren Minimierung eines etwaigen potenziellen Sicherheitsrisikos wurden die Zulassungsinhaber ferner ersucht, einen detaillierten Plan mit genauen kurzen Fristen zur Ausstattung der kleineren Packungsgröße (25 g) mit einem Applikator sowie zum Rückruf der Packungsgrößen zu 35 g und 50 g in allen EU-Mitgliedstaaten, in denen die Präparate zugelassen sind, vorzulegen. Allgemeine Nutzen-Risiko-Bewertung Die aktuellen Behandlungsleitlinien für Scheidenatrophie empfehlen die Anwendung niedrig dosierter lokaler vaginaler Östrogene zusammen mit nicht-hormonellen Gleit- oder Befeuchtigungsmitteln. Eine vaginale Östrogentherapie bewirkt nachweislich eine Verbesserung der Anzeichen und Symptome von Scheidenatrophie. Auf Grundlage der Gesamtheit der bislang verfügbaren Daten zur Sicherheit und Wirksamkeit von Arzneimitteln mit 0,01 Gew.-% Estradiol bestätigte der CHMP, dass das Nutzen- Risiko-Verhältnis vorbehaltlich der Einschränkungen, Warnhinweise, Änderungen in den Produktinformation und vereinbarten Risikominimierungsmaßnahmen weiterhin positiv ist. 11
12 Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen In Erwägung nachstehender Gründe: Der Ausschuss berücksichtigte das Verfahren nach Artikel 31 der Richtlinie 2001/83/EG für die Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung sowie für Festdosiskombinationspräparate mit 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon zur topischen Anwendung. Der Ausschuss prüfte alle verfügbaren Daten aus klinischen Studien, pharmakoepidemiologischen Studien, der veröffentlichten Literatur, den Erfahrungen nach der Markteinführung sowie die von den Zulassungsinhabern eingereichten schriftlichen Antworten und mündlich vorgetragenen Erläuterungen zur Wirksamkeit und Sicherheit dieser Arzneimittel zur topischen Anwendung. Was die Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung anbelangt, ist das Nutzen-Risiko-Verhältnis im aktuell zugelassenen Anwendungsgebiet in Anbetracht der derzeit verfügbaren Daten nach Ansicht des Ausschusses positiv, vorbehaltlich der Einschränkungen, Warnhinweise und sonstigen Änderungen an der Produktinformation sowie der weiteren vereinbarten Risikominimierungsmaßnahmen. Insbesondere wird die Behandlung auf Scheidenatrophie bei postmenopausalen Frauen angewendet, die Dauer der Behandlung sollte auf vier Wochen begrenzt werden, und das Präparat ist nur für die intravaginale Applikation bestimmt. Darüber hinaus wurden die Gegenanzeigen und Warnhinweise aktualisiert, um die internationalen Leitlinien und den derzeitigen klinischen Wissensstand zur Sicherheit einer systemischen HRT zu berücksichtigen, vor allem in Bezug auf Thromboembolie sowie Brustund Endometrialkrebs, sowie die bekanntermaßen mangelnde Sensitivität von Spontanmeldungen von unerwünschten Ereignissen. Damit die Anwendung der Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung tatsächlich auf höchstens 4 Wochen begrenzt bleibt, erlegte der CHMP die Rücknahme der Packungsgröße zu 100 g in allen EU-Mitgliedstaaten auf, in denen die Präparate zugelassen sind. Die Zulassungsinhaber wurden ferner ersucht, einen detaillierten Plan mit genauen kurzen Fristen zur Anpassung der kleineren Packungsgröße (25 g) sowie zum Rückruf der Packungsgrößen zu 35 g und 50 g in allen EU-Mitgliedstaaten, in denen die Präparate derzeit zugelassen sind, vorzulegen. Was die Arzneimittel mit 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon zur topischen Anwendung anbelangte, vertrat der Ausschuss die Meinung, dass diese Präparate in Anbetracht der derzeit verfügbaren Sicherheitsdaten für die anfängliche kurzzeitige äußere Behandlung von akuten, leichten, entzündlichen Hauterkrankungen des äußeren Genitalbereichs bei postmenopausalen Frauen angewendet werden sollten, bei denen schwach wirksame Kortikosteroide und Estradiol indiziert sind. Es wurden Einschränkungen, Warnhinweise und sonstige Änderungen an der Produktinformation vorgeschlagen, um den derzeitigen klinischen Wissensstand über die Sicherheit einer HRT, insbesondere zu Thromboembolie und Brust- und Endometrialkrebs, widerzuspiegeln. Der Ausschuss ist der Ansicht, dass nach derzeitigem klinischen Wissensstand der Nutzen von Arzneimitteln mit 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon gegenüber dem Risiko in der Indikation Lichen sclerosus genitalis nicht überwiegt, sodass diese Indikation daher gestrichen werden sollte 12
13 gelangte der Ausschuss folglich zu dem Schluss, dass das Nutzen-Risiko-Verhältnis der Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung sowie der Arzneimittel mit 0,005 Gew.-% Estradiol und 0,4 Gew.-% Prednisolon zur topischen Anwendung weiterhin positiv ist, vorbehaltlich der Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen in der Form von Einschränkungen, Warnhinweisen und sonstigen Änderungen an der Produktinformation sowie der vereinbarten Risikominimierungsmaßnahmen, soweit zutreffend. 13
14 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die Änderungen der entsprechenden Abschnitte der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilage sind das Ergebnis des Befassungsverfahrens. Die Produktinformationen können nachfolgend von den zuständigen Behörden der Mitgliedstaaten und in Absprache mit dem Referenzmitgliedstaat, falls erforderlich, gemäß dem Verfahren in Kapitel 4 von Titel III der Richtlinie 2001/83/EG aktualisiert werden. 14
15 Teil A. - Arzneimittel mit 0,01 Gew.-% Estradiol zur topischen Anwendung (gemäß Anhang I) [Die bestehenden Produktinformationen müssen in der Weise geändert werden (ggf. Einfügen, Ersetzen oder Löschen des Texts), dass sie den vereinbarten Wortlaut, wie im Folgenden aufgeführt, widerspiegeln] I. Zusammenfassung der Merkmale des Arzneimittels Abschnitt Anwendungsgebiete [Der Wortlaut des Anwendungsgebiets sollte gelöscht und durch folgenden Text ersetzt werden] Zur Behandlung von vaginaler Atrophie aufgrund von Estrogenmangel bei postmenopausalen Frauen. Abschnitt 4.2 Dosierung und Art der Anwendung [Der folgende Text sollte den bestehenden Text dieses Abschnitts ersetzen] Sowohl für den Beginn als auch für die Fortführung einer Behandlung postmenopausaler Symptome ist die niedrigste wirksame Dosis für die kürzestmögliche Therapiedauer anzuwenden (siehe auch Abschnitt 4.4). Art der Anwendung: Vaginalcreme [Phantasiebezeichnung] sollte mit einem Applikator eingeführt werden. Eine Applikatorfüllung (= 2 g Creme) wird vor dem Schlafengehen eingeführt. Während der ersten Woche sollte [Phantasiebezeichnung] jeden zweiten Tag, d. h. in Abständen von 48 Stunden, und danach zweimal wöchentlich (Erhaltungsdosis) angewendet werden. Der Applikator sollte nach jedem Gebrauch mit warmem Wasser gereinigt werden. Die Behandlung kann an einem beliebigen Tag begonnen werden. Die maximale Behandlungsdauer beträgt 4 Wochen. Die endometriale Sicherheit einer verlängerten Behandlung sowie wiederholter Behandlungszyklen ist nicht erwiesen. Da es während der Behandlung mit 15
16 [Phantasiebezeichnung] zu einer systemischen Exposition kommt, wird eine verlängerte Behandlung von mehr als 4 Wochen nicht empfohlen. Wenn die Symptome länger als 4 Wochen anhalten, sollten alternative Therapien in Erwägung gezogen werden. Wenn unerwartete Blutungen auftreten, muss die Behandlung mit [Phantasiebezeichnung] unterbrochen werden, bis die Ursache der Blutungen geklärt ist (siehe Abschnitt 4.4 zur endometrialen Sicherheit). Wenn eine Dosis vergessen wird, sollte sie nachgeholt werden, sobald sich die Patientin erinnert. Eine doppelte Dosis sollte vermieden werden. Die Erfahrungen in der Behandlung von Frauen im Alter über 65 Jahren sind begrenzt. Abschnitt 4.3 Gegenanzeigen [Der folgende Text sollte den bestehenden Text dieses Abschnitts ersetzen] [Phantasiebezeichnung] sollte in folgenden Fällen nicht angewendet werden: - bestehender oder früherer Brustkrebs bzw. ein entsprechender Verdacht - estrogenabhängiger maligner Tumor bzw. ein entsprechender Verdacht (z. B. Endometriumkarzinom) - nicht abgeklärte Blutung im Genitalbereich - unbehandelte Endometriumhyperplasie - frühere oder bestehende venöse thromboembolische Erkrankungen (tiefe Venenthrombose, Lungenembolie) - bekannte thrombophile Erkrankungen (z. B. Protein-C-, Protein-S- oder Antithrombin-Mangel, siehe Abschnitt 4.4) - bestehende oder erst kurze Zeit zurückliegende arterielle thromboembolische Erkrankungen (z. B. Angina pectoris, Myokardinfarkt) - akute Lebererkrankung oder zurückliegende Lebererkrankungen, solange sich die Leberfunktionstests nicht normalisiert haben - bekannte Überempfindlichkeit gegenüber dem Wirkstoff oder einen der sonstigen Bestandteile - Porphyrie Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung [Der gesamte aktuelle Text in diesem Abschnitt sollte gelöscht und durch folgenden Text ersetzt werden] 16
17 Eine Hormonsubstitutionstherapie (HRT) sollte nur zur Behandlung solcher postmenopausaler Beschwerden begonnen werden, welche die Lebensqualität beeinträchtigen. Nutzen und Risiken sollten in jedem Einzelfall mindestens jährlich sorgfältig gegeneinander abgewogen werden. Eine HRT sollte nur so lange fortgeführt werden, wie der Nutzen gegenüber den Risiken überwiegt. [Phantasiebezeichnung] sollte nicht bei Patientinnen angewendet werden, die mit einer systemischen Hormonsubstitutionstherapie (HRT) behandelt werden. Während der Behandlung mit [Phantasiebezeichnung] kommt es nach jeder Anwendung zu einem vorübergehenden Anstieg der Estradiol-Plasmaspiegel oberhalb des physiologischen Bereichs postmenopausaler Frauen. Aus Sicherheitsgründen ist die Behandlungsdauer daher auf 4 Wochen begrenzt. Es ist auf mögliche systemische Wirkungen zu achten. Medizinische Untersuchung/Verlaufsuntersuchungen Vor Beginn bzw. Wiederaufnahme einer Hormontherapie ist eine vollständige Eigen- und Familienanamnese der Patientin zu erheben. Die körperliche Untersuchung (einschließlich Unterleib und Brust) sollte sich an diesen Anamnesen sowie den Gegenanzeigen und Warnhinweisen orientieren. Während der Behandlung werden regelmäßige Kontrolluntersuchungen empfohlen, die sich in Häufigkeit und Art nach der individuellen Situation der Frau richten. Die Frauen sollten darüber aufgeklärt werden, welche Veränderungen der Brüste sie dem Arzt oder dem medizinischen Fachpersonal mitteilen sollten. Die Untersuchungen, einschließlich bildgebender Verfahren wie Mammografie, sind entsprechend der gegenwärtig üblichen Vorsorgepraxis und den klinischen Notwendigkeiten der einzelnen Frau durchzuführen. Das pharmakokinetische Profil von [Phantasiebezeichnung] zeigt, dass es während der Behandlung zu einer systemischen Resorption von Estradiol in Konzentrationen kommt, die vorübergehend oberhalb der postmenopausalen Spiegel liegen (siehe Abschnitt 5.2). Da es sich jedoch um ein HRT-Arzneimittel handelt, ist Folgendes zu berücksichtigen: Erkrankungen, die eine Überwachung erfordern Die Patientinnen sollten engmaschig überwacht werden, wenn eine der folgenden Erkrankungen vorliegt oder früher vorlag bzw. sich während einer Schwangerschaft oder einer zurückliegenden Hormonbehandlung verschlechtert hat. Es sollte berücksichtigt werden, dass diese Erkrankungen während der Estrogentherapie erneut auftreten oder sich verschlechtern können, insbesondere: - Leiomyom (Uterusfibromyome) oder Endometriose - Risikofaktoren für Thromboembolien (siehe unten) - Risikofaktoren für estrogenabhängige Tumore, z. B. Auftreten von Mammakarzinom bei Verwandten 1. Grades - Hypertonie - Lebererkrankungen (z. B. Leberadenom) - Diabetes mellitus mit oder ohne Beteiligung der Gefäße 17
18 - Cholelithiasis - Migräne oder (schwere) Kopfschmerzen - Systemischer Lupus erythematodes - Endometriumhyperplasie in der Vorgeschichte (siehe unten) - Epilepsie - Asthma - Otosklerose Während der Behandlung mit [Phantasiebezeichnung] kommt es nach jeder Anwendung zu einem Anstieg der Estradiol-Plasmaspiegel oberhalb des physiologischen Bereichs postmenopausaler Frauen. Aus Sicherheitsgründen ist die Behandlungsdauer daher auf 4 Wochen begrenzt. Es ist auf mögliche systemische Wirkungen zu achten. [Phantasiebezeichnung] sollte nicht bei Patientinnen angewendet werden, die mit einer systemischen Hormonsubstitutionstherapie (HRT) behandelt werden. Gründe für den sofortigen Abbruch der Behandlung Die Therapie ist bei Vorliegen einer Gegenanzeige sowie in den folgenden Situationen abzubrechen: - Ikterus oder Verschlechterung der Leberfunktion - Signifikante Erhöhung des Blutdrucks - Einsetzen migräneartiger Kopfschmerzen - Schwangerschaft Endometriumhyperplasie und -karzinom Frauen mit einem intakten Uterus mit abnormalen Blutungen unbekannter Ursache oder Frauen mit einem intakten Uterus, die zuvor mit unopponierten Estrogenen behandelt wurden, sollten besonders sorgfältig untersucht werden, um eine Hyperstimulation/maligne Erkrankung des Endometriums vor Beginn der Behandlung mit [Phantasiebezeichnung] auszuschließen. Bei Frauen mit intaktem Uterus ist das Risiko für Endometriumhyperplasien und -karzinome bei längerfristiger Estrogen-Monotherapie erhöht. Der berichtete Anstieg des Risikos für die Entstehung eines Endometriumkarzinoms bei Anwenderinnen einer Estrogen-Monotherapie schwankt zwischen einer 2-fachen bis zu einer 12-fachen Zunahme, verglichen mit Frauen ohne diese Therapie, abhängig von der Dauer der Anwendung und der Höhe der Estrogendosis. Nach Beendigung der Behandlung bleibt das Risiko für mindestens 10 Jahre erhöht. Die endometriale Sicherheit einer Langzeitanwendung (mehr als ein Jahr) oder einer wiederholten Anwendung lokaler vaginal verabreichter Estrogene ist unbekannt. Bevor ein 4-wöchiger Behandlungszyklus mit [Phantasiebezeichnung] wiederholt wird, sollte die Behandlung daher überprüft werden, insbesondere in Hinblick auf etwaige Symptome von Endometriumhyperplasien oder -karzinomen. 18
19 Sollten zu irgendeinem Zeitpunkt während der Behandlung Blutungen oder Schmierblutungen auftreten, sollte die Ursache geklärt werden. Dies kann eine Endometriumbiopsie zum Ausschluss einer malignen Erkrankung des Endometriums umfassen. Die Frauen sollten angewiesen werden, sich an ihren Arzt zu wenden, wenn während der Behandlung mit [Phantasiebezeichnung] Blutungen oder Schmierblutungen auftreten. Eine unopponierte Estrogen-Stimulation kann zu einer prämalignen oder malignen Transformation residualer Endometrioseherde führen. Daher ist bei der Anwendung dieses Arzneimittels bei Frauen, bei denen aufgrund einer Endometriose eine Hysterektomie vorgenommen wurde, Vorsicht geboten, vor allem, wenn eine residuale Endometriose vorliegt. Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. Brustkrebs Die Gesamtevidenz weist auf ein erhöhtes, von der Anwendungsdauer der HRT abhängiges Brustkrebsrisiko für Frauen hin, die Estrogen-Progestagen-Kombinationen anwenden. Möglicherweise gilt dies auch für eine HRT mit Estrogen-Monopräparaten. Die WHI-Studie zeigte kein erhöhtes Brustkrebsrisiko bei hysterektomierten Frauen unter einer Estrogen-Monotherapie. Beobachtungsstudien haben unter einer Estrogen- Monotherapie meist ein geringfügig erhöhtes Risiko für eine Brustkrebsdiagnose gezeigt, das jedoch wesentlich niedriger war als das Risiko bei Anwenderinnen von Estrogen- Progestagen-Kombinationen. Das erhöhte Risiko zeigt sich nach einigen Anwendungsjahren, kehrt jedoch einige (spätestens fünf) Jahre nach Behandlungsende wieder auf das Grundrisiko zurück. Ein Zusammenhang zwischen Brustkrebsrisiko und der lokalen vaginalen Estrogentherapie ist unsicher. Eine HRT, insbesondere eine kombinierte Behandlung mit Estrogenen und Progestagenen, führt zu einer erhöhten Brustdichte in der Mammografie, was sich nachteilig auf die radiologische Brustkrebsdiagnostik auswirken kann. Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. Ovarialkarzinom Das Ovarialkarzinom ist viel seltener als Brustkrebs. Die Langzeitanwendung (mindestens 5-10 Jahre) von Estrogen-Monoarzneimitteln zur Hormonsubstitutionstherapie ist mit einem leicht erhöhten Ovarialkarzinom-Risiko verbunden. Einige Studien, einschließlich der WHI- Studie, deuten darauf hin, dass das entsprechende Risiko unter der Langzeitanwendung einer kombinierten HRT vergleichbar oder geringfügig geringer ist (siehe Abschnitt 4.8). Ein Zusammenhang zwischen dem Ovarialkarzinom-Risiko und der lokalen vaginalen Estrogentherapie ist unsicher. Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. 19
20 Venöse Thromboembolie Eine HRT ist mit einem 1,3- bis 3-fach erhöhten Risiko für venöse Thromboembolien (VTE), d. h. tiefe Venenthrombosen oder Lungenembolien, verbunden. Im ersten Jahr einer HRT ist das Auftreten einer VTE wahrscheinlicher als später. Patientinnen mit bekannter Thrombophilie haben ein erhöhtes VTE-Risiko. Eine HRT kann dieses Risiko erhöhen und darf daher bei diesen Patientinnen nicht angewendet werden (siehe Abschnitt 4.3). Zu den allgemein anerkannten VTE-Risikofaktoren gehören die Anwendung von Estrogenen, ein höheres Alter, größere Operationen, längere Immobilisierung, erhebliches Übergewicht (BMI >30 kg/m 2 ), Schwangerschaft/Wochenbett, systemischer Lupus erythematodes (SLE) und Krebs. Es besteht kein Konsens über die mögliche Rolle von Varizen bei VTE. Ein Zusammenhang zwischen venösen Thromboembolien und der lokalen vaginalen Estrogentherapie ist unsicher. Wie bei allen postoperativen Patienten müssen vorbeugende Maßnahmen zur Verhinderung einer VTE nach der Operation berücksichtigt werden. Bei längerer Immobilisierung nach einer geplanten Operation wird empfohlen, die HRT 4 bis 6 Wochen vor dem Eingriff auszusetzen. Die Behandlung sollte erst dann wieder aufgenommen werden, wenn die Frau wieder vollständig mobilisiert ist. Bei Frauen ohne VTE in der Vorgeschichte, aber mit Verwandten ersten Grades, die bereits in jungen Jahren an VTE erkrankten, kann ein Thrombophilie-Screening in Erwägung gezogen werden. Vorher sollte die Patientin eingehend über die begrenzte Aussagekraft dieses Verfahrens beraten werden (es wird nur ein Teil der Defekte identifiziert, die zu einer Thrombophilie führen). Wird ein thrombophiler Defekt festgestellt und sind außerdem Thrombosen bei Verwandten bekannt oder ist der festgestellte Defekt schwerwiegend (z. B. Antithrombin-, Protein-Sund/oder Protein-C-Mangel oder eine Kombination von Defekten), so darf eine HRT nicht angewendet werden. Bei Frauen unter einer dauerhaften Behandlung mit Antikoagulantien sollte vor der Anwendung einer HRT das Risiko-Nutzen-Verhältnis sorgfältig abgewogen werden. Sollte sich eine VTE nach Beginn der HRT entwickeln, muss das Arzneimittel abgesetzt werden. Die Patientinnen sollten darauf hingewiesen werden, dass sie sich sofort an einen Arzt wenden müssen, wenn sie mögliche Symptome einer Thromboembolie bemerken (z. B. schmerzhafte Schwellung eines Beins, plötzlicher Schmerz im Brustkorb, Atemnot). Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. Koronare Herzkrankheit Es gibt keine Hinweise aus randomisierten kontrollierten Studien, dass eine kombinierte HRT mit Estrogen und Progestagen oder eine Estrogen-Monotherapie Frauen vor einem Myokardinfarkt schützt, unabhängig davon, ob bei ihnen eine koronare Herzkrankheit vorliegt oder nicht. 20
21 In randomisierten kontrollierten Studien wurden keine Hinweise auf ein erhöhtes Risiko einer koronaren Herzkrankheit bei hysterektomierten Frauen unter einer Estrogen- Monotherapie gefunden. Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. Ischämischer Schlaganfall Die kombinierte Behandlung mit Estrogen und Progestagen und die Estrogen-Monotherapie sind mit einem bis zu 1,5-fach erhöhten ischämischen Schlaganfallrisiko verbunden. Das relative Risiko ist unabhängig vom Alter und der Zeitspanne, die seit der Menopause vergangen ist. Da allerdings das Grundrisiko, einen Schlaganfall zu erleiden, in hohem Maß altersabhängig ist, nimmt das Gesamtrisiko eines Schlaganfalls für Frauen unter einer HRT mit zunehmendem Alter zu. Ein Zusammenhang zwischen ischämischen Schlaganfällen und der niedrigdosierten lokalen vaginalen Estrogentherapie ist unsicher. Die Risikoschätzungen wurden anhand der systemischen Exposition (HRT) erstellt und es ist nicht bekannt, inwiefern diese für die lokale Behandlung gelten. Sonstige Erkrankungen Estrogene können eine Flüssigkeitsretention bewirken; daher müssen Patientinnen mit kardialen oder renalen Funktionsstörungen sorgfältig beobachtet werden. Frauen mit vorbestehender Hypertriglyzeridämie sollten während einer Estrogen- oder Hormonsubstitutionstherapie engmaschig überwacht werden, weil im Zusammenhang mit einer Estrogentherapie unter derartigen Umständen von seltenen Fällen eines starken Triglyzeridanstiegs im Plasma mit der Folge einer Pankreatitis berichtet wurde. Ein Zusammenhang zwischen vorbestehender Hypertriglyzeridämie und der niedrigdosierten lokalen vaginalen Estrogentherapie ist unsicher. Estrogene erhöhen die Konzentration des thyroxinbindenden Globulins (TBG), wodurch es zu einem Anstieg des gesamten zirkulierenden Schilddrüsenhormons kommt, was anhand des proteingebundenen Jods (PBI), des T4-Spiegels (Säulen- oder Radioimmunassay) oder T3-Spiegels (Radioimmunassay) gemessen wird. Die T3-Harzaufnahme ist herabgesetzt, was einen TBG-Anstieg widerspiegelt. Die freien T4- und freien T3-Konzentrationen verändern sich nicht. Andere Bindungsproteine können im Serum erhöht sein, wie das kortikoidbindende Globulin (CBG) und das geschlechtshormonbindende Globulin (SHBG), was zu einem Ansteigen der zirkulierenden Kortikosteroide bzw. Sexualhormone führt. Freie oder biologisch aktive Hormonkonzentrationen bleiben unverändert. Andere Plasmaproteine können erhöht sein (Angiotensinogen/Reninsubstrat, Alpha-1-Antitrypsin, Coeruloplasmin). Unter einer HRT verbessern sich die kognitiven Fähigkeiten nicht. Es gibt Hinweise aus der WHI-Studie auf ein erhöhtes Risiko für eine wahrscheinliche Demenz bei Frauen, die bei Beginn einer kontinuierlichen kombinierten HRT oder einer Estrogen-Monotherapie älter als 65 Jahre waren. In seltenen Fällen wurden nach der Anwendung von Hormonen, wie die in [Phantasiebezeichnung] enthaltene Substanz, benigne und in noch selteneren Fällen maligne Lebertumore beobachtet, die in Einzelfällen zu lebensbedrohlichen intraabdominellen 21
22 Blutungen führten. Bei Auftreten schwerer Beschwerden im Oberbauch, einer vergrößerten Leber oder Zeichen einer intraabdominellen Blutung sollte bei der Differentialdiagnose ein Lebertumor in Erwägung gezogen werden. Hinweis: Der intravaginale Applikator kann zu einem leichten lokalen Trauma führen, insbesondere bei Frauen mit schwerer Vaginalatrophie. [Phantasiebezeichnung] sollte nicht unmittelbar vor dem Geschlechtsverkehr und nicht als Gleitmittel verwendet werden, um mögliche unerwünschte Wirkungen beim Partner zu vermeiden. Die Anwendung von [Phantasiebezeichnung] zusammen mit Latexprodukten (z. B. Kondome, Diaphragma) kann die Funktionsfähigkeit dieser Produkte senken und somit ihre Zuverlässigkeit einschränken, da [Phantasiebezeichnung] Hilfsstoffe enthält (andere Inhaltsstoffe, insbesondere Stearate). Cetylstearylalkohol kann lokale Hautreizungen hervorrufen (z. B. Kontaktdermatitis). Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen [Der gesamte aktuelle Text in diesem Abschnitt sollte gelöscht und durch folgenden Text ersetzt werden] Wechselwirkungen von [Phantasiebezeichnung] mit anderen Arzneimitteln wurden nicht untersucht. Der Metabolismus der Estrogene kann jedoch durch die gleichzeitige Anwendung von Substanzen verstärkt werden, die Arzneimittel-metabolisierende Enzyme, vor allem die Cytochrom-P450-Enzyme, induzieren; zu diesen Substanzen gehören Antikonvulsiva (z. B. Phenobarbital, Phenytoin, Carbamazepin) und Antiinfektiva (z. B. Rifampicin, Rifabutin, Nevirapin, Efavirenz). Ritonavir und Nelfinavir haben, wenn sie zeitgleich mit Steroidhormonen angewandt werden, enzymstimulierende Eigenschaften, obwohl sie eigentlich als starke Enzymhemmer bekannt sind. Pflanzliche Zubereitungen, die Johanniskraut (Hypericum perforatum) enthalten, können den Metabolismus der Estrogene induzieren. Klinisch kann ein erhöhter Estrogenmetabolismus zu einer verminderten Wirkung dieser Hormone und zu Veränderungen des uterinen Blutungsmusters führen. Abschnitt 4.6. Fertilität, Schwangerschaft und Stillzeit [Der folgende Text sollte in diesen Abschnitt eingefügt und der aktuelle Text gelöscht werden] 22
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 5 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 5 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 26.08.2014 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 26.08.2014 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Bezeichnung Darreichungsform Stärken Zieltierarten Häufigkeit und Art der Anwendung. Clavulanic acid 10 mg. Clavulanic acid 10 mg
 Anhang I Liste der Bezeichnungen, der Darreichungsform, der Stärke des Tierarzneimittels, der Zieltierarten, der Art der Anwendung sowie des Antragsstellers/Inhabers der Genehmigung für das Inverkehrbringen
Anhang I Liste der Bezeichnungen, der Darreichungsform, der Stärke des Tierarzneimittels, der Zieltierarten, der Art der Anwendung sowie des Antragsstellers/Inhabers der Genehmigung für das Inverkehrbringen
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
!!! Folgeerkrankungen
 Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Screening Das Programm. zur Früherkennung von Brustkrebs
 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Du verhütest jahrelang! Mit der passenden Pille?
 Du verhütest jahrelang! Mit der passenden Pille? INHALT WAS VERSTEHT MAN UNTER VERHÜTUNGSHORMONEN? Was versteht man unter Verhütungshormonen?... 3 Verhütungshormone sind Östrogene und Gestagene, die zur
Du verhütest jahrelang! Mit der passenden Pille? INHALT WAS VERSTEHT MAN UNTER VERHÜTUNGSHORMONEN? Was versteht man unter Verhütungshormonen?... 3 Verhütungshormone sind Östrogene und Gestagene, die zur
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Mitteilung der Kommission. Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03)
 20.5.2003 Amtsblatt der Europäischen Union C 118/5 Mitteilung der Kommission Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03) Durch diese Mitteilung soll
20.5.2003 Amtsblatt der Europäischen Union C 118/5 Mitteilung der Kommission Muster für eine Erklärung über die zur Einstufung als KMU erforderlichen Angaben (2003/C 118/03) Durch diese Mitteilung soll
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Richtlinie. des Gemeinsamen Bundesausschusses. zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie )
 Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung
 Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung ÄNDERUNG DES ÜBEREINKOMMENS ÜBER DEN ZUGANG ZU INFORMATIONEN, DIE ÖFFENTLICHKEITSBETEILIGUNG AN ENTSCHEIDUNGSVERFAHREN
Zwischen Deutschland, Liechtenstein, Österreich und der Schweiz abgestimmte deutsche Übersetzung ÄNDERUNG DES ÜBEREINKOMMENS ÜBER DEN ZUGANG ZU INFORMATIONEN, DIE ÖFFENTLICHKEITSBETEILIGUNG AN ENTSCHEIDUNGSVERFAHREN
Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Wiederholungsverordnung
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Stand der Revision: 13.11.2013
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Information und Beratung des Patienten bei der Abgabe von Arzneimitteln Erst- und Stand der Revision: 13.11.2013
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
3.9 Brustdrüse der Frau
 ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
Hormonersatztherapie und Mammakarzinom. W. Stummvoll G. Hofmann
 Hormonersatztherapie und Mammakarzinom W. Stummvoll G. Hofmann Östrogene Östron (E1): Östradiol (E2): Östriol (E3): 1 OH-Gruppe 2 OH-Gruppen 3 OH-Gruppen Standard der Substitutionstherapie: Prä-/Perimenopause
Hormonersatztherapie und Mammakarzinom W. Stummvoll G. Hofmann Östrogene Östron (E1): Östradiol (E2): Östriol (E3): 1 OH-Gruppe 2 OH-Gruppen 3 OH-Gruppen Standard der Substitutionstherapie: Prä-/Perimenopause
Anhang II. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 12 Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung
Anhang II Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 12 Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung
SOZIALVORSCHRIFTEN IM STRAßENVERKEHR Verordnung (EG) Nr. 561/2006, Richtlinie 2006/22/EG, Verordnung (EU) Nr. 165/2014
 LEITLINIE NR. 7 Gegenstand: Die Bedeutung von innerhalb von 24 Stunden Artikel: 8 Absätze 2 und 5 der Verordnung (EG) Nr. 561/2006 Leitlinien: Nach Artikel 8 Absatz 2 der Verordnung muss innerhalb von
LEITLINIE NR. 7 Gegenstand: Die Bedeutung von innerhalb von 24 Stunden Artikel: 8 Absätze 2 und 5 der Verordnung (EG) Nr. 561/2006 Leitlinien: Nach Artikel 8 Absatz 2 der Verordnung muss innerhalb von
BESCHLUSS DES GEMEINSAMEN EWR-AUSSCHUSSES Nr. 15/2001 vom 28. Februar 2001. zur Änderung des Anhangs IX (Finanzdienstleistungen) des EWR-Abkommens
 BESCHLUSS DES GEMEINSAMEN EWR-AUSSCHUSSES Nr. 15/2001 vom 28. Februar 2001 zur Änderung des Anhangs IX (Finanzdienstleistungen) des EWR-Abkommens DER GEMEINSAME EWR-AUSSCHUSS - gestützt auf das Abkommen
BESCHLUSS DES GEMEINSAMEN EWR-AUSSCHUSSES Nr. 15/2001 vom 28. Februar 2001 zur Änderung des Anhangs IX (Finanzdienstleistungen) des EWR-Abkommens DER GEMEINSAME EWR-AUSSCHUSS - gestützt auf das Abkommen
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
VERNEHMLASSUNGSBERICHT DER REGIERUNG BETREFFEND DIE ABÄNDERUNG DES KONSUMKREDITGESETZES (KKG) (UMSETZUNG DER RICHTLINIE 2011/90/EU)
 VERNEHMLASSUNGSBERICHT DER REGIERUNG BETREFFEND DIE ABÄNDERUNG DES KONSUMKREDITGESETZES (KKG) (UMSETZUNG DER RICHTLINIE 2011/90/EU) Ressort Wirtschaft Vernehmlassungsfrist: 31. Januar 2013 3 INHALTSVERZEICHNIS
VERNEHMLASSUNGSBERICHT DER REGIERUNG BETREFFEND DIE ABÄNDERUNG DES KONSUMKREDITGESETZES (KKG) (UMSETZUNG DER RICHTLINIE 2011/90/EU) Ressort Wirtschaft Vernehmlassungsfrist: 31. Januar 2013 3 INHALTSVERZEICHNIS
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
Dokumentation für die software für zahnärzte der procedia GmbH Onlinedokumentation
 Dokumentation für die software für zahnärzte der procedia GmbH Onlinedokumentation (Bei Abweichungen, die bspw. durch technischen Fortschritt entstehen können, ziehen Sie bitte immer das aktuelle Handbuch
Dokumentation für die software für zahnärzte der procedia GmbH Onlinedokumentation (Bei Abweichungen, die bspw. durch technischen Fortschritt entstehen können, ziehen Sie bitte immer das aktuelle Handbuch
FRAGE 39. Gründe, aus denen die Rechte von Patentinhabern beschränkt werden können
 Jahrbuch 1963, Neue Serie Nr. 13, 1. Teil, 66. Jahrgang, Seite 132 25. Kongress von Berlin, 3. - 8. Juni 1963 Der Kongress ist der Auffassung, dass eine Beschränkung der Rechte des Patentinhabers, die
Jahrbuch 1963, Neue Serie Nr. 13, 1. Teil, 66. Jahrgang, Seite 132 25. Kongress von Berlin, 3. - 8. Juni 1963 Der Kongress ist der Auffassung, dass eine Beschränkung der Rechte des Patentinhabers, die
Künstlicher Hüftgelenksersatz
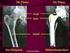 Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft:
 Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft: Hinweis: Die im Folgenden dargestellten Fallkonstellationen beziehen sich auf
Im Folgenden werden einige typische Fallkonstellationen beschrieben, in denen das Gesetz den Betroffenen in der GKV hilft: Hinweis: Die im Folgenden dargestellten Fallkonstellationen beziehen sich auf
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN. Vorschlag für GEMEINSAME REGELUNG
 KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 15.4.2004 SEK(2004) 411 endgültig Vorschlag für GEMEINSAME REGELUNG zur Festlegung der Modalitäten für die Überweisung eines Teils der Dienstbezüge
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 15.4.2004 SEK(2004) 411 endgültig Vorschlag für GEMEINSAME REGELUNG zur Festlegung der Modalitäten für die Überweisung eines Teils der Dienstbezüge
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
Ein neues System für die Allokation von Spenderlungen. LAS Information für Patienten in Deutschland
 Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Keine CE-Kennzeichnung ohne klinische Bewertung
 Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
Informationen zum Thema Europäische Krankenversicherungskarte
 Gesundheitskarte AKTUELL Informationen zum Thema Europäische Krankenversicherungskarte Von Anfang an ist die Rückseite der elektronischen Gesundheitskarte für die Aufnahme der Europäischen Krankenversicherungskarte
Gesundheitskarte AKTUELL Informationen zum Thema Europäische Krankenversicherungskarte Von Anfang an ist die Rückseite der elektronischen Gesundheitskarte für die Aufnahme der Europäischen Krankenversicherungskarte
LÄNGER LEBEN BEI GUTER GESUNDHEIT
 LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
Änderung des IFRS 2 Anteilsbasierte Vergütung
 Änderung IFRS 2 Änderung des IFRS 2 Anteilsbasierte Vergütung Anwendungsbereich Paragraph 2 wird geändert, Paragraph 3 gestrichen und Paragraph 3A angefügt. 2 Dieser IFRS ist bei der Bilanzierung aller
Änderung IFRS 2 Änderung des IFRS 2 Anteilsbasierte Vergütung Anwendungsbereich Paragraph 2 wird geändert, Paragraph 3 gestrichen und Paragraph 3A angefügt. 2 Dieser IFRS ist bei der Bilanzierung aller
WICHTIGE INFORMATIONEN ÜBER CYPROTERONACETAT- UND ETHINYLESTRADIOL-HALTIGE KOMBINATIONSPRÄPARATE UND DAS RISIKO FÜR BLUTGERINNSEL
 Patienteninformationskarte, DE Version: 29.06.2014 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie
Patienteninformationskarte, DE Version: 29.06.2014 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie
Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt?
 DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Antikoagulation 2012: alles anders?
 Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
KOMPLETTE ZUSAMMENFASSUNG DER WISSENSCHAFTLICHEN BEURTEILUNG VON ARZNEIMITTELN, DIE VALPROINSÄURE/VALPROAT ENTHALTEN (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Wie funktioniert ein Mieterhöhungsverlangen?
 Wie funktioniert ein Mieterhöhungsverlangen? Grundsätzlich steht einem Vermieter jederzeit die Möglichkeit offen, die gegenwärtig bezahlte Miete gemäß 558 BGB an die ortsübliche Miete durch ein entsprechendes
Wie funktioniert ein Mieterhöhungsverlangen? Grundsätzlich steht einem Vermieter jederzeit die Möglichkeit offen, die gegenwärtig bezahlte Miete gemäß 558 BGB an die ortsübliche Miete durch ein entsprechendes
DNotI. Fax - Abfrage. GrEStG 1 Abs. 3 Anteilsvereinigung bei Treuhandverhältnissen. I. Sachverhalt:
 DNotI Deutsches Notarinstitut Fax - Abfrage Gutachten des Deutschen Notarinstitut Dokumentnummer: 1368# letzte Aktualisierung: 14. Juni 2004 GrEStG 1 Abs. 3 Anteilsvereinigung bei Treuhandverhältnissen
DNotI Deutsches Notarinstitut Fax - Abfrage Gutachten des Deutschen Notarinstitut Dokumentnummer: 1368# letzte Aktualisierung: 14. Juni 2004 GrEStG 1 Abs. 3 Anteilsvereinigung bei Treuhandverhältnissen
zur Verfügung gestellt von Gebrauchs.info GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Lösung Fall 8 Anspruch des L auf Lieferung von 3.000 Panini á 2,-
 Lösung Fall 8 Anspruch des L auf Lieferung von 3.000 Panini á 2,- L könnte gegen G einen Anspruch auf Lieferung von 3.000 Panini á 2,- gem. 433 I BGB haben. Voraussetzung dafür ist, dass G und L einen
Lösung Fall 8 Anspruch des L auf Lieferung von 3.000 Panini á 2,- L könnte gegen G einen Anspruch auf Lieferung von 3.000 Panini á 2,- gem. 433 I BGB haben. Voraussetzung dafür ist, dass G und L einen
Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG
 Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG 1. Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung mit Selbstbeteiligung
Inhaltsübersicht Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung der Europäische Reiseversicherung AG 1. Produktinformationsblatt zur Jahres-Reiserücktritts-Versicherung mit Selbstbeteiligung
Video Unlimited -Nutzungsbeschränkungen
 Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN
 Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Elternzeit Was ist das?
 Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
LV 1871 Basisrente Performer RieStar Sofortrente. Die Rente, die bis zu x-mal mehr leistet. Kundeninformation
 LV 1871 Basisrente Performer RieStar Sofortrente Die Rente, die bis zu x-mal mehr leistet Kundeninformation Wie gesund gehen wir in Rente? Ein neuer Lebensabschnitt Gut vorgesorgt mit der extra-rente Für
LV 1871 Basisrente Performer RieStar Sofortrente Die Rente, die bis zu x-mal mehr leistet Kundeninformation Wie gesund gehen wir in Rente? Ein neuer Lebensabschnitt Gut vorgesorgt mit der extra-rente Für
Neue Gerichtsentscheidungen zur Haftung des pharmazeutischen Unternehmers
 Neue Gerichtsentscheidungen zur Haftung des pharmazeutischen Unternehmers Rechtsanwalt Herbert Wartensleben Fachanwalt für Medizinrecht Anwaltskanzlei Wartensleben Gut Gedau 1 52223 Stolberg Tel: 0 24
Neue Gerichtsentscheidungen zur Haftung des pharmazeutischen Unternehmers Rechtsanwalt Herbert Wartensleben Fachanwalt für Medizinrecht Anwaltskanzlei Wartensleben Gut Gedau 1 52223 Stolberg Tel: 0 24
Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information):
 Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach -
 Bundesrat Drucksache 555/13 (Beschluss) 05.07.13 Beschluss des Bundesrates Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach - Der
Bundesrat Drucksache 555/13 (Beschluss) 05.07.13 Beschluss des Bundesrates Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach - Der
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Die monatliche Selbstuntersuchung der Brust
 Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
? Kann ich mit Karotten zu viel Vitamin A
 Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm KHK
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Diabetische Retinopathie
 Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Brustkrebs und Mammographie
 Arbeitseinheit im Rahmen des ESF-Projekts Alphabetisierung- Grundbildung- Gesundheit Brustkrebs und Mammographie erstellt von Marion Döbert, VHS Bielefeld, 2007 Viele Wörter sind schwer zu lesen und zu
Arbeitseinheit im Rahmen des ESF-Projekts Alphabetisierung- Grundbildung- Gesundheit Brustkrebs und Mammographie erstellt von Marion Döbert, VHS Bielefeld, 2007 Viele Wörter sind schwer zu lesen und zu
Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren
 Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren Programm zur Früherkennung von Brustkrebs Praktische Hinweise Mit Ihrer persönlichen Einladung zur Teilnahme an dem Programm
Programm zur Früherkennung von Brustkrebs für Frauen zwischen 50 und 69 Jahren Programm zur Früherkennung von Brustkrebs Praktische Hinweise Mit Ihrer persönlichen Einladung zur Teilnahme an dem Programm
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Die außerordentliche Revision wird gemäß 508a Abs 2 ZPO mangels der Voraussetzungen des 502 Abs 1 ZPO zurückgewiesen.
 10 Ob 40/15b Der Oberste Gerichtshof hat als Revisionsgericht durch den Senatspräsidenten Dr. Fellinger als Vorsitzenden, die Hofräte Univ.-Prof. Dr. Neumayr und Dr. Schramm und die Hofrätinnen Dr. Fichtenau
10 Ob 40/15b Der Oberste Gerichtshof hat als Revisionsgericht durch den Senatspräsidenten Dr. Fellinger als Vorsitzenden, die Hofräte Univ.-Prof. Dr. Neumayr und Dr. Schramm und die Hofrätinnen Dr. Fichtenau
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Osteoporose. Ein echtes Volksleiden. Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen
 Osteoporose Osteoporose 9 Osteoporose Ein echtes Volksleiden Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen in den entwickelten Ländern zu den häufigsten Erkrankungen
Osteoporose Osteoporose 9 Osteoporose Ein echtes Volksleiden Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen in den entwickelten Ländern zu den häufigsten Erkrankungen
Vor- und Nachteile der Kastration
 Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Diabetische Netzhauterkrankung
 Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Behandlung von Krebsvorstufen. Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe
 Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß
 Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Gebrauchsinformation: Information für Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Mit. BKK MedPlus. einfach besser versorgt!
 Mit BKK MedPlus einfach besser versorgt! DMP - Was ist das? Das Disease Management Programm (kurz DMP) ist ein strukturiertes Behandlungsprogramm für Versicherte mit chronischen Erkrankungen. Chronisch
Mit BKK MedPlus einfach besser versorgt! DMP - Was ist das? Das Disease Management Programm (kurz DMP) ist ein strukturiertes Behandlungsprogramm für Versicherte mit chronischen Erkrankungen. Chronisch
PUBLIC LIMITE DE RAT DER EUROPÄISCHEN UNION. Brüssel, den 4. Mai 2007 (25.05) (OR. en) 8935/1/07 REV 1. Interinstitutionelles Dossier: 2005/0261(COD)
 Conseil UE RAT DER EUROPÄISCHEN UNION Brüssel, den 4. Mai 2007 (25.05) (OR. en) PUBLIC Interinstitutionelles Dossier: 2005/0261(COD) 8935/1/07 REV 1 LIMITE JUSTCIV 110 CODEC 421 DOKUMENT TEILWEISE ZUGÄNGLICH
Conseil UE RAT DER EUROPÄISCHEN UNION Brüssel, den 4. Mai 2007 (25.05) (OR. en) PUBLIC Interinstitutionelles Dossier: 2005/0261(COD) 8935/1/07 REV 1 LIMITE JUSTCIV 110 CODEC 421 DOKUMENT TEILWEISE ZUGÄNGLICH
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker!
 Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Krank durch Schlafstörungen
 Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der betroffenen Chargen siehe Anhang 1)
 22. Mai 2015 An: Betrifft: Risikomanager und Chirurgen DRINGENDER CHARGENSPEZIFISCHER RÜCKRUF EINES MEDIZINPRODUKTES Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der
22. Mai 2015 An: Betrifft: Risikomanager und Chirurgen DRINGENDER CHARGENSPEZIFISCHER RÜCKRUF EINES MEDIZINPRODUKTES Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der
