In vitro Generierung und Chimärismusanalyse humaner Knochenmarkstromazellen nach allogener hämatopoetischer Stammzelltransplantation
|
|
|
- Ursula Pfeiffer
- vor 5 Jahren
- Abrufe
Transkript
1 Aus der Medizinischen Universitätsklinik Abteilung für Hämatologie/Onkologie der Albert-Ludwigs-Universität Freiburg im Breisgau In vitro Generierung und Chimärismusanalyse humaner Knochenmarkstromazellen nach allogener hämatopoetischer Stammzelltransplantation INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau vorgelegt 2008 von Tisa Nieborg geb. Küttler geboren in Gelsenkirchen
2 Dekan: Prof. Dr. C. Peters 1. Gutachter: Prof. Dr. J. Finke 2. Gutachter: Prof Dr. P. Fisch Jahr der Promotion: 2008
3 Inhaltsverzeichnis 1 Einleitung Die Knochenmarktransplantation Geschichte Das blutbildende System Knochenmark- oder Blutstammzelltransplantation Konditionierung Die Folgen der Transplantation Engraftment und hämatopoetischer Chimärismus Graft-versus-Host Disease Zytomegalievirusinfektion Reduzierte Konditionierung Das Knochenmark Mesenchymale Stammzellen Struktur und Funktion von Knochenmarkstromazellen Entstehungsmechanismen des nicht-hämatopoetischen Chimärismus Zellkonversion: Plastizität und Transdifferenzierung Zellfusion Zielsetzung 27 2 Material Geräte Chemikalien und Reagenzien Antikörper Y-Chromosom Gensonde Lösungen und Medien 31 3 Methoden 32 A: Generierung von Knochenmarkstromazellen in vitro Patientenauswahl Generierung von Knochenmarkstromazellen 36 3
4 3.2.1 Ansatz der Knochenmarkstromakulturen Mediumwechsel Zellsplitting Zellernte und Fixierung 39 B: Stromazellpopulation und Chimärismusanalyse Immunfluoreszenzfärbung und FISH-Analyse Fluoreszenz In-situ Hybridisierung Kombination von Y-Chromosom FISH, Kernfärbung und Vimentin/von-Willebrand-Faktor Immunfluoreszenzfärbung Kombination von Y-Chromosom FISH mit Immunfluoreszenzfärbungen für Vimentin/von-Willebrand-Faktor und CD14/CD Kombination von Kernfärbung und Immunfluoreszenzfärbungen für Vimentin/von-Willebrand und CD14/CD Kontrollen der Fluoreszenzfärbungen Auswertungen der Fluoreszenzfärbungen Statistik 53 4 Resultate 54 A: Analyse des Wachstumsverhaltens von Knochenmarkstromazellen in vitro Stromazellwachstum und Konditionierung Patientenproben vor der Transplantation Patientenproben nach der Transplantation Einflüsse auf das Stromazellwachstum nach der Transplantation Patientenalter Diagnose Primäre Therapien zur Erlangung der Remission Art des Transplantates Anzahl der Stammzellen im Transplantat Remissionsstatus Verwendung von Anti-Thymozyten-Globulin während der Konditionierung Auftreten akuter Graft-versus-Host Disease Zytomegalievirus 64 4
5 Virostatische Therapie bei der Probenentnahme Einfluss der verschiedenen Konditionierungen auf das Stromazellwachstum nach der Transplantation Hämatopoetische Regeneration nach der Transplantation Transfusion von Erythrozyten/Thrombozytenkonzentraten Leukozytenregeneration nach der Transplantation Thrombozytenregeneration nach der Transplantation 70 B: Stromazellpopulation und Chimärismusanalyse Charakterisierung der Stromazellkulturen Stromazellwachstum in vitro Zellkomposition und Chimärismusanalyse Stromazellformationen in vitro Chimärismusanalyse der Stromazellen 78 5 Diskussion 82 A: Generierung und Wachstum von Knochenmarkstromazellen in vitro Studienlage und Methodik Schädigung der Stromazellen und die Konsequenzen Eigene Ergebnisse Konditionierung als prädiktiver Faktor für das Stromazellwachstum? Weitere Einflüsse auf das Stromazellwachstum Hämatopoetische Regeneration nach allogener HZT Studien Eigene Ergebnisse 89 B: Chimärismus von Knochenmarkstromazellen nach allogener HZT Nicht-hämatopoetischer Chimärismus Studien Chimärismus von Knochenmarkstromazellen Eigene Ergebnisse 93 5
6 6 Zusammenfassung 96 7 Literaturverzeichnis 98 8 Anhang Abkürzungsverzeichnis Publikation Lebenslauf Dank 119 6
7 1 Einleitung 1.1 Die Knochenmarktransplantation Geschichte Blut ist ein ganz besondrer Saft (Goethe, 1808). Nicht erst bei Goethe wird dem Organ große Aufmerksamkeit zuteil. In der griechischen Mythologie ist nachzulesen, dass bereits Medea das Blut des alternden Jason mit einem speziellen Trunk erneuerte, den sie intravenös verabreicht haben soll. Der Held fand danach wieder zu alter Stärke. Infusionen von Blut oder Mark sollten schon damals den Körper reinigen und Krankheiten heilen. Die wahrscheinlich erste dokumentierte Blutübertragung fand 1667 in Cambridge statt. Dort verband R. Lower die Halsschlagader eines Lammes mit der Ellbogenvene eines Menschen. Aus dem 18. und 19. Jahrhundert stammen Berichte über Transplantationen von endokrinem Gewebe, wie z.b. Schilddrüsengewebe und bereits im Mittelalter wurde versucht, mit Hauttransplantationen Verunstaltungen als Verletzungsfolge zu kurieren. Einen großen Schritt in Richtung Organverpflanzung bedeutete die Entdeckung des ersten Blutgruppensystems durch K. Landsteiner im Jahr Durch die Kenntnis der Blutgruppen A, B und 0 war damit die Bluttransfusion eine therapeutische Option bei Verletzungen und Erkrankungen geworden und der erste Schritt zu einer erfolgreichen Organverpflanzung getan. Im frühen 20. Jahrhundert wurde dann die Organtransplantation als Behandlungsmöglichkeit anerkannt und die ersten Versuche, Organe zu transplantieren, begannen. Zunächst wurde versucht Tierorgane auf den Menschen zu übertragen. Durch die Fehlschläge aufgrund der Abstoßungsreaktionen wurde jedoch das Vorhaben in den 30er Jahren nahezu völlig aufgegeben. Erst nach dem 2. Weltkrieg blühte das Interesse an der Transplantation wieder auf. Im Zuge dessen wurde verstärkt über die Abstoßungsreaktionen des Körpers nachgedacht, damals noch als unbekanntes Moment bezeichnet, da die Ursachen noch nicht nachvollziehbar waren. 7
8 Bereits 1912 wurde von dem Pathologen G. Schöne die These aufgestellt, dass körpereigene Immunprozesse für die Abstoßung körperfremder Organe verantwortlich sein könnten. Diese These wurde bestätigt, als einem Patienten in Boston im Dezember 1954 die Niere seines eineiigen Zwillingsbruders verpflanzt wurde. In diesem Fall war die größtmögliche Ähnlichkeit des Gewebes gegeben. Der Patient überlebte acht Jahre mit dem Spenderorgan bis er infolge eines Herzinfarktes starb. Dies machte deutlich, dass erfolgreiche Transplantationen bei nichtidentischen Gewebsmerkmalen nur durch die Unterdrückung der Abstoßungsreaktion möglich werden konnten wurde von Professor Dausset in Paris das HLA-System (Human Leukocyte Antigen-System, HLA) entdeckt. Mit seiner Hilfe unterscheidet das Immunsystem anhand spezifisch ererbter Merkmale zwischen fremdem und eigenem Gewebe wurde dann erstmals Gewebe von Spender und Empfänger typisiert. Bis heute werden Organe idealerweise nur zwischen Personen transplantiert, die eine möglichst ähnliche Gewebetypisierung aufweisen, damit die Abstoßungsreaktion nach der Transplantation deutlich geringer ausfällt. Die Entwicklung von Arzneimitteln zur spezifischen Unterdrückung der Immunabwehr begann dann in den 60er Jahren des vergangenen Jahrhunderts. Bereits vor 1960 wurden Kortison und Azathioprin bei transplantierten Patienten eingesetzt. Ein Durchbruch auf diesem Gebiet gelang den Forschern gegen Ende der 70er Jahre. Sie entdeckten die immunsuppressive Wirkung eines Pilzes in Bodenproben aus Norwegen, den Wirkstoff Ciclosporin, der 1983 eingeführt wurde. Seither wurden die Medikamente ständig weiterentwickelt, verbessert und neue Substanzen in die Therapie eingeführt, so dass heute sehr gute Möglichkeiten zur Verfügung stehen, der Organabstoßung entgegenzuwirken. Insbesondere für die Entwicklung der Knochenmarktransplantation wurde mit der Detonation der Atombomben über Hiroshima und Nagasaki ein neues Kapitel eröffnet. Die tragischen Folgen waren äußerst aufschlussreich für die Medizin: es war möglich, durch Bestrahlung Knochenmark zu entfernen. Französische Forscher verabreichten 1958 einer Gruppe von Strahlungsopfern, deren eigenes Knochenmark bei einem Unfall zerstört wurde, humanes Knochenmark intravenös. Fünf der sechs Patienten überlebten die Transplantation problemlos und führten danach ein beschwerdefreies Leben. In diesem Zusammenhang fanden die 8
9 Mediziner heraus, dass auch das Transplantat gegen den neuen Wirt reagieren konnte (Graft versus Host Disease, GvHD). Der Amerikaner E. D. Thomas nutzte die Beobachtungen aus Japan und Frankreich und behandelte einen Tumorpatienten erfogreich mit einer hochdosierten Ganzkörperstrahlentherapie und anschließender Knochenmarktransplantation. In der Folgezeit wurde dieser neue Therapieansatz stetig weiterentwickelt. Somit wurde der Weg geebnet für die Entwicklung der modernen Knochenmarktransplantation als Standardtherapie für viele hämatologische Neoplasien, welche aber auch zunehmend als Immuntherapie für die Behandlung solider Tumoren eingesetzt wird (Little, Storb, 2002) erhielt E. D. Thomas den Nobelpreis für Medizin für sein Lebenswerk auf dem Gebiet der Knochenmarktransplantation Das blutbildende System Das Knochenmark ist die Produktionsstätte der Zellen des menschlichen Blutes. Dem Knochenmark wird das periphere Blut gegenübergestellt. Dieses besteht aus dem Blutplasma sowie den darin enthaltenen Zellen und Zellbestandteilen. Eine grobe Unterteilung unterscheidet zwischen Erythrozyten, Thrombozyten und Leukozyten/Lymphozyten. Im Knochenmark kann eine weitaus größere Anzahl von unterschiedlichen Zellen klassifiziert werden. Es handelt sich hierbei um unreife Vorläuferzellen der genannten Zellen des peripheren Blutes. Die unreifsten Zellen des Knochenmarks, die sogenannten hämatopoetischen Stammzellen, werden heute durch den Nachweis bestimmter Oberflächenmoleküle v.a. CD34 (Cluster of Differentiation) differenziert. Die Expression dieses Oberflächenantigens wird bei der weiteren Differenzierung der ausreifenden hämatopoetischen Zellen herunterreguliert, sodass CD34 den entscheidenden Marker für die Bestimmung der Stammzellen darstellt (Bonnet, 2002). Die hämatopoetischen Stammzellen können sich unter der Wirkung von bestimmten Wachstumsfaktoren (multipotente Progenitoren, MPP; common lymphocyte progenitor, CLP; common myeloid progenitor; CMP) in sämtliche hämatopoetische Zelltypen (myeloide, erythroide oder lymphoide Vorläuferzellen) differenzieren (Metcalf et al, 1989; Lagasse et al, 2001). Damit sorgen die Stammzellen für die konstante Erneuerung der Zellen des Blutes und des Immunsystems. Eine einzige hämatopoetische Stammzelle wäre also in der Lage, 9
10 das gesamte hämatopoetische System zu regenerieren. Dies wurde im Tierversuch bereits demonstriert (Osawa et al, 1996). Die Stammzellen reproduzieren sich selbst, so dass ihr Bestand für unbegrenzte Zeit regelmäßig erneuert wird (Blau, 2001). Während die von den lymphoiden Vorläuferzellen abstammenden Lymphozyten noch einer Prägung bedürfen (z.t. im Thymus, z.t. im Knochenmark), und später nicht nur im Knochenmark, sondern auch in Milz und Lymphknoten gebildet werden (Lymphopoiese), proliferieren und reifen alle anderen Vorläuferzellen bis zu ihrer Endstufe im Knochenmark heran (Myelopoiese). Daran sind u.a. auch zwei renale Hormone beteiligt, das Erythropoietin für die Reifung und Proliferation von Erythrozyten und das Thrombopoietin für die Reifung der Megakaryozyten als Vorstufe der Thrombozyten, bzw. für die Reifung der Thrombozyten selbst. So schließlich gelangen die reifen Zellen in den Blutkreislauf. Abbildung 1: Klassisches Modell der Hämatopoese im Knochenmark. Aus mulitpotenten hämatopoetischen Stammzellen gehen myeloide, erythrozytäre und lymphoide Vorläuferzellen hervor, welche sich weiter zu den Blutzellen differenzieren 10
11 1.1.3 Knochenmark- oder Blutstammzelltransplantation Ist das blutbildende System durch eine Krankheit in seiner Funktion gestört, kann eine Stammzelltransplantation (als Knochenmark- bzw. periphere Blutstammzelltransplantation, KMT bzw. PBSZT) eine mögliche Therapie sein. Heute besitzt die Transplantation hämatopoetischer Stammzellen (HZT) einen wichtigen Stellenwert in der Behandlung von schweren hämatologischen oder auch onkologischen Erkrankungen und wird als differenzierte hämatopoetische Zelltherapie vermutlich noch weiter an Bedeutung gewinnen (Little, Storb, 2002; Horowitz, 2004). Bei folgenden hämatologischen Erkrankungen ist heute an eine Stammzelltransplantation im Rahmen der Primärbehandlung zu denken: akute Leukämien und Myelodysplasien chronisch myeloische Leukämie schwere aplastische Anämie myeolproliferative Syndrome, Philadelphia-Chromosom negativ multiples Myelom aggressive Non-Hodgkin-Lymphome niedrig maligne Lymphome, chronisch lymphatische Leukämie. Hämatopoetische Stammzellen können auf zwei Wegen gewonnen werden. Bis in die 80er Jahre war eine Knochenmarkentnahme die einzige Möglichkeit, um ausreichend hämatopoetische Stammzellen zu gewinnen. Das Knochenmark wird mittels Punktion aus dem Beckenkamm des Spenders gewonnen. Dieser Eingriff erfordert, da er recht schmerzhaft ist, eine Allgemeinanästhesie. Inzwischen können die Stammzellen zumeist aus der peripheren Blutbahn gewonnen werden, welches ein wesentlich schonenderes Verfahren darstellt. Durch die Gabe eines hämatopoetischen Wachstumsfaktors (Granulozyten-Colony-stimulating-Factor, G-CSF) können die Stammzellen zum vermehrten Übertritt in das zirkulierende Blut angeregt werden. Nach dieser Mobilisierungsphase werden durch spezielle Zellauftrennungsverfahren (Leukapheresen) gezielt Stammzellen aus dem Blut geerntet. Der vorübergehende Verlust der Knochenmarkzellen wird durch die gute Regenerationsfähigkeit der Stammzellen bald wieder ausgeglichen. Die gewonnenen hämatopoetischen Stammzelltransplantate werden dem Empfänger intravenös infundiert und müssen mindestens 2x10 6 CD34 + -Zellen/kg 11
12 Körpergewicht (KG), bzw mononukleäre Zellen/kg KG enthalten (Schmitz, 2004). Die Transplantate bestehen allerdings nicht ausschließlich aus Stammzellen. Sie enthalten auch eine Vielzahl anderer weißer Blutzellen unterschiedlicher Reife. Damit suggerieren die Bezeichnung periphere Blutstammzelltransplantation als auch der Überbegriff für PBSZT und KMT hämatopoetische Stammzelltransplantation fälschlicherweise, dass ausschließlich hämatopoetische Stammzellen transplantiert werden (Abkowitz, 2002; Manz et al 2004). Die Transplantation von hämatopoetischen Stammzellen wird nach dem Grad der genetischen Unterschiede zwischen Spender und Empfänger in autologe und allogene Stammzelltransplantation eingeteilt. Bei der autologen Transplantation sind Spender und Empfänger dieselbe Person. Hingegen werden dem Patienten bei der allogenen Stammzelltransplantation die Zellen eines gesunden Spenders übertragen. Der Spender kann ein HLAidentisches Familienmitglied (familiär-allogene Transplantation) oder ein ebenfalls HLA-identischer fremder Spender sein (fremd-allogene Transplantation). Auch sind fremd- oder familiär-allogene Transplantationen möglich, wenn beim Spender nur die Hälfte der HLA-Merkmale identisch ist (haplo-ident). Solche Differenzen in den Gewebemerkmalen können jedoch nicht nur eine Transplantatabstoßung begünstigen, sondern führen trotz entsprechender Immunsuppression zu schwersten Graft-versus-Host-Reaktionen, d.h. einer Abwehrreaktion der transplantierten Immunzellen gegen Empfängerzellen, was im Folgenden noch näher erläutert werden wird. Eine Besonderheit bilden die syngenen Transplantationen bei denen der Spender genetisch gleich ist (eineiige Zwillinge). Im Folgenden wird ausschließlich über die allogenen Transplantationen berichtet, da diese in der vorliegenden Arbeit relevant sind Konditionierung Im Allgemeinen werden Patienten mit einer hämatologischen Neoplasie mit einer Konditionierungstherapie auf die eigentliche Stammzelltransplantation vorbereitet. 12
13 Die Konditionierungstherapie dient folgenden Zielen: Das Erreichen einer Remission, d.h., der Eradikation sämtlicher neoplastischer Zellen bei einer malignen Erkrankung, mit dem Ergebnis, dass vorübergehend keine Krankheitszeichen nachweisbar sind; Immunsuppression des Empfängers bei allogenen Transplantationen, damit die übertragenden Stammzellen nicht abgestoßen werden (Armitage, 1994). Das Konditionierungsregime hängt von der Grunderkrankung und dem Krankheitsstadium ab. Die klassischen myeloablativ bezeichneten Konditionierungen (myeloablativ = knochenmarkzerstörend) bestehen z. B. aus der Kombination einer Ganzkörperbestrahlung (12 Gray) und einer Hochdosischemotherapie (Cyclophosphamid (120mg/kg) und Etoposid (50 mg/kg)), oder einer rein medikamentösen Therapie (Busulphan (16 mg/kg) und Cyclophosphamid (120 mg/kg)). Die Zytostatika- und Bestrahlungsdosen sind so ausgewählt, dass die Haupttoxizität die Knochenmarkaplasie (irreversible Knochenmarkschädigung) darstellt, keine irreversiblen Organschäden auftreten und trotzdem eine maximale antineoplastische Wirkung erzielt wird. Neben zytotoxischen Antitumoreffekten werden bei der allogenen Stammzelltransplantation auch immunologische Effekte (Graft-versus-Leukämie Reaktion) erzielt. Dies ist der Ansatzpunkt für das Verfahren der reduzierten Konditionierung (z. B. Fludarabin (150mg/m 2 ), BCNU ( mg/kg) und Melphalan ( mg/kg)), welches während der letzten Jahre zunehmend Anwendung findet. Das Prinzip der Stammzelltransplantation mit reduzierter Konditionierung besteht darin, eine wirksame Immunsuppression des Empfängers zu erreichen, damit sich nach der Transplantation genügend Spenderstammzellen etablieren können. In der Folge werden dann die immunologischen Effekte des Tranplantates genutzt, um verbliebene neoplastische Zellen aus dem Organismus des Empfängers zu eliminieren. Nach der Konditionierungsphase kann dann die Stammzelltransplantation erfolgen. Die transplantierten hämatopoetischen Stammzellen nisten sich im Knochenmark ein und können sich dort nach etwa 2-3 Wochen wieder zu funktionsfähigen Blutzellen differenzieren. 13
14 1.2 Die Folgen der Transplantation Engraftment und hämatopoetischer Chimärismus Die Blutbildung bleibt nach einer Stammzelltransplantation lebenslang spendertypisch, d.h. dass das hämatopoetische System des Empfängers nach dem Engraftment (Akzeptanz des neuen Gewebes) des Transplantates von den genetisch verschiedenen hämatopoetischen Spenderzellen gebildet wird. Auch Abkömmlinge zirkulierender hämatopoetischer Zellen wie Alveolarmakrophagen (Thomas et al, 1976), Kupffer-Zellen der Leber (Gale et al, 1978), Langerhans- Zellen der Haut (Hessel et al, 1996; Volc-Platzer et al, 1984) und Mikroglia-Zellen des ZNS (Unger et al, 1993), aber auch epitheliale Zellen (Spyridonidis et al, 2004a) können nach der Transplantation den Genotyp des Spenders aufweisen, wohingegen andere Zelltypen weiterhin vom Empfänger stammen. Klinisch wird hier der Begriff (hämatopoetischer) Chimärismus verwendet. Die Chimäre der griechischen Mythologie ein Wesen mit Körperteilen von Löwe, Ziege und Drachen gilt als Symbol für die Toleranz genetisch verschiedener Individuen und ihrer Organe (Bryant, Martin, 2004). Abbildung 2: Chimaera aus der griechischen Mythologie Graft versus Host Disease Ist der Spender genetisch verschieden, kann dies nach der Regeneration des transplantierten Knochenmarks durch die Produktion von Lymphozyten zu schwerwiegenden Alloreaktionen des Immunsystems wie Abstoßung des 14
15 Transplantats oder zur so genannten Graft-versus-Host Disease (GvHD) führen. Dies bedeutet, dass die immunkompetenten Zellen aus dem Transplantat im Empfängerorganismus zelluläre Immunreaktionen vermitteln und spezifisch gegen den Empfänger gerichtete zytotoxische Antikörper und T-Zellen bilden. Im gesunden Organismus werden diese Zellen rasch abgebaut. Bei Empfängern mit unterdrückter oder geschwächter Immunabwehr (als Folge der Konditionierung) kann die GvHD als Sekundärreaktion zu einer schweren akuten oder chronischen Erkrankung führen. Die akute Form der GvHD tritt definitionsgemäß innerhalb der ersten 100 Tage nach allogener Transplantation auf und ist ein Syndrom, welches mit Dermatitis, Hepatitis und Enteritis einhergeht. Die chronische GvHD, welche sich später als 100 Tage nach allogener Transplantation manifestiert, ist im Krankheitsbild sehr variabel. Sie kann verschiedenste Organsysteme betreffen und ähnelt einer chronischen Autoimmunerkrankung. Das GvHD- Risiko ist am geringsten bei der Transplantation von HLA-identischen Geschwistern und nimmt bei Einsatz nur teilweise HLA-identischer Verwandter oder bei nicht verwandten Spendern mit phänotypisch identischen Haupt-HLA- Merkmalen zu (Ruggeri et al, 2002). Aus diesem Grund wird in der Regel bei allen allogenen Transplantationen eine GvHD-Prophylaxe mit verschiedenen Immunsuppressiva (z.b. Cyclosporin A, Kortison, Methothrexat, Antithymozytenglobulin) durchgeführt, um die Immunreaktion der Spenderzellen zu hemmen Zytomegalievirusinfektion Ein hohes Risiko bei der Entwicklung einer GvHD-Reaktion besteht ferner darin, dass die zu ihrer Behandlung notwendige immunsuppressive Therapie nicht nur die Immunreaktion des Transplantates hemmt, sondern gleichzeitig auch einen starken Einfluss auf die Infektionsabwehr des Empfängers nimmt. Somit können u.a. latent-persistierende Erreger reaktiviert werden, wie z.b. am häufigsten das Zytomegalievirus (CMV). Das humane CMV gehört zu der Familie der Herpesviren (Herpesviridae), ist ubiquitär verbreitet und besitzt wie alle Herpesviren die Eigenschaft der lebenslangen Persistenz im infizierten Organismus. Die Infektion mit dem CMV 15
16 sie verläuft bei Immunkompetenten in der Regel asymptomatisch kann bei Patienten mit iatrogener Imunsuppression im Rahmen von Organtransplantationen zu lebensbedrohlichen Krankheitsverläufen führen (Sissons, Borgsiewicz, 1989). Diese können verschiedene Organsysteme betreffen (z.b. Hepatitis, Encephalitis, gastrointestinale Ulcerationen). Eine der gefürchtetsten Organmanifestationen ist die atypische interstitielle CMV-Pneumonie, welche besonders bei Patienten nach hämatopoetischer Stammzelltransplantation mit einem Infektionsmaximum um den 60. Tag post transplantationem auftritt und eine der häufigsten Todesursachen nach HZT darstellt (Sissons, Borgsiewicz, 1989). Des Weiteren können CMV- Infektionen (Primärinfektionen und Reaktivierungen) bei diesen Patienten eine Abstoßung des Transplantates begünstigen (Becker, 1993; Britt, 1996). Da die CMV-Infektion nach allogener hämatopoetischer Stammzelltransplantation mit einer hohen Letalität behaftet ist, muß sie deshalb möglichst frühzeitig, d.h. vor dem Auftreten von Symptomen behandelt werden, oder im Sinne einer Expositionsprophylaxe vermieden werden. Zur Expositionsprophylaxe kann bei seronegativen Patienten mit seronegativem Spender z.b. die Gabe von Blutprodukten nur ebenfalls seronegativer Spender erfolgen, um eine Primärinfektion zu vermeiden. Für die CMV-seropositiven Patienten, oder die seronegativen Patienten mit seropositivem Stammzellspender wird eine Frühintervention durchgeführt, d.h., dass diese Patienten mittles verschiedener sensitiver Nachweisverfahren hinsichtlich eines Auftretens der CMV-Infektion überwacht werden. Ist der Nachweis einer Infektion gesichert, kann dann frühzeitig eine antivirale Therapie mit dem Nukleosidanalogon Ganciclovir durchgeführt werden (Stamminger, 1997). 1.3 Reduzierte Konditionierung Das Standardverfahren der allogenen Stammzelltransplantation umfasst eine Konditionierungstherapie, deren hochdosierter Charakter eine irreversible Eradikation der neoplastischen aber damit auch der gesunden Zellen im Knochenmarkraum des Patienten bewirken soll. Für die erfolgreiche Durchführung dieser myeloablativen allogenen Stammzelltransplantation sind ein entsprechender Allgemeinzustand des Patienten, normale Organfunktionen, entsprechendes Alter, sowie die Infektionsfreiheit zum Zeitpunkt der 16
17 Konditionierung wesentliche Voraussetzungen, da diese sehr intensive Therapieform zu lebensbedrohlichen Komplikationen an nicht blutbildenden Organen, wie z. B. intestitielle Pneumonie oder Veno-Okklusiv-Erkrankungen der Leber führen kann. Die Häufigkeit an Komplikationen nimmt altersabhängig zu. In Anbetracht des durchschnittlichen Erkrankungsalters besteht z.b. bei manchen Leukämieformen im 5. Lebensjahrzehnt allein aufgrund der Akuttoxizität der Konditionierungstherapie ein erhöhtes Therapierisiko. Dadurch kann eine erfolgreiche Durchführung der allogenen Stammzelltransplantation mit zunehmendem Alter unmöglich werden. In der Vergangenheit führte das dazu, dass Patienten mit vorhersehbaren hohen transplantationsassoziierten Risiken von der myeloablativen allogenen Stammzelltransplantation ausgeschlossen wurden, und somit an den Folgen ihrer Grunderkrankung verstarben. Aber auch bei jüngeren Patienten mit Begleiterkrankungen oder vorbestehenden Organfunktionseinschränkungen kann die Toxizität der Konditionierungstherapie zum akuten Funktionsverlust oder zur dauerhaften Schädigung lebenswichtiger Organe führen. Bei der allogenen Stammzelltransplantation wird nicht nur ein neues Blutbildungssystem, sondern auch das neue Immunsystem des Spenders durch reife und neu produzierte Immunzellen übertragen. Damit addieren sich weitere Effekte verursacht durch die Lymphozyten des Spenders, einerseits resultieren daraus primär erhöhte Risiken für virale und Pilz-Infektionen, aber es findet auch die entscheidende immunologische Auseinandersetzung zwischen Spender und Empfänger statt. Die Spender-T-Lymphozyten können die Zellen des Patienten als fremd erkennen und damit potentiell eine GvHD in der akuten oder chronischen Form auslösen. Es wurde aber beobachtet, dass sich gerade diese Immunreaktion der Spender-T-Lymphozyten auch gegen restliche neoplastische Zellen richten kann, und dass damit die Patienten mit einer GvHD wesentlich besser gegen Krankheitsrückfälle geschützt waren (Weiden et al, 1979). Dieser Effekt wird als Graft-versus-Leukämie Reaktion (GvL) bezeichnet und wurde belegt, als bei krankheitsrückfälligen Leukämiepatienten eine Transplantation ausschließlich mit Spender-Lymphozyten zum Heilungserfolg führte (Kolb, 1990; Kolb, Holler 1997). Um sich diesen Effekt zunutze zu machen, wurden in jüngerer Zeit andere Verfahren der Konditionierungstherapie entwickelt, deren primäres Ziel die Etablierung der Spenderblutbildung ohne eine weitestgehende Eradikation 17
18 neoplastischer Stammzellen ist. Dieses Therapieziel kann mit vorrangig immunsuppressiven Verfahren erreicht werden, bei denen die Dosis-Intensität wesentlich geringer ist (reduzierte Konditionierung), als bei den herkömmlichen myeloablativen Konditionierungsschemata. Die antineoplastische Wirkung der allogenen Stammzelltransplantation nach reduzierter Konditionierung beruht entscheidend auf den T-Lymphozyten des Spenders, welche gegen die von neoplastischen Stammzellen exprimierten Histokompabilitäts-Antigene, aber möglicherweise auch gegen Leukämie-assoziierte Antigene reagieren und die Leukämiezellen dadurch vernichten können. Zur Induktion des GvL-Effektes nach einer Konditionierung mit reduzierter Intensität ist ein frühzeitiges Ausschleichen der immunsuppressiven Therapie erforderlich, die zur Vorbeugung oder zur Therapie immunologischer Unverträglichkeitsreaktionen im Posttransplantationsverlauf appliziert wird. Reicht der Entzug der immunsuppressiven Medikation allein nicht aus, können Spender-T-Zellen (Donor- Lymphocytes-Infusion, DLI) in aufsteigender Dosis fraktioniert übertragen werden, bis ein vollständiger Chimärismus (Lymphozyten haben den Genotyp des Spenders, keine patienteneigenen Lymphozyten mehr nachweisbar) der Spender- T-Zellen und/oder eine komplette Remission der Erkrankung erreicht ist. Der medizinische Gewinn, der aus der Reduzierung der Konditionierungsintensität resultiert, liegt vor allem darin, dass aufgrund der geringeren Toxizität auch Patienten mit höherem Alter, reduziertem Allgemeinbefinden oder bestehenden Infektionen mit dieser Methode therapiert werden können (McSweeney et al, 2001; Slavin et al, 1998). Die Nebenwirkungen durch die Toxizität der Chemotherapeutika wie Diarrhöen, Übelkeit, Erbrechen, Mukositis und Haarausfall sind bei diesem reduzierten Regime ebenfalls weniger ausgeprägt. Des Weiteren wurde bei den Patienten beobachtet, dass nach der Transplantation weniger Transfusionen von Erythrozyten - und Thrombozytenkonzentraten notwendig waren und der Charakter der Zytopenien im Posttransplantationsverlauf weniger aggressiv war, als im Vergleich zu myeloablativ vorbehandelten Patienten (Weissinger et al, 2001; Childs et al, 1999). Ob zusätzliche positive Effekte auch für die Regenierung der Stromazellen des Knochenmarks und seiner protektiven Rolle gegenüber der Hämatopoese nach der Transplantation der geringeren Toxizität dieses Konditionierungsschemas zuzuschreiben ist, bleibt noch abzuwarten. 18
19 Die bisherigen klinischen Erfahrungen mit reduzierten Konditionierungsschemata vor allogener Stammzelltransplantation zeigen jedoch, dass dieses Verfahren auch bei älteren Patienten oder bei Patienten mit limitierenden Begleiterkrankungen deutlich besser verträglich ist, als eine myeloablative Konditionierung. Somit kann auch diesen Patienten die Therapiemöglichkeit einer Stammzelltransplantation angeboten werden und damit zu einer Senkung der Frühmortalität beitragen. Die erfolgreichen Stammzelltransplantationen bei älteren Patienten mit reduzierter Konditionierungstherapie scheinen dies zu bestätigen (Gratwohl et al, 2002). 1.4 Das Knochenmark Das blutbildende oder rote Knochenmark (KM) ist ein weiches und fetthaltiges Gewebe, welches die Hohlräume zwischen den Knochenbälkchen der Knochenspongiosa ausfüllt. Dabei bilden die retikulären Bindegewebszellen mit ihren Fortsätzen ein stabiles Gerüst, das so genannte Knochenmarkstroma. In den dazwischen liegenden Hohlräumen, den Sinusoiden, nisten die hämatopoetischen Stammzellen und stehen damit in ständiger Verbindung mit den Stromazellen. Frühere Beobachtungen einer nicht zufälligen räumlichen Verteilung der erythroiden sowie der myeloischen Vorläuferzellen im Knochenmark führten zu der Vermutung, dass hämatopoetisches Gewebe eine differenzierte Struktur besitzt, die eine wesentliche Bedeutung für die Proliferation und Differenzierung hämatopoetischer Zellen hat (Lambertsen et al; 1984, Lord et al, 1975). Die Entwicklung experimenteller Methoden, z.b. in vitro Assays für hämatopoetische Vorläuferzellen (Metcalf et al, 1979), in vitro Knochenmarklangzeitkulturen (Dexter et al, 1984), sowie die Genklonierung für verschiedene hämatopoetische Zytokine (Olsson et al, 1992; Sieff et al, 1987) ermöglichte weitere umfassende Untersuchungen der strukturellen und physiologischen Eigenschaften des hämatopoetischen Milieus, sowohl in vitro als auch in vivo. Die auf diesem Weg gewonnenen Erkenntnisse zeigen, dass die Blutbildung über komplexe Interaktionen zwischen hämatopoetischen Zellen sowie den unterschiedlichen Stromazellen reguliert wird und der Funktion der 19
20 Knochenmarkstromazellen hierbei eine entscheidende Rolle zukommt (Cashman et al, 1990; Eaves et al, 1991; Liesveld et al, 1989) Mesenchymale Stammzellen Das Knochenmark beherbergt neben den hämatopoetischen Stammzellen auch Stammzellen, die sich nicht in hämatopoetische Zelltypen differenzieren, die mesenchymalen Stammzellen (MSC). Diese Zellen sind CD45 -, CD34 - (Graf, 2002) und konnten auch in anderen Geweben, wie Fettgewebe, in Plazenta, in Gelenksynovia, wie auch im Nabelschnurblut nachgewiesen werden (Gronthos et al, 2001; Fukuchi et al 2004; De Bari et al, 2001; Lee et al 2004). Es gibt bislang keine sichere Übereinstimmung bezüglich der Charakterisierung der mesenchymalen Stammzellen. Daher werden die Stammzell-Populationen nach den verwendeten Kulturbedingungen und Methoden zur Isolierung unterschieden: nach Friedenstein (Friedenstein et al, 1976; Owen et al, 1987) nach Prockop (Colter et al, 2000, 2001) nach Simmons (Simmons, Torok-Storb, 1991) und nach Verfaillie (Reyes et al, 2001a; Reyes, Verfaillie, 2001b). Unter definierten Bedingungen können mesenchymale Stammzellen in vitro in Osteoblasten, Adipozyten, Chondrozyten Muskelzellen, Vorläufer von Neuronen und in Stromazellen differenziert werden (Caplan, 1991; Pittenger et al, 1999; Wakitani et al, 1995; Woodbury et al, 2000; Makino et al 1999). Im Jahr 2001 wurde von der Arbeitsgruppe um Verfaillie eine weitere in vitro adhärent wachsende adulte Stammzelle aus dem Knochenmark beschrieben, welche als MAPC (multipotent adult progenitor cells) bezeichnet wird (Reyes, Verfaillie, 2001b). Diese Zellen besitzen neben der Fähigkeit einer mesenchymalen Differenzierung auch das Potenzial sich in funktionell aktive Zellen von Endothel, Neuroektoderm (Neurone, Astrozyten, Oligodendrozyten) und in Hepatozyten zu differenzieren (Jiang et al, 2002a; Jiang et al, 2002b; Schwartz et al, 2002). Es konnte gezeigt werden, dass MAPC auch in vivo ihre eigentliche pluripotente Differenzierungsfähigkeit entfalten können, indem sie sich, als murine Einzelzellen in frühe Blastozysten injiziert, in den Organismus integrieren konnten und an der Entwicklung fast aller somatischen Gewebe beteiligt waren (Jiang et al, 2002a). 20
21 Kürzlich konnte eine weitere Population von pluripotenten Stammzellen aus murinem Knochenmark (Kucia et al, 2006) und aus humanem Nabelschnurblut (Kucia et al, 2007) beschrieben werden. Diese Zellen, als VSEL (very small embryonic like cells) bezeichnet, haben eine ähnliche Morphologie und einen ähnlichen Phänotyp wie embryonale Stammzellen. Des Weiteren besitzen sie die Fähigkeit, sich in vitro in Zellarten aller drei Keimbätter zu differenzieren. Sowohl für MAPC als auch für VSEL wurden bereits viele Oberflächenmarker nachgewiesen (Anjos-Afonso, 2007). Es zeigten sich auch hier häufig Übereinstimmungen, was vermuten lässt, dass es sich hier möglicherweise um denselben Zelltyp handeln könnte (Ratajczak et al, 2007). Auch ist es unklar, ob es sich bei diesen Zelltypen um eine seltene, besonders frühe und unreife Subfraktion der mesenchymalen Stammzellen handelt, oder um gänzlich andere Zellen. Es konnte bislang auch nicht zweifelsfrei gezeigt werden, ob das vielseitige Differenzierungspotential tatsächlich in vivo existiert, oder erst durch spezifische Kulturbedingungen in vitro induziert wird (Gurtner et al, 2007; Herzog et al, 2003) Struktur und Funktion der Knochenmarkstromazellen Die Knochenmarkstromazellen sind strukturell in hämatopoetischen Mikromilieus organisiert. Damit wird ein lokales Netzwerk beschrieben, welches durch komplexe Interaktionen die Selbsterneuerung, Proliferation und Differenzierung hämatopoetischer Stammzellen, bzw. Vorläuferzellen beeinflussen kann (Dexter, 1982). Dieses Mikromilieu wird gebildet durch: die verschiedenen Elemente von Stromazellen wie Adipozyten, Fibroblasten, Makrophagen, und Endothelzellen, Immunzellen wie B- und T-Lymphozyten, Natürliche Killerzellen pluripotente Stammzellen, durch ihre Fähigkeit der ständigen Selbsterneuerung und Bildung von Vorläuferzellen aller hämatopoetischen Zelllinien definiert Vorläuferzellen, welche im Teilungs- und Differenzierungspotential bereits festgelegt sind und bereits ausgereifte Zellen aller Zelllinien (Dorshkind, 1990; Mayani et al, 1992a; Torok-Storb et al, 1988). 21
22 Fibroblastäre Zellen machen den größten Anteil der Knochenmarkstromazellen aus. Sie können sich in zwei Populationen differenzieren. Zum einen adventitielle Fibroblasten, welche die Endothelzellen umgeben. Sie regulieren u.a. den Übertritt reifer Blutzellen in die Knochenmarksinus. Die zweite Population fibroblastärer Zellen ist innerhalb der blutbildenden Areale lokalisiert. Diese Zellen bilden durch ihre zytoplasmatischen Ausläufer sowohl ein stützendes Gerüst, stehen aber auch darüber in direktem Zell-Zell-Kontakt mit den hämatopoetischen Zellen (Lichtman, 1984; Shaklai et al, 1979). Makrophagen hingegen differenzieren sich aus hämatopoetischen Stammzellen (Bradley et al, 1966). Einerseits umgeben sie die perisinusoidalen Endothelzellen, des Weiteren sind sie aber auch in erythroblastischen Arealen zu finden, wo einzelne Makrophagen von reifenden Erythroblasten umgeben sind. Diese zentralen Makrophagen stehen über interzelluläre Verbindungen wie gap junctions mit den erythroiden Vorläuferzellen in direktem Kontakt und sind in der Lage hämatopoetische Wachstumsfaktoren freizusetzen (Campbell et al, 1987). Somit scheint ihnen eine Schlüsselrolle in der Regulation der Reifung erythrozytärer Zellen zuzukommen (Lichtman, 1984; Shaklai et al, 1979). Weit weniger eindeutig ist, welchen Einfluss Endothelzellen und Adipozyten auf die Blutbildung haben. Es konnte aber gezeigt werden, dass beide Zellpopulationen ebenfalls zur Bildung hämatopoetischer Wachstumsfaktoren fähig sind (Lanotte et al, 1982; Quesenberry et al, 1987). Die extrazelluläre Matrix eine Substanz mit hochorganisierter Struktur, welche von verschiedenen Stromaelementen, vor allem Endothelzellen, Makrophagen und Fibroblasten gebildet wird stellt einen weiteren wichtigen Bestandteil des hämatopoetischen Mikromilieus dar. Die Hauptbestandteile sind Kollagen, Proteoglykane, sowie die Glykoproteine, Fibronektin und Laminin (Campbell et al, 1987; Nathan et al, 1987; Owen et al, 1988). Die extrazelluläre Matrix besitzt eine physikalisch stabilisierende Funktion und ist im Besonderen auch an der Interaktion zwischen Stromazellen und hämatopoetischen Zellen beteiligt. Es konnte beobachtet werden, dass Glykosaminoglykane als Bestandteil der Proteoglykane die von den Stromazellen sezernierten Wachstumsfaktoren binden können (Gordon et al, 1987). Des Weiteren konnten spezifische Rezeptoren für das Glykosaminoglykan Hyaluronsäure identifiziert werden, welche eine 22
23 Freisetzung der Zytokine Interleukin 1 (IL-1 ) und Interleukin 6 (IL-6) durch Makrophagen katalysieren (Khaldoyanidi et al, 1999). Zytokine sind von entscheidender Bedeutung für die Regulation von Wachstum und Differenzierung hämatopoetischer Vorläufer- und Stammzellen. Sie werden zu einem großen Teil von den Stromazellen des Knochenmarks gebildet und können sowohl einen stimulierenden, als auch einen hemmenden Einfluss auf die Hämatopoese ausüben (Cashman et al, 1990; Delwiche et al, 1985; Eaves et al, 1991; Mayani et al, 1992b; Sieff, 1987). Makrophagen Endothelzellen Fibroblasten Stimulatorische Zytokine/Wachstumsfaktoren IL-1, IL-6, G-CSF, M-CSF, GM-CSF, PDGF IL-1, IL-6, G-CSF, M-CSF, GM-CSF IL-1 G-CSF, GM-CSF Inhibitorische Zytokine/Wachstumsfaktoren TGF-, TNF-, IFN- IFN- IFN-, IFN- Tabelle 1: Beispiele zytokin-produzierender Stromazellen Die Komplexität der zellulären Interaktionen des hämatopoetischen Mikromilieus wird durch die Wirkungsweise der Zytokine widergespiegelt. Durch transmembranöse Rezeptoren oder zytokinbildende Proteine vermittelt, ist der Wirkeffekt sowohl von der Zytokinkonzentration, als auch von der Art und dem Reifungsgrad der Zielzelle abhängig (Olsson et al, 1992; Dorshkind et al, 1990). Außerdem unterliegen die Stromazellen und damit die Zytokinproduktion und Sekretion selbst der Regulation verschiedener Zytokine, sowohl eigener als auch fremder (Pietrangeli et al, 1988). Daher wird eine basale von einer bedarfsinduzierten Zytokinproduktion unterschieden (Dorshkind et al, 1990; Mayani et al, 1992a). Es wird deutlich, dass die Hämatopoese im Knochenmark das Ergebnis eines Gleichgewichts aus stimulierenden und inhibierenden Faktoren ist, welches wesentlich durch die Zellen des Mikromilieus, insbesondere der Knochenmarkstromazellen in Form von direkten Zell-Zell-Kontakten, Bildung der extrazellulären Matrix, sowie Produktion und Sekretion von löslichen oder 23
24 membrangebundenen Zytokinen reguliert wird (Clark et al, 1987; Dexter, 1982; Gordon et al, 1987; Makgoba et al, 1988; Metcalf, 1989; Toksöz et al, 1980) Entstehungsmechanismen des nicht-hämatopoetischen Chimärismus Mit dem Ziel die verschiedenen Prozesse während einer Knochenmarktransplantation im Detail zu verstehen, wurden in der Vergangenheit unzählige Forschungen betrieben. Dabei wurde der Fokus hauptsächlich auf das Engraftment, die anschliessende Hämatopoese und die Immunrekonstitution gelegt. Daher wurde den möglichen Effekten der HZT auf die nichthämatopoetischen Gewebe zunächst wenig Beachtung geschenkt wurde von der Arbeitsgruppe von Ferrari das Forschungsfeld der Stammzelltransplantation revolutioniert, indem sie vermuteten, dass Fibroblasten in Muskelzellen transdifferenzieren können (Ferrari et al, 1998), was somit zu der Annahme führte, dass im Knochenmark gewebespezifische Stammzellen beherbergt sind. Bislang herrschte die Meinung vor, dass jedes Gewebe im adulten Organismus seine gewebespezifischen, adulten Stammzellen enthält, welche über linienspezifische Vorläuferzellen terminale ausgereifte Zellen des entsprechenden Gewebes hervorbringt und weder ein Wechsel zwischen verschiedenen Zelllinien möglich ist, noch eine Umkehrung der Differenzierungsrichtung (Hüttmann et al, 2003; Wagers, Weissman, 2004). Zahlreiche Untersuchungen wurden anschließend durchgeführt und es wird sich bis heute mit dem Phänomen des nicht-hämatopoetischen Chimärismus auseinandergesetzt. Dabei umfassen mögliche Theorien das Vorkommen von multi- bis pluripotenten Stammzellen im Knochenmark, über welche bereits berichtet worden ist (z.b. MAPC und VSEL, siehe auch Abschnitt 1.4.1), die Fusion von Spender und Empfängerzellen und die Konversion von determinierten Knochenmarkzellen in andere Differenzierungen. Es ist bislang allerdings nicht eindeutig geklärt, welcher genaue Mechanismus für das Auftreten eines nichthämatopoetischen Chimärismus verantwortlich ist. 24
25 1.5.1 Zellkonversion: Plastizität und Transdifferenzierung Im frühen Embryonalstadium beginnt bereits in den Zellen der Prozess, welcher eine Aufteilung in die drei zukünftigen Gewebetypen (Keimblätter) bewirkt. Somit bilden die drei Keimblätter (Ektoderm, Mesoderm und Endoderm) den embryonalen Ursprung aller Körperzellen, denn jede differenzierte Zelle lässt sich von diesen Keimblättern ableiten. Aus dem Ektoderm entwickeln sich die Epidermis und das Nervensystem, das Endoderm bringt den Darm, die Lunge und die Leber hervor. Muskeln, Knorpel, Knochen, Herz, Blut und Niere enstehen aus dem Mesoderm. Es galt lange Zeit als Dogma, dass nach der Entstehung der Keimblätter die Zugehörigkeit sämtlicher (adulter) Stammzellen und deren Abkömmlingen zu einem Keimblatt irreversibel festgelegt ist und sie sich somit nicht in spezialisierte Zellen eines anderen Gewebetypes entwickeln können. Allerdings konnte in jüngerer Zeit gezeigt werden, dass scheinbar zumindest einige adulte Stammzellen sich unter geeigneten Bedingungen auch über Gewebe- und sogar Keimblattgrenzen hinweg zu differenzieren vermögen (Blau et al, 2001). Des Weiteren berücksichtigt das klassische Konzept der linientreuen Zelldifferenzierung nicht, dass u.a. durch lokale und systemische humorale Signale, durch Kontakt mit umgebenden Zellen und durch Faktoren der extrazellulären Matrix eine spezifische Umgebung (Mikromilieu) geschaffen wird, welche auf den Phänotyp der Zellen Einfluss nehmen können. Daher wird mittlerweile vermutet, dass die Zelldifferenzierung nicht einfach hierarchisch gegliedert ist, sondern dass durch Veränderungen im Mikromilieu der Zustand der Zelldifferenzierung veränderbar ist (Blau et al, 2001; Fuchs, Segre, 2000; Quesenberry et al, 2002). In einer Reihe von Studien, in welchen nach allogener HZT Spenderzellen in nichthämatopoetischen Geweben nachgewiesen werden konnten (z.b. Leber, Pankreas, Skelettmuskel, Nervengewebe und Endothel) wurde der Begriff Transdifferenzierung verwendet. Darunter versteht man den Prozess, wenn Zellen gewebespezifische Eigenschaften verlieren und Kennzeichen eines anderen Gewebes ausbilden. Andere Autoren prägten den Begriff Plastizität in Bezug auf die Differenzierungsflexibilität von Zellen. Damit wird die Fähigkeit von 25
26 gewebespezifischen Stammzellen bezeichnet, eine Nachkommenschaft zu erzeugen, welche allerdings die Eigenschaften eines anderen Gewebetypes besitzen (Alvarez-Dolado, 2003). So zeigten Krause et al, dass eine einzelne Knochenmarkzelle (im Verdünnungsversuch definierte Lin - -KM-Zelle) fähig war, nach der Transplantation in letal bestrahlten Mäusen, die Hämatopoese langfristig zu regenerieren und sich im weiteren Verlauf in epitheliale Zellen der Leber, Lunge, Gastrointestinaltrakt und der Haut differenzieren konnte und somit ein nicht-hämatopoetische Chimärismus detektiert wurde (Krause et al, 2001). Um der Fülle an neuen Beschreibungen und der daraus resultierenden Konfusion im Forschungsfeld des nicht-hämatopoetischen Chimärismus Einhalt zu gebieten wurden in der Folgezeit klare Kriterien geschaffen, welche die Phänomene der Differenzierungsflexibilität besser charakterisieren sollten und dies unter dem Begriff Zellkonversion zusammengefasst. Die Existenz dieser Zellkonversion wurde bei niederen Wirbeltieren eindrücklich bewiesen, als gezeigt wurde, dass Amphibien fähig sind Gewebeschädigungen vollständig zu regenerieren. Dabei dedifferenzieren reife Zellen nahe der Wunde in primitive Vorläuferzellen, welche dann durch Proliferation und erneute Differenzierung den Defekt komplett ersetzen (Brockes, Kumar, 2002). Allerdings konnte bis heute nicht zweifelsfrei gezeigt werden, dass dieses Phänomen im Säugerorganismus in vivo gleichfalls stattfindet (Spyridonidis et al, 2008) Zellfusion Ein weiterer Mechanismus, welcher für die Entstehung des nichthämatopoetischen Chimärismus ursächlich sein soll, ist das Phänomen der Zellfusion. Die Fusion von Zellen ist ein physiologisches Ereignis beim Menschen: das menschliche Leben beginnt mit der Fusion von Eizelle und Spermium. Aber auch im adulten Organismus fusionieren Zellen, z.b. bei der Entstehung von Osteoklasten aus mononukleären Phagozyten (Vignery, 2000), oder von Muskelfasern aus Myoblasten (Anderson, 2000). Es wird vermutet, dass nicht-hämatopoetischer Chimärismus nach einer allogenen HZT durch die Fusion von Stammzellen aus dem Knochenmark mit gewebespezifischen, bereits terminal differenzierten Zellen entsteht. Zunächst waren in vitro Versuche richtungsweisend (Ying et al, 2002; Spees et al, 2003). 26
27 Der Zusammenhang zwischen Zellfusion und Differenzierungsflexibilität von Zellen konnte aber auch in vivo hergestellt werden. Vassilopoulos et al konnten bei FAHknockout-Mäusen zeigen, dass die Zellfusion das Prinzip für die Generierung chimärer FAH + -Hepatozyten nach HZT mit FAH + -Spenderzellen darstellte. Im Kontrast dazu stehen zwei Studien ebenfalls an Mäusen, welche zeigten (unter Verwendung eines Cre/lox-Systems), dass nach einer HZT epitheliale Zellen aus Lunge, Leber und Haut (Harris et al, 2004) bzw. Pankreaszellen (Ianus et al, 2003) ohne Fusion aus Knochenmarkzellen entstehen. Daher kann auch die Zellfusion nicht als ausschliessliche Erklärung für die Entstehung chimärer Zellen in nichthämatopoetischen Geweben nach einer Stammzelltransplantation dienen. 1.6 Zielsetzung Die verschiedenen Elemente des Stroma im Knochenmark stellen die strukturelle und funktionelle Unterstützung für die hämatopoetischen Stammzellen dar. Wird dieses Mikromilieu bei der Therapie einer neoplastischen Erkrankung des hämatopoetischen Systems nun einer aggressiven Chemotherapie oder Strahlentherapie ausgesetzt, werden die Stromazellen ebenso angegriffen und eliminiert, wie die erkrankten Stammzellen. Nach der Transplantation muss sich demnach das gesamte System regenerieren. Die Stromazellen können hier eine besondere Rolle in ihrer Funktion als Regulator der Hämatopoese einnehmen (Torok-Storb, Holmberg, 1994). Es kann aber auch zu verlängerten Erholungszeiten der Hämatopoese nach der Transplantation (Migliaccio et al, 1990; Carlo-Stella et al, 1997). Besonders die hochdosierte Strahlentherapie im Vergleich zur Chemotherapie oder die sequentielle Hochdosischemotherapie im Vergleich zur Single-Hochdosischemotherapie sind toxischer für die Stromazellen (Ayash et al, 1994; Bitran et al, 1996). Dies wurde durch die Beobachtung verzögerter hämatopoetischer Erholung nach Transplantation und vorausgehender Strahlentherapie oder Single-Hochdosischemotherapie trotz vergleichbarer infundierter Menge von hämatopoetischen Stammzellen und durch Versuche in vitro gezeigt (Moreau et al, 2002). Mit der vorliegenden Arbeit soll eine Einschätzung über die potentiellen Vorteile der reduzierten Konditionierung im Vergleich zu den myeloablativen Konditionierungen bezüglich der Zerstörung der Kochenmarkstromazellen, die als 27
28 strukturelle und funktionelle Unterstützung für die hämatopoetischen Stammzellen fungieren, in vivo möglich gemacht werden. Knochenmark, in vitro als Langzeitkultur angesetzt, besitzt die Fähigkeit Stromazellen zu generieren. So wurden Knochenmarkproben von insgesamt 55 Patienten nach einer allogenen Stammzelltransplantation in Kultur gesetzt. 32 Patienten, welche mit einem auf Fludarabin basierten, reduzierten Konditionierungsschema behandelt wurden, konnten mit einer Kontrollgruppe von 23 Patienten verglichen werden, die eine Behandlung mit einem Busulphan/Cyclophosphamid-Regime oder eine Ganzkörperbestrahlung als Konditionierung vor der Transplantation erhielten. Die verschiedenen Wachstumsraten der Stromazellen der einzelnen Knochenmarkproben von Patienten mit unterschiedlichen Konditionierungstherapien sollten stellvertretend für die toxischen Effekte der verschiedenen Konditionierungsverfahren in vivo dienen. Zunächst wurden jedoch alle Zellen der Proben morphologisch untersucht, um den vielseitigen Charakter des Knochenmarkstroma darzustellen. Hierfür wurden die Zellen nativ betrachtet und Immunfluoreszenzfärbungen mit verschiedenen stromalen Markern (z.b. Vimentin für mesenchymale Zellen, von-willebrand- Faktor für endotheliale Zellen) durchgeführt. Außerdem wurden verschiedene Faktoren, wie z.b. Patientenalter, Diagnose Remissionsstatus u.a., von welchen eine Einflussnahme auf das Stromawachstum nicht ausgeschlossen werden konnte, hinsichtlich des Knochenmarkstromawachstums untersucht. Um eine Aussage über die Herkunft der Knochenmarkstromazellen machen zu können, wurde eine Chimärismusanalyse bei den Proben von sechs Patientinnen nach der allogenen Stammzelltransplantation durchgeführt. Alle Patientinnen wurden mit einem reduzierten Regime konditioniert. Die Spender waren allesamt männlich (sex-mismatched Stammzelltransplantation), sodass die Chimärismusanalyse mittels Y-Chromosom Fluoreszenz in-situ Hybridisierung und Immunfluoreszenzfärbungen den Ursprung der Stromazellen zeigen konnte. 28
29 2 Material 2.1. Geräte Cryotubes Deckgläser Elektrische Pipette Pipetboy Falcon -Tubes Färbeküvetten HYBrite Inverses Mikroskop CK 2 Kochplatte mit Magnetrührer Laborflaschen Megafuge 1,0 R Neubauer-Zählkammer ph-meter ph 535 MultiCal Pattex Pistole Supermatic 200 plus Pattex hot Sticks Phasenkontrastmikroskop LSM 510 Pipetus Akku Pipettenspitzen Präzisionswaage Scaltec SBC52 Reaktionsgefäße SafeLock-Tubes Sicherheitswerkbank Vortex REAX top Wasserbad Zellinkubator Zellkulturflaschen Zweikammer-Objektträger Corning, Schipohl- Rijk, NL neolab, Heidelberg, D Integra Biosciences, Fernwald, D Falcon, Heidelberg, D neolab, Heidelberg, D Vysis, Bergisch-Gladbach, D Olympus, Hamburg, D Janke&Kunkel, Staufen, D neolab, Heidelberg, D Heraeus Sepatech, Stuttgart, D Brand, Wertheim/Main, D WTW, Weilheim, D Henkel, Düsseldorf, D Henkel, Düsseldorf, D Carl Zeiss AG, Jena, D Hirschmann, Eberstadt, D Greiner, Frickenhausen, D Scaltec, Heiligenstadt, D Eppendorf, Hamburg, D Eppendorf, Hamburg, D Heraeus Sepatech, Stuttgart, D Heidolph, Schwabach, D Julabo, Seelbach, D Heraeus Sepatech, Stuttgart, D Becton Dickinson, Heidelberg, D Becton Dickinson, Heidelberg, D 29
30 2.2 Chemikalien und Reagenzien Aceton SIGMA, Deisenhofen, D Antikörperverdünnungsmedium DAKO, Glostrup, DK Bovines Serum Albumin (BSA) SIGMA, Deisenhofen, D Di-Natriumhydrogenphosphat- Dihydrat Merck, Darmstadt, D Ethanol Baker, Deventer, NL Fetal Calf Serum (FCS) Seromed, Berlin, D Goat-Serum DAKO, Glostrup, DK Human Albumin 20% Immuno Baxter, Unterschleißheim, D Hydrocortison SIGMA, Deisenhofen, D Kaliumdihydrogenphosphat Merck, Darmstadt, D Liquemin N 5000 Hoffmann LaRoche, Basel, CH Methanol Merck, Darmstadt, D Natriumcitrat-Dihydrat Merck, Darmstadt, D Natriumchlorid Merck, Darmstadt, D NP-40 (Nonoxynol 40) Calbiochem/Merck, Darmstadt, D, ProLong Antifade Mounting Medium Molecular Probes, Leiden, NL RNAse A Hoffmann LaRoche, Basel, CH Trypsin-EDTA SIGMA, Deisenhofen, D Tween 20 SIGMA, Deisenhofen, D 2.3 Antikörper monoclonal mouse anti-human CD45, Leucocyte Common Antigen (Clones 2B11, PD7/26) monoclonal mouse anti-human-cd14, (Clone Tük 4) mouse-anti-human-vimentin mouse-anti-human-von-willebrand Factor Alexa 647 F(ab`) 2 fragment of goat anti-mouse IgG (H+L) Dako, Glostrup, DK Dako, Glostrup, DK Biotechnology, Heidelberg, D Serotec, Düsseldorf, D Molecular Probes, Leiden, NL 30
31 Draq5 mouse IgG 1 -FITC mouse-anti-human-cd45-fitc mouse IgG 1+2 -negative Control Biostatus, Shepshed, UK Immunotech, Marseille, F Invitrogen GmbH, Karlsruhe, D Serotec, Düsseldorf, D 2.4 Y-Chromosom-Gensonde CEP Y (Satellite III) Spectrum orange Hybridisierungspuffer Vysis, Bergisch-Gladbach, D Vysis, Bergisch-Gladbach, D 2.5 Lösungen und Medien MyeloCult H5100 StemCell Technologies, Vancouver, CA Phosphat buffered Saline (PBS) GIBCO, NY, USA Saline sodium citrate (SSC): 175,3g NaCl + 88,2g Na-Citrat-Dihydrat + 800ml Aqua bidest; ph auf 7,0 einstellen Volumen mit Aqua bidest auf 1000 ml autoklavieren 2x SSC-Waschlösungen: 100ml 20xSSC+ 2x SSC/0,1% NP40 1ml NP40 bzw. 2x SSC/0,3% NP40 3ml NP40 bzw. 2x SSC/0,1% Tween20 1ml Tween ml Aqua bidest; ph auf 7,0 einstellen Volumen mit Aqua bidest auf 1000ml Phosphate Buffered Saline (PBS) Stammlösung (20x): 29,25g Na 2 HPO 4 x 2 H 2 O + 4,9g KH 2 PO g NaCl Volumen mit Aqua bidest auf 1000ml, 30 min rühren (ph 6,8-7,0) 31
32 3 Methoden A: Generierung von Knochenmarkstromazellen in vitro 3.1 Patientenauswahl Diese Studie schließt insgesamt 82 Patienten ein, welche zwischen 2000 und 2003 eine allogene hämatopoetische Stammzelltransplantation als Therapie einer hämatologischen Neoplasie an der Universitätsklinik Freiburg erhalten hatten. Die Auswahl der Patienten erfolgte nach dem Zufallsprinzip. Für diagnostische Zwecke wurde den Patienten aus dem Beckenkamm regelmäßig heparinisiertes Knochenmark entnommen. Nach Einwilligung der Patienten konnte Zellmaterial, welches für die Routineuntersuchungen nach der HZT nicht mehr benötigt wurde für wissenschaftliche Zwecke verwendet werden. Die Proben wurden vor der Konditionierung, am Tag +30 und Tag +100 nach der Transplantation gewonnen und direkt in Langzeitkulturen angesetzt. Es wurden insgesamt 125 Kulturen von den 82 Patienten angesetzt. Davon waren 36 Kulturen von 10 Patienten im Verlauf kontaminiert, wurden verworfen und gingen damit nicht in die Analyse ein. In die Auswertung sind somit 89 Proben eingegangen. Dabei wurden bei 17 Patienten Proben nur vor der allogenen Stammzelltransplantation entnommen (17 Proben) und für die Analyse nach der Transplantation standen von insgesamt 55 Patienten 72 Proben zur Verfügung. Anhand des Konditionierungsregimes vor der Transplantation wurden die 55 Patienten in drei Gruppen eingeteilt: 1. Patienten mit reduzierter Konditionierung (FBM-Gruppe, n=32) 2. Patienten mit myeloablativer Standardchemotherapie (BuCy-Gruppe, n=14) 3. Patienten mit myeloablativer Standardchemotherapie und fraktionierter Bestrahlung (TBI-Gruppe, n=9) Die klinischen Charakteristika sind in der folgenden Tabelle zusammengefasst. 32
33 Konditionierung FBM Standardmyeloablativ total Patientenanzahl Alter 1 54 (22-67) 40 (20-51) 45 (20-67) Geschlecht (m/w) 17/15 16/7 33/22 Transplantat KM PBSC Diagnose AML ALL MDS CML/MPS MM, NHL/CLL SAA Remissionsstatus CR1/ CP SAA/MDS unbehandelt andere Spender familiär HLA-ident familiär HLA-nicht ident fremd HLA-ident fremd HLA-nicht ident ATG ja nein Immunsuppression CsA/MTX CsA/MMF andere
34 Konditionierung FBM Standardmyeloablativ total Akute GvHD Grad 0-I Grad II-IV CMV, IgG seropositiv Patient + und/oder Spender beide negativ CMV-Reakivierung ja nein Tabelle 2: Klinische Charakteristika der Patienten, 1 Median (Range); CR1/2, erste oder zweite komplette Remission; CP1 erste chronische Phase Die klinische Entscheidung, die Patienten mit einer reduzierten Konditionierung, anstelle einer Standardkonditionierungstherapie für die Transplantation zu induzieren (Gruppe 1), hing sowohl vom Alter (>55 Jahre), der Diagnose (Schwere aplastische Anämie (SAA), Lymphome, Myelodysplastisches Syndrom (MDS)), als auch von den Komorbiditäten ab. Die Patienten aus der FBM-Gruppe, im Folgenden auch mit FBM abgekürzt, erhielten ein Schema bestehend aus Fludarabin (150mg/m 2 ), BCNU (Bis- Chlorethyl-Nitrosurea, auch Carmustin, mg/kg) und Melphalan ( mg/kg). Eine Ausnahme bildeten Patienten mit schwerer aplastischer Anämie (SAA), welche mit Fludarabin (150 mg/m 2 ) und Cyclophosphamid (150 mg/kg) behandelt wurden, aber trotzdem zu dieser Gruppe gerechnet wurden, da dieses Schema ebenfalls reduziert ist. Die Patienten aus der myeloablativ behandelten BuCy-Gruppe, im Folgenden mit BuCy abgekürzt, erhielten die Standardchemotherapie Busulphan (16 mg/kg) und Cyclophosphamid (120 mg/kg) als Konditionierung. Das Konditionierungsregime für die Patienten aus der zweiten myeloablativ behandelten Gruppe, im weiteren Text mit TBI (total body irradiation) benannt, bestand aus einer fraktionierten Ganzkörperbestrahlung (12 Gy), kombiniert mit einer medikamentösen Therapie mit Cyclophosphamid (120mg/kg) und Etoposid (50 mg/kg). 34
35 Zur Prophylaxe gegen die GvHD wurde allen Patienten Cyclosporin A (CsA) verabreicht. Die Patienten aus der FBM-Gruppe bekamen als zusätzliches Immunsuppressivum Mycophenolat Mofetil (MMF), die Patienten aus der Gruppe der myeloablativen Konditionierungen wurden mit Methotrexat (MTX) als Zusatz am ersten (15 mg/m 2 ), dritten und sechsten (jeweils 10 mg/m 2 ) Tag nach der Transplantation versorgt. Darüber hinaus erhielten alle Patienten, bei welchen der Spender nicht familiärer Herkunft war, oder bei welchen das Transplantat in den HLA-Merkmalen nicht übereinstimmte, der Spender somit haplo-ident war, noch zusätzlich direkt vor der Transplantation Antithymozyten-Globulin (ATG-S, 20/mg/kg/d) für 1-3 Tage, um das Risiko einer Transplantatabstoßung zu minimieren. 35
36 3.2 Generierung von Knochenmarkstromazellen Wie oben beschrieben wurde den Patienten im Peritransplantationsverlauf regelmäßig Knochenmark entnommen um den Verlauf und das Engraftment (das Anwachsen des Transplantates) beurteilen zu können. Mit dem Einverständnis der Patienten konnte Knochenmarkaspirat, welches nicht mehr für die Routinediagnostik im Rahmen der hämatopoetischen Stammzelltransplantation benötigt wurde, für wissenschaftliche Zwecke verwendet werden. Von insgesamt 72 Patienten konnten 89 Kulturen erfolgreich angesetzt werden. 17 Kulturen (von 17 Patienten) wurden vor Beginn der Konditionierung entnommen, um eventuelle Unterschiede im Wachstumsverhalten der Stromakulturen vor und nach der Transplantation und der Konditionierung zu ermitten. Damit sollte eine Aussage möglich gemacht werden, ob die Behandlung mit den entsprechenden Konditionierungsregimes eine Vorhersage über die Fähigkeit der Generierung von Stromazellen in vitro wagen kann. Die verbleibenden 72 Kulturen von den 55 Patienten nach der hämatopoetischen Stammzelltransplantation wurden entweder am Tag +30 (n=47) oder Tag +100 (n=25) nach der Transplantation entnommen. In allen drei Konditionierungsgruppen konnten Proben untersucht werden, die sowohl vor der HZT, als auch an Tag +30 und an Tag +100 gewonnen wurden, wie es in Tabelle 3 dargestellt ist. Proben vor Transplantation (n=17) Proben Tag +30 nach Transplantation (n=47) Proben Tag +100 nach Transplantation (n=25) FBM Standardmyeloablativ BuCy TBI Tabelle 3: Übersicht der gewonnen Proben insgesamt 36
37 Bei acht Patienten konnten mehrfach Knochenmarkproben (insgesamt 17 Proben) in Langzeitkulturen angesetzt werden (FBM-Gruppe: Patienten 1-5, 11 Kulturen; BuCy-Gruppe: Patienten 6-8, 6 Kulturen). Die doppelten Proben der einzelnen Patienten wurden hauptsächlich an verschiedenen Entnahmezeitpunkten gewonnen (1 Kultur Tag +30 und 1 Kultur Tag +100). Bei einem Patienten war an einem Entnahmezeitpunkt ausreichend Zellmaterial für mehrere Kulturansätze vorhanden (FBM1: zwei Kulturen an Tag +30 und eine an Tag +100). Zeitpunkt der KM-Entnahme Tag +30 (n) Tag +100 (n) Wachstum + Wachstum - Wachstum + Wachstum - FBM FBM FBM FBM FBM BuCy BuCy BuCy Tabelle 4: Übersicht der acht Patienten mit mehrfach angesetzten Kulturen Die Proben dieser acht Patienten wiesen eine unterschiedliche Dynamik im Wachstumsverhalten auf, wurden aber bezüglich ihrer Fähigkeit Stromazellen zu generieren, als positiv gewertet. Für die spätere Analyse der Faktoren, von welchen eine Einflussnahme auf die Fähigkeit zur Generierung von Knochenmarkstromazellen nicht ausgeschlossen werden konnte (z.b. Alter, Diagnose, Remissionsstatus), wurden diese acht Patienten aufgrund der unterschiedlichen Wachstumsdynamik ausgeklammert und die univariate Analyse mit den verbleibenden 47 Patienten (FBM-Gruppe: 27; Standard-myeloablative- Gruppe: 20) durchgeführt (siehe Abschnitt 4.2). 37
38 3.2.1 Ansatz der Knochenmarkstomakulturen Alle Proben wurden innerhalb der ersten 24h nach der Entnahme unter aseptischen Bedingungen zur Kultivierung vorbereitet. Das entnommene Knochenmark wurde in 1-2ml Portionen (ca. 1,5-2x10 6 Zellen/ml) mit 5ml eines Nährmediums (Myelocult + Hydrocortison 500ml:25 l) versehen und in Zellkulturflaschen bei 37 C/ 6% CO 2 inkubiert. Zweimal pro Woche wurden die Kulturen hinsichtlich ihres Stromawachstums mikroskopisch ausgewertet und gleichzeitig die Morphologie der Zellen beobachtet (siehe auch Abschnitt 3.3 und Abschnitt 4.6.1). Als positives Wachstum wurde ein Stromazellrasen von mehr als 75% der Fläche der Kulturflasche definiert und der Zeitraum der Wachstumsphase, welche die Zellen zur Generierung einer konfluenten Fläche benötigten, wurde anschließend protokolliert. Die Knochenmarkproben wurden entweder so lange kultiviert, bis ein vollständiger Zellrasen in den Kulturflaschen gewachsen war, oder bis zu einem Maximum von acht Wochen. Jene Proben, welche nach acht Wochen kein Stromawachstum zeigten, bzw. welche weniger als 25% der Kulturflaschenfläche Zellrasen aufwiesen, wurden negativ gewertet Mediumwechsel Einmal pro Woche musste das Nährmedium gewechselt werden. Beim ersten Mediumwechsel wurde das Medium vollständig erneuert, bei jedem weiteren Wechsel nur noch die Hälfte des Volumens aufgefrischt. Stromazellen wachsen im Gegensatz zu hämatopoetischen (Stamm)Zellen adhärent und so ist eine Trennung von den mobilen hämatopoetischen Zellen möglich, damit die Stromazellen optimalen Wachstumsbedingungen ausgesetzt sind und eine möglichst reine Kultur entstehen kann. Zunächst wurde das Zell-Mediumgemisch in ein Falconröhrchen überführt und bei 2000 rpm für 5 min zentrifugiert. Beim ersten Wechsel wurde der Überstand fast vollständig entnommen und die Zellen mit 6ml frischem Nährmedium versetzt. Im weiteren Verlauf wurde lediglich ein Überstand von 3ml entnommen und durch 3ml frisches Nährmedium ersetzt. Die Inkubation konnte dann fortgesetzt werden. 38
39 3.2.3 Zellsplitting Als eine deutliche Zellvermehrung beobachtet werden konnte, wurden die Zellen auf zwei neue Kulturflaschen gesplittet. So konnte noch mehr Zellmaterial gewonnen werden. Dafür wurden die Stromazellen dreimal mit PBS gewaschen. Zum Lösen der Zellen aus der Kulturflasche wurde 3ml Trypsin-EDTA auf die Zellen gegeben, die Kulturflasche leicht angeklopft, und dann ca. 8 min bei 37 /6% CO 2 inkubiert. Die Reaktion wurde mit 10ml PBS/FCS 10% gestoppt. Nach erneutem Zentrifugieren und zweimaligem Waschen konnten die Zellen in neues Medium aufgenommen und auf zwei Flaschen zur weiteren Kultivierung verteilt werden Zellernte und Fixierung Etwa 7-10 Tage später hatten sich die Zellen soweit vermehrt, dass sie nun für die weiteren Untersuchungen geerntet werden konnten. Hierfür wurden die Zellen dreimal mit PBS gewaschen und wieder mit 3ml Trypsin- EDTA vom Flaschenboden gelöst. Nach Abstoppen der Reaktion mit 10ml PBS/FCS 10% und erneut zweimaligem Waschen mit PBS, wurden die Zellen in 500 l PBS resuspendiert. Die Zellzahl konnte nun in der Neubauerzählkammer bestimmt werden. Hiernach pipettierte man 1-2x10 4 Zellen auf die Objektträgerfläche (4cm 2 /Kammer) eines Zweikammerobjektträgers. Es konnten auf zwei Areale pro Objektträger je à 4cm 2 Zellen aufgebracht werden. Der Objektträger hat einen speziellen Kammeraufsatz und einen für Zellkulturen beschichteten Boden, so dass die Zellen nach kurzer Inkubation im Nährmedium an den Boden adhärieren können. Zu den Zellen gab man 800 l Nährmedium dazu und inkubierte die Objektträger dann bei 37 C/6% CO 2 für weitere drei Tage. Als nun die Zellen adhärent waren, konnten sie auf dem Objektträger fixiert werden. Dazu wurde das Nährmedium abpipettiert, verworfen, und die Zellen dreimal mit PBS gewaschen. Nachdem die Objektträger völlig getrocknet waren, wurde der Kammeraufsatz entfernt. Die Zellen wurden in einer Küvette mit Methanol/Aceton 1:1 bei -20 C für 10 min fixiert und standen somit für die verschiedenen Färbemethoden zur Verfügung. 39
40 B: Stromazellpopulation und Chimärismusanalyse 3.3 Immunfluoreszenzfärbungen und FISH-Analyse Zur Analyse der einzelnen Zellpopulationen der Knochenmarkstromazellproben und zur Differenzierung ihrer Herkunft von Spender oder Empfänger (Chimärismusanalyse), wurden die Zellen von insgesamt 26 Patienten verschiedenen Färbemethoden unterzogen. So konnten die einzelnen Zellstrukturen sichtbar gemacht werden. Wie bereits erwähnt (siehe Abschnitt 3.2.1) erfolgte die erste morphologische Begutachtung bereits während der Zeit der Kultivierung. Zweimal wöchentlich wurden die Kulturen unter dem Phasen-Konrast-Mikroskop beobachtet, um das Wachstumsverhalten der Zellen zu erfassen. Um zusätzlich zu der mikroskopischen Begutachtung einen genaueren Überblick über die Morphologie der Zellen zu erhalten, wurden zwei Objektträger von je zwei verschiedenen Patienten (1 FBM, 1 BuCy nach HZT) mit Hämatoxylin/Eosin gefärbt. Eine Übersicht über die Patienten ist in den folgenden Tabellen dargestellt. Alter zum Geschlecht Patient Zeitpunkt Patient/ Tag der Diagnose Konditionierung (Nr.) der HZT Geschlecht Probenentnahme (Jahre) Spender 1 41 MDS (FBM) w/ vor HZT 2 55 NHL (FBM) w/ vor HZT 3 50 AML (BuCy) m/ vor HZT 4 51 ALL (TBI) m/ vor HZT 5 35 ALL (TBI) w/ vor HZT Tabelle 5: Patienten mit gefärbten Proben, vor der HZT entnommen Die Proben der Patienten Nr. 1-5 wurden vor der hämatopoetischen Stammzelltransplantation gewonnen, um eine eventuelle Veränderung der Stromazellpopulationen nach der Konditionierungstherapie und anschließender Stammzelltransplantation zu erfassen. 40
41 Alter zum Geschlecht Patient Zeitpunkt Patient/ Tag der Diagnose Konditionierung (Nr.) der HZT Geschlecht Probenentnahme (Jahre) Spender nicht-geschlechtsidente HZT 6 62 AML FBM w/m Tag MDS FBM w/m Tag NHL FBM w/m Tag MPS FBM w/m Tag AML FBM w/m Tag NHL FBM w/m Tag SAA FBM m/w Tag MDS FBM m/w Tag MM FBM m/w Tag NHL FBM m/w Tag AML FBM m/w Tag CML BuCy m/w Tag AML BuCy m/w Tag ALL TBI m/w Tag +100 geschlechtsidente HZT SAA FBM w/w Tag AML FBM w/w Tag AML BuCy w/w Tag ALL TBI w/w Tag MDS CML FBM m/m Tag AML FBM m/m Tag AML BuCy m/m Tag +100 Tabelle 6: Patienten mit gefärbten Proben, nach der HZT entnommen Um einen eventuellen Chimärismus der Stromazellen nachzuweisen, wurde bei den sechs Patientinnen, nach einer sex-mismatched Stammzelltranplantation (männlicher Spender, weiblicher Empfänger, Patient Nr. 6-11) die Kombination einer Y-Chromosom-FISH mit Immunfluoreszenzfärbungen für spezifische Marker der Stromazellen (z.b. Vimentin als Marker für mesenchymale Zellen, von- Willebrand-Faktor als Marker für endotheliale Zellen) verwendet. 41
42 Damit sichergestellt werden konnte, dass keine kontaminierenden hämatopoetischen Zellen (CD45 + ) oder Makrophagen (CD14 + ) Einfluß auf das Ergebnis nehmen, wurden die konservierten Zellen mit spezifischen Antikörpern (CD45 für hämatopoetische Zellen und CD14 für Makrophagen) gegengefärbt. Um die Zellpopulationen in den gewonnenen Knochenmarkproben der einzelnen Patienten nach der hämatopoetischen Stammzelltransplantation (Patient Nr ) analysieren zu können, wurden verschiedene Immunfluoreszenzfärbungen (Fluoreszenzfärbung für Vimentin mit CD14, oder CD45 u.a., siehe unten) kombiniert. Folgende Antikörper wurden zusätzlich zu der Gen-Sonde für das Y-Chromosom zur Darstellung der entsprechenden Zellstrukturen verwendet: Antikörper/Sonde CEP Y (Satellite III) Spectrum orange (Vysis) Draq5 (Biostatus) mouse-anti-human-vimentin (Biotechnology) mouse-anti-human-von-willebrand- Factor (Serotec) mouse-anti-human-cd45 (DAKO) mouse-anti-human-cd14 (DAKO) Alexa 647 F(ab`) 2 fragment of goat anti-mouse IgG (H+L) (Molecular Probes) Ziel-Antigen, Spezifische DNA-Sequenz des Y-Chromosoms unspezifisch DNA Vimentin, mesenchymale Zellen von-willebrand-faktor, endotheliale Zellen CD45 + hämatopoetische Zellen (Primärantikörper) CD14 + Makrophagen (Primärantikörper) Fc-Teil des Primärantikörper (Sekundärantikörper) Tabelle 7: Übersicht über verwendete Antikörper 42
43 3.3.1 Fluoreszenz In-situ Hybridisierung (FISH): Um den Ursprung der Stromazellen nach der Transplantation zu bestimmen, d.h., ob die Stromazellen mit dem Transplantat übertragen worden sind oder der Organismus des Patienten selbst neue eigene Stromazellen bildet, wurde bei sechs Patientinnen (Patienten Nr in Tabelle 6), welche eine sex-mismatched Stammzelltransplantation (männlicher Spender) erhalten hatten, eine FISH- Analyse durchgeführt. Die Methode der In-situ Hybridisierung wurde 1969 erstmalig beschrieben (Gall, Pardue, 1969). Mittels der Technik der In-situ Hybridisierung wurde es möglich Nukleinsäuresequenzen (DNA oder RNA) sichtbar zu machen. Die FISH basiert auf dem Prinzip, dass sich z.b direkt mit einem Fluorochrom (z.b. Rhodamin) markierte Einzelstrang-DNA-Fragmente (oder RNA-Fragmente), die auch als Sonden bezeichnet werden, an komplementäre DNA-Sequenzen (oder RNA) spezifisch zu einem stabilen Doppelstrang zusammenlagern. Dieser Vorgang wird als Hybridisierung bezeichnet (Nath, Johnson, 1999). Im Rahmen dieser Arbeit wurde eine Test-Sonde verwendet, welche direkt mit einem Rhodamin-Derivat als Fluoreszenz-Farbstoff markiert ist und spezifisch an DNA-Sequenzen des DYZ1 Lokus in der q12 Region des Y-Chromosoms bindet. Wie bereits beschrieben, müssen die markierten Nukleinsäurefragmente als Einzelstränge vorliegen, damit die komplementären Basensequenzen zu einem Hybridmolekül zusammenlagern können. Daher werden die Ziel-DNA und die markierte DNA-Sonde durch Hitze denaturiert (gespalten) und die anschließende Hybridisierung wird durch eine Inkubation bei 37 C ermöglicht. 43
44 Abbildung 3: Prinzip der FISH Der DNA-Sonde sind unmarkierte DNA-Fragmente beigemischt, welche unspezifische Bindungen der Sonde im Zellkernplasma und Zytoplasma verhindern sollen. Unterschiedliche Bedingungen im Färbeverfahren können den Anteil der korrekt gebundenen Sonden beeinflussen. Es ist wichtig, dass die Temperatur während Denaturierung und Hybridisierung möglichst konstant ist und entsprechend definierte Konzentrationen der Salze und der DNA-stabilisierenden Moleküle, welche den Hybridisierungs- und Waschlösungen zugegeben sind, benutzt werden (Leitch, Jackson, 1994). Sind Gen-Sonde und Ziel-DNA hybridisiert, können die Fluoreszenzsignale daraufhin mit einem entsprechenden Mikroskop nachgewiesen werden Kombination von Y-Chromosom FISH, Kernfärbung und Vimentin/von- Willebrand-Faktor Immunfluoreszenzfärbung Um eine Aussage drüber treffen zu können, ob ein Y-Chromosom als Marker für eine Spenderzelle innerhalb des Zellkernes der Stromazellen lokalisiert ist, wurde die FISH mit einer Vimentin- oder von-willebrand-faktor- Immunfluoreszenzfärbung (Marker für Stromazellen) kombiniert (Spyridonidis et al, 2004a). Damit eine genaue Zuordnung der Hybridisierungssignale der Gen-Sonde 44
45 zu den einzelnen Zellen möglich ist, wurden auch die Zellkerne mit einem DNAbindendem Fluorochrom (Draq5) dargestellt. Da der zur Kernfärbung verwendete Farbstoff Draq5 nicht nur an DNA, sondern auch an zytoplasmatische oder nukleoläre RNA binden kann, mussten die Zellen jeweils vor und nach der FISH einer Behandlung mit einer RNAse unterzogen werden. Durch die damit einhergehende Zerstörung der RNA kann deren Anfärbung mit Draq5 vermieden werden (Suzuki et al, 1997). Die Objektträger mit den fixierten Stromazellen wurden dazu mit 100 l RNAse A (Konzentration 2mg/ml in PBS 1% BSA) versehen und 45 min bei 37 C/6%CO 2 in der Feuchtkammer inkubiert. Danach wusch man die Objektträger zweimal für 5 min in einer Küvette mit 2xSSC bei Raumtemperatur. Als Vorbereitung für die FISH mussten die Zellen dann 30 min in 2xSSC 0,1%NP40 bei 37 C gewaschen werden, um die Zellmembranen zu lysieren. Danach dehydrierte man die Zellen in einer Ethanolreihe 70%, 85%, 100% jeweils für 1,5 min und ließ die Objektträger lufttrocknen. Sodann wurde für die FISH- Analyse die Sonde vorbereitet. Dazu wurden 10 l Sondengemisch pro Objektträgerfeld benötigt, welches sich aus 1 l mit einem Rhodamin-Derivat direkt-markierter Gen-Sonde, 2 l bidestilliertem Wasser und 7 l Hybridisierungspuffer (enthält Dextransulfat, Formamid und SSC) zusammensetzte. Das Sondengemisch wurde auf den Objektträger gegeben, mit einem Deckgläschen versehen und mit Silikon versiegelt, um ein Verdunsten des Sonden- Puffer- Gemisches während der Prozesse der Denaturierung und anschließender Hybridisierung zu vermeiden. Die Denaturierung von Gen-Sonde und der DNA der Stromazellen wurde mit Hilfe eines Hybridisierungsgerätes erreicht. Die Objektträger wurden im HYBrite auf der auf 73 C erhitzten Metallplatte des Gerätes für 3 min belassen. Zur Hybridisierung zwischen der Y- Chromosom-Sonde und der zellulären DNA wurden die Zellen über Nacht in einer Feuchtkammer im Zellinkubator bei 37 C/6% CO 2 inkubiert. Am nächsten Tag wurde das Silikon vorsichtig gelöst und die Objektträger kurz in einer Küvette mit 2xSSC 0,3%NP40 gewaschen, um die Deckgläschen zu lösen. Es folgte ein letzter Waschschritt für die FISH: dreimaliges Waschen der Zellen in einer Küvette mit 2xSSC 0,3%NP40 für jeweils 2 min bei 73 C. Im Anschluss an die FISH für das Y-Chromosom wurde die Immunfluoreszenz- Färbung zur Darstellung der stromalen Marker Vimentin und von-willebrand- 45
46 Faktor (mouse-anti-human-vimentin, mouse-anti-human-von-willebrand-factor) durchgeführt. Um unspezifische Antikörperbindungen zu vermeiden, wurden zunächst mögliche Bindungsstellen mit PBS 1% BSA geblockt. Die Flüssigkeit wurde nach 30 min Inkubation vom Objektträger abgeklopft und danach kurz in 2xSSC gewaschen. Pro Zellareal wurden nun 10 l des mit Fluoresceinisothiocyanat (FITC) direkt-markierten Antikörpers aufpipettiert, mit Deckgläschen versiegelt und für 2 Stunden in der Feuchtkammer im Zellinkubator bei 37 C/6% CO 2 bebrütet. Um die Deckgläschen nach der Inkubation wieder zu lösen, wurden die Objektträger kurz in 2xSSC geschwenkt, und danach dreimal für jeweils 5 min in 2xSSC 0,1% Tween 20 bei Raumtemperatur gewaschen. Nach der Immunfluoreszenzfärbung schloss sich die Darstellung der nukleären DNA mit dem Farbstoff Draq5 an. Dazu wurde zunächst die oben bereits beschriebene Behandlung der Zellen mit RNAse A und der anschließende Waschvorgang wiederholt. Danach wurden die Objektträger mit 100 l des Kernfarbstoffes Draq5 (5mM 1:1000 in PBS) für 10 min bei Raumtemperatur inkubiert. Um das Ausbleichen der Fluorochrome zu verhindern, wurden die Objektträger mit den fixierten Stromazellen nach zweimaligem Waschvorgang in 2xSSC 0,1% Tween 20 bei Raumtemperatur mit je 10 l ProLong Antifade Mounting Medium versehen und mit Deckgläschen versiegelt. Nach dem Aushärten des Mounting Medium konnten die Objektträger bis zur mikroskopischen Auswertung gelagert werden Kombination von Y-Chromosom FISH und Immunfluoreszenzfärbungen für Vimentin/von-Willebrand-Faktor und CD14/CD45 Zum Nachweis eines eventuellen Chimärismus der Knochenmarkstromazellen musste ausgeschlossen werden, dass die Expression der gewebespezifischen Marker der gefärbten Zellen lediglich durch kontaminierende hämatopoetische Spenderzellen vorgetäuscht wurde. Des Weiteren konnten positive Signale der Y- Chromosom-Gensonde in hämatopoetischen Spenderzellen die Analyse des nicht-hämatopoetischen Chimärismus der Stromazellen verfälschen. Deshalb war eine weitere Untersuchung auf hämatopoetische Marker unerlässlich. Dazu wurde die Expression des CD45-Oberflächenantigens gemessen. Dieses Protein wird ausschließlich von hämatopoetischen Zellen (ausgenommen Erythrozyten, 46
47 Thrombozyten) exprimiert (Trowbridge, Thomas, 1994). Eine weitere Fehlerquelle konnte die Detektion von Makrophagen darstellen. Makrophagen können andere Zellen phagozytieren und damit vorübergehend spezifische Marker dieser Zellen bilden (Meletis, Friesen, 2002). Daher musste auch ein Nachweis mit Antikörpern gegen den von Makrophagen exprimierten Marker CD14 erfolgen. So wurde eine Dreifachfärbung für das Y-Chromosom und die Zellantigene Vimentin/von-Willebrand-Faktor und CD45/CD14 durchgeführt, um eine Kontamination mit hämatopoetischen CD45 + /CD14 + -Zellen auszuschließen. Die verwendeten Antikörper gegen CD45 und CD14 sind nicht direkt mit einem Fluorochrom markiert. Daher wurde hier die Methode der indirekten Fluoreszenzfärbung in das bereits beschriebene Protokoll (Abschnitt 3.3.2) integriert. Das Prinzip beruht darauf, dass zunächst der Primärantikörper zu den Zellen gegeben wird, dort sein entsprechendes Antigen erkennt und sich daran bindet. Der Sekundärantikörper ist direkt mit einem Fluorochrom gebunden und erkennt den Fc-Teil des Primärantikörpers, an welchen er sich bindet und so durch die Fluoreszenz-Markierung die entsprechenden Strukturen sichtbar machen kann. Abbildung 4: Prinzip der Immunfluoreszenzfärbung mit Primär- und Sekundärantikörper 47
48 Zunächst erfolgte die Y-Chromosom FISH, wie oben bereits beschrieben. Nachdem die Gen-Sonde hybridisiert war und die Objektträger dem letzten Waschschritt unterzogen waren, wurden mögliche Bindungstellen mit Ziegen- Serum (Verdünnung 1:10 in PBS 1% BSA) geblockt, um unspezifische Antikörperbindungen zu vermeiden. Nach 20 min wurde die Flüssigkeit vom Objektträger abgeklopft und dieser danach kurz in einer Küvette mit 2xSSC gewaschen. Für die Methode der indirekten CD14, oder CD45 Immunfluoreszenzfärbung wurden die Zellen für 60 min bei Raumtemperatur mit 100 l Primärantikörper (monoclonal mouse-anti-human-cd45/cd14) jeweils in einer Konzentration von 16 l/ml (1:20) inkubiert. Anschließend folgte ein dreimaliger Waschvorgang für je 5 min in 2xSSC 0,1 % Tween 20 ebenfalls bei Raumtemperatur. Nun konnten 100 l des mit dem Fluorochrom Alexa 647 markierten goat-anti-mouse-sekundärantikörper (Alexa 647 F(ab`) 2 fragment of goat-anti-mouse IgG) in einer Konzentration von 20 l (1:100) auf die Objektträger gegeben und dort für weitere 60 min bei Raumtemperatur belassen werden. Zur Verdünnung der Antikörper wurde ein Antikörperverdünnungsmedium verwendet, welches mit Ziegen-Serum in einer Konzentration von 1,5% versetzt war. Nach der Inkubation mit dem Sekundärantikörper schloss sich unmittelbar die direkte Immunfluoreszenzfärbung mit den Antikörpern gegen Vimentin oder von- Willebrand-Faktor (s.o.) an. Die Antikörperinkubation erfolgte diesmal bei Raumtemperatur und der anschließende dreimalige Waschvorgang wurde erneut für je 5 min in 2xSSC 0,1 % Tween 20 bei Raumtemperatur durchgeführt. Um das Ausbleichen der Fluorochrome zu verhindern wurden die Objektträger mit den gefärbten Stromazellen mit je 10 l ProLong Antifade Mounting Medium versehen und mit Deckgläschen versiegelt. 48
49 3.3.4 Kombination von Kernfärbung und Immunfluoreszenzfärbungen für Vimentin/von-Willebrand-Faktor und CD14/CD45 Vimentin/von-Willebrand-Faktor + CD14: Um ausschließen zu können, dass Makrophagen ebenso stromale Marker exprimieren, wurden die Immunfluoreszenzfärbungen für Vimentin oder von- Willebrand-Faktor in Kombination mit einer CD14-Färbung (mouse-anti-human- CD14 als Primärantikörper, als Sekundärantikörper Alexa 647 direkt-markierter goat-anti-mouse-igg) wie in Abschnitt beschrieben durchgeführt. CD45 (direkt) + CD14 (indirekt): In diesem Zusammenhang wurde auch die Fähigkeit der Makrophagen überprüft, CD45 als Oberflächenantigen hämatopoetischer Zellen exprimieren zu können, indem eine indirekte Immunfluoreszenzfärbung für CD14 (mouse-anti-human- CD14 als Primärantikörper, als Sekundärantikörper Alexa 647 direkt-markierter goat-anti-mouse-igg) mit einer direkten Immunfluoreszenzfärbung für CD45 (mouse-anti-human-cd45-fitc) kombiniert wurde (s.o.). Vimentin/von-Willebrand-Faktor + CD45 (indirekt): Des Weiteren sollte untersucht werden, ob die Vimentin + - oder von-willebrand- Faktor + -Zellen den hämatopoetischen Marker CD45 exprimieren können. Dafür wurden die direkten Immunfluoreszenzfärbungen entweder mit Vimentin oder von- Willebrand-Faktor in Kombination mit der indirekten CD45-Färbung (mouse-antihuman-cd45 als Primärantikörper, Alexa 647 direkt-markierter goat-anti-mouse- IgG als Sekundärantikörper) nach dem bereits beschriebenem Protokoll durchgeführt. Damit die Zuordnung der einzelnen Zellen vereinfacht wurde, kam bei allen oben genannten Färbungs-Kombinationen eine Zellkern-Färbung mit Draq5 zur Anwendung. 49
50 3.4 Kontrollen der Fluoreszenzfärbungen Folgende Antikörper fanden bei den Kontrollfärbungen Verwendung: Antikörper/Sonde CEP Y (Satellite III) Spectrum orange (Vysis) mouse IgG 1 -FITC (Immunotech) mouse IgG 1+2 -negative Control (Serotec) mouse-anti-human-cd45 (DAKO) mouse-anti-human-cd14 (DAKO) Alexa 647 F(ab`) 2 fragment of goat anti-mouse IgG (H+L) (Molecular Probes) mouse-anti-human-cd45 FITC (Invitrogen) Tabelle 8: Übersicht der verwendeten Kontrollantikörper Y-Chromosom FISH: Als Negativkontrolle für die FISH-Analyse wurden Zellen von bereits transplantierten weiblichen Patienten mit weiblichem Spender verwendet, da hier kein Vorkommen von Y-Chromosomen anzunehmen war. Für die Positivkontrolle dienten Zellen von männlichen Patienten, welche ihr hämatopoetisches Transplantat von einem männlichen Spender erhalten hatten und somit zu erwarten war, dass bei der FISH Y-Chromosomen zur Darstellung kommen würden. 50
51 Direkte Vimentin/von-Willebrand-Faktor Fluoreszenzfärbungen: Von allen Patientenproben wurden Objektträger zur Kontrolle der direkt mit einem Fluorochrom markierten Antikörper gegen Vimentin und von-willebrand-faktor mit einem FITC-markierten Maus-IgG 1 Antikörper gefärbt. Dieser Antikörper ist nicht gegen humane Strukturen gerichtet und somit konnte die Färbung mit den genannten Antikörpern als erfolgreich angesehen werden, wenn bei den Kontrollzellen keine unspezifischen FITC-Signale detektiert wurden. Indirekte CD14/CD45 Fluoreszenzfärbungen: Für die Negativkontrolle der indirekten CD14 und CD45 Fluoreszenzfärbung diente ein unmarkierter Maus-Isotypkontrollantikörper als Primärantikörper. Er wurde in einer Verdünnung von 1:20 angewendet, die Verdünnung wurde wieder mit einem Antikörperverdünnungsmedium durchgeführt, welches mit 1,5% Ziegen- Serum versetzt war. Für die Fluoreszenzfärbung kam als Sekundärantikörper der mit Alexa 647 direkt markierte goat-anti-mouse-antikörper zur Anwendung. Als Positivkontrolle dienten aus EDTA-Blut gewonnene mononukleäre Zellen. Die bereits bei der Kombination von Y-Chromosom FISH + Vimentin/von-Willebrand Faktor + CD14/CD45 verwendeten Antikörper gegen die Antigene CD14 und CD45 wurden wie oben beschrieben eingesetzt, d.h. wieder mit einer Konzentration von 16 l/ml auf die Zellen gegeben. Als Sekundärantikörper wurde wieder der mit Alexa 647 direkt markierte goat-anti-mouse-antikörper verwendet, um ein Fluoreszenzsignal zu erhalten, und damit die CD14 + /CD Zellen darzustellen. 3.5 Auswertung der Fluoreszenzfärbungen Unter dem Begriff Fluoreszenz versteht man den Übergang eines Moleküls (Fluorochrom) von einem elektronisch angeregten Zustand (durch Absorption eines Photons) zurück in den Grundzustand, wobei die überschüssige Energie durch Emission eines Photons (Fluoreszenz) abgegeben wird. In dieser Arbeit wurden drei Fluoreszenzfarbstoffe verwendet (Tabelle 9). Bei den Immunfluoreszenzfärbungen waren die Fluorochrome Alexa 647 und FITC direkt an die Antikörper gebunden. Auch das Rhodamin-Derivat war direkt an die Y- Chromosom-Sonde gebunden. 51
52 Fluorochrom Absorptionsmaximum 1 Emissionsmaximum 1 (nm) (nm) FITC Alexa Draq Rhodamin-Derivat Tabelle 9 : Fluoreszenzfarbstoffe, 1 Wert ist geräteabhängig, 2 nach Herstellerangaben Die Auswertung der Fluoreszenzfärbungen wurde am konfokalen Laserscanningmikroskop LSM 410 vorgenommen. Für jedes Fluorochrom wurde die Emission innerhalb eines bestimmten Wellenbereiches gemessen, nachdem sie durch die drei Lasersysteme des Mikroskopes nahe ihrem Absorptionsmaximum angeregt worden waren. So konnten die Signale einem Farbkanal zugeordnet werden und waren damit völlig unabhängig von der eigentlichen Fluoreszenzfarbe der einzelnen Fluorochrome. Fluorochrom Markierte Struktur Farbkanal FITC Vimentin, von-willebrand-faktor, CD45 grün Alexa 647 CD45, CD14 grün Draq5 Nukleäre DNA blau Rhodamin-Derivat Y-Chromosom rot Tabelle 10: Fluorochrome der verschiedenen Antikörper mit zugeordnetem Farbkanal 52
53 3.6 Statistik Die Ergebnisse sind als Mediane oder als Einzelwerte dargestellt. Die statistische Auswertung erfolgte mit Hilfe des Fisher s Exact-Tests für dichotome Merkmale. Des Weiteren kam der McNemar Test zum Vergleich von Merkmalen innerhalb einer Gruppe zum Einsatz. Für unabhängige Gruppen mit gemeinsamem, nicht normalverteiltem Merkmal wurde der Mann-Whitney-Test für unverbundene Stichproben verwendet. Ein Resultat wurde als statistisch signifikant betrachtet, wenn die Nullhypothese mit 95 % Wahrscheinlichkeit abgelehnt werden konnte (p < 0,05). 53
54 4. Resultate A: Analyse des Wachstumsverhaltens von Knochenmarkstromazellen in vitro 4.1 Stromazellwachstum und Konditionierung Patientenproben vor der Transplantation Um den Einfluss der Konditionierungstherapien auf das Wachstumsverhalten der Stromazellen zu erfassen, wurden insgesamt 17 Proben von 17 Patienten vor Beginn der Konditionierung, und damit vor der Transplantation entnommen und in Langzeitkulturen angesetzt. Bei 58 % dieser Kulturen konnte Zellwachstum beobachtet werden (10/17). Die Krankheitsaktivität zu diesem Zeitpunkt schien ohne Einfluss auf das Wachstum zu sein, denn die Proben der Patienten, welche sich im Stadium der kompletten Remission (complete remission, CR) befanden, wiesen in 36% Wachstum von Stromazellen auf. Bei den Proben der Patienten, welche nicht in kompletter Remission waren, konnte bei 54% Wachstum beobachtet werden (36% versus 54%, p>0.05, nicht signifikant, ns). FBM Standard-myeloablativ gesamt BuCy TBI total Stromazellwachstum vor HZT 66% (6/9) 50% (4/8) 40% (2/5) 66% (2/3) 58% (10/17) p> 0.05, ns p> 0.05, ns Tabelle 11: Übersicht über das Stromazellwachstum der einzelnen Proben vor HZT Es wurde kein Unterschied im Wachstumsverhalten beobachtet, als die Proben den vorgesehenen Konditionierungstherapiegruppen zugeordnet wurden (FBM 66% (6/9) versus Standard-myeloablativ 50% (4/8), p>0.05, ns). 54
55 Auch im Vergleich der beiden konventionell geplanten Konditionierungstherapien BuCy und TBI zeigten sich keine deutlichen Veränderungen im Wachstum der Stromakulturen. Die Proben der drei Patienten, welche für ein Konditionierungsregime nach dem TBI-Schema (Strahlentherapie 12 Gray, Cyclophosphamid und Etoposid) geplant waren, produzierten Stromazellen mit derselben Effizienz, wie die Kulturen der Patienten, welche für die andere Standard-myeloablative Konditionierungstherapie mit BuCy (Busulfan, Cyclophosphamid) vorgesehen waren (TBI 66% (2/3) versus BuCy 40% (2/5), p>0.05, ns). Aufgrund der geringen Patientenzahl kann allerdings nicht darauf geschlossen werden, dass irgendein klinisches oder biologisches Merkmal die Fähigkeit zur Generierung von Stromazellen kennzeichnen könnte. Somit kann auch mit der klinischen Entscheidung für die reduzierte Konditionierung oder eine der beiden konventionellen myeloablativen Konditionierungstherapien keine Vorhersage über das Wachstum der Stromazellen in vitro gewagt werden Patientenproben nach der Transplantation Nach der Transplantation wurden insgesamt 72 Knochenmarkproben von 55 verschiedenen Patienten untersucht. Davon waren 32 Patienten mit reduzierter Konditionierung vorbehandelt, die anderen 23 Patienten wurden mit der Standardmyeloablativen Therapie versorgt (BuCy oder TBI). Das Knochenmark wurde am Tag +30 nach der Transplantation (47 Proben) und am Tag +100 nach der Transplantation (25 Proben) gewonnen (siehe auch Tabelle 12). Die Patienten befanden sich am Tag +30 mit Ausnahme eines Patienten alle im Stadium der kompletten Remission, wohingegen am Tag +100 nach Transplantation nur 46 von den 55 Patienten keine Krankheitszeichen aufwiesen. Im Kollektiv mit reduzierter Konditionierung (FBM) waren 28 der 32 Patienten in CR, im BuCy-Kollektiv: 9 von 14 Patienten und im TBI-Arm alle 9 Patienten. Das Stromawachstum zu Tag +30, Tag +100 und total nach der Stammzelltransplantation ist in der folgenden Tabelle 12 dargestellt. 55
56 Stromawachstum Tag +30 nach HZT Stromawachstum Tag +100 nach HZT Stromawachstum total nach HZT FBM 75% (21/28) 80% (12/15) 77% (33/43) Standardmyeloablativ 36% (7/19) 50% (5/10) 41% (12/29) BuCy 50% (6/12) 50% (4/8) 50% (10/20) TBI 14% (1/7) 50% (1/2) 22% (2/9) Tabelle 12: Übersicht über das Stromazellwachstum der einzelnen Proben nach HZT Im Verlauf entwickelten insgesamt 21 Patienten eine schwere akute Graft-versus- Host Disease >Grad II (FBM: 12/32, BuCy: 3/14, TBI: 6/9). Bei 28 Patienten wurde aufgrund der Immunsuppression eine symptomatische Reaktivierung des Zytomegalievirus beobachtet (FBM: 15/32, BuCy: 7/14, TBI: 6/9). Proben der FBM-Gruppe: Es wurden 43 Knochenmarkproben von 32 Patienten mit reduzierter Konditionierung bis zum Tag +100 entnommen (siehe Tabelle 13). In 77% der Fälle (33/43) wurde ein positives Stromawachstum beobachtet. Im Vergleich zu den Proben, welche vor der Transplantation entnommen wurden, zeigte sich trotz der Behandlung mit den entsprechenden konditionierenden Chemotherapeutika keine signifikante Veränderung im Wachstumsverhalten (77% 33/43) versus 66% 6/9), p>0.05, ns). vor HZT total nach HZT Stromawachstum 66% (6/9) 77% (33/43) p>0.05, ns Tabelle 13: Vergleich Stromazellwachstum vor und nach HZT (FBM-Gruppe) 56
57 Auch gab es keine relevanten Unterschiede im Vergleich der einzelnen Gruppen der verschiedenen Entnahmezeitpunkte untereinander. vor HZT Tag +30 nach HZT Tag +100 nach HZT Stromawachstum 66% (6/9) 75% (21/28) 80% (12/15) p>0.05, ns p>0.05, ns Tabelle 14: Vergleich Stromazellwachstum an verschiedenen Entnahmezeitpunkten (FBM- Gruppe) Proben der standard-myeloablativ konditionierten Patienten: In der Gruppe der Patienten, welche im Vorfeld eine Standard-myeloablative Konditionierung erhalten hatten (23 Patienten), wuchsen die Stromazellen bis zum Tag +100 in 41% der Proben (12/29). Hier wurde beobachtet, dass im Vergleich zu der Gruppe mit reduzierter Konditionierung das Wachstum signifikant seltener festzustellen war (Standard-myeloablativ: 41% (12/29) versus FBM: 77% (33/43), p<0.05, s). FBM Standard-myeloablativ Stromawachstum total nach HZT 77% (33/43) 41% (12/29) p<0.05, s Tabelle 15: Vergleich Stromazellwachstum FBM und Standard-myeloablative nach HZT 57
58 Bei der genaueren Beobachtung der beiden Untergruppen (BuCy und TBI) wurde deutlich, dass die Proben aus der TBI-Gruppe öfter Stromawachstum vermissen ließen (siehe Tabelle 12). Die insgesamt nach der HZT gewonnenen Proben aus der BuCy-Gruppe zeigten im Vergleich zur FBM-Gruppe deutlich weniger Wachstum in vitro, wenngleich keine statistisch signifikanten Level erreicht wurden (BuCy: 50% (10/20) versus FBM: 77% (33/43), p>0.05, ns). FBM BuCy Stromawachstum total nach HZT 77% (33/43) 50% (10/20) p>0,05, ns Tabelle 16: Vergleich Stromazellwachstum FBM und BuCy nach HZT Dagegen konnten bei den 9 Proben von Patienten aus der TBI-Gruppe nur zweimal Stromawachstum beobachtet werden. Vergleicht man diese Gruppe mit den beiden anderen Gruppen, so werden hier, unter der Berücksichtigung, dass die Fallzahlen in der TBI-Gruppe sehr klein sind, statistisch signifikante Unterschiede erreicht (FBM: 77% (33/43) versus TBI: 22% (2/9), p<0.05, s; BuCy: 50% (10/20) versus TBI: 22% (2/9), p<0.05, s). FBM TBI BuCy Stromawachstum total nach HZT 77% (33/43) 22% (2/9) 50% (10/20) p<0.05, s p<0.05, s Tabelle 17: Vergleich Stromazellwachstum FBM, TBI und BuCy nach HZT 58
59 4.2 Einflüsse auf das Stromazellwachstum nach der Transplantation Bei allogenen hämatopoetischen Stammzelltransplantationen wirken viele verschiedenste Faktoren zusammen, welche den Erfolg oder das Versagen dieser Therapieform beeinflussen können. Daher wurden in der vorliegenden Arbeit einige dieser Faktoren, wie das Patientenalter, die zugrunde liegende Diagnose, der Remissionsstatus zum Zeitpunkt der HZT, die Art des Transplantates, die infundierte Anzahl der Stammzellen im Transplantat, die Verwendung von ATG wegen fremd-allogener oder HLA-nicht-identer HZT, die Reaktivierung von CMV, die virostatische Therapie bei Probenentnahme, sowie das Auftreten akuter GvHD >II, von welchen eine Einflussnahme auf das Stromawachstum nicht ausgeschlossen werden konnte, in die Analyse einbezogen. Das Stromawachstumsmuster von den 72 Proben der 55 verschiedenen Patienten wurde entweder vom Entnahmetag +30 (47 Proben) oder am Tag +100 (25 Proben) nach der Stammzelltransplantation ausgewertet. Bei acht Patienten konnten mehrfach Knochenmarkproben (insgesamt 17 Proben) in Langzeitkulturen angesetzt werden (FBM-Gruppe: 5 Patienten, 11 Kulturen; BuCy-Gruppe: 3 Patienten, 6 Kulturen; siehe Tabelle 4 im Abschnitt 3.2). Die Proben dieser acht Patienten wiesen eine unterschiedliche Dynamik im Wachstumsverhalten auf. Daher wurden sie für diese Auswertung ausgeklammert und eine univariate Analyse mit den verbleibenden 47 Patienten (FBM-Gruppe: 27 Patienten; Standard-myeloablative-Gruppe: 20 Patienten) durchgeführt Patientenalter Um einen Einfluss auf das Stromawachstum festzustellen wurden die Proben bezüglich des Patientenalters auf Unterschiede im Wachstumsverhalten untersucht. Dabei wurde die Altersgrenze bei 50 Jahren angesetzt. Hinsichtlich des Stromawachstums konnte kein signifikanter Unterschied bei den Patientenproben in Abhängigkeit vom Alter festgestellt werden (>50 Jahre: 64% versus <50 Jahre: 68%, p>0.05, ns). 59
60 Alter >50 Jahre <50 Jahre Stromawachstum nach HZT 64% (18/28) 68% (13/19) p>0.05, ns Tabelle 18: Abhängigkeit Stromawachstum und Alter Diagnose Für die Analyse der Diagnosen wurden die Patienten in ebenfalls zwei Gruppen eingeteilt. Patienten mit der Diagnose Myelodysplastisches Syndrom (MDS) und Schwere aplastische Anämie (SAA) bildeten die eine Gruppe, alle anderen (AML, ALL, CML/MPS, MM, NHL/CLL) wurden in die zweite Gruppe eingeteilt. Auch bei der Betrachtung dieser Konstellation zeigten sich keine Unterschiede im Wachstumsverhalten der einzelnen Stromakulturen wie es in der folgenden Tabelle 19 gezeigt ist. Diagnose MDS/SAA andere Stromawachstum nach HZT 100% (8/8) 59% (23/39) p>0.05, ns Tabelle 19: Abhängigkeit Stromawachstum und Diagnose Primäre Therapien zur Erlangung der Remission Im Vorfeld jeder hämatologischen Stammzelltransplantation werden die Patienten, je nach Diagnose verschiedentlich behandelt, um eine möglichst komplette Remission zu erlangen. Daran schließt sich dann die eigentliche Konditionierung als Vorbereitung für die Stammzelltransplantation an. Im Hinblick auf die Fähigkeit der Generierung von Stromazellen nach der HZT wurden die Patientenproben auch hinsichtlich dieses Parameters untersucht. Im Median wurden die Patienten 60
61 vor der HZT drei Therapien unterzogen (Anzahl primärer Therapien: 3, range 0-12). Daher wurde dies als Grenze für die zu unterscheidenden Gruppen gewählt. Anzahl primärer Therapien vor HZT 1 <3 3 Stromawachstum nach HZT 67% (16/24) 61% (14/23) p>0.05, ns Tabelle 20: Abhängigkeit Stromawachstum und Anzahl primärer Therapien, 1 Median Art des Transplantates Einige Patienten bekamen als hämatopoetisches Transplantat Knochenmark (KM) übertragen. Die Proben dieser Patienten wurden daher mit den Proben von den anderen Patienten verglichen, welche periphere Blutstammzellen (periphere blood stem cells, PBSC) als Transplantat erhalten hatten. Auch zwischen den beiden Gruppen konnte kein signifikanter Unterschied im Wachstum der Stromazellen festgestellt werden. Transplantat KM PBSC Stromawachstum nach HZT 60% (3/5) 64% (27/42) p>0.05, ns Tabelle 21: Abhängigkeit Stromawachstum und Transplantat; KM, Knochenmark; PBSC periphere Blutstammzellen Anzahl der Stammzellen im Transplantat Bei den Patienten welche periphere Blutstammzellen als Transplantat erhalten hatten (n=42) wurde der Anteil der CD34 + -Zellen (hämatopoetische Stammzellen) ermittelt. Im Median enthielten die Transplantate 10,22 x 10 8 CD34 + -Zellen/kg 61
62 Körpergewicht des Patienten, was wiederum als Grenze für den Vergleich zwischen den Patientenproben dienen konnte, welche mehr oder weniger Stammzellen bei der Transplantation erhielten. In der Analyse der beiden Gruppen bezüglich des Stromawachstums zeigten sich keine statistisch relevanten Unterschiede. CD34 + -Zellen/kg KG 1 <10,22 x ,22 x 10 8 Stromawachstum nach HZT 80% (28/23) 69% (13/19) p>0.05, ns Tabelle 22: Abhängigkeit Stromawachstum und Anzahl CD34 + -Zellen im Transplantat; 1 Median; KG, Körpergewicht Remissionstatus Um herauszufinden, ob die Krankheitsaktivität eine Wirkung auf das Wachstum der Stromakulturen entfalten konnte, wurde das Wachstum in Abhängigkeit vom Remissionstatus zum Zeitpunkt der Transplantation und 100 Tage nach der Transplantation (Tag +100) als Faktor verglichen. Dabei wurden die Proben der Patienten, welche zur Zeit der Transplantation, oder am Tag +100 nach der HZT in kompletter Remission waren zu einer Gruppe zusammengefasst und allen anderen Patienten (welchen nicht in CR waren) gegenübergestellt. Die Krankheitsaktivität zeigte keinen signifikanten Einfluss auf das Wachstum der Proben der einzelnen Patienten. Remission bei HZT Remission Tag +100 nach HZT CR andere CR andere Stromawachstum nach HZT 50% (6/12) 71% (25/35) 66% (26/39) 62% (5/8) p>0.05, ns p>0.05, ns Tabelle 23: Abhängigkeit Stromawachstum und Remissionstatus; CR, komplette Remission 62
63 4.2.7 Verwendung von Antithymozyten-Globulin während der Konditionierung Um das Risiko einer Abstoßungsreaktion zu minimieren, erhielten 32 Patienten, bei welchen das hämatopoetische Transplantat nicht HLA-ident war, direkt vor der Transplantation Antithymozyten-Globulin (ATG-S, 20/mg/kg/d, 1-3 Tage). Hinsichtlich des Wachstumsverhaltens der Stromakulturen wurde nun eine Analyse vorgenommen, wobei die Patienten mit ATG in der Behandlung den anderen Patienten (mit HLA-identen Spendern, kein ATG in der Behandlung) gegenübergestellt wurden. Die zusätzliche Immunsuppression mit ATG zeigte sich nicht beeinflussend auf das Stromawachstum. ATG ja nein Stromawachstum nach HZT 72% (23/32) 53% (8/15) p>0.05, ns Tabelle 24: Abhängigkeit Stromawachstum und Verwendung von ATG-S; ATG, Antithymozytenglobulin Auftreten akuter Graft-versus-Host Disease Die Graft-versus-Host Disease stellt eine gefürchtete Komplikation bei allen allogenen Transplantationen dar. Besonders die akute Form, welche sich definitionsgemäß innerhalb der ersten hundert Tage nach der Transplantation manifestiert, kann einen schweren Krankheitsverlauf zeigen, weshalb in der Regel bei allen allogenen Transplantationen eine GvHD-Prophylaxe mit verschiedenen Immunsuppressiva durchgeführt wird. Dem Auftreten einer schweren Graft-versus-Host Disease >Grad II (GvHD) als gefürchtete Komplikation, wurde in dieser Arbeit eine Einflussnahme auf das Zellwachstum der Kulturen zugesprochen. Insgesamt kam es bei 19 Patienten zu einer akut schweren GvHD >Grad II. Diese Gruppe wurde mit den Patienten verglichen, welche keine GvHD enwickelten, oder diese nur in geringem Maße ausgeprägt war (Grad 0-I). 63
64 Es zeigten sich jedoch keine Unterschiede bei den Wachstumsraten der verschiedenen Kulturen. Akute GvHD (Grad 0-IV) 0-I II-IV Stromawachstum nach HZT 67% (19/28) 63%(12/19) p>0.05, ns Tabelle 25: Abhängigkeit Stromawachstum und akute GvHD Zytomegalievirus Durch die immunsuppressive Therapie ist das Risiko der symptomatischen Reaktivierung verschiedener stummer Virusinfektionen zu beobachten. Der Infektion mit dem Zytomegalievirus kommt speziell bei Patienten nach allogener hämatopoetischer Stammzelltransplantation eine herausragende Bedeutung zu, da die Infektion zur gefürchteten CMV-Pneumonie führen kann, welche mit einer hohen Letalität behaftet ist. Die Stromazellkulturen von Patienten, welche post transplantationem eine symptomatische CMV-Infektion erlitten, wurden demnach auch auf Unterschiede im Wachstumsverhalten im Vergleich zu den Proben der asymptomatischen Patienten untersucht. Die symptomatische Reaktivierung des Zytomegalievirus bei den Patienten hatte keinen signifikanten Einfluss auf das Wachstum der Stromazellkulturen. CMV-Reaktivierung nein ja Stromawachstum nach HZT 77% (17/22) 56% (14/25) p>0.05, ns Tabelle 26: Abhängigkeit Stromawachstum und CMV-Reaktivierung; CMV, Zytomegalievirus 64
65 Virostatische Therapie bei der Probenentnahme Nach der Stammzelltransplantation erhielten insgesamt 22 Patienten eine virostatische Therapie gegen das CMV. Daher wurden die Knochenmarkproben von diesen Patienten im Vergleich zu den Proben der Patienten, welche keine virostatische Therapie erhielten, hinblicklich der Generierung von Stromazellen betrachtet. Hinsichtlich des Stromawachstums konnte auch bei diesen Gruppen kein signifikanter Unterschied bei den einzelnen Patientenproben festgestellt werden. Virostatische Therapie bei Probenentnahme nein ja Stromawachstum nach HZT 64% (16/25) 50% (11/22) p>0.05, ns Tabelle 27: Abhängigkeit Stromawachstum und virostatische Therapie 65
66 4.3 Einfluss der verschiedenen Konditionierungen auf das Stromazellwachstum nach der Transplantation Ein besonderes Augenmerk wurde in dieser Arbeit auf die Auswirkungen der verschiedenen Konditionierungstherapien gerichtet. Daher wurden die einzelnen Patientenproben, welche nach der allogenen HZT entnommen wurden (n=47), nun den drei Konditionierungsgruppen zugeordnet. Wie in Abschnitt 4.2 bereits beschrieben konnten bei acht Patienten mehrfach Knochenmarkproben (insgesamt 17 Proben) in Langzeitkulturen angesetzt werden (siehe Tabelle 4 im Abschnitt 3.2). Da die Proben dieser acht Patienten eine unterschiedliche Dynamik im Wachstumsverhalten aufwiesen wurden sie auch für diese Auswertung ausgeklammert und die univariate Analyse mit den verbleibenden 47 Patientenproben durchgeführt (FBM-Gruppe: 27 Patientenproben; Standardmyeloablative-Gruppe: 20 Patientenproben, davon BuCy: 11 und TBI: 9). Standardmyeloablativ FBM BuCy TBI total n Tabelle 28: Übersicht der ausgewerteten Patientenproben Bei 85% der Patienten aus der FBM-Gruppe (23/27) konnte in den Proben bis zu Tag +100 nach der hämatopoetischen Stammzelltransplantation Stromazellwachstum nachgewiesen werden. Im Vergleich dazu wurde in der Standard-myeloablativen Gruppe nur bei 40% (8/20) ein positives Wachstum beobachtet. Der statistische Vergleich ergab einen signifikanten Unterschied im Wachstumsverhalten der verschiedenen Patientengruppen. FBM Standard-myeloablativ Stromawachstum nach HZT 85% (23/27) 40% (8/20) p<0.05, s Tabelle 29: Vergleich Stromawachstum nach Konditionierung mit FBM oder Standardmyeloablativ 66
67 Eine genauere Analyse der beiden Untergruppen der Standard-myeloablativen Patienten zeigte, dass deutlich weniger Zellwachstum in den angesetzten Kulturen der TBI-Gruppe (22%, BuCy-Gruppe: 54%) zu verzeichnen war und im statistischen Vergleich mit der FBM-Gruppe ebenfalls signifikante Level erreicht werden konnten. FBM TBI Stromawachstum nach HZT 85% (23/27) 22% (2/9) p<0.05, s Tabelle 30: Vergleich Stromawachstum nach Konditionierung mit FBM oder TBI Die Proben der Patienten aus der BuCy-Gruppe wiesen in 54% der Kulturen ein positives Zellwachstum auf. Im Hinblick auf die andere myeloablative Gruppe (TBI) waren deutlich mehr Kulturen positiv. Im Vergleich mit den Proben der Patienten aus der FBM-Gruppe (85%) zeigten sich keine signifikanten Unterschiede im Wachstum, wenngleich eine klare Tendenz zu sehen war, dass die Proben der Patienten, welche eine reduzierte Konditionierung im Vorfeld der Stammzelltransplantation erhalten hatten, doch wesentlich häufiger Stromazellen generieren konnten. FBM BuCy Stromawachstum nach HZT 85% (23/27) 54% (6/11) p>0.05, ns Tabelle 31: Vergleich Stromawachstum nach Konditionierung mit FBM oder BuCy 67
68 4.4 Hämatopoetische Regeneration nach der Transplantation Nach der hämatopoetischen Stammzelltransplantation nisten sich die neuen Stammzellen im Knochenmark ein und benötigen etwa zwei bis drei Wochen, um sich wieder zu funktionsfähigen Zellen zu differenzieren, seien es Erythrozyten, Leukozyten, oder Thrombozyten. Da die verschiedenen Elemente der Knochenmarkstromazellen die strukturelle und funktionelle Unterstützung für die Stammzellen darstellen, und durch die enge Interaktion der beiden Systeme die Selbsterneuerung und Differenzierung der Stammzellen durch das Stromagerüst katalysiert wird, wurden die hämatopoetische Regeneration und das Stromawachstum der Patientenproben bis Tag +100 nach der Stammzelltransplantation analysiert. Für diese Analyse mussten acht Patienten (FBM: 4, BuCy:4) ausgeschlossen werden, da sie bereits vor dem Tag +100 einen Krankheitsrückfall erlitten hatten Transfusion von Erythrozyten- und Thrombozytenkonzentraten Zunächst wurde der Verbrauch von Erythrozyten- und Thrombozytenkonzentraten beobachtet (EK und TK), die nach der Transplantation von den Patienten benötigt wurden. Es zeigte sich kein signifikanter Unterschied im Verbrauch der Blutzellkonzentrate zwischen den Patienten, deren Knochenmarkproben Stromazellen ausbilden konnten und derer, welche kein Zellwachstum in ihren Proben aufweisen konnten. Stromawachstum nach HZT ja (n=26) nein (n=13) EK (n) p>0.05, ns TK (n) p>0.05, ns Tabelle 32: Abhängigkeit Stromawachstum und Substitution von Blutkonzentraten, 1 Median; EK Erythrozytenkonzentrate; TK Thrombozytenkonzentrate 68
69 4.4.2 Leukozytenregeneration nach der Transplantation Um eine genauere Aussage über die hämatopoetische Erholung in Bezug auf das Wachstumsverhalten zu erhalten, wurde die Regeneration der einzelnen Zellarten in den verschieden konditionierten Gruppen separat betrachtet. Den Patienten wurde nach der hämatologischen Stammzelltransplantation regelmäßig Blut abgenommen um die Regeneration und das Engraftment ( die Akzeptanz der fremden Zellen im Empfängerorganismus) zu überwachen. So wurde der Zeitraum, in welchem die neuen Stammzellen Leukozyten ausdifferenzieren konnten, als Parameter genutzt. Als Grenze musste die Zellzahl von 1x10 9 /l erreicht werden. Es zeigte sich, dass die Leukozytenregeneration in keiner Gruppe signifikant verlangsamt oder gar beschleunigt war. Auch der Vergleich zwischen den Patienten, deren Kulturen Stromazellen generieren konnten mit denen, deren Knochenmarkkulturen kein Zellwachstum aufwiesen, konnte keine statistisch relevanten Unterschiede darstellen. So kann ein positives Stromazellwachstum in vitro keine Vorhersage für eine zügige Regeneration der Leukozyten nach hämatopoetischer Stammzelltransplantation darstellen. Stromawachstum n Leukozyten 1x10 9 /l (Tage) 1 total ja nein >0.05, ns FBM ja nein >0.05, ns Standardmyeloablativ ja nein >0.05, ns BuCy ja nein >0.05, ns TBI ja nein >0.05, ns Tabelle 33: Abhängigkeit Stromawachstum und Leukozytenregeneration nach HZT, 1 Median 69
70 4.4.3 Thrombozytenregeneration nach der Transplantation Als weiterer Marker für die Regeneration der neuen Hämatopoese kann auch die Differenzierung und Bildung von Thrombozyten dienen. Auch hier wurde als Parameter der Zeitraum verwendet, welchen die neuen Stammzellen brauchten, um Thrombozyten zu bilden. Es musste die Zellzahl von 100x10 9 /l erreicht werden, der Zeitraum wurde in Tagen gemessen. Auch hier fanden sich keine Korrelationen zwischen den Ergebnissen des Wachstumsverhaltens der Stromazellen und der Dauer der tatsächlichen laborchemischen Normothrombozytämie. Stromawachstum n Thrombozyten 100x10 9 /l (Tage) 1 total ja nein >0.05, ns FBM ja nein >0.05, ns Standard ja nein >0.05, ns BuCy ja nein >0.05, ns TBI ja nein >0.05, ns Tabelle 34: Abhängigkeit Stromawachstum und Thrombozytenerholung nach HZT, 1 Median 70
71 B: Stromazellpopulation und Chimärismusanalyse 4.5 Charakterisierung der Stromazellkulturen Im Knochenmark stellen die verschiedenen Elemente des Knochenmarkstroma die strukturelle und funktionelle Unterstützung der hämatopoetischen Stammzellen dar und nehmen nach einer hämatopoetischen Stammzelltransplantation eine besondere Rolle in ihrer Funktion als Regulator der Hämatopoese ein. In dieser Arbeit wurde nun neben dem Wachstumsverhalten ein weiterer Schwerpunkt zum einen auf die Komposition der verschiedenen Stromazellen in den entnommenen Kulturen gelegt und zum anderen versucht, den Ursprung dieser Zellen zu ermitteln (Chimärismusanalyse). Es wurden alle 89 Proben der 72 Patienten (vor HZT 17 Proben von 17 Patienten; nach HZT 72 Proben von 55 Patienten) in dieser Analyse berücksichtigt Stromazellwachstum in vitro Stromazellwachstum vor und nach HZT: Zunächst wurde der Zeitraum zwischen Kulturansatz und erstem Auftreten von Zellwachstum in den Patientenproben, welcher bei den regelmäßigen miroskopischen Kontrollen protokolliert worden war, ausgewertet. Bei den positiven Proben ließ sich erstes Zellwachstum nach etwa 20 Tagen feststellen. Dabei zeigte sich kein Unterschied im Hinblick auf den Zeitpunkt, zu welchem die Proben gewonnen wurden, denn sowohl die Proben, welche vor Beginn der Konditionierungstherapie entnommen wurden, als auch die Proben, entnommen zu den verschiedenen Zeitpunkten nach der Stammzelltransplantation brachten die gleichen Ergebnisse. Proben vor HZT n=17 Zeitraum bis zum ersten 20 Zellwachstum, Tage 1 (14-36) Proben nach HZT n=72 20 (8-38) total n=89 20 (8-38) Tabelle 35: Wachstumsdynamik der Proben von Ansatz bis zum ersten Zellwachstum, 1 Median, (range) 71
72 Während der Zellkultivierung war auffällig, dass verschiedene Kulturen deutlich länger zu brauchen schienen, um einen konfluenten Zellrasen nach Beginn des Zellwachstums zu bilden. So wurde auch dieser Zeitraum, nämlich zwischen Auftreten von erstem Zellwachstum und konfluentem Zellrasen (>75% der Kulturfläche) genauer betrachtet. Es wurde deutlich, dass die Kulturen, welche vor der Stammzelltransplantation und damit vor Beginn der Konditionierungstherapie entnommen worden waren, wesentlich schneller einen konfluenten Zellrasen generieren konnten, als die Proben der Patienten post transplantationem. Proben vor HZT Proben nach HZT total Zeitraum bis zur 9 Konfluenz, Tage 1 (3-31) 30 (7-64) 22,5 (3-64) Tabelle 36: Wachstumsdynamik bis zum Erreichen der Konfluenz, 1 Median, (range) Stromazellwachstum nach HZT und Konditionierung: Die Zuordnung der Patientenproben in die jeweiligen Konditionierungsgruppen wies bezüglich des erstmaligen Auftretens von Stromazellwachstum nach Kulturansatz keine Unterschiede auf. So konnten die Kulturen der Patienten der FBM-Gruppe nach 20,5 Tagen und die Patienten aus der Standardmyeloablativen-Gruppe nach 20 Tagen Stromazellen generieren. FBM Standard-myeloablativ Zeitraum bis zum ersten 20,5 Zellwachstum, Tage 1 (8-38) 20 (11-34) Tabelle 37: Vergleich Wachstumsdynamik zwischen FBM und Standard-myeloablativ, 1 Median, (range) 72
73 Nun wurde auch hier bei den Proben der Zeitraum bis zur Ausbildung eines konfluenten Zellrasens den entsprechenden Konditionierungsgruppen zugeordnet. Diese Auswertung zeigte, dass die Proben der Patienten, welche mit dem reduzierten Konditionierungsschema vorbehandelt wurden, etwas schneller (nach 26 Tagen) konfluentes Wachstum vorweisen konnten. Die Proben der Standardmyeloablativen-Gruppe konnten im Median erst nach 33 Tagen einen kompletten Zellrasen generieren. FBM Standard-myeloablativ total Zeitraum bis zur 26 Konfluenz, Tage 1 (8-64) 33 (7-61) 30 (7-64) Tabelle 38: Vergleich Wachstumsdynamik bis zum Erreichen der Konfluenz zwischen FBM und Standard-myeloablativ, 1 Median, (range) 73
74 4.6 Zellkomposition und Chimärismusanalyse Stromazellformationen in vitro Native Zellen: Die Stromazellkulturen wurden morphologisch zunächst nativ, d.h. ohne Verwendung von Immunfluoreszenzfärbungen spezifischer stromaler Marker wie Vimentin oder von-willebrand-faktor betrachtet. Bei der Analyse unter Verwendung des Phasenkontrastmikroskops der ungefärbten Zellen zeigte sich in allen Proben eine homogene, fibroblastäre Formation der Zellen. Damit die Morphologie der Zellen noch deutlicher dargestellt werden konnte wurden exemplarisch jeweils zwei Objektträger von zwei verschiedenen Patientenproben (FBM und BuCy nach HZT) mit Hämatoxylin/Eosin gefärbt. Abbildung 5: links: Stromazellen nativ (Phasenkontrastmikroskop), rechts: Stromazellen nach Hämatoxylin/Eosin-Färbung 74
75 Immunzytochemische Färbungen: Die generierten Zellen aus den verschiedenen Knochenmarkproben wurden geerntet und auf Objektträgern fixiert. Danach konnten die Immunzytochemischen Färbungen wie in Abschnitt 3.3 beschrieben durchgeführt werden. Es wurden dazu die Proben von insgesamt 26 Patienten verwendet. Fünf Patientenproben wurden vor Beginn der Konditionierungstherapie entnommen, 21 Proben wurden von den Patienten nach der Stammzelltransplantation gewonnen. Davon waren 15 Patienten mit dem reduzierten, auf Fludarabin-basierendem Konditionierungsregime FBM vorbehandelt. Die restlichen Patienten wurden im Vorfeld mit der Standard-myeloablativen Konditionierung therapiert. Eine Übersicht bietet die folgende Tabelle. FBM nach HZT Standard-myeloablative nach HZT vor HZT Tag +30 Tag +100 Tag +30 Tag +100 Patienten (n) Tabelle 39: Übersicht über immunzytochemisch gefärbte Patientenproben Nach der Durchführung der verschiedenen Immunfluoreszenzfärbungen zur Anfärbung der spezifischen stromalen Markern (Vimentin, von-willebrand-faktor) konnte die Zellkompostition der Stromakulturen ausgewertet werden. In allen Proben, ob vor oder nach der HZT entnommen, ob reduzierte oder Standardmyeloablative Konditionierung vor der Stammzelltransplantation, zeigten sich starke Expressionen der Vimentin + - und von-willebrand-faktor + -Zellen. 75
76 Abbildung 6: Stromazellen mit Kernfärbung (blau) und Immunfluoreszenzfärbung für Vimentin (grün) Abbildung 7: Stromazellen mit von-willebrand-faktor-immunfluoreszenzfärbung (grün) 76
77 Hingegen konnten bei den Patientenproben, welche mit den Immunfluoreszenzfärbungen CD14/CD45 behandelt wurden, kaum, bzw. keine Zellen mit den Oberflächenantigenen CD14 (Makrophagen) und CD45 (hämatopoetische Zellen) mit den entsprechenden Antikörpern detektiert werden, unabhängig davon, welcher Konditionierungsgruppe die Proben zugeordnet waren oder zu welchem Zeitpunkt sie dem Patienten entnommen worden waren. Abbildung 8: links: Stromazellen mit Kernfärbung (blau) und Immunfluoreszenzfärbung für CD45 (keine Signale); rechts: Stromazellen mit Kernfärbung (blau) und Immunfluoreszenzfärbung für CD14 (keine Signale) Die Kombination der Immunfluoreszenzfärbungen für CD45 oder CD14 mit einem der beiden Marker für Stromazellen (Vimentin/von-Willebrand-Faktor), um darzustellen, ob CD bzw. CD14 + -Zellen auch diese Oberflächenantigene exprimieren können, zeigten, dass sich die Zellkulturen der verschiedenen Patienten nahezu ausschließlich aus Vimentin + - bzw. von-willebrand-faktor + - Zellen zusammensetzten. So konnte durch die morphologischen und immunzytochemischen Analysen gezeigt werden, dass in den verschiedenen Patientenproben, unabhängig davon, zu welcher Konditionierungsgruppe sie gehörten, oder zu welchem Zeitpunkt die Entnahme der Knochenmarkzellkultur erfolgte, keine Unterschiede in der Zellkomposition fest zu stellen waren. 77
78 4.6.2 Chimärismusanalyse der Stromazellen Es wurden außerdem Stromazellen von sechs Patientinnen gesondert analysiert, welche alle eine Konditionierung mit dem reduzierten Schema erhalten und danach periphere Blutstammzellen als Transplantat erhalten hatten. Die Spender dieser Patientinnen waren allesamt männlich, so dass eine mögliche Ko- Übertragung von Stromazellen neben den hämatopoetischen Stammzellen und damit der Ursprung der Stromazellen untersucht werden konnte. Dazu wurde bei diesen Zellen eine Chimärismusanalyse durchgeführt, da nach einer wie hier vorliegenden sex-mismatched Stammzelltransplantation mit männlichem Spender bei weiblichen Patienten bei einer tatsächlichen Ko-Übertragung von Stromazellen oder anderen Mechanismen, welche zu einem Chimärismus führen können, Y- Chromosom + -Stromazellen in den Kulturen zu erwarten waren. Somit wurden die auf den Objektträgern fixierten Zellen mit einer Dreifächfärbung bestehend aus Y- Chromosom-FISH (zur Detektion der Y-Chromosome), Kernfärbung Draq5 um die FISH-Signale eindeutig zuordnen zu können, einer Immunfluoreszenzfärbung für Oberflächenantigene stromaler Zellen (Vimentin, von-willebrand-faktor) und zum Ausschluss einer Verunreinigung der Kultur mit hämatopoetischen Zellen mit einer Immunfluoreszenzfärbung für CD45/CD14 behandelt. Abbildung 9: Färbeschema der Patientenproben für die Chimärismusanalyse 78
79 Als Negativkontrolle für die FISH-Analyse wurden Zellen von bereits transplantierten weiblichen Patienten mit weiblichem Spender verwendet, da hier kein Vorkommen von Y-Chromosomen anzunehmen war. Für die Positivkontrolle dienten Zellen von männlichen Patienten, welche ihr Transplantat von einem männlichen Spender erhalten hatten und somit zu erwarten war, dass bei der FISH Y-Chromosomen zur Darstellung kommen würden. Die Kontrollfärbungen zeigten ausschließlich bei den männlichen Patientenproben mit männlichem Spender fluoreszierende Signale. Abbildung 10: Negativ-Kontrolle: Stromazellen von weiblichen Patientinnen nach sexmatched HZT mit Y-Chromosom-FISH (kein Signal), Kernfärbung (blau), von-willebrand- Faktor-Immunfluoreszenzfärbung (grün), Immunfluoreszenzfärbung für CD45 (keine Signale) Abbildung 11: Positiv-Kontrolle: Stromazellen von männlichen Patienten nach sex-matched HZT mit Y-Chromosom-FISH (rot), Kernfärbung (blau), Immunfluoreszenzfärbung für CD14 (keine Signale) und von-willebrand-faktor-immunfluoreszenzfärbung (grün) 79
80 Die auf Chimärismus zu untersuchenden Proben der sechs weiblichen Patienten mit männlichem Spender zeigten allesamt eine starke Expression von Vimentin und von-willebrand-faktor. Es ließen sich in keiner Probe CD (Makrophagen) oder CD (hämatopoetische Zellen) Zellen nachweisen, womit sich diese Proben bezüglich der Stromazellkomposition nicht von den restlichen Kulturen unterschieden. Abbildung 12: Stromazellen einer Patientin nach sex-mismatched HZT mit Y-Chromosom- FISH (keine Signale), Kernfärbung (blau), Immunfluoreszenzfärbung für CD45 (keine Signale) und Vimentin-Immunfluoreszenzfärbung (grün) 80
81 Bei einer Probe konnte eine Y-Chromosom + -Zelle detektiert werden, welche allerdings sowohl Vimentin als auch von-willebrand-faktor negativ war und somit am ehesten eine kontaminierende hämatopoetische Spenderzelle darstellte. Abbildung 13: Stromazelle einer Patientin nach sex-mismatched HZT mit Y-Chromosom- FISH (rot), Kernfärbung (blau) und Immunfluoreszenzfärbung für Vimentin und von- Willebrand-Faktor (jeweils keine Signale) Jedoch konnten in keiner anderen Zelle der sechs verschiedenen Patientenproben weitere positive Signale für ein Y-Chromosom entdeckt werden, was den Ursprung der Knochenmarkstromazellen dieser Patientenproben dem jeweiligen Spender zugeordnet hätte. Somit konnten in dieser Arbeit keine chimären Knochenmarkstromazellen nachgewiesen werden. 81
82 5 Diskussion A: Generierung und Wachstum von Stromazellen in vitro 5.1 Studienlage und Methodik Es gibt verschiedene Untersuchungen und Ansätze, um die Schädigung der Knochenmarkstromazellen ex vivo nach einer allogenen hämatopoetischen Stammzelltransplantation mit vorausgegangener Konditionierungstherapie zu evaluieren, wie z.b. die Beobachtung des Wachstumsverhaltens der stromalen Elemente in Kulturen oder die Generierung fibroblastärer Colony-forming-units. Die Ergebnisse der Studien zeigen nicht unbedingt übereinstimmende Ergebnisse, was möglicherweise durch unterschiedliche Studiendesigns bedingt ist, aber auch dadurch, dass verschiedene Elemente des stromalen Mikromilieus untersucht worden sind (Nikkels et al, 1987) Schädigung der Stromazellen und die Konsequenzen Es stellt sich nun die Frage, ob die Knochenmarkstromazellen trotz vorheriger Konditionierung nach einer allogenen hämatopoetischen Stammzelltransplantation weiterhin genauso die Fähigkeit besitzen, die Proliferation und Differenzierung der hämatopoetischen Stammzellen in vivo zu unterstützen. In verschiedenen Studien konnte gezeigt werden, dass die Knochenmarkstromazellen von Patienten mit soliden Tumoren oder Knochenmarkaspirate von gesunden Spendern in über 99% konfluentes Zellwachstum generieren können (Treweeke et al, 1993; Koc et al, 2000). Hingegen ist bei Patienten mit hämatologischen Neoplasien, unabhängig davon, ob die Erkrankungen therapiert worden waren oder nicht, wesentlich seltener Stromawachstum in Knochenmarkaspiraten zu beobachten gewesen (50%). Des Weiteren brauchten diese Kulturen deutlich mehr Zeit um einen konfluenten Zellrasen zu bilden. Andere Studien haben sich mit dem Knochenmarkstromawachstum bei verschiedenen hämatologischen Neoplasien wie z.b. MDS oder SAA 82
83 auseinandergesetzt und Beeinträchtigungen darstellen können. Auch bezüglich Unterschiede im Alter und bezüglich verschiedener Therapiestrategien wurden die Knochenmarkstromazellen hinsichtlich ihrer Wachstumsfähigkeit betrachtet und ähnliche Ergebnisse demonstriert (Treweeke et al, 1993; Domenech et al, 1994). Diese Studien weisen darauf hin, dass das Stromawachstum in vitro verschiedene klinische Einflüsse reflektieren kann. Daher kann die Betrachtung des Wachstumsverhaltens von Knochenmarkstromakulturen in vitro eine entsprechend funktionierende Methode für die Beurteilung der möglichen Effekte der verschiedenen Konditionierungstherapien vor einer allogenen hämatopoetischen Stammzelltransplantation auf die Knochenmarkstromazellen in vivo darstellen. 5.2 Eigene Ergebnisse Wir konnten bei dem Vergleich der Wachstumsraten der Stromakulturen, gewonnen vor der Konditionierung und nach der Transplantation, tatsächlich deutliche Unterschiede ausmachen. So konnten insgesamt 58% der Proben vor der Konditionierung Stromazellwachstum zeigen, hingegen konnten die Proben aus der TBI-Gruppe nach der Konditionierung und HZT von Tag +30 lediglich in 14% (1/7) Stromazellen generieren und alle Proben aus der TBI-Gruppe nach der Transplantation wiesen in 22% (2/9) Zellwachstum auf. Dies deutet darauf hin, dass in vitro Veränderungen, oder Beeinträchtigungen der Wachstumsfähigkeit von Stromazellen, verursacht durch Transplantations-assoziierte Faktoren wie z.b. das konditionierende Regime, aufgezeigt werden können und somit unsere Methode geeignet ist, um diese Veränderungen zu detektieren. Aufgrund der geringen Patientenzahl kann allerdings nicht darauf geschlossen werden, dass irgendein klinisches oder biologisches Merkmal für die Fähigkeit zur Generierung von Stromazellen kennzeichnend ist. Somit kann auch die klinische Entscheidung für die reduzierte Konditionierung oder eine der beiden konventionellen myeloablativen Konditionierungstherapien keine Vorhersage über das Wachstum der Stromazellen in vitro wagen. 83
84 5.2.1 Konditionierung als prädiktiver Faktor für das Stromazellwachstum? Mit unserer Arbeit konnten wir zeigen, dass die reduzierte Konditionierung nach dem FBM-Schema allein keinen Einfluß auf das Wachstum Stromazellen in vitro genommen hat. Wir haben das Zellwachstum vor Beginn der Transplantation mit den Kulturen, welche nach der HZT gewonnen wurden verglichen und konnten keine signifikanten Unterschiede feststellen. Die Kulturen, welche vor der Konditionierung entnommen wurden, wiesen in 58% (10/17, die Kulturen der späteren FBM-Patienten in 66%, 6/9) Stromazellwachstum auf, die Proben der FBM-Patienten nach der Stammzelltransplantation konnten in 77% (33/43) Stromazellen generieren (58%, bzw. 66% versus 77%, p>0.05, nicht signifikant). Allerdings konnten wir signifikante Unterschiede feststellen, als wir alle Proben, welche nach der allogenen Stammzelltransplantation gewonnen wurden, in die verschiedenen Konditionierungsgruppen (FBM, BuCy und TBI) einordneten und anschließend auf die Fähigkeit Stromazellen generieren zu können untersuchten. Der Vergleich der Gruppen zeigte, dass die Proben der Patienten aus der FBM- Gruppe deutlich häufiger konfluente Stromazellpopulationen ausbilden konnten (85%, 23/27) als die Proben der Standard-myeloablativen Gruppe (40%, 8/20), was statistisch einen signifikanten Level erreicht hat (85% versus 40%, p<0.05, signifikant) Weitere Einflüsse auf das Stromazellwachstum Wir konnten allerdings nicht sicher davon ausgehen, dass die geringere Fähigkeit der Knochenmarkkulturen der Patienten aus der Standard-myeloablativen-Gruppe zur Generierung von Stromazellen nur auf das Konditionierungsregime zurückzuführen ist, sondern dass noch viele weitere Faktoren existieren, welche im Rahmen einer allogenen Stammzelltransplantation ebenfalls einen Einfluss auf das Stromawachstum nehmen können. Daher schlossen sich diesbezüglich weitere Untersuchungen an. Im Vergleich einiger Faktoren, von welchen eine Einflussnahme auf das Stromawachstum angenommen werden konnte, zeigten sich jedoch änhliche Verhältnisse in den verschiedenen Gruppen, und schieden somit als Ursache für 84
85 den Unterschied im Stromawachstum zwischen den beiden Konditionierungsgruppen aus (siehe Tabelle 40). So wurden bei beiden Gruppen hauptsächlich periphere Blutstammzellen (PBSC) als hämatopoetisches Transplantat verwendet (PBSC: FBM-Gruppe: 93%, Standard-myeloablativ-Gruppe: 78%), die Zahl der Stammzellen im Transplantat wies im Median keine Unterschiede auf (FBM: 10.4 x 10 8 Zellen/kg KG, Standardmyeloablativ: x 10 8 Zellen/kg KG) und die Anzahl der vorangegangenen intensiven Therapien, um vor der Transplantation eine Remission zu erreichen, war im Median gleich (beide 3). Des Weiteren zeigten sich in beiden Gruppen ähnlich viele Patienten mit einer symptomatischen Reaktivierung des Zytomegalievirus durch die Immunsuppression (FBM: 47%, Standardmyeloablativ: 56%) und auch die Anzahl der CMV-seropositiven Patienten zeigte keine große Differenz innerhalb der beiden Gruppen (FBM: 81%, Standardmyeloablativ 91%). Sowohl in der FBM-Gruppe als auch bei den Standardmyeloablativen Patienten trat die akute GvHD >II gleichmäßig auf (GvHD>II, FBM: 37%, Standard-myeloablativ: 39%). Konditionierung FBM (n) Standard-myeloablativ (n) PBSC 30 (93%) 18 (78%) Anzahl der Stammzellen im Transplantat 1 10,4 x ,02 x 10 8 Anzahl der Therapien zum Erreichen der CR 1 3 (0-12) 3 (0-7) Akute GvHD >II 12 (37%) 9 (39%) CMV-Reaktivierung 15 (47%) 13 (56%) CMV-IgG-seropositiv 26 (81%) 21 (91%) Tabelle 40: Übersicht über Auftreten und Verteilung verschiedener Faktoren bei FBM und Standard-myeloablativ von welchen eine Einflussnahme auf das Stromazellwachstum angenommen werden konnte, 1 Median 85
86 Interessanterweise zeigten sich doch bei vier weiteren Faktoren, von welchen man eine Korrelation zu verminderter Wachstumsfähigkeit der Stromazellen erwarten konnte, genau umgekehrte Verhältnisse bezüglich der gezeigten Wachstumsraten in den entsprechenden Konditionierungsgruppen (siehe Tabelle 41). Es wurde in beiden Patientengruppen noch das Alter, die Diagnose, der Remissionstatus zum Zeitpunkt der HZT und die Identität des Spenders (fremd/familiär) und die damit verbundene Gabe von ATG als ein das Stromawachstum beeinflussender Faktor angesehen. Dies zeigte, dass ausgerechnet die Patienten aus der FBM-Gruppe älter waren (Median, FBM: 54 Jahre, Standard-myeloablativ: 40 Jahre) und zum Zeitpunkt der HZT viel seltener das Stadium der kompletten Remission erreicht hatten, als die Patienten der Standard-myeloablativen Gruppe (CR, FBM: 9%, Standard-myeloablativ: 44%). Weiterhin waren mehrere fremd-allogene oder HLAnicht idente Stammzelltransplantationen in dieser Gruppe zu verzeichnen, was die zusätzliche Medikation von ATG zur Prophylaxe gegen eine Transplantatabstoßung notwendig machte (FBM: 78%, Standard-myeloablativ 60%) und es litten mehr Patienten in der FBM-Gruppe an MDS oder SAA (FBM: 21%, Standard-myeloablativ: 4%). Konditionierung FBM (n) Standard-myeloablativ (n) Alter (Jahre) 1 54 (22-67) 40 (20-51) Diagnose MDS/SAA 7 (21%) 1 (4%) Komplette Remission bei HZT 3 (9%) 11 (44%) ATG bei HZT 25 (78%) 14 (60%) Tabelle 41: Übersicht über vier weitere Faktoren von welchen eine Einflussnahme auf das Stromazellwachstum angenommen werden konnte, 1 Median 86
87 Deshalb untersuchten wir das Wachstumsverhalten der Stromazellen in einer univariaten Analyse um die Fähigkeit der Knochenmarkaspirate Stromazellen zu generieren hinsichtlich dieser Faktoren beurteilen zu können, bzw. ob diese Faktoren tatsächlich einen Einfluss auf das Stromawachstum in vitro besitzen. Nach der Auswertung der einzelnen Parameter konnten wir für keinen der genannten Faktoren einen Einfluss auf unsere Stromakulturen nachweisen. Es zeigten sich keine signifikanten Unterschiede im Wachstum der Zellkulturen. So ist die Verwendung der Standard-myeloablativen Konditionierung im Gegensatz zum reduzierten FBM-Regime die einzige Ursache, auf welche wir ein geringeres Stromazellwachstum zurückführen konnten. Betrachtet man die Patientenproben der Standard-myeloablativen Gruppe noch gesondert in ihren Untergruppen (BuCy und TBI), so zeigte sich, dass besonders die Proben der Patienten, welche zusätzlich noch mit einer fraktionierten Ganzkörperbestrahlung behandelt wurden (TBI-Gruppe), selten Stromazellen in vitro generieren konnten (Wachstum TBI-Gruppe: 22%). Ähnliche Ergebnisse wurden in anderen Studien präsentiert, welche zeigen konnten, dass das Knochenmarkstroma durch eine konditionierende Bestrahlung wesentlich stärker geschädigt wird, als nach einer Konditionierung mit einer reinen Chemotherapie (Treweeke et al, 1993; Domenech et al, 1994, Moreau et al, 2002). Wir konnten im Vergleich der FBM-Gruppe und der BuCy-Gruppe keine statistisch signifikanten Unterschiede im Zellwachstum nachweisen, jedoch ist eine klare Tendenz zu sehen, dass die Proben der Patienten aus der FBM-Gruppe deutlich häufiger Stromazellen generieren konnten (Wachstum FBM: 85%, BuCy: 54%). Auch dieses Erbgebnis korreliert mit einer Reihe von weiteren Studien. Es konnte in verschiedenen Versuchen in vitro gezeigt werden, dass Busulphan (als Bestandteil des myeloablativen Schemas) eine toxische Wirkung auf die Stromazellen besitzt, während BCNU (als Bestandteil der reduzierten Konditionierung) keinen Effekt auf die Proliferation des Knochenmarkstroma zu haben scheint (Fried et al, 1977; McManus, Weiss, 1984; Uhlmann et al, 1991). Aufgrund der geringen Patientenanzahl haben diese Ergebnisse jedoch lediglich einen hinweisenden Charakter und lassen demnach keine allgemeingültigen Rückschlüsse zu. 87
88 5.3 Hämatopoetische Regeneration nach allogener HZT Die hämatopoetischen Stammzellen werden strukturell und funktionell durch die verschiedenen Elemente des Knochenmarkstroma unterstützt. Besonders nach einer Stammzelltransplantation kommt den Stromazellen durch ihre Rolle als Regulator für die Hämatopoese eine besondere Bedeutung zu (Torok-Storb, Holmberg, 1994). Allerdings wird bei der Therapie einer neoplastischen Erkrankung des hämatopoetischen Systems das Mikromilieu der Stromazellen ebenso der aggressiven Chemotherapie oder Strahlentherapie ausgesetzt und die Zellen damit angegriffen und eliminiert, wie die erkrankten Stammzellen. Dies kann zu verlängerten Erholungszeiten der Hämatopoese nach der Transplantation führen Studien Es gibt zahlreiche Untersuchungen, welche sich mit der verzögerten hämatopoetischen Regeneration nach einer Stammzelltransplantation auseinandersetzen (Migliaccio et al, 1990; Carlo-Stella et al, 1997; Torok-Storb et al, 1994; Lazarus et al, 1992). Bei allogenen hämatologischen Stammzelltransplantationen können demnach viele biologische Faktoren für ein verzögertes Engraftment ursächlich sein. Dies mag auch ein Grund dafür sein, dass sich bislang wenig mit dem anderen Part des Mikromilieus, außer dem Stammzellkompartiment nämlich der Stromazellpopulation hinsichtlich der hämatopoetischen Regenerierung beschäftigt wurde (Annaloro et al, 2000). In einer Studie von Annaloro et al wurden bei Patienten nach einer autologen Stammzelltransplantation und verzögertem Engraftment bei dieser Form der Transplantation fallen keine extramedullären Faktoren als Grund für eine verzögerte hämatologische Erholung ins Gewicht Knochenmarkbiopsien entnommen und ausgewertet. Als Vergleich diente ein Patientenkollektiv, welches durchweg ein normales Engraftment nach der autologen Stammzelltransplantation zeigte. Die Knochenmarkzellpopulation war vor der HZT bei allen Proben unauffällig, nach der Stammzelltransplantation waren in allen Proben z.t. schwere Schädigungen, wie z.b. retikuläre Ödeme oder eine massive Verringerung der Knochenmarkzellpopulation zu erkennen. Dies zeigt, dass das Maß der 88
89 Zerstörung der Knochenmarkstromazellen durch ein intensives Konditionierungsregime durchaus bei der Beobachtung der hämatopoetischen Regeneration zu beücksichtigen ist, da der Einfluss auf das Engraftment und die anschließende Differenzierung der hämatopoetischen Stammzellen durch die enge Interaktion mit dem Stromamilieu doch immens zu sein scheint (Torok-Storb, Holmberg, 1994). Dies wurde ebenfalls durch die Beobachtung verzögerter hämatopoetischer Erholung nach Stammzelltransplantationen mit vorausgehender Strahlentherapie oder Single-Hochdosischemotherapie, trotz vergleichbarer infundierter Menge von hämatopoetischen Stammzellen, aber auch durch Versuche in vitro gezeigt (Moreau et al, 2002). Des Weiteren konnte die Forschungsgruppe von Koc bei Patienten nach autologer HZT und zusätzlicher Gabe von mesenchymalen Stammzellen direkt nach der Transplantation eine sehr schnelle hämatologische Regenerierung nachweisen (Koc et al, 2000) Eigene Ergebnisse: In der vorliegenden Arbeit wurde die hämatopoetische Erholung (und damit das Engraftment) hinsichtlich des Wachstums der aus den Knochenmarkkulturen generierten Stromazellen untersucht. Damit eine genaue Aussage über die hämatopoetische Erholung gemacht werden konnte, wurde die Regeneration der einzelnen Zellarten in den verschieden konditionierten Gruppen separat analysiert. Es zeigte sich, dass die Leukozytenregeneration in keiner Gruppe signifikant verlangsamt oder beschleunigt war. Auch der Vergleich zwischen den Patienten, deren Kulturen Stromazellen generieren konnten und jenen, deren Knochenmarkkulturen kein Zellwachstum aufwiesen, konnte keine statistisch relevanten Unterschiede darstellen. Die gleichen Ergebnisse zeigten sich bei der Betrachtung der thrombozytären Regeneration nach der HZT. Auch hier konnten wir keine Unterschiede zwischen den verschiedenen Konditionierungsgruppen und den Patienten mit positiven, bzw. stromazellnegativen Kulturen ausmachen. Damit konnte die Fähigkeit des Knochenmarks, Stromazellen in vitro zu generieren keine Vorhersage über das Engraftment und die hämatopoetische Regeneration nach einer Stammzelltransplantation wagen. 89
90 Dieser Unterschied zu den Ergebnissen der bereits genannten Studien mag zum einen in der doch relativ geringen Proben-, bzw. Patientenanzahl liegen. Zum anderen haben wir eine Methode (in vitro Generierung von Knochenmarkstromazellen) benutzt, um die Charakteristik der Stromazellen des Knochenmark darzustellen, welche bezüglich der tatsächlichen Gegebenheiten in vivo, nämlich der Generierung von Knochenmarkstromazellen und der daraus resultierenden funktionellen Unterstützung des Engraftments und Differenzierung der hämatopoetischen Stammzellen, nicht vollständig übertragbar zu sein scheint. Für diese Untersuchung würden sich Zellkulturen nach dem Dexter-Typ wahrscheinlich besser eignen. In diesen Zellkulturen können in vitro Stromazellen generiert werden, wobei die hämatopoetischen Stammzellen in den Kulturen erhalten bleiben. Letztendlich gibt es weiterhin viele medulläre aber auch extramedulläre Faktoren, welche die Zellzahlen im peripheren Blut nach einer HZT variieren können. Daher wird durch diese Vielzahl an Variablen die Aussagekraft der Fähigkeit des Knochenmarks nach einer Konditionierung mit einem reduziertem Protokoll, oder einem myeloablativem Schema und anschließender HZT Stromazellen zu generieren im Hinblick auf die hämatopoetische Regeneration nach der HZT doch stark beeinflusst. 90
91 B: Chimärismusanalyse von Knochenmarkstromazellen nach allogener HZT 5.4 Nicht-hämatopoetischer Chimärismus Studien Eine große Anzahl verschiedener Studien hat sich in den letzten Jahren mit nichthämatopoetischem Chimärismus nach allogener HZT in vivo bei Tieren befasst. Es gelang z.b. der Nachweis von Spenderzellen in epithelialen Geweben, wie Leberparenchym (Lagasse et al, 2000; Krause et al, 2001; Vassilopoulos et al, 2003), Alveolarepithel (Krause et al, 2001; Theise et al, 2002), Nierenparenchym (Kale et al, 2003; Poulsom et al, 2001), aber auch in Stromazellen aus dem Knochenmark (Anklesaria et al, 1989). Auch beim Menschen existiert ein nicht-hämatopoetischer Chimärismus nach allogener hämatopoetischer Stammzelltransplantation. Anfänglich gab es einige Studien, die einen Chimärismus von epithelialem Gewebe nach einer HZT beschrieben (Alison et al, 2000; Theise et al, 2000b; Körbling et al, 2002; Okamoto et al, 2002). Allerdings wurden die Ergebnisse der Studien aufgrund methodologischer Einschränkungen mit Skepsis betrachtet, da nicht sicher ausgeschlossen werden konnte, ob die detektierten epithelialen Spenderzellen nicht wahrhaftig hämatopoetische Zellen waren, welche über die Zirkulation in epitheliales Gewebe eingedrungen waren und damit fehlinterpretiert wurden (Blau et al, 2001; Abkowitz, 2002; Herzog et al, 2003). Weitere Studien versuchten bei Patienten nach allogener Stammzelltransplantation bei Epithelzellen aus Mundabstrichen Spenderzellen zu detektieren, was eine wesentlich verlässlichere Methode darstellte, da man bei Mundabstrichen isolierte, morphologisch gut differenzierbare Zellen untersuchen kann (Spyridonidis et al, 2004b; Tran et al, 2003). Damit ist die Gefahr einer Fehlinterpretation von kontaminierenden hämatopoetischen Spenderzellen deutlich geringer. 91
92 Abbildung 15: Epithelialer Chimärismus im Mundabstrich einer Frau nach sex-mismatched HZT. Die zwei einzelnen Zellen aus einem Mundabstrich sind mit einer Immunhistochemie für Zytokeratin und FISH gefärbt. Ein detektiertes Y-Chromosom (rot) innerhalb des Zellkernes (blau) einer Zytokeratin + -Zelle (grün) ist mit einem Pfeil markiert. Bei der Generierung von Knochenmarkstromazellen in Langzeitkulturen können die Zellen ebenso gut morphologisch untersucht werden, da Stromazellen adhärent wachsen und somit gut differenzierbar sind Chimärismus von Knochenmarkstromazellen Bereits in den 80er Jahren wurde die Existenz des Chimärismus von Knochenmarkstromazellen nach einer Transplantation bei Mäusen nachgewiesen. Die Forschungsgruppe um Anklesaria konnte zeigen, dass nach einer Konditionierungstherapie infundierte humane und murine Stromazellen nicht nur ein komplettes Engraftment bewiesen, sondern auch ihre gesamte Funktion als Regulator der Hämatopoese im Empfängerorganismus entfalten konnten (Anklesaria et al, 1989). Anhand dieser Daten stellte sich nun die Frage, ob auch beim Menschen nach allogener hämatopoetischer Stammzelltransplantation Stromazellen aus dem Transplantat gebildet werden können. Es existierten vor, bzw. zu Beginn der Laborarbeit fünf Studien, welche über Y-Chromosom-Analysen bei sexmismatched transplantierten Patientinnen einen Chimärismus von Knochenmarkstromazellen nachzuweisen versuchten (Simmons et al, 1987; Laver et al, 1987; Agematsu, Nakahori, 1991; Koc et al, 1999; Awaya et al, 2002). Es konnten in keiner Arbeit Spenderzellen im Knochenmarkstroma nachgewiesen werden. 92
und mehr und mehr
 Modul 2 Aufgabe 1: Blutstammzellen 1. Todesursachen in der Schweiz (2010) In der folgenden Abbildung sind die häufigsten Todesursachen in der Schweiz für das Jahr 2010 aufgeführt, wie sie vom Bundesamt
Modul 2 Aufgabe 1: Blutstammzellen 1. Todesursachen in der Schweiz (2010) In der folgenden Abbildung sind die häufigsten Todesursachen in der Schweiz für das Jahr 2010 aufgeführt, wie sie vom Bundesamt
Reisen nach Hämopoietischer Stammzelltransplantation (HSCT) André Tichelli
 Reisen nach Hämopoietischer Stammzelltransplantation (HSCT) André Tichelli Reisen in Entwicklungsländer Wo ist das Problem? Risiko bei gesunden Personen Bestimmte Vorsichtsmassnahmen Prophylaktische Massnahmen
Reisen nach Hämopoietischer Stammzelltransplantation (HSCT) André Tichelli Reisen in Entwicklungsländer Wo ist das Problem? Risiko bei gesunden Personen Bestimmte Vorsichtsmassnahmen Prophylaktische Massnahmen
Einfluss der Lymphombehandlung auf das Blut. Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern
 Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einführung-2 Block Blut und Immunologie Teil Immunologie
 Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
DISSERTATION. Zur Erlangung des akademischen Grades Doctor medicinae (Dr. med.)
 1 Aus der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie und dem Institut für Medizinische Genetik der Medizinischen Fakultät Charité Universitätsmedizin Berlin DISSERTATION Chromosomale
1 Aus der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie und dem Institut für Medizinische Genetik der Medizinischen Fakultät Charité Universitätsmedizin Berlin DISSERTATION Chromosomale
Jiirgen Neumann. Immunbiologie. Eine Einfiihrung. Mit 124 Abbildungen. ^y Springer
 Jiirgen Neumann Immunbiologie Eine Einfiihrung Mit 124 Abbildungen ^y Springer 1 Das Immunsystem 1.1 Bedeutung des Immunsystems 1 1.2 Das Immunsystem unterscheidet zwischen korpereigen und korperfremd
Jiirgen Neumann Immunbiologie Eine Einfiihrung Mit 124 Abbildungen ^y Springer 1 Das Immunsystem 1.1 Bedeutung des Immunsystems 1 1.2 Das Immunsystem unterscheidet zwischen korpereigen und korperfremd
Inhalt 1 Das Immunsystem Rezeptoren des Immunsystems
 Inhalt 1 Das Immunsystem 1.1 Bedeutung des Immunsystems..................................... 1 1.2 Das Immunsystem unterscheidet zwischen körpereigen und körperfremd.................................................
Inhalt 1 Das Immunsystem 1.1 Bedeutung des Immunsystems..................................... 1 1.2 Das Immunsystem unterscheidet zwischen körpereigen und körperfremd.................................................
Fragen und Antworten zur hämatopoetischen Stammzelle
 Fragen und Antworten zur hämatopoetischen Stammzelle Grundlagen, Indikationen, therapeutischer Nutzen von Rainer Haas, Ralf Kronenwett 1. Auflage Fragen und Antworten zur hämatopoetischen Stammzelle Haas
Fragen und Antworten zur hämatopoetischen Stammzelle Grundlagen, Indikationen, therapeutischer Nutzen von Rainer Haas, Ralf Kronenwett 1. Auflage Fragen und Antworten zur hämatopoetischen Stammzelle Haas
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten
 Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
medialog Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung durch Verödung von Nierennerven Ausgabe 1/14
 Universitätsklinikum Halle (Saale) medialog zeitschrift des universitätsklinikums halle (saale) Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung durch Verödung
Universitätsklinikum Halle (Saale) medialog zeitschrift des universitätsklinikums halle (saale) Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung durch Verödung
Immunbiologie. Teil 3
 Teil 3 Haupthistokompatibilitätskomplex (1): - es gibt einen grundlegenden Unterschied, wie B-Lymphozyten und T-Lymphozyten ihr relevantes Antigen erkennen - B-Lymphozyten binden direkt an das komplette
Teil 3 Haupthistokompatibilitätskomplex (1): - es gibt einen grundlegenden Unterschied, wie B-Lymphozyten und T-Lymphozyten ihr relevantes Antigen erkennen - B-Lymphozyten binden direkt an das komplette
Deutsche Arbeitsgemeinschaft der Pflegenden KMT / SZT
 Donorlymphozyten adoptive Immuntherapie Deutsche Arbeitsgemeinschaft der Pflegenden KMT / SZT - 15.04.2011 Dr. med. Sebastian Theurich Einsatzmöglichkeiten von Donorlymphozyten- Infusionen nach allogener
Donorlymphozyten adoptive Immuntherapie Deutsche Arbeitsgemeinschaft der Pflegenden KMT / SZT - 15.04.2011 Dr. med. Sebastian Theurich Einsatzmöglichkeiten von Donorlymphozyten- Infusionen nach allogener
Hämatopoese TITAN. Dezember 2005 S.Gärtner
 Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
Transplantation von Stammzellen und soliden Organen einige Gemeinsamkeiten, viele Unterschiede
 Transplantation von Stammzellen und soliden Organen einige Gemeinsamkeiten, viele Unterschiede Martin Stern Abteilung Hämatologie/Departement Biomedizin Universitätsspital Basel Nomenklatur I Stammzelle
Transplantation von Stammzellen und soliden Organen einige Gemeinsamkeiten, viele Unterschiede Martin Stern Abteilung Hämatologie/Departement Biomedizin Universitätsspital Basel Nomenklatur I Stammzelle
Einfluss von Immunsuppressiva auf die antivirale T-Zellantwort ex vivo
 Aus der Universitätsklinik für Kinder- und Jugendmedizin Tübingen Abteilung Kinderheilkunde I mit Poliklinik Ärztlicher Direktor: Professor Dr. R. Handgretinger Einfluss von Immunsuppressiva auf die antivirale
Aus der Universitätsklinik für Kinder- und Jugendmedizin Tübingen Abteilung Kinderheilkunde I mit Poliklinik Ärztlicher Direktor: Professor Dr. R. Handgretinger Einfluss von Immunsuppressiva auf die antivirale
MECHANISMS INVOLVED IN ANTITHYMOCYTE GLOBULIN IMMUNOSUPPRESSIVE ACTIVITY IN A NONHUMAN PRIMATE MODEL
 MECHANISMS INVOLVED IN ANTITHYMOCYTE GLOBULIN IMMUNOSUPPRESSIVE ACTIVITY IN A NONHUMAN PRIMATE MODEL Preville, Xavier; Flacher, Monique; LeMauff, Brigitte; Beauchard, Sandrine; Davelu, Paul; Tiollier,
MECHANISMS INVOLVED IN ANTITHYMOCYTE GLOBULIN IMMUNOSUPPRESSIVE ACTIVITY IN A NONHUMAN PRIMATE MODEL Preville, Xavier; Flacher, Monique; LeMauff, Brigitte; Beauchard, Sandrine; Davelu, Paul; Tiollier,
Analyse der frühen Hämatopoese (PD Dr. rer. nat. Bernd Giebel)
 Analyse der frühen Hämatopoese (PD Dr. rer. nat. Bernd Giebel) Lernziele: Nachweisverfahren unterschiedlicher myeloischer Vorläuferzellen (Colony Forming Cell Assay) Das hämatopoetische System Das menschliche
Analyse der frühen Hämatopoese (PD Dr. rer. nat. Bernd Giebel) Lernziele: Nachweisverfahren unterschiedlicher myeloischer Vorläuferzellen (Colony Forming Cell Assay) Das hämatopoetische System Das menschliche
Inhaltsverzeichnis. 3j Stammzellquelle 24
 Inhaltsverzeichnis [TJ Entwicklung der Stammzeil-bzw. Knochenmarktransplantation 12 1.1. Bausteine der hämatopoetischen Stammzelltransplantation 12 2. '] Humanes Leukozyten-Antigen (HLA) 16 2.1. Antigen-Präsentation
Inhaltsverzeichnis [TJ Entwicklung der Stammzeil-bzw. Knochenmarktransplantation 12 1.1. Bausteine der hämatopoetischen Stammzelltransplantation 12 2. '] Humanes Leukozyten-Antigen (HLA) 16 2.1. Antigen-Präsentation
4.1. Dauer der Aplasie nach Hochdosis-Chemotherapie und Retransfusion
 4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
Unser Immunsystem verstehen Transplantation - rettet Leben!
 Unser Immunsystem verstehen Transplantation - rettet Leben! B-Transplantation-RZ-fin-2-A4.indd 1 23.05.17 15:19 B-Transplantation-RZ-fin-2-A4.indd 2 23.05.17 15:19 Transplantation - rettet Leben! Herausgeber:
Unser Immunsystem verstehen Transplantation - rettet Leben! B-Transplantation-RZ-fin-2-A4.indd 1 23.05.17 15:19 B-Transplantation-RZ-fin-2-A4.indd 2 23.05.17 15:19 Transplantation - rettet Leben! Herausgeber:
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 159 Basale Aufgabe
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 159 Basale Aufgabe
Medieninformation 30. Jänner 2019, Linz
 Medieninformation 30. Jänner 2019, Linz Weltkrebstag 2019: Neue Erkenntnisse und Forschungen in der Stammzelltransplantation Seit 25 Jahren werden am Ordensklinikum Linz Elisabethinen Stammzelltransplantationen
Medieninformation 30. Jänner 2019, Linz Weltkrebstag 2019: Neue Erkenntnisse und Forschungen in der Stammzelltransplantation Seit 25 Jahren werden am Ordensklinikum Linz Elisabethinen Stammzelltransplantationen
Mikroimmuntherapie. Mikroimmuntherapie
 Ein neues therapeutisches Konzept mit breitem Wirkungsspektrum verbindet in idealer Weise Schulmedizin und ganzheitliche Ansätze. Dank der Fortschritte der experimentellen und klinischen Immunologie kann
Ein neues therapeutisches Konzept mit breitem Wirkungsspektrum verbindet in idealer Weise Schulmedizin und ganzheitliche Ansätze. Dank der Fortschritte der experimentellen und klinischen Immunologie kann
Einführung, Zellen und Organe
 Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 Einführung, Zellen und Organe Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Stempel für Anwesenheit in der
Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 Einführung, Zellen und Organe Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Stempel für Anwesenheit in der
Gewinnung von Stammzellen. ES-Zellen werden aus frühen Embryonen im
 Gewinnung von Stammzellen ES-Zellen werden aus frühen Embryonen im Blastocystenstadium gewonnen Entnahme embryonaler Stammzellen Entwicklung eines menschlichen Embryos: Die früheste Differenzierung der
Gewinnung von Stammzellen ES-Zellen werden aus frühen Embryonen im Blastocystenstadium gewonnen Entnahme embryonaler Stammzellen Entwicklung eines menschlichen Embryos: Die früheste Differenzierung der
04a / Blutstammzellen. Blutstammzellen spenden und empfangen
 Blutstammzellen spenden und empfangen Wer kann sich als Blutstammzellspender registrieren lassen und somit potenzieller Spender werden? Als Spender können sich alle gesunden Personen im Alter von 18 55
Blutstammzellen spenden und empfangen Wer kann sich als Blutstammzellspender registrieren lassen und somit potenzieller Spender werden? Als Spender können sich alle gesunden Personen im Alter von 18 55
Hochdosistherapie mit Stammzellersatz : Grundlagen und Stellenwert des Verfahrens
 Hochdosistherapie mit Stammzellersatz : Grundlagen und Stellenwert des Verfahrens PD. Dr. D. Bunjes Abteilung Innere Medizin III Universitätsklinikum Ulm Therapieverfahren Hochdosistherapie mit autologer
Hochdosistherapie mit Stammzellersatz : Grundlagen und Stellenwert des Verfahrens PD. Dr. D. Bunjes Abteilung Innere Medizin III Universitätsklinikum Ulm Therapieverfahren Hochdosistherapie mit autologer
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
Inhaltsverzeichnis. KDL_Thalheimer_Haematologie.indb :45:27
 Inhaltsverzeichnis Vorwort 2018... 5 1 Allgemeine Kodierregeln...15 1.1 Definition der Hauptdiagnose...15 1.2 Definition der Nebendiagnose...17 1.3 Prozeduren...21 1.4 Allgemeiner Prüfalgorithmus...22
Inhaltsverzeichnis Vorwort 2018... 5 1 Allgemeine Kodierregeln...15 1.1 Definition der Hauptdiagnose...15 1.2 Definition der Nebendiagnose...17 1.3 Prozeduren...21 1.4 Allgemeiner Prüfalgorithmus...22
Transplantation von Blut-Stammzellen
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Öffentliche Gesundheit Faktenblatt Januar 2017 Transplantation von Blut-Stammzellen 1 Geschichte Zwei bahnbrechende
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Öffentliche Gesundheit Faktenblatt Januar 2017 Transplantation von Blut-Stammzellen 1 Geschichte Zwei bahnbrechende
Chronische lymphatische Leukämie (CLL)
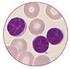 Chronische lymphatische Leukämie (CLL) Peter Dreger Medizinische Klinik V Universitätsklinikum Heidelberg 9/2005 CLL: Entstehung Neu auftretender "Programmfehler" im genetischen Programm einer B-Abwehrzelle
Chronische lymphatische Leukämie (CLL) Peter Dreger Medizinische Klinik V Universitätsklinikum Heidelberg 9/2005 CLL: Entstehung Neu auftretender "Programmfehler" im genetischen Programm einer B-Abwehrzelle
1. Welche Aussagen zum Immunsystem sind richtig?
 1. Welche Aussagen zum Immunsystem sind richtig? a) Das Immunsystem wehrt körperfremde Substanzen ab b) Die Elimination maligne entarteter Zellen gehört nicht zu den Aufgaben des Immunsystems c) Das Immunsystem
1. Welche Aussagen zum Immunsystem sind richtig? a) Das Immunsystem wehrt körperfremde Substanzen ab b) Die Elimination maligne entarteter Zellen gehört nicht zu den Aufgaben des Immunsystems c) Das Immunsystem
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Über die Diagnose und Therapie von Blutkrankheiten. Neues über die Graft-versus-Host-Krankheit (GvHD)
 Über die Diagnose und Therapie von Blutkrankheiten Mai 2017 Catherine Nissen Neues über die Graft-versus-Host-Krankheit (GvHD) Was kann GvHD verursachen? Bisher unerkannte Gewebsmerkmale Wenn nach einer
Über die Diagnose und Therapie von Blutkrankheiten Mai 2017 Catherine Nissen Neues über die Graft-versus-Host-Krankheit (GvHD) Was kann GvHD verursachen? Bisher unerkannte Gewebsmerkmale Wenn nach einer
Transplantationstoleranz Wo stehen wir? Yakup Tanriver Klinik Innere Medizin IV Nephrologie und Allgemeinmedizin Universitätsklinikum Freiburg
 Transplantationstoleranz Wo stehen wir? Yakup Tanriver Klinik Innere Medizin IV Nephrologie und Allgemeinmedizin Universitätsklinikum Freiburg Inhalte T Zell Aktivierung Direkte und Indirekte Allo-Antigenerkennung
Transplantationstoleranz Wo stehen wir? Yakup Tanriver Klinik Innere Medizin IV Nephrologie und Allgemeinmedizin Universitätsklinikum Freiburg Inhalte T Zell Aktivierung Direkte und Indirekte Allo-Antigenerkennung
Die Entwicklung von B Lymphozyten
 Die Entwicklung von B Lymphozyten Die Entwicklung von B Lymphozyten Übersicht Gliederung I II III IV Stammzellen im Knochenmark VDJ Rekombination Positive Selektion Negative Selektion I Stammzellen im
Die Entwicklung von B Lymphozyten Die Entwicklung von B Lymphozyten Übersicht Gliederung I II III IV Stammzellen im Knochenmark VDJ Rekombination Positive Selektion Negative Selektion I Stammzellen im
Stroma des roten Knochenmarks und der lymphatischen Organe. Zellen stehen über lange Fortsätze miteinander in Kontakt
 Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
Allogene Stammzelltransplantation bei MDS. PD Dr. Christof Scheid Klinik I für Innere Medizin Uniklinik Köln
 Allogene Stammzelltransplantation bei MDS PD Dr. Christof Scheid Klinik I für Innere Medizin Uniklinik Köln (Hochdosis)chemotherapie/ Konditionierung -Aplasiogen -Myeloablativ Autologe Stammzelltransplantation
Allogene Stammzelltransplantation bei MDS PD Dr. Christof Scheid Klinik I für Innere Medizin Uniklinik Köln (Hochdosis)chemotherapie/ Konditionierung -Aplasiogen -Myeloablativ Autologe Stammzelltransplantation
Charakterisierung von CD25+ regulatorischen T Zellen
 Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 142 Basale Aufgabe
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 142 Basale Aufgabe
Experimentelle Embryologie I
 Embryonale Stammzellen Totipotente Zellen nicht determiniert Pluripotente Zellen determiniert, aber nicht differenziert Gewinnung der Stammzellen: Möglichkeit A: im Blastozystenstadium nach dem Schlupf
Embryonale Stammzellen Totipotente Zellen nicht determiniert Pluripotente Zellen determiniert, aber nicht differenziert Gewinnung der Stammzellen: Möglichkeit A: im Blastozystenstadium nach dem Schlupf
Das Österreichische Stammzellregister und seine Aufgaben:
 1 Österreichische Knochenmarkspendezentrale FONDS ÖSTERREICHISCHES STAMZELLREGISTER Florianigasse 38/12 A - 1080 Wien, Austria, Europe Tel.: +43-1 403 71 93 Fax.: +43-1 408 23 21 DVR.Nr.: 5111415 Das Österreichische
1 Österreichische Knochenmarkspendezentrale FONDS ÖSTERREICHISCHES STAMZELLREGISTER Florianigasse 38/12 A - 1080 Wien, Austria, Europe Tel.: +43-1 403 71 93 Fax.: +43-1 408 23 21 DVR.Nr.: 5111415 Das Österreichische
Bestandteile des Immunsystems
 Das Immunsystem des Menschen ist eines der wichtigsten Systeme des menschlichen Körpers, denn mit einem defekten Immunsystem führen viele Erkrankungen durch Keime unweigerlich zum Tod, weil der Körper
Das Immunsystem des Menschen ist eines der wichtigsten Systeme des menschlichen Körpers, denn mit einem defekten Immunsystem führen viele Erkrankungen durch Keime unweigerlich zum Tod, weil der Körper
Was gibt es Neues zur Stammzelltransplantation. E Holler Klinik f Innere Medizin III Klinikum der Universität Regensburg
 Was gibt es Neues zur Stammzelltransplantation E Holler Klinik f Innere Medizin III Klinikum der Universität Regensburg Themen Aktuelle Entwicklungen der Indikationen: Fortschritte generell? Neue allogene
Was gibt es Neues zur Stammzelltransplantation E Holler Klinik f Innere Medizin III Klinikum der Universität Regensburg Themen Aktuelle Entwicklungen der Indikationen: Fortschritte generell? Neue allogene
Frage 1: Wo liegt der Ursprung der somatischen Stammzellen?
 1 2.Doppelstunde 19.10.2016 ESF II/6 WS2016/17 Frage 1: Wo liegt der Ursprung der somatischen Stammzellen? Frage 1: Wo liegt der Ursprung der somatischen Stammzellen? 1.1. Was ist eine Stammzelle? Hypothese:
1 2.Doppelstunde 19.10.2016 ESF II/6 WS2016/17 Frage 1: Wo liegt der Ursprung der somatischen Stammzellen? Frage 1: Wo liegt der Ursprung der somatischen Stammzellen? 1.1. Was ist eine Stammzelle? Hypothese:
Graft-versus-Host-Erkrankung: Neutrophile sind nicht neutral
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/graft-versus-hosterkrankung-neutrophile-sind-nicht-neutral/ Graft-versus-Host-Erkrankung: Neutrophile sind nicht
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/graft-versus-hosterkrankung-neutrophile-sind-nicht-neutral/ Graft-versus-Host-Erkrankung: Neutrophile sind nicht
XIX. Onkologische Fachtagung für medizinische Berufe. Immuntherapie
 XIX. Onkologische Fachtagung für medizinische Berufe Berlin, 13.05.2016 Immuntherapie Dr. Christian Jakob Imperial College, NHS Trust Centre for Clinical and Experimental Haematology Hammersmith Hospital
XIX. Onkologische Fachtagung für medizinische Berufe Berlin, 13.05.2016 Immuntherapie Dr. Christian Jakob Imperial College, NHS Trust Centre for Clinical and Experimental Haematology Hammersmith Hospital
Gewebeprotektive Eigenschaften von. lnterleukin-22 in der Leber
 Gewebeprotektive Eigenschaften von lnterleukin-22 in der Leber Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann
Gewebeprotektive Eigenschaften von lnterleukin-22 in der Leber Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann
Veränderungen des Immunsystems im Alter
 Veränderungen des Immunsystems im Alter Prof. Ulrich Sack Institut für Klinische Immunologie und Transfusionsmedizin Universitätsklinikum Leipzig Immunseneszenz Altersabhängige Restrukturierung nahezu
Veränderungen des Immunsystems im Alter Prof. Ulrich Sack Institut für Klinische Immunologie und Transfusionsmedizin Universitätsklinikum Leipzig Immunseneszenz Altersabhängige Restrukturierung nahezu
Neue Behandlungsmethode bei Leukämie
 Medieninformation, 15. April 2013, Linz Ganzkörperbestrahlung mit geringen Nebenwirkungen Neue Behandlungsmethode bei Leukämie Erstmals in Österreich ist ein an Leukämie erkrankter Patient mit einer neuartigen
Medieninformation, 15. April 2013, Linz Ganzkörperbestrahlung mit geringen Nebenwirkungen Neue Behandlungsmethode bei Leukämie Erstmals in Österreich ist ein an Leukämie erkrankter Patient mit einer neuartigen
Stammzellen besitzen 2 Hauptcharaktereigenschaften: Quellen von pluripotenten Stammzellen:
 Stammzellen besitzen 2 Hauptcharaktereigenschaften: - langfristiger Selbstaufbau - produzieren viele verschiedene Arten von differenzierten Zellen Quellen von pluripotenten Stammzellen: -innere Zellmasse
Stammzellen besitzen 2 Hauptcharaktereigenschaften: - langfristiger Selbstaufbau - produzieren viele verschiedene Arten von differenzierten Zellen Quellen von pluripotenten Stammzellen: -innere Zellmasse
Entzündung. Teil 18.
 Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
STAMMZELLEN. Therapie der Zukunft?
 STAMMZELLEN Therapie der Zukunft? WAS SIND STAMMZELLEN? Ausgangszellen für die Bildung aller Gewebe und Organe, aus denen ein Lebewesen besteht Charakteristische Merkmale (Unterscheidung von anderen Zellen)
STAMMZELLEN Therapie der Zukunft? WAS SIND STAMMZELLEN? Ausgangszellen für die Bildung aller Gewebe und Organe, aus denen ein Lebewesen besteht Charakteristische Merkmale (Unterscheidung von anderen Zellen)
III. Ergebnisteil CD8 CD4. III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut
 27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
Stammzelltransplantation
 Cornelie Haag Medizinische Klinik und Poliklinik 1 Universitätsklinikum Carl-Gustav-Carus Dresden 1 Klinische Einteilung - Begriffsbestimmung Autologe Quelle: Patient selbst KM oder peripheres Blut (Apherese)
Cornelie Haag Medizinische Klinik und Poliklinik 1 Universitätsklinikum Carl-Gustav-Carus Dresden 1 Klinische Einteilung - Begriffsbestimmung Autologe Quelle: Patient selbst KM oder peripheres Blut (Apherese)
INHALTSVERZEICHNIS.
 INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Geschichte der Nierentransplantation 1 1.2. Geschichte von Ciclosporin 3 1.3. Nomenklatur von Ciclosporin ' 4 1.4. Ciclosporin: chemische Struktur, physikalische
INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Geschichte der Nierentransplantation 1 1.2. Geschichte von Ciclosporin 3 1.3. Nomenklatur von Ciclosporin ' 4 1.4. Ciclosporin: chemische Struktur, physikalische
Stammzellenforschung Karina Köppl LK Biologie
 Stammzellenforschung Karina Köppl LK Biologie 1.Was sind Stammzellen? Reparaturreserve des Körpers undifferenzierte Zellen von Menschen und Tieren Stammzellen sind in der Lage, sich zu teilen und neue
Stammzellenforschung Karina Köppl LK Biologie 1.Was sind Stammzellen? Reparaturreserve des Körpers undifferenzierte Zellen von Menschen und Tieren Stammzellen sind in der Lage, sich zu teilen und neue
Grundlagen der Immunologie
 Grundlagen der Immunologie 9. Vorlesung Die zentrale (thymische) T-Zell-Entwicklung Alle Blutzellen stammen von der multipotenten hämatopoetischen Stammzelle des Knochenmarks Figure 1-3 Zentrale Lymphozytenentwicklung
Grundlagen der Immunologie 9. Vorlesung Die zentrale (thymische) T-Zell-Entwicklung Alle Blutzellen stammen von der multipotenten hämatopoetischen Stammzelle des Knochenmarks Figure 1-3 Zentrale Lymphozytenentwicklung
W e n n H e r z z e l l e n h ö h e r s c h l a g e n
 EINSICHTEN 2010 N E W S L E T T E R 0 3 l e b e n s w i s s e n s c h a f t e n S u s a n n e W e d l i c h W e n n H e r z z e l l e n h ö h e r s c h l a g e n Stammzellen sind als Forschungsobjekt umstritten:
EINSICHTEN 2010 N E W S L E T T E R 0 3 l e b e n s w i s s e n s c h a f t e n S u s a n n e W e d l i c h W e n n H e r z z e l l e n h ö h e r s c h l a g e n Stammzellen sind als Forschungsobjekt umstritten:
Immunbiologie. Teil 4
 Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
Inaugural-Dissertation zur Erlangung der medizinischen Doktorwürde an der Charité - Universitätsmedizin Berlin
 Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Medizinischen Klinik III Direktor: Prof. Dr. med. Eckhard Thiel Unterschiede in der T-Zell-Immunität gegen die Tumorantigene EpCAM,
Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Medizinischen Klinik III Direktor: Prof. Dr. med. Eckhard Thiel Unterschiede in der T-Zell-Immunität gegen die Tumorantigene EpCAM,
Leukämie. weißes Blut, Blutkrebs. bösartige Erkrankung der weißen Blutkörperchen
 Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
INAUGURAL- DISSERTATION
 Aus der Medizinischen Universitätsklinik Abteilung Innere Medizin I der Albert- Ludwigs- Universität Freiburg im Breisgau Analyse zu epithelialem Chimärismus an humanen Kolonbiopsien nach allogener hämatopoetischer
Aus der Medizinischen Universitätsklinik Abteilung Innere Medizin I der Albert- Ludwigs- Universität Freiburg im Breisgau Analyse zu epithelialem Chimärismus an humanen Kolonbiopsien nach allogener hämatopoetischer
in vivo -- Das Magazin der Deutschen Krebshilfe vom
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 11.11.2008 Expertengespräch zum Thema Leberkrebs Und zu diesem Thema begrüße ich jetzt Prof. Dr. Michael Manns, Direktor der Klinik für Gastroenterologie,
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 11.11.2008 Expertengespräch zum Thema Leberkrebs Und zu diesem Thema begrüße ich jetzt Prof. Dr. Michael Manns, Direktor der Klinik für Gastroenterologie,
in vivo -- Das Magazin der Deutschen Krebshilfe vom
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 10.03.2009 Expertengespräch zum Thema Plasmozytom Wir haben ihn eben schon im Film gesehen zusammen mit Wolfgang S., heute ist er hier: Prof.
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 10.03.2009 Expertengespräch zum Thema Plasmozytom Wir haben ihn eben schon im Film gesehen zusammen mit Wolfgang S., heute ist er hier: Prof.
medialog Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung durch Verödung von Nierennerven Ausgabe 1/14
 Ausgabe 1/14 Universitätsklinikum Halle (Saale) medialog zeitschrift des universitätsklinikums halle (saale) Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung
Ausgabe 1/14 Universitätsklinikum Halle (Saale) medialog zeitschrift des universitätsklinikums halle (saale) Urologie Da Vinci: Verbindung zwischen Tradition und Moderne Innere Medizin Blutdrucksenkung
Prävention, was ist das? Zur Prävention gehören:
 Prävention, was ist das? Im engeren Sinne der Praxis-Hygiene verstehen wir unter Prävention vorbeugende Maßnahmen zur Verhinderung von Krankheiten. Zur Prävention gehören: Aufklärung über gesunde Lebensführung
Prävention, was ist das? Im engeren Sinne der Praxis-Hygiene verstehen wir unter Prävention vorbeugende Maßnahmen zur Verhinderung von Krankheiten. Zur Prävention gehören: Aufklärung über gesunde Lebensführung
Basale Aufgabe eines Immunsystems
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
Angeborene und erworbene Immunantwort
 Molekulare Mechanismen der Pathogenese bei Infektionskrankheiten Angeborene und erworbene Immunantwort Hans-Georg Kräusslich Abteilung Virologie, Hygiene Institut INF 324, 4.OG http://www.virology-heidelberg.de
Molekulare Mechanismen der Pathogenese bei Infektionskrankheiten Angeborene und erworbene Immunantwort Hans-Georg Kräusslich Abteilung Virologie, Hygiene Institut INF 324, 4.OG http://www.virology-heidelberg.de
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Einführung in die Immunbiologie. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Einführung in die Immunbiologie Das komplette Material finden Sie hier: School-Scout.de S 2 M 2 Das Immunsystem eine Übersicht Das
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Einführung in die Immunbiologie Das komplette Material finden Sie hier: School-Scout.de S 2 M 2 Das Immunsystem eine Übersicht Das
Immuntherapie eine Hoffnung? Adrian Ochsenbein Inselspital / Bern University Hospital
 Immuntherapie eine Hoffnung? Inselspital / Bern University Hospital 23.11.2017 Übersicht unser Immunsystem und Krebs Immuntherapie Antikörpertherapie T Zell Therapie Immune Checkpoint Modulation Impfungen
Immuntherapie eine Hoffnung? Inselspital / Bern University Hospital 23.11.2017 Übersicht unser Immunsystem und Krebs Immuntherapie Antikörpertherapie T Zell Therapie Immune Checkpoint Modulation Impfungen
Immundefizienz-Virus bei Mensch bzw. Katze. - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und
 HIV- SIV FIV Allgemeines (1): - es muß unterschieden werden zwischen - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und - der Ausbildung eines manifesten Krankheits- Syndroms, das
HIV- SIV FIV Allgemeines (1): - es muß unterschieden werden zwischen - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und - der Ausbildung eines manifesten Krankheits- Syndroms, das
Lymphome bei Patienten mit Sjögren-Syndrom
 Lymphome bei Patienten mit Sjögren-Syndrom Puchtler 5/2014 25.05.2014 0 Zusammensetzung des Blutes Rote Blutkörperchen (Erythrozyten) Blutplättchen (Thrombozyten) Weiße Blutkörperchen (Leukozyten) - Granulozyten
Lymphome bei Patienten mit Sjögren-Syndrom Puchtler 5/2014 25.05.2014 0 Zusammensetzung des Blutes Rote Blutkörperchen (Erythrozyten) Blutplättchen (Thrombozyten) Weiße Blutkörperchen (Leukozyten) - Granulozyten
Betrachtung der Organkonstruktion aus eigenen Zellen aus ethischer Sicht. Pfr. Dr. Roland Graf
 Betrachtung der Organkonstruktion aus eigenen Zellen aus ethischer Sicht Pfr. Dr. Roland Graf Ethisch akzeptable Quellen: adulte Stammzellen induzierte pluripotente Stammzellen Ethisch nicht akzeptabel:
Betrachtung der Organkonstruktion aus eigenen Zellen aus ethischer Sicht Pfr. Dr. Roland Graf Ethisch akzeptable Quellen: adulte Stammzellen induzierte pluripotente Stammzellen Ethisch nicht akzeptabel:
Stammzellen. Therapie der Zukunft?
 Stammzellen Therapie der Zukunft? Was sind Stammzellen? Embryo, aus embryonalen Stammzellen bestehend Stammzellen sind Ausgangszellen für die Bildung aller Gewebe und Organe, aus denen ein Lebewesen besteht
Stammzellen Therapie der Zukunft? Was sind Stammzellen? Embryo, aus embryonalen Stammzellen bestehend Stammzellen sind Ausgangszellen für die Bildung aller Gewebe und Organe, aus denen ein Lebewesen besteht
in vivo -- Das Magazin der Deutschen Krebshilfe vom
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 15.12.2009 Expertengespräch zum Thema Leukämie Dr. Karl-Anton Kreuzer ist heute bei uns. Schön, dass Sie zu uns gekommen sind. Schönen guten
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 15.12.2009 Expertengespräch zum Thema Leukämie Dr. Karl-Anton Kreuzer ist heute bei uns. Schön, dass Sie zu uns gekommen sind. Schönen guten
Innovatives Heilungskonzept ohne Nebenwirkungen
 EPO in der Wundtherapie Innovatives Heilungskonzept ohne Nebenwirkungen Hannover (24. März 2010) - Wissenschaftlern der Medizinischen Hochschule Hannover (MHH) ist es gelungen, mit dem körpereigenen Hormon
EPO in der Wundtherapie Innovatives Heilungskonzept ohne Nebenwirkungen Hannover (24. März 2010) - Wissenschaftlern der Medizinischen Hochschule Hannover (MHH) ist es gelungen, mit dem körpereigenen Hormon
Originalien. Medizinische Klinik I Universitätsklinikum TU Dresden. Zusammenfassung:
 U. Platzbecker, G. Ehninger und M. Bornhäuser Neue Konzepte in der allogenen Blutstammzelltransplantation Medizinische Klinik I Universitätsklinikum TU Dresden Zusammenfassung: Die allogene Blutstammzelltransplantation
U. Platzbecker, G. Ehninger und M. Bornhäuser Neue Konzepte in der allogenen Blutstammzelltransplantation Medizinische Klinik I Universitätsklinikum TU Dresden Zusammenfassung: Die allogene Blutstammzelltransplantation
Informationsbroschüre zur ABO-inkompatiblen Nierenlebend-Transplantation am Transplantationszentrum Freiburg
 Informationsbroschüre zur -inkompatiblen Nierenlebend-Transplantation am Transplantationszentrum Freiburg Das Freiburger Transplantationszentrum hat eine lange Erfahrung in der Durchführung von Nierenlebend-Transplantationen.
Informationsbroschüre zur -inkompatiblen Nierenlebend-Transplantation am Transplantationszentrum Freiburg Das Freiburger Transplantationszentrum hat eine lange Erfahrung in der Durchführung von Nierenlebend-Transplantationen.
Immunologie für Einsteiger AKADEMISCHER VERLAG
 Lothar Rink Andrea Kruse Hajo Haase Immunologie für Einsteiger AKADEMISCHER VERLAG Inhaltsverzeichnis Vorwort VII 3.3 Zelluläre Komponenten 48 Granulocyten 48 Mastzellen 52 1 Das Immunsystem: eine Übersicht
Lothar Rink Andrea Kruse Hajo Haase Immunologie für Einsteiger AKADEMISCHER VERLAG Inhaltsverzeichnis Vorwort VII 3.3 Zelluläre Komponenten 48 Granulocyten 48 Mastzellen 52 1 Das Immunsystem: eine Übersicht
Leukämien. Ursachen. Symptome. Diagnose. Behandlung. Heilungschancen. Eine Information der Krebsliga
 Leukämien Ursachen Symptome Diagnose Behandlung Heilungschancen Eine Information der Krebsliga Leukä mien Leukämien sind bösartige Erkrankungen blutbildender Zellen. In der Umgangssprache wird dieser Krebs
Leukämien Ursachen Symptome Diagnose Behandlung Heilungschancen Eine Information der Krebsliga Leukä mien Leukämien sind bösartige Erkrankungen blutbildender Zellen. In der Umgangssprache wird dieser Krebs
Frauen mit Brustkrebs könnten von einer autologen Stammzelltransplantation profitieren
 Frauen mit Brustkrebs könnten von einer autologen Stammzelltransplantation profitieren IQWiG findet Belege für längeres ereignisfreies Überleben aber auch Hinweise auf schwerwiegende Komplikationen Berlin
Frauen mit Brustkrebs könnten von einer autologen Stammzelltransplantation profitieren IQWiG findet Belege für längeres ereignisfreies Überleben aber auch Hinweise auf schwerwiegende Komplikationen Berlin
Akute Leukämien und das Myelodysplastische Syndrom
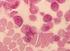 Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
22. Onkologisches Symposium Große Fortschritte in der Leukämietherapie
 22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
Herztransplanation erste erfolgreiche kurative Herztransplantation am Menschen am 3. Dezember 1967 Christiaan Barnard im Groote Schuur Hospital in Kap
 HERZTRANSPLANTATION Herztransplanation erste erfolgreiche kurative Herztransplantation am Menschen am 3. Dezember 1967 Christiaan Barnard im Groote Schuur Hospital in Kapstadt. 1968 transplantierte Norman
HERZTRANSPLANTATION Herztransplanation erste erfolgreiche kurative Herztransplantation am Menschen am 3. Dezember 1967 Christiaan Barnard im Groote Schuur Hospital in Kapstadt. 1968 transplantierte Norman
Einfluss des HLA Match auf die Langzeitprognose von Korneatransplantaten 1
 Aus der Augenklinik und Poliklinik der Charité Universitätsmedizin Berlin, Campus Benjamin Franklin Leiter: Prof. Dr. M. Foerster Einfluss des HLA Match auf die Langzeitprognose von Korneatransplantaten
Aus der Augenklinik und Poliklinik der Charité Universitätsmedizin Berlin, Campus Benjamin Franklin Leiter: Prof. Dr. M. Foerster Einfluss des HLA Match auf die Langzeitprognose von Korneatransplantaten
Zusammenfassung...1. Abstract...3
 INHALTSVERZEICHNIS Zusammenfassung...1 Abstract...3 1 Einleitung...4 1.1 Die Leber...4 1.1.1 Funktion der Leber...4 1.1.2 Mikroanatomie der Leber...5 1.1.3 LSEC...6 1.1.4 Hepatozyten...6 1.1.5 Effektorfunktionen
INHALTSVERZEICHNIS Zusammenfassung...1 Abstract...3 1 Einleitung...4 1.1 Die Leber...4 1.1.1 Funktion der Leber...4 1.1.2 Mikroanatomie der Leber...5 1.1.3 LSEC...6 1.1.4 Hepatozyten...6 1.1.5 Effektorfunktionen
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Blutzellen: Übersicht. Erythrozyten: Zahl und Form. Erythropoiese. Erythrozyten: Verformbarkeit
 Blutzellen: Übersicht Erythrozyten: Zahl und Form >99% der Blutzellen :4.8*10 12 ; : 5.3*10 12 /Liter Hauptinhaltsstoff: H 2 O und Hämoglobin Form: kernlos bikonkav Oberflächenvergrößerung Erythropoiese
Blutzellen: Übersicht Erythrozyten: Zahl und Form >99% der Blutzellen :4.8*10 12 ; : 5.3*10 12 /Liter Hauptinhaltsstoff: H 2 O und Hämoglobin Form: kernlos bikonkav Oberflächenvergrößerung Erythropoiese
Informationsbroschüre HLA-Typisierung
 Informationsbroschüre HLA-Typisierung Stammzellspender oder Spender von Blutplättchen Informationsbroschüre HLA-Typisierung Einleitung 3 Warum eine Stammzelltransplantation? 3 Warum Blutplättchenspender?
Informationsbroschüre HLA-Typisierung Stammzellspender oder Spender von Blutplättchen Informationsbroschüre HLA-Typisierung Einleitung 3 Warum eine Stammzelltransplantation? 3 Warum Blutplättchenspender?
Matthias Birnstiel. Allergien. Modul. Medizinisch wissenschaftlicher Lehrgang CHRISANA. Wissenschaftliche Lehrmittel, Medien, Aus- und Weiterbildung
 Matthias Birnstiel Modul Allergien Medizinisch wissenschaftlicher Lehrgang CHRISANA Wissenschaftliche Lehrmittel, Medien, Aus- und Weiterbildung Inhaltsverzeichnis des Moduls Allergien Immunsystem und
Matthias Birnstiel Modul Allergien Medizinisch wissenschaftlicher Lehrgang CHRISANA Wissenschaftliche Lehrmittel, Medien, Aus- und Weiterbildung Inhaltsverzeichnis des Moduls Allergien Immunsystem und
Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt
 Vaskulitiden wenn Blutgefäße sich entzünden Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt Hamburg (24. August 2010) - Fieber, Nachtschweiß und Gewichtsverlust, rheumatische Beschwerden
Vaskulitiden wenn Blutgefäße sich entzünden Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt Hamburg (24. August 2010) - Fieber, Nachtschweiß und Gewichtsverlust, rheumatische Beschwerden
Inhaltsverzeichnis. KDL_Haematologie.indb 9 26.01.2015 15:20:42
 Inhaltsverzeichnis Vorwort 2015...5 1 Allgemeine Kodierregeln...15 1.1 Definition der Hauptdiagnose...15 1.2 Definition der Nebendiagnose...17 1.3 Prozeduren...20 1.4 Allgemeiner Prüfalgorithmus...20 1.5
Inhaltsverzeichnis Vorwort 2015...5 1 Allgemeine Kodierregeln...15 1.1 Definition der Hauptdiagnose...15 1.2 Definition der Nebendiagnose...17 1.3 Prozeduren...20 1.4 Allgemeiner Prüfalgorithmus...20 1.5
Zertifizierungen in der Onkologie. William H. Krüger
 Zertifizierungen in der Onkologie William H. Krüger JACIE Joint Accreditation Committee - ISCT & EBMT 1998 International Society of Cellular Therapy European Group for Blood and Marrow Transplantation
Zertifizierungen in der Onkologie William H. Krüger JACIE Joint Accreditation Committee - ISCT & EBMT 1998 International Society of Cellular Therapy European Group for Blood and Marrow Transplantation
Bedeutung der metabolischen Azidose für den Verlauf der renalen Osteopathie bei Hämodialysepatienten.
 Aus der Universitätsklinik und Poliklinik für Innere Medizin II der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Osten) Bedeutung der metabolischen Azidose für den Verlauf der renalen
Aus der Universitätsklinik und Poliklinik für Innere Medizin II der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Osten) Bedeutung der metabolischen Azidose für den Verlauf der renalen
Hygiene Medical Advice Medizinische Beratung Dr. Helmut Pailer
 Hygiene 2010-2011 Seminarleiter www.medical-advice.at Ärztlicher Dienst der Steiermärkischen Gebietskrankenkasse +43664 4201946 Email: helmut.pailer@a1.net Unspezifische und Spezifische Abwehr DAS IMMUNSYSTEM
Hygiene 2010-2011 Seminarleiter www.medical-advice.at Ärztlicher Dienst der Steiermärkischen Gebietskrankenkasse +43664 4201946 Email: helmut.pailer@a1.net Unspezifische und Spezifische Abwehr DAS IMMUNSYSTEM
Leukämie (CML) Was ist Chronische Myeloische Leukämie? Download. Published on Novartis Austria (https://www.novartis.at)
 Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
