Grundlagen der Physik 2 Schwingungen und Wärmelehre
|
|
|
- Heike Kohler
- vor 7 Jahren
- Abrufe
Transkript
1 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
2 Klausur Die Klausur ndet am 26. Juli 2007 von 9:00-11:00 im Hörsaal H2 (eventuell auch H14) statt 1. Hilfsmittel: 6 Seiten (3 Blätter) A4 von eigener Hand beschrieben, Taschenrechner. Bemerkung: Diese Klausurnote kann zur Befreiung der Studiengebührenzahlung führen! 1 Klausur Grundlagen 1 wird am am Nachmittag geschrieben. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
3 Externe Parameter Externe Parameter und die Anzahl Zustände In der Physik heisst die Grösse E i x j = X j, i die zur Variablen x j konjugierte verallgemeinerte Kraft. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
4 Externe Parameter Externe Parameter Mit Y = E i x erhalten wir die Beziehung Ei Y = = X x Die dazugehörige Arbeit δw i ist allgemein so deniert (Gleichung für totale Dierentiale): δw de i = α X α, i x α Variable die Distanz x das Volumen V die Oberäche A verallgemeinerte Kraft die normale Kraft F der Druck p die Oberächenspannung σ S Tabelle: Beispiele für verallgemeinerte Kräfte Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
5 Externe Parameter Externe Parameter Wie ändert sich nun Ω (E, x) wenn x nach x + δx ändert? σ(e) ist nach der Denition in der Gleichung für den Zustandswechsel die Zahl der Moleküle Ω(E, x) von unterhalb E nach oberhalb E wechselt. Die Grösse dx nimmt x zu, weil σ(e) Zustände hinzukommen und σ(e + δe) Zustände wegfallen. und damit Ω (E, x) dx = σ (E) σ (E + δe) = σ x E δe dσ dx = Ω (E, x) δe Y Ω (E, x) dx = σ x E δe = [ Ω (E, x) E δe Y dx = [Ω (E, x) Y ] dx E Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24 ] δe
6 Externe Parameter Externe Parameter dx kommt auf beiden Seiten der Gleichung vor und kann deshalb gekürzt werden. Ω (E, x) x = [Ω (E, x) Y ] E Ω (E, x) = E Y Ω (E, x) Y E Wir teilen beide Seiten durch Ω (E, x) und bekommen 1 Ω (E, x) = 1 Ω (E, x) Y Y Ω (E, x) x Ω (E, x) E E Diese Gleichung ist äquivalent zu ln Ω (E, x) x ln Ω (E, x) = Y Y E E Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
7 Externe Parameter Externe Parameter Wenn Ω E f ist, ist der erste Summand ln Ω E Y f Y. Den zweiten E Summanden kann man abschätzen, wenn man die Ableitung Y durch die E Steigung der Gerade zum Nullpunkt Y ersetzt. Dann ist der erste E Summand auf der rechten Seite der Gleichung für grosse Systeme (f 1) um den Faktor f grösser als der zweite Summand. Der zweite Summand Y Ω kann deshalb vernachlässigt werden. Mit β(e) = und Gleichung E E (4) bekommt man ln Ω x = ln Ω E Y = β Y = β X Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
8 Externe Parameter Beispiele Externe Parameter Wir setzen x = V ln Ω x = ln Ω V = Ω ln U U V p = β p = kt da ja nach dem 1. Hauptsatz für die innere Energie gilt du = δq pdv und damit U = p. Gemittelt bekommen V wir also Y = U V und X = p. Bei mehreren externen Parametern modiziert sich Gleichung (7) zu ln Ω x α = β X α Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
9 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen Wir betrachten ein isoliertes System A 0 = A + A, das aus zwei Teilsystemen besteht. Das Volumen V ist vom Volumen V durch einen beweglichen Kolben getrennt. Die Gesamtenergie sei konstant: E 0 = E + E = const, wie auch das Gesamtvolumen V 0 = V + V = const. Die beiden Systeme tauschen Wärme und mechanische Arbeit aus. Skizze eines gekoppelten Systems, das durch einen Kolben getrennt ist. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
10 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen Wir betrachten eine innitesimale Änderung des Zustandes mit den externen Parametern x α und verwenden die verallgemeinerten Kräfte d ln Ω = ln Ω E d E + n = β ( d E + α α=1 ln Ω x α d x α X α d x α ) In unserem Falle ist x α = V und E = U die innere Energie. Somit erhalten wir mit δw = pdv für unseren innitesimalen Prozess d ln Ω = β (d U + p dv ) = β (d U δw ) = βδq was nichts anderes als der erste Hauptsatz ist. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
11 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen Wir können für innitesimale Prozesse auch schreiben δq = TdS = d U δw Bei einem adiabatischen Prozess ist δq = 0 und damit ds = 0. Somit ändert sich auch Ω bei einem adiabatischen Prozess nicht! Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
12 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen Das Gleichgewicht ist erreicht, wenn die Wahrscheinlichkeit p (E 0 ) maximal ist. Die Anzahl Zustände des Gesamtsystems sind Ω 0 (E 0 ) = Ω (E,V ) Ω ( E,V ) ln Ω 0 = ln Ω + ln Ω Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
13 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen S 0 = S + S Das Maximum der Wahrscheinlichkeit d ln Ω 0 = d ( ln Ω + ln Ω ) = 0 d ln Ω = ln Ω ln Ω de + E V dv = βde + β p dv d ln Ω = β de + β p dv = β de β p dv Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
14 Gleichgewicht Gleichgewicht zwischen zwei Systemen mit veränderbarem Teilvolumen Die Summe der Gleichungen ergibt ( β β ) de + ( β p β p ) dv = 0 Dies muss für beliebige de und dv gelten. Darum haben wir β β = 0 β = β T = T β p β p = 0 p = p Dies sind die erwarteten Gleichgewichtsbedingungen, aber nun mit statistischen Argumenten hergeleitet. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
15 Eigenschaften der Entropie, dritter Hauptsatz Messung S f S i = f i ds = f i δq T Diese Integrale gelten für quasistatische Prozesse, also Prozesse bei denen das untersuchte System immer im Gleichgewicht ist. Sie sind aber unabhängig vom Prozess. Die Aussage, dass f δq unabhängig i T vom Weg ist, ist äquivalent zur Aussage, dass die potentielle Energie in konservativen Kraftfeldern unabhängig vom Weg sei. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
16 Eigenschaften der Entropie, dritter Hauptsatz Messung Skizze einer Apparatur zur Messung der Entropie. Mit dem Widerstand R wird die Heizleistung P = UI in das thermisch isolierte System gebracht. Das Thermometer misst die Temperatur T. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
17 Eigenschaften der Entropie, dritter Hauptsatz Messung Q = t 0 Pdτ = U I t in der Zeit t in das System gebracht. Die Temperatur steigt dann wie T (t). Wenn wir also ds = δq P(t) dt U(t) I (t) dt = = T T (t) T (t) integrieren, erhalten wie die Entropiedierenz. S = t 0 P(τ) dt T (τ) Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
18 Eigenschaften der Entropie, dritter Hauptsatz Messung 400 Entropiemessung P/T Entropiemessung T [K] T P P [W] (P/T) [W/K] S = J/K t [s] t [s] P(t) dt Links ist T (t) und P(t) gezeigt, rechts T (t). Die ausgefüllte Fläche ist die Entropiedierenz S. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
19 Eigenschaften der Entropie, dritter Hauptsatz Unbestimmtheit der Entropie in der klassischen Physik Da die Entropie als S = k ln Ω geschrieben werden kann, hängt die Entropie eindeutig vom Makrozustand des Systems ab, wenn wir das Phasenraumvolumen auf h 0 = xieren. Bei einer klassischen Betrachtung würde gelten Ω = 1... dg h f 1... dg f dp 1... dp f 0 und damit ( S = k ln... dg 1... dg f dp 1... dp f ) kf ln h 0 Das heisst, dass bei klassischer Betrachtung S nicht eindeutig deniert ist. Erst die Quantenmechanik mit dem von Planck gefundenen Phasenraumvolumen macht die Betrachtung eindeutig, also h 0 =! Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
20 Eigenschaften der Entropie, dritter Hauptsatz Verhalten von S bei T 0 Ω f k ln Ω k ln f kf 3. Hauptsatz (strenge Form) Wenn T gegen 0 geht, verschwindet die Entropie, also ist lim S = 0 T 0 Max Planck Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
21 Eigenschaften der Entropie, dritter Hauptsatz Verhalten von S bei T 0 Es gibt nun Systeme (zum Beispiel Gläser), die bei T = 0 in metastabile Zustände mit praktisch unendlicher Lebensdauer geraten. Diese metastabilen Systeme sind nicht im Grundzustand, deshalb ist lim T 0 > Hauptsatz (engere Form) Für T 0 gilt, dass lim S = 0 ist. Alternativ bedeutet das, T 0 dass lim S = S 0, wobei S 0 unabhängig von allen Parametern des T 0 betreenden Systems ist. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
22 Eigenschaften der Entropie, dritter Hauptsatz Wärmekapazitäten in der Nähe des Temperaturnullpunktes Wärmekapazität Die Wärmekapazitäten von Stoen hängen mit der Entropie zusammen. Aus du = n c mol dt = TdS folgt und nach der Integration S (T,V ) = ds = n c mol dt T T n c V, mol (T,V ) dt T und 0 T S (T,p) = n c p, mol (p,t ) dt T 0 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
23 Eigenschaften der Entropie, dritter Hauptsatz Wärmekapazitäten in der Nähe des Temperaturnullpunktes Wärmekapazität Also sind die Grenzwerte für die Wärmekapazitäten ( ) lim c V, mol = lim c p, mol = lim cp, mol c V, mol = 0 T 0 T 0 T 0 Insbesondere verschwindet die Dierenz von c p, mol und c V, mol wenn die Temperatur gegen den absoluten Nullpunkt geht. Unser früheres Resultat für das ideale Gas c p, mol = c V, mol + R gilt also nur für hohe Temperaturen. In anderen Worten: in der Nähe des Temperaturnullpunktes gibt es keine idealen Gase. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
24 Mischungen Mischungsentropie System aus zwei Molekülsorten A und B (links) und nach Mischung. Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre / 24
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 18. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 18. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 18. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 18. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 14. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 14. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 14. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 14. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 14. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 14. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 14. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 14. 06.
k B T de + p k B T dv µ k B T dn oder de = T ds pdv + µdn (1) Enthalpie I = E + pv zu betrachten und es gilt di = T ds + V dp + µdn (3)
 III. hermodynamik 14. Wärme und Arbeit 14.1 Wiederholung Ziffer 4: Reversible Zustandsänderungen (a) Zustandsgrößen im thermodynamischen Gleichgewicht: Extensive Zustandsgrößen: E, V, N; ln Φ(E, V, N)
III. hermodynamik 14. Wärme und Arbeit 14.1 Wiederholung Ziffer 4: Reversible Zustandsänderungen (a) Zustandsgrößen im thermodynamischen Gleichgewicht: Extensive Zustandsgrößen: E, V, N; ln Φ(E, V, N)
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 21. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 21. 05.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 21. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 21. 05.
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 05. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 05. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 05. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 05. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal
 Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 02. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 02. 07. 2007 Inhaltsverzeichnis
Grundlagen der Physik II Othmar Marti 02. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 02. 07. 2007 Inhaltsverzeichnis
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
Winter-Semester 2017/18. Moderne Theoretische Physik IIIa. Statistische Physik
 Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti.
 (c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 10. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
(c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 10. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Übungen zur Theoretischen Physik F SS Ideales Boltzmann-Gas: ( =25 Punkte, schriftlich)
 Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Übungen zur Theoretischen Physik F SS 2016 Prof. Dr. A. Shnirman Blatt 2 Dr. B. Narozhny, Dipl.-Phys. P. Schad Lösungsvorschlag
Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Übungen zur Theoretischen Physik F SS 2016 Prof. Dr. A. Shnirman Blatt 2 Dr. B. Narozhny, Dipl.-Phys. P. Schad Lösungsvorschlag
2 Grundbegriffe der Thermodynamik
 2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
Statistische Physik I
 Statistische Physik I 136.020 SS 2010 Vortragende: C. Lemell, S. YoshidaS http://dollywood.itp.tuwien.ac.at/~statmech Übersicht (vorläufig) 1) Wiederholung Begriffsbestimmung Eulergleichung 2) Phänomenologische
Statistische Physik I 136.020 SS 2010 Vortragende: C. Lemell, S. YoshidaS http://dollywood.itp.tuwien.ac.at/~statmech Übersicht (vorläufig) 1) Wiederholung Begriffsbestimmung Eulergleichung 2) Phänomenologische
Die Carnot-Maschine SCHRITT III. Isotherme Kompression bei einer Temperatur T 2 T 2. Wärmesenke T 2 = konstant. Nicolas Thomas
 Die Carnot-Maschine SCHRITT III Isotherme Kompression bei einer Temperatur T 2 T 2 Wärmesenke T 2 = konstant Die Carnot-Maschine SCHRITT IV Man isoliert das Gas wieder thermisch und drückt den Kolben noch
Die Carnot-Maschine SCHRITT III Isotherme Kompression bei einer Temperatur T 2 T 2 Wärmesenke T 2 = konstant Die Carnot-Maschine SCHRITT IV Man isoliert das Gas wieder thermisch und drückt den Kolben noch
Kompressible Gasdynamik
 Hauptseminar Lineare und Nichtlineare Wellenphänomene 14. Januar 2013 Inhaltsverzeichnis 1 Thermodynamische Grundlagen 2 Bewegungsgleichungen 3 Konstruktion der Charakteristiken Allgemeine Konstruktion
Hauptseminar Lineare und Nichtlineare Wellenphänomene 14. Januar 2013 Inhaltsverzeichnis 1 Thermodynamische Grundlagen 2 Bewegungsgleichungen 3 Konstruktion der Charakteristiken Allgemeine Konstruktion
6.7 Die Entropie und der Zweite Hauptsatz
 6.7. DIE ENROPIE UND DER ZWEIE HAUPSAZ 261 6.7 Die Entropie und der Zweite Hauptsatz 6.7.1 Definition der Entropie Im vorhergehenden Abschnitt haben wir im ersten Hauptsatz der hermodynamik die Änderung
6.7. DIE ENROPIE UND DER ZWEIE HAUPSAZ 261 6.7 Die Entropie und der Zweite Hauptsatz 6.7.1 Definition der Entropie Im vorhergehenden Abschnitt haben wir im ersten Hauptsatz der hermodynamik die Änderung
Die innere Energie and die Entropie
 Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 04. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 04. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 04. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 04. 06.
Repetitorium QM 1 - Tag 5
 Thermodynamik und 4. März 2016 Inhaltsverzeichnis 1 Thermodynamik Hauptsätze der Thermodynamik 2 Zustandsgrößen Thermodynamik Hauptsätze der Thermodynamik Ziel: Beschreibung des makroskopischen Gleichgewichtszustandes
Thermodynamik und 4. März 2016 Inhaltsverzeichnis 1 Thermodynamik Hauptsätze der Thermodynamik 2 Zustandsgrößen Thermodynamik Hauptsätze der Thermodynamik Ziel: Beschreibung des makroskopischen Gleichgewichtszustandes
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti.
 (c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
(c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Musterlösung zu Übung 7
 PCI hermodynamik G. Jeschke FS 05 Musterlösung zu Übung 7 08.04.05 a Der Goldbarren wird beim Einbringen in das Reservoir sprunghaft erwärmt. Der Wärmeaustausch erfolgt daher auf irreversiblem Weg. Um
PCI hermodynamik G. Jeschke FS 05 Musterlösung zu Übung 7 08.04.05 a Der Goldbarren wird beim Einbringen in das Reservoir sprunghaft erwärmt. Der Wärmeaustausch erfolgt daher auf irreversiblem Weg. Um
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 4.09.00 Inhaltsverzeichnis Inhaltsverzeichnis Thermodynamische Hauptsätze. Aufgabe :..................................... Aufgabe :.....................................
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 4.09.00 Inhaltsverzeichnis Inhaltsverzeichnis Thermodynamische Hauptsätze. Aufgabe :..................................... Aufgabe :.....................................
Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie
 Sommer-Semester 2011 Moderne Theoretische Physik III Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Di 09:45-11:15, Lehmann HS 022, Geb 30.22 Do 09:45-11:15,
Sommer-Semester 2011 Moderne Theoretische Physik III Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Di 09:45-11:15, Lehmann HS 022, Geb 30.22 Do 09:45-11:15,
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
1. Thermodynamik magnetischer Systeme
 1. Thermodynamik magnetischer Systeme 1 1.1 Thermodynamische Potentiale 2 1.2 Magnetische Modellsysteme G. Kahl (Institut für Theoretische Physik) Statistische Physik II Kapitel 1 5. April 2013 1 / 15
1. Thermodynamik magnetischer Systeme 1 1.1 Thermodynamische Potentiale 2 1.2 Magnetische Modellsysteme G. Kahl (Institut für Theoretische Physik) Statistische Physik II Kapitel 1 5. April 2013 1 / 15
Kapitel 4. Thermodynamisches Gleichgewicht zwischen zwei Systemen. 4.1 Systeme im thermischen Kontakt 1; E 1 =? 2; E 2 =?
 Kapitel 4 hermodynamisches Gleichgewicht zwischen zwei Systemen Im letzten Abschnitt haben wir am Beispiel des idealen Gases die Entropie (S(E)) bestimmt, und zwar im Rahmen des mikrokanonischen Ensembles
Kapitel 4 hermodynamisches Gleichgewicht zwischen zwei Systemen Im letzten Abschnitt haben wir am Beispiel des idealen Gases die Entropie (S(E)) bestimmt, und zwar im Rahmen des mikrokanonischen Ensembles
Der 1. Hauptsatz. Energieerhaltung:
 Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
3 Der 1. Hauptsatz der Thermodynamik
 3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen Welche Reaktion läuft spontan freiwillig ab? H 2 + I 2 2HI H 2 + I 2 2HI H 2 + I 2 2HI Wie ist der Energieumsatz einer Reaktion? Welche Wärme
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen Welche Reaktion läuft spontan freiwillig ab? H 2 + I 2 2HI H 2 + I 2 2HI H 2 + I 2 2HI Wie ist der Energieumsatz einer Reaktion? Welche Wärme
9.4 Der 2. Hautsatz: spontane Prozesse und Entropie
 9.4 Der 2. Hautsatz: spontane Prozesse und Entropie Beispiele für spontane Prozesse: Ein heisser Körper kühlt sich auf Umgebungstemperatur ab. Ein kalter Köper erwärmt sich auf Umgebungstemperatur. Die
9.4 Der 2. Hautsatz: spontane Prozesse und Entropie Beispiele für spontane Prozesse: Ein heisser Körper kühlt sich auf Umgebungstemperatur ab. Ein kalter Köper erwärmt sich auf Umgebungstemperatur. Die
Allgemeine Vorgehensweise
 Allgemeine Vorgehensweise 1. Skizze zeichnen und Systemgrenze ziehen 2. Art des Systems festlegen (offen, geschlossen, abgeschlossen) und Eigenschaften charakterisieren (z.b. adiabat, stationär, ruhend...)
Allgemeine Vorgehensweise 1. Skizze zeichnen und Systemgrenze ziehen 2. Art des Systems festlegen (offen, geschlossen, abgeschlossen) und Eigenschaften charakterisieren (z.b. adiabat, stationär, ruhend...)
Moderne Theoretische Physik IIIa WS 18/19
 Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
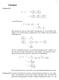 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Übungen zu Theoretische Physik IV
 Physikalisches Institut Übungsblatt 4 Universität Bonn 02. November 2012 Theoretische Physik WS 12/13 Übungen zu Theoretische Physik IV Priv.-Doz. Dr. Stefan Förste http://www.th.physik.uni-bonn.de/people/forste/exercises/ws1213/tp4
Physikalisches Institut Übungsblatt 4 Universität Bonn 02. November 2012 Theoretische Physik WS 12/13 Übungen zu Theoretische Physik IV Priv.-Doz. Dr. Stefan Förste http://www.th.physik.uni-bonn.de/people/forste/exercises/ws1213/tp4
Differentialrechnung
 Kapitel 7 Differentialrechnung Josef Leydold Mathematik für VW WS 205/6 7 Differentialrechnung / 56 Differenzenquotient Sei f : R R eine Funktion. Der Quotient f = f ( 0 + ) f ( 0 ) = f () f ( 0) 0 heißt
Kapitel 7 Differentialrechnung Josef Leydold Mathematik für VW WS 205/6 7 Differentialrechnung / 56 Differenzenquotient Sei f : R R eine Funktion. Der Quotient f = f ( 0 + ) f ( 0 ) = f () f ( 0) 0 heißt
2 Wärmelehre. Reibungswärme Reaktionswärme Stromwärme
 2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas. Thermodynamik
 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
9. Vorlesung Wintersemester
 9. Vorlesung Wintersemester 1 Die Phase der angeregten Schwingung Wertebereich: bei der oben abgeleiteten Formel tan φ = β ω ω ω0. (1) ist noch zu sehen, in welchem Bereich der Winkel liegt. Aus der ursprünglichen
9. Vorlesung Wintersemester 1 Die Phase der angeregten Schwingung Wertebereich: bei der oben abgeleiteten Formel tan φ = β ω ω ω0. (1) ist noch zu sehen, in welchem Bereich der Winkel liegt. Aus der ursprünglichen
Karlsruher Institut für Technologie Festkörperphysik. Übungen zur Theoretischen Physik F SS 10
 Karlsruher Institut für Technologie Institut für Theoretische Festkörperphysik Übungen zur Theoretischen Physik F SS 10 Prof. Dr. G. Schön Lösungsvorschlag zu Blatt 2 Dr. J. Cole 30.04.2010 1. Van-der-Waals
Karlsruher Institut für Technologie Institut für Theoretische Festkörperphysik Übungen zur Theoretischen Physik F SS 10 Prof. Dr. G. Schön Lösungsvorschlag zu Blatt 2 Dr. J. Cole 30.04.2010 1. Van-der-Waals
Klausur Thermodynamik E2/E2p SoSe 2019 Braun. Formelsammlung Thermodynamik
 Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Thermodynamik. Kapitel 4. Nicolas Thomas
 Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
ad Physik A VL2 (11.10.2012)
 ad Physik A VL2 (11.10.2012) korrigierte Varianz: oder: korrigierte Stichproben- Varianz n 2 2 2 ( x) ( xi ) n 1 i1 1 n 1 n i1 1 Begründung für den Vorfaktor : n 1 Der Mittelwert der Grundgesamtheit (=
ad Physik A VL2 (11.10.2012) korrigierte Varianz: oder: korrigierte Stichproben- Varianz n 2 2 2 ( x) ( xi ) n 1 i1 1 n 1 n i1 1 Begründung für den Vorfaktor : n 1 Der Mittelwert der Grundgesamtheit (=
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Thermodynamik und Statistische Physik
 Thermoynamik un Statistische Physik (Kompenium Herausgegeben von Jeffrey Kelling Felix Lemke Stefan Majewsky Stan: 14. Februar 2009 1 Inhaltsverzeichnis Statistische Operatoren 3 Zustäne 3 Darstellung
Thermoynamik un Statistische Physik (Kompenium Herausgegeben von Jeffrey Kelling Felix Lemke Stefan Majewsky Stan: 14. Februar 2009 1 Inhaltsverzeichnis Statistische Operatoren 3 Zustäne 3 Darstellung
Thermodynamics and Information
 ,, TU Berlin Sommersemester 2012 Inhaltsverzeichnis, 1 2 3 4 5 6 Idee des Maxwellschen s 1871, Gedankenexperiment um den zweiten Hauptsatz der Thermodynamik zu entkräften bzw. ihn in Frage zu stellen separiert
,, TU Berlin Sommersemester 2012 Inhaltsverzeichnis, 1 2 3 4 5 6 Idee des Maxwellschen s 1871, Gedankenexperiment um den zweiten Hauptsatz der Thermodynamik zu entkräften bzw. ihn in Frage zu stellen separiert
16 Vektorfelder und 1-Formen
 45 16 Vektorfelder und 1-Formen 16.1 Vektorfelder Ein Vektorfeld v auf D R n ist eine Abbildung v : D R n, x v(x). Beispiele. Elektrisches und Magnetisches Feld E(x), B(x), Geschwindigkeitsfeld einer Strömung
45 16 Vektorfelder und 1-Formen 16.1 Vektorfelder Ein Vektorfeld v auf D R n ist eine Abbildung v : D R n, x v(x). Beispiele. Elektrisches und Magnetisches Feld E(x), B(x), Geschwindigkeitsfeld einer Strömung
Erinnerung an die Thermodynamik
 2 Erinnerung an die Thermodynamik 2.1 Erinnerung an die Thermodynamik Hauptsätze der Thermodynamik Thermodynamische Potentiale 14 2 Erinnerung an die Thermodynamik 2.1 Thermodynamik: phänomenologische
2 Erinnerung an die Thermodynamik 2.1 Erinnerung an die Thermodynamik Hauptsätze der Thermodynamik Thermodynamische Potentiale 14 2 Erinnerung an die Thermodynamik 2.1 Thermodynamik: phänomenologische
I.1.3 b. (I.7a) I.1 Grundbegriffe der Newton schen Mechanik 9
 I. Grundbegriffe der Newton schen Mechanik 9 I..3 b Arbeit einer Kraft Wird die Wirkung einer Kraft über ein Zeitintervall oder genauer über die Strecke, welche das mechanische System in diesem Zeitintervall
I. Grundbegriffe der Newton schen Mechanik 9 I..3 b Arbeit einer Kraft Wird die Wirkung einer Kraft über ein Zeitintervall oder genauer über die Strecke, welche das mechanische System in diesem Zeitintervall
Molekulare Bioinformatik
 Molekulare Bioinformatik Wintersemester 2013/2014 Prof. Thomas Martinetz Institut für Neuro- und Bioinformatik Universität zu Luebeck 14.01.2014 1 Molekulare Bioinformatik - Vorlesung 11 Wiederholung Wir
Molekulare Bioinformatik Wintersemester 2013/2014 Prof. Thomas Martinetz Institut für Neuro- und Bioinformatik Universität zu Luebeck 14.01.2014 1 Molekulare Bioinformatik - Vorlesung 11 Wiederholung Wir
Institut für Thermodynamik Prof. Dr. rer. nat. M. Pfitzner Thermodynamik I - Lösung 5
 Aufgabe 20 In einem Kalorimeter soll die mittlere spezifische Wärmekapazität eines Öls zwischen 20 C und 00 C bestimmt werden. Das Kalorimeter wurde mit 3 kg Öl gefüllt. Mit einer elektrischen Heizung
Aufgabe 20 In einem Kalorimeter soll die mittlere spezifische Wärmekapazität eines Öls zwischen 20 C und 00 C bestimmt werden. Das Kalorimeter wurde mit 3 kg Öl gefüllt. Mit einer elektrischen Heizung
Statistische Thermodynamik I Lösungen zur Serie 11
 Statistische Thermodynamik I Lösungen zur Serie Verschiedenes 20 Mai 206 Barometrische Höhenformel: Betrachte die rdatmosphäre im homogenen Gravitationspotential M gz der rde Unter der Annahme, dass sich
Statistische Thermodynamik I Lösungen zur Serie Verschiedenes 20 Mai 206 Barometrische Höhenformel: Betrachte die rdatmosphäre im homogenen Gravitationspotential M gz der rde Unter der Annahme, dass sich
Boltzmannscher Zugang zur Statistischen Physik
 Kapitel 0 Boltzmannscher Zugang zur Statistischen Physik Makroskopische Systeme beinhalten etwa N A Teilchen. Wegen der riesigen Anzahl mikroskopischer Freiheitsgrade können wir nicht mehr die Bewegung
Kapitel 0 Boltzmannscher Zugang zur Statistischen Physik Makroskopische Systeme beinhalten etwa N A Teilchen. Wegen der riesigen Anzahl mikroskopischer Freiheitsgrade können wir nicht mehr die Bewegung
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
PCI (Biol./Pharm.) Thermodyn. Musterlösung Übung 5 H.P. Lüthi / R. Riek HS Musterlösung Übung 5
 Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Ordinatenabschnitt Ursprungsgerade
 2 3 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0 0 Ursprung (0 0) Abszissenachse ( x-achse ) x f(x 1 ): Funktionswert bei x 1 x 1 : Stelle/
2 3 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0 0 Ursprung (0 0) Abszissenachse ( x-achse ) x f(x 1 ): Funktionswert bei x 1 x 1 : Stelle/
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 8 Lösungsvorschlag
 T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale
 8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper ist im Gleichgewicht,
8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper ist im Gleichgewicht,
Was ist Physik? Modell der Natur universell es war schon immer so
 Was ist Physik? Modell der Natur universell es war schon immer so Kultur Aus was sind wir gemacht? Ursprung und Aufbau der Materie Von wo/was kommen wir? Ursprung und Aufbau von Raum und Zeit Wirtschaft
Was ist Physik? Modell der Natur universell es war schon immer so Kultur Aus was sind wir gemacht? Ursprung und Aufbau der Materie Von wo/was kommen wir? Ursprung und Aufbau von Raum und Zeit Wirtschaft
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
im 1. Fachsemester Vladimir Dyakonov / Volker Drach Professor Dr. Vladimir Dyakonov, Experimentelle Physik VI
 Physik für Mediziner im 1. Fachsemester #9 02/11/2010 Vladimir Dyakonov / Volker Drach dyakonov@physik.uni-wuerzburg.de Wärmelehre Teil 1 - Energie, Wärmekapazität Def. 1: Lehre der Energie, ihrer Erscheinungsform
Physik für Mediziner im 1. Fachsemester #9 02/11/2010 Vladimir Dyakonov / Volker Drach dyakonov@physik.uni-wuerzburg.de Wärmelehre Teil 1 - Energie, Wärmekapazität Def. 1: Lehre der Energie, ihrer Erscheinungsform
Alexander Riegel.
 Alexander Riegel riegel@uni-bonn.de 2 9 10 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0 0 Ursprung (0 0) Abszissenachse ( x-achse ) x f(x 1
Alexander Riegel riegel@uni-bonn.de 2 9 10 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0 0 Ursprung (0 0) Abszissenachse ( x-achse ) x f(x 1
Experimentalphysik I : Mechanik und Wärmelehre WS 2010/11 Prof. Dr. J. Winter
 Informationen zur Klausur 2. Teilklausur Freitag, den 28.1.2011 Schwingungen (2.7) Wellen (2.8) Wärmelehre kin. Gastheorie (3.1) Wärme (3.2) Wärmetransport (3.3) 1. Haupsatz (isotherm, adiabatisch, isochor,
Informationen zur Klausur 2. Teilklausur Freitag, den 28.1.2011 Schwingungen (2.7) Wellen (2.8) Wärmelehre kin. Gastheorie (3.1) Wärme (3.2) Wärmetransport (3.3) 1. Haupsatz (isotherm, adiabatisch, isochor,
11.2 Die absolute Temperatur und die Kelvin-Skala
 11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
Klausur zur Statistischen Physik SS 2013
 Klausur zur Statistischen Physik SS 2013 Prof. Dr. M. Rohlfing Die folgenden Angaben bitte deutlich in Blockschrift ausfüllen: Name, Vorname: geb. am: in: Matrikel-Nr.: Übungsgruppenleiter: Aufgabe maximale
Klausur zur Statistischen Physik SS 2013 Prof. Dr. M. Rohlfing Die folgenden Angaben bitte deutlich in Blockschrift ausfüllen: Name, Vorname: geb. am: in: Matrikel-Nr.: Übungsgruppenleiter: Aufgabe maximale
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Thermodynamik. Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur
 Thermodynamik Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur kann voraussagen, ob eine chemische Reaktion abläuft oder nicht kann nichts über den zeitlichen
Thermodynamik Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur kann voraussagen, ob eine chemische Reaktion abläuft oder nicht kann nichts über den zeitlichen
Kompressible Strömungen
 Kompressible Strömungen Problemstellungen: - Wie lassen sich Überschallströmungen realisieren? - Welche Windkanalgeometrie ist notwendig? - Thermodynamische Beziehungen in Überschallströmungen? - Unterschall
Kompressible Strömungen Problemstellungen: - Wie lassen sich Überschallströmungen realisieren? - Welche Windkanalgeometrie ist notwendig? - Thermodynamische Beziehungen in Überschallströmungen? - Unterschall
Gewöhnliche Dierentialgleichungen
 Gewöhnliche Dierentialgleichungen sind Gleichungen, die eine Funktion mit ihren Ableitungen verknüpfen. Denition Eine explizite Dierentialgleichung (DGL) nter Ordnung für die reelle Funktion t x(t) hat
Gewöhnliche Dierentialgleichungen sind Gleichungen, die eine Funktion mit ihren Ableitungen verknüpfen. Denition Eine explizite Dierentialgleichung (DGL) nter Ordnung für die reelle Funktion t x(t) hat
Klassische Theoretische Physik II. V: Prof. Dr. M. Mühlleitner, Ü: Dr. M. Rauch. Klausur 2 Lösung. 22. September 2015, 12-14 Uhr
 KIT SS 15 Klassische Theoretische Physik II V: Prof. Dr. M. Mühlleitner, Ü: Dr. M. Rauch Klausur Lösung. September 15, 1-14 Uhr Aufgabe 1: Kurzfragen (3+4+1+1 Punkte (a Die erhaltenen Größen und evtl.
KIT SS 15 Klassische Theoretische Physik II V: Prof. Dr. M. Mühlleitner, Ü: Dr. M. Rauch Klausur Lösung. September 15, 1-14 Uhr Aufgabe 1: Kurzfragen (3+4+1+1 Punkte (a Die erhaltenen Größen und evtl.
zentrale Aufgabe der statistischen Mechanik: Bestimmung von Boltzmanns Hypothese das mikrokanonische Ensemble
 zentrale Augabe der statistischen echanik: estimmung von oltzmanns Hypothese der gleichen a-priori Wahrscheinlichkeit: das mikrokanonische nsemble isoliertes ystem: ystem ist gegen die Umgebung abgeschirmt
zentrale Augabe der statistischen echanik: estimmung von oltzmanns Hypothese der gleichen a-priori Wahrscheinlichkeit: das mikrokanonische nsemble isoliertes ystem: ystem ist gegen die Umgebung abgeschirmt
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
10.Einführung in die Festkörperphysik
 1.1 1.Einführung in die Festkörperphysik Die Festkörperphysik ist ein Zweig der modernen Physik, in dem mittlerweile ca. 5% aller Physiker arbeiten. Viele moderne Anwendungen insbesondere im Bereich der
1.1 1.Einführung in die Festkörperphysik Die Festkörperphysik ist ein Zweig der modernen Physik, in dem mittlerweile ca. 5% aller Physiker arbeiten. Viele moderne Anwendungen insbesondere im Bereich der
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 31. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 31. 05.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 31. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 31. 05.
Phasengleichgewicht und Phasenübergänge. Gasförmig
 Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Die innere Energie eines geschlossenen Systems ist konstant
 Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
für Pharmazeuten und Lehramtskandidaten WS 2017/2018
 für Pharmazeuten und Lehramtskandidaten WS 2017/2018 Alexander Riegel riegel@uni-bonn.de 2 3 4 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0
für Pharmazeuten und Lehramtskandidaten WS 2017/2018 Alexander Riegel riegel@uni-bonn.de 2 3 4 Ordinatenachse ( y-achse ) f x Gerade Ordinatenabschnitt f x = 0 Ursprungsgerade Nullstelle f x = x 0 = 0
D-ITET Analysis II FS 13 Prof. Horst Knörrer. Musterlösung 1. 3xy 2 = 2 x 2. y y. 3 y y. 3 x v x + v = 2 3 v v.
 D-ITET Analysis II FS 3 Prof. Horst Knörrer Musterlösung. a) Es gilt: dy d 3 + y 3 3y 3 y + y 3. Dies ist eine homogene Differentialgleichung, das heisst y hängt nur von y ab. Setze v : y y() v() y v +
D-ITET Analysis II FS 3 Prof. Horst Knörrer Musterlösung. a) Es gilt: dy d 3 + y 3 3y 3 y + y 3. Dies ist eine homogene Differentialgleichung, das heisst y hängt nur von y ab. Setze v : y y() v() y v +
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Stetige Funktionen. Definition. Seien (X, d) und (Y, ϱ) metrische Räume und f : X Y eine Abbildung. D(f) X sei der Definitionsbereich von f.
 Stetige Funktionen Abbildungen f : X Y, wobei X und Y strukturierte Mengen sind (wie z.b. Vektorräume oder metrische Räume), spielen eine zentrale Rolle in der Mathematik. In der Analysis sind Abbildungen
Stetige Funktionen Abbildungen f : X Y, wobei X und Y strukturierte Mengen sind (wie z.b. Vektorräume oder metrische Räume), spielen eine zentrale Rolle in der Mathematik. In der Analysis sind Abbildungen
Aufgaben zur Experimentalphysik II: Thermodynamik
 Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Prof. Dr. U. Schollwöck Sommersemester 2013
 Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale
 8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 4 Lösung. P + a )
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter ogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 4 Lösung. van der Waals Gas, Adiabatengleichung
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter ogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 4 Lösung. van der Waals Gas, Adiabatengleichung
Mathematischer Vorkurs
 Mathematischer Vorkurs Dr. Agnes Lamacz Mathematischer Vorkurs TU Dortmund Seite 1 / 170 Logarithmus- und Exponentialfunktion Kapitel 9 Logarithmus- und Exponentialfunktion Mathematischer Vorkurs TU Dortmund
Mathematischer Vorkurs Dr. Agnes Lamacz Mathematischer Vorkurs TU Dortmund Seite 1 / 170 Logarithmus- und Exponentialfunktion Kapitel 9 Logarithmus- und Exponentialfunktion Mathematischer Vorkurs TU Dortmund
(b) Schritt I: freie adiabatische Expansion, also ist δw = 0, δq = 0 und damit T 2 = T 1. Folglich ist nach 1. Hauptsatz auch U = 0.
 3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
Klausur Höhere Mathematik I für die Fachrichtung Physik
 Karlsruher Institut für Technologie (KIT Institut für Analysis Prof. Dr. Tobias Lamm Dr. Patrick Breuning WS /3 4.3.3 Klausur Höhere Mathematik I für die Fachrichtung Physik Aufgabe ((4+3+3 Punkte a Welche
Karlsruher Institut für Technologie (KIT Institut für Analysis Prof. Dr. Tobias Lamm Dr. Patrick Breuning WS /3 4.3.3 Klausur Höhere Mathematik I für die Fachrichtung Physik Aufgabe ((4+3+3 Punkte a Welche
Klausurenkurs zum Staatsexamen (WS 2016/17): Differential und Integralrechnung 3
 Dr. Erwin Schörner Klausurenkurs zum Staatsexamen (WS 206/7): Differential und Integralrechnung 3 3. (Herbst 20, Thema 3, Aufgabe 2) Gegeben ist für m R die Funktion f m : ], 2π[ R; f m (x) = Folgende
Dr. Erwin Schörner Klausurenkurs zum Staatsexamen (WS 206/7): Differential und Integralrechnung 3 3. (Herbst 20, Thema 3, Aufgabe 2) Gegeben ist für m R die Funktion f m : ], 2π[ R; f m (x) = Folgende
Klassische und Relativistische Mechanik
 Klassische und Relativistische Mechanik Othmar Marti 30. 11. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Physik Klassische und Relativistische Mechanik
Klassische und Relativistische Mechanik Othmar Marti 30. 11. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Physik Klassische und Relativistische Mechanik
