Russisch Roulette auf Rezept? Vom verantwortungsvollen Umgang mit Arzneimittelnebenwirkungen Prof. Dr. Karl Broich
|
|
|
- Carl Küchler
- vor 6 Jahren
- Abrufe
Transkript
1 Russisch Roulette auf Rezept? Vom verantwortungsvollen Umgang mit Arzneimittelnebenwirkungen Prof. Dr. Karl Broich
2 Gliederung Aktuelle und neue Zulassungswege / early Access Rolle der Pharmakovigilanz Forschung am BfArM zu Pharmakovigilanzthemen 2
3 Aufgaben der Zulassung laut AMG Das BfArM prüft anhand der Zulassungsunterlagen und gemäß dem Stand der wissenschaftlichen Erkenntnisse, ob das zur Zulassung beantragte Arzneimittel die vom Antragsteller angegebene therapeutische Wirksamkeit besitzt, die nach den anerkannten pharmazeutischen Regeln angemessene pharmazeutische Qualität aufweist, EU- weite in seiner Anwendung gemäß den Maßgaben der erteilten Zulassung unbedenklich ist, und Harmonisierung der Nutzen dieser Anwendung die mit ihr verbundenen Risiken überwiegt (positives Nutzen-Risiko-verhältnis). 3
4 Aspekte der Nutzenbewertung bei Zulassung und auch danach Art der Behandlung kurativ, präventiv oder symptomatisch Klinische Bedeutung Häufigkeit und Schwere der zu behandelnden Erkrankung Nutzen für besondere Patientengruppen Erwartete Anzahl der Patienten Vergleich mit therapeutischen Alternativen
5 Warum Pharmakovigilanz? vor Zulassung kontrollierte klin. Prüfung eng definierte Patientengruppe, eher kleine Fallzahlen nach Zulassung und Markteinführung breite Anwendung in der Allgemeinbevölkerung keine eng umschriebene Patientengruppe höhere Fallzahl Kenntnisse zur Sicherheit relativ gering, insbesondere zu seltenen UAW Pharmakovigilanz 5
6 Pharmakovigilanz 6
7 Gegenläufige Tendenzen Industrie: innovationsfördernde Rahmenbedingungen Leistungsträger: HTA und vergleichende Bewertungen Patienten: möglichst früher Zugang zu neuen Arzneimitteln Medien/Öffentlichkeit: größtmögliche Arzneimittelsicherheit arzneimitteltherapeutische Möglichkeiten unzureichend Überangebot vergleichbarer Arzneimittel Zeitverlauf bis zur Zulassung/Vermarktung kurzer Zeitraum: Erkenntnisstand u. U. nicht ausreichend umfangreichere Studien und Prüfung: verzögerter Marktzugang
8 From RCT to toolkit for evidence generation Current scenario: Post-licensing treatment experience of many patients does not contribute to evidence generation Adaptive Licensing: After initial license, patient experience is captured to contribute to real-world information 8
9 Von der breiten zur engen Indikation Final target indication in blue, patient group with highest need in red. Both strategies are acceptable from a regulatory point of view Blockbuster strategy Differentiation ; variation of license? Adaptive pathway Real-world monitoring; RCTs Real-world monitoring Slide modified from Tomas Salmonson 9
10 Welche Studien können behördlich zu welchem Zeitpunkt angeordnet werden? bei Zulassung Unbedenklichkeitsprüfungen (PASS) Wirksamkeitsprüfungen (PAES) nach Zulassung Unbedenklichkeitsprüfungen (PASS) Wirksamkeitsprüfungen (PAES)
11 PRAC: Beratungsgremium
12 Weitere Informationsquellen zu Nutzen und Risiken Datenbanken zu Nebenwirkungen national und EudraVigilance Signaldetektion Periodic Safety Update Reports (PSUR) Post-Authorisation Safety Studies (PASS) Aktive Überwachungsprogramme Daten aus der wissenschaftlichen Literatur
13 Spektrum berichteter Nebenwirkungen nach der Zulassung.. umfasst auch solche bei Off-label-Anwendung Fehlgebrauch Medikationsfehlern, d.h. unabsichtliche Fehlanwendung, z.b. Nicht-Beachtung von Kontraindikationen Dosierungsfehlern Verwechslungen Missbrauch im Sinne von absichtlicher Überdosierung Seltene Nebenwirkungen, die aufgrund geringer Fallzahl bei klinischen Prüfungen nicht entdeckt werden können Spontanerfassung
14 Nationale und internationale Informationswege Spontanmeldesystem Arzt, Apotheker, Patient, Anwälte, Landesbehörden, BMG IFG BerufsO. f. Ärzte, Apotheker pharmazeutische Unternehmer, Sponsoren Arzneimittelkommissionen der Heilberufe Vertrag 63c AMG, 13 GCP-VO Stufenplan WHO Bundesinstitut für Arzneimittel und Medizinprodukte 62 Abs. 3 AMG EMA
15 Spontanmeldesystem: Limitierungen keine systematische Datenerfassung Freiwilligkeit Ausmaß des underreportings oder overreportings unklar Zähler und Nenner unbekannt d.h. Exposition unbekannt, Anzahl der Fälle unklar daher keine quantitativen oder vergleichenden Häufigkeitsabschätzungen durchführbar Ergänzung des Kenntnisstandes durch Studien notwendig z.b. Sicherheitsstudien nach der Zulassung (sogenannte Post-authorisation safety studies) zur quantitativen Abschätzung des anwendungsbezogenen Risikos kontrollierte klinische Prüfungen epidemiologische Studien wie Fall-Kontroll- und Kohortenstudien Register
16 Nebenwirkungsmeldungen in Deutschland Berichte/55565 Eingänge Meldequellen: 14,730% 5,467% 85,270% Pharm. Unternehmer AMK Intensiv. Monitoring Andere 3,763% 0,179% 1,629% 2,633% 0,591% Ak der deutschen Ärzteschaft Ak der deutschen Zahnärzte Heilberufe Ak: Arzneimittelkommission 16
17 Nebenwirkungen (ATC code basiert) in unserem Spontanmeldesystem
18 Nebenwirkungen (%) von Antidepressiva Metaanalysis from 36 trials in acute MDD (Gartlehner et al. 2009) Webbased Monitoring for 6 months (Härmark et al. 2013)
19 Viele Meldungen = schlechtes Arzneimittel? Einflussgrößen des Meldeverhaltens Bekanntheit des Wirkstoffes/ der Wirkstoffklasse Höhere Aufmerksamkeit bei neuen Wirkstoffen Mediale Aufmerksamkeit Wissenschaftliche Literatur Digitale Medien (Fach-)Öffentlichkeit Schwere und Bedeutung der Nebenwirkung Verordnungszahlen
20 Ergebnisse zur Wirksamkeit Phase III ROCKET AF Schlaganfallprophylaxe bei Vorhofflimmern Behandlung Ereignis Xarelto Ereignisrate (100 Patientenjahre) Warfarin Ereignisrate (100 Patientenjahre) Hazard Ratio (95 % KI) p-wert Schlaganfall und systemische Embolie ohne Beteiligung des ZNS 269 (2,12) 306 (2,42) 0,88 (0,74 1,03) 0,117 Schlaganfall, systemische Embolie ohne Beteiligung des ZNS und vaskulärer Tod 572 (4,51) 609 (4,81) 0,94 (0,84 1,05) 0,265 Schlaganfall, systemische Embolie ohne Beteiligung des ZNS, vaskulärer Tod und Myokardinfarkt 659 (5,24) 709 (5,65) 0,93 (0,83 1,03) 0,158 Schlaganfall 253 (1,99) 281 (2,22) 0,90 (0,76 1,07) 0,221 systemische Embolie ohne Beteiligung des ZNS 20 (0,16) 27 (0,21) 0,74 (0,42 1,32) 0,308 Myokardinfarkt 130 (1,02) 142 (1,11) 0,91 (0,72 1,16) 0,464
21 Ergebnisse zur Sicherheit aus Phase III ROCKET AF Schlaganfallprophylaxe bei Vorhofflimmern Behandlung Ereignis Xarelto Ereignisrate (100 Patientenjahre) Warfarin Ereignisrate (100 Patientenjahre) Hazard Ratio (95 % KI) p-wert Schwere Blutungen 395 (3,60) 386 (3,45) 1,04 (0,90-1,20) 0,576 Tod durch Blutungen* 27 (0,24) 55 (0,48) 0,50 (0,31-0,79) 0,003 Kritische Organblutung* 91 (0,82) 133 (1,18) 0,69 (0,53-0,91) 0,007 Intrakranielle Blutung* 55 (0,49) 84 (0,74) 0,67 (0,47-0,93) 0,019 Hämoglobin-Abfall* 305 (2,77) 254 (2,26) 1,22 (1,03-1,44) 0,019 Transfusion von 2 oder mehr Einheiten Erythrozytenkonzentrat oder Vollblut* Nicht schwere klinisch relevante Blutungen 183 (1,65) 149 (1,32) 1,25 (1,01-1,55) 0, (11,80) (11,37) 1,04 (0,96-1,13) 0,345 Gesamtmortalität 208 (1,87) 250 (2,21) 0,85 (0,70-1,02) 0,073
22 Anzahl der Verdachtsfälle* mit Blutungen und tödlichem Verlauf (Deutschland) *Kausalzusammenhang im Einzelfall nicht eindeutig belegt N Rivaroxaban (AM Xarelto) Dabigatran (AM Pradaxa) Apixaban (AM Eliquis) Quelle: Nebenwirkungsdatenbank des BfArM, Stand:
23
24 Verordnungszahlen: NOAK Mio. DDD Rivaroxaban (AM Xarelto) Dabigatran-etexilatmesilat (AM Pradaxa ) Apixaban (AM Eliquis, ab 2013) Datenquelle: Arzneiverordnungsreport 2012, 2013, 2014, Springer-Verlag Berlin, Heidelberg 24
25 NOAK-Register Dresden 25
26 Maßnahmenkatalog zur Risikominimierung als Auflage für den Zulassungsinhaber Kennzeichnung ( schwarzes Dreieck ) Textanpassung von Fach- und Gebrauchsinformation Durchführung von Studien Verschreibungspflicht Erarbeitung von Schulungsmaterial Anwendungsbeschränkungen Kontrollierte Abgabesysteme Marktrücknahme
27 Forschung am BfArM Bewertung durch den Wissenschaftsrat 2014: Die aktuelle Einrichtung des Forschungsbereichs und die Besetzung der Forschungsdirektion im Jahr 2012 wird durch den WR ausdrücklich begrüßt. Fundierung der regulatorischen und beratenden Tätigkeiten durch qualitativ hochwertige eigene Forschung Spitzenstellung weiter festigen, zukünftig sicherstellen und ausbauen 27
28 Forschungsschwerpunkte Sicherheit und Wirksamkeit bzw. Leistungsfähigkeit von Arzneimitteln und Medizinprodukten Pharmakogenetik, Individualisierte Medizin Pharmakoepidemiologie Klinische Implantatsicherheit 28
29 Struktur der Forschung am BfArM DZNE Wissenschaftlicher Beirat Forschungsschwerpunkte Regulation DZIF Uni Bonn Zentrum für translationale Medizin Pharmakoepidemiologie Graduiertenschule Pharmakogenetik Individualisierte Medizin Implantatsicherheit Forschungs -abteilung - Nachwuchs -förderung - Seminare, Weiterbildung - Integration ins Haus Arzneimittelzulassung Pharmakovigilanz Medizinprodukte Legaler BTM-Verkehr Interner Forschungsrat Aufgabenbegleitende Forschung 29
30 Risikokommunikation der BOB
31 Zusammenfassung BfArM ist proaktiver Partner national und europäisch Zulassung und Vigilanz zunehmend verzahnt über den Lifecycle Zentralisierung und Harmonisierung der Pharmakovigilanz in der EU early access -Programme auf limitierter Datenbasis zunehmend in Entwicklung Forschungsaktivitäten zur Pharmakovigilanz werden ausgebaut Aktiverer Dialog mit Verbesserung der Transparenz und Kommunikation BfArM im Dialog Bulletin zur Arzneimittelsicherheit
32 BfArM: Wissenschaftliche und regulatorische Kompetenz Vielen Dank für Ihre Aufmerksamkeit!
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich
 Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Entwicklung und Zulassung von Arzneimitteln Der wachsende Druck auf Zulassungsentscheidungen Prof. Dr. Karl Broich
 Entwicklung und Zulassung von Arzneimitteln Der wachsende Druck auf Zulassungsentscheidungen Prof. Dr. Karl Broich Gliederung Organisation und Struktur Rolle in Europa Aktuelle und neue Zulassungswege
Entwicklung und Zulassung von Arzneimitteln Der wachsende Druck auf Zulassungsentscheidungen Prof. Dr. Karl Broich Gliederung Organisation und Struktur Rolle in Europa Aktuelle und neue Zulassungswege
Pharmakovigilanz: Risiken erfassen und kontrollieren
 Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Arzneimittel und Medizinprodukte: Funktion des BfArM
 Arzneimittel und Medizinprodukte: Funktion des BfArM Prof. Dr. med. Karl Broich Dr. Ansgar Schulte, MBA Prof. Dr. Karl Broich Wiss. Beirat BfArM 12.02.2016 Seite 1 Agenda Das BfArM Medizinprodukte Arzneimittelentwicklung
Arzneimittel und Medizinprodukte: Funktion des BfArM Prof. Dr. med. Karl Broich Dr. Ansgar Schulte, MBA Prof. Dr. Karl Broich Wiss. Beirat BfArM 12.02.2016 Seite 1 Agenda Das BfArM Medizinprodukte Arzneimittelentwicklung
Neue orale Antikoagulantien (NOAK) - - blutet es nun weniger im Gastrointestinaltrakt? 14. Februar FRANK SCHMITZ Klinikum Hildesheim GmbH
 Neue orale Antikoagulantien (NOAK) - - blutet es nun weniger im Gastrointestinaltrakt? 14. Februar 2014 FRANK SCHMITZ Klinikum Hildesheim GmbH Neue orale Antikoagulantien (NOAK) 1. Historie 2. Pharmakologie
Neue orale Antikoagulantien (NOAK) - - blutet es nun weniger im Gastrointestinaltrakt? 14. Februar 2014 FRANK SCHMITZ Klinikum Hildesheim GmbH Neue orale Antikoagulantien (NOAK) 1. Historie 2. Pharmakologie
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international
 Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess
 Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess Ministerialrat a. D. Dr. Horst Möller, ehem. Leiter des Referates Arzneimittelsicherheit des BMG, Außerordentliches Mitglied
Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess Ministerialrat a. D. Dr. Horst Möller, ehem. Leiter des Referates Arzneimittelsicherheit des BMG, Außerordentliches Mitglied
Pharmapackage. PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung. Rechtsanwalt Professor Burkhard Sträter
 Pharmapackage PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung Rechtsanwalt Professor Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Pharmapackage PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung Rechtsanwalt Professor Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
/ November 2008
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Zweites Deutsches Fernsehen Redaktion Frontal 21 Unter den Linden 36-38 10117 Berlin Postanschrift:
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Zweites Deutsches Fernsehen Redaktion Frontal 21 Unter den Linden 36-38 10117 Berlin Postanschrift:
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen
 Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen 81. Routinesitzung am 16.11.2017 16.11.2017 Seite 1 Scharfschaltung EudraVigilance 16.11.2017 Seite 2 Go-live -Plan der EMA 3.7.
Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen 81. Routinesitzung am 16.11.2017 16.11.2017 Seite 1 Scharfschaltung EudraVigilance 16.11.2017 Seite 2 Go-live -Plan der EMA 3.7.
Von den klinischen Studiendaten zur Indikation Kompass für die Nutzenbewertung?
 Bundesinstitut für Arzneimittel und Medizinprodukte Von den klinischen Studiendaten zur Indikation Kompass für die Nutzenbewertung? Karl Broich Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Bundesinstitut für Arzneimittel und Medizinprodukte Von den klinischen Studiendaten zur Indikation Kompass für die Nutzenbewertung? Karl Broich Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
ZUSAMMENFASSUNG. vfa-positionspapier Arzneimittelsicherheit
 vfa-positionspapier Arzneimittelsicherheit ZUSAMMENFASSUNG Über den gesamten Lebenszyklus eines Arzneimittels besteht eine Kernaufgabe der pharmazeutischen Unternehmen darin, das Risikoprofil von Arzneimitteln
vfa-positionspapier Arzneimittelsicherheit ZUSAMMENFASSUNG Über den gesamten Lebenszyklus eines Arzneimittels besteht eine Kernaufgabe der pharmazeutischen Unternehmen darin, das Risikoprofil von Arzneimitteln
Medikament nicht voreilig absetzen
 Schlaganfallvorbeugung, Dabigatran und Todesfälle Medikament nicht voreilig absetzen Berlin (23. November 2011) - Die aktuelle Diskussion um Todesfälle durch Blutungen oder eine erhöhte Herzinfarktrate
Schlaganfallvorbeugung, Dabigatran und Todesfälle Medikament nicht voreilig absetzen Berlin (23. November 2011) - Die aktuelle Diskussion um Todesfälle durch Blutungen oder eine erhöhte Herzinfarktrate
Dr. Simone Heinemann - Meerz Gemeinschaftspraxis Kardiologie-Angiologie
 Dr. Simone Heinemann - Meerz Gemeinschaftspraxis Kardiologie-Angiologie NOAK s sind (nicht) besser als Vitamin-K- Antagonisten GLIEDERUNG kurze Übersicht zur Pharmakologie der neuen oralen Antikoagulanzien
Dr. Simone Heinemann - Meerz Gemeinschaftspraxis Kardiologie-Angiologie NOAK s sind (nicht) besser als Vitamin-K- Antagonisten GLIEDERUNG kurze Übersicht zur Pharmakologie der neuen oralen Antikoagulanzien
Nutzenbewertung und unabhängige Arzneimittelinformationen
 Gemeinsame Fortbildungs- und Informationsveranstaltung der AkdÄ und der AMK Berlin, 11. Juli 2015 Nutzenbewertung und unabhängige Arzneimittelinformationen Dr. med. Katrin Bräutigam Geschäftsführerin der
Gemeinsame Fortbildungs- und Informationsveranstaltung der AkdÄ und der AMK Berlin, 11. Juli 2015 Nutzenbewertung und unabhängige Arzneimittelinformationen Dr. med. Katrin Bräutigam Geschäftsführerin der
Impfstoffsicherheit in Deutschland
 Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE
 DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
Herzrhythmusstörungen und Schlaganfall: Primär- und Sekundärprophylaxe
 Bayerischer Internistenkongress Herzrhythmusstörungen und Schlaganfall: Primär- und Sekundärprophylaxe Samstag, 17.10.2015 T. Korte Herz-Gefäss-Zentrum Nymphenburg am Klinikum Dritter Orden Vorhofflimmern
Bayerischer Internistenkongress Herzrhythmusstörungen und Schlaganfall: Primär- und Sekundärprophylaxe Samstag, 17.10.2015 T. Korte Herz-Gefäss-Zentrum Nymphenburg am Klinikum Dritter Orden Vorhofflimmern
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung
 Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung
 Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft
 Arzneimittelkommission der deutschen Ärzteschaft Fachausschuss der Bundesärztekammer Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft Zu den Änderungsvorschlägen der Europäischen Kommission
Arzneimittelkommission der deutschen Ärzteschaft Fachausschuss der Bundesärztekammer Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft Zu den Änderungsvorschlägen der Europäischen Kommission
Blutgerinnungsmanagement aus der Sicht des Gerinnungsexperten
 Blutgerinnungsmanagement aus der Sicht des Gerinnungsexperten Sabine Eichinger Univ. Klinik für Innere Medizin I Medizinische Universität Wien Direkte orale Antikoagulantien Eliquis Apixaban Lixiana Edoxaban
Blutgerinnungsmanagement aus der Sicht des Gerinnungsexperten Sabine Eichinger Univ. Klinik für Innere Medizin I Medizinische Universität Wien Direkte orale Antikoagulantien Eliquis Apixaban Lixiana Edoxaban
Was wissen wir, und was sollten wir wissen bei der Zulassung neuer Arzneimittel?
 Was wissen wir, und was sollten wir wissen bei der Zulassung neuer Arzneimittel? Wolf-Dieter Ludwig HELIOS Klinikum Berlin-Buch Klinik für Hämatologie, Onkologie, Tumorimmunologie und Palliativmedizin
Was wissen wir, und was sollten wir wissen bei der Zulassung neuer Arzneimittel? Wolf-Dieter Ludwig HELIOS Klinikum Berlin-Buch Klinik für Hämatologie, Onkologie, Tumorimmunologie und Palliativmedizin
IQWiG Herbstsymposium / Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V)
 IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
Paul-Ehrlich-Institut
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
INRswiss Tag DOAK. Aktueller Stand
 INRswiss Tag DOAK - Aktueller Stand Prof. Dr. Dr. med. Walter A. Wuillemin Abteilung für Hämatologie Hämatologisches Zentrallabor Luzerner Kantonsspital Universität Bern 64. Jähriger Hausarzt Aktenkonsilium
INRswiss Tag DOAK - Aktueller Stand Prof. Dr. Dr. med. Walter A. Wuillemin Abteilung für Hämatologie Hämatologisches Zentrallabor Luzerner Kantonsspital Universität Bern 64. Jähriger Hausarzt Aktenkonsilium
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
1. Hamburger Pharma Tag 17. April 2012. Pharmakovigilanzregelungen Ein wirkliches Plus für die Arzneimittelsicherheit?
 1. Hamburger Pharma Tag 17. April 2012 Pharmakovigilanzregelungen Ein wirkliches Plus für die Arzneimittelsicherheit? Simone Winnands Agenda Definitionen zur Pharmakovigilanz Pharmakovigilanz im Zulassungsumfeld
1. Hamburger Pharma Tag 17. April 2012 Pharmakovigilanzregelungen Ein wirkliches Plus für die Arzneimittelsicherheit? Simone Winnands Agenda Definitionen zur Pharmakovigilanz Pharmakovigilanz im Zulassungsumfeld
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v.
 Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße
 Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße 80. Routinesitzung am 16. Mai 2017 80. Routinesitzung 16. Mai
Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße 80. Routinesitzung am 16. Mai 2017 80. Routinesitzung 16. Mai
Pharmakovigilanz Basics und Beispiele Gemeinsame Fortbildungs- und Informationsveranstaltung von AkdÄ und AMK am 11.07.
 Pharmakovigilanz Basics und Beispiele Gemeinsame Fortbildungs- und Informationsveranstaltung von AkdÄ und AMK am 11.07.2015 in Berlin Dr. med. Thomas Stammschulte 13. Juli 2015 Interessenkonflikte Referent
Pharmakovigilanz Basics und Beispiele Gemeinsame Fortbildungs- und Informationsveranstaltung von AkdÄ und AMK am 11.07.2015 in Berlin Dr. med. Thomas Stammschulte 13. Juli 2015 Interessenkonflikte Referent
Paul-Ehrlich-Institut Bundesamt für Sera und Impfstoffe
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
Sicherheitsrelevante Hinweise für medizinische Fachkreise
 Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Dr. Johannes Knollmeyer Direktor Gesundheitspolitik Sanofi-Aventis Deutschland GmbH
 Versorgungsforschungskongress 2015 Versorgungforschung und klinische Forschung: Synergien und Alleinstellungsmerkmale Perspektive der pharmazeutischen Industrie Dr. Johannes Knollmeyer Direktor Gesundheitspolitik
Versorgungsforschungskongress 2015 Versorgungforschung und klinische Forschung: Synergien und Alleinstellungsmerkmale Perspektive der pharmazeutischen Industrie Dr. Johannes Knollmeyer Direktor Gesundheitspolitik
Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat
 Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat An der Blutgerinnung sind beteiligt: Blutplättchen (Thrombozyten) Gerinnungsfaktoren - im Blutplasma
Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat An der Blutgerinnung sind beteiligt: Blutplättchen (Thrombozyten) Gerinnungsfaktoren - im Blutplasma
Antikoagulation bei Vorhofflimmern
 Orale Antikoagulation bei VHF Was kommt nach Marcumar? Köln, 17. September 2011 Antikoagulation bei Vorhofflimmern Priv.-Doz. Dr. med. Jochen Müller-Ehmsen muller.ehmsen@uni-koeln.de Klinik III für Innere
Orale Antikoagulation bei VHF Was kommt nach Marcumar? Köln, 17. September 2011 Antikoagulation bei Vorhofflimmern Priv.-Doz. Dr. med. Jochen Müller-Ehmsen muller.ehmsen@uni-koeln.de Klinik III für Innere
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 13.11.2013 Inhaltsübersicht
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 13.11.2013 Inhaltsübersicht
Studien in der Onkologie Bewertung und Bedeutung
 Studien in der Onkologie Bewertung und Bedeutung Referentin Annette Schuster Münchner Studienzentrum am Klinikum rechts der Isar der Technischen Universität t MünchenM 1 eigentlich wollte ich nicht an
Studien in der Onkologie Bewertung und Bedeutung Referentin Annette Schuster Münchner Studienzentrum am Klinikum rechts der Isar der Technischen Universität t MünchenM 1 eigentlich wollte ich nicht an
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Antikoagulation bei erhöhtem gastro-intestinalem Blutungsrisiko
 Antikoagulation bei erhöhtem Antikoagulation bei Blutungsanamnese im GI-Trakt: Balanceakt zwischen Blutung, Ischämie und Embolie Prof. Frank M. Baer Interdisziplinäre Fortbildung, St. Antonius KH, 9.5.2012
Antikoagulation bei erhöhtem Antikoagulation bei Blutungsanamnese im GI-Trakt: Balanceakt zwischen Blutung, Ischämie und Embolie Prof. Frank M. Baer Interdisziplinäre Fortbildung, St. Antonius KH, 9.5.2012
Antikoagulation 2012: alles anders?
 Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Aktionsplan Arzneimitteltherapiesicherheit. Dr. Anne Dwenger Bundesministerium für Gesundheit
 Aktionsplan Arzneimitteltherapiesicherheit Dr. Anne Dwenger Bundesministerium für Gesundheit Relevanz der AMTS Ziel des AP In den USA ca. 7 % aller Krankenhausaufnahmen aufgrund von UAW (Lazarou et al,
Aktionsplan Arzneimitteltherapiesicherheit Dr. Anne Dwenger Bundesministerium für Gesundheit Relevanz der AMTS Ziel des AP In den USA ca. 7 % aller Krankenhausaufnahmen aufgrund von UAW (Lazarou et al,
Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen
 Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen PD Dr. med. Thomas Sudhop Abteilung Wissenschaftlicher Service Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM),
Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen PD Dr. med. Thomas Sudhop Abteilung Wissenschaftlicher Service Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM),
Gadolinium-haltige Kontrastmittel, Ablagerungen u.a. in Haut, Knochen und Gehirn Verfahren nach Art. 31 der RL 2001/83/EG
 Gadolinium-haltige Kontrastmittel, Ablagerungen u.a. in Haut, Knochen und Gehirn Verfahren nach Art. 31 der RL 2001/83/EG 78. Routinesitzung, 26. April 2016 Absender Titel 19.05.2016 Seite 1 Verwendung
Gadolinium-haltige Kontrastmittel, Ablagerungen u.a. in Haut, Knochen und Gehirn Verfahren nach Art. 31 der RL 2001/83/EG 78. Routinesitzung, 26. April 2016 Absender Titel 19.05.2016 Seite 1 Verwendung
Die Stellungnahme des Bundesinstitutes für Arzneimittel und Medizinprodukte ist zu diesem Thema eindeutig:
 Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014
 Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
V I N VerordnungsInfo Nordrhein
 V I N VerordnungsInfo Nordrhein Vitamin-K-Antagonisten (VKA*) oder neue orale Antikoagulantien (NOAK**) bei nicht valvulärem Vorhofflimmern? Seit der Einführung der neuen oralen Antikoagulantien (NOAKs)
V I N VerordnungsInfo Nordrhein Vitamin-K-Antagonisten (VKA*) oder neue orale Antikoagulantien (NOAK**) bei nicht valvulärem Vorhofflimmern? Seit der Einführung der neuen oralen Antikoagulantien (NOAKs)
Neue Antikoagulanzien
 1. Unabhängiger Fortbildungskongress der Ärztekammer Berlin, Berlin 1.12.2012 Workshop 2: Neue Antikoagulanzien Hans Wille Institut für Klinische Pharmakologie Klinikum Bremen Mitte ggmbh www.pharmakologie
1. Unabhängiger Fortbildungskongress der Ärztekammer Berlin, Berlin 1.12.2012 Workshop 2: Neue Antikoagulanzien Hans Wille Institut für Klinische Pharmakologie Klinikum Bremen Mitte ggmbh www.pharmakologie
nachrichtlich: Stufenplanbeteiligte, Zul mit DE= CMS
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen
 TÜV Süd Akademie Umsetzung der MDR/IVDR in der Praxis Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen der Marktüberwachung Dr. Andrea Röthler Head of Project Management, Manager
TÜV Süd Akademie Umsetzung der MDR/IVDR in der Praxis Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen der Marktüberwachung Dr. Andrea Röthler Head of Project Management, Manager
An Pharmazeutische Unternehmer (s. Verteiler) Stufenplanbeteiligte
 BfArM, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn An Pharmazeutische Unternehmer (s. Verteiler) ABTEILUNG Pharmakovigilanz BEARBEITET Dr. Gerhard Lauktien VON TEL +49 (0)228 99 307-5563 E-MAIL HAUSANSCH
BfArM, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn An Pharmazeutische Unternehmer (s. Verteiler) ABTEILUNG Pharmakovigilanz BEARBEITET Dr. Gerhard Lauktien VON TEL +49 (0)228 99 307-5563 E-MAIL HAUSANSCH
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Patientenrelevante Endpunkte bei ZNS-Indikationen Was geht? Dr. Karl Broich, Bundesinstitut für Arzneimittel und Medizinprodukte
 Patientenrelevante Endpunkte bei ZNS-Indikationen Was geht? Dr. Karl Broich, Bundesinstitut für Arzneimittel und Medizinprodukte AGENDA Rolle der Regulatoren Klinische Prüfung und Endpunkte bei ZNS-Indikationen
Patientenrelevante Endpunkte bei ZNS-Indikationen Was geht? Dr. Karl Broich, Bundesinstitut für Arzneimittel und Medizinprodukte AGENDA Rolle der Regulatoren Klinische Prüfung und Endpunkte bei ZNS-Indikationen
Vitamin-K- Antagonisten NOAK VKA. Neue orale Antikoagulanzien. Informationen für Ärzte: Vorteile VKA gegenüber NOAK
 Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Vorteile VKA gegenüber NOAK Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Vorteile VKA gegenüber NOAK Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Apotheker als Partner in der Arzneimittelsicherheit Christian Hoffmann Apothekerkammer Hamburg
 Apotheker als Partner in der Arzneimittelsicherheit Christian Hoffmann Apothekerkammer Hamburg Fachtagung Medikamentenabhängigkeit im Alter 21. August 2013 Ein paar Zahlen Patienten über 65 Jahre 48% >
Apotheker als Partner in der Arzneimittelsicherheit Christian Hoffmann Apothekerkammer Hamburg Fachtagung Medikamentenabhängigkeit im Alter 21. August 2013 Ein paar Zahlen Patienten über 65 Jahre 48% >
Vorsitzender der Ethikkommission der Bayerischen Landesärztekammer
 Prüferbewertung und Eignung von Prüfstellen Worauf achtet die Ethikkommission? Prof. Dr. Joerg Hasford Vorsitzender der Ethikkommission der Bayerischen Landesärztekammer Die nachfolgenden Ausführungen
Prüferbewertung und Eignung von Prüfstellen Worauf achtet die Ethikkommission? Prof. Dr. Joerg Hasford Vorsitzender der Ethikkommission der Bayerischen Landesärztekammer Die nachfolgenden Ausführungen
Vitamin-K- Antagonisten NOAK VKA. Neue orale Antikoagulanzien. Informationen für Ärzte: Umstellung von NOAK auf VKA
 Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Umstellung von NOAK auf VKA Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Umstellung von NOAK auf VKA Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT)
 Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Succimer. Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016
 Succimer Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Seite 1 Hintergrund Nebenwirkungsmeldung zu einem anaphylaktischen
Succimer Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Seite 1 Hintergrund Nebenwirkungsmeldung zu einem anaphylaktischen
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Was sind klinische Prüfungen Eine Einführung. Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa
 Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Pflanzliche und traditionelle Arzneimittel
 Pflanzliche und traditionelle Arzneimittel Dr. Friederike Stolte BfArM, Bonn Phytopharmaka Vollantrag (klinische Prüfungen und neue Tests) Bibliographischer Antrag (well-established, 10 Jahre) Mixed application
Pflanzliche und traditionelle Arzneimittel Dr. Friederike Stolte BfArM, Bonn Phytopharmaka Vollantrag (klinische Prüfungen und neue Tests) Bibliographischer Antrag (well-established, 10 Jahre) Mixed application
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs
 AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
Rivaroxaban. Indikation. Empfehlungen zur wirtschaftlichen Verordnungsweise (1 5)
 Ausgabe 2/2013 Wirkstoff AKTUELL Gemäß internationalen Leitlinien zählen VitaminKAntagonisten wie Phenprocoumon zum Standard in Indikation Alter 75 Jahre Schlaganfall Empfehlungen zur wirtschaftlichen
Ausgabe 2/2013 Wirkstoff AKTUELL Gemäß internationalen Leitlinien zählen VitaminKAntagonisten wie Phenprocoumon zum Standard in Indikation Alter 75 Jahre Schlaganfall Empfehlungen zur wirtschaftlichen
Womit haben wir es eigentlich zu tun?
 Womit haben wir es eigentlich zu tun? Wie häufig sind Thrombosen und Embolien? One of the least understood aspects of venous thrombosis risk is advancing age. Incidence rates ofvte increasedramaticallyataboutage55
Womit haben wir es eigentlich zu tun? Wie häufig sind Thrombosen und Embolien? One of the least understood aspects of venous thrombosis risk is advancing age. Incidence rates ofvte increasedramaticallyataboutage55
UNIVERSITÄTS- BIBLIOTHEK. Westdeutscher Verlag
 im-- Axel Murswieck Die staatliche Kontrolle der Arzneimittelsicherlieit in der Bundesrepublik und den USA UNIVERSITÄTS- BIBLIOTHEK t Westdeutscher Verlag INHALTSVERZEICHNIS VORWORT A- UNTERSUCHUNGSANSATZ
im-- Axel Murswieck Die staatliche Kontrolle der Arzneimittelsicherlieit in der Bundesrepublik und den USA UNIVERSITÄTS- BIBLIOTHEK t Westdeutscher Verlag INHALTSVERZEICHNIS VORWORT A- UNTERSUCHUNGSANSATZ
Umgang mit Medikationsfehlern - Ein Bericht der AG AMTS des BfArM - Dr. rer. nat. Claudia Kayser BfArM
 Umgang mit Medikationsfehlern - Ein Bericht der AG AMTS des BfArM - Dr. rer. nat. Claudia Kayser BfArM Zielsetzung Klare, eindeutige und allgemein verständliche Durch regulatorische Maßnahmen Medikationsfehler
Umgang mit Medikationsfehlern - Ein Bericht der AG AMTS des BfArM - Dr. rer. nat. Claudia Kayser BfArM Zielsetzung Klare, eindeutige und allgemein verständliche Durch regulatorische Maßnahmen Medikationsfehler
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015: Neue Daten aus klinischem Alltag bestätigen niedrige
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015: Neue Daten aus klinischem Alltag bestätigen niedrige
Service-Angebote des BPI
 Pharmakovigilanz Service-Angebote des BPI BPI-Pharmakovigilanz Knowledge Base Mit dem EU-Pharmapackage und dem Zweiten Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften vom 19. Oktober
Pharmakovigilanz Service-Angebote des BPI BPI-Pharmakovigilanz Knowledge Base Mit dem EU-Pharmapackage und dem Zweiten Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften vom 19. Oktober
Therapeutische Indikationen. Anwendungsfälle in europäischen Bereichen
 Therapeutische Indikationen Anwendungsfälle in europäischen Bereichen Dr. med. Hans-Peter Dauben Mannheim, 09.Sep 2010 Inhalt Therapeutische Indikationen - die medizinische und die autorisierte Indikation
Therapeutische Indikationen Anwendungsfälle in europäischen Bereichen Dr. med. Hans-Peter Dauben Mannheim, 09.Sep 2010 Inhalt Therapeutische Indikationen - die medizinische und die autorisierte Indikation
Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson
 Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Antrag auf Änderung der Verordnung über verschreibungspflichtige Arzneimittel für den Wirkstoff Fluticasonpropionat in der Darreichungsform Nasenspray
 Antrag auf Änderung der Verordnung über verschreibungspflichtige Arzneimittel für den Wirkstoff Fluticasonpropionat in der Darreichungsform Nasenspray 1. Juli 2014 Gegenstand des Antrags Aufhebung der
Antrag auf Änderung der Verordnung über verschreibungspflichtige Arzneimittel für den Wirkstoff Fluticasonpropionat in der Darreichungsform Nasenspray 1. Juli 2014 Gegenstand des Antrags Aufhebung der
Kritische Gesichtspunkte zu Umbrella Protokollen und Adaptiven Designs aus der Sicht der Genehmigungsbehörde
 Kritische Gesichtspunkte zu Umbrella Protokollen und Adaptiven Designs aus der Sicht der Genehmigungsbehörde Heiko Preußer, BfArM Sachgebietsleiter Klinik Fachgebiet Klinische Prüfung Historischer Überblick
Kritische Gesichtspunkte zu Umbrella Protokollen und Adaptiven Designs aus der Sicht der Genehmigungsbehörde Heiko Preußer, BfArM Sachgebietsleiter Klinik Fachgebiet Klinische Prüfung Historischer Überblick
Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln
 Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln vom 6. Dezember 2010 Abwehr von Gefahren durch Arzneimittel, Stufe II 1. SSRI und TCA: Risiko von Knochenbrüchen 2. SSRI, Venlafaxin
Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln vom 6. Dezember 2010 Abwehr von Gefahren durch Arzneimittel, Stufe II 1. SSRI und TCA: Risiko von Knochenbrüchen 2. SSRI, Venlafaxin
Bewertung von Arzneimitteln. Überblick über den AMNOG Prozess
 Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Tragende Gründe. Vom 19. Juni 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Qualitätsmanagement in klinischen Prüfungen
 Qualitätsmanagement in klinischen Prüfungen Dr. Katalina Mettke GCP Inspektorin FG GCP-Inspektionen 17. Januar 2017 Ringvorlesung QM K. Mettke 17.01.2017 Seite 1 Inhaltsverzeichnis 1. Was ist Qualitätsmanagement
Qualitätsmanagement in klinischen Prüfungen Dr. Katalina Mettke GCP Inspektorin FG GCP-Inspektionen 17. Januar 2017 Ringvorlesung QM K. Mettke 17.01.2017 Seite 1 Inhaltsverzeichnis 1. Was ist Qualitätsmanagement
Parenteralia. Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017
 Parenteralia Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Hintergrund Diskussion auf der 76. Sitzung
Parenteralia Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Hintergrund Diskussion auf der 76. Sitzung
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
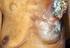 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Patientensicherheit und Sponsor-
 MEDIDATA GmbH Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Zulassungsanforderungen, Patientensicherheit und Sponsor- Interessen? Prof. Dr. med. Thomas D. Bethke, MBA, FFPM Medical Director,
MEDIDATA GmbH Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Zulassungsanforderungen, Patientensicherheit und Sponsor- Interessen? Prof. Dr. med. Thomas D. Bethke, MBA, FFPM Medical Director,
Aktuelle europäische Entwicklungen HMPWG und Arzneibuch
 Aktuelle europäische Entwicklungen HMPWG und Arzneibuch Dr. Christiane Kirchner Chr. Kirchner BfArM im Dialog 26.04.2016 Seite 1 Übersicht 1. Einleitung 2. Homeopathic Medicinal Products Working Group
Aktuelle europäische Entwicklungen HMPWG und Arzneibuch Dr. Christiane Kirchner Chr. Kirchner BfArM im Dialog 26.04.2016 Seite 1 Übersicht 1. Einleitung 2. Homeopathic Medicinal Products Working Group
Pharmakologie 1 Allgemeine Prinzipien Spezielle Arzneistoffgruppen 78
 Pharmakologie 1 Allgemeine Prinzipien 20 2 Spezielle Arzneistoffgruppen 78 I Allgemeine Prinzipien 1 Allgemeine Prinzipien 1.1 Arzneimittelherkunft Am Anfang der Entwicklung steht die Synthese neuer chemischer
Pharmakologie 1 Allgemeine Prinzipien 20 2 Spezielle Arzneistoffgruppen 78 I Allgemeine Prinzipien 1 Allgemeine Prinzipien 1.1 Arzneimittelherkunft Am Anfang der Entwicklung steht die Synthese neuer chemischer
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Dossierbewertung A15-29 Nutzenbewertung gemäß 35a SGB V Version 1.0 Edoxaban Prophylaxe von Schlaganfällen und SEE bei Patienten mit NVAF
 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Edoxaban gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Edoxaban gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen
 Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
