III, 1 66 (2015) c Thermodynamik. Dr. Jürgen Bolik. Technische Hochschule Nürnberg. f (v) 10 3 s m 1000 K 3000 K. m s
|
|
|
- Maike Ackermann
- vor 6 Jahren
- Abrufe
Transkript
1 III, 1 66 (2015) c 2015 Thermodynamik Dr. Jürgen Bolik Technische Hochschule Nürnberg f (v) 10 3 s m K K K 3000 K v m s
2 TH Nürnberg 2 Inhaltsverzeichnis 1 Grundbegriffe Die Temperatur Wärme und Energie Arbeit und innere Energie Die Wärmekapazität Thermische Ausdehnung Die kinetische Gastheorie und die Zustandsgleichung idealer Gase Die kinetische Gastheorie Die Zustandsgleichung idealer Gase Folgerungen aus der Zustandsgleichung für ideale Gase Der Zusammenhang von C p und C V Die Geschwindigkeitsverteilung im idealen Gas Reale Gase Zustandsänderungen idealer Gase Der zweite und der dritte Hauptsatz der Thermodynamik Der Begriff der Entropie Der zweite und der dritte Hauptsatz Wärmekraftmaschinen und Kraftwärmemaschinen Arbeitsdiagramme Der Wirkungsgrad von Carnot-Wärmekraftmaschinen Die Leistungszahl von Carnot-Kraftwärmemaschinen Reversible Kreisprozesse Wärmetransport Wärmeleitung Wärmestrahlung Konvektion Diffusiver Wärmetransport Wärmeübergang und Wärmedurchgang
3 TH Nürnberg 3 1 Grundbegriffe 1.1 Die Temperatur Sind zwei Systeme jedes für sich im Gleichgewicht und hat für beide Systeme die Temperatur T den gleichen Wert, so bleiben beide Systeme im Gleichgewicht, wenn sie miteinander in thermischen Kontakt gebracht werden. Nimmt T in beiden Systemen verschiedene Werte an, so bleiben beide Systeme nicht im Gleichgewicht, wenn sie miteinander in thermischen Kontakt gebracht werden. Welche Bedingung muss das System erfüllen, damit ein Test-System, genannt Thermometer existiert? Transitivität des thermischen Gleichgewichts Sind zwei Gleichgewichtssysteme mit einem dritten im thermischen Gleichgewicht, so sind sie auch untereinander im thermischen Gleichgewicht. Anmerkung: Der Satz wird oft als nullter Hauptsatz der Thermodynamik bezeichnet. Thermometer Zur Temperaturmessung sind im Prinzip alle Größen geeignet, die in reproduzierbarer Weise von der Temperatur abhängen. Am direktesten wäre eine Messung der Molekülenergie oder der Molekülgeschwindigkeit. Bequemer benutzt man in Quecksilber- oder Alkohol-Thermometern die Wärmeausdehnung von Flüssigkeiten, in Bimetallstreifen die von Festkörpern. Thermodynamische Temperaturskala und der Begriff der absoluten Temperatur Als Messnormal für die Einheit der absoluten Temperatur wurde der Tripelpunkt (Gleichgewichtspunkt der festen, flüssigen und gasförmigen Phase des Systems) des Wassers gewählt. Der Grund für diese Wahl ist die Tatsache, dass es nur einen einzigen Wert (p, T ) von Druck und Temperatur gibt, bei dem alle drei Phasen koexistieren können, und dass die Temperatur nicht durch Änderungen der Mengenverhältnisse von fester, flüssiger und gasförmiger Substanz beeinflusst wird.
4 TH Nürnberg 4 Seit 1960 wird dem Tripelpunkt des Wassers die Temperatur T t (in Kelvin) zugeordnet, wobei T t = 273, 16 K (exakt) p kpa 101,33 0,61 fest T flüssig gasförmig 0, ϑ C Abbildung 1.1 Der Tripelpunkt des Wassers Der Nullpunkt der Kelvinskala ist der absolute Nullpunkt.
5 TH Nürnberg 5 Verschiedene Temperaturskalen Das Kelvin (K), die Einheit der thermodynamischen Temperatur T, ist der 273,16-te Teil der thermodynamischen Temperatur des Tripelpunktes des Wassers. Grad Celsius ( C) ist die Einheit der Temperaturskala ϑ. Deren Bezugspunkte sind bei 1013,25 hpa: Schmelzpunkt des Eises: 0 C Siedepunkt des Wassers: 100 C Grad Fahrenheit ( F ) ist die Einheit einer weiteren Temperaturskala θ. Transformation der Temperaturskalen Die Umrechnung zwischen der Kelvin- und Celsius-Skala erfolgt mittels T K = ϑ C + 273, 15 und die zwischen Fahrenheit- und Celsius-Skala mittels θ F = 9 ϑ 5 C + 32
6 TH Nürnberg Wärme und Energie Der Versuch von James Prescott Joule ( ): Abbildung 1.2 Apparatur von Joule zur Messung des mechanischen Wärmeäquivalents Arbeit und innere Energie Wird das Volumen eines Systems quasi-statisch von V i auf V f verändert und hat während dieses Prozesses der mittlere Druck des Systems den messbaren Wert p(v ), dann ist die vom System geleistete Arbeit gegeben durch: W if = V f V i dw = V f V i p(v )dv. Der erste Hauptsatz der Thermodynamik Jedem Makrozustand eines Systems kann eine Größe U (genannt innere Energie) zugeordnet werden, die für abgeschlossene Systeme eine Erhaltungsgröße ist: U = const. Falls das System mit seiner Umgebung wechselwirken kann und dabei von einem Makrozustand in einen anderen übergeht, gilt für die Energieänderung U = W + Q. Dabei ist W die vom System geleistete makroskopische Arbeit. Die Größe Q heißt die vom System aufgenommene Wärmemenge.
7 TH Nürnberg 7 Wie ist der Zusammenhang von Arbeit und innerer Energie, wenn das System thermisch isoliert ist, d.h. Q = 0 gilt? Für Q = 0 gilt: oder U = W b U b U a = W ab = a dw Die innere Energie ist hierdurch bis auf eine beliebige additive Konstante bestimmt. Die Wärmeenergie Die Wärme Q ab, die vom System beim Übergang vom Makrozustand a zu einem anderen Makrozustand b absorbiert wird, ist definiert als Q ab = (U b U a ) + W ab, wobei W ab die vom System in diesem Prozess geleistete makroskopische Arbeit ist. Anmerkung: Bei Phasenübergängen (1. Ordnung) führt eine Erwärmung nicht notwendig zu einer Temperaturerhöhung (latente Wärme). Q Dampf Wasser Eis Abbildung 1.3 latente Wärme T Das Mol und die Avogadro-Zahl 1 Mol (mol) ist die Stoffmenge eines Systems, das aus ebensoviel Einzelteilchen besteht, wie Atome in 12 g des Elements 12 C enthalten sind. Damit enthält 1mol die Avogadro-Zahl an Teilchen, nämlich N A = 1g/mol 1, g = mol 1.
8 TH Nürnberg Die Wärmekapazität Wir betrachten ein makroskopisches System, dessen Zustand durch seine absolute Temperatur T beschrieben werden kann. Der Parameter y sei beispielsweise das Volumen V (isochore Zustandsänderung) oder der mittlere Druck p (isobare Zustandsänderung) des Systems und bleibe während einer Wärmezufuhr konstant. Bei der Temperatur T führen wir nun eine infinitesimal kleine Wärmemenge zu und halten dabei y konstant. Dann definieren wir ( ) dq C y := dt y als die Wärmekapazität des Systems, wobei der Index y angibt, welcher Parameter konstant bleibt. Dabei ist dq eine infinitesimal kleine, dem System zugeführte Wärmemenge. Die spezifische Wärmekapazität Die Wärmemenge, die einem homogenen System zugeführt werden muss, um eine gegebene Temperaturänderung dt hervorzurufen, wird der darin enthaltenen Materiemenge proportional sein. Daher ist es zweckmäßig, eine Größe, die spezifische Wärmekapazität, zu definieren, die nur von der Natur der Substanz und nicht von der vorhandenen Menge abhängt. Die spezifische Wärmekapazität (pro Masseneinheit) c y ist definiert durch c y := 1 m C y und die molare Wärmekapazität C mol,y ist definiert durch C mol,y := 1 ν C y. Dabei bezeichnet ν := N/N A und N die Anzahle der Moleküle. Anmerkung: Statt C mol,y schreiben wir auch C y. Unter welchen Bedingungen gilt Q = cm T, wobei c = c y?
9 TH Nürnberg 9 Allgemeiner erhalten wir T 2 Q = m c(t ) dt T 1 Spezifische und molare Wärmekapazitäten einiger Elemente bei 20 C Element c in J kg 1 K 1 rel. Atommasse µ C in J mol 1 K 1 Li ,94 23,4 Be ,02 15,9 Diamant C ,01 5,9 Mg ,32 24,7 Si ,06 20,1 K ,10 28,8 Fe ,85 25,5 Ag ,88 25,1 W ,92 24,7 Pb ,21 26,8 Tabelle 1.1 Spezifische und molare Wärmekapazität von Festkörpern Die relative Atommasse µ ist gegeben durch: µ := m A m 0, wobei m 0 = 1, kg die Atomgewichtseinheit und m A die Atommasse ist. Freiheitsgrade Bewegungsarten: Translation, Rotation, Schwingung Jede solche unabhängige Bewegungsmöglichkeit nennt man einen Freiheitsgrad. Bewegungsmöglichkeiten der Moleküle ergeben sich durch Translation, Rotation und Schwingung.
10 TH Nürnberg 10 Mit f bezeichnen wir die Summe f := f transl + f rot + f osc. Dabei ist f transl die Anzahl der Translationsfreiheitsgrade, f rot die Anzahl der Rotationsfreiheitsgrade und f osc ein Wert, der die Schwingungen berücksichtigt. Den Wert f nennen wir ebenfalls Freiheitsgrad. Freiheitsgrade von Gasmolekülen 1 Molekül- f transl f rot 2 osc f struktur 1-atomig atomig atomig, linear atomig, gewinkelt n-atomig, linear 3 2 3n-5 6n-5 n 2 n-atomig, gewinkelt 3 3 3n-6 6n-6 n 3 Tabelle 1.2 Freiheitsgrade : Die Rotation um die Molekülachse wird hier als eingefroren betrachtet. : Die beiden Deformationsschwingungen unterscheiden sich weder in der Symmetrie noch in der Frequenz.
11 TH Nürnberg 11 Die Zahl f für einige Gasmoleküle 1-atomige Moleküle: f = f transl = 3 Beispiele: Ar, He, Kr starre 2-atomige Moleküle: f = f transl + f rot = 5 Beispiele: H 2, O 2, N 2 bei Raumtemperatur oszillierende 2-atomige Moleküle: f = f transl + f rot + f osc = 7 Gleichverteilungssatz (Äquipartitionstheorem) Auf jeden Freiheitsgrad eines Moleküls entfällt im thermischen Gleichgewicht die gleiche mittlere Energie 1 2 kt. Dabei ist k = 1, J K 1 die Boltzmann-Konstante. Ein Molekül mit f Freiheitsgraden enthält daher die mittlere Gesamtenergie W = f 2 kt. Welche Energie benötigt man, um die Temperatur eines homogenen Körpers der Masse m, bestehend aus Atomen der Masse m A, von T 1 auf T 2 > T 1 zu erhöhen? Dazu braucht man die Energie m f m A 2 k T. Die Wärmekapazität des Körpers ist daher C = m m A f 2 k. Seine spezifische Wärmekapazität ist c = f 2m A k. Es gilt m A = µm 0, wobei µ die relative Atommasse und m 0 = 1, kg die Atomgewichtseinheit ist.
12 TH Nürnberg 12 Beispiel: Für Eisen erhalten wir c = 3k µm 0 = 444J kg 1 K 1, wegen f = f osc = 6 und µ = 55, 85. Der gemessenen Wert ist c = 460J kg 1 K 1. Die molare Wärmekapazität ist C mol = N A f 2 k. Die Regel von Dulong und Petit Für Metalle, und allgemein für Elementkristalle mit f = 6 gilt C mol = 3N A k = 24, 9J mol 1 K 1. Die Regel von Dulong und Petit ist, wie obige Tabelle zur molaren Wärmekapazität zeigt, für schwerere Elemente gut erfüllt. Im unteren Temperaturbereich treten Abweichungen von dieser Regel auf.
13 TH Nürnberg 13 Einfrieren von Schwingungs- und Rotationsfreiheitsgraden C mol R 3 Pb 2 Cu 1 C K T Abbildung 1.4 C mol (T ) von Elementkristallen Dabei ist die Gaskonstante R gegeben durch R := N A k = 8, 31 JK 1 mol 1. Anmerkungen zum Einfrieren der Schwingungs- und Rotationsfreiheitsgraden Bei tiefen Temperaturen geringere Energieaufnahme durch verringerte Freiheitsgrade. In der Nähe des absoluten Nullpunkts strebt der zugehörige energetische Beitrag gegen Null. Die Wärmekapazität von Gasen Bei Gasen muss man unterscheiden, ob die spezifische Wärmekapazität bei konstantem Volumen (c V ) oder bei konstantem Druck (c p ) gemessen wird. c p enthält auch die Arbeit, die das Gas bei seiner Wärmeausdehnung leisten muss. Bei Festkörpern ist der Unterschied weniger groß, da die Ausdehnung relativ gering ist.
14 TH Nürnberg 14 Spezifische und molare Wärmekapazitäten einiger Gase bei 0 C c p in c V in C p in C V in γ J kg 1 K 1 J kg 1 K 1 J mol 1 K 1 J mol 1 K 1 He ,9 12,6 1,66 Ar ,7 12,4 1,67 Luft ,1 20,7 1,40 O ,3 21,0 1,40 N ,0 20,7 1,40 H ,5 20,2 1,41 CO ,9 25,1 1,30 N 2 O ,1 26,5 1,29 Tabelle 1.3 Spezifische und molare Wärmekapazität von Gasen Der Adiabaten- oder Isentropen-Exponent γ ist gegeben durch: γ := c p c V = C p C V. Beispiele N 2 bei Zimmertemperatur Es gilt f = 5 für N 2 bei Zimmertemperatur. Nach Rechnung erhalten wir: c V = 738J kg 1 K 1. Die Messung ergibt: c V = 740J kg 1 K 1. H 2 O bei Zimmertemperatur Die Molekülatome von H 2 O sind hier nahezu frei. Wir setzen daher f = 6 für jedes einzelne Atom und rechnen mit der mittleren relativen Atommasse 1 ( ) = 6. 3 Damit erhalten wir rechnerisch: c = 4150J kg 1 K 1. Die Messung ergibt: c = 4185J kg 1 K 1. Zusammenhang der Einheiten Joule und cal Die Energie 4, 185J, die man braucht, um 1g H 2 O um 1K zu erwärmen, wird 1 cal genannt.
15 TH Nürnberg 15 Temperaturabhängigkeit von c V Translations-, Rotations- und Schwingungsanteile der Wärmekapazität sind temperaturabhängig. Die folgende Abbildung zeigt den Einfluss der Temperatur auf den Schwingungsanteil c osz der Wärmekapazität. c osz 0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 T h ν Abbildung 1.5 Die Wärmekapazität c osz (T ) für ein diatomares ideales Gas Kalorimeter Die spezifische Wärmekapazität c kann mit dem Mischungskalorimeter bestimmt werden. Thermometer Rührwerk Probekörper Abbildung 1.6 Mischungskalorimeter Mischungkalorimetrie In einem Gefäß bekannter Wärmekapazität C G befindet sich eine Wassermasse m 1 der Temperatur T 1. Der Probekörper, dessen c gemessen werden soll, hat die Masse m 2 und wird auf T 2 (z. B. im Wasserdampfbad, T 2 = 100 C ) erhitzt und in das Kalorimeter gegeben. Schließlich stellt sich eine Mischungstemperatur T m ein.
16 TH Nürnberg 16 Bestimmung der Wärmekapazität des Probekörpers Nach dem Energieerhaltungssatz erhalten wir Q 2 = cm 2 (T 2 T m ) = Q 1 = (c 0 m 1 + C G )(T m T 1 ) c 0 ist die spezifische Wärmekapazität des Wassers. Es folgt: c = c 0m 1 + C G m 2 T m T 1 T 2 T m.
17 TH Nürnberg Thermische Ausdehnung Anwendung: Beispielsweise für Thermometer (z.b. Quecksilber- oder Alkohol-Thermometer, Bimetallstreifen) Die Länge l eines Festkörpers hängt von der Temperatur T näherungsweise linear ab, d.h.: l = l 0 (1 + αt ). α heißt linearer Ausdehnungskoeffizient. Linearer Ausdehnungskoeffizient α in 10 6 K 1 Festkörper 100 C 300 C 500 C Quarzglas 0,510 0,627 0,612 Eisen 12,00 Aluminium 23,8 25,6 27,4 Kupfer 16,7 NaCl 40,0 Tabelle 1.4 Linearer Ausdehnungskoeffizient α für einige Materialien Der Raumausdehnungskoeffizient γ Die Abhängigkeit des Volumens V = V (T ) ergibt sich aus der Abhängigkeit l = l(t ). Für einen Würfel mit Kantenlänge l(t ) erhalten wir: V (T ) = (l(t )) 3 = l0(1 3 + αt ) 3 l0( αT ) = V 0 (1 + γt ), da αt 1 ist. Für den Raumausdehnungskoeffizienten gilt daher γ = 3α.
18 TH Nürnberg 18 Räumliche Ausdehnung von Flüssigkeiten Flüssigkeiten dehnen sich i.a. stärker aus als Festkörper. Raumausdehnungskoeffizient Flüssigkeit γ in 10 3 K 1 bei 18 C Aceton 1,43 Ethanol 1,62 Benzol 1,06 Quecksilber 0,181 Tabelle 1.5 Raumausdehnungskoeffizient γ für einige Flüssigkeiten Die Dichteanomalie des Wassers ρ 0 C 4 C ϑ Abbildung 1.7 Dichteanomalie des Wassers Dichtemaximum bei 4 C
19 TH Nürnberg 19 2 Die kinetische Gastheorie und die Zustandsgleichung idealer Gase 2.1 Die kinetische Gastheorie Die kinetische Gastheorie leitet die Eigenschaften der Gase aus mechanischen Bewegungsvorgängen der einzelnen Moleküle ab. Wir betrachten nun ein verdünntes Gas im Gleichgewichtsfall, das in einen quaderförmigen Kasten, eingeschlossen ist, wobei zwei gegenüberliegende Randflächen A 1 und A 2 jeweils den Flächeninhalt A haben. Wir interessieren uns dabei für die Frage: Wie viele Moleküle treffen in einer Zeiteinheit auf die Randflächen? u Δ t A Abbildung 2.1 Impulsübertragung und Gasdruck Annahmen Die Masse des Moleküls sei m. Die Moleküle verhalten sich wie vollkommen elastische Kugeln. Eine Wechselwirkung tritt nur durch Stöße auf. Die N Moleküle bewegen sich voneinander unabhängig, ohne eine Richtung im Raum zu bevorzugen, mit der Geschwindigkeit u := v2 = v2 x + v 2 y + v 2 z.
20 TH Nürnberg 20 Die Molekülzahldichte n := N V zeitlich konstant. ist homogen und, in Folge der Gleichgewichtsbedingung, In der Nähe von A 1 bewegen sich n Moleküle pro Volumeneinheit in und ebenso viele 6 entgegen der Normalenrichtung von A 1. Ein Molekül mit der Geschwindigkeit v gibt an die Wand den Impuls 2mv ab. Innerhalb des Quaders betrachten wir ein Volumen mit der Grundfläche A und der Höhe u t. Darin befinden sich nau t Moleküle. Nach unserem Modell wird daher folgende Kraft auf die Wand ausgeübt: F = 2mu 1 6 nau. Der auf die Wand ausgeübte Druck p ist daher p = 1 A F = 1 3 mnu2.
21 TH Nürnberg Die Zustandsgleichung idealer Gase Nach der kinetischen Wärmetheorie ist die Temperatur nur ein anderes Maß für die mittlere kinetische Energie der Moleküle. Betrachten wir nur die Translationsenergie, so erhalten wir nach dem Gleichverteilungssatz W trans = 1 2 mu2 = 3 2 kt. Die Grundgleichung der kinetischen Gastheorie von Daniel Bernoulli lässt sich daher folgendermaßen schreiben: p = nkt. Mit n = N V erhalten wir schließlich pv = NkT. p T V Abbildung 2.2 Der Graph der Zustandsfunktion p(v, T ) eines Idealgases Der Zustand einer gegebenen Masse M eines idealen Gases mit fester Teilchenzahl N ist damit durch die drei Größen T, p und V vollständig beschrieben. Zwei davon können unabhängig voneinander variiert werden. Die dritte ist dann eindeutig bestimmt. Setzen wir N = νn A und R = N A k = 8, 31JK 1 mol 1, so gilt: pv = νrt.
22 TH Nürnberg Folgerungen aus der Zustandsgleichung für ideale Gase Das Gesetz von Boyle-Mariotte: Bei konstanter Temperatur gilt p V 1 Das 1. Gesetz von Gay-Lussac: Bei konstantem Druck gilt V T Das 2. Gesetz von Gay-Lussac: Bei konstantem Volumen gilt p T Anmerkung: Die zusätzlichen Bezeichnungen Gesetz von Charles und Gesetz von Amontons werden in der Literatur leider nicht einheitlich verwendet. Das 1. Gesetz von Gay-Lussac lässt sich auch folgendermaßen formulieren V (T ) = V 0 (1 + γ 0 (T T 0 )) mit γ 0 := 1 T 0, wobei V 0 := V 0 (T 0 ) ist. γ 0 ist der Volumenausdehnungskoeffzient γ bei der Temperatur T 0. Anmerkung: Rechnerisch ist hierbei V (T = 0 K) = 0. Betrachten wir nun T 0 = 273, 15 K, so zeigt sich, dass für die Volumenausdehnung eines Idealgases: Bei einer Temperaturerhöhung um 1 K beträgt die Volumenausdehnung 1 273,15 = 3, des Volumens bei 0 C.
23 TH Nürnberg 23 Die folgende Tabelle bietet einen Vergleich dieses theoretischen Wertes mit empirischen Daten für den Raumausdehnungskoeffizienten im Temperaturbereich T [0 C, 100 C]: Raumausdehnungskoeffizient γ in 10 3 K 1 Luf t 3,675 H 2 3,662 He 3,660 Ar 3,676 CO 2 3,726 Tabelle 2.1 Raumausdehungskoeffizient γ für einige Gase Das Gesetz von Avogadro für Idealgase zweier Gase ist, bei gleicher Temperatur und gleichem Druck, iden- Das Molvolumen V ν tisch. oder anders formuliert Zwei gleich große Gasvolumina enthalten bei gleicher Temperatur und gleichem Druck die gleiche Anzahl von Teilchen. Begründung: Nach der Zustandsgleichung erhalten wir ν = pv RT. Anmerkung: Für p 0 = 1013, 25 hp a und T 0 = 273, 15 K erhalten wir V ν = R T 0 p 0 = 22, 4 dm3 mol.
24 TH Nürnberg Der Zusammenhang von C p und C V Bei konstantem Druck erfordert die Erwärmung eines Gases mehr Energie als bei konstantem Volumen, da das System auch für die Volumenzunahme Energie benötigt. Nach dem 1. Gesetz von Gay-Lussac erhalten wir und somit V = V T T p V = pv T T T = νrt T = νr T Daher gilt für die molare Wärmekapazität C p C p = C V + R = ( f 2 + 1)R und für den Adiabaten-Exponenten γ := C p = f + 2 C V f Daher erhalten wir für die Molwärmen C V und C p in Abhängigkeit von f: Molwärmen von Gasen nach der kinetischen Theorie der Wärme Molekül- f C V C p γ struktur in J mol 1 K 1 in J mol 1 K 1 1-atomig 3 12,5 20,8 1,667 2-atomig 5 20,8 29,1 1,40 3-atomig, gewinkelt 6 24,9 33,3 1,33 Tabelle 2.2 Molwärmen C V und C p von Gasen : Die Moleküle werden hier als nicht-oszillierend vorausgesetzt.
25 TH Nürnberg Die Geschwindigkeitsverteilung im idealen Gas Die Geschwindigkeitsverteilung f(v) Wir betrachten ein verdünntes Gas bestehend aus N Molekülen der Masse m mit Volumen V, wobei sich der Schwerpunkt des Systems mit der Geschwindigkeit v bewegt. Für die Molekülgeschwindigkeit in Luft erhalten wir, abhängig von der Temperatur, folgende Verteilungsfunktion f(v): f (v) 10 3 s m K K K 3000 K v m s Abbildung 2.3 Die Geschwindigkeitsverteilung in Luft Die Maxwell-Boltzmann-Verteilung Die Funktion f : R 3 R mit m f(v) := ( 2πkT ) 3 2 e m v 2 2kT ist die Wahrscheinlichkeitsdichte der Maxwell-Boltzmann-Verteilung. Auch für die (kartesischen) Geschwindigkeitskomponenten lassen sich Verteilungsfunktionen angeben. Hinsichtlich v x gilt m g(v x ) = ( 2πkT ) 1 2 e mvx 2 2kT.
26 TH Nürnberg 26 Der Mittelwert u Um u zu bestimmen, betrachten wir v 2 x = vxg(v 2 m x ) dv x = ( 2πkT ) 1 2 vxe 2 mv 2 x 2kT dvx. Dabei ist g(v x ) die Dichtefunktion einer Gauß-Verteilung, falls T = const. Mit folgt 0 x 2 e a2 x 2 dx = m v x 2 = ( 2πkT ) 1 2 π 4a 3, für a > 0, π 2 (2kT m ) 3 2 = kt m. y N (0,1) N (0,2) N (0, 3 2 ) Abbildung 2.4 Die Dichtefunktion der Normalverteilung x Wegen v 2 x = v 2 y = v 2 z, können wir v 2 = 3 v 2 x und somit schreiben. 1 2 m v 2 = 3 2 kt Damit erhalten wir wieder 3kT u = m.
27 TH Nürnberg Reale Gase Die oben genannte Zustandsgleichung gilt für ein Idealgas, in dem die Teilchen, abgesehen von kurzzeitigen Stößen keine Kräfte aufeinander ausüben und ein vernachlässigbares Eigenvolumen haben. Diese Voraussetzungen sind umso schlechter erfüllt, je dichter das Gas und je tiefer die Temperatur ist. Da Moleküle einen gewissen Raum beanspruchen und Anziehungskräfte aufeinander ausüben, ist die Zustandsgleichung des idealen Gases nicht allgemein gültig. Die van der Waals-Gleichung Ein besseres Modell als die Zustandsgleichung des Idealgases bietet die van der Waals-Gleichung (p + a )(V Vm 2 m b) = RT Dabei sind die Größen a und b Konstanten und V m das molare Volumen. p T >T c T =T c T <T c Abbildung 2.5 Van der Waals-Isothermen V Die Temperatur, oberhalb der sich ein Gas durch Druckerhöhung nicht mehr verflüssigen lässt, heißt seine kritische Temperatur T c.
28 TH Nürnberg Zustandsänderungen idealer Gase Hierbei werden Änderungen der Zustandsgrößen p, V, T betrachtet. Die Teilchenzahl N ist konstant. Wir unterscheiden zwischen isochoren Zustandsänderungen isobaren Zustandsänderungen isothermen Zustandsänderungen adiabatischen Zustandsänderungen Ist die innere Energie, wie bei idealen Gasen, Bewegungsenergie, so gilt: du = νc V dt. Weitere Formen der inneren Energie zeigen sich, wenn Energie bei Schmelz- Verdampfungs- oder Lösungsvorgängen, oder beispielsweise zur Überwindung der chemischen Bindungsenergie oder elektromagnetischen Wechselwirkung aufgewandt wird.
29 TH Nürnberg 29 a) Isochore Zustandsänderung Hier ist V = const. Somit gilt p T. p p 1 T 1 p 0 T 0 V 0=V 1 V Abbildung 2.6 Isochore Zustandsänderung Außerdem gilt hier dv = 0. Nach dem 1. Hauptsatz erhalten wir du = dq p dv du = dq. Anmerkung: Wir verwenden hier dq lediglich im Sinne einer bequemen Schreibweise, also auch dann, wenn Q hinsichtlich der zu betrachtenden Variablen nicht differenzierbar ist. Ferner gilt dq = νc V dt.
30 TH Nürnberg 30 b) Isobare Zustandsänderungen Hier ist p = const. Somit gilt V T. p p 0= p 1 T 1 T 0 V 0 V 1 V Abbildung 2.7 Isobare Zustandsänderung Nach dem 1. Hauptsatz erhalten wir du = dq p dv. Ferner gilt dq = νc p dt und nach der Zustandsgleichung für ideale Gase pdv = νrdt. Insgesamt erhalten wir daher du = νdt (C p R) = νc V dt.
31 TH Nürnberg 31 c) Isotherme Zustandsänderungen Hier ist T = const. Somit gilt p V 1. p p 1 T 0 =T 1 p 0 V 1 V 0 V Abbildung 2.8 Isotherme Zustandsänderung Die innere Energie U eines Idealgases mit f Freiheitsgraden und N Molekülen beträgt U = f 2 NkT. Da hier T konstant ist, erhalten wir U = 0 und nach dem 1. Hauptsatz: V 1 Q p dv = 0 V 0 Außerdem gilt hier V 1 V 0 p dv = νrt V 1 V 0 Schließlich erhalten wir Q = νrt ln( V 1 V 0 ). 1 V dv = νrt ln V V1 = νrt ln( V 1 ). V 0 V 0
32 TH Nürnberg 32 d) adiabatische Zustandsänderungen Eine thermodynamische Zustandsänderung ohne Wärmeaustausch (d.h. mit dq = 0) wird adiabatisch genannt. p p 1 p 0 V 1 V 0 V Abbildung 2.9 Adiabatische Zustandsänderung Der 1. Hauptsatz lautet dq = du + p dv. Für die innere Energie U eines Idealgases gilt du = νc V dt. Daher erhalten wir für eine adiabatische Zustandsänderung: νc V dt = p dv. Mit der Zustandsgleichung des Idealgases p = νrt V 1 und der molaren Wärmekapazität C V, mit C V = f 2 R, erhalten wir f 2 dt T = dv V. Eine Integration impliziert V T f 2.
33 TH Nürnberg 33 Mit dem Adiabatenexponent γ = f + 2 f erhalten wir V T 1 γ 1 Mit Hilfe der Zustandsgleichung erhalten wir und daher T = pv νr pv νr V γ 1 = const. Zusammengefasst bedeutet das: p V γ mit γ: 1 < γ 5 3. Zum Vergleich: Für die Isothermen des Idealgases gilt p V 1. Betrachten wir nun p V γ und beispielsweise V T 1 γ 1 so zeigt sich, dass sich p auch als Funktion mit der Temperatur T als einziger Variablen ausdrücken lässt: So erhalten wir p T γ γ 1. Zusammengefasst lauten die Adiabaten- oder Poisson-Gleichungen: pv γ = c 1 T V γ 1 = c 2 p 1 γ T γ = c 3. Dabei sind c i, i = 1, 2, 3 reelle Konstanten.
34 TH Nürnberg 34 Bei adiabatischer Kompression wird das Gas erwärmt. Ursache ist die, bei der Kompression geleistete Arbeit. Anders als bei der isothermen Kompression kann hier die Wärme nicht an ein Wärmebad abgeführt werden. Die Temperaturerhöhung lässt sich mittels T 1 T 0 = ( V 1 V 0 ) 1 γ berechnen. W und U lassen sich auch für adiabatische Zustandsänderungen berechnen: Es gilt für γ 1: V 1 V 0 p dv = c 1 V 1 V 0 V γ dv = V 1 V 0 V γ dv, wobei Da c 1 = pv γ, erhalten wir schließlich 1 γ + 1 V γ+1 V1 = 1 1 γ (V1 V 1 γ 0 ). V 0 1 γ V 1 Der Term V 0 p dv = 1 1 γ (p 1V γ 1 V 1 γ 1 p 0 V γ 0 V 1 γ 0 ) = 1 1 γ (p 1V 1 p 0 V 0 ). U = 1 1 γ (p 1V 1 p 0 V 0 ) lässt sich mit Hilfe der Zustandsgleichung folgendermaßen umformen: U = 1 γ 1 νr (T 1 T 0 ). Berücksichtigen wir, dass für γ γ = f + 2 f = f
35 TH Nürnberg 35 und für die molare Wärmekapazität C V C V = f 2 R gilt, so zeigt sich, dass R γ 1 = C V. Somit erhalten wir für die Änderung der inneren Energie U wieder U = νc V T. Betrachten wir die Bestimmung der inneren Energie wie in unserer Bemerkung zum 1. Hauptsatz der Thermodynamik, so zeigt sich, dass die innere Energie eines idealen Gases durch du = νc V dt auch allgemein, d.h. nicht nur im Rahmen adiabatischer Zustandsänderungen, bis auf eine additive Konstante, bestimmt ist.
36 TH Nürnberg 36 e) Beschreibungen und Folgerungen der Zustandstandsänderungen Überblick Beschreibung der Zustandsänderung Zustandsänderung Bedingung Graph im Funktionen der p(v )-Diagramm Zustandsgrößen isochor dv = 0 V = const. pt 1 = const. isobar dp = 0 p = const. V T 1 = const. isotherm dt = 0 p V 1 pv = const. adiabatisch dq = 0 p V γ pv γ = const. (isentrop) T V γ 1 = const. p 1 γ T γ = const. Folgerungen der Zustandsänderung Zustandsänderung I. Hauptsatz Q V 1 V 0 p dv isochor du = dq Q = νc V T 0 isobar du = dq p dv Q = νc p T p V isotherm dq = p dv Q = νrt ln( V 1 V 0 ) Q adiabatisch du = p dv Q = γ (p 1V 1 p 0 V 0 ) (isentrop) Tabelle 2.3 Überblick: Zustandsänderungen Anmerkung: C p und C V werden hier als von T unabhängige Größen vorausgesetzt.
37 TH Nürnberg 37 3 Der zweite und der dritte Hauptsatz der Thermodynamik 3.1 Der Begriff der Entropie Der mikroskopisch-statistische Begriff der Entropie S ist mit der Wahrscheinlichkeit P eines Zustandes verknüpft. Der makroskopisch-phänomenologische Begriff der Entropie ist hingegen mit der aufgenommenen Wärmemenge und der Temperatur verknüpft. Zusätzlich nehmen wir hierbei an, dass die Zustandsänderung zwischen zwei Makrozuständen eines Gleichgewichtssystems, als quasistatischer infinitesimaler (d.h. reversibler) Prozess stattfindet. Dabei definieren wir S folgendermaßen: Nach der mikroskopisch-statistischen Definition durch S = k ln P. und nach der makroskopisch-phänomenologischen Definition durch ds = dq T. Die letztere, klassische Definition besagt, dass sich der infinitesimale Unterschied der Entropie zweier benachbarter Systemzustände ds bestimmen lässt mittels der, bei einer bestimmten absoluten Temperatur T, in einem reversiblen Prozess, vom System aufgenommenen infinitesimalen Wärmeenergie dq.
38 TH Nürnberg 38 Wir nehmen an, dass sich zum Zeitpunkt t 0 alle N Moleküle eines Gases in einer Gefäßhälfte befinden sich die Moleküle, abgesehen von Stößen an den Gefäßwänden oder bei Kollisionen der Gasteilchen, mit gleicher Wahrscheinlichkeit in jede beliebige Richtung des Raumes bewegen können, Wechelwirkungen nur durch diese Stöße auftreten und N hinreichend groß ist. Liegen keine weiteren Einschränkungen vor, so beträgt die Wahrscheinlichkeit, dass nach einer angemessenen Zeit dieser Zustand 0 vorliegt P = 2 N. Folglich ist die Wahrscheinlichkeit, dass dann der komplementäre Zustand 1 vorliegt, etwa 2 N - mal größer als das Eintreten des Zustandes 0. Daher ist die Entropie des Zustandes 1 um etwa S = k ln 2 N = kn ln 2 höher als die für Zustand 0. Andererseits gilt für den Wärmeaustausch bei isothermer Expansion Q = νrt ln V 1 V 0 = νrt ln 2. Demnach erhalten wir, nun nach der klassischen Definition der Entropie, S = Q T Anmerkungen = νr ln 2 = kn ln 2. für isochore Zustandsänderungen gilt ds = dq T = νc dt V T und damit, bei konstantem C V, 1 T = T (S) = T 0 exp( S). νc V für isobare Zustandsänderungen gilt ds = dq T = νc dt p T und damit, bei konstantem C p, T = T (S) = T 0 exp( 1 νc p S).
39 TH Nürnberg Der zweite und der dritte Hauptsatz Zweiter Hauptsatz Die Entropie S erfüllt für jeden Makrozustand eines Gleichgewichtssystems die folgenden Bedingungen: Für jeden Prozess zwischen zwei Gleichgewichtszuständen eines thermisch isolierten Systems gilt: S 0. Durchläuft ein nicht-abgeschlossenes System einen quasistatischen infinitesimalen Prozess, wobei es die Wärmemenge dq aufnimmt, so gilt ds = dq T. Der erste Hauptsatz der Thermodynamik schließt ein perpetuum mobile erster Art aus. Das wäre eine Maschine, die Arbeit leistet, ohne weitere Veränderungen in der Natur herbeizuführen, d.h. der Umgebung Energie zu entziehen. Der zweite Hauptsatz der Thermodynamik schließt ein perpetuum mobile zweiter Art aus. Das wäre eine Maschine, die Arbeit leistet, indem sie als einzige Veränderung in der Natur ein Wärmereservoir abkühlt. Eine derartige Maschine könnte jede Zustandsänderung in einen reversiblen Prozess einbetten, so dass es keine irreversiblen Vorgänge gäbe. Dritter Hauptsatz Die Entropie S eines Gleichgewichtssystems hat die Grenzwerteigenschaft S S 0 für T 0. Dabei ist S 0 eine von den Systemparametern unabhängige Konstante.
40 TH Nürnberg Wärmekraftmaschinen und Kraftwärmemaschinen Unter einem Kreisprozess verstehen wir eine Folge von Zustandsänderungen, die periodisch durchlaufen wird. Damit erhalten wir Maschinen, die eine Folge von Zustandsänderungen zyklisch durchlaufen. Zusätzlich können wir uns die Folge von Zustandsänderungen auch in umgekehrter Reihenfolge denken. Wärmekraftmaschinen wandeln Wärmeenergie in mechanische Energie um. Beispiele: Dampfmaschinen, Verbrennungsmotoren, Gas- und Dampfturbinen Kraftwärmemaschinen wandeln mechanische Energie in Wärmeenergie um. Beispiele: Kältemaschinen (Kühlschrank, Klimaanlage), Wärmepumpe Q 2 Q 2 W W Q 1 Q 1 Wärmekraftmaschine Kraftwärmemaschine Abbildung 3.1 Wärme und Arbeit Bei Wärmekraftmaschinen wird Wärme dem heißen Gas entzogen, mechanische Energie abgegeben und Wärme an das kühle Gas abgeführt.
41 TH Nürnberg 41 Bei Kraftwärmemaschinen wird Wärme dem heißen Gas zugeführt, mechanische Energie zugeführt und Wärme dem kühlen Gas entzogen Arbeitsdiagramme Der Carnot-Kreisprozess Folge der Zustandsänderungen: isotherm, adiabatisch, isotherm, adiabatisch p V V Abbildung 3.2 Carnot-Zyklus im p-v-diagramm T S Abbildung 3.3 Carnot-Zyklus im T-S-Diagramm
42 TH Nürnberg 42 Der Stirling-Kreisprozess Folge der Zustandsänderungen: isotherm, isochor, isotherm, isochor p V Abbildung 3.4 Stirling-Zyklus im p-v-diagramm T S Abbildung 3.5 Stirling-Zyklus im T-S-Diagramm
43 TH Nürnberg 43 Der Otto-Kreisprozess Folge der Zustandsänderungen: adiabatisch, isochor, adiabatisch, isochor p V Abbildung 3.6 Otto-Zyklus im p-v-diagramm T S Abbildung 3.7 Otto-Zyklus im T-S-Diagramm
44 TH Nürnberg 44 Der Diesel-Kreisprozess Folge der Zustandsänderungen: isobar, adiabatisch, isochor, adiabatisch p V Abbildung 3.8 Diesel-Zyklus im p-v-diagramm T S Abbildung 3.9 Diesel-Zyklus im T-S-Diagramm
45 TH Nürnberg Der Wirkungsgrad von Carnot-Wärmekraftmaschinen Der Carnot-Kreisprozess p V V Abbildung 3.10 Carnot-Zyklus im p-v-diagramm Folge der Zustandsänderungen: 1.) isotherme Expansion 1 2, 2.) adiabatische Expansion 2 3, 3.) isotherme Kompression 3 4, 4.) adiabatische Kompression 4 1 isotherme Expansion 1 2 und isotherme Kompression 3 4 Die innere Energie U ist konstant, d.h. U = 0. Wärmeaustausch bei 1 2 Q = νrt 1 ln( V 2 V 1 ) und bei 3 4 Q = νrt 3 ln( V 4 V 3 ) adiabatische Expansion 2 3 und adiabatische Kompression 4 1 Die Wärmeenergie Q ist konstant, d.h. Q = 0. Mit unserer Formel für die innere Energie du = νc V dt erhalten wir daher bei 2 3: V 3 V 2 p dv = νc V (T 3 T 2 )
46 TH Nürnberg 46 V 1 und bei 4 1: V 4 p dv = νc V (T 1 T 4 ). Um den Wirkungsgrad einer Carnot-Wärmekraftmaschine zu berechnen, bestimmen wir den Wert p dv hinsichtlich eines Carnot-Kreisprozesses. Für die beiden adiabatischen Prozesse berücksichtigen wir: Da T 2 = T 1 und T 4 = T 3 gilt, unterscheiden sich die Werte für die Volumenarbeit bei 2 3 und 4 1 nur durch das Vorzeichen und heben sich daher auf. Für die beiden isothermen Prozesse berücksichtigen wir: Sowohl T 2 = T 1 und T 4 = T 3 sind durch die Adiabatengleichung verknüpft. So gilt und daher T 1 T 4 = ( V 4 V 1 ) γ 1 = T 2 T 3 = ( V 3 V 2 ) γ 1 V 4 V 3 = V 1 V 2. Betrachten wir einen Umlauf , so erhalten für den gesamten Wärmeaustausch Q: Q = νrt 1 ln( V 2 V 1 ) + νrt 3 ln( V 4 V 3 ) = νr ln( V 2 V 1 )(T 1 T 3 ) und für die nutzbare mechanische Arbeit W Nutzen W Nutzen = νr ln( V 2 V 1 )(T 1 T 3 ). Für den Wirkungsgrad einer Wärmekraftmaschine gilt η = W Nutzen Q Aufwand.
47 TH Nürnberg 47 Daher erhalten wir η = νr ln( V 2 V 1 )(T 1 T 3 ) νrt 1 ln( V 2 V 1 ) = T 1 T 3 T Die Leistungszahl von Carnot-Kraftwärmemaschinen Nun betrachten wir einen Umlauf (entgegen dem Uhrzeigersinn). Hier wird die mechanische Arbeit aufgewandt, um Wärmeenergie auszutauschen. Für die Leistungszahl ɛ einer Kraftwärmemaschine gilt ɛ = Q Nutzen W Aufwand. Kältemaschinen Nutzen: Wärme, die bei der isothermen Expansion 4 3 ausgetauscht wird. Der Wärmeaustausch Q bei 4 3 beträgt Q = νrt 3 ln( V 3 V 4 ) = νrt 3 ln( V 2 V 1 ). W Aufwand für eine Carnot-Kraftwärmemaschine ist gleich dem Wert von W Nutzen für eine Carnot-Wärmekraftmaschine. Für die Leistungszahl erhalten wir daher ɛ = νrt 3 ln( V 2 V 1 ) νr ln( V 2 V 1 )(T 1 T 3 ) = T 3. T 1 T 3
48 TH Nürnberg 48 Wärmepumpe Nutzen: Wärme, die bei der isothermen Kompression 2 1 ausgetauscht wird. Der Wärmeaustausch Q bei 2 1 beträgt Q = νrt 1 ln( V 1 V 2 ) = νrt 1 ln( V 2 V 1 ). Für die Leistungszahl erhalten wir daher ɛ = νrt 1 ln( V 2 V 1 ) νr ln( V 2 V 1 )(T 1 T 3 ) = T 1. T 1 T Reversible Kreisprozesse Wir nennen einen periodisch und reversibel arbeitenden thermischen Energiewandler, dessen Wärmeaustausch zwei Wärmereservoirs 1 und 2 nutzt Carnot-Maschine und den zyklischen Prozess von Zustandsänderungen, den die Maschine hervorruft, einen Carnot-Kreisprozess.
49 TH Nürnberg 49 Angenommen, es gebe zwei Carnot-Wärmekraftmaschinen A und B mit η A > η B, dann könnten wir die Laufrichtung von B umkehren und B als Kältemaschine nutzen. 2 Q 2B Q 2A B W B A W A W B Q 1B Q 1A 1 Abbildung 3.11 Wirkungsgrad reversibler Kreisprozesse Bei jedem Zyklus, würde die Wärmekraftmaschine A die Wärme Q 2,A aus dem Reservoir 2 entnehmen, die Arbeit W A = η A Q 2,A verrichten und die Wärme Q 1,A an Reservoir 1 abgeben. Entsprechend würde die Kältemaschine B die Wärme Q 1,B aus dem Reservoir 1 entnehmen, die Arbeit W B nutzen und die Wärme Q 2,B = W B η 1 B an Reservoir 2 abgeben. Wir können dabei annehmen, dass Q 2,B = Q 2,A ist. Nach unserer Annahme ist η A > η B und daher wäre die Arbeit W B, die B nutzt kleiner als die Arbeit W A, die A verrichtet.
50 TH Nürnberg 50 Damit hätten wir insgesamt Arbeit verrichtet, indem wir lediglich das Reservoir 1 abgekühlt hätten. Da das jedoch gegen den 2. Hauptsatz verstößt, muss η A = η B sein und alle Carnot-Prozesse müssen den haben. gleichen Wirkungsgrad η rev Verzichten wir lediglich auf die Eigenschaft, dass die Maschine reversibel arbeitet, so erhalten wir irreversibel arbeitende Wärmekraft- bzw. Kraftwärmemaschinen C. Wir nehmen an, dass η C > η rev. Ist C eine Wärmekraftmaschine, so können wir die Annahme wie oben zum Widerspruch führen. Ist C eine Kraftwärmemaschine, so könnten wir A und C zusammenschalten, um eine Maschine zu erhalten, die insgesamt zwar keine Arbeit verrichtet, aber ständig Wärme vom kalten zum warmen Speicher transportiert. Das widerspricht allerdings dem 2. Hauptsatz. 2 Q 2A Q 2C>Q 2A A W A=W C C Q 1A Q 1C>Q 1A 1 Abbildung 3.12 Kreisprozesse Wirkungsgrad irreversibler
51 TH Nürnberg 51 Da die Konstruktion der Maschine unabhängig vom Verlauf des Prozesses und der Arbeitssubstanz ist, können wir als Beispiel für den auch den Kreisprozess einer allgemeinen Carnot-Maschine speziellen Carnot-Kreisprozess, bestehend aus zwei adiabatischen und zwei isothermen Prozessen, heranziehen, um η rev zu bestimmen.
52 TH Nürnberg 52 4 Wärmetransport Wärmeenergie kann durch Strahlung, Leitung oder Strömung transportiert werden. Wärmestrahlung ist eine Form der elektromagnetischen Wechselwirkung. Wärmeleitung erfolgt durch die Energieübertragung durch Impulse im Rahmen einer statistischen Molekülbewegung. Dabei muss die Molekülenergie örtlich variieren, d.h. ein Temperaturgefälle vorliegen. Wärmeströmung ist gegeben bei makroskopischem Materie- und Wärmetransport. 4.1 Wärmeleitung Wärme strömt in Richtung eines Temperaturgefälles. Die Stärke des Wärmestroms P und die der Wärmestromdichte j hängen dabei vom Temperaturgradienten ab. grad T = T = ( T x, T y, T z ) Der Wärmestrom P ist definiert durch P := Q t. Betrachten wir den Wärmestrom, der durch ein Flächenelement A Ω eines Gebietes Ω R 3 tritt, so erhalten wir P = ( j, ν)dω. A Dabei bezeichnet j die Wärmestromdichte und ν den äußeren Normalenvektor auf A.
53 TH Nürnberg 53 T T 1 j T 2 x Abbildung 4.1 Temperaturprofil Zwischen Wärmestromdichte j und dem Temperaturgradienten grad T besteht der Zusammenhang j = λ grad T. Dabei ist λ eine Materialkonstante, die Wärmeleitfähigkeit. Der Wärmestrom P und der Temperaturgradient grad T : T T 1 j 1 j 2 T 2 T 3 λ 1 λ 2 x Abbildung 4.2 Wärmeleitung Die Betrag der Wärmestromdichte j ist proportional dem Betrag des Temperaturgradienten. Existieren Wärmequellen oder Wärmesenken, so bilanzieren wir, die zeitliche Änderung des Wärmeinhalts Q eines Volumens dv mittels div j dv = Q t, nach Anwendung des Gaußschen Intergralsatzes: div j d 3 x = ( j, ν) dω. Ω Ω
54 TH Nürnberg 54 Für die spezifische Wärmekapazität c = c V gilt c = 1 ( ) Q. m T Daher erhalten wir und somit Q t = T t V cρ dv T t = 1 ρc div j. Insgesamt haben wir nun die homogene Wärmeleitungsgleichung hergeleitet. T t λ ρc T = 0 Anmerkung: ist hier der Laplace-Operator, d.h. := div grad = 2 x y z 2.
55 TH Nürnberg 55 Wärmeleitfähigkeit einiger Stoffe Temperatur λ in C in W m 1 K 1 Silber [-100, 100] 420 Kupfer [0, 100] 390 Aluminium [0, 200] 230 Platin [-100, 100] 71 Blei Quarzglas [0, 100] 1,4 Seide 0 0,04 Helium 0 0, ,17 Luft 0 0, ,031 Wasser 0 0, ,67 Tabelle 4.1 Die Wärmeleitfähigkeit λ Anmerkungen zur Wärmeleitungsgleichung Die homogene Wärmeleitungsgleichung lautet: T t λ ρc T = 0 Die in dieser partiellen Differentialgleichung auftretende Größe λ ρc heißt Temperatur-Leitwert. Dieser Wert bestimmt die Zeit, die zum Temperaturausgleich benötigt wird. Die (inhomogene) Wärmeleitungsgleichung erlaubt eine Analyse der Temperaturverteilung bei zusätzlichen Wärmequellen oder Wärmesenken. Betrachten wir nun die stationäre Wärmeverteilung eines Volumenelements V einer Wand. Dabei habe die eine Wandfläche die Temperatur T 1, die andere die Temperatur T 2 < T 1. Das Volumen V sei V = A d, wobei A die Querschnittsfläche und d die Schichtdicke sei.
56 TH Nürnberg 56 Mit der Wärmestromdichte j = λ grad T können wir den Betrag des Wärmestromes P = ja umformen zu P = Aλ T 1 T 2 d. Wir definieren den Wärmewiderstand R th nun folgendermaßen: R th := T 1 T 2 P und erhalten für unser Beispiel R th = d A λ.
57 TH Nürnberg 57 Besteht die Wand auschließlich aus ebenen Schichten i der Dicke d i mit jeweils gleichem Schichtquerschnitt A, so zeigt sich, dass sich der gesamte Wärmewiderstand R th,ges additiv aus den einzelnen Wärmewiderständen R th,i zusammensetzt, d.h. R th,ges = i R th,i. T T 1 j 1 j 2 j n 1 T 2 T 3... T n λ 1 λ 2 λ n 1 x Abbildung 4.3 Temperaturverteilung in einer inhomogenen Wand Dieses Ergebnis für R th,ges erhalten wir, wenn wir beachten, dass für den Wärmestrom P i = P j = P ges gilt und P ges = T 1 T n R th,ges = (T 1 T 2 ) + (T 2 T 3 ) + (T 3 T 4 ) (T n 1 T n ) R th,ges = P ges R th,1 + P ges R th, P ges R th,n 1 R th,ges. Den Temperaturverlauf bestimmen wir folgendermaßen: Gemäß gilt P ges = T 1 T n R th,ges = P 1 = T 1 T 2 R th,1 = P i = T i T i+1 R th,i T i T i+1 = R th,i R th,ges (T 1 T n ).
58 TH Nürnberg 58 Für ein homogenes Material ist λ i = λ j und R th,i = d i R th,ges d Innerhalb der homogenen Wand können wir linear interpolieren und erhalten T (x) = T 1 x d (T 1 T 2 ). Andererseits können wir in unserem Wandmodell auch die Querschnittsfläche A so unterteilen, dass sich A additiv aus Teilflächen A i zusammensetzt und sich der Wärmestrom P additiv aus Wärmeströmen P i zusammensetzt, wobei sich P i innerhalb eines Volumens V i befindet und für das das Volumen V i gilt V i = A i d. Die Temperatur der Wandflächen sei wieder T 1 und T 2 < T 1. Dann erhalten wir und mit P i = T 1 T 2 R th,i P th,ges = i P th,i schließlich 1 R th,ges = i 1 R th,i.
59 TH Nürnberg Wärmestrahlung Die temperaturabhängige Strahlung eines Körpers wird als Wärmestrahlung bezeichnet. Die Strahlungsfrequenz ist dabei abhängig von der Temperatur des Körpers und der Beschaffenheit seiner Oberfläche, aber unabhängig von der Temperatur der Umgebung. Radiowellen Mikrowellen sichtbares Infrarotstrahlung Licht UV- Röntgenstahlung Strahlung Gammastahlung ν s 1 λ m Abbildung 4.4 Das elektromagnetische Spektrum Thermisches Gleichgewicht herrscht, wenn emittierte und absorbierte Strahlungsleistung gleich sind. Körper, die alle auffallende Strahlungsenergie absorbieren und vollständig in Wärme verwandeln, bezeichnet man als absolut schwarze Körper, die emittierte Strahlung als schwarze Strahlung oder Hohlraumstrahlung.
60 TH Nürnberg 60 Das Plancksche Strahlungsgesetz Die spektrale Energiedichte ρ = ρ(ν, T ) der Hohlraumstrahlung, als Funktion der Strahlungsfrequenz ν und der Temperatur T, genügt dem Planckschen Strahlungsgesetz: ρ(ν, T ) = 4πh ν 3 c 3 kt 1. e hν In folgender Abbildung ist ρ als Funktion ρ = ρ(ν), parametrisiert für T, dargestellt: ρ(ν,t ) Js m K 6000 K 4000 K 2000 K IR UV ν s 1 Abbildung 4.5 Die spektrale Energiedichte ρ(ν, T ) Das Wiensche Verschiebungsgesetz gibt an, bei welcher Frequenz ν m oder Wellenlänge λ m das Maximum der Energiedichte der Hohlraumstrahlung liegt. Der Wert λ m beträgt λ m = w T 1, wobei w = 2, m K. Das Stefan-Boltzmann-Gesetz Die Strahlungsleistung P des schwarzen Körpers, die er pro Flächeneinheit seiner Oberfläche emittiert, lässt sich berechnen durch P 0 ρ(ν, T ) dν T 4.
61 TH Nürnberg 61 Das Stefan-Boltzmann-Gesetz lautet P = σt 4, wobei für die Stefan-Boltzmann-Konstante σ = 5, W m 2 K 4 gilt. Hat der Körper die Temperatur T 1, die Oberfläche A und seine Umgebung die Temperatur T 2 < T 1, so ist die resultierende Strahlungsleistung gegeben durch P = Aσ(T 4 1 T 4 2 ). Da wir auch hier R th := T 1 T 2 P setzen, erhalten wir R th = 1 Aσ T1 T 2 T 4 1 T 4 2. Der Wärmetransport zwischen zwei festen Körpern und einem Fluid lässt sich allgemein, d.h. nicht nur im Falle des Wärmestrahlung, durch die Wärmeübergangszahl α charakterisieren. Diese ist definiert durch: α := j T 1 T 2. Falls der Wärmestrom j in Richtung des Normalenvektors der Randfläche weist, erhalten wir P = ja = αa(t 1 T 2 ) und für den thermischen Widerstand R th : R th = 1 αa. Gilt T 1 = T 2 + ϑ mit ϑ T 2, so erhalten wir T 4 1 T 4 2 = (T 2 + ϑ) 4 T 4 2 4T 3 2 ϑ. In diesem Fall gilt P 4σAT 3 2 ϑ. Das impliziert R th := T 1 T 2 P 1 4σA 1 T 3 2
62 TH Nürnberg 62 und α = 1 R th A 4σT 3 2. Bei T 300 K erhalten wir 4σT W m 2 K 1. Handelt es sich nicht um einen schwarzen Strahler, so wird lediglich ein Bruchteil dieser Leistung emittiert und das Emissionsvermögen der Oberfläche muss in Betracht gezogen werden. Für den Emissionsgrad ɛ dieser Körper gilt daher ɛ < Konvektion Ein Fluid kann im mechanischen Gleichgewicht sein, d.h. keine makroskopische Bewegung aufweisen, ohne dabei im thermischen Gleichgewicht zu sein. Wir nehmen nun an, dass das Fluid nicht im thermischen Gleichgewicht ist. Ist das mechanische Gleichgewicht stabil, so tritt keine Strömung auf, die Temperaturunterschiede ausgleicht. Ist das mechanische Gleichgewicht instabil oder liegt kein mechanisches Gleichgewicht vor, so tritt eine Strömung auf, die Temperaturunterschiede ausgleicht. Diese Strömung wird als Konvektion bezeichnet. Die Konvektion wird durch lokale Temperatur- und damit Dichteunterschiede verursacht.
63 TH Nürnberg 63 In Flüssigkeiten und Gasen ist der konvektive Wärmetransport oft wesentlich effektiver als der Wärmetransport mittels Wärmeleitung. T 1 T 2 >T 1 g Abbildung 4.6 Konvektionsrollen Freie Konvektion Ist ein Fluid, unter dem Einfluss des Schwerefelds, nicht im thermischen Gleichgewicht, aber im mechanischen Gleichgewicht, so stellt sich eine von der Höhe z abhängige Temperaturverteilung T = T (z) ein, nicht im mechanischen Gleichgewicht, so tritt eine Strömung auf, die die Temperaturunterschiede ausgleicht. Diese Strömung wird als freie Konvektion bezeichnet.
64 TH Nürnberg Diffusiver Wärmetransport Ist die Teilchenzahldichte inhomogen, so wird der Konzentrationsgradient durch Teilchenströme ausgeglichen. Dieses Transportphänomen heißt Diffusion. Zwar wird der Diffusionsstrom vom Konzentrationsgradienten und der Wärmestrom vom Temperaturgradienten verursacht, jedoch hängen im allgemeinen beide Ströme von beiden Gradienten ab. 4.5 Wärmeübergang und Wärmedurchgang Unter Wärmeübergang verstehen wir den Wärmetransport zwischen einem Körper der Temperatur T 1 und der Umgebung mit der Temperatur T 2. Dabei geht von dem Körper die Wärmeleistung P = αa(t 1 T 2 ) an die Umgebung über. Sind T 2 und die Wärmeübergangszahl α konstant und fehlt ab t = t 0 eine weitere Wärmezufuhr, so kühlt der Körper gemäß dt 1 dt = 1 c m P = τ(t 1 T 2 ) für t > t 0 ab. Dabei ist τ := c m α A. Die Lösung dieser gewöhnlichen Differentialgleichung führt auf Newtons Abkühlungsgesetz T 1 (t) T 2 = (T 1 (t 0 ) T 2 )e t τ. Wir berechnen den Wärmedurchgang durch einen Platte zwischen zwei Medien der Temperaturen T 1 bzw. T 2 mittels P = ka(t 1 T 2 ). Der Wert ka wird als Wärmeleitwert, der Wert R th := 1 ka als Wärmewiderstand dieses Wärmedurchgangs bezeichnet.
65 TH Nürnberg 65 Unter der Annahme, dass der Wärmedurchgang aus einem Wärmeübergang Medium 1 - Platte, einer Wärmeleitung durch die Platte und einem Wärmeübergang Platte - Medium 2 besteht, erhalten wir für den Wärmewiderstand dieses Wärmedurchgangs R th = 1 α 1 A + d λa + 1 α 2 A. Dabei sind d die Plattendicke und α i die jeweiligen Wärmeübergangszahlen. Oft wird ein konvektiver Wärmetransport durch einen Strahlungstransport begleitet. Den gesamten thermischen Widerstand R th dieses Prozesses berechnen wir dann mittels 1 R th = 1 R th,k + 1 R th,s, wobei R th,k den Wärmewiderstand der Konvektion und R th,s den des Strahlungstransports bezeichnet.
66 TH Nürnberg 66 Literatur [1] L. Bergmann C. Schaefer, Lehrbuch der Experimentalphysik, Band III Optik, W. de Gruyter [2] F. H. Busse, Convection driven zonal flows and vortices in the major planets, Chaos 4 (2), 1994 [3] C. Gerthsen, H. O. Kneser, H. Vogel, Physik, Springer-Verlag [4] E. Hering, R. Martin, M. Stohrer, Physik für Ingenieure, Springer-Verlag [5] L. D. Landau, E. M. Lifschitz, Lehrbuch der Theoretischen Physik, Band V, Statistische Physik, Teil I, Akademie Verlag [6] L. D. Landau, E. M. Lifschitz, Lehrbuch der Theoretischen Physik, Band VI, Hydrodynamik, Akademie Verlag [7] F. Reif, Statistische Physik und Theorie der Wärme, W. de Gruyter [8] A. Sommerfeld, Thermodynamik und Statistik, Verlag Harri Deutsch
I, 1 60 (2011) c Thermodynamik. Dr. Jürgen Bolik. Georg-Simon-Ohm Hochschule
 I, 1 60 (2011) c 2011 Thermodynamik Dr. Jürgen Bolik Georg-Simon-Ohm Hochschule Nürnberg Georg-Simon-Ohm-Hochschule Nürnberg 2 Inhaltsverzeichnis 1 Grundlagen 3 1.1 Grundbegriffe...................................
I, 1 60 (2011) c 2011 Thermodynamik Dr. Jürgen Bolik Georg-Simon-Ohm Hochschule Nürnberg Georg-Simon-Ohm-Hochschule Nürnberg 2 Inhaltsverzeichnis 1 Grundlagen 3 1.1 Grundbegriffe...................................
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
Vorlesung Physik für Pharmazeuten PPh Wärmelehre
 Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
1. Wärmelehre 1.1. Temperatur Wiederholung
 1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
II, 1 65 (2012) c 2012. Thermodynamik. Dr. Jürgen Bolik. Georg-Simon-Ohm-Hochschule. f (v) 10 3 s m 1000 K 3000 K. m s
 II, 1 65 (2012) c 2012 Thermodynamik Dr. Jürgen Bolik Georg-Simon-Ohm-Hochschule Nürnberg f (v) 10 3 s m 5 4 3 100 K 2 300 K 1 1000 K 3000 K 0 500 1000 1500 v m s Georg-Simon-Ohm-Hochschule Nürnberg 2
II, 1 65 (2012) c 2012 Thermodynamik Dr. Jürgen Bolik Georg-Simon-Ohm-Hochschule Nürnberg f (v) 10 3 s m 5 4 3 100 K 2 300 K 1 1000 K 3000 K 0 500 1000 1500 v m s Georg-Simon-Ohm-Hochschule Nürnberg 2
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
11.2 Die absolute Temperatur und die Kelvin-Skala
 11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
2 Grundbegriffe der Thermodynamik
 2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
Allgemeines Gasgesetz. PV = K o T
 Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Wärmelehre Wärme als Energie-Form
 Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
4.6.5 Dritter Hauptsatz der Thermodynamik
 4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Zwei neue Basisgrössen in der Physik
 Nachtrag zur orlesung am vergangenen Montag Zwei neue Basisgrössen in der Physik 9. Wärmelehre, kinetische Gastheorie Temperatur T: Wärme ist verknüpft mit ungeordneter Bewegung der Atome oder Moleküle.
Nachtrag zur orlesung am vergangenen Montag Zwei neue Basisgrössen in der Physik 9. Wärmelehre, kinetische Gastheorie Temperatur T: Wärme ist verknüpft mit ungeordneter Bewegung der Atome oder Moleküle.
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
(VIII) Wärmlehre. Wärmelehre Karim Kouz WS 2014/ Semester Biophysik
 Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Hochschule Düsseldorf University of Applied Sciences. 13. April 2016 HSD. Energiespeicher. Thermodynamik
 13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik - Einführung in die Wärmelehre - Prof. Dr. Ulrich Hahn WS 2008/09 Entwicklung der Wärmelehre Sinnesempfindung: Objekte warm kalt Beschreibung der thermische Eigenschaften
Physik III im Studiengang Elektrotechnik - Einführung in die Wärmelehre - Prof. Dr. Ulrich Hahn WS 2008/09 Entwicklung der Wärmelehre Sinnesempfindung: Objekte warm kalt Beschreibung der thermische Eigenschaften
1 Thermodynamik allgemein
 Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #7 am 18.01.006 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #7 am 18.01.006 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Verbundstudium TBW Teil 1 Wärmelehre 1 3. Semester
 Verbundstudium TBW Teil 1 Wärmelehre 1 3. Semester 1. Temperaturmessung Definition der Temperaturskala durch ein reproduzierbares thermodynam. Phänomen, dem Thermometer Tripelpunkt: Eis Wasser - Dampf
Verbundstudium TBW Teil 1 Wärmelehre 1 3. Semester 1. Temperaturmessung Definition der Temperaturskala durch ein reproduzierbares thermodynam. Phänomen, dem Thermometer Tripelpunkt: Eis Wasser - Dampf
10. Thermodynamik Der erste Hauptsatz Der zweite Hauptsatz Thermodynamischer Wirkungsgrad Der Carnotsche Kreisprozess
 Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Physik 1 für Chemiker und Biologen 13. Vorlesung
 Physik 1 für Chemiker und Biologen 13. Vorlesung 30.01.2017 Diese Woche (30.1.-3.2.): Vorlesung heute: o Thermodynamik & statistische Physik o Kurzer Ausblick: Spezielle Relativitätstheorie Übungen: Besprechung
Physik 1 für Chemiker und Biologen 13. Vorlesung 30.01.2017 Diese Woche (30.1.-3.2.): Vorlesung heute: o Thermodynamik & statistische Physik o Kurzer Ausblick: Spezielle Relativitätstheorie Übungen: Besprechung
8.1. Kinetische Theorie der Wärme
 8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt
 1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
Physik für Biologen und Zahnmediziner
 Physik für Biologen und Zahnmediziner Kapitel 11: Wärmelehre Dr. Daniel Bick 13. Dezember 2017 Daniel Bick Physik für Biologen und Zahnmediziner 13. Dezember 2017 1 / 36 Übersicht 1 Wellen 2 Wärmelehre
Physik für Biologen und Zahnmediziner Kapitel 11: Wärmelehre Dr. Daniel Bick 13. Dezember 2017 Daniel Bick Physik für Biologen und Zahnmediziner 13. Dezember 2017 1 / 36 Übersicht 1 Wellen 2 Wärmelehre
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Experimentalphysik II: Thermodynamik
 Experimentalphysik II: Thermodynamik Ferienkurs Wintersemester 08/09 William Hefter 23/02/2009 Inhaltsverzeichnis 1 Thermodynamik 2 1.1 Temperatur, Wärme und Arbeit.................................. 2
Experimentalphysik II: Thermodynamik Ferienkurs Wintersemester 08/09 William Hefter 23/02/2009 Inhaltsverzeichnis 1 Thermodynamik 2 1.1 Temperatur, Wärme und Arbeit.................................. 2
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
II. Wärmelehre. II.2. Die Hauptsätze der Wärmelehre. Physik für Mediziner 1
 II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
13.Wärmekapazität. EP Vorlesung 14. II) Wärmelehre
 13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
2 Wärmelehre. Reibungswärme Reaktionswärme Stromwärme
 2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
Versuche: Brownsche Bewegung pneumatisches Feuerzeug Wärmekapazität gleicher Massen von verschiedenen Metallen
 14. Vorlesung EP II. Wärmelehre 1. Temperatur und Stoffmenge 11. Ideale Gasgleichung 1. Gaskinetik 13. Wärmekapazität Versuche: Brownsche Bewegung pneumatisches Feuerzeug Wärmekapazität gleicher Massen
14. Vorlesung EP II. Wärmelehre 1. Temperatur und Stoffmenge 11. Ideale Gasgleichung 1. Gaskinetik 13. Wärmekapazität Versuche: Brownsche Bewegung pneumatisches Feuerzeug Wärmekapazität gleicher Massen
Thermodynamik Hauptsatz
 Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
TU-München, Musterlösung. Experimentalphysik II - Ferienkurs Andreas Schindewolf
 TU-München, 18.08.2009 Musterlösung Experimentalphysik II - Ferienkurs Andreas Schindewolf 1 Random Kreisprozess a Wärme wird nur im isochoren Prozess ab zugeführt. Hier ist W = 0 und Q ab = nc V t b T
TU-München, 18.08.2009 Musterlösung Experimentalphysik II - Ferienkurs Andreas Schindewolf 1 Random Kreisprozess a Wärme wird nur im isochoren Prozess ab zugeführt. Hier ist W = 0 und Q ab = nc V t b T
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern?
 An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Temperatur Der nullte Hauptsatz der Thermodynamik: Thermoskop und Thermometer Kelvin, Celsius- und der Fahrenheit-Skala Wärmeausdehnung
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Temperatur Der nullte Hauptsatz der Thermodynamik: Thermoskop und Thermometer Kelvin, Celsius- und der Fahrenheit-Skala Wärmeausdehnung
Kapitel IV Wärmelehre und Thermodynamik
 Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Beispiel für ein thermodynamisches System: ideales Gas (Edelgas)
 10. Hauptsätze tze der Wärmelehre Thermodynamik: zunächst: Klassische Mechanik punktförmiger Teilchen, starrer und deformierbarer Körper aber: Bewegungsgleichungen für N=10 23 Teilchen mit 6N ariablen
10. Hauptsätze tze der Wärmelehre Thermodynamik: zunächst: Klassische Mechanik punktförmiger Teilchen, starrer und deformierbarer Körper aber: Bewegungsgleichungen für N=10 23 Teilchen mit 6N ariablen
Wärme als Energieform
 Wärme als Energieform Wärme bedeutet ungeordnete thermische Bewegung der Atome bzw. Moleküle Gase und Flüssigkeiten Festkörper Translation, Rotation und innere Schwingung von Molekülen Schwingung aller
Wärme als Energieform Wärme bedeutet ungeordnete thermische Bewegung der Atome bzw. Moleküle Gase und Flüssigkeiten Festkörper Translation, Rotation und innere Schwingung von Molekülen Schwingung aller
13.Wärmekapazität. EP Vorlesung 15. II) Wärmelehre
 13.Wärmekapazität EP Vorlesung 15 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Wärmekapazität von Festkörpern
13.Wärmekapazität EP Vorlesung 15 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Wärmekapazität von Festkörpern
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand
 1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand Wie erfolgt die Beschreibung des Zustands eines Systems? über Zustandsgrößen (makroskopische Eigenschaften, die den Zustand eines Systems kennzeichnen)
1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand Wie erfolgt die Beschreibung des Zustands eines Systems? über Zustandsgrößen (makroskopische Eigenschaften, die den Zustand eines Systems kennzeichnen)
Hauptsatz der Thermodynamik
 0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang lektrotechnik - kinetische Gastheorie - Prof. Dr. Ulrich Hahn WS 008/09 Molekularbewegung kleine sichtbare Teilchen in Flüssigkeiten oder Gasen: unregelmäß äßige Zitterbewegung
Physik III im Studiengang lektrotechnik - kinetische Gastheorie - Prof. Dr. Ulrich Hahn WS 008/09 Molekularbewegung kleine sichtbare Teilchen in Flüssigkeiten oder Gasen: unregelmäß äßige Zitterbewegung
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
4.6 Hauptsätze der Thermodynamik
 Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
3 Der 1. Hauptsatz der Thermodynamik
 3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
9. Thermodynamik. 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala. 9.4 Wärmekapazität
 9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
E2: Wärmelehre und Elektromagnetismus 3. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 3. Vorlesung 16.04.2018 https://xkcd.com/1978/ Heute: - Gleichverteilungssatz - 1. Hauptsatz - Volumenarbeit - Wärmekapazität - Wärmekapazität des idealen Gases -
E2: Wärmelehre und Elektromagnetismus 3. Vorlesung 16.04.2018 https://xkcd.com/1978/ Heute: - Gleichverteilungssatz - 1. Hauptsatz - Volumenarbeit - Wärmekapazität - Wärmekapazität des idealen Gases -
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Prof. Dr. U. Schollwöck Sommersemester 2013
 Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #4 am 3.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #4 am 3.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
4 Hauptsätze der Thermodynamik
 I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
Thermodynamik Thermodynamische Systeme
 Thermodynamik Thermodynamische Systeme p... Druck V... Volumen T... Temperatur (in Kelvin) U... innere Energie Q... Wärme W... Arbeit Idealisierung; für die Betrachtung spielt die Temperatur eine entscheidende
Thermodynamik Thermodynamische Systeme p... Druck V... Volumen T... Temperatur (in Kelvin) U... innere Energie Q... Wärme W... Arbeit Idealisierung; für die Betrachtung spielt die Temperatur eine entscheidende
22. Entropie; Zweiter Hauptsatz der Wärmelehre
 22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti.
 (c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 10. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
(c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 10. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
Der Magnus-Effekt. Rotierender Körper in äußerer Strömung: Anwendungen:
 Der Magnus-Effekt Rotierender Körper in äußerer Strömung: Ohne Strömung: Körper führt umgebendes Medium an seinen Oberflächen mit Keine resultierende Gesamtkraft. ω Mit Strömung: Geschwindigkeiten der
Der Magnus-Effekt Rotierender Körper in äußerer Strömung: Ohne Strömung: Körper führt umgebendes Medium an seinen Oberflächen mit Keine resultierende Gesamtkraft. ω Mit Strömung: Geschwindigkeiten der
NTB Druckdatum: DWW
 WÄRMELEHRE Der Begriff der Thermisches Gleichgewicht und - Mass für den Wärmezustand eines Körpers - Bewegung der Atome starke Schwingung schwache Schwingung gleichgewicht (Thermisches Gleichgewicht) -
WÄRMELEHRE Der Begriff der Thermisches Gleichgewicht und - Mass für den Wärmezustand eines Körpers - Bewegung der Atome starke Schwingung schwache Schwingung gleichgewicht (Thermisches Gleichgewicht) -
Festkörper - System steht unter Atmosphärendruck gemessenen Wärmen erhalten Index p : - isoliert
 Kalorimetrie Mit Hilfe der Kalorimetrie können die spezifischen Wärmekapazitäten für Festkörper, Flüssigkeiten und Gase bestimmt werden. Kalorische Grundgleichung: ΔQ = c m ΔT Festkörper - System steht
Kalorimetrie Mit Hilfe der Kalorimetrie können die spezifischen Wärmekapazitäten für Festkörper, Flüssigkeiten und Gase bestimmt werden. Kalorische Grundgleichung: ΔQ = c m ΔT Festkörper - System steht
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Inhaltsverzeichnis. Formelzeichen...XIII. 1 Einleitung Einheiten physikalischer Größen...3
 Inhaltsverzeichnis Formelzeichen...XIII 1 Einleitung...1 2 Einheiten physikalischer Größen...3 3 Systeme...6 3.1 Definition von Systemen...6 3.2 Systemarten...7 3.2.1 Geschlossenes System...7 3.2.2 Offenes
Inhaltsverzeichnis Formelzeichen...XIII 1 Einleitung...1 2 Einheiten physikalischer Größen...3 3 Systeme...6 3.1 Definition von Systemen...6 3.2 Systemarten...7 3.2.1 Geschlossenes System...7 3.2.2 Offenes
Winter-Semester 2017/18. Moderne Theoretische Physik IIIa. Statistische Physik
 Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Physik I Mechanik der Kontinua und Wärmelehre Thomas Schörner-Sadenius
 Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
f) Ideales Gas - mikroskopisch
 f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
Hochschule Düsseldorf University of Applied Sciences. 20. April 2016 HSD. Energiespeicher Wärme
 Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Repetitorium. Thermodynamik. 3., überarbeitete und ergänzte Auflage. von. Wilhelm Schneider. unter Mitarbeit von. Stefan Haas und Karl Ponweiser
 Repetitorium Thermodynamik 3., überarbeitete und ergänzte Auflage von Wilhelm Schneider unter Mitarbeit von Stefan Haas und Karl Ponweiser Oldenbourg Verlag München Inhaltsverzeichnis 1 Grundbegriffe 1
Repetitorium Thermodynamik 3., überarbeitete und ergänzte Auflage von Wilhelm Schneider unter Mitarbeit von Stefan Haas und Karl Ponweiser Oldenbourg Verlag München Inhaltsverzeichnis 1 Grundbegriffe 1
Kapitel 8: Thermodynamik
 Kapitel 8: Thermodynamik 8.1 Der erste Hauptsatz der Thermodynamik 8.2 Mechanische Arbeit eines expandierenden Gases 8.3 Thermische Prozesse des idealen Gases 8.4 Wärmemaschine 8.5 Der zweite Hauptsatz
Kapitel 8: Thermodynamik 8.1 Der erste Hauptsatz der Thermodynamik 8.2 Mechanische Arbeit eines expandierenden Gases 8.3 Thermische Prozesse des idealen Gases 8.4 Wärmemaschine 8.5 Der zweite Hauptsatz
Auswahl von Prüfungsfragen für die Prüfungen im September 2011
 Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
Carnotscher Kreisprozess
 Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
Ferienkurs Experimentalphysik II Thermodynamik Grundlagen - Lösungen
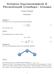 Ferienkurs Experimentalphysik II Thermodynamik Grundlagen - Lösungen Lennart Schmidt 08.09.011 Aufgabe 1: Berechnen Sie den Volumenausdehnungskoeffizienten für das ideale Gas. Zustandsgleichung des idealen
Ferienkurs Experimentalphysik II Thermodynamik Grundlagen - Lösungen Lennart Schmidt 08.09.011 Aufgabe 1: Berechnen Sie den Volumenausdehnungskoeffizienten für das ideale Gas. Zustandsgleichung des idealen
Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung
 Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion 16. Phasenübergänge (Verdampfen, Schmelzen, Sublimieren) Versuche: Wärmeleitung
Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion 16. Phasenübergänge (Verdampfen, Schmelzen, Sublimieren) Versuche: Wärmeleitung
Inhaltsverzeichnis. Formelzeichen. 1 Einleitung 1. 2 Einheiten physikalischer Größen 3
 Formelzeichen XIII 1 Einleitung 1 2 Einheiten physikalischer Größen 3 3 Systeme 7 3.1 Definition von Systemen 7 3.2 Systemarten 8 3.2.1 Geschlossenes System 8 3.2.2 Offenes System 9 3.2.3 Adiabates System
Formelzeichen XIII 1 Einleitung 1 2 Einheiten physikalischer Größen 3 3 Systeme 7 3.1 Definition von Systemen 7 3.2 Systemarten 8 3.2.1 Geschlossenes System 8 3.2.2 Offenes System 9 3.2.3 Adiabates System
1. Klausur zur Vorlesung Physikalische Chemie I
 1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
Thermodynamik I Formeln
 Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 8 Lösungsvorschlag
 T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
4.1.2 Quantitative Definition durch Wärmekapazitäten
 4 Energie Aus moderner (mikroskopischer Sicht ist klar, daß die Summe U der kinetischen Energien der Moleküle eines Gases (und ggf. ihrer Wechselwirkungsenergien eine thd. Zustandsgröße des Gases ist,
4 Energie Aus moderner (mikroskopischer Sicht ist klar, daß die Summe U der kinetischen Energien der Moleküle eines Gases (und ggf. ihrer Wechselwirkungsenergien eine thd. Zustandsgröße des Gases ist,
Thermodynamik. Thermodynamics. Markus Arndt. Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008
 Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 ladimir Dyakonov #0 am 4.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 ladimir Dyakonov #0 am 4.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
WÄRME I. Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität
 Physik für Pharmazeuten WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität wozu Wärmelehre? Temperatur bin ich mittags größer als am morgen? wieso wird Sodaflasche kalt,
Physik für Pharmazeuten WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität wozu Wärmelehre? Temperatur bin ich mittags größer als am morgen? wieso wird Sodaflasche kalt,
Physik und Elektrotechnik 2
 III, 1 100 (2016) c 2016 Physik und Elektrotechnik 2 Dr. Jürgen Bolik Technische Hochschule Nürnberg R L R L Z Y Y Z TH Nürnberg 2 Inhaltsverzeichnis 1 Wechselströme 3 1.1 Wechselstromwiderstände............................
III, 1 100 (2016) c 2016 Physik und Elektrotechnik 2 Dr. Jürgen Bolik Technische Hochschule Nürnberg R L R L Z Y Y Z TH Nürnberg 2 Inhaltsverzeichnis 1 Wechselströme 3 1.1 Wechselstromwiderstände............................
Hydrodynamik: bewegte Flüssigkeiten
 Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
