Kutane Lymphome und Leukämien
|
|
|
- Mathilde Kramer
- vor 5 Jahren
- Abrufe
Transkript
1 Kutane Lymphome und Leukämien W. Kempf a * und L. Cerroni b a Kempf und Pfaltz Histologische Diagnostik, Z urich, Schweiz a Dermatologische Klinik, Universitätsspital Zürich, Z urich, Schweiz b Universitätsklinik f ur Dermatologie und Venerologie, Medizinische Universität Graz, Graz, Österreich Kutane Lymphome (KL) stellen die zweithäufigste Form extranodaler Non-Hodgkin-Lymphome dar und repräsentieren eine klinisch, histologisch, phänotypisch und prognostisch heterogene Gruppe kutaner Neoplasien. Die Inzidenz der KL beträgt 5 10 Fälle pro 1 Million Einwohner pro Jahr, wobei die kutanen T-Zell-Lymphome (KTZL) die Mehrheit (65 %) der KL ausmachen. Die Klassifikation der KL richtet sich nach der WHO-Klassifikation lymphoider Tumoren (2008, 4. Auflage), welche die WHO/EORTC-Klassifikation f ur KL (2005) weitestgehend ubernommen und integriert hat. Die Klassifikation folgt dem sog. Multiparameter-Prinzip, bei welchem die einzelnen Lymphomentitäten durch eine charakteristische Konstellation klinischer, histologischer, immunphänotypischer und genetischer Merkmale definiert sind. Die diagnostische Zuordnung von KL hat daher unter Ber ucksichtigung aller Parameter zu erfolgen. Der histologischen Beurteilung und insbesondere der klinisch-pathologischen Korrelation kommt eine zentrale Rolle in der Diagnostik der KL zu. 1 Kutane T- und T/NK-Zell-Lymphome Die kutanen T-Zell Lymphome (KTZL) machen 65 % der kutanen Lymphome aus. Klinisch zeigen KTZL ein breites Manifestationsspektrum mit Papeln, Patches, Plaques, knotigen Tumoren sowie erythrodermatischen Formen. Auch histologisch bilden die KTZL eine heterogene Gruppe mit unterschiedlichen Wachstumsmustern und Zytomorphologie der Tumorzellen. Histologisch kann ein epidermotropes und oberflächlich bandförmiges Wachstumsmuster von einem diffusen-nodulären Wachstumsmuster unterschieden werden, wobei bei der gleichen Lymphomentität in Abhängigkeit des Krankheitsstadiums verschiedene Muster beobachtet werden können. Neben den Tumorzellen finden sich bei vielen Formen der KTZL eine Beimengung reaktiver Zellen wie eosinophiler Granulozyten, Histiozyten und kleiner reaktiver Lymphozyten sowie insbesondere bei KTZL-Formen mit nodulär-diffusen Infiltraten häufig auch eine Beimengung von B-Zellen. Die immunhistochemische Phänotypisierung von Tumorzellen spielt in der Diagnostik der KTZL eine wichtige Rolle. Die wichtigsten lymphozytären Differenzierungsantigene, welche zur Diagnostik von KTZL Anwendung finden, sind unten aufgef uhrt. Bestimmte Formen wie das subkutane Pannikulitisartige T-Zell Lymphom sind durch einen distinkten Phänotyp definiert, während andere KTZL-Formen wie die Mycosis fungoides (MF) ein breites phänotypisches Spektrum aufweisen. Die Expression bestimmter Antigene erlaubt eine prognostische Aussage. Eine wachsende Anzahl von immunhistochemisch nachweisbaren Antigenen (CD30, CD52, PD-1) stellt zudem Angriffspunkte f ur neue Behandlungsansätze wie Fusionsproteine monoklonaler Antikörper und Toxinen. KTZL repräsentieren mono- und oligoklonale neoplastische Proliferationen von T-Zellen. Eine monoklonale Rearrangierung von T-Zell-Rezeptor (TZR)-Genen kann mittels Southern blot-verfahren oder mittels Polymerase-Kettenreaktion (polymerase chain reaction; PCR) nachgewiesen werden, wobei * werner.kempf@kempf-pfaltz.ch Seite 1 von 57
2 beim PCR-basiertem Nachweis die Anwendung des BIOMED2-Protokolls den internationalen Standard darstellt. Eine vorgängig durchgef uhrte Mikrodissektion erhöht dabei die Sensitivität des PCR-basierten Klonalitätsnachweises. Der Nachweis einer klonalen T-Zell-Population mittels PCR kann jedoch f ur sich alleine betrachtet nicht als diagnostischer Beweis f ur das Vorliegen eines KTZL bewertet werden, da klonale T-Zell-Populationen auch bei einigen inflammatorischen Dermatosen (Lichen ruber, Psoriasis, Ekzem) nachgewiesen werden können. Bei NK-Zellen, welche keinen T-Zell-Rezeptor aufweisen, erfolgt der Nachweis einer Klonalität durch die Expression eines restringierten Repertoires von Killerzellinhibitorischen Rezeptoren (KIRs). Die Ausbreitungsdiagnostik beinhaltet neben einer genauen klinischen Untersuchung inkl. Lymphknotenpalpation eine Untersuchung des peripheren Blutes zur Erfassung eines leukämischen Blutbildes und radiologische Untersuchungen mittels konventioneller CT oder PET(Positronen-Emissions- Tomographie)-CT, welche dem Ausschluss eines sekundär kutanen Befalls durch ein primär nodales T-Zell Lymphom dienen. Eine Knochenmarksbiopsie ist vor allem bei aggressiven KTZL-Formen angezeigt. Die Stadieneinteilung erfolgt nach der TNM-Klassifikation, wobei f ur KTZL-modifizierte Stadieneinteilungen entwickelt wurden. Die Ätiologie kutaner Lymphome ist bislang nicht geklärt. Einzig f ur das adulte T-Zell-Lymphom/ Leukämie (ATLL), welches vor allem in Asien und in der Karibik auftritt, konnte das humanes T-lymphotrope Virus (HTLV) 1 bzw. 2 als auslösendes onkogenes Virus identifiziert werden. In der Pathogenese der KTZL spielt insbesondere in der fr uhen Phase der Mycosis fungoides ein verlängertes Überleben der Tumorzellen durch verminderte Apoptose eine zentrale Rolle, während in den späteren Krankheitsstadien und bei aggressiven Lymphomformen genetische Aberrationen und epigenetische Veränderungen zu einer gesteigerten Proliferation durch Verlust von Tumorsuppressorgen-Aktivität oder erhöhter Aktivität von Transkriptionsfaktoren (z. B. NFkappaB) f uhren. Klinische Symptome, wie der mit einigen KTZL einhergehende Pruritus, und die Zusammensetzung der Infiltrate mit Beimengung eosinophiler Granulozyten oder reaktiver Zellen kann durch Sekretion von Zytokinen erklärt werden. WHO Klassifikation lymphoider Neoplasien (4. Aufl. 2008)** Reife T-Zell- und NK-Zell-Neoplasien Mycosis fungoides (MF) MF Varianten und Subtypen Follikuläre/follikulotrope MF Pagetoide Retikulose Kutanes elastolytisches Lymphom (granulomatous slack skin) Sézary-Syndrom Kutane CD30+ T- Zell lymphoproliferative Erkrankungen Kutanes anaplastisches großzelliges Lymphom Lymphomatoide Papulose Subkutanes Panniculitis-artiges T-Zell Lymphom Extranodales NK/T-Zell Lymphom, nasaler Typ Primär kutanes peripheres T-Zell Lymphom, seltene Subtypen Primär kutanes CD8+ aggressives epidermotropes zytotoxisches T-Zell Lymphom (provisorische Entität) Primär kutanes gamma/delta T-Zell Lymphom Primär kutanes CD4+ klein-/mittelgroßzelliges T-Zell Lymphom (provisorische Entität) Primär kutanes peripheres T-Zell Lymphom, nicht weiter spezifiziert (NOS) (Fortsetzung) Seite 2 von 57
3 Adultes T-Zell Leukämie/Lymphom Angioimmunoblastisches T-Zell-Lymphom ** Die Liste beinhaltet primär kutane Lymphome und systemische Lymphome mit häufig zu beobachtendem sekundärem Hautbefall. 1.1 Mycosis Fungoides ICD-O: 9700/3 Definition und klinisches Bild Die Mycosis fungoides (MF) ist das häufigste KTZL, welches durch eine charakteristische Evolution des klinischen und histologischen Bildes mit drei Erkrankungsstadien charakterisiert ist. Männer sind häufiger betroffen. Der Erkrankungsbeginn liegt in der Lebensdekade, wobei die MF auch im Kindesalter auftreten kann. Prädilektionsstellen sind nicht UV-Licht-exponierte Areale, insbesondere der Stamm, wobei die Erkrankung in späteren Stadien in der Regel das gesamte Integument befällt. Drei Erkrankungsphasen werden unterschieden: 1. Im Patch-Stadium finden sich diskret infiltrierte, erythematöse Herde mit fein-lamellärer Schuppung, die in Größe und Form variieren. Das Patch-Stadium kann sich uber Jahre ohne wesentliche Progression erstrecken. 2. Das Plaque-Stadium ist durch plattenartig infiltrierte, erythematöse Herde mit scharfer Begrenzung gekennzeichnet. 3. Meist auf dem Boden vorbestehender Plaques entwickeln sich im Tumorstadium große, rasch wachsende Tumoren, die ulzerieren und eine Ausdehnung von mehreren Zentimetern erreichen können. Eine Erythrodermie kann in jedem Krankheitsstadium der MF auftreten, wobei bei der erythrodermatischen MF im Gegensatz zum Sézary-Syndrom (SS) keine zirkulierenden Tumorzellen im peripheren Blut nachweisbar sind. Der Verlauf der MF erstreckt sich gewöhnlich uber mehrere Jahre mit einer 5- und 10-Jahres-Überlebensrate von uber 80 %. Bei % der Patienten kommt es zu einer Progression in das Tumorstadium mit Bildung nodulärer Tumoren, wobei erhöhte beta-2-mikroglobulin- und Lactatdehydrogenase-Werte im peripheren Blut auf eine Progression einer MF hinweisen. Im Tumorstadium weist ein Großteil der Patienten eine Transformation in ein großzelliges Lymphom auf. Im Endstadium können im Rahmen einer Dissemination nahezu alle Organe befallen sein, wobei die Lunge, die Milz und die Leber am häufigsten betroffen sind. Die Todesursache ist jedoch meist eine von den ulzerierten Tumoren ausgehende Sepsis mit Multiorganversagen im septischen Schock. Klinisch scheint bei der MF ausschließlich das Integument befallen zu werden. Molekularbiologische Untersuchungen haben jedoch gezeigt, dass sich mittels PCR bereits Tumorzellen im peripheren Blut und in den Lymphknoten nachweisen lassen. Die Bedeutung dieser Befunde ist aber noch nicht geklärt. Die im Verlauf beobachtete Lymphknotenvergrößerung entspricht initial meist einer reaktiven dermatopathischen Lymphadenopathie, in späteren Stadien kann es jedoch auch zum spezifischen Befall durch die Tumorzellen kommen. Die Ätiologie der MF ist ungeklärt. Obwohl HTLV-1 Sequenzen in vereinzelten MF-Fällen nachgewiesen wurden, konnten größere Multicenterstudien eine Assoziation mit onkogenen Retroviren nicht belegen. Ebenso konnte kein chemisch-physikalisches Karzinogen als Auslöser identifiziert werden. Seite 3 von 57
4 Abb. 1 Mycosis fungoides, Patch-Stadium, Übersicht: Bandförmiges, perivaskulär betontes Infiltrat kleiner lymphozytärer Zellen in der oberen Dermis (HE) Abb. 2 Mycosis fungoides, Patch-Stadium: Perlschnurartig entlang der Junktionszone aufgereihte Lymphozyten ( lining-up ) mit Chromatin-dichten Kernen, die von einem optisch leeren Saum umgeben sind ( Halo-Zellen ; HE) Histologie Im Patch-Stadium ist die MF durch ein perivaskulär betontes lymphozytäres Infiltrat in der papillären Dermis charakterisiert (Abb. 1). Typischerweise finden sich perlschnurartig angeordnete Lymphozyten im Bereich der Junktionszone ( lining-up ) (Abb. 2). Intraepidermal sind vorwiegend lymphozytäre Einzelzellen mit teils leicht vergrößerten, zerebriformen Kernen erkennbar, die zudem häufig von einem optisch leeren Saum umgeben sind ( Halo-Zellen ). Ansammlungen lymphozytärer Zellen, sog. Pautrier sche Ansammlungen oder Mikroabszesse, sind im Patch-Stadium nur spärlich und selten vorhanden. Charakteristischerweise findet sich keine oder eine nur sehr gering ausgeprägte Spongiose im Bereich der Exozytose von Lymphozyten. Die Epidermis kann akanthotisch verbreitert sein, während bei poikilodermatischen Formen eine atrophe Epidermis mit vakuolärer Degeneration, Seite 4 von 57
5 Abb. 3 Mycosis fungoides, Plaque-Stadium: Lymphozytäres, bandförmiges Infiltrat in der oberen und mittleren Dermis, psoriasiforme Akanthose der Epidermis (HE) Abb. 4 Mycosis fungoides, Plaque-Stadium: Ausgeprägter Epidermotropismus mit sog. Pautrier schen Ansammlungen oder Mikroabszessen kleiner bis mittelgroßer lymphoider Zellen mit Kernatypien; beachte das Fehlen einer Spongiose im Bereich der Tumorzell-Ansammlungen (HE) erweitere kapilläre Gefäße und eine Pigmentinkontinenz zu beobachten sind. Eosinophile Granulozyten und Histiozyten sind dem Infiltrat beigemengt. Das dermale Bindegewebe im Bereich der Infiltrate zeigt irregulär angeordnete Kollagen-Fasern. Das Plaque-Stadium zeigt ein dichtes, bandförmiges Infiltrat im oberen und mittleren Korium (Abb. 3). Die Infiltrate bestehen uberwiegend aus atypischen kleinen bis mittelgroßen lymphoiden Zellen, die zerebriforme Kerne und einen schmalen Zytoplasmasaum aufweisen. Elektronenmikroskopisch lassen sich die ausgeprägte Konvolution der Kernmembran und die irreguläre Chromatinstruktur darstellen. Der Epidermotropismus des Infiltrates ist im Plaque-Stadium am ausgeprägtesten, wobei die Pautrier schen Ansammlungen lymphozytärer Zellen in mehr als der Hälfte der Biopsien nachweisbar sind (Abb. 4). Häufig sind neben eosinophilen Granulozyten auch Plasmazellen vorhanden. Die Epidermis ist nicht selten psoriasiform akanthotisch verbreitert und zeigt ein hyperund parakeratotisches Verhornungsmuster. Die topische Behandlung mit Steroiden oder Seite 5 von 57
6 Abb. 5 Mycosis fungoides, Tumor-Stadium, Übersicht: Dichtes, diffuses Infiltrat im Bereich der gesamten Dermis mit Ulzeration der Epidermis (HE) Abb. 6 Mycosis fungoides, Tumor-Stadium: Tumorzellen mit ausgeprägter Kernpleomorphie, Mitosen und einem blass eosinophilem Zytoplasma. Einige Tumorzellen gleichen Immunoblasten. Reaktive Zellen, insbesondere eosinophile Granulozyten, sind dem Infiltrat beigemengt (HE) UV-Lichtbehandlung können in einer Abnahme des Epidermotropismus atypischer Lymphozyten und apoptotischen Keratinozyten resultieren. Nebst der interfollikulären Epidermis kann auch das Epithel des Haarfollikels (Follikulotropismus) und Schweißdr usen (Syringotropismus) durch Tumorzellen infiltriert werden. Das Tumorstadium ist durch ein noduläres Infiltrat aus Tumorzellen unterschiedlicher Größe charakterisiert, welches meist die gesamte Dermis umfasst und gelegentlich die Subkutis infiltriert (Abb. 5). Insbesondere mittelgroße und große Tumorzellen zeigen pleomorphe Kerne und Mitosen und können eine immunoblastäre oder anaplastische Zytomorphologie (Abb. 6) entwickeln. Der Epidermotropismus kann im Tumorstadium fehlen. Häufig findet sich eine Ulzeration sowie eine Beimengung von eosinophilen Granulozyten und Plasmazellen. Seite 6 von 57
7 Der Begriff der Transformation, welche nicht notwendigerweise einem Tumorstadium entsprechen muss und diesem vorausgehen kann, ist durch das Auftreten von mittelgroßen bis großen pleomorphen Tumorzellen definiert, welche mindestens 25 % der Infiltratzellen ausmachen. Histopathologische Merkmale der Mycosis fungoides Patch-Stadium Bandförmiges, z. T. perivaskulär betontes ( patchy-lichenoid ) lymphozytäres Infiltrat in der oberen Dermis Einzelzell-Epidermotropismus ohne begleitende Spongiose ( dysproportionate epidermotropism ) und Aufreihung von leicht vergrößerten Lymphozyten mit Kernatypien entlang der Junktionszone ( basilar epidermotropism ); Sehr selten Pautrier sche Ansammlungen Intraepidermale atypische Lymphozyten erscheinen größer als intradermale Lymphozyten Irregulär angeordnete, teils fibrosierte Kollagenfasern im Bereich der Infiltrate Plaque-Stadium Dichtes, oft bandförmiges Infiltrat atypischer vorwiegend kleiner Lymphozyten mit zerebriformen Kernen im oberen und mittleren Korium Ausgeprägter Epidermotropismus mit Pautrier schen Ansammlungen Beimengung von eosinophilen Granulozyten und Plasmazellen Psoriasiforme Akanthose, Hyper- und Parakeratose Tumorstadium Noduläres Infiltrat pleomorpher Tumorzellen unterschiedlicher Größe mit Mitosen Beimengung einer variablen Anzahl von eosinophilen Granulozyten und Plasmazellen Verlust des Epidermotropismus möglich Häufig Ulzeration Immunhistologie und Genotypisierung Die Tumorzellen entsprechen CD4-positiven T-Helfer- Memory Lymphozyten, welche eine Expression von CD2, CD3 und CD45RO aufweisen. Ein kompletter oder partieller Verlust der Expression von CD7 wird häufig beobachtet, ist jedoch nicht krankheitsspezifisch und kann auch bei inflammatorischen Dermatosen gesehen werden. Die Tumorzellen exprimieren den alpha/beta-t-zell-rezeptor (beta-f1) und in sehr seltenen Fällen den gamma/delta-t-zell- Rezeptor (TCR-gamma). Den Tumorzellen beigemengt finden sich vereinzelte B-Lymphozyten, dendritische Zellen und Histiozyten. Seltenere Phänotypen umfassen CD8+/CD4, CD4 /CD8, CD4+/CD8 + sowie CD56+ Formen der MF, diese zeigen aber keine schlechtere Prognose als die CD4+ Form. Einzig die Expression von CD30 durch die dermale Komponente der Infiltrate und ein hoher Proliferationsindex (Ki-67) im Patch- und Plaque-Stadium gehen mit einer schlechteren Prognose einher, während eine Expression von CD30 im Tumorstadium der MF mit einem längeren Überleben einhergeht als bei CD30- negativen Fällen. Eine klonale T-Zell-Population kann mittels PCR im Plaque- und Tumorstadium in 90 % der Fälle nachgewiesen werden, während in Patch-Stadium lediglich 50 % der Fälle eine monoklonale Rearrangierung von TCR gamma-genen aufweisen. Der diagnostische Wert der Klonalitätsanalyse ist deshalb limitiert. Seite 7 von 57
8 Differenzialdiagnosen Sézary-Syndrom: Histologisch und immunphänotypisch kann das SS nicht von der MF unterschieden werden. Das klinische Bild und der Nachweis zirkulierender Tumorzellen im peripheren Blut (Lutzner-/ Sézary-Zellen) sind f ur die diagnostische Abgrenzung ausschlaggebend. Lymphomatoide Papulose: Die LyP Typ B und D mit Epidermotropismus von Lymphozyten unterschiedlicher Größe und Expression von CD4 bzw. CD8 muss von einer MF im Patch-Stadium aufgrund der klinischen Präsentation unterschieden werden, wobei die LyP durch rezidivierende Papeln und kleine Knoten mit spontaner R uckbildung der Einzelläsionen gekennzeichnet ist. Dies gilt auch f ur die LyP Typ C mit kohäsiven Verbänden CD30-positiver Tumorzellen, welche vom Tumorstadium der MF abgegrenzt werden muss. Primär kutanes anaplastisches großzelliges Lymphom: Im Gegensatz zu MF manifestiert sich das ALCL meist mit einem solitären oder gruppierten Tumorknoten ohne vorausgegangene Patches und Plaques. Kutanes peripheres T-Zell-Lymphom, nicht weiter spezifiziert (NOS): Die Unterscheidung gegen- uber einem Tumorstadium der MF beruht auf dem klinischen Bild, da beim PTL-NOS der Tumorentwicklung keine Patches und Plaques vorausgehen. Adultes T-Zell-Lymphom/Leukämie (ATLL): Die ATLL wird durch das onkogene Retrovirus HTLV-1/2 verursacht und tritt vor allem in Japan, der Karibik und im S udosten der USA auf. An der Haut manifestiert sich die Erkrankung mit disseminierten papulo-nodulären Läsionen oder Plaques. Im Krankheitsverlauf können große Tumoren und eine leukämische Phase auftreten. Die ATLL kann sich mit epidermotropen oder nodulären Infiltraten von atypischen Lymphozyten unterschiedlicher Größe manifestieren, welche von einer MF histologisch allein nicht unterschieden werden können. In den Pautrier - schen Ansammlungen findet sich gelegentlich lymphozytärer Kernstaub. Eine leukämische Phase mit atypischen lymphoiden Tumorzellen im peripheren Blut (sog. flower cells) wird häufig beobachtet. Der Phänotyp der Tumorzellen entspricht CD4-positiven T-Helferzellen, welche eine Expression von CD25 und häufig auch eine Expression von CD30 zeigen. Der Nachweis von HTLV-1/2 DNA, die in das Wirtsgenom der Tumorzellen integriert ist, ist diagnostisch wegleitend. Parapsoriasis: Es handelt sich um eine heterogene Gruppe von Erkrankungen mit chronischem Verlauf, welche sich klinisch mit erythematösen, diskret schuppenden und teils poikilodermatischen Läsionen präsentiert. Die nosologische Einordnung und der Bezug zur Mycosis fungoides werden kontrovers diskutiert. Die großherdige Form der Parapsoriasis (large plaque parapsoriasis; LPP) d urfte einer MF mit indolentem Verlauf entsprechen, während die kleinfleckige Form (small plaque parapsoriasis; SPP) wahrscheinlich eine chronische inflammatorische Dermatose darstellt. Histologisch finden sich perivaskuläre lympho-histiozytäre Infiltrate mit fokaler Exozytose von CD4+ Lymphozyten in die dar uber liegende Epidermis und fokaler Hyperparakeratose. Klonale T-Zellen können bei ca. 20 % der LPP-Fälle nachgewiesen werden. T-Zell-Pseudolymphom: Dichte bandförmige lymphozytäre Infiltrate mit Exozytose von teils atypischen, vorwiegend kleinen Lymphozyten mit chromatindichten Kernen können im Rahmen von Arzneimittel-Reaktionen (lymphomatoide Arzneimittel-Reaktion) oder kontaktallergischen Prozessen (lymphomatoide Kontaktdermatitis) auftreten. Eine ausgeprägte Exozytose von Lymphozyten kann zudem beim Lichen sclerosus et atrophicans beobachtet werden und eine MF imitieren. 1.2 Varianten und Subtypen der Mycosis Fungoides ICD-O: 9700/3 Zahlreiche klinische, histologische und phänotypische Varianten der MF sind beschrieben worden. Während die uniläsionäre Form eine exzellente Prognose aufweist, gehen die follikuläre (bzw. folliku- Seite 8 von 57
9 Abb. 7 Follikuläre Mycosis fungoides, Übersicht: Perifollikulär betontes dichtes lymphozytäres Infiltrat mit ausgeprägter Exozytose von kleinen bis mittelgroßen atypischen Lymphozyten mit chromatindichten Kernen, Muzinansammlungen im Haarfollikelepithel, Beimengung von eosinophilen Granulozyten lotrope) und die granulomatöse MF mit einem aggressiveren Verlauf und einer schlechteren Prognose einher. Die Identifikation der MF-Varianten hat daher Implikationen f ur die Behandlung. Einige klinisch-pathologische Varianten der MF Follikuläre/follikulotrope MF mit/ohne follikulärer Muzinose Granulomatöse MF und granulomatous slack skin Hyper- und hypopigmentierte MF Spongiotische MF Bullöse MF Pustulöse MF Hyperkeratotisch-verruköse MF Follikuläre Mycosis fungoides (FMF) ICD-O: 9700/3 Die FMF manifestiert sich klinisch mit alopezischen erythematösen Patches oder follikulär gebundenen Papeln, welche zu Plaques konfluieren. Histologisch finden sich follikulozentrische Infiltrate meist kleiner bis mittelgroßer Lymphozyten mit Exozytose in den Haarfollikelepithelien (Follikulotropismus; Abb. 7). In der Hälfte der Fälle tritt eine follikuläre Muzinose mit Muzin im Follikelepithel auf, welches zu seenartigen Ansammlungen konfluieren kann. Ein Epidermotropismus im Bereich der interfollikulären Epidermis kann fehlen. Kernatypien der lymphozytären Infiltratzellen, eine hohe CD4:CD8-Ratio sowie der Nachweis einer klonalen T-Zell-Population sind in der Abgrenzung gegen uber der idiopathischen follikulären Muzinose hilfreich Granulomatöse Mycosis Fungoides (GMF) ICD-O: 9700/3 Die GMF manifestiert sich nicht selten mit hyperpigmentierten Patches und Plaques. Histologisch finden sich ausgedehnte Infiltrate kleiner bis mittelgroßer Lymphoyzten mit meist diskreter Kernatypie und epitheloidzellige Granulome, welche eine Sarkoidose imitieren, oder ein Granuloma anulare-artiges Seite 9 von 57
10 Abb. 8 Granulomatöse Mycosis fungoides, Übersicht: Dermales sarkoidales granulomatöses Infiltrat aus epitheloidzelligen Granulomen und vorwiegend kleinen Lymphozyten mit leichter Kernpleomorphie (HE) Abb. 9 Pagetoide Retikulose: Pagetoide Durchsetzung der Epidermis durch atypische Lymphozyten. Vergleichsweise spärliches lymphozytäres Infiltrat in der oberen Dermis (HE) Infiltratmuster (Abb. 8). Ein Epidermotropismus fehlt in der Hälfte der Fälle, was die Diagnose zusätzlich erschwert. Dem Infiltrat sind eosinophile Granulozyten und Plasmazellen beigemengt. Kernatypien und der Nachweis einer klonalen T-Zell-Population stellen wichtige diagnostische Marker zur Abgrenzung der GMF gegen uber der Sarkoidose oder anderen inflammatorischen granulomatösen Erkrankungen dar Pagetoide Retikulose ICD-O: 9700/3; Synonym: Morbus Woringer-Kolopp Definition und klinisches Bild In der WHO-EORTC-Klassifikation und der WHO-Klassifikation (4. Aufl. 2008) ist die PR als Subtyp der MF mit uniläsionärer Manifestation in Form einer scharf begrenzten, erythemato-squamösen, psoriasiformen oder einer hyperkeratotischen Läsion und einem ausgeprägtem Epidermotropismus von T-Zellen definiert. Männer sind häufiger betroffen. Die Arne Seite 10 von 57
11 und Beine stellen die Prädilektionsstellen dar. Die PR zeigt eine exzellente Prognose ohne Dissemination oder extrakutane Ausbreitung. Histologie Die akanthotisch verbreiterte Epidermis wird im Rahmen eines ausgeprägten Epidermotropismus von atypischen lymphoiden Zellen unterschiedlicher Größe durchsetzt. Die Zellen weisen neben den atypischen chromatindichten Kernen einen in der HE-Färbung optisch leeren Zytoplasmasaum auf (sog. Halo-Zellen; Abb. 9). In den oberen Dermisschichten finden sich perivaskuläre Infiltrate, welche vorwiegend aus kleinen Lymphozyten mit teils atypischen Kernen bestehen. Immunhistologie und Genotypisierung Die Tumorzellen weisen ein breites phänotypisches Spektrum auf und exprimieren CD3, CD4 oder CD8 und in einigen Fällen auch CD30 oder CD56. Eine klonale T-Zell-Population kann nachgewiesen werden. Differenzialdiagnose Die Differenzialdiagnose umfasst histologisch das kutane aggressive epidermotrope CD8-positive zytotoxische T-Zell-Lymphom (sog. Berti-Lymphom; CD8+ AEKTZL), das kutane gamma/delta-t-zell-lymhom (epidermotrope Form; CGD-TZL) und die LyP Typ B und D. Die Abgrenzung erfolgt aufgrund des klinischen Bildes mit papulo-nodulären Läsionen bei der LyP, disseminierten erosiven und ulzerierten Plaques und Knoten beim CD8+ AEKTZL und dem CGD-TZL. Phänotypisch exprimiert das CD8+ AEKTZL CD45RA und ist negativ f ur CD30. Beim CGD-TZL findet sich eine Expression des gamma/delta-t-zell-rezeptors. Der Morbus Paget sowie andere Tumoren mit pagetoidem Wachstumsmuster (superfiziell spreitendes Melanom, Morbus Bowen, intraepitheliale Form des Talgdr usenkarzinoms) können aufgrund des Immunphänotyps unterschieden werden. Histopathologische Merkmale der pagetoiden Retikulose Pagetoide Durchsetzung der akanthotischen Epidermis mit atypischen Lymphozyten unterschiedlicher Größe Tumorzellen mit chromatindichten, teils gekerbten Kernen und einem optisch leeren Zytoplasmasaum ( Halo-Zellen ) Variabler Immunphänotyp: CD4+/ CD8+/, CD30 /+, CD56 / Kutanes elastolytisches Lymphom ICD-O: 9700/3; Synonym: granulomatous slack skin; GSS Definition und klinisches Bild Es handelt sich um eine seltene KTZL-Form, welche meist zwischen dem 30. und 40. Lebensjahr auftritt und sich mit initial poikilodermatischen großflächigen Infiltraten meist im Bereich intertriginöser Hautareale manifestiert. Im Verlauf entwickeln sich die f ur die Erkrankung charakteristischen atrophen und herabhängenden Hautpartien, die an eine Cutis laxa erinnern und ulzerieren können. Der Verlauf erstreckt sich uber Jahre bis Jahrzehnte, wobei bei der Hälfte der Patienten ein Zweitlymphom auftritt (vor allem Hodgkin-Lymphom). Histologie Es finden sich diffuse dermale Infiltrate uberwiegend kleiner bis mittelgroßer Lymphozyten mit atypischen, teils zerebriformen Kernen und darin eingestreut histiozytäre Riesenzellen mit bis zu 40 Zellkernen pro Riesenzelle, wobei die Riesenzellen eine Elastophagozytose und eine Phagozytose lymphozytärer Zellen (Emperipolese) zeigen (Abb. 10). In der Elastica-Van-Gieson-Färbung wird ein nahezu vollständiger Verlust der elastischen Fasern im Bereich der Infiltrate deutlich. Seite 11 von 57
12 Abb. 10 Kutanes elastolytisches T-Zell-Lymphom (granulomatous slack skin): Charakteristische histiozytäre Riesenzelle mit kranzartig angeordneten Zellkernen; beachte die Phagozytose von kleinen Lymphozyten (Emperipolesis) und elastischen Fasern (Elastophagozytose) durch die Riesenzellen (HE) Immunhistologie und Genotypisierung Die Tumorzellen exprimieren einen T-Helfer-Phänotyp (CD3+, CD4+, CD8 ), während die histiozytären Zellen u. a. CD68 exprimieren. Eine klonale T-Zell-Population ist in den meisten Fällen nachweisbar. Differenzialdiagnose Infolge uberlappender histologischer Befunde mit der GMF beruht die Abgrenzung auf dem klinischen Bild mit Cutis laxa-artigen Veränderungen bei der GSS. Infektiöse granulomatöse bzw. Histiozyten-reiche Hauterkrankungen wie atypische Mykobakteriosen zeigen meist eine Nekrosebildung und ein gemischtzelliges Infiltrat mit Beimengung von Plasmazellen. Histopathologische Merkmale des kutanen elastolytischen Lymphoms Diffuses Infiltrat kleiner bis mittelgroßer Lymphozyten mit teils atypischen gekerbten Kernen in der gesamten Dermis, teils bis in das subkutane Fettgewebe reichend Zahlreiche mehrkernige histiozytäre Riesenzellen mit randständig kranzartig angeordneten Kernen (bis zu 40 Kerne pro Riesenzelle) mit Einschl ussen elastischer Fasern (Elastophagozytose) und von Lymphozyten (Emperipolesis) 1.3 Sézary-Syndrom ICD-O: 9701/3 Definition und klinisches Bild Das Sézary-Syndrom (SS) ist ein seltenes T-Zell-Lymphom, welches durch eine Erythrodermie und zirkulierende Tumorzellen im peripheren Blut gekennzeichnet ist. Das SS tritt vor allem bei älteren Patienten auf, wobei Männer häufiger betroffen sind. Das klinische Bild ist durch eine Erythrodermie, eine Alopezie und palmoplantare Hyperkeratose charakterisiert, welche von einem ausgeprägten Pruritus begleitet werden. Es finden sich vergrößerte Lymphknoten, die in den Initialstadien reaktiver Natur (dermatopathische Lymphadenopathie) sind, jedoch im weiteren Verlauf Ausdruck eines spezifischen Befalls darstellen kann. Im peripheren Blutbild lassen sich mehr als Sézary-Zellen pro ml nachweisen, welche durch zerebriforme hyperchromatische Kerne gekennzeichnet sind. Das SS ist Seite 12 von 57
13 Abb. 11 Sézary-Syndrom, Übersicht: Bandförmiges lymphozytäres Infiltrat im oberen Korium ohne Epidermotropismus (HE). Beachte: Das histologische Bild ist nicht diagnostisch eine Neoplasie der sog. central memory T-Zellen mit Expression des homing Rezeptors CCR-7, L-Selectin und des Differenzierungsmarker CD27. Die Erkrankung unterscheidet sich von der MF, welche den Phänotyp von sog. skin resident effector memory T-Zellen aufweist. Die Prognose des SS ist schlecht mit einer mittleren Überlebensrate von weniger als 3 Jahren. Histologie Beim SS finden sich perivaskuläre oder bandförmige lymphozytäre Infiltrate im oberen und mittleren Korium mit unterschiedlich stark ausgeprägtem Epidermotropismus (Abb. 11). Pautrier sche Ansammlungen sind seltener zu sehen als bei der MF (Plaque-Stadium). Die monomorphen Tumorzellen entsprechen uberwiegend kleinen und teils auch mittelgroßen Lymphozyten mit chromatindichten, teils zerebriformen Kernen mit einer Beimengung vereinzelter Blasten. Dem Infiltrat können eosinophile Granulozyten beigemengt sein. In bis zu 40 % der Biopsien finden sich jedoch unspezifische, d. h. nicht diagnostische Befunde, wobei insbesondere der Epidermotropismus atypischer Lymphozyten fehlen kann. Die Entnahme mehrere Hautbiopsien erhöht die diagnostische Aussagekraft. Im Rahmen eines spezifischen Befalls des Lymphknotens durch das SS kommt es zu einer teilweisen oder vollständigen Aufhebung der Lymphknotenarchitektur durch ein dichtes, monotones Infiltrat der kleinen bis mittelgroßen Tumorzellen. In seltenen Fällen kann eine Transformation mit großzelliger Zytomorphologie der Tumorzellen in der Haut oder im Lymphknoten gesehen werden. Histopathologische Merkmale des Sézary-Syndroms Histopathologisches Bild oft nicht diagnostisch Perivaskuläres oder bandförmiges monotones Infiltrat in der oberen Dermis mit atypischen kleinen und vereinzelt mittelgroßen Lymphozyten mit zerebriformen Kernen Variabler, ausgeprägter Epidermotropismus mit Aufreihung atypischer lymphozytärer Zellen entlang der Junktionszone und Bildung sog. Pautrier scher Ansammlungen Beimengung von eosinophilen Granulozyten und Plasmazellen Ödem oder Fibrose im Stratum papillare Seite 13 von 57
14 Immunhistologie und Genotypisierung Die Tumorzellen exprimieren einen T-Helfer-Phänotyp (CD3+, CD4+ und CD45RO) mit variablem Verlust anderer T-Zell-Marker (CD2, CD7). Eine Expression von PD-1, welche jedoch nicht krankheitsspezifisch ist, kann in vielen Fällen nachgewiesen werden. Eine klonale T-Zellpopulation lässt sich in den meisten Fällen sowohl in den Hautbiopsien als auch im peripheren Blut nachweisen. Die zirkulierenden Tumorzellen beim SS sind CD4+ CD26-. In der Flowzytometrie findet sich zudem eine erhöhte Expression von CD164, einem hämatopoetischen Stammzellmarker, durch die Tumorzellen. Differenzialdiagnose Andere T-Zell-Lymphome: Das SS kann infolge uberlappender bzw. identischer histologischer und phänotypischer Befunde einzig unter Einbezug des klinisches Bildes und der Befunde hämatologischer Untersuchungen von der MF unterschieden werden. Das adulte T-Zell-Lymphom/Leukämie zeigt wie das SS zirkulierende vergrößerte Lymphozyten mit Kernatypien im peripheren Blut (sog. flower cells), weist jedoch die f ur die Erkrankung charakteristische Integration von HTLV-1/2 in das Wirtsgenom der Tumorzelle auf. Inflammatorische Erythrodermien: Im Vordergrund stehen die erythrodermatische Psoriasis, die atopische Dermatitis, die Pityriasis rubra pilaris und erythrodermatische Formen von Arzneimittel- Reaktionen. Die Unterscheidung ist sehr anspruchsvoll, wobei ein ausgeprägter Epidermotropismus atypischer Lymphozyten, eine deutlich erhöhte CD4:CD8-Ratio und der Nachweis eines identischen T-Zell-Klons in der Haut und den Lymphknoten diagnostisch hilfreich sind. Der Nachweis von CD4+ CD164+ Tumorzellen beim SS mittels Flowzytometrie unterscheidet das SS von der MF und der atopischen Dermatitis. Eine sichere Unterscheidung aufgrund histologischer und phänotypischer Merkmale gelingt jedoch in lediglich 60 % der Fälle, was den Stellenwert der klinisch-pathologischen Korrelation und hämatologischer Untersuchungen unterstreicht. Als Red-man-Syndrom wurde eine ätiologisch heterogene, klinisch und histologisch dem Sézary- Syndrom ähnliche Erkrankung bezeichnet, bei welcher sich jedoch im peripheren Blutbild keine Tumorzellen nachweisen lassen. Einige Fälle stellen möglicherweise ein Vorläuferstadium eines Sézary- Syndroms dar. 1.4 Kutane CD30-positive lymphoproliferative Erkrankungen ICD-O: 9718/3 Die kutanen CD30-positiven lymphoproliferativen Erkrankungen (CD30+ LPE) sind die zweithäufigste KTZL-Form. Es handelt sich um ein Spektrum von Erkrankungen, welches die lymphomatoide Papulose (LyP), das primär kutane anaplastische großzellige T-Zell-Lymphom (AGL) und sog. Borderline-Läsionen umfasst. Das gemeinsame immunphänotypische Merkmal ist die Expression von CD30 durch die atypischen Lymphozyten. Die CD30-positiven lymphoproliferativen Erkrankungen der Haut zeigen uberlappende histologische Befunde, weshalb die diagnostische Zuordnung stets einer klinisch-pathologischen Korrelation bedarf Lymphomatoide Papulose ICD-O: 9718/3 Definition und klinisches Bild Die 1968 von W. Macaulay beschriebene Erkrankung ist durch rezidivierende, papulöse bis klein noduläre Hautveränderungen mit spontaner R uckbildung und eine pleomorphe oder anaplastische Zytomorphologie der CD30+ Lymphozyten charakterisiert. Die Erkrankung kann in jedem Lebensalter auftreten und zeigt keine eindeutige Geschlechterpräferenz. Die papulo-nodulären Läsionen zeigen eine charakteristische Evolution: Nach einer initialen Wachstumsphase kommt es Seite 14 von 57
15 innerhalb von 3 8 Wochen zu einer vollständigen spontanen R uckbildung der Einzelläsion, gelegentlich unter Hinterlassung einer kleinen Narbe. Gleichzeitig können an anderen Körperstellen neue Läsionen auftreten. Die Erkrankung zeigt einen chronischen, gutartigen Verlauf, welcher sich uber Monate bis Jahrzehnte erstrecken kann, ohne dass die Lebenserwartung eingeschränkt ist. Ungefähr % der Patienten erkranken jedoch vor, während oder nach der LyP an einer weiteren kutanen oder nodalen lymphoproliferativen Erkrankung (sog. LyP-assoziierte Lymphome), insbesondere einer MF, einem kutanen oder nodalen AGL oder einem Hodgkin-Lymphom (HL). Die Ätiologie der LyP ist bislang ungeklärt. Histologie F unf histologische Typen wurden identifiziert, welche sich bez uglich des Infiltratmusters und der Infiltratzusammensetzung unterscheiden, jedoch keine prognostische Bedeutung haben. Unterschiedliche Typen können gleichzeitig bei einem Patienten auftreten. Abb. 12 Lymphomatoide Papulose. Keilförmiges dermales Infiltrat mit Ulzeration (HE) Abb. 13 Lymphomatoide Papulose. Gemischtzelliges Infiltrat, welches aus großen anaplastischen Tumorzellen, kleinen reaktiven Lymphozyten, eosinophilen und neutrophilen Granulozyten, Plasmazellen und Histiozyten besteht und einem Typ A der lymphomatoiden Papulose entspricht (HE) Seite 15 von 57
16 Typ A (gemischtzelliger bzw. histiozytoider Typ) ist durch ein dermales, keilförmiges Infiltrat charakterisiert, das aus einzeln oder in kleinen Gruppen angeordneten pleomorphen und anaplastischen lymphoiden Zellen mit Beimengung von eosinophilen und neutrophilen Granulozyten, Histiozyten und kleinen Lymphozyten besteht (Abb. 12 und 13). Die mittelgroßen bis großen pleomorphen und anaplastischen lymphoiden Zellen weisen chromatinarme, teils vesikuläre Kerne und ein blasseosinophiles Zytoplasma auf. Die mitotische Aktivität ist hoch. Die lymphoiden Zellen erinnern teils an Reed-Sternberg-Zellen oder Hodgkin-Zellen. Typ B (epidermotroper Typ) zeigt ein bandförmiges lymphozytäres Infiltrat im oberen Korium mit Epidermotropismus von uberwiegend kleinen bis mittelgroßen Lymphozyten mit chromatindichten, teils zerebriformen Kernen, wobei große atypische lymphoide Zellen beigemengt sein können. Typ C (anaplastischer Typ) weist ein noduläres, dichtes kohäsives Infiltrat auf mit großen pleomorphen und anaplastischen Tumorzellen mit mitotischer Aktivität und lediglich wenigen inflammatorischen Zellen. Eine Ulzeration ist häufig zu beobachten. Typ D (CD8+ epidermotroper Typ) ist charakterisiert durch ein ausgeprägt epidermotropes Infiltrat kleiner bis mittelgroßer CD8+ und CD30+ Lymphozyten mit chromatindichten atypischen Kernen. Es können zusätzlich perivaskuläre und subkutane Infiltrate auftreten. Typ E (angioinvasiver Typ) ist durch angiozentrische und angiodestruktive Infiltrate von vorwiegend mittelgroßen atypischen lymphoiden Zellen in allen Dermisschichten und teils auch der Subkutis gekennzeichnet, wobei die Zerstörung der Gefäße zu ausgedehnten Nekrosen und zur Ulzeration f uhrt. Es findet sich häufig eine Beimengung von eosinophilen Granulozyten. Histopathologische Merkmale der lymphomatoiden Papulose Typ A: Keilförmiges, gemischtzelliges Infiltrat mit einzeln oder in kleinen Gruppen angeordneten pleomorphen und anaplastischen lymphoiden Zellen mit mitotischer Aktivität, zahlreichen eosinophilen und neutrophilen Granulozyten, Histiozyten und kleinen reaktiven Lymphozyten, Ulzeration oder narbige Fibrose Typ B: Bandförmiges epidermotropes Infiltrat in den oberen Dermisschichten aus kleinen bis mittelgroßen lymphoiden Zellen mit chromatindichten, teils zerebriformen Kernen Typ C: Kohäsive Verbände großer pleomorpher und anaplastischer Tumorzellen und wenige beigemengte reaktive inflammatorische Zellen Typ D: Ausgeprägt epidermotropes Infiltrat kleiner bis mittelgroßer atypischer Lymphozyten mit chromatindichten Kernen und Expression von CD8 und CD30 Typ E: Angiozentrische und angiodestruktive Infiltrate vorwiegend mittelgroßer atypischer lymphoider Zellen mit Zerstörung dermaler und teils auch subkutaner Gefäße, ausgedehnte Nekrosen und Ulzeration, Beimengung eosinophiler Granulozyten Immunhistologie und Genotypisierung Die atypischen Lymphozyten entsprechen aktivierten T-Zellen mit Expression von CD3, CD4 oder CD8 und CD25. Das charakteristische Merkmal ist die Expression von CD30 durch die atypischen lymphoiden Zellen bei allen histologischen LyP-Typen (Abb. 14), wobei die Expression von CD30 bei der LyP Typ B variabel sein kann und teils auch vollständig fehlen kann. Eine Expression von CD8 findet sich bei der LyP Typ D und in 70 % der LyP Typ E-Fälle. CD15 wird in der Hälfte der LyP-Fälle exprimiert. Eine Expression zytotoxischer Marker (insbesondere TIA-1) zeigen 70 % der Fälle. Eine klonale T-Zell-Population kann in % der Fälle in Abhängigkeit vom Seite 16 von 57
17 Abb. 14 Lymphomatoide Papulose. Charakteristische Expression des CD30-Antigens durch die Tumorzellen (Immunhistologie APAAP) histologischen Typ nachgewiesen werden und ist damit lediglich von begrenztem Nutzen f ur die Diagnostik. Differenzialdiagnose Andere Lymphome: Die Differenzialdiagnose der LyP Typ A umfasst einen kutanen Befall durch ein Hodgkin-Lymphom (HL) sowie eine Transformation einer MF mit Expression von CD30. Die Abgrenzung bedarf des Einbezugs der von Staging-Untersuchungen beim HL und des klinischen Kontextes bei der MF. Der Expression von CD15 kommt hierbei kein differenzialdiagnostischer Nutzen zu, da CD15 auch in der Hälfte der LyP Fälle exprimiert wird. Das klinische Bild ist wegweisend bei der Unterscheidung der LyP Typ B von einer MF (Patch- bzw. Plaque-Stadium) und einer LyP Typ C von einem AGL. Sekundär kutane Infiltrate eines systemischen AGL m ussen durch Staging-Untersuchungen abgegrenzt werden. Der Typ D kann aufgrund des klinischen Bildes vom CD8+ AEKTZL unterschieden werden, welches sich mit erosiven oder ulzerierten Plaques und Tumoren manifestiert. Die immunhistochemischen Befunde (TCR-gamma-Expression bzw. Expression von CD56 und EBV-assoziierter RNA; EBER) und insbesondere das klinische Bild sind von zentraler Bedeutung in der Differenzierung zwischen LyP Typ E und Infiltraten eines extranodalen T/NK-Zell-Lymphoms und eines kutanen gamma/delta-t-zell-lymphoms. Inflammatorische und infektiöse Erkrankungen: Insbesondere bei der LyP Typ A umfasst die Differenzialdiagnose auch entz undliche Dermatosen wie Arthropodenstich-Reaktionen, Infestation (Skabies) und Arzneimittel-Reaktionen, bei denen CD30-positive vergrößerte und atypisch erscheinende Lymphozyten auftreten können. Infektiöse Prozesse, insbesondere Parapoxvirus-Infektionen, können mit einer Beimengung von mittelgroßen atypischen CD30-positiven Lymphozyten einhergehen und eine LyP Typ A imitieren. Die LyP Typ B und D muss von der Pityriasis lichenoides et varioliformis acuta (PLEVA) unterschieden werden, wobei die Vakuolisierung und die fokale Hyperparakeratose mit Einschl ussen von neutrophilen Granulozyten sowie das Fehlen von Kernatypien f ur eine PLEVA sprechen. Seite 17 von 57
18 Abb. 15 Kutanes anaplastisches großzelliges Lymphom. Noduläres dermales Infiltrat (HE) Abb. 16 Kutanes anaplastisches großzelliges Lymphom. Kohäsives Infiltrat vorwiegend großer anaplastischer Lymphozyten mit mitotischer Aktivität und blass eosinophilem Zytoplasma; zahlreiche apoptotische Tumorzellen sind erkennbar (HE) Kutanes anaplastisches großzelliges Lymphom ICD-O: 9718/3 Definition und klinisches Bild Das primär kutane AGL ist durch die Zytomorphologie und die Expression von CD30 durch mehr als 75 % der Tumorzellen definiert. Die Erkrankung manifestiert sich in der Mehrzahl der Patienten als rasch wachsender solitärer Knoten oder gruppierte Tumoren, welche zur Ulzeration neigen. Im Gegensatz zum systemischen bzw. nodalen AGL weist die kutane Form eine sehr gute Prognose mit einer 5-Jahres-Überlebensrate von 90 % auf. Ein extrakutaner Befall tritt selten auf, ist Seite 18 von 57
19 jedoch bei einer uber die lokoregionären Lymphknoten hinausgehenden Ausbreitung mit einer hohen Mortalität assoziiert. Histologie Das noduläre, uberwiegend dermale Infiltrat, welches sich bis in die Subkutis ausdehnen kann, besteht aus kohäsiven Verbänden großer pleomorpher, anaplastischer oder immunoblastischer Tumorzellen (Abb. 15). Eine Ulzeration ist häufig zu beobachten. Die Tumorzellen zeigen eine ausgeprägte Kernpleomorphie der mäßig chromatindichten, teils vesikulären Kerne, eine hohe mitotische Aktivität und einen breiten, blass-eosinophilen Zytoplasmasaum mit deutlichen Zellgrenzen (Abb. 16). Ein Epidermotropismus von Tumorzellen ist selten, kann jedoch in einigen Fällen beobachtet werden. Eosinophile Granulozyten, Histiozyten und kleine Lymphozyten sind meist in geringer Anzahl vorhanden. Die Tumorinfiltrate können von einer pseudoepitheliomatösen Hyperplasie der Epidermis begleitet sein. Histologische Varianten des AGL (kleinzellig, lymphozytenreich, sarkomatoid), welche beim systemischen AGL beschrieben wurden, sind beim KAGL selten anzutreffen. Die neutrophilen-reiche Form des kutanen AGL ist durch einzelne oder in kleinen Aggregate von Tumorzellen in einem dichten Infiltrat neutrophiler Granulozyten charakterisiert, wobei diese Variante besonders bei immundefizienten Patienten vorkommt. Histopathologische Merkmale des kutanen anaplastischen großzelligen Lymphoms Noduläres kohäsives Infiltrat mittelgroßer und großer pleomorpher und anaplastischer Tumorzellen Wenige beigemengte eosinophile oder neutrophile Granulozyten, meist an der Peripherie des Tumors Ulzeration Immunhistologie und Genotypisierung Die Tumorzellen zeigen neben der charakteristischen Expression von CD30 einen CD4-positiven T-Zell-Phänotyp mit schwacher oder fehlender Expression von CD3 sowie einem variablen Verlust weiterer T-Zellmarker wie CD2 und CD5. CD8+ Fälle zeigen keine schlechtere Prognose. Zytotoxische Marker und EMA können in einigen Fällen exprimiert werden. Im Gegensatz zum systemischen ALCL weist das calcl nur in weniger als 10 % der Fälle eine Expression von ALK-1/p80 und eine Translokation t(2;5) auf. Ein Rearrangement des IRF4-DUSP22 Locus auf Chromosom 6p25.3 ist in 28 % des primär kutanen AGL vorhanden und lässt sich mittels FISH nachweisen. Ein monoklonales Rearrangement von TZR gamma-genen findet sich in der Mehrzahl der Fälle. Differenzialdiagnose Das primär kutane AGL muss von sekundär kutanen Infiltraten eines systemischen bzw. nodalen AGL mittels Staging-Untersuchungen abgegrenzt werden. Die Unterscheidung eines primär kutanen AGL von einer Transformation einer MF mit Expression von CD30 erfolgt aufgrund des klinischen Bildes mit Patches und Plaques bei der MF, welche der Entwicklung von Tumoren bei der MF vorausgehen. Im Gegensatz zum primär kutanen AGL zeigt das kutane periphere T-Zell-Lymphom NOS keine oder lediglich eine partielle Expression von CD30. Seite 19 von 57
20 Die LyP Typ C, welche sich ebenfalls mit kohäsiven Verbänden CD30-positiver pleomorpher und anaplastischer lymphoider Zellen manifestiert, erfolgt aufgrund der klinischen Präsentation mit rezidivierenden papulo-nodulären Läsionen und spontaner Regression der individuellen Läsionen bei der LyP. Andere nicht lymphozytäre pleomorphe oder anaplastische Neoplasien wie das atypische Fibroxanthom, das wenig differenzierte spinozelluläre Karzinom und das noduläre maligne Melanom können aufgrund des Immunphänotyps vom primär kutanen AGL unterschieden werden. Der immunhistochemische Nachweis der großen CD30+ Tumorzellen ermöglicht die Unterscheidung der neutrophilen-reichen Form des AGL vom Pyoderma gangraenosum und anderen neutrophilenreichen Prozessen. 1.5 Subkutanes Pannikulitis-artiges T-Zell-Lymphom ICD-O: 9708/3 Definition und klinisches Bild Das subkutane Pannikulitis-artige T-Zell-Lymphom (SPTZL) stellt eine seltene Lymphom-Entität dar, die durch die Lokalisation in der Subkutis und ihren Phänotyp mit Expression von TZR-alpha/beta definiert ist. Das SPTZL tritt uberwiegend bei Patienten nach dem 50. Abb. 17 Subkutanes Pannikulitis-artiges T-Zell-Lymphom. Übersicht: Subkutane lobuläre Infiltrate lymphozytärer Zellen, welche in der Übersichtsversgrösserung nicht von einer inflammatorischen Pannikulitis zu unterscheiden ist (HE) Seite 20 von 57
21 Abb. 18 Subkutanes Pannikulitis-artiges T-Zell-Lymphom. Charakteristische perlschnurartige Anordnung von kleinen und mittelgroßen pleomorphen Tumorzellen um die infiltrierten Fettzellen ( rimming ) (HE) Lebensjahr auf und zeigt keine Geschlechtsprädilektion. Die Erkrankung manifestiert sich mit multiple indurierten Plaques und subkutanen Knoten, wobei die Extremitäten die Prädilektionsstellen darstellen. Die Läsionen imitieren klinisch ein Erythema nodosum oder andere Pannikulitisformen. Ulzerationen sind selten zu beobachten. In einigen Fällen tritt im Krankheitsverlauf ein Hämophagozytose-Syndrom auf. Das SPTZL zeigt eine g unstige Prognose mit einer 5-Jahres-Überlebensrate von 80 %. Eine Ausbreitung in andere Organe ist selten zu beobachten. Das SPTZL muss von der subkutanen Form des gamma/delta-t-zell-lymphoms unterschieden werden, welche eine ung unstige Prognose aufweist. Histologie Die Erkrankung ist durch lobuläre Infiltrate vorwiegend mittelgroßer Lymphozyten mit pleomorphen, meist mäßig chromatindichten Kernen gekennzeichnet (Abb. 17). Diese umgeben perlschnurartig Lipozyten (sog. Rimming; Abb. 18), wobei es sich hierbei nicht um ein krankheitsspezifisches Phänomen handelt. Dem Infiltrat sind Plasmazellen, kleine Lymphozyten und Histiozyten beigemengt, wobei letztere eine Phagozytose von Kerntr ummern zeigen. Die Tumorzellinfiltrate sind auf die Subkutis beschränkt und greifen in der Regel nicht auf die Dermis uber. Histopathologische Merkmale des subkutanen Pannikulitis-artigen T-Zell-Lymphoms Subkutanes lobuläres lymphozytäres Infiltrat aus pleomorphen lymphoiden Zellen unterschiedlicher Größe und Chromatingehalt Kranzförmige Anordnung von Tumorzellen um Fettzellen, lymphozytäre Kerntr ummer (Karyorrhexis) mit Phagozytose durch Histiozyten Beimengung von Plasmazellen Expression von CD8 und beta-f1 (T-Zell-Rezeptor alpha/beta) Seite 21 von 57
22 Abb. 19 Subkutanes Pannikulitis-artiges T-Zell-Lymphom: Expression von CD8 (links) durch die Tumorzellen und hohe proliferative Aktivität, Ki-67 (rechts) (Immunhistologie DAB) Immunhistologie und Genotypisierung Die Tumorzellen exprimieren CD3, CD8, TIA-1 und beta-f1 als immunhistochemischen Marker f ur die Expression des TZR-alpha/beta (Abb. 19). Es findet sich keine Expression von CD4 und CD56. Die Tumorzellen zeigen eine gesteigerte proliferative Aktivität (Abb. 19). Eine klonale T-Zell-Population kann in den meisten Fällen nachgewiesen werden. Es besteht keine Assoziation mit EBV. Differenzialdiagnose Die Abgrenzung gegen uber der subkutanen Form des gamma/delta-t-zell- Lymphom (GD-TZL) beruht auf der Expression der gamma/delta-kette des TZR, welche am Paraffineingebetteten, Formalin-fixierten Gewebe durch Expression von TZR-gamma und am Kryo-asservierten Gewebe durch Expression von TZR-delta nachgewiesen werden kann. Das GD-TZL geht zudem häufiger mit einem Hämophagozytose-Syndrom einher und zeigt histologisch nicht selten eine Ausbreitung der Infiltrate in die Dermis und in einigen Fällen auch eine epidermotrope Komponente. Die Differenzialdiagnose des SPTZL umfasst des Weiteren Infiltrate des extranodalen NK/T-Zell-Lymphoms vom nasalen Typ, das eine Expression von CD56 und eine Assoziation mit EBV in der in situ-hybridisierung aufweist. Unter den nicht-neoplastischen Erkrankungen ist die Lupus-Pannikulitis (LP) zu erwähnen, wobei die kleinen Lymphozyten bei der LP keine Kernatypien zeigen. Bei der LP finden sich kleine Aggregate von CD123+ plasmazytoiden dendritischen Zellen, welche dem SPTZL fehlen. Bei einigen Patienten mit SPTZL tritt im Erkrankungsverlauf ein Lupus erythematodes auf oder er geht der Erkrankung voraus, so dass eine Unterscheidung zwischen einer LP und einem SPTZL im individuellem Fall schwierig sein kann. 1.6 Extranodales NK/T-Lymphom vom nasalen Typ und NK-Zell-Lymphome ICD-O: 9719/3 Definition und klinisches Bild Diese seltenen Lymphom-Formen zeigen eine Differenzierung von T/ NK-Zellen oder NK-Zellen und sind mit EBV assoziiert. Der Hautbefall stellt meist eine sekundäre Ausbreitung des Lymphoms im Rahmen eines systemischen Befalles dar. Es finden sich erythematöse bis livide Knoten unterschiedlicher Größe mit einer Ulzeration. Ein Befall im Bereich der Nasenschleimhaut Seite 22 von 57
23 Abb. 20 Extranodales T/NK-Lymphom vom nasalen Typ. Dermal diffuses dichtes Infiltrat mittelgroßer bis großer atypischer Lymphozyten mit Nachweis von Epstein-Barr-Virus-RNA (EBER) in den Tumorzellen (Inset) (HE und in situ Hybridisierung) Abb. 21 Extranodales T/NK-Lymphom vom nasalen Typ: Angiozentrisches und angiodestruktives Wachstum mit Durchsetzung und Zerstörung der Gefäßwände durch Tumorzellen (HE) und des Gaumens mit mutilierenden Ulzerationen ist typisch f ur das extranodale T/NK-Zell-Lymphom vom nasalen Typ. Insbesondere in Asien sowie in Mittel- und S udamerika (Mexiko) findet sich das Hydroa-vacciniforme-artige T-Zell-Lymphom, welches bei Kindern und Adoleszenten auftritt und durch vesikulo-bullöse Läsionen an lichtexponierten Arealen sowie ein ausgeprägtes Gesichtsödem charakterisiert ist. Das extranodale NK/T-Zell-Lymphom vom nasalen Typ, NK-Zell-Lymphome und das Hydroa-vacciniforme-artige T-Zell-Lymphom zeigen einen aggressiven Verlauf mit einer mittleren Überlebenszeit von weniger als 3 Jahren. Seltene Fälle mit ungewöhnlich indolentem und protrahiertem Verlauf wurden beschrieben. Histologie Die Erkrankung ist durch vorwiegend angiozentrische und angiodestruktive dermale und/oder subkutane Infiltrate von atypischen lymphoiden Zellen variabler Größe und ausgeprägter Kern- Seite 23 von 57
24 pleomorphie charakterisiert (Abb. 20 und 21). Oftmals sind zahlreiche eosinophile Granulozyten, Histiozyten und Plasmazellen beigemengt. Als Folge der Gefäßzerstörung finden sich Nekrosen und Ulzeration. Histopathologische Merkmale des extranodalen T/NK-Zell-Lymphoms vom nasalen Typ Angiozentrische und angiodestruktive dermale und subkutane Infiltrate mittelgroßer atypischer Lymphozyten Nekrosen und Ulzeration Beimengung von eosinophilen Granulozyten, Plasmazellen und Histiozyten Expression von CD56 und Nachweis von Epstein-Bar-Virus-RNA (EBER) mittels in situ Hybridisierung Immunhistologie und Phänotypisierung Die Tumorzellen exprimieren bei Vorliegen eines T/NK-Zell- Phänotyps CD3 epsilon und den NK-Zell-Marker CD56, während bei einem reinen NK-Zell-Phänotyp ausschließlich CD56 oder CD57 exprimiert werden. Zytotoxische Marker wie TIA-1, Granzym B und Perforin lassen sich nachweisen. EBV lässt sich mittels in situ-hybridisierung (EBER) in den Tumorzellen nachweisen (Abb. 20, Inset). Differenzialdiagnose Die Differenzialdiagnose umfasst kutane Infiltrate angiozentrischer und angiodestruktiver lymphozytärer Infiltrate. Das CGD-TCL unterscheidet sich immunhistochemisch vom extranodalen T/NK-Zell-Lymphom durch die Expression von TZR-gamma/delta und das Fehlen einer Assoziation mit EBV. Die Abgrenzung gegen uber der angioinvasiven LyP (Typ E) beruht auf rezidivierenden papulösen Läsionen mit spontaner Regression der Einzelläsionen bei der LyP. Sowohl beim CD8+ AEKTZL als auch bei der LyP Typ D stehen die epidermotropen Infiltrate von CD8+ atypischen Lymphozyten im Vordergrund, wobei die LyP im Gegensatz zum CD8+ AEKTZL eine Expression von CD30 zeigt. Differenzialdiagnose und Expressionsmuster kutaner angiozentrischer und angiodestruktiver lymphozytärer Infiltrate Extranodales T/NK-Zell-Lymphom, nasaler Typ und NK-Zell-Lymphome: CD3epsilon+, CD56+, CD30 /+, EBER+ Kutanes gamma/delta-t-zell-lymphom: CD3+, CD8+ oder CD56+, TCR-gamma+, TCR-beta- EBER Kutanes CD8-positives aggressives epidermotropes zytotoxisches T-Zell-Lymphom: CD8+ CD30- CD45RA+, EBER Lymphomatoide Papulose Typ D: Epidermotrope und angiozentrische Infiltrate von CD8+ und CD30+ Lymphozyten, EBER Lymphomatoide Papulose, angioinvasiver Typ E: CD3+, CD8+ (70 %), CD30+, EBER 1.7 Kutane periphere T-Zell-Lymphome Die Gruppe der kutanen peripheren T-Zell-Lymphome (PTL) beinhaltet zum einen seltene Subtypen wie das kutane CD4-positive klein-/mittelgroßzellige T-Zell-Lymphom (CD4+ SMTL), das kutane gamma/ delta-t-zell-lymphom (KGD-TZL) und das kutane CD8-positive aggressive epidermotrope zytotoxische Seite 24 von 57
25 T-Zell-Lymphom (CD8+ AEKTZL). Die ubrigen Fälle, welche keiner dieser seltenen PTL-Subtypen und keiner der anderen KTZL-Entitäten zugeordnet werden können, werden als kutanes peripheres T-Zell- Lymphom als nicht weiter spezifiziert (PTL, NOS) bezeichnet Kutane periphere T-Zell-Lymphome, seltene Subtypen Kutanes CD4-positives klein-/mittelgroßzelliges T-Zell-Lymphom ICD-O: 9709/3 Definition und klinisches Bild Es handelt sich um eine PTL-Form, welche in der WHO-Klassifikation (4. Aufl. 2008) als provisorische Entität aufgef uhrt wird. In den meisten Fällen manifestiert sie sich als solitärer Knoten im Kopf-Hals-Bereich bei Patienten in der Lebensdekade. Die solitäre Form der Erkrankung weist eine exzellente Prognose mit einer 5-Jahres-Überlebensrate von uber 95 % auf. In den seltenen Fällen mit multiplen Tumoren wurde ein aggressiver Verlauf beobachtet. Die multifokale Form wird daher von einigen Autoren den PTL NOS zugeordnet. Angesichts der Expression von PD-1 und anderer Marker follikulärer Helfer-T-Zellen wird postuliert, dass es sich beim CD4+ SMTL um eine Neoplasie follikulärer Helfer-T-Zellen handelt. Histologie Die Erkrankung ist durch ein dermales und teils bis in die Subkutis reichendes knotiges Infiltrat gekennzeichnet, welches aus kleinen und mittelgroßen Lymphozyten mit pleomorphen chromatindichten Kernen besteht (Abb. 22 und 23). Ein Epidermotropismus fehlt oder ist nur fokal und diskret ausgeprägt, während ein Follikulotropismus nicht selten zu beobachten ist. Dem Infiltrat sind in kleinen Aggregaten angeordnete B-Zellen, eosinophile Granulozyten, Plasmazellen sowie Histiozyten beigemengt. Abb. 22 Kutanes CD4-positives klein-/mittelgroßzelliges T-Zell-Lymphom: Dermales noduläres Infiltrat ohne Epidermotropismus (HE) Seite 25 von 57
26 Abb. 23 Kutanes CD4-positives klein-/mittelgroßzelliges T-Zell-Lymphom: Infiltrat aus kleinen und mittelgroßen Lymphozyten mit pleomorphen chromatindichten Kernen (HE) Histopathologische Merkmale des kutanen CD4-positiven klein-/mittelgroßzelligen T-Zell- Lymphoms Dermales noduläres Infiltrat aus kleinen und mittelgroßen Lymphozyten Kein signifikanter Epidermotropismus, fokaler Follikulotropismus Beimengung von eosinophilen Granulozyten, Plasmazellen, Histiozyten (manchmal in kleinen Granulomen) Expression von CD3, CD4 und PD-1, Ansammlungen von CD20-positiven B-Zellen Immunhistologie und Genotypisierung Die kleinen bis mittelgroßen atypischen Lymphozyten zeigen einen CD3+ CD4+ CD30 Phänotyp und eine unterschiedlich stark ausgeprägte Expression von PD-1 (programmed death-1) und weiterer Marker von follikulären Helfer-T-Zellen (CXCL-13, bcl-6, CD10, ICOS). Die PD1-positiven Lymphozyten sind häufig in kleinen Rosetten angeordnet. Eine klonale T-Zell- Population kann in ca. 60 % der Fälle mittels PCR nachgewiesen werden. Differenzialdiagnose Die Differenzialdiagnose umfasst in erster Linie das kutane noduläre T-Zell- Pseudolymphom (T-PSL), welches in 5 % der Fälle eine Reaktion auf Medikamente, insbesondere Antiepileptika, darstellt. Eine sichere Unterscheidung der solitären Form des CD4+ SMTL vom nodulären T-PSL ist weder klinisch noch histologisch oder phänotypisch möglich, weshalb von einigen Autoren als gemeinsame Bezeichnung der Begriff CD4-positive klein-/mittelgroßzellige T-Zell-Proliferation mit ungeklärtem malignem Potential bzw. kutane CD4-positive klein-/mittelgroßzellige lymphoproliferative Erkrankung vorgeschlagen wurde. Die Abgrenzung gegen uber einem Tumorstadium einer MF erfolgt aufgrund des klinischen Bildes mit Patches und Plaques bei der MF, welche der Tumorentstehung vorausgehen. Seite 26 von 57
27 Abb. 24 CD8-positives kutanes T-Zell-Lymphom, Übersicht: Ausgeprägt epidermotropes lymphozytäres Infiltrat in einer akanthotisch verbreiterten und hyper-parakeratotisch verhornenden Epidermis (HE), Expression von CD8 durch die Tumorzellen (Inset) (Immunhistologie DAB) Primär kutanes CD8-positives aggressives epidermotropes zytotoxisches T-Zell-Lymphom ICD-O 9709/3 Definition und klinisches Bild Diese sehr seltene KTZL-Form ist durch epidermotrope Infiltrate CD8-positiver zytotoxischer Lymphozyten und einen aggressiven Verlauf charakterisiert. Die Erkrankung manifestiert sich mit disseminierten erosiven und ulzerierten Plaques und Knoten. Eine extrakutane Ausbreitung mit einem Befall der enoralen Schleimhaut, viszeraler Organe und des zentralen Nervensystems kann im Verlauf auftreten. Die Patienten versterben innerhalb der ersten 3 Jahre nach der Diagnose. Histologie Die kleinen bis mittelgroßen atypischen Lymphozyten mit pleomorphen, chromatindichten Kernen zeigen einen ausgeprägten Epidermotropismus. Nekrotische Keratinozyten und eine fokale epidermale Nekrose sind charakteristische Merkmale (Abb. 24). Eine Spongiose und eine fokale intraepidermale Blasenbildung können beobachtet werden. Neben der epidermotropen Komponente lassen sich häufig auch angiozentrische und angiodestruktive Infiltrate nachweisen. Histopathologische Merkmale des primär kutanen CD8-positiven aggressiven epidermotropen zytotoxischen T-Zell-Lymphoms Epidermotropismus von kleinen bis mittelgroßen atypischen Lymphozyten mit chromatindichten Kernen Nekrotische Keratinozyten und fokale epidermale Nekrose, oberflächliche Ulzeration Spongiose und intraepidermale Blasenbildung Expression von CD8 und TIA-1 Seite 27 von 57
28 Abb. 25 Kutanes gamma/delta Lymphom: Dermale und vorwiegend subkutane, lobulär betonte lymphozytäre Infiltrate. Ulzeration (HE) Immunhistologie und Genotypisierung Die Tumorzellen entsprechen CD3+ CD8+ Lymphozyten mit einer Expression von zytotoxischen Markern (TIA-1 Granzyme B und/oder Perforin). Die Zellen exprimieren CD45RA als Marker naiver T-Zellen. Ein Verlust von T-Zell-Markern wie CD2 oder CD7 wird gesehen. Die Tumorzellen sind negativ f ur CD30. Es besteht keine Assoziation mit EBV. Differenzialdiagnose Bei der CD8-positiven MF finden sich klinisch Patches und Plaques ohne Erosionen oder Ulzeration. Histologisch fehlen apoptotische Keratinozyten und eine epidermale Nekrose. Die pagetoide Retikulose, bei welcher die epidermotropen Tumorzellen eine Expression von CD8 aufweisen können, erfolgt die Abgrenzung aufgrund des klinischen Bildes mit der f ur die PR typischen uniläsionären Plaque. Die CD8-positive epidermotrope Form der LyP (Typ D) zeigt Papeln und kleine Knoten mit spontaner Regression der einzelnen Herde. Das KGD-TZL weist die charakteristische Expression von TCR-gamma bzw. TCR-delta auf. Kutanes gamma/delta T-Zell-Lymphom ICD-O 9726/3 Definition und klinisches Bild Es handelt sich um eine sehr seltene aggressive kutane Neoplasie zytotoxischer T-Zellen mit Expression des TZR gamma/delta. Klinisch zeigen sich disseminierte erosive Plaques und ulzerierte Knoten mit Prädilektion der Extremitäten und einem häufigen Befall der hautnahen Schleimhäute. Ein Hämophagozytose-Syndrom kann als akut lebensbedrohende Komplikation hinzukommen. Das KGD-TZL weist einen aggressiven Verlauf mit einer mittleren Überlebenszeit von 15 Monaten auf. Histologie Die Erkrankung manifestiert sich mit epidermotropen, dermalen und/oder subkutanen Infiltraten mittelgroßer bis großer Lymphozyten mit pleomorphen, chromatindichten Kernen (Abb. 25 und 26). Ein angiozentrisches und angiodestruktives Wachstum und Nekrosen sind häufig zu verzeichnen. Bei der subkutanen Form des GD-TZL lassen sich lobuläre Infiltrate nachweisen sowie neben den Tumorzellen Kerntr ummer-speichernde Makrophagen und Nekrosen (Abb. 25 und 26). Immunhistologie und Genotypisierung Die Tumorzellen zeigen einen CD3+, CD4, CD8 /+ und CD56+ Phänotyp und eine Expression zytotoxischer Proteine. Am Formalin-fixierten, Paraffineingebetteten Material kann die Expression von TZR gamma (Abb. 26, inset) und am kryoasservierten Gewebe die Expression von TZR delta immunhistochemisch dargestellt werden. Ein monoklonales Seite 28 von 57
29 Abb. 26 Kutanes gamma/delta Lymphom: Subkutane Infiltrate mittelgroßer Lymphozyten mit pleomorphen Kernen und charakteristischer Expression von T-Zell-Rezeptor gamma (Inset)(HE und Immunhistologie DAB) Rearrangement von TZR gamma oder delta-genen ist in den meisten Fällen nachweisbar. Es besteht keine Assoziation mit einer EBV-Infektion. Differenzialdiagnose Das CD8+ AEKTZL zeigt keine Expression von TZR-gamma und exprimiert CD8. Das extranodale T/NK-Zell-Lymphom bzw. NK-Zell-Lymphome zeigen wie das KGD-TZL eine Expression von CD56, weisen jedoch eine Assoziation mit EBV (EBER+) auf. Die angioinvasive Form der lymphomatoiden Papulose (Typ E) lässt sich aufgrund des klinischen Bildes mit rezidivierenden Papeln mit spontaner Regression unterscheiden. Histopathologische Merkmale des kutanen gamma/delta T-Zell-Lymphoms Epidermotrope, dermale und/oder subkutane lymphozytäre Infiltrate Angiozentrische und angiodestruktive Infiltrate und Nekrosen möglich Vorwiegend mittelgroße Lymphozyten mit pleomorphen chromatindichten Kernen Bei subkutaner Form Phagozytose von lymphozytären Kerntr ummern durch Histiozyten Expression von TZR-gamma am formalin-fixierten paraffin-eingebetteten Gewebe bzw. TZR-delta am kryoasservierten Gewebe Kutanes peripheres T-Zell-Lymphom, nicht weiter spezifiziert ICD-O 9702/3 Definition und klinisches Bild Dieser Kategorie gehören alle KTZL-Fälle an, welche nicht einer der anderen Lymphomentitäten zugeordnet werden können. Die fr uher als Mycosis fungoides d emblée bezeichneten Fälle werden ebenfalls dieser Lymphomform zugeordnet. Diese Lymphomform ist sehr selten und manifestiert sich mit lokalisierten oder generalisierten rot-braunen oder lividen Knoten mit Ulzeration ohne vorausgegangene Patches oder Plaques. Die Prognose ist vor allem bei multifokalem Befall infaust. Seite 29 von 57
30 Histologie Es finden sich dichte noduläre bzw. diffuse dermale Infiltrate von uberwiegend mittelgroßen bis großen Lymphozyten und pleomorphen Kerne. Ein Epidermotropismus fehlt. In einigen Fällen liegt ein angiozentrisches und angiodestruktives Wachstum vor. In unterschiedlichem Ausmaß sind eosinophile Granulozyten, kleine Lymphozyten und Histiozyten beigemengt. Eine Ulzeration findet sich in den meisten Fällen. Histopathologische Merkmale des kutanen peripheren T-Zell-Lymphoms, nicht weiter spezifiziert (PTL, NOS) Ausschlussdiagnose (alle andere T- und NK/T-Zell-Lymphome sollten ausgeschlossen werden) Vorwiegend dermale diffuse oder noduläre Infiltrate aus mittelgroßen bis großen Lymphozyten mit Kernpleomorphie, kein Epidermotropismus Beimengung von eosinophilen Granulozyten, Histiozyten und Plasmazellen Ulzeration Expression von CD3, CD4 oder CD8 und zytotoxischen Markern (TIA-1, Granzyme B, Perforin), fehlende oder partielle (<50 % der Tumorzellen) Expression von CD30, hohe Proliferationsrate (MIB-1) Immunhistologie und Genotypisierung Die Tumorzellen exprimieren meist einen zytotoxischen CD4+ oder CD8+ T-Zell-Phänotyp mit variablem Verlust von T-Zell-Antigenen. CD30 wird nicht oder von weniger als der Hälfte der Tumorzellen exprimiert. In einigen Fällen kann eine Expression von PD-1, CXCL-13 und weiterer Marker follikulärer Helfer T-Zellen durch die Tumorzellen nachgewiesen werden. Es ist ungeklärt, ob es sich bei diesen Fällen um eine eigenständige Lymphomentität handelt. Differenzialdiagnose Die Differenzialdiagnose umfasst kutane Infiltrate mittelgroßer bis großer lymphozytärer Tumorzellen. Staging-Untersuchungen sind von zentraler Bedeutung zur Unterscheidung gegen uber einem sekundär kutanen Befall eines nodalen PTL. Infiltrate großzelliger Tumorzellen im Rahmen einer LyP und eines kutanen AGL können durch die Expression von CD30 durch die Mehrzahl der atypischen Lymphozyten abgegrenzt werden. 1.8 Angioimmunoblastisches Lymphom ICD-O 9705/3 Definition und klinisches Bild Das angioimmunoblastische Lymphom (AIL) stellt eine Neoplasie follikulärer Helfer-T-Zellen dar und wird den peripheren T-Zell-Lymphomen zugeordnet und ist durch das Auftreten von B-Symptomen (Fieber, Nachtschweiß und Gewichtsverlust), eine generalisierte Lymphadenopathie sowie eine Hepato- und Splenomegalie charakterisiert. Im Blut lässt sich eine Anämie, eine Leukozytose und eine polyklonale Hypergammaglobulinämie nachweisen. Hauterscheinungen werden bei der Hälfte der Patienten beobachtet, wobei makulo-papulöse Exantheme im Vordergrund stehen. In einigen Fällen treten Plaque-artige oder knotige Infiltrate auf. Nicht selten stellt der Hautbefall die Erstmanifestation des AIL dar. Der Verlauf der Grunderkrankung ist aggressiv und f uhrt bei % der Patienten innerhalb von Monaten bis wenigen Jahren zum Tod. Histologie In vielen Fällen findet sich ein mäßig ausgeprägtes dermales perivaskuläres Infiltrat, das aus lymphozytären Zellen und eosinophilen Granulozyten besteht (Abb. 27). Eine signifikante Kernatypie Seite 30 von 57
31 Abb. 27 Angioimmunoblastisches Lymphom, kutaner Befall: Dichte dermale perivaskuläre Infiltrate vorwiegend kleiner, teils atypischer Lymphozyten (links; HE) mit Expression von PD-1 durch die Tumorzellen (rechts; Immunhistochemie - APAAP). Immunhistologie APAAP) der Lymphozyten lässt sich meist nicht nachweisen. Seltener finden sich dichte Infiltrate vorwiegend mittelgroßer pleomorpher Lymphozyten. Die Lymphknotenbiopsie zeigt die f ur die Erkrankung typischen Veränderungen mit prominenten postkapillären Venulen und einem polymorphen Infiltrat aus pleomorphen Lymphozyten unterschiedlicher Größe und teils hellem Zytoplasma, Plasmazellen und eosinophilen Granulozyten. Immunhistologie und Genotypisierung Die Tumorzellen exprimieren T-Zell-Marker (CD3, CD4) und den Phänotyp follikulärer Helfer-T-Zellen mit variabel ausgeprägter Expression von PD-1, CXCL-13, bcl-6, CD10 und ICOS, wobei PD-1 und CXCL-13 am häufigsten exprimiert werden (Abb. 27, rechts). Eine klonale Rearrangierung von TZR-gamma-Genen können auch in einigen Fällen von klinisch und histologisch unspezifisch erscheinenden Infiltraten nachgewiesen werden. EBV-RNA (EBER) ist in den Hautinfiltraten selten zu finden, während EBV in der Mehrzahl der Lymphknoteninfiltrate ein konsistentes Merkmal der AILT darstellt. Differenzialdiagnose Die Zuordnung zu einer AIL beruht auf den Resultaten der Lymphknotenbiopsie und bildgebender Verfahren sowie laborchemischer Befunde. Die Differenzialdiagnose umfasst bei initialen und gering ausgeprägten vorwiegend superfiziellen perivaskulären Infiltraten inflammatorische Dermatosen wie Arzneimittelreaktionen oder paravirale Exantheme. Bei spezifischen Hautinfiltraten der AIT m ussen andere T-Zell-Lymphome wie eine MF (Tumorstadium) durch das klinische Bild oder durch Staging-Untersuchungen oder das kutane CD4+ SMTL differenzialdiagnostisch abgegrenzt werden. 2 Kutane B-Zell-Lymphome Kutane B-Zell-Lymphome (KBZL) sind Neoplasien des Immunsystems, charakterisiert durch eine Proliferation von B-Lymphozyten, die ein gewebespezifisches homing pattern mit Infiltration der Haut aufweisen. Diese Lymphome stellen eine wichtige Gruppe der primären kutanen Lymphome dar. Die KBZL repräsentieren ca. 35 % aller kutanen Lymphome. Seite 31 von 57
32 Tab. 0.1 Kutane B-Zell-Lymphome gemäß der WHO-Klassifikation f ur hämatopoetische und lymphoproliferative Erkrankungen (4. Aufl. 2008) und WHO-EORTC-Klassifikation WHO-EORTC-Klassifikation (2005) WHO-Klassifikation (4. Aufl. 2008) Primär kutanes Marginalzonen-B-Zell-Lymphom Extranodales Marginalzonen-Lymphom vom MALT-Typ Primär kutanes Keimzentrumslymphom Primär kutanes Keimzentrumslymphom Wachstumsmuster: follikulär, gemischt, diffus Primär kutanes diffuses großzelliges B-Zell-Lymphom, Primär kutanes diffuses großzelliges B-Zell-Lymphom, Bein-Typ Bein-Typ Primär kutanes diffuses großzelliges B-Zell-Lymphom, Diffuses großzelliges B-Zell-Lymphom andere Intravaskuläres B-Zell-Lymphom Intravaskuläres B-Zell-Lymphom Die Klassifikation erfolgt auch bei den kutanen B-Zell-Lymphomen entsprechend der WHO-Klassifikation lymphoider Tumoren (4. Aufl. 2008) und der WHO/EORTC-Klassifikation f ur KL (2005), wobei 3 Hauptgruppen unterschieden werden: das kutane Keimzentrums-Lymphom (KZL) und das kutane Marginalzonen-Lymphom (MZL), welche niedrig maligne Lymphome darstellen, und das diffuse großzellige B-Zell Lymphom vom Bein-Typ (DGBL-BT) als aggressive KBZL-Form. Die fr uher als kutanes Immunozytom und primär kutanes Plasmozytom bezeichneten Tumoren werden hierbei dem kutanen MZL zugeordnet. Übrige Formen des DGBL (sog. DGBL, andere; primary cutaneous diffuse large B-cell lymphoma, others) und das intravaskuläre B-Zell-Lymphom stellen sehr seltene Formen von KBZL dar. 2.1 Klassifikation Primäre (KBZL) repräsentieren ein breites Spektrum von Lymphomen mit charakteristischen klinischen, histologischen, immunphänotypischen und molekulargenetischen Eigenschaften. Es hat sich gezeigt, dass Lymphome der Lymphknoten und primäre KBZL ausgeprägte prognostische Unterschiede aufweisen, auch wenn beide nahezu identische morphologische Befunde zeigen. Außerdem finden sich nicht selten verschiedene immunologische und molekulare Alterationen (Beispiel: bcl-2 Proteinexpression und t(14;18) bei Keimzentrumslymphomen), die einen wichtigen Hinweis f ur eine unterschiedliche Pathogenese nodaler Lymphome im Vergleich zu den primären KBZL darstellen. Die primären KBZL können aus diesen Gr unden nicht zwanglos den nodalen Lymphomen gleichgestellt werden. Dieser Erkenntnis tragen die WHO-Klassifikation lymphoider Tumoren (4. Aufl. 2008) und die WHO/EORTC-Klassifikation f ur KL (2005) Rechnung. Sie st utzen sich sowohl auf exakt definierte klinische Kriterien (z. B. Lokalisation, Prognose) wie auch auf moderne morphologische, immunologische und molekulargenetische Befunde (Tab. 0.1). 2.2 Kutanes Keimzentrumslymphom ICD-O 9690/3; Synonym: follikuläres Lymphom; primary cutaneous follicle center lymphoma Definition und klinisches Bild Kutane Keimzentrumslymphome (KZL) sind neoplastische Proliferationen von Keimzentrumszellen in der Haut. Sie stellen die häufigste Form der KBZL dar. Das klinische Bild imponiert mit solitären Tumoren oder mit gruppierten rötlichen Papeln, Plaques und Knoten, die von Papeln bzw. anulären Erythemen und Plaques umgeben sind. Bevorzugte Lokalisationen betreffen Kopf und R ucken. Ein Teil der als Reticulohistiocytoma Crosti bezeichneten Tumoren wird heute zu den kutanen Keimzentrumslymphomen gezählt. Eine seltene Manifestationsform stellt die sog. Seite 32 von 57
33 Abb. 28 Kutanes Keimzentrumslymphom: Diffuses Wachstumsmuster (HE) Abb. 29 a, b Kutanes Keimzentrumslymphom: follikuläres Wachstumsmuster (a und b; HE). agminierte Form dar, bei welcher sich multiple Papeln und kleine Tumorknoten finden, welche klinisch in erster Linie an eine entz undliche Dermatose wie eine Rosazea denken lassen. Die Prognose des KZL ist sehr gut mit einer 5-Jahres-Überlebensrate von uber 90 %. Obwohl kutane Rezidive bei etwa 50 % der Patienten beobachtet werden können, bleiben diese Lymphome in den meisten Fällen auf die Haut beschränkt. Histologie Kutane KZL zeigen histologisch knotige oder diffuse Infiltrate in der gesamten Dermis, welche bis in die Subkutis reichen können (Abb. 28 und 29). Die Epidermis ist nicht betroffen. Drei Wachstumsmuster werden unterschieden: follikuläres, gemischt follikulär-diffuses und diffuses Muster. Ein deutliches follikuläres Muster mit neoplastischen Keimzentren wird nicht selten beobachtet. Zytomorphologisch uberwiegen Zellen mit Merkmalen von Zentrozyten (kleine und mittelgroße Zellen mit gekerbten unregelmäßigen Kernen) und Zentroblasten (größere Zellen mit hellen rundlichen Kernen und membranständigen Nukleolen sowie schmalem Zytoplasmasaum; Abb. 30), untermischt mit Immunoblasten (größere Zellen mit hellen rundlichen Kernen und großem zentralem Nukleolus), kleine Seite 33 von 57
34 Abb. 30 Kutanes Keimzentrumslymphom: Proliferation von Zentrozyten und beigemengten Zentroblasten (HE) Abb. 31 Kutanes Keimzentrumslymphom: Neoplastische Keimzentrumszellen weisen eine CD10-Positivität auf (Immunhistochemie DAB) Lymphozyten, Histiozyten und selten eosinophile Granulozyten und Plasmazellen. In den meisten Fällen finden sich zusätzlich kleine T-Lymphozyten, die gelegentlich auch in sehr großer Zahl vorliegen können. Eine besondere Variante des KZL imponiert mit spindeligen und/oder bizarren Zellen, welche an andere Tumoren (v. a. Sarkome) denken lassen können. Positivität auf CD20 und anderen Markern des KZL erlauben eine eindeutige Diagnose. Immunhistologie und Genotypisierung Neoplastische B Lymphozyten exprimieren B-Zell-assoziierte Antigene (CD20, CD79a) und monoklonale Immunglobuline. Sie sind negativ f ur CD5. CD10 (Abb. 31), Bcl-6 und CD21 sind positiv in jenen Fällen, die histologisch durch ein follikuläres Muster charakterisiert sind. Nicht-follikuläre KZL sind in der Regel CD10- und CD21-negativ, Bcl-6 aber oft positiv. Im Gegensatz zu nodalen KZL ist die Färbung f ur bcl-2-protein (Bcl-2) in den meisten Fällen negativ. Seite 34 von 57
35 Im Vergleich mit den reaktiven Keimzentren ist die Proliferationsrate (Ki-67) bei den neoplastischen Keimzentren oft (aber nicht immer!) vermindert (reaktive Keimzentren: nahezu 100 % Ki-67-Positivität; neoplastische Keimzentren: <50 % Positivität). Die Molekularanalyse der Keimzentren nach Mikrodissektion in Fällen von KZL mit follikulärem Muster zeigte eine Monoklonalität der Zentrozyten und Zentroblasten. Die interchromosomale 14;18 Translokation, welche f ur nodale Keimzentrumslymphome typisch ist, kann nur in sehr seltenen Fällen kutaner KZL nachgewiesen werden. Differenzialdiagnosen Differenzialdiagnostisch bereitet die Unterscheidung von gutartigen kutanen Pseudolymphomen, die häufig Keimzentren aufweisen, mitunter Schwierigkeiten. Ein n utzliches Kriterium zur Differenzierung benigner von malignen kutanen follikulären lymphoproliferativen Erkrankungen ist die Analyse der Ki67-Positivität (MIB-1) im Bereich der Keimzentren. Maligne Keimzentren zeigen oft eine deutlich niedrigere Proliferationsrate im Vergleich zu gutartigen (reaktiven) Keimzentren. In einigen Fällen von KZL mit follikulärem Muster zeigt die Färbung f ur Bcl-6 das Vorliegen von Clustern positiver interfollikulärer Lymphozyten. Diese werden in gutartigen B-Zell-Proliferationen mit follikulärem Muster (Pseudolymphome) nicht beobachtet. Kriterien zur Diagnose des Keimzentrumslymphoms Knotige oder diffuse Infiltrate von Zentrozyten und Zentroblasten, follikuläres Muster nicht selten CD20+, CD5, Bcl2, Bcl6+; CD10+ in Fällen mit follikulärem Muster Reduzierte Proliferation (Ki-67) neoplastischer Keimzentren t(14;18) nicht nachweisbar 2.3 Kutanes Marginalzonen-Lymphom ICD-O 9699/3; Synonym: Extranodales Marginalzonen-Lymphom vom MALT-Typ Definition und klinisches Bild Das kutane Marginalzonen-Lymphom (MZL) wird als Subtyp der extranodalen Marginalzonen-Lymphome vom MALT(mucosa-associated lymphoid tissue)-typ aufgefasst. Dem MZL werden das in der fr uheren Terminologie als kutanes Immunozytom bekannte und das primär kutane Plasmozytom als morphologische Varianten zugeordnet. Das klinische Bild zeigt rezidivierende rötliche Papeln, Plaques und Knoten, wobei bei uber 70 % der Patienten multiple Läsionen vorliegen. Bevorzugte Lokalisationen sind der Stamm und die oberen Extremitäten. Die Prognose ist sehr gut mit einer 5-Jahres-Überlebensrate von uber 95 %. In einer Studie konnte nach mehr als 4 Jahren Verlaufskontrolle keine extrakutane Beteiligung beobachtet werden. Histologie Histologisch findet man knotige oder diffuse Infiltrate im Bereich der gesamten Dermis bis in die Subkutis reichend. Die Epidermis ist nicht betroffen. Zytomorphologisch uberwiegen kleine bis mittelgroße Zellen mit gekerbten Kernen und einem blassen breiten Zytoplasma ( centrocyte-like Zellen). Das typische histopathologische Muster zeigt knotige Infiltrate mit reaktiven Keimzentren umgeben von neoplastischen Marginal-Zone-Zellen, lymphoplasmazytoiden Zellen und Plasmazellen (Abb. 32 und 33). Zusätzlich werden einzelne Blasten, Eosinophile und Histiozyten beobachtet. Eine granulomatöse Reaktion mit histiozytären Riesenzellen wurde in einigen Fällen nachgewiesen. Die lymphoplasmazelluläre Variante des MZL (fr uher kutanes Immunozytom) zeigt histologisch dermale und subkutane knotige Infiltrate, die kleine Lymphozyten, lymphoplasmozytoide Zellen und Plasmazellen enthalten. Plasmazellen sind oft an der Peripherie der Tumorinfiltrate angeordnet. Diag- Seite 35 von 57
36 Abb. 32 Kutanes Marginalzonen-Lymphom. Knotige Infiltrate in der gesamten Dermis bis in die obere Subkutis reichend (HE) Abb. 33 Kutanes Marginalzonen-Lymphom. Marginalzonen-Zellen (Zentrozyten-ähnliche Zellen), lymphoplasmazytoide Zellen, Plasmazellen, kleine Lymphozyten und vereinzelt Blasten (HE) nostisch hinweisend sind PAS-positive kugelige Einschl usse im Kern ( Dutcher bodies ) und/oder im Zytoplasma ( Russell-Körperchen ). Reaktive Keimzentren werden selten beobachtet (Abb. 34). Die plasmazellreiche Variante des MZL (fr uher kutanes Plasmozytom) zeigt histologisch eine Proliferation von uberwiegend Plasmazellen. Das Zellbild kann einerseits monoton erscheinen oder die Plasmazellen zeigen ein breites morphologisches Spektrum mit typischen Marschalkó-Zellen, atypischen Plasmazellen und Riesenformen bzw. mehrkernigen Plasmazellen (Abb. 35). Sog. Dutcher- und Russell- Körperchen werden nur selten beobachtet. Kleine, reaktive Lymphozyten sind in der Regel nicht vorhanden. Amyloidablagerungen werden bei MZL nicht beobachtet, finden sich aber häufiger bei kutanen Metastasen eines primären extrakutanen Plasmozytoms. Seite 36 von 57
37 Abb. 34 Kutanes Marginalzonen-Lymphom, lymphoplasmazelluläre Variante. Monomorphe Proliferation von lymphoplasmozoiden Zellen und kleinen Lymphozyten (HE) Abb. 35 Kutanes Marginalzonen-Lymphom, plasmazellreiche Variante. Das Infiltrat besteht fast ausschließlich aus Plasmazellen (HE) Abb. 36 Kutanes Marginalzonen-Lymphom, blastäre Variante. Proliferation uberwiegend blastärer Zellen, welche zum Teil an Plasmablasten erinnern (HE) Seite 37 von 57
38 Abb. 37 Kutanes Marginalzonen-Lymphom: Monoklonale kappa Leichtkettenexpression (links: lambda; rechts: kappa) Die blastäre Variante des MZL imponiert mit uberwiegend blastären Zellen, welche zum Teil an den Plasmablasten erinnern. (Abb. 36) Diese Variante kann de novo oder als Transformation eines bekannten MZL auftreten. Die Prognose bei den de novo Fällen scheint gleich wie bei den anderen Varianten des MZL zu sein, während die Fälle mit der blastären Transformation eine schlechtere Prognose haben könnten (es sind allerdings nur sehr wenige Fälle beobachtet worden). Immunhistologie und Genotypisierung Die Tumorzellen zeigen Positivität f ur CD20, CD79a und Bcl-2. Sie sind negativ f ur CD5 und CD10. Eine monoklonale Immunglobulinexpression kann in den meisten Fällen mittels Immunhistochemie oder in-situ-hybridisierung nachgewiesen werden. Typischerweise sind die monoklonalen Plasmazellen an der Peripherie der knotigen Infiltrate angeordnet. Hilfreiche diagnostische Hinweise bietet auch der Antikörper gegen proliferierende Zellen (MIB-1), welcher die proliferierenden Zellen an der Peripherie der Infiltrate zeigt. In einigen Fällen wurde eine Expression von IgG4 durch die monoklonalen Plasmazellen beobachtet (Abb. 37). Der Klonalitätsnachweis des Ig-Schwerkettengene-Rearrangements mittels molekularbiologischer Methoden gelingt in einem großen Teil der primären kutanen MZL. Differenzialdiagnosen Das MZL sollte von gutartigen lymphoidzelligen Infiltraten abgegrenzt werden. Das wichtigste Kriterium f ur die Differenzialdiagnose ist der Nachweis der Monoklonalität mittels Immunhistologie (Leichtkettenrestriktion) und Molekularbiologie. Immunhistochemisch oder mittels in situ Hybridisierung ist die Leichtkettenrestriktion oft nur in den lymphoplasmazytoiden Zellen und Plasmazellen nachweisbar. Seite 38 von 57
39 Abb. 38 a, b Kutanes großzelliges B-Zell-Lymphom, Bein-Typ: a Diffuses Infiltrat in der gesamten Dermis; b Proliferation von Zentroblasten untermischt mit Immunoblasten Kriterien zur Diagnose des kutanen Marginalzonen-Lymphoms. Knotige oder diffuse Infiltrate, neoplastische Marginalzone-Zellen und Plasmazellen oft nur am Rand der Knoten, mehrere Varianten (lymphoplasmazytäre; plamazelluläre; blastäre) CD20+, CD5, Bcl2+, monoklonale Leichtkettenexpression 2.4 Kutanes diffuses großzelliges B-Zell-Lymphom, Bein-Typ ICD-O 9680/3 Definition und klinisches Bild Das primäre kutane diffus großzellige B-Zell-Lymphom vom Bein-Typ (DGBL-BT) tritt bevorzugt an den Unterschenkeln älterer Patienten auf, wobei die Erkrankung häufiger bei Frauen auftritt. und einen aggressiven Verlauf mit einer 5-Jahres-Überlebensrate von durchschnittlich 50 % (20 60 %) zeigt. Das klinische Spektrum ist durch bräunlich-rote bis blau-rote exulzerierte solitäre oder lokal aggregierte Papeln, Knoten und Plaques gekennzeichnet. Rezidive und extrakutane Manifestationen werden beobachtet. Läsionen mit den gleichen klinisch-pathologischen Merkmalen können auch an anderen Körperstellen auftreten. Histologie Histologisch zeigen diese Lymphome dichte, knotige oder diffuse Infiltrate im Bereich der gesamten Dermis und der oberen Subkutis. Zytomorphologisch uberwiegen große Tumorzellen mit den Charakteristika von Zentroblasten und/oder Immunoblasten (große helle Kerne mit deutlicher Kernmembran, zentral gelegenen prominenten Nukleoli und breitem basophilen Zytoplasma; Abb. 38). Die Zahl der Mitosen ist meist groß. Epidermotropismus von neoplastischen B-Lymphozyten wird manchmal beobachtet. In diesen Fällen ist die Unterscheidung von einer Mycosis fungoides im Tumorstadium nur mittels immunhistochemischer und molekularbiologischer Untersuchungen möglich. Seite 39 von 57
40 Immunhistologie und Genotypisierung Die immunhistologischen Untersuchungen ergeben folgendes Profil: die Tumorzellen weisen oberflächliche und/oder zytoplasmatische Immunglobuline auf und sind bei Anwendung von pan-b-zell-markern (CD19, CD20) positiv. Sie sind in der Regel bcl-2- und MUM1- positiv und zeigen eine hohe Proliferationsrate (MIB1). Die Expression von bcl-6 ist variabel ausgeprägt. In den meisten Fällen ist ein monoklonales Rearrangement des IgH-Gens nachweisbar. Die t(14;18) ist nicht vorhanden. In einigen Fällen findet sich ein Verlust der Expression und Funktion von p16 aufgrund einer chromosomalen Aberration von 9p21.3 oder Promotor-Hypermethylierung, welche einen prognostisch ung unstigen Faktor darstellt. Differenzialdiagnosen Das großzellige B-Zell-Lymphom des Beines ist von anderen großzelligen kutanen Tumoren (z. B. anaplastisches großzelliges Lymphom, Metastasen, usw.) abzugrenzen. Die klinisch-pathologische Korrelation bzw. das immunhistochemische Profil erlauben in den meisten Fällen eine genaue Diagnose. Eine wichtige Differenzialdiagnose ist die diffuse Variante des KZL, da beide Lymphome aus uberwiegend großen Lymphozyten bestehen. Die Tumorzellen sind uberwiegend Immunoblasten und Zentroblasten im DGBL-BT, uberwiegend große Zentrozyten im KZL. Im Unterschied zum KZL sind die Tumorzellen bei DGBL-BT positiv f ur Bcl-2 und MUM-1. Kriterien zur Diagnose des großzelligen B-Zell-Lymphoms, Bein-Typ. Dichte, diffuse Infiltrate mit uberwiegend großen Lymphozyten (Zentroblasten, Immunoblasten) CD20+, Bcl2+, MUM-1+, Bcl-6+/, IgM+ 2.5 Intravaskuläres B-Zell-Lymphom der Haut ICD-O: 9712/3 Definition und klinisches Bild Es handelt sich um eine intravaskuläre Proliferation großer, atypischer B-Lymphozyten. Die Haut und das Zentral-Nerven-System sind die häufigste Lokalisationen dieses sehr seltenen Lymphoms. Eine Variante des intravaskulären großzelligen Lymphoms zeigt ein T-Phänotyp der Abb. 39 Intravaskuläres B-Zell-Lymphom der Haut: Ansammlungen großer, atypischer Lymphozyten in den Gefäßen der Dermis (HE), immunhistochemische Darstellung der endothelialen Auskleidung der Gefäße (Inset: CD31; Immunhistochemie DAB) Seite 40 von 57
41 neoplastischen Zellen. Das klinische Bild imponiert mit diffusen, unscharf begrenzten, erythematösen Plaques, welche vor allem am Stamm und an den proximalen unteren Extremitäten auftreten. Histologie Histologisch zeigen intravaskuläre großzellige B-Zell-Lymphome (IGBZL) Ansammlungen großer, atypischer Lymphozyten in den Gefäßen der Dermis und Subkutis (Abb. 39). In manchen Fällen sind perivaskuläre atypische Lymphozyten ebenso nachweisbar. Die Gefäße können durch die neoplastische Infiltration nahezu vollständig okkludiert sein. Immunhistologie und Genotypisierung Die neoplastischen Zellen sind f ur pan-b-zell-marker (CD19, CD20) positiv und zeigen eine hohe Proliferationsrate (MIB1). In den meisten Fällen ist ein monoklonales Rearrangement des IgH-Gens nachweisbar. Wie bereits angef uhrt, zeigt ein geringer Teil der Fälle einen T-Zell-Phänotyp (meist zytotoxisch und mit Positivität auf EBV; CD3+, CD56+, TIA1+, EBER1+; Abb. 39, Inset). Differenzialdiagnosen Das IGBZL sollte von gutartigen intravaskulären Zellproliferationen wie z. B. der intravaskulären Histiozytose unterschieden werden. Das histologische Bild und vor allem das immunhistochemische Profil erlauben die genaue Klassifizierung dieser Fälle. Kriterien zur Diagnose des intravaskulären großzelligen B-Zell-Lymphoms Intravaskuläre Proliferation großer atypischer Lymphozyten CD20+, Bcl-2+, MUM-1+ 3 Leukämien der Haut Spezifische Hautmanifestationen sind durch histopathologisch nachweisbaren Infiltrate von Leukämiezellen charakterisiert und werden als Leukemia cutis bezeichnet. Sie sind im Rahmen der verschiedenen Leukämieformen relativ selten und treten in der Regel erst im Verlauf der bereits klinisch und hämatologisch festgestellten Leukämie auf. Hautläsionen können aber auch gleichzeitig mit den ersten Veränderungen im Blut und Knochenmark aufgedeckt werden. Es werden seltene Fälle beobachtet, bei denen die Hautveränderungen anscheinend das Primärsymptom der Erkrankung darstellen und den ersten Hinweis auf die Diagnose einer Leukämie geben. Die definitive Zuordnung zu einer distinkten Leukämieform beruht auf der immunhistochemischen Charakterisierung der Tumorzellen an der Knochenmarkbiopsie und/oder an zirkulierenden Tumorzellen im Blut mittels FACS-Analyse und der Bestimmung genetischer Aberrationen. Bei den lymphatischen Leukämien werden spezifische Infiltrate vor allem bei Patienten mit chronischer lymphatischer Leukämie, B-Zell-Typ (B-CLL) beobachtet. Spezifische Hautmanifestationen bei der akuten lymphoblastischen Leukämie, der T-Zell-chronischen lymphatischen Leukämie (T-CLL), Prolymphozytenleukämie und Haarzell-Leukämie sind dagegen selten. In der Gruppe der myeloischen Leukämien werden spezifische Hautinfiltrate am häufigsten bei der akuten Monozytenleukämie (akute myeloische Leukämie (AML) M4 und M5 der French-American-British (FAB)-Klassifikation) mit einer Häufigkeit von % beobachtet. Seltener kommen spezifische Hautmanifestationen bei der akuten Seite 41 von 57
42 myeloischen Leukämie der FAB-Subtypen M0, M1, M2 und M3 und bei der chronischen myeloischen Leukämie (CML) vor. Spezifische Hautmanifestationen bei myeloischer Leukämie sind in der Regel ein Hinweis auf eine schlechte Prognose und kurze Überlebenszeit. Bei der B-CLL d urfte jedoch kein Zusammenhang zwischen dem Auftreten von Hautinfiltraten und der Prognose bestehen. Bei Leukämiepatienten können leukämische Zellen auch bei verschiedenen neoplastischen oder entz undlichen Hauterkrankungen (z. B. Sweet-Syndrom, vegetierender Herpes simplex, Borrelien- Infektionen, Plattenepithelkarzinom) oder an traumatisierten Stellen beobachtet werden. Es wird angenommen, dass dieses Phänomen eine Kolonisation von zirkulierenden malignen Zellen in diese Hautareale darstellt. 3.1 Spezifische Hautinfiltrate bei lymphoblastischer Leukämie ICD-O: 9728/3 Definition und klinisches Bild Die lymphoblastische Leukämie (LBL) ist eine systemische hämatologische Erkrankung, welche durch die Proliferation von B- oder T-Lymphoblasten charakterisiert ist. Spezifische Hautbeteiligung ist eher selten. Besonders bei Kindern werden allerdings manchmal spezifische Infiltrate bei lymphoblastischen Lymphomen am Capillitium beobachtet. Es finden sich solitäre oder multiple, unterschiedlich große, gelegentlich auch ulzerierte rotbraune Tumoren. Die Hautveränderungen können im Verlauf, manchmal jedoch auch vor Stellung der Diagnose der hämatologischen Erkrankung auftreten. Histologie Die spezifischen histopathologischen Hautveränderungen bei T- und B-lymphoblastischer Leukämie (T-LBL, B-LBL) sind im Wesentlichen identisch: Man beobachtet meist ein dichtes, diffuses, monomorphes Infiltrat, bestehend aus Lymphoblasten in der gesamten Dermis und im subkutanen Fett. Manchmal liegt ein sternhimmelartiges ( starry sky ) Muster vor (Abb. 40a). Typisch ist eine mosaik- bzw. pflasterstein-artige Anordnung der Tumorzellen (Abb. 40b). Zytomorphologisch dominieren mittelgroße lymphoide Zellen mit runden oder eckigen, nicht selten jedoch auch unregelmäßigen, gekerbten Kernen, unauffälligen Nukleoli und wenig Zytoplasma. Vereinzelt findet man auch Makrophagen mit Kerntr ummern. Abb. 40 a, b B-lymphoblastische Leukämie. a Beachte das starry sky -Muster, b Pflasterstein-artige Proliferation von Blasten Seite 42 von 57
43 Immunohistochemie Bei der B-LBL findet sich eine Positivität mit CD79a und TdT, CD10, CD34 und PAX-5. CD20 wird nicht immer exprimiert. Die T-LBL weist eine Positivität bei Anwendung von CD1a, CD3, CD43 und TdTauf, sowie häufig auf CD34. Es zeigen sowohl die B-LBL, als auch die T-LBL eine Expression von CD99 und bcl-2. Molekulargenetische Analysen von T-Zell-Rezeptor-Genen und Immunglobulin-Schwerketten-Genen (JH) sind hilfreich bei der Diagnosebestätigung und zeigen die monoklonale Neuordnung von JH-Genen und T-Zell-Rezeptor-Gamma-Genen. Histopathologische und immunhistologische Kriterien spezifischer Hautinfiltrate bei lymphoblastischer Leukämie Dichtes, diffuses, monomorphes Infiltrat von Lymphoblasten in der gesamten Dermis und im subkutanen Fett Sternhimmelartiges ( starry sky ) oder Pflasterstein-artiges Muster Typische mosaikartige Anordnung der Lymphoblasten Überwiegend mittelgroße, lymphoide Zellen mit runden, eckigen oder pleomorphen Kernen, unauffälligen Nukleoli und wenig Zytoplasma; vereinzelt Makrophagen mit Kerntr ummern B-LBL: Positiv f ur CD20 und/oder CD79a, TdT; CD10 und PAX-5 T-LBL: Positiv f ur TdT, CD1a, CD3, CD7, CD43 und CD34 Differenzialdiagnosen Die Differenzialdiagnose betrifft die myelomonozytäre Leukämie mit Proliferation unreifer Granulozyten und Monozyten (Leder-Färbung positiv), das Mantelzell-Lymphom (sig+, CD5+, Zyklin D1+), das Merkelzell-Karzinom (primär kutanes neuroendokrines Karzinom; Zytokeratin 20+, Neurofilament +), Hautmetastasen (kleinzelliges Bronchuskarzinom), das Rhabdomyosarkom und das Ewing-Sarkom. 3.2 Spezifische Hautinfiltrate bei chronischer lymphatischer Leukämie, B-Zell-Typ ICD-O: 9823/3 Definition und klinisches Bild Die chronische lymphatische Leukämie, B-Zell-Typ (B-CLL), ist die häufigste Leukämie des Erwachsenenalters in westlichen Ländern (Inzidenz: 3 5 Neuerkrankungen/ Erwachsene pro Jahr). Fast alle Betroffenen sind uber 50 Jahre alt, wobei Männer doppelt so häufig wie Frauen diese Erkrankung aufweisen. Bei Patienten mit B-CLL treten spezifische Hautinfiltrate in der Regel erst im Verlauf der bereits klinisch und hämatologisch festgestellten Leukämie auf. Zum Zeitpunkt des ersten Auftretens weisen die meisten Patienten ein leukämisches Blutbild (Lymphozytose > / l) und/oder Infiltration des Knochenmarks durch Lymphozyten (>30 %) auf. Die spezifischen Hautläsionen präsentieren sich als einzelne, lokalisierte oder disseminierte, rote bis braune Papeln, Plaques und Knoten. Auch eine Erythrodermie kann auftreten. In einzelnen Fällen werden aufeinanderfolgende Episoden von spezifischen Hautmanifestationen beobachtet. Ein weiteres typisches Erscheinungsbild ist die Lokalisation spezifischer Infiltrate im Bereich abgeheilter Herpes zoster- und Herpes simplex-läsionen. Spezifische Infiltrate einer B-CLL können auch auf der typischen Stelle eines Lymphozytoms (Areola mammae, Ohrläppchen) in Assoziation mit einer Borrelia burgdorferi Infektion auftreten. Seite 43 von 57
44 Abb. 41 a, b Chronische lymphatische Leukämie, B-Zell-Typ. a Diffuses dermales Infiltrat b aus kleinen Lymphozyten mit hyperchromatischen Kernen, mit Koexpression von CD20 und CD5 (Inset) (Immunhistochemie DAB) Histologie Spezifische Hautmanifestationen einer B-CLL sind meist durch dichte dermale, bis in die Subkutis reichende Infiltrate mit einem uberwiegend perivaskulären bzw. periadnexiellen, diffusen bzw. knotigem Muster charakterisiert (Abb. 41). In der Regel wird eine Infiltration der Subkutis beobachtet, weniger häufig findet man auch epidermale Veränderungen wie Exozytose von vereinzelten Lymphozyten, Spongiose, Blasenbildung und Ulzerationen. Nicht selten beobachtet man eine auffällige Beteiligung der Adnexstrukturen und der Nerven. Zytomorphologisch (Abb. 41) entsprechen die neoplastischen Zellen uberwiegend kleinen bis mittelgroßen, runden Lymphozyten mit einem hyperchromatischen Kern und spärlichem Zytoplasma. Vereinzelt können auch Zellen mit unregelmäßigen Kernen und Mitosen beobachtet werden. Gelegentlich weisen die Infiltrate Proliferationszentren mit Paraimmunoblasten und Prolymphozyten auf, die von kleinen B-Lymphozyten umgeben sind. Unterschiedlich häufig kommen auch eosinophile und neutrophile Granulozyten, Plasmazellen, Histiozyten, Riesenzellen und Mastzellen vor. Hautinfiltrate bei B-CLL zeigen manchmal histopathologische Merkmale einer großzelligen Transformation (Richter-Syndrom). Es finden sich dichte, diffuse Ansammlungen von monomorphen, großen Zentroblasten- und Immunoblasten-ähnlichen leukämischen Zellen. Die Blasten des Richter-Syndroms können zum gleichen Klon der B-CLL (großzellige Transformation) oder zu einem anderen, unterschiedlichen Klon gehören (sog. Zweitlymphom). Immunhistologie Besonders hilfreich zur Diagnosebestätigung einer B-CLL sind immunhistochemische Methoden. Man findet neoplastische B-Lymphozyten mit Koexpression von CD20+/CD43+ und oftmals einer Expression von CD5 und CD23. In einer kleinen Zahl der Fälle kann eine Immunglobulin- Leichtketten-Restriktion (Kappa- oder Lambda-Positivität) beobachtet werden. Proliferationsmarker (MIB1) sind in 5 80 % der neoplastischen B-Lymphozyten positiv. Die Färbung auf ZAP-70 erlaubt die Differenzierung zwischen nicht mutierten (positiv; schlechtere Prognose) und mutierten Fälle (negativ; bessere Prognose) zu etablieren. Seite 44 von 57
45 Histopathologische und immunhistologische Kriterien spezifischer Hautinfiltrate bei B-CLL Diffuses knotiges Muster, perivaskuläre/periadnexielle Infiltrate Subkutis fast immer betroffen Überwiegend kleine bis mittelgroße runde Lymphozyten mit hyperchromatischen Kernen und spärlichem Zytoplasma; manchmal vereinzelt mittelgroße atypische Zellen Selten große, Zentroblasten- und Immunoblasten-ähnliche Zellen entsprechend großzelliger Transformation (Richter-Syndrom) Positiv: CD20, CD23, CD43 und CD5; ZAP-70-Expression je nach Mutationsstatus Differenzialdiagnosen Spezifische Hautinfiltrate einer B-CLL weisen meistens charakteristische histopathologische und immunhistochemische Merkmale auf. Die Läsionen m ussen von einer Anzahl entz undlicher und neoplastischer Hautveränderungen unterschieden werden. Die wichtigsten Differenzialdiagnosen betreffen die lymphocytic infiltration (Jessner-Kanof), den Lupus erythematodes tumidus, das gyrierte Erythem vom tiefen Typ sowie B-Zell-Lymphome und B-Zell-Pseudolymphome. Probleme gibt es manchmal bei der Abgrenzung von spezifischen Hautinfiltraten mit einer großen Anzahl von reaktiven Zellen gegen uber unspezifischen, inflammatorischen Hauterkrankungen bei Patienten mit B-CLL. In einzelnen Fällen kann eine endg ultige Diagnose nur durch molekularbiologische Untersuchungen gestellt werden. 3.3 Spezifische Hautinfiltrate bei myeloischen Leukämien ICD-O: 9860/3 Definition und klinisches Bild Verschiedene FAB-Subtypen der akuten myeloischen Leukämie (AML) und chronischen myeloischen Leukämie (CML) weisen spezifische Hautmanifestationen mit ähnlichen klinischen Merkmalen auf. Spezifische Hautinfiltrate präsentieren sich meistens als einzelne, lokalisierte oder disseminierte, braun-rötliche bis bläuliche Papeln, Plaques und Knoten, oder auch als makulopapulöses Exanthem, welches ein Arzneimittelexanthem oder andere inflammatorische Dermatosen imitiert. Häufig findet man Ekchymosen und Purpura. Bei der AML kann die Zeitspanne zwischen der Diagnose der systemischen hämatologischen Erkrankung und dem Auftreten von spezifischen Hautveränderungen von wenigen Wochen bis zu einigen Monaten variieren. Manchmal können die spezifischen Hautinfiltrate den hämatologischen Veränderungen im peripheren Blut und Knochenmark um einige Monate vorausgehen (aleukämische leukaemia cutis ). Bei CML können spezifische Hautmanifestationen vor oder gleichzeitig mit der Entwicklung eines Blastenschubes auftreten, oder sie werden im Rahmen des Endstadiums beobachtet. Selten kommt es bei Patienten mit AML und CML zur Tumorbildung mit Infiltration der Dermis, Subkutis oder von tieferem Gewebe. Klinisch findet man kutan-subkutane Tumoren, die als granulozytisches Sarkom (Chlorom, Myelosarkom) bezeichnet werden. Besonders bei Patienten mit AML-FAB M4 und M5, findet sich manchmal neben den Hautveränderungen auch eine Beteiligung der Mundschleimhaut oder der Orbita. Histologie Spezifische Hautinfiltrate bei myeloischen Leukämien sind vor allem durch ein mäßig dichtes, diffuses oder knotiges Infiltrat in der Dermis charakterisiert (Abb. 42). Häufig findet man eine Mitbeteiligung der Subkutis, oft mit leukämischen Zellen zwischen den Adipozyten. Sehr charakteris- Seite 45 von 57
46 Abb. 42 a, b Akute myeloische Leukämie. a Infiltrate in der Dermis bis in die Subkutis reichend, b mit unreifen Zellen der granulozytären Reihe Abb. 43 Monozytenleukämie mit figurate pattern tisch ist ein reihenweises Vordringen der Zellen zwischen den Kollagenfasern. In manchen Fällen, besonders bei Monozytenleukämie (AML-FAB M4 und M5) wird ein charakteristisches Muster, das aus konzentrischen oder reihenförmigen Schichten von myeloischen Zellen rund um Blutgefäße, adnexielle Strukturen oder zwischen den Kollagenfasern besteht ( figurate pattern ), beobachtet (Abb. 43). Gelegentlich zeigt sich ein Infiltratmuster, welches eine entz undliche Dermatose imitiert. Zytomorphologisch zeigen M1- und M2-Leukämien meistens mittelgroße oder große, mononukleäre Zellen mit blassem Zytoplasma und großen, leicht exzentrischen, basophilen Zellkernen (atypische Myeloblasten und Myelozyten). Bei M4- und M5-Leukämien stehen hingegen meistens mittelgroße, runde bis ovale, mononukleäre Zellen mit leicht eosinophilem Zytoplasma und deutlichen, manchmal gekerbten, bilobulären oder nierenförmigen, basophilen Zellkernen (atypische Monozyten) im Vordergrund. Die chronische myeloische Leukämie zeigt ein Infiltrat aus neoplastischen leukämischen Zellen aller Reifungsstadien der granulozytären Reihe (Myelozyten, Metamyelozyten, eosinophile Metamyelozyten Seite 46 von 57
47 Abb. 44 Akute myeloische Leukämie. Die neoplastischen Zellen (Promyelozyten, Myelozyten) zeigen eine Reaktivität f ur Myeloperoxidase (Immunhistochemie DAB) und segmentierte neutrophile Granulozyten). Manchmal uberwiegen Blasten oder mittelgroße, runde, mononukleäre, atypische Zellen der granulozytären Reihe. Im Rahmen des granulozytischen Sarkoms findet man vor allem in der Dermis und der Subkutis ein knotiges Infiltrat, das aus mittelgroßen bis großen, pleomorphen Zellen der granulozytären Reihe und Blasten (Myelozyten und Myeloblasten) besteht. Charakteristisch ist in den meisten Fällen das Vorliegen von eosinophilen Myelozyten. Spezifische Hautinfiltrate myeloischer Leukämien zeigen oft eine variable Anzahl von Mitosen und apoptotischen Zellen. In manchen Fällen finden sich auch reaktive Zellen (z. B. kleine Lymphozyten, Mastzellen). Gelegentlich werden die Tumorzell-Infiltrate von Ansammlungen plasmazytoider dendritischer Zellen begleitet, welche von Infiltraten der blastären Neoplasie plasmazytoider dendritischer Zellen abgegrenzt werden m ussen. Immunhistologie Histochemisch findet man eine positive Reaktion bei Anwendung der Naphtol -AS-D- Chloracetatesterase-Färbung (Leder-Färbung) in uber 50 % der Fälle von AML und bei bis zu 80 % der Fälle von CML. Spezifische Infiltrate myeloischer Leukämien können meist bei Verwendung verschiedener Antikörpern auf formalinfixiertem, paraffineingebetteten Gewebeschnitten diagnostiziert werden. Die Unterteilung der myeloischen Leukämien in der Haut in ihre verschiedenen Subtypen mittels histochemischer und immunhistochemischer Merkmale ist nur sehr begrenzt möglich. Immunhistologische Analysen ergeben häufig eine starke Positivität mit Lysozym, Myeloperoxidase (MPO) und CD68 (Abb. 44). Eine variable Positivität findet man mit CD11c, CD13, CD15, und CD33. Der Marker f ur das neuronale Zelladhäsionsmolek ul (NCAM, CD56) kann in einigen Fällen positiv sein, sowie die Färbung auf plasmazytoide dendritische Zellen (CD123). Es findet sich eine Positivität bei Anwendung von MIB1 (Ki67; % von neoplastischen Zellen). CD34, CD20 und CD3 sind meistens negativ. Die Tumorzellen können zudem eine Expression von CD1a und S-100 aufweisen. Seite 47 von 57
48 Histopathologische und immunhistologische Kriterien spezifischer Hautinfiltrate bei myeloischen Leukämien Diffuses oder knotiges, häufig bis in die Subkutis reichendes Infiltrat in der Dermis Vor allem bei Monozytenleukämien konzentrische oder reihenweise Schichtung neoplastischer Zellen rund um Blutgefäße bzw. adnexielle Strukturen und zwischen den Kollagenfasern ( figurate pattern ) Bei AML und myelodysplastischem Syndrom uberwiegend mittelgroße oder große, mononukleäre, atypische Myeloblasten und Myelozyten; bei CML meistens ein Infiltrat aus Myelozyten, Metamyelozyten, eosinophilen Metamyelozyten und segmentierten neutrophilen Granulozyten; bei granulozytischem Sarkom mittelgroße bis große Myelozyten und Myeloblasten mit vereinzelten eosinophilen Myelozyten Positive Reaktion mit Naphtol-AS-D-Chloracetatesterase, Lysozym, Myeloperoxidase und CD68, gelegentliche Expression von CD11c, CD13, CD15, CD33, CD56 und CD123 Differenzialdiagnosen Die Abgrenzung von entz undlichen Hautveränderungen und Lymphomen kann extrem schwierig sein, insbesondere wenn die myeloische Leukämie nicht bekannt ist. Das granulozytische Sarkom wird oft als malignes Lymphom fehlinterpretiert. Die Abgrenzung von der blastären Neoplasie plasmazytoider dendritischer Zellen erfolgt anhand des immunhistochemischen Profils, kann aber in einigen Fälle nicht eindeutig sein. Fehlinterpretationen der immunhistologischen Befunde beruhen hauptsächlich bei fehlender Expression konventioneller myeloischer Marker. In diesen Fällen können eine sorgfältige klinisch-pathologische Korrelation und die Anwendung zusätzlicher diagnostischer Techniken (Elektronenmikroskopie, Molekularbiologie) zu einer genauen Abklärung der Herkunft der Zellen f uhren. Spezifische Hautinfiltrate einer CML m ussen von viralen und bakteriellen Infektionen, von einer Vaskulitis, vom Sweet-Syndrom sowie von der extramedullärer Hämatopoese unterschieden werden. Es ist anzumerken, dass leukämische Zellen häufig bei Patienten mit myeloischer Leukämie-assoziiertem Sweet-Syndrom im Hautinfiltrat gefunden werden können. 3.4 Blastäre Neoplasie plasmazytoider dendritischer Zellen ICD-O: 9727/3 Definition und klinisches Bild Die blastäre Neoplasie plasmazytoider dendritischer Zellen (blastic plasmacytoid dendritic cell neoplasia, BPDZN) ist eine seltene Erkrankung und stellt eine neoplastische Proliferation plasmazytoider dendritischer Zellen dar, die in fr uheren Klassifikationen als blastisches NK-Zell-Lymphom bzw. agranuläre CD4/CD56-positive hämatodermische Neoplasie bezeichnet wurde. Die Erkrankung kann sich in jeder Altersgruppe entwickeln und zeigt in einigen Fällen eine Koinzidenz mit einem myelodysplastischen Syndrom. Die BPDZN manifestiert sich oftmals initial an der Haut, wobei eine leukämische Aussaat bei 70 % der Patienten auftritt. Typischerweise finden sich rasch entwickelnde Plaques oder Knoten mit bräunlich-kontusiformem Aspekt am gesamten Integument und Seite 48 von 57
49 Abb. 45 a-c Blastäre Neoplasie plasmazytoider dendritischer Zellen: a Dichte diffuse dermale Infiltrate und intratumorale Erythrozyten-Extravasate, b blastäre Tumorzellen mit feindispersem Chromatin; c charakteristische Expression von CD4, CD56, CD123 und TCL-1 durch die Tumorzellen (Immunhistochemie DAB) Seite 49 von 57
50 der Mundschleimhaut. Die Erkrankung zeigt einen sehr aggressiven Verlauf mit einer mittleren Überlebenszeit von weniger als 2 Jahren. Histologie Von der Epidermis durch eine Grenzzone abgesetzt finden sich diffuse dermale Infiltrate meist mittelgroßer blastärer Zellen mit feindispersem Chromatin und einem kaum abgrenzbaren Zytoplasmasaum (Abb. 45a, b). Intratumorale Erythrozyten-Extravasate sind ein charakteristisches Merkmal. Bei initialem Befall finden sich perivaskuläre Infiltrate im oberen und mittleren Korium, bei welchen die Tumorzellen einzeln oder in kleinen Gruppen vorliegen und kleine Lymphozyten beigemengt sind. Immunhistologie und Genotypisierung Die Tumorzellen sind durch eine Expression von CD4, CD56 und CD123 sowie weitere Marker plasmazytoider dendritischer Zellen wie CD2AP, BDCA-2, BCL11a charakterisiert (Abb. 45c), zeigen jedoch keine Expression von T- oder B-Zell-Markern. Inkomplette Phänotypen und eine Expression von CD3 sind jedoch beschrieben worden. Im Gegensatz zur akuten myeloischen Leukämie zeigt die BPDZN eine Expression von TCL-1. Es lässt sich kein klonales Rearrangement von TCR- oder IgH-Genen nachweisen, da es sich nicht um eine Neoplasie von Lymphozyten handelt. Genetische Analysen ergaben eine häufige Deletion in der Region 9p21.3 (CDKN2A/ CDKN2B). Ein biallelischer Verlust des Locus 9p21.3 geht mit einer k urzeren Überlebenszeit einher. Histopathologische Merkmale der blastischen Neoplasie plasmazytoider dendritischer Zellen Diffuse dermale Infiltrate meist mittelgroßer blastärer Zellen Blastäre Tumorzellen mit feindispersem Chromatin Intratumorale Erythrozyten-Extravasate Expression von CD4, CD56, CD123 und variable Expression von TdT. Expression von TCL-1 und BDCA-2 Differenzialdiagnose Die akute myeloische Leukämie (AML) zeigt analoge histologische Befunde wie die BPDZN, wobei die Tumorzellen bei der AML eine Expression myelomonozytärer Marker (u. a. CD33, CD68, Myeloperoxidase) aufweisen. Im Gegensatz zur AML exprimieren die Tumorzellen bei der BPDZN TCL-1. Ansammlungen reaktiver PDZ können im Rahmen einer akuten myeloischen Leukämie auftreten, wobei die Kombination aus leukämischem Infiltrat und beigemengten PDZ in den immunhistochemischen Färbungen verdeutlicht wird. Auch Infiltrate von diffusen großzelligen B-Zell-Lymphomen, blastäre Infiltrate des Mantelzell-Lymphoms und das Merkelzell-Karzinom sowie andere neuroendokrine Karzinome können immunhistochemisch durch die Expression von B-Zell-Markern, Zyklin D1 bzw. neuroendokriner Marker (Chromogranin, Synaptophysin) von der BPDZN abgegrenzt werden. 3.5 Kutane extramedulläre Hämatopoese Definition und klinisches Bild Die kutane extramedulläre Hämatopoese wird durch das Vorhandensein von hämatopoetischen Zellen in der Haut definiert. Die kutane extramedulläre Hämatopoese kann im Rahmen verschiedener systemischer Erkrankungen als Ausdruck einer kompensatorischen Hämatopoese auftreten; z. B. bei Neugeborenen nach intrauterinen Virusinfektionen, hereditärer Sphärozytose und bei Erwachsenen im Rahmen eines myelodysplastischen Syndroms. Des weiteren wurde selten auch ein lokalisierter Typ von kutaner extramedullärer Hämatopoese bei verschiedenen Hauttumoren beobachtet, wie beispielsweise bei älteren Pilomatrixomen. Seite 50 von 57
51 Abb. 46 Kutane extramedulläre Hämatopoese. Myeloische Zellen, Erythroblasten und Megakaryozyten gelangen zur Ansicht Bei Neugeborenen findet sich die kutane extramedulläre Hämatopoese meistens in Form generalisierter purpurischer bis bläulich makulo-papulöser Effloreszenzen (sogenannte blueberry-muffin babies), die nach intrauterinen Infektionen, wie z. B. der TORCH-Gruppe (Toxoplasmose, Röteln, Zytomegalie und Herpes simplex), auftreten. Bei Erwachsenen mit myelodysplastischem Syndrom ist die kutane extramedulläre Hämatopoese durch bläuliche Flecken, Papeln und Plaques gekennzeichnet. Histologie Histologisch ist die kutane extramedulläre Hämatopoese durch das Vorliegen von Infiltraten in der Dermis oder Subkutis charakterisiert, die aus unreifen und reifen hämatopoetischen Zellen der granulozytären, megakaryozytären und erythropoetischen Reihe bestehen. Die myeloischen Zellen weisen meistens einen vesikulären Zellkern und manchmal ein granuläres Zytoplasma auf (Myeloblasten, Promyelozyten, Myelozyten, Metamyelozyten), es können jedoch auch einige polymorphkernige Leukozyten vorkommen. Megakaryozyten sind relativ große, irreguläre Zellen, die durch einen großen, eingebuchteten und gelappten, hyperchromatischen Kern gekennzeichnet sind. F ur Erythroblasten ist ein dunkler, hyperchromatischer Kern und ein Hämoglobin-haltiges, eosinophies Zytoplasma charakteristisch (Abb. 46). Immunhistologie Immunhistochemische Marker können zur Bestätigung des Vorliegens individueller Zelllinien der extramedullären Hämatopoese verwendet werden, jedoch kann bei unreifen Zellen die spezifische Färbung negativ sein. Hämatopoetische Zellen der myeloischen Reihe sind positiv auf Lysozym, Chloracetatesterase, Myeloperoxidase und Elastase; Megakaryozyten exprimieren Faktor VIII; Erythroblasten weisen oft eine Positivität f ur Glykophorin A auf. Histopathologische und immunhistologische Kriterien der kutanen extramedullären Hämatopoese Meist diffuses, manchmal bis in die Subkutis reichendes Infiltrat in der Dermis mit unreifen und reifen hämatopoetischen Zellen der granulozytären, megakaryozytären und erythropoetischen Reihe Myeloische Reihe positiv: Lysozym, Chloracetatesterase, Myeloperoxidase und Elastase; Megakaryozyten Faktor VIII positiv, Erythroblasten Glykophorin A positiv Seite 51 von 57
Lymphomen. Bernhard Opitz Zytologiekurs KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE)
 Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Martin Kessler. Dipl. ECVIM-CA (Onc) FTA für Kleintiere
 Das kutane Lymphomerkennen und therapieren Martin Kessler Dipl. ECVIM-CA (Onc) FTA für Kleintiere Kutanes Lymphom Epidermotrope und nicht-epidermotrope Formen Epidermotropes Lymphom: Infiltration mit neoplastischen
Das kutane Lymphomerkennen und therapieren Martin Kessler Dipl. ECVIM-CA (Onc) FTA für Kleintiere Kutanes Lymphom Epidermotrope und nicht-epidermotrope Formen Epidermotropes Lymphom: Infiltration mit neoplastischen
Zytologie der Malignen Lymphome
 Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Martha-Maria-Abend. Hodgkin-Lymphome- Histologische Befunde und. Antje Hölsken. Buchmann Institut für Pathologie
 Hodgkin-Lymphome- Histologische Befunde und Klassifizierung i Antje Hölsken. Buchmann Institut für Pathologie Martha-Maria-Abend Krankenhaus Martha-Maria M Halle-Dölau Hodgkin-Lymphom Thomas Hodgkin,1832:
Hodgkin-Lymphome- Histologische Befunde und Klassifizierung i Antje Hölsken. Buchmann Institut für Pathologie Martha-Maria-Abend Krankenhaus Martha-Maria M Halle-Dölau Hodgkin-Lymphom Thomas Hodgkin,1832:
Klassifikation, Diagnose und Therapieoptionen
 DFP-Literaturstudium: Primär kutane Lymphome Klassifikation, Diagnose und Therapieoptionen Bei primär kutanen Lymphomen (kl) handelt es sich um eine heterogene Gruppe von Non-Hodgkin-Lymphomen mit definitionsgemäß
DFP-Literaturstudium: Primär kutane Lymphome Klassifikation, Diagnose und Therapieoptionen Bei primär kutanen Lymphomen (kl) handelt es sich um eine heterogene Gruppe von Non-Hodgkin-Lymphomen mit definitionsgemäß
47. Warthin-Tumor. Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504
 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 505 47.
47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 504 47. Warthin-Tumor Universitätsklinikum Leipzig AöR (2015): Histopathologischer Kurs, I. Sändig 505 47.
5.4 Lymphknotenzytologie
 Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Zytologie von Körperhöhlenergüssen, Liquor und Lymphknoten 5.4 Lymphknotenzytologie 5.4.1 Benigne Veränderungen Tastbare Schwellungen am Hals, supraklavikulär, axillär oder inguinal entsprechen häufig
Hautlymphome. Zurich Open Repository and Archive University of Zurich Main Library Strickhofstrasse 39 CH-8057 Zurich
 Zurich Open Repository and Archive University of Zurich Main Library Strickhofstrasse 39 CH-8057 Zurich www.zora.uzh.ch Year: 2013 Hautlymphome Stieger, Pascale; Cozzio, Antonio Posted at the Zurich Open
Zurich Open Repository and Archive University of Zurich Main Library Strickhofstrasse 39 CH-8057 Zurich www.zora.uzh.ch Year: 2013 Hautlymphome Stieger, Pascale; Cozzio, Antonio Posted at the Zurich Open
Mikroskopischer Kurs Allgemeine Pathologie 3. Chronische Entzündungen. Lernziele / Agenda: Was ist heute für sie /euch drin?
 Mikroskopischer Kurs Allgemeine Pathologie 3 Chronische Entzündungen Jena, 15.12.2015 PD Dr. med. Bernd F.M. Romeike Lernziele / Agenda: Was ist heute für sie /euch drin? Arten chronischer Entzündungen
Mikroskopischer Kurs Allgemeine Pathologie 3 Chronische Entzündungen Jena, 15.12.2015 PD Dr. med. Bernd F.M. Romeike Lernziele / Agenda: Was ist heute für sie /euch drin? Arten chronischer Entzündungen
Minireview. Zusammenfassung. Summary. Werner Kempf 1, Christina Mitteldorf 2, Laszlo J. Karai 3, Alistair Robson 4
 Minireview Eingereicht: 23.11.2016 Angenommen: 9.1.2017 Interessenkonflikt Keiner. DOI: 10.1111/ddg.13207 English online version on Wiley Online Library Die histologischen Typen der lymphomatoiden Papulose
Minireview Eingereicht: 23.11.2016 Angenommen: 9.1.2017 Interessenkonflikt Keiner. DOI: 10.1111/ddg.13207 English online version on Wiley Online Library Die histologischen Typen der lymphomatoiden Papulose
Porcines Dermatitis Nephropathie Syndrom. Postweaning Multisystemic Wasting Disease
 Porcines Dermatitis Nephropathie Syndrom PDNS Postweaning Multisystemic Wasting Disease PMWS Ätiologie (1): - derzeitig wird eine Reihe von Krankheitsbildern mit dem Porcinen Circovirus-2 assoziiert -
Porcines Dermatitis Nephropathie Syndrom PDNS Postweaning Multisystemic Wasting Disease PMWS Ätiologie (1): - derzeitig wird eine Reihe von Krankheitsbildern mit dem Porcinen Circovirus-2 assoziiert -
Klinische Angaben. Lehrserie Nr. 191
 INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 191 Klinik und Morphologie entzündlicher Hauterkrankungen
INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 191 Klinik und Morphologie entzündlicher Hauterkrankungen
Gießener Kleintierabend Lymphknotenzytologie
 Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome
 3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
Klinische Angaben. Lehrserie Nr. 322
 INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 322 Spektrum lymphatischer Infiltrate in der Haut
INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 322 Spektrum lymphatischer Infiltrate in der Haut
Eosinophilie. Zytologie. Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV
 Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Manifestationsformen von Non-Hodgkin Lymphomen
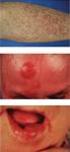 Manifestationsformen von Non-Hodgkin Lymphomen? Lymphknotenarchitektur Leukozytose (> 10 G/l) reife Blutzellen Differentialblutbild atypische Zellen oder Blasten reaktiv (Infektion, Entzündung) autonom
Manifestationsformen von Non-Hodgkin Lymphomen? Lymphknotenarchitektur Leukozytose (> 10 G/l) reife Blutzellen Differentialblutbild atypische Zellen oder Blasten reaktiv (Infektion, Entzündung) autonom
NON-HODGKIN-LYMPHOME (C82-C85)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
Morbus Waldenström. Diagnostische Empfehlung. Methode Antikoagulans Empfehlung. Zytomorphologie EDTA obligat
 1/7 Morbus Waldenström Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin fakultativ FISH
1/7 Morbus Waldenström Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin fakultativ FISH
NON-HODGKIN-LYMPHOME (C82-C85)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
Tumorzentrum Regensburg e.v.
 Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
Fallvorstellung 8. Mai 2007
 Fallvorstellung 8. Mai 2007 67jährige Patientin mit CLL und Fieber 5 Süd Anamnese Aktuelle Anamnese: Aufnahme 13.3.2007 bei Fieber bis 38.8 C, Müdigkeit, Nachtschweiß Bisherige Anamnese: CLL ED 1997 Z.n.
Fallvorstellung 8. Mai 2007 67jährige Patientin mit CLL und Fieber 5 Süd Anamnese Aktuelle Anamnese: Aufnahme 13.3.2007 bei Fieber bis 38.8 C, Müdigkeit, Nachtschweiß Bisherige Anamnese: CLL ED 1997 Z.n.
1.2.5 Kutane Lymphome
 1.2 Maligne Tumoren 1 1.2.5 Kutane Lymphome von Inhalt Einleitung und Klassifikationen 1.2.5.1 Kutane T-Zell-Lymphome (CTCL) Mycosis fungoides (MF)
1.2 Maligne Tumoren 1 1.2.5 Kutane Lymphome von Inhalt Einleitung und Klassifikationen 1.2.5.1 Kutane T-Zell-Lymphome (CTCL) Mycosis fungoides (MF)
Immundefizienz-Virus bei Mensch bzw. Katze. - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und
 HIV- SIV FIV Allgemeines (1): - es muß unterschieden werden zwischen - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und - der Ausbildung eines manifesten Krankheits- Syndroms, das
HIV- SIV FIV Allgemeines (1): - es muß unterschieden werden zwischen - der Infektion mit einem Immundefizienz-Virus (HIV, SIV, FIV, BIF) und - der Ausbildung eines manifesten Krankheits- Syndroms, das
MYELOPROLIFERATIVE NEOPLASIEN
 MYELOPROLIFERATIVE NEOPLASIEN STELLENWERT VON JAK-2 BEI DER DIFFERENZIERUNG K.P. Hellriegel, Berlin 6. Juni 2009 JAK 2 V617F * Definition Erworbene klonale Mutation der Janus-Kinase 2, einer durch die
MYELOPROLIFERATIVE NEOPLASIEN STELLENWERT VON JAK-2 BEI DER DIFFERENZIERUNG K.P. Hellriegel, Berlin 6. Juni 2009 JAK 2 V617F * Definition Erworbene klonale Mutation der Janus-Kinase 2, einer durch die
Entz undliche Dermatosen mit Interface-Dermatitis
 Entz undliche Dermatosen mit Interface-Dermatitis J. Wenzel* Klinik und Poliklinik f ur Dermatologie und Allergologie, Universitätsklinikum Bonn, Bonn, Deutschland Der Begriff Interface-Dermatitis (IFD)
Entz undliche Dermatosen mit Interface-Dermatitis J. Wenzel* Klinik und Poliklinik f ur Dermatologie und Allergologie, Universitätsklinikum Bonn, Bonn, Deutschland Der Begriff Interface-Dermatitis (IFD)
Brustkrebs aktuell - OSP am Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms?
 Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
W. KEMPF M. HANTSCHKE H. KUTZNER W. BURGDORF. Dermatopathologie MIT 242 FARBIGEN ABBILDUNGEN STEINKOPFF DARMSTADT
 W. KEMPF M. HANTSCHKE H. KUTZNER W. BURGDORF Dermatopathologie MIT 242 FARBIGEN ABBILDUNGEN STEINKOPFF DARMSTADT I Grundlagen 1.1 Dermatopathologische Grundbegriffe: Glossar 3 1.2 Die Hautbiopsie 5 1.3
W. KEMPF M. HANTSCHKE H. KUTZNER W. BURGDORF Dermatopathologie MIT 242 FARBIGEN ABBILDUNGEN STEINKOPFF DARMSTADT I Grundlagen 1.1 Dermatopathologische Grundbegriffe: Glossar 3 1.2 Die Hautbiopsie 5 1.3
T-Zell. Prolymphozytenleukämie
 T-Zell Prolymphozytenleukämie Zytologie Histologie Durchflusszytometrie Prof. Dr. med. Dr. phil. T. Haferlach PD. Dr. med. S. Höller Dr. med. M. Herling, Dr. rer. nat. A. Schrader, P. Mayer Klassische
T-Zell Prolymphozytenleukämie Zytologie Histologie Durchflusszytometrie Prof. Dr. med. Dr. phil. T. Haferlach PD. Dr. med. S. Höller Dr. med. M. Herling, Dr. rer. nat. A. Schrader, P. Mayer Klassische
Molekularpathologie der Lymphome
 Molekularpathologie der Lymphome (n= 90, WHO 2016) Programm Allgemeine Lymphompathogenese Das Keimzentrum als gefährlicher Ort Pathogenese des follikulärenlymphoms (FL) Molekulare Hintergründe von FL Progression/
Molekularpathologie der Lymphome (n= 90, WHO 2016) Programm Allgemeine Lymphompathogenese Das Keimzentrum als gefährlicher Ort Pathogenese des follikulärenlymphoms (FL) Molekulare Hintergründe von FL Progression/
Spezielle Pathologie des Atmungstraktes. 13. Teil
 Spezielle Pathologie des Atmungstraktes 13. Teil 7. Staublungen-Erkrankungen Pneumokoniosen Anthrakose Allgemeines (1): - Partikel bleiben je nach ihrer Größe im Atmungstrakt hängen - Nasenhöhle > 5 μm
Spezielle Pathologie des Atmungstraktes 13. Teil 7. Staublungen-Erkrankungen Pneumokoniosen Anthrakose Allgemeines (1): - Partikel bleiben je nach ihrer Größe im Atmungstrakt hängen - Nasenhöhle > 5 μm
Histologie Kurs Spezielle Pathologie für Zahnmediziner. Kurz-Skript. 56 / Fokale fibröse Hyperplasie / Rhagade
 Histologie Kurs Spezielle Pathologie für Zahnmediziner Kurz-Skript PD Bernd F.M. Romeike Institut für Pathologie FSU Jena Siehe auch digitale Mikroskopie unserer Kollegen unter: http://eliph.klinikum.uni-heidelberg.de/archive/664/kurskasten-zahnmediziner
Histologie Kurs Spezielle Pathologie für Zahnmediziner Kurz-Skript PD Bernd F.M. Romeike Institut für Pathologie FSU Jena Siehe auch digitale Mikroskopie unserer Kollegen unter: http://eliph.klinikum.uni-heidelberg.de/archive/664/kurskasten-zahnmediziner
Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen. Betreuer: Prof. Dr. M. Reinacher
 Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. M. Reinacher Untersuchungen zur Klassifikation maligner Lymphome sowie zur differentiellen Expression
Aus dem Institut für Veterinär-Pathologie der Justus-Liebig-Universität Gießen Betreuer: Prof. Dr. M. Reinacher Untersuchungen zur Klassifikation maligner Lymphome sowie zur differentiellen Expression
St.Galler Ophtag. Felicitas Hitz Klinik für Onkologie und Hämatologie
 St.Galler Ophtag Felicitas Hitz Klinik für Onkologie und Hämatologie 31.5.2018 WHO 2017: Lymphoproliferative Erkrankungen Klinik, Morphologie, Immunphänotyp, Genetik Extranodale Lymphome mit Primärmanifestation
St.Galler Ophtag Felicitas Hitz Klinik für Onkologie und Hämatologie 31.5.2018 WHO 2017: Lymphoproliferative Erkrankungen Klinik, Morphologie, Immunphänotyp, Genetik Extranodale Lymphome mit Primärmanifestation
Dr. med. Antonios Kolios. FMH Dermatologie und Venerologie Oberarzt Immunologie
 2017-10-26 1. Interdiziplinäres Sarkoidose-Symposium USZ Zürich Kutane Sarkoidose 140 YEARS OF THE GREAT IMITATOR Dr. med. Antonios Kolios FMH Dermatologie und Venerologie Oberarzt Immunologie Klinik für
2017-10-26 1. Interdiziplinäres Sarkoidose-Symposium USZ Zürich Kutane Sarkoidose 140 YEARS OF THE GREAT IMITATOR Dr. med. Antonios Kolios FMH Dermatologie und Venerologie Oberarzt Immunologie Klinik für
11. Praktikum. Brustpathologie. Semmelweis Universität II. Institut für Pathologie
 11. Praktikum Brustpathologie Semmelweis Universität II. Institut für Pathologie Überblick 1. - Gutartige Läsionen - Puerperale Mastitis - Nicht-puerperale Mastitis (Duktektasie) - Fettnekrose - Fibrozystische
11. Praktikum Brustpathologie Semmelweis Universität II. Institut für Pathologie Überblick 1. - Gutartige Läsionen - Puerperale Mastitis - Nicht-puerperale Mastitis (Duktektasie) - Fettnekrose - Fibrozystische
Einleitung 1. 1 Einleitung
 Einleitung 1 1 Einleitung Das maligne Melanom ist ein bösartiger Tumor des melaninbildenden Systems. Es gehört zu den aggressivsten Tumoren der Haut oder Schleimhaut und neigt zu lymphatischer und/oder
Einleitung 1 1 Einleitung Das maligne Melanom ist ein bösartiger Tumor des melaninbildenden Systems. Es gehört zu den aggressivsten Tumoren der Haut oder Schleimhaut und neigt zu lymphatischer und/oder
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML
 Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Seite: 434. Alphabetisch. Kapitel 14: Präkanzerosen. Bild. Ursachen. Effloreszenzen. Suche Inhalt drucken letzte aufgerufene Seite zurück vorwärts
 Kapitel 14: Präkanzerosen Seite: 434 Präkanzerosen Seite: 435 Keratose; Squama Senile Keratose oder solare Keratose Erhabene, rötliche, scharf begrenzte Plaques mit rauher, schuppiger Oberfläche. Die Schuppen
Kapitel 14: Präkanzerosen Seite: 434 Präkanzerosen Seite: 435 Keratose; Squama Senile Keratose oder solare Keratose Erhabene, rötliche, scharf begrenzte Plaques mit rauher, schuppiger Oberfläche. Die Schuppen
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Heinz Ludwig I.Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Wilhelminenspital
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Heinz Ludwig I.Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Wilhelminenspital
10.2 Klinische Symptomatik
 Aktinische Keratose 29 10.2 Klinische Symptomatik Aktinische Keratosen treten, oft multipel, als raue, hyperkeratotische bzw. schuppende Maculae, Papeln oder Plaques auf. Die Größe variiert von einem Millimeter
Aktinische Keratose 29 10.2 Klinische Symptomatik Aktinische Keratosen treten, oft multipel, als raue, hyperkeratotische bzw. schuppende Maculae, Papeln oder Plaques auf. Die Größe variiert von einem Millimeter
Retrospektive Auswertung von Diagnostik und Therapie kutaner Lymphome
 Retrospektive Auswertung von Diagnostik und Therapie kutaner Lymphome Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Eberhard Karls Universität zu Tübingen
Retrospektive Auswertung von Diagnostik und Therapie kutaner Lymphome Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Eberhard Karls Universität zu Tübingen
Lösungsvorschlag fürs Histotestat. Allgemeine Pathologie
 Lösungsvorschlag fürs Histotestat Allgemeine Pathologie Niere anämischer Niereninfarkt Koagulationsnekrose (Verlust der Zellkerne) Hämorrhagischer/ granulozytärer Randsaum Hypereosinophilie Herzmuskel
Lösungsvorschlag fürs Histotestat Allgemeine Pathologie Niere anämischer Niereninfarkt Koagulationsnekrose (Verlust der Zellkerne) Hämorrhagischer/ granulozytärer Randsaum Hypereosinophilie Herzmuskel
Referat Blut Teil 3: Leukämien
 n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
Mikroskopisches Differentialblutbild
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
3.18 Morbus Hodgkin. Kernaussagen. Inzidenz und Mortalität: Nach der Jahrtausendwende
 132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MORBUS HODGKIN (C81) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MORBUS HODGKIN (C81) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MORBUS HODGKIN (C81) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MORBUS HODGKIN (C81) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
PSORIASIS VULGARIS PSORIASIS VULGARIS PSORIASIS VULGARIS
 PSORIASIS VULGARIS häufig, etwa 2% der Bevölkerung chronisch rezidivierender Verlauf erbliche Veranlagung (HLA-Assoziation) äußere Faktoren als Auslöser (Trigger) PSORIASIS VULGARIS scharf begrenzte Maculae
PSORIASIS VULGARIS häufig, etwa 2% der Bevölkerung chronisch rezidivierender Verlauf erbliche Veranlagung (HLA-Assoziation) äußere Faktoren als Auslöser (Trigger) PSORIASIS VULGARIS scharf begrenzte Maculae
Dr. Barbara Kiesewetter. Medical University Vienna, Clinical Division of Oncology. Potential new agents for MZL Indolent Lymphoma Workshop - Bologna
 Dr. Barbara Kiesewetter Medical University Vienna, Clinical Division of Oncology Potential new agents for MZL Indolent Lymphoma Workshop - Bologna 1 Maligne Lymphome Lymphsystem = Teil des Abwehrsystems
Dr. Barbara Kiesewetter Medical University Vienna, Clinical Division of Oncology Potential new agents for MZL Indolent Lymphoma Workshop - Bologna 1 Maligne Lymphome Lymphsystem = Teil des Abwehrsystems
Entzündung. Teil 24.
 Teil 24 www.patho.vetmed.uni-muenchen.de/matnew.html Entzündungen an Häuten und Schleimhäuten en an Haut / Schleimhaut Einteilung nach Histologie (1): an einschichtigem Epithel Atmungs-, Verdauungs-, Genitaltrakt,
Teil 24 www.patho.vetmed.uni-muenchen.de/matnew.html Entzündungen an Häuten und Schleimhäuten en an Haut / Schleimhaut Einteilung nach Histologie (1): an einschichtigem Epithel Atmungs-, Verdauungs-, Genitaltrakt,
Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II)
 Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II) (Dieses Skript ersetzt auf keinen Fall die Vorlesungen und dient lediglich zur Vorbereitung des Kurses und als Erinnerungshilfe
Kurspräparate Teil Neuropathologie im Kurs Spezielle Pathologie (Pathologie II) (Dieses Skript ersetzt auf keinen Fall die Vorlesungen und dient lediglich zur Vorbereitung des Kurses und als Erinnerungshilfe
Bericht aus Kiel Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel)
 Bericht aus Kiel 2017 Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist geschafft? Kiel ist das führende Zentrum für Diagnostik von Lymphomen bei Kindern. Fast alle Gewebebiopsien von
Bericht aus Kiel 2017 Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist geschafft? Kiel ist das führende Zentrum für Diagnostik von Lymphomen bei Kindern. Fast alle Gewebebiopsien von
Aktueller Stand der morphologischen Beurteilung immunogener Myopathien
 Manuskript Aktueller Stand der morphologischen Beurteilung immunogener Myopathien Dieter Pongratz Friedrich-Baur-Institut der Medizinischen Fakultät an der Neurologischen Klinik und Poliklinik der Ludwig
Manuskript Aktueller Stand der morphologischen Beurteilung immunogener Myopathien Dieter Pongratz Friedrich-Baur-Institut der Medizinischen Fakultät an der Neurologischen Klinik und Poliklinik der Ludwig
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14* 6,5 3,4 Mortalität Saarland 14* 1,6 2 geschätzte Inzidenz
PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14* 6,5 3,4 Mortalität Saarland 14* 1,6 2 geschätzte Inzidenz
Fläche Stratum. Dicke vitale Epi-
 4. Ergebnisse 4.1. Dicke und Fläche der vitalen Epidermis und des Stratum corneum Um das Ausmaß der Verhornung und der Hyperplasie der Epidermis zu ermitteln, wurden in jedem der fünf unterschiedlich gefärbten
4. Ergebnisse 4.1. Dicke und Fläche der vitalen Epidermis und des Stratum corneum Um das Ausmaß der Verhornung und der Hyperplasie der Epidermis zu ermitteln, wurden in jedem der fünf unterschiedlich gefärbten
Entzündung. Teil 18.
 Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Teil 18 www.patho.vetmed.uni-muenchen.de/matnew.html Proliferative Entzündungen: Granulomatöse Entzündung Unterschiede granulierende - granulomatöse Entzündung Mononukleäres Phagozyten System (MPS) Dendritische
Einführung-2 Block Blut und Immunologie Teil Immunologie
 Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
Einführung-2 Block Blut und Immunologie Teil Immunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Folien für diese Seminare finden Sie: www.ruhr-uni-bochum.de/homeexpneu Lehre Modellstudiengang
Herzbiopsie. Katharina Glatz Staffmeeting 19. Januar 2012
 Herzbiopsie Katharina Glatz Staffmeeting 19. Januar 2012 Einsender USB Transplantatbiopsien Selten Eigenherzbiopsien Luzern Myokarditis Unklare Herzinsuffizienz Material Formalin Konventionelle Lichtmikroskopie
Herzbiopsie Katharina Glatz Staffmeeting 19. Januar 2012 Einsender USB Transplantatbiopsien Selten Eigenherzbiopsien Luzern Myokarditis Unklare Herzinsuffizienz Material Formalin Konventionelle Lichtmikroskopie
Aus dem Universitätsklinikum Münster Klinik und Poliklinik für Dermatologie und Venerologie Direktor: Universitätsprofessor Dr. med. T.A.
 Aus dem Universitätsklinikum Münster Klinik und Poliklinik für Dermatologie und Venerologie Direktor: Universitätsprofessor Dr. med. T.A. Luger Die Behandlung kutaner T-Zell-Lymphome unter besonderer Berücksichtigung
Aus dem Universitätsklinikum Münster Klinik und Poliklinik für Dermatologie und Venerologie Direktor: Universitätsprofessor Dr. med. T.A. Luger Die Behandlung kutaner T-Zell-Lymphome unter besonderer Berücksichtigung
Plattenepithelkarzinom
 Hallesches Seminar Klinische Zytologie in der Pneumologie, Grundlagenkurs Teil II Plattenepithelkarzinom 31.Mai 01. Juni 2013, Halle KRANKENHAUS ST. ELISABETH & ST. BARBARA L. Welker Zytologisches Labor
Hallesches Seminar Klinische Zytologie in der Pneumologie, Grundlagenkurs Teil II Plattenepithelkarzinom 31.Mai 01. Juni 2013, Halle KRANKENHAUS ST. ELISABETH & ST. BARBARA L. Welker Zytologisches Labor
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 3,8 7,7 Mortalität Saarland 214,9,6 geschätzte Inzidenz
SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 3,8 7,7 Mortalität Saarland 214,9,6 geschätzte Inzidenz
BRUST. Einführende Bemerkungen. Klassifiziert Erprobungszeitraum
 BRUST Klassifiziert 1972. Erprobungszeitraum 1973-1977 Einführende Bemerkungen 1. Größe: Es ist anerkannt, daß alle Tumoren, die größer als 5 cm im Durchmesser sind, dieselbe Prognose haben. Es erscheint
BRUST Klassifiziert 1972. Erprobungszeitraum 1973-1977 Einführende Bemerkungen 1. Größe: Es ist anerkannt, daß alle Tumoren, die größer als 5 cm im Durchmesser sind, dieselbe Prognose haben. Es erscheint
Werner Kempf Markus Hantschke Heinz Kutzner Walter Burgdorf. Dermatopathologie. 3. Auflage
 Werner Kempf Markus Hantschke Heinz Kutzner Walter Burgdorf Dermatopathologie 3. Auflage Dermatopathologie Werner Kempf Markus Hantschke Heinz Kutzner Walter Burgdorf Dermatopathologie Mit 131 Abbildungen
Werner Kempf Markus Hantschke Heinz Kutzner Walter Burgdorf Dermatopathologie 3. Auflage Dermatopathologie Werner Kempf Markus Hantschke Heinz Kutzner Walter Burgdorf Dermatopathologie Mit 131 Abbildungen
Immunmediierte Hauterkrankungen des Pferdes ein Ausschnitt
 Immunmediierte Hauterkrankungen des Pferdes ein Ausschnitt J.-M. Müller Klinik für Pferde Stiftung Tierärztliche Hochschule Hannover Alopecia areata Sommerekzem Pemphigus foliaceus Bullöses Pemphigoid
Immunmediierte Hauterkrankungen des Pferdes ein Ausschnitt J.-M. Müller Klinik für Pferde Stiftung Tierärztliche Hochschule Hannover Alopecia areata Sommerekzem Pemphigus foliaceus Bullöses Pemphigoid
Lymphome. Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster. November 2011
 Lymphome Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster November 2011 Krebserkrankungen des Kindesalters Leukämien 34.5% Leukämien Andere 3.9% Andere Keimzelltumore 3.1% Keimzelltumoren
Lymphome Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster November 2011 Krebserkrankungen des Kindesalters Leukämien 34.5% Leukämien Andere 3.9% Andere Keimzelltumore 3.1% Keimzelltumoren
Klinische Angaben. Lehrserie Nr. 211
 INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 211 Pathologie der GvHD und transplantationsassoziierter
INTERNATIONALE AKADEMIE FÜR PATHOLOGIE DEUTSCHE ABTEILUNG e.v. INTERNATIONAL ACADEMY OF PATHOLOGY GERMAN DIVISION INC. Klinische Angaben Lehrserie Nr. 211 Pathologie der GvHD und transplantationsassoziierter
3.1 Ergebnisse des endoskopischen Screenings. Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals-
 32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
Welche Informationen finden Sie in Ihrem Befund?
 Welche Informationen finden Sie in Ihrem Befund? Impressum Herausgeberin UniversitätHamburg,MIN-Fakultät,Gesundheitswissenschaften Martin-Luther-King-Platz6 20146Hamburg Internet: www.spupeo.de www.chemie.uni-hamburg.de/igtw/gesundheit/gesundheit.htm
Welche Informationen finden Sie in Ihrem Befund? Impressum Herausgeberin UniversitätHamburg,MIN-Fakultät,Gesundheitswissenschaften Martin-Luther-King-Platz6 20146Hamburg Internet: www.spupeo.de www.chemie.uni-hamburg.de/igtw/gesundheit/gesundheit.htm
Einfluss der Lymphombehandlung auf das Blut. Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern
 Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Merke. Differenzialdiagnose. Maligne Tumoren anderer Entität, benigne Herdbefunde.
 Befunde in der Bildgebung.4 Invasive Tumoren.4.1 Invasiv-duktale Karzinome Das IDC stellt einen im terminalen Milchgang entstandenen, durch die Basalmembran gewachsenen malignen Mammatumor dar, der keine
Befunde in der Bildgebung.4 Invasive Tumoren.4.1 Invasiv-duktale Karzinome Das IDC stellt einen im terminalen Milchgang entstandenen, durch die Basalmembran gewachsenen malignen Mammatumor dar, der keine
Analtumor (1) D01.3 Carcinoma in situ des Analkanals und des Anus (ohne Haut)
 Analtumor (1) Epidemiologie: Das Analkarzinom tritt eher selten auf. Insgesamt erkranken in Deutschland pro Jahr 0,5-1,5 pro 100.000 Einwohner daran, mit steigender Tendenz. Frauen sind etwa dreimal so
Analtumor (1) Epidemiologie: Das Analkarzinom tritt eher selten auf. Insgesamt erkranken in Deutschland pro Jahr 0,5-1,5 pro 100.000 Einwohner daran, mit steigender Tendenz. Frauen sind etwa dreimal so
Betrachtet man den Ausfall der immunhistochemischen Reaktionen für die einzelnen Tumoren, so reagiert ein Teil von ihnen sowohl mit Antikörpern, die
 5 Zusammenfassung Pulmonale Blastome sind seltene Lungentumoren. Das pulmonale Blastom wird in der derzeit gültigen dritten Auflage der WHO-Klassifikation (TRAVIS et al 1999) vom pleuro-pulmonalen Blastom
5 Zusammenfassung Pulmonale Blastome sind seltene Lungentumoren. Das pulmonale Blastom wird in der derzeit gültigen dritten Auflage der WHO-Klassifikation (TRAVIS et al 1999) vom pleuro-pulmonalen Blastom
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 214 12,4 1,3 Mortalität Saarland 214 11, 1,6 geschätzte Inzidenz
PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 214 12,4 1,3 Mortalität Saarland 214 11, 1,6 geschätzte Inzidenz
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
Leistungsverzeichnis. LV_IMMST_erw_CD7_CD26. Immunstatus erweitert (Lymphocytentypisierung incl. CD7/CD26)
 Seite 1 von 6 1. Klinische Indikation Analyt: Immunstatus erweitert (Lymphocytentypisierung incl. CD7/CD26) Auftreten von atypischen oder als aktiviert eingestuften Lymphocyten im peripheren Blut V. a.
Seite 1 von 6 1. Klinische Indikation Analyt: Immunstatus erweitert (Lymphocytentypisierung incl. CD7/CD26) Auftreten von atypischen oder als aktiviert eingestuften Lymphocyten im peripheren Blut V. a.
Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, Dr. M. Engels, Institut für Pathologie
 Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, 03.11.2012 Dr. M. Engels, Institut für Pathologie Adenokarzinom Plattenepithelkarzinom molekulare Subtypen
Zytomorphologie und genetischer Befund beim Lungenkarzinom - gibt es eine Korrelation? Halle, 03.11.2012 Dr. M. Engels, Institut für Pathologie Adenokarzinom Plattenepithelkarzinom molekulare Subtypen
Chronisch lymphatische Leukämie, Morbus Hodgkin und Non-Hodgkin- Lymphome
 MIT - FORUM ONKOLOGIE Chronisch lymphatische Leukämie, Morbus Hodgkin und Non-Hodgkin- Lymphome Dr. Gerhard Hubmann Berlin, 23.9.2012 Hoffbrand, Pettit: Klinische Hämatologie. S.157 RAI Klassifikation
MIT - FORUM ONKOLOGIE Chronisch lymphatische Leukämie, Morbus Hodgkin und Non-Hodgkin- Lymphome Dr. Gerhard Hubmann Berlin, 23.9.2012 Hoffbrand, Pettit: Klinische Hämatologie. S.157 RAI Klassifikation
Therapie und Nachsorge von Patienten mit primär kutanen Lymphomen
 Aus dem CharitéCentrum für Dermatologie und Innere Medizin Klinik für Dermatologie, Venerologie und Allergologie Geschäftsführender Direktor: Prof. Dr. med. Dr. h.c. Torsten Zuberbier Habilitationsschrift
Aus dem CharitéCentrum für Dermatologie und Innere Medizin Klinik für Dermatologie, Venerologie und Allergologie Geschäftsführender Direktor: Prof. Dr. med. Dr. h.c. Torsten Zuberbier Habilitationsschrift
Psoriasiforme entz undliche Dermatosen
 Psoriasiforme entz undliche Dermatosen H. Beltraminelli* und R. Blum Universitätsklinik f ur Dermatologie, Inselspital, Bern University Hospital, University of Bern, Bern, Schweiz 1 Psoriasis Definition
Psoriasiforme entz undliche Dermatosen H. Beltraminelli* und R. Blum Universitätsklinik f ur Dermatologie, Inselspital, Bern University Hospital, University of Bern, Bern, Schweiz 1 Psoriasis Definition
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
12. Gemeinsame Jahrestagung, September, Radebeul. Sächsische Radiologische Gesellschaft,
 12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
HARNBLASE (C67, D09.0, D41.4)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HARNBLASE (C67, D9., D41.4) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HARNBLASE (C67, D9., D41.4) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
Krebs - was kann ich tun?
 Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Fragebogen zur okulären Sarkoidose
 Fragebogen zur okulären Sarkoidose Institut: Name 1. Welches sind die 5 häufigsten klinischen Entitäten in Ihrer Uveitis-Sprechstunde, wie ist der prozentuale Anteil (z.b. HLA-B27 ass. anteriore Uveitis,
Fragebogen zur okulären Sarkoidose Institut: Name 1. Welches sind die 5 häufigsten klinischen Entitäten in Ihrer Uveitis-Sprechstunde, wie ist der prozentuale Anteil (z.b. HLA-B27 ass. anteriore Uveitis,
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Brentuximab Vedotin (ADCETRIS ) Takeda GmbH Modul 3 D Behandlung erwachsener Patienten mit CD30+ kutanem T-Zell-Lymphom
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Brentuximab Vedotin (ADCETRIS ) Takeda GmbH Modul 3 D Behandlung erwachsener Patienten mit CD30+ kutanem T-Zell-Lymphom
W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie
![W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie](/thumbs/64/51142463.jpg) W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf Dermatopathologie W. Kempf M. Hantschke H. Kutzner W. Burgdorf Dermatopathologie Mit 242 farbigen Abbildungen PD Dr. med. Werner Kempf Kempf und Pfaltz
W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf Dermatopathologie W. Kempf M. Hantschke H. Kutzner W. Burgdorf Dermatopathologie Mit 242 farbigen Abbildungen PD Dr. med. Werner Kempf Kempf und Pfaltz
Epi Histopathologische Untersuchung auf metastatische Aktivität
 49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
49 In den Straßenformen waren sowohl das Stratum superficiale als auch das Stratum profundum des Koriums deutlich verbreitert und wurden von breiten Bindegewebssträngen durchzogen (Abb.12). iese bestanden
Das Merkel Zell Karzinom der Haut Klinischer Samstag
 Das Merkel Zell Karzinom der Haut Klinischer Samstag 28.4. 2012 Klemens Rappersberger Dermatologische Abteilung KA-Rudolfstiftung Figure 11-3 Immigrant cells in the epidermis Downloaded from: StudentConsult
Das Merkel Zell Karzinom der Haut Klinischer Samstag 28.4. 2012 Klemens Rappersberger Dermatologische Abteilung KA-Rudolfstiftung Figure 11-3 Immigrant cells in the epidermis Downloaded from: StudentConsult
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
Immunbiologie. Teil 4
 Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie
![W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf. Dermatopathologie](/thumbs/48/24515909.jpg) W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf Dermatopathologie W. Kempf M. Hantschke H. Kutzner W. Burgdorf Dermatopathologie Mit 242 farbigen Abbildungen PD Dr. med. Werner Kempf Kempf und Pfaltz
W. Kempf ] M. Hantschke ] H. Kutzner ] W. Burgdorf Dermatopathologie W. Kempf M. Hantschke H. Kutzner W. Burgdorf Dermatopathologie Mit 242 farbigen Abbildungen PD Dr. med. Werner Kempf Kempf und Pfaltz
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Papeln, Pusteln, Krusten beim Hund - Algorithmus
 Plan dieser Vorlesung Papeln, Pusteln, Krusten Dr. Chiara Noli, DVM, Dip ECVD Ospedale Veterinario Cuneese Borgo San Dalmazzo (CN) - Italien Definition und Pathogenese Liste der verschiedenen Differentialdiagnosen
Plan dieser Vorlesung Papeln, Pusteln, Krusten Dr. Chiara Noli, DVM, Dip ECVD Ospedale Veterinario Cuneese Borgo San Dalmazzo (CN) - Italien Definition und Pathogenese Liste der verschiedenen Differentialdiagnosen
Aktualisierungsliste zur ICD-10-GM 2011 Sondervorabversion Leukämien und Lymphome
 Aktualisierungsliste zur ICD-10-GM 2011 Sondervorabversion Leukämien und Lymphome Diese Aktualisierungsliste enthält die aktuellen Änderungen im Bereich Leukämien und Lymphome der ICD-10-GM 2011 gegenüber
Aktualisierungsliste zur ICD-10-GM 2011 Sondervorabversion Leukämien und Lymphome Diese Aktualisierungsliste enthält die aktuellen Änderungen im Bereich Leukämien und Lymphome der ICD-10-GM 2011 gegenüber
