Kennlinie der Brennstoffzelle
|
|
|
- Volker Knopp
- vor 7 Jahren
- Abrufe
Transkript
1 E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul Kabel lange Schläuche kurze Schläuche Schlauchverschlussstopfen Zusätzliche Komponenten: Lampe -15 Watt Destilliertes Wasser Durchführung: Beachten Sie die Anweisungen aus der Bedienungsanleitung! Beim Experimentieren Schutzbrille tragen und Zündquellen fernhalten!!! Bild z1a (Spülen): Solarmodul A V R Lampe + - ml ml O H O H
2 1. Bauen Sie eine Anordnung nach Bild z1a auf. Polung am beachten!. Prüfen Sie, ob die Gaszuleitungsschläuche an und richtig angeschlossen sind. Stellen Sie den Wahlschalter der auf Offen. 3. Stellen Sie sicher, dass beide Gasspeicher am bis zur ml-markierung mit destilliertem Wasser gefüllt sind und stellen Sie mit dem beleuchteten Solarmodul am einen konstanten Strom ein (zwischen und 3 ma). Sie müssen das Solarmodul so in Richtung der Lampe ausrichten, dass Sie im eine deutliche Gasentwicklung beobachten.. Spülen Sie für 5 Minuten das gesamte System aus, und Schläuchen mit den erzeugten Gasen. Stellen Sie anschließend den Wahlschalter der für 3 Minuten auf 3 Ohm, Sie sollten jetzt bereits am Amperemeter der Messbox einen Strom beobachten. Stellen Sie nun zum erneuten Spülen den Wahlschalter der Messbox für 3 Minuten wieder auf Offen. Bild z1b (Speichern): Sauerstoff aus Wasserstoff aus O H Schlauchverschlussstopfen 5. Unterbrechen Sie kurzzeitig die Stromversorgung des s und schließen Sie die beiden kurzen Schläuche an den Auslassöffnungen der mit den Verschlussstopfen (siehe Bild z1b). Stellen Sie nun die Verbindung Solarmodul- wieder her und speichern die erzeugten Gase in den Gasspeichern des s. Unterbrechen Sie die Verbindung wenn auf der Wasserstoffseite des s die ml-markierung erreicht ist. 7. Entfernen Sie die Kabel zwischen Solarmodul und und schließen Sie damit das Voltmeter der an die an (siehe Bild z1c). Messen Sie nun die Kennlinie der durch Variation des Messwiderstandes (Wahlschalter der Messbox). Beginnen Sie bei Offen (Ruhespannung) und dann nach rechts drrehend zu kleineren Widerständen. Nehmen Sie für jede Schalterstellung den Wert von Strom und Spannung auf. Warten Sie vor dem Ablesen jeweils 3 Sekunden. Tragen Sie die Werte in die Messtabelle ein. Messen Sie zum Schluss noch die Werte für die Lampe und den Elektromotor. 9. Stellen Sie nach Aufnahme der Kennlinie den Wahlschalter der Messbox wieder auf Offen und entfernen Sie außerdem die Verschlußstopfen an der.
3 Bild z1c (Aufnahme der Kennlinie): A V R + - ml ml O H O H Messtabelle: R in Ω U in V I in ma Auswertung: 1. Zeichnen Sie die U-I-Kennlinie der.. Interpretieren Sie die Kennlinie. 3. Zeichnen Sie ein P-I-Diagramm.. Tragen Sie den Wert für die Spannung und die Stromstärke der Lampe und des Motors in die U-I-Kennlinie ein. 5. Berechnen Sie die Leistungsaufnahme der Lampe und des Motors und tragen Sie die Werte in das P-I-Diagramm ein.
4 Interpretation/Hinweise: Kennlinie 1 Spannung in V,9,,7, Elektromotor Lampe,5 3 5 Strom in ma Um die Kennlinie der zu verstehen, sollte man sich die Kennlinie eines s in Erinnerung rufen (Experiment e1 des Schülerkastens Solar-Wasserstoff-Technologie). Die Vorgänge in der sind die Umkehrung der Elektrolyse. Bei der Elektrolyse von Wasser müssen mindestens 1,3 V aufgebracht werden, damit die Zersetzung von Wasser beginnt, in der Regel ist die Spannung noch höher (Überspannung). Bei einer (als galvanische Zelle) wird aus gleichen Gründen weniger Spannung erzeugt. Auch hier beeinflussen das Material der Elektroden (Katalyse), der Innenwiderstand, die Temperatur aber auch die Menge an Wasserstoff und Sauerstoff die zugeführt werden, die Kennlinie. Bei sehr geringer oder gar keiner Stromentnahme beträgt die Spannung der ca.,9 V. Man bezeichnet diese Spannung als Ruhespannung (in Analogie zur Batterie). Sie ist bei der stark von der Menge und Reinheit der zugeführten Gase abhängig. Je mehr Strom man der entnimmt, desto kleiner wird die Spannung. Bei Spannungsabnahme ergibt sich ebenfalls ein exponentieller Anstieg des Stroms. Trägt man den Arbeitspunkt des Elektromotors in das P-I-Diagramm ein, so ist zu sehen, dass der Motor nicht im optimalen Punkt läuft, d.h. Wasserstoff geht hier verloren. Der kann also mehr Leistung entnommen werden. In der Praxis ist man bestrebt, die bei möglichst hohem Strom zu betreiben (also bei hoher Leistung). Bei einem hohen Strom nimmt aber gleichzeitig der Wirkungsgrad einer ab (siehe Experiment z), so dass auch hier die Aufgabe besteht einen optimalen Arbeitspunkt (hoher Wirkungsgrad, hohe Leistung) zu finden. Eine genaue Erklärung zum Verständnis der Kennlinie einer entnehmen Sie bitte der Anleitung z.
5 Leistung Spannung in V Lampe Elektromotor 3 5 Strom in ma
6 E z FARADAY- und Energiewirkungsgrad der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul Stoppuhr Kabel lange Schläuche kurze Schläuche Schlauchverschlussstopfen Zusätzliche Komponenten: Lampe -15 Watt Destilliertes Wasser Durchführung: Beachten Sie die Anweisungen aus der Bedienungsanleitung! Beim Experimentieren Schutzbrille tragen und Zündquellen fernhalten!!! Bild za (Spülen): Solarmodul A V R Lampe + - ml ml O H O H
7 1. Bauen Sie eine Anordnung nach Bild za auf. Polung am beachten!. Prüfen Sie, ob die Gaszuleitungsschläuche an und richtig angeschlossen sind. Stellen Sie den Wahlschalter der auf Offen. 3. Stellen Sie sicher, dass beide Gasspeicher am bis zur ml-markierung mit destilliertem Wasser gefüllt sind und stellen Sie mit dem beleuchteten Solarmodul am einen konstanten Strom ein (zwischen und 3 ma). Sie müssen das Solarmodul so auf die Lampe ausrichten, dass Sie im eine deutliche Gasentwicklung beobachten.. Spülen Sie für 5 Minuten das gesamte System mit den im erzeugten Gasen. Stellen Sie anschließend den Wahlschalter der für 3 min auf 3 Ohm, Sie sollten jetzt am Amperemeter der Messbox einen Strom messen. Stellen Sie nun zum erneuten Spülen den Wahlschalter der Messbox für 3 Minuten wieder auf Offen. Bild zb (Speichern): Sauerstoff aus Wasserstoff aus O H Schlauchverschlussstopfen 5. Unterbrechen Sie die Verbindung Solarmodul- und schließen Sie die beiden kurzen Schläuche an den Auslassöffnungen der mit den Stopfen (siehe Bild zb). Stellen Sie nun die Verbindung Solarmodul- wieder her und speichern die erzeugten Gase in den Gasspeichern des s. Unterbrechen Sie die Verbindung wenn auf der Wasserstoffseite des s die ml-markierung erreicht ist. 7. Da das System aufgrund seiner Schläuche und Dichtungen immer eine gewisse Leckrate aufweist, muss zuerst eine Nullmessung durchgeführt werden. Messen Sie über eine Zeit von 5 Minuten den Verlust an Wasserstoff aus dem Wasserstoffspeicher ohne Last (Stellung Offen ) und bestimmen Sie die Leckrate des Systems in ml Wasserstoff pro Minute.. Stellen Sie nun die Verbindung Solarmodul- wieder her und füllen Sie den Wasserstoffspeicher erneut auf ml auf. Anschließend unterbrechen Sie die Spannungsversorgung des s wieder. 9. Entfernen Sie nun die Kabel zwischen Solarmodul und und schließen Sie damit das Voltmeter der an die an (siehe Bild zc). Stellen Sie einen Widerstand von 3 Ohm ein. Messen Sie das Volumen, dass die in 1 s aus dem Wasserstoffspeicher des s verbraucht. Messen Sie außerdem Strom und Spannung der und notieren Sie alle Werte. Stellen Sie nach 1 s den Wahlschalter auf Offen.
8 . Wiederholen Sie die Schritte bis 9 noch zweimal und bilden Sie den Mittelwert des durch die verbrauchten Wasserstoffvolumens. Stellen Sie nach den Messungen den Wahlschalter auf Offen und entfernen Sie die Verschlußstopfen an der. Bild zc (Bestimmung des Wirkungsgrades): A V R + - ml ml O H O H Messtabelle: ohne Verbraucher - Nullmessung: t = 3 s = 5 min Verlustvolumen Wasserstoff aus Speicher: V = ml Bestimmung der Leckrate des Systems V/t = ml/min mit Verbraucher: R = Ω t = s V 1 = ml U = V V = ml Vmittel = ml I = ma V 3 = ml (verbrauchter Wasserstoff) Auswertung: 1. Bestimmen Sie die jeweiligen Wasserstoffvolumina.. Bestimmen Sie den FARADAY- Wirkungsgrad der. 3. Bestimmen Sie den Energiewirkungsgrad der.
9 Interpretation/Hinweise: Beispielmessung: Nullmessung t = 5 min V = 1,5 ml Leckrate: V/t =,3 ml/min mit Verbraucher: R = 3 Ω t = 1 s V1 =,5 ml U =,7 V V =, ml Vmittel =,5 ml I = 33 ma V3 =, ml (verbrauchter Wasserstoff aus Gasspeicher) Um einen Strom von 33 ma zu liefern, verbraucht die 5, (,5-,9) ml Wasserstoff. Bestimmung des FARADAY- Wirkungsgrades der Der FARADAY-Wirkungsgrad ist das Verhältnis aus dem theoretischen Wasserstoffverbrauch bei einem bestimmten Stromfluss durch den Verbraucher und dem experimentell bestimmten Wasserstoffverbrauch. η = VH theoretisch / VH experimentell Der FARADAY- Wirkungsgrad sollte möglichst 1 (%) betragen. Mit dem. FARADAYschen Gesetz lässt sich der theoretisch zu erwartende Wasserstoffverbrauch berechnen. I t = n z F n = V / V m VH theoretisch = I t V m / z F VH theoretisch = 33 ma 1 s l mol -1 / 9 C mol -1 VH theoretisch = 5, ml Einheiten: siehe Experiment e3 (Schülerkasten Solar-Wasserstoff-Technologie)
10 Beispielmessung: η = VH theoretisch / VH experimentell η = 5, ml / 5, ml η =,93 Aus folgenden Gründen kann der FARADAY-Wirkungsgrad der unter eins liegen: 1. Elektrochemische Parallelreaktionen, die weniger Elektronen pro verbrauchtem Wasserstoff liefern,. Chemische Reaktion von Wasserstoff und Sauerstoff an den Katalysatoren (katalytische Verbrennung) und 3. Wasserstoff- und Sauerstoff- Rekombination oder Diffusion durch Lecks. Bestimmung des Energiewirkungsgrades der Der Energiewirkungsgrad der ist das Verhältnis aus der gewonnenen elektrischen Energie und dem theoretischen Energieinhalt des verbrauchten Wasserstoffs. η = elektrische Energie / theor. Energieinhalt des verbrauchten Wasserstoffs η = U I t / Ho H VH experimentell η =,7 V 33 ma 1s / 11 9 kj m -3 5, ml η =, Einheiten: kj ml 1 ma 3 J 1 VAs 1 m 3 m 3 V ma s 1A 1 kj 1 J ml Bei einer Spannung von,7 V liegt der theoretische Wirkungsgrad bei,5. η theoretisch = Uexperimentell / U Ho U Ho ist die Spannung bezogen auf den oberen Heizwert des Wasserstoffs. Sie beträgt 1, V. U Ho = H o V m / z F Über die Bedeutung des Energiewirkungsgrades können Sie in unserem Lehrmaterial zur Solar- Wasserstoff-Technologie nachlesen.
11 Experimentvariationen: Bestimmen Sie den Energiewirkungsgrad in Abhängigkeit vom Strom der durch die fließt. Stellen Sie durch Variation des Widerstandes an der Ströme zwischen und 5 ma ein. Gehen Sie nicht über 5 ma! Bestimmen Sie den stromabhängigen Wirkungsgrad und interpretieren Sie das Ergebnis. Hinweise zur Interpretation können Sie unserem Lehrmaterial zur Solar-Wasserstoff-Technologie entnehmen.
12 E z3 Einfluss der Katalysatormenge auf die Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung (Grundaufbau) Zusätzliche Membran mit,1 mg/cm Pt (Membran hat Markierung) Innensechskantschlüssel Schraubenschlüssel Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul Kabel lange Schläuche kurze Schläuche Schlauchverschlussstopfen Zusätzliche Komponenten: Lampe -15 Watt Destilliertes Wasser Durchführung: Beachten Sie die Anweisungen aus der Bedienungsanleitung! Beim Experimentieren Schutzbrille tragen und Zündquellen fernhalten!!! Bild z3a (Spülen): Solarmodul A V R Lampe + - ml ml O H O H
13 1. Führen Sie zuerst die Messungen mit der mit der Membran mit,3 mg/cm Katalysatorbelegung durch. Achten Sie darauf, dass die Endplatten auf 7 mm Abstand zusammengeschraubt sind. Bauen Sie eine Anordnung nach Bild z3a auf. Polung am beachten!. Prüfen Sie, ob die Gaszuleitungsschläuche an und richtig angeschlossen sind. Stellen Sie den Wahlschalter der auf Offen. 3. Stellen Sie sicher, dass beide Gasspeicher am bis zur ml-markierung mit destilliertem Wasser gefüllt sind und stellen Sie mit dem beleuchteten Solarmodul am einen konstanten Strom ein (zwischen 5 und 3 ma). Sie müssen das Solarmodul so in Richtung der Lampe ausrichten, dass Sie im eine deutliche Gasentwicklung beobachten.. Spülen Sie für 5 Minuten das gesamte System aus, und Schläuchen mit den erzeugten Gasen. Stellen Sie anschließend den Wahlschalter der für 3 Minuten auf 3 Ohm, Sie sollten jetzt bereits am Amperemeter der Messbox einen Strom beobachten. Stellen Sie nun zum erneuten Spülen den Wahlschalter der Messbox für 3 Minuten wieder auf Offen. Bild z3b (Speichern): Sauerstoff aus Wasserstoff aus O H Schlauchverschlussstopfen 5. Unterbrechen Sie kurzzeitig die Stromversorgung des s und schließen Sie die beiden kurzen Schläuche an den Auslassöffnungen der mit den Verschlussstopfen (siehe Bild z3b). Stellen Sie nun die Verbindung Solarmodul- wieder her und speichern die erzeugten Gase in den Gasspeichern des s. Unterbrechen Sie die Verbindung wenn auf der Wasserstoffseite des s die ml-markierung erreicht ist. 7. Entfernen Sie die Kabel zwischen Solarmodul und und schließen Sie damit das Voltmeter der an die an (siehe Bild z3c). Messen Sie nun die Kennlinie der durch Variation des Messwiderstandes (Wahlschalter der Messbox). Beginnen Sie bei Offen (Ruhespannung) und dann nach rechts drehend zu kleineren Widerständen. Nehmen Sie für jede Schalterstellung den Wert von Strom und Spannung auf. Warten Sie vor dem Ablesen jeweils 3 Sekunden. Tragen Sie die Werte in die Messtabelle ein.
14 1. Stellen Sie nach Aufnahme der Kennlinie den Wahlschalter der Messbox wieder auf Offen und entfernen Sie außerdem die Verschlussstopfen an der.. Zerlegen Sie nun die wie in der Aufbauanleitung skizziert und bauen Sie die Membran mit,1 mg/cm Katalysatorbelegung ein. Achten Sie darauf, dass der Abstand der Endplatten 7 mm beträgt. 3. Messen Sie die Kennlinie wie unter beschrieben.. Zerlegen Sie nach Durchführung der Messungen die und bauen Sie die Membran mit,3 mg/cm Pt wieder ein (Grundaufbau). Bild z3c (Aufnahme der Kennlinie): A V R + - ml ml O H O H Messtabelle:,1 mg/cm Katalysator,3 mg/cm Katalysator R in Ω U in V I in ma U in V I in ma Auswertung: 1. Zeichnen Sie die U-I-Kennlinien der mit beiden Katalysatorbelegungen.. Zeichnen Sie auch die P-I-Diagramme. 3. Interpretieren Sie die Ergebnisse.
15 Interpretation/Hinweise: 1 Kenlinie als Funktion der Katalysatorbelegung,9,,7 Spannung in V,,5,,3,,1 Katalysator,1 mg Katalysator,3 mg 3 5 Strom in ma 3 Leistung als Funktion der Katalysatorbelegung 5 Leistung in mw 15 5 Katalysator,1 mg Katalysator,3 mg 3 5 Strom in ma Die Interpretation der Ergebnisse ist zusammenfassend in Anleitung z beschrieben.
16 E z Einfluss der Gaszufuhr auf die Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung (Grundaufbau) Endplatte mit Luftschlitzen Innensechskantschlüssel Schraubenschlüssel Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul Kabel lange Schläuche kurze Schläuche Schlauchverschlussstopfen Zusätzliche Komponenten: Lampe -15 Watt Destilliertes Wasser Durchführung: Beachten Sie die Anweisungen aus der Bedienungsanleitung! Beim Experimentieren Schutzbrille tragen und Zündquellen fernhalten!!! Bild za (Spülen, Messung mit Sauerstoff): Solarmodul A V R Lampe + - ml ml O H O H
17 1. Führen Sie die Messungen mit der Membran mit,3 mg/cm Katalysatorbelegung durch. Achten Sie darauf, dass die Endplatten auf 7 mm zusammengeschraubt sind. Bauen Sie eine Anordnung nach Bild za auf. Polung am beachten!. Prüfen Sie, ob die Gaszuleitungsschläuche an und richtig angeschlossen sind. Stellen Sie den Wahlschalter der auf Offen. 3. Stellen Sie sicher, dass beide Gasspeicher am bis zur ml-markierung mit destilliertem Wasser gefüllt sind und stellen Sie mit dem beleuchteten Solarmodul am einen konstanten Strom ein (zwischen 5 und 3 ma). Sie müssen das Solarmodul so in Richtung der Lampe ausrichten, dass Sie eine deutliche Gasentwicklung im beobachten.. Spülen Sie für 5 Minuten das gesamte System aus, und Schläuchen mit den erzeugten Gasen. Stellen Sie anschließend den Wahlschalter der für 3 Minuten auf 3 Ohm, Sie sollten jetzt bereits am Amperemeter der Messbox einen Strom beobachten. Stellen Sie nun zum erneuten Spülen den Wahlschalter der Messbox für 3 Minuten wieder auf Offen. Bild zb (Speichern, Messung mit Sauerstoff): Sauerstoff aus Wasserstoff aus O H Schlauchverschlussstopfen 5. Unterbrechen Sie kurzzeitig die Stromversorgung des s und schließen Sie die beiden kurzen Schläuche an den Auslassöffnungen der mit den Verschlussstopfen (siehe Bild zb). Stellen Sie nun die Verbindung Solarmodul- wieder her und speichern die erzeugten Gase in den Gasspeichern des s. Unterbrechen Sie die Verbindung wenn auf der Wasserstoffseite des s die ml-markierung erreicht ist. 7. Entfernen Sie die Kabel zwischen Solarmodul und und schließen Sie damit das Voltmeter der an die an (siehe Bild zc). Messen Sie nun die Kennlinie der durch Variation des Messwiderstandes (Wahlschalter der Messbox). Beginnen Sie bei Offen (Ruhespannung) und dann nach rechts drehend zu kleineren Widerständen. Nehmen Sie für jede Schalterstellung den Wert von Strom und Spannung auf. Warten Sie vor dem Ablesen jeweils 3 Sekunden. Tragen Sie die Werte in die Messtabelle ein.
18 9. Stellen Sie nach Aufnahme der Kennlinie den Wahlschalter der Messbox wieder auf Offen und entfernen Sie außerdem die Verschlussstopfen an der. Bild zc (Aufnahme der Kennlinie mit Sauerstoff): A V R + - ml ml O H O H. Entfernen Sie nun die Schläuche auf der Sauerstoffseite der. Die wird nun mit Sauerstoff aus der Umgebungsluft versorgt, der durch die Gasstutzen einströmen kann. Führen Sie nun das Experiment wie unter beschrieben erneut durch, wobei lediglich der Wasserstoff aus dem Gasspeicher des s entnommen wird (siehe Bild zd). Bild zd: (Aufnahme der Kennlinie/Luft durch Gasstutzen) Wasserstoff aus O H Schlauchverschlussstopfen
19 11. Verfahren Sie mit der Messung der Kennlinie wie unter. beschrieben, warten Sie aber bei jedem Messpunkt ca. Minuten bevor Sie die Werte von Strom und Spannung ablesen, da die Einstellung eines Gleichgewichtes länger dauert als im Sauerstoffbetrieb. 1. Zerlegen Sie anschließend die und bauen Sie statt der Sauerstoffendplatte die Endplatte mit den Luftschlitzen ein. Beim Zusammenschrauben halten Sie bitte den Abstand der beiden Endplatten von 7 mm ein. 13. Die wird nun mit Sauerstoff aus der Umgebungsluft versorgt, der durch die Luftschlitze einströmen kann. Führen Sie das Experiment wie unter beschrieben erneut durch, wobei auch hier nur der Wasserstoff aus dem Gasspeicher des s entnommen wird (siehe Bild ze). Warten Sie bei Aufnahme der Kennlinie für jeden Messpunkt ca. 1 Minute. Bild zd: (Aufnahme der Kennlinie/Luft durch Luftschlitze) Wasserstoff aus O H Schlauchverschlussstopfen 1. Zerlegen Sie nach Durchführung der Messungen die und bauen Sie die Sauerstoffendplatte wieder ein (Grundaufbau). Messtabelle: Sauerstoff Luft durch Gasstutzen Luft durch Luftschlitze R in Ω U in V I in ma U in V I in ma U in V I in ma Auswertung: 1. Zeichnen Sie die drei U-I-Kennlinien der in Abhängigkeit von der unterschiedlichen Sauerstoffzufuhr.. Zeichnen Sie auch die P-I-Diagramme. 3. Interpretieren Sie die Ergebnisse.
20 Interpretation/Hinweise: 1 Kenlinie als Funktion des Sauerstoffangebotes,9,,7 Spannung in V,,5,,3,,1 Luft/Gasstutzen Luft/Luftplatte Sauerstoff 3 5 Strom in ma 3 Leistung als Funktion des Sauerstoffangebotes 5 Leistung in mw 15 5 Luft/Gasstutzen Luft/Luftplatte Sauerstoff 3 5 Strom in ma Die Interpretation der Ergebnisse ist zusammenfassend in Anleitung z beschrieben.
21 E z5 Einfluss des Gesamtwiderstandes auf die Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung (Grundaufbau) Einsteckwiderstand,7 Ω Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul Kabel lange Schläuche kurze Schläuche Schlauchverschlussstopfen Zusätzliche Komponenten: Lampe -15 Watt Destilliertes Wasser Durchführung: Beachten Sie die Anweisungen aus der Bedienungsanleitung! Beim Experimentieren Schutzbrille tragen und Zündquellen fernhalten!!! Bild z5a (Spülen): Solarmodul A V R Lampe + - ml ml O H O H
22 1. Führen Sie die Messungen mit der Membran mit,3 mg/cm Katalysatorbelegung durch. Achten Sie darauf, dass die Endplatten auf 7 mm zusammengeschraubt sind. Bauen Sie eine Anordnung nach Bild z5a auf. Polung am beachten!. Prüfen Sie, ob die Gaszuleitungsschläuche an und richtig angeschlossen sind. Stellen Sie den Wahlschalter der auf Offen. 3. Stellen Sie sicher, dass beide Gasspeicher am bis zur ml-markierung mit destilliertem Wasser gefüllt sind und stellen Sie mit dem beleuchteten Solarmodul am einen konstanten Strom ein (zwischen 5 und 3 ma). Sie müssen das Solarmodul so in Richtung der Lampe ausrichten, dass Sie eine deutliche Gasentwicklung im beobachten.. Spülen Sie für 5 Minuten das gesamte System aus, und Schläuchen mit den erzeugten Gasen. Stellen Sie anschließend den Wahlschalter der für 3 Minuten auf 3 Ohm, Sie sollten jetzt bereits am Amperemeter der Messbox einen Strom beobachten. Stellen Sie nun zum erneuten Spülen den Wahlschalter der Messbox für 3 Minuten wieder auf Offen. Bild z5b (Speichern): Sauerstoff aus Wasserstoff aus O H Schlauchverschlussstopfen 5. Unterbrechen Sie kurzzeitig die Stromversorgung des s und schließen Sie die beiden kurzen Schläuche an den Auslassöffnungen der mit den Verschlussstopfen (siehe Bild z5b). Stellen Sie nun die Verbindung Solarmodul- wieder her und speichern die erzeugten Gase in den Gasspeichern des s. Unterbrechen Sie die Verbindung wenn auf der Wasserstoffseite des s die ml-markierung erreicht ist. 7. Entfernen Sie die Kabel zwischen Solarmodul und und schließen Sie damit das Voltmeter der an die an (siehe Bild z5c). Messen Sie nun die Kennlinie der durch Variation des Messwiderstandes (Wahlschalter der Messbox). Beginnen Sie bei Offen (Ruhespannung) und dann nach rechts drehend zu kleineren Widerständen. Nehmen Sie für jede Schalterstellung den Wert von Strom und Spannung auf. Warten Sie vor dem Ablesen jeweils 3 Sekunden. Tragen Sie die Werte in die Messtabelle ein.
23 Bild z5c (Aufnahme der Kennlinie): A V R + - ml ml O H O H Bild z5d (Aufnahme der Kennlinie mit Einsteckwiderstand): A V R + -,7 Ω ml ml O H O H
24 9. Stellen Sie nach Aufnahme der Kennlinie den Wahlschalter der Messbox wieder auf Offen und entfernen Sie außerdem die Verschlussstopfen an der.. Stecken Sie nun den Einsteckwiderstand mit,7 Ω in eine der nbuchsen (Bild z5d) und messen Sie erneut die Kennlinie wie unter beschrieben. Messtabelle: Kenlinie ohne Widerstand mit Einsteckwiderstand R in Ω U in V I in ma U in V I in ma Auswertung: 1. Zeichnen Sie die U-I-Kennlinien der mit und ohne Einsteckwiderstand.. Zeichnen Sie auch die P-I-Diagramme. 3. Interpretieren Sie die Ergebnisse.
25 Interpretation/Hinweise: 1 Kenlinie als Funktion des nwiderstandes,9,,7 Spannung in V,,5,,3,,1 ohne Widerstand Widerstand,7 Ohm 3 5 Strom in ma 3 Leistung als Funktion des nwiderstandes 5 Leistung in mw 15 5 ohne Widerstand Widerstand,7 Ohm 3 5 Strom in ma Die Interpretation der Ergebnisse ist zusammenfassend in Anleitung z beschrieben.
26 z Theoretische Grundlagen zu n 1 Funktionsprinzip und allgemeine Charakteristika n sind hocheffiziente elektrochemische Stromerzeuger. Die hat gegenüber der konventionellen Stromerzeugung ein einfacheres Funktionsprinzip: die direkte Umwandlung des Energieträgers in elektrische Energie. nkraftwerk chemische Energie elektrische Energie Wärme mechanische Energie Konventionelles Kraftwerk Abb. 1: Die im Vergleich zu herkömmlichen Stromerzeugungsverfahren Das Grundprinzip einer ist die direkte Stromerzeugung aus einem Brennstoff (z.b. Wasserstoff) und einem Oxidant (Sauerstoff) in einem elektrochemischen Prozess.
27 Eine besteht aus zwei Elektroden und dem Elektrolyten. Die Anode wird mit dem Brennstoff und die Kathode mit dem Oxidanten versorgt, der Elektrolyt verbindet die beiden Elektroden miteinander. An der Anode (Minus-Pol) wird der Brennstoff oxidiert. Die dabei abgegebenen Elektronen fließen über den äußeren Stromkreis zur Kathode (Plus-Pol). Hier wird der Oxidant durch Elektronenaufnahme reduziert. Durch den Elektronenfluss kann im äußeren Stromkreis Arbeit verrichtet werden. Der Ladungstransport in der wird durch die Ionenbewegung im Elektrolyten realisiert. Elektrischer Verbraucher e - e - Brennstoff e - e - Luft / Sauerstoff Ionen Elektrolyt Anode Kathode Abb. : Funktionsprinzip einer. Eine liefert damit wie Batterie und Akkumulator Energie aus einem elektrochemischen Prozess. Der wesentliche Unterschied besteht allerdings darin, dass bei der die Elektroden selbst nicht umgewandelt werden, die also nicht entladen werden kann. Vergleich von Batterie, Akkumulator und Gemeinsamkeit: Sie erzeugen elektrische Energie aus chemischer Energie über eine elektrochemische Reaktion. Unterschiede: Batterie: Entladen, wenn alle miteinander reagierenden Ausgangsstoffe verbraucht sind. Akkumulator: elektrochemische Reaktion reversibel, lässt sich nach Entladung wieder aufladen. : einsetzbar ohne Erschöpfung, Ausgangsstoffe werden bei Bedarf zugeführt.
28 Funktionsprinzip der "Zerlegbaren " Die zerlegbare ist in der Polymerelektrolyt-Membran-Technologie ausgeführt. Der Begriff Polymer-Elektrolyt-Membran- (PEMFC) bezieht sich auf die protonenleitende Polymerfolie, die als Elektrolyt dient. Der Begriff PEM steht für "Proton-Exchange-Membrane". Die PEM- wird mit Wasserstoff und Sauerstoff betrieben. Die elektrochemische Energiewandlung in der PEM- ist praktisch der Umkehrvorgang der Wasserelektrolyse. An der Anode werden Wasserstoffmoleküle unter Abgabe von Elektronen zu positiv geladenen Wasserstoffionen oxidiert. Die Wasserstoffionen diffundieren durch die ionenleitende Polymerelektrolytmembran (Elektrolyt) zur Kathode. An der Kathode reagieren die Wasserstoffionen mit Sauerstoff und den aus dem elektrischen Leiter zugeführten Elektronen zu Wasser. Abb. 3: Funktionsprinzip einer PEM-. Werden Anode und Kathode mit einem elektrischen Leiter (z.b. Elektromotor) verbunden, fließen die Elektronen (elektrischer Strom) von der Anode zur Kathode. Anode: H H + + e - Oxidation (Elektronenabgabe) Kathode: O + H + + e - H O Reduktion (Elektronenaufnahme) Gesamtreaktion: H + O H O G = -37 kj/mol (bei 5 C) Die theoretisch mögliche Spannung einer Einzelzelle ergibt sich aus den thermodynamischen Daten der Reaktion von Wasserstoff und Sauerstoff zu Wasser. Der Wert für eine Einzelzelle beträgt unter Standardbedingungen 1,3 V. 1,3V = G z F Im Betrieb kommt es bei Stromfluss zu Verlusten (Überspannungen) z.b. durch Reaktionshemmungen (Experiment z3), Innenwiderstände (Experiment z5) oder eine ungenügende
29 Gasdiffusion (Experiment z). Dies führt in der Praxis zu niedrigeren Zellspannungen. Sie betragen für eine Einzelzelle typischerweise, -,9 V. Das Herzstück einer PEM- ist die Membran-Elektroden-Einheit. Die Membran wird dabei mit fein verteiltem Platinkatalysator beschichtet (etwa,1 -,5 mg Platin pro cm ). Die so beschichteten Membranen werden anschließend mit porösen Kohlenstoffelektroden in der verpresst. Dabei entsteht ein elektrischer Kontakt. Die Polymerelektrolytmembran reicht durch den Andruck teilweise in die porösen Elektrodenstrukturen hinein, es bildet sich die Grenzfläche Gas/Katalysator/Elektrolyt aus. Der Katalysator muss sowohl zum Gas als auch zu den Protonen-Leitern (Polymerelektrolytmembran) und Elektronen-Leitern (Elektroden) Kontakt haben. An diesen Stellen laufen die elektrochemischen Reaktionen ab (Abb. (Rechts)). In der Reaktion werden Wasserstoff und Sauerstoff katalytisch umgesetzt, die Elektroden werden selbst nicht verändert. Die Platin-Teilchen wirken als katalytische Zentren, die um so wirksamer sind je größer deren Oberfläche ist. Abb. : Schnitt durch eine (Polymerelektrolyt-)Membran-Elektroden-Einheit unter Verdeutlichung der bei der nreaktion ablaufenden Prozesse. Die Elektrolytmembran arbeitet wie ein Ionenaustauscher. Die Protonen der in der Membran enthaltenen Säuregruppen sind beweglich. Ist die Membran feucht, so transportiert sie Protonen zwischen der Anodenelektrode und der Kathodenelektrode. Der elektrische Kontakt erfolgt über Stromableiter, in diesem Fall spezielle Edelstahllochbleche. Die Stromableiter müssen auch bei großen n den Gasantransport und den Wasserabtransport gewährleisten, d.h. gas- und flüssigkeitsdurchlässig sein. Der Strom einer ist proportional zur Fläche der Elektroden und erreicht Werte von bis zu A/cm.
30 Die Strom-Spannungs-Kennlinie einer Die Strom-Spannungs-Kennlinie und die Leistungskennlinie der zerlegbaren können in den Experimenten bestimmt werden. In den Experimenten z3-z5 kann zusätzlich der Einfluss spezifischer Parameter auf die Form der Kennlinie untersucht werden. In Abb. 5 ist die Strom-Spannungs-Kennlinie einer schematisch dargestellt. Sie besteht aus 3 Bereichen, die typisch für elektrochemische Kennlinien sind. Strom in ma Abb. 5: Strom-Spannungs-Kennlinie einer eingeteilt in die drei Bereiche Katalyse, Widerstand der und Transport der Reaktanden. Wie lässt sich der Verlauf einer solchen Kennlinie verstehen? U (H /H 3 O + //H O/O ) ist die thermodynamisch maximal erreichbare Spannung, die eine liefern kann. Der Wert ergibt sich aus der elektrochemischen Spannungsreihe und beträgt 1,3 V. Die tatsächlichen Zellspannungen liegen immer darunter. Die Differenz aus der gemessenen Zellspannung und der thermodynamischen Spannung bezeichnet man als Überspannung. Die Größe der Überspannung ist das entscheidende Merkmal für die Leistungsfähigkeit einer. Die Überspannung setzt sich aus verschiedenen Beiträgen zusammen. Deren Größe bestimmt in Abhängigkeit vom Stromfluss den Verlauf der Kennlinie. Die Einzelbeiträge sind: (I) Durchtrittsüberspannung - Einfluss des Katalysators Bei kleinen Strömen und bei Spannungen nahe der thermodynamischen Spannung bestimmen die katalytischen Vorgänge an den Elektroden den Verlauf der Kennlinie. Dieser ist hier durch einen exponentiellen Anstieg des Stroms mit der Überspannung gekennzeichnet. Entscheidend für die Höhe des Stroms ist die Geschwindigkeit der katalytischen Umsetzung der Gase H und O, d.h. die Geschwindigkeit mit der die Elektronen durch die Grenze zwischen Pt-Katalysator und Elektrolyt
31 hindurchtreten. Dieser Elementarvorgang ist in Abb. (rechts) dargestellt. Die damit verbundene Überspannung bezeichnet man als Durchtrittsüberspannung. Die Menge an Katalysator bestimmt die Gesamthöhe des erreichbaren Stromes; je mehr Katalysator man verwendet, desto höher der erreichbare Strom (Experiment z3). (II) Innenwiderstand - Einfluss des Aufbaus der Jede hat einen Innenwiderstand (Elektrolyt, Stromableiter, innerer Aufbau, externe Verkabelung), der sich bei hohen Strömen als OHMscher Spannungsabfall bemerkbar macht. Die Spannungs-Strom-Kennlinie ist in diesem Fall linear, d.h. die Spannungsabnahme ist proportional der Stromerhöhung. Dieser Widerstand muss gerade bei großen n sehr klein gehalten werden, da es sonst zu großen Leistungseinbußen kommt. In Experiment z5 wird dieser Unterschied durch einen Einsteckwiderstand simuliert, d.h. es wird das Verhalten der Kennlinie in Abhängigkeit vom Gesamtwiderstand untersucht. (III) Diffusionsüberspannung - Einfluss des Stofftransportes Bei höheren Strömen wird der Antransport der Gase durch die poröse Elektrodenstruktur (Abb. (Mitte)) bestimmend. Eine Diffusionsüberspannung tritt dann auf, wenn die Gase am Katalysator schneller verbraucht werden, als sie dorthin diffundieren können. Typisches Indiz für das Auftreten einer Diffusionsüberspannung ist das "Abknicken" der Spannungs-Strom-Kennlinie nach unten. Die Spannung der wird mit Erhöhung des Stromes dann sehr schnell kleiner, die Elektrode "verarmt" an Gas. In der Experimentieranleitung z wird die Messung der Kennlinie im Luftbetrieb beschrieben. Sie knickt bei ca. ma ab, ein typisches Beispiel für eine Diffusionsüberspannung. Bei Einbau der Luftplatte ist der Strom beinahe so hoch wie bei Sauerstoffbetrieb, d.h. die erhält genug Sauerstoff aus der Umgebungsluft. Ziel jeder nentwicklung ist es, diese drei Überspannungsbeiträge zu minimieren durch (I) bessere Elektrokatalysatoren, (II) gut leitende Materialien und Kontakte, sowie (III) optimierte Elektrodenstrukturen und Gasführungen.
Kennlinie der Brennstoffzelle
 E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
Kennlinie der Methanol- Brennstoffzelle
 E m1 Kennlinie der Methanol- Brennstoffzelle Material: Methanol-Brennstoffzelle Flasche mit 1M Methanol-Lösung Spritztülle Verbraucher-Messbox 4 Kabel Verschlussstopfen Tank Zusätzliche Komponenten: Methanol
E m1 Kennlinie der Methanol- Brennstoffzelle Material: Methanol-Brennstoffzelle Flasche mit 1M Methanol-Lösung Spritztülle Verbraucher-Messbox 4 Kabel Verschlussstopfen Tank Zusätzliche Komponenten: Methanol
Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe
 Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe Wintersemester 2012/13 4. Versuch: Brennstoffzelle Dipl.-Ing. Sebastian Lang Learning outcome Nachdem Sie sich mit diesem Versuch auseinandergesetzt
Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe Wintersemester 2012/13 4. Versuch: Brennstoffzelle Dipl.-Ing. Sebastian Lang Learning outcome Nachdem Sie sich mit diesem Versuch auseinandergesetzt
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle
 E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
Experimentiertag. Datum: Name: Klasse: Schule:
 Experimentiertag Datum: Name: Klasse: Schule: E1 V 1 Generator, Propeller, Solarmodul Wovon hängt die Spannung ab? 1.) Spannung aus dem Generator: (Taucht in der Spannungsanzeige kein Minuszeichen auf,
Experimentiertag Datum: Name: Klasse: Schule: E1 V 1 Generator, Propeller, Solarmodul Wovon hängt die Spannung ab? 1.) Spannung aus dem Generator: (Taucht in der Spannungsanzeige kein Minuszeichen auf,
Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN
 10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
Brennstoffzelle. Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes. Schüler-Skript und Versuchsanleitung
 Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle
 Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 1 Kennlinie des Elektrolyseurs Versuchszweck Beim
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 1 Kennlinie des Elektrolyseurs Versuchszweck Beim
Physikalisches Grundpraktikum für Physiker/innen Teil I. Alternative Energiequellen
 Fachrichtungen der Physik UNIVERSITÄT DES SAARLANDES Physikalisches Grundpraktikum für Physiker/innen Teil I Alternative Energiequellen WWW-Adresse Grundpraktikum Physik: 0http://grundpraktikum.physik.uni-saarland.de/
Fachrichtungen der Physik UNIVERSITÄT DES SAARLANDES Physikalisches Grundpraktikum für Physiker/innen Teil I Alternative Energiequellen WWW-Adresse Grundpraktikum Physik: 0http://grundpraktikum.physik.uni-saarland.de/
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in. Reihenschaltung/Parallelschaltung
 TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
Brennstoffzelle und Solar-Wasserstoff-Technologie
 Brennstoffzelle und Solar-Wasserstoff-Technologie Seite 1 von 21 Seite 2 von 21 Seite 3 von 21 Seite 4 von 21 2.4. Zugelassene Bediener Mit der Anlage dürfen Sie nur arbeiten, wenn Sie die Bedienungsanleitung
Brennstoffzelle und Solar-Wasserstoff-Technologie Seite 1 von 21 Seite 2 von 21 Seite 3 von 21 Seite 4 von 21 2.4. Zugelassene Bediener Mit der Anlage dürfen Sie nur arbeiten, wenn Sie die Bedienungsanleitung
Elektrizität. = C J m. Das Coulomb Potential φ ist dabei:
 Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Brenstoffzelle (BRZ)
 Seite 1 Themengebiet: Thermodynamik 1 Literatur A. Macdonald, M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris, Berlin, 2007 A.J. Bard, L.R. Faulkner, Electrochemical Methods Fundamentals
Seite 1 Themengebiet: Thermodynamik 1 Literatur A. Macdonald, M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris, Berlin, 2007 A.J. Bard, L.R. Faulkner, Electrochemical Methods Fundamentals
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle. Inhaltsfeld: Elektrochemie
 Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Eigenschaften der Brennstoffzelle
 Experimentelle Übungen für Fortgeschrittene Aufgaben im Institut für Materialphysik Aufgabe 2 Eigenschaften der Brennstoffzelle Inhaltsverzeichnis 1 Aufgabe 2 2 Theoretische Voraussetzungen 2 3 Literatur
Experimentelle Übungen für Fortgeschrittene Aufgaben im Institut für Materialphysik Aufgabe 2 Eigenschaften der Brennstoffzelle Inhaltsverzeichnis 1 Aufgabe 2 2 Theoretische Voraussetzungen 2 3 Literatur
Vorlesung 3: Elektrodynamik
 Vorlesung 3: Elektrodynamik, georg.steinbrueck@desy.de Folien/Material zur Vorlesung auf: www.desy.de/~steinbru/physikzahnmed georg.steinbrueck@desy.de 1 WS 2015/16 Der elektrische Strom Elektrodynamik:
Vorlesung 3: Elektrodynamik, georg.steinbrueck@desy.de Folien/Material zur Vorlesung auf: www.desy.de/~steinbru/physikzahnmed georg.steinbrueck@desy.de 1 WS 2015/16 Der elektrische Strom Elektrodynamik:
1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls
 1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls Hintergrund: Gegeben ist ein Datenblatt eines Solarpanels. Der Schüler soll messtechnisch die Daten eines kleinen Solarmoduls
1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls Hintergrund: Gegeben ist ein Datenblatt eines Solarpanels. Der Schüler soll messtechnisch die Daten eines kleinen Solarmoduls
Physik für die Sekundarstufe II. Wasserstoff. Energie für morgen. Averil Macdonald. heliocentris
 Physik für die Sekundarstufe II Wasserstoff Energie für morgen Averil Macdonald heliocentris Inhalt Teil 1 Vorbereitete experimentelle Lektionen mit Lehrerinformationen zur Vermittlung von Rahmenplaninhalten
Physik für die Sekundarstufe II Wasserstoff Energie für morgen Averil Macdonald heliocentris Inhalt Teil 1 Vorbereitete experimentelle Lektionen mit Lehrerinformationen zur Vermittlung von Rahmenplaninhalten
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
Bedienungsanleitung. F109 Fuel Cell Stack 5. F110 Fuel Cell Stack 10
 Bedienungsanleitung F109 Fuel Cell Stack 5 F110 Fuel Cell Stack 10 H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel.: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: info@h-tec-education.com
Bedienungsanleitung F109 Fuel Cell Stack 5 F110 Fuel Cell Stack 10 H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel.: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: info@h-tec-education.com
Q t U I R = Wiederholung: Stromstärke: Einheit 1 Ampere, C = A s. Elektrischer Widerstand: Einheit 1 Ohm, Ω = V/A
 1 Wiederholung: Stromstärke: I = Q t Einheit 1 Ampere, C = A s Elektrischer Widerstand: R = U I U = R I Einheit 1 Ohm, Ω = V/A Standard Widerstände: 2 Aber auch dies sind Widerstände: Verstellbare Widerstände
1 Wiederholung: Stromstärke: I = Q t Einheit 1 Ampere, C = A s Elektrischer Widerstand: R = U I U = R I Einheit 1 Ohm, Ω = V/A Standard Widerstände: 2 Aber auch dies sind Widerstände: Verstellbare Widerstände
E5: Faraday-Konstante
 E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
1.) Skizzierieren Sie den Aufbau einer PEM Brennstoffzelle und erläutern Sie deren Funktionsweise.
 E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
Die Wirkungsweise einer Brennstoffzelle. Ein Vortrag von Bernard Brickwedde
 Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
JUFOTech. wko.at/tirol/jufotech DATENBLATT. Jugend forscht in der Technik. Titel der Projektarbeit: Fachgebiet:
 Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Dunkel- und Hellkennlinie des Solarmoduls. Beachten Sie die Anweisungen aus der Bedienungsanleitung! Messgerät + V + A. Solarmodul
 P s1 Dunkel- und Hellkennlinie des Solarmoduls Material: Solarmodul Verbrauchermodul Strom- und Spannungsmessgeräte 5 Kabel Zusätzliche Komponenten: Schwarze Pappe (Teil 1) Netzteil (Teil 1) Lampe 100-150
P s1 Dunkel- und Hellkennlinie des Solarmoduls Material: Solarmodul Verbrauchermodul Strom- und Spannungsmessgeräte 5 Kabel Zusätzliche Komponenten: Schwarze Pappe (Teil 1) Netzteil (Teil 1) Lampe 100-150
Experimente mit Brennstoffzellen - Kennlinienaufnahme
 Experimente mit Brennstoffzellen - Kennlinienaufnahme Ziel dieses Unterrichtsentwurfes ist es, die Funktionsweise von Brennstoffzellen näher kennen zu lernen. Die Strom-Spannungs-Kennlinie eines Elektrolyseurs
Experimente mit Brennstoffzellen - Kennlinienaufnahme Ziel dieses Unterrichtsentwurfes ist es, die Funktionsweise von Brennstoffzellen näher kennen zu lernen. Die Strom-Spannungs-Kennlinie eines Elektrolyseurs
Das Brennstoffzellen-Radio
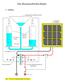 Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.de 2 von 18 6. Wir bauen eine Zitronenbatterie (Kl. 9/10) Chemische
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.de 2 von 18 6. Wir bauen eine Zitronenbatterie (Kl. 9/10) Chemische
E 3 Brennstoffzelle. 1 Aufgabenstellung
 E 3 Brennstoffzelle 1 Aufgabenstellung 1.1 Ermitteln Sie den Wirkungsgrad eines Elektrolyseurs. 1. Nehmen Sie die Strom-Spannungs-Kennlinie eines Brennstoffzellensystems auf und erläutern Sie den erhaltenen
E 3 Brennstoffzelle 1 Aufgabenstellung 1.1 Ermitteln Sie den Wirkungsgrad eines Elektrolyseurs. 1. Nehmen Sie die Strom-Spannungs-Kennlinie eines Brennstoffzellensystems auf und erläutern Sie den erhaltenen
HappyEvening am Brennstoffzellen zur mobilen Energiebereitstellung
 HappyEvening am 15.10.2008 Brennstoffzellen zur mobilen Energiebereitstellung T. Pröll 15.10.2008 Inhalt Grundlagen Zelltypen und Anwendungen PEM-Brennstoffzelle (Prinzip) Direkt-Methanol-Brennstoffzelle
HappyEvening am 15.10.2008 Brennstoffzellen zur mobilen Energiebereitstellung T. Pröll 15.10.2008 Inhalt Grundlagen Zelltypen und Anwendungen PEM-Brennstoffzelle (Prinzip) Direkt-Methanol-Brennstoffzelle
Strom-Spannungs-Kennlinie und Leistung einer PEM Brennstoffzelle
 Strom-Spannungs-Kennlinie und Leistung ENT Schlüsselworte Brennstoffzelle, Protonen-Austausch-Membran, Kennlinie, elektrische Leistung, Innenwiderstand, Wasserstoff Prinzip In reagieren Wasserstoff und
Strom-Spannungs-Kennlinie und Leistung ENT Schlüsselworte Brennstoffzelle, Protonen-Austausch-Membran, Kennlinie, elektrische Leistung, Innenwiderstand, Wasserstoff Prinzip In reagieren Wasserstoff und
Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse
 Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
Elektrizität in den Themenfeldern 6 und 9
 Elektrizität in den Themenfeldern 6 und 9 1 Intention TF 6 Entwicklung von Vorstellungen zum Energietransport mit dem Träger Elektrizität Energienutzung im Alltag; Einheiten J und kwh Zusammenhang von
Elektrizität in den Themenfeldern 6 und 9 1 Intention TF 6 Entwicklung von Vorstellungen zum Energietransport mit dem Träger Elektrizität Energienutzung im Alltag; Einheiten J und kwh Zusammenhang von
Physikalisches Anfaengerpraktikum. Brennstoffzelle
 Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
ACHTUNG! Nur zum Gebrauch für Kinder über
 P ROFI FUEL CELL KIT BEDIENUNGSANLEITUNG D ACHTUNG! Nur zum Gebrauch für Kinder über 10 Jahren. Benutzung nur unter der genauen Aufsicht von Erwachsenen, die sich mit den im Experimentierkasten beschriebenen
P ROFI FUEL CELL KIT BEDIENUNGSANLEITUNG D ACHTUNG! Nur zum Gebrauch für Kinder über 10 Jahren. Benutzung nur unter der genauen Aufsicht von Erwachsenen, die sich mit den im Experimentierkasten beschriebenen
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2007
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
1. Messungen an einer Modell-Windanlage
 1. Messungen an einer Modell-Windanlage Georg Begusch, Leopold Mathelitsch, Gerhard Rath, Erich Reichel, Eduard Schittelkopf Zuerst sollen Sie einige physikalische Eigenschaften von Windenergieanlagen
1. Messungen an einer Modell-Windanlage Georg Begusch, Leopold Mathelitsch, Gerhard Rath, Erich Reichel, Eduard Schittelkopf Zuerst sollen Sie einige physikalische Eigenschaften von Windenergieanlagen
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073
 Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
Grundwissen. Physik. Jahrgangsstufe 8
 Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester VL #19 am
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #9 am 30.05.007 Vladimir Dyakonov Leistungsbeträge 00 W menschlicher Grundumsatz 00 kw PKW-Leistung
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #9 am 30.05.007 Vladimir Dyakonov Leistungsbeträge 00 W menschlicher Grundumsatz 00 kw PKW-Leistung
6.1 Elektrodenpotenzial und elektromotorische Kraft
 6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
Aufgabenblatt Z/ 01 (Physikalische Größen und Einheiten)
 Aufgabenblatt Z/ 01 (Physikalische Größen und Einheiten) Aufgabe Z-01/ 1 Welche zwei verschiedenen physikalische Bedeutungen kann eine Größe haben, wenn nur bekannt ist, dass sie in der Einheit Nm gemessen
Aufgabenblatt Z/ 01 (Physikalische Größen und Einheiten) Aufgabe Z-01/ 1 Welche zwei verschiedenen physikalische Bedeutungen kann eine Größe haben, wenn nur bekannt ist, dass sie in der Einheit Nm gemessen
Was ist Elektrochemie? Elektrochemie. Elektrochemie ist die Lehre von der Beziehung
 Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Themengebiet: Thermodynamik. Brennstoffzelle, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung,
 Seite 1 Themengebiet: Thermodynamik Stichwörter, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung, Literatur [1] A. Macdonald and M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris,
Seite 1 Themengebiet: Thermodynamik Stichwörter, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung, Literatur [1] A. Macdonald and M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris,
TR Transformator. Blockpraktikum Herbst Moritz Stoll, Marcel Schmittfull (Gruppe 2b) 25. Oktober 2007
 TR Transformator Blockpraktikum Herbst 2007 (Gruppe 2b) 25 Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 11 Unbelasteter Transformator 2 12 Belasteter Transformator 3 13 Leistungsanpassung 3 14 Verluste
TR Transformator Blockpraktikum Herbst 2007 (Gruppe 2b) 25 Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 11 Unbelasteter Transformator 2 12 Belasteter Transformator 3 13 Leistungsanpassung 3 14 Verluste
18. Vorlesung III. Elektrizität und Magnetismus
 18. Vorlesung III. Elektrizität und Magnetismus 17. Elektrostatik Zusammenfassung Nachtrag zur Influenz: Faraday-Käfig 18. Elektrischer Strom (in Festkörpern, Flüssigkeiten und Gasen; elektrische Stromkreise)
18. Vorlesung III. Elektrizität und Magnetismus 17. Elektrostatik Zusammenfassung Nachtrag zur Influenz: Faraday-Käfig 18. Elektrischer Strom (in Festkörpern, Flüssigkeiten und Gasen; elektrische Stromkreise)
E7 Elektrolyse. Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch. Münster, den
 E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
Spule, Kondensator und Widerstände
 Spule, Kondensator und Widerstände Schulversuchspraktikum WS 00 / 003 Jetzinger Anamaria Mat.Nr.: 975576 Inhaltsverzeichnis. Vorwissen der Schüler. Lernziele 3. Theoretische Grundlagen 3. Der elektrische
Spule, Kondensator und Widerstände Schulversuchspraktikum WS 00 / 003 Jetzinger Anamaria Mat.Nr.: 975576 Inhaltsverzeichnis. Vorwissen der Schüler. Lernziele 3. Theoretische Grundlagen 3. Der elektrische
Energie und elektrische Ladung, Entropie, Impuls. M. Pohlig WHG-Durmersheim
 ,, M. Pohlig WHG-Durmersheim michael@pohlig.de Vorbemerungen Energiestromstärke P = E t W = J s Karlsruhe Juli 2007 2 P I Zusammenhang P ~ I U = const. Karlsruhe Juli 2007 3 P U Zusammenhang P ~ U I =
,, M. Pohlig WHG-Durmersheim michael@pohlig.de Vorbemerungen Energiestromstärke P = E t W = J s Karlsruhe Juli 2007 2 P I Zusammenhang P ~ I U = const. Karlsruhe Juli 2007 3 P U Zusammenhang P ~ U I =
Inhalt. 1. Erläuterungen zum Versuch 1.1. Aufgabenstellung und physikalischer Hintergrund 1.2. Messmethode und Schaltbild 1.3. Versuchdurchführung
 Versuch Nr. 02: Bestimmung eines Ohmschen Widerstandes nach der Substitutionsmethode Versuchsdurchführung: Donnerstag, 28. Mai 2009 von Sven Köppel / Harald Meixner Protokollant: Harald Meixner Tutor:
Versuch Nr. 02: Bestimmung eines Ohmschen Widerstandes nach der Substitutionsmethode Versuchsdurchführung: Donnerstag, 28. Mai 2009 von Sven Köppel / Harald Meixner Protokollant: Harald Meixner Tutor:
Die elektrische Energie wird durch Ionen transportiert. Ionen sind elektrisch geladene Atome bzw. Elektrolyt
 Galvanische Elemente Galvanische (Galvani ital.physiker) Elemente wandeln chemische in elektrische um. Sie bestehen aus zwei Elektroden (Anode, Kathode) und einer elektrisch leitenden Flüssigkeit, dem
Galvanische Elemente Galvanische (Galvani ital.physiker) Elemente wandeln chemische in elektrische um. Sie bestehen aus zwei Elektroden (Anode, Kathode) und einer elektrisch leitenden Flüssigkeit, dem
Elektrochemie. Grundbegriffe. Oxidation: Ist die Teilreaktion bei der Elektronen abgegeben werden.
 Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden
Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL. WiSe 2015/2016. Versuch 6. Brennstoffzelle. Rami Saoudi (356563) Guido Petri () Gruppe 29
 PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Brennstoffzelle Rami Saoudi (356563) Guido Petri () Gruppe 29 1. EINFÜHRUNG Ziel des Versuchs war es die Funktionsweise einer
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Brennstoffzelle Rami Saoudi (356563) Guido Petri () Gruppe 29 1. EINFÜHRUNG Ziel des Versuchs war es die Funktionsweise einer
Der elektrische Widerstand R. Auswirkung im Stromkreis Definition Ohmsches Gesetz
 Der elektrische Widerstand R Auswirkung im Stromkreis Definition Ohmsches Gesetz Kennlinie Wir wissen, am gleichen Leiter bewirken gleiche Spannungen gleiche Ströme. Wie ändert sich der Strom, wenn man
Der elektrische Widerstand R Auswirkung im Stromkreis Definition Ohmsches Gesetz Kennlinie Wir wissen, am gleichen Leiter bewirken gleiche Spannungen gleiche Ströme. Wie ändert sich der Strom, wenn man
Stefan Reißmann ANORGANISCH-CHEMISCHES TUTORIUM WS 2000/2001
 7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
ELEKTRISCHE SPANNUNGSQUELLEN
 Physikalisches Grundpraktikum I Versuch: (Versuch durchgeführt am 17.10.2000) ELEKTRISCHE SPANNUNGSQUELLEN Denk Adelheid 9955832 Ernst Dana Eva 9955579 Linz, am 22.10.2000 1 I. PHYSIKALISCHE GRUNDLAGEN
Physikalisches Grundpraktikum I Versuch: (Versuch durchgeführt am 17.10.2000) ELEKTRISCHE SPANNUNGSQUELLEN Denk Adelheid 9955832 Ernst Dana Eva 9955579 Linz, am 22.10.2000 1 I. PHYSIKALISCHE GRUNDLAGEN
Übungsblatt: Arbeit oder Energie und Leistung
 Übungsblatt: Arbeit oder Energie und Leistung 1.) Zeichnen Sie das Schema der Messschaltung, mit der Sie die elektrische Leistung eines Gleichstrommotors (24V) mit Hilfe eines Wattmeters messen. 2.) 3
Übungsblatt: Arbeit oder Energie und Leistung 1.) Zeichnen Sie das Schema der Messschaltung, mit der Sie die elektrische Leistung eines Gleichstrommotors (24V) mit Hilfe eines Wattmeters messen. 2.) 3
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2009
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 009 VL #6 am 7.05.009 Vladimir Dyakonov / Volker Drach Leistungsbeträge 00 W menschlicher Grundumsatz
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 009 VL #6 am 7.05.009 Vladimir Dyakonov / Volker Drach Leistungsbeträge 00 W menschlicher Grundumsatz
Galvanoplastik. Elektrochemie B. Lukas Woolley, Rafael Adamek, Peter Krack. 24 Februar ETH Zürich
 Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
ELEXBO A-Car-Engineering
 1 Aufgabe: -Bauen Sie alle Schemas nacheinander auf und beschreiben Ihre Feststellungen. -Beschreiben Sie auch die Unterschiede zum vorherigen Schema. Bauen Sie diese elektrische Schaltung auf und beschreiben
1 Aufgabe: -Bauen Sie alle Schemas nacheinander auf und beschreiben Ihre Feststellungen. -Beschreiben Sie auch die Unterschiede zum vorherigen Schema. Bauen Sie diese elektrische Schaltung auf und beschreiben
AfuTUB-Kurs Das ohmsche Gesetz
 Technik Klasse E 03: Ohmsches, & Amateurfunkgruppe der TU Berlin https://dk0tu.de WiSe 2017/18 SoSe 2018 cbea This work is licensed under the Creative Commons Attribution-NonCommercial-ShareAlike 3.0 License.
Technik Klasse E 03: Ohmsches, & Amateurfunkgruppe der TU Berlin https://dk0tu.de WiSe 2017/18 SoSe 2018 cbea This work is licensed under the Creative Commons Attribution-NonCommercial-ShareAlike 3.0 License.
Strom-Spannungs-Kennlinie und Leistung einer Solarzelle
 Strom-Spannungs-Kennlinie und Leistung einer Solarzelle ENT Schlüsselworte Solarzelle, Kennlinie, Spannung, Stromstärke, Leistung, Widerstand, Innenwiderstand, Anpassung Prinzip Die Strom-Spannungs-Kennlinie
Strom-Spannungs-Kennlinie und Leistung einer Solarzelle ENT Schlüsselworte Solarzelle, Kennlinie, Spannung, Stromstärke, Leistung, Widerstand, Innenwiderstand, Anpassung Prinzip Die Strom-Spannungs-Kennlinie
1.2 Stromkreis Stromquelle Batterie
 1.2 Stromkreis 1 + + + Stromquelle Batterie + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + - - Pluspol: Positiv geladene Atome warten sehnsüchtig auf Elektronen. Minuspol:
1.2 Stromkreis 1 + + + Stromquelle Batterie + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + - - Pluspol: Positiv geladene Atome warten sehnsüchtig auf Elektronen. Minuspol:
Galvanische Zellen aus Nichtmetallen (Artikelnr.: P )
 Lehrer-/Dozentenblatt Galvanische Zellen aus Nichtmetallen (Artikelnr.: P7400900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 10-13 Lehrplanthema: Physikalische Chemie Unterthema:
Lehrer-/Dozentenblatt Galvanische Zellen aus Nichtmetallen (Artikelnr.: P7400900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 10-13 Lehrplanthema: Physikalische Chemie Unterthema:
Wasserstoff als Energieträger Gliederung:
 Wasserstoff als Energieträger Gliederung: Wasserstoff: Energie speichern und verteilen Die Brennstoffzelle Wasserstoff aus der Ptm6 Alge Wasserstoff als Energiespeicher Der umweltfreundliche Akku: Um Wasserstoff
Wasserstoff als Energieträger Gliederung: Wasserstoff: Energie speichern und verteilen Die Brennstoffzelle Wasserstoff aus der Ptm6 Alge Wasserstoff als Energiespeicher Der umweltfreundliche Akku: Um Wasserstoff
Die elektrische Ladung
 Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
-1 (außer in Verbindung mit Sauerstoff: variabel) Sauerstoff -2 (außer in Peroxiden: -1)
 1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
6.3 Stromerzeugung mit galvanischen Zellen. Aufbauprinzip + Kontakte Abdichtung
 6.3 Stromerzeugung mit galvanischen Zellen Aufbauprinzip + Kontakte Abdichtung Elektrolyt Anode Stromkollektor Kathode Behälter Separator (Diaphragma) Anode: Kathode: Elektrolyt: Separator: Oxidation eines
6.3 Stromerzeugung mit galvanischen Zellen Aufbauprinzip + Kontakte Abdichtung Elektrolyt Anode Stromkollektor Kathode Behälter Separator (Diaphragma) Anode: Kathode: Elektrolyt: Separator: Oxidation eines
Inhalt. History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ. Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell.
 Brennstoffzellen Inhalt History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell o Stacks o Anwendung o Fazit History Erste BZ vor
Brennstoffzellen Inhalt History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell o Stacks o Anwendung o Fazit History Erste BZ vor
Grundlagen der Bauelemente. Inhalt. Quellen: Autor:
 Grundlagen der Bauelemente Inhalt 1. Der micro:bit... 2 2. Der Stromkreis... 4 3. Die Bauteile für die Eingabe / Input... 5 4. Die Bauteile für die Ausgabe / Output... 5 5. Der Widerstand... 6 6. Die Leuchtdiode
Grundlagen der Bauelemente Inhalt 1. Der micro:bit... 2 2. Der Stromkreis... 4 3. Die Bauteile für die Eingabe / Input... 5 4. Die Bauteile für die Ausgabe / Output... 5 5. Der Widerstand... 6 6. Die Leuchtdiode
R. Brinkmann Seite
 R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Einführung in die Elektronik Leiter und Nichtleiter. Metallische Leiter und Nichtleiter. Alle Werkstoffe, die in der Elektrotechnik verwendet werden
R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Einführung in die Elektronik Leiter und Nichtleiter. Metallische Leiter und Nichtleiter. Alle Werkstoffe, die in der Elektrotechnik verwendet werden
Spannungsquellen. Grundpraktikum I. Mittendorfer Stephan Matr. Nr Übungsdatum: Abgabetermin:
 Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Schulversuchspraktikum. Name Annika Münch. Sommersemester Klassenstufen 11 / 12. Batterie und Akkus. Kurzprotokoll
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 11 / 12 Batterie und Akkus Kurzprotokoll Auf einen Blick: In diesem Protokoll sind noch weitere Experimente zum Thema Batterie
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 11 / 12 Batterie und Akkus Kurzprotokoll Auf einen Blick: In diesem Protokoll sind noch weitere Experimente zum Thema Batterie
Abiturprüfung Physik, Grundkurs
 Seite 1 von 6 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Entladung eines Kondensators In dieser Aufgabe geht es um die Entladung eines Kondensators. Im ersten Teil (Teilaufgabe 1)
Seite 1 von 6 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Entladung eines Kondensators In dieser Aufgabe geht es um die Entladung eines Kondensators. Im ersten Teil (Teilaufgabe 1)
Bedienungsanleitung. T126 TutorialBasic
 Bedienungsanleitung T126 TutorialBasic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: info@h-tec-education.com Website: www.h-tec-education.com
Bedienungsanleitung T126 TutorialBasic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: info@h-tec-education.com Website: www.h-tec-education.com
Serie 180, Musterlösung
 Brückenkurs Physik donat.adams@fhnw.ch www.adams-science.org Serie 180, Musterlösung Brückenkurs Physik Datum: 10. September 2018 1. Coulombgesetz HGEZP2 Berechnen Sie die Kräfte (a) Q 1 = 25 µc und Q
Brückenkurs Physik donat.adams@fhnw.ch www.adams-science.org Serie 180, Musterlösung Brückenkurs Physik Datum: 10. September 2018 1. Coulombgesetz HGEZP2 Berechnen Sie die Kräfte (a) Q 1 = 25 µc und Q
Energiespeichersysteme
 Speichersysteme - A-1 Energiespeichersysteme 1. Wasserstofftechnologie a) Gewinnung von Wasserstoff b) Sicherheitsproblematik c) Speicherung, Systemlösungen 2. Konventionelle Blockheizkraftwerke - Kraft-Wärme-(Kälte-)Kopplung
Speichersysteme - A-1 Energiespeichersysteme 1. Wasserstofftechnologie a) Gewinnung von Wasserstoff b) Sicherheitsproblematik c) Speicherung, Systemlösungen 2. Konventionelle Blockheizkraftwerke - Kraft-Wärme-(Kälte-)Kopplung
Grundpraktikum Physikalische Chemie
 Grundpraktikum Physikalische Chemie Versuch 10: Elektrische Leitfähigkeit von Elektrolyten überarbeitet: Tobias Staut, 2014.07 Inhaltsverzeichnis 1 Vorbereitung und Eingangskolloquium 3 2 Messung der Überführungszahlen
Grundpraktikum Physikalische Chemie Versuch 10: Elektrische Leitfähigkeit von Elektrolyten überarbeitet: Tobias Staut, 2014.07 Inhaltsverzeichnis 1 Vorbereitung und Eingangskolloquium 3 2 Messung der Überführungszahlen
Grundlagen der Elektrotechnik LF-2
 Grundbildung IT-Systemelektroniker Grundlagen der Elektrotechnik LF-2 Mitschriften der Ausbildung Jörg Schumann 13. Februar 2016 Inhaltsverzeichnis Inhaltsverzeichnis 1 Ladungsträger 3 2 elektrische Spannung
Grundbildung IT-Systemelektroniker Grundlagen der Elektrotechnik LF-2 Mitschriften der Ausbildung Jörg Schumann 13. Februar 2016 Inhaltsverzeichnis Inhaltsverzeichnis 1 Ladungsträger 3 2 elektrische Spannung
Energiediagramme! Energie strömt nicht alleine, sie braucht immer einen Träger. Beispiele: 1) Glühlampe
 Kompetenztage 7 diagramme! strömt nicht alleine, sie braucht immer einen Träger. umwandler träger sind zum Beispiel: Benzin, Nahrungsmittel für chemische, r Strom für diagramm Licht für Lichtenergie fließende
Kompetenztage 7 diagramme! strömt nicht alleine, sie braucht immer einen Träger. umwandler träger sind zum Beispiel: Benzin, Nahrungsmittel für chemische, r Strom für diagramm Licht für Lichtenergie fließende
Kapitel 2 Repetitionen Chemie und Werkstoffkunde. Thema 6 Oxidation und Reduktion
 BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
Wind-Wasserstoff-Anlage
 Wind-Wasserstoff-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Brennstoffzelle, Windkraftanlage, Wasserstoff, Energieumwandlung Prinzip Windenergie kann mit Hilfe eines Windgenerators
Wind-Wasserstoff-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Brennstoffzelle, Windkraftanlage, Wasserstoff, Energieumwandlung Prinzip Windenergie kann mit Hilfe eines Windgenerators
Übungsaufgaben Elektrotechnik
 Flugzeug- Elektrik und Elektronik Prof. Dr. Ing. Günter Schmitz Aufgabe 1 Übungsaufgaben Elektrotechnik Gegeben sei eine Zusammenschaltung einiger Widerstände gemäß Bild. Bestimmen Sie den Gesamtwiderstand
Flugzeug- Elektrik und Elektronik Prof. Dr. Ing. Günter Schmitz Aufgabe 1 Übungsaufgaben Elektrotechnik Gegeben sei eine Zusammenschaltung einiger Widerstände gemäß Bild. Bestimmen Sie den Gesamtwiderstand
AFu-Kurs nach DJ4UF. Technik Klasse E 03 Ohmsches Gesetz, Leistung & Arbeit. Amateurfunkgruppe der TU Berlin. Stand
 Technik Klasse E 03 Ohmsches, & Amateurfunkgruppe der TU Berlin http://www.dk0tu.de Stand 27.10.2015 This work is licensed under the Creative Commons Attribution-ShareAlike 3.0 License. Amateurfunkgruppe
Technik Klasse E 03 Ohmsches, & Amateurfunkgruppe der TU Berlin http://www.dk0tu.de Stand 27.10.2015 This work is licensed under the Creative Commons Attribution-ShareAlike 3.0 License. Amateurfunkgruppe
Power, der die Puste nie ausgeht!
 Fuel Cells Die Brennstoffzelle im Westerwald-Treff Power, der die Puste nie ausgeht! Die Brennstoffzelle im Westerwald-Treff Die Projektpartner Das Brennstoffzellen-Projekt im Hotelpark Westerwald-Treff
Fuel Cells Die Brennstoffzelle im Westerwald-Treff Power, der die Puste nie ausgeht! Die Brennstoffzelle im Westerwald-Treff Die Projektpartner Das Brennstoffzellen-Projekt im Hotelpark Westerwald-Treff
Dielektrizitätskonstante
 Dielektrizitätskonstante Spannung am geladenen Plattenkondensator sinkt, wenn nichtleitendes Dielektrikum eingeschoben wird Ladung bleibt konstant : Q = C 0 U 0 = C D U D Q + + + + + + + + + + + - - -
Dielektrizitätskonstante Spannung am geladenen Plattenkondensator sinkt, wenn nichtleitendes Dielektrikum eingeschoben wird Ladung bleibt konstant : Q = C 0 U 0 = C D U D Q + + + + + + + + + + + - - -
PEM-Elektrolyseur Betriebsanleitung
 R PEM-Elektrolyseur Betriebsanleitung 2 1 3 5 4 Fig. 1: PEM-Elektrolyseur 1 ZWECK UND BESCHREIBUNG Bei einem PEM-Elektrolyseur besteht der Elektrolyt aus einer protonenleitfähigen Membran und Wasser (PEM
R PEM-Elektrolyseur Betriebsanleitung 2 1 3 5 4 Fig. 1: PEM-Elektrolyseur 1 ZWECK UND BESCHREIBUNG Bei einem PEM-Elektrolyseur besteht der Elektrolyt aus einer protonenleitfähigen Membran und Wasser (PEM
Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2
 Werner-v.-Siemens-Labor für elektrische Antriebssysteme Prof. Dr.-Ing. Dr. h.c. H. Biechl Prof. Dr.-Ing. E.-P. Meyer Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2 Spannungsteiler Ersatzspannungsquelle
Werner-v.-Siemens-Labor für elektrische Antriebssysteme Prof. Dr.-Ing. Dr. h.c. H. Biechl Prof. Dr.-Ing. E.-P. Meyer Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2 Spannungsteiler Ersatzspannungsquelle
