Brenstoffzelle (BRZ)
|
|
|
- Susanne Buchholz
- vor 7 Jahren
- Abrufe
Transkript
1 Seite 1 Themengebiet: Thermodynamik 1 Literatur A. Macdonald, M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris, Berlin, 2007 A.J. Bard, L.R. Faulkner, Electrochemical Methods Fundamentals and Applications, Wiley, New York, 2001 C.H. Hamann, W. Vielstich, Elektrochemie, Wiley-VCH, Weinheim, 1998 K. Kordesch, G. Simader, Fuel Cells and Their Applications, VCH, Weinheim, 1996 A.F. Hollemann, E. Wiberg, Lehrbuch der Anorganischen Chemie, degruyter, Berlin, 1995 G. Wedler, Lehrbuch der physikalischen Chemie, VCH, Weinheim, Grundlagen 2.1 PEM-Brennstoffzellen In einer Brennstoffzelle wird chemische Energie, die im Brennstoff und im Oxidationsmittel gespeichert ist, in elektrische Energie umgewandelt. Man spricht hierbei von einer elektrochemischen Reaktionen. Eine Brennstoffzelle besteht aus einer Anode, an der der Brennstoff zuströmt und einer Kathode, an der das Oxidationsmittel zuströmt. Diese beiden Elektroden bestehen aus porösem Kohlenstoffgewebe, das mit sehr fein verteiltem Platin als Katalysator beschichtet sind. Die beiden Elektroden sind durch einen Polymerelektrolytmembran getrennt, die die beiden Gase, H 2 und O 2, voneinander trennt, jedoch für Protonen durchlässig ist (PEM = proton exchange membrane). An den Außenseiten der Elektroden liegen Gasflussplatten, die dafür sorgen, dass die Gase über die gesamte Elektrodenfläche verteilt werden. Gleichzeitig wird das entstehende Wasser darüber abgeführt. In Abbildung 1 ist der Aufbau und die Funktionsweise der Brennstoffzelle zusammengefasst. Abbildung 1: Aufbau einer PEM-Brennstoffzelle
2 Seite Chemische Reaktion Die eigentliche chemische Reaktion findet an der Drei-Phasen-Grenze zwischen Gas, Wasser und Katalysator statt. An dieser Grenzfläche adsorbieren die Gase am Katalysator, werden ionisiert und diffundieren dann weg. An der Anode erfolgt die Oxidation des H 2, wobei Elektronen freigesetzt werden wobei Elektronen freigesetzt werden. H 2 2H + + 2e, (1) Die Reduktion des O 2 erfolgt an der Kathode, wozu Elektronen benötigt werden Beide Reaktionen laufen freiwillig ab. Bei der Gesamtreaktion O 2 + 4e 2O 2. (2) O 2 + 2H 2 2O 2 + 4H + (3) wird Energie frei - sie ist exotherm. Ist der Stromkreis geschlossen, fließt ein Strom, ist er nicht geschlossen, baut sich zwischen den Elektroden ein Potential auf. Die bei der Oxidation entstehenden Protonen H + können durch die Membran diffundieren und verbinden sich an der anderen Elektrode mit den dort entstehenden Sauerstoffionen O 2 zum Reaktionsendprodukt Wasser H 2 O. Hier muss für eine kontinuierliche Abführung des Wassers gesorgt werden, damit die Zelle nicht überflutet wird. Im Experiment müssen die Zellen daher wiederholt mit den Gasen gespült werden! Katalysator Die Reaktion in der Brennstoffzelle läuft zwar freiwillig, aber nicht sehr schnell ab. Ein positiver Katalysator beschleunigt die Reaktionsgeschwindigkeit, durch Erniedrigung der benötigten Aktivierungsenergie. Katalysatoren nehmen an einer chemischen Reaktion teil, werden aber nicht verbraucht. 2.2 Der Elektrolyseur Der Elektrolyseur dient zur Erzeugung der benötigten Gase (H 2 und O 2 ) aus Wasser. Seine Funktionsweise entspricht fast genau der einer Brennstoffzelle, allerdings laufen die Vorgänge umgekehrt ab. Legt man an den Elektrolyseur eine Spannung an, wird an der Anode Wasser aufgespalten An der Kathode entsteht Wasserstoff 2H 2 O(l) O 2 (g) + 4H + + 4e. (4) 2H + + 2e H 2 (g), (5) wobei die Protonen durch die Membran von der Anode zur Kathode wandern. Die Gesamtreaktion ist endotherm, es muss also Energie zugeführt werden. 2H 2 O(l) 2H 2 (g) + O 2 (g) (6)
3 Seite 3 U E 0 U 0 elektro kinetischer Bereich ohmscher Bereich diffusions kontrollierter Bereich I grenz I Abbildung 2: Typische Kennlinie einer Brennstoffzelle. Es können drei Bereiche unterscheiden werden: Elektrokinetischer Bereich, Ohmscher Bereich und der Bereich mit Diffusionseinfluss. 2.3 Kennlinie einer Brennstoffzelle Eine ideale elektrochemische Zelle verhält sich wie eine Konstantspannungsquelle. Die theoretisch mögliche Spannung bei der idealen Wasserstoff-Brennstoffzelle beträgt U theo = 1,23 V, was auch die Mindestspannung für die Elektrolyse von Wasser ist. Um die Abweichungen der Zelle vom idealen Verhalten zu charakterisieren wird die Abhängigkeit der Zellspannung U vom Zellstrom I, die Kennlinie der Brennstoffzelle, betrachtet (siehe Abbildung 2). Die Differenz zwischen der theoretisch möglichen Spannung E 0 und der tatsächlichen Zellspannung wird Überspannung genannt. Dazu tragen verschiedene Faktoren bei, die in den verschiedenen Bereichen der Kennlinie deutlich erkennbar sind. Der Wirkungsbereich der einzelnen Faktoren reicht jedoch über diese Bereiche hinaus Durchtritts-Überspannung Der Bereich kleiner Zellströme wird elektrokinetischer Bereich genannt. Hier ist die Kennlinie durch katalytische Prozesse an den Elektroden bestimmt. Der Hauptfaktor ist die Geschwindigkeit der katalytischen Umwandlung der Gase, die der Geschwindigkeit entspricht, mit der die Elektronen die Kontaktfläche zwischen den Gasmolekülen und dem Platinkatalysator überqueren. Charakteristisch für diese (Ladungs-)Durchtrittsüberspannung η Durch ist der schnelle Abfall der Spannung (Anstieg der Überspannung) bei kleinem Strom. In Abschnitt 2.4 wird dieser elektrokinetische Bereich näher erläutert Ohmsche Überspannung Jede Zelle hat einen inneren Widerstand R in, der z.b. durch den Widerstand gegen den Stromfluss im Elektrolyten verursacht wird. Die Spannung nimmt linear mit dem Strom ab, entsprechend steigt die ohmsche Überspannung η Ohm mit dem Strom gemäß η Ohm = R in I. (7)
4 Seite Diffussionsüberspannung Bei hohen Strömen wird die Diffusion der Gase durch die porösen Elektroden zum Katalysator und zum Elektrolyten der bestimmende Faktor. Wenn sie durch die elektrochemische Reaktion am Katalysator schneller Verbraucht werden, als sie durch Diffusion dorthin gelangen können, tritt eine Diffussionsüberspannung η Diff auf. Dies äußert sich in einem plötzlichen Abknicken der Kennlinie nach unten. Die Spannung nimmt mit steigendem Strom stark ab. Bei Erreichen des Grenzstroms I grenz sinkt die Spannung auf Null ab Gesamtsystem Zusammenfassend kann das Brennstoffzellensystem mit den Gleichungen U = E 0 η Durch η Ohm η Diff (8) ( ) RT I = E 0 (1 α)z F ln R in I η Diff J beschrieben werden, wobei R = 8, mol K die allgemeine Gaskonstante, T die absolute Temperatur, F = C mol die Faradaykonstante und z die Anzahl der durchtretenden Elektronen bedeutet. Es ist verständlich, dass der Einfluss von η Diff bei kleinen Strömen noch keine Rolle spielt, da an der Elektrode mehr Gas angeboten wird, als verbraucht werden kann. η Ohm spielt im gesamten Bereich eine Rolle. Der Term für η Durch ändert sich bei kleinen Strömen stark, und wird für große Ströme konstant. Er wird im folgenden Abschnitt genauer erklärt. I Durchtrittsüberspannung Die Durchtrittsüberspannung η Durch einer Elektrode beruht auf der endlichen Geschwindigkeit des Ladungsdurchtritts der Elektronen durch die Phasengrenze Elektrode/Elektrolyt. Die Durchtrittsgeschwindigkeit hängt von den an der Durchtrittsreaktion beteiligten Spezies, vom Elektrolyten und vom Katalysator ab. Zwischen dem Strom I und der Durchtrittsüberspannung η Durch besteht ein Zusammenhang, der durch die Butler-Volmer-Gleichung ( ) ( )] α z F ηdurch (1 α)z F ηdurch I = I 0 [exp exp (9) RT RT beschrieben wird. Der Durchtrittsfaktor α liegt zwischen 0 und 1 und gibt den Anteil von η Durch an, der für die Aktivierungsenergie der anodische Oxidation benötigt wird. Der Anteil der Aktivierungsenergie der kathodischen Reduktion entspricht 1 α. Der Austauschstrom I 0 beschreibt die Größe des Stoffaustausches durch anodische und kathodische Reaktion am Gleichgewichtspotential (dynamisches Gleichgewicht). Auch wenn kein Strom fließt kommt es an den Elektroden zum Durchtritt von Elektronen in die Lösung und zurück. Anodische Ströme I an und kathodische Ströme I kat sind betragsmäßig gleich und heben sich auf. Unterscheiden sich I an und I kat im Betrag, so fließt ein Strom, zum Beispiel auf Grund einer ablaufenden Reaktion oder einer angelegten Spannung. Für ausreichend große Überspannung kann man in der Butler-Volmer-Gleichung (9) jeweils eine Reaktion vernachlässigen und gelangt zu den einfacheren Gleichungen für die Oxidation ( ) α z F ηdurch I = I 0 exp (10) RT
5 Seite 5 und für die Reduktion ( ) (1 α)z F ηdurch I = I 0 exp. (11) RT Nach Vorzeichenkonvention werden anodische Ströme (Oxidation) mit einem positiven und kathodische Ströme (Reduktion) mit einem negativen Vorzeichen versehen. Von den beiden ablaufenden Reaktionen ist die Reduktion von O 2 (Gleichung (2)) die langsamere. Sie bestimmt damit die Geschwindigkeit und das Verhalten im elektrokinetischen Bereich. Aus Gleichung (11) ergibt sich die Tafelgleichung für die Durchtrittsüberspannung η Durch = ( RT I (1 α)z F ln I 0 ). (12) Daraus können mit Hilfe von experimentellen Daten die Parameter α und I 0 bestimmt werden. 2.5 Wirkungsgrad Der Wirkungsgrad ist ein Maß für das Verhältnis von Nutzen zu Aufwand. In diesem Versuch werden drei verschiedene Wirkungsgrade betrachtet Faraday-Wirkungsgrad Der Faraday-Wirkungsgrad ε F ist das Verhältnis aus dem experimentell bestimmten, pro Zeit umgesetzten Wasserstoffvolumen, zum theoretisch erwarteten Wasserstoffvolumen, das man über die Anzahl der Ladungen errechnet. Bei einem elektrischen Strom I ergibt sich in der Zeit t ein Volumen von mit dem molaren Gasvolumen V m bei Laborbedingungen. V H2,theo = I t V m z F, (13) Für den Elektrolyseur ist dabei das experimentell gemessene Volumen das Nutzvolumen, der Stromfluss ist der Aufwand, es gilt also ε F,Elektrolyseur = V H 2,exp. (14) V H2,theo Bei der Brennstoffzelle wird das gemessene Volumen verbraucht, der Strom wird genutzt, es ist laso ε F,BRZ = V H 2,theo. (15) V H2,exp Ein Faraday-Wirkungsgrad deutlich kleiner als 100% deutet auf Nebenreaktionen (z.b. Korrosion) im System hin Energiewirkungsgrad Beim Energiewirkungsgrad ε E setzt man den Energieinhalt des umgesetzten Gases mit der gewonnenen bzw. eingesetzten elektrischen Energie W = U I t ins Verhältnis. Der chemische Energiegehalt von H 2 beträgt dabei H 0 = 286 kj mol. Diese Energie wird bei der Verbrennung frei und muss entsprechend bei der Elektrolyse aufgebracht werden.
6 Seite Wirkungsgrad des experimentellen Aufbaus Der Wirkungsgrad ε Aufbau bezieht sich auf den gesamten Versuch. Die an der Brennstoffzelle abgegebene Arbeit W BRZ wird zu der im Elektrolyseur aufgewendeten elektrischen Arbeit W Elektrolyseur ins Verhältnis gesetzt: ε Aufbau = = W BRZ (16) W Elektrolyseur U BRZ I BRZ t U Elektrolyseur I Elektrolyseur t 3 Versuchsdurchführung Aufgabe 1: Bestimmung der Leckrate Erzeugen Sie mit dem Elektrolyseur, bei geschlossenen Klemmen, einen Gasvorrat von etwa 30 ml. Trennen Sie alle elektrischen Verbindungen und messen Sie den Füllstand des Wasserreservoirs über 10 Minuten in sinnvollen Zeitabständen. Schätzen Sie die Unsicherheiten ihrer Messung ab. Aufgabe 2: Charakterisierung des Elektrolyseurs Nehmen Sie die Werte auf, die benötigt werden um ein U-I-Diagramm des Elektrolyseurs zu erstellen. Variieren Sie den Strom in 0,1 A Schritten. Bestimmen Sie die Spannung, bei der der Stromfluss einsetzt (U(I 0)) möglichst genau. Achtung! Der Strom darf 1,5 A nicht überschreiten! Aufgabe 3: Der Wirkungsgrad des Elektrolyseurs Stellen Sie einen Strom von ungefähr 1 A am Elektrolyseur ein und bestimmen Sie die zugehörige Spannung. Messen Sie bei geschlossenen Klemmen jede Minute den Füllstand des Wasserstoffreservoirs über 6 Minuten. Bestimmen Sie die Gaserzeugungsrate. Aufgabe 4: Spülen Sie zur Vorbereitung der nächsten Versuche die Zelle 2 mal. Erzeugen Sie hierzu jeweils etwa 40 ml H 2 und 20 ml O 2. Öffnen Sie dann beide Schlauchklemmen, so dass das Gas surch die Brennstoffzellen strömt. Wiederholen Sie diesen Vorgang vor jeder Messung. Sollte während der folgenden Aufgaben der Strom zusammenbrechen, so befindet sich Wasser in der Leitung und die Zelle muss erneut gespült werden. Aufgabe 5: Der Wirkungsgrad der Brennstoffzelle Verbinden Sie die beiden Brennstoffzellen zu einer Parallelschaltung (siehe Abbildung 3). Der Lastwiderstand wird zunächst offen gelassen. Erzeugen Sie einen Gasvorrat von mindestens 40 ml und trennen Sie die Stromversorgung vom Elektrolyseur. Messen sie bei einem Lastwiderstand von 0,3 Ω oder 0,5 Ω die Zeit, die benötigt wird um ein Gasvolumen vom 30 ml zu verbrauchen. Notieren Sie in sinnvollen Zeitintervallen auch Spannung und Strom der Brennstoffzellen. Aufgabe 6: Kennlinie der Brennstoffzelle in Parallelschaltung Betreiben Sie die Brennstoffzelle in Parallelschaltung. Erzeugen Sie bei offenem Lastwiderstand ein ausreichendes Gasvolumen. Messen Sie für alle eingebauten Lastwiderstände den Strom und die Spannung an der
7 Seite 7 O 2 H 2 Kathoden Anoden V V Anode Kathode V R L R L A A A a) b) c) Abbildung 3: Schaltplan: a) Elektrolyseur, b) Reihenschaltung, c) Parallelschaltung. Brennstoffzelle. Es wird empfohlen mit dem größten Widerstand zu beginnen. Beachten Sie, dass die Werte sich erst nach ungefähr 30 Sekunden stabilisieren. Führen Sie drei Messreihen durch und bestimmen Sie ihre Unsicherheiten Aufgabe 7: Kennlinie der Brennstoffzelle in Reihenschaltung Wiederholen Sie die Vorgehensweise für die Reihenschaltung der Brennstoffzellen. 4 Auswertung Aufgabe 8: Bestimmung der Leckrate Tragen Sie den Gasvorrat gegen die Zeit graphisch auf und bestimmen Sie über eine Ausgleichsgerade die Leckrate. Achten Sie auf die korrekte Handhabung der Unsicherheiten. Aufgabe 9: Charakterisierung des Elektrolyseurs Tragen Sie die Spannung des Elektrolyseurs gegen den Strom graphisch auf und diskutieren Sie die Kennlinie. Aufgabe 10: Der Wirkungsgrad des Elektrolyseurs Bestimmen Sie analog zur Leckrate die Gaserzeugungsrate. Korrigieren Sie ihr Ergebnis um die Leckrate (auf richtiges Vorzeichen achten) und bestimmen Sie die beiden Wirkungsgrade ε E und ε F und die Unsicherheiten. Diskutieren Sie ihr Ergebnis und untersuchen Sie welche Auswirkung der Strom am Elektrolyseur auf den Wirkungsgrad hat. Aufgabe 11: Der Wirkungsgrad der Brennstoffzelle Bestimmen Sie graphisch die Wasserstoff-Verbrauchsrate. Korrigieren Sie auch hier das Ergebnis um die Leckrate und bestimmen Sie die beiden Wirkungsgrade ε E und ε F mit Unsicherheiten. Diskutieren Sie ihr Ergebnis! Aufgabe 12: Kennlinie der Brennstoffzelle Da das System aus zwei Brennstoffzellen besteht, müssen Sie Ihre Messdaten auf eine Zelle zurückrechnen. Nehmen Sie dabei an, dass diese vollkommen identisch sind. Tragen Sie die Spannung über dem Strom auf (Kennlinie).
8 Seite 8 Bestimmen Sie nun aus dem ohmschen Bereich der Kennlinie den Innenwiderstand der Brennstoffzelle mit Hilfe einer Ausgleichsgeraden. Überprüfen Sie, ob die Werte der Parallelschaltung und die Werte der Reihenschaltung innerhalb der Unsicherheiten übereinstimmen. Aufgabe 13: Charakterisierung der Elektrochemischen Zelle Ermitteln Sie aus dem elektrokinetischen Bereich der Kennlinie den Durchtrittsfaktor α und die Austauschstromstärke I 0. Verwenden Sie hierfür eine sinnvolle Auftragung der Durchtittsüberspannung η Durch über den Strom I. Vergleichen Sie die Werte für Parallel- und Reihenschaltung. Hierfür ist Gleichung (12) sehr nützlich.
Themengebiet: Thermodynamik. Brennstoffzelle, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung,
 Seite 1 Themengebiet: Thermodynamik Stichwörter, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung, Literatur [1] A. Macdonald and M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris,
Seite 1 Themengebiet: Thermodynamik Stichwörter, Wirkungsgrad, Durchtrittsüberspannung, Diffusionsüberspannung, Literatur [1] A. Macdonald and M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris,
Brennstoffzelle. Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes. Schüler-Skript und Versuchsanleitung
 Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in. Reihenschaltung/Parallelschaltung
 TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Physikalisches Anfaengerpraktikum. Brennstoffzelle
 Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 1 Kennlinie des Elektrolyseurs Versuchszweck Beim
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 1 Kennlinie des Elektrolyseurs Versuchszweck Beim
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
Elektrizität. = C J m. Das Coulomb Potential φ ist dabei:
 Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E5: Faraday-Konstante
 E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN
 10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle
 Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
HappyEvening am Brennstoffzellen zur mobilen Energiebereitstellung
 HappyEvening am 15.10.2008 Brennstoffzellen zur mobilen Energiebereitstellung T. Pröll 15.10.2008 Inhalt Grundlagen Zelltypen und Anwendungen PEM-Brennstoffzelle (Prinzip) Direkt-Methanol-Brennstoffzelle
HappyEvening am 15.10.2008 Brennstoffzellen zur mobilen Energiebereitstellung T. Pröll 15.10.2008 Inhalt Grundlagen Zelltypen und Anwendungen PEM-Brennstoffzelle (Prinzip) Direkt-Methanol-Brennstoffzelle
Die Wirkungsweise einer Brennstoffzelle. Ein Vortrag von Bernard Brickwedde
 Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
1.) Skizzierieren Sie den Aufbau einer PEM Brennstoffzelle und erläutern Sie deren Funktionsweise.
 E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
Technische Universität München. Brennstoffzelle. Roland Fuchsberger
 Brennstoffzelle Roland Fuchsberger Inhalt Elektrochemische Grundlagen Elektrochemische Zelle Faradaysches Gesetz Nernstsche Gleichung Brennstoffzelle Geschichte Verschiedene Typen Marktanalyse Portabel
Brennstoffzelle Roland Fuchsberger Inhalt Elektrochemische Grundlagen Elektrochemische Zelle Faradaysches Gesetz Nernstsche Gleichung Brennstoffzelle Geschichte Verschiedene Typen Marktanalyse Portabel
Galvanoplastik. Elektrochemie B. Lukas Woolley, Rafael Adamek, Peter Krack. 24 Februar ETH Zürich
 Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
Was ist Elektrochemie? Elektrochemie. Elektrochemie ist die Lehre von der Beziehung
 Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Kennlinie der Methanol- Brennstoffzelle
 E m1 Kennlinie der Methanol- Brennstoffzelle Material: Methanol-Brennstoffzelle Flasche mit 1M Methanol-Lösung Spritztülle Verbraucher-Messbox 4 Kabel Verschlussstopfen Tank Zusätzliche Komponenten: Methanol
E m1 Kennlinie der Methanol- Brennstoffzelle Material: Methanol-Brennstoffzelle Flasche mit 1M Methanol-Lösung Spritztülle Verbraucher-Messbox 4 Kabel Verschlussstopfen Tank Zusätzliche Komponenten: Methanol
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle. Inhaltsfeld: Elektrochemie
 Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Stefan Reißmann ANORGANISCH-CHEMISCHES TUTORIUM WS 2000/2001
 7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
E 3 Brennstoffzelle. 1 Aufgabenstellung
 E 3 Brennstoffzelle 1 Aufgabenstellung 1.1 Ermitteln Sie den Wirkungsgrad eines Elektrolyseurs. 1. Nehmen Sie die Strom-Spannungs-Kennlinie eines Brennstoffzellensystems auf und erläutern Sie den erhaltenen
E 3 Brennstoffzelle 1 Aufgabenstellung 1.1 Ermitteln Sie den Wirkungsgrad eines Elektrolyseurs. 1. Nehmen Sie die Strom-Spannungs-Kennlinie eines Brennstoffzellensystems auf und erläutern Sie den erhaltenen
Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle
 E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
Protokoll zu. Versuch 17: Elektrochemische Zellen
 Physikalisch-Chemisches Praktikum 1 26.04.2004 Daniel Meyer / Abdullah Atamer Protokoll zu Versuch 17: Elektrochemische Zellen 1. Versuchsziel Es sollen die EMK verschiedener Zellen mit Elektroden 1. Art
Physikalisch-Chemisches Praktikum 1 26.04.2004 Daniel Meyer / Abdullah Atamer Protokoll zu Versuch 17: Elektrochemische Zellen 1. Versuchsziel Es sollen die EMK verschiedener Zellen mit Elektroden 1. Art
Physik für die Sekundarstufe II. Wasserstoff. Energie für morgen. Averil Macdonald. heliocentris
 Physik für die Sekundarstufe II Wasserstoff Energie für morgen Averil Macdonald heliocentris Inhalt Teil 1 Vorbereitete experimentelle Lektionen mit Lehrerinformationen zur Vermittlung von Rahmenplaninhalten
Physik für die Sekundarstufe II Wasserstoff Energie für morgen Averil Macdonald heliocentris Inhalt Teil 1 Vorbereitete experimentelle Lektionen mit Lehrerinformationen zur Vermittlung von Rahmenplaninhalten
Praktikum Physikalische Chemie I 26. November Zersetzungsspannung. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Korrosion und Korrosionsschutz
 Korrosion und Korrosionsschutz Von Tobias Reichelt und Birte Schwan Teil A I. Einleitung II. Thermodynamik III. Kinetik Teil B I. Korrosionsarten (atmosphärischer Korrosion) II. Vermeidungsstrategien III.
Korrosion und Korrosionsschutz Von Tobias Reichelt und Birte Schwan Teil A I. Einleitung II. Thermodynamik III. Kinetik Teil B I. Korrosionsarten (atmosphärischer Korrosion) II. Vermeidungsstrategien III.
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Modul: Allgemeine Chemie 8. Wichtige Reaktionstypen Säure Base Reaktionen Konzepte, Gleichgewichtskonstanten Säure-Base Titrationen; Indikatoren Pufferlösungen Redoxreaktionen Oxidationszahlen, Redoxgleichungen
Vorlesung 3: Elektrodynamik
 Vorlesung 3: Elektrodynamik, georg.steinbrueck@desy.de Folien/Material zur Vorlesung auf: www.desy.de/~steinbru/physikzahnmed georg.steinbrueck@desy.de 1 WS 2015/16 Der elektrische Strom Elektrodynamik:
Vorlesung 3: Elektrodynamik, georg.steinbrueck@desy.de Folien/Material zur Vorlesung auf: www.desy.de/~steinbru/physikzahnmed georg.steinbrueck@desy.de 1 WS 2015/16 Der elektrische Strom Elektrodynamik:
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2009
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 009 VL #6 am 7.05.009 Vladimir Dyakonov / Volker Drach Leistungsbeträge 00 W menschlicher Grundumsatz
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 009 VL #6 am 7.05.009 Vladimir Dyakonov / Volker Drach Leistungsbeträge 00 W menschlicher Grundumsatz
Elektrochemische Kinetik. FU Berlin Constanze Donner / Ludwig Pohlmann 2010 1
 Elektrochemische Kinetik FU Berlin Constanze Donner / Ludwig Pohlmann 2010 1 FU Berlin Constanze Donner / Ludwig Pohlmann 2010 2 Elektrochemische Kinetik Was war: Die NernstGleichung beschreibt das thermodynamische
Elektrochemische Kinetik FU Berlin Constanze Donner / Ludwig Pohlmann 2010 1 FU Berlin Constanze Donner / Ludwig Pohlmann 2010 2 Elektrochemische Kinetik Was war: Die NernstGleichung beschreibt das thermodynamische
Erich Tag Elektrochemie
 STUDIENBÜCHER CHEMIE Erich Tag Elektrochemie Eine Einführung in die Theorie elektrochemischer Gleichgewichte und elektrochemischer Prozesse Herausgegeben von W. Botsch, E. Höfling und J. Mauch VERLAG MORITZ
STUDIENBÜCHER CHEMIE Erich Tag Elektrochemie Eine Einführung in die Theorie elektrochemischer Gleichgewichte und elektrochemischer Prozesse Herausgegeben von W. Botsch, E. Höfling und J. Mauch VERLAG MORITZ
Dynamik des lokalen Strom/Spannungsverhaltens von Nafion-Membranen
 Dynamik des lokalen Strom/Spannungsverhaltens von Nafion-Membranen Präsentation der Ergebnisse der Aversumsprojekte 2009 Steffen ink a Wolfgang G. Bessler, b A. Masroor, b Emil Roduner a a Universität
Dynamik des lokalen Strom/Spannungsverhaltens von Nafion-Membranen Präsentation der Ergebnisse der Aversumsprojekte 2009 Steffen ink a Wolfgang G. Bessler, b A. Masroor, b Emil Roduner a a Universität
Fragen zum Versuch Kinetik:
 Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Physik 4 Praktikum Auswertung PVM
 Physik 4 Praktikum Auswertung PVM Von J.W, I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Solarzelle......... 2 2.2. PV-Modul......... 2 2.3. Schaltzeichen........ 2 2.4. Zu ermittelnde
Physik 4 Praktikum Auswertung PVM Von J.W, I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Solarzelle......... 2 2.2. PV-Modul......... 2 2.3. Schaltzeichen........ 2 2.4. Zu ermittelnde
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073
 Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
EinFaCh 1. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie.
 Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung
 Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
ELEKTROCHEMIE. Elektrischer Strom: Fluß von elektrischer Ladung. elektrolytische (Ionen) Zwei Haupthemen der Elektrochemie.
 ELEKTROCHEMIE Elektrischer Strom: Fluß von elektrischer Ladung Elektrische Leitung: metallische (Elektronen) elektrolytische (Ionen) Zwei Haupthemen der Elektrochemie Galvanische Zellen Elektrolyse Die
ELEKTROCHEMIE Elektrischer Strom: Fluß von elektrischer Ladung Elektrische Leitung: metallische (Elektronen) elektrolytische (Ionen) Zwei Haupthemen der Elektrochemie Galvanische Zellen Elektrolyse Die
Aufgabe 5 1 (L) Die folgende Redox-Reaktion läuft in der angegebenen Richtung spontan ab: Cr 2
 Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 2015/2016 Prof. Dr. Eckhard Bartsch / Marcel Werner M.Sc. Aufgabenblatt 5 vom 27.11.15 Aufgabe 5 1
Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 2015/2016 Prof. Dr. Eckhard Bartsch / Marcel Werner M.Sc. Aufgabenblatt 5 vom 27.11.15 Aufgabe 5 1
6.1 Elektrodenpotenzial und elektromotorische Kraft
 6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
5. Messtechnik Grundlegende Zweiteilung der Meßmethoden: A) Kontrolle/Steuerung des fließenden Stromes ( galvanostatisch ):
 5. Messtechnik Grundlegende Zweiteilung der Meßmethoden: A) Kontrolle/Steuerung des fließenden Stromes ( galvanostatisch ): Sehr einfach zu realisieren Historisch zuerst Führt zu kontraintuitiven Begriffsbildungen
5. Messtechnik Grundlegende Zweiteilung der Meßmethoden: A) Kontrolle/Steuerung des fließenden Stromes ( galvanostatisch ): Sehr einfach zu realisieren Historisch zuerst Führt zu kontraintuitiven Begriffsbildungen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.de 2 von 18 6. Wir bauen eine Zitronenbatterie (Kl. 9/10) Chemische
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Strom aus Obst? Das komplette Material finden Sie hier: School-Scout.de 2 von 18 6. Wir bauen eine Zitronenbatterie (Kl. 9/10) Chemische
Strom und Spannungsmessung, Addition von Widerständen, Kirchhoffsche Regeln, Halbleiter, p-n-übergang, Dioden, fotovoltaischer Effekt
 Versuch 27: Solarzellen Seite 1 Aufgaben: Vorkenntnisse: Lehrinhalt: Literatur: Messung von Kurzschlussstrom und Leerlaufspannung von Solarzellen, Messung der I-U-Kennlinien von Solarzellen, Bestimmung
Versuch 27: Solarzellen Seite 1 Aufgaben: Vorkenntnisse: Lehrinhalt: Literatur: Messung von Kurzschlussstrom und Leerlaufspannung von Solarzellen, Messung der I-U-Kennlinien von Solarzellen, Bestimmung
ELEKTRISCHE SPANNUNGSQUELLEN
 Physikalisches Grundpraktikum I Versuch: (Versuch durchgeführt am 17.10.2000) ELEKTRISCHE SPANNUNGSQUELLEN Denk Adelheid 9955832 Ernst Dana Eva 9955579 Linz, am 22.10.2000 1 I. PHYSIKALISCHE GRUNDLAGEN
Physikalisches Grundpraktikum I Versuch: (Versuch durchgeführt am 17.10.2000) ELEKTRISCHE SPANNUNGSQUELLEN Denk Adelheid 9955832 Ernst Dana Eva 9955579 Linz, am 22.10.2000 1 I. PHYSIKALISCHE GRUNDLAGEN
Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe
 Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe Wintersemester 2012/13 4. Versuch: Brennstoffzelle Dipl.-Ing. Sebastian Lang Learning outcome Nachdem Sie sich mit diesem Versuch auseinandergesetzt
Verfahrenstechnisches Tutorium Prof. Dr.-Ing. M. J. Hampe Wintersemester 2012/13 4. Versuch: Brennstoffzelle Dipl.-Ing. Sebastian Lang Learning outcome Nachdem Sie sich mit diesem Versuch auseinandergesetzt
Physikepoche Klasse 11. Elektrizitätslehre
 Physikepoche Klasse 11 Elektrizitätslehre Der elektrische Gleichstromkreis Nur in einem geschlossenen Stromkreis können die elektrischen Ladungsträger vom negativen Pol der Spannungsquelle zum positiven
Physikepoche Klasse 11 Elektrizitätslehre Der elektrische Gleichstromkreis Nur in einem geschlossenen Stromkreis können die elektrischen Ladungsträger vom negativen Pol der Spannungsquelle zum positiven
Leiterkennlinien elektrischer Widerstand
 Leiterkennlinien elektrischer Widerstand Experiment: Wir untersuchen den Zusammenhang zwischen der anliegenden Spannung und der Stromstärke I bei verschiedenen elektrischen Leitern. Als elektrische Leiter
Leiterkennlinien elektrischer Widerstand Experiment: Wir untersuchen den Zusammenhang zwischen der anliegenden Spannung und der Stromstärke I bei verschiedenen elektrischen Leitern. Als elektrische Leiter
Inhalt. History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ. Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell.
 Brennstoffzellen Inhalt History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell o Stacks o Anwendung o Fazit History Erste BZ vor
Brennstoffzellen Inhalt History Prinzip der Brennstoffzelle Wasserstoff-Sauerstoff-BZ Polymer Elektrolyte Membrane Fuel Cell Direct Methanol Fuel Cell o Stacks o Anwendung o Fazit History Erste BZ vor
E7 Elektrolyse. Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch. Münster, den
 E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
Grundpraktikum Physikalische Chemie. Versuch 16 Kinetischer Salzeffekt
 Grundpraktikum Physikalische Chemie Versuch 16 Kinetischer Salzeffekt Version: März 2016 1. Theorie 1.1. Kinetischer Salzeffekt Eine bimolekulare chemische Reaktion lässt sich mithilfe von Konzepten der
Grundpraktikum Physikalische Chemie Versuch 16 Kinetischer Salzeffekt Version: März 2016 1. Theorie 1.1. Kinetischer Salzeffekt Eine bimolekulare chemische Reaktion lässt sich mithilfe von Konzepten der
Simulation elektrochemischer Abläufe in Direkt-Methanolbrennstoffzellen
 Simulation elektrochemischer Abläufe in Direkt-Methanolbrennstoffzellen Torsten Köhler Mohrenstr. 39 10117 Berlin +49 30 2 03 72 0 www.wias-berlin.de Februar 2005 1/19 Inhalt 1. Elektrochemische Grundlagen
Simulation elektrochemischer Abläufe in Direkt-Methanolbrennstoffzellen Torsten Köhler Mohrenstr. 39 10117 Berlin +49 30 2 03 72 0 www.wias-berlin.de Februar 2005 1/19 Inhalt 1. Elektrochemische Grundlagen
Phasengleichgewicht. 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. A fl. A g
 Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Die Modellierung einer Lithium-Batterie Zwischenpräsentation zum Praktikum Nichtlineare Modellierung in den Naturwissenschaften
 MÜNSTER Die Modellierung einer Lithium-Batterie Zwischenpräsentation zum Praktikum Nichtlineare Modellierung in den Naturwissenschaften Christoph Fricke, Natascha von Aspern, Carla Tameling 12.06.2012
MÜNSTER Die Modellierung einer Lithium-Batterie Zwischenpräsentation zum Praktikum Nichtlineare Modellierung in den Naturwissenschaften Christoph Fricke, Natascha von Aspern, Carla Tameling 12.06.2012
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Musterlösung Übungsserie 5
 Institut für Energietechnik Laboratorium für Aerothermochemie und Verbrennungssysteme Prof. Dr. Konstantinos Boulouchos Musterlösung Übungsserie 5 Aufgabe 1 Brennstoffzellen 1. Schreibe die Reaktionsgleichungen
Institut für Energietechnik Laboratorium für Aerothermochemie und Verbrennungssysteme Prof. Dr. Konstantinos Boulouchos Musterlösung Übungsserie 5 Aufgabe 1 Brennstoffzellen 1. Schreibe die Reaktionsgleichungen
Physikalische Chemie Praktikum. Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln
 Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Elektrochemie: Spannung galvanischer Ketten
 Elektrochemie: Spannung galvanischer Ketten 1 Theorie Bei einer Redoxreaktion werden Elektronen von einer Spezies auf eine andere übertragen. Der Elektronendonor, der selbst oxidiert wird, wird Reduktionsmittel
Elektrochemie: Spannung galvanischer Ketten 1 Theorie Bei einer Redoxreaktion werden Elektronen von einer Spezies auf eine andere übertragen. Der Elektronendonor, der selbst oxidiert wird, wird Reduktionsmittel
Kennlinie der Brennstoffzelle
 E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2
 Werner-v.-Siemens-Labor für elektrische Antriebssysteme Prof. Dr.-Ing. Dr. h.c. H. Biechl Prof. Dr.-Ing. E.-P. Meyer Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2 Spannungsteiler Ersatzspannungsquelle
Werner-v.-Siemens-Labor für elektrische Antriebssysteme Prof. Dr.-Ing. Dr. h.c. H. Biechl Prof. Dr.-Ing. E.-P. Meyer Praktikum Grundlagen der Elektrotechnik 1 (GET1) Versuch 2 Spannungsteiler Ersatzspannungsquelle
PE Peltier-Effekt. Inhaltsverzeichnis. Moritz Stoll, Marcel Schmittfull (Gruppe 2) 25. April Einführung 2
 PE Peltier-Effekt Blockpraktikum Frühjahr 2007 (Gruppe 2) 25. April 2007 Inhaltsverzeichnis 1 Einführung 2 2 Theoretische Grundlagen 2 2.1 Seebeck-Effekt...................... 2 2.2 Peltier-Effekt.......................
PE Peltier-Effekt Blockpraktikum Frühjahr 2007 (Gruppe 2) 25. April 2007 Inhaltsverzeichnis 1 Einführung 2 2 Theoretische Grundlagen 2 2.1 Seebeck-Effekt...................... 2 2.2 Peltier-Effekt.......................
Laboratorium für Grundlagen Elektrotechnik
 niversity of Applied Sciences Cologne Fakultät 07: nformations-, Medien- & Elektrotechnik nstitut für Elektrische Energietechnik Laboratorium für Grundlagen Elektrotechnik Versuch 1 1.1 Aufnahme von Widerstandskennlinien
niversity of Applied Sciences Cologne Fakultät 07: nformations-, Medien- & Elektrotechnik nstitut für Elektrische Energietechnik Laboratorium für Grundlagen Elektrotechnik Versuch 1 1.1 Aufnahme von Widerstandskennlinien
Praktikum II TR: Transformator
 Praktikum II TR: Transformator Betreuer: Dr. Torsten Hehl Hanno Rein praktikum2@hanno-rein.de Florian Jessen florian.jessen@student.uni-tuebingen.de 30. März 2004 Made with L A TEX and Gnuplot Praktikum
Praktikum II TR: Transformator Betreuer: Dr. Torsten Hehl Hanno Rein praktikum2@hanno-rein.de Florian Jessen florian.jessen@student.uni-tuebingen.de 30. März 2004 Made with L A TEX and Gnuplot Praktikum
Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse
 Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
Grundlagen. Stromkreisgesetze. Andreas Zbinden. Gewerblich- Industrielle Berufsschule Bern. 1 Ohmsches Gesetz 2. 2 Reihnenschaltung von Widerständen 6
 Elektrotechnik Grundlagen Stromkreisgesetze Andreas Zbinden Gewerblich- Industrielle Berufsschule Bern Inhaltsverzeichnis 1 Ohmsches Gesetz 2 2 Reihnenschaltung von Widerständen 6 3 Parallelschaltung von
Elektrotechnik Grundlagen Stromkreisgesetze Andreas Zbinden Gewerblich- Industrielle Berufsschule Bern Inhaltsverzeichnis 1 Ohmsches Gesetz 2 2 Reihnenschaltung von Widerständen 6 3 Parallelschaltung von
Praktikum I PE Peltier-Effekt
 Praktikum I PE Peltier-Effekt Florian Jessen, Hanno Rein, Benjamin Mück Betreuerin: Federica Moschini 27. November 2003 1 Ziel der Versuchsreihe Der Peltier Effekt und seine Umkehrung (Seebeck Effekt)
Praktikum I PE Peltier-Effekt Florian Jessen, Hanno Rein, Benjamin Mück Betreuerin: Federica Moschini 27. November 2003 1 Ziel der Versuchsreihe Der Peltier Effekt und seine Umkehrung (Seebeck Effekt)
Elektrochemische Thermodynamik. Wiederholung : Potentiale, Potentialbegriff
 Elektrochemische Thermodynamik Wiederholung : Potentiale, Potentialbegriff Elektrische Potentiale in der EC Begriffe: Galvani-Potentialdifferenz, Galvani-Spannung: zwischen den inneren Potentialen zweier
Elektrochemische Thermodynamik Wiederholung : Potentiale, Potentialbegriff Elektrische Potentiale in der EC Begriffe: Galvani-Potentialdifferenz, Galvani-Spannung: zwischen den inneren Potentialen zweier
Was ist Elektrochemie?
 Was ist Elektrochemie? Eine elektrochemische Reaktion erfüllt folgende vier Eigenschaften: Sie findet an Phasengrenzen statt. Die einzelnen Phasen sind unterschiedlich geladen. (unterschiedliche elektrische
Was ist Elektrochemie? Eine elektrochemische Reaktion erfüllt folgende vier Eigenschaften: Sie findet an Phasengrenzen statt. Die einzelnen Phasen sind unterschiedlich geladen. (unterschiedliche elektrische
Strömungssimulation in Li-Dualinsertationszellen
 Strömungssimulation in Li-Dualinsertationszellen Julius Sewing, Nikolaus Krause, Dennis Dieterle j.sewing@gmx.net nikokrause@gmx.de dennis.dieterle@uni-muenster.de 22. Juni 2010 Sewing, Krause, Dieterle
Strömungssimulation in Li-Dualinsertationszellen Julius Sewing, Nikolaus Krause, Dennis Dieterle j.sewing@gmx.net nikokrause@gmx.de dennis.dieterle@uni-muenster.de 22. Juni 2010 Sewing, Krause, Dieterle
Technische Oberschule Stuttgart
 Aufnahmeprüfung Physik 2010 Seite 1 von 9 Zu bearbeiten sind 4 der 6 Aufgaben innerhalb von 60 Minuten. Aufgabe 1 (Mechanik): Ein Bauer pflügt seinen Acker, dabei braucht der Traktor für eine Strecke von
Aufnahmeprüfung Physik 2010 Seite 1 von 9 Zu bearbeiten sind 4 der 6 Aufgaben innerhalb von 60 Minuten. Aufgabe 1 (Mechanik): Ein Bauer pflügt seinen Acker, dabei braucht der Traktor für eine Strecke von
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Grundwissen. Physik. Jahrgangsstufe 8
 Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Das Brennstoffzellen-Radio
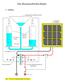 Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Auswertung. D07: Photoeffekt
 Auswertung zum Versuch D07: Photoeffekt Alexander Fufaev Partner: Jule Heier Gruppe 434 1 Einleitung In diesem Versuch geht es darum, den Photoeffekt auf verschiedene Weisen zu untersuchen. In Versuchsteil
Auswertung zum Versuch D07: Photoeffekt Alexander Fufaev Partner: Jule Heier Gruppe 434 1 Einleitung In diesem Versuch geht es darum, den Photoeffekt auf verschiedene Weisen zu untersuchen. In Versuchsteil
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Praktikum Lasertechnik, Protokoll Versuch Halbleiter
 Praktikum Lasertechnik, Protokoll Versuch Halbleiter 16.06.2014 Ort: Laserlabor der Fachhochschule Aachen Campus Jülich Inhaltsverzeichnis 1 Einleitung 1 2 Fragen zur Vorbereitung 2 3 Geräteliste 2 4 Messung
Praktikum Lasertechnik, Protokoll Versuch Halbleiter 16.06.2014 Ort: Laserlabor der Fachhochschule Aachen Campus Jülich Inhaltsverzeichnis 1 Einleitung 1 2 Fragen zur Vorbereitung 2 3 Geräteliste 2 4 Messung
Chlor-Alkali-Elektrolyse
 Chlor-Alkali-Elektrolyse 1. Allgemeine Erklärung der Elektrolyse 2. Verfahren 2.1 Diaphragmaverfahren 2.2 Membranverfahren 2.3 Amalgamverfahren 3.Vorteile und Nachteile der Verfahren 4. Überspannung 1.
Chlor-Alkali-Elektrolyse 1. Allgemeine Erklärung der Elektrolyse 2. Verfahren 2.1 Diaphragmaverfahren 2.2 Membranverfahren 2.3 Amalgamverfahren 3.Vorteile und Nachteile der Verfahren 4. Überspannung 1.
Spannungsquellen. Grundpraktikum I. Mittendorfer Stephan Matr. Nr Übungsdatum: Abgabetermin:
 Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Grundlagen der Physiologie
 Grundlagen der Physiologie Bioenergetik www.icbm.de/pmbio Energieformen Von Lebewesen verwertete Energieformen o Energie ist etwas, das Arbeit ermöglicht. o Lebewesen nutzen nur zwei Formen: -- Licht --
Grundlagen der Physiologie Bioenergetik www.icbm.de/pmbio Energieformen Von Lebewesen verwertete Energieformen o Energie ist etwas, das Arbeit ermöglicht. o Lebewesen nutzen nur zwei Formen: -- Licht --
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester VL #19 am
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #9 am 30.05.007 Vladimir Dyakonov Leistungsbeträge 00 W menschlicher Grundumsatz 00 kw PKW-Leistung
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #9 am 30.05.007 Vladimir Dyakonov Leistungsbeträge 00 W menschlicher Grundumsatz 00 kw PKW-Leistung
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Strömungssimulation in Li-Dualinsertationszellen
 Strömungssimulation in Li-Dualinsertationszellen Christoph Wiesian, Dennis Dieterle, Sven Wagner c.wiesian@uni-muenster.de dennis.dieterle@uni-muenster.de sven.wagner@uni-muenster.de 22.12.2009 Wiesian,
Strömungssimulation in Li-Dualinsertationszellen Christoph Wiesian, Dennis Dieterle, Sven Wagner c.wiesian@uni-muenster.de dennis.dieterle@uni-muenster.de sven.wagner@uni-muenster.de 22.12.2009 Wiesian,
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
KORROSION UND KORROSIONSSCHUTZ VON METALLEN
 11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression
 1 Einführung Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression Datenauswertung In einem naturwissenschaftlichen Experiment werden Sie meist
1 Einführung Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression Datenauswertung In einem naturwissenschaftlichen Experiment werden Sie meist
Aufgaben zur Elektrizitätslehre
 Aufgaben zur Elektrizitätslehre Elektrischer Strom, elektrische Ladung 1. In einem Metalldraht bei Zimmertemperatur übernehmen folgende Ladungsträger den Stromtransport (A) nur negative Ionen (B) negative
Aufgaben zur Elektrizitätslehre Elektrischer Strom, elektrische Ladung 1. In einem Metalldraht bei Zimmertemperatur übernehmen folgende Ladungsträger den Stromtransport (A) nur negative Ionen (B) negative
TR Transformator. Blockpraktikum Herbst Moritz Stoll, Marcel Schmittfull (Gruppe 2b) 25. Oktober 2007
 TR Transformator Blockpraktikum Herbst 2007 (Gruppe 2b) 25 Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 11 Unbelasteter Transformator 2 12 Belasteter Transformator 3 13 Leistungsanpassung 3 14 Verluste
TR Transformator Blockpraktikum Herbst 2007 (Gruppe 2b) 25 Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 11 Unbelasteter Transformator 2 12 Belasteter Transformator 3 13 Leistungsanpassung 3 14 Verluste
