TECHNISCHE UNIVERSITÄT MÜNCHEN
|
|
|
- Georg Rudolf Beyer
- vor 7 Jahren
- Abrufe
Transkript
1 TECHNISCHE UNIVERSITÄT MÜNCHEN Klinik und Poliklinik für Strahlentherapie und Radiologische Onkologie der Technischen Universität München (Direktor: Univ.-Prof Dr. M. Molls) Strahlentherapie des diffus großzelligen B-Zell-Lymphoms Eine retrospektive Analyse Sarah Cathrin Klemm Vollständiger Abdruck der von der Fakultät für Medizin der Technischen Universität München zur Erlangung des akademischen Grades eines Doktors der Medizin genehmigten Dissertation. Vorsitzender: Prüfer der Dissertation: Univ.-Prof. Dr. E. J. Rummeny 1. apl. Prof. Dr. H. C.-W. E. Geinitz 2. Univ.-Prof. Dr. M. Molls Die Dissertation wurde am bei der Technischen Universität München eingereicht und durch die Fakultät für Medizin am angenommen.
2 Für Papa
3 II Inhaltsverzeichnis Inhaltsverzeichnis... II Tabellenverzeichnis... VI Anhangsverzeichnis... VII Abkürzungsverzeichnis... VIII 1 Einleitung Non-Hodgkin-Lymphome Epidemiologie Ätiologie Histologie des diffus großzelligen B-Zell-Lymphoms Klassifikation der Non-Hodgkin-Lymphome Stadieneinteilung der Non-Hodgkin-Lymphome Klinische Präsentation Prognostische Faktoren Diagnostik Therapie des DLBCL Therapiegrundlagen Systemische Therapie Radiotherapie Therapie der lokalisierten Stadien Therapie der fortgeschrittenen Stadien Therapie im Rezidiv Therapeutische Perspektiven Fragestellung... 22
4 III 2 Material und Methoden Auswahlkriterien Einschlusskriterien Ausschlusskriterien Datenerhebung Datenerfassung Follow-up Statistische Methoden Strahlentherapie Nebenwirkungen der Strahlentherapie Beurteilung des Therapieerfolges Ergebnisse Patientenkollektiv Charakteristika Therapie im Kollektiv Therapieansprechen Nebenwirkungen im Kollektiv Überleben Univariate Analyse Gesamtüberleben Ereignisfreies Überleben Multivariate Analyse Rezidivanalyse Lokale Kontrolle... 55
5 IV Outfield Rezidive Fallbeschreibungen Diskussion Charakteristika Gesamtüberleben Univariate Analyse Multivariate Analyse Ereignisfreies Überleben Univariate Analyse Multivariate Analyse Rezidivanalyse Lokale Kontrolle Nebenwirkungen Zweitmalignome Die Rolle der Strahlentherapie Zusammenfassung Anhang Literaturverzeichnis Danksagung... 98
6 V Abbildungsverzeichnis Abbildung 1: Die häufigsten Histologien der NHL... 2 Abbildung 2: Vergleich CHOP mit RCHOP Abbildung 3: Gesamtüberleben Abbildung 4: Ereignisfreies Überleben Abbildung 5: Einfluss Stadium auf das Gesamtüberleben Abbildung 6: Einfluss Alter auf das Gesamtüberleben Abbildung 7: Einfluss ECOG auf das Gesamtüberleben Abbildung 8: Einfluss IPI auf das Gesamtüberleben Abbildung 9: Einfluss CTX-Ansprechen auf das Gesamtüberleben Abbildung 10:Einfluss Therapie auf das Gesamtüberleben Abbildung 11: Einfluss LDH auf das Gesamtüberleben Abbildung 12: Einfluss Stadium auf das ereignisfreie Überleben Abbildung 13: Einfluss Alter auf das ereignisfreie Überleben Abbildung 14: Einfluss ECOG auf das ereignisfreie Überleben Abbildung 15: Einfluss IPI auf das ereignisfreie Überleben Abbildung 16: Einfluss LDH Erhöhung auf das ereignisfreie Überleben Abbildung 17: Einfluss CTX-Ansprechen auf das ereignisfreie Überleben Abbildung 18: Einfluss Therapie auf das ereignisfreie Überleben Abbildung 19: Rezidivfreies Überleben... 54
7 VI Tabellenverzeichnis Tabelle 1: Übersicht über das fünf Jahres Gesamtüberleben Tabelle 2: Übersicht über das fünf Jahres ereignisfreie Überleben Tabelle 3: Überlebensraten vergleichbarer Studien... 66
8 VII Anhangsverzeichnis Tabelle 4: Patientencharakteristika Tabelle 5: Vergleich der Lymphomklassifikationen Tabelle 6: Stadieneinteilung nach Ann-Arbor Tabelle 7: ECOG Performance Status... 88
9 VIII Abkürzungsverzeichnis a.p./p.a. ABC ACOMED ACVBP AIDS ALT AP AST AZ Bcl BUN BWK bzw. CD CEPP CEVED CHOEP CHOP CLL COP COP-BLAM CR anterior-posterior/posterior-anterior Activated B-cell-like Chemotherapieschema mit Adriamycin, Cyclophosphamid, Vincristin, Methotrexat, Etoposid, Dexamethason Doxorubicin, Cyclophosphamid, Vindesin, Bleomycin, Prednison Acquired Immune Deficiency Syndrome Alanin-Aminotransferase Alkalische Phosphatase Aspartat-Aminotransferase Allgemeinzustand B-Zell-Lymphom Protoonkogen Blood urea nitrogen (Blut-Harnstoff-Stickstoff) Brustwirbelkörper beziehungsweise Cluster of differentiation, Oberflächenmarker von B-Zellen Chemotherapieschema mit Cyclophosphamid, Etoposid, Prednison, Procarbazin Chemotherapieschema mit CCNU, Etoposid, Vindesin und Dexamethason Chemotherapieschema mit CHOP + Etoposid Chemotherapieschema mit Cyclophosphamid,Hydroxydaunorubicin,Vincristin, Prednison Chronisch lymphatische Leukämie Chemotherapieschema mit Cyclophosphamid, Vincristin, Prednison Chemotherapieschema mit Cyclophosphamid, Vincristin, Prednison, Bleomycin, Doxorubicin, Procarbazin Komplette Remission
10 IX CS CT CTV CTx DHAP DLBCL DVH EBV ECOG EF EFS ESHAP FL GCB GELA Gem-Ox GTV HIV ICE ICRU IF IGRT ILSG ILSG IMRT Klinisches Staging Computertomographie Clinical Target Volume Chemotherapie Chemotherapieschema mit Dexamethason, Cytarabin, Cisplatin diffuse large B-cell-lymphoma (diffus großzelliges B-Zell-Lymphom) Dosis-Volumen-Histogramm Epstein-Barr-Virus Eastern Cooperative Oncology Group Extended field Ereignisfreies Überleben Chemotherapieschema mit Etoposid, Methylprednison, Cytarabin, Cisplatin Follikuläres Lymphom Germinal center B-cell-like Groupe d Etude des Lymphomes de L Adulte (Studiengruppe für Lymphome) Chemotherapieschema mit Gemcitabin, Oxaliplatin Gross tumor volume Humanes Immundefizienz Virus Chemotherapieschema mit Ifosfamid, Carboplatin, Etoposid International Commission on Radiation Units and Measurements Involved field Image-guided radiation therapy (bidlgestützte Strahlentherapie) International lymphoma study group International Lymphoma Study Group Intensitätsmodulierte Strahlentherapie
11 X IPI IV J-ÜLR LDH LK MALT MEFÜLZ MeV MGBG CHOP MRT MÜZL n.s. NCCN NHL OS PD PET PR PS PTV R.E.A.L. International prognostic Index Irradiated Volume Jahres-Überlebens-Rate Lactat-Dehydrogenase Lymphknoten Mucosa associated lymphoid tissue (Mukosa assoziiertes lymphatisches Gewebe) Mittlere ereignisfreie Überlebenszeit Mega-Elektronenvolt Chemotherapieschema mit CHOP + Mitoguazone Magnetresonanztomographie Mittlere Überlebenszeit nicht signifikant National Comprehensive Cancer Network Non-Hodgkin-Lymphom Overall survival, Gesamtüberleben Progress Positronen-Emissions-Tomographie Partielle Remission Pathologisches Staging Planning Target Volume Revised European-American Classification of Lymphoid Neoplasms R-CHOP RTx Chemotherapieschema mit CHOP + Rituximab Radiotherapie s. siehe SCID schwerer kombinierter Immundefekt
12 XI SD TLI TNI TV UV vs. WHO WK Stable disease (keine Befundänderung) Total lymphatische Bestrahlung Total nodale Bestrahlung Treated Volume Ultraviolett (-Strahlung) versus World Health Organization Wirbelkörper
13 1 1 Einleitung 1.1 Non-Hodgkin-Lymphome Non-Hodgkin-Lymphome (NHL) sind maligne Tumore des Lymphsystems und entwickeln sich in jedem lymphatischen Gewebe des Körpers innerhalb und außerhalb der Lymphknoten. Entstehen können sie sowohl aus Vorläuferzellen der B- und T- Zellen, als auch aus den reifen lymphatischen Zellen, wobei B-Zell-Lymphome in beiden Gruppen deutlich häufiger sind (53, 121). Der Begriff der Non-Hodgkin-Lymphome umfasst viele verschiedene Subtypen, die sich histologisch, molekularbiologisch und immunphänotypisch stark unterscheiden. Auch die Klinik und die Therapie sind sehr heterogen. So erfordert jede dieser Entitäten eine individuelle Diagnostik und Behandlung. Die indolenten Lymphome, wie zum Beispiel das follikuläre Lymphom oder das MALT-Lymphom, verlaufen eher chronisch und werden selten geheilt. Die aggressiven Non-Hodgkin-Lymphome zeigen einen akuten Verlauf und führen ohne adäquate Behandlung rapide zum Tod. Eine frühzeitige, intensive Therapie führt jedoch bei der Hälfte der Patienten zu einer dauerhaften Remission. Da die Non-Hodgkin-Lymphome sehr chemo- und radiosensibel sind, ergeben sich verschiedene therapeutische Möglichkeiten. Die Kombination verschiedener Therapiemodalitäten hat vor allem in den letzten Jahren zu einer deutlichen Verbesserung der Prognose geführt (41). Diese Arbeit beschäftigt sich mit dem diffus großzelligen B-Zell-Lymphom (DLBCL), einem aggressiven Non-Hodgkin-Lymphom. Besonders eingegangen wird auf den Einfluss prognostischer Faktoren auf das Gesamt- und das ereignisfreie Überleben, weiter soll der Stellenwert der Strahlentherapie in der Behandlung des DLBCL beleuchtet werden. 1.2 Epidemiologie Non-Hodgkin-Lymphome machen rund 4% aller malignen Erkrankungen aus. Das Robert-Koch-Institut berichtete 2008 über 7270 neuerkrankte Männer und 6430 neuerkrankte Frauen. Die Prognose für 2012 belief sich auf 7800 Neuerkankungen bei den Männern und 6500 bei den Frauen (116). Ein Drittel aller NHL sind aggressive Lymphome, zwei Drittel davon sind diffus großzellige B-Zell-Lymphome (137). Insgesamt sind etwa 30-40% aller Non-Hodgkin-Lymphome diffus großzellige B-Zell-
14 2 Lymphome, damit bilden sie die größte Subgruppe. Zusammen mit den follikulären Lymphomen stellen sie die Hälfte der Non Hodgkin-Lymphome dar (47). Histologien DLBCL 10% 5% 5% 35% FL 20% CLL 25% T-Zell-Lymphome MALT-Lymphom Mantelzell-lymphom Abbildung 1: Die häufigsten Histologien der NHL Die Inzidenz aller NHL hat in den letzten Jahren kontinuierlich zugenommen. Das National Cancer Institute in Maryland, USA, berichtet von einem jährlichen Anstieg von 3%, sowie einem Mortalitätsanstieg von 1,5% pro Jahr (13). Das Erkrankungsrisiko scheint mit zunehmendem Alter zu steigen, so konnte ein Inzidenzanstieg bei Patienten über 60 Jahren beobachtet werden. Männliches Geschlecht und weiße Hautfarbe sind weitere Risikofaktoren (137). Zusätzlich haben Patienten mit primärer oder erworbener Immunschwäche, wie zum Beispiel nach einer Organtransplantation oder durch AIDS, ein höheres Erkrankungsrisiko. Viele weitere Faktoren konnten als Risiko identifiziert werden (13, 74, 134). Bei genauer Betrachtung fallen starke geographische Unterschiede bezüglich der Inzidenz der NHL auf. So ist die Inzidenz in Westeuropa, Nordamerika und Australien besonders hoch, während sie in Südamerika, Asien und Japan nicht so stark ansteigt (13, 137, 140). Auch die einzelnen Subgruppen der NHL weisen unterschiedliche geographische Häufigkeitsverteilungen auf. Das Burkitt-Lymphom tritt endemisch vor allem bei Kindern in Afrika auf, das intestinale
15 3 Lymphom findet sich überwiegend im Mittleren Osten und die adulte T-Zell-Leukämie kommt gehäuft in Südjapan und in der Karibik vor (6, 53). 1.3 Ätiologie Eine eindeutige Ursache für die Entstehung der Non-Hodgkin-Lymphome wurde bis heute noch nicht gefunden. Angeborene und erworbene Immundefekte scheinen die bedeutendste Rolle bei der Entstehung der Non-Hodgkin-Lymphome zu spielen (112), trotzdem kann die steigende Inzidenz der NHL damit nicht ausreichend erklärt werden. Patienten mit angeborenen Immundefekten weisen ein Risiko von 25% auf, an einem B-Zell-NHL zu erkranken und zeigen auch ein erhöhtes Erkrankungsrisiko für andere angeborene Immundefekte, wie zum Beispiel das Wiskott-Aldrich-Syndrom, die Ataxia teleangiectasia oder die SCID (45). Einige Studien haben auch eine Assoziation zwischen dem Non-Hodgkin-Lymphom und bestimmten Autoimmunerkrankungen gefunden. Dazu gehören unter anderem die Rheumatoide Arthritis, das Sjögren Syndrom, der systemische Lupus erythematodes und die Zöliakie (122). Ebenso begünstigt eine immunsuppressive Therapie, zum Beispiel nach einer Nieren-, Herzoder Knochenmarkstransplantation die Entstehung eines NHL (64). Zurückzuführen ist dieses erhöhte Risiko vermutlich auf eine reaktivierte EBV-Infektion. Beim Erstkontakt infiziert das Epstein-Barr-Virus die Lymphozyten und verweilt dort lebenslang (112). Das intakte Immunsystem kann die infizierte Wirtszelle durch zytotoxische T-Zellen an der Vermehrung hindern. Ist diese Immunkompetenz nicht vorhanden, können sich diese Wirtszellen unkontrolliert vermehren. In seiner Membran besitzt das EBV ein Onkoprotein, das zur Entstehung eines Lymphoms führen kann (73, 81). Bei einer Infektion mit HIV ist das Risiko an einem NHL zu erkranken zum Beispiel 60-mal höher als das eines Gesunden (18, 134). Durch die Zerstörung der CD4+-Lymphozyten können sich auch hier EBV-infizierte Zellen vermehren und so zur Entstehung des Lymphoms beitragen. Eine weitere Ursache für das erhöhte Risiko bei einer AIDS- Erkrankung findet sich in einer Studie von Baggiolini: Veränderungen des Stroma-Zell- Faktors SDF1-3 A führen zu vermehrter Chemokinproduktion. Diese regulieren normalerweise die Reifung und Proliferation der B-Lymphozyten. Ist dieser Mechanismus beeinträchtigt, reifen die Lymphozyten nicht vollständig oder zeigen unkontrolliertes Wachstum (11). Das diffus großzellige B-Zell-Lymphom ist eine der häufigsten histologischen Entitäten bei AIDS Patienten (122). Auch diskutiert wird außerdem das Hepatitis-C-Virus als möglicher Verursacher des NHL, allerdings sind die Ergebnisse nicht eindeutig. Einige Studien haben eine
16 4 Assoziation der B-Zell-Lymphome mit dem Virus gezeigt (59, 110, 127), andere haben dies jedoch widerlegt (79). Ein sehr kleiner Teil der Non-Hodgkin-Lymphome lässt sich durch eine positive Familienanamnese erklären. Das Risiko für Menschen, bei denen ein oder mehrere enge Verwandte bereits an einer hämatoonkologischen Krankheit der lymphatischen Wege leiden oder litten, ist zwei - bis dreifach erhöht. Allerdings könnte dies eventuell auch an einer gemeinsamen Exposition liegen, die wiederum zu einem Lymphom führen kann (80, 100, 112). Ein weiterer Risikofaktor ist ein vorangegangenes Hodgkin- Lymphom mit multimodaler Therapie. Hier ist das Risiko an einem Non-Hodgkin- Lymphom zu erkranken 20-fach erhöht (96). Für die Lymphome sind einige chromosomale Aberrationen bekannt, die die Entstehung des Tumors begünstigen können. Meist sind es Translokationen, die entweder zur Aktivierung von Onkogenen oder zu einer Inaktivierung von Tumorsuppressorgenen führen. Beim diffus großzelligen B-Zell-Lymphom lassen sich oftmals die Translokationen t(3;14)(q27q32) und t(2;3)(p12q27) nachweisen. Hier wird das bcl-6 Gen überexprimiert und führt zur Entartung der Zelle (53, 81, 117). Auch der Einfluss verschiedener Umwelt- und Expositionsfaktoren scheint eine Rolle bei der Entstehung der Non-Hodgkin-Lymphome zu spielen. So haben bestimmte Berufsgruppen, wie zum Beispiel Landwirte oder Forstarbeiter, ein erhöhtes Erkrankungsrisiko (28). Pestizide, vor allem Phenoxyessigsäurederivate, aber auch andere Insektizide und Dünger wurden mit dem Auftreten von Non-Hodgkin- Lymphomen assoziiert (36). Einige Studien haben ein erhöhtes Risiko bei langjähriger Anwendung von Haarfärbemittel beschrieben. Vor allem dunkle langhaltende Farben sollen gefährlich sein (23, 143), andere Studien konnten diesen Zusammenhang jedoch nicht nachweisen (63). Ebenso verhält es sich mit der Assoziation zwischen NHL und Sonnen- bzw UV-Lichtexposition. Obwohl manche Studien ein erhöhtes Risiko zeigten, bleibt dieser Risikofaktor umstritten (13). Der Einfluss von Umweltfaktoren hängt unter Umständen mit Mutationen in Enzym-Genen zusammen, die der Entgiftung schädlicher Stoffe dienen. Das Cytochrom P 450 (CYP) Enzym und die Glutathion-S Transferase dienen zum Beispiel der Entgiftung von Lösungsmitteln (131). Gerade bei der Entstehung des aggressiven großzelligen B-Zell-Lymphoms wurde eine Assoziation mit einem Polymorphismus im CYP2E1 Enzym gefunden (129).
17 5 Desweiteren beeinflusst die Ernährung das Erkrankungsrisiko. Zuviel Protein, Fett und Fleisch scheinen die Entstehung eines NHL wahrscheinlicher zu machen (27, 34), während der Verzehr von Obst und Gemüse das Risiko senken soll (144). Genauso wie die Rolle des Alkoholkonsums sind diese Ergebnisse jedoch nicht eindeutig und das Forschen nach den Ursachen für die Entstehung der Non-Hodgkin-Lymphome wird noch lange erforderlich bleiben (13, 28). 1.4 Histologie des diffus großzelligen B-Zell-Lymphoms Die diffus großzelligen B-Zell-Lymphome stellen eine sehr heterogene Gruppe dar. Einige Lymphome dieser Entität sprechen besonders gut auf eine Chemo- bzw. Radiotherapie an, andere hingegen scheinen therapieresistent zu sein. Dies lässt sich durch unterschiedliche histologische, genetische und biologische Eigenschaften erklären. Die Ursprungszellen der DLBCL sind reife B-Lymphozyten, Zentroblasten oder Immunoblasten. Durch genetische und molekulare Alterationen folgt der jeweilige Lymphozyt nicht seiner normalen Differenzierung und es entsteht eine neoplastische Zelle (49). Beim DLBCL zeigt sich histologisch ein diffuses Wachstumsmuster großer Zellen, die ungefähr die doppelte Größe eines normalen Lymphozyten aufweisen. Der Proliferationsindex ist hoch und liegt in der Regel bei > 40%. Je nach Dominanz der Ursprungszelle unterscheidet man einen zentroblastischen Typ (80% der Fälle), einen immunoblastischen Typ (10% der Fälle) und verschiedene andere Typen. Die Zentroblasten haben einen rund-ovalen, nicht eingebuchteten Kern und viele kleine periphere Nukleoli mit engem basophilem Zytoplasmasaum. Die immunoblastischen Zellen sind etwas größer mit einem prominenten zentralen Nukleolus und reichlich basophilem Zytoplasma. Weitere Entitäten des DLBCL sind der anaplastische Typ, der plasmoblastische Typ, der oft bei AIDS-kranken Patienten auftritt und der seltene ALKpositive Typ (49, 53). Das T-Zell-reiche B-Zell-Lymphom, das diffus mediastinale B- Zell-Lymphom, das intravaskuläre Lymphom und die EBV-assoziierte lymphoide Granulomatose zählen zwar auch zu den großzelligen B-Zell-Lymphomen, sind aber klinisch und prognostisch als eigene Entitäten zu werten (49). Der Immunphänotyp der Lymphome kann durch die Methode der Durchflusszytometrie und Histochemie ermittelt werden. Das DLBCL exprimiert mindestens einen der typischen B-Zell-Marker: CD19, CD20, CD22, CD79a, CD45 und häufig sig. Nicht so häufig ist die Expression von CD5 und CD10 (37, 53) % der DLBCL zeigen eine Expression des bcl-2-gens und rund 70% des bcl-6-gens (53, 128). Häufig zeigt sich dann auch eine Translokation des myc-gens, die zu einer schlechteren Prognose führt
18 6 (4, 14, 65). Ebenso eine Deletion des Tumorsuppressor-Gens p53 und eine dadurch bedingte fehlende Apoptose von Zellen mit DNA-Schäden führt zu einer schlechteren Prognose (132). Weitere typische genetische Alterationen des DLBCL, wie zum Beispiel die Translokation t(14; 18) (q32;q21) sind bereits weiter oben beschrieben. Mit Hilfe von DNA Microarrays können Genexpressionsprofile der Zellen erstellt werden, die die DLBCL in zwei große Subgruppen unterteilen: in den sogenannten germinal center (GCB) bzw. Keimzentrums-Typ und den post-germinal/activated (ABC) bzw. Nachkeimzentrums-Typ (92). Dies beschreibt an welcher Stelle der Differenzierung die Lymphozyten entartet sind. Lymphome, die nicht einer dieser beiden Gruppen zugeordnet werden können, werden als Typ 3 bezeichnet: nototherwise-specified (5, 119). Die GCB haben eine bessere Prognose als der ABC Typ (119) und zeigen die t(14;18) (q32q21) Translokation, die eigentlich typisch für die follikulären Lymphome ist. Dies lässt darauf schließen, dass dieser DLBCL Typ follikulären Ursprungs ist (53). Der aktivierte B-Zell Typ zeichnet sich durch den Verlust des 6q21 Locus, eine Trisomie 3, der Expression von NF-Kappa B und weitere Mutationen aus, die zur Entstehung des Tumors führen können (5). 1.5 Klassifikation der Non-Hodgkin-Lymphome Eine einheitliche Klassifikation für die Lymphome zu finden, führte seit der Entdeckung dieser Erkrankung zu Konflikten. Immer wieder wurde versucht, eine Einteilung zu schaffen, die als Leitlinie gelten konnte und auf der diagnostische und therapeutische Entscheidungen basierten beschrieb Thomas Hodgkin erstmals eine maligne Erkrankung des lymphatischen Systems, das Hodgkin Lymphom. Es dauerte viele Jahre bis Brill und Symmers im Jahre 1925 das follikuläre Lymphom als erstes Non- Hodgkin-Lymphom entdeckten (22). In den folgenden Jahren wurden weitere Non- Hodgkin-Lymphome entdeckt, unter anderem das Burkitt-Lymphom (1958). Außerdem wurde die Transformation von Lymphozyten in Blasten beobachtet und eine Differenzierung in B- und T-Lymphozyten wurde beschrieben (61) unternahm Rappaport den ersten Klassifikationsversuch. Die von ihm vorgeschlagene Klassifikation beruhte vor allem auf der Morphologie des Tumors. Das erste Kriterium war das Wachstumsbild (diffus vs. nodulär), das zweite Kriterium betrachtete die Zellgröße (klein vs. groß) und das dritte Kriterium die Zytologie (gut differenziert vs. schlecht differenziert). Es stellte sich heraus, dass diese Einteilung sehr gut mit dem klinischen Verlauf der Krankheit korrelierte. Allerdings berücksichtigte die Einteilung Rappaports nicht, dass Lymphome nach Transformation in Blasten, aus
19 7 zwei unterschiedlichen Vorläuferzellen entstehen konnten, den B- und den T- Lymphozyten (113). Fast zehn Jahre später folgte eine Klassifikation, die diese Eigenschaft der Lymphome beschrieb, die Kiel-Klassifikation. Sie wurde 1974 von Lennert, Stein und Kaiserling entwickelt. Hier wurden die Lymphome erstmals nach ihren Vorläuferzellen klassifiziert, die noch nicht neoplastisch verändert waren. Die Lymphome wurden in B- und T-Zell-Lymphome unterteilt. Außerdem wurden die Zellart (Zyten vs. Blasten) und die Wachstumsdynamik betrachtet. Auch die Größe der Zellen spielte in dieser Klassifikation weiterhin eine Rolle. Zusammen mit der Chromatindichte der Tumorzellkerne konnten die Lymphome so in niedrig-maligne und hoch-maligne gruppiert werden. Dies ermöglichte Vorhersagen über die Prognose des jeweiligen Lymphoms. In Europa fand diese Einteilung viel Anklang und wurde dort zur führenden Klassifikation (17, 76). Eine ähnliche Klassifikation wurde zur gleichen Zeit von Lukes und Collins vorgeschlagen. Auch sie beruhte auf der Tatsache, dass die Lymphome aus unterschiedlichen normalen Zellen des lymphatischen Systems entstanden. Die beiden gruppierten die Lymphome jedoch zusätzlich nach der Form ihrer Zellkerne. Sie unterschieden zwischen runden (non-cleaved), eingedrückten (cleaved), gewundenen (convoluted) und nicht-gewundenen (non-convoluted) Kernen (84). Währenddessen entwickelten sich noch weitere Klassifikationen. Dazu zählten die British National Lymphoma Investigation Classification, die Klassifikation von Dorfmann, sowie eine 1976 von der WHO vorgeschlagene Klassifikation. Keine dieser Klassifikationen setzte sich durch und so gab es zu dieser Zeit weltweit sechs verschiedene Klassifikationssysteme (61). Dies änderte sich, als 1982 ein amerikanisches Ärzteteam, bestehend aus Hämatologen, Onkologen und Pathologen, einen neuen Klassifikationsvorschlag publizierte. Sie prüften die Reproduzierbarkeit der bisherigen Systeme und fanden heraus, dass keines dem anderen überlegen war (130). Die von ihnen entwickelte Working Formulation of Non-Hodgkins-Lymphoma for Clinical Usage sollte nun eine einheitliche Klassifikation ermöglichen. Sie war jedoch nicht als neue, eigenständige Klassifikation gedacht, sondern sollte als Übersetzer für die bisher bestehenden Einteilungen dienen. Sie basierte auf der Klassifikation von Rappaport und bezog sich auf die Morphologie der Lymphome. Wie bei der Klassifikation von Rappaport erfolgte die Einteilung nach Wachstumsbild, Zellgröße und Zytologie der Lymphomzellen. Eine Rolle spielte auch die Form des Zellkerns, ein Kriterium, welches bereits Lukes und Collins in ihrer Klassifikation berücksichtigt hatten. Eine große Schwäche dieser Klassifikation war jedoch, genau wie damals bei Rappaport, die Nichtbeachtung der
20 8 verschiedenen lymphatischen Vorläuferzellen der Lymphome. Da zu dem Zeitpunkt der Entstehung der Working Formulation eine Immunphänotypisierung in den Laboren noch kein Standardverfahren war, wurden die Lymphome unabhängig von ihrem Immunphänotyp nach morphologischen Kriterien gruppiert. So entstanden pathologisch heterogene Subgruppen, die nicht reproduzierbar waren. Aber auch klinisch stellte dies ein Problem dar, da je nach Ursprungszelle unter Umständen verschiedene Therapien indiziert gewesen wären (68). Insgesamt beinhaltete die Klassifikation zehn Hauptgruppen und eine Gruppe mit gemischten Entitäten, die wiederum drei großen Lymphomgruppen zugeordnet wurden. Basierend auf den Überlebensraten einer großen retrospektiven Studie der 1970er Jahre wurden die Lymphome in low-grade, intermediate-grade und high grade unterteilt und so Aussagen über die Prognose getroffen (2, 68). Die Terminologie der Rappaport schen Klassifikation wurde in der Working Formulation etwas verändert: der Begriff histiozytär wurde durch den Begriff großzellig ersetzt. Diese Gruppe wurde dann unterteilt in großzellige Lymphome vom follikulären Typ (Kernform cleaved/non-cleaved) und großzellige immunoblastische Lymphome. Die erste Gruppe zeigte ein etwas besseres Überleben, dadurch entstand innerhalb der Entität der großzelligen Lymphome eine Unterscheidung zwischen intermediate grade und high grade Lymphomen. Diese Heterogenität war ein weiterer Nachteil der Klassifikation (2, 68). Trotz dieser Schwachstellen wurde die Working Formulation in den USA schnell anerkannt. Besonders beliebt war sie bei den Klinikern, für die sie als Therapieleitfaden fungierte (68) wurde die in Europa führende Kiel-Klassifikation aktualisiert. Es erfolgten weitere Abgrenzungen zu neuen Lymphomtypen und die Einteilung in B-und T-Zell-Lymphome galt als neues Prinzip (61). Da die aktualisierte Kiel-Klassifikation und die Working Formulation grundsätzlich nicht vereinbar waren, wurde 1990 in Europa ein erneuter Versuch unternommen, ein weltweit akzeptiertes Klassifikationssystem zu schaffen. Der Engländer und Entdecker des MALT-Lymphoms Peter Isaacson und der Deutsche Harald Stein gründeten die International Lymphoma Study Group (ILSG), in die Hämatopathologen aus den USA, Europa und Hongkong aufgenommen wurden entwickelten sie die R.E.A.L.-Klassifikation ( Revised European-American Classification of Lymphoid Neoplasms ). Sie berücksichtigte den Immunphänotyp der Lymphome und unterschied drei Gruppen: die B-Zell-Lymphome, T/NK-Zell-Lymphome und das Hodgkin-Lymphom. Auch leukämische Formen wurden in diese Klassifikation aufgenommen und je nach Ursprungszelle in die Gruppen eingeteilt. Die B- und T-Zell-
21 9 Lymphome wurden nach der Reife ihrer nicht neoplastischen Vorläuferzelle subgruppiert. Vorläufer-B- und Vorläufer-T-Zell-Lymphome unterschieden sich von peripheren B- und T-Zell-Lymphomen (58, 68). Neben dem Immunphänotyp wurden die Lymphome nach Morphologie, Genotyp und Klinik klassifiziert. So wurden die extranodalen Lymphome nun als eigenständige Krankheit angesehen, ebenso wie das MALT-Lymphom (Mucosa-associated lymphoid tissue) und die T-Zell-Lymphome, was ein völlig neues Konzept darstellte (67, 69). Revolutionär an der R.E.A.L-Klassifikation war auch, dass alle Merkmale eine gleichrangige Bedeutung erhielten. Je nach Lymphomentität stellten sich unterschiedliche Merkmale als besonders wichtig heraus. Der Immunphänotyp diente zum Beispiel vor allem der Diagnose des diffus großzelligen B-Zell-Lymphoms (DLBCL), des Mantelzell-Lymphoms und der T-Zell- Lymphome, wohingegen beim follikulären Lymphom und beim MALT-Lymphom die Morphologie des histologischen Präparats viel entscheidender für die Diagnose war (57). Auch unterschied diese Klassifikation zwischen histologischem Grad und klinischer Aggressivität. Ein Grading-System, das mehrere Lymphomentitäten umfasste, wurde daher als nicht sinnvoll erachtet. Stattdessen erfolgte das Grading nur innerhalb der einzelnen Lymphomsubgruppen (68). Wichtig war, dass alle 19 Pathologen der International Lymphoma Study Group über die Reproduzierbarkeit der aufgeführten Merkmale Konsensus fanden. Um diese zu überprüfen, untersuchten Armitage und seine Mitarbeiter in einer retrospektiven Analyse 1378 Patienten mit Non- Hodgkin-Lymphom. Pathologen von neun Instituten in acht verschiedenen Ländern beteiligten sich an der Studie. Die Ergebnisse zeigten eine Reproduzierbarkeit der Diagnose von 85-95% für die häufigsten Lymphomtypen (1, 68). Damit war sie den vorherigen Klassifikationssystemen überlegen, die stets eine schlechte Reproduzierbarkeit aufwiesen (2). Durch die R.E.A.L.-Klassifikation war also die erste einheitliche Einteilung geschaffen, die in vielen Ländern der Welt schnell akzeptiert wurde. Trotzdem schlug die WHO der ILSG vor, den Konsensus weiter zu vergrößern, indem noch weitere Lymphomexperten hinzugezogen werden. So sollte eine weltweit akzeptierte Klassifikation entstehen. Zehn Komitees mit 52 Lymphomexperten aus der ganzen Welt arbeiteten, unter Einbeziehung neuer Daten über die einzelnen Lymphomentitäten, einen neuen Klassifikationsvorschlag aus. Im November 1997 wurde dieser dann bei einem Treffen in Airlie House in Virginia einem Team aus Hämatoonkologen, dem Clinical Advisory Board, vorgestellt. Der Vorschlag wurde von den Experten einstimmig akzeptiert (57, 61). Wie das R.E.A.L-System beruht diese neue WHO-Klassifikation von 1998 auf der Einteilung der Lymphome nach ihrer physiologischen Vorläuferzelle und deren Reifegrad, der Morphologie, dem Genotyp
22 10 und der Klinik. So entstehen auch hier drei Hauptgruppen: B-Zell-Lymphome, T/NK- Zell-Lymphome und das Hodgkin-Lymphom (61). Auf ein Grading über mehrere Lymphomgruppen hinweg wurde weiterhin verzichtet. Da der histologische Grad oft nicht mit der klinischen Aggressivität der Neoplasie übereinstimmt, erfolgt das Grading bis heute nur innerhalb der einzelnen Lymphomentität. Aufgrund neuer Erkenntnisse seit 1994 wurden einige Änderungen in der Terminologie vorgenommen. Das follicle center -Lymphom der R.E.A.L.-Klassifikation wurde nun als follikuläres Lymphom bezeichnet. Das angiozentrische Lymphom wurde durch den Begriff nasales T/NK-Zell-Lymphom ersetzt und das hochgradige Lymphom, Burkittlike, konnte durch histochemische Untersuchungen entweder dem Burkitt Lymphom als gesonderte Entität oder den großzelligen B-Zell-Lymphomen zugeordnet werden (68). Das Prinzip der neuen WHO-Klassifikation ist, wie bei dem R.E.A.L.-System, die Anerkennung der Lymphome als verschiedene Krankheiten mit ganz unterschiedlichen Merkmalen. Weltweit akzeptiert ist sie heute der Gold-Standard der Lymphomklassifikationen und gewährleistet optimale individuelle Therapiestrategien (61). Tabelle 5 im Anhang gibt einen Überblick über die einzelnen Lymphomklassifikationen. 1.6 Stadieneinteilung der Non-Hodgkin-Lymphome Die Stadieneinteilung der Non-Hodgkin-Lymphome folgt dem Staging-System nach Ann Arbor. Je nach Ausdehnung des Tumors unterteilt es die Lymphome in die Stadien I-IV. Zusätzlich wird das Vorliegen einer B-Symptomatik beurteilt. Diese beschreibt eine Trias der folgenden Symptome: Fieber > 38 C, Nachtschweiß und Gewichtsverlust von >10% des Körpergewichts innerhalb von sechs Monaten. Der Buchstabe B bezeichnet das Vorhandensein dieser Symptomatik bei Erstdiagnose, der Buchstabe A das Fehlen der genannten Symptome wurde dieses System auf einem Workshop in Ann Arbor, Michigan, von Carbone, Kaplan, Musshoff und weiteren Spezialisten vorgeschlagen. Aufgrund neuer Erkenntnisse in Diagnostik und Therapie der Lymphome sollte es die bis dahin bestehende Rye-Klassifikation aktualisieren und stieß auf breite Akzeptanz. Obwohl die genannten Klassifikationen ursprünglich für das Hodgkin Lymphom entwickelt wurden, fanden sie jedoch bald auch Anwendung beim Staging der Non-Hodgkin-Lymphome (24, 32).
23 11 Das Ann-Arbor System unterschied sich in drei wesentlichen Punkten von der 1965 entwickelten Rye-Klassifikation (24, 118). Zum einen wurde die Unterteilung in die Subgruppen nodaler und extranodaler Befall vorgenommen. Das damalige System hatte die extranodalen Manifestationen der Lymphome dem Stadium IV zugeordnet, da von einer schlechteren Prognose ausgegangen wurde. Dazu zählten zum Beispiel der Befall von Lunge, Niere, Haut, Knochen oder des Gastrointestinaltraktes. Wie Musshoff jedoch feststellte, war durch moderne Therapie die Heilungsrate vergleichbar mit einem nodalen Befall und so entstand innerhalb der einzelnen Stadien die Zusatzbezeichnung E für extranodale Manifestationen (24). Eine weitere Änderung bestand in der Unterscheidung zwischen klinischem (CS) und pathologischem Staging (PS). Das klinische Staging umfasst die Anamnese, eine klinische Untersuchung, Laborwerte und bildgebende Verfahren, das pathologische Staging bezieht sich auf Erkenntnisse durch chirurgische Maßnahmen, wie Laparoskopien oder Biopsien der befallenen Lymphknoten bzw. Organe (32). Die dritte Veränderung betraf die Definition der B-Symptomatik. In der Rye-Klassifikation bestand sie aus Fieber, Nachtschweiß und Juckreiz (24) wurde das System von Musshoff und Volmer nochmals modifiziert, was besonders das Staging der Magenlymphome betraf (94). Bis heute bildet das Ann-Arbor Staging System die wichtigste Grundlage bei der Therapieauswahl für Patienten mit Non-Hodgkin-Lymphomen (41). Die heute gängige Definition der Stadien I-IV findet sich im Anhang (Tabelle 6). 1.7 Klinische Präsentation Das diffus großzellige B-Zell-Lymphom, als aggressives Lymphom, zeigt in der Regel eine akute bzw. subakute Symptomatik, während die indolenten Lymphome nicht so schnell wachsen und daher eher schleichend und spät zu Symptomen führen (51). Klassisch für eine Lymphommanifestation ist eine Lymphadenopathie. Beim DLBCL zeigt sich diese häufig in einer Vergrößerung der cervicalen und abdominellen Lymphknoten, kann jedoch auch jedes andere lymphatische Gewebe betreffen (49). Als nodal wird neben jeglichen Lymphknoten des Körpers auch ein Befall des Waldeyer-Rachenrings, inklusive Tonsillen, Zungenboden und Nasopharynx, sowie der Milz bezeichnet (81). Bei 47% der Patienten mit aggressivem NHL zeigt sich eine klassische Symptomtrias, die in Punkt 1.6 bereits beschriebene B-Symptomatik. Auf diese sollte bei der Anamnese besonders geachtet werden (51). Obwohl diese Symptomatik auch bei nodalem Befall gesehen wird, scheint sie etwas häufiger bei Patienten mit extranodalem Befall aufzutreten. Dieser findet sich primär bei 10-35% der
24 12 Patienten (51), für das diffus großzellige B-Zell-Lymphom wurden sogar Raten bis zu 40% beschrieben (91). Am häufigsten betroffen ist der Gastrointestinaltrakt, aber auch jedes andere Organ kann von dem Tumor befallen werden. Dazu zählen unter anderem Haut, ZNS, Orbita, Schilddrüse, Speicheldrüsen, Skelett, Hoden, Niere, Lunge und Leber, in seltenen Fällen auch Prostata, Mamma oder die Ovarien (51, 81). Rund 15% der Patienten mit DLBCL weisen bei Erstdiagnose einen Knochenmarksbefall auf (53). Bei extranodalem Befall richtet sich die Symptomatik nach dem betroffenen Organ. So stellt sich der Patient mit gastrointestinalem Befall typischerweise mit Übelkeit, Erbrechen oder Völlegefühl vor, während bei einem Befall des Mediastinums thorakale Schmerzen und Husten im Vordergrund stehen. Durch das Einwachsen des Tumors in bestimmte Organe, kann es auch zu medizinischen Notfällen kommen. Beispiele hierfür sind eine Rückenmarkskompression, eine Perikardtamponade, eine akute Atemwegsobstruktion, eine Thrombembolie, eine Meningitis lymphomatosa oder auch die obere Einflussstauung bei Kompression der V.cava durch die Tumormasse. In diesen Fällen muss sofort gehandelt werden und eine entlastende Therapie eingeleitet werden (51). Aufgrund der Eigenschaft der aggressiven Non-Hodgkin-Lymphome und damit auch des DLBCL, so rapide und infiltrativ zu wachsen, befinden sich bis zu 60% der Patienten bei Erstdiagnose bereits in einem fortgeschrittenen Stadium (41). 1.8 Prognostische Faktoren Der wichtigste prognostische Faktor für Patienten mit diffus großzelligem B-Zell- Lymphom ist der IPI (International Prognostic Index). Er wurde 1993 publiziert, um Patienten mit hochaggressivem Lymphom vor der Therapie anhand ihrer klinischen Präsentation in prognostische Gruppen einteilen zu können. Fünf Faktoren sind relevant: das Alter (< 60 Jahre vs. 60 Jahre), ein erhöhter LDH-Spiegel, das Ann- Arbor-Stadium (I/II vs. III/IV), der Performance Status (< 2 vs. 2) und ein Extranodalbefall (< 2 vs. 2). Für jeden Faktor wird ein Punkt gegeben und die Summe aus diesen Punkten ergibt den IPI Score. Daraus entstehen vier Risikogruppen mit unterschiedlichem Gesamtüberleben nach fünf Jahren (3): Low risk (IPI 0-1), 5-J-ÜL: 73% Low intermediate risk (IPI 2), 5-J-ÜL: 51% High intermediate risk (IPI 3), 5-J-ÜL: 43% High risk (IPI 4-5), 5-J-ÜL: 26%.
25 13 Für Patienten unter 60 Jahren wurde der sogenannte age-adjusted -IPI eingeführt. Er enthält nur drei prognostische Faktoren: erhöhter LDH-Spiegel, Ann-Arbor Stadium und den Performance Status. Daraus ergeben sich vier andere Risikogruppen (3): Low risk (IPI 0) Low intermediate risk (IPI 1) High intermediate risk (IPI 2) High risk (IPI 3). Auch dieser Score fand schnell Anklang und wird bis heute zur Prognosebestimmung verwendet. Seit der Veröffentlichung des IPI Scores kam es zu einer bahnbrechenden Veränderung in der Therapie der DLBCL. Der Antikörper Rituximab wurde in das Standardtherapieregime aufgenommen und verbesserte die Ergebnisse deutlich. Daher wurde die prognostische Aussagekraft des bisherigen IPI-Scores in Frage gestellt. Ziepert und Kollegen fanden jedoch heraus, dass diese Zweifel unbegründet waren und der Standard IPI auch in der Rituximab-Ära noch valide bleibt (145). Ein weiterer prognosebestimmender Faktor der DLBCL ist der Typ des Genexpressionsprofils. Patienten mit einem Lymphom des germinal-center Typs (GCB) zeigten ein deutlich besseres Überleben als Patienten mit einem Lymphom vom aktivierten B-Zell-Typ (ABC), da dieses den NF-к-B Signalweg aktiviert, der wiederum die Wirkung der Chemotherapeutika abschwächt (5). Wichtig für die Prognose des rezidivierten Non-Hodgkin-Lymphoms ist das Ansprechen auf die Firstline Therapie. Wurde dabei eine komplette Remission erzielt, ist die Chance höher, auch bei einer Rezidivtherapie einen Erfolg zu erzielen. Hat die initiale Therapie jedoch versagt, ist es wahrscheinlich, dass auch die Therapie des Rezidivs nicht anschlägt (53, 109). 1.9 Diagnostik Für die bestmögliche Therapieplanung ist es wichtig, eine genaue Diagnostik durchzuführen, die Informationen über den Zustand des Patienten, die Eigenschaften und die Lokalisation des Tumors gibt (53). Neben einer ausführlichen Anamnese und der klinischen Untersuchung der Patienten, umfasst das initiale Staging Laborwerte, eine Bildgebung und vor allem eine Biopsie des betroffenen Areals, um die Diagnose eines Non-Hodgkin-Lymphoms stellen und das genaue Stadium festlegen zu können. Zu den Laborwerten zählen ein großes Blutbild mit Differential, das zum Zeitpunkt der Diagnose bei 60% der Patienten abnorme Werte aufweist (20), die Serumelektrolyte,
26 14 v.a. Calcium, die Serumglucose und Albumin. Wichtig ist außerdem die Beurteilung der Leber- und Nierenfunktion, da die meisten Chemotherapeutika nephrotoxisch wirken und die Leber belasten. Daher werden die folgenden Werte erhoben: AP, AST, ALT, Creatinin, BUN, Harnsäure und β2-mikroglobulin. Letztere weisen auf eine Tumorlyse hin, genau wie eine Erhöhung der Lactatdehydrogenase (LDH) (53), die bei Erstdiagnose in 50% der Patienten mit DLBCL einen pathologischen Wert zeigt (1). Bei Risikofaktoren sollte zusätzlich eine HIV-Serologie, sowie eine Hepatitis B- und C- Serologie durchgeführt werden (95, 99, 133), da es bei diesen Erkrankungen gehäuft zum Auftreten von Non-Hodgkin-Lymphomen kommen kann. Bei allen Patienten sollte eine Knochenmarkspunktion mit Aspiration erfolgen. Dieses Aspirat wird dann cytogenetisch untersucht, um einen möglichen Befall des Knochenmarks durch den Tumor feststellen zu können (51). Standard der bildgebenden Verfahren bei der Diagnostik der Lymphome ist die Computertomographie (CT) des Thorax, des Abdomens und des Beckens. Man erkennt deutlich ob ein nodaler oder ein extranodaler Befall vorliegt und besonders intraabdominelle Organe lassen sich gut darstellen. Ein weiteres Verfahren ist die Magnetresonanztomographie (MRT), sie kommt bei Verdacht auf Knochen- oder ZNS-Befall zum Einsatz (53, 95). Die Positron- Emissions-Tomographie (PET) stellt ein neueres Verfahren beim Staging von Non- Hodgkin-Lymphomen dar. Durch den Tracer Fluordesoxyglucose werden maligne Tumoren sichtbar gemacht, die glykolytische Aktivität besitzen (52). Diese Untersuchung in Kombination mit einer Computertomographie ist heute essentiell bei der Diagnostik des diffus großzelligen B-Zell-Lymphoms (95). Aktuelle Studien zeigen, dass vor allem auch ein Knochenmarksbefall mit Hilfe einer PET-CT akkurater diagnostiziert werden kann, als durch eine Biopsie (19, 72). Bei Lymphomen des ZNS, bei Knochenmarksbefall, sowie bei epiduralen Lymphomen, ist eine Lumbalpunktion notwendig. Diese sollte auch bei Befall der Nasennebenhöhlen und bei testikulären Lymphomen erfolgen, da diese häufig mit einem ZNS-Befall einhergehen. Weitere Risikofaktoren für einen Befall der Rückenmarksflüssigkeit sind hochaggressive Lymphome, sowie HIV-assoziierte Lymphome. Daher sollte auch hier immer eine Lumbalpunktion durchgeführt werden (53, 95). Die endgültige Diagnosesicherung erfolgt jedoch nur durch eine Biopsie der Manifestation. Bei vergrößerten Lymphknoten, die länger als vier bis sechs Wochen persistieren oder größenprogredienten Lymphknoten sollte immer einer Gewebeprobe entnommen werden (51). Eine Feinnadelaspiration kann zwischen benigner Lymphadenopathie und lymphoproliferativer Erkrankung unterscheiden, eignet sich jedoch nicht zur Diagnosestellung einzelner Histologien (7). Für die histologischen, immunologischen
27 15 und molekulargenetischen Untersuchungen ist eine größere Gewebeprobe notwendig (60), die entweder CT gesteuert (16) oder laparoskopisch entnommen werden kann (8) Therapie des DLBCL Therapiegrundlagen Früher war die Strahlentherapie die Behandlungsform der ersten Wahl für das diffus großzellige B-Zell-Lymphom. Heute weiß man, dass dieses aggressive Lymphom aufgrund seiner Invasivität und Wachstumsgeschwindigkeit als systemische Erkrankung betrachtet werden muss und daher auch systemisch therapiert werden sollte (62, 135). Trotzdem bietet die adjuvante Bestrahlung des Tumors verbesserte lokale Kontrollraten, sowie einen Vorteil bezüglich des Gesamtüberlebens (12, 90, 108) Systemische Therapie Als Firstline Chemotherapie wird das CHOP-Schema oder ein ähnliches Schema verwendet. Es enthält Cyclophosphamid, Doxorubicin, Vincristin und Prednison (44). Seinen Durchbruch erfuhr dieses Schema vor 35 Jahren, da es einen deutlichen Überlebensvorteil gegenüber anderen Chemotherapeutika zeigte (86). Die Gabe des Antikörpers Rituximab gehört seit rund zehn Jahren zu einem festen Bestandteil der Therapie der aggressiven, CD20 positiven Lymphome: die Groupe d Etudes des Lymphomes de l Adulte zeigte damals einen deutlichen Überlebensvorteil für die Patienten, die zusätzlich zu CHOP den Antikörper erhalten hatten (31) und bewies diesen auch weiterhin ein paar Jahre später (44). Seitdem haben auch andere Studien immer wieder gezeigt, dass die zusätzliche Gabe des Antikörpers sowohl das Gesamtüberleben, als auch das krankheitsfreie Überleben verbesserte (44, 56, 105, 124) und festigten so die Rolle des Antikörpers in der Therapie des DLBCL (29, 56). Der Antikörper wird jeweils am ersten Tag des Chemotherapiezykluses gegeben. Neuere Studien untersuchten den Effekt einer Verkürzung der Zeit zwischen den einzelnen Chemotherapiegaben von 21 auf 14 Tage. Anfangs konnte bei Zugabe von Rituximab für dieses 14-tägige Schema ein Überlebensvorteil gezeigt werden (104, 106, 107), inzwischen wurde dieser Vorteil jedoch widerlegt. Die Applikation von R- CHOP-14 zeigte zusätzlich eine höhere Rate an Nebenwirkungen, daher gilt R-CHOP- 21 weiterhin als Firstline Therapie (33, 35). Immer wieder wurde die Anwendung von intensiveren chemotherapeutischen Regimes geprüft. Während früher keine
28 16 Verbesserung der Überlebensraten gezeigt werden konnte (46), zeigten aktuellere Studien einen Überlebensvorteil für eine intensivierte Chemotherapie mit ACVBP (Doxorubicin, Cyclophosphamid, Vindesin, Bleomycin, Prednison), vor allem bei zusätzlicher Gabe von Rituximab und konsolidierender Strahlentherapie (71, 114). Bei sehr gebrechlichen Patienten (Alter > 85 Jahre, hohe Anzahl an Komorbiditäten oder geringer Leistungsstatus) hat sich auch die Anwendung von Rituximab als Monotherapie bewährt. Zusätzlich kann hier die Gabe der Chemotherapeutika Bendamustin oder Vinblastin erfolgreich sein (30, 103). Abbildung 2: Vergleich CHOP mit RCHOP (44) Radiotherapie Erfolg zeigt die Strahlentherapie bei der Therapie des DLBCL vor allem im Rahmen der lokalen Kontrolle, bei Bestrahlung eines Bulk-Tumors, eines extranodalen Befalls (9, 120) oder zur Reduktion von einzelnen verbliebenen Lymphommanifestationen nach Chemotherapie (141). Auch im Rahmen der palliativen Behandlung spielt sie eine bedeutende Rolle (137). Eine kombinierte Radiochemotherapie kann die Heilungschancen der Lymphompatienten deutlich verbessern (108). Im Rahmen dieser Kombinationstherapie wird die Radiotherapie in der Regel vier bis sechs Wochen nach Abschluss der Chemotherapie begonnen und wird dann über drei bis vier Wochen durchgeführt (55). Je nach Tumorgröße und Zustand des Patienten schwanken Dosis und Feldgröße.
29 17 Feldgrößen bzw. behandelte Volumina Die Größe des Bestrahlungsfeldes bzw. des zu behandelnden Volumens ist abhängig von der Ausbreitung der Lymphommanifestationen, aber auch von der Zielsetzung der Therapie. Man unterscheidet verschiedene Feldgrößen/Volumina (41, 137): Involved node: Bestrahlt wird hier nur der makroskopisch sichtbare Tumor, also das GTV (gross tumor volume) mit einem Sicherheitssaum von 1-2 cm. Involved field (IF) : Dieses Volumen umfasst die gesamte befallene LK-Region mit einem Sicherheitssaum von 1-2 cm. Bei Extranodalbefall umschließt es diesen und die erste angrenzende LK-Region. Extended field (EF): Dieses Volumen ist etwas größer. Es besteht aus dem Involved field und beinhaltet mindestens die nächste benachbarte LK-Station. Die folgenden Felder sind typisch für eine EF-Bestrahlung (137): - Waldeyer-Rachenring, vom Boden der Keilbeinhöhle bis zu den cervicalen Lymphknoten reichend - Mantelfeld, umfasst die LK submandibulär, cervical, supra- und infraclaviculär, axillär, mediastinal, hilär und reicht bis zum BWK 10 - Minimantelfeld: umfasst das Mediastinum, die LK hilär, supra- und infraklavikulär; von Larynx bis Th (15) - Abdominelles Bad: Bestrahlung des gesamten Bauchraumes, unter Einschluss der pelvinen und inguinalen LK, sowie der Milz und der Leber - Stanford Technik: hier wird das gesamte Abdomen und das Becken bis zur WK- Vorderkante bestrahlt. TLI/TNI: Die TNI (total nodal irradiation) schließt, mit Ausnahme der mesenterialen LK, alle LK-Regionen des Körperstammes, sowie cervicale LK und die Milz ein. Bei der TLI (total lymphatic irradiation) werden zusätzlich der Waldeyer- Rachenring und die mesenterialen LK bestrahlt. Aufgrund starker Toxizität und verbesserten Therapiealternativen, werden diese Methoden heute nur noch selten angewendet. Die klinischen Zielvolumina, die bestrahlt werden, werden nach den ICRU Reports definiert (87): GTV (Gross Tumor Volume): Dieses Volumen bezeichnet den makroskopisch sichtbaren Tumor.
30 18 CTV (Clinical Target Volume): Hier werden zusätzlich an den Tumor angrenzende Regionen erfasst, die mit großer Wahrscheinlichkeit Tumorzellen enthalten. PTV (Planning Target Volume): Dieses Volumen berücksichtigt räumliche Verschiebungen durch Atmung, Peristaltik oder durch eingeschränkte Reproduzierbarkeit des Feldes bei fraktionierter Bestrahlung und beinhaltet daher einen zusätzlichen Sicherheitssaum. TV (Treated Volume): Dieses Volumen wird von einer Fläche begrenzt, auf der die Energiedosis ausreichend ist, um das erwünschte Therapieziel zu erreichen. IV (Irradiated Volume): Hier werden zusätzlich die Regionen berücksichtigt, die ungewollt Strahlung erhalten. Dieses Volumen sollte möglichst klein gehalten werden. Um die Toxizität möglichst gering zu halten, erfolgt die adjuvante Bestrahlung des diffus großzelligen B-Zell-Lymphoms üblicherweise in Involved field Technik (95). Dosis Die Bestrahlungsdosis bei der Behandlung des DLBCL liegt zwischen 30 und 50 Gy. Nach verkürzter Chemotherapie (drei bis sechs Zyklen) mit anschließender Involved field Bestrahlung der Tumorregion sind höhere Dosen von Gy anzuwenden, um eine optimale lokale Kontrolle zu erzielen (90, 141). Bei Patienten, die sich nach Chemotherapie in kompletter Remission befinden, scheint eine geringere Bestrahlungsdosis ähnlich effektiv zu sein (38, 83). Haben die Patienten die volle Chemotherapie erhalten (sechs bis acht Zyklen), sind ebenfalls geringere Dosen (30-40 Gy) ausreichend (108). Bei sehr ausgedehnter Tumormanifestation vor der Chemotherapie oder einem Resttumor wird oft ein etwas größeres Feld mit einer Dosis von Gy bestrahlt und anschließend ein Boost von 10 Gy auf diese kleinere Region gegeben (137). Technik Bis zu den 1990er Jahren wurden die Bestrahlungen in einer konventionellen 2D- Technik geplant. Anhand der bildgebenden Verfahren (Röntgen oder CT) wurde der Tumor lokalisiert und die Feldgröße bestimmt. Diese musste ausreichend groß sein, um den Tumor auch in seinen Ausläufern mit der verschriebenen Dosis zu erfassen. Am Therapiesimulator wurde die Ausdehnung in Körperlängs- und Körperquerrichtung bestimmt. Die Dosis in der Tiefe wurde durch die Wahl einer geeigneten
31 19 Photonenenergie erreicht. Die Bestrahlung erfolgte über opponierende Gegenfelder (ap/pa). Diese Technik ist jedoch nicht sehr präzise, da die exakte Dosisverteilung innerhalb des Feldes nicht genau ermittelt werden kann und die Übertragung der Tumorausdehnung von Röntgen- oder CT-Aufnahmen in die Simulationsbilder fehleranfällig ist (121). Daher wurde die konformale 3D-Planungstechnik entwickelt. Anhand einer CT-Aufnahme in Bestrahlungsposition können in einem Computer- Planungssystem die Tumorlokalisation und das Bestrahlungsvolumen genau definiert werden. Schicht für Schicht wird das geplante Volumen eingezeichnet und die Dosis, die das Lymphom treffen soll, festgelegt. Auch die umgebenden Risikoorgane können so genau identifiziert werden und anhand des Dosis-Volumen-Histogramms (DVH) kann ermittelt werden, wie viel Dosis diese maximal treffen darf, um die Nebenwirkungen so gering wie möglich zu halten (111). Die Definitionen der geplanten Zielvolumina erfolgen nach den oben genannten Kriterien (87). Nachdem die endgültige Dosisverteilung vom Physiker berechnet und vom Strahlentherapeuten akzeptiert wurde, wird der Plan am Patienten simuliert. Bei der Strahlentherapie können die Bestrahlungsfelder durch Multi-Leaf-Kollimatoren im Linearbeschleuniger an die Form des Tumors bzw. des Planungszielvolumens angepasst werden. Wichtig bei der Planung ist, dass sich bestimmte Voraussetzungen im Laufe der Bestrahlung verändern können. So müssen zum Beispiel die Veränderungen durch die Beweglichkeit der Organe durch Atmung oder minimale Veränderungen bei Aufbau und Lagerung des Patienten in jeder Bestrahlungssitzung in die Planung einbezogen werden. Bestimmte Organe können je nach Zustand des Patienten auch ihre Form und Größe ändern, zum Beispiel die Blase oder der Magen (111). Eine Erweiterung dieser Bestrahlungstechnik ist die Intensitäts-modulierte Radiotherapie (IMRT). Durch metallische Kompensatoren im Bestrahlungsweg oder bewegliche Multi-Leaf-Blenden können nicht nur die Bestrahlungsfelder an die Lymphomform angepasst, sondern auch die Intensitäten innerhalb der Felder reguliert werden. Dadurch läßt sich der Hochdosisbereich noch besser an das Planungsvolumen anpassen und das umliegende Normalgewebe wird bestmöglich geschont. Dieses Verfahren eignet sich besonders bei kompliziert geformten Tumoren und bei Tumoren, die eng an Risikoorgane grenzen, zum Beispiel im Kopf-Hals-Bereich (137, 138). Eine weitere neue Hochpräzisionstechnik ist die image-guided-radiotherapy (IGRT). Hier erfolgt kurz vor der Bestrahlung noch einmal eine Röntgen- oder CT-Aufnahme des Patienten. Dadurch kann die Position des Tumors und der Risikoorgane erneut überprüft und bei Bedarf die Position des Bestrahlungstisches korrigiert werden. Auch
32 20 bei dieser Methode soll sichergestellt werden, dass das geplante Volumen die nötige Dosis erhält und die Risikoorgane optimal geschont werden (41) Therapie der lokalisierten Stadien Zu den lokalisierten Stadien zählen das Ann-Arbor Stadium I und das Ann-Arbor Stadium II mit einer Tumorgröße < 5 cm (non-bulky). Ein Stadium II Befall mit Bulk Tumor weist eine deutlich schlechtere Prognose auf und wird daher wie die fortgeschrittenen Stadien behandelt (41). Initial sollte immer eine Chemotherapie erfolgen, eine zusätzliche Bestrahlung zeigte deutliche Überlebensvorteile. Drei Zyklen CHOP gefolgt von einer Involved field Radiotherapie mit Gy verbesserten sowohl das krankheitsfreie Überleben als auch das Gesamtüberleben, gegenüber acht Zyklen Chemotherapie ohne Bestrahlung (90). Auch die Toxizität bei verkürzter Chemotherapie war geringer. Zwar traten auf lange Sicht mehr outfield Rezidive in Kombination mit der Strahlentherapie auf, jedoch beeinflussten diese keine der beiden Überlebensraten (88). Auch nach der Einführung von Rituximab als Standardtherapie des DLBCL konnte der Benefit einer Involved field Bestrahlung nach Chemotherapie bestätigt werden: drei Zyklen R-CHOP und anschließende IF-RT mit Gy erzielten gute Resultate (102). Eine Studie des MD Anderson Cancer Centers von Phan et al. aus dem Jahre 2010 zeigte einen signifikanten Überlebensvorteil für Patienten, die nach sechs Zyklen R-CHOP bestrahlt wurden, im Gegensatz zu Patienten, die nur R- CHOP erhalten hatten (108). Aufgrund dieser Ergebnisse und nach den bestehenden NCCN-Leitlinien sollten Patienten mit lokalisiertem diffus großzelligen B-Zell-Lymphom nach dem folgendem Schema therapiert werden: Patienten ohne Risikofaktoren (nach dem IPI-Score) erhalten drei bis vier Zyklen R-CHOP und anschließend eine Involved field Bestrahlung (95). Für Patienten mit einer initial sehr großen Tumormasse (Bulk) oder anderen Risikofaktoren sind sechs bis acht Zyklen R-CHOP mit anschließender IF Strahlentherapie des Bulks adäquat (95, 97). Bei Kontraindikationen für eine Strahlentherapie sind alternativ zu diesem Schema auch 6-8 Zyklen systemischer Therapie ohne Bestrahlung denkbar (95). Bestehen Kontraindikationen für eine Chemotherapie (hohes Alter, Komorbiditäten, Palliation) kann eine Extended field Bestrahlung als alleinige Therapie erwogen werden. Dann sollte die gesamte Region mit einer Dosis von Gy bestrahlt werden und anschließend die befallenen Regionen bis zu einer Gesamtdosis von Gy geboostet werden (137). Allerdings können dadurch keine dauerhaften Erfolge erzielt werden (62, 135).
33 Therapie der fortgeschrittenen Stadien Auch im Stadium II mit bulky-disease, Stadium III und Stadium IV ist eine Firstline Chemotherapie essentiell. Standard sind sechs bis acht Zyklen R-CHOP, auch Varianten dieses Schemas, wie zum Beispiel eine Verkürzung der Intervalle zwischen den Zyklen oder der Zusatz des Zytostatikums Etoposid können Erfolge erzielen (95). Die Rolle der Strahlentherapie in diesen Stadien ist umstritten, allerdings konnte immer wieder ein signifikanter Vorteil einer Strahlentherapie nach erfolgreicher Chemotherapie gezeigt werden (75, 108). Besonders bei initialem Bulk- oder Extranodal-Befall ist die Bestrahlung der ursprünglichen Tumormasse, sogar im disseminierten Stadium IV, zu empfehlen (9, 120). Die Dosis schwankt zwischen Gy Therapie im Rezidiv Der Therapiestandard des rezidivierten Lymphoms ist seit der PARMA-Studie die Hochdosischemotherapie mit anschließender autologer Stammzelltransplantation (109). Sie zeigte Langzeitüberlebensraten von 50% im Gegensatz zu konventioneller Chemotherapie. Hochdosisschemata zur Stammzellmobilisierung sind zum Beispiel ICE (Ifosfamid, Carboplatin, Etoposid), DHAP (Dexamethason, Cytarabin, Cisplatin) (54), ESHAP (Etoposid, Methylprednisolon, Cytarabin, Cisplatin) (136) oder Gem-Ox (Gemcitabin und Oxaliplatin) (82), jeweils mit oder ohne Rituximab. Nach Entnahme der Stammzellen erfolgt die myelosuppressive Therapie. Nach zwei bis drei Zyklen wird das Therapieansprechen evaluiert, bei erfolgreicher Therapie wird die Stammzelltransplantation durchgeführt (50, 95). Alternativ werden Patienten, bei denen aufgrund von Alter oder Komorbiditäten ein solch intensives Therapieregime nicht möglich ist, mit anderen Chemotherapeutika behandelt. Zur Anwendung kommt zum Beispiel auch hier das R-Gem-Ox-Schema oder das CEPP Schema (Cyclophosphamid, Etoposid, Prednison, Procarbazin) (95). Auch hier kann eine Therapie mit dem Antikörper Rituximab in Kombination mit Chemotherapie Erfolge erzielen, allerdings scheint das Ansprechen auf eine Rituximab Therapie höher zu sein, wenn die Patienten in der Firstline Therapie noch kein Rituximab erhalten haben (44). Eine allogene Stammzelltransplantation weist eine sehr hohe Morbidität und Mortalität auf und sollte daher nur bei Patienten angewendet werden, bei denen die autologe Transplantation scheiterte (101). Eine konsolidierende Bestrahlung nach autologer Stammzelltransplantation scheint den Therapieerfolg zu erhöhen, ist jedoch noch nicht Teil der Standardtherapie des rezidivierten DLBCL (70).
34 Therapeutische Perspektiven Da der Einsatz von Rituximab bahnbrechende Erfolge gebracht hat, stellte sich seitdem immer wieder die Frage, ob weitere neue Therapeutika möglicherweise einen ähnlichen Effekt erzielen können. Daher wurden in den letzten Jahren viele neue Therapiemöglichkeiten erforscht (93). Einer dieser Ansätze zeigt die Wirksamkeit des Proteasom-Inhibitors Bortezomib bei diffus großzelligen B-Zell-Lymphomen des ABC- Typs. Er hemmt NF-к-B und erhöht so die Chemosensitivität dieses Lymphoms (40). Weitere positive Ergebnisse konnten mit dem CD22-Antikörper Epratuzumab und dem CD80-Antikörper Galiximab, jeweils in Kombination mit Rituximab, erreicht werden (77, 78). Neben den verschiedenen Oberflächenmolekülen der B-Zellen gibt es aber auch andere Angriffspunkte dieser neuen targeted therapy. Enzyme, wie zum Beispiel Rezeptor-Tyrosinkinasen und Histondeacetylasen oder Moleküle, die für die Regulation der Apoptose verantwortlich sind, können Ziele bei der Therapie der Non-Hodgkin- Lymphome sein (93). Langzeitergebnisse durch prospektive Studien und Vergleiche mit anderen Therapeutika bleiben abzuwarten Fragestellung Diese Arbeit zeigt einen Überblick über die Ergebnisse einer retrospektiven Analyse von 102 Patienten mit histologisch gesichertem DLBCL, die zwischen 1987 und 2009 am Klinikum Rechts der Isar in München radiotherapeutisch behandelt wurden. Das Ziel dieser Analyse ist es, den Einfluss verschiedener Faktoren auf das Gesamt- und ereignisfreie Überleben zu bewerten und verschiedene Therapieoptionen zu vergleichen. Die Rolle der Strahlentherapie in der Behandlung des DLBCL ist seit einigen Jahren sehr umstritten, daher sollen die Ergebnisse dieser Analyse einen Hinweis darauf geben, ob eine Bestrahlung in der Therapie des DLBCL weiterhin sinnvoll ist. 2 Material und Methoden 2.1 Auswahlkriterien Zunächst wurden für diese Arbeit 400 Patienten, die aufgrund eines Non-Hodgkin- Lymphoms zwischen 1987 und 2009 an der Klinik für Strahlentherapie des Universitätsklinikums der TU München, Klinikum Rechts der Isar, behandelt wurden, in
35 23 einer Datenbank erfasst. Die Akten wurden aus den verschiedenen Archiven zusammengetragen und retrospektiv analysiert Einschlusskriterien Einschlusskriterien für die weitere Analyse waren ein bioptisch und histologisch gesichertes DLBCL, sowie eine strahlentherapeutische Behandlung in unserer Klinik. 130 Patienten erfüllten die Einschlusskriterien Ausschlusskriterien Patienten mit Primärmanifestation im ZNS und Patienten, die sich bereits mit Tumorrezidiv erstmals bei uns vorstellten, wurden aus der Studie ausgeschlossen. Ausschlusskriterien waren außerdem ein transformiertes DLBCL und ein das Überleben beeinflussendes Zweitmalignom. Damit blieben 102 Patienten, die für diese Arbeit retrospektiv analysiert wurden. 2.2 Datenerhebung Datenerfassung Der Krankheitsverlauf der Patienten und Informationen über Diagnostik und Therapie wurden den Akten der Strahlentherapie des Klinikums Rechts der Isar entnommen. Fehlende Dokumente konnten im SAP System eingesehen werden oder bei den untersuchenden Instituten angefordert werden. Während der Analyse wurde jeder Patient nach bestimmten Kriterien beurteilt. Erhoben wurden, neben Alter und Geschlecht, auch die genaue Lokalisation der Erstmanifestation des NHL, das genaue Stadium nach Ann Arbor bei Erstdiagnose und Details über die Therapie. Außerdem wurde der Leistungsstatus nach ECOG erfasst. Er beschreibt den Allgemeinzustand eines Patienten bei Erstdiagnose und berücksichtigt vor allem die Fähigkeit den Alltag alleine bewältigen zu können (98), (s. Anhang). Um die Prognose besser einschätzen zu können, wurde die Höhe der LDH vor und nach der Strahlentherapie erhoben. Eine erhöhte LDH weist auf einen Zellzerfall hin und fungiert daher als Tumormarker. Als pathologisch wurden Werte >240 U/l gewertet. Anhand all dieser Parameter konnte nun der International Prognostic Index (IPI) ermittelt werden. Ein extranodaler Befall wurde definiert als Befall von Gewebe und Organen außerhalb eines Lymphknotens bzw. anderen lymphatischen Gewebes, ein nodaler Befall wurde charakterisiert als Befall des
36 24 Lymphknotens bzw. anderen lymphatischen Gewebes selbst. Als Tumorbulk wurde jede Tumormanifestation > 5cm bezeichnet. Die Erhebung oben genannter Werte war aufgrund von mangelnder Dokumentation oder teilweise sehr weit zurückliegender Diagnostik nicht bei allen Patienten möglich. Erhoben wurden zusätzlich genaue Informationen über die Therapiemodalitäten: Art des Chemotherapeutikums und Anzahl der Zyklen, die Bestrahlungsindikation, -dauer und dosis, die Größe des bestrahlten Volumens, die Bestrahlungstechnik und die Art der applizierten Strahlen (Photonen/Elektronen). Nach Chemo- und Radiotherapie wurde jeweils der Remissionsstatus erfasst. Außerdem wurden Informationen über den Rezidivzeitpunkt, -manifestationsort und -therapie gewonnen Follow-up Die Nachsorge erfolgte im ersten Jahr nach der Behandlung alle drei bis sechs Monate in der Ambulanz der Klinik für Strahlentherapie im Klinikum Rechts der Isar, München, danach jährlich. Eine zusätzliche internistisch-onkologische Nachsorge erfolgte ein- bis zweimal pro Jahr, entweder bei niedergelassenen Ärzten oder in der III. Medizinischen Klinik des Klinikums Rechts der Isar und beinhaltete eine körperliche Untersuchung und eine diagnostische Bildgebung mittels CT bzw. PET-CT. Informationen über die ersten Jahre nach Ende der Therapie konnten so den Akten der Nachsorgeambulanz entnommen werden. Auskunft über das Gesamtüberleben wurde über das Tumorzentrum München und die zuständigen Einwohnermeldeämter ermittelt. Allerdings konnte aus diesen Daten die Todesursache nicht bei allen Patienten ermittelt werden. Diese wurde durch Auskunft der weiterbehandelnden Ärzte und durch die Angehörigen der Verstorbenen in Erfahrung gebracht. Aufgrund der teilweise sehr langen Follow-up Zeit war dies jedoch nicht bei allen Patienten möglich. Um den Allgemeinzustand der überlebenden Patienten beurteilen zu können, wurden diese telefonisch befragt. So konnte etwas über den weiteren Krankheitsverlauf nach Therapie und über mögliche Langzeitnebenwirkungen der Strahlentherapie in Erfahrung gebracht werden. Mit dem Einverständnis der Patienten wurden auch die weiterbehandelnden Ärzte angeschrieben. So wurden Informationen über eventuelle Rezidive und weitere Therapien eingeholt. Ende der Datenerfassung inklusive Follow-up war im Oktober 2010.
37 Statistische Methoden Für die weitere Analyse wurden alle Daten kodiert. Die statistische Auswertung erfolgte mit dem SPSS Programm, Version 18. Die primären Studienendpunkte waren das Gesamtüberleben und das ereignisfreie Überleben. Der sekundäre Endpunkt war die lokale Kontrolle im Bestrahlungsfeld. Das Gesamtüberleben wurde definiert als Zeit zwischen dem Tag der Erstdiagnose und dem Todeszeitpunkt, unabhängig von der Todesursache. Das ereignisfreie Überleben bezeichnete den Zeitraum zwischen Erstdiagnose und dem Auftreten von Rezidiv oder Tod, unabhängig von der Todesursache. Die lokale Kontrolle wurde aus dem Zeitraum zwischen Erstdiagnose und Rezidivauftreten errechnet. Die Überlebensraten wurden mit der Kaplan-Meier Methode bestimmt. Um den Einfluss verschiedener unabhängiger Parameter, wie zum Beispiel Stadium, Leistungsstatus oder Alter, auf das Überleben einschätzen zu können, wurden die uni- und multivariate Analyse mit Hilfe der Cox- Regression durchgeführt. Um die Gruppen bezüglich des Überlebens miteinander vergleichen und diese Unterschiede auf statistische Signifikanz überprüfen zu können, wurde der log-rank Test verwendet. Als statistisch signifikant galt ein p-wert 0,05. Die Häufigkeitsverteilung innerhalb der verschiedenen Untergruppen wurde mit dem Chi-Quadrat-Test analysiert. 2.4 Strahlentherapie Die Bestrahlung erfolgte mit einem Linearbeschleuniger mit sechs bis 15 MeV. Bei der Bestrahlungsplanung wurde die genaue Tumorlokalisation mittels einer CT- oder MRT- Aufnahme definiert. Auf dieser wird dann in einem Planungssystem das angestrebte Bestrahlungsvolumen von den Radiotherapeuten eingezeichnet und von den Physikern berechnet. Vor der endgültigen Bestrahlung erfolgt die Simulation des Bestrahlungsfeldes. Unter Röntgenkontrolle wird die optimale Tischposition und Lagerung des Patienten festgelegt. Benachbartes Gewebe und definierte Risikoorgane werden ausgeblockt und dadurch geschont. Seit den 1990er Jahren erfolgte eine computerassistierte 3D Konformationsbestrahlung, die eine exaktere Erfassung der Manifestation und eine bessere Schonung des Normalgewebes gewährleistete (137). Die Feldgrößen bestanden aus Involved field und Extended field, wie bereits in beschrieben.
38 Nebenwirkungen der Strahlentherapie In der Strahlenbehandlung wird prinzipiell zwischen akuten und chronischen Nebenwirkungen unterschieden. Zu den akuten Nebenwirkungen zählen diese, die innerhalb von 90 Tagen nach Strahlentherapieende auftreten, die chronischen Nebenwirkungen treten ab dem 91. Tag auf (111). Die akuten Nebenwirkungen sind im Allgemeinen reversibel, während chronische Nebenwirkungen persistieren können. Die akuten Nebenwirkungen wurden in dieser Arbeit nach den Common Toxicity Criteria Version 3.0 (CTCAE-3.0) beurteilt. Sie beschreiben adverse events, also unerwünschte Ereignisse und teilen diese in fünf unterschiedliche Schweregrade ein. Der fünfte Schweregrad bedeutet den Tod durch dieses unerwünschte Ereignis. Auch Grad 0 wird dokumentiert (keine Nebenwirkung). Grad 1 Nebenwirkungen verschwinden spontan wieder und bedürfen keiner Therapie. Grad 2 bezeichnet therapiebedürftige Toxizität, dies kann jedoch ambulant erfolgen. Die Grad 3 und 4 Nebenwirkungen erfordern eine stationäre Aufnahme und intensive Therapie und können lebensbedrohlich sein. Besonders bei Grad 4 ist häufig eine Unterbrechung oder sogar ein Abbruch der Radiotherapie notwendig (137). Die chronischen Nebenwirkungen werden nach dem LENT-SOMA-Score klassifiziert, der 1992 vom National Cancer Institute durch die Zusammenarbeit verschiedener Arbeitsgruppen entwickelt wurde. LENT beschreibt die late effects on normal tissues und SOMA die subjective objective management analysis. Auch dieser Score umfasst fünf Schweregrade, wobei Grad 5 wiederum eine letale Toxizität bedeutet und Grad 0 dokumentiert, dass keine Spätfolgen aufgetreten sind (123). Die Nebenwirkungen der Strahlentherapie hängen von der therapierten Region ab. Akute Nebenwirkungen zeigen sich im Bereich der bestrahlten Haut anhand von Erythemen, Epitheliolysen bis hin zu Ulcera. Auch Lymphödeme oder stauungen sind möglich (41, 137). Bei abdomineller Bestrahlung kommt es häufig zu gastrointestinalen Beschwerden, wie zum Beispiel Schmerzen, Diarrhoe oder Obstipation. Auch Strikturen, Stenosen und Fisteln des Darms sind möglich. Bei Bestrahlung der Beckenregionen können die Blase und die Nieren betroffen sein. Dies zeigt sich durch Zystitiden mit Dys- und Pollakisurie bzw. durch Nephritiden (41, 137). Bei Bestrahlung im Kopf-Hals-Bereich zeigen sich häufig eine Mukositis und/oder eine Xerostomie, sowie eine Dysphagie. Im Bereich der Lunge kann es zu einer Strahlenpneumonitis kommen (41, 137). Besonders die Kombination einer Radio- und Chemotherapie wirkt toxisch auf das Lungenparenchym. So ist zum Beispiel die Inzidenz einer Pneumonitis bei einer Bestrahlung nach Bleomycin deutlich erhöht, da dieses Zytostatikum
39 27 lungenschädigend wirkt (139). Die Bestrahlung kann, vor allem bei kombinierter Radiochemotherapie, auch toxisch auf die Hämatopoese wirken und eine Leuko-oder Thrombozytopenie hervorrufen. Diese erfordern, aufgrund der Infektions- bzw. Blutungsgefahr, besondere Überwachung (41, 137). Chronische Nebenwirkungen zeigen sich an den Organen zum Beispiel als Hepato-, Nephro- oder Kardiomyopathie. Dieser Effekt wird durch eine vorangegangene Zytostatikatherapie besonders verstärkt, da viele Chemotherapeutika selbst bereits toxisch auf diese Organe wirken (123, 137). Eine Langzeitnebenwirkung bei Bestrahlung im Genitalbereich kann die Infertilität sein, weshalb eine Kryokonservierung der Spermien bei diesen Patienten ratsam ist (41). Im Gegensatz zur Normalbevölkerung ist das Risiko ein Zweitmalignom zu entwickeln um ca. 6% erhöht. Bevorzugt treten solide Tumore, die akut lymphatische Leukämie und Morbus Hodgkin auf (41) Beurteilung des Therapieerfolges Das Therapieansprechen wurde nach den allgemein anerkannten Kriterien beurteilt (26). Eine komplette Remission lag vor, wenn nach der Therapie radiologisch und klinisch keine Anzeichen der Krankheit mehr festzustellen waren. Bei nodalem Befall musste sich der Lymphknoten auf normale Größe zurückgebildet haben. Eine Teilremission wurde definiert als ein Rückgang der Tumormasse von 50%, aber ohne Anzeichen einer kompletten Remission. Außerdem durften keine neuen Lymphommanifestationen sichtbar sein oder andere Lymphknoten an Größe zugenommen haben. Als Progress wurde eine Zunahme des Tumors oder das Auftreten einer neuen Tumormanifestation während oder am Ende der Therapie bezeichnet. Kein Ansprechen, stable disease, wurde definiert, wenn sich die Tumormanifestation < 50%, kaum sichtbar oder gar nicht reduziert hatte. Ein Rezidiv lag vor, wenn nach mehrmonatiger Remission eine neue Tumormanifestation auftrat. Diese wurden meist durch eine Bildgebung bei den Nachuntersuchungen entdeckt. Es wurde zwischen Infield- und Outfield Rezidiven unterschieden, je nachdem, ob die neue Manifestation innerhalb (Infield) oder außerhalb (Outfield) des zuvor bestrahlten Feldes lag (25, 26). Ebenso kamen diese Kriterien bei der Beurteilung des Chemotherapieansprechens zur Anwendung.
40 28 3 Ergebnisse 3.1 Patientenkollektiv Charakteristika 55 der 102 Patienten (54%) waren Männer, 47 (46%) Frauen. Das mediane Alter bei Erstdiagnose betrug 58 Jahre. 44 der Patienten (43%) zeigten bei Erstdiagnose ein Stadium I nach Ann-Arbor, 23 (22%) ein Stadium II, 15 (15%) ein Stadium III und 20 Patienten (20%) ein Stadium IV. 32 Patienten (32%) stellten sich mit B-Symptomatik vor, bei 72% dieser Patienten war die Erkrankung bereits fortgeschritten, im Stadium III oder IV. Extranodaler Befall fand sich bei 41 Patienten (40%), 61 Patienten (60%) hatten einen nodalen Befall. 57 Patienten (56%) wiesen einen Tumor-Bulk auf, während bei 45 der 102 Patienten (44%) die Tumormasse < 5 cm betrug. 19 Patienten (19%) hatten bei Erstdiagnose einen IPI-Score von 0, 36 (35%) einen IPI von 1-2 und 21 (21%) einen IPI Score von 3. Bei 26 Patienten (25%) war die Zuteilung zum IPI- Score aufgrund fehlender Daten nicht möglich. Die Charakteristika des Kollektivs sind in Tabelle 1 dargestellt (s. Anhang) Therapie im Kollektiv Alle 102 Patienten wurden radiotherapeutisch behandelt. Die Bestrahlung erfolgte bei der Mehrzahl der Patienten (83%) nach einer Chemotherapie, bei einer Patientin (1%) vor der Chemotherapie und bei 16% war die Strahlentherapie die alleinige Therapie des Lymphoms. Von den 85 Patienten (83%), bei denen die Chemotherapie first-line Therapie nach Erstdiagnose war, wurden 67% mit drei bis sechs Zyklen des CHOP- Regimes behandelt. Die Hälfte dieser Patienten (49%) erhielt zusätzlich den Antikörper Rituximab. Die restlichen 33% der Patienten erhielten andere Chemotherapie Schemata, drei davon in Kombination mit Rituximab. 19 Patienten (19%) erhielten CHOP- ähnliche Schemata: COP-BLAM (n=8), COP (n=3), CHOEP (n=3) und MGBG- CHOP (n=5). Ein weiterer Patient erhielt eine Kombination der Zytostatika Cyclophosphamid und Vincristin, drei weitere eine Monotherapie mit Vincristin. Die anderen Schemata waren ACOMED (n=3), CEVED (n=1) und Caelyx (n=1). 3.2 Therapieansprechen Das Ansprechen auf die Chemotherapie wurde nach den oben beschriebenen Kriterien beurteilt. Von den 85 Patienten, die mittels einer Chemotherapie behandelt wurden,
41 29 erreichten 23 (27%) eine Vollremission und wurden adjuvant bestrahlt. In Teilremission nach der Chemotherapie befanden sich 47 Patienten (55%). Hier wurde die Strahlentherapie angewandt, um eine vollständige Remission zu erzielen. Bei vier von 85 Patienten (5%) fand sich keine Veränderung der Tumorausdehnung und neun Patienten (11%) zeigten einen Progress unter Chemotherapie. Bei diesen beiden Untergruppen sollte die Bestrahlung den mangelnden Therapieerfolg verbessern. Bei zwei Patienten (2%) konnte das Ansprechen nicht beurteilt werden, da keine Bildgebung nach Chemotherapie vorlag. In der Regel begann die Strahlentherapie drei bis vier Wochen nach Ende der Chemotherapie. 17 Patienten (17%) erhielten nach Erstdiagnose sofort eine Strahlentherapie ohne vorhergehende Chemotherapie. Eine Patientin erhielt aufgrund eines sehr ausgeprägten Tumorbulks zuerst eine Bestrahlung, die den Tumor verkleinern sollte, anschließend folgten sechs Zyklen Chemotherapie nach dem CHOP-Schema. Nach der Therapie befand sich die Patientin in partieller Remission und lebt nun seit drei Jahren rezidivfrei. 16 Patienten (16%) wurden mit alleiniger Strahlentherapie behandelt, davon befanden sich neun Patienten im Stadium I, sechs im Stadium II und einer im Stadium III. Die Indikation für die alleinige Radiotherapie stellte sich bei zwölf Patienten aufgrund ihres hohen Alters oder gravierender Komorbiditäten, zwei Patienten lehnten eine Chemotherapie ab und zwei Patienten wurden vor 1995 bestrahlt, einer Zeit, in der die alleinige Radiotherapie bei lokalisiertem Stadium I noch Therapie der Wahl war. Die Indikation für eine Strahlentherapie der restlichen Patienten stellte sich bei 65 Patienten (64%) als Konsolidierung nach Chemotherapie. Von diesen konsoliderend bestrahlten Patienten wiesen 39 außerdem einen Bulk-Tumor und 18 einen Extranodalbefall auf. Bei 20 Patienten (20%) erfolgte eine zusätzliche Bestrahlung, da nach Chemotherapie ein Resttumor vorhanden war, der Tumor sich als refraktär oder sogar progredient erwies. 81 der Patienten (79%) wurden mit der Involved field Technik bestrahlt. Nur 21 Patienten (21%) wurden in einem Extended field bestrahlt. Diese Patienten wurden alle in den Jahren zwischen behandelt, eine Zeit in der es üblich war, weitläufigere Felder zu bestrahlen. Eine Bestrahlung des Mantelfeldes erfolgte bei vier Patienten, des Waldeyer schen Rachenrings bei drei Patienten und eine Bestrahlung beider Felder bei zwei weiteren Patienten. Eine Bestrahlung des abdominellen Bads wurde bei zwei Patienten durchgeführt. Insgesamt vier Patienten mit dessiminiertem
42 30 Befall (Stadium IV) erhielten eine prophylaktische Radiotherapie des Hirnschädels und der Neuroachse. Das Ansprechen auf die Bestrahlung der 85 Patienten, die zuerst eine Chemotherapie erhalten hatten, war wie folgt: Patienten, die sich nach Chemotherapie in kompletter Remission befanden (n=23), blieben zu 95% in CR. Bei einem Patienten war der Therapieerfolg aufgrund fehlender Daten nicht erneut beurteilbar. Von den Patienten, die sich nach CTx in partieller Remission befanden (n=47), erreichten 60% (28 Patienten) eine komplette Remission nach Radiotherapie. 32% (15 Patienten) blieben in PR und ein Patient (2%) zeigte nach Bestrahlung einen Progress im Bestrahlungsfeld. Bei drei Patienten (6%) konnte das Ansprechen nicht mehr beurteilt werden. Von den vier Patienten, die nach Chemotherapie unveränderte Tumormassen aufwiesen, zeigte nach Radiotherapie ein Patient eine komplette Remission, ein weiterer eine Teilremission und ein dritter einen Progress außerhalb des Bestrahlungsfeldes. Das Ansprechen des vierten Patienten konnte aufgrund fehlender Daten nicht beurteilt werden. Einer der neun Patienten (11%), die nach der CTx einen Progress zeigten, erreichte nach der Bestrahlung eine komplette Remission. Bei einem Patienten (11%) konnte ein Stillstand der Erkrankung hervorgerufen werden (SD). Bei den restlichen sieben Patienten (78%) waren die Lymphommanifestationen weiter progredient. Bei zwei weiteren Patienten konnte das Ansprechen auf die Chemotherapie aufgrund ungenügender Datenlage nicht erhoben werden. Beide Patienten befanden sich nach Radiotherapie in kompletter Remission. Insgesamt ergab sich bei allen 102 Patienten folgendes Ansprechen nach Chemoradiotherapie bzw. alleiniger Bestrahlung: bei 61% der Patienten verschwand die Tumormasse nach Bestrahlung vollständig und 24 (23%) der Patienten zeigten eine Teilremission. Bei einem Patienten fand sich keine Veränderung des Lymphoms und neun Patienten befanden sich nach Therapie im Progress. Bei sieben dieser Patienten war die Krankheit jedoch bereits vor der Strahlentherapie im Progress gewesen. Bei weiteren sieben Patienten konnte die Wirkung der Strahlentherapie nicht beurteilt werden, da sie nach dem Ende der Therapie bald verstarben (n=6) oder das Land verließen (n=1) und dadurch keine weitere Bildgebung erfolgen konnte. 3.3 Nebenwirkungen im Kollektiv Im gesamten Kollektiv zeigten 60 Patienten (59%) akute Nebenwirkungen während der Bestrahlung, davon 35 Patienten im Grad 1 oder Grad 2. Grad 1 Nebenwirkungen fanden sich insgesamt bei 24 Patienten (23%), Grad 2 Nebenwirkungen bei 11 Patienten
43 31 (11%). Mäßige bis schwerere Toxizität fand sich in Grad 3 bei 23 Patienten (23%) und in Grad 4 bei zwei Patienten (2%). Eine Unterbrechung der Therapie aufgrund der Nebenwirkungen war bei vier Patienten nötig. Alle vier wurden symptomatisch behandelt und die Radiotherapie konnte komplikationslos nach einer Pause von zehn bis 14 Tagen zu Ende geführt werden. Bei vier Patienten wurde die Therapie abgebrochen. Zwei Patienten zeigten eine AZ-Verschlechterung während der Bestrahlung und kein Ansprechen der Tumormanifestationen. Beide verstarben im Outfield Progress der Erkrankung. Ein weiterer Patient zeigte Grad 3 Nebenwirkungen im Gastrointestinaltrakt und brach daher die Therapie ab, er lebt seit zwei Jahren rezidivfrei. Ein Patient, der bereits vor Bestrahlung an einer Leberinsuffizienz litt, zeigte während der Bestrahlung des Oropharynx eine deutliche Verschlechterung des Allgemeinzustandes, litt an Atemnot aufgrund eines ausgeprägten Aszites. Er verstarb an den Folgen des Leberversagens. Insgesamt wurden 41 Patienten (40%) im Kopf-Hals-Bereich bestrahlt. 30 dieser Patienten (73%) zeigten akute Nebenwirkungen, elf in Grad 1, sechs in Grad 2 und elf in Grad 3. Zwei Patienten zeigten Grad 4 Nebenwirkungen. Die häufigste Nebenwirkung in diesem Areal war eine Dysphagie, die bei 18 dieser Patienten (44%) auftrat. Die zweithäufigste Nebenwirkung war eine Mucositis, bei 27% der Patienten. Weitere häufige Nebenwirkungen umfassten ein Erythem des bestrahlten Areals (neun Patienten) und Veränderungen des Blutbildes (neun Patienten). Selten waren Geschmacks- und Gewichtsverlust (jeweils drei Patienten), Xerostomie (drei Patienten), Ulcera der Mundöhle (zwei Patienten), Otitis externa und Parotitis (jeweils ein Patient). Meist traten mehrere dieser Toxizitäten kombiniert auf. Bei zwei älteren Patienten mit Grad 3 Nebenwirkung musste die Bestrahlung aufgrund starker Mucositis kurz unterbrochen werden. Nach erfolgreicher Behandlung konnte die Strahlentherapie nach zehn bis elf Tagen problemlos fortgesetzt werden. Die Patienten mit Grad 4 Nebenwirkung waren 70 und 71 Jahre alt und befanden sich bei Diagnose im Ann- Arbor Stadium III. Beide zeigten eine starke AZ-Verschlechterung, woraufhin die Therapie abgebrochen wurde. Ein Patient verstarb wenige Tage später am Progress des Tumors, der andere an den Folgen eines bereits bestehenden Leberversagens. 24 Patienten (23%) erhielten eine Strahlentherapie des Mediastinums oder des Thorax. Bei 13 dieser Patienten traten akute Nebenwirkungen auf. Sieben zeigten Toxizität in Grad 1, zwei in Grad 2, drei in Grad 3 und ein weiterer Patient zeigte schwere Nebenwirkungen, CTC Grad 4. Die Nebenwirkungen waren Dyspnoe (vier Patienten), Husten (drei Patienten) und Schmerzen (zwei Patienten) im bestrahlten Gebiet. Bei
44 32 vier Patienten fanden sich Blutbildveränderungen und bei drei weiteren verschlechterte sich der Allgemeinzustand durch die Bestrahlung, oft traten diese Reaktionen gemeinsam auf. Die Grad 4 Nebenwirkung manifestierte sich durch starke Atemnot und Husten, so dass die Therapie abgebrochen werden musste. Kurz darauf verstarb der Patient am Progress seiner Erkrankung. 16 Patienten (16%) wurden im Bereich des Gastrointestinaltraktes bestrahlt, neun zeigten akute Toxizität. Vier dieser Patienten hatten milde Nebenwirkungen (Grad 1 oder 2), die restlichen fünf Patienten mäßige Nebenwirkungen (Grad 3). Die häufigste Nebenwirkung in diesem Bereich war Nausea (sechs Patienten), gefolgt von Emesis (drei Patienten), Blutbildveränderungen (drei Patienten) und Diarrhoe (zwei Patienten). Bei einem Patienten fand sich ein Erythem des bestrahlten Areals. Auch hier traten diese Akutreaktionen meist in Kombination auf. Bei einer Patientin mit Grad 3 Nebenwirkung war aufgrund starker Übelkeit, Erbrechen und zusätzlichem Gewichtsverlust vorübergehend eine Unterbrechung der Therapie nötig. Diese konnte jedoch nach symptomatischer Behandlung komplikationslos weitergeführt werden. Bei einem weiterem Patienten (Grad 3) war aufgrund starker Diarrhoe und Übelkeit ein Abbruch kurz vor Ende der Therapie nötig. Er lebt heute seit zwei Jahren rezidivfrei. Vier Patienten (4%) wurden prophylaktisch im Bereich des ZNS (Pinkelschädel bzw. Neuroachse) bestrahlt, bei allen traten Nebenwirkungen auf (ein Patient Grad 1, drei Patienten Grad 3). Alle diese Patienten zeigten Veränderungen des Blutbildes, bei einem Patienten musste die Strahlentherapie daraufhin kurzfristig unterbrochen werden. Bei einem anderen traten zusätzlich eine lokale Alopezie und ein Erythem der bestrahlten Haut auf. Weitere Bestrahlungsfelder waren ossäre bzw. dermale Bereiche bei acht Patienten (8%), von denen jedoch nur drei Patienten milde Nebenwirkungen zeigten und pelvine Areale (LK iliacal-inguinal) bei vier Patienten (4%). Hier trat bei nur einem Patienten eine milde Nebenwirkung im Grad 1 auf (Radioderm). Außerdem wurden vier weitere Patienten (4%) im Bereich der Wirbelkörper bestrahlt und ein Patient (1%) an der Orbita. Bei diesen fünf Patienten wurden keine Akuttoxizitäten beobachtet. Hämatotoxizität fand sich insgesamt bei 21 Patienten (21%). Zehn Patienten zeigten eine Thrombopenie, neun Patienten eine Leukopenie und zwei Patienten eine Anämie. Es konnte kein bevorzugtes Bestrahlungsareal ausfindig gemacht werden, dass diese Akutreaktionen hervorrief. Im Allgemeinen wurden die Bestrahlungen gut toleriert, nur
45 33 bei einem Patient (prophylaktische RTx des Pinckelschädels) musste die Therapie kurzzeitig unterbrochen werden. 3.4 Überleben Die mediane Follow-Up Zeit betrug 89 Monate, das Minimum waren 16, das Maximum 253 Monate. Die mediane Überlebenszeit betrug 175 Monate. Die Überlebensrate aller 102 Patienten nach zwei und fünf Jahren lag bei 70 ± 5% und 64 ± 5%. Nach sieben Jahren sank sie auf 61 ± 5%. Abbildung 3: Gesamtüberleben
46 34 Die Wahrscheinlichkeit, dass nach zwei Jahren kein Ereignis eingetreten ist, lag bei 63 ± 5%, nach fünf und sieben Jahren lag sie bei 57 ± 5% und 54 ±5 %. Die mediane ereignisfreie Zeit betrug 37 Monate. Abbildung 4: Ereignisfreies Überleben Univariate Analyse Gesamtüberleben Sechs Faktoren beeinflussten signifikant das Gesamtüberleben (Overall Survival, OS) in der univariaten Analyse: das Ann-Arbor-Stadium, das Alter bei Erstdiagnose (< 60 Jahrej. vs. 60 Jahre), der ECOG-Performance-Score, der International Prognostic Index (IPI), das Ansprechen auf Chemotherapie vor der Bestrahlung und der Typ der applizierten Chemotherapie.
47 35 Ann-Arbor-Stadium Die Überlebenswahrscheinlichkeit für die Stadien I und II betrug nach zwei Jahren 79 ± 5%, nach fünf und sieben Jahren jeweils 72 ± 6%. Patienten, die sich mit Stadium III oder IV vorstellten, hatten eine zwei Jahres-Überlebensrate von 51 ± 8%, nach fünf Jahren sank sie auf 47 ± 9% und nach sieben Jahren auf 37 ± 9%. Die mediane Überlebenszeit wurde von Patienten in den Stadien I und II nicht erreicht (KI 95%, 2-253) und betrug 60 Monate für die Patienten in den Stadien III und IV (KI 95%, 3-197), (p = 0.003). Abbildung 5: Einfluss Stadium auf das Gesamtüberleben
48 36 Alter Patienten, die bei Erstdiagnose jünger als 60 Jahre alt waren, hatten nach zwei Jahren eine Überlebenswahrscheinlichkeit von 74 ± 6%, Patienten über 60 Jahre von 65 ± 7%. Nach fünf Jahren änderte sich die Überlebensrate der jüngeren Patienten nicht, die Älteren hatten dann eine Überlebenswahrscheinlichkeit von 51 ± 8%. Nach sieben Jahren betrug die Überlebenswahrscheinlichkeit bei Patienten über 60 Jahre 47 ± 8%, bei denen unter 60 Jahre 71 ± 6%. Patienten unter 60 Jahren erreichten die mediane Überlebenszeit nicht (KI 95%, 2-253), bei den Älteren betrug sie 83 Monate (KI 95%, 2-142), (p = 0.012). Abbildung 6: Einfluss Alter auf das Gesamtüberleben
49 37 ECOG-Performance-Status Patienten, die bei Diagnose einen ECOG Status von 0 oder 1 aufwiesen, hatten nach zwei Jahren eine Überlebenswahrscheinlichkeit von 81 ± 5%, nach fünf und sieben Jahren betrug sie 76 ± 5% und 73 ± 5%. Bei einem ECOG von 2 oder 3, lag die zwei J- ÜLR bei 37 ± 11% und die fünf und sieben J-ÜLR jeweils bei 26 ± 10%. Für Patienten, die sich mit einem ECOG Status von 4 vorstellten, lag die Überlebenswahrscheinlichkeit nach zwei, fünf und sieben Jahren bei 0%. Die mediane Überlebenszeit wurde von Patienten mit ECOG 0 oder 1 nicht erreicht (KI 95%, 2-253), lag bei 18 Monaten für Patienten mit ECOG 2 oder 3 (KI 95%, 2-112) und bei 5 Monaten für Patienten mit ECOG 4 (KI 95%, 5-8), (p<0.001). Abbildung 7: Einfluss ECOG auf das Gesamtüberleben
50 38 IPI Die Patienten wurden nach dem International prognostic Index in vier Gruppen geteilt. Patienten mit einem IPI von 0 oder 1 hatten zwei, fünf und sieben J-ÜLR von 90 ± 5%, 87 ± 6% und 87 ± 6%. Bei Patienten mit einem IPI von 2 lagen diese Raten bei 63 ± 12%, 48 ± 13% und 36 ± 14%. Patienten, die einen IPI von 3 aufwiesen, hatten nach zwei, fünf und sieben Jahren eine Überlebenswahrscheinlichkeit von 44 ± 17%. Patienten mit einem IPI von 4 oder 5 zeigten nach zwei, fünf und sieben Jahren eine Überlebenswahrscheinlichkeit von 33 ± 14%. Die mediane Überlebenszeit der Patienten mit IPI 0 oder 1 wurde nicht erreicht (KI 95%, 2-253) und lag bei einem IPI von 2 oder 3 bei 38 Monaten (KI 95%, 7-197) oder 22 Monaten (KI 95%, 3-97). Bei einem IPI von 4 oder 5 betrug sie 18 Monate (KI 95%, 4-87), (p < 0.001). Abbildung 8: Einfluss IPI auf das Gesamtüberleben
51 39 Chemotherapieansprechen vor der Bestrahlung Auch das unterschiedliche Ansprechen auf eine Chemotherapie vor der Bestrahlung zeigte Auswirkungen auf das Gesamtüberleben. Patienten, die vor der konsolidierenden Bestrahlung in kompletter Remission (CR) waren, hatten nach zwei Jahren eine höhere Überlebenswahrscheinlichkeit als diejenigen in partieller Remission (zwei J-ÜLR 100% und 74% (±6)). Nach fünf und sieben Jahren betrug die Überlebenswahrscheinlichkeit für Patienten in CR immer noch jeweils 100%, für die in PR 71 ± 7% und 63 ± 8%. Zeigte das Lymphom nach Chemotherapie kein Ansprechen (SD), lagen die zwei, fünf und sieben J-ÜLR bei 50 ± 25% und war es progredient (PD) nach zwei Jahren bei 9 ± 9% und nach fünf und sieben Jahren bei je 0%. Patienten, die keine Chemotherapie erhalten hatten zeigten eine zwei J ÜLR von 59 ± 12% und nach fünf und sieben Jahren von jeweils 40 ± 12%. Die mediane Überlebenszeit wurde von Patienten in CR und PR nicht erreicht (KI 95%, ; KI 95%, 2-205) und betrug 14 (KI 95%, 6-253) und 11 Monate (KI 95%, 4-48) bei Patienten in SD und PD. Die mediane Überlebenszeit von Patienten, die keine Chemotherapie erhalten hatten, lag bei 38 Monaten (KI 95%, 2-206), (p < 0.001). Abbildung 9: Einfluss CTX-Ansprechen auf das Gesamtüberleben
52 40 Therapie Patienten, die eine CHOP-Chemotherapie erhalten hatten, zeigten nach zwei und fünf Jahren eine Überlebenswahrscheinlichkeit von 74 ± 6% und nach sieben Jahren von 71 ± 6%. Für andere Schemata lagen die zwei, fünf und sieben J-ÜLR bei 62 ± 9%, 59 ± 9% und 47 ± 9% und für die alleinige Radiotherapie bei 64 ± 15%, 46 ± 15% und 45 ± 15%. Die mediane Überlebenszeit wurde nicht erreicht von Patienten, die nach dem CHOP-Schema (KI 95%, 4-197) behandelt wurden, betrug 66 Monate für andere Schemata (KI 95%, 2-253) und 38 Monate für die alleinige Strahlentherapie (KI 95%, 2-206), (p = 0.01). Abbildung 10:Einfluss Therapie auf das Gesamtüberleben
53 41 Andere prognostische Faktoren Sieben Faktoren zeigten in der Analyse keine statistische Signifikanz: die Anzahl der Chemotherapiezyklen vor der Bestrahlung, das Vorhandensein eines Bulk-Tumors, das Vorhandensein einer B-Symptomatik, die Lokalisation bezüglich des Zwerchfells, die Erhöhung der LDH vor Therapie, die zusätzliche Applikation des Antikörpers Rituximab und die Bestrahlungstechnik. Die Ergebnisse der Auswertung des prognostischen Faktors der LDH Erhöhung seien hier dennoch kurz erwähnt: war die LDH vor der Therapie erhöht, lag die zwei Jahres Überlebensrate bei 62 ± 8%. Nach fünf und sieben Jahren sank diese auf 58 ± 8%. Bei Patienten ohne LDH Erhöhung betrug die Überlebenswahrscheinlichkeit nach zwei, fünf und sieben Jahren 78 ± 6%, 71 ± 7% und 68 ± 7%. Die mediane Überlebenszeit wurde von Patienten mit normaler LDH nicht erreicht (KI 95%, 2-253) und lag bei 102 Monaten (KI 95%, 3-197) bei Patienten mit erhöhter LDH (p=0.087). Abbildung 11: Einfluss LDH auf das Gesamtüberleben
54 Ereignisfreies Überleben Das ereignisfreie Überleben (Event free Survival: EFS) wurde signifikant von sieben Faktoren beeinflusst: Ann-Arbor-Stadium, Alter bei Erstdiagnose (< 60 Jahre vs. 60 Jahre), ECOG-Performance-Score, IPI, Erhöhung der LDH vor Therapie, Chemotherapieansprechen vor Strahlentherapie und der Typ der applizierten Chemotherapie. Ann-Arbor-Stadium Bei Patienten mit Ann-Arbor-Stadium I oder II lag die Wahrscheinlichkeit nach zwei Jahren ereignisfrei überlebt zu haben bei 74 ± 5%, nach fünf Jahren bei 68 ± 6% und nach sieben bei 66 ± 6%. Für Patienten im Stadium III und IV betrugen diese Raten 40 ± 8%, 34 ± 9% und 27 ± 9%. Die mediane ereignisfreie Zeit wurde in den Stadien I und II nicht erreicht (KI 95%, 1-242) und lag bei 12 Monaten für die fortgeschrittenen Stadien (KI 95%, 0-101) (p<0.0001). Abbildung 12: Einfluss Stadium auf das ereignisfreie Überleben
55 43 Alter Das ereignisfreie Überleben (EFÜL) nach zwei und fünf Jahren lag bei 64 ± 7% für Patienten, die bei Diagnose < 60 Jahre alt waren, und bei 61 ± 7% und 48 ± 8% für Patienten 60 Jahre. Nach sieben Jahren lagen diese Raten bei 62 ± 7% für die jüngeren Patienten und bei 43% ± 8% für die Älteren. Die mediane Zeit ereignisfrei überlebt zu haben wurde von Patienten < 60 Jahren nicht erreicht (KI 95%, 1-242) und lag bei 54 Monaten für Patienten 60 Jahren (KI 95%, 0-138), (p=0.035). Abbildung 13: Einfluss Alter auf das ereignisfreie Überleben
56 44 ECOG-Performance-Status Hatten die Patienten bei Erstdiagnose einen ECOG-Status von 0 oder 1, lagen die zwei, fünf und sieben Jahresraten für das ereignisfreie Überleben bei 75 ± 5%, 71 ± 5% und 66 ± 6%. Bei einem ECOG-Status von 2 oder 3 betrug die Wahrscheinlichkeit nach zwei Jahren ereignisfrei überlebt zu haben 26 ± 10% und nach fünf und sieben Jahren jeweils 21 ± 9%. Bei Patienten mit einem ECOG-Status von 4 (n=2) lagen diese Wahrscheinlichkeiten bei 0%. Die mediane Zeit des ereignisfreien Überlebens wurde für Patienten mit ECOG 0 oder 1 nicht erreicht (KI 95%, 1-242), betrug 7 Monate (KI 95%, 0-107) bei Patienten mit ECOG 2 oder 3 und 0 Monate (KI 95%, 0-5) bei einem ECOG-Status von 4 (p<0.0001). Abbildung 14: Einfluss ECOG auf das ereignisfreie Überleben
57 45 IPI Das ereignisfreie Überleben unterschied sich signifikant bei Patienten mit unterschiedlichem IPI. Patienten mit IPI 0 oder 1 hatten eine zwei, fünf und sieben Jahres Wahrscheinlichkeit von 87 ± 5%, 85 ± 6% und 81 ± 7% ereignisfrei überlebt zu haben. Bei einem IPI von 2 lagen diese Raten nach zwei, fünf und sieben Jahren bei 50 ± 12%, 44 ± 12% und 29 ± 14%, bei einem IPI von 3 jeweils bei 44 ± 17%. Patienten mit einem IPI von 4 oder 5 hatten nach zwei Jahren eine Wahrscheinlichkeit von 25 ± 12% ereignisfrei überlebt zu haben, nach fünf und sieben Jahren betrug sie jeweils 0%. Die mediane ereignisfreie Überlebenszeit wurde von Patienten mit einem IPI von 0/1 nicht erreicht (KI 95% 2-242) und betrug 16 Monate (KI 95%, 1-173), 15 Monate (KI 95%, 1-93) und vier Monate (Ki 95%, 0-26) bei Patienten mit IPI 2, 3 und IPI 4-5, (p<0.0001). Abbildung 15: Einfluss IPI auf das ereignisfreie Überleben
58 46 LDH-Erhöhung vor der Therapie War die LDH vor Therapie erhöht (> 240 U/L), lag die Wahrscheinlichkeit nach zwei Jahren ereignisfrei überlebt zu haben bei 53 ± 9% und nach fünf und sieben Jahren bei jeweils 49 ± 9%. Lag der Wert im Normbereich, betrugen die zwei, fünf und sieben Jahresraten für das ereignisfreie Überleben 76 ± 6%, 71 ± 7% und 65 ± 7%. Die mediane ereignisfreie Überlebenszeit wurde von Patienten mit normaler LDH nicht erreicht (KI 95%, 1-242) und lag bei 29 Monaten (KI 95%, 0-173) für Patienten mit erhöhter LDH, (p=0.009). Abbildung 16: Einfluss LDH Erhöhung auf das ereignisfreie Überleben
59 47 Chemotherapieansprechen vor der Bestrahlung Die Wahrscheinlichkeit nach zwei, fünf und sieben Jahren ereignisfrei überlebt zu haben lag für Patienten, die nach CTx in kompletter Remission (CR) waren jeweils bei 91 ± 6%, für Patienten in partieller Remission (PR) bei 64 ± 7%, 58 ± 8% und 53 ± 8%. Bei refraktärem Lymphom (SD) lagen die zwei, fünf und sieben Jahresraten für das ereignisfreie Überleben bei jeweils 50 ± 25% und bei Progress der Erkrankung betrugen sie jeweils 0%. Die mediane ereignisfreie Überlebenszeit wurde von Patienten in CR nicht erreicht (KI 95%, 3-232) und betrug 96 Monate (KI 95%, 1-200) für Patienten in PR. War die Erkrankung in Progress (KI 95%, 0-9) oder zeigte kein Ansprechen (KI 95%,2-242) lag die mediane ereignisfreie Zeit bei je drei Monaten, (p<0.0001). Abbildung 17: Einfluss CTX-Ansprechen auf das ereignisfreie Überleben
60 48 Therapie Für Patienten, die mit dem CHOP Schema behandelt wurden, lagen die Raten für das ereignisfreie Überleben nach zwei, fünf und sieben Jahren bei 72 ± 6%, 70 ± 6% und 66 ± 7%. Hatten sie ein anderes Schema erhalten, sanken diese Raten nach zwei Jahren auf 50 ± 9% und nach fünf und sieben Jahren auf jeweils 43 ± 9%. Bei Patienten, die nur bestrahlt wurden betrug die Wahrscheinlichkeit nach zwei, fünf und sieben Jahren ereignisfrei überlebt zu haben 50 ± 12%, 37 ± 12% und 31 ± 12%. Die mediane ereignisfreie Zeit wurde von Patienten, die mit einer CHOP-Chemotherapie behandelt wurden nicht erreicht (KI95%, 0-188), betrug 16 Monate (KI 95%, 0-213) für Patienten mit einer anderen Chemotherapie und 13 Monate (KI 95%, 1-203) für Patienten, die nur strahlentherapeutisch behandelt wurden, (p=0.005). Abbildung 18: Einfluss Therapie auf das ereignisfreie Überleben
61 49 Andere prognostische Faktoren Fünf Faktoren zeigten in der Analyse keine statistische Signifikanz: das Vorhandensein eines Bulk-Tumors, B-Symptomatik, die Lokalisation bezüglich des Zwerchfells, die zusätzliche Applikation des Antikörpers Rituximab und die Bestrahlungstechnik Multivariate Analyse In der multivariaten Analyse mit den signifikanten Faktoren der univariaten Analyse, IPI, Ansprechen auf CTx und Typ der applizierten Chemotherapie, zeigte nur IPI weiterhin eine Signifikanz (p=0.001). Schloß man weitere Faktoren in die Analyse ein, ergaben sich folgende Signifikanzen: in der Analyse mit den Faktoren Geschlecht, Tumorbulk, B-Symptomatik, Befallsmuster (nodal vs, extranodal), Rituximab-Gabe, IPI, Ansprechen auf Chemotherapie und Typ der applizierten Chemotherapie, zeigten IPI (p < , KI 95%, 1-4) und die Gabe von Rituximab (p=0.004, KI 95%, 0-1) Signifikanz. Für das ereignisfreie Überleben zeigte in der multivariaten Analyse mit den signifikanten Faktoren der univariaten Analyse - IPI, Ansprechen auf CTx, Typ der applizierten Chemotherapie und Erhöhung der LDH - nur IPI weiterhin eine Signifikanz (p < 0.001, KI 95%, 1-3). In der Analyse mit den Faktoren Geschlecht, Tumorbulk, B- Symptomatik, Befallsmuster (nodal vs, extranodal), Rituximab-Gabe, IPI, Ansprechen auf Chemotherapie und Typ der applizierten Chemotherapie, zeigte nur IPI (p < 0.001, KI 95%, 2-3) Signifikanz.
62 50 Faktor Anzahl 5-J- MÜZ Univariat Multivariat ÜL (p) (p) Alter < (52%) 74% Ø erreicht n.s (48%) 51% 83 Monate Befall Supradiaphragmal 59 (58%) 72% Ø erreicht 0.84 n.s. Infradiaphragmal 16 (16%) 50% 22 Monate Beides 27 (27%) 53% 83 Monate Ann Arbor I & II 67 (66%) 72% Ø erreicht n.s. Stadium III & IV 35 (34%) 47% 60 Monate Ansprechen CR 23 (27%) 100% Ø erreicht < n.s. auf CTx PR 47 (55%) 65% Ø erreicht SD 4 (5%) 50% 10 Monate PD 9 (11%) 0% 14 Monate Unbekannt 2 (2%) Typ der CTX CHOP 62 (61%) 74% Ø erreicht 0.01 n.s. andere 29 (28%) 59% 66 Monate keine 11 (11%) 46% 38 Monate IPI % Ø erreicht < < % 38 Monate 3 44% 22 Monate % 18 Monate Fehlend ECOG (73%) 76% Ø erreicht < n.s (19%) 26% 18 Monate 4 2 (2%) 0% 5 Monate Fehlend 7 (7%) B- Ja 33 (32%) 56% 105 Monate n.s. Symptomatik Nein 69 (68%) 67% 175 Monate
63 51 Bulk Ja 57 (56%) 55% Ø erreicht 0.33 n.s. Nein 45 (44%) 75% 123 Monate Rituximab Ja 34 (33%) 73% Ø erreicht Nein 68 (67%) 60% 123 Monate RTx Plan 3D 49 (48%) 58% Ø erreicht n.s. 2D 53 (52%) 69% 103 Monate RTx Feld IF 81 (79%) 65% Ø erreicht 0.34 n.s. EF 21 (21%) 57% 123 Monate RTx Dosis < 36 Gy 33 (325) 69% Ø erreicht 0.59 n.s. 36 Gy 69 (68%) 62% 90 Monate LDH- Ja 34 (33%) 58% 102 Monate n.s. Erhöung Nein 46 (45%) 71% Ø erreicht Fehlend 22 (22%) CTX-Zyklus < 6 31 (36%) 61% Ø erreicht n.s. vor RT (n=85) 6 54 (64%) 73% Ø erreicht Tabelle 1: Übersicht über das fünf Jahres Gesamtüberleben
64 52 Faktor Anzahl 5-J- MEFÜLZ Univariat Multivariat EFÜL (p) (p) Alter < (52%) 64% Ø erreicht n.s (48%) 48% 54 Monate Befall Supradiaphragmal 59 (58%) 66% 173 Monate 0.08 n.s. Infradiaphragmal 16 (16%) 44% 9 Monate Beides 27 (27%) 44% 54 Monate Ann Arbor I & II 67 (66%) 68% Ø erreicht < n.s. Stadium III & IV 35 (34%) 34% 12 Monate Ansprechen CR 23 (27%) 91% Ø erreicht < n.s. auf CTx PR 47 (55%) 58% 96 Monate SD 4 (5%) 50% 3 Monate PD 9 (11%) 0% 3 Monate Unbekannt 2 (2%) Typ der CTX CHOP 58 (57%) 70% Ø erreicht n.s. andere 28 (27%) 43% 16 Monate keine 16 (16%) 37% 13 Monate IPI 0 19 (19%) 89% Ø erreicht < (35%) 64% 173 Monate 3 21 (21%) 33% 5 Monate Fehlend 26 (25%) ECOG (73%) 71% Ø erreicht < n.s (19%) 21% 7 Monate 4 2 (2%) 0% 0 Monate Fehlend 7 (7%) B- Ja 33 (32%) 50% 54 Monate 0.34 n.s. Symptomatik Nein 69 (68%) 60% 173 Monate
65 53 Bulk Ja 57 (56%) 49% 54 Monate 0.42 n.s. Nein 45 (44%) 66% 54 Monate Rituximab Ja 34 (33%) 66% Ø erreicht 0.09 n.s. Nein 68 (67%) 56% 96 Monate RTx Plan 3D 49 (48%) 65% Ø erreicht 0.06 n.s. 2D 53 (52%) 50% 32 Monate RTx Feld IF 81 (79%) 57% 96 Monate 0.67 n.s. EF 21 (21%) 57% 97 Monate RTx Dosis < 36 Gy 33 (325) 62% Ø erreicht 0.42 n.s. 36 Gy 69 (68%) 55% 90 Monate LDH- Ja 34 (33%) 49% 29 Monate n.s. Erhöung Nein 46 (45%) 71% Ø erreicht Fehlend 22 (22%) CTX-Zyklus < 6 31 (36%) 53% 75 Monate 0.20 n.s (64%) 63% Ø erreicht Tabelle 2: Übersicht über das fünf Jahres ereignisfreie Überleben
66 Rezidivanalyse Bei einer medianen Follow-up Zeit von 59 Monaten, gab es 49 Ereignisse (Rezidiv oder Tod, unabhängig von der Todesursache). Insgesamt trat bei 14 Patienten (14%) ein Rezidiv auf, fünf Patienten rezidivierten innerhalb des Bestrahlungsfeldes, neun Patienten außerhalb. Die Wahrscheinlichkeit nach fünf Jahren rezidivfrei zu sein lag bei 84% (±4). Die Zeit von der Strahlentherapie bis zum Auftreten eines Rezidivs betrug im Mittel sechs Monate und umfasste eine Zeitspanne von 0 bis 74 Monate. Abbildung 19: Rezidivfreies Überleben
Hodgkin-Lymphom. Dr. med. Christoph Engel. Institut für Medizinische Informatik, Statistik und Epidemiologie (IMISE) Universität Leipzig
 Hodgkin-Lymphom Dr. med. Christoph Engel Institut für Medizinische Informatik, Statistik und Epidemiologie (IMISE) Universität Leipzig Hodgkin-Lymphom: Definition und klinische Symptomatik Definition:
Hodgkin-Lymphom Dr. med. Christoph Engel Institut für Medizinische Informatik, Statistik und Epidemiologie (IMISE) Universität Leipzig Hodgkin-Lymphom: Definition und klinische Symptomatik Definition:
Dr. Barbara Kiesewetter. Medical University Vienna, Clinical Division of Oncology. Potential new agents for MZL Indolent Lymphoma Workshop - Bologna
 Dr. Barbara Kiesewetter Medical University Vienna, Clinical Division of Oncology Potential new agents for MZL Indolent Lymphoma Workshop - Bologna 1 Maligne Lymphome Lymphsystem = Teil des Abwehrsystems
Dr. Barbara Kiesewetter Medical University Vienna, Clinical Division of Oncology Potential new agents for MZL Indolent Lymphoma Workshop - Bologna 1 Maligne Lymphome Lymphsystem = Teil des Abwehrsystems
LYMPHOME. H. Jürgens. Vorlesung WS 2001/2002.
 LYMPHOME H. Jürgens Vorlesung WS 2001/2002 http://medweb.uni-muenster.de/institute/paedonco/lehre/index.html Differentialdiagnose (DD) - Lymphadenitis / Lymphom Lymphadenitis Lymphom Häufigkeit +++ (+)
LYMPHOME H. Jürgens Vorlesung WS 2001/2002 http://medweb.uni-muenster.de/institute/paedonco/lehre/index.html Differentialdiagnose (DD) - Lymphadenitis / Lymphom Lymphadenitis Lymphom Häufigkeit +++ (+)
Behandlungspfade Interdisziplinäres Onkologisches Zentrum Klinikum Ernst von Bergmann Potsdam. Hodgkin- Lymphom. Stand Dezember 2017
 Hodgkin- Lymphom Stand Dezember 2017 Erstdiagnose Notwendige Diagnostik Risikofaktoren Hodgkin- Lymphom Referenzhistologie obligat Klinische Untersuchung Anamnese (Alkoholschmerz) B- Symptome Fieber Nachtschweiß
Hodgkin- Lymphom Stand Dezember 2017 Erstdiagnose Notwendige Diagnostik Risikofaktoren Hodgkin- Lymphom Referenzhistologie obligat Klinische Untersuchung Anamnese (Alkoholschmerz) B- Symptome Fieber Nachtschweiß
Lymphome. Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster. November 2011
 Lymphome Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster November 2011 Krebserkrankungen des Kindesalters Leukämien 34.5% Leukämien Andere 3.9% Andere Keimzelltumore 3.1% Keimzelltumoren
Lymphome Pädiatrische Hämatologie und Onkologie Universitätskinderklinik Münster November 2011 Krebserkrankungen des Kindesalters Leukämien 34.5% Leukämien Andere 3.9% Andere Keimzelltumore 3.1% Keimzelltumoren
St.Galler Ophtag. Felicitas Hitz Klinik für Onkologie und Hämatologie
 St.Galler Ophtag Felicitas Hitz Klinik für Onkologie und Hämatologie 31.5.2018 WHO 2017: Lymphoproliferative Erkrankungen Klinik, Morphologie, Immunphänotyp, Genetik Extranodale Lymphome mit Primärmanifestation
St.Galler Ophtag Felicitas Hitz Klinik für Onkologie und Hämatologie 31.5.2018 WHO 2017: Lymphoproliferative Erkrankungen Klinik, Morphologie, Immunphänotyp, Genetik Extranodale Lymphome mit Primärmanifestation
NON-HODGKIN-LYMPHOME (C82-C85)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
NON-HODGKIN-LYMPHOME (C82-C85)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
Manifestationsformen von Non-Hodgkin Lymphomen
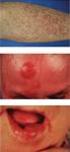 Manifestationsformen von Non-Hodgkin Lymphomen? Lymphknotenarchitektur Leukozytose (> 10 G/l) reife Blutzellen Differentialblutbild atypische Zellen oder Blasten reaktiv (Infektion, Entzündung) autonom
Manifestationsformen von Non-Hodgkin Lymphomen? Lymphknotenarchitektur Leukozytose (> 10 G/l) reife Blutzellen Differentialblutbild atypische Zellen oder Blasten reaktiv (Infektion, Entzündung) autonom
Maligne Lymphome. R. Weide Praxisklinik für Hämatologie und Onkologie Koblenz
 Maligne Lymphome R. Weide Praxisklinik für Hämatologie und Onkologie Koblenz Maligne Lymphome 1. Systematik der malignen Lymphome 2. Grundlagen der Therapie 3. Kasuistiken 4. Zusammenfassung Pluripotente
Maligne Lymphome R. Weide Praxisklinik für Hämatologie und Onkologie Koblenz Maligne Lymphome 1. Systematik der malignen Lymphome 2. Grundlagen der Therapie 3. Kasuistiken 4. Zusammenfassung Pluripotente
Was macht uns krank - Non Hodgkin Lymphome
 Was macht uns krank - Non Hodgkin Lymphome M. Müller Vivantes Auguste-Viktoria-Klinikum Berlin Lymphome? Definition: Bösartige Erkrankung der Lymphozyten (Immunabwehr-Zellen) Lymphknotenschwellung und
Was macht uns krank - Non Hodgkin Lymphome M. Müller Vivantes Auguste-Viktoria-Klinikum Berlin Lymphome? Definition: Bösartige Erkrankung der Lymphozyten (Immunabwehr-Zellen) Lymphknotenschwellung und
Grundlagen und Therapieoptionen bei Non-Hodgkin Lymphomen
 Grundlagen und Therapieoptionen bei Non-Hodgkin Lymphomen Univ. Prof. Dr. Johannes Drach AKH Wien Univ. Klinik für Innere Medizin I Klinische Abteilung für Onkologie NHL: Grundlagen der Behandlungsmöglichkeiten
Grundlagen und Therapieoptionen bei Non-Hodgkin Lymphomen Univ. Prof. Dr. Johannes Drach AKH Wien Univ. Klinik für Innere Medizin I Klinische Abteilung für Onkologie NHL: Grundlagen der Behandlungsmöglichkeiten
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Heinz Ludwig I.Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Wilhelminenspital
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Heinz Ludwig I.Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Wilhelminenspital
Tumorerkrankungen im Kindesalter. - ein Überblick -
 Tumorerkrankungen im Kindesalter - ein Überblick - Elisabeth Holfeld 2. Brandenburger Krebskongress 25.02.2011 Hauptunterschiede zwischen Tumoren im Kindes- und Erwachsenenalter Häufigkeit der Tumoren
Tumorerkrankungen im Kindesalter - ein Überblick - Elisabeth Holfeld 2. Brandenburger Krebskongress 25.02.2011 Hauptunterschiede zwischen Tumoren im Kindes- und Erwachsenenalter Häufigkeit der Tumoren
Tumorzentrum Regensburg e.v.
 Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Strahlentherapie bei Lymphomen
 Strahlentherapie bei Lymphomen Frank Zimmermann Klinik für Radioloonkologie Universitätsspital Basel Petersgraben 4 CH 4031 Basel zimmermannf@uhbs.ch M. Hodgkin: Zielvolumina EF IF M. Hodgkin: Zielvolumina
Strahlentherapie bei Lymphomen Frank Zimmermann Klinik für Radioloonkologie Universitätsspital Basel Petersgraben 4 CH 4031 Basel zimmermannf@uhbs.ch M. Hodgkin: Zielvolumina EF IF M. Hodgkin: Zielvolumina
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Lymphomen. Bernhard Opitz Zytologiekurs KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE)
 Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Zytologei bei Non Hodgkin Lymphomen Bernhard Opitz Zytologiekurs 31.05 01.06.2013 KRANKENHAUS ST. ELISABETH UND ST. BARBARA HALLE (SAALE) WHO-Klassifikation der lymphatischen Neoplasien 2008 B-Zell-Neoplasien
Jahreshauptversammlung 2014 Bericht aus Kiel
 KINDERKREBSINITIATIVE BUCHHOLZ Holm-Seppensen (KKI) Jahreshauptversammlung 2014 Bericht aus Kiel 50 Jahre LKR 40 Jahre Kiel-Klassifikation 1963 Karl Lennert Prof. Hamperl (stellvertretender Vorsitzende
KINDERKREBSINITIATIVE BUCHHOLZ Holm-Seppensen (KKI) Jahreshauptversammlung 2014 Bericht aus Kiel 50 Jahre LKR 40 Jahre Kiel-Klassifikation 1963 Karl Lennert Prof. Hamperl (stellvertretender Vorsitzende
Einfluss der Lymphombehandlung auf das Blut. Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern
 Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2011-2015
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2011-2015
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2012-2016
Querschnittsfach
 Klinik für Kleintiere Innere Medizin (Prof. Dr. R. Neiger) und klinische Laboratoriumsdiagnostik (HDoz. Dr. A. Moritz) Justus-Liebig-Universität Gießen Querschnittsfach 10.11.2008 Dyspnoe, Schnarchen Müdigkeit,
Klinik für Kleintiere Innere Medizin (Prof. Dr. R. Neiger) und klinische Laboratoriumsdiagnostik (HDoz. Dr. A. Moritz) Justus-Liebig-Universität Gießen Querschnittsfach 10.11.2008 Dyspnoe, Schnarchen Müdigkeit,
Zytologie der Malignen Lymphome
 Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Zytologie der Malignen Lymphome Henrik Griesser Fachbereich Pathologie und Zytodiagnostik 25.Tagung für Klinische Zytologie in Konstanz, 22. 26. März 2017 Indikationen der FNAC Diagnose Rezidiverkennung
Postoperative Bestrahlung nach Mastektomie und brusterhaltender Operation: Vergleich prognostischer Faktoren und Bedeutung des Lokalrezidivs.
 Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Jürgen Dunst) Postoperative Bestrahlung nach Mastektomie und brusterhaltender
Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Jürgen Dunst) Postoperative Bestrahlung nach Mastektomie und brusterhaltender
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie
 Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
KML-Videoberichte. in Kooperation mit:
 KML-Videoberichte in Kooperation mit: Aggressive Lymphome in Kooperation mit: T-NHL Seite 3 CHOEP VERSUS CHOP ERZIELT BESSERE ERGEBNISSE BEI DER FIRSTLINE THERAPY VON T-CELL LYMPHOMEN A. Janikova für die
KML-Videoberichte in Kooperation mit: Aggressive Lymphome in Kooperation mit: T-NHL Seite 3 CHOEP VERSUS CHOP ERZIELT BESSERE ERGEBNISSE BEI DER FIRSTLINE THERAPY VON T-CELL LYMPHOMEN A. Janikova für die
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
Phase II-Studie zur Behandlung des nicht kleinzelligen Bronchialkarzinoms im Stadium III b und IV mit der Kombination Docetaxel und Carboplatin
 Aus der Universitätsklinik und Poliklinik für Innere Medizin II an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Herr Professor Dr. med. Bernd Osten) Phase II-Studie zur Behandlung des nicht
Aus der Universitätsklinik und Poliklinik für Innere Medizin II an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Herr Professor Dr. med. Bernd Osten) Phase II-Studie zur Behandlung des nicht
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie
 Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
Fallvorstellung 8. Mai 2007
 Fallvorstellung 8. Mai 2007 67jährige Patientin mit CLL und Fieber 5 Süd Anamnese Aktuelle Anamnese: Aufnahme 13.3.2007 bei Fieber bis 38.8 C, Müdigkeit, Nachtschweiß Bisherige Anamnese: CLL ED 1997 Z.n.
Fallvorstellung 8. Mai 2007 67jährige Patientin mit CLL und Fieber 5 Süd Anamnese Aktuelle Anamnese: Aufnahme 13.3.2007 bei Fieber bis 38.8 C, Müdigkeit, Nachtschweiß Bisherige Anamnese: CLL ED 1997 Z.n.
Bericht aus Kiel Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel)
 Bericht aus Kiel 2017 Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist geschafft? Kiel ist das führende Zentrum für Diagnostik von Lymphomen bei Kindern. Fast alle Gewebebiopsien von
Bericht aus Kiel 2017 Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist geschafft? Kiel ist das führende Zentrum für Diagnostik von Lymphomen bei Kindern. Fast alle Gewebebiopsien von
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Lymphome bei Patienten mit Sjögren-Syndrom
 Lymphome bei Patienten mit Sjögren-Syndrom Puchtler 5/2014 25.05.2014 0 Zusammensetzung des Blutes Rote Blutkörperchen (Erythrozyten) Blutplättchen (Thrombozyten) Weiße Blutkörperchen (Leukozyten) - Granulozyten
Lymphome bei Patienten mit Sjögren-Syndrom Puchtler 5/2014 25.05.2014 0 Zusammensetzung des Blutes Rote Blutkörperchen (Erythrozyten) Blutplättchen (Thrombozyten) Weiße Blutkörperchen (Leukozyten) - Granulozyten
in vivo -- Das Magazin der Deutschen Krebshilfe vom
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 10.03.2009 Expertengespräch zum Thema Plasmozytom Wir haben ihn eben schon im Film gesehen zusammen mit Wolfgang S., heute ist er hier: Prof.
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 10.03.2009 Expertengespräch zum Thema Plasmozytom Wir haben ihn eben schon im Film gesehen zusammen mit Wolfgang S., heute ist er hier: Prof.
DGHO 2010 Geriatrische Onkologie
 DGHO 2010 Geriatrische Onkologie Besonderheiten bei hämatologischen Neoplasien Prof. Dr. Ernst Späth-Schwalbe Vivantes Klinikum Spandau Klinik für Innere Medizin - Hämatologie, Onkologie alt bei hämatologischen
DGHO 2010 Geriatrische Onkologie Besonderheiten bei hämatologischen Neoplasien Prof. Dr. Ernst Späth-Schwalbe Vivantes Klinikum Spandau Klinik für Innere Medizin - Hämatologie, Onkologie alt bei hämatologischen
Langzeit-follow-up Datenbanken bei Mammakarzinom unter besonderer Berücksichtigung der Therapiewahl
 Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Morbus Waldenström. Diagnostische Empfehlung. Methode Antikoagulans Empfehlung. Zytomorphologie EDTA obligat
 1/7 Morbus Waldenström Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin fakultativ FISH
1/7 Morbus Waldenström Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin fakultativ FISH
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. e medianes e Vergleich medianes Vergleichsquelle 2012-2016 männlich 67 4,6 4,6 48,2 46,3
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. e medianes e Vergleich medianes Vergleichsquelle 2012-2016 männlich 67 4,6 4,6 48,2 46,3
Brustkrebs aktuell - OSP am Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms?
 Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Krebs bei Kindern Leukämien
 Krebs bei Kindern Krebserkrankungen im Kindesalter werden seit 19 in den alten Bundesländern und seit 1991 auch in den neuen Bundesländern systematisch im bundesweiten Deutschen Kinderkrebsregister an
Krebs bei Kindern Krebserkrankungen im Kindesalter werden seit 19 in den alten Bundesländern und seit 1991 auch in den neuen Bundesländern systematisch im bundesweiten Deutschen Kinderkrebsregister an
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie
 Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
Indolente Non Hodgkin- Lymphome (NHL) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft für Hämatologie
Molekularpathologie der Lymphome
 Molekularpathologie der Lymphome (n= 90, WHO 2016) Programm Allgemeine Lymphompathogenese Das Keimzentrum als gefährlicher Ort Pathogenese des follikulärenlymphoms (FL) Molekulare Hintergründe von FL Progression/
Molekularpathologie der Lymphome (n= 90, WHO 2016) Programm Allgemeine Lymphompathogenese Das Keimzentrum als gefährlicher Ort Pathogenese des follikulärenlymphoms (FL) Molekulare Hintergründe von FL Progression/
WELT LYMPHOM TAG
 WELT LYMPHOM TAG 15.09.2012 Indolente Dr. med. Michael Baumann Zentrum für Labormedizin St. Gallen Onkologie/Haematologie Kantonsspital St. Gallen INHALT was ist das genau? wie entstehen sie? sind alle
WELT LYMPHOM TAG 15.09.2012 Indolente Dr. med. Michael Baumann Zentrum für Labormedizin St. Gallen Onkologie/Haematologie Kantonsspital St. Gallen INHALT was ist das genau? wie entstehen sie? sind alle
Follikuläres Lymphom. Beschreibung. Diagnose. Therapie gefördert vom
 Follikuläres Lymphom Beschreibung Diagnose Therapie 1999-2009 gefördert vom www.lymphome.de Follikuläres Lymphom 1 Was ist ein follikuläres Lymphom? Das follikuläre Lymphom (FL) ist eine Erkrankung der
Follikuläres Lymphom Beschreibung Diagnose Therapie 1999-2009 gefördert vom www.lymphome.de Follikuläres Lymphom 1 Was ist ein follikuläres Lymphom? Das follikuläre Lymphom (FL) ist eine Erkrankung der
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN
 DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
Therapie metastasierter Hodentumoren
 Therapie metastasierter Hodentumoren Prof. Dr. Jörg Beyer Vivantes Klinikum Am Urban Dieffenbachstrasse 1 joerg.beyer@vivantes.de Fall No 1: Patient 33 Jahre Hodentumor rechts Z.n. Orchidektomie reines
Therapie metastasierter Hodentumoren Prof. Dr. Jörg Beyer Vivantes Klinikum Am Urban Dieffenbachstrasse 1 joerg.beyer@vivantes.de Fall No 1: Patient 33 Jahre Hodentumor rechts Z.n. Orchidektomie reines
1 Einleitung Das Mammakarzinom Epidemiologie Ätiologie Risikofaktoren Protektive Faktoren 3
 Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
Vom 2. November Hinweise zur Anwendung von Fludarabin gemäß 30 Abs. 2 AM-RL. a) Nicht zugelassenes Anwendungsgebiet (Off-Label-Indikation)
 Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Anwendung von Fludarabin bei anderen
Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Anwendung von Fludarabin bei anderen
Martha-Maria-Abend. Hodgkin-Lymphome- Histologische Befunde und. Antje Hölsken. Buchmann Institut für Pathologie
 Hodgkin-Lymphome- Histologische Befunde und Klassifizierung i Antje Hölsken. Buchmann Institut für Pathologie Martha-Maria-Abend Krankenhaus Martha-Maria M Halle-Dölau Hodgkin-Lymphom Thomas Hodgkin,1832:
Hodgkin-Lymphome- Histologische Befunde und Klassifizierung i Antje Hölsken. Buchmann Institut für Pathologie Martha-Maria-Abend Krankenhaus Martha-Maria M Halle-Dölau Hodgkin-Lymphom Thomas Hodgkin,1832:
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
in vivo -- Das Magazin der Deutschen Krebshilfe vom
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 13.05.2008 Expertengespräch zum Thema Hodgkin Lymphom Und zu diesem Thema begrüße ich jetzt Professor Andreas Engert, leitender Oberarzt der
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 13.05.2008 Expertengespräch zum Thema Hodgkin Lymphom Und zu diesem Thema begrüße ich jetzt Professor Andreas Engert, leitender Oberarzt der
3.18 Morbus Hodgkin. Kernaussagen. Inzidenz und Mortalität: Nach der Jahrtausendwende
 132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
132 Ergebnisse zur Morbus Hodgkin 3.18 Morbus Hodgkin Kernaussagen Inzidenz und Mortalität: Nach der tausendwende erkrankten pro in Deutschland etwa 1.040 und 940 an einem Morbus Hodgkin (Hodgkin-Lymphom).
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14* 6,5 3,4 Mortalität Saarland 14* 1,6 2 geschätzte Inzidenz
PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14* 6,5 3,4 Mortalität Saarland 14* 1,6 2 geschätzte Inzidenz
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2010-2014
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2010-2014
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PLASMOZYTOM (C9) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL
 Neue Maßstäbe in der Lymphomtherapie Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL Mannheim (2. Oktober 2009) - Der monoklonale Antikörper Rituximab
Neue Maßstäbe in der Lymphomtherapie Chemoimmuntherapie mit Rituximab: Standard bei der CLL sowie beim aggressiven und follikulären NHL Mannheim (2. Oktober 2009) - Der monoklonale Antikörper Rituximab
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML
 Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Aufbau 01.04.2010. Leukozyten - Differentialblutbild
 Erklärung der wichtigsten Laborparameter und der bildgebenden Diagnostik beim und bei Lymphomen Doz. Dr. Michael Fiegl Hämato-Onkologie (Direktor: Prof. Dr. G. Gastl) Programm für PatientInnen Innsbruck,
Erklärung der wichtigsten Laborparameter und der bildgebenden Diagnostik beim und bei Lymphomen Doz. Dr. Michael Fiegl Hämato-Onkologie (Direktor: Prof. Dr. G. Gastl) Programm für PatientInnen Innsbruck,
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. e medianes e Vergleich medianes Vergleichsquelle 2011-2015 männlich 131 3,6 3,4 49,6
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate altersstandardisierte Rate (ESR)* arithm. e medianes e Vergleich medianes Vergleichsquelle 2011-2015 männlich 131 3,6 3,4 49,6
Diffuses großzelliges B-Zell Lymphom - Medikamentöse Tumortherapie - Protokolle
 Diffuses großzelliges B-Zell Lymphom - Medikamentöse Tumortherapie - Protokolle Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber
Diffuses großzelliges B-Zell Lymphom - Medikamentöse Tumortherapie - Protokolle Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber
Maligne Lymphome. Patiententag am 24.03.2007. Gemeinschaftspraxis für Hämatologie und Internistische Onkologie Siegburg Dr. med.
 Maligne Lymphome Patiententag am 24.03.2007 Gemeinschaftspraxis für Hämatologie und Internistische Onkologie Siegburg Dr. med. Stefan Fronhoffs Was sind maligne Lymphome? Komplexe Vielzahl verschiedener
Maligne Lymphome Patiententag am 24.03.2007 Gemeinschaftspraxis für Hämatologie und Internistische Onkologie Siegburg Dr. med. Stefan Fronhoffs Was sind maligne Lymphome? Komplexe Vielzahl verschiedener
Therapie von fortgeschrittenen Hodenkarzinomen. Annette Dieing
 Therapie von fortgeschrittenen Hodenkarzinomen Annette Dieing 14.01.2014 Stadieneinteilung Fortgeschrittene Stadien Heilungsraten Anteil der Patienten Langzeit- Überleben Frühe Stadien 75% 99% Fortgeschrittene
Therapie von fortgeschrittenen Hodenkarzinomen Annette Dieing 14.01.2014 Stadieneinteilung Fortgeschrittene Stadien Heilungsraten Anteil der Patienten Langzeit- Überleben Frühe Stadien 75% 99% Fortgeschrittene
AstraZeneca. Nach dem Start der Therapie nehmen die Patienten die Studientherapie,
 Klinikum Mutterhaus der Borromäerinnen ggmbh Postfach 2920 5219 Trier Studienzentrum Aktuell (Juni 2016) wird die Teilnahme an folgenden Studien angeboten: Studien für die Indikation Bronchialkarzinom
Klinikum Mutterhaus der Borromäerinnen ggmbh Postfach 2920 5219 Trier Studienzentrum Aktuell (Juni 2016) wird die Teilnahme an folgenden Studien angeboten: Studien für die Indikation Bronchialkarzinom
Primärtherapie follikuläres Lymphom Grad I-IIIA
 Primärtherapie follikuläres Lymphom Grad I-IIIA Primäres Staging Stadium I, II Stadium III, IV Radiatio (kuratives Ziel) Extended Field keine Behandlungsindikation mit Behandlungsindikation (oder geplante
Primärtherapie follikuläres Lymphom Grad I-IIIA Primäres Staging Stadium I, II Stadium III, IV Radiatio (kuratives Ziel) Extended Field keine Behandlungsindikation mit Behandlungsindikation (oder geplante
Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
 46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
Mantelzell-Lymphom (MCL)
 1/8 Mantelzell-Lymphom (MCL) Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin obligat FISH
1/8 Mantelzell-Lymphom (MCL) Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung EDTA oder Heparin obligat Chromosomenanalyse Heparin obligat FISH
Hodgkin und non-hodgkin Lymphome. Dr.Werling Klára V.Jahrgang
 Hodgkin und non-hodgkin Lymphome Dr.Werling Klára V.Jahrgang Hodgkin- Lymphome Eine bösartige Neoplasien des lymphatischen Systems Kennzeichnend ist der histologische Nachweis von ein- oder mehrkernigen
Hodgkin und non-hodgkin Lymphome Dr.Werling Klára V.Jahrgang Hodgkin- Lymphome Eine bösartige Neoplasien des lymphatischen Systems Kennzeichnend ist der histologische Nachweis von ein- oder mehrkernigen
Uterine Leiomyosarkome
 Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
Was drückt den da? 12. Jahrestagung der Gesellschaft für Gastroenterologie und Hepatologie in Berlin und Brandenburg 26.
 12. Jahrestagung der Gesellschaft für Gastroenterologie und Hepatologie in Berlin und Brandenburg 26. Januar 2018 Was drückt den da? Tillmann Schumacher Zentrum für Innere Medizin Klinik für Gastroenterologie
12. Jahrestagung der Gesellschaft für Gastroenterologie und Hepatologie in Berlin und Brandenburg 26. Januar 2018 Was drückt den da? Tillmann Schumacher Zentrum für Innere Medizin Klinik für Gastroenterologie
2. Regensburger Patiententag
 2. Regensburger Patiententag 7. Feb. 2015 Neues aus der Therapie von Leukämien und Lymphomen Wolfgang Herr Innere Medizin III Hämatologie und Onkologie Leukämien und Lymphome entstehen durch Veränderungen
2. Regensburger Patiententag 7. Feb. 2015 Neues aus der Therapie von Leukämien und Lymphomen Wolfgang Herr Innere Medizin III Hämatologie und Onkologie Leukämien und Lymphome entstehen durch Veränderungen
Krebs - was kann ich tun?
 Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Strahlentherapie bei Lungenkrebs
 Basiskurs Krebswissen Sommer 2018 Strahlentherapie bei Lungenkrebs 1 Joachim Widder, UK Strahlentherapie Lungenkrebs (Bronchuskarzinom) Ursachen, Häufigkeit Histologische (feingewebliche) Typen Stadieneinteilung
Basiskurs Krebswissen Sommer 2018 Strahlentherapie bei Lungenkrebs 1 Joachim Widder, UK Strahlentherapie Lungenkrebs (Bronchuskarzinom) Ursachen, Häufigkeit Histologische (feingewebliche) Typen Stadieneinteilung
Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg
 Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm. Direktorin PD Dr. med. Gabriele Hänsgen) Vergleich der Wirksamkeit von Orthovoltbestrahlung
Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm. Direktorin PD Dr. med. Gabriele Hänsgen) Vergleich der Wirksamkeit von Orthovoltbestrahlung
Welche Untersuchungen führt der Urologe bei Verdacht auf einen Hodentumor durch?
 Hodenkrebs Was ist ein Hodentumor, was ist Hodenkrebs? Ein Hodentumor ist ein in der Regel bösartiges Geschwulst (Tumor) im Hoden, der potentiell über den Blut oder Lymphweg Tochtergeschwulste (Metastasen)
Hodenkrebs Was ist ein Hodentumor, was ist Hodenkrebs? Ein Hodentumor ist ein in der Regel bösartiges Geschwulst (Tumor) im Hoden, der potentiell über den Blut oder Lymphweg Tochtergeschwulste (Metastasen)
Therapie von Patienten bis 65 Jahren mit fortgeschrittener chronischer lymphatischer Leukämie mit Fludarabin versus Fludarabin/Cyclophosphamid
 10 CLL4-Protokoll der deutschen CLL-Studiengruppe Therapie von Patienten bis 65 Jahren mit fortgeschrittener chronischer lymphatischer Leukämie mit Fludarabin versus Fludarabin/Cyclophosphamid - CLL4-Protokoll
10 CLL4-Protokoll der deutschen CLL-Studiengruppe Therapie von Patienten bis 65 Jahren mit fortgeschrittener chronischer lymphatischer Leukämie mit Fludarabin versus Fludarabin/Cyclophosphamid - CLL4-Protokoll
Maligne Lymphome. Kurzinformation über eine seltene, aber zunehmende Krebserkrankung. Beschreibung. Diagnose. Therapie.
 Maligne Lymphome Kurzinformation über eine seltene, aber zunehmende Krebserkrankung Beschreibung Diagnose Therapie Hilfe und Unterstüzung www.lymphome.de Was sind maligne Lymphome? 1 Lymphome sind bösartige
Maligne Lymphome Kurzinformation über eine seltene, aber zunehmende Krebserkrankung Beschreibung Diagnose Therapie Hilfe und Unterstüzung www.lymphome.de Was sind maligne Lymphome? 1 Lymphome sind bösartige
6. Diskussion 6.1. Diskussion der Daten
 6. Diskussion 6.1. Diskussion der Daten Die 1995 im BJ publizierte Metaanalyse zeigte, dass für Patienten im Stadium III b und IV des Bronchialkarzinoms eine Chemotherapie einen Überlebensvorteil ergibt.
6. Diskussion 6.1. Diskussion der Daten Die 1995 im BJ publizierte Metaanalyse zeigte, dass für Patienten im Stadium III b und IV des Bronchialkarzinoms eine Chemotherapie einen Überlebensvorteil ergibt.
Einfluss der Niedrigdosisbelastung (V10) auf das Pneumonitisrisiko bei thorakaler Bestrahlung
 Einfluss der Niedrigdosisbelastung (V10) auf das Pneumonitisrisiko bei thorakaler Bestrahlung M. Becker-Schiebe 1, M. Renz 1, H. Christiansen 2, W. Hoffmann 1 1 Klinik für Radioonkologie und Strahlentherapie
Einfluss der Niedrigdosisbelastung (V10) auf das Pneumonitisrisiko bei thorakaler Bestrahlung M. Becker-Schiebe 1, M. Renz 1, H. Christiansen 2, W. Hoffmann 1 1 Klinik für Radioonkologie und Strahlentherapie
Morbus Hodgkin. Welt Lymphom Tag Seminar für f r Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für f r Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Dr. Gudrun Pohl Wilhelminenspital 1. Med. Abteilung Zentrum für Onkologie und Hämatologie Morbus Hodgkin
Welt Lymphom Tag Seminar für f r Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Dr. Gudrun Pohl Wilhelminenspital 1. Med. Abteilung Zentrum für Onkologie und Hämatologie Morbus Hodgkin
Lungentumoren Frank Zimmermann Klinik für Radioonkologie Universitätsspital Basel Petersgraben 4 CH 4031 Basel radioonkologiebasel.
 Lungentumoren Frank Zimmermann Klinik für Radioonkologie Universitätsspital Basel Petersgraben 4 CH 4031 Basel radioonkologiebasel.ch Heutige Lernziele C IM 240 lung carcinoma 2 C SU 94 C RN 4 types of
Lungentumoren Frank Zimmermann Klinik für Radioonkologie Universitätsspital Basel Petersgraben 4 CH 4031 Basel radioonkologiebasel.ch Heutige Lernziele C IM 240 lung carcinoma 2 C SU 94 C RN 4 types of
MUND UND RACHEN (C00-C14)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MUND UND RACHEN (C-C14) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MUND UND RACHEN (C-C14) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
Immun-Onkologie Gezielt gegen Krebs mit dem eigenen Immunsystem
 Immun-Onkologie Gezielt gegen Krebs mit dem eigenen Immunsystem URBAN NOVAK Universitätsklinik für Medizinische Onkologie 14 th World Lymphoma Awareness Day Luzern, 16.09.2017 Immunüberwachung funktioniert
Immun-Onkologie Gezielt gegen Krebs mit dem eigenen Immunsystem URBAN NOVAK Universitätsklinik für Medizinische Onkologie 14 th World Lymphoma Awareness Day Luzern, 16.09.2017 Immunüberwachung funktioniert
Follikuläres Lymphom Marginalzonen-Lymphom. Dr. med. Christian Taverna Leitender Arzt Onkologie
 Follikuläres Lymphom Marginalzonen-Lymphom Dr. med. Christian Taverna Leitender Arzt Onkologie Maligne Lymphome Lymphknoten-Krebs Lymphdrüsen-Krebs Ein Krebs, der von Zellen des lymphatischen Systems ausgeht
Follikuläres Lymphom Marginalzonen-Lymphom Dr. med. Christian Taverna Leitender Arzt Onkologie Maligne Lymphome Lymphknoten-Krebs Lymphdrüsen-Krebs Ein Krebs, der von Zellen des lymphatischen Systems ausgeht
Seite Diskussion
 Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt
 Vaskulitiden wenn Blutgefäße sich entzünden Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt Hamburg (24. August 2010) - Fieber, Nachtschweiß und Gewichtsverlust, rheumatische Beschwerden
Vaskulitiden wenn Blutgefäße sich entzünden Wie sich die schleichende Autoimmunerkrankung kontrollieren lässt Hamburg (24. August 2010) - Fieber, Nachtschweiß und Gewichtsverlust, rheumatische Beschwerden
Bericht aus Kiel. Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel)
 Bericht aus Kiel Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist passiert? Wo wollen wir hin? Was ist passiert? Wo wollen wir hin? Die KKI-Labore in Kiel 1992 Hämatopathologie und Lymphknotenregister
Bericht aus Kiel Prof. Dr. Wolfram Klapper (Sektion Hämatopathologie, Kiel) Was ist passiert? Wo wollen wir hin? Was ist passiert? Wo wollen wir hin? Die KKI-Labore in Kiel 1992 Hämatopathologie und Lymphknotenregister
Therapie der CLL (QS( Georg Günther, Annette Sauer, Anke Gerhardt Potsdam
 Therapie der CLL (QS( QS-Projekt) Georg Günther, Annette Sauer, Anke Gerhardt Potsdam QS-Projekt B-CLL - Bendamustin Grundlagen Projektdesign Therapieplan Aktueller Stand Street Teams Grundlagen (1) CLL
Therapie der CLL (QS( QS-Projekt) Georg Günther, Annette Sauer, Anke Gerhardt Potsdam QS-Projekt B-CLL - Bendamustin Grundlagen Projektdesign Therapieplan Aktueller Stand Street Teams Grundlagen (1) CLL
Niedrigmaligne Lymphome Chronisch-Lymphatische Leukämie (CLL)
 Höhepunkte des Amerikanischen Hämatologie-Kongresses Atlanta, 2017 Niedrigmaligne Lymphome Chronisch-Lymphatische Leukämie (CLL) PD Dr. Dr. M. R. Müller Medizinische Klinik Abt. Onkologie/Hämatologie Überblick
Höhepunkte des Amerikanischen Hämatologie-Kongresses Atlanta, 2017 Niedrigmaligne Lymphome Chronisch-Lymphatische Leukämie (CLL) PD Dr. Dr. M. R. Müller Medizinische Klinik Abt. Onkologie/Hämatologie Überblick
1. Vorbemerkung Ziel der vorliegenden Arbeit Das Mammakarzinom Historischer Überblick 2
 INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
Linzer Hämato-Onkologische Tage 8./9. Nov Ein Unglück kommt selten alleine. Karl Moyses LK Mostviertel Scheibbs Interne Abteilung
 Linzer Hämato-Onkologische Tage 8./9. Nov. 2013 Ein Unglück kommt selten alleine Karl Moyses LK Mostviertel Scheibbs Interne Abteilung Kasuistik Blutbild Leukozyten G/l 3,0-50a, - arterielle Hypteronie
Linzer Hämato-Onkologische Tage 8./9. Nov. 2013 Ein Unglück kommt selten alleine Karl Moyses LK Mostviertel Scheibbs Interne Abteilung Kasuistik Blutbild Leukozyten G/l 3,0-50a, - arterielle Hypteronie
